LABEL CERDAS PENDETEKSI ESCHERICHIA COLI
DARI BERBAGAI INDIKATOR WARNA
HANDAYANI DWIRIANTI
DEPARTEMEN TEKNOLOGI INDUSTRI PERTANIAN FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Label Cerdas Pendeteksi Escherichia coli dari Berbagai Indikator Warna adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
ABSTRAK
HANDAYANI DWIRIANTI. Label Cerdas Pendeteksi Escherichia coli dari Berbagai Indikator Warna. Dibimbing oleh ENDANG WARSIKI.
Kemasan cerdas merupakan kemasan yang mampu memberikan informasi mengenai kondisi serta kualitas dari produk yang dikemasnya. Penelitian ini dilakukan untuk membuat label yang dapat mendeteksi bakteri Escherichia coli. Penelitian pendahuluan dilakukan dengan mencari formulasi terbaik yang dapat menghasilkan label cerdas dalam waktu singkat dengan perubahan warna sebagai indikator adanya E.coli. Label pertama yaitu label PVA-EMB yang terdiri dari EMB agar, PVA, tapioka, agar bubuk, dan gliserol. Label ini dapat mendeteksi E.coli pada hari ketiga dengan perubahan warna dari merah muda kemudian timbul koloni berwarna hijau. Hal ini kurang memenuhi kebutuhan karena EMB agar itu sendiri dapat mendeteksi keberadaan E.coli dalam waktu 24 jam. Oleh karena itu dilakukan modifikasi agar label dapat mengalami perubahan warna akibat keberadaan E.coli. Label BHI-laktosa terdiri dari BHI broth, laktosa, methyl red, tapioka, agar bubuk, dan gliserol. Label ini tidak menimbulkan perubahan warna. Label ketiga yaitu label methyl red yang terdiri dari methyl red, tapioka, agar bubuk, dan gliserol. Label ini menghasilkan label yang cukup baik karena dapat berubah warna dalam waktu singkat. Selanjutnya dilakukan uji sensitifitas pada label methyl red terhadap E.coli dan uji kuantifikasi warna untuk mengetahui perubahan warna selama kurun waktu tertentu. Label mampu mendeteksi keberadaan E.coli dalam kurun waktu 9-12 jam dan mengalami perubahan warna dari jingga menjadi merah muda sampai merah terang.
ABSTRACT
HANDAYANI DWIRIANTI. Escherichia coli Smart Label Detector with Different Colour Indicator.Supervised by ENDANG WARSIKI.
Intelligent packaging is the packaging that is designed to provide information about the condition and quality of packaged products. This study was aimed to produce a label that can detect pathogenic bacteria Eschericia coli. Preliminary research was carried out to obtain the best formulation for E.coli smart label detector. The first label is the label PVA-EMB consisted of EMB agar, PVA, tapioca, agar powder, and glycerol. This label can detect E.coli on the third day with the changing colors of pink to green colored colonies. It was not effective because the EMB itself can detect the presence of E.coli within 24 hours. Therefore, modification of the formulation is neccesary to produce a better label. The next label is the label BHI-lactose consisted of BHI broth, lactose, methyl red, tapioca, agar powder, and glycerol. This label was not resulted on significant colour change. The third label is the label methyl red consisted of methyl red, tapioca, agar powder, and glycerol. Label methyl red was the best formulation therefore E.coli sensitivity test and color quantification test was needed to determine the colour change on label. This label can detect E.coli in 9-12 hours with a color change from orange to pink-bright red.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Teknologi Pertanian
pada
Departemen Teknologi Industri Pertanian
LABEL CERDAS PENDETEKSI ESCHERICHIA COLI
DARI BERBAGAI INDIKATOR WARNA
DEPARTEMEN TEKNOLOGI INDUSTRI PERTANIAN FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
2014
Judul Skripsi : Label Cerdas Pendeteksi Escherichia coli dari Berbagai Indikator Warna
Nama : Handayani Dwirianti NIM : F34100090
Disetujui oleh
Dr Endang Warsiki, STP MSi Dosen Pembimbing
Diketahui oleh
Prof Dr Ir Nastiti Siswi Indrasti Ketua Departemen
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Judul yang dipilih dalam penelitian ini yaitu “Label Cerdas Pendeteksi Escherichia coli dari Berbagai Indikator Warna”. Penulis menyampaikan terima kasih kepada:
1. Dr Endang Warsiki STP MSi selaku Pembimbing Akademik atas perhatian dan bimbingannya selama penelitian dan penyelesaian skripsi.
2. Dr Ir Mohammad Yani M.Eng dan Drs Chilwan Pandji Apt MSc selaku dosen penguji atas kritik dan sarannya.
3. Ayahanda Tedi Suharja, Ibunda Ucu Kusumayati, dan adik Indriani Dwilestari, beserta seluruh keluarga besar atas doa, semangat, dan kasih sayangnya.
4. Nanda Arisandika Surya, Hanisa Pratiwi, Roseiga Anggarani, Riris Oktaviasari, Aloysius Boris, dan Umi Maharani atas semangat dan dukungannya.
5. Keluarga besar TIN 47 atas keceriaan dan kenangan indah tak terlupakan. 6. Seluruh sanak dan kerabat yang tidak bisa disebutkan satu-persatu.
Semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
DAFTAR TABEL xii
DAFTAR GAMBAR xii
DAFTAR LAMPIRAN xii
PENDAHULUAN 1
Perumusan Masalah 2
Tujuan Penelitian 2
TINJAUAN PUSTAKA 3
Kemasan Cerdas 3
Escherichia coli 4
Escherichia coli pada Daging 6
Polivinil Alkohol (PVA) 7
Brain Heart Infusion Broth dan Laktosa 8
Indikator Warna Pendeteksi Escherichia coli 8
Eosin Methylene Blue Agar 8
Methyl Red 9
METODE PENELITIAN 10
Bahan 10
Alat 10
Metodologi 10
HASIL DAN PEMBAHASAN 15
Label PVA-EMB 15
Label BHI-Laktosa 15
Label Methyl Red 17
Sensitifitas Label Terhadap Pertumbuhan E.coli 18
Kuantifikasi Perubahan Warna Label Cerdas 21
SIMPULAN DAN SARAN 24
Simpulan 24
Saran 24
DAFTAR PUSTAKA 25
LAMPIRAN 28
DAFTAR TABEL
1 Fungsi indikator kemasan cerdas 4
2 Jenis patogen pada E.coli 5
3 Parameter batas kehidupan bakteri patogen E.coli 6
4 Syarat mutu mikrobiologi daging sapi 7
5 Komposisi Brain Heart Infusion Broth 8
6 Komposisi EMB agar 9
7 Jumlah koloni E.coli pada pengulangan pertama 19 8 Jumlah koloni E.coli pada pengulangan kedua 20
9 Sensitifitas label tanpa bakteri 21
10 Hasil konversi nilai ke warna sebenarnya 22
DAFTAR GAMBAR
1 Kemasan cerdas sebagai informasi kualitas bahan terkemas 3
2 Struktur monomer polivinil alkohol 7
3 Batas pH indikator warna methyl red 9
4 Perubahan warna pada indikator warna methyl red 10
5 Diagram alir pembuatan label PVA-EMB 11
6 Diagram alir pembuatan label BHI-Laktosa 12
7 Diagram alir pembuatan label methyl red 13
8 Metode penggoresan bahan label cerdas 13
9 Uji sensitifitas label 14
10 Diagram alir perhitungan E.coli pada label cerdas 14
11 Perubahan warna label PVA-EMB 15
12 Perubahan warna label BHI-laktosa 16
13 Ilustrasi perubahan warna label cerdas di dalam cawan 16
14 Label BHI-laktosa dengan metode penangkapan 17
15 Perubahan warna label methyl red dengan metode penggoresan 17
16 Perubahan warna label methyl red 18
DAFTAR LAMPIRAN
1 Jumlah E.coli yang tertangkap oleh label pada pengulangan pertama 27 2 Perbandingan hasil kuantifikasi perubahan warna pada label 28
pada pengulangan pertama
1
PENDAHULUAN
Latar Belakang
Kemasan cerdas adalah kemasan yang memiliki fungsi sebagai informasi mengenai kualitas pangan yang dikemasnya. Informasi ini dapat berupa berbagai macam perubahan yang tertera pada kemasan. Dalam aplikasinya, kemasan cerdas dibuat dengan menambahkan indikator yang digunakan sebagai pendeteksi dari kerusakan pangan yang dikemas dan dapat menjadi informasi bagi konsumen mengenai kondisi pangan yang dikemas.
Beberapa kemasan cerdas yang telah ada yaitu kemasan cerdas indikator warna daun erpa (Nofrida 2013), kemasan cerdas pendeteksi kebusukan fillet ikan nila (Hasnedi 2009), dan kemasan cerdas menggunakan pewarna natural dan sintetik (Warsiki dan Putri 2012). Kemasan cerdas Nofrida (2013) yaitu kemasan cerdas untuk mendeteksi kerusakan produk akibat terpapar suhu tinggi. Kemasan cerdas ini diaplikasikan pada produk susu pasteurisasi yang mudah mengalami kerusakan jika disimpan pada suhu yang tinggi. Label akan berubah warna dari merah menjadi kuning dalam waktu singkat apabila produk tidak disimpan pada suhu yang tepat atau terpapar matahari. Apabila produk disimpan pada suhu refrigerator (3+2°C) dan suhu freezer ((-10)+2°C), label tetap berwarna merah secara visual dan mengalami perubahan warna menjadi kuning dalam kurun waktu yang lebih lama. Kemasan cerdas Hasnedi (2009) yaitu kemasan cerdas dengan indikator warna BTB (Bromthymol Blue) untuk mendeteksi kebusukan fillet ikan nila. Pewarna BTB ini berfungsi sebagai indikator warna yang dapat berubah warna dari kuning menjadi biru saat fillet ikan nila membusuk. Lain halnya dengan kemasan cerdas indikator warna Warsiki dan Putri (2012), dimana pewarna yang digunakan adalah pewarna alami dengan menggunakan bunga rosella, buah bit, dan daun bayam, dan pewarna sintetik menggunakan pewarna cherry (CL 16255). Pewarna sintetik ini menjadi informasi yang lebih baik untuk menunjukkan penurunan mutu produk pangan akibat perubahan pH produk dibandingkan dengan pewarna alami. Contoh lain kemasan cerdas dengan indikator warna adalah pembuatan label cerdas pendeteksi E.coli oleh Lestari (2013). Indikator warna yang digunakan adalah eosin dan methylene blue yang terdapat pada Eosin Methylene Blue (EMB) agar. Dengan memanfaatkan kedua pewarna tersebut, label dapat menunjukkan adanya bakteri E.coli dengan timbulnya koloni berwarna hijau metalik pada label.
Penelitian ini didasari pada faktor yang mempercepat proses pembusukan pangan karena adanya mikroba. Pertumbuhan mikroba, khususnya bakteri patogen, pada bahan pangan selain merusak kondisi pangan juga dapat membahayakan konsumen. Salah satu jenis bakteri patogen yang dapat membahayakan konsumen adalah Escherichia coli, dimana bakteri jenis ini mudah ditemui pada bahan pangan berprotein dan berkadar air tinggi seperti daging dan ikan.
2
label cerdas pendeteksi E.coli yang mampu memperbaiki sifat fisis mekanis label dengan penambahan polimer PVA agar label tidak mudah larut. Label yang diharapkan mengalami perubahan warna ketika mendeteksi keberadaan E.coli dengan perubahan warna yang terlihat baik secara visual. Keberadaan koloni E.coli pada label Lestari (2013) tidak terlihat jelas secara visual sehingga sulit untuk melihat adanya bakteri E.coli dengan perubahan warna tersebut, maka perlu dicari indikator lain yang dapat mendeteksi E.coli dengan perubahan warna yang baik secara visual sehingga keberadaan E.coli menjadi lebih mudah diinformasikan kepada konsumen.
Perumusan Masalah
Salah satu faktor yang dapat menyebabkan kerusakan mutu pangan yaitu adanya bakteri patogen. Bakteri patogen dapat membahayakan konsumen. Salah satu bakteri patogen yaitu E.coli, dimana E.coli yang berada di alam sebagian besar bersifat patogen dan dapat menimbulkan berbagai macam penyakit. Label cerdas pendeteksi E.coli merupakan label yang direkatkan pada bagian permukaan kemasan suatu produk. Label cerdas yang dibuat ini mampu mendeteksi keberadaan E.coli dengan perubahan warna yang signifikan dan dapat terlihat secara visual sehingga dapat menjadi informasi yang baik bagi konsumen untuk mengetahui kondisi pangan yang dikemas akibat adanya bakteri E.coli.
Tujuan Penelitian
Tujuan dari penelitian ini adalah sebagai berikut:
1. Membuat label cerdas pendeteksi Escherichia coli dari berbagai indikator warna
2. Mencari formulasi terbaik label cerdas pendeteksi Escherichia coli
3
TINJAUAN PUSTAKA
Kemasan Cerdas
Kemasan memiliki kontak secara langsung baik dengan lingkungan maupun dengan produk yang dikemasnya. Kemasan ini dapat berperan secara dinamis untuk mengkomunikasikan informasi tentang kualitas pangan terkemas dengan adanya beberapa indikator, misalnya waktu/temperatur dan biosensor (Warsiki et al. 2013).
Kemasan modern dibagi menjadi dua jenis, yaitu kemasan cerdas dan kemasan aktif. Menurut Robertson (2006), kemasan cerdas (smart packaging) adalah kemasan yang dijadikan sebagai indikator, baik menggunakan indikator eksternal maupun indikator internal, dan mampu memberikan informasi tentang kualitas bahan pangan yang dikemasnya. Kerry et al.(2008) menambahkan bahwa kemasan cerdas adalah kemasan yang menggunakan bahan cerdas untuk memberikan informasi kepada pengguna. Contoh dari kemasan jenis ini dapat dilihat pada gambar berikut.
Gambar 1 Kemasan cerdas sebagai informasi kualitas bahan terkemas (Kerry et al. 2008)
Sensor yang tertera pada gambar di atas menunjukkan keadaan bahan terkemas dengan perubahan warna sebagai informasi kepada konsumen. Saat sensor berwarna kuning, maka sensor telah aktif dan akan berubah warna menjadi warna merah muda saat bahan terkemas telah kadaluarsa.
4
yang dihasilkan oleh pangan dapat diserap oleh karbon aktif yang terdapat pada kemasan.
Kemasan cerdas memanfaatkan beberapa indikator sebagai informasi mengenai kualitas pangan. Fungsi indikator-indikator yang digunakan pada kemasan cerdas dapat dilihat pada Tabel 1.
Tabel 1 Fungsi indikator kemasan cerdas
Indikator Fungsi
Time/temperature indicator
Beberapa kemasan dengan indikator ini hanya menggunakan waktu atau suhu, namun ada pula yang menggunakan reaksi enzimatik. Indikator tersebut dapat digunakan oleh konsumen sebagai informasi kualitas produk.
Contoh kemasan TTI ini adalah printed bar code label. Kode bar ini akan berubah seiring waktu dan barang tersebut dapat diketahui kondisinya saat tidak layak untuk dijual.
Oxygen indicator Perubahan warna akan terjadi pada kemasan ketika terdapat oksigen di dalam kemasan. Kemasan dengan indikator oksigen ini diterapkan untuk menunjukkan kebocoran pada kemasan. Contoh dari kemasan indikator oksigen adalah MAP (Modified Atmosphere Packaging)
Carbondioxide indicator
Umumnya indikator ini digunakan untuk mendetesi aktivitas mikrobiologi melalui perubahan warna pada kemasan.
Microbial growth indicator
Indikator yang digunakan untuk mendeteksi metabolisme dari mikroba. Namun indikator ini belum tersedia secara komersial.
Ripening indicator
Indikator yang digunakan untuk menunjukkan waktu terbaik untuk mengonsumsi melalui indikator warna pada kemasan.
Media indikator E.coli termasuk ke dalam kelompok indikator pertumbuhan mikroba dengan mekanisme perubahan warna. Perubahan warna yang terjadi pada label cerdas dikarenakan adanya indikator warna yang terdapat pada label (Lestari 2013).
Escherichia coli
5
penyakit pernapasan, radang paru-paru, dan penyakit lainnya. E.coli juga digunakan sebagai salah satu parameter dalam air minum untuk menunjukkan kontaminasi dari air itu sendiri (CDC 2012). Berikut adalah jenis patogen dari bakteri E.coli (Tabel 2).
Tabel 2 Jenis patogen pada E.coli
Strain Singkatan Dampak
Enteroinvasive E.coli EIEC Menyebabkan penyakit menyerupai disentri, terkadang dengan diare berdarah. Enteropathogenic E.coli EPEC Menyebabkan muntah dan diare pada bayi Enterotoxigenic E.coli ETEC Menyebabkan diare dan dehidrasi.
Verocytotoxin producing E.coli
(enterohaemorrhagic E.coli)
VTEC (EHEC)
Penyakit yang menimbulkan diare ringan hingga berat dengan darah, demam, kerusakan permanen ginjal, dan dapat menyebabkan kematian. Tingkat kematian sekitar 5%. Anak-anak dan para lanjut usia mudah terserang penyakit ini.
Sumber: DoH (1994) dalam Pawsey (2002)
Golongan taksonomi E.coli adalah sebagai berikut. Dunia : Bacteria
Filum : Protobacteria
Kelas : Gammaproteobacteria Ordo : Enterobacteriales Famili : Enterobactericeace Genus : Escherichia
Spesies : E. coli
Tidak semua strain E.coli berbahaya bagi manusia. Menurut Kuntaman (2011), E.coli merupakan bakteri yang terdapat di dalam usus manusia yang dapat membantu pencernaan manusia. E.coli dalam usus manusia tidak berbahaya karena usus manusia dilengkapi dengan sistem pertahanan tubuh untuk mempertahankan diri dari serangan bakteri lewat saluran pencernaan. Fungsi E.coli pada usus besar yaitu untuk menutup permukaan usus besar agar bakteri lain, bakteri patogen berbahaya, dapat terus keluar melalui kotoran. E.coli juga dapat menghasilkan bahan antibiotik bagi tubuh manusia yang dapat membunuh bakteri patogen lain. Apabila E.coli bertemu dengan bakteri lain yang bersifat menguntungkan bagi E.coli, maka E.coli akan menghasilkan berbagai produk seperti asam amino, dimana asam amino itu sendiri merupakan salah satu komponen yang dibutuhkan oleh tubuh manusia
6
ditularkan melalui air atau makanan yang terkontaminasi dan dapat pula akibat kontak dengan hewan atau manusia lainnya.
Semua perlakuan dan formulasi yang dilakukan untuk memproduksi makanan harus diperhatikan dari segala sisi, khususnya adanya mikroba patogen E.coli, untuk menghindari potensi-potensi berbahaya bagi konsumen. Parameter kehidupan bakteri patogen E.coli dapat dilihat pada Tabel 3.
Tabel 3 Parameter batas kehidupan bakteri patogen E.coli
Parameter Minimum Optimum Maksimum
Suhu (°C)
E.coli (semua tipe) 7-8 35-40 44-46
VTEC O157:H7 6,5 37 44-45
pH
(E.coli patogen) 4,4 - - aw
(E.coli patogen) 0,95 - - Sumber: Blackburn et al. (2003)
Menurut Rahayu dan Nurwitri (2012), E.coli O157:H7 menyebar melalui konsumsi air minum yang telah terkontaminasi dan juga daging mentah atau susu non pasteurisasi. Ketiganya merupakan kebutuhan yang sangat penting bagi tubuh manusia sehingga hal ini perlu diperhatikan agar konsumen tidak mengalami dampak serius akibat mengonsumsi E.coli dari makanan maupun minuman yang dikonsumsinya.
Escherichia coli pada Daging
Daging merupakan bahan pangan yang memiliki kadar air tinggi sehingga mudah ditumbuhi oleh mikroba. Mikroba yang tumbuh pada daging dapat merusak kondisi daging menjadi tidak segar sehingga berwarna keabuan dan juga menjadi tidak layak untuk dikonsumsi. Selain kadar air yang tinggi, kondisi yang mendukung mikroba untuk tumbuh pada daging adalah ada atau tidaknya oksigen, terutama pada kondisi aerobik. Beberapa jenis mikroba yang dapat merusak daging diantaranya adalah E.coli, Clostridium, Pseudomonas, Achromobacter, dan Proteus (Rahayu dan Nurwitri 2012).
Daging yang terkontaminasi dapat disebabkan oleh beberapa hal, misalnya seperti kontak daging secara langsung dengan udara, air cucian daging yang terkontaminasi bakteri, dan sistem pengemasan, distribusi, dan transportasi yang tidak sesuai penanganannya sehingga daging mudah terkontaminasi. Hal ini didukung oleh pernyataan Rahayu dan Nurwitri (2012) dimana mikroba dapat merusak daging pada kondisi anaerobik terutama pada saat daging dikemas dalam kondisi vakum. Hal ini dapat terjadi karena bakteri anaerobik dapat menempel pada kemasan dan kemudian mengkontaminasi daging yang dikemas.
7
konsumsi makanan dan air (WHO 1997). D’Mello et al. (2003) mengklasifikasikan foodborne disease ini menjadi dua kategori, yaitu penyakit yang menyebabkan infeksi pada saluran pencernaan dan penyakit yang menyebabkan keracunan atau kecanduan terhadap makanan akibat racun yang belum terbentuk sempurna pada makanan. E.coli pada daging yang dapat menimbulkan berbagai macam penyakit yang berbahaya ini termasuk pada foodborne disease yang dapat menyebabkan infeksi pada saluran pencernaan.
Keberadaan dan keberlangsungan hidup dari bakteri patogen yang terdapat pada daging mentah dapat berkontribusi dalam meningkatkan resiko kesehatan terhadap manusia saat daging siap dikonsumsi. Salah satunya penyebabnya adalah karena daging yang disajikan kurang matang sehingga bakteri patogen, seperti E.coli, masih dapat bertahan hidup pada daging yang disajikan sehingga adanya bakteri E.coli dapat ditemukan pada daging mentah, daging yang kurang matang, dan daging yang terkontaminasi setelah melalui proses pemasakan (Pawsey 2002). Standar mutu mikrobiologi daging segar menurut SNI 3932 dapat dilihat pada Tabel 4.
Tabel 4 Syarat mutu mikrobiologi daging sapi
Jenis Uji Satuan Persyaratan
Total plate count cfu/g Maksimum 1 × 106 Coliform cfu/g Maksimum 1 × 102 Staphylococcus aureus cfu/g Maksimum 1 × 102 Salmonella sp per 25 gram Negatif Esherichia coli cfu/g Maksimum 1 × 101 Sumber:BSN (2008)
Polivinil Alkohol (PVA)
Polivinil alkohol merupakan polimer yang dibuat dari monomer vinil asetat dan merupakan suatu resin yang dibuat dari penggabungan molekul-molekul (polimerisasi) yang didapatkan dari hasil hidrolisis polivinil ester dengan menggunakan polivinil asetat. PVA dapat digunakan sebagai lapisan tipis yang sensitive (Ompusunggu 2012).
Polivinil Alkohol (PVA) adalah polimer sintetik yang mudah terurai secara biologi (biodegradable). Polivinil alkohol berbentuk serbuk berwarna putih dan dapat larut dalam air pada suhu 80°C dan memiliki ketahanan sobek sekitar 147-834 N/mm, kuat tarik sebesar 44-64 MN/m2, serta pemanjangan sebesar 150-400% (Hodgkinson dan Taylor 2000). Struktur monomer dari polivinil alkohol dapat dilihat pada Gambar2.
8
Brain Heart Infusion Broth dan Laktosa
BHI (Brain Heart Infusion) broth merupakan media non-selektif diperkaya yang digunakan untuk memperbanyak jumlah bakteri dan biasa digunakan untuk isolasi bakteri anaerob dan mikroorganisme lainnya (Anonim 2014).Media ini dapat digunakan sebagai media general bagi bakteri karena nutrisi yang terdapat pada BHI merupakan nutrisi umum yang dibutuhkan oleh sebagian besar bakteri untuk memperbanyak diri. Berikut adalah komposisi dari BHI broth (Tabel 5).
Tabel 5 Komposisi Brain Heart Infusion Broth
Komposisi Jumlah
(gram/Liter) Brain heart extract 17,5
Pepton 10
Glukosa 2
Sodium chloride 5 Disodium hydrogen phosphate 2,5 Sumber: SIFIN (2006)
Dalam proses fermentasinya, E.coli dapat memfermentasi tiga jenis gula untuk dapat bertahan hidup dan berkembang biak, yaitu glukosa, laktosa, dan sukrosa. Dalam fermentasi ketiganya, E.coli kemudian membentuk asam-asam organik dan gas (Frobisher 1968). Penambahan laktosa pada label cerdas bertujuan agar E.coli yang terdapat pada label dapat bertahan hidup dan bertambah banyak jumlahnya sehingga kondisi ini dapat mengubah warna label akibat kondisi asam hasil fermentasi E.coli, selain itu penambahan ini juga dilakukan untuk membedakan spesies E.coli dengan bakteri gram negatif lainnya (Puspaningrum 2008).
Indikator Warna Pendeteksi Escherichia coli Eosin Methylene Blue Agar
9
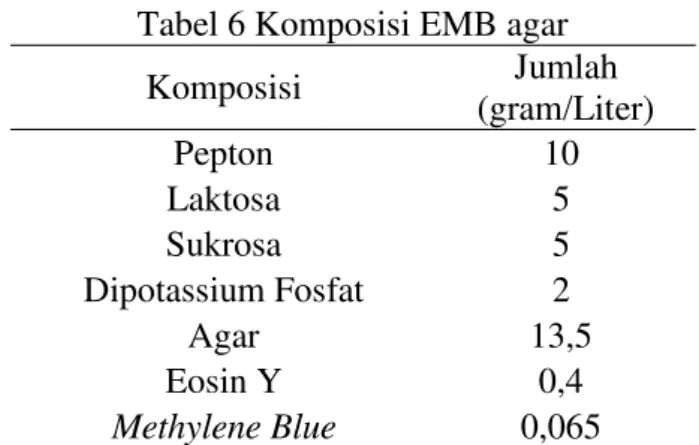
Tabel 6 Komposisi EMB agar
Komposisi Jumlah
(gram/Liter)
Pepton 10
Laktosa 5
Sukrosa 5
Dipotassium Fosfat 2
Agar 13,5
Eosin Y 0,4
Methylene Blue 0,065 Sumber: Lal dan Cheeptham (2013)
Methyl Red
Methyl red merupakan indikator warna yang akan berubah warna apabila bereaksi dengan larutan asam. Menurut Ancharya (2014), tes dengan menggunakan indikator warna methyl red digunakan untuk menentukan bahwa suatu mikroba melakukan fermentasi asam saat diberi suplai glukosa. Produk yang dihasilkan dari hasil fermentasi ini menghasilkan asam-asam dan akan menghasilkan penurunan pH pada media dibawah 4,4 sehingga akan mengubah methyl red menjadi warna merah. Pada saat kondisi netral, methyl red berwarna jingga, yaitu pada kondisi pH antara 4,4 hingga 6,2. Berikut adalah gambar batas pH dari indikator warna methyl red.
Gambar3 Batas pH indikator warna methyl red
Dalam dunia industri, methyl red digunakan untuk mengidentifikasi limbah industri dengan cara mengetahui jumlah E.coli pada sampel limbah. Menurut Clarence (2013), methyl red berfungsi untuk mewarnai larutan dalam sampel air limbah. Jumlah E.coli yang berlebihan pada limbah menandakan bahwa limbah sudah tidak memenuhi standar karena dapat mencemari lingkungan.Cara mengidentifikasi limbah ini yaitu dengan menguji sampel limbah yang diteteskan dengan beberapa tetes larutan indikator.Jika larutan berubah menjadi berwarna merah, maka limbah industri dapat mencemari sumber air di sekitarnya.
10
(a) (b)
Gambar 4 Perubahan warna pada indikator methyl red (LACC 2014) (a) negatif; (b) positif
METODE PENELITIAN
Bahan
Bahan yang digunakan dalam penelitian ini adalah aquades, Eosin Methylene Blue (EMB) Agar, Polivinil Alkohol (PVA), Brain Heart Infusion (BHI) Broth, laktosa, methyl red (MR), agar bubuk, tapioka, dan gliserol.
Alat
Alat-alat yang digunakan dalam penelitian ini, yaitu gelas piala, gelas arloji, erlenmeyer, sudip, pipet volumetrik, pipet mikro, kertas pH, plastik wrap, neraca analitik, termometer, magnetic stirrer, hot stirrer, pipet mikro, plat kaca berukuran 20 cm × 30 cm, oven, botol scotch, dan cawan petri.
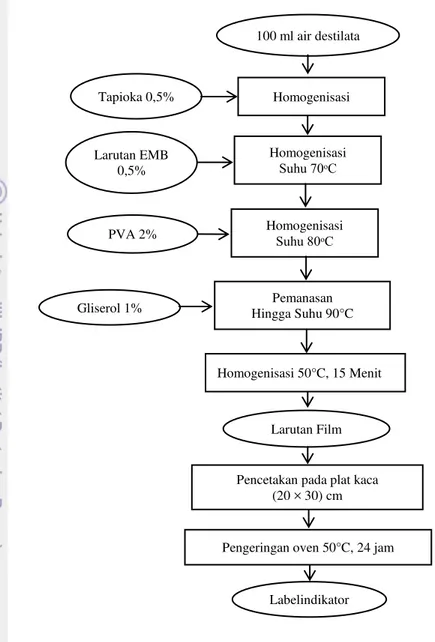
Metodologi Pembuatan Label PVA-EMB
11
Gambar 5 Diagram alir pembuatan label PVA-EMB
Pembuatan Label BHI-Laktosa
Pembuatan label BHI-laktosa dilakukan dengan mencampurkan bahan-bahan yang dibutuhkan oleh E.coli sebagai nutrisi untuk berkembang biak. Media umum yang digunakan untuk menumbuhkan bakteri pada formulasi ini adalah media BHI broth dan diberi penambahan laktosa. Penambahan bahan methyl red digunakan sebagai indikator warna untuk mendeteksi keberadaan E.coli. Pembuatan label ini dilakukan dengan menghomogenkan bahan-bahan yang terdiri dari BHI broth, laktosa, methyl red, tapioka, dan bubuk agar dengan air destilata, kemudian campuran ditambahkan gliserol. Setelah seluruh bahan homogen dengan baik, larutan disterilisasi dalam otoklaf pada suhu 121°C selama 15 menit. Larutan pembuat label dimasukkan ke dalam cawan dan didinginkan hingga memadat. Setelah itu label dicetak dengan ukuran 3 cm × 3 cm dan dikemas. Diagram alir pembuatan label BHI broth-laktosa dapat dilihat pada Gambar 6.
PVA 2% Homogenisasi Suhu 80ᵒC
Pemanasan Hingga Suhu 90°C Gliserol 1%
Homogenisasi 50°C, 15 Menit
Larutan Film
Pencetakan pada plat kaca (20 × 30) cm
Pengeringan oven 50°C, 24 jam
Labelindikator 100 ml air destilata
Tapioka 0,5% Homogenisasi
Larutan EMB 0,5%
Homogenisasi
12
Gambar 6 Diagram alir pembuatan label BHI-Laktosa
*Keterangan: Campuran bahan terdiri dari BHI broth, laktosa, methyl red, tapioka, dan bubuk agar
Pembuatan LabelMethyl Red
Formulasi label methyl red memanfaatkan indikator warna methyl red sebagai bahan utamanya. Pembuatan label ini dilakukan serupa dengan pembuatan label BHI broth-laktosa namun tanpa penambahan BHI broth dan laktosa sehingga bahan pembuat label methyl red ini terdiri dari methyl red, tapioka, bubuk agar, dan gliserol. Diagram alir pembuatan label methyl red dapat dilihat pada gambar berikut.
Homogenisasi
Otoklaf 121°C, 15 menit
Larutan Agar
Gliserol Campuran Bahan*
Air Destilata
Penuangan pada cawan petri
Pendinginan
Pencetakan ukuran 3 cm × 3 cm
Pengemasan
13
Gambar 7 Diagram alir pembuatan labelmethyl red Uji Sensitifitas Label Terhadap Pertumbuhan E.coli
Metode Penggoresan
Larutan label dimasukkan ke dalam cawan dan didiamkan hingga berbentuk padat, kemudian bahan digoreskan dengan biakan E.coli secara langsung. Hal ini bertujuan untuk mengetahui perubahan warna pada label saat mengalami kontak langsung dengan bakteri E.coli. Metode penggoresan dapat dilihat pada gambar berikut.
Gambar 8 Metode penggoresan bahan label cerdas
Metode Penangkapan
Uji sensitifitas dengan metode penangkapan dilakukan pada label yang telah dicetak berukuran 3 cm × 3 cm dan dikemas di dalam plastik LDPE (Low Density Polyethylene). Label yang dapat mendeteksi adanya koloni E.coli dipresentasikan dengan warna merah muda pada label. Uji ini bertujuan untuk mengetahui perubahan warna pada label. Pengujian dilakukan dengan merekatkan label pada
Penuangan pada cawan petri
Pendinginan
Pengemasan
Label Cerdas Pencetakan ukuran 3 cm × 3 cm
Otoklaf 121°C, 15 menit
Larutan Agar
Gliserol Homogenisasi
Air Destilata
Tapioka
14
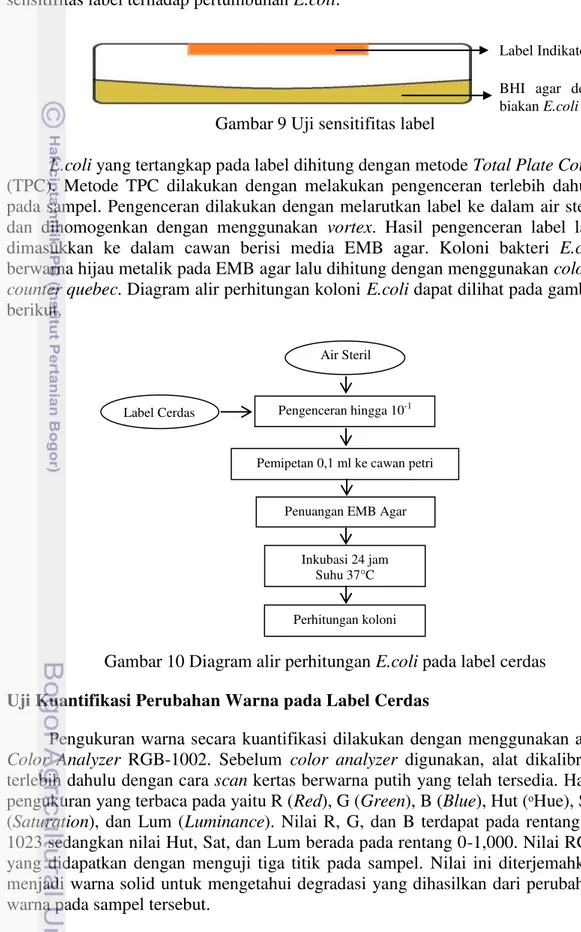
bagian dalam tutup cawan yang berisi E.coli dan dibiakan dengan menggunakan media BHI agar. Cawan dengan label cerdas yang diujikan kemudian dimasukkan ke dalam inkubator dengan suhu 37°C. Gambar 9 menunjukkan langkah uji sensitifitas label terhadap pertumbuhan E.coli.
Gambar 9 Uji sensitifitas label
E.coli yang tertangkap pada label dihitung dengan metode Total Plate Count (TPC). Metode TPC dilakukan dengan melakukan pengenceran terlebih dahulu pada sampel. Pengenceran dilakukan dengan melarutkan label ke dalam air steril dan dihomogenkan dengan menggunakan vortex. Hasil pengenceran label lalu dimasukkan ke dalam cawan berisi media EMB agar. Koloni bakteri E.coli berwarna hijau metalik pada EMB agar lalu dihitung dengan menggunakan colony counter quebec. Diagram alir perhitungan koloni E.coli dapat dilihat pada gambar berikut.
Gambar 10 Diagram alir perhitungan E.coli pada label cerdas
Uji Kuantifikasi Perubahan Warna pada Label Cerdas
Pengukuran warna secara kuantifikasi dilakukan dengan menggunakan alat Color Analyzer RGB-1002. Sebelum color analyzer digunakan, alat dikalibrasi terlebih dahulu dengan cara scan kertas berwarna putih yang telah tersedia. Hasil pengukuran yang terbaca pada yaitu R (Red), G (Green), B (Blue), Hut (ᵒHue), Sat (Saturation), dan Lum (Luminance). Nilai R, G, dan B terdapat pada rentang 0-1023 sedangkan nilai Hut, Sat, dan Lum berada pada rentang 0-1,000. Nilai RGB yang didapatkan dengan menguji tiga titik pada sampel. Nilai ini diterjemahkan menjadi warna solid untuk mengetahui degradasi yang dihasilkan dari perubahan warna pada sampel tersebut.
Pengenceran hingga 10-1
Air Steril
Label Cerdas
Inkubasi 24 jam Suhu 37°C
Perhitungan koloni Pemipetan 0,1 ml ke cawan petri
Penuangan EMB Agar
Label Indikator
15
HASIL DAN PEMBAHASAN
Label PVA-EMB
Label PVA-EMB menggunakan bahan EMB agar dengan memanfaatkan indikator warna eosin dan methylene blue yang dapat mengubah warna film menjadi warna hijau. Perubahan warna film yang ditandai dengan munculnya koloni hijau pada film menjadi informasi kepada konsumen bahwa bahan pangan terkemas telah terkontaminasi oleh E.coli. Perubahan warna pada label dapat dilihat saat pengamatan pada jam ke-72 (Gambar 11).
(a) (b)
Gambar 11 Perubahan warna label PVA-EMB (a) sebelum; (b) sesudah 72 jam
Perubahan warna label telah menimbulkan warna yang cukup baik, yaitu dari merah muda kemudian timbul koloni berwarna hijau saat label mendeteksi adanya E.coli. Perubahan warna ini kurang efektif karena waktu yang dibutuhkan oleh label untuk menunjukkan adanya E.coli dapat dilihat pada hari ketiga atau jam ke-72 sedangkan EMB agar itu sendiri dapat mendeteksi adanya E.coli dalam waktu 24 jam (Puspaningrum 2008). Selain itu, label yang dihasilkan juga mudah terkontaminasi oleh jamur. Hal ini karena nutrisi yang terdapat pada film juga merupakan nutrisi yang baik untuk jamur, oleh karena itu perlu dibuat formulasi yang lebih baik lagi untuk menghasilkan label yang dapat mendeteksi adanya E.coli dalam waktu kurang dari 24 jam, dengan bahan yang hanya dapat ditumbuhi oleh E.coli, dan dapat menimbulkan warna yang signifikan agar dapat menjadi informasi yang baik bagi konsumen.
Label BHI-Laktosa
16
Label BHI-laktosa ini berwarna coklat tua sebelum digoreskan dengan biakan E.coli. Label yang diuji dengan metode penggoresan mengalami perubahan warna dari coklat tua menjadi coklat kemerahan. Perubahan warna ini tidak signifikan karena tidak dapat terlihat secara kasat mata. Perubahan warna pada label cerdas di dalam cawan dapat dilihat saat cawan dilalui oleh cahaya. Perubahan warna pada label cerdas di dalam cawan dapat dilihat pada Gambar 12.
(a) (b)
Gambar 12 Perubahan warna label BHI-laktosa
(a) kontrol; (b) label cerdas digoreskan biakan E.coli Warna merah pada label timbul disekitar label yang tidak mengalami goresan biakan E.coli. Warna merah ini timbul karena label diberi indikator warna methyl red dimana indikator ini akan berubah menjadi warna merah saat mendeteksi keberadaan E.coli. Ilustrasi warna merah pada label cerdas di dalam cawan dapat dilihat pada Gambar 13.
Gambar 13 Ilustrasi perubahan warna label cerdas di dalam cawan
Label berupa agar dikemas dengan LDPE (Low Density Polyethylene) yang memiliki tingkat permeabilitas yang paling tinggi dan laju uap air yang rendah. Tingkat permeabilitas pada film itu sendiri adalah kemampuan dari suatu film untuk dapat dilewati oleh suatu zat tertentu. Semakin tinggi nilai permeabilitas dari suatu film, maka semakin mudah suatu film dapat ditembus oleh suatu zat. Laju transmisi uap air adalah kemampuan suatu kemasan untuk menahan uap air masuk ke dalam kemasan. Untuk memilih plastik yang akan dijadikan sebagai sachet untuk label cerdas, diperlukan plastik dengan permeabilitas yang tinggi, agar kondisi media akibat dikonsumsi oleh E.coli dapat menembus permukaan plastik sehingga label dapat mendeteksi adanya E.coli, dan dibutuhkan plastik dengan laju transmisi uap air yang rendah agar plastik yang dijadikan sebagai sachet tidak menahan E.coli untuk masuk ke dalam label. Menurut Joseph (1984), LDPE memiliki tingkat permeabilitas yang tinggi dengan laju uap air yang rendah sehingga plastik jenis LDPE merupakan kemasan terbaik sebagai pengemas label.
17
(a) (b)
Gambar 14 Label BHI-laktosa dengan metode penangkapan (a) sebelum; (b) sesudah 24 jam
Label BHI-laktosa ini dapat mendeteksi E.coli dan mengalami perubahan warna dari coklat tua menjadi coklat kemerahan dalam waktu 24 jam. Perubahan warna pada label ini hanya terjadi saat label diuji dengan metode penggoresan. Pengujian label BHI-laktosa dengan metode penangkapan tidak menimbulkan perubahan warna. Label BHI-laktosa ini kurang efektif untuk digunakan oleh konsumen sebagai informasi bahwa produk pangan yang dikemas telah terkontaminasi bakteri E.coli.
Label Methyl Red
Pada pembuatan label ini, methyl red digunakan sebagai bahan utama dalam pembuatan label cerdas. Pemilihan methyl red sebagai bahan dasar formulasi karena E.coli dapat menghasilkan asam dari hasil fermentasinya dan akan mengubah pH media menjadi asam. Kondisi asam ini akan tertangkap oleh label cerdas sehingga label cerdas berubah warna dari jingga menjadi merah saat mendeteksi adanya asam hasil fermentasi bakteri E.coli.
Pembuatan label methyl red ini dilakukan dengan memodifikasi pembuatan label BHI-laktosa. Pada label BHI-laktosa, warna yang dihasilkan adalah coklat tua karena adanya campuran bahan BHI broth dan laktosa sehingga perubahan warna merah tidak terlihat dengan baik. Pada pembuatan label methyl red, bahan BHI broth dan laktosa dihilangkan untuk menghilangkan warna gelap pada label untuk menghasilkan warna label yang lebih cerah.
Label yang diuji dengan metode penggoresan mengalami perubahan warna dari jingga menjadi merah muda. Gambar perubahan warna label cerdas di dalam cawan dapat dilihat pada Gambar 15.
(a) (b) (c)
18
Label yang diuji dengan metode penangkapan juga mengalami perubahan warna dari warna jingga menjadi merah muda. Perubahan warna pada label ini terjadi dalam waktu kurang dari 24 jam. Perubahan warna pada label dapat dilihat pada Gambar 16.
(a) (b)
Gambar 16 Perubahan warna label methyl red (a) sebelum; (b) sesudah 19 jam
Perubahan warna pada label methyl red ini berubah dari jingga menjadi merah muda dalam waktu kurang dari 24 jam, yaitu pada jam ke-19. Perubahan warna yang terjadi ini diduga karena adanya asam-asam hasil fermentasi E.coli yang mengubah kondisi media menjadi kondisi asam. Asam-asam ini lalu volatile dan terdeteksi oleh label. Selain karena adanya asam-asam yang volatile, perubahan warna juga dapat dikarenakan bakteri E.coli memiliki kemampuan untuk berpindah tempat dengan cara terbang, bergerak, maupun berenang karena adanya flagella, yaitu struktur panjang menyerupai ekor yang terdapat pada E.coli (Anonim 2014). Hal ini menyebabkan E.coli di dalam cawan berpindah tempat dari media kemudian masuk ke dalam lapisan plastik kemasan label sehingga E.coli tertangkap oleh label yang menyebabkan E.coli pada label mengonsumsi substrat yang terdapat pada label dan menghasilkan kondisi asam hasil fermentasinya. Kondisi asam akibat hasil fermentasi E.coli pada label ini menyebabkan perubahan warna label menjadi merah muda.
Perubahan warna yang terjadi pada label menghasilkan perubahan yang signifikan dan terlihat baik secara visual. Dengan perubahan ini, maka label methyl red dapat menjadi informasi yang baik untuk menunjukkan keberadaan E.coli. Dengan demikian, label methyl red ini merupakan formulasi terbaik.
Sensitifitas Label Terhadap Pertumbuhan E.coli
19
mengetahui waktu yang dibutuhkan oleh label untuk berubah warna saat mendeteksi keberadaan E.coli.
Sebelum uji sensitifitas label cerdas dilakukan, biakan E.coli melalui proses pengenceran terlebih dahulu. Proses pengenceran ini bertujuan untuk mengetahui jumlah biakan E.coli yang akan dimasukkan ke dalam cawan berisi media BHI agar. Pengenceran dilakukan dari 100 hingga 10-15 lalu diuji dengan media EMB agar untuk mengetahui jumlah koloni E.coli pada masing-masing pengenceran. Pada uji ini pengenceran yang dipakai adalah 100, 10-5, 10-10, dan 10-15. Setelah itu, E.coli diinokulasi dengan metode tuang ke dalam cawan yang telah direkatkan label cerdas pada bagian dalam tutup cawan. Uji sensitifitas dilakukan dengan metode penangkapan. Perubahan warna pada label cerdas diamati setiap 3 jam selama 24 jam dan label cerdas pada setiap pengenceran di setiap pengamatan diencerkan menggunakan air steril. Setelah itu biakan E.coli pada air steril dimasukkan ke dalam cawan berisi media EMB agar untuk mengetahui jumlah E.coli yang dapat ditangkap oleh label. Uji sensitifitas ini dilakukan sebanyak dua kali pengulangan. Jumlah koloni E.coli keempat pengenceran pada pengulangan pertama adalah sebagai berikut.
Tabel 7 Jumlah koloni E.coli pada pengulangan pertama Pengenceran Jumlah koloni (cfu)
100 TBUD
10-5 TBUD
10-10 TBUD
10-15 27
Keterangan:
TBUD (Terlalu Banyak Untuk Dihitung)
Jumlah koloni E.coli yang diinokulasi ke dalam BHI agar pada pengenceran 100 adalah sebanyak 27 × 1015 cfu. Dapat dilihat pada Lampiran 2 bahwa pada pengenceran ini label cerdas dapat berubah warna menjadi merah mudah pada jam ke-12. Lain halnya pada label cerdas yang diuji dengan pengenceran yang lebih tinggi dimana perubahan warna terjadi lebih lama dibandingkan pada pengenceran 100. Hal ini karena pada pengenceran 100 jumlah E.coli yang diinokulasi ke dalam media BHI agar sudah lebih dari 300 koloni atau TBUD (Terlalu Banyak Untuk Dihitung) sehingga jumlah koloni E.coli semakin banyak karena terus berkembangbiak pada media dan penurunan pH media menjadi kondisi asam semakin cepat terjadi. Penurunan pH media yang cepat ini menyebabkan label cerdas berubah warna menjadi merah muda dengan cepat. Jumlah koloni E.coli yang tertangkap pada label cerdas yaitu TBUD (Terlalu Banyak Untuk Dihitung). Hal ini karena E.coli diinokulasi dengan metode tuang, dimana dengan metode tuang ini mikroba yang diinokulasi tidak hanya tumbuh dibagian permukaan agar, tetapi juga di dalam agar sehingga pertumbuhan E.coli semakin cepat. Pertumbuhan E.coli yang sangat cepat ini mengakibatkan label dapat mendeteksi kondisi asam pada media dan menangkap E.coli yang berpindah tempat dari permukaan agar ke permukaan label.
20
Tabel 8 Jumlah koloni E.coli pada pengulangan kedua Pengenceran Jumlah koloni (cfu)
100 TBUD
10-5 TBUD
10-10 TBUD
10-15 26
Keterangan:
TBUD (Terlalu Banyak Untuk Dihitung)
Jumlah E.coli yang diinokulasi ke dalam BHI agar pada pengenceran 100 di pengulangan kedua ini adalah sebanyak 26 × 1015 cfu. Pada pengulangan kedua ini, label cerdas dapat mendeteksi adanya E.coli pada jam ke-9 untuk pengenceran 100, jam ke-12 pada pengenceran 10-5, jam ke-15 pada pengenceran 10-10, dan jam ke-18 pada pengenceran 10-15. Hal ini tidak berbeda jauh dengan pengulangan sebelumnya karena jumlah E.coli pada pengenceran 100 hingga 10-10 adalah TBUD. Karena jumlah E.coli yang banyak pada kondisi awal inilah media lebih cepat berubah menjadi kondisi asam sehingga label cerdas pun lebih cepat berubah warna.
Label cerdas berbahan dasar methyl red ini dapat berubah warna dengan cepat, yaitu pada jam ke-9, pada pengulangan pertama, dan jam ke-12, pada pengulangan kedua. Label ini dapat mendeteksi keberadaan E.coli apabila jumlah E.coli dalam keadaan awal koloni telah lebih dari 300 koloni. Apabila jumlah E.coli pada biakan kurang dari 300 koloni, maka waktu yang dibutuhkan oleh label untuk berubah warna lebih lama. Hal ini karena E.coli akan membutuhkan waktu yang lebih lama untuk berkembang biak sehingga perubahan kondisi media menjadi kondisi asam pun perlu waktu yang lebih lama. Apabila nutrisi di lingkungan hidup E.coli tidak cukup memenuhi kebutuhan E.coli untuk hidup, maka waktu yang dibutuhkan oleh E.coli untuk mengubah kondisi media membutuhkan waktu yang lebih lama. Label cerdas ini cukup efektif untuk digunakan karena dapat berubah warna dari jingga menjadi merah mudah dalam waktu 9 hingga 12 jam dengan perubahan warna yang signifikan sehingga dapat menjadi informasi yang baik bagi konsumen.
21
Tabel 9 Sensitifitas label tanpa bakteri E.coli
Perlakuan Jam ke-
0 12 24
Negatif
Tanpa media
S. thypi
Keterangan : Perlakuan negatif dilakukan tanpa media dan tanpa biakan E.coli
Kuantifikasi Perubahan Warna Label Cerdas
Warna merupakan cahaya yang dipancarkan dengan panjang gelombang yang berbeda dan tertangkap oleh indra penglihatan, yaitu mata. Warna ini kemudian diterjemahkan oleh otak untuk membedakan warna-warna yang terdapat pada suatu objek. Menurut Nofrida (2013), warna merupakan salah satu faktor yang penting dalam penentuan mutu pangan, baik untuk indikator kematangan, kesegaran, maupun kerusakan pangan.
Perubahan warna pada label menentukan kelayakan label untuk digunakan sebagai media informasi. Terdapat beberapa alat yang dapat digunakan untuk mengukur warna secara kuantitatif, seperti spektrofotometer dan kromameter. Perbedaan penggunaan alat-alat tersebut yaitu spektrofotometer digunakan untuk menguji warna sampel berupa cairan yang dapat ditembus cahaya sedangkan kromameter digunakan untuk menguji warna pada sampel berupa padatan.
Nilai yang ditunjukkan pada alat ini adalah nilai RGB (Red, Green, dan Blue) dan nilai HSL (Hue, Saturation, dan Luminance). Nilai RGB mewakili warna primer yang dapat menghasilkan satu warna solid. Hue, saturation, dan luminance adalah cara yang baik untuk melihat warna dengan pendekatan secara visual (Bolch 2007). Hue adalah komponen yang menentukan warna yang terdapat pada sampel. Nilai °Hue ini menunjukkan warna utama yang terdapat pada sampel. Jika nilainya berubah, maka warna utama dari sampel tersebut akan berbeda. Nilai saturation menunjukkan intensitas warna yang terdapat pada sampel. Nilai saturation minimal menunjukkan bahwa sampel menunjukkan warna hitam-putih, sedangkan saturation dalam nilai maksimal menunjukkan sampel memiliki warna yang bervariasi. Luminance adalah intensitas gelap-terang atau kecerahan-kegelapan warna dari suatu sampel (Courvoisier 2008).
22
converter ini dapat ditemukan pada aplikasi Paint Microsoft Windows Version 6.1.
Nilai yang ditunjukkan oleh color analyzer menunjukkan angka pada rentang 0 hingga 1023 dimana nilai RGB pada aplikasi Paint berada pada rentang 0 hingga 255. Saat color analyzer dikalibrasi pada kertas putih yang tersedia, color analyzer menujukkan nilai RGB masing-masing adalah 1023. Maka semakin besar nilai RGB pada color analyzer akan menunjukkan bahwa warna yang ditunjukkan semakin terang dan semakin mendekati warna putih. Begitu pula nilai RGB pada aplikasi. Saat nilai RGB masing-masing adalah 255, warna yang tertera adalah warna putih. Konversi nilai color analyzer ke warna yang sebenarnya dilakukan dengan dua cara, yaitu dengan memasukkan nilai color analyzer secara langsung pada aplikasi Paint dan mengkonversi nilai terlebih dahulu sebelum angka dimasukkan pada aplikasi Paint. Karena nilai RGB maksimal pada color analyzer dan aplikasi berbeda, maka saat nilai color analyzer menunjukkan angka lebih dari 255, angka yang dimasukkan ke aplikasi adalah 255. Contoh konversi warna dapat dilihat pada tabel berikut.
Tabel 10 Hasil konversi nilai ke warna sebenarnya Perlakuan
Konversi Foto Aplikasi
Hasil
Konversi nilai color analyzer sebelum dimasukkan pada aplikasi Paint dilakukan untuk mensinkronisasi nilai color analyzer dengan nilai yang akan dimasukkan ke aplikasi. Konversi nilai dilakukan dengan cara sebagai berikut.
dimana : Nkon = Nilai Hasil Konversi Nca = Nilai Color analyzer
Contoh:
Pada pengenceran 100 pada jam ke-15, nilai yang ditunjukkan pada color analyzer untuk nilai R (Red) adalah 268. Maka perhitungan nilai konversi dilakukan dengan cara berikut.
255 1023 Nkon = Nca ×
255
1023 = perbandingan skala
255 1023 Nkon = 268 ×
23
Nilai yang didapatkan dari hasil konversi untuk nilai R (Red) adalah 67. Maka nilai yang dimasukkan pada aplikasi Paint untuk nilai R (Red) adalah 067. Begitu pula untuk nilai Green dan Blue pada masing-masing sampel. Nilai RGB hasil konversi ini lalu dimasukkan pada aplikasi Paint dan dikonversi menjadi warna solid sebenarnya seperti yang tertera pada Tabel 10 kolom 4 dan 7. Nilai RGB dari pengujian label menggunakan color analyzer baik yang telah dikonversi maupun dimasukkan ke dalam aplikasi secara langsung dapat dilihat pada Lampiran 2 dan 3.
Seperti yang dapat dilihat pada Tabel 10 bahwa kedua hasil konversi ke warna yang sebenarnya menghasilkan warna solid yang berbeda. Nilai yang dimasukkan secara langsung, tanpa konversi nilai, ke aplikasi menghasilkan warna yang lebih mendekati warna label sebenarnya karena warna berada di sekitar warna jingga hingga merah muda.Lain halnya dengan nilai yang dikonversi terlebih dahulu sebelum nilai dimasukkan ke aplikasi. Warna yang dihasilkan adalah warna coklat tua yang bervariasi namun perbedaannya tidak terlihat secara visual. Oleh karena itu konversi nilai color analyzer menjadi warna yang sebenarnya tidak menghasilkan warna yang sesuai sehingga aplikasi Paint ini dirasa kurang tepat untuk mengkonversi warna hasil uji kuantifikasi menggunakan color analyzer ke warna yang sebenarnya. Dengan demikian nilai tanpa konversi menghasilkan warna yang mendekati dengan warna yang visual hasil yang sebenarnya. Namun cara ini memiliki tingkat kesalahan dibandingkan nilai yang dikonversi. Tingkat kesalahan dihitung pada nilai Red yang memiliki nilai lebih dari 255 yang sesuai dengan perumusan berikut.
dimana : TK = Tingkat Kesalahan Nkon = Nilai Hasil Konversi
Dari hasil uji pada Lampiran 2 dan 3 dapat dilihat bahwa degradasi warna yang dihasilkan dengan tanpa konversi nilai berubah dari warna jingga dan pada jam ke-9 hingga jam ke-12 warna berubah menjadi merah muda pada pengenceran 100. Hal ini menunjukkan bahwa perubahan warna pada label cerdas menjadi warna merah muda disebabkan karena label cerdas telah mendeteksi keberadaan E.coli. Perubahan warna label cerdas menjadi warna merah mudah juga dapat dilihat pada label cerdas dengan pengujian E.coli pada pengenceran 10-5 di jam ke-12. Perbedaan waktu perubahan warna pada label terjadi karena jumlah koloni E.coli pada masing-masing pengenceran berbeda-beda. Semakin banyak jumlah koloni E.coli pada kondisi awal E.coli di dalam media, maka label semakin cepat berubah warna.
Dengan adanya hasil kuantifikasi warna ini, nilai yang telah diterjemahkan ke dalam warna yang sebenarnya telah membuktikan adanya perbedaan warna sebelum label cerdas diuji pada biakan E.coli dan setelah label telah mendeteksi adanya E.coli.
255 - Nkon
24
SIMPULAN DAN SARAN
Simpulan
Label PVA-EMB dapat mendeteksi E.coli pada jam ke-72 dengan perubahan warna label dari merah muda kemudian timbul koloni berwarna hijau saat mendeteksi keberadaan E.coli. Label BHI-laktosa tidak dapat mendeteksi keberadaan E.coli. Label methyl red dapat mendeteksi E.coli dengan perubahan warna dalam waktu kurang dari 24 jam. Label terbaik adalah label methyl red.
Label methyl red dapat berubah warna dari jingga menjadi merah muda dalam kurun waktu 9 hingga 12 jam dengan nilai RGB dalam rentang berturut-turut adalah 176-443, 41-221, dan 31-197. Konversi nilai RGB pada color analyzer ke dalam aplikasi Paint memiliki warna solid yang berbeda dengan tingkat kesalahan sebesar 57% hingga 75%.
Saran
25
DAFTAR PUSTAKA
Ancharya T. 2014. Methyl red (MR) test: principle, procedure, and result. http://microbeonline.com/methyl-red-mr-test-principle-procedure-results/ [Internet]. [diunduh 2014 Juli 12].
Anonim. 2014. 4 faktor yang membuat bakteri bersifat patogen. http://www.amazine.co/22871/4-faktor-yang-membuat-bakteri-bersifat-patogen/ [Internet]. [diunduh 2014 Agustus 29].
Anonim. 2014. Brain Heart Infusion Agar. http://www.anaerobesystems.com/ [Internet]. [diunduh 2014 Juni 12].
Blackburn C, McClure P, Betts R, Legan D, Vandeven M, Cole M, Stewart C, Ross T, McMeekin T, Johnston M et al. 2003. Foodborne pathogens: hazards, risk analysis, and control. Cambridge: Woodgead Publishing Ltd. Bolch LN. 2007. Hue-saturation-luminance. http://www.larry-bolch.com/
shade/hsl.htm. [Internet]. [diunduh 2014 Agustus 17]
Brody AL, Strupinsky ER, Kline LR. 2001. Active packaging for food applications. London: CRC Press.
[BSN] Badan Standarisasi Nasional. 2008. Standar mutu karkas dan daging sapi (SNI 3932:2008). http://sisni.bsn.go.id [Internet]. [diunduh 2014 Juli 12]. [CDC] Centers for Disease Control and Prevention. 2012. Escherichia coli.
http://www.cdc.gov/ecoli/general/index.html. [Internet]. [diunduh 2014 Juli 7]
Clarence OK. 2013. Sessence of Photoelectric colorimetric assays of alcoholic methyl red dye solution in the purification of azo dye-contaminated waste water. J Chem. 1 (3) : 071-076.
Courvoisier J. 2008. Hue, saturation, and luminance adjustments. http://www.peachpit.com/articles. [Internet]. [diunduh 2014 Agustus 17].
D’Mello JPF, Arnold DL, Baratta EJ, Bardocz S, Beresford NA, Berman F, Cabras P, Eicholzer M, Ewen SWB, Feeley M et al. 2003. Food safety: contaminants and toxins. London: CABI Publishing.
[DoH] Departement of Health. 1994. Management of outbreaks of foodborne disease. Di dalam: Pawsey. 2002. Case studies in food microbiology for food safety and quality. London: The Royal Society of Chemistry.
Frobisher. 1968. Fundamentals of microbiology. 8th edition. Philadelphia: WB Saunders Company.
Hasnedi YW. 2009. Pengembangan kemasan cerdas (smart packaging) dengan sensor berbahan dasar kitosan-asetat, polivinil alkohol, dan pewarna indikator bromthymol blue sebagai pendeteksi kebusukan fillet ikan nila. [Skripsi]. Bogor (ID): Program Studi Teknologi Hasil Perikanan, Fakultas Perikanan dan Kelautan, Institut Pertanian Bogor.
Hodgkinson N, Taylor M. 2000. Thermoplastic poly (vinyl alcohol) (PVOH). Di dalam: Nofrida R. 2013. Film indikator warna daun erpa (Aerva sanguinolenta) sebagai kemasan cerdas untukproduk rentan suhu dan cahaya [Tesis] Bogor (ID): Sekolah Pascasarjana Institut Pertanian Bogor. Joseph FH. 1984. Package Engineering. Di dalam: Suhelmi. 2007. Pengaruh
26
Departemen Teknologi Industri Pertanian, Fakultas Teknologi Pertanian, Institut Pertanian Bogor.
Kerry JP, Day BPF, Lagaron JM, OcioMJ, Hogan SA, Taoukis PS, Pacquit K, Crowley K, Diamond D, Butler Pet al. 2008. Smart packaging technologies. UK: John Wiley & Sons Ltd.
Kuntaman. 2011. Escherichia coli, sahabat manusia, penyelamat dunia, yang disiasiakan. http://kuntaman-fk.web.unair.ac.id/artikel_detail [Internet]. [diunduh 2014 Juli 7].
[LACC] Los Angeles City College. 2014. Methyl red broth or mixed acid fermentation tests. http://faculty.lacitycollege.edu/hicksdr/mrvp.htm [Internet]. [diunduh 2014 Agustus17].
Lal, Cheeptam. 2013. Eosin-methylene blue agar plates protocol. http://www.microbelibrary.org/component/resource/laboratory-test/2869-eosin-methylene-blue-agar-plates-protocol. [Internet]. [diunduh 2014 Agustus 17].
Lestari IA. 2013. Pembuatan label cerdas pendeteksi Escherichia coli. [Skripsi]. Bogor (ID): Departemen Teknologi Industri Pertanian, Fakultas Teknologi Pertanian, Institut Pertanian Bogor.
[NJH] New Jersey Departement of Health. 2007. Frequently asked question about Escherichia coli 0157:H7. http://www.state.nj.us/health/cd/documents/ faq/ecoli_faq.pdf. [Internet]. [diunduh 2014 Juli 7].
Neogen. 2011. Eosin methylene blue agar. www.neogen.com/Acumedia/ pdf/ProdInfo/7103_PI.pdf. [Internet].[diunduh 2014Agustus17].
Nofrida R. 2013. Film indikator warna daun erpa (Aerva sanguinolenta) sebagai kemasan cerdas untuk produk rentan suhu dan cahaya. [Tesis]. Bogor (ID): Sekolah Pascasarjana Institut Pertanian Bogor.
Ompusunggu H. 2012. Sintesis dan karakterisasi sifat termal nanokomposit PVA/ZnS dengan metode simple mixing. [Skripsi]. Medan (ID): Jurusan Fisika, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Negeri Medan.
Pawsey. 2002. Case studies in food microbiology for food safety and quality. London: The Royal Society of Chemistry.
Puspaningrum A. 2008. Penerapan metode polymerase chain reaction menggunakan primer 16E1 dan 16E2 untuk mendeteksi Escherichia coli dalam berbagai sampel air. [Skripsi]. Depok (ID): Departemen Farmasi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Indonesia. Rahayu, Nurwitri. 2012. Mikrobiologi pangan. Bogor (ID): IPB Press.
Robertson GI. 2006. Food packaging – principles and practice. Second edition. Florida: CRC Press.
Sheftel VO. 2000. Indirect food aditives and polymer: migration and toxicology. London: Lewis Publisher.
SIFIN. 2006. Brain heart infusion broth. www.sifin.de/english/produktinfo/brain-heart-infusion-broth-tn1216.pdf. [Internet]. [diunduh 2014 Agustus 17]. Warsiki E, Yuliasih I, Nofrida R. 2013. Pengaruh suhu penyimpanan terhadap
perubahan warna label cerdas indikator warna daun erpa. J TIP. 23 (3): 232-241.
27
28
Lampiran 1 Jumlah E.coli yang tertangkap oleh label
Pengenceran Jam ke-
0 3 6 9 12 15 18 21 24
100 - - TBUD TBUD TBUD TBUD TBUD TBUD TBUD
- - TBUD TBUD TBUD TBUD TBUD TBUD TBUD
10-5 - - TBUD TBUD TBUD TBUD TBUD TBUD TBUD
- - TBUD TBUD TBUD TBUD TBUD TBUD TBUD
10-10 - 2 240 TBUD TBUD TBUD TBUD TBUD TBUD
- - TBUD TBUD TBUD TBUD TBUD TBUD TBUD
10-15 - 1 300 TBUD TBUD TBUD TBUD TBUD TBUD
- - TBUD TBUD TBUD TBUD TBUD TBUD TBUD Keterangan:
29
Konversi Foto Aplikasi
Hasil
30
Lampiran 2 Perbandingan hasil kuantifikasi perubahan warna pada label pada pengulangan pertama (lanjutan)
Konversi Foto Aplikasi
Hasil
31
Lampiran 2 Perbandingan hasil kuantifikasi perubahan warna pada label pada pengulangan pertama (lanjutan)
Pengenceran 10-10
Konversi Foto Aplikasi
Hasil
32
Lampiran 2 Perbandingan hasil kuantifikasi perubahan warna pada label pada pengulangan pertama (lanjutan)
Pengenceran 10-15
Konversi Foto Aplikasi
Hasil
33
Lampiran 3 Perbandingan hasil kuantifikasi perubahan warna label pada pengulangan kedua
Konversi Foto Aplikasi
Hasil
34
Lampiran 3 Perbandingan hasil kuantifikasi perubahan warna label pada pengulangan kedua (lanjutan)
Konversi Foto Aplikasi
Hasil
35
Lampiran 3 Perbandingan hasil kuantifikasi perubahan warna label pada pengulangan kedua (lanjutan)
Konversi Foto Aplikasi
Hasil
36
Lampiran 3 Perbandingan hasil kuantifikasi perubahan warna label pada pengulangan kedua (lanjutan)
Konversi Foto Aplikasi
Hasil
37
RIWAYAT HIDUP
Penulis dilahirkan di Cirebon pada tanggal 20 Oktober 1992 sebagai anak sulung dari pasangan Tedi Suharja dan Ucu Kusumayati. Tahun 2010 penulis lulus dari SMA Negeri 1 Bogor dan pada tahun yang sama penulis lulus seleksi di Institut Pertanian Bogor melalui jalur Undangan Seleksi Mahasiswa IPB (USMI) dan diterima di Departemen Teknologi Industri Pertanian, Fakultas Teknologi Pertanian.
Selama mengikuti perkuliahan, penulis pernah menjadi wakil sekretaris di Himpunan Mahasiswa Teknologi Industri (HIMALOGIN) tahun 2011/2012, staf lini produksi pada divisi technopreneur Himpunan Mahasiswa Teknologi Industri (HIMALOGIN) tahun 2012/2013, dan asisten praktikum mata kuliah Teknologi Penyimpanan dan Penggudangan tahun ajaran 2012/2013. Pada bulan Juni-Agustus 2013 penulis melaksanakan Praktik Lapangan di PT. Indofood Fritolay Makmur Tangerang dengan judul Mempelajari Pengawasan Mutu Produk Snack serta Validasi Moisture Analyzer dan Soxtec di PT Indofood Fritolay Makmur Tangerang. Penulis pernah mengikuti kepanitiaan Agroindustrial Fair sebagai staf Publikasi pada tahun 2011 dan 2012, Hari Warga Industri (Hagatri) Masa Perkenalan Departemen Teknologi Industri Pertanian tahun 2012 sebagai Tim Kreatif, dan One Day Student Technopreneurship Program Workshop (One Step RAMP IPB) sebagai sekretaris pada tahun 2012.