LABEL CERDAS INDIKATOR WARNA DARI EKSTRAK
KUBIS MERAH (
Brassica oleracea)
MUHAMAD HARIS
DEPARTEMEN TEKNOLOGI INDUSTRI PERTANIAN FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Label Cerdas Indikator Warna dari Ekstrak Kubis Merah (Brassica oleracea) adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2015
Muhamad Haris
ABSTRAK
MUHAMAD HARIS. Label Cerdas Indikator Warna dari Ekstrak Kubis Merah (Brassica oleracea). Dibimbing oleh ENDANG WARSIKI
Kemasan cerdas adalah kemasan indikator yang diletakkan didalam atau diluar kemasan makanan untuk memberikan informasi mengenai keadaan kemasan dan kualitas produk di dalamnya. Salah satu jenis terpopuler dewasa ini ialah dalam bentuk label/film berupa campuran PVA (Polivinil Alkohol) dan bahan pewarna alami sebagai indikator. Tujuan dari penelitian ini adalah untuk mempelajari dan mengembangkan label cerdas dari bahan PVA dengan penambahan pewarna ekstrak kubis merah sebagai indikator serta mempelajari teknik pewarnaan film. Tahap pertama yakni ekstraksi kubis merah yaitu dengan cara: 1) perebusan, 2) penghancuran dengan blender, dan 3) ekstraksi menggunakan pelarut etanol 98%, dengan proses terpilih yakni perebusan selama 7 menit menghasilkan ekstrak dengan pH 6.21 dan kadar antosianin 25.02 mg per 100 gram bahan. Selanjutnya, tahap pembuatan film menggunakan PVA dengan formulasi: 3 g (b/b), 3.5 g (b/b), dan 4 g (b/b), dimana film terbaik dengan ketebalan 0.15 mm, kekuatan tarik 2.64 kgf/mm² dan elongasi 210 % ditunjukkan pada formulasi PVA 3.5 g. Metode pembuatan film dengan teknik pencampuran menghasilkan film tidak berwarna, sedangkan metode pengolesan menghasilkan
film berwarna yang merata dan stabil. Hasil pengukuran warna film untuk suhu ruang, kulkas dan freezer berturut-turut pada koefisien determinasi nilai L yakni 0.782, 0.418 dan 0.066; nilai a* 0.7975, 0.5880, dan 0.7179; dan nilai b* 0.8393, 0.4534, 0.3631. Persamaan linier nilai ohue menghasilkan koefisien determinasi tinggi berturut-turut 0.8536, 0.6586, 0.8061. Peningkatan suhu penyimpanan menyebabkan terjadinya peningkatan nilai ohue, dan semakin lama waktu penyimpanan juga menyebabkan ohue semakin meningkat.
ABSTRACT
MUHAMAD HARIS. Smart Label Color Indicator of Red Cabbage Extract (Brassica oleracea). Supervised by ENDANG WARSIKI.
Smart packaging is an indicator, either it is placed internally or externally in the food packaging to provide information about the quality of the product packed. One of the most popular nowadays is in the form of film made from PVA (polyvinyl alcohol) with additional natural dyes as its indicator. The purpose of this research was to study and develop smart packaging made from PVA and red cabbage extract as the natural dyes and figure out the best formulation as well as to study the film coloring technic. First step was the red cabbage color extraction conducted in methods namely: 1) boiling, 2) crushing in a blender, and 3) solvent extraction using 98% ethanol; while the selected process was by boiling for 7 minutes resulting extract with pH of 6.21 and anthocyanin content of 25.02 mg per 100 gram red cabbage. Afterwards, film preparation with PVA powders formulations applied as following: 3 g (w/w), 3.5 g (w/w) and 4 g (w/w); while the best film resulted with thickness of 0.15 mm, tensile strength of 2.64 kgf/mm² and elongation of 210% shown by 3.5 g PVA powder film formulation. Film formulation technique by mixing method produced colorless film, whereas tinting method showed more uniform and stable colored film. Indicator film color measurement for room, cooler and freezer temperature showed L determination coefficient were 0.782, 0.418 and 0.066, respectively; a* value of 0.7975, 0.5880 and 0.7179, respectively; and b* value of 0.8393, 0.4534 and 0.3631, respectively.
o
Hue linier equation revealed high determination coefficients of 0.8536, 0.6586 and 0.8061, respectively. Rising storage temperature lead to increase in ohue value, and the longer storage time the higher ohue value.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Teknologi Pertanian
pada
Departemen Teknologi Industri Pertanian
LABEL CERDAS INDIKATOR WARNA DARI EKSTRAK
KUBIS MERAH (
Brassica oleracea)
DEPARTEMEN TEKNOLOGI INDUSTRI PERTANIAN FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
2015
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga skripsi berjudul “Label Cerdas Indikator Warna dari Ekstrak Kubis Merah (Brassica oleracea)” ini berhasil diselesaikan. Tema yang dipilih dalam penelitian ini ialah Teknologi Pengemasan.
Terima kasih penulis sampaikan kepada:
1. Dr. Endang Warsiki S.TP, M.Si. selaku dosen pembimbing atas bimbingan dan motivasi yang diberikan.
2. Dr. Ir. Sugiarto, M.Si dan Dr. Farah Fahma, S.TP. MT. selaku dosen penguji atas saran dan masukan yang diberikan.
3. Seluruh dosen dan staff Departemen Teknologi Industri Pertanian
4. Seluruh laboran Departemen Teknologi Industri Pertanian yang telah membantu selama proses penelitian.
5. Bapak Sudirja, Ibu Nurhayati, adik Reza Hidayat, Tutus Kuryani, serta seluruh keluarga dan sahabat, atas segala doa dan kasih sayangnya. 6. Teman-teman di pondok Emperor dan pondok Dinzayu 4 serta
teman-teman TIN 46 atas kebersamaan yang berkesan, perjuangan, semangat dan doa yang diberikan.
Semoga karya ilmiah ini bermanfaat.
Bogor, Agustus 2015
DAFTAR ISI
DAFTAR TABEL x
DAFTAR GAMBAR x
DAFTAR LAMPIRAN xi
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
TINJAUAN PUSTAKA 2
Label/Kemasan Cerdas 2
Polivinil Alkohol (PVA) Sebagai Matriks Film 3
METODE 5
Bahan dan Alat 5
Metode 6
Ekstraksi dan Karakterisasi Pewarna Kubis Merah 6
Pembuatan Film PVA 6
Pembuatan Label/Film Indikator Warna 8
Karakterisasi Sifat Fisik dan Mekanis Label/Film Indikator 8
Analisis Perubahan Warna Film Indikator 8
HASIL DAN PEMBAHASAN 10
Ekstraksi dan Karakterisasi Pewarna Kubis Merah 10
Label/Film Berbahan Dasar PVA 11
Pembuatan Label/Film Indikator Warna 12
Karakteristik Sifat Fisik dan Mekanis Film Indikator 13
Analisis Perubahan Warna Film Indikator 14
SIMPULAN DAN SARAN 24
Simpulan 24
Saran 24
DAFTAR PUSTAKA 25
LAMPIRAN 27
RIWAYAT HIDUP 31
DAFTAR TABEL
1 Formulasi film PVA 6
2 Interpretasi Nilai R2 11
3 Hasil setiap cara ekstraksi kubis merah 10
4 Kadar antosianin pada berbagai tanaman 10
5 Hasil ekstraksi dengan cara perebusan 11
6 Hasil formulasi pembuatan film PVA 11
7 Hasil pengujian sifat fisik film PVA 14
8 Persamaan regresi dan nilai R2 dari grafik nilai L* suhu ruang, suhu
kulkas, dan suhu freezer 17
9 Persamaan regresi dan nilai R2 dari grafik nilai a* suhu ruang, suhu
kulkas, dan suhu freezer 20
10 Persamaan regresi dan nilai R2 dari grafik nilai b* suhu ruang, suhu
kulkas, dan suhu freezer 22
11 Persamaan regresi dan nilai R2 dari hubungan lama penyimpanan terhadap nilai ohue film indikator suhu ruang, suhu kulkas, dan suhu
freezer 23
DAFTAR GAMBAR
1 Kemasan cerdas pada produk 3
2 Rumus bangun antosianin 5
3 Diagram alir pembuatan film PVA 6
4 Label/film indikator dengan pewarna kubis merah
(a) 4 mL dan (b) 6 mL 13
5 Perubahan warnaindikator (i) awal penyimpanan (0 jam), (ii) akhir penyimpanan (120 jam) pada (a) suhu ruang, (b) suhu kulkas, dan
(c) suhu freezer 16
6 Grafik nilai L* film indikator selama penyimpanan suhu ruang 16 7 Grafik nilai L* film indikator selama penyimpanan suhu kulkas 17 8 Grafik nilai L* film indikator selama penyimpanan suhu freezer 17 9 Grafik nilai a* film indikator selama penyimpanan suhu ruang 19 10 Grafik nilai a* film indikator selama penyimpanan suhu kulkas 19 11 Grafik nilai a* film indikator selama penyimpanan suhu freezer 19 12 Grafik nilai b* film indikator selama penyimpanan suhu ruang 21 13 Grafik nilai b* film indikator selama penyimpanan suhu kulkas 21 14 Grafik nilai b* film indikator selama penyimpanan suhu freezer 21 15 Hubungan lama penyimpanan terhadap nilai ohue film indikator
selama penyimpanan suhu ruang 22
16 Hubungan lama penyimpanan terhadap nilai ohue film indikator
selama penyimpanan suhu kulkas 22
17 Hubungan lama penyimpanan terhadap nilai ohue film indikator
DAFTAR LAMPIRAN
1 Prosedur analisa uji 27
1
PENDAHULUAN
Latar Belakang
Teknologi dalam bidang kemasan saat ini sedang berkembang pesat. Salah satu yang mendorong munculnya berbagai inovasi, kebaruan, dan tren ialah tuntutan konsumen terhadap kemudahan penggunaan kemasan. Dewasa ini industri pengemasan kerap dituntut untuk meneliti berbagai material baru mengingat semakin pekanya konsumen terhadap nilai keamanan produk terkemas. Salah satu alternatif kemasan modern saat ini yang mempunyai kriteria tersebut yaitu kemasan cerdas. Kemasan cerdas merupakan kemasan yang mampu menginformasikan kesegaran dari produk makanan yang dikemasnya. Hal ini dikarenakan teknologi tersebut dapat memberikan informasi kepada konsumen untuk memantau kualitas dan keamanan produk pangan baik selama penyimpanan, transportasi dan pemasaran.
Penurunan mutu produk tidak dapat dilihat tanpa adanya sebuah indikator. Oleh sebab itu perlu indikator yang dapat berperan sebagai media informasi kepada konsumen akan kesegaran produk selama penyimpanan yang mudah rusak, seperti produk yang rentan penurunan kualitas akibat berbagai faktor. Salah satu jenis kemasan cerdas ialah Time Temperature Indicators (TTI) atau biasa dikenal sebagai label indikator warna. Beberapa penelitian kemasan cerdas berbentuk label telah banyak dilakukan. Nofrida et al. (2013), Warsiki et al.
(2013) telah meneliti label cerdas indikator warna untuk mendeteksi kerusakan susu pasteurisasi, serta meneliti label indikator pendeteksi Eschericia coli (Warsiki dan Rahayuningsih 2014), Staphlylococcus aureus (Warsiki et al. 2014), dan Salmonella typhimurium (Warsiki et al. 2014). Hong dan Park (2000) mengembangkan indikator warna untuk memantau fermentasi dan umur simpan
kimchi dengan menggunakan perubahan pH dan suhu di dalam kemasan sebagai sensor untuk perubahan warna pada kemasan produk tersebut. Penelitian mengenai label cerdas juga dilakukan oleh Vaikousi et al. (2008) yang mengembangkan label cedas untuk memonitor mutu mikrobial pada produk yang disimpan pada suhu dingin, serta Warsiki dan Putri (2012) tentang label cerdas dengan indikator warna dari bahan alami dan sintetik.
2
Dalam pembuatan label cerdas berbahan dasar PVA menggunakan indikator warna, diperlukan bahan pewarna yang memiliki stabilitas tertentu yang dapat dipengaruhi oleh faktor-faktor seperti suhu penyimpanan dan bahan yang akan dikemas. Salah satu sumber pewarna adalah antosianin. Antosianin adalah pigmen yang bisa larut dalam air. Secara kimiawi antosianin bisa dikelompokkan ke dalam flavonoid dan fenolik. Zat tersebut berperan dalam pemberian warna terhadap bunga atau bagian tanaman lain dari mulai merah, biru sampai ke ungu termasuk juga kuning dan tidak berwarna (seluruh warna kecuali hijau) (Sudiatso 2001). Salah satu sumber pewarna alami dapat diperoleh dari komoditas kubis merah. Kubis merah adalah tanaman yang banyak mengandung antosianin. Antosianin yang diekstrak dari kubis merah bersifat sensitif terhadap panas dan cahaya, sehingga dapat dimanfaatkan sebagai warna indikator pada label cerdas untuk pendeteksi kerusakan produk akibat suhu tinggi. Tanaman ini digunakan sebagai bahan utama pewarna alami dalam penelitian ini.
Tujuan Penelitian
Tujuan umum penelitian ini adalah membuat label cerdas indikator warna berbahan dasar PVA murni dengan pewarna alami kubis merah sebagai indikator warna. Tujuan khusus penelitian ini mendapatkan formulasi PVA terbaik yang menghasilkan film/ label cerdas dengan karakteristik fisik dan mekanis terbaik dan dapat berubah warna pada suhu tinggi.
TINJAUAN PUSTAKA
Label/Kemasan Cerdas
Label atau kemasan cerdas bertujuan untuk mengawasi kondisi makanan terkemas dengan tujuan untuk mendapatkan informasi mengenai kualitas makanan dalam kemasan sewaktu transportasi dan penyimpanan. Pengawasan kondisi makanan dilakukan dengan menggunakan indikator yang dibedakan atas indikator luar dan indikator dalam. Indikator luar adalah indikator yang diletakkan di luar kemasan sementara indikator dalam adalah indikator yang ditempatkan di dalam kemasan, dapat ditempatkan pada head-space kemasan atau ditambahkan pada penutup kemasan. Contoh indikator luar yaitu indikator waktu, indikator suhu dan indikator pertumbuhan mikroba. Sementara contoh indikator dalam adalah indikator oksigen, indikator karbon dioksida, indikator patogen dan indikator pertumbuhan mikroba (Ahvenainen 2003). Menurut Robertson (2006) kemasan cerdas (smart packaging) merupakan kemasan yang memiliki indikator baik yang diletakkan secara internal maupun secara eksternal, yang mampu memberikan informasi tentang keadaan kemasan dan atau kualitas makanan di dalamnya.
3 informasi visual secara langsung kepada produsen, pengecer, dan konsumen mengenai kondisi produk. Selain itu, keuntungan lain penggunaan kemasan cerdas pada produk makanan akan mempertahankan integritas dan aktif dalam mencegah pembusukan, meningkatkan atribut produk (penampilan/warna, rasa, aroma, viskositas, dan tekstur), serta dapat merespon secara aktif terhadap perubahan produk atau lingkungan kemasan (Kuswandi et al. 2011).
Gambar 1 Kemasan cerdas pada produk (Anonim 2009).
Kemasan cerdas pada gambar di atas bekerja berdasarkan waktu kadarluarsanya. Saat produk mendekati kadarluarsa label tersebut akan berubah warna menjadi biru dan akan berubah menjadi biru tua saat produk telah melewati tanggal kadarluarsanya. Dengan demikian, konsumen dapat membedakan mana produk yang masih segar dan mana yang sudah tidak dapat dikonsumsi.
Polivinil Alkohol (PVA) Sebagai Matriks Film
Polivinil alkohol adalah suatu kopolimer vinil alkohol yang tersusun dari komonomer unit vinil seperti ethylene dan prophylene. Pembentukan polivinil alkohol dilakukan melalui proses hidrolisis (saponifikasi) dari polivinil asetat. Reaksi ini dapat berjalan dengan adanya katalis yaitu garam palladium (II) klorida (Schonberger et al. 1997). Polivinil alkohol merupakan polimer sintetik yang mudah diuraikan secara biologi (biodegradable) dan tidak beracun. Pada pengembangannya, polivinil alkohol sudah diaplikasikan dalam bidang kesehatan, pelapis bahan, bahan pembuat detergen, lem, serta pengemulsi (Hodgkinson dan Taylor 2000).
Polivinil alkohol berbentuk serbuk yang berwarna putih dan dapat larut dalam air pada suhu 80oC serta memiliki densitas sebesar 1.20 – 1.30 g/cm3 (Sheftel 2000). Polivinil alkohol dapat digunakan sebagai bahan pembuatan kemasan plastik film. Mutu PVA yang baik ditentukan oleh derajat hidrolisisnya. Derajat hidrolisis berpengaruh terhadap kelarutan PVA dalam air, semakin tinggi derajat hidrolisisnya maka kelarutannya akan semakin rendah. PVA dengan derajat hidrolisis 98.5% atau lebih dapat dilarutkan dalam air pada suhu 70°C (Hassan dan Peppas 2000).
PVA dalam penelitian ini digunakan sebagai bahan dasar pembuatan film
4
Gliserol sebagai Plasticizer
Gliserol adalah senyawa alkohol polihidrat dengan tiga buah gugus hidroksil dalam satu molekul (alkohol trivalen). Rumus kimia gliserol adalah C3H8O3
dengan nilai densitas 1.23 g/cm3 dan titik didihnya 204oC, berbentuk cair, tidak berbau, transparan, higroskopis, dan dapat larut dalam air dan alkohol. Penambahan gliserol dengan jumlah sedikit akan menghasilkan film yang lebih fleksibel dan halus, namun tidak terlalu menurunkan kuat tarik dari film yang dihasilkan (Nurdiana 2002)
Penambahan plasticizer yaitu gliserol mempengaruhi tingkat elastisitas film
yang dihasilkan. Semakin banyak penambahan plasticizer, maka elastisitas film
akan semakin tinggi. Plasticizer adalah bahan organik dengan bobot molekul rendah yang ditambahkan dengan maksud memperlemah kekakuan suatu film. Plasticizer didefinisikan sebagai substansi non volatil yang mempunyai titik didih tinggi, yang jika ditambahkan ke senyawa lain akan mengubah sifat fisik dan mekanik senyawa tersebut. Penambahan plasticizer akan menghindarkan film dari keretakan selama penanganan maupun penyimpanan yang dapat mengurangi sifat–sifat tahanan film (Sumarto 2008).
Kubis Merah Sebagai Sumber Pewarna
Kubis merah merupakan salah satu jenis sayuran yang banyak terdapat di Indonesia. Kubis ini memiliki banyak manfaat karena memiliki banyak kandungan antara lain vitamin (A, B, C, dan E), mineral (kalium, kalsium, fosfor, natrium, dan besi), serta mengandung zat antosianin yang mampu mengubah warna kubis menjadi merah (Ekasari 2009).
Kubis merah mengandung setidaknya tiga puluh enam dari 300 macam antosianin yang berperan dalam berbagai warna merah dan biru pada tanaman (Charron et. al. 2007). Antosianin terdiri dari beberapa cincin karbon ke hidrogen atau kelompok hidroksil terikat. Pembentukan kimia ini memungkinkan molekul antosianin untuk mengambil dua bentuk (di mana salah satu atom hidrogen melekat pada eksterior dan satu tidak). Bahan asam ditandai dengan memiliki lebih banyak atom hidrogen (H+) dari kelompok hidroksil (OH-) sehingga ketika terkena asam, antosianin merebut atom hidrogen dan berubah merah. Dalam kondisi basa dimana tidak ada kelebihan hidrogen atom, molekul warna yang muncul adalah biru atau hijau (Charron et. al. 2007).
Antosianin merupakan pewarna paling penting dan paling luas dalam tumbuhan yang memberikan hampir semua warna merah jambu, merah, lembayung muda, ungu dan biru pada kelopak bunga, daun dan buah pada tumbuhan tingkat tinggi. Semua antosianin memiliki struktur dasar satu gugus aromatik yaitu sianidin dan turunannya dengan penambahan atau pengurangan gugus hidroksil melalui metilisasi atau glikosilasi (Harborne 1983). Fungsi antosianin pada tanaman adalah dalam hal resistensi terhadap penyakit (Salisbury dan Ross 1995).
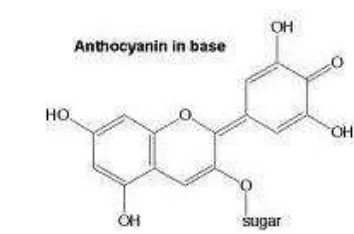
5 kelompok flavonoid yang dikenali. Flavonoid pada umumnya dapat larut dalam air. Flavonoid terdapat pada semua bagian tumbuhan termasuk akar, daun, kayu, kulit, tepung sari, nektar, bunga, buah buni, dan biji (Harbone 1987). Gambar 2 menunjukkan struktur rumus bangun antosianin.
Gambar 2 Rumus Bangun Antosianin (Harbone 1987)
Antosianin yang terkandung dalam kubis merah sangat dipengaruhi stabilitasnya oleh berbagai faktor, antara lain suhu, oksigen dan cahaya. Peningkatan suhu pengolahan hingga penyimpanan dapat mengakibatkan kerusakan dan perubahan warna antosianin secara cepat, hal ini akan berpengaruh terhadap film yang dibuat. Selanjutnya, oksigen dapat menstimulasi terjadinya proses degradasi antosianin secara langsung dan tidak langsung. Secara langsung oksigen mampu menyebabkan oksidasi antosianin membentuk senyawa tidak berwarna yang menurunkan stabilitas warna antosianin. Cahaya juga dapat menyebabkan terjadinya proses degradasi antosianin. Cahaya memiliki energi tertentu yang mampu menstimulasi terjadinya reaksi fotokimia (fotooksidasi) dapat memnyebabkan pembukaan cincin karbon nomor dua. Pada akhirnya reaksi fotokimia (fotooksidasi) tersebut mampu membentuk senyawa yang tidak berwarna seperti kalkon yang merupakan indikator degradasi warna antosianin (Ningrum 2005).
METODE
Bahan dan Alat
Bahan yang digunakan dalam penelitian ini yaitu kristal PVA (polivinil alcohol), gliserol, akuades, etanol teknis 98% dan kubis merah. Sedangkan alat yang digunakan antara lain gelas piala, gelas ukur, neraca analitik, mikro pipet,
6
Metode
Ekstraksi dan Karakterisasi Pewarna Kubis Merah
Tahap pertama yang dilakukan adalah ekstraksi bahan pewarna alami dari kubis merah. Kubis merah yang digunakan adalah kubis merah yang masih segar, warna ungu pekat, daun tidak rusak. Sebelum digunakan, kubis merah dicuci dengan cepat agar mencegah berkurangnya rendemen antosianin. Setelah dicuci daun dikeringkan dengan cara diangin-anginkan. Kemudian ruas-ruas kubis dilepas untuk mempermudah proses pengecilan sebelum ditimbang. Ruas yang telah dilepaskan kemudian dipotong kecil agar ekstrak warna dari dalam daun dapat keluar. Setelah itu ditimbang sesuai kebutuhan yang akan digunakan dalam ekstraksi. Dalam penelitian ini dilakukan 3 (tiga) cara untuk mengekstraksi kubis merah.
(i) Perebusan, menggunakan air mendidih dengan suhu 80 sampai 100oC. Hal ini didasarkan oleh kandungan antosianin yang ada dalam buah kubis merah akan mengeluarkan zat warnanya ketika kontak dengan suhu tinggi. Perebusan dimulai dengan mendidihkan air terlebih dahulu, kemudian potongan kubis merah baru dimasukkan. Perebusan dilakukan selama rentang waktu 7 sampai 10 menit hingga seluruh permukaan daun berwarna putih. Perbandingan kubis merah dengan akuades ditentukan dengan komposisi 1:1 , 1:2 , 1:3.
(ii) Penghancuran, menggunakan blender. Hal ini ditujukan agar memperluas permukaan bahan dan ektrak warna dapat lebih pekat. Langkah pertama dimulai dengan memasukan potongan kubis merah kedalam blender yang sebelumnya telah ditimbang terlebih dahulu. Kemudian dimasukkan akuades dengan perbandingan 1:1 , 1:2 , dan 1:3.
(iii) Pelarutan, menggunakan bahan kimia. Dalam hal ini dipilih alkohol 98% sebagai pelarut. Ekstraksi dengan bahan kimia ditujukan agar kandungan antosianin dapat terekstrak. Langkah pertama yang dilakukan adalah memasukkan potongan kubis merah kedalam erlenmeyer. Kemudian dimasukkan pelarut alkohol 98%. Banyaknya pelarut yang digunakan ditentukan dengan perbandingan 1:1 , 1:2 , dan 1:3. Selanjutnya didiamkan selama 24 jam pada tempat gelap.
Ekstrak dikarakterisasi dengan mengukur pH dan kadar total antosianin. Prosedur analisa dapat dilihat pada Lampiran 1.
Pembuatan Film PVA
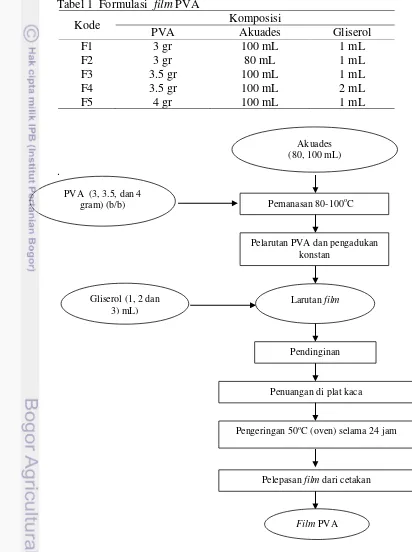
Penelitian pada tahap ini ditujukan untuk memperoleh formulasi pembuatan
7
Akuades (80, 100 mL)
Pemanasan 80-100oC PVA (3, 3.5, dan 4
gram) (b/b)
Pelarutan PVA dan pengadukan konstan
Gliserol (1, 2 dan 3) mL)
Larutan film
Pendinginan
Penuangan di plat kaca
Pengeringan 50oC (oven) selama 24 jam
Pelepasan film dari cetakan
Film PVA
larutan didinginkan di suhu ruang. Pembentukan lembaran film dilakukan dengan cara menuang larutan pada media plat kaca berukuran 20 cm × 30 cm, kemudian diratakan menggunakan sudip kaca. Setelah itu dilakukan pengeringan di dalam oven dengan suhu 50oC selama 24 jam. Formulasi film divariasikan jumlah akuades, PVA dan gliserol seperti pada Tabel 1. Diagram alir pembuatan film
PVA dapat dilihat pada Gambar 3. Tabel 1 Formulasi film PVA
Kode Komposisi
PVA Akuades Gliserol
F1 3 gr 100 mL 1 mL
F2 3 gr 80 mL 1 mL
F3 3.5 gr 100 mL 1 mL
F4 3.5 gr 100 mL 2 mL
F5 4 gr 100 mL 1 mL
.
8
Formulasi film terbaik dipilih berdasarkan karakteristik fisiknya seperti kemudahan pelepasan film dari cetakan, ketebalan dan kelenturan film sebagai label. Hasil terbaik dari tahap ini akan digunakan untuk penelitian pada tahap selanjutnya. Ketebalan merupakan salah satu parameter untuk mengetahui karakteristik film yang telah dibuat. Ketebalan film dipengaruhi oleh volume larutan film dan luas cetakan yang digunakan dalam pembuatan film, semakin besar volume larutan film yang dimasukkan ke dalam cetakan dengan ukuran tertentu maka akan semakin tebal film yang dihasilkan. Ketebalan juga dipengaruhi oleh kekentalan atau viskositas larutan film yang digunakan, semakin besar persentase padatan bahan baku dan plasticizer yang digunakan maka akan semakin meningkatkan ketebalan yang dihasilkan (Buckmann et al. 2002).
Kuat tarik dan persen pemanjangan merupakan sifat mekanik yang berhubungan dengan kekuatan film, semakin tinggi nilai kuat tarik suatu film
maka semakin kuat juga film tersebut. Kuat tarik atau kekuatan tarik menunjukkan ukuran ketahanan film, yaitu regangan maksimal yang dapat diterima sampel sebelum putus, sedangkan persen pemanjangan atau elongasi merupakan perubahan panjang maksimum yang di alami (Theresia 2003).
Pembuatan Label/Film Indikator Warna
Teknik pencampuran pewarna kedalam larutan film PVA digunakan dengan 2 cara, yaitu pencampuran langsung kedalam larutan film dan pengolesan pada permukaan film kering. Pembuatan film indikator warna dengan metode pencampuran dapat dilihat pada Lampiran 2. Sedangkan pembuatan film indikator warna dengan metode oles ditujukkan pada Lampiran 3.
Karakterisasi Sifat Fisik dan Mekanis Label/Film Indikator
Karakterisasi sifat fisik kemasan cerdas (film indikator) dilakukan untuk mengetahui sifat fisik yang dimiliki oleh label (film indikator) yang terbuat dari PVA dan dengan tambahan pewarna ekstrak kubis merah. Pengujian yang dilakukan adalah uji ketebalan film. Sedangkan sifat mekanis dari label/film dilakukan dengan cara pengujian yang meliputi kekuatan tarik dan elongasi. Prosedur analisis karakterisasi sifat fisik dan mekanis film indikator dapat dilihat pada Lampiran 1.
Analisis Perubahan Warna Film Indikator
Pada penelitian ini, dilakukan pengukuran warna film indikator dengan menggunakan alat colorimeter. Colorimeter merupakan alat yang digunakan untuk mengukur warna dari suatu sampel padat. Film indikator diletakkan pada 3 (tiga) tempat berbeda, yaitu pada suhu ruang (±25oC), suhu kulkas (±3-5oC) dan suhu freezer (± (-5)-(-10)oC). Pengamatan dilakukan setiap hari di laboratorium teknologi pengemasan distribusi dan transportasi (TPDT) Departemen Teknologi Industri Pertanian dan diukur nilai warnanya menggunakan alat colorimeter.
9 CIELab merupakan sistem pengukuran yang paling sering digunakan. L* menyatakan parameter kecerahan, a* menyatakan cahaya pantul yang menghasilkan warna kromatik campuran merah-hijau, dan b* menyatakan warna kromatik campuran biru-kuning. Prosedur pengukuran disajikan pada Lampiran 1. Data L*a*b* terhadap waktu t kemudian dilakukan regresi linier untuk memperoleh kecendeungan perubahan warna label. Secara matematik persamaan linier dinyatakan sebagai berikut (Usman dan Akbar 2008):
...(Persamaan 1) Dimana : x = lama penyimpanan
y = hasil pengukuran komponen warna a = slope garis regresi
b = nilai komponen warna pada kondisi garis regresi berpotongan dengan sumbu y
Tingkat ketepatan dan ketelitian pengukuran ditunjukkan dengan melihat nilai korelasi garis regresi (kecenderungan data). Nilai pengukuran dinyatakan baik jika nilai korelasinya lebih dari 80% (R2 ≥ 0.80). Menurut Usman dan Akbar (2008), nilai R2 terbesar adalah +1 dan terkecil adalah -1 sehingga dapat ditulis -1
≤ R2 ≤ +1. Apabila nilai
R2 = +1, maka disebut hubungan positif sempurna dan hubungannya linier langsung sangat tinggi. Sebaliknya jika nilai R2 = -1, maka disebut hubungan negatif sempurna dan hubungannya tidak langsung sangat tinggi (invers). Nilai R2 tidak mempunyai satuan (dimensi). Makna dari nilai R2 yang dihitung dapat diinterpretasikan dengan Tabel 2.
Tabel 2 Interpretasi dari nilai R2 (Usman dan Akbar 2008)
R2 Interpretasi
0 Tidak berkorelasi
0.01 – 0.20 Sangat rendah
0.21 – 0.40 Rendah
0.41 – 0.60 Agak rendah 0.61 – 0.80 Cukup tinggi
0.81 – 0.99 Tinggi
10
HASIL DAN PEMBAHASAN
Ekstraksi dan Karakterisasi Pewarna Kubis Merah
Karakterisasi pewarna kubis merah dilakukan dengan melihat kepekatan pewarna secara visual, semakin sedikit jumlah air yang digunakan maka secara visual semakin pekat pewarna kubis yang dihasilkan. Menurut Marwati (2011), bahan pengekstrak dan cara mengekstraksi akan berpengaruh pada warna ekstrak yang digunakan sebagai indikator alami. Ekstraksi pewarna kubis merah dapat dilakukan dengan 3 cara, yaitu cara perebusan, penghancuran dengan blender, dan cara pelarutan dengan etanol. Dari ketiga cara tersebut terpilih cara terbaik untuk ekstraksi yaitu dengan cara perebusan. Cara ini terpilih karena menghasilkan ekstrak warna yang pekat dan hanya menggunakan bahan serta teknik yang sederhana. Berbeda dengan cara penghancuran blender yang menghasilkan warna kurang pekat karena kandungan antosianin dalam kubis banyak yang tertinggal di saringan. Metode perendaman dengan etanol 98% menghasilkan warna pekat, namun cara ekstraksinya sangat lama karena setelah proses perendaman harus dilakukan proses evaporasi untuk menghilangkan etanol yang ada pada larutan. Selain itu cara ini dikhawatirkan masih meninggalkan kadar alkohol karena walaupun sudah dilakukan proses penguapan tetap akan meninggalkan sisa alkohol. Untuk keamanan pangan maka cara ekstraksi ini tidak di pilih. Tabel 3 menunjukkan hasil dari setiap cara ekstraksi kubis merah, dan Tabel 4 menunjukkan perbandingan kadar antosianin dari berbagai tanaman lain.
Tabel 3 Hasil setiap cara ekstraksi kubis merah Ekstraksi pH Kadar Total Antosianin
(mg/100 gram bahan)
Perebusan 6.35 25.02
Penghancuran 6.18 23.58 Etanol 98 % 5.85 24.45
Tabel 4 Kadar antosianin pada berbagai tanaman Sumber Kadar Total Antosianin
Daun erpa 116,65 Nofrida 2013
11 lebih kecil (1:1) warna kubis merah sulit untuk diratakan akibat volume air yang lebih sedikit. Selain itu ekstrak warna 1:2 yang cukup pekat dan tidak berbeda nyata dengan perbandingan 1:1. Alasan lain adalah jumlah ekstrak yang dihasilkan perbandingan 1:2 lebih banyak dibandingkan dengan perebusan yang menggunakan perbandingan 1:1. Semakin sedikit jumlah air yang digunakan untuk mengekstrak bahan maka akan semakin pekat warna ekstrak yang dihasilkan. Cara ekstraksi kubis merah dengan perebusan menggunakan akuades selain harganya murah juga menghasilkan warna yang pekat karena ketika proses perebusan sel-sel yang mengandung antosianin terbuka dan menyebabkan pigmen warna larut ke dalam pelarut dalam hal ini air. Tabel 5 menunjukkan hasil ektraksi cara perebusan dengan akuades.
Tabel 5 Hasil ekstraksi dengan cara perebusan Perbandingan (kubis merah : akuades)
1 : 3 1 : 2 1 : 1
Label/Film Berbahan Dasar PVA
PVA dipilih sebagai bahan dasar pembuat film indikator karena PVA dapat membentuk film dan membran dengan baik. Selain itu PVA bersifat
biodegradable. Untuk melarutkan PVA, pelarut yang digunakan adalah akuades dengan suhu 80 - 100oC. Formulasi terpilih ini merupakan formulasi paling baik dari masing-masing jumlah bahan seperti akuades, PVA, dan gliserol yang berbeda-beda dan telah diujicobakan sebelumnya. Penggunaan PVA kurang dari 3 gram menghasilkan label/film yang sangat tipis sehingga memiliki elastisitas yang sangat tinggi dan sulit untuk dikikis dari plat kaca. Penggunaan PVA lebih dari 4 gram tidak menghasilkan karakter label/film yang baik seperti ketebalan yang sangat tebal dan elastisitas yang sangat tinggi. Dari kelima formulasi terpilih, kode formulasi terbaik yaitu F3. Hal ini berdasarkan sifat film yang dihasilkannya, yaitu dari ketebalan, elastisitas, kemudahan film dikikis dari plat kaca, dan sifat film
yang tidak lengket. Dari formulasi tersebut jumlah PVA terbaik pembentuk lembaran film yaitu 3.5 g. Dalam pembuatan film berbahan dasar PVA digunakan
plasticizer yaitu gliserol. Gliserol memiliki keunggulan sebagai plasticizer karena titik didih yang tinggi sehingga tidak ada gliserol yang menguap dalam proses. Penambahan jumlah gliserol kedalam larutan film dilakukan sebanyak 1, 2, dan 3 mL. Menurut Warsiki et al. (2012) penambahan gliserol sebagai plasticizer
12
penambahan gliserol sebagai plasticizer sebanyak 0.5 mL dan 0.8 mL. Atas dasar informasi itu, dilakukan penambahan gliserol sebagai plasticizer sebanyak 1 mL ke dalam larutan film PVA. Penambahan jumlah gliserol sebanyak 2 dan 3 mL membuat film yang dihasilkan bersifat lengket. Semakin banyak penambahan jumlah gliserol maka semakin lengket dan berminyak film yang dihasilkan.
Pembuatan Label/Film Indikator Warna
Penelitian pada tahap ini adalah pembuatan film indikator warna. Formulasi pembuatan film PVA telah didapatkan formulasi terbaik yaitu dengan jumlah PVA sebanyak 3.5 gram, akuades sebanyak 100 mL, dan penambahan plastisizer
gliserol sebanyak 1 mL Setelah didapatkan lembaran film indikator, tahap selanjutnya adalah pemberian pewarna alami. Formulasi ekstrak pewarna kubis merah dengan perbandingan 1:2 akan digunakan sebagai bahan pewarna film
indikator. Formulasi perbandingan tersebut merupakan yang terbaik untuk digunakan pada tahap pewarnaan film indikator. Pembuatan label/ film indikator warna dilakukan dengan 2 metode, yaitu pencampuran langsung dan metode oles. 1. Metode Pencampuran
Perlakuan dengan menambahkan berbagai konsentrasi pewarna (2, 4,6,8,10) mL pewarna /100 mL larutan film PVA) kedalam larutan film lalu dihomogenisasi pada suhu 30oC . Pada penambahan pewarna sebanyak 2 mL dan 4 mL, warna yang dihasilkan pada larutan film indikator masih terlalu pucat. Penambahan pewarna sebanyak 6 mL warna yang dihasilkan lebih baik, hanya saja masih kurang menarik untuk dijadikan sebagai pewarna indikator. Sementara pada penambahan warna sebanyak 8 mL, warna yang dihasilkan cukup pekat dan lebih menarik untuk dijadikan pewarna indikator.
Hasil dari teknik pewarnaan langsung kedalam larutan PVA ini menghasilkan film indikator dengan warna ungu yang tidak diharapkan. Larutan film dengan pewarna kubis merah menghasilkan warna yang tidak stabil, sehingga larutan film sudah berubah warna menjadi ungu pucat mendekati bening seperti warna film PVA tanpa warna. Ketika bahan dikeringkan pada oven suhu 50oC menghasilkan film yang tidak berwarna dan tidak bisa digunakan sebagai indikator warna. Hal ini disebabkan karena ekstrak pewarna kubis merah di dalam
film sangat rentan terhadap suhu ruang dan suhu tinggi, sehingga sudah berubah warna selama pengeringan, maupun selama pembuatan film. Menurut Jackman dan Smith (1996), secara umum stabilitas antosianin dapat dipengaruhi oleh beberapa faktor yaitu struktur dan konsentrasi antosianin, suhu, pH, oksigen, cahaya, enzim, asam askorbat, gula, sulfit dan sebagainya. Pada saat pewarna dicampurkan kedalam larutan film, pewarna antosianin pada ekstrak kubis merah terdegradasi dan mengalami kehilangan warna ungu (memudar).
2. Metode Oles
13 bergerak, sehingga kemungkinan terbentuk konfigurasi rantai yang beragam, tetapi polimer dalam bentuk padat memiliki rantai tidak teratur sehingga gerakan dan konfigurasinya terbatas, sehingga ketika pewarna dioleskan pada film yang sudah dalam bentuk lembaran menghasilkan film dengan warna yang lebih stabil dibanding ketika pewarna dicampurkan dalam larutan film yang berbentuk cair.
Metode pengolesan dilakukan hingga didapatkan film indikator warna dengan warna merata secara visual. Pada prosedur sebelumnya pewarna kubis merah dicampur terlebih dahulu dengan larutan film baru dikeringkan dengan oven. Sementara pada pewarnaan metode oles, larutan film terlebih dahulu dikeringkan dalam oven selama 24 jam pada suhu 50º C. Setelah itu pewarna indikator dengan volume tertentu dioleskan pada lembaran film. Pada metode sebelumnya volume pewarna yang digunakan adalah 8 ml, sedangkan pada metode oles volume pewarna yang digunakan sebanyak 4 mL dan 6mL. Volume sebanyak 4 mL yang digunakan dengan metode oles menghasilkan lembaran film
dengan warna yang tidak merata dan belum dapat menutup lembaran film dengan warna ungu pudar (Gambar 4a). Penambahan pewarna yang dipilih sebanyak 6 mL/400 cm2 film (Gambar 4b), karena apabila volume pewarna yang ditambahkan kurang dari 6 ml warna film yang dihasilkan kurang pekat, sementara apabila warna yang ditambahkan lebih dari 6 ml lembaran film akan mudah sobek. Film
yang telah diberi pewarna, dimasukkan kedalam oven 50oC selama 75-90 menit untuk mengeringkan warna sekaligus untuk menurunkan kadar air pada lembaran
film tersebut.
(a) (b)
Gambar 4 Label/film indikator dengan pewarna kubis merah (a) 4 mL; (b) 6 mL
Karakteristik Sifat Fisik dan Mekanis Film Indikator
14
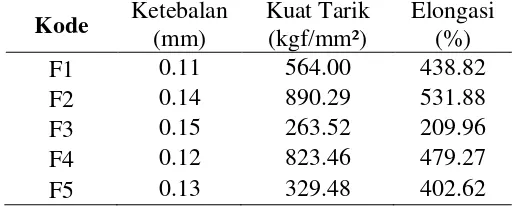
Tabel 7 Hasil pengujian sifat fisik film PVA Kode Ketebalan
Dari kelima formula yang telah di uji, kode formulasi F3 memberikan hasil terbaik. Nilai ketebalan film yang dihasilkan dari kode F3 paling tebal diantara formula lainnya, yaitu sebesar 0.15 mm. Kekuatan tarik dari formula 3 sebesar 263.52 kgf/mm2 merupakan kekuatan tarik paling ideal dibanding kekuatan tarik yang lainnya. Persen elongasi yang paling sesuai dengan penelitian Hodgkinson dan Taylor (2000) adalah formulasi F3, yaitu sebesar 209.96 %. Polivinil alkohol memiliki kuat sobek sekitar 147 – 834 N/mm, kuat tarik sebesar 44 – 64 MN/m2, serta persen pemanjangan sebesar 150 – 400 %. Dengan karakteristik tersebut, polivinil alkohol dapat dibentuk menjadi kemasan plastik film yang
biodegradable (Hodgkinson dan Taylor 2000).
Nilai kuat tarik film yang dihasilkan tinggi yaitu 263.52kgf/cm2, jika dibandingkan dengan kuat tarik film dari bahan kitosan saja yaitu sebesar 13.3 kgf/cm2 (Putri 2012) dan dengan kuat tarik film dari bahan film kitosan-PVA yaitu sebesar 42.67 kgf/cm2 serta kuat tarik dari film agar bubuk sebesar 81.05 kgf/cm2 (Lestari 2013).
Elongasi atau persen pemanjangan film yang dihasilkan 209.96%, semakin besar nilai persen pemanjangan, maka akan semakin elastis film tersebut. Elongasi film yang dihasilkan lebih tinggi daripada elongasi film kitosan-PVA dengan
plasticizer gliserol yaitu 78.06%, juga lebih tinggi dari elongasi film kitosan dengan plasticizer sorbitol yaitu 16.6% (Purwanti 2010) dan plastisizer gliserol yaitu 20.8% (Putri 2012). Jika dibandingkan dengan film dari polimer lain, nilai elongasi juga lebih tinggi, yaitu elongasi film dari pati ubi jalar sebesar 9.00±2.70%, dengan pati ubi kayu sebesar 10.67±2.39%, dengan pati kentang sebesar 4.67±1.55%, dengan pati garut sebesar 4.33±1.55% dan dengan pati jagung sebesar 25.33±6.29% (Ardian 2011).
Analisis Perubahan Warna Film Indikator
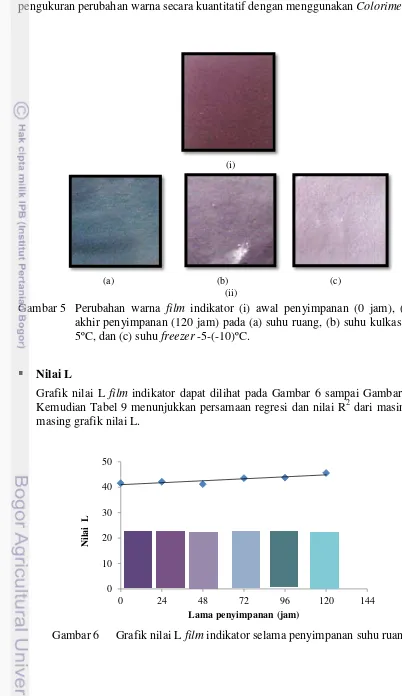
15 Agar hasil pengamatan secara visual tersebut dapat dianalisa, maka dilakukan pengukuran perubahan warna secara kuantitatif dengan menggunakan Colorimeter.
(i)
(a) (b) (c)
(ii)
Gambar 5 Perubahan warna film indikator (i) awal penyimpanan (0 jam), (ii) akhir penyimpanan (120 jam) pada (a) suhu ruang, (b) suhu kulkas 3-5ºC, dan (c) suhu freezer -5-(-10)ºC.
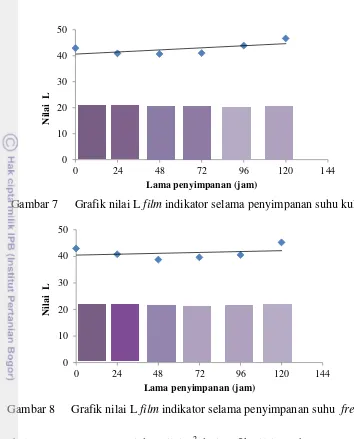
Nilai L
Grafik nilai L film indikator dapat dilihat pada Gambar 6 sampai Gambar 8. Kemudian Tabel 9 menunjukkan persamaan regresi dan nilai R2 dari masing-masing grafik nilai L.
Gambar 6 Grafik nilai L film indikator selama penyimpanan suhu ruang
0 10 20 30 40 50
0 24 48 72 96 120 144
Nila
i
L
16
Gambar 7 Grafik nilai L film indikator selama penyimpanan suhu kulkas
Gambar 8 Grafik nilai L film indikator selama penyimpanan suhu freezer
Tabel 8 Persamaan regresi dan nilai R2 dari grafik nilai L suhu ruang, suhu kulkas(3-5ºC0, dan suhu freezer ( -5-(-10)ºC)
Suhu penyimpanan Persamaan regresi Nilai R2
Ruang y = 0.0326x + 40.984 0.782
Kulkas y = 0.0336x + 40.649 0.418
Freezer y = 0.0137x + 40.483 0.066
Berdasarkan ketiga grafik tersebut dapat dilihat bahwa terjadi perubahan warna film selama penyimpanan. Pada penyimpanan di suhu ruang, film indikator rata-rata sudah mulai berubah dari 0 hingga 24 jam pertama penyimpanan mengalami kenaikan nilai L. Dari 24 jam hingga 48 jam mengalami penurunan nilai L dan kembali naik pada jam ke-72 hingga jam 120 (Gambar 6). Sementara pada penyimpanan suhu kulkas 3-5ºC (Gambar 7) dan suhu freezer -5-(-10)ºC (Gambar 8) warna film indikator rata-rata sudah mulai berubah pada 24 jam pertama hingga jam ke-48 penyimpanan mengalami penurunan nilai L. Jam ke-72 hingga 120 mengalami peningkatan nilai L.
17 Selama pengamatan yang dilakukan terjadi penurunan tingkat kecerahan warna di beberapa titik pengamatan. Hal ini dapat disebabkan metode pemberian warna pada film juga mempengaruhi kepekatan warna pada film. Metode oles yang digunakan untuk memberi warna pada film dilakukan secara manual, kemungkinan ketidakrataan olesan sangat tinggi. Selain itu, adanya perubahan tingkat kecerahan pada film indikator ini diakibatkan oleh ketidakstabilan pigmen yang terdapat dalam pewarna yang digunakan. Dalam kubis ungu terdapat pigmen antosianin yang memberikan warna ungu. Kestabilan Pigmen antosianin ini dipengaruhi oleh pH, paparan cahaya, oksigen, dan suhu. Selama pembuatan dan penyimpanan, pewarna ini selalu kontak dengan suhu dan cahaya. Menurut Sutrisno (1987), suhu dan lama pemanasan menyebabkan terjadi dekomposisi dan perubahan struktur pigmen sehingga terjadi pemucatan. Penyimpanan suhu rendah lebih dapat mempertahankan kestabilan dari warna tersebut. Oleh karena itu, kenaikan tingkat kecerahan warna pada suhu kulkas dan suhu freezer tidak terlalu cepat seperti pada suhu ruang.
Berdasarkan Tabel 9, pengukuran nilai L pada suhu ruang, suhu kulkas dan suhu freezer menghasilkan persamaan regresi dan nilai korelasi. Berdasarkan persamaan regresi diperoleh nilai slope masing-masing suhu penyimpanan berturut-turut adalah 0.0326 , 0.0336 dan 0.0137. Hal ini menyatakan bahwa nilai L pada ketiga suhu penyimpanan tersebut memiliki kecenderungan meningkat selama penyimpanan karena slope yang dihasilkan bernilai positif. Nilai slope
menunjukkan bahwa kenaikan nilai L pada suhu ruang sebesar 0.0326 setiap 24 jam. Sementara pada penyimpanan suhu suhu kulkas, kenaikan nilai L terjadi setiap 24 jam sebesar 0.0336, dan suhu freezer sebesar 0.0137 setiap 24 jam.
Nilai L hasil pengukuran Colorimeter untuk film indikator pada penyimpanan suhu ruang berkorelasi positif cukup tinggi dengan lama paparan karena nilai R2 yang dimiliki lebih dari 0.6. Berdasarkan hasil yang dipaparkan pada Tabel 9, sebesar 78.2% hubungan antara lama paparan matahari dan perubahan nilai L yang dapat dijelaskan oleh model regresi, sedangkan sisanya tidak dapat dijelaskan akibat pengaruh variabel lain. Sementara pada suhu kulkas, hubungan antara nilai L dan lama penyimpanan berkorelasi agak rendah karena nilai R2 bernilai lebih tinggi dari 0.4 tetapi kurang dari 0.6 (0.4 ≤ R2≥0.6), berarti hanya 41.8% hubungan antara lama paparan matahari dan perubahan nilai L yang dapat dijelaskan oleh model regresi. Pada suhu freezer berkorelasi sangat rendah karena nilai R2 berada di bawah 0.2. Hal ini berarti kemampuan lama paparan suhu freezer dalam menjelaskan perubahan warna film indikator sangat rendah hanya sebesar 6.6%. Sehingga untuk penyimpanan suhu rendah ini terdapat pengaruh yang cukup lambat antara x (lama penyimpanan) terhadap y (perubahan warna film / nilai L).
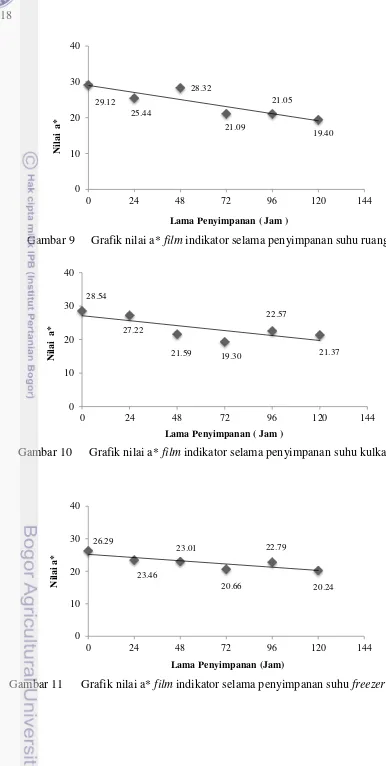
Nilai a*
18
Gambar 9 Grafik nilai a* film indikator selama penyimpanan suhu ruang
Gambar 10 Grafik nilai a* film indikator selama penyimpanan suhu kulkas
Gambar 11 Grafik nilai a* film indikator selama penyimpanan suhu freezer
19 Pada ketiga grafik nilai a* diatas (Gambar 9,10,11) terlihat bahwa nilai a* dari film indikator cenderung bergerak turun meskipun penurunan yang terjadi tidak konstan. Terjadi kenaikan dibeberapa titik pada setiap suhu penyimpanan. Nilai a* di awal penyimpanan suhu ruang bernilai 29.12 . Kemudian pada penyimpanan selama 120 jam (akhir penyimpanan) menjadi 19.40. Pada suhu kulkas, nilai a* di awal penyimpanan bernilai 28.54. Selama penyimpanan 120 jam, nilai a* turun menjadi 21.37. Hal yang sama juga terjadi pada penyimpanan suhu freezer, yaitu dari nilai awal 26.29 turun menjadi 20.24.
Parameter nilai a*Colorimeter pada suhu ruang memiliki persamaan regresi
y = -0.0821x + 28.997 dengan koefisien determinasi 0.7975. Hal ini menunjukkan bahwa model regresi yang dihasilkan memiliki hubungan negatif tinggi. Bernilai negatif karena nilai slope yang dihasilkan bernilai negatif sehingga grafik yang dihasilkan menurun mulai dari jam ke-0 hingga jam ke-120. Penurunan yang terjadi sebesar 0.0821 setiap 24 jam. Model regresi pada suhu ruang ini memiliki koefisien determinasi sebesar 0.7975, artinya hubungan antara lama paparan matahari terhadap penurunan nilai a* dapat dijelaskan dengan cukup baik oleh model regresi tersebut berdasarkan nilai R2 yang lebih dari 0.61. Sementara pada suhu kulkas, persamaan regresi yang dimiliki yaitu y = -0.062x + 27.152 dengan koefisien determinasi 0.5880. Sama seperti pada penyimpanan suhu ruang, model regresi yang dihasilkan miliki hubungan negatif, hanya saja dengan korelasi yang agak rendah. Hal ini dikarenakan koefisien determinasi yang dihasilkan bernilai kurang dari 0.60 dan lebih dari 0.41. Sementara pada suhu freezer menghasilkan koefisiensi determinasi sebesar 0.7197 dengan persamaan regresi y = -0.0412x + 25.213. Hubungan korelasi regrasi pada penyimpanan suhu freezer memiliki hubungan negatif cukup tinggi, karena nilai R2 yang lebih dari 0.61.
Tabel 9 Persamaan regresi dan nilai R2 dari grafik nilai a* suhu ruang, suhu kulkas, dan suhu freezer
Suhu penyimpanan Persamaan regresi Nilai R2
Ruang y = -0.0821x + 28.997 0.7975
Kulkas y = -0.062x + 27.152 0.5880
Freezer y = -0.0412x + 25.213 0.7197
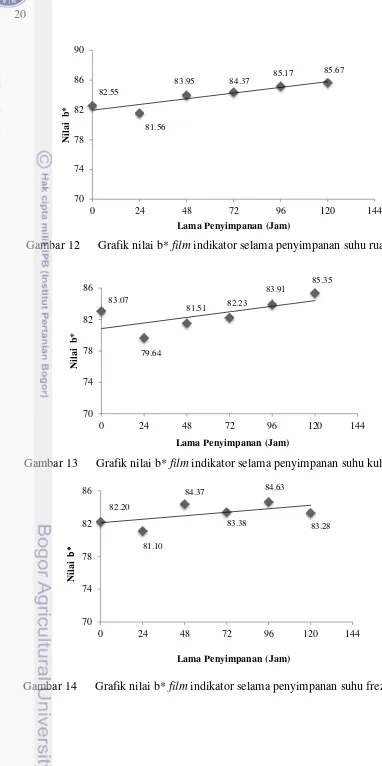
Nilai b
20
Gambar 12 Grafik nilai b* film indikator selama penyimpanan suhu ruang
Gambar 13 Grafik nilai b* film indikator selama penyimpanan suhu kulkas
21 Tabel10 Persamaan regresi dan nilai R2 dari grafik nilai b* suhu ruang, suhu
kulkas, dan suhu freezer
Suhu penyimpanan Persamaan regresi Nilai R2
Ruang y = 0.032x + 81.960 0.8393
Kulkas y = 0.0297x + 80.838 0.4534
Freezer y = 0.0179x + 82.089 0.3631
Berdasarkan data hasil pengukuran Colorimeter tersebut, persamaan linier yang menghasilkan koefisien determinasi tinggi berturut-turut 0.8393, 0.4534, 0.3631. Parameter nilai b* Colorimeter pada suhu ruang memiliki persamaan regresi y = 0.032x + 81.960, pada suhu kulkas, persamaan regresi yang dimiliki yaitu y = 0.0297x + 80.838. Suhu freezer memiliki persamaan regresi y = 0.0179x + 82.089.
Nilai b* pada indikator film penyimpanan suhu ruang berkorelasi positif tinggi dengan lama penyimpanan dengan nilai korelasi lebih dari 0.8. Hal ini menunjukkan bahwa model regresi yang dihasilkan memiliki hubungan yang kuat, sebesar 83,93% hubungan antara lama penyimpanan dengan kenaikan nilai b* dapat dijelaskan oleh model regresi. Untuk penyimpanan suhu kulkas, nilai korelasinya agak rendah karena nilai korelasi berada pada kisaran 0.41<R2 < 0.60. Sedangkan nilai b* korelasi suhu freezer merupakan yang paling rendah, yaitu hanya 0.3631. Nilai tersebut menginpretasikan korelasi yang rendah karena nilai korelasi berada pada kisaran 0.21<R2 < 0.40
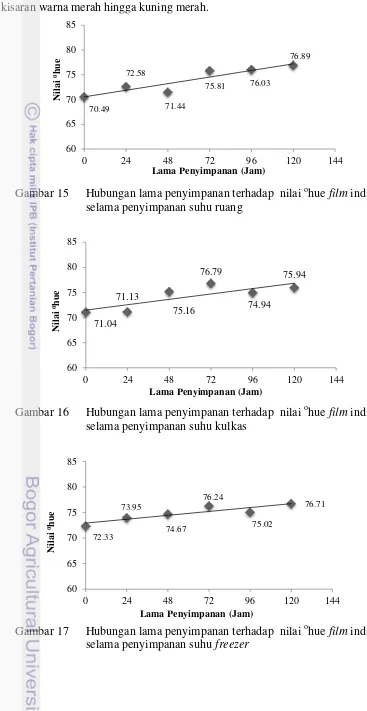
Nilai ohue
Nilai °hue atau nilai derajat Hue merupakan atribut yang menunjukkan derajat warna visual yang terlihat. Nilai °hue diperoleh melalui perhitungan invers 30 tangen perbandingan nilai b dengan nilai a. Nilai °hue merupakan gambaran dari sumbu 360o di mana daerah kuadran 1 menunjukkan warna kemerahan, daerah kuadran 2 menunjukkan warna kuning hijau, daerah kuadran 3 menunjukkan warna hijau biru, dan kuadran 4 menunjukkan warna ungu.
Sampel yang disimpan pada suhu ruang terjadi peningkatan nilai °hue dari 70.49o pada jam ke-0 menjadi 72.58o pada jam ke-24. Kemudian °hue mengalami penurunan pada jam ke-48 menjadi 71.44o. Nilai ohue kembali meningkat pada jam ke-72 menjadi 75.81o, dan terus meningkat pada jam 96 hingga jam ke-120 dengan nilai °hue sebesar 76.03o dan 76.89o. Semua nilai °hue berada pada daerah kisaran kuadran 2.
Untuk sampel yang disimpan pada suhu kulkas nilai °hue meningkat dari 71.04° pada hari ke-0 menjadi 76.79° pada hari ke-3, yang merupakan nilai °hue yang berada pada daerah kisaran warna kuning, pada hari ke-4 nilai °hue sampel turun menjadi 74.94° yang berada pada daerah kisaran warna kuning. Kemudian nilai °hue kembali naik pada hari ke-5 dengan nilai 75.94° yang berada pada daerah kisaran warna kuning.
22
tabel daerah kisaran warna °hue film yang disimpan pada suhu freezer berada pada kisaran warna merah hingga kuning merah.
Gambar 15 Hubungan lama penyimpanan terhadap nilai ohue film indikator selama penyimpanan suhu ruang
Gambar 16 Hubungan lama penyimpanan terhadap nilai ohue film indikator selama penyimpanan suhu kulkas
23 Tabel10 Persamaan regresi dan nilai R2 dari hubungan lama penyimpanan terhadap nilai ohue film indikator suhu ruang, suhu kulkas, dan suhu freezer
Suhu penyimpanan Persamaan regresi Nilai R2
Ruang y = 0.0556x + 70.54 0.8536
Kulkas y=0.0447x + 71.485 0.6586
Freezer y = 0.0317x + 72.919 0.8061
Berdasarkan data hasil perhitungan tersebut, persamaan linier yang menghasilkan koefisien determinasi tinggi berturut-turut 0.8536, 0.6586, 0.8061. Parameter nilai ohue pada suhu ruang memiliki persamaan regresi y = 0.0556x + 70.54 , pada suhu kulkas, persamaan regresi yang dimiliki yaitu y=0.0447x + 71.485. Suhu freezer memiliki persamaan regresi y = 0.0317x + 72.919.
Persamaan matematis menggambarkan adanya peningkatan nilai ohue, dapat dilihat nilai kemiringan (slope) persamaan matematis nilai ohue pada suhu ruang lebih tinggi dibanding pada penyimpanan suhu dingin. Hal ini menunjukkan semakin tinggi suhu penyimpanan, nilai ohue semakin meningkat. Pada suhu ruang, setiap hari terjadi peningkatan nilai ohue sebesar 0.0556 satuan. Suhu kulkas mengalami peningkatan nilai ohue sebesar 0.0447 satuan per hari, dan suhu freezer mengalami peningkatan nilai ohue sebesar 0.0317 satuan per hari.
24
SIMPULAN DAN SARAN
Simpulan
Jumlah PVA terbaik untuk pembuatan film indikator PVA sebanyak 3.5 gram. Hasil film memiliki penampakan yang lebih bening dan mengkilat. Penggunaan pewarna kubis merah sebagai warna indikator, tidak memungkinkan untuk dilakukan pengeringan bersamaan dengan larutan film. Teknik pewarnaan agar pewarna alami tetap dapat dipergunakan sebagai pewarna indikator adalah metode oles dengan volume terbaik yang digunakan untuk mengoleskan pewarna alami pada film adalah 6 ml per 400 cm2. Film indikator dengan pewarna alami akan merespon melalui perubahan warna terhadap suhu penyimpanan.
Perubahan warna film indikator selama penyimpanan sangat dipengaruhi oleh faktor suhu dan cahaya. Nilai L menunjukkan tingkat kecerahan film
indikator yang disimpan. Hasil pengukuran warna film indikator menghasilkan koefisien determinasi L untuk suhu ruang sebesar 0.782, suhu kulkas sebesar 0.418, dan 0.066 untuk suhu freezer. Hasil pengukuran parameter nilai a* film
indikator menghasilkan koefisien determinasi berturut-turut untuk suhu ruang, kulkas, dan freezer yaitu sebesar 0.7975, 0.5880, dan 0.7179. Sedangkan hasil pengukuran parameter nilai b* menghasilkan koefisien determinasi berturut-turut untuk suhu ruang, kulkas, dan freezer yaitu sebesar 0.8393, 0.4534, 0.3631. Persamaan linier nilai ohue menghasilkan koefisien determinasi tinggi berturut-turut 0.8536, 0.6586, 0.8061. Parameter nilai ohue pada suhu ruang memiliki persamaan regresi y = 0.0556x + 70.54 , sedangkanpada suhu kulkas mempunyai persamaan regresi yang dimiliki yaitu y=0.0447x + 71.485. Suhu freezer memiliki persamaan regresi y = 0.0317x + 72.919. Peningkatan suhu penyimpanan menyebabkan terjadinya peningkatan nilai ohue, dan semakin lama waktu penyimpanan juga menyebabkan ohue semakin meningkat.
Saran
25
DAFTAR PUSTAKA
Ahvenainen R. 2003. Active and intelligent packaging. Di dalam : Ahvenainen R, editor. Novel Food Packaging Techniques. Abington : Woodhead Publishing. hlm 5-21
Anonim. 2009. Takut makanan kadarluarsa?. [Internet]. [diunduh 2013 Sept 9] Tersedia pada URL http://www.jepang.net/2009/08/takut-makanan-kadaluarsa.html
Apriyanto J. 2007. Karakteristik biofilm dari bahan dasar polivinil alcohol dan chitosan. [Skripsi]. Bogor (ID) : Institut Pertanian Bogor.
Ardian FN. 2011. Pengaruh jenis pati terhadap kuat tarik dan persen pemanjangan plastik biodegradabel dengan metode grafting. ?. [Internet]. [diunduh 2013 Desember 7] tersedia pada http://elibrary.ub.ac.id/handle/123456789/26342 Charron CS, Clevidence BA, Britz SJ, Novotny DJ. 2007. The effect of dose size
on bioavailability of acylated and nonacylated anthocyanins from red cabbage (Brassica oleracea). Journal of Agricultural and Food Chemistry. 55(13):5354-5362
Ekasari W. 2009. Kubis Sayur Yang Kaya Manfaat. Departemen Farmakognosi dan Fitokimia Fakultas Farmasi Universitas Airlangga
Jackman RL, Smith JL. 1996. Anthocyanins and betalains. Di dalam : Hendry, G. F. And J.D. Houghton. Natural Food Colourants. London : Blackie Academic Prof : 244-309
Lestari IA. 2013. Pembuatan Label Cerdas Pendeteksi Escherichia coli. [Skripsi]. Bogor (ID) : Institut Pertanian Bogor
Marwati S. 2011. Kestabilan warna Ekstrak Kubis Ungu (Brassica oleracea)
sebagai Indikator Alami Titrasi Asam Basa. Prosiding Seminar Nasional Penelitian, Pendidikan dan Penerapan MIPA FMIPA UNY, 11 Mei 2011 Marwati S. 2012. Aplikasi Beberapa Bunga Berwarna sebagai Indikator Alami
Titrasi Asam Basa. Prosiding Seminar Nasional Penelitian, Pendidikan dan Penerapan MIPA FMIPA UNY, 2 Juni 2012
Nofrida R, Warsiki E, Yuliasih I. 2013. Film Indikator Warna Daun Erpa (Aerva sanguinolenta) sebagai Kemasan Cerdas untuk Produk Rentan Suhu dan Cahaya. IPB. Pasca Sarjana.
Nurdiana D. 2002. Karakteristik fisik edible film dari kitosan dengan sorbitol sebagai plasticizer. [skripsi]. Bogor (ID) : Institut Pertanian Bogor.
Putri CDW. 2012. Kemasan cerdas indikator warna untuk mendeteksi kesegaran buah potong nenas.[Skripsi]. Bogor (ID) : Institut Pertanian Bogor
Robertson GL. 2006. Food Packaging –Principles and Practice. Second edition, CRC Press, Boca Raton, FL, USA.
Schonberger H, Maumann A, Keller W. 1997. Study of microbial degradation of plyvinyl alcohol (PVA) in wastewater treatment Plants. Di dalam. Apriyanto J. 2007. Karakteristik biofilm dari bahan dasar polivinil alcohol dan chitosan. [Skripsi]. Bogor (ID) : Institut Pertanian Bogor.
Seafast Center. 2012. Pewarna alami untuk pangan. Bogor (ID): Seafast Center Sheftel VO. 2000. Indirect Food Additives and Polymer : Migration
26
[SLTC] Society of Leather Technologists and Chemists. 1996. Official methods of Analysis. Northampton (UK): SLTC. Publisher, 736-737, 1167-1169. Smith H. 1975. Phytochrome and Photo Morphologenesis. Mc-Graw Hill Book Publishing
Sumarto. 2008. Mempelajari pengaruh penambahan asam lemak dan natrium benzoat terhadap sifat fisik, mekanik, dan aktivitas antimikroba film edibel kitosan .[Skripsi].Bogor (ID): Institut Pertanian Bogor.
Theresia V. 2003. Aplikasi dan karakteristik sifat fisik mekanik plastik
biodegradable dari campuran LDPE dan tapioka. [skripsi]. Bogor (ID) : Institut Pertanian Bogor
Usman H dan Akbar PS. 2008. Pengantar Statistika. PT Bumi Aksara, Jakarta. Vaikousi H, Biliaderis, Koutsoumanis KP. 2008. Development of a microbial TTI
prototype for monitoring microbiological quality of chilled food. Amerika : American Society for Microbiology
Vaikousi H, Biliaderis, Koutsoumanis KP. 2009. Applicability of a microbial Time Temperature Indicator (TTI) for monitoring spoilage of modified atmosphere packed minced meat. J Food Microbiol. 133 : 272-278
Warsiki E, Sunarti TC dan Damanik R. 2010. Pengembangan Kemasan Antimikrobial untuk Memperpanjang Umur Simpan Produk. Prosiding Seminar Tahunan Hasil-hasil Riset IPB Tahun 2009. Buku ke-5 : Rekayasa dan Teknologi Pangan. ISBN : 978-602-8853-03-3, 978-602-8853-08-8. hlm 579-588.
Warsiki E dan Sunarti TC. 2011. Evaluasi Sifat Fisik-Mekanis dan Permeabilitas
Film Kitosan. Jurnal Teknologi Industri Pertanian. ISSN : 0216-3160. Volume 21 No 3. hlm 139-145.
Warsiki E dan Putri CDW. 2012. Pembuatan label/film indikator warna dengan pewarna alami dan sintetis. E-J Agroindustry Indonesia. 1(2): 82 – 87
Warsiki E, Yuliasih I, Nofrida R. 2013. Smart Label for Milk Deterioration Detection. The 105 most Prospective Indonesia Innovation. The Ministry of Research and Tecnology, The Republic of Indonesia
Warsiki E, Mulyorini R. 2014. Smart Label to Detect Pathogenic Bacteria on Meat. Proceeding of Annually Seminar on Research Results of Bogor Agricultural University in Year of 2015. Vol 5: Food, Energy, Engineering and Technology (In Press)
Warsiki E, Rahayuningsih M, Latifah N. 2014. Smart Label for Rapid Detection of Staphylococcus aureus. Proceedingof National Seminar on Synergy of Food, Feed, and Renewable Energy. (In Press)
Warsiki E, Rahayuningsih M, Anggraeni RR. 2014. Color-Based Indicator From Various Selective Media as a Smart Label to Detect The Growth of Salmonella typhimurium. Agroindustrial Technology Journal. (Accepted)
Winarno FG. 1983. Kerusakan Bahan Pangan. Jakarta: Gramedia Pustaka Utama Winarno FG. 1984. Kimia Pangan dan Gizi. Jakarta: Gramedia Pustaka Utama.
hal. 251
27
LAMPIRAN
Lampiran 1 Prosedur Analisis Uji
1. Uji Ketebalan Film (SLTC 1996)
Ketebalan film diukur dengan cara mengukur ketebalan pada tiga titik permukaan
film dan dihitung rata-rata dari hasil pengukuran. Pengukuran ketebalan menggunakan alat thickness gauge. Alat diletakkan di atas bidang horizontal dengan permukaan yang rata kemudian sampel diletakkan di antara tatakan dan penekan dengan sisi grain berada di atas (jika dapat diidentifikasi). Jika sisi grain-nya tidak dapat diidentifikasi, maka sampel diletakkan dengan salah satu sisi ke atas. Penekan dilepas, ditunggu sekitar 5 detik ±1 detik, kemudian angka yang terbaca pada meteran dicatat sebagai ketebalan. Hasil ketebalan yang terbaca kemudian dirata-ratakan.
2. Uji Kekuatan Tarik (SLTC 1996)
Pengujian kekutan tarik dilakukan dengan menggunakan alat tensile strength tester. Sampel dipasang pada alat penguji dengan cara menjepitkan kedua ujung sampel pada alat penjepit. Jarak antar jepitan adalah 5 cm. Setelah sampel terpasang, mesin dinyalakan dan dimatikan ketika sampel terputus. Kuat tarik ditentukan berdasarkan beban maksimum pada saat film pecah dan persentase pemanjangan didasarkan atas pemanjangan film saat film pecah. Nilai kekuatan tarik dapat dihitung dengan menggunakan rumus sebagai berikut:
Kekuatan tarik
=
F = nilai yang terbaca pada alat (kgf) l = lebar kulit yang diuji (mm) t = ketebalan kulit (mm)
Berikut ini adalah bentuk sampel untuk uji kekuatan tarik
Dimensi (mm) :
L l1 L2 B b1 a
28
3. Perpanjangan putus atau elongasi (SLTC 1996)
Pengujian perpanjangan (elongasi) adalah pengukuran perpanjangan film
yang ditarik mulai dari kondisi awal sampai dengan akhir yaitu terputusnya film
pada saat pengujian kekuatan tarik. Perpanjangan dihitung dengan membandingkan perpanjangan film ketika terputus pada saat pengujian kekuatan tarik dengan panjang film diawal pengukuran. Penghitungan perpanjangan putus dilakukan dengan menggunakan rumus sebagi berikut:
Persen Perpanjangan putus = 100 % Keterangan :
a = panjang awal
b = panjang setelah putus
4. Konsentrasi Total Antosianin (Less dan Francis 1972 )
Konsentrasi antosianin diukur dengan teknik spektrofotometri. Sebanyak 1 ml filtrat hasil ekstraksi diencerkan hingga 100 mL dengan etanol 95 %: HCl 1.5 13 N (85:15). Filtrat kemudian diukur absorbansinya dengan spektrofotometer pada panjang gelombang 535 nm (Dianawati 2001).Total antosianin kemudian dihitung dengan rumus :
Total Antosianin (mL/100 g sampel) = (Absorbansi × fp) × 100 98.2 × Wsampel (g) Dimana : fp = faktor pengenceran
Faktor 98.2 = nilai ε (serapan molar) dari pigmen antosianin dalam pelarut etanol 95% : HCl 1.5 N (85:15), yang merujuk pada absorbansi antosianin dalam etanol asam yang di ukur dalam celah selebar 1 cm pada panjang gelombang 535 nm dalam konsentrasi 1% (v/v).
Wsampel = berat sampel 5. Warna
Pengukuran warna dilakukan dengan menggunakan alat Colortex Colorimeter dengan spesifikasi Colorimetry IV Version 4.0. Nilai yang terbaca pada alat antara lain nilai L, a, dan b (tingkat kecerahan). Intensitas warna ditunjukan melalui nilai Chroma yang dihitung dengan rumus sebagai berikut :
√
O
H = tan-1 (b/a) Keterangan :
C = Chroma, menunjukkn intensitas warna sampel H = oHue, menunjukkan warna sampel
L = Tingkat kecerahan
a = merupakan warna campuran merah-hijau b = merupakan warna campuran kuning-biru
o
29
Akuades 100 mL
Pemanasan 80-100oC PVA (3, 3.5,
dan 4 gram (b/b)
Gliserol (1, 2 dan 3) mL)
Pelarutan PVA dan pengadukan konstan
Larutan
film
Homogenisasi
Pencetakan dengan plat kaca ukuran 30 x 20 cm
Pengeringan suhu 50oC (oven) dan suhu ruang (25 + 3oC selama 24 jam
Pelepasan film dari cetakan
Film
Indikator
(2, 4, 6 ,8 dan 10 ) mL pewarna kubis merah
Lampiran 2 Diagram alir pembuatan film indikator warna (metode pencampuran)
30
Akuades 100 mL
Pemanasan 100oC PVA (3, 3.5,
dan 4 gram (b/b)
Gliserol (1, 2 dan 3) mL)
Pelarutan PVA dan pengadukan konstan
Larutan
film
Homogenisasi
Pencetakan dengan plat kaca ukuran 30 x 20 cm
Pengeringan suhu 50oC (oven) selama 24 jam
Film Indikator
Pewarna kubis merah Lembaran film
Pengolesan pewarna
Lampiran 3 Diagram alir pembuatan film indikator warna (metode oles)
31
RIWAYAT HIDUP
Penulis dilahirkan di Pandeglang pada tanggal 16 Desember 1990 sebagai putra pertama dari bapak Sudirja dan ibu Nurhayati. Tahun 2009 penulis lulus dari SMA Negeri 1 Pandeglang dan pada tahun yang sama diterima di Institut Pertanian Bogor (IPB) melalui jalur Undangan Seleksi Masuk IPB (USMI) dan diterima di Departemen Teknologi Industri Pertanian, Fakultas Teknologi Pertanian.
Selama menjadi mahasiswa, penulis aktif dalam beberapa organisasi dan perkuliahan. Pada tahun 2010 penulis menjadi panitia IASLS (Indonesian Agroindustrial Student Leader Summit) Forum Agroindustri Indonesia sebagai staf divisi acara. Pada tahun 2011 penulis juga menjadi panitia dalam acara Hari Warga Industri (Hagatri) HIMALOGIN IPB dan panitia Atsiri Fair HIMALOGIN IPB. Penulis juga aktif dalam kegiatan seperti menjadi asisten praktikum Teknologi Minyak Atsiri, Rempah dan Fitofarmaka dan asisten praktikum Teknologi Bahan Penyegar pada tahun ajaran 2012/2013. Penulis aktif dalam organisasi yaitu menjadi staff departemen Kewirausahaan tahun 2010-2011 Himpunan Mahasiswa Teknologi Industri (HIMALOGIN) Teknologi Industri Pertanian IPB dan Anggota Forum Agroindustri Indonesia (Foragrin)