PERANAN DAN EFEKTIFITAS BAKTERI UNTUK
PERBAIKAN KUALITAS AIR MEDIA DAN LIMBAH
PEMELIHARAAN UDANG VANAMEI (Litopenaeus vanamei)
LUFISARI HERDIANTI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul “Peranan dan Efektifitas Bakteri untuk Perbaikan Kualitas Air Media dan Limbah Pemeliharaan Udang Vanamei (Litopenaeus vanamei)” adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Oktober 2015
Lufisari Herdianti
RINGKASAN
LUFISARI HERDIANTI. Peranan dan Efektifitas Bakteri untuk Perbaikan Kualitas Air Media dan Limbah Pemeliharaan Udang Vanamei (Litopenaeus Vanamei). Dibimbing oleh KADARWAN SOEWARDI dan SIGID HARIYADI.
Budidaya udang di kawasan pesisir berpotensi menimbulkan pencemaran bahan organik di perairan. Hal ini disebabkan karena semakin tinggi tingkat teknologi yang diterapkan dalam budidaya udang buangan limbah yang dikeluarkan semakin banyak. Upaya yang dapat dilakukan untuk memperkecil adanya pencemaran dari budidaya udang adalah dengan pengelolaan kualitas air yang baik dari mulai awal budidaya sampai pengolahan limbah sebelum dibuang ke perairan. Dalam penelitian ini telah dilakukan pengelolaan kualitas air pada media budidaya dengan penggunaan bakteri pengurai. Penelitian ini bertujuan untuk mengetahui efektivitas bakteri komersil Super Nit, Super Bac dan kombinasi keduanya untuk peningkatan kualitas air media budidaya udang vanamei (Litopenaeus vanamei). Penelitian ini terdiri dari tiga bagian: Bagian pertama adalah penelitian pendahuluan dan penelitian utama. Penelitian pendahuluan bertujuan untuk menentukan waktu penambahan bakteri berdasarkan jumlah total koloni bakteri sedangkan penelitian utama untuk membandingkan efektifitas bakteri yang terdiri dari 4 perlakuan yakni 1) Kontrol, 2) Perlakuan bakteri Super Nit 3) Perlakuan bakteri Super bac dan 4) Perlakuan campuraan kedua bakteri, dengan 3 kali ulangan.. Hasil dari penelitian pendahuluan menunjukkan bahwa Super Nit dan Super Bac mencapai jumlah maksimum koloni pada hari ke-2, sehingga penambahan bakteri pada penelitian utama adalah 2 hari sekali. Sedangkan hasil dari penelitian utama menunjukkan bahwa perlakuan Campuran memberikan efek terbaik dalam menjaga kualitas air budidaya yang super intensif karena mampu mengurangi amonia, nitrit, dan COD sebesar 96%, 83%, dan 42%.
Penelitian tahap kedua adalah untuk mengkaji respon beberapa sumber karbon terhadap pertumbuhan bakteri. Hasil penelitian menunjukkan bahwa penambahan molase dan gula pasir mampu mempercepat pertumbuhan bakteri. Namun penambahan gula pasir mengasilkan pertumbuhan bakteri yang lebih cepat dibandingkan molase. Penelitian tahap ketiga adalah aplikasi bakteri untuk mengolah limbah budidaya udang dalam tandon sebelum dibuang ke perairan.Tujuan dari penelitian ketiga adalah mengetahui efektifitas bakteri aerob dan anaerob dalam menurunkan bahan organik dan nutrien dalam limbah budidaya udang. Penelitian ini terdiri dari empat perlakuan yaitu aplikasi bakteri anaerob dengan aktivasi, bakteri anaerob tanpa aktivasi, bakteri aerob, dan kontrol atau tanpa penambahan bakteri. Hasil penelitian menunjukkan bahwa selama 9 hari penelitian nilai COD, total nitrogen, dan total fosfor mengalami penurunan masing-masing 15%, 95% dan 65%. Jika dibiarkan lebih lama dalam tandon penurunannya mungkin akan lebih tinggi karena bekteri masih akan terus bekerja.
SUMMARY
LUFISARI HERDIANTI. Role and Effectiveness Bacteria to Improved the Water Quality and Wastewater Treatment on Vanamei Ponds. Supervised by KADARWAN SOEWARDI and SIGID HARIYADI.
Aquaculture in coastal area can leads water pollution. The higher aquaculture technology may cause the higher of pollutants. Water quality management using bacteria from begining aquaculture can be used to minimize water pollution. The aim of this first study was to determine the effectiveness of commercial bacterial, including Super Nit, Super Bac, and a combination of both for increasing water quality in white shrimp (Litopenaeus vanamei) ponds with super intensive aquaculture. This study consisted of three parts. This first study consisted of two methods: a preliminary study and the primary study. The aim of preliminary study was to determine the time required to add bacteria based on the total number of bacterial colonies. The result showed that total number of Super Nit and Super Bac were maximum in 2 days. The primary study consisted of 4 treatments with 3 replications. The result showed that bacterial combination give the best effect to maintain water quality in super intensive cultivation because it can reduce ammonia (96%), nitrite (83%), and COD (42%).
The objective of the second study was to assess some carbonaceous substrate to increasing bacteria population. Bacteria population can control inorganic nitrogen. One of major water quality problems in aquaculture system is the accumulation of toxic inorganic nitrogeneous (NH3- and NO2-). The result
showed that addition of molasses and sugar can accelerated bacteria growth to decrease inorganic nitrogeneous. Bacteria use carbohydrates as a food to generate energy and to grow, I e., to produce proteins and new cells. In spite of wastewater from super intensive aquaculture contains high amount of organic matter, ammonia, and phosphorus. Several techniques are currently used to treat the effluent. The third experiments used to evaluate efficiency of aerobic and anaerobic bacteria to determine organic matter and nutrients removal by using aerobic and anaerobic bacteria. Four treatment groups including activated anaerobic bateria, non activated anaerobic bacteria, aerobic bateria, and without bacteria. The result showed that bacteria can remove COD (15%), total nitrogen (95%) and total phosphorus (65%).
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Pengelolaan Sumber Daya Perairan
PERANAN DAN EFEKTIFITAS BAKTERI UNTUK
PERBAIKAN KUALITAS AIR MEDIA DAN LIMBAH
PEMELIHARAAN UDANG VANAMEI (Litopenaeus vanamei)
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2015
Judul Tesis : Peranan dan Efektifitas Bakteri untuk Perbaikan Kualitas Air Media dan Limbah Pemeliharaan Udang Vanamei (Litopenaeus vanamei)
Nama : Lufisari Herdianti NIM : C251140196
Disetujui oleh Komisi Pembimbing
Prof Dr Ir Kadarwan Soewardi Ketua
Dr Ir Sigid Hariyadi, MSc Anggota
Diketahui oleh
Ketua Program Studi Pengelolaan Sumber Daya Perairan
Dekan Sekolah Pascasarjana
Dr Ir Sigid Hariyadi, MSc Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur Penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya, sehingga karya ilmiah berjudul “Peranan dan Efektifitas Bakteri untuk Perbaikan Kualitas Air Media dan Limbah Pemeliharaan Udang Vanamei (Litopenaeus vanamei)” dapat diselesaikan.
Penulis menyampaikan terimakasih kepada:
1. Institut Pertanian Bogor yang telah memberikan kesempatan untuk menempuh studi di sekolah pascasarjana pada program studi Pengelolaan Sumber Daya Perairan.
2. Prof Dr Ir Kadarwan Soewardi dan Dr Ir Sigid Hariyadi, MSc selaku komisi pembimbing.
3. Dr Ir Hefni Effendi, MPhill selaku dosen penguji.
4. Staff Laboratorium Produktivitas Lingkungan Perairan dan seluruh staf Tata Usaha Program Studi Pengelolaan Sumberdaya Perairan, Departemen MSP, FPIK, IPB.
5. Keluarga tercinta, Ayahanda Slamet Riyadi (alm), Ibu Sri Haryanti, adik Ridho Hardiyanto yang selalu memberikan doa dan motivasi.
6. Tim Penelitian Bakteri Ciherang (Nopionna Dwi, F.J Al Ilmi I, Alifani Y, Aldiano R, Bang Keni, Mang Awang) atas kerjasamanya.
7. Teman-teman Fasttrack SDP (Dewi Fitriawati, Yuyun Qonita, Nina Nurmalia D, Ayu Ramadhini H, Febi Ayu, Annisa Trisna, Lusita Meilana) , SPL (Nurul Mega, Siska Agustina, Agus Alim H, Akrom Muflih, Widyanti O) 2013, MSP 47, KMK 47, Desi Nurafida, Lia Kusuma, dan Pamungkas Tri S atas semangat dan dukungannya.
Penulis menyadari bahwa tesis ini masih jauh dari kesempurnaan. Namun, Penulis berharap agar tesis ini dapat memberikan manfaat bagi ilmu pengetahuan untuk pihak-pihak yang membutuhkan.
Bogor, Oktober 2015
DAFTAR ISI
DAFTAR ISI v
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
Manfaat Penelitian 2
2 METODE 3
Lokasi dan Waktu Penelitian 3
Metode Penelitian 3
3 HASIL DAN PEMBAHASAN 11
Hasil 11
Pembahasan 22
4 KESIMPULAN DAN SARAN 25
Kesimpulan 25
Saran 25
DAFTAR PUSTAKA 26
LAMPIRAN 29
DAFTAR TABEL
1 Perlakuan pada penelitian pendahuluan 4
2 Parameter yang diukur selama penelitian pendahuluan 4 3 Parameter kualitas air yang diukur selama penelitian 1 5 4 Parameter kualitas air yang diukur selama penelitian 2 7
5 Parameter yang diukur selama penelitian 3 8
6 Nilai pKa dari Ammonia pada suhu antara 5-30˚C 8
7 Tabel ANOVA 10
8 Parameter lingkungan selama penelitian 12
9 Kisaran nilai optimum pada pemeliharaan udang vanamei (SNI 2006) 12 10 Perbandingan karakteristik limbah buangan dengan BPPBAP Maros 16 11 Parameter lingkungan media budidaya pada pengujian sumber karbon 16
DAFTAR GAMBAR
1 Sketsa penelitian pada penelitian pendahuluan bagian 1 4 2 Sketsa penelitian pada penelitian utama bagian 1 5
3 Sketsa penelitian pada penelitian 2 6
4 Sketsa penelitian pada penelitian 3 7
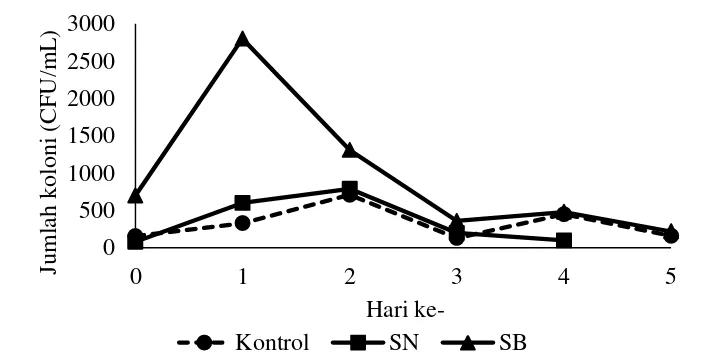
5 Pertumbuhan bakteri pada penelitian pendahuluan 11
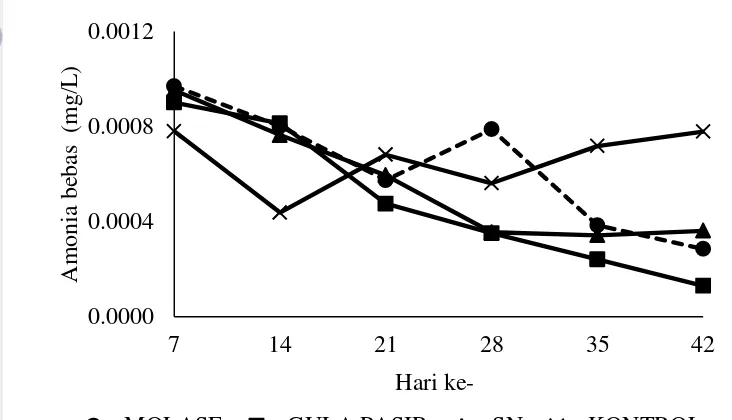
6 Perubahan amonia bebas pada penelitian 1 12
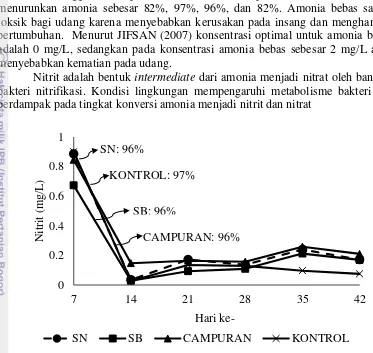
7 Perubahan nitrit pada penelitian 1 13
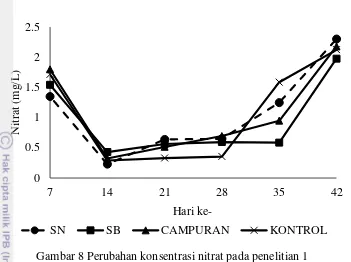
8 Perubahan konsentrasi nitrat pada penelitian 1 14 9 Perubahan konsentrasi COD pada penelitian 1 15 10 Pertumbuhan jumlah koloni bakteri pada penelitian 1 15 11 Pengaruh sumber karbon terhadap perubahan amonia bebas pada
penelitian 2 17
12 Pengaruh sumber karbon terhadap perubahan nitrit pada penelitian 2 18 13 Pengaruh sumber karbon terhadap perubahan nitrat pada penelitian 2 18 14 Pengaruh sumber karbon terhadap perubahan COD pada penelitian 2 19
15 Pengaruh sumber karbon terhadap jumlah total koloni bakteri pada
penelitian 2 19
16 Perubahan konsentrasi total nitrogen pada penelitian 3 20 17 Perubahan konsentrasi total fosfat pada penelitian 3 21
18 Perubahan konsentrasi COD pada penelitian 3 21
DAFTAR LAMPIRAN
1 Komposisi pembuatan fermentasi molase 29
2 Komposisi pembuatan fermentasi gula pasir 29
3 Prosedur aktivasi bakteri anaerob 29
4 Prosedur aplikasi bakteri anaerob 29
1
PENDAHULUAN
Latar Belakang
Pencemaran air di pesisir merupakan suatu permasalahan yang sangat kompleks karena pesisir merupakan muara dari beberapa sungai, serta daerah yang dijadikan sebagai tempat pembuangan limbah dari kegiatan antropogenik. Kegiatan antropogenik di daerah pesisir antara lain adalah industri, budidaya, penangkapan, dan lain sebagainya. Budidaya merupakan salah satu penyumbang polutan organik terbesar di daerah pesisir. Saat ini sudah mulai digunakan teknologi budidaya super intensif dengan padat penebaran udang tinggi hingga 5000/m3 (Samocha 2009). Semakin tinggi teknologi budidaya yang diterapkan maka limbah yang dihasilkan juga semakin tinggi.
Sistem budidaya dengan padat tebar tinggi memiliki beberapa kekurangan yaitu kualitas air yang buruk karena akumulasi bahan organik, sisa pakan, feses, peningkatan densitas fitoplankton, timbul gas toksik seperti NH3 dan H2S
(Sharmila et al. 1996) dan dapat meningkatkan penularan penyakit pada biota budidaya (Pattukumar et al. 2010). Meskipun produktivitas budidaya super intensif tinggi, perlu adannya pengelolaan kualitas air karena limbah yang dihasilkan berpotensi mencemari lingkungan perairan.
Upaya pengelolaan kualitas air dapat dimulai dari awal pemeliharaan. Pengelolaan air dari awal pemeliharaan mampu menciptakan kualitas air yang baik selama pemeliharaan sehingga mendukung pertumbuhan biota budidaya serta limbah yang dihasilkan tidak mencemari lingkungan. Pengelolaan kualitas air tambak dapat dilakukan dengan penggunaan bakteri untuk mempercepat proses dekomposisi limbah organik karena bakteri memiliki kemampuan fisiologis dan metabolisme untuk menurunkan polutan (Boopathy 2000). Penerapan mikroorganisme seperti bakteri menguntungkan mampu mendegradasi bahan organik, mereduksi penyakit, dan membantu siklus nutrien (Moriarty 1984). Selain itu, pemberian konsorsium bakteri nitrifikasi dan denitrifikasi berpengaruh positif terhadap perbaikan kondisi kualitas air tambak, pertumbuhan, dan produksi udang windu (Badjoeri & Widiyanto 2008). Selain itu Bacillus spp. mampu menurunkan amonia dan meningkatkan kualitas air pada budidaya udang (Foon 2004).
2
Perumusan Masalah
Pengelolaan budidaya berwawasan lingkungan sangat dibutuhkan pada saat ini, karena limbah yang dihasilkan oleh kegiatan budidaya khususnya teknologi super intensif cukup tinggi jumlahnya dan memiliki potensi mencemari lingkungan perairan pesisir. Penggunaan teknologi super intensif perlu diikuti dengan pengolahan limbah yang lebih intensif sejak dalam proses budidaya maupun sebelum limbah dibuang ke perairan. Pengolahan limbah ini dapat digunakan dengan penggunaan bakteri pengurai yang dapat memanfaatkan bahan organik yang dihasilkan selama masa pemeliharaan. Bakteri yang akan digunakan adalah bakteri yang baru yang mulai dipasarkan dan banyak petambak yang merasakan manfaatnya. Sejauh mana bakteri tersebut mampu memperbaiki kualitas air tambak perlu dilakukan penelitian dalam skala laboratorium. Bakteri yang akan dipilih untuk diteliti adalah bakteri konsorsium yang terdiri dari gabungan dari Nitrosomonas sp., Nitrobacter sp., Bacillus sp. serta Lactobacillus plantarum. Prinsipnya adalah untuk mengkonversi bahan organik sebagai sumber karbon untuk pertumbuhan bakteri sehingga dapat memperbaiki kualitas air tambak dan dapat dimanfaatkan sebagai makanan udang, serta air buangan tambak yang tidak mencemari lingkungan.
Dalam penelitian ini akan dikaji sejauh mana manfaat bakteri tersebut dalam mengurangi limbah sehingga mampu memperbaiki kualitas air tambak dan juga limbah tambak yang dibuang ke perairan, serta penerapan metode yang efektif dalam pengelolaan budidaya dengan meningkatkan populasi bakteri untuk mengurangi bahan organik dari penambahan beberapa sumber karbon.
Tujuan Penelitian
Penelitian ini bertujuan untuk:
1. Mengkaji peranan bakteri dalam memperbaiki kualitas air media pemeliharaan udang vanamei (Litopenaeus vannamei).
2. Mengkaji efektifitas beberapa sumber karbon untuk meningkatkan populasi bakteri.
3. Mengkaji pengelolaan limbah tambak sebelum dibuang ke perairan.
Manfaat Penelitian
3
2
METODE
Lokasi dan Waktu Penelitian
Penelitian dilaksanakan di dua tempat yaitu: Lapangan percobaan sebagai tempat percobaan dan Laboratorium Produktivitas dan Lingkungan Perairan untuk analisis kualitas air dan analisis jumlah total bakteri. Penelitian terdiri dari penelitian pendahuluan yang dilakukan selama 5 hari dan penelitian utama selama 2 bulan, dari bulan Februari hingga Maret 2015.
Metode Penelitian
Tahap Persiapan
Tahap persiapan meliputi persiapan sistem budidaya sebagai unit percobaan. Sistem budidaya berupa tangki berukuran 19 L, kemudian diisi dengan air laut sebanyak 15 L. Air laut yang digunakan adalah air laut komersil dengan salinitas 25 psu. Air laut disterilisasi menggunakan kaporit 20 mg/L, kemudian diaerasi selama 3 hari. Selanjutnya diberikan fermentasi molase yang bertujuan untuk menumbuhkan plankton. Penambahan fermentasi molase sebanyak 10 mL/L dilakukan 3 hari sebelum udang dimasukkan kedalam media. Setelah plankton tumbuh, udang PL 10 dimasukkan kedalam media dengan kepadatan 15 ekor/tangki (Atjo 2013). Udang dipelihara selama 7 hari sebelum penelitian utama. Selama pemeliharaan, dilakukan pemberian pakan dengan metode blind feeding.
Penelitian 1
Pengujian peranan bakteri komersial SN (Nitrobacter sp., Nitrosomonas sp, dan Bacillus sp.), SB (Lactobacillus plantarum dan Bacillus sp.), dan gabungan keduanya (SN+SB) dalam meningkatkan kualitas air pemeliharaan udang vanamei super intensif.
1.1 Penelitian Pendahuluan
4
Tabel 1. Perlakuan pada penelitian pendahuluan No. Perlakuan Label Keterangan 1. Kontrol KONTROL Tanpa perlakuan
2. Super Nit SN Perlakuan penambahan 1 mL/L konsorsium bakteri nitrifikasi (Nitrosomonas sp.,
Nitrobacter sp., dan Bacillus sp.)
3. Super Bac SB Perlakuan penambahan 1 mL/L konsorsium bakteri Lactobacillus plantarum dan Bacillus
sp.).
Gambar 1 Sketsa penelitian pada penelitian pendahuluan bagian 1
Pengamatan dilakukan setiap 1 hari sekali selama 5 hari. Pengamatan hari ke-0 dilakukan sebelum penambahan bakteri. Pada setiap pengamatan dilakukan pengambilan contoh air untuk pengukuran parameter yang tersaji pada Tabel 2.
Tabel 2 Parameter yang diukur selama penelitian pendahuluan
Parameter Satuan Alat/metode
Fisika
1. Suhu ˚C Thermometer/probe elektroda*
Kimia
1. Oksigen terlarut mg/L DO-meter/ probe elektroda*
2. pH - pH-meter/probe elektroda*
Biologi
1. Jumlah total bakteri CFU/mL Total Plate Count/Nutrien Agar
*Sumber: APHA (2012)
Setelah dilakukan pengamatan selama 5 hari, maka dari ketiga perlakuan akan diketahui pertumbuhan bakteri dari masing-masing perlakuan. Waktu pada saat jumlah bakteri maksimum digunakan sebagai acuan untuk menambahkan bakteri pada penelitian utama.
1.2 Penelitian Utama
Dalam penelitian utama terdiri dari 4 perlakuan dengan 3 ulangan, sehingga terdiri dari 12 unit percobaan. Perlakuan terdiri dari (Gambar 2):
1. Penambahan SN 1 mL/L selama X hari sekali (SN1; SN2; SN3).
SN SB KONTROL
5 2. Penambahan SB 1 mL/L selama X hari sekali (SB1; SB2; SB3).
3. Penambahan SN 0,5 mL/L dan SB 0,5 mL/L selama X hari sekali (CAMPURAN1; CAMPURAN2; CAMPURAN3).
4. Kontrol (Tanpa penambahan bakteri) (KONTROL1; KONTROL2; KONTROL3).
Keterangan: X adalah 2 hari (diperoleh dari penelitian pendahuluan)
Gambar 2 Sketsa penelitian pada penelitian utama bagian 1
Setelah 7 hari pemeliharaan, kemudian dilakukan pengukuran kualitas air awal pada setiap unit percobaan sebagai H0, selanjutnya dimasukkan bakteri sesuai dengan perlakuan yang diberikan pada waktu yang ditentukan dari penelitian pendahuluan. Selanjutnya dilakukan pemeliharaan udang selama 42 hari di dalam sistem percobaan. Kemudian dilakukan pengamatan kualitas air dan jumlah total bakteri setiap 7 hari sekali. Berikut merupakan parameter yang diukur pada penelitian utama (Tabel 3).
Tabel 3 Parameter kualitas air yang diukur selama penelitian 1
Parameter Satuan Alat/metode
Fisika
1. Suhu ˚C Thermometer/probe elektroda*
2. Salinitas psu Refraktometer
Kimia
1. Oksigen terlarut mg/L DO-meter/ Modifikasi Winkler*
2. Ph - pH-meter/probe elektroda*
3. Nitrat (NO3-N) mg/L Spektrofotometer/Brucine**
4. Nitrit (NO2-N) mg/L Spektrofotometer/ Sulfanilamid* 5. TAN (NH3-N) mg/L Spektrofotometer/ Phenate*
6. COD mg/L Spektrofotometer/ Refluks tertutup**
Biologi
6
Penelitian 2
Pengujian beberapa sumber karbon untuk meningkatkan populasi bakteri.
Untuk mengetahui sumber karbon yang efektif dalam meningkatkan populasi bakteri maka digunakan dua jenis sumber karbon yaitu molase dan gula pasir. Penggunaan sumber karbon yang berbeda bertujuan untuk mengetahui peranannya dalam meningkatkan populasi bakteri dalam media budidaya sehingga keberadaan bahan organik dapat dikontrol. Pada penelitian ini hanya digunakan bakteri SN untuk perlakuan. Perlakuan yang dicobakan terdiri dari (Gambar 3):
1. Penambahan fermentasi molase 3 hari sekali sebanyak 10 mL/L (MOLASE1; MOLASE2; MOLASE3) (Lampiran 1)
2. Penambahan fermentasi gula pasir 3 hari sekali sebanyak 10 mL/L (GULA PASIR1; GULA PASIR2; GULA PASIR3) (Lampiran 2)
3. Penambahan bakteri tanpa pemberian sumber karbon (SN1; SN2; SN3) 4. Kontrol (tidak ada penambahan bakteri dan sumber karbon) (KONTROL1;
KONTROL2; KONTROL3)
Setelah 7 hari pemeliharaan, kemudian dilakukan pengukuran kualitas air awal pada setiap unit percobaan sebagai H0, selanjutnya dimasukkan bakteri setiap 2 hari sekali dan penambahan sumber karbon sesuai dengan perlakuan. Selanjutnya dilakukan pemeliharaan udang selama 42 hari di dalam sistem percobaan. Kemudian dilakukan pengamatan kualitas air dan jumlah total bakteri setiap 7 hari sekali. Berikut ini merupakan parameter yang diukur pada penelitian 2 (Tabel 4).
Gambar 3 Sketsa penelitian pada penelitian 2
Penelitian 3
Pengujian metoda penurunan bahan organik limbah tambak sebelum dibuang ke perairan.
Pengujian metoda penurunan bahan organik limbah tambak bertujuan untuk mengetahui metoda paling efektif dalam menurunkan bahan organik sebelum dibuang ke lingkungan perairan.
7 Limbah budidaya yang digunakan adalah air hasil budidaya pada penelitian utama. Limbah dihomogenkan dengan mencampur seluruh limbah ke dalam tangki penampungan. Selanjutnya limbah dibagi kedalam tangki berukuran 15 L. Pada pengolahan limbah ini digunakan 2 bakteri berbeda yaitu: bakteri anaerob dan bakteri aerob. Pada Penelitian ini dilakukan 4 perlakuan dengan 3 kali ulangan. Perlakuan yang diberikan terdiri dari (Gambar 4):
1. Pengolahan limbah menggunakan konsorsium bakteri anaerob (dengan aktivasi) (ANAEROB AKTIVASI1; ANAEROB AKTIVASI2; ANAEROB AKTIVASI3) (Lampiran 3).
2. Pengolahan limbah menggunakan konsorsium bakteri anaerob (secara langsung) (ANAEROB LANGSUNG1; ANAEROB LANGSUNG2; ANAEROB LANGSUNG3) (Lampiran 4).
3. Pengolahan limbah menggunakan bakteri terbaik pada penelitian 1 (SN+SB1; SN+SB2; SN+SB3).
4. Tanpa penambahan bakteri (KONTROL1; KONTROL2; KONTROL3). Tabel 4 Parameter kualitas air yang diukur selama penelitian 2
Parameter Satuan Alat/metode
Fisika
1. Suhu ˚C Thermometer/probe elektroda*
2. Salinitas PSU Refraktometer
Kimia
1. Oksigen terlarut mg/L DO-meter/ Modifikasi Winkler*
2. pH - pH-meter/probe elektroda*
3. TAN (NH3-N) mg/L Spektrofotometer/ Phenate*
4. COD mg/L Spektrofotometer/ Refluks tertutup**
Biologi
5. Jumlah total bakteri CFU/mL Total Plate Count/Nutrien Agar Sumber: * APHA 2012
**APHA 2005
8
Masing-masing limbah pada perlakuan ditempatkan pada tangki penampungan tanpa pemberian aerasi, serta pada perlakuan anaerob aktivasi dan anaerob langsung, tangki dibuat dalam keadaan tertutup untuk mencegah adanya fotosintesis. Pengamatan setiap 3 hari sekali sebanyak 4 kali dengan parameter sebagai berikut (Tabel 5):
Tabel 5 Parameter yang diukur selama penelitian 3
Parameter Satuan Metode
A Fisika
1 Suhu ˚C Probe elektroda*
B Kimia
1 pH - Probe elektroda*
2 Oksigen terlarut mg/L Probe elektroda *
3 COD mg/L Refluks tertutup/ Refluks tertutup* 4 Total fosfat mg/L Spektrofotometrik/ Molibdate* 5 Total nitrogen mg/L Spektrofotometrik/ Phenate * *APHA (2012)
Analisis Data
Efektifitas penurunan
Efekifitas penurunan digunakan untuk mengetahui persentase penurunan parameter limbah organik oleh bakteri.
Persentase unionized ammonia
Amonia tak terionisasi bersifat toksik bagi biota dan keberadaannya tergantung pada pH dan suhu pada saat pengambilan contoh air. Amonia tak terionisasi dapat dihitung menggunakan rumus (Strictland dan Parson 1972). Metode interpolasi digunakan untuk mendapatkan nilai pKA saat suhu pada saat pengambilan contoh tidak terdapat pada Tabel 6.
Tabel 6 Nilai pKa dari Ammonia pada suhu antara 5-30˚C
Suhu (˚C) 5 10 15 20 25 30
pKa 9,90 9,73 9,56 9,40 9,24 9,09
Analisis Statistik
9 dengan tiga ulangan dan enam kali waktu pengamatan. Sedangkan untuk penelitian 2 menggunakan empat perlakuan yaitu: Molase, Gula pasir, SN, dan Kontrol dengan tiga ulangan dan lima kali waktu pengamatan. Pada penelitian 3 menggunakan empat perlakuan yaitu: Anaerob aktivasi, Anaerob langsung, SN+SB, dan Kontrol. Tujuan dari RAL in time adalah untuk mengetahui perubahan respon dari suatu periode waktu ke periode waktu lainnya serta untuk mengetahui interaksi antara perlakuan dan waktu pengamatan (Widiharih 2001). Model linier yang digunakan:
ρi(j) : Pengaruh acak dari perlakuan ke-i, ulangan ke-k yang menyebar normal
(0, 2ρ)
αi : Pengaruh perlakuan ke-i ik : Komponen galat (a)
βj :Pengaruh waktu ke-j
(αβ)jk : Pengaruh interaksi perlakuan ke-i dan waktu ke-j
ijk : Pengaruh acak dari interaksi waktu dengan perlakuan yang menyebar
normal (0, 2ρ)
Analisis data dengan RAL in time disajikan dalam tabel ANOVA pada Tabel 7 dengan hipotesis yang dapat diuji dari rancangan tersebut adalah sebagai berikut:
1. Pengaruh perlakuan terhadap respon Hipotesis :
3. Pengaruh interaksi perlakuan dan waktu pengamatan Hipotesis :
H0 : (αβ)C0 (αβ)C6 … (αβ)K34 = 0 (tidak ada pengaruh perlakuan dan
waktu pengamatan)
H1 : u (αβ)j ≠ ( u u w u
10
Tabel 7 Tabel ANOVA
Sumber: (Widiharih 2001 )
Penarikan kesimpulan dilihat dari tabel analisis sidik ragam pada Tabel 7. Kesimpulan yang dapat diambil adalah sebagai berikut:
Jika nilai Fhitung > Ftabel, maka tolak H0, berarti minimal terdapat satu
perlakuan/waktu/interaksi yang memberikan pengaruh.
Jika nilai Fhitung < Ftabel, maka gagal tolak H0, berarti tidak ada
perlakuan/waktu/interaksi yang memberikan pengaruh.
Pengaruh perlakuan/waktu/interaksi yang memberikan yang signifikan dapat dilihat dengan uji lanjut menggunakan uji perbandingan berganda Duncan.
Uji perbandingan berganda duncan (DMRT, Duncan multiple range test)
Uji berganda duncan mempersiapkan sugugus nilai pembanding yang nilainya meningkat tergantung dari jarak peringkat dua buah perlakuan yang dibandingkan. Hipotesis yang digunakan adalah:
H0 : Ȳi-Ȳh = 0
H1 : Ȳi-Ȳh≠ 0
Nilai kritis Duncan dapat dihitung sebagai berikut: Rp=rα;p;dbg SȲ
Ȳ √
∑
Dimana rα;p;dbg nilai tabel Duncan pada taraf nyata α, jarak peringkat dua
perlakuan p dan derajat bebas sebesar dbg. (Mattjik dan Sumertajaya 2006). Uji
11
3
HASIL DAN PEMBAHASAN
Hasil
Penelitian 1
1.1 Penelitian Pendahuluan
Hasil yang diperoleh menunjukkan bahwa jumlah koloni bakteri SB mencapai jumlah tertinggi pada hari ke-1 (2,8 x 103 CFU/mL) kemudian menurun pada hari ke-2 menjadi 1,3x103 CFU/mL. Konsorsium bakteri SN mencapai jumlah tertinggi pada hari ke-2 (7,9 x 102 CFU/mL) kemudian turun pada hari ke-3 (Gambar 5).
Gambar 5 Pertumbuhan bakteri pada penelitian pendahuluan Dari hasil tersebut digunakan sebagai acuan waktu penambahan bakteri selama penelitian utama. Penambahan bakteri dilakukan setiap 2 hari sekali dengan asumsi pada hari ke 2 bakteri berada pada fase statis yaitu laju pertumbuhannya sama dengan laju kematiannya. Penambahan bakteri setiap 2 hari bertujuan untuk menjaga populasi bakteri pada media karena tingginya populasi bakteri menguntungkan dapat menjaga kualitas air tambak, mereduksi populasi
Vibrio sp., menurunkan penyakit dan penyebab stress, serta mempercepat pertumbuhan dan meningkatkan survival rate (Pattukumar et al. 2010).
Penelitian Utama Parameter lingkungan
12
Tabel 8 Parameter lingkungan selama penelitian
Parameter Perlakuan
Seluruh parameter lingkungan yang diukur pada semua perlakuan masih termasuk dalam kisaran normal hidup udang vanamei (Tabel 9). Kisaran nilai pH yaitu 6-8,5. Suhu berkisar antara 27-29 ˚C. O u 4-6 mg/L, dan salinitas berkisar antara 20-23 psu.
Tabel 9 Kisaran nilai optimum pada pemeliharaan udang vanamei (SNI 2006)
No Parameter air Nilai optimum
1. pH 7,5-8,5
Pada siklus nitrogen, senyawa nitrogen selalu konstan. Pakan merupakan sumber utama nitrogen. Protein dalam pakan dimanfaatkan oleh udang dan dikeluarkan sebagai feses yang mengandung amonia. Amonia bebas dan nitrit adalah dua senyawa yang dapat bersifat toksik pada udang apabila terdapat dalam konsentrasi yang tinggi.
13 Konsentrasi amonia bebas selama pemeliharan menunjukkan adanya penurunan setelah hari ke-14 (Gambar 6). Semua perlakuan memberikan pengaruh pada penurunan amonia bebas (p<0,05) dengan perlakuan terbaik adalah SB karena mampu menurunkan amonia bebas paling besar (Lampiran 5). Pada hari ke-14 hingga ke-28 perlakuan SN, SB, Campuran dan Kontrol mampu menurunkan amonia sebesar 82%, 97%, 96%, dan 82%. Amonia bebas sangat toksik bagi udang karena menyebabkan kerusakan pada insang dan menghambat pertumbuhan. Menurut JIFSAN (2007) konsentrasi optimal untuk amonia bebas adalah 0 mg/L, sedangkan pada konsentrasi amonia bebas sebesar 2 mg/L akan menyebabkan kematian pada udang.
Nitrit adalah bentuk intermediate dari amonia menjadi nitrat oleh bantuan bakteri nitrifikasi. Kondisi lingkungan mempengaruhi metabolisme bakteri dan berdampak pada tingkat konversi amonia menjadi nitrit dan nitrat
Gambar 7 Perubahan nitrit pada penelitian 1
Hasil penelitian menunjukan adanya penurunan nitrit setelah aplikasi bakteri (Gambar 7). Pada hari ke-7 hingga ke-14 perlakuan SN, SB, Campuran dan Kontrol mampu menurunkan amonia sebesar 96%, 96%, 96%, dan 97%. Semua perlakuan memberikan pengaruh signifikan pada perubahan nitrit (p<0,05) selama penelitian (Lampiran 6). Namun pada kontrol konsentrasi nitrit lebih rendah dari ketiga perlakuan lain. Hal ini diduga nitrogen pada perlakuan kontrol masih banyak berbentuk amonia bebas (Gambar 7) dan belum teroksidasi menjadi nitrit. Nitrit dapat mengakibatkan stress pada udang. Pada konsentrasi 4,5 mg/L nitrit dapat mengganggu transportasi oksigen dalam sel dan peredaran darah (Boyd 1990 dalam JIFSAN 2007).
Nitrat merupakan hasil oksidasi dari amonia dan nitrit. Nitrat merupakan senyawa yang dimanfaatkan oleh fitoplankton untuk pertumbuhannya. Perubahan konsentrasi nitrat selama pemeliharaan tersaji pada Gambar 8.
14
Gambar 8 Perubahan konsentrasi nitrat pada penelitian 1
Konsentrasi nitrat selama pemeliharaan menunjukkan adanya peningkatan pada semua perlakuan (Gambar 8) dimana perlakuan yang diberikan tidak memberikan pengaruh pada perubahan nitrat (p>0,05) (Lampiran 7). Hal ini diduga karena adanya pengaruh penambahan fermentasi molase yang meningkatkan konsentrasi nitrat.
Parameter Bahan Organik
Meningkatnya konsentrasi bahan organik dalam tambak dikarenakan adanya input pakan. Bahan organik yang berlebihan akan menimbulkan permasalahan seperti penurunan kualitas air. Peningkatan bahan organik didasar perairan akan mengganggu keseimbangan oksigen terlarut di perairan, karena peningkatan konsumsi oksigen lebih besar dibandingkan dengan tingkat kebutuhan oksigen (Jati 2012 dalam Putra et al. 2014). Kandungan bahan organik dapat diukur dengan parameter COD karena COD menggambarkan jumlah total oksigen yang dibutuhkan untuk mengoksidasi bahan organik secara kimiawi, baik yang dapat didegradasi secara biologis maupun yang sukar didegradasi secara biologis menjadi CO2 dan H2O. Perubahan COD selama masa pemeliharaan disajikan pada
Gambar 9.
Perubahan fluktuatif terjadi pada nilai COD selama penelitian (Gambar 9). Berdasarkan uji statistik perlakuan yang diberikan memberikan pengaruh signifikan (p<0,05) (Lampiran 8) dengan perlakuan terbaik adalah perlakuan Campuran yang memberikan rata-rata konsentrasi paling rendah yaitu 87,25 mg/L dan pada hari ke-28 perlakuan Campuran mampu menurunkan COD hingga 56,5 mg/L. Nilai COD relatif tinggi, hal ini diduga karena seluruh bahan organik terukur pada COD termasuk bakteri dan plankton.
15
Gambar 9 Perubahan konsentrasi COD pada penelitian 1
Parameter Biologi
Menurut Browdy et al. (2001) strategi pengelolaan komunitas mikrobial secara umum dapat dikategorikan menjadi 3, yaitu: suplementasi nutrien, ekspansi habitat, dan aplikasi kultur mikroorganisme. Kultur bakteri juga berpotensi dalam pembentukan probiotik. Probiotik merupakan sel mikroba hidup yang jika dikonsumsi dalam jumlah yang cukup akan memberikan manfaat bagi kesehatan. Penambahan bakteri pada penelitian diharapkan mampu meningkatkan kualitas air pada media pemeliharaan. Pertumbuhan jumlah koloni bakteri selama penelitian disajikan pada Gambar 10.
16
Berdasarkan hasil yang diperoleh, bakteri SN yang terdiri dari Nitrobacter
sp, Nitrosomonas sp, dan Bacillus sp., memiliki jumlah koloni paling banyak dari perlakuan lainnya yaitu sebesar 2,5x105 CFU/mL. Menurut Moriarty (1999)
Bacillus sp. dengan kepadatan 104-105 mampu mendesak populasi Vibrio sp. karena Bacillus sp. mampu memproduksi antibiotik yang mampu menghambat pertumbuhan Vibrio. Selain itu bakteri berpengaruh positif pada konsentrasi amonia dan oksigen terlarut (Bowdy et al. 2001) karena amonia diubah menjadi nitrit dan nitrat oleh Nitrobacter sp. dan Nitrosomonas sp.
Perbandingan data kualitas air
Dibawah ini merupakan perbandingan data kualitas air budidaya dari Balai Penelitian dan Pengembangan Budidaya Air Payau Maros (BPPBAP 2014). BPPBAP melakukan percobaan budidaya udang vanamei dengan teknologi supra intensif dengan penerapan probiotik setiap 1 minggu sekali.
Tabel 10 Perbandingan karakteristik limbah buangan dengan BPPBAP Maros (2014)
Parameter BPPBAP Maros Penelitian ini
Kisaran SN SB Campuran
Nitrat (mg/L) 0,24-0,3 2,30 1,97 2,18
Nitrit (mg/L) 0,78-0,79 0,17 0,17 0,21
Karakteristik limbah buangan dari BPPBAP Maros memiliki nilai nitrit lebih tinggi dari perlakuan yang diberikan pada penelitian ini. Hal ini menunjukkan bahwa penerapan bakteri dengan frekuensi lebih sering mampu mengurangi konsentrasi nitrit.
Penelitian 2
Parameter lingkungan
Pada penelitian ini diukur parameter lingkungan untuk mengetahui kondisi lingkungan pada media budidaya. Hasil pengukuran parameter lingkungan disajikan pada Tabel 11.
Tabel 11 Parameter lingkungan media budidaya pada pengujian sumber karbon
Parameter Perlakuan
MOLASE GULAPASIR SN KONTROL
pH 6-6,5 5,8-6,5 6-6,5 5,8-6,5
u u (˚C) 26,5-28 27-28,6 27,1-28,5 26,5-28,3
Oksigen terlarut (mg/L) 4-6 4-6,5 4-6,5 4-6,5
(‰) 18-20 18-10 20-21 19-20
17
Parameter Kimia Nitrogen
Manipulasi rasio C:N dalam mengontrol nitrogen anorganik merupakan metode potensial didalam budidaya. Penambahan sumber karbon mampu mengurangi nitrogen anorganik pada budidaya ikan nila skala produksi (Avnimelech 1999). Pengaruh perlakuan sumber karbon terhadap perubahan nilai amonia bebas tersaji pada Gambar 11.
Gambar 11 Pengaruh sumber karbon terhadap perubahan amonia bebas pada penelitian 2
Perlakuan tidak memberikan perlakuan pada perubahan nilai amonia bebas (p>0,05). Namun, penambahan molase dan gula pasir mampu menurunkan amonia bebas pada media budidaya terlihat dari kecenderungan adanya penurunan amonia bebas pada setiap waktu pengamatan (p<0,05). Laju penurunan amonia bebas pada Molase, Gula pasir, dan SN lebih cepat daripada Kontrol.
Nitrit sebagai senyawa intermediate, merupakan salah satu senyawa yang berbahaya terhadap biota budidaya. Sehingga, keberadaan nitrit harus diminimalisir. Berikut adalah perubahan nilai nitrit selama penelitian (Gambar 12). Berdasarkan uji statistik, perlakuan yang diberikan belum memberikan pengaruh yang berbeda nyata terhadap perubahan konsentrasi nitrit (p>0,05). Perubahan nilai nitrit hanya dipengaruhi oleh waktu pengamatan dimana pada hari ke-28 nilai nitrit mencapai rata-rata terendah.
Nitrat merupakan nutrien yang mampu dimanfaatkan plankton untuk pertumbuhannya. Pertumbuhan plankton menguntungkan pada sistem budidaya sangat diharapkan. Sehingga keberadaan nitrat menjadi penting dalam sistem budidaya. Perubahan nitrat terhadap sumber karbon tersaji pada Gambar 13.
Berdasarkan uji statistik, perlakuan yang diberikan memberikan pengaruh signifikan terhadap perubahan nilai nitrat (p<0,05). Namun molase dan gula pasir belum mampu meningkatkan nila nitrat karena pada tanpa adanya penambahan karbon nitrat pada media budidaya sudah dapat meningkat.
18
Gambar 12 Pengaruh sumber karbon terhadap perubahan nitrit pada penelitian 2
Gambar 13 Pengaruh sumber karbon terhadap perubahan nitrat pada penelitian 2 Keberadaan bahan organik dalam media budidaya juga perlu dikelola, karena bahan organik berpengaruh pada oksigen terlarut dalam proses dekomposisinya. Bahan organik mampu digambarkan dengan nilai COD. Berikut adalah pengaruh sumber karbon terhadap perubahan COD selama penelitian (Gambar 14).
Berdasarkan hasil uji statistik semua perlakuan memberikan pengaruh signifikan pada perubahan nilai COD (p<0,05) dengan perlakuan terbaik pada Gula pasir. Kontrol merupakan perlakuan tanpa penambahan sumber karbon dan bakteri menunjukkan adanya peningkatan COD selama penelitian.
19
Gambar 14 Pengaruh sumber karbon terhadap perubahan COD pada penelitian 2
Parameter Biologi
Bakteri dan mikroorganisme menggunakan karbohidrat (gula, pati, dan selulosa) sebagai makanan untuk menghasilkan energi dalam pertumbuhan dan memproduksi protein dan sel baru (Avnimelech 1999). Pengaruh sumberkarbon terhadap perubahan jumlah total koloni bakteri disajikan pada Gambar 18.
Gambar 15 Pengaruh sumber karbon terhadap jumlah total koloni bakteri selama penelitian
Penambahan sumber karbon memberikan pengaruh pada jumlah total koloni bakteri selama penelitian. Molase dan Gula pasir memberikan pengaruh besar pada peningkatan jumlah total koloni bakteri. Perlakuan Kontrol hanya
20
memberikan pengaruh sedikit pada perubahan jumlah total koloni bakteri selama penelitian.
Penelitian 3
Pada pengujian metoda penurunan bahan organik limbah budidaya sebelum dibuang ke perairan menggunakan bakteri anaerob dan bakteri paling efektif dari penelitian sebelumnya. Parameter yang diamati meliputi total nitrogen, total fosfat, dan COD. Total nitrogen terdiri dari nitrogen organik dan nitrogen anorganik. Sebagian besar nitrogen dalam media pemeliharaan berasal dari pakan yang diberikan. Perubahan konsentrasi total nitrogen selama pengamatan tersaji pada Gambar 16.
Gambar 16 Perubahan konsentrasi total nitrogen pada penelitian 3
Berdasarkan uji statistik perlakuan dan waktu pengamatan memberikan pengaruh signifikan pada nilai total nitrogen(p<0,05) (Lampiran 17). Penurunan total nitrogen ini diduga karena sudah tidak ada input pakan pada limbah sehingga sisa total nitrogen mampu direduksi oleh bakteri seiring berjalannya waktu.
Total fosfat terdiri dari fosfat organik dan fosfat anorganik. Fosfat dengan jumlah berlebih berpotensi menimbulkan terjadinya blooming plankton karena terjadi peningkatan kesuburan perairan. Konsentrasi total fosfat selama pengolahan limbah tersaji pada Gambar 17.
21
Gambar 17 Perubahan konsentrasi total fosfat pada penelitian 3
Parameter COD yang diukur menggambarkan penurunan bahan organik selama pengolahan limbah. COD perlu diturunkan hingga memenuhi baku mutu sebelum dibuang ke perairan umum karena bahan organik yang tinggi dapat menimbulkan pencemaran bagi perairan. Perubahan nilai COD disajikan pada Gambar 18.
Gambar 18 Perubahan konsentrasi COD pada penelitian 3
Berdasarkan uji statistik seluruh perlakuan memberikan pengaruh signifikan pada perubahan COD (p<0,05) (Lampiran 11). SN+SB dan Anaerob aktivasi pada hari ke 9 menurunkan rata-rata konsentrasi COD hingga 89,5 mg/L dan 88,8 mg/L. Meskipun konsentrasi COD masih berada diatas baku mutu, terjadi tren penurunan nilai COD pada setiap pengamatan, sehingga apabila limbah didiamkan dengan waktu yang lebih lama maka nilai COD dapat memenuhi baku mutu sebelum dibuang ke perairan. Bakteri memproduksi enzim ekstraseluler
22
hidrolase protease yang mampu mengubah protein menjadi amonia melalui proses hidrolisis (Karigar & Rao 2011). Kemampuan inilah yang menunjukkan bahwa bakteri mampu mendegradasi bahan organik.
Pembahasan
Budidaya udang vanamei super intensif menjadi orientasi sistem budidaya masa depan dengan ciri volume wadah budidaya kecil dengan padat penebaran tinggi, produktivitas tinggi (Wasielesky et al. 2006; Krummenauer et al. 2001 dalam Wasielesky et al. 2013). Budidaya dengan pola superintensif berpengaruh langsung pada peningkatan produksi dari flok (Wasielesky et al. 2013). Namun masih terdapat permasalahan pada budidaya dengan pola superintensif yaitu padat tebar yang berlebih akan menurunkan pertumbuhan dan kelangsungan hidup udang (Wasielesky et al. 2013). Selain itu menurut Peterson & Grififith (1999) dalam Wasielesky et al. (2013) padat tebar berlebih dapat mengurangi ruang gerak dan ketersediaan pakan alami, meningkatkan kanibalisme (Abdussamad & Thampy 1994 dalam Wasielesky et al. 2013), penurunan kualitas air media (Nga
et al. 2005 dalam Wasielesky et al. 2013), dan akumulasi bahan organik pada dasar kolam (Arnold et al. 2005 dalam Wasielesky et al. 2013).
Beberapa penelitian dilakukan untuk mengatasi permasalahan tersebut, diantaranya adalah penggunakan mikroba seperti bakteri. Berdasarkan penelitian Putra et al. (2014), terdapat hubungan positif antara bahan organik dengan total bakteri, dimana semakin besar nilai bahan organik maka nilai total bakteri juga semakin besar. Bakteri yang digunakan dalam penelitian merupakan konsorsium bakteri yang menguntungkan. Konsorsium bakteri merupakan suatu campuran populasi mikroba dalam bentuk komunitas yang mempunyai hubungan kooperatif, komensal, dan mutualistik (Nugroho 2006). Penggunaan konsorsium bakteri cenderung memberikan hasil kerja yang lebih baik dibandingkan penggunaan bakteri isolat tunggal, karena diharapkan kerja enzim dari tiap jenis mikroba dapat saling melengkapi dan bertahan hidup (Komarawidjaja 2009).
Hasil penelitian menunjukan SN mampu menurunkan amonia dan nitrit sebesar 82% dan 96% pada hari ke-14 hingga hari ke-28. Berdasarkan penelitian Devaraja et al. (2013) Bacillus spp. mampu menurunkan amonia nitrogen dan tidak bersifat pathogenik, selain itu Bacillus spp. dapat tumbuh pada rentang pH, suhu, salinitas, dan amonia yang tinggi dan mampu mensekresikan enzim ekstraselular seperti protease, amilase, dan lipase yang mampu membantu dalam proses degradasi bahan organik pada ekosistem perairan (Karigar&Rao 2011). Konsorsium bakteri SN terdapat Nitrosomonas sp. dan Nitrobacter sp.
Nitrosomonas sp. merupakan bakteri yang mengoksidasi amonia menjadi nitrit, sedangkan Nitrobacter sp. merupakan bakteri yang mengoksidasi nitrit menjadi nitrat. Menurut Altschul et al. (1997) dalam Sombatjinda (2011) bakteri pengoksidasi amonia terdiri dari lima genera yaitu: Nitrosomonas, Nitrosovibrio, Nitrosococcus, Nitrsolobus, dan Nitrospira, sedangkan bakteri pengoksidasi nitrit terdiri dari tiga genera yaitu: Nitrobacter, Nitrococcus, dan Nitrospira.
23 dapat menguraikan karbohidrat menjadi asam laktat. Asam laktat yang dihasilkan dapat menghambat pertumbuhan mikroorganisme patogen. Lactobacillus
menghasilkan enzim laktase yang memecah laktosa menjadi glukosa dan galaktosa, selanjutnya glukosa digunakan dalam fermentasi asam laktat untuk menghasilkan produk berupa asam laktat dan energi (Martoharsono 2006). Asam laktat yang dihasilkan oleh Lactobacilus plantarum berpotensi untuk pembentukan probiotik. Probiotik didefinisikan sebagai mikroorganisme hidup yang memberikan manfaat untuk kesehatan apabila diberikan dalam jumlah yang cukup (Balcazar et al. 2008). Berdasarkan penelitian Rengpipat et al. (1998) dan Prabhu et al. (1999) probiotik mampu meningkatkan pertumbuhan udang dan memelihara kualitas air.
Parameter COD pada penelitian 1 menunjukkan bahwa tidak adanya penurunan bahan organik. Hal tersebut diduga karena pada pengukuran COD, bakteri yang masih hidup juga terukur sebagai bahan organik. Jumlah koloni bakteri selama penelitian 1 menunjukkan hubungan positif dengan COD, terkecuali pada perlakuan kontrol. Bahan organik dalam diubah oleh bakteri menjadi senyawa nitrogen seperti amonia, nitrit, dan nitrat. Perubahan bahan organik menjadi senyawa nitrogen berdampak pada rasio N:P di kolam. Pada produksi udang, rasio N:P sangat penting karena berpengaruh pada keberadaan plankton didalamnya. Menurut Levich & Bulgakov (1992) dalam Felisberto et al.
(2011) pada rasio N:P 20:1 dan 50:1 biomassa Chlorophyceae akan mencapai maksimal dan berpengaruh positif pada produksi udang, sedangkan pada rasio N:P 2-5:1 maka plankton yang tidak diinginkan seperti Chyanophyceae yang akan tumbuh. Selain itu tingginya akumulasi nitrogen dan fosfor mampu mendukung pertumbuhan pakan alami yang berguna untuk pertumbuhan udang (Thakur & Lin 2003).
Akumulasi nitrogen anorganik merupakan permasalahan utama dalam budidaya pola intensif (Colt & Armstrong 1981 dalam Avnimelech 1999). Salah satu metode paling efektif dalam mengontrol nitrogen anorganik adalah dengan penambahan sumber karbon. Penambahan sumber karbon merupakan cara yang efektif dan ekonomis daripada cara konvensional. Pada cara konvensional penanganan nitrogen anorganik adalah dengan penggantian air media. Cara ini kurang efektif karena menghasilkan limbah yang cukup tinggi dan berpotensi mencemari lingkungan.
Dari hasil penelitian penggunaan beberapa sumber karbon menunjukan bahwa Molase, Gula pasir, dan SN efektif menurunkan amonia bebas sebesar 70,6%, 85,6%, dan 64%. Sedangkan nitrit dapat diturunkan oleh Molase sebesar 44,3%, Gula pasir sebesar 45,1%, dan SN sebesar 42%. Rendahnya efektifitas penurunan tersebut diduga karena dosis yang digunakan kurang tepat. Avnimelech (1999) menyebutkan bahwa nitrogen anorganik dapat dihilangkan dengan mudah dengan penambahan sumber karbon apabila dilakukan pada dosis yang tepat. Penambahan karbohidrat sebanyak 20 g/m3 dengan kandungan karbon sebesar 50% mampu menurunkan total amonia nitrogen sebesar 1 mg/L (Avnimelech 1999).
24
berperan pada penurunan nitrogen anorganik karena menstimulasi pertumbuhan bakteri sebagai respon pada peningkatan C:N rasio, dimana amonia dan nitrit memiliki korelasi negatif dengan jumlah koloni bakteri. Hal tersebut menjelaskan bahwa bakteri menggunakan sumber karbon untuk memperbanyak selnya (Panjaitan 2010). Penambahan glukosa dapat meningkatkan jumlah bakteri heterotrof di air (Parsons et al 1981; Middleboe et al. 1995 dalam Panjaitan 2010). Berikut ini adalah penggunaan sumber karbon untuk pertumbuhan sel mikrobial (Avnimelech 1999): Corganik CO2 + energi + C yang terasimilasi pada sel
mirobial. Selain mengurangi nitrogen anorganik sumber karbon juga mampu memproduksi protein yang terkandung dalam bakteri dan dapat dimanfaatkan oleh ikan sebagai pengganti pakan. Sehingga FCR dapat ditekan dan mengurangi biaya pakan.
Budidaya udang dengan pola superintensif memiliki buangan limbah yang sangat tinggi. Limbah tambak budidaya udang apabila dibuang ke perairan umum akan menyebabkan eutrofikasi yang memicu blooming alga. Limbah budidaya memiliki karakteristik: partikel tersuspensi dan terlarut tinggi , bahan organik terlarut tinggi, mikroorganisme pathogen tinggi, BOD tinggi, oksigen terlarut rendah, dan hidrogen sulfida tinggi (Panjaitan 2010). Oleh karena itu, diperlukan sebuah pengolahan limbah agar limbah yang dibuang tidak mencemari lingkungan perairan.
25
4
KESIMPULAN DAN SARAN
Kesimpulan
1. Perlakuan Campuran (SN:SB 1:1) memberikan pengaruh terbaik dalam menjaga kualitas air tambak budidaya super intensif karena mampu menurunkan amonia bebas, nitrit, dan COD paling optimal dari ketiga perlakuan lain.
2. Penambahan gula pasir dan molase mampu mempercepat pertumbuhan bakteri serta menurunkan COD. Namun gula pasir dan molase belum efektif dalam mengontrol nitrogen anorganik.
3. Pada pengolahan limbah penggunaan bakteri anaerob mampu menurunkan bahan organik lebih cepat dari bakteri aerob. Namun, tren penurunan hampir sama maka limbah dapat didiamkan saja tanpa penambahan bakteri dalam jangka waktu lebih lama.
Saran
26
DAFTAR PUSTAKA
[APHA] American Public Health Association. 2005. Standard Method For The Examination Of Water And Waste Water: Water Pollution Control Federation. Port City (US): APHA.
[APHA] American Public Health Association. 2012. Standard Method For The Examination Of Water And Waste Water: Water Pollution Control Federation. Port City (US): APHA.
[BPPBAP] Balai Penelitian dan Pengembangan Budidaya Air Payau. 2014. Pengembangan Budidaya Udang Vaname Super Intensif di Tambak Kecil. Kementrian Kelautan dan Perikanan Maros:Sulawesi Selatan (ID):BPPBAP
[JIFSAN] Joint Institut for Food Safety and Applied Nutrition. 2007. Growout Pond and Water Quality Management.University of Maryland:JIFSAN [SNI] Standard Nasional Indonesia. 2006. Produksi udang vaname (Litopenaeus
vanamei) di tambak dengan teknologi intensif. SNI 01-7256-2006 Indonesia (ID): SNI
Atjo, H. 2013. Budidaya udang vaname supra-intensif Indonesia. Dipresentasikan pada Launching Budidaya Udang Vaname Superintensif Indonesia. Barru, 24 Oktober 2013. MAI-SCI Sulawesi Selatan.4 halaman.
Avnimelech Y. 1999. Carbon/nitrogen ratio as a control element in aquaculture systems. Aquaculture 176:227-235
Badjoeri M, Widiyanto T. 2008. Penggunaan bakteri nitrifikasi untuk bioremediasi dan pengaruhnya terhadap konsentrasi amonia dan nitrit di tambak udang. Oseanografi dan Limnologi di Indonesia 34(2):261-278 Balcazar J L, Venderell D, de Blas I, Zarzuela I R, Muzquiz J L, Girones O.
Chaacterization of probiotic properties of lactic acid bacteria isolated from intestinal microbiota of fish. Aquaculture 278: 188-191
Boopathy R. 2000. Factor limiting bioremediaton technologies. Bioresources Technology 74:63-67
Briggs M R, Funge-Smith S J. 1994. Nutrient budget of some intensive marine shrimp ponds in Thailand. Aquaculture Fisheries Management 25: 789-881
Browdy C L, Bratvold D, Hopkins J S, Stokes A D, Sandifer P A. 2001. Emerging technologies for mitigation of environmental impact associated with shrimp aquaculture pond effluents. Asian Fisheries Science. 14:255-265 Devaraja T, Banerjee S, Yusoff F, Shariff M, Khatoon H. 2013. A holistic
approach for selection of Bacillus spp. As a bioremediator for shrimp postlarvae culture. Turkish Journal of Biology 37: 92-100
Felisberto S A, Leandrini J A, Rodrigues L. 2011. Effects of nutrients enrichment on algal comunities: an experimental in mesocoms approach.Acta Limnologica Brasiliensia 23(2): 128-137
Foon N G C. 2004. Effectiveness of Bacillus spp. On Ammonia reduction and Improvement of Water Quality in Shrimp Hatchery. Malaysia [tesis]: Universiti Putra Malaysia
27 Komarawidjaja W. 2003. Pengaruh Aplikasi Konsorsium Mikroba Nitrifikasi terhadap Konsentrasi Amonia (NH3) pada Air Tambak. Jurnal Teknik Lingkungan. Vol.4(2): 62-67.
Martoharsono S.2006. Biokimia 2. Yogyakarta: Gadjah Mada University Press (ID)
Mattjik AA, Sumertajaya IM. 2006. Perancangan Percobaan dengan Aplikasi SAS dan Minitab Jilid I. Edisi kedua. Bogor(ID): IPB-Press
Metacalf, Eddy. 2003. Wastewater Engineering: Treatment, Disposal, and Reuse.
McGraw Hill Book Company: NewYork
Moriarty D J W. 1999. Disease control in shrimp aquaculture with probiotic bacteria. Microbial Interactions in Aquaculture
Moriarty, D.J.W., 1984. Role of bacteria and meiofauna in the productivity of prawn aquaculture ponds. Proceeding of the 1st International Conference on the Culture of Penaeid Prawns/Shrimps, Dec. 4-7, Aquaculture Department, California, pp: 47-64.
Nugroho A. 2006. Produksi Biosurfaktan oleh Bakteri Pengguna Hidrokarbon dengan Penambahan Variasi Sumber Karbon. Biodiversitas. Vol.7 (4): 312-316.
Panjaitan P. 2010. Shrimp culture of Penaeus monodon with zero water exchange model (ZWEM) using molasses. Journal of Coastal Development 14(1): 35-44
Pattukumar V, Sahu M K, Murugan M, Sethubathi G V, Sivakumar K, Arul V. 2010. Population of Vibrio parahaemolyticus (pathogen) and Bacillus
(beneficial bacteria) in Penaes monodon (Fabricus 1798) culture. Journal of Biological Sciences. 10(4):142-150
Prabhu S, Lobelle R, Levy L S. 1999. The FeLV-945 LTR confers a replicative advantage dependent on presence of tandem triplication. Virology
263:460-470
Putra S J W, Nitisupardjo M, Widyorini N. 2014. Analisis hubungan bahan organik dengan total bakteri pada tambak udang intensif sistem bioflok di BBPBAP Jepara. Diponegoro Journal of Maquares 3(3):121-129
Rengpipat S W, Phianphak S, Piyatiratitivorakul, Menasveta P. 1998. Effect of probiotics on Black Tiger Shrimp (Penaeus monodon) survival and growth.
Aquaculture 167:301-313
Retnosari A A, Shovitri M. 2013. Kemampuan isolat Bacillus sp. dalam mendegradasi limbah tangki septik. Jurnal Sains dan Semi Pomits 2(1): 2337-3520
Samocha T. 2009. Pasific white shrimp production in a superintensive raceway system. Application note from YSI Environmental
Sombatjinda S, Boonapatcharoen N, Ruengjitchatchawalya M, Wantawin C, Withyachumnamkul B, Techkamjanaruk S. 2011. Dynamic of microbial communities in an Eathern shrimp pnd during the shrimp growing period. Environment and Natural Resources Research 1(1): 171-180
Strickland J D H, Parsons T R. 1972. A Practical Handbook of Seawater Analysis. Ottawa: Fisheries Research Board of Canada
28
Thakur D P, Lin C K. 2003. Water quality and nutrient budget in closed shrimp (Penaeus monodon) culture systems. Aquaculture Engineering 27:159-176 Wasielesky Q Jr, Froes C, Foes G, Krummenauer D, Lara G, Poersch L. 2013. Nursery of Litopenaeus vanamei reared in a biofloc system: the effect of stocking densities and compensatory growth. Journal of Shellfish Research 32(3):799-806
29
LAMPIRAN
Lampiran 1 Komposisi pembuatan fermentasi molase
- Air tawar bersih : 400 ml
- Dedak/katul : 200 mg
- Molase : 200 mg
- Agromalac : 20 mg
- Ragi /yeast : 2 mg
- Bakteri (sesuai perlakuan) : 1 mL/L
- Diperam selama : 24 jam
Lampiran 2 Komposisi pembuatan fermentasi gula pasir
- Air tawar bersih : 400 ml
- Dedak/katul : 200 mg
- Gula pasir : 200 mg
- Agromalac : 20 mg
- Ragi /yeast : 2 mg
- Bakteri (sesuai perlakuan) : 1 mL/L
- Diperam selama : 24 jam
Lampiran 3 Prosedur aktivasi bakteri anaerob - Air limbah diambil sebanyak 1L
- Ditambahkan bakteri anaerob sebanyak 2 g - Dicairkan dengan sedikit air limbah
- Masukkan pada 1L air limbah dan tidak boleh terkena udara langsung - Diamkan selama 2 jam
- Aplikasi pada perlakuan, pada saat aplikasi tidak boleh ada kontak dengan udara
Lampiran 4 Prosedur aplikasi bakteri anaerob
- Bakteri sebanyak 2 g dicairkan pada 1 liter air limbah - Kemudian diaplikasikan tanpa ada kontak dengan udara
Lampiran 5 Hasil uji statistik pengaruh bakteri pada perubahan amonia bebas
R-Square Coeff Var Root MSE Respon Mean
0.897726 58.45787 0.107335 0.183611
Source DF Type I SS Mean Square F Value Pr > F
Perlakuan 3 0.20753889 0.06917963 6.00 0.0015
30
Perlakuan*Waktu 15 0.38926111 0.02595074 2.25 0.0171
Means with the same letter are not significantly different.
Duncan Grouping Mean N Interaksi
A 0.97000 3 KONTROL14
Means with the same letter are not significanly different
Lampiran 6 Hasil uji statistik pengaruh bakteri pada perubahan nitrit
R-Square Coeff Var Root MSE Respon Mean
0.929073 35.56408 0.090046 0.253194
Source DF Type I SS Mean Square F Value Pr > F
Perlakuan 3 0.08224861 0.02741620 3.38 0.0256
Waktu 5 4.87784028 0.97556806 120.32 <.0001
31 Lampiran 7 Hasil uji statistik pengaruh bakteri pada perubahan nitrat
R-Square Coeff Var Root MSE Respon Mean
0.912397 24.91108 0.261255 1.048750
Source DF Type I SS Mean Square F Value Pr > F
Perlakuan 3 0.24763750 0.08254583 1.21 0.3164
Waktu 5 31.36382917 6.27276583 91.90 <.0001
Perlakuan*Waktu 15 2.51072083 0.16738139 2.45 0.0095
Means with the same letter are not significantly different.
Duncan Grouping Mean N Interaksi
A 2.3000 3 SN42*
32
Lampiran 8 Hasil uji statistik pengaruh bakteri pada perubahan COD
R-Square Coeff Var Root MSE Respon Mean
0.837979 9.265508 9.100813 98.22250
Source DF Type I SS Mean Square F Value Pr > F Perlakuan 3 8143.252050 2714.417350 32.77 <.0001
Waktu 5 6514.192683 1302.838537 15.73 <.0001
Perlakuan*Waktu 15 5904.542550 393.636170 4.75 <.0001
Means with the same letter are not significantly different. Duncan Grouping Mean N Interaksi
A 126.090 3 KONTROL42*
33 Lampiran 9 Hasil uji statistik pengaruh bakteri terhadap total nitrogen pada
limbah
R-Square Coeff Var Root MSE Respon Mean
0.997781 5.737254 0.155013 2.701875
Source DF Type I SS Mean Square F Value Pr > F
Perlakuan 3 1.9096562 0.6365521 26.49 <.0001
Waktu 3 338.5759729 112.8586576 4696.74 <.0001
Perlakuan*Waktu 9 5.3339688 0.5926632 24.66 <.0001
Means with the same letter are not significantly different. Duncan Grouping Mean N Interaksi
A 6.5300 3 A0
Means with the same letter are not significanly different
Lampiran 10 Hasil uji statistik pengaruh bakteri terhadap total fosfat pada limbah
R-Square Coeff Var Root MSE Respon Mean
0.930965 11.34968 0.126194 1.111875
Source DF Type I SS Mean Square F Value Pr > F
Perlakuan 3 0.14465625 0.04821875 3.03 0.0437
Waktu 3 6.43070625 2.14356875 134.60 <.0001
34
Lampiran 11 Hasil uji statistik pengaruh bakteri terhadap COD pada limbah
R-Square Coeff Var Root MSE Respon Mean
0.955151 2.052031 2.048598 99.83271
Source DF Type I SS Mean Square F Value Pr > F
Perlakuan 3 150.800940 50.266980 11.98 <.0001
Waktu 3 2605.404023 868.468008 206.94 <.0001
Perlakuan*Waktu 9 103.902652 11.544739 2.75 0.0167
Means with the same letter are not significantly different.
Duncan Grouping Mean N Interaksi
A 110.500 3 A0
A 110.500 3 AL0
A 110.500 3 C0
A 110.500 3 K0
B 103.660 3 K3
B 103.230 3 AL3
C B 102.230 3 A3
C B 101.947 3 C3
C D 98.943 3 K6
E D 95.803 3 K9*
E D 95.800 3 AL6
E F 93.800 3 AL9*
G F 91.373 3 C6
G F 90.227 3 A6
G 89.510 3 C9*
G 88.800 3 A9*
K* AL* C* A*
95,08 93,8 89,51 88,8
DE EF G G
35
RIWAYAT HIDUP
Penulis dilahirkan di Klaten pada tanggal 29 Agustus 1992. Penulis merupakan putri pertama dari dua bersaudara dari pasangan Drs. Slamet Riyadi (alm) dan Sri Haryanti S.Pd. Pendidikan formal ditempuh di TK Kemala Bhayangkari 61 Pedan (1997), SD N 2 Majegan (1999), SMP N 1 Karanganom (2004), SMA N 1 Karanganom (2007), S1 Institut Pertanian Bogor di Departemen Manajemen Sumberdaya Perairan (2014) dan pada tahun 2014 Penulis diterima sebagai mahasiswa Pasca Sarjana (S2) Program Sinergi Fasttrack S1-S2 Sekolah Pascasarjana, Institut Pertanian Bogor pada program studi Pengelolaan Sumberdaya Perairan.