FUSI GEN KITINASE Aeromonas caviae WS7b DENGAN
PROMOTOR sigB DARI Bacillus subtilis 168 DAN
EKSPRESINYA PADA Escherichia coli
ADE SAPUTRA
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
ABSTRAK
ADE SAPUTRA. Fusi Gen Kitinase Aeromonas caviae WS7b dengan Promotor sigB dari Bacillus subtilis 168 dan Ekspresinya pada Escherichia coli . Dibimbing oleh GIYANTO.
Hama dan penyakit adalah salah satu masalah yang dihadapi oleh petani dalam sistem pertanian. Banyak metode pengendalian yang dilakukan oleh petani untuk mengurangi kehilangan hasil yang disebabkan oleh hama dan penyakit, salah satunya adalah penggunaan agens antagonis. Di alam, banyak organisme yang berpotensi menjadi agens antagonis bagi patogen tanaman. Organsime yang memiliki potensi tersebut dan digunakan dalam penelitian ini adalah Aeromonas caviae WS7b. Bakteri ini mampu mengendalikan beberapa cendawan patogen tanaman. Bakteri ini memiliki gen yang mampu menghasilkan enzim kitinase, yaitu gen chiA. Enzim ini mendegradasi dinding sel cendawan yang tersusun dari kitin. Tetapi bakteri ini tidak dapat langsung dilepas di alam sebagai agens antagonis karena bakteri ini bersifat patogen pada manusia. Sehingga perlu dilakukan rekayasa genetik terhadap gen chiA tersebut. Gen chiA ini akan digabung dengan promotor gen sigB yang terdapat pada Bacillus subtilis 168, gen
sigB ini akan terekspresi sebagai respon terhadap cekaman lingkungan secara umum. Sehingga gen chiA ini akan terekspresi saat bakteri berada dalam cekaman lingkungan. Tahap awal penelitian ini adalah ekstraksi DNA total dari Bacillus subtilis 168 dan Aeromonas caviae WS7b dengan metode yang berbeda untuk masing-masing bakteri. Kemudian dilakukan amplifikasi terhadap gen chiA dan promotor gen sigB menggunakan metode polymerase chain reaction (PCR). Fragmen promotor sigB dan chiA berhasil diamplifikasi dengan PCR. Tahap berikutnya adalah penyiapan plasmid pDL2 yang akan digunakan sebagai pembawa gen rekombinan. Plasmid pDL2 diperbanyak dengan cara mentransformasikannya ke dalam bakteri Escherichia coli DH5 . Kemudian bakteri E. coli tersebut diperbanyak pada media nutrient agar (NA) yang mengandung ampisilin dengan konsentrasi 50 µg/ml. E. coli DH5 yang telah tertransformasi oleh pDL2 dibiakan pada media ampisilin dengan konsentrasi yang sama dengan saat melakukan trasnformasi. Plasmid yang telah diperbanyak dalam sel bakteri E. coli DH5 , kemudian diekstraksi. Hasil amplifikasi fragmen promoter sigB dan chiA, dipotong menggunakan enzim restriksi. Promoter gen
sigB dipotong menggunakan enzim restriksi HpaI dan NheI, sedangkan gen chiA dipotong menggunakan NheI dan ApaI. Promotor gen sigB dan chiA digabungkan dengan enzim ligasi. Kedua fragmen tersebut telah berhasil digabungkan, sehingga menjadi gen rekombinan. Plasmid pDL2 yang telah dipurifikasi, dipotong menggunakan dua enzim restriksi, yaitu HpaI dan ApaI, sehingga membentuk ujung yang sama dengan gen rekombinan. Kemudian gen rekombinan yang telah dihasilkan sebelumnya, digabungkan dengan plasmid dan direkatkan dengan enzim ligasi. DNA rekombinan yang telah disambungkan dengan plasmid, berhasil ditransfomasikan ke dalam sel bakteri E. coli DH5 . Bakteri transforman ini menunjukkan aktivitas kitinase pada media kitin, karena di sekitar koloni bakteri transforman tersebut terbentuk zona bening. Hal ini menandakan bahwa gen kitinase A. caviae WS7b mampu terekspresi dengan baik di bawah promotor
FUSI GEN KITINASE Aeromonas caviae WS7b DENGAN
PROMOTOR sigB DARI Bacillus subtilis 168 DAN
EKSPRESINYA PADA Escherichia coli
ADE SAPUTRA
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian pada Fakultas Pertanian, Institut Pertanian Bogor
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
Judul Penelitian : Fusi Gen Kitinase Aeromonas caviae WS7b dengan Promotor sigB dari Bacillus subtilis 168 dan Ekspresinya pada Escherichia coli
Nama Mahasiswa : Ade Saputra
NRP : A34053156
Disetujui
Pembimbing
Dr. Ir. Giyanto, MSi.
NIP: 19670709 199303 1 002
Diketahui
Ketua Departemen Proteksi Tanaman
Dr. Ir. Dadang, MSc.
NIP: 19640204 199002 1 002
RIWAYAT HIDUP
Penulis dilahirkan di Bandung pada tanggal 6 Oktober 1987 sebagai anak pertama dari dua bersaudara dari pasangan Reddy Susanto dan Nunik Kustianti. Penulis menyelesaikan sekolah di SMUN 6 Surabaya pada tahun 2005 dan diterima di IPB melalui jalur UMPTN pada tahun yang sama. Pada tahun kedua masuk ke Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor.
PRAKATA
Puji syukur penulis panjatkan kehadirat Allah SWT karena dengan rahmat dan karunia-Nya, penelitian yang berjudul “ Fusi Gen Kitinase Aeromonas caviae
WS7b dengan Promotor sigB dari Bacillus subtilis 168 dan Ekspresinya pada
Escherichia coli” dapat diselesaikan oleh penulis. Pada kesempatan ini penulis ingin mengucapkan terima kasih kepada kedua orang tua dan adikku tercinta (Reddy Susanto H, Nunik Kustianti dan Evi Yulianti), Dr. Giyanto, Dr. Kikin H Mutaqin, Dr. Tri Asmira Damayanti, Dr Dadan Hindayana, dan rekan-rekan Laboratorium Bakteriologi (Mbak Didi, Mbak Saksak, Mas Eko, Mbak Sulis, Mbak Nisa, Mbak Methy, Mbak Reni, Mbak Anggie, Mbak Ika, Mas Hakim, dan Mas Yoyo) serta teman-teman DPT’42 yang telah memberikan dukungan dan bantuan selama penelitian.
Bogor, November 2009
DAFTAR ISI
Uji potensi antagonisme A. caviae WS7b dan B. subtilis 168 terhadap cendawan patogen ... 8
Preparasi DNA kromosom dan plasmid pDL2 Ekstraksi DNA kromosom A. caviae WS7b ... 9
Ekstraksi DNA Bacillus subtilis 168 ... 9
Amplifikasi Gen chiA dan promotor sigB Amplifikasi promotor sigB dengan PCR ... 10
Amplifikasi promotor sigB dengan PCR ... 11
Purifikasi fragmen chiA dan promotor sigB ... 11
Penyambungan fragmen promotor sigB dan chiA Pemotongan fragmen promotor sigB dan chiA ... 12
Ligasi fragmen promotor sigB dan chiA ... 13
Penyisipan fragmen sigB-chiA pada plasmid pDL2 Pemotongan dan purifikasi plasmid pDL2 ... 14
Ligasi fragmen sigB-chiA dengan pDL2 ... 15
Transformasi plasmid rekombinan pada E. coli DH5 Penyiapan E. coli DH5 kompeten ... 15
Transformasi plasmid rekombinan ke dalam E. coli DH5 ... 15
Pengujian aktivitas kitinase transforman E. coli DH5 ... 16
HASIL DAN PEMBAHASAN Uji aktivitas kitinase A. caviae WS7b dan B. subtilis 168 ... 17
Uji potensi antagonisme A. caviae WS7b dan B. subtilis 168 terhadap cendawan ... 17
Ekstraksi DNA A. caviae WS7b dan B. subtilis 168 ... 19
Amplifikasi promotor sigB dengan PCR ... 20
Amplifikasi fragmen chiA dengan PCR ... 22
Penyisipan fragmen sigB-chiA pada plasmid pDL2 ... 25 Transformasi plasmid rekombinan ke dalam E. coli DH5 ... 26 Pengujian aktivitas kitinase transforman E. coli DH5 ... 27 KESIMPULAN DAN SARAN
Kesimpulan ... 28 Saran ... 28
DAFTAR GAMBAR
Halaman
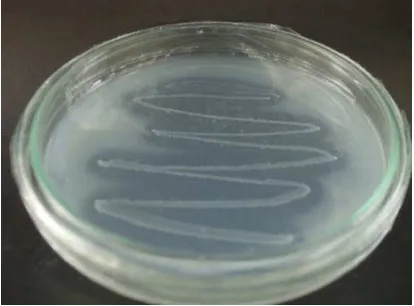
Gambar 1 Aktivitas enzim kitinase A. caviae WS7b pada media kitin ... 6
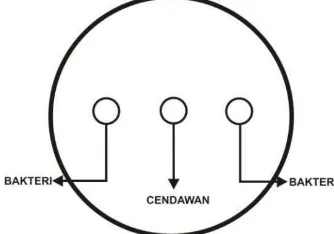
Gambar 2 Skema uji dual culture antara bakteri dan cendawan uji ... 9
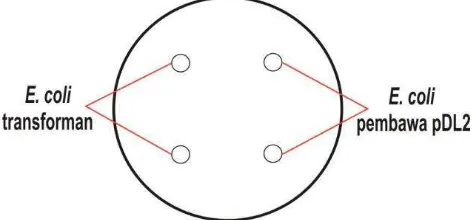
Gambar 3 Uji aktivitas kitinase E. coli transforman dan E. coli pembawa pDL2 pada media kitin ... 16
Gambar 4 Aktivitas kitinase A. caviae WS7b pada media agar kitin ... 17
Gambar 5 Uji dual culture Pythium sp dengan B. subtilis 168 dan A.caviae WS7b ... 18
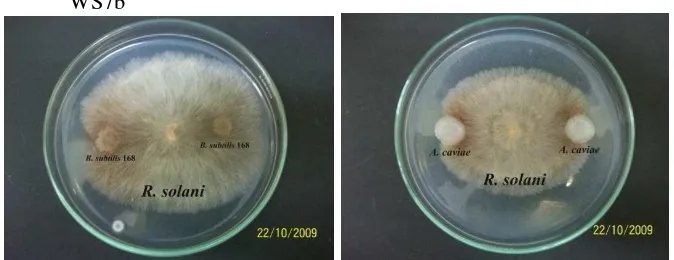
Gambar 6 Uji dual culture R. solani dengan B. subtilis 168 dan A.caviae WS7b ... 18
Gambar 7 Uji dual culture F. oxysporum dengan B. subtilis 168 dan A.caviae WS7b ... 19
Gambar 8 Hasil ekstraksi DNA total A. caviae WS7b dan B. subtilis 168 .. 20
Gambar 9 Hasil amplifikasi fragmen promotor sigB ... 21
Gambar 10 Sekuen nukleotida promotor sigB ... 22
Gambar 11 Hasil amplifikasi fragmen gen chiA ... 23
Gambar 12 Sekuen nukleotida fragmen gen chiA dengan ukuran 2,9 kb ... 24
Gambar 13 Situs restriksi pada fragmen promotor sigB ... 24
Gambar 14 Situs restriksi pada fragmen promotor chiA ... 25
Gambar 15 Hasil penggabungan fragmen sigB-chiA ... 25
Gambar 16 Hasil pemotongan plasmid pDL2 ... 25
Gambar 17 Skema hasil penggabungan fragmen sigB-chiA dengan pDL2 .. 25
Gambar 18 Skema letak fragmen DNA rekombinan pada plasmid pDL2 .... 26
Gambar 19 Hasil transformasi plasmid pDL2 ke dalam bakteri E. coli DH5 (a) Kontrol (b) pDL2 pembawa DNA rekombinan ... 26
Gambar 20 Aktivitas kitinase E. coli DH5 transforman pada media kitin .. 27
PENDAHULUAN
Latar Belakang
Hama dan penyakit merupakan salah satu masalah utama dalam sistem
pertanian. Teknik pengendalian yang digunakan oleh petani untuk mengatasi
masalah ini, antara lain dengan pestisida, kultur teknis, mekanis, dan
menggunakan musuh alami. Namun, pengendalian terhadap hama dan penyakit
yang paling sering dilakukan oleh petani adalah pengendalian secara kimiawi.
Penggunaan pestisida secara tidak bijaksana akan dapat menimbulkan masalah di
lingkungan. Menurut Delph (1994), fungisida yang telah dipergunakan oleh
masyarakat Jepang selama bertahun-tahun dan pada tahun 1971 terjadi resistensi
pada fungisida berbahan aktif kasugamicin dan diikuti oleh beberapa jenis
fungisida lainnya, seperti benzimidazole, dicarboximid, organofos, oksicarboksin,
sterptomicin, dan lain-lain. Penggunaan agens hayati di lapangan merupakan salah
satu alternatif pengendalian terhadap hama dan penyakit tanaman. Penggunaan
agens hayati di lapangan memiliki beberapa keuntungan, antara lain
meningkatkan produktivitas tanaman dengan sumberdaya yang ada, mencegah
terjadinya resistensi pathogen terhadap bahan kimia, aman bagi lingkungan, sesuai
dengan konsep pertanian berkelanjutan (Cook & Baker 1996). Menurut Soglio et al.. (1998), Trichoderma harzianum Th008 mampu menghambat pertumbuhan cendawan Rhizoctonia solani pada perakaran kedelai. Selain menjadi agens pengendali hayati, juga ada yang mikroorganisme yang menjadi pemicu
pertumbuhan tanaman, sehingga lebih tahan terhadap serangan penyakit, seperti
Bacillus subtilis, dan Pseudomonas fluorescens (Siddiqui 2006). Pada kondisi lapang di Thailand, plant growth promoting rhizobacteria (PGPR) yang terdiri atas campuran B. amyloliquefaciens strain IN973a dan B. pumilus strain IN973a, dapat menginduksi ketahanan sistemik pada tanaman terhadap penyakit hawar
daun yang disebabkan oleh Sclerotium rolfsii, antraknosa pada cabai yang disebabkan oleh Colletotrichum gloeosporioides, dan mosaik pada mentimun yang disebabkan oleh CMV (Siddiqui 2006).
FUSI GEN KITINASE Aeromonas caviae WS7b DENGAN
PROMOTOR sigB DARI Bacillus subtilis 168 DAN
EKSPRESINYA PADA Escherichia coli
ADE SAPUTRA
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
ABSTRAK
ADE SAPUTRA. Fusi Gen Kitinase Aeromonas caviae WS7b dengan Promotor sigB dari Bacillus subtilis 168 dan Ekspresinya pada Escherichia coli . Dibimbing oleh GIYANTO.
Hama dan penyakit adalah salah satu masalah yang dihadapi oleh petani dalam sistem pertanian. Banyak metode pengendalian yang dilakukan oleh petani untuk mengurangi kehilangan hasil yang disebabkan oleh hama dan penyakit, salah satunya adalah penggunaan agens antagonis. Di alam, banyak organisme yang berpotensi menjadi agens antagonis bagi patogen tanaman. Organsime yang memiliki potensi tersebut dan digunakan dalam penelitian ini adalah Aeromonas caviae WS7b. Bakteri ini mampu mengendalikan beberapa cendawan patogen tanaman. Bakteri ini memiliki gen yang mampu menghasilkan enzim kitinase, yaitu gen chiA. Enzim ini mendegradasi dinding sel cendawan yang tersusun dari kitin. Tetapi bakteri ini tidak dapat langsung dilepas di alam sebagai agens antagonis karena bakteri ini bersifat patogen pada manusia. Sehingga perlu dilakukan rekayasa genetik terhadap gen chiA tersebut. Gen chiA ini akan digabung dengan promotor gen sigB yang terdapat pada Bacillus subtilis 168, gen
sigB ini akan terekspresi sebagai respon terhadap cekaman lingkungan secara umum. Sehingga gen chiA ini akan terekspresi saat bakteri berada dalam cekaman lingkungan. Tahap awal penelitian ini adalah ekstraksi DNA total dari Bacillus subtilis 168 dan Aeromonas caviae WS7b dengan metode yang berbeda untuk masing-masing bakteri. Kemudian dilakukan amplifikasi terhadap gen chiA dan promotor gen sigB menggunakan metode polymerase chain reaction (PCR). Fragmen promotor sigB dan chiA berhasil diamplifikasi dengan PCR. Tahap berikutnya adalah penyiapan plasmid pDL2 yang akan digunakan sebagai pembawa gen rekombinan. Plasmid pDL2 diperbanyak dengan cara mentransformasikannya ke dalam bakteri Escherichia coli DH5 . Kemudian bakteri E. coli tersebut diperbanyak pada media nutrient agar (NA) yang mengandung ampisilin dengan konsentrasi 50 µg/ml. E. coli DH5 yang telah tertransformasi oleh pDL2 dibiakan pada media ampisilin dengan konsentrasi yang sama dengan saat melakukan trasnformasi. Plasmid yang telah diperbanyak dalam sel bakteri E. coli DH5 , kemudian diekstraksi. Hasil amplifikasi fragmen promoter sigB dan chiA, dipotong menggunakan enzim restriksi. Promoter gen
sigB dipotong menggunakan enzim restriksi HpaI dan NheI, sedangkan gen chiA dipotong menggunakan NheI dan ApaI. Promotor gen sigB dan chiA digabungkan dengan enzim ligasi. Kedua fragmen tersebut telah berhasil digabungkan, sehingga menjadi gen rekombinan. Plasmid pDL2 yang telah dipurifikasi, dipotong menggunakan dua enzim restriksi, yaitu HpaI dan ApaI, sehingga membentuk ujung yang sama dengan gen rekombinan. Kemudian gen rekombinan yang telah dihasilkan sebelumnya, digabungkan dengan plasmid dan direkatkan dengan enzim ligasi. DNA rekombinan yang telah disambungkan dengan plasmid, berhasil ditransfomasikan ke dalam sel bakteri E. coli DH5 . Bakteri transforman ini menunjukkan aktivitas kitinase pada media kitin, karena di sekitar koloni bakteri transforman tersebut terbentuk zona bening. Hal ini menandakan bahwa gen kitinase A. caviae WS7b mampu terekspresi dengan baik di bawah promotor
FUSI GEN KITINASE Aeromonas caviae WS7b DENGAN
PROMOTOR sigB DARI Bacillus subtilis 168 DAN
EKSPRESINYA PADA Escherichia coli
ADE SAPUTRA
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian pada Fakultas Pertanian, Institut Pertanian Bogor
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
Judul Penelitian : Fusi Gen Kitinase Aeromonas caviae WS7b dengan Promotor sigB dari Bacillus subtilis 168 dan Ekspresinya pada Escherichia coli
Nama Mahasiswa : Ade Saputra
NRP : A34053156
Disetujui
Pembimbing
Dr. Ir. Giyanto, MSi.
NIP: 19670709 199303 1 002
Diketahui
Ketua Departemen Proteksi Tanaman
Dr. Ir. Dadang, MSc.
NIP: 19640204 199002 1 002
RIWAYAT HIDUP
Penulis dilahirkan di Bandung pada tanggal 6 Oktober 1987 sebagai anak pertama dari dua bersaudara dari pasangan Reddy Susanto dan Nunik Kustianti. Penulis menyelesaikan sekolah di SMUN 6 Surabaya pada tahun 2005 dan diterima di IPB melalui jalur UMPTN pada tahun yang sama. Pada tahun kedua masuk ke Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor.
PRAKATA
Puji syukur penulis panjatkan kehadirat Allah SWT karena dengan rahmat dan karunia-Nya, penelitian yang berjudul “ Fusi Gen Kitinase Aeromonas caviae
WS7b dengan Promotor sigB dari Bacillus subtilis 168 dan Ekspresinya pada
Escherichia coli” dapat diselesaikan oleh penulis. Pada kesempatan ini penulis ingin mengucapkan terima kasih kepada kedua orang tua dan adikku tercinta (Reddy Susanto H, Nunik Kustianti dan Evi Yulianti), Dr. Giyanto, Dr. Kikin H Mutaqin, Dr. Tri Asmira Damayanti, Dr Dadan Hindayana, dan rekan-rekan Laboratorium Bakteriologi (Mbak Didi, Mbak Saksak, Mas Eko, Mbak Sulis, Mbak Nisa, Mbak Methy, Mbak Reni, Mbak Anggie, Mbak Ika, Mas Hakim, dan Mas Yoyo) serta teman-teman DPT’42 yang telah memberikan dukungan dan bantuan selama penelitian.
Bogor, November 2009
DAFTAR ISI
Uji potensi antagonisme A. caviae WS7b dan B. subtilis 168 terhadap cendawan patogen ... 8
Preparasi DNA kromosom dan plasmid pDL2 Ekstraksi DNA kromosom A. caviae WS7b ... 9
Ekstraksi DNA Bacillus subtilis 168 ... 9
Amplifikasi Gen chiA dan promotor sigB Amplifikasi promotor sigB dengan PCR ... 10
Amplifikasi promotor sigB dengan PCR ... 11
Purifikasi fragmen chiA dan promotor sigB ... 11
Penyambungan fragmen promotor sigB dan chiA Pemotongan fragmen promotor sigB dan chiA ... 12
Ligasi fragmen promotor sigB dan chiA ... 13
Penyisipan fragmen sigB-chiA pada plasmid pDL2 Pemotongan dan purifikasi plasmid pDL2 ... 14
Ligasi fragmen sigB-chiA dengan pDL2 ... 15
Transformasi plasmid rekombinan pada E. coli DH5 Penyiapan E. coli DH5 kompeten ... 15
Transformasi plasmid rekombinan ke dalam E. coli DH5 ... 15
Pengujian aktivitas kitinase transforman E. coli DH5 ... 16
HASIL DAN PEMBAHASAN Uji aktivitas kitinase A. caviae WS7b dan B. subtilis 168 ... 17
Uji potensi antagonisme A. caviae WS7b dan B. subtilis 168 terhadap cendawan ... 17
Ekstraksi DNA A. caviae WS7b dan B. subtilis 168 ... 19
Amplifikasi promotor sigB dengan PCR ... 20
Amplifikasi fragmen chiA dengan PCR ... 22
Penyisipan fragmen sigB-chiA pada plasmid pDL2 ... 25 Transformasi plasmid rekombinan ke dalam E. coli DH5 ... 26 Pengujian aktivitas kitinase transforman E. coli DH5 ... 27 KESIMPULAN DAN SARAN
Kesimpulan ... 28 Saran ... 28
DAFTAR GAMBAR
Halaman
Gambar 1 Aktivitas enzim kitinase A. caviae WS7b pada media kitin ... 6
Gambar 2 Skema uji dual culture antara bakteri dan cendawan uji ... 9
Gambar 3 Uji aktivitas kitinase E. coli transforman dan E. coli pembawa pDL2 pada media kitin ... 16
Gambar 4 Aktivitas kitinase A. caviae WS7b pada media agar kitin ... 17
Gambar 5 Uji dual culture Pythium sp dengan B. subtilis 168 dan A.caviae WS7b ... 18
Gambar 6 Uji dual culture R. solani dengan B. subtilis 168 dan A.caviae WS7b ... 18
Gambar 7 Uji dual culture F. oxysporum dengan B. subtilis 168 dan A.caviae WS7b ... 19
Gambar 8 Hasil ekstraksi DNA total A. caviae WS7b dan B. subtilis 168 .. 20
Gambar 9 Hasil amplifikasi fragmen promotor sigB ... 21
Gambar 10 Sekuen nukleotida promotor sigB ... 22
Gambar 11 Hasil amplifikasi fragmen gen chiA ... 23
Gambar 12 Sekuen nukleotida fragmen gen chiA dengan ukuran 2,9 kb ... 24
Gambar 13 Situs restriksi pada fragmen promotor sigB ... 24
Gambar 14 Situs restriksi pada fragmen promotor chiA ... 25
Gambar 15 Hasil penggabungan fragmen sigB-chiA ... 25
Gambar 16 Hasil pemotongan plasmid pDL2 ... 25
Gambar 17 Skema hasil penggabungan fragmen sigB-chiA dengan pDL2 .. 25
Gambar 18 Skema letak fragmen DNA rekombinan pada plasmid pDL2 .... 26
Gambar 19 Hasil transformasi plasmid pDL2 ke dalam bakteri E. coli DH5 (a) Kontrol (b) pDL2 pembawa DNA rekombinan ... 26
Gambar 20 Aktivitas kitinase E. coli DH5 transforman pada media kitin .. 27
PENDAHULUAN
Latar Belakang
Hama dan penyakit merupakan salah satu masalah utama dalam sistem
pertanian. Teknik pengendalian yang digunakan oleh petani untuk mengatasi
masalah ini, antara lain dengan pestisida, kultur teknis, mekanis, dan
menggunakan musuh alami. Namun, pengendalian terhadap hama dan penyakit
yang paling sering dilakukan oleh petani adalah pengendalian secara kimiawi.
Penggunaan pestisida secara tidak bijaksana akan dapat menimbulkan masalah di
lingkungan. Menurut Delph (1994), fungisida yang telah dipergunakan oleh
masyarakat Jepang selama bertahun-tahun dan pada tahun 1971 terjadi resistensi
pada fungisida berbahan aktif kasugamicin dan diikuti oleh beberapa jenis
fungisida lainnya, seperti benzimidazole, dicarboximid, organofos, oksicarboksin,
sterptomicin, dan lain-lain. Penggunaan agens hayati di lapangan merupakan salah
satu alternatif pengendalian terhadap hama dan penyakit tanaman. Penggunaan
agens hayati di lapangan memiliki beberapa keuntungan, antara lain
meningkatkan produktivitas tanaman dengan sumberdaya yang ada, mencegah
terjadinya resistensi pathogen terhadap bahan kimia, aman bagi lingkungan, sesuai
dengan konsep pertanian berkelanjutan (Cook & Baker 1996). Menurut Soglio et al.. (1998), Trichoderma harzianum Th008 mampu menghambat pertumbuhan cendawan Rhizoctonia solani pada perakaran kedelai. Selain menjadi agens pengendali hayati, juga ada yang mikroorganisme yang menjadi pemicu
pertumbuhan tanaman, sehingga lebih tahan terhadap serangan penyakit, seperti
Bacillus subtilis, dan Pseudomonas fluorescens (Siddiqui 2006). Pada kondisi lapang di Thailand, plant growth promoting rhizobacteria (PGPR) yang terdiri atas campuran B. amyloliquefaciens strain IN973a dan B. pumilus strain IN973a, dapat menginduksi ketahanan sistemik pada tanaman terhadap penyakit hawar
daun yang disebabkan oleh Sclerotium rolfsii, antraknosa pada cabai yang disebabkan oleh Colletotrichum gloeosporioides, dan mosaik pada mentimun yang disebabkan oleh CMV (Siddiqui 2006).
2
karena adanya aktifitas enzim kitinase di daerah perakaran yang dikoloni oleh
Trichoderma harzianum Th008. Aeromonas caviae menunjukkan aktivitas enzim kitinase yang tinggi pada saat ditumbuhkan pada media kitin. Enzim kitinase yang
dihasilkan oleh A. caviae mampu menghambat pertumbuhan cendawan patogen (Inbar & Chet,1991). Menurut Armini (2005), gen kitinase dari A. caviae WS7b yang dikloning pada tanaman kentang mampu menghambat pertumbuhan miselia
cendawan Fusarium oxysporum f.sp lycopersici dan tidak mempengaruhi ukuran umbi. Tetapi untuk dilepas di lapang sebagai agens hayati, A. caviae sangat berbahaya karena dapat menyebabkan diare akut pada anak-anak (Janda 1991)
dan dewasa (Joseph 1996). Sehingga perlu dilakukan rekayasa genetik untuk
memodifikasi gen penghasil kitinase yang ada pada A. caviae WS7B ini dan memindahkannya ke bakteri lain yang aman untuk dilepas ke lapang. Bakteri yang
dipilih sebagai inang DNA rekombinan ini adalah Bacillus subtilis, karenabakteri ini terbukti aman bagi lingkungan dan diketahui sebagai salah satu bakteri plant growth promoting rhizobacteria (PGPR).
Bacillus subtilis memiliki kemampuan merespons cekaman lingkungan secara umum. Gen yang menyandikan kemampuan tersebut adalah gen sigB. Saat akan terjadi ekspresi suatu gen, ada dua proses yang harus dilalui yaitu transkripsi
dan translasi. Dalam proses transkripsi, daerah promotor dari suatu gen akan
selalu dikenali oleh RNA polimerase, demikian halnya dengan gen sigB. RNA polimerase akan mengenali promotor sigB saat akan terjadi proses transkripsi. Promotor gen ini memiliki potensi untuk meningkatkan frekuensi ekspresi dari
gen yang disambungkan dengannya saat terjadi cekaman. Gen yang akan
digabung dengan promotor tersebut dalam adalah gen chiA yang terdapat pada A. caviae WS7b. Gen ini pada A. caviae telah diketahui potensinya sebagai pengasil enzim kitinase (Sitrit et al. 1995).
Tujuan Penelitian
Penelitian ini bertujuan mendapatkan fusi gen kitinase Aeromonas caviae
WS7b dengan promotor sigB dari Bacillus subtilis 168 dan ekspresinya pada
3
TINJAUAN PUSTAKA
Bacillus subtilis Sebagai Agens Hayati
Louis Pasteur pertama kali menggunakan Bacillus anthracis (Genus
Bacillus) sebagai vaksin antibakteri. Pada pertengahan abad ke-20, Bacillus telah diketahui secara keseluruhan peranannya dalam menginfeksi manusia, hewan, dan
serangga, serta diketahui bahwa bakteri ini menghasilkan antibiotik, protease, dan
produk berguna lainnya. Kemampuan Bacillus spp membentukan spora,
diketahui sebagai suatu fenomena biologi yang menarik dan menjadi salah satu
faktor dalam patogenesis. Penggunan B. subtilis sebagai percobaan untuk mempelajari regulasi gen, metabolisme, dan perbedaan bisa menjadi cara untuk
mempelajari bakteri ini. (Sonenshein 2002).
Menurut Hornby (1990), B. subtilis mampu menghasilkan antibiotik iturin A. Grup Bacillus mampu menghasilkan jenis antibiotik iturin yang lain, seperti
mycosubtilin, bacillomycin, fengymycin, mycobacillin, dan mycocerein yang
telah terbukti sangat efektif menghambat pertumbuhan cendawan, sehingga
mampu dilepas ke lapang sebagai agens hayati cendawan patogen. Bacillus subtilis starin 168 juga bermanfaat dalam bidang bioteknologi, yaitu sebagai inang kloning gen karena memiliki karakteristik, antara lain mampu tumbuh pada
media murah, non-patogenik, mampu menangkap molekul DNA, stabil dan
kultur, mempunyai informasi genetik yang lengkap, mempunyai genotipe spesifik
untuk efektifitas hasil kloning (Madigan et al. 1997).
Saat ini, Informasi genetik pada B. subtilis 168 telah diketahui secara lengkap. Terdapat 4.107 gen yang diduga ada dalam genom B. subtilis, sekitar 1.500 gen memiliki fungsi yang spesifik, dan 1.000 gen lainnya dapat
diklasifikasikan sebagai gen yang belum diketahui fungsi spesifiknya. Salah satu
gen yang bekerja berdasarkan respons lingkungan dan telah diketahui fungsinya
adalah sigB ( B). Gen sigB adalah gen yang respons terhadap berbagai jenis cekaman lingkungan, antara lain cekaman oxidatif (Mostertz & Hecker 2003),
4
(Price 2002). Sintesis protein dari gen ini bisa terjadi untuk melindungi sel bakteri
dari cekaman lingkungan. Respons ini menjadikan bakteri dapat bertahan pada
lingkungan alaminya, seperti pada saat sumber yang tersedia tidak mencukupi dan
interaksi antara bakteri tersebut dengan beberapa patogen. Respons terhadap
cekaman lingkungan ini diduga disandikan oleh lebih dari 200 gen yang secara
langsung atau tidak langsung dikendalikan sigB. Dalam beberapa kasus, operon yang dikendalikan sigB memiliki promotor yang kompleks dan bisa diaktivasi oleh faktor sigma yang lain (Helmann 2002). Dalam proses transkripsi ada
beberapa hal yang terjadi, antara lain mengenali promotor, inisiasi, elongasi dan
terminasi. Jadi pengenalan terhadap promotor adalah hal yang sangat penting
dalam melakukan transkripsi secara normal. Promotor adalah bagian dari segmen
DNA yang dikenali oleh RNA polimerase (Price 2002).
Aeromonas caviae
Aeromonas caviae adalah bakteri gram negatif, tidak membentuk spora, berbentuk batang, bakteri yang bersifat anaerob fakultatif yang hidup di perairan,
bakteri ini masuk ke dalam famili Aeromonadaceae. Bakteri jenis ini memiliki
kemiripan karakteristik biokimia dengan anggota dari Enterobacteriaceae, yang
membedakan hanya sifatnya yang oxidase positif (Popoff 1984). Aeromonas spp. menghasilkan berbagai jenis enzim hidrolisis seperti arilamidase, amilase,
deoksiribonuklease, esterase, peptidase, elastase, kitinase, dan lipase (Carnahan et al. 1988). A. caviae menunjukkan aktivitas kitinase yang tinggi pada saat ditumbuhkan pada media kitin. Pada kondisi rumah kaca, A. caviae mampu mengurangi perkembangan Rhizoctonia solani sebesar 78% dan Fusarium oxysporum f.sp. vasinfectum sebesar 57% pada tanaman kapas, sedangkan pada tanaman kacang buncis mampu mengurangi perkembangan Sclerotium rolfsii sebesar 60% (Inbar & Chet 1991). Menurut Soglio et al. (1998), pada
Trichoderma harzianum Th008, enzim ini bisa menghambat pertumbuhan
5
kitinase yang dihasilkan oleh A. caviae dapat menjadi masukkan penting untuk pengembangan biokontrol atau untuk merakit tanaman transgenik dengan ekspresi
kiitinase asal bakteri. Selama ini gen kitinase yang dipakai umumnya berasal daria
Serratia marcescens, yang hanya memiliki kemiripan 73% sekuen asam amino turunan dengan produk kitinase dari gen chiA pada A. caviae WS7B.
Bakteri A. caviae yang akan digunakan dalam penelitian ini adalah A. caviae
WS7B. Menurut Wenuganen (1996), isolat bakteri tanah ini diperoleh dari Pulau
Bangka, Propinsi Sumatera Selatan, yang diisolasi dari areal pertanian yang
mengandung relatif sedikit nematoda patogen tumbuhan. Setelah dilakukan
pengujian menggunakan media kitin, bakteri ini menunjukkan aktivitas kitinase
yang tinggi (Gambar 1). Gen kitinase ini dikloning oleh Wenuganen (1996) pada
vektor plasmid pUC19 dan diberi nama pWS506. Gen kitinase tersebut dapat
diekspresikan dengan baik E. coli DH5 di bawah promotor gen penyandi enzim -galaktosidase (lacZ). Menurut Price (2002), mekanisme general strees respon
yang disandikan oleh gen sigB pada B. subtilis, berawal dari studi yang telah dipelajari pada E. coli. Pada B. subtilis banyak penanda genetik yang sama dengan
E. coli (Slepecky & Hemphill 1992). Pada E. coli juga terdapat mekanisme global stress respon, tetapi disandikan oleh gen barA yang memiliki kemiripan gen hingga 94% dengan gen yang sejenis pada bakteri lain (Nagasawa et al. 1992). Sehingga ada kemungkinan untuk mengkonstruksi gen chiA di bawah promotor
sigB dengan vektor kloning E. coli DH5 dan gen hasil konstruksi ini akan terekspresi,
6
Teknologi DNA Rekombinan
Teknologi DNA rekombinan disebut juga kloning gen atau molekuler
kloning, adalah memindahkan informasi genetik (DNA) dari suatu organism ke
organism lainnya. Eksperimen DNA rekombinan secara umum meliputi, (i)
pengekstraksian DNA dari organism donor, baik untuk DNA klon, DNA sisipan,
DNA target, maupun DNA asing, atau hasil pemotongan secara enzimatis, dan
penyambungan ke DNA vector untuk membentuk molekul DNA rekombinasi
baru, (ii) transfer hasil konstruksi vektor kloning-DNA sisipan ke dalam suatu sel
inang, dan pemeliharaan di dalam sel tersebut (transformasi) dan (iii) identifikasi
sel-sel inang yang menangkap dan membawa konstruksi DNA (transformans), dan
seleksinya (iv) konstruksi DNA mampu menghasilkan protein yang diinginkan
pada sel inang (Glick & Pasternak 2003).
Enzim Kitinase
Kitinase adalah enzim yang memiliki kemampuan mendegradasi kitin
(Gambar 1), yaitu polisakarida yang dibangun oleh satuan N-asetilglukosamin
dengan ikatan (1-4) merupakan biopolimer yang paling melimpah di alam
karena merupakan komponen structural dinding sel cendawan kecuali oomycetes,
kerangka luar artropoda, kerangka luar molusca, cangkang luar crustacean dan
nematoda (Cabib 1987 dalam Malik 2000).
Kitinase bakteri adalah kitinase yang dihasilkan oleh bakteri, mempunyai
mekanisme aktivitas anti cendawan yang berbeda dari kitinase tanaman. Kitinase
bakteri berperan penting dalam menjaga keseimbangan ekologis dengan
mendegradasi dan merubah kitin menjadi bentuk biologis yang bermanfaat,
disamping memanfaatkan kitin sebagai sumber nutrisi (Roberts & Selitrennikoff
1988).
Menurut Gan et al. (2007), hasil kloning gen penghasil enzim kitinase (Lpchi1) yang dihasilkan oleh Lecanicilium psalliotae (syn. Verticillium psalliotae) mampu mendegradasi cangkang telur Meloidogyne incognita. Telur nematoda yang diberi perlakukan enzim kitinase hasil purifikasi tidak menetas
7
antara kitinase dan protease terhambat penetasannya hingga 56,5%. Menurut
Downing et al. (2000), kointroduksi gen cry1Ac7 dan kitinase pada P. fluorescens
mampu meningkatkan kemampuan biokontrol terhadap serangga hama, dengan
konsentrasi Cry1Ac7 yang lebih rendah. Hal ini merupakan suatu keuntungan
karena dapat mengurangi resistensi serangga hama terhadap protein Cry1.
Enzim kitinase (ChiA dan ChiB) yang dihasilkan Serratia marcescens dan telah ditransformasikan ke dalam sel bakteri P. fluorescens atau E. coli menjadi agens biokontrol baru yang mampu menghambat pertumbuhan cendawan patogen
8
BAHAN DAN METODE
Tempat dan WaktuPenelitian dilakukan di Laboratorium Bakteriologi, Departemen Proteksi
Tanaman, Fakultas Pertanian, Institut Pertanian Bogor. Penelitian dilaksanakan
pada bulan Februari 2009 sampai Oktober 2009.
Uji Aktivitas Kitinase Aeromonas Caviae WS7b dan Bacillus subtilis 168 Bakteri yang diuji adalah Aeromonas caviae WS7b dan Bacillus subtilis
168. Kedua bakteri ini merupakan isolat koleksi Laboratorium Bakteriologi,
Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor.
Isolat bakteri tersebut ditumbuhkan pada media NA (nutrient agar), kemudian setelah diinkubasi selama 1 hari, kedua bakteri ini ditumbuhkan pada media LB
(luria broth) masing-masing 10 ml, kemudian dishaker selama 12 jam. Bakteri yang telah ditumbuhkan selama 12 jam tersebut, diteteskan sebanyak 10 µl di atas
media kitin.
Uji Potensi Antagonisme Aeromonas caviae WS7b dan Bacillus subtilis 168 terhadap Cendawan Patogen
Bakteri Aeromonas caviae WS7b dan Bacillus subtilis 168 ditumbuhkan pada media LB selama 12 jam, kemudian diteteskan sebanyak 2 tetes di bagian
tepi media PDA (potato dextrose agar) sebanyak 5 µl (Gambar 2). Kedua bakteri tersebut masing-masing di uji dengan beberapa cendawan, yaitu Rhizoctonia solani, Sclerotium Rolfsii, Pyricularia oryzae, Fusarium oxysporum, dan Pythium sp.
9
Preparasi DNA Kromosom dan Plasmid pDL2 Ekstraksi DNA Kromosom Aeromonas caviae WS7b
Bakteri A. caviae ditumbuhkan pada 10 ml LB (luria broth) atau media cair lainnya selama 12 jam (sangat baik jika bakteri dipanen pada saat memasuki fase
stasioner, yaitu pada saat OD600 sebesar 1,2). Kemudian sel bakteri dipanen
sebanyak 2 ml dengan sentrifugasi berkecepatan 8000 rpm selama 5 menit, dibilas
dengan volume yang sama (2 ml) menggunakan 0,85% larutan NaCl dan
didiamkan selama 5 menit. Setelah itu, dibilas dengan larutan TES Buffer, yang
terdiri atas 10 mM tris-HCl pH 8, 25 mM EDTA, 150 mM NaCl. Sel
disuspensikan ke dalam 1 ml TE yang terdiri atas 10 mM tris-HCl pH 8 dan 25
mM EDTA, kemudian ditambahkan lisozim sebanyak 2 mg/ml TE dan 20% SDS
sebanyak 0,05 ml. Campuran tersebut diinkubasi pada suhu 370C hingga suspensi
terlihat jernih. Suspensi tersebut kemudian diekstraksi dengan
fenol-klorofom-isoamilalkohol sebanyak 1 ml, campurkan secara merata dengan cara
membalik-balikkan tabung reaksi. Setelah tercampur merata, suspensi tersebut disentrifugasi
dengan kecepatan 8000 rpm selama 10 menit. Fase atas diambil menggunakan
pipet tip yang telah digunting bagian ujungnya dengan gunting steril. Jika fase
atas yang terbentuk masih belum jernih bisa diambil (dipisahkan dari fenol), maka
perlu ditambahkan TE dan SDS (10% SDS sebanyak 0,1 ml/ml TE), dicampurkan
dengan baik dan diekstrak kembali dengan fenol-klorofom-isoamilalkohol
sebanyak 1 ml serta disentrifugasi kembali pada suhu ruangan karena pada suhu
rendah SDS akan berpresipitasi. Fase yang telah dipisahkan, ditambahkan 3 M
sodium asetat dengan pH 4,8 sebanyak 1/10 volume dan ditambahkan etanol
100% sebanyak 2 kali volume, dicampurkan secara merata. DNA yang terbentuk
bisa dipancing dengan pipet tip serta dibilas dengan alkohol 70% dan
dikeringanginkan atau dipresipitasikan dengan sentrifugasi berkecepatan 12000
rpm selama 10 menit. Kemudian DNA dilarutkan pada TE atau air steril.
Ekstraksi DNA Kromosom Bacillus subtilis 168
10
menit. Sel bakteri yang telah dipelet ditambahkan dengan 100 ml larutan TKE 1X,
yang terdiri atas 100 mM tris-HCl pH 8, 1 M KCl, dan 200 mM EDTA, serta
ditambahkan pula lisozim sebanyak 1-2 mg/ml TKE. Kemudian diinkubasi selama
1 jam pada suhu 370C dan ditambahkan larutan sarkosil (N-lauryl sarcosinate) hingga konsentrasi akhirnya 1%. Campuran tersebut akan menjadi bening yang
mengindikasikan bahwa sel telah mengalami lisis sempurna. Setelah itu,
ditambahkan fenol-klorofom-isoamilalkohol sebanyak 200 µl dan larutan TKE
sebanyak 100 µl, dicampurkan dengan cara divortex selama 10 detik. Campuran
tersebut disentrifugasi dengan kecepatan 12000 rpm selama 3 menit pada suhu
40C, maka akan terlihat tiga fase. Fase paling atas diambil menggunakan pipet tip
yang telah digunting bagian ujungnya dengan gunting steril. Fase atas yang telah
dipisahkan tersebut, ditambahkan dengan alkohol 99% sebanayak 500 µl secara
perlahan-lahan, maka akan terbentuk dua fase. DNA diambil menggunkan pipet
tip dengan cara memutar-mutarkan beberapa kali, kemudian dibilas menggunakan
alkohol 70% dan dikeringanginkan dengan posisi pipet terbalik. Setelah
mengering, DNA dilarutkan ke dalam 50 µl H2O steril dan didiamkan selama
semalam pada suhu 40C.
Amplifikasi Gen chiA dan Promotor sigB Amplifikasi chiA dengan Polymerase Chain Reaction (PCR)
PCR dilakukan menggunakan tabung PCR dengan total volume 50 µl yang
terdiri atas bufer PCR 1X, dNTPmix 0,1µM, primer forward 20 pmol, primer
reverse 20 pmol, Taq polimerase 1,25 unit, DNA template 1 µg, dan air steril. Susunan primer yang digunakan untuk mengamplifikasi gen chiA sebagai berikut:
chiAF 5’- AATGTCGCTAGCGCGTACCTAGGATAGCGGGGCC - 3’ 34 mer
chiAR 5’-AATGTCGGGCCCCAGGATCTGCTGCTCAGCCTGTGG- 3’ 36 mer Susunan primer ini memiliki situs pemotongan oleh enzim restriksi NheI dan
ApaI, yaitu pada nukleotida yang diberi garis bawah.
11
selama 1 menit, elongation pada suhu 720C selama 3,25 menit. Tahap kedua dilakukan berulang sebanyak 30 siklus. Tahap ketiga, yaitu final elongation pada suhu 720C selama 5 menit.
Amplifikasi Promotor sigB dengan Polymerase Chain Reaction (PCR)
PCR dilakukan pada larutan yang memiliki total volume 50 µl, terdiri atas
bufer PCR 1X, dNTPmix 0,1µM, primer forward 20 pmol, primer reverse 20 pmol, Taq polimerase 1,25 unit, DNA template 1 µg, dan air steril. Susunan primer yang digunakan untuk mengamplifikasi promotor gen sigB sebagai berikut:
sigBF5’-AGTATCGTTAACCGGTTTCTTGGAGCGTCCTGATCTG-3’(37 mer)
sigBR 5’- AATGTCGCTAGCCAGAAACATCGAGGAATTCGGC - 3’ (34 mer) Susunan nukleotida pada primer yang diberi garis bawah adalah situs pemotongan
enzim restriksi HpaI dan NheI.
Dalam proses amplifikasi promotor sigB ini, program PCR yang akan dilalui terdiri atas tiga tahap. Tahap pertama adalah pre-denaturation pada suhu 940C selama 2 menit. Tahap kedua, denaturation pada suhu 940C selama 30 detik, annealing pada suhu 550C selama 30 detik, elongation pada suhu 720C selama 3,5 menit. Tahap kedua ini dilakukan secara berulang sebanyak 30 siklus.
Tahap ketiga, yaitu final elongation pada suhu 720C selama 10 menit.
Purifikasi Fragmen chiA dan Promotor sigB dari Agarose
Purifikasi hasil amplifikasi gen dengan polymerase chain reaction (PCR) dari kedua jenis bakteri tersebut menggunakan Hi YieldTM Gel/PCR DNA
Extraction Kit (Research Biotech Corporation). Fragmen gen chiA dan promotor
sigB dielektroforesis menggunakan agarose. Agarose dipotong tepat di sekitar fragmen gen yang telah diamplifikasi dan dielektroforesis. Gel yang telah
dipotong, dimasukkan ke dalam tabung efendof terpisah untuk masing-masing
fragmen, kemudian dilelehkan pada suhu 550C. Gel agarose yang telah cair
ditambahkan bufer DF sebanyak 5 kali volume dan dicampurkan merata dengan
12
kolom DF yang ditempatkan pada tabung pengumpul dan disentrifugasi dengan
kecepatan 8000 rpm selama 30 detik. Supernatan yang terbentuk pada tabung
pengumpul dibuang, lalu tabung pengumpul dikembalikan pada posisi
sebelumnya. Bufer pencuci yang telah ditambahkan etanol dimasukkan ke dalam
kolom DF sebanyak 500 µl, setelah itu disentrifugasi dengan kecepatan 8000
selama 30 detik, supernatan yang terbentuk pada tabung pengumpul, dibuang dan
diletakkan kembali tabung pengumpul pada posisi semula. Untuk tujuan
pengeringan sisa-sisa cairan, tabung pengumpul dan DF disentrifugasi kembali
dengan kecepatan 14000 rpm selama 2 menit. Kolom DF dipindahkan ke dalam
tabung mikro yang baru dan ditambahkan bufer pelarut sebanyak 15 µl pada
bagian tengah kolom DF, didiamkan dengan posisi berdiri selama 2 menit. Setelah
bufer pelarut terserap sempurna pada bagian tengah kolom DF, dilakukan
sentrifugasi dengan kecepatan 14000 rpm selama 2 menit.
Penyambungan Fragmen Promotor sigB dan chiA Pemotongan Fragmen Promotor sigB dan chiA
Fragmen promotor sigB dipotong menggunakan dua enzim restriksi, yaitu
NheI dan HpaI. Enzim restriksi yang digunakan memiliki buffer yang berbeda, sehingga pemotongan gen menggunakan enzim restriksi dilakukan satu per satu.
Enzim yang pertama digunakan adalah NheI. Fragmen promotor sigB diambil sebanyak 10 µl, kemudian ditempatkan di dalam tabung efendof. Suspensi
restriksi fragmen promotor sigB terdiri atas bufer tango 1X, 1 unit enzim NheI, dan air steril. Suspensi tersebut diinkubasi selama 12 jam pada suhu 370C.
Setelah diinkubasi selama 12 jam, fragmen yang telah terpotong dipurifikasi
dengan metode presipitasi etanol. Ke dalam larutan yang mengandung fragmen
hasil pemotongan, ditambahkan 3M sodium asetat dengan pH 4,8 sebanyak 1/10
volume total larutan, kemudian ditambahkan etanol 99% sebanyak 2X volume
total larutan, campurkan larutan tersebut secara merata. Sebelum disentrifugasi,
larutan diinkubasi selama 2 jam pada suhu -800C. Kemudian disentrifugasi
dengan kecepatan 13000 rpm pada suhu 40C. Supernatan yang terbentuk dibuang,
13
kemudian dikeringanginkan. Setelah kering, ditambahkan air steril atau TE
sebanyak 50 µl.
Enzim restriksi kedua yang digunakan adalah HpaI. Larutan fragmen promotor sigB yang telah dipurifikasi, diambil sebanyak 10 µl, kemudian ditempatkan di dalam tabung efendof. Larutan restriksi fragmen promotor sigB terdiri bufer B 1X, 1 unit enzim HpaI, dan air steril. Larutan tersebut diinkubasi selama 12 jam pada suhu 370C. Kemudian dipurifikasi menggunakan metode
presipitasi etanol yang sebelumnya telah dijelaskan.
Fragmen chiA juga dipotong menggunakan dua enzim restriksi, yaitu NheI dan ApaI. Enzim restriksi yang digunakan memiliki bufer yang berbeda pula, sehingga pemotongan gen menggunakan enzim restriksi dilakukan satu per satu.
Enzim yang pertama digunakan adalah NheI. Fragmen gen chiA diambil sebanyak 10 µl, kemudian ditempatkan di dalam tabung efendof. Larutan restriksi fragmen
gen chiA terdiri atas bufer tango 1X, 1 unit enzim NheI, dan air steril. Suspensi tersebut diinkubasi selama 12 jam pada suhu 370C.
Setelah diinkubasi selama 12 jam, fragmen yang telah terpotong dipurifikasi
dengan metode presipitasi etanol. Enzim restriksi kedua yang digunakan adalah
ApaI. Fragmen chiA yang telah dipurifikasi, diambil sebanyak 10 µl, kemudian ditempatkan di dalam tabung efendof. Larutan restriksi fragmen gen chiA terdiri atas buffer B 1X, 1 unit enzim ApaI, dan air steril. Suspensi tersebut diinkubasi selama 12 jam pada suhu 370C. Kemudian dipurifikasi menggunakan metode
campuran kedua gen tersebut ditambahkan solution A sebanyak 40 µl dan solution
B sebanyak 10 µl, suspensi tersebut dicampurkan secara merata. Kemudian
14
hasil ligasi dipurifikasi menggunakan metode purifikasi etanol yang sama dengan
sebelumnya.
Penyisipan Fragmen sigB-chiA pada Plasmid pDL2 Pemotongan dan Purifikasi Plasmid pDL2
Plasmid pDL2 yang telah dipurifikasi, dipotong menggunakan dua enzim
restriksi, yaitu HpaI dan ApaI. Enzim restriksi yang digunakan memiliki bufer yang sama, sehingga pemotongan plasmid ini dapat langsung dilakukan oleh dua
enzim restriksi sekaligus. Hasil purifikasi plasmid pDL2 diambil sebanyak 10 µl,
kemudian ditempatkan di dalam tabung efendof. Ke dalam larutan plasmid
tersebut ditambahkan bufer B 1X, 5 unit enzim HpaI, 2 unit enzim ApaI, dan air steril. Larutan restriksi plasmid tersebut diinkubasi selama 12 jam pada suhu
370C.
Setelah diinkubasi selama 12 jam, plasmid yang telah terpotong dipurifikasi
dengan metode presipitasi etanol. Ke dalam larutan hasil resriksi plasmid
ditambahkan 3M sodium asetat dengan pH 4,8 sebanyak 1/10 volume, kemudian
ditambahkan etanol 99% sebanyak 2X volume, campurkan larutan tersebut secara
merata. Sebelum disentrifugasi, larutan diinkubasi selama 2 jam pada suhu -800C.
Kemudian disentrifugasi dengan kecepatan 13000 rpm pada suhu 40C. Supernatan
yang terbentuk dibuang, sedangkan pelet yang terbentuk dibilas dengan etanol
70% sebanyak 2 kali, kemudian dikeringanginkan. Setelah kering, ditambahkan
air steril atau TE sebanyak 50 µl.
Ligasi Fragmen sigB-chiA dengan pDL2
Larutan dari pDL2 hasil restriksi dan fragmen DNA hasil rekombinan
ditempatkan pada tabung efendof masing-masing sebanyak 5 µl. Ke dalam
campuran plasmid dan fragmen rekombinan tersebut ditambahkan solution A sebanyak 40 µl dan solution B sebanyak 10 µl, suspensi tersebut dicampurkan secara merata. Kemudian suspensi tersebut diinkubasi selama 4 jam pada suhu
160C. Setelah diinkubasi, suspensi dipurifikasi menggunakan metode presipitasi
15
Transformasi Plasmid Rekombinan pada E. coli DH5 Penyiapan E. coli DH5 Kompeten
E. coli DH5 dikulturkan di dalam 5 ml media LB pada suhu 370C selama 12 jam, kemudian kultur bakteri tersebut diinokulasikan sebanyak 300 µl ke
dalam 30 ml LB baru dan di-shaker selama 2 jam pada suhu 370C (nilai OD550 = 0,2-0,25). Bakteri tersebut kemudian disentrifugasi dengan kecepatan 5000 rpm
selama 5 menit pada suhu 40C dan dipisahkan dengan supernatannya. Pelet bakteri
tersebut dicampurkan dengan 50 mM CaCl2 sebanyak 15 ml, kemudian campuran
tersebut didiamkan di dalam wadah berisi es selama 30 menit, setelah itu
disentrifugasi dengan kecepatan 5000 rpm selama 5 menit pada suhu 40C dan
dipisahkan dengan supernatannya. Pelet tersebut dicampurkankan kembali dengan
larutan stok yang terdiri atas 50 mM CaCl2 dan 20% gliserol sebanyak 3 ml.
Suspensi tersebut didiamkan di dalam lemari es pada suhu -700C.
Transformasi Plasmid Rekombinan ke dalam E. coli DH5
Sebanyak 100 µl E. coli DH5 kompeten didiamkan di dalam es selama 30 menit untuk mencairkan stok bakteri kompeten tersebut. Setelah itu ditambahkan
100 µl sel bakteri kompeten ke dalam larutan DNA yang terdiri atas 5 µl plasmid
pDL2, 10 µl 500 mM MgCl2-100 mM CaCl2, 8 µl polyethyleneglycol 30%, dan H2O steril hingga volume akhirnya mencapai 100 µl dicampurkan secara merata
dan diinkubasi pada kondisi dingin selama 20 menit. Campuran tersebut
diinkubasi pada suhu 420C selama 3 menit (heat shock), setelah itu diletakkan dalam es selama 2 menit. Kemudian ditambahkan 500 µl LB ke dalam campuran
tersebut, setelah itu pindahkan ke dalam tabung reaksi steril dan diinkubasi pada
suhu 370C selama 60 menit sambil di-shaker. Sel bakteri ditempatkan pada tabung efendof dan dipanen dengan sentrifugasi berkecepatan 8000 rpm selama 5 menit.
Supernatan yang terbentuk disisakan sebanyak 100 µl dan dicampurkan kembali
dengan pelet bakteri transforman dengan cara divortek selama 5-10 detik.
Campuran tersebut disebarkan di atas NA yang mengandung antibiotik ampisilin
dengan konsentrasi 50 µg/ml. Kemudian bakteri transforman diinkubasi pada suhu
16
Pengujian Aktivitas Kitinase E. coli DH5 Transforman
Bakteri yang digunakan sebagai uji adalah bakteri E. coli DH5 transforman dan E. coli DH5 pembawa plasmid pDL2. Kedua Bakteri E. coli DH5 tersebut ditumbuhkan pada media NA + ampisilin 50 µg/ml media, kemudian setelah
diinkubasi selama 1 hari, bakteri ini ditumbuhkan pada media LB + ampisilin 50
µg/ml media masing-masing 10 ml, kemudian dishaker selama 12 jam. Bakteri yang telah ditumbuhkan tersebut, diteteskan sebanyak 5 µl di atas media kitin
(Gambar 3). Pengamatan terhadap aktivitas kitinolitik kedua bakteri tersebut
dilakukan pada dua hari setelah perlakuan.
17
HASIL DAN PEMBAHASAN
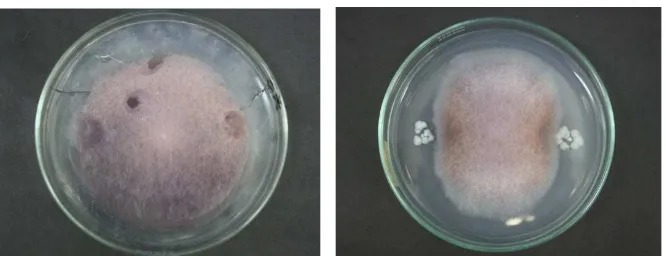
Uji Aktivitas Kitinase Aeromonas Caviae WS7b dan Bacillus subtilis 168 Pengujian aktivitas kitinase terhadap Aeromonas caviae WS7b dan Bacillus subtilis 168, menunjukkan hasil positif pada A. caviae dan hasil negative pada B. subtilis. Seperti yang terlihat pada Gambar 4, zona bening terbentuk di sekitar koloni A. caviae, sedangkan di sekitar B. subtilis tidak terlihat zona bening. Menurut Wenuganen (1996), A. caviae WS7b menunjukkan aktivitas kitinase yang kuat pada media agar kitin. Gen yang menyandikan aktivitas kitinase pada A. caviae adalah gen chiA (Sitrit et al. 1995).
Gambar 4 Aktivitas kitinase A. caviae WS7b pada media agar kitin
Uji Potensi Antagonisme Aeromonas caviae WS7b dan Bacillus subtilis 168 terhadap Cendawan Patogen
Pengujian dual culture A. caviae dan B. subtilis terhadap beberapa cendawan menunjukkan bahwa terjadi penghambatan pertumbuhan cendawan
18
sebelumnya, bahwa aktivitas kitinase aktif ini disandikan oleh gen chiA (Sitrit et al. 1995). Pada kondisi rumah kaca, A. caviae mampu mengurangi perkembangan
Rhizoctonia solani sebesar 78% dan Fusarium oxysporum f.sp. vasinfectum
sebesar 57% pada tanaman kapas, sedangkan pada tanaman kacang buncis mampu
mengurangi perkembangan Sclerotium rolfsii sebesar 60% (Inbar & Chet 1991). Menurut Soglio et al.. (1998), pada Trichoderma harzianum Th008, enzim ini bisa menghambat pertumbuhan Rhizoctonia solani. Menurut Boer & Veen (2001), mekanisme kitinolitik yang dilakukan bakteri untuk mendegradasi kitin belum
diketahui secara jelas. Pada pengujian A. caviae WS7b terhadap Pythium sp terlihat zona penghambatan, walaupun dinding sel cendawan ini tidak tersusun
dari kitin, karena cendawan ini masuk ke dalam kelompok Oomycetes. Hal ini
menunjukkan terdapat mekanisme penghambatan lain yang dilakukan oleh A. caviae WS7b terhadap Pythium sp (Gambar 5).
Gambar 5 Uji dual culture Pythium sp dengan B. subtilis 168 dan A. caviae
WS7b
19
Gambar 7 Uji dual culture F. oxysporum dengan B. subtilis 168 dan A.caviae
WS7b
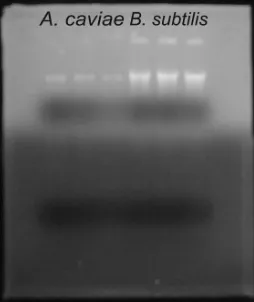
Ekstraksi DNA Aeromonas caviae WS7b dan Bacillus subtilis 168 Hasil yang didapatkan dari ekstraksi DNA kromosom kedua bakteri tersebut
menunjukkan bahwa DNA kromosom total berhasil diekstraksi dengan baik.
Seperti pada Gambar 8, terlihat bahwa DNA kromosom total kedua jenis bakteri
tersebut utuh/tidak pecah dan tidak terdapat campuran 16S rRNA atau 23S rRNA.
DNA kromosom total dari Bacillus subtilis 168 dan Aeromonas caviae WS7b didapatkan dengan metode yang berbeda karena kedua bakteri tersebut dari
golongan gram yang berbeda. B. subtilis adalah bakteri golongan gram positif, yang berarti memiliki lapisan peptidoglikan yang tebal, sehingga untuk
menghancurkan sel bakteri tersebut membutuhkan lisozim. Sedangkan A. caviae
adalah bakteri gram negatif yang memiliki lapisan peptidoglikan tipis, sehingga
untuk menghancurkan sel bakteri tersebut penggunaan lisozim tidak terlalu
dipentingkan. Hasil ekstraksi DNA B. subtilis 168totalmenunjukkan perpendaran warna kuning yang lebih terang dibandingkan hasil ekstraksi DNA total terhadap
A.caviae WS7b, hal ini disebabkan metode yang digunakan untuk mengekstraksi DNA total B. subtilis telah mengalami optimasi, sehingga memberikan hasil yang optimal dan khusus untuk mengekstraksi DNA dari B. subtilis, sedangkan metode yang digunakan untuk mengekstraksi DNA total dari A. caviae adalah metode yang biasa digunakan untuk mengekstraksi DNA total bakteri secara umum.
20
Gambar 8 Hasil ekstraksi DNA total A. caviae WS7b dan B. subtilis 168
Menurut Sambrook et al. (2000), proses pendegradasian dinding sel dilakukan secara enzimatik seperti penggunaan lisozim, sedangkan untuk
mendegradasi membran sel menggunakan deterjen.pada metode yang digunakan
yang berfungsi sebagai deterjen adalah sodium dedoxyl sulfat atau N lauryl sarcocinate. Penggunaan EDTA dalam proses ektraksi DNA bertujuan untuk menghindari rusaknya DNA karena larutan ini mengikat Mg2+. Ion ini dibutuhkan
oleh enzim DNase untuk mendegradasi DNA. Metode pemancingan DNA
kromosom menggunakan ujung tip bertujuan untuk meminimalkan terjadinya
campuran bahan-bahan lain yang tidak diinginkan, sehingga dengan penggunaan
metode ini hanya DNA kromosom yang terambil.
Menurut Old & Primrose (1986), pada dasarnya tahap yang dilalui dalam
ekstraksi DNA kromosom antara lain (i) penghancuran dinding sel, baik secara
mekanis atau enzimatis, sebagai contoh penggunaan lisozim, (ii) pelisisan sel,
dapat dilakukan dengan penambahan deterjen, seperti SDS, (iii) pembersihan
debris sel menggunakan pelarut organic fenol, kloroform, dan isoamil alcohol, (iv)
pengandapan DNA dari lisat jernih dengan menambahkan etanol dan garam
natrium.
Amplifikasi Promotor sigB dengan Polymerase Chain Reaction
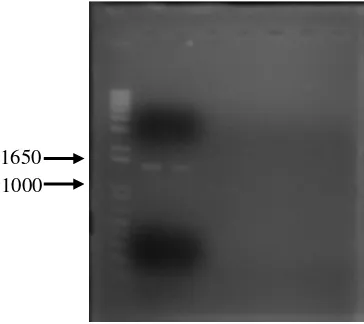
Terlihat pada Gambar 9, bahwa fragmen promotor sigB telah teramplifikasi dengan baik dan tidak terdapat fragmen-fragmen non-spesifik. Fragmen promotor
21
warna kuning yang tajam. Hal ini menunjukkan bahwa fragmen promotor sigB berhasil diamplifikasi dalam jumlah yang sangat banyak.
Gambar 9 Hasil amplifikasi fragmen promotor sigB
Gen-gen yang terdapat pada B. subtilis 168, termasuk gen sigB paling mudah diamplifikasi karena bakteri tersebut memiliki subunit . Subunit adalah
protein yang sangat asam dan memiliki pengaruh yang kuat terhadap RNA
polimerse in vitro, tapi tidak berpengaruh pada proses yang terjadi secara in vivo.
Keberadaan subunit pada proses transkripsi secara in vitro meningkatkan
selektivitas transkripsi, menekan terjadinya inisiasi pada bagian yang bukan
promoter (Helman & Moran dalam Sonenshein et al. 2002). Gen sigB dalam DNA B. subtilis total terletak pada urutan 522417 - 523211 basa (MBGD 2009). Menurut GenBank (2009), gen sigB memiliki ukuran sekitar 800 bp terletak pada 522862 – 523650 bp dengan persentase GC sebesar 45,374%. Gen sigBMenurut Price (2002), gen ini berperan merespon cekaman lingkungan secara umum.
22
841 cagcaggatctagggccgtacacaccttcgcacacagttgatcaattatcagaaggaggg 901 ctcggtctatatttaatggaaacgctcatggatgaagtcagagtgcaaaaccactccggc
961 gtcaccgtagcgatgacaaagtatttaaatggggagcgagttgatcatgacacaaccatc
1021 aaaaactacgaaactaactaaagatgaagtcgatcggctcataagcgattaccaaacaaa
Gambar 10 Sekuen nukleotida promotor sigB
Sekuens nukleotida hasil amplifikasi fragmen promotor sigB dengan PCR memiliki ukuran sekitar 1.4 kb. Pada hasil amplifikasi tersebut juga terdapat situs
restriksi untuk enzim HpaI dan NheI. Seperti yang terlihat pada Gambar 10, sekuen nukleotida yang diberi kotak warna hitam adalah situs penempelan primer
saat proses amplifikasi, sedangkan sekuen nukleotida yang ditebalkan hurufnya
(TTG) adalah metionin, yang menjadi kodon inisiasi proses translasi oleh RNA
polimerase saat terjadi ekspresi gen. Sekuen nukleotida fragmen sigB yang diberi garis bawah adalah sekuen konsensus. Menurut Kalman et al. (1991) pada fragmen sigB B. subtilis 168 terdapat sekuen konsensus, yaitu daerah yang dikenali oleh sigma faktor dalam proses transkripsi nukleotida -10 (GGGTAT),
dan -35 (AGGTTTAA), juga terdapat kodon yang diketahui sebagai kodon
inisiasi transkripsi +1 (TAG).
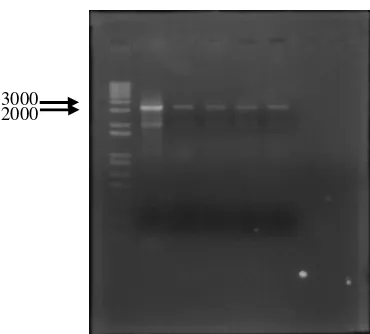
Amplifikasi Fragmen Gen chiA dengan Polymerase Chain Reaction Fragmen chiA telah berhasil diamplifikasi dengan baik, namun masih terdapat produk PCR non-spesifik yang memiliki ukuran lebih kecil dan terletak
tepat di bawah fragmen chiA. Dalam proses purifikasi fragmen chiA hasil amplifikasi, agarose dipotong tepat di sekitar fragmen gen yang diinginkan,
sehingga produk PCR non-spesifik tersebut tidak terambil. Perpendaran warna
kuning pada hasil amplifikasi menunjukkan bahwa fragmen ini berhasil
23
Gambar 11 Hasil amplifikasi fragmen gen chiA
Menurut Malik (2005), sekuen nukleotida lengkap gen chiA dari A. caviae WS7b terdiri dari 2.937 pasang basa (Gambar 12), yang mengandung suatu
kerangka baca terbuka sepanjang 2.595 nukleotida yang menyandikan 865 residu
asam amino. Pada kerangka baca tersebut tidak ditemukan daerah promotor
berupa sekuen consensus -35 dan -10, tetapi terdapat sinyal inisiasi transkripsi
berupa sekuen mirip sekuen pengikatan ribosom. Persentase GC dari gen ini
sebesar 63,74% (1656 basa), sedangkan persentase AT adalah 36,26% (936 basa).
1 ccggtctaag ggtctgcgta cctaggatag cggggccacc acaggttgta tcgtccatgg 61 gccaagccat ggctgcgatg ttgtctgcgt tacctggcag gttgcgttgc ctttttcgtt
121 gttaattcca ataacgaaat aaggaagttc aaatatgtta agtccaaaac tttccctgct
181 ggcgcttctg gtcggggggc tttgcactac ctccgccttc gccgctgccc cgggcaaacc 241 caccattggc tccggcccca ccaagtttgc catcgttgaa gtcaatcagg ccgcttcggc 301 ctacaaccag ttggtgaccg tccacaagga tggcgctccc gtcagcgtga cctggaacct 361 ctggtccggt gacgtcggac agaccgccaa ggtactgctc gacggcaagg aggtgtggtc 421 aggcccggcc ttcgccgcgg gtaccgccaa cttcaaggtc accaaggggg ggcgttacca 481 gatgcaggtg gccctgtgca acgcccatgg ctgcaccctc tccgacaaga aggagctgat 541 ggtcgccgat accgacggca gccacctggc gccgctcaat gcgcccctca aggagaacaa 601 caagccttac gccaacaagt ccggcaaggt ggtgggggcc tactacgtgg agtggggggt 661 ctatggtcgc aagttcaccg tggacaagat cccggcccag aacctgaccc atatcctcta 721 cggcttcacc cccatctgcg gtggcaacgg catcaacgac agcctcaaag agatctccgg 781 cagcttcgag gcgttgcagc gctcctgtgc gggccgcgaa gacttcaagg tctccatcca 841 tgatccctgg gcggcgatcc agatgtccca gggcaacctc agcgcctggg atgagcccta 901 caagggcaac ttcggcaacc tgatggcgct caaacaggcc catccggacc tcaagatcct 961 gccgtctgtc ggcggatgga ccctctcaga tcccttctat ttcctgggtg acaagaccaa 1021 gcgcgatacc ttcgtcgcct cggtcaaaga gttcctgcag acctggaaat tcttcgacgg 1081 cgtggacatc gactgggagt tcccgggcgg acagggggcc aaccccagcc tgggcggccc 1141 gaatgacggc gccacctatg tggtgctgat gaaggagctg cgagccatgc tcgatgaact 1201 ggaagccgag accggccgcc agtatgagct gacctcggcc atcagcgccg gcggtgacaa 1261 gattgccaag gtggattatc aggcggctca gcagtacatg gaccacatct tcctgatgag 1321 ctacgacttc agcggcgcct tcgacctgac gaatctgccc caccagacca acctctttgc 1381 ctccagctgg gatccggcca ccaagtacac cgccgacaag ggcgtcaagg cgctgctggg 1441 tcagggggtg acaccgggca agattgtggt gggggcggcc atgtatggcc gtggcatgac
24
1501 cggagtgaag aactaccagg ccggcaaccc ctgcaccggc accgccaccg gaccggtgag 1561 cggtacctgg gaaaatggcg tggtggatta ccgcgacatc gtcaacaacc gcatgggcgc 1621 aggctgggag cagggctatg acgagtcggc cgaggccccc tatgtcttca aggccagcag 1681 tggtgacctc atcaccttcg acaacgaccg ctcggtcaag gccaaggggc agtacgtgct 1741 ggcgaaccag ctcggcggtc tgttcgcctg ggaaattgat gcggacaacg gcgacatcct 1801 caacgccatg cacgaggggc tgggccacgg cgagggtacg ctgccgccgg tcaacaagcc 1861 gccggttgcc aatgccggca gcgatctgag tgccaccggc ccggccgagg tgaccctcaa 1921 gggcagtgcc tcccacgatc cggaaaacgg ggcgctgacc tacagctgga aacaggtctc 1981 cggaccccag gccagcctgc tggatgccac ccaggccaag gcccgtgtgg tactggatgc 2041 cgtcagcagc gacatcaatc tggtgttcga gctgaccgtg accgacgatc aggggctctc 2101 ggccaaggat caggtggtgg tcaccaacaa ggcgccgcag ccgaacctgc cccccgtggt 2161 cagcgtaccg gccagtgcga ccgtcgaggc cggcaagcag gtgagcatca aggccaccgc 2221 ttccgacccc aatggtgatg ccctgagcta tcagtggaca gtgccggccg ggctcagcgc 2281 caccggtctg gacagcgcga ccctggtggt cacgggctcg aacgtgacca gtgacacggc 2341 ctacgatctg accctggtgg tcaccgacgg ggcgctggat gccacagccg ttacccgcct 2401 gaccgtcaag ccggccagta caggtggtgg ctgtgaggcc tgcgatccgg atgcggccaa 2461 ccacccggcc tggagtgcag gtaccgtcta caacaccaat gacaaggtga gccacaacca 2521 gctggtgtgg caggccaagt attggaccca gggcaacgag ccgagccgca ccgccgatca 2581 gtggaaactg gtgagccagg tgcaactggg ttgggatgcc ggagtggtct acaacggtgg 2641 tgatgtcacc agccacaacg gccgtaagtg gaaggcccag tactggtcca agggcgatga
2701 gcccggcaag gccgccgtct gggtcgatca gggcgcggcg agctgcaact gatctgccgt
2761 gatgaaaaat ggggccgagg ggatttttgt cttgcgtggt cgggtgtgtg ttccctgtca 2821 ggggaaaggc gcactcgctt tgtcaaaaag gcccgtcagg gccttttttc atggtatgtc
2881 accggttcac agcggttttt gccacaggct gagcagcaga tcctg
Gambar 12 Sekuen nukleotida fragmen gen chiA dengan ukuran 2,9 kb
Menurut Malik (2005) Sekuen gen chiA memiliki situs pengikatan ribosom (shine Dalgarno) AGGA, kodon inisiasi translasi ATG, kodon terminasi translasi TGA , dan sekuen ulang terbalik sebagai terminasi transkripsi (hairpin structure). Sekuen nukleotida yang diberi kotak warna hitam adalah situs penempelan primer
saat proses amplifikasi.
Penyambungan Fragmen Promotor sigB dan chiA
Hasil amplifikasi fragmen promotor sigB memiliki situs restriksi yang sesuai dengan pDL2 dan fragmen chiA. Fragmen promotor sigB yang terpotong oleh enzim restriksi HpaI memiliki bentuk ujung tumpul, sedangkan fargmen yang terpotong dengan enzim restriksi NheI memiliki bentuk ujung berperekat (Gambar 13). Semua situs pemotongan pada fragmen gen bersifat palindromik.
25
Hasil amplifikasi gen chiA memiliki situs restriksi yang sesuai dengan pDL2 dan fragmen sigB. Fragmen chiA yang terpotong oleh enzim restriksi NheI dan ApaI memiliki bentuk ujung berperekat pada kedua sisinya (Gambar 14).
Gambar 14 Situs restriksi pada fragmen promotor chiA
Seperti yang terlihat pada Gambar 15, hasil restriksi fragmen promotor sigB dan chiA, disambung menggunakan enzim ligase yang terdapat di dalam DNA Ligation Kit ver. 1 (Takara Biotech.Inc). Ujung berperekat memiliki peluang
menyambung yang lebih besar daripada ujung tumpul. Hasil ligasi antara kedua
fragmen ini memiliki ukuran sekitar 4,3 kbps.
Gambar 15 Hasil penggabungan fragmen sigB-chiA
Penyisipan Fragmen sigB-chiA pada Plasmid pDL2
Plasmid pDL2 memiliki situs restriksi yang mampu dipotong oleh enzim
restriksi HpaI dan ApaI. Pemotongan ini akan menyebabkan pDL 2 memiliki ujung tumpul dan ujung berperekat pada masing-masing sisi perpotongannya
(Gambar 16).
Gambar 16 Hasil pemotongan plasmid pDL2
Hasil ligasi fragmen sigB dengan chiA disambungkan dengan plasmid pDL2 yang memiliki situs restriksi yang terpotong oleh enzim HpaI dan ApaI (Gambar 17 dan 18).
26
Gambar 18 Skema letak fragmen DNA rekombinan pada plasmid pDL2
Transformasi Plasmid rekombinan ke dalam E. coli DH5
Hasil transformasinya akan berupa koloni bakteri yang tumbuh pada media
NA (nutrient agar) yang telah diberi antibiotik penanda, yaitu ampisilin. Plasmid pDL2 membawa gen penyandi resisten terhadap ampisilin, sehingga bakteri yang
tidak mengandung plasmid pDL2 tidak akan tumbuh pada media tersebut, kecuali
bakteri tersebut mengalami mutasi secara spontan. Plasmid pDL2 yang digunakan
memiliki ukuran 9193 bps. Keberhasilan transformasi plasmid pDL2 terlihat
dengan perbandingan jumlah koloni bakteri yang tumbuh pada kontrol. Jumlah
koloni yang tumbuh pada kontrol harus jauh lebih sedikit dibandingkan dengan
jumlah koloni yang tumbuh pada biakan yang mengandung plasmid (Gambar 19).
a b