PENGARUH ATRAKTAN UNTUK MENINGKATKAN PENGGUNAAN TEPUNG DARAH PADA PAKAN IKAN
KERAPU BEBEK Cromileptes altivelis
SITI SARAH HALIMATUSADIAH
DEPARTEMEN BUDIDAYA PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER INFORMASI Dengan ini saya menyatakan bahwa Skripsi yang berjudul :
PENGARUH ATRAKTAN UNTUK MENINGKATKAN PENGGUNAAN TEPUNG DARAH PADA PAKAN IKAN KERAPU BEBEK Cromileptes altivelis
adalah benar merupakan hasil karya yang belum diajukan dalam bentuk apapun kepada perguruan tinggi mana pun. Semua sumber data dan informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir Skripsi ini.
Bogor, Januari 2009
RINGKASAN
SITI SARAH HALIMATUSADIAH. Pengaruh Atraktan Untuk Meningkatkan Penggunaan Tepung Darah Pada Pakan Ikan Kerapu Bebek Cromileptes altivelis.
Dibimbing oleh MIA SETIAWATI dan NUR BAMBANG PRIYO UTOMO.
Tepung darah merupakan sumber protein alternatif sebagai pengganti sumber protein dari tepung ikan. Tepung darah mempunyai protein tinggi 92%, leucin 13,61%, fosfor 0,33% dan kandungan besi (Fe) yang tinggi sampai 2.700 mg/kg dalam bahan kering. Namun tepung darah tidak memiliki palatabiliti sehingga penggunaan tepung darah dalam formulasi pakan dapat mengurangi nafsu makan ikan. Untuk itu diperlukan bahan pakan tambahan yang dapat meningkatkan nafsu makan ikan yaitu berupa atraktan. Atraktan yang digunakan dalam penelitian ini adalah taurin dan tepung cumi. Penelitian ini bertujuan untuk mengetahui pengaruh pemberian atraktan (taurin dan tepung cumi) untuk meningkatkan pemanfaatan tepung darah dalam pakan buatan terhadap kinerja pertumbuhan ikan kerapu bebek Cromileptes altivelis.
Penelitian dilaksanakan pada bulan Juli - September 2008. Formulasi pakan uji dibuat dengan kandungan nutrien yang sama dari semua pakan perlakuan yaitu protein 50,1±0,80% dan energi 3454,73±13,7kal/kg. Sebagai pakan uji yaitu: pakan A (tanpa tepung darah), pakan B (tepung darah 6 %), pakan C (tepung darah 6 % dan atraktan), pakan D (tepung darah 12 %) dan pakan E (tepung darah 12% dan atraktan). Atraktan terdiri dari taurin 1 % dan tepung cumi 3 %. Ikan uji yang digunakan adalah benih kerapu bebek Cromileptis altivelis dengan panjang 5,46±0,09cm dan berat 1,9±0,21g. Wadah percobaan adalah 15 buah akuarium berdimensi 40x60x50 cm dengan menggunakan sistem resirkulasi. Ikan dimasukan ke dalam akuarium dengan kepadatan 10 ekor/70 liter air. Ikan diberi makan 3 kali sehari secara at satiation pada pukul 07.00, 12.00 dan 17.00 WIB. Penelitian menggunakan Rancangan Acak Lengkap (RAL) dengan lima perlakuan dan masing-masing perlakuan terdiri dari tiga kali ulangan. Perbedaan antar perlakuan dapat diketahui melalui hasil pengujian menggunakan Anova dan dilanjutkan dengan uji Duncan.
PENGARUH ATRAKTAN UNTUK MENINGKATKAN
PENGGUNAAN TEPUNG DARAH PADA PAKAN IKAN
KERAPU BEBEK
Cromileptes altivelis
SITI SARAH HALIMATUSADIAH
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada Fakultas Perikanan dan Ilmu Kelautan
Institut Pertanian Bogor
PROGRAM STUDI TEKNOLOGI DAN MANAJEMEN AKUAKULTUR FAKULTAS PERIKANAN DAN ILMU KELAUTAN
Judul Skripsi : Pengaruh Atraktan Untuk Meningkatkan Penggunaan Tepung Darah Pada Pakan Ikan Kerapu Bebek Cromileptes altivelis
Nama Mahasiswa : Siti Sarah Halimatusadiah
NRP : C.14104038
Disetujui Komisi Pembimbing
Pembimbing I Pembimbing II
Mia Setiawati, M.Si Nur Bambang P.U M.Si NIP. 131 999 588 NIP. 132 049 461
Diketahui,
Dekan Fakultas Perikanan dan Ilmu Kelautan
Prof. Dr. Ir. Indra Jaya, M.Sc NIP. 131 578 799
KATA PENGANTAR
Segala puji dan syukur penulis panjatkan kehadirat Allah SWT karena atas rahmat-Nyalah Penulis dapat menyelesaikan skripsi ini. Shalawat serta salam kepada Nabi Muhammad SAW, keluarga, sahabat serta kita sebagai umatnya. Penelitian ini dilaksanakan sejak bulan Juli sampai September 2008, dengan judul ” Pengaruh Atraktan Untuk Meningkatkan Penggunaan Tepung Darah Pada Pakan Ikan Kerapu Bebek Cromileptes altivelis”.
Penyusun sampaikan rasa terima kasih sebesar-besarnya kepada :
1. Ibu Mia Setiawati M.Si dan Bapak Nur Bambang Priyo Utomo selaku Komisi Pembimbing atas bimbingan, arahan dan motivasinya selama pelaksanaan penelitian hingga penyelesaian skripsi,
2. Ibu Ir. Iis Diyatin, MM selaku dosen tamu,
3. Bapak, mamah serta adik-adik tercinta atas segala do’a dan kasih sayang yang senantiasa tercurah untuk penulis,
4. Danny Wibawa dan keluarga di Jakarta atas do’a, semangat dan dukungannya,
5. Seluruh dosen, teknisi, dan karyawan dalam lingkungan Departemen Budidaya Perairan atas segala bantuanya,
6. Teman-teman BDP 41 atas kebersamaannya selama ini. Semoga karya ilmiah ini dapat bermanfaat
Bogor, Januari 2009
RIWAYAT HIDUP
Penulis dilahirkan di Bogor pada tanggal 30 November 1985 sebagai anak pertama dari tiga bersaudara dari Ayah Herry Sastramihardja dan Ibu Titin Fatimah. Pendidikan formal yang dilalui penulis adalah TK Semboja Sari, SDN Empang IV, SMPN 2 Bogor dan SMUN 4 Bogor. Pada tahun 2004 penulis lulus seleksi masuk IPB melalui jalur Undangan Seleksi Masuk Institut Pertanian Bogor (USMI) dengan pilihan Program Studi Teknologi dan Manajemen Akuakultur, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan.
DAFTAR ISI
Halaman
DAFTAR TABEL... ix
DAFTAR LAMPIRAN... x
I. PENDAHULUAN... 1.1 Latar Belakang... 1
1.2 Tujuan ... 2
II. TINJAUAN PUSTAKA... 3
2.1 Kebutuhan Nutrien Kerapu Bebek... 3
2.2 Tepung Darah (Blood Meal)... 4
2.3 Atraktan ... 5
III. METODOLOGI... 8
3.1 Tempat dan Waktu Penelitian... 8
3.2 Pakan uji ... 8
3.3 Pemeliharaan Hewan Uji ... 9
3.4 Pengamatan Harian... 10
3.5 Kecernaan ... 10
3.6 Analisa Statistik ... 10
IV. HASIL DAN PEMBAHASAN... 14
4.1 Hasil... 14
4.2 Pembahasan ... 16
V. KESIMPULAN DAN SARAN... 21
DAFTAR PUSTAKA... 22
DAFTAR TABEL
Halaman
1. Profil asam amino tepung darah (Johnson et al., 2000)... 4 2. Komposisi bahan pakan dan komposisi proksimat pakan uji ... 9 3. Konsumsi pakan (KP), laju pertumbuhan harian (LPH), pertumbuhan
DAFTAR LAMPIRAN
Halaman
1. Komposisi proksimat bahan penyusun pakan (% bobot kering)... 25
2. Prosedur analisis proksimat (Takeuchi, 1988) ... 25
3. Analisa statistika ... 30
4. Kadar protein dan Cr2O3 dalam pakan dan feses uji kecernaan... 36
5. Parameter kualitas air (suhu, salinitas, pH, DO, TAN dan alkalinitas). 36 6. Komposisi proksimat ikan kerapu... 36
7. Rata-rata bobot dan panjang ikan kerapu... 37
8. Konsumsi pakan ikan kerapu ... 37
9. Kelangsungan hidup ikan kerapu ... 38
10. Retensi protein ... 38
I. PENDAHULUAN
1.1Latar Belakang
Kerapu bebek Cromileptes altivelis merupakan ikan yang hidup di terumbu karang dan sudah dapat dibudidayakan. Kendala utama pada budidaya ikan kerapu adalah terbatasnya ikan rucah sebagai pakan utama, sehingga diperlukan pakan alternatif berupa pakan buatan yang memiliki kandungan nutrien yang sesuai dengan kebutuhan ikan. Salah satu bahan pakan yang dapat digunakan pada akan kerapu yaitu tepung darah. Tepung darah merupakan salah satu sumber protein dalam pakan buatan karena memiliki kandungan protein yang tinggi yaitu 92%, leusin 13,61% dan hanya mengandung 0,33% fosfor. Keistimewaan dari tepung darah adalah kandungan besi (Fe) yang tinggi sampai 2.700 mg/kg dalam bahan kering (Johnson and Summerfelt, 2000).
Tepung darah bisa diterima baik oleh kerapu bebek Cromileptes altivelis sampai pada level 9 %, tetapi hasil optimum didapatkan pada level pemakaian 6 %. Penggunaan tepung darah 6 % sebagai sumber Fe-organik pada pakan buatan kerapu bebek dapat menggantikan pemakaian sumber Fe-anorganik Ferosulfat (FeSO4.7H2O) sekaligus mengurangi penggunaan tepung ikan dalam formulasi
pakan (Setiawati dkk., 2008). Fe berfungsi sebagai mikromineral penting yang mempengaruhi fungsi imunitas dan meningkatkan sistem pertahanan tubuh terhadap infeksi (Webster dan Lim, 2002).
dalam pakan dapat meningkatkan konsumsi pakan pada ikan sea bass Dicentrarchus labrax (Martinez et al., 2004). Sehingga taurin diduga berperan sebagai atraktan pada pakan. Atraktan juga dapat ditemukan pada hewan invertebrata laut. Tepung cumi dan produk cumi lainnya memiliki atraktan berupa glysin dan betain yang penting untuk merangsang kebiasaan makan (Hertrampf dan Pascual, 2000).
1.2Tujuan
Penelitian ini bertujuan untuk mengetahui pengaruh pemberian atraktan (taurin dan tepung cumi) untuk meningkatkan pemanfaatan tepung darah sampai level 12% dalam pakan buatan terhadap kinerja pertumbuhan ikan kerapu bebek Cromileptes altivelis yang terdiri dari pegukuran parameter konsumsi pakan, retensi protein, retensi lemak, laju pertumbuhan harian, pertumbuhan panjang relatif, efisiensi pakan dan kelangsungan hidup.
2.1 Kebutuhan Nutrien Ikan Kerapu Bebek
Ketersediaan pakan merupakan salah satu persyaratan mutlak bagi berhasilnya usaha budidaya ikan (Kompiang, 1996). Jumlah dan kualitas pakan yang tepat sangat berkaitan dengan pertumbuhan ikan. Kebutuhan nutrisi ikan kerapu sama dengan ikan lainnya yaitu meliputi protein, lemak, karbohidrat, vitamin dan mineral (Direktorat Jendral Perikanan Budidaya, 2001).
Protein adalah elemen penting pada organ dan otot dari tubuh hewan, berperan dalam membentuk jaringan baru untuk pertumbuhan, pengganti jaringan yang rusak, pembentukan enzim dan hormon, serta pengatur berbagai metabolisme dalam tubuh (Furuichi, 1988). Kebutuhan protein pada pakan untuk spesies laut yang bersifat karnivor seperti halnya ikan kerapu umumnya tinggi (Boonyaratpalin, 1997). Menurut Giri (1998) kebutuhan protein stadia juvenil untuk beberapa jenis ikan kerapu ternyata relatif tinggi, di atas 47 % bergantung kepada spesiesnya. Kandungan protein pakan optimal untuk ikan dipengaruhi oleh keseimbangan protein dan energi, komposisi asam amino, kecernaan protein dan sumber energi pakan (Halver, 1989).
Lemak dalam pakan mempunyai 2 fungsi utama yaitu sebagai sumber energi dan sumber asam lemak. Lemak juga diperlukan untuk memelihara bentuk dan fungsi fospolipid, membantu absorpsi vitamin yang larut dalam lemak dan mempertahankan daya apung (NRC, 1993). Menurut Suwirya et al. (2004), kebutuhan asam lemak esensial ikan laut sekitar 9-16 % dalam pakan dengan 2,5 % omega-3 HUFA. Lemak memegang peranan penting sebagai sumber energi dalam pakan ikan terutama ikan karnivor dimana ketersediaan karbohidrat dalam pakannya rendah.
Vitamin adalah senyawa organik yang sangat komplek, diperlukan dalam jumlah yang sangat kecil untuk pertumbuhan yang normal, reproduksi, kesehatan, dan metabolisme (Kompiang, 1996). Mineral adalah nutrien esensial untuk hewan air dan harus tersedia dalam jumlah yang cukup. Mineral digunakan untuk proses respirasi dan osmoregulasi (NRC, 1977). Hewan air dapat menyerap sebagian mineral yang dibutuhkan dari air melalui insang atau seluruh permukaan tubuh. Mineral diperlukan juga untuk mekanisme homeostasi dan pembentukan kerangka tulang (Watanabe and Cho, 1988).
2.2 Tepung Darah (Blood Meal)
Salah satu alternatif bahan subsitusi tepung ikan adalah tepung darah (Bureau et al., 1999). Diantara bahan makanan yang berasal dari hewan, tepung darah yang paling tinggi kadar proteinnya yaitu sekitar 80% dari bobot kering. Berdasarkan hasil analisa Laboatorium Nurisi Ikan kadar protein tepung darah adalah 88,45% (Lampiran 1). Tepung darah adalah sumber yang kaya leusin tapi miskin methionine dan isoleusin (Hertrampf dan Pascual, 2000). Profil asam amino tepung darah disajikan dalam Tabel 1. Kombinasi tepung darah dan tepung jagung akan membantu untuk memperkaya komposisi pakan ikan karena tepung jagung memiki kandungan lysine yang rendah dan isoleusine yang tinggi (Harris, 1980).
Tabel 1. Profil Asam amino tepung darah (Johnson and Summerfelt, 2000). Profil asam amino Komposisi (%)
Arginin 4,12 Histidin 7,32 Isoleucin 0,63 Leucin 13,61 Lysin 8,75 Methionin 0,76 Phenylalanin 6,28 Threonin 3,12 Tryptophan 1,54 Valine 9,12
316oC kemudian dimasukkan ke dalam vacum pada suhu rendah yaitu 49oC.. Produk SBC mengandung protein tinggi 92%, leusin 13,61% dan hanya mengandung 0,33% fosfor. SBC memiliki karakter yang sangat menjanjikan sebagai bahan pakan karena memiliki kecernaan protein yang tinggi yaitu 89.7% (Johnson and Summerfelt, 2000). Kemampuan cerna terhadap suatu jenis pakan bergantung pada kuantitas dan kualitas pakan, jenis bahan pakan, kandungan gizi pakan, jenis serta aktivitas enzim-enzim pencernaan pada sistem pencernaan ikan, ukuran dan umur ikan seta sifat fisik dan kimia perairan (NRC, 1993).
Produk SBC memiliki kandungan zat besi yang tinggi yaitu sebesar 2.700 mg/kg (Johnson and Summerfelt, 2000) . Kadar zat besi yang tinggi ini memungkinkan untuk pemakaian tepung darah dalam pakan sebagai sumber zat besi organik.
Tepung darah bisa diterima baik oleh kerapu bebek Cromileptes altivelis sampai pada level 9 %, tetapi hasil optimum didapatkan pada level pemakaian 6 %. Penggunaan tepung darah 6 % sebagai sumber Fe-organik pada pakan buatan kerapu bebek dapat menggantikan pemakaian sumber Fe-anorganik Ferosulfat (FeSO4.7H2O) sekaligus mengurangi penggunaan tepung ikan dalam formulasi
pakan. Pemakaian mineral organik lebih efisien dibandingkan sumber Fe-anorganik (Setiawati dkk., 2008). Fe berfungsi sebagai mikromineral penting yang mempengaruhi fungsi imunitas dan meningkatkan sistem pertahanan tubuh terhadap infeksi. Fe juga berpengaruh pada metabolisme energi (lemak, protein dan karbohidrat) (Webster dan Lim, 2002).
Konsumsi pakan dipengaruhi oleh palatabiliti pakan yang diberikan (Halver, 1989). Pemakaian tepung darah sebagai sumber zat besi akan berdampak menurunkan palatabiliti pakan kerapu sehingga akan berpengaruh pada asupan pakan secara langsung oleh ikan. Sehingga diperlukan bahan pakan tambahan yang dapat meningkatkan nafsu makan ikan (Setiawati dkk., 2008)
2.3 Atraktan
pakan harus dilengkapi dengan perangsang yang disebut atraktan untuk membuat asupan pakan ikan lebih efisien. Atraktan mengandung sinyal yang memungkinkan hewan akuatik mengenali pellet lebih baik sebagai sumber makanannya (Hertrampf dan Pascual, 2000).
Atraktan umumnya dihasilkan dari asam amino bebas. Menurut Michael (1980), keberadaan asam amino bebas mempunyai peranan penting untuk proses osmoregulasi. Peran lain dari asam amino bebas adalah sebagai komponen untuk memacu pertumbuhan, sebagai sumber energi dan sebagai bahan atraktan pada makanan (Yufera et al., 2002). Pemberian asam amino bebas campuran lebih efektif daripada asam amino tunggal. Penggunaan asam amino bebas tunggal bahkan tidak memberikan respon makan terhadap ikan. Glysin, proline, taurine dan valine memberikan respon makan yang lebih sensitif pada ikan karnivor (Houlihan et al., 2002).
Pengambilan makanan pada ikan dipengaruhi oleh bahan kimia yang terdifusi dari makanan ke dalam air dan merangsang sel kemosensori ikan. Kebiasaan makan ikan dipengaruhi oleh campuran bahan kimia yang terdapat dalam pakan sehingga sel-sel komosensori pada ikan harus dirangsang agar menimbulkan respon terhadap pakan. Kebiasaan makan pada ikan telah menunjukkan bahwa olfaktori (indra penciuman) dan gustatori (indra perasa) sensitif terhadap bahan makanan yang mirip dengan makanan mereka. Olfaktori merupakan indra jarak jauh sedangkan gustatori merupakan indra jarak dekat. Olfaktori bertugas memberikan isyarat untuk mendekati makanan sedangkan gustatori memegang peranan penting dalam keputusan menerima atau menolak makanan (Houlihan et al., 2002).
dikonsumsi ikan sea bass Dicentrarchus labrax pada pakan yang diberi taurin 0,2% adalah 210,44 gram sementara pada ikan yang tidak diberi taurin adalah 70,21 gram (Martinez et al., 2004)
III. METODOLOGI
3.1 Tempat dan Waktu Penelitian
Penelitian dilaksanakan pada bulan Juli - September 2008. Analisa proksimat dan pembuatan pakan uji dilakukan di Laboratorium Nutrisi Ikan, dan analisa kualitas air di Laboratorium Lingkungan, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor (IPB). Pengujian pakan dan pemeliharaan ikan dilaksanakan di Stasiun Lapang Pusat Studi Ilmu Kelautan Institut Pertanian Bogor (PSIK IPB) – Ancol, Jakarta Utara.
3.2 Pakan Uji
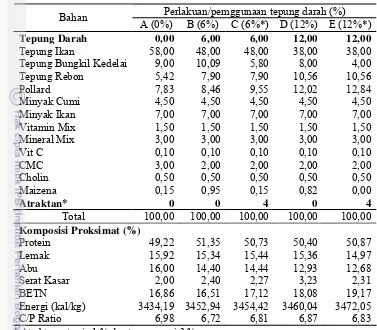
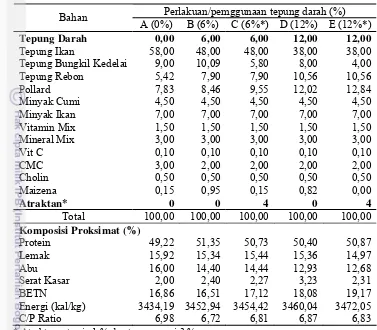
Bahan baku pakan terlebih dahulu diproksimat dengan menggunakan metode Takeuchi, 1989 (Lampiran 2) untuk mengetahui kadar air, abu, serat kasar, protein, lemak dan BETN. Formulasi pakan uji dibuat dengan kandungan nutrien yang sama dari semua pakan perlakuan yaitu protein 50,1±0,80% dan energi 3454,73±13,7kal/kg. Tepung darah bisa diterima baik oleh kerapu bebek Cromileptes altivelis sampai pada level 9 %, tetapi hasil optimum didapatkan pada level pemakaian 6 %.(Setiawati dkk., 2008). Penggunaan tepung darah sebanyak 6% dapat mengurangi penggunaan tepung ikan sebanyak 10%. Komposisi pakan uji dan hasil proksimat pakan dapat dilihat di Tabel 2. Sebagai pakan uji yaitu: 1. Pakan A : Pakan kontrol (tanpa tepung darah)
2. Pakan B : Tepung darah 6 %
3. Pakan C : Tepung darah 6 % dan atraktan 4. Pakan D : Tepung darah 12 %
5. Pakan E : Tepung darah 12 % dan atraktan
Tabel 2. Komposisi bahan pakan dan komposisi proksimat pakan uji (100 gr berat kering)
Perlakuan/pemggunaan tepung darah (%) Bahan
A (0%) B (6%) C (6%*) D (12%) E (12%*)
Tepung Darah 0,00 6,00 6,00 12,00 12,00
Tepung Ikan 58,00 48,00 48,00 38,00 38,00
Tepung Bungkil Kedelai 9,00 10,09 5,80 8,00 4,00
Tepung Rebon 5,42 7,90 7,90 10,56 10,56
Pollard 7,83 8,46 9,55 12,02 12,84
Minyak Cumi 4,50 4,50 4,50 4,50 4,50
Total 100,00 100,00 100,00 100,00 100,00
Komposisi Proksimat (%)
Protein 49,22 51,35 50,73 50,40 50,87
Lemak 15,92 15,34 15,44 15,36 14,97
Abu 16,00 14,40 14,44 12,93 12,68
Serat Kasar 2,00 2,40 2,27 3,23 2,31
BETN 16,86 16,51 17,12 18,08 19,17
Energi (kal/kg) 3434,19 3452,94 3454,42 3460,04 3472,05
C/P Ratio 6,98 6,72 6,81 6,87 6,83
* Atraktan = taurin 1 % dan tepung cumi 3 %
3.3 Pemeliharaan Hewan Uji
Ikan uji yang digunakan adalah benih kerapu bebek (Cromileptis altivelis) dengan panjang 5,46±0,09cm dan berat 1,9±0,21g. Sebelum mulai penelitian, ikan diadaptasikan terlebih dahulu terhadap lingkungan dan pakan perlakuan (pakan kontrol). Selama pemeliharaan kualitas air dijaga dengan dilakukan penyiponan dan ganti air setiap hari.
Sebagai wadah percobaan digunakan 15 akuarium berdimensi 40x60x50 cm3 dengan menggunakan resirkulasi yang dilengkapi dengan tandon penampungan air dan tandon filter. Akuarium yang digunakan berisi 70 liter air yang dilengkapi dengan aerasi dan sistem air mengalir dengan pergantian air pada debit 1 liter/menit.
dilakukan pengukuran panjang dan berat. Ikan dimasukan ke dalam akuarium dengan kepadatan 10 ekor/70 liter air. Ikan diberi makan 3 kali sehari secara at satiation pada pukul 07.00, 12.00 dan 17.00 WIB.
3.4 Pengamatan Harian
Masa pemeliharaan berlangsung selama 40 hari dan dilakukan pengamatan harian berupa konsumsi pakan, mortalitas, respon makan, suhu dan salinitas. Sedangkan untuk analisa kualitas air seperti DO (Disolve Oksigen), NH3, dan
alkalinitas dilakukan pada awal, tengah dan akhir selama masa penelitian.
3.5 Kecernaan
Uji kecernaan pakan berlangsung selama 40 hari, kegiatan pengumpulan feses ikan dimulai pada hari ke-4 setelah pemberian pakan uji. Sebagai marker digunakan zat indikator Chromium oxide (Cr2O3) sebanyak 0,6 % pada saat
pembuatan pakan. Untuk uji kecernaan bahan (tepung darah) dibuat dua jenis pakan, yaitu pakan uji tanpa tepung darah (digunakan pakan perlakuan A) dan pakan acuan yang terdiri dari campuran 30 % pakan uji (pakan perlakuan A) dan 70 % tepung darah.
3.6Analisis Statistik
Penelitian menggunakan Rancangan Acak Lengkap (RAL) dengan lima perlakuan dan masing-masing perlakuan terdiri dari tiga kali ulangan. Perbedaan antar perlakuan dapat diketahui melalui hasil pengujian menggunakan Anova dan dilanjutkan dengan uji Duncan.
3.6.1 Konsumsi Pakan (KP)
Konsumsi pakan dihitung dengan cara menimbang total pakan yang dikonsumsi ikan selama perlakuan pemberian pakan.
3.6.2 Laju Pertumbuhan Harian
Sampling dilakukan pada awal dan akhir penelitian. Laju pertumbuhan harian dihitung berdasarkan persamaan (NRC, 1993) :
Laju pertumbuhan harian (%) 1 x100%
W0 = bobot rata-rata individu pada waktu awal (gram)
t = waktu pemeliharaan (hari)
3.6.3 Pertumbuhan Panjang Relatif
Sampling dilakukan pada awal dan akhir penelitian. Pertumbuhan relatif dihitung berdasarkan persamaan (Effendi, 1978)
Pertumbuhan panjang relatif (%)
(
)
x100%Lo
Nilai efisiensi makanan menunjukkan kualitas makanan yang diberikan dan dapat dihitung berdasarkan persamaan ( NRC, 1993) sebagai berikut:
(
)
3.6.5 Retensi Protein (RP)
Retensi protein ditentukan dengan membandingkan jumlah protein yang disimpan dalam tubuh ikan dengan jumlah protein yang dikonsumsi oleh ikan. Retensi protein dirumuskan dengan (Takeuchi, 1988):
(
)
F = kandungan protein tubuh pada akhir penelitian (gram) I = kandungan protein tubuh pada awal penelitian (gram) P = jumlah protein yang dimakan ikan (gram)
3.6.6 Retensi Lemak (RL)
Retensi lemak ditentukan dengan membandingkan jumlah lemak yang disimpan dalam tubuh ikan dengan jumlah lemak yang dikonsumsi oleh ikan. Retensi lemak dirumuskan dengan (Takeuchi, 1988):
(
)
J = kandungan lemak tubuh pada akhir penelitian (gram) K = kandungan lemak tubuh pada awal penelitian (gram) P = jumlah lemak yang dimakan ikan (gram)
3.6.7 Tingkat Kelangsungan Hidup (KH)
Tingkat kelangsungan hidup adalah perbandingan jumlah ikan yang hidup pada akhir penelitian terhadap jumlah ikan pada awal penelitian. Tingkat kelangsungan hidup dihitung dengan rumus (NRC, 1993):
3.6.8 Koofisien Kecernaan (apparent digestibility cooficient)
Kualitas bahan pakan/pakan ikan dapat diukur melalui kecernaannya. Pengukuran pencernaan bahan pakan/pakan ikan dilakukan dengan menggunakan zat indikator berupa Cr2O3 pada pakan acuan dan pakan uji. Berikut ini adalah
langkah-langkah mengujian kecernaan: A. Kecernaan Bahan Kering.
Nilai kecernaan bahan bisa diketahui dari nilai kecernaan pakan uji dan pakan acuan. Nilai kecernaan pakan acuan (ADR) dan pakan uji (ADT) dihitung berdasarkan modifikasi persamaan (Takeuchi, 1988);
Kecernaan pakan ( % ) = ( − )×100 ADR = kecernaan pakan acuan
B. Kecernaan Protein Tepung Darah
Koofisien kecernaan protein pakan (ADC) = [1- (a/a’ x b’/b)] x 100% Keterangan
a = % indikator khromium dalam pakan a’ = % indikator khromium dalam feses b = % protein dalam pakan
0,00
Kontrol Tepung darah 6% Tepung darah 6% ditambah atraktan Tepung darah 12% Tepung darah 12% ditambah atraktan
IV. HASIL DAN PEMBAHASAN
4.1 Hasil
4.1.1 Kinerja Pertumbuhan
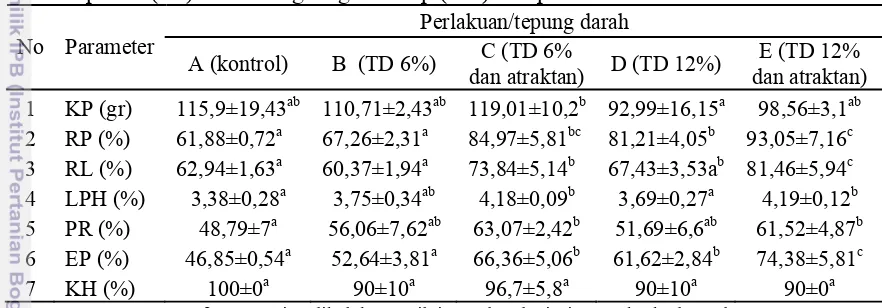
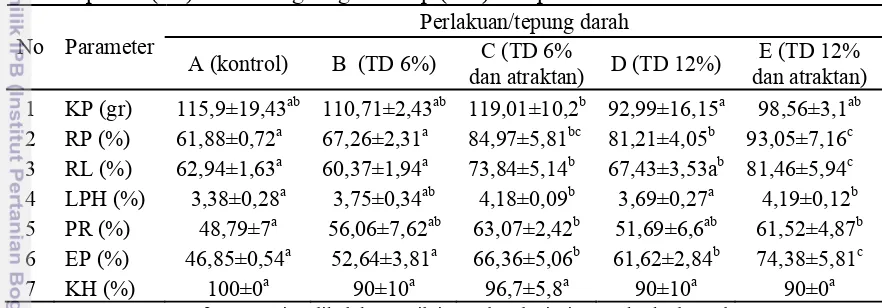
Hasil yang diperoleh setelah pemberian pakan buatan dengan pemakaian tepung darah dan atraktan terhadap kinerja pertumbuhan kerapu bebek selama 40 hari disajikan pada Tabel 3.
Tabel 3. Konsumsi pakan (KP), retensi protein (RP), retensi lemak (RL), laju pertumbuhan harian (LPH), pertumbuhan panjang relatif (PR), efisiensi pakan (EP) dan kelangsungan hidup (KH) kerapu bebek.
Perlakuan/tepung darah 1 KP (gr) 115,9±19,43ab 110,71±2,43ab 119,01±10,2b 92,99±16,15a 98,56±3,1ab 2 RP (%) 61,88±0,72a 67,26±2,31a 84,97±5,81bc 81,21±4,05b 93,05±7,16c
Ket : Huruf superscript dibelakang nilai standar deviasi yang berbeda pada baris yang sama menunjukkan pengaruh perlakuan yang berbeda nyata (P≤0,05) pada selang kepercayaan 95 %.
Gambar 1 menunjukkan pertambahan bobot ikan kerapu bebek pada tiap perlakuan selama 40 hari.
Gambar 1. Pertambahan bobot ikan kerapu bebek pada tiap perlakuan selama 40 hari.
0,00
Pemberian pakan perlakuan pada ikan kerapu memberikan pengaruh yang berbeda nyata (p≤0,05) terhadap konsumsi pakan (KP), laju pertumbuhan harian (LPH), pertumbuhan panjang relatif (PR), efisiensi pakan (EP), retensi protein (RP) dan retensi lemak (RL). Sedangkan untuk parameter kelangsungan hidup (KH) tidak berbeda nyata antar perlakuan. Data selengkapnya terdapat pada Lampiran 3. Nilai konsumsi pakan tertinggi terdapat pada perlakuan tepung darah 6% ditambah atraktan yaitu 119,01±10,2g dan terendah pada perlakuan tepung darah 12% tanpa atraktan yaitu 98,56±3,1g. Untuk nilai retensi protein dan retensi lemak tertinggi terdapat pada perlakuan tepung darah 12% ditambah atraktan yaitu 93,05±7,16% dan 81,46±5,94%, sedangkan terendah terdapat pada perlakuan kontrol yaitu 61,88±0,72% dan 62,94±1,63%. Laju pertumbuhan harian tertinggi terdapat pada perlakuan tepung darah 12% ditambah atraktan dan tepung darah 6% ditambah atraktan yaitu 4,18-4,19% dan terendah pada perlakuan kontrol yaitu 3,38±0,28%. Pertumbuhan panjang relatif tertinggi terdapat pada perlakuan tepung darah 6% ditambah atraktan dan tepung darah 12% ditambah atraktan yaitu 61,52-63,07% dan terendah pada perlakuan kontrol yaitu 48,79±7%. Efisiensi pakan tetinggi terdapat pada perlakuan tepung darah 12% ditambah atraktan yaitu 74,38±5,81% dan terendah pada perlakuan kontrol yaitu 46,85±0,54%.
4.1.2 Kecernaan
Pengukuran kecernaan pada pakan ikan kerapu menggunakan zat indikator Chromium oxide (Cr2O3) sebanyak 0,6 % sebagai marker. Pengukuran
kecernaan protein dan kecernaan total pada pakan ikan kerapu disajikan pada Tabel 4.
Tabel 4. Kecernaan protein dan kecernaan total pakan
Perlakuan Kecernaan protein (%) Kecernaan total (%)
A (pakan kontrol) 98,54 55,06
C (tepung darah 6% + atraktan) 98,79 62,06
Nilai kecernaan tepung darah dengan kadar protein 88,48% adalah 81,36%.
Pada perlakuan tepung darah 12% ditambah atraktan menunjukkan nilai kecernaan protein dan kecernaan total tertinggi dengan nilai kecernaan 98,92% dan 65,75%. Sedangkan untuk nilai kecernaan protein dan kecernaan total terendah terdapat pada perlakuan kontrol dengan niali kecernaan 98,54% dan 55,06%. Data selengkapnya terdapat pada Lampiran 4.
4.2 Pembahasan
Tepung darah merupakan sumber protein alternatif pengganti sumber protein dari tepung ikan. Tepung darah merupakan bahan makanan yang berasal dari hewan dengan kadar proteinnya paling tinggi yaitu sekitar 80% dari bobot kering (Hertrampf dan Pascual, 2000). Hasil analisa proksimat di laboratorium nutrisi ikan menunjukkan bahwa kadar protein tepung darah jenis SBC sebesar 88,48% (Lampiran 1).
pernyataan Martinez et al (2004), bahwa penggunaan taurin dalam pakan dapat meningkatkan konsumsi pakan.
Tepung darah jenis SBC memiliki kecernaan yang tinggi yaitu 81,36%. Kecernaan protein menunjukkan sejumlah protein pakan yang tercerna dalam tubuh. Tingginya nilai kecernaan protein menunjukkan semakin banyaknya protein yang dicerna oleh saluran pencernaan ikan yang selanjutnya akan diserap dan dimanfaatkan untuk pertumbuhan ikan. Nilai kecernaan protein pakan tertinggi terdapat pada perlakuan tepung darah 12% ditambah atraktan sehingga menghasilkan nilai retensi protein yang tinggi. Kecernaan total mengindikasikan total kecernaan nutrien sebagai sumber energi (protein, lemak, karbohidrat). Nilai kecernaan total tertinggi terdapat pada pakan perlakuan tepung darah 12% ditambah atraktan, sedangkan nilai kecernaan pakan terendah terdapat pada pakan perlakuan kontrol. Kemampuan cerna terhadap suatu jenis pakan bergantung pada kuantitas dan kualitas pakan, jenis bahan pakan, kandungan gizi pakan, jenis serta aktivitas enzim-enzim pencernaan pada sistem pencernaan ikan, ukuran dan umur ikan serta sifat fisik dan kimia perairan (NRC, 1993). Pada setiap pakan perlakuan yang membedakan adalah kuantitas pakan yang dikonsumsi ikan dan jenis bahan pakan sehingga nilai kecernaan dari tiap pakan perlakuan berbeda. Tepung darah jenis SBC memiliki nilai kecernaan yang tinggi sehingga pakan dengan bahan baku tepung darah memiliki nilai kecernaan pakan yang tinggi.
Retensi protein adalah persentase protein yang disimpan dalam tubuh. Nilai retensi protein pada perlakuan kontrol, tepung darah 6% dan tepung darah 12% adalah 61.88%, 67.26% dan 81.21%. Hal tersebut menunjukkan bahwa peningkatan tepung darah sampai level 12% dapat meningkatkan retensi protein. Nilai retensi protein pada perlakuan kontrol menunjukkan hasil yang berbeda nyata terhadap perlakuan tepung darah 6% ditambah atraktan dan tepung darah 12% ditambah atraktan. Tepung darah memiliki nilai kecernaan protein yang tinggi. Jika nilai kecernaan protein tinggi maka protein pakan yang diserap oleh tubuh ikan juga semakin tinggi sehingga nilai retensi protein akan tinggi. Nilai kecernaan protein yang tinggi akan meningkatkan nilai retensi protein
12% yaitu 62.94%, 60.37% dan 67.43%. Nilai retensi lemak tertinggi terdapat pada perlakuan tepung darah 12% (Tabel 3). Dengan tingginya nilai retensi lemak, kandungan lemak yang disimpan dalam tubuh ikan tinggi. Lemak diperlukan untuk pembentukan berbagai penyusun membran sel dan sebagai pelarut beberapa vitamin (NRC, 1993). Nilai retensi lemak pada perlakuan kontrol memberikan hasil yang berbeda nyata terhadap perlakuan tepung darah 6% ditambah atraktan dan tepung darah 12% ditambah atraktan. Nilai retensi lemak pada perlakuan tepung darah 12% ditambah atraktan menunjukan nilai yang paling tinggi sebesar 81,46%. Hal tersebut berarti ikan kerapu memanfaatkan karbohidrat sebagai energi (protein sparing effect). Berdasarkan hasil proksimat pakan (tabel 2), kadar karbohidrat pada pakan perlakuan tepung darah 12% ditambah atraktan lebih tinggi dibanding pakan perlakuan lainnya. Pemanfaatan karbohidrat pada pakan perlakuan tepung darah 12% ditambah atraktan lebih tinggi sehingga protein dan lemak yang diretensi oleh tubuh ikan akan lebih tinggi.
kinerja pertumbuhan ikan. Hal ini sesuai dengan pernyataan Yufera et al (2002), bahwa asam amino bebas sebagai komponen untuk memacu pertumbuhan dan sebagai sumber energi.
Efisiensi pakan adalah nilai (%) makanan yang dapat dimanfaatkan oleh tubuh. Nilai efisiensi menunjukkan kualitas pakan buatan yang diberikan pada ikan. Semakin tinggi nilai efisiensinya maka semakin bagus kualitas pakannya. Nilai efisiensi pakan pada perlakuan kontrol, tepung darah 6% dan tepung darah 12% yaitu 46.85%, 52.64% dan 61.62%. Peningkatan level darah sampai 12% ternyata dapat meingkatkan nilai efisiensi pakan. Nilai efisiensi pakan pada perlakuan kontrol memberikan hasil yang berbeda nyata terhadap perlakuan tepung darah 6% ditambah atraktan dan tepung darah 12% ditambah atraktan. Nilai efisiensi pakan pada perlakuan kontrol, tepung darah 6 ditambah atraktan dan tepung darah 12% ditambah atraktan adalah 46.85%, 66.36% dan 74.38%. Tingginya nilai efisiensi makanan karena jumlah konsumsi pakan lebih rendah tetapi menghasilkan pertumbuhan yang lebih tinggi.
Kelangsungan hidup merupakan peluang hidup suatu individu. Kelangsungan hidup pada setiap perlakuan tidak menunjukkan hasil yang berbeda nyata. Hal tersebut menunjukkan bahwa pemakaian tepung darah sampai level 12% tidak mempengaruhi kelangsungan hidup ikan. Selain pakan yang berkualitas, kondisi lingkungan dari ikan kerapu harus berada dalam kisaran yang optimum. Kualitas air yang berperan terhadap kelangsungan hidup pada ikan kerapu meliputi suhu air, oksigen terlarut, salinitas, pH air dan amonia. Suhu air pada pemeliharaan ikan kerapu selama 40 hari adalah 29,5-30 oC, nilai oksigen terlarut 8-8,7mg/L, salinitas 30-32ppt, pH air 7,62-8,5 dan amonia 0,0065-0,178ppm. Data kualitas air terdapat pada Lampiran 5. Kualitas air tersebut sudah masuk dalam kisaran kualitas air yang optimum untuk ikan kerapu.
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Penggunaan tepung darah dapat ditingkatkan sampai level 12% jika ditambahkan atraktan karena memberikan hasil terbaik terhadap kinerja pertumbuhan ikan kerapu dan efisiensi pakan sebesar 74.38%.
5.2 Saran
DAFTAR PUSTAKA
Boonyaratpalin, M.1997. Nutrisional Requirements of Marine Food Fish Cultured in South East Asia. Aquaculture 151, 283-313
Bureau, D. P. , A. M. Harris, C. Y. Cho. 1999. Apparent digestibility of rendered animal protein ingredients for rainbow trout (Oncorhynchus mykiss). Aquaculture, 180 : 345-358
Cullison, A.G. 1979. Feeds and Feeding, 2nd Edition. Reston Publishing Co., Reston, VA, 595 pp
Direktorat Jendral Perikanan Budidaya. 2001. Pembesaran Kerapu Macan Epinephelus fuscoguttatus dan Kerapu Tikus Cromileptes altivelis di Keramba Jaring Apung. Balai Budidaya Laut. Lampung
Effendi, M.I. 1978. Dinamika populasi ikan, hal 1-20. Dalam Biologi perikanan, bagian 2. Faperikan-IPB
Furuici, M. 1988. Fish nurition, p. 3-77. In Fish nutrition and mariculture. T. Watanabe (ed). Kanagawa International Fisheries Training Centre. JICA.
Giri, N. A.1998. Aspek nutrisi dalam menunjang pembenihan ikan kerapu. Seminar teknologi perikanan pantai. Hotel Sahid Raya Denpasar, 6-7 Agustus 1998. Loka penelitian perikanan pantai bekerjasama dengan JICA (ATA-379).
Halver, J. E. 1989. Fish Nutrision. Second Edition. Academic Press Inc. New York. 789 pp.
Harris, L. E. 1980. Feedstuffs. In: T. V. R. Pillary (Editor), Fish Feed Technology. Lectures Presented at The FAO/UNDIP Training Course in Fish Feed Technology , College of Fisheries, University of Washington, Seattle, WA, 9 October-15 December,1978, pp. 111-170
Hertrampf, J.W., dan Pascual, F.P., 2000. Handbook on Ingredients for Aquaculture Feeds. Kluwer Academic Publishers, London, 573 pp.
Houlihan, D., Boujard, T., and Jobling, M. 2002. Food Intake in Fish. University of Tromso. Norway.
Kompiang, I. P. 1996. Penyiapan Rencana Pengembangan Teknologi Nutrisi. Makalah disampaikan Pada Pelatihan Rekayasa Tenologi Budidaya Perikanan, 18 Desember s/d 16 Januari 1996, di Balai Budidaya Air Payau, Jepara. 11 Hal
Martinez JB, Chatzfotis S, Divanach P and Takeuchi T. 2004. Effect of Dietary Taurine Supplementation on Growth Performance and Feed
Selection of Sea Bass Dicentrarchus labrax Fry Feed Selection With Demand-Feeder. Fish Sci 70:74-79
Michael, BN.1980. The Diet of Prawn.
http://www.FAO.org/dorcep/field/003/AB915E/AB915E00.htm.
National Research Council. 1977. Nutrient requirements of Warmwater Fishes. National Academy of Sci., Washington,D.C.125 p
---. 1993. Nutrient requirements of fish. National Academic Press. Washington D. C. 115 pp.
Park GS, Takeuchi T, Yokohama M, Seikai T. 2002. Optimal Dietary Taurine Level for Growth of Juvenil Japanese Flounder Paralichthys Olivaceaus. Fish Sci 68: 824-829.
Setiawati, M., P. Purnama dan I. Mokoginta. 2008. Penggunaan Tepung Darah Sebagai Substitusi Tepung Ikan Pada Pakan Kerapu Bebek Cromileptes altivelis. Jurnal Akuakultur (belum dipublikasi)
---. 2008. Penggunaan Tepung Darah Sebagai Sumber Zat Besi Organik dalam Pakan Kerapu Bebek Cromileptes altivelis. Makalah Poster. Simposium Bioteknologi Akuakultur. Bogor 14 Agustus 2008
Suwirya, K., N. A Giri and M. Marzuki. 2004. Effect of Dietary n-3 HUFA on Growth of Humpback Grouper Cromileptes altivelis and Tiger Grouper Epinephelus fuscoguttatus Juvenils. Advances in Grouper Aquaculture. ACIAR Moograph. 110.
Takeuchi, T. 1988. Laboratory work chemical evaluation of dietary nutrients, p. 179-225. In Fish nutrition and mariculture. T. Watanabe (ed). Kanagawa International Fisheries Training Centre. JICA.
Watanabe, T., and C. Y. Cho. 1988. Nutritional energetics, p. 72-92. In Fish Nutrition and marine culture. T. Watanabe (ed). Kanagawa International Fisheries Training Centre. JICA.
Wikipedia. 2006. Taurine Information. http://en.wikipedia.org/wiki/taurine
Lampiran 1. Komposisi proksimat bahan penyusun pakan (% bobot kering)
Berat kering (%)
Bahan Protein Lemak Abu Serat kasar BETN
Tepung Darah 88,48 0,97 3,63 2,89 4,03
Tepung Ikan 68,81 9,72 18,14 1,00 2,34
Tepung Bungkil Kedelai 48,69 2,17 6,76 9,18 33,20
Tepung Terigu 10,82 2,05 0,50 0,49 86,14
Tepung pollard 15,97 6,47 4,49 7,57 65,51
Tepung cumi 57,97 4,33 17,45 0,24 20,02
Tepung rebon 73,71 6,68 6,75 5,22 7,64
Lampiran 2. Prosedur Analisis Proksimat (Takeuchi, 1988) A. Kadar Protein
Tahap Oksidasi
1. Sampel ditimbang sebanyak 0.5 gram dan dimasukkan ke dalam labu Kjeldahl.
2. Katalis (K2SO4+CuSo4.5H2O) dengan rasio 9:1 ditimbang sebanyak 3
gram dan dimasukkan ke dalam labu Kjeldahl.
3. 10 ml H2SO4 pekat ditambahkan ke dalam labu Kjeldahl dan kemudian
labu tersebut dipanaskan dalam rak oksidasi/digestion pada suhu 400oC selama 3-4 jam sampai terjadi perubahan warna cairan dalam labu menjadi hijau bening.
4. Larutan didinginkan lalu ditambahkan air destilasi 100 ml. Kemudian larutan dimasukkan ke dalam labu takar dan diencerkan dengan akuades sampai volume larutan mencapai 100 ml. Larutan sampel siap didestilasi.
Tahap Destilasi
1. Beberapa tetes H2SO4 dimsukkan ke dalam labu, sebelumnya labu diisi
setengahnya dengan akuades untuk menghindari kontaminasi oleh ammonia lingkungan. Kemudian didihkan selama 10 menit.
2. Erlenmeyer diisi 10 ml H2SO4 0.05 N dan ditambahkan 2 tetes indicator
Lanjutan Lampiran 2.
3. 5 ml larutan sampel dimasukkan ke dalam tabung destilasi melalui corong yang kemudian dibilas dengan akuades dan ditambahkan 10 ml NaOH 30% lalu dimasukkan melalui corong tersebut dan ditutup.
4. Campuran alkaline dalam labu destilasi disuling menjadi uap air selama 10 menit terjadi pengembunan pada kondensor.
5. Labu erlenmeyer diturunkan hingga ujung pipa kondensor berada di leher labu, diatas permukaan larutan. Kondensor dibilas dengan akuades selama 1-2 menit.
Tahap Titrasi
1. Larutan hasil destilasi ditritasi dengan larutan NaOH 0.05 N. 2. Volume hasil titrasi dicatat.
3. Prosedur yang sama juga dilakukan pada blanko.
Kadar Protein (%) = 0.0007 * x (Vb – Vs) x 6.25 ** x 20 x 100% S
Keterangan : Vb = Volume hasil titrasi blanko (ml) Vs = Volume hasil titrasi sampel (ml)
S = Bobot sampel (gram)
* = Setiap ml 0.05 NaOH ekivalen dengan 0.0007 gram Nitrogen ** = Faktor Nitrogen
B. Kadar Lemak
Metode ekstraksi Soxhlet
1. Labu ekstraksi dipanaskan dalam oven pada suhu 110o dalam waktu 1 jam. Kemudian didiinginkan dalam desikator selama 30 menit dan ditimbang bobot labu tersebut (X1)
2. Sampel ditimbang sebanyak 3-5 gram (A), dan dimasukkan ke dalam selongsong tabung filter dan dimasukkan ke dalam soxhlet dan pemberat diletakkan di atasnya.
Lanjutan Lampiran 2.
4. Labu yang telah dihubungkan dengan soxhlet dipanaskan di atas water bath sampai cairan yang merendam sampel dalam soxhlet berwarna bening.
5. Labu dilepaskan dan tetap dipanaskan hingga N-hexan menguap.
6. Labu dan lemak yang tersisa dipanakan dalam oven selama 15-60 menit, kemudian didinginkan dalam desikator selama 15-30 menit dan ditimbang (X2)
Metode Folch
1. Labu silinder dioven terlebih dahulu pada suhu 110oC selama 1 jam, didinginkan dalam desikaotr selama 30 menit kemudian ditimbang (X1).
2. Sampel ditimbang sebanyak 2-3 gram (A) dan dimasukkan ke dalam gelas homogenize dan ditambahkan larutan kloroform / methanol (20xA) , sebagian disisakan untuk membilas pada saat penyaringan.
3. Sampel dihomogenizer selama 5 menit setelah itu disraing dengan vacuum pump.
4. Sampel yang telah disaring tersebut dimasukkan dalamlabu pemisah yang telah diberi larutan MgCl2 0.03 N(0.2xC), kemudian dikocok dengan kuat
minimal selama 1 menit kemudian ditutup dengan aluminium foil dan didiamkan selama 1 malam.
5. Lapisan bawa yang terdapat dalam labu pemisah disaring ke dalam labu silinder kemudian dievaporator sampai kering. Sisa kloroform / methanol yang terdpat dalam labu ditiup dengan menggunakan vacuum setelah itu ditimbang (X2)
Kadar Lemak (%) = X2 –X1 x 100%
A
C. Kadar Air
1. Cawan dipanaskan dalam oven pada suhu 100oC selama 1 jam dan kemudian dimasukkan dalam dessikator selama 30 menit dan ditimbang (X1)
Lanjutan Lampiran 2.
3. Cawan dan bahan dipansakan dalam oven pada suhu 110oC selama 4 jam kemudian dimasukkan dalam desikator selam 30 menit dan ditimbang (X2)
Kadar Air (%) = (X1+A)-X2 x 100%
A D. Kadar Abu
1. Cawan dipanaskan dalam oven pada suhu 100oC selama 1 jam dan kemudian dimasukkan dalam dessikator selama 30 menit dan ditimbang (X1)
2. Bahan ditimbang 2-3 gram (A)
3. Cawan dan bahan dipansakan dalam tanur pada suhu 600oC sampai mnejadi abu kemudian dimasukkan dalam desikator selam 30 menit dan ditimbang (X2)
Kadar Abu (%) = X2 –X1 x 100%
E. Kadar Serat Kasar
1. Kertas filter dipanaskan dalam oven selama 1 jam pada suhu 110oC setelah itu didinginkan dalam desikator selama 15 menit dan ditimbang (X1)
2. Sampel ditimbang sebnayak 0.5 gram (A) dimasukkan kedalam Erlenmeyer 250 ml
3. H2SO4 0.3 N sebanyak 50 ml ditambahkan ke dalam Erlenmeyer
kemudian dipanaskan di atas pembakar Bunsen selama 30 menit. Setelah itu NaOH 1.5 N sebanyak 25 ml ditambahkan ke dalam Erlenmeyer dan dipanskan kembali selama 30 menit.
4. Larutan dan bahan yang telah dipanaskan kemudian disraing dalam corong Buchner dan dihubungkan pada vacuum pump untuk mempercepat filtrasi. 5. Larutan dan bahan yang ada pada corong Buchner kemudaian dibilas
secara berturut-turut dengan 50 ml air panas, 50 ml H2SO4 0.3 N, 50 ml air
panas, dan 25 ml acetone.
Lanjutan Lampiran 2.
7. Setelah itu dipanaskan dalam tanur 600oC hingga berwarna putih atau menjadi abu (± 4 jam). Kemudian dimasukkan dalam oven 105-110oC selama 15 menit, didinginkan dalam desikator selama 5-15 menit dan ditimabang (X3)
Kadar Serat Kasar (%) = (X2 – X1 – X3) x 100%
A
F. Prosedur Determinasi Chromium oxide (Furukawa dan Tsukahara, 1966) 1. 0.1 – 0.2 gr sampel berisi Cr2O3 kedalam labu Kjehdahl,
2. Ditambahkan 5 ml HNO3 (p) dan ditempatkan dalam rak digestion dalam ruang asam,
3. Pemanasan selama 30 menit, kemudian didinginkan. 4. Ditambahkan 3 ml perchloric acid 70 % (pa),
5. Dipanaskan sampai warna berubah menjadi kuning dan asap putih menguap, tambahkan waktu pemanasan selama ± 10 menit.
Lampiran 3. Analisa statistika 1. Konsumsi pakan
Perlakuan Konsumsi pakan (gram)
Kontrol 115,90
Subset for alpha = .05
TRIAL N 1 2
tepung darah 12% 3 92,9900 tepung darah 12%
+ atraktan 3 98,5600 98,5600
tepung darah 6% 3 110,7133 110,7133
kontrol 3 115,9000 115,9000
tepung darah 6%
+ atraktan 3 119,0133
Sig. ,059 ,087
Means for groups in homogeneous subsets are displayed. a Uses Harmonic Mean Sample Size = 3,000.
2. Retensi Protein
Perlakuan . Retensi protein (%)
Kontrol 61,88
1980,753 4 495,188 23,097 ,000
214,396 10 21,440
Lanjutan Lampiran 3
Subset for alpha = .05
Means for groups in homogeneous subsets are displayed. Uses Harmonic Mean Sample Size = 3,000.
a.
3. Retensi Lemak
Perlakuan . Retensi lemak (%)
Kontrol 62,94 Between Groups 876,175 4 219,044 13,596 ,000
Within Groups 161,105 10 16,110
Lanjutan Lampiran 3
Subset for alpha = .05
Means for groups in homogeneous subsets are displayed. Uses Harmonic Mean Sample Size = 3,000.
a.
4. Laju pertumbuhan harian
Perlakuan Laju pertumbuhan harian
Lanjutan Lampiran 3
Subset for alpha = .05
Means for groups in homogeneous subsets are displayed. Uses Harmonic Mean Sample Size = 3,000.
a.
5. Pertumbuhan relative
Perlakuan Pertumbuhan Relatif
Lanjutan Lampiran 3
Subset for alpha = .05
Means for groups in homogeneous subsets are displayed. Uses Harmonic Mean Sample Size = 3,000.
a.
6. Efisiensi Pakan
Perlakuan Efisiensi pakan
Kontrol 46,85
Groups 1428.883 4 357.221 21.721 .000
Within Groups 164.461 10 16.446
Lanjutan Lampiran 3
Subset for alpha = .05
Means for groups in homogeneous subsets are displayed. Uses Harmonic Mean Sample Size = 3,000.
a.
7. Survival rate
Lampiran 4. Kadar protein dan Cr2O3 dalam pakan dan feses uji kecernaan
Lampiran 5. Parameter kualitas air (suhu, salinitas, pH, DO, TAN dan alkalinitas)
Perlakuan Parameter
A B C D E
Suhu (oC) 29.5-29.75 29.5-29.75 29.5-30 29.5-29.75 29.5-29.75
Salinitas 30-32 30-32 30-32 30-32 30-32
pH 7.62-8.37 7.64-8.42 7.62-8.39 7.63-8.5 7.65-8.4
DO 8.26-8.7 8.26-8.7 8-8.26 8.26-8.5 8.26-8.5
NH3 0,0065-0,087 0,0069-0,108 0,0065-0,083 0,0067-0,122 0,007-0,178 Alkalinitas 50.54-108.86 46.65-108.86 50.54-108.86 50.54-108.86 46.65-108.86
Lampiran 6. Komposisi proksimat ikan
berat kering (%) Perlakuan
kadar air
(%) Abu Protein Lemak
Lampiran 7. Rata-rata bobot dan panjang ikan kerapu
Bobot (gram) Panjang (cm)
Perlakuan
Awal Akhir Awal Akhir
1.90±0.22 6.38±2.11 5.5±0 7.79±0.95 1.97±0.26 8.18±1.59 5.5±0.1 8.56±0.55 A
(kontrol)
1.95±0.17 7.56±2.03 5.47±0.12 8.15±0.67 1.86±0.2 9.19±1.21 5.33±0.06 8.71±0.38 1.94±0.27 8.54±1.64 5.43±0.12 8.51±0.55 B
(Tepung darah 6%)
1.85±0.22 6.92±1.68 5.43±0.06 8.05±0.68 1.9±0.26 9.56±1.91 5.47±0.06 8.84±0.67 1.99±0.3 10.65±1.07 5.53±0.15 9.18±0.37 C
(tepung darah
6%+atraktan) 1.94±0.19 9.85±1.64 5.5±0 8.89±0.5 1.86±0.14 7.09±2.01 5.47±0.06 7.9±0.7 1.92±0.25 8.92±1.11 5.5±0 8.66±0.45 D
(tepung darah 12%)
1.93±0.19 8.52±1.23 5.53±0.15 8.47±0.51 1.83±0.14 9.62±1.32 5.43±0.06 8.89±0.4 1.84±0.18 9.9±2.06 5.37±0.06 8.86±0.52 E
(tepung darah
12%+atraktan) 1.86±0.2 9.14±3.12 5.5±0 8.58±1.16
Lampiran 8. Konsumsi pakan kerapu
Perlakuan Konsumsi pakan (gram) rata-rata
Lampiran 9. Kelangsungan hidup ikan kerapu
Lampiran 10. Retensi Protein
Lampiran 11. Retensi Lemak
15.19 2.09 11.87 64.36
21.34 2.17 15.22 61.16
A
18.84 2.15 14.07 63.29
62.94±1.53
16.59 2.09 12.39 62.07
17.34 2.13 12.67 60.79
B
17.03 2.10 12.02 58.26
60.37±1.94
17.67 2.15 15.82 77.40
17.28 2.18 15.35 76.18
C
20.18 2.13 15.85 67.95
73.84±5.14
11.75 2.13 10.45 70.78
14.38 2.11 11.28 63.74
D
16.71 2.13 13.45 67.77
67.43±3.53
14.39 2.12 14.30 84.59
14.59 2.10 14.52 85.17
E
15.28 2.15 13.55 74.61
81.46±5.94
PENGARUH ATRAKTAN UNTUK MENINGKATKAN PENGGUNAAN TEPUNG DARAH PADA PAKAN IKAN
KERAPU BEBEK Cromileptes altivelis
SITI SARAH HALIMATUSADIAH
DEPARTEMEN BUDIDAYA PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
RINGKASAN
SITI SARAH HALIMATUSADIAH. Pengaruh Atraktan Untuk Meningkatkan Penggunaan Tepung Darah Pada Pakan Ikan Kerapu Bebek Cromileptes altivelis.
Dibimbing oleh MIA SETIAWATI dan NUR BAMBANG PRIYO UTOMO.
Tepung darah merupakan sumber protein alternatif sebagai pengganti sumber protein dari tepung ikan. Tepung darah mempunyai protein tinggi 92%, leucin 13,61%, fosfor 0,33% dan kandungan besi (Fe) yang tinggi sampai 2.700 mg/kg dalam bahan kering. Namun tepung darah tidak memiliki palatabiliti sehingga penggunaan tepung darah dalam formulasi pakan dapat mengurangi nafsu makan ikan. Untuk itu diperlukan bahan pakan tambahan yang dapat meningkatkan nafsu makan ikan yaitu berupa atraktan. Atraktan yang digunakan dalam penelitian ini adalah taurin dan tepung cumi. Penelitian ini bertujuan untuk mengetahui pengaruh pemberian atraktan (taurin dan tepung cumi) untuk meningkatkan pemanfaatan tepung darah dalam pakan buatan terhadap kinerja pertumbuhan ikan kerapu bebek Cromileptes altivelis.
Penelitian dilaksanakan pada bulan Juli - September 2008. Formulasi pakan uji dibuat dengan kandungan nutrien yang sama dari semua pakan perlakuan yaitu protein 50,1±0,80% dan energi 3454,73±13,7kal/kg. Sebagai pakan uji yaitu: pakan A (tanpa tepung darah), pakan B (tepung darah 6 %), pakan C (tepung darah 6 % dan atraktan), pakan D (tepung darah 12 %) dan pakan E (tepung darah 12% dan atraktan). Atraktan terdiri dari taurin 1 % dan tepung cumi 3 %. Ikan uji yang digunakan adalah benih kerapu bebek Cromileptis altivelis dengan panjang 5,46±0,09cm dan berat 1,9±0,21g. Wadah percobaan adalah 15 buah akuarium berdimensi 40x60x50 cm dengan menggunakan sistem resirkulasi. Ikan dimasukan ke dalam akuarium dengan kepadatan 10 ekor/70 liter air. Ikan diberi makan 3 kali sehari secara at satiation pada pukul 07.00, 12.00 dan 17.00 WIB. Penelitian menggunakan Rancangan Acak Lengkap (RAL) dengan lima perlakuan dan masing-masing perlakuan terdiri dari tiga kali ulangan. Perbedaan antar perlakuan dapat diketahui melalui hasil pengujian menggunakan Anova dan dilanjutkan dengan uji Duncan.
I. PENDAHULUAN
1.1Latar Belakang
Kerapu bebek Cromileptes altivelis merupakan ikan yang hidup di terumbu karang dan sudah dapat dibudidayakan. Kendala utama pada budidaya ikan kerapu adalah terbatasnya ikan rucah sebagai pakan utama, sehingga diperlukan pakan alternatif berupa pakan buatan yang memiliki kandungan nutrien yang sesuai dengan kebutuhan ikan. Salah satu bahan pakan yang dapat digunakan pada akan kerapu yaitu tepung darah. Tepung darah merupakan salah satu sumber protein dalam pakan buatan karena memiliki kandungan protein yang tinggi yaitu 92%, leusin 13,61% dan hanya mengandung 0,33% fosfor. Keistimewaan dari tepung darah adalah kandungan besi (Fe) yang tinggi sampai 2.700 mg/kg dalam bahan kering (Johnson and Summerfelt, 2000).
Tepung darah bisa diterima baik oleh kerapu bebek Cromileptes altivelis sampai pada level 9 %, tetapi hasil optimum didapatkan pada level pemakaian 6 %. Penggunaan tepung darah 6 % sebagai sumber Fe-organik pada pakan buatan kerapu bebek dapat menggantikan pemakaian sumber Fe-anorganik Ferosulfat (FeSO4.7H2O) sekaligus mengurangi penggunaan tepung ikan dalam formulasi
pakan (Setiawati dkk., 2008). Fe berfungsi sebagai mikromineral penting yang mempengaruhi fungsi imunitas dan meningkatkan sistem pertahanan tubuh terhadap infeksi (Webster dan Lim, 2002).
dalam pakan dapat meningkatkan konsumsi pakan pada ikan sea bass Dicentrarchus labrax (Martinez et al., 2004). Sehingga taurin diduga berperan sebagai atraktan pada pakan. Atraktan juga dapat ditemukan pada hewan invertebrata laut. Tepung cumi dan produk cumi lainnya memiliki atraktan berupa glysin dan betain yang penting untuk merangsang kebiasaan makan (Hertrampf dan Pascual, 2000).
1.2Tujuan
Penelitian ini bertujuan untuk mengetahui pengaruh pemberian atraktan (taurin dan tepung cumi) untuk meningkatkan pemanfaatan tepung darah sampai level 12% dalam pakan buatan terhadap kinerja pertumbuhan ikan kerapu bebek Cromileptes altivelis yang terdiri dari pegukuran parameter konsumsi pakan, retensi protein, retensi lemak, laju pertumbuhan harian, pertumbuhan panjang relatif, efisiensi pakan dan kelangsungan hidup.
dalam pakan dapat meningkatkan konsumsi pakan pada ikan sea bass Dicentrarchus labrax (Martinez et al., 2004). Sehingga taurin diduga berperan sebagai atraktan pada pakan. Atraktan juga dapat ditemukan pada hewan invertebrata laut. Tepung cumi dan produk cumi lainnya memiliki atraktan berupa glysin dan betain yang penting untuk merangsang kebiasaan makan (Hertrampf dan Pascual, 2000).
1.2Tujuan
Penelitian ini bertujuan untuk mengetahui pengaruh pemberian atraktan (taurin dan tepung cumi) untuk meningkatkan pemanfaatan tepung darah sampai level 12% dalam pakan buatan terhadap kinerja pertumbuhan ikan kerapu bebek Cromileptes altivelis yang terdiri dari pegukuran parameter konsumsi pakan, retensi protein, retensi lemak, laju pertumbuhan harian, pertumbuhan panjang relatif, efisiensi pakan dan kelangsungan hidup.
2.1 Kebutuhan Nutrien Ikan Kerapu Bebek
Ketersediaan pakan merupakan salah satu persyaratan mutlak bagi berhasilnya usaha budidaya ikan (Kompiang, 1996). Jumlah dan kualitas pakan yang tepat sangat berkaitan dengan pertumbuhan ikan. Kebutuhan nutrisi ikan kerapu sama dengan ikan lainnya yaitu meliputi protein, lemak, karbohidrat, vitamin dan mineral (Direktorat Jendral Perikanan Budidaya, 2001).
Protein adalah elemen penting pada organ dan otot dari tubuh hewan, berperan dalam membentuk jaringan baru untuk pertumbuhan, pengganti jaringan yang rusak, pembentukan enzim dan hormon, serta pengatur berbagai metabolisme dalam tubuh (Furuichi, 1988). Kebutuhan protein pada pakan untuk spesies laut yang bersifat karnivor seperti halnya ikan kerapu umumnya tinggi (Boonyaratpalin, 1997). Menurut Giri (1998) kebutuhan protein stadia juvenil untuk beberapa jenis ikan kerapu ternyata relatif tinggi, di atas 47 % bergantung kepada spesiesnya. Kandungan protein pakan optimal untuk ikan dipengaruhi oleh keseimbangan protein dan energi, komposisi asam amino, kecernaan protein dan sumber energi pakan (Halver, 1989).
Lemak dalam pakan mempunyai 2 fungsi utama yaitu sebagai sumber energi dan sumber asam lemak. Lemak juga diperlukan untuk memelihara bentuk dan fungsi fospolipid, membantu absorpsi vitamin yang larut dalam lemak dan mempertahankan daya apung (NRC, 1993). Menurut Suwirya et al. (2004), kebutuhan asam lemak esensial ikan laut sekitar 9-16 % dalam pakan dengan 2,5 % omega-3 HUFA. Lemak memegang peranan penting sebagai sumber energi dalam pakan ikan terutama ikan karnivor dimana ketersediaan karbohidrat dalam pakannya rendah.
Vitamin adalah senyawa organik yang sangat komplek, diperlukan dalam jumlah yang sangat kecil untuk pertumbuhan yang normal, reproduksi, kesehatan, dan metabolisme (Kompiang, 1996). Mineral adalah nutrien esensial untuk hewan air dan harus tersedia dalam jumlah yang cukup. Mineral digunakan untuk proses respirasi dan osmoregulasi (NRC, 1977). Hewan air dapat menyerap sebagian mineral yang dibutuhkan dari air melalui insang atau seluruh permukaan tubuh. Mineral diperlukan juga untuk mekanisme homeostasi dan pembentukan kerangka tulang (Watanabe and Cho, 1988).
2.2 Tepung Darah (Blood Meal)
Salah satu alternatif bahan subsitusi tepung ikan adalah tepung darah (Bureau et al., 1999). Diantara bahan makanan yang berasal dari hewan, tepung darah yang paling tinggi kadar proteinnya yaitu sekitar 80% dari bobot kering. Berdasarkan hasil analisa Laboatorium Nurisi Ikan kadar protein tepung darah adalah 88,45% (Lampiran 1). Tepung darah adalah sumber yang kaya leusin tapi miskin methionine dan isoleusin (Hertrampf dan Pascual, 2000). Profil asam amino tepung darah disajikan dalam Tabel 1. Kombinasi tepung darah dan tepung jagung akan membantu untuk memperkaya komposisi pakan ikan karena tepung jagung memiki kandungan lysine yang rendah dan isoleusine yang tinggi (Harris, 1980).
Tabel 1. Profil Asam amino tepung darah (Johnson and Summerfelt, 2000). Profil asam amino Komposisi (%)
Arginin 4,12 Histidin 7,32 Isoleucin 0,63 Leucin 13,61 Lysin 8,75 Methionin 0,76 Phenylalanin 6,28 Threonin 3,12 Tryptophan 1,54 Valine 9,12
316oC kemudian dimasukkan ke dalam vacum pada suhu rendah yaitu 49oC.. Produk SBC mengandung protein tinggi 92%, leusin 13,61% dan hanya mengandung 0,33% fosfor. SBC memiliki karakter yang sangat menjanjikan sebagai bahan pakan karena memiliki kecernaan protein yang tinggi yaitu 89.7% (Johnson and Summerfelt, 2000). Kemampuan cerna terhadap suatu jenis pakan bergantung pada kuantitas dan kualitas pakan, jenis bahan pakan, kandungan gizi pakan, jenis serta aktivitas enzim-enzim pencernaan pada sistem pencernaan ikan, ukuran dan umur ikan seta sifat fisik dan kimia perairan (NRC, 1993).
Produk SBC memiliki kandungan zat besi yang tinggi yaitu sebesar 2.700 mg/kg (Johnson and Summerfelt, 2000) . Kadar zat besi yang tinggi ini memungkinkan untuk pemakaian tepung darah dalam pakan sebagai sumber zat besi organik.
Tepung darah bisa diterima baik oleh kerapu bebek Cromileptes altivelis sampai pada level 9 %, tetapi hasil optimum didapatkan pada level pemakaian 6 %. Penggunaan tepung darah 6 % sebagai sumber Fe-organik pada pakan buatan kerapu bebek dapat menggantikan pemakaian sumber Fe-anorganik Ferosulfat (FeSO4.7H2O) sekaligus mengurangi penggunaan tepung ikan dalam formulasi
pakan. Pemakaian mineral organik lebih efisien dibandingkan sumber Fe-anorganik (Setiawati dkk., 2008). Fe berfungsi sebagai mikromineral penting yang mempengaruhi fungsi imunitas dan meningkatkan sistem pertahanan tubuh terhadap infeksi. Fe juga berpengaruh pada metabolisme energi (lemak, protein dan karbohidrat) (Webster dan Lim, 2002).
Konsumsi pakan dipengaruhi oleh palatabiliti pakan yang diberikan (Halver, 1989). Pemakaian tepung darah sebagai sumber zat besi akan berdampak menurunkan palatabiliti pakan kerapu sehingga akan berpengaruh pada asupan pakan secara langsung oleh ikan. Sehingga diperlukan bahan pakan tambahan yang dapat meningkatkan nafsu makan ikan (Setiawati dkk., 2008)
2.3 Atraktan
pakan harus dilengkapi dengan perangsang yang disebut atraktan untuk membuat asupan pakan ikan lebih efisien. Atraktan mengandung sinyal yang memungkinkan hewan akuatik mengenali pellet lebih baik sebagai sumber makanannya (Hertrampf dan Pascual, 2000).
Atraktan umumnya dihasilkan dari asam amino bebas. Menurut Michael (1980), keberadaan asam amino bebas mempunyai peranan penting untuk proses osmoregulasi. Peran lain dari asam amino bebas adalah sebagai komponen untuk memacu pertumbuhan, sebagai sumber energi dan sebagai bahan atraktan pada makanan (Yufera et al., 2002). Pemberian asam amino bebas campuran lebih efektif daripada asam amino tunggal. Penggunaan asam amino bebas tunggal bahkan tidak memberikan respon makan terhadap ikan. Glysin, proline, taurine dan valine memberikan respon makan yang lebih sensitif pada ikan karnivor (Houlihan et al., 2002).
Pengambilan makanan pada ikan dipengaruhi oleh bahan kimia yang terdifusi dari makanan ke dalam air dan merangsang sel kemosensori ikan. Kebiasaan makan ikan dipengaruhi oleh campuran bahan kimia yang terdapat dalam pakan sehingga sel-sel komosensori pada ikan harus dirangsang agar menimbulkan respon terhadap pakan. Kebiasaan makan pada ikan telah menunjukkan bahwa olfaktori (indra penciuman) dan gustatori (indra perasa) sensitif terhadap bahan makanan yang mirip dengan makanan mereka. Olfaktori merupakan indra jarak jauh sedangkan gustatori merupakan indra jarak dekat. Olfaktori bertugas memberikan isyarat untuk mendekati makanan sedangkan gustatori memegang peranan penting dalam keputusan menerima atau menolak makanan (Houlihan et al., 2002).
dikonsumsi ikan sea bass Dicentrarchus labrax pada pakan yang diberi taurin 0,2% adalah 210,44 gram sementara pada ikan yang tidak diberi taurin adalah 70,21 gram (Martinez et al., 2004)
III. METODOLOGI
3.1 Tempat dan Waktu Penelitian
Penelitian dilaksanakan pada bulan Juli - September 2008. Analisa proksimat dan pembuatan pakan uji dilakukan di Laboratorium Nutrisi Ikan, dan analisa kualitas air di Laboratorium Lingkungan, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor (IPB). Pengujian pakan dan pemeliharaan ikan dilaksanakan di Stasiun Lapang Pusat Studi Ilmu Kelautan Institut Pertanian Bogor (PSIK IPB) – Ancol, Jakarta Utara.
3.2 Pakan Uji
Bahan baku pakan terlebih dahulu diproksimat dengan menggunakan metode Takeuchi, 1989 (Lampiran 2) untuk mengetahui kadar air, abu, serat kasar, protein, lemak dan BETN. Formulasi pakan uji dibuat dengan kandungan nutrien yang sama dari semua pakan perlakuan yaitu protein 50,1±0,80% dan energi 3454,73±13,7kal/kg. Tepung darah bisa diterima baik oleh kerapu bebek Cromileptes altivelis sampai pada level 9 %, tetapi hasil optimum didapatkan pada level pemakaian 6 %.(Setiawati dkk., 2008). Penggunaan tepung darah sebanyak 6% dapat mengurangi penggunaan tepung ikan sebanyak 10%. Komposisi pakan uji dan hasil proksimat pakan dapat dilihat di Tabel 2. Sebagai pakan uji yaitu: 1. Pakan A : Pakan kontrol (tanpa tepung darah)
2. Pakan B : Tepung darah 6 %
3. Pakan C : Tepung darah 6 % dan atraktan 4. Pakan D : Tepung darah 12 %
5. Pakan E : Tepung darah 12 % dan atraktan
Tabel 2. Komposisi bahan pakan dan komposisi proksimat pakan uji (100 gr berat kering)
Perlakuan/pemggunaan tepung darah (%) Bahan
A (0%) B (6%) C (6%*) D (12%) E (12%*)
Tepung Darah 0,00 6,00 6,00 12,00 12,00
Tepung Ikan 58,00 48,00 48,00 38,00 38,00
Tepung Bungkil Kedelai 9,00 10,09 5,80 8,00 4,00
Tepung Rebon 5,42 7,90 7,90 10,56 10,56
Pollard 7,83 8,46 9,55 12,02 12,84
Minyak Cumi 4,50 4,50 4,50 4,50 4,50
Total 100,00 100,00 100,00 100,00 100,00
Komposisi Proksimat (%)
Protein 49,22 51,35 50,73 50,40 50,87
Lemak 15,92 15,34 15,44 15,36 14,97
Abu 16,00 14,40 14,44 12,93 12,68
Serat Kasar 2,00 2,40 2,27 3,23 2,31
BETN 16,86 16,51 17,12 18,08 19,17
Energi (kal/kg) 3434,19 3452,94 3454,42 3460,04 3472,05
C/P Ratio 6,98 6,72 6,81 6,87 6,83
* Atraktan = taurin 1 % dan tepung cumi 3 %
3.3 Pemeliharaan Hewan Uji
Ikan uji yang digunakan adalah benih kerapu bebek (Cromileptis altivelis) dengan panjang 5,46±0,09cm dan berat 1,9±0,21g. Sebelum mulai penelitian, ikan diadaptasikan terlebih dahulu terhadap lingkungan dan pakan perlakuan (pakan kontrol). Selama pemeliharaan kualitas air dijaga dengan dilakukan penyiponan dan ganti air setiap hari.
Sebagai wadah percobaan digunakan 15 akuarium berdimensi 40x60x50 cm3 dengan menggunakan resirkulasi yang dilengkapi dengan tandon penampungan air dan tandon filter. Akuarium yang digunakan berisi 70 liter air yang dilengkapi dengan aerasi dan sistem air mengalir dengan pergantian air pada debit 1 liter/menit.
dilakukan pengukuran panjang dan berat. Ikan dimasukan ke dalam akuarium dengan kepadatan 10 ekor/70 liter air. Ikan diberi makan 3 kali sehari secara at satiation pada pukul 07.00, 12.00 dan 17.00 WIB.
3.4 Pengamatan Harian
Masa pemeliharaan berlangsung selama 40 hari dan dilakukan pengamatan harian berupa konsumsi pakan, mortalitas, respon makan, suhu dan salinitas. Sedangkan untuk analisa kualitas air seperti DO (Disolve Oksigen), NH3, dan
alkalinitas dilakukan pada awal, tengah dan akhir selama masa penelitian.
3.5 Kecernaan
Uji kecernaan pakan berlangsung selama 40 hari, kegiatan pengumpulan feses ikan dimulai pada hari ke-4 setelah pemberian pakan uji. Sebagai marker digunakan zat indikator Chromium oxide (Cr2O3) sebanyak 0,6 % pada saat
pembuatan pakan. Untuk uji kecernaan bahan (tepung darah) dibuat dua jenis pakan, yaitu pakan uji tanpa tepung darah (digunakan pakan perlakuan A) dan pakan acuan yang terdiri dari campuran 30 % pakan uji (pakan perlakuan A) dan 70 % tepung darah.
3.6Analisis Statistik
Penelitian menggunakan Rancangan Acak Lengkap (RAL) dengan lima perlakuan dan masing-masing perlakuan terdiri dari tiga kali ulangan. Perbedaan antar perlakuan dapat diketahui melalui hasil pengujian menggunakan Anova dan dilanjutkan dengan uji Duncan.
3.6.1 Konsumsi Pakan (KP)
Konsumsi pakan dihitung dengan cara menimbang total pakan yang dikonsumsi ikan selama perlakuan pemberian pakan.
3.6.2 Laju Pertumbuhan Harian
Sampling dilakukan pada awal dan akhir penelitian. Laju pertumbuhan harian dihitung berdasarkan persamaan (NRC, 1993) :
Laju pertumbuhan harian (%) 1 x100%
W0 = bobot rata-rata individu pada waktu awal (gram)
t = waktu pemeliharaan (hari)
3.6.3 Pertumbuhan Panjang Relatif
Sampling dilakukan pada awal dan akhir penelitian. Pertumbuhan relatif dihitung berdasarkan persamaan (Effendi, 1978)
Pertumbuhan panjang relatif (%)
(
)
x100%Lo
Nilai efisiensi makanan menunjukkan kualitas makanan yang diberikan dan dapat dihitung berdasarkan persamaan ( NRC, 1993) sebagai berikut:
(
)
3.6.5 Retensi Protein (RP)
Retensi protein ditentukan dengan membandingkan jumlah protein yang disimpan dalam tubuh ikan dengan jumlah protein yang dikonsumsi oleh ikan. Retensi protein dirumuskan dengan (Takeuchi, 1988):
(
)
F = kandungan protein tubuh pada akhir penelitian (gram) I = kandungan protein tubuh pada awal penelitian (gram) P = jumlah protein yang dimakan ikan (gram)
3.6.6 Retensi Lemak (RL)
Retensi lemak ditentukan dengan membandingkan jumlah lemak yang disimpan dalam tubuh ikan dengan jumlah lemak yang dikonsumsi oleh ikan. Retensi lemak dirumuskan dengan (Takeuchi, 1988):
(
)
J = kandungan lemak tubuh pada akhir penelitian (gram) K = kandungan lemak tubuh pada awal penelitian (gram) P = jumlah lemak yang dimakan ikan (gram)
3.6.7 Tingkat Kelangsungan Hidup (KH)
Tingkat kelangsungan hidup adalah perbandingan jumlah ikan yang hidup pada akhir penelitian terhadap jumlah ikan pada awal penelitian. Tingkat kelangsungan hidup dihitung dengan rumus (NRC, 1993):
3.6.8 Koofisien Kecernaan (apparent digestibility cooficient)
Kualitas bahan pakan/pakan ikan dapat diukur melalui kecernaannya. Pengukuran pencernaan bahan pakan/pakan ikan dilakukan dengan menggunakan zat indikator berupa Cr2O3 pada pakan acuan dan pakan uji. Berikut ini adalah
langkah-langkah mengujian kecernaan: A. Kecernaan Bahan Kering.
Nilai kecernaan bahan bisa diketahui dari nilai kecernaan pakan uji dan pakan acuan. Nilai kecernaan pakan acuan (ADR) dan pakan uji (ADT) dihitung berdasarkan modifikasi persamaan (Takeuchi, 1988);
Kecernaan pakan ( % ) = ( − )×100 ADR = kecernaan pakan acuan
B. Kecernaan Protein Tepung Darah
Koofisien kecernaan protein pakan (ADC) = [1- (a/a’ x b’/b)] x 100% Keterangan
a = % indikator khromium dalam pakan a’ = % indikator khromium dalam feses b = % protein dalam pakan
0,00
Kontrol Tepung darah 6% Tepung darah 6% ditambah atraktan Tepung darah 12% Tepung darah 12% ditambah atraktan
IV. HASIL DAN PEMBAHASAN
4.1 Hasil
4.1.1 Kinerja Pertumbuhan
Hasil yang diperoleh setelah pemberian pakan buatan dengan pemakaian tepung darah dan atraktan terhadap kinerja pertumbuhan kerapu bebek selama 40 hari disajikan pada Tabel 3.
Tabel 3. Konsumsi pakan (KP), retensi protein (RP), retensi lemak (RL), laju pertumbuhan harian (LPH), pertumbuhan panjang relatif (PR), efisiensi pakan (EP) dan kelangsungan hidup (KH) kerapu bebek.
Perlakuan/tepung darah 1 KP (gr) 115,9±19,43ab 110,71±2,43ab 119,01±10,2b 92,99±16,15a 98,56±3,1ab 2 RP (%) 61,88±0,72a 67,26±2,31a 84,97±5,81bc 81,21±4,05b 93,05±7,16c
Ket : Huruf superscript dibelakang nilai standar deviasi yang berbeda pada baris yang sama menunjukkan pengaruh perlakuan yang berbeda nyata (P≤0,05) pada selang kepercayaan 95 %.
Gambar 1 menunjukkan pertambahan bobot ikan kerapu bebek pada tiap perlakuan selama 40 hari.
Gambar 1. Pertambahan bobot ikan kerapu bebek pada tiap perlakuan selama 40 hari.
0,00