ABSTRAK
OPTIMASI HIDROLISIS JERAMI PADI UNTUK PRODUKSI BIOETANOL DENGAN METODE SIMULTANEOUS SACCHARIFICATION AND
FERMENTATION
Oleh
ANWIKA UTAMI PUTRI DJUARDI
Anwika Utami Putri Djuardi Penelitian ini dilakukan dua tahap yaitu tahap optimasi hidrolisis dan tahap SSF. Tahap optimasi hidrolisis terdiri dari 2 tahap, yaitu optimasi konsentrasi substrat (6; 8; 10 dan 12% (b/v)) dan optimasi konsentrasi enzim (20; 25; 30 dan 35 FPU/g selulosa). Konsentrasi substrat dan enzim optimal pada tahap optimasi hidrolisis ini selanjutnya akan digunakan pada tahap SSF. Sebelum dilakukannya tahap SSF, jerami padi dihidrolisis terlebih dahulu (prehidrolisis) selama beberapa waktu (0, 12, dan 24 jam) pada kondisi proses suhu 500C, pH 4,8, dan kecepatan shaker 150 rpm. Setelah prehidrolisis, kondisi suhu proses diturunkan menjadi 380C, masing-masing sampel ditambahkan 10% (v/v) Saccharomyces cerevisiae, kemudian sampel diinkubasi pada suhu 38oC, 150 rpm selama 72 jam. Hasil penelitian menunjukkan bahwa konsentrasi substrat 12% dan konsentrasi enzim 35 FPU/g selulosa merupakan konsentrasi optimal yang menghasilkan gula reduksi (g/L) tertinggi (37,33 g/L) pada proses hidrolisis. Perlakuan waktu prehidrolisis 0 jam (tanpa prehidrolisis) merupakan perlakuan yang menghasilkan kadar etanol tertinggi yaitu sebesar 16,19 g/L pada proses SSF jerami padi.
ABSTRACT
HYDROLYSIS OPTIMIZATION OF RICE STRAW FOR BIOETHANOL PRODUCTION BY USING SIMULTANEOUS SACCHARIFICATION AND
FERMENTATION METHOD
By
ANWIKA UTAMI PUTRI DJUARDI
Anwika Utami Putri Djuardi This study was conducted in two stages, the first stage is enzymatic hydrolysis optimization and the second stage is SSF process. The enzymatic hydrolysis optimization stage was carried out in two steps, namely optimization of substrate concentration of rice straw (6; 8; 10 and 12% (w / v)) and optimization of enzyme celullase concentration (20; 25; 30 and 35 FPU/g cellulose). The optimum concentration of substrate and enzyme as resulted from this stage will be aplicated in SSF process. Prior to the SSF, an enzymatic prehydrolysis of rice straw carried out in different time periods (0, 12 and 24 h) and it performed on the condition of process at 500C, pH 4,8 and rotary shaker 150 rpm. After that, the temperature process was decreased to 380C and each sample was added with 10% (v/v) Saccharomyces cerevisiae, then the samples were incubated at 380C, 150 rpm for 72 hours. The results showed that the concentration of substrat 12 % (w/v) and the concentration of enzyme cellulase 35 FPU/g cellulose were the optimal concentration that produce the highest reducing sugars (37,33 g/L) in the 32 h hydrolysis incubation, and the treatment of prehydrolysis 0 h was a treatment that produce the highest ethanol concentration, 16,19 g/L, in the 72 h SSF process.
OPTIMASI HIDROLISIS JERAMI PADI UNTUK PRODUKSI BIOETANOL DENGAN METODE SIMULTANEOUS
SACCHARIFICATION AND FERMENTATION
Oleh
ANWIKA UTAMI PUTRI DJUARDI
Skripsi
Sebagai Salah Satu Syarat untuk Mencapai Gelar SARJANA TEKNOLOGI PERTANIAN
Pada
Jurusan Teknologi Hasil Pertanian Fakultas Pertanian Universitas Lampung
FAKULTAS PERTANIAN UNIVERSITAS LAMPUNG
RIWAYAT HIDUP
Penulis dilahirkan di Bandar Lampung, pada tanggal 19 Juli 1993 dan merupakan anak kedua dari tiga bersaudara dari pasangan Bapak Dian Komarsyah Ibu Siswati Hifnie.
Penulis menyelesaikan Taman Kanak-kanak di TK PTPN VII Bandar Lampung pada tahun 1999, Sekolah Dasar di SDN 2 Rawalaut Bandar Lampung pada tahun 2005, Sekolah Menengah Pertama (SMP) di SMP Negeri 4 Bandar Lampung pada tahun 2008, dan Sekolah Menengah Atas di SMA Negeri 2 Bandar Lampung pada tahun 2011.
DIKTI, menerima penghargaan sebagai Mahasiswa Berprestasi terbaik pertama pada tingkat Fakultas Pertanian pada tahun 2014 dan menerima penghargaan sebagai Mahasiswa Berprestasi terbaik ketiga pada tingkat Universitas pada tahun 2014.
SANWACANA
Puji syukur penulis ucapkan ke hadirat Allah SWT, atas berkah dan kuasa-Nya sehingga penulis dapat menyelesaikan skripsi yang berjudul “Optimasi Hidrolisis Jerami Padi untuk Produksi Bioetanol dengan Metode Simultaneous Saccharification and Fermentation” sebagai salah satu syarat untuk memperoleh gelar sarjana pada Jurusan Teknologi Hasil Pertanian, Fakultas Pertanian, Universitas Lampung.
Selama penulisan skripsi ini penulis banyak memperoleh bimbingan, bantuan, semangat, serta nasehat dari berbagai pihak. Oleh karena itu, pada kesempatan ini penulis ingin menyampaikan ucapan terima kasih yang tulus kepada:
1. Bapak Prof. Dr. Ir. Wan Abbas Zakaria, M.S., selaku Dekan Fakultas Pertanian Universitas Lampung;
2. Ibu Ir. Susilawati, M.Si., selaku Ketua Jurusan Teknologi Hasil Pertanian, Fakultas Pertanian, Universitas Lampung atas nasehat dan saran yang diberikan kepada penulis;
4. Ibu Ir. Marniza, M.Si., selaku pembimbing kedua atas kesediaanya memberikan bimbingan, saran, nasehat, arahan, dan terutama motivasi yang telah diberikan selama penyusunan skripsi ini;
5. Ibu Dr. Dewi Sartika, S.T.P., M.Si., selaku penguji atas masukan, saran dan pengetahuan yang diberikan kepada penulis sampai selesainya skripsi ini; 6. Bapak Dr. Ir. Subeki, M.Si., M.Sc., selaku pembimbing akademik yang telah
memberikan bimbingan, saran serta nasehat kepada penulis selama ini;
7. Bapak dan Ibu tercinta, serta Teh Adis dan Dek Tisya tersayang selaku keluarga atas segala doa, kebahagiaan, kasih sayang, bimbingan, serta motivasinya sehingga penulis selalu bersemangat untuk menyelesaikan skripsi ini;
8. Teman-teman “Janji Gerhana” THP angkatan 2011 atas seluruh bantuan, kepedulian serta kebersamaannya selama ini, semoga kita semua kelak menjadi orang-orang yang sukses dunia dan akhirat;
9. Almamater tercinta dan semua pihak yang tidak dapat penulis sebutkan satu persatu yang telah membantu penulis dalam penyusunan skripsi ini.
Semoga Allah SWT senantiasa memberikan balasan atas jasa dan kebaikan yang diberikan kepada penulis. Penulis berharap semoga karya sederhana ini dapat bermanfaat bagi kita semua, Amin Ya Rabbal 'Alamin.
Bandar Lampung, Agustus 2015 Penulis
ivi
DAFTAR ISI
Halaman
DAFTAR TABEL ... vii
DAFTAR GAMBAR ... ix
I. PENDAHULUAN 1.1 Latar Belakang ... 1
1.2 Tujuan ... 5
1.3 Kerangka Pemikiran ... 5
II. TINJAUAN PUSTAKA 2.1 Jerami Padi ... 9
2.1.1 Potensi Jerami Padi sebagai Bahan Baku Bioetanol ... 10
2.1.2 Struktur Lignoselulosa Jerami Padi ... 10
2.1.2.1 Selulosa ... 12
2.1.2.2 Hemiselulosa ... 12
2.1.2.3 Lignin ... 13
2.2 Produksi Bioetanol ... 15
2.2.1 Pretreatment ... 17
2.2.2 Hidrolisis ... 18
2.2.3 Fermentasi ... 23
2.2.4 Pemurnian Etanol ... 24
2.3 Metode Simultaneous Saccharification andFermentation ... 25
III. BAHAN DAN METODE 3.1 Tempat dan Waktu ... 28
3.2 Bahan dan Alat ... 28
3.3 Metode Penelitian... 29
3.4 Pelaksanaan Penelitian ... 29
3.4.1 Pretreatment Menggunakan Basa ... 30
3.4.2 Tahap Optimasi Hidrolisis ... 31
3.4.2.1 Optimasi Konsentrasi Substrat ... 32
3.4.2.2 Optimasi Konsentrasi Enzim ... 33
3.4.3 Produksi Etanol dengan Metode SSF ... 34
vi 3.4.3.2 Tahap Simultaneous Saccharification and
Fermentation ... 34
3.5. Pengamatan ... 36
3.5.1 Analisis Lignin, Selulosa dan Hemiselulosa Jerami Padi ... 36
3.5.2 Analisis Kadar Gula... 37
3.5.2.1 Penyiapan Kurva Standar ... 37
3.5.2.2 Penentuan Kadar Gula Reduksi pada Sampel... 38
3.5.2.3 Pembuatan Reagen ... 39
3.5.3 Analisis Kadar Etanol dengan Gas Chromatograhy ... 40
IV. HASIL DAN PEMBAHASAN 4.1 Pengaruh Pretreatment terhadap Komposisi Lignoselulosa Jerami Padi ... 41
4.2 Pengaruh Hidrolisis Jerami Padi pada Berbagai Konsentrasi Substrat terhadap Gula Reduksi ... 43
4.3 Pengaruh Hidrolisis Jerami Padi pada Berbagai Konsentrasi Enzim terhadap Gula Reduksi ... 47
4.4 Pengaruh Waktu Prehidrolisis terhadap Kadar Etanol pada Proses Simultaneous Saccharification andFermentation (SSF) ... 51
V. KESIMPULAN DAN SARAN 5.1 Kesimpulan ... 54
5.2 Saran ... 54
DAFTAR PUSTAKA ... 55
DAFTAR TABEL
Tabel Halaman
1. Kadar gula reduksi jerami padi setelah prehidrolisis selama 0 (tanpa
prehidrolisis), 12 dan 24 jam dan kadar etanol setelah SSF 72 jam ... 51 2. Hasil pengamatan kadar lignoselulosa jerami padi sebelum pretreatment .... 61 3. Hasil pengamatan kadar lignoselulosa jerami padi setelah pretreatment ... 61 4. Pengamatan kadar gula reduksi hasil hidrolisis jerami padi pada berbagai
konsentrasi substrat (ulangan ke-1) ... 63 5. Pengamatan kadar gula reduksi hasil hidrolisis jerami padi pada berbagai
konsentrasi substrat (ulangan ke-2) ... 64 6. Pengamatan kadar gula reduksi hasil hidrolisis jerami padi pada berbagai
konsentrasi substrat (ulangan ke-3) ... 65 7. Rekapitulasi data kadar gula reduksi hasil hidrolisis jerami padi pada
berbagai konsentrasi substrat ... 66 8. Pengamatan kadar gula reduksi hasil hidrolisis jerami padi dengan
berbagai konsentrasi enzim (ulangan ke-1) ... 67 9. Pengamatan kadar gula reduksi hasil hidrolisis jerami padi dengan
berbagai konsentrasi enzim (ulangan ke-2) ... 68 10. Pengamatan kadar gula reduksi hasil hidrolisis jerami padi dengan
berbagai konsentrasi enzim (ulangan ke-3) ... 69 11. Rekapitulasi data kadar gula reduksi hasil hidrolisis jerami padi dengan
berbagai konsentrasi enzim ... 70 12. Pengamatan kadar gula reduksi hasil prehidrolisis jerami padi selama
viii 13. Pengamatan kadar etanol hasil SSF jerami padi pada berbagai perlakuan
DAFTAR GAMBAR
Gambar Halaman
1. Dinding sel tanaman yang tersusun oleh struktur lignoselulosa . ... 11
2. Struktur selulosa ... 12
3. Struktur hemiselulosa ... 13
4. Struktur lignin ... 14
5. Mekanisme hidrolisis selulosa menggunakan enzim selulase kompleks ... 21
6. Senyawa-senyawa inhibitor yang terbentuk di dalam proses hidrolisis lignoselulosa. ... 22
7. Tahapan proses pembuatan etanol dengan metode SSF ... 27
8. Diagram alir proses persiapan bahan baku ... 30
9. Diagram alir proses pretreatment menggunakan basa ... 31
10. Diagram alir tahap optimasi konsentrasi substrat ... 32
11. Diagram alir tahap optimasi konsentrasi enzim... 33
12. Diagram alir tahap SSF ... 35
13. Kadar selulosa, hemiselulosa dan lignin jerami padi sebelum dan setelah pretreatment, dengan cara direndam dalam larutan NaOH 1,0 M pada suhu 1210C selama 15 menit. ... 41
x 15. Persentase yield gula reduksi hasil hidrolisis berbagai konsentrasi substrat
jerami padi dengan enzim selulase 25 FPU pada suhu 500C selama 32
jam ... 44
16. Kadar gula reduksi hasil hidrolisis jerami padi dengan berbagai konsentrasi enzim selulase (20, 25, 30, 35 FPU) pada suhu 500C selama 32 jam ... 48
17. Persentase yield gula reduksi hasil hidrolisis jerami padi dengan berbagai konsentrasi enzim selulase (20, 25, 30, 35 FPU) pada suhu 500C selama 32 jam ... 48
18. Kadar etanol setelah SSF selama 72 jam ... 52
19. Kurva standar gula reduksi ... 73
20. Jerami padi yang telah digrinder menjadi ukuran 40 mesh ... 73
21. Penimbangan jerami padi yang akan di-pretreatment ... 74
22. Jerami padi yang di-pretreatment menggunakan alat autoclave ... 74
23. Sampel jerami setelah di-pretreatment ... 75
24. Sampel jerami padi yang siap untuk dihidrolisis ... 75
25. Sampel jerami padi setelah hidrolisis... 76
26. Analisis gula reduksi jerami padi hasil hidrolisis ... 76
27. Sampel jerami padi yang siap untuk diprehidrolisis ... 77
I. PENDAHULUAN
1.1 Latar Belakang
Saat ini persediaan Bahan Bakar Minyak (BBM) di Indonesia semakin menipis. Menurut data statistik migas ESDM (2009), total Cadangan minyak bumi
Indonesia pada tahun 2009 yaitu sebesar 7.998,50 MMSTB. Total cadangan minyak bumi tersebut semakin berkurang pada tahun ke tahun hingga pada tahun 2014 cadangan minyak bumi di Indonesia menurut data statistik migas ESDM (2014) menjadi sekitar 7.549,81 MMSTB. Besar cadangan tersebut diperkirakan akan habis dalam waktu beberapa belas tahun ke depan dengan asumsi jika konsumsi BBM terus meningkat namun tidak ditemukannya cadangan minyak baru ataupun teknologi baru yang dapat meningkatkan recovery minyak bumi (ESDM, 2015). Oleh karena itu, perlu adanya pengembangan energi baru yang dapat menjadi solusi alternatif sebagai pengganti bahan bakar minyak.
2 yang akan menjadi fokus utama pemerintah untuk dikembangkan produksinya ialah Bahan Bakar Nabati (BBN) termasuk bioetanol.
Bioetanol adalah jenis senyawa alkohol (C2H5OH) yang merupakan hasil
metabolit sekunder mikroba seperti Saccharomyces cerevisiae pada substrat nabati yang mengandung pati atau gula (Samsuri et al., 2007). Bioetanol yang telah dikembangkan di Indonesia merupakan bioetanol generasi pertama. Bioetanol generasi pertama adalah bioetanol yang berasal dari substrat nabati yang memiliki komponen gula maupun pati seperti molasses/tetes tebu, ubi kayu, ubi jalar dan jagung. Bioetanol generasi pertama harganya masih relatif tinggi karena bahan bakunya juga digunakan sebagai bahan pangan dan pakan (Odling-Smee, 2007). Oleh karena itu, untuk menurunkan harga dan menghindari masalah tersebut maka bioetanol generasi kedua perlu dikembangkan.
Bioetanol generasi kedua adalah bioetanol yang dapat dibuat dari bahan nabati yang mengandung selulosa dan hemiselulosa (Carere et al., 2008). Sumber nabati yang mengandung selulosa dan hemiselulosa tinggi dan belum dimanfaatkan secara maksimal ialah limbah padat agroindustri. Lignoselulosa yang terdapat pada limbah padat agroindustri mengandung tiga komponen penyusun utama, yaitu selulosa (30-50%-berat), hemiselulosa (15-35%-berat), dan lignin (13-30%-berat) (Soerawidjaja, 2009). Tingginya kandungan selulosa dan hemiselulosa menunjukkan bahwa limbah agroindustri layak untuk dijadikan sebagai bahan baku pembuatan bioetanol. Salah satu limbah padat agroindustri yang ketersediaannya melimpah dan berpotensial di Indonesia ialah jerami padi.
3 jerami padi yang dapat dimanfaatkan yaitu sekitar 50% dari total GKG hasil panen atau sekitar 35,46 juta ton pada tahun 2014. Potensi jerami padi menjadi bioetanol telah diperkirakan oleh Kim dan Dale (2004) yaitu sebesar 0,28 L/Kg jerami padi dan menurut sumber lain yaitu Badger (2002) potensinya adalah sebesar 0,20 L/Kg jerami padi. Berdasarkan data-data tersebut, potensi bioetanol dari jerami padi yang dapat diproduksi di Indonesia pada tahun 2014 ialah sebesar 9,93 juta kL (Kim dan Dale, 2004) atau sekitar 7,09 juta kL (Badger, 2002). Besarnya potensi bioetanol yang dapat diproduksi dari jerami padi tersebut diperkirakan dapat memenuhi sekitar 24-33% konsumsi premium yang sebesar 29,71 juta kL pada tahun 2014.
Proses pengolahan jerami padi menjadi bioetanol bukan hal yang mudah. Jerami padi memiliki komponen selulosa dan hemiselulosa (holoselulosa) dalam jaringan tanaman yang berikatan kuat dengan lignin, sehingga holoselulosa sulit dihidrolisis karena strukturnya kompleks dan heterogen (Perez et al., 2002). Salah satu cara yang dapat mengatasi masalah tersebut ialah dengan perlakuan awal secara basa untuk memisahkan lignin dari komponen holoselulosa. Sutikno et al. (2010) telah menemukan bahwa dengan merendam limbah agroindustri yang telah dikeringkan dan ditepungkan dalam larutan NaOH 1 M pada suhu ruang selama 48 jam atau pada suhu 121oC selama 15 menit dapat menghilangkan komponen lignin hingga 99%. Selanjutnya holoselulosa tersebut perlu dihidrolisis menjadi gula-gula reduksi seperti glukosa dan xilosa sebelum difermentasi menjadi etanol dengan bantuan mikroba.
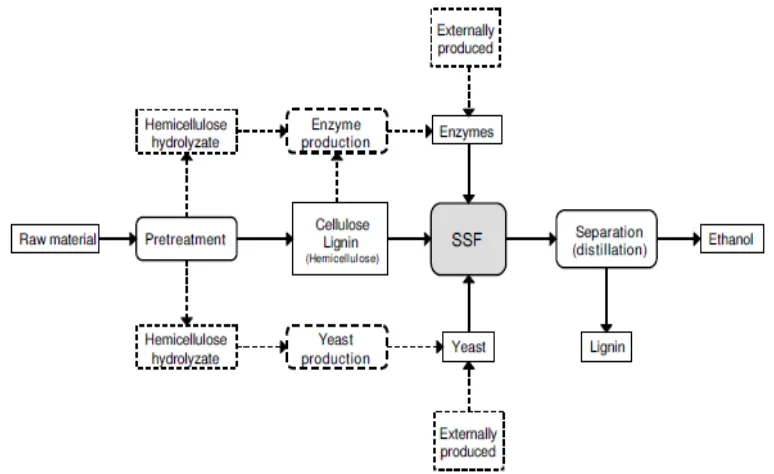
4 Saccharificiaton and Fermentation (SSF). SSF adalah metode pembuatan bioetanol yang menggabungkan tahapan hidrolisis enzimatik selulosa bersama dengan tahapan proses fermentasinya. Salah satu kelebihan utama dari penggunaan metode SSF adalah dapat mencegah terhambatnya kerja enzim oleh produk glukosa dan selobiosa yang selama ini menjadi kelemahan dari metode pembuatan etanol secara terpisah (Olofsson et al., 2008). Selain itu, metode SSF dapat menghemat penggunaan peralatan dan investasi biaya produksi sebesar 20% (Wingren, 2003).
Saat ini, metode SSF terus dilakukan pengembangannya. Salah satu pengembangan pada metode SSF ialah memaksimalkan proses hidrolisis dengan melakukan hidrolisis pendahuluan (prehidrolisis) sebelum dilaksanakannya SSF. Proses prehidrolisis ini dapat dilakukan pada kondisi suhu optimum hidrolisis enzimatik yaitu pada rentang suhu 45-500C (Tengborg, 2001), sehingga pada waktu prehidrolisis tersebut enzim dapat bekerja optimal. Gula reduksi hasil prehidrolisis ini kemudian dapat dijadikan sebagai susbtrat awal bagi mikroba fermentasi. Hal tersebut bertujuan untuk menghindari terjadinya kematian mikroba fermentasi akibat minimnya gula reduksi pada saat awal proses SSF (Hoyer et al., 2013).
5 perlu dilakukan penelitian untuk mendapatkan kondisi optimum proses hidrolisis tersebut dan waktu prehidrolisis pada pembuatan etanol dari jerami padi dengan menggunakan metode SSF, sehingga proses konversi akan menghasilkan gula reduksi yang maksimal dan rendemen etanol yang tinggi.
1.2 Tujuan
Tujuan dari penelitian ini ialah:
1. Mendapatkan konsentrasi substrat dan konsentrasi enzim optimal yang menghasilkan kadar gula reduksi (g/L) tertinggi pada proses hidrolisis. 2. Mengetahui waktu prehidrolisis optimal pada SSF yang menghasilkan
kadar etanol (g/L) tertinggi.
1.3 Kerangka Pemikiran
6 tetap rendah sehingga membuat proses hidrolisis tetap optimal tanpa adanya hambatan yang signifikan.
Tahap yang perlu dimaksimalkan pada pembuatan bioetanol dengan menggunakan metode SSF salah satunya ialah tahap hidrolisis. Fungsi tahap hidrolisis adalah memecah sebanyak mungkin polimer holoselulosa (selulosa dan hemiselulosa) untuk menjadi monomer glukosa dan xilosa yang selanjutnya akan digunakan oleh ragi untuk difementasi menjadi etanol. Proses hidrolisis dapat dilakukan dengan dua metode yaitu menggunakan asam dan enzim. Kelemahan dari penggunaan asam dalam proses hidrolisis ialah dapat menimbulkan degradasi gula dalam reaksi hidrolisis, serta terjadinya pembentukan produk samping berupa inhibitor yang tidak diinginkan seperti furfural, 5-hydroxymethylfurfural (HMF), asam levulinik (levulinic acid), asam asetat (acetic acid), dan beberapa senyawa lain. Selain itu, hidrolisis secara asam dapat menimbulkan korosif pada lingkungan (Taherzadeh dan Karimi, 2007). Oleh karena itu, pembuatan bioetanol dengan penggunaan enzim dinilai lebih menguntungkan dan aman dibandingkan dengan penggunaan asam. Selain itu, kelebihan dari penggunaan enzim ialah bekerja secara spesifik, artinya enzim tersebut hanya dapat memecah substrat tertentu sehingga tidak terbentuk senyawa-senyawa lain yang tidak diinginkan.
7 Sedangkan faktor konsentrasi enzim diketahui bahwa secara teoritis konsentrasi enzim akan berbanding linear dengan kecepatan reaksinya. Semakin tinggi konsentrasi enzim yang digunakan maka akan semakin cepat proses hidrolisisnya, namun pada konsentrasi tertentu enzim tidak lagi dapat meningkatkan kecepatan reaksi melebihi Vmaxnya (Mandels et al., 1976).
Hasil penelitian Rodhe et al. (2011) menunjukkan bahwa hidrolisis jerami padi dengan konsentrasi substrat 5 % dan konsentrasi enzim selulase 25 FPU/g selulosa pada kondisi proses pH 4,8, suhu 500C dan kecepatan goyangan shaker 150 rpm selama 36 jam menghasilkan kadar gula reduksi tertinggi sebesar 16,575 g/L. Berdasarkan hasil penelitian tersebut, pada penelitian ini akan dilakukan optimasi proses hidrolisis dengan 2 tahap perlakuan yaitu: perlakuan konsentrasi substrat dan perlakuan konsentrasi enzim selulase. Perlakuan konsentrasi substrat akan dilakukan dengan konsentrasi 6, 8, 10, dan 12 % dan konsentrasi enzim 25 FPU/g selulosa pada kondisi pH 4,8, suhu 500
C dan kecepatan goyangan sebesar 150 rpm selama 32 jam. Selanjutnya setelah didapatkan konsentrasi substrat terbaik dalam menghasilkan gula reduksi terbanyak, tahap perlakuan konsentrasi enzim akan dilakukan dengan menggunakan konsentrasi enzim selulase pada 20, 25, 30 dan 35 FPU/g-selulosa substrat dan pada kondisi yang sama seperti pada tahap perlakuan konsentrasi substrat. Hasil dari penelitian ini selanjutnya akan diaplikasikan pada tahap SSF.
II. TINJAUAN PUSTAKA
2.1 Jerami Padi
Jerami padi merupakan salah satu limbah agroindustri yang paling banyak ketersediaannya di Indonesia. Berdasarkan data Badan Pusat Statistik (2014), produksi padi di Indonesia pada tahun 2014 sebesar 70,83 juta ton gabah kering giling (GKG), sedangkan produksi jerami padi yang dihasilkan dapat mencapai 50% dari produksi gabah kering panen atau sekitar 35,46 juta ton. Namun demikian, pemanfaatan jerami padi oleh para petani pada umumnya masih rendah.
10 2.1.1 Potensi Jerami Padi sebagai Bahan Baku Bioetanol
Berdasarkan potensinya sebagai bahan baku bioetanol, Kim dan Dale (2004) telah membuat prediksi bahwa sebanyak 0,28 L/Kg jerami padi dapat dijadikan etanol. Jika dihitung dari ketersediaan bahan baku jerami padi pada tahun 2014, maka etanol yang dapat dihasilkan sebesar 9,93 juta kL (Kim dan Dale, 2004). Dengan jumlah tersebut, maka produksi bioetanol dari jerami padi dapat memenuhi 24-33% konsumsi premium yang sebesar 29,71 juta kL pada tahun 2014.
Namun disisi lain, proses pembuatan bioetanol dari jerami padi masih memiliki berbagai kendala. Hal ini dikarenakan, jerami padi tidak dapat langsung difermentasi oleh mikroba menjadi etanol sebab jerami padi masih mengandung struktur lignoselulosa yang kompleks yang terdiri dari komponen selulosa, hemiselulosa, dan lignin. Struktur lignoselulosa yang kompleks ini harus didegradasi terlebih dahulu untuk melepaskan lignin dari struktur lignoselulosa dan hanya menyisakan selulosa dan hemiselulosanya. Setelah itu, selulosa dan hemiselulosa baru dapat dihidrolisis untuk dikonversi menjadi gula sederhana yang selanjutnya akan difermentasikan oleh mikroba untuk menjadi etanol.
2.1.2 Struktur Lignoselulosa Jerami Padi
11 kadar selulosa sebesar 28,36%, kadar hemiselulosa sebesar 23-28%, kadar lignin sebesar 12-16% dan kadar abu serta zat ekstraktif sebesar 15-20%.
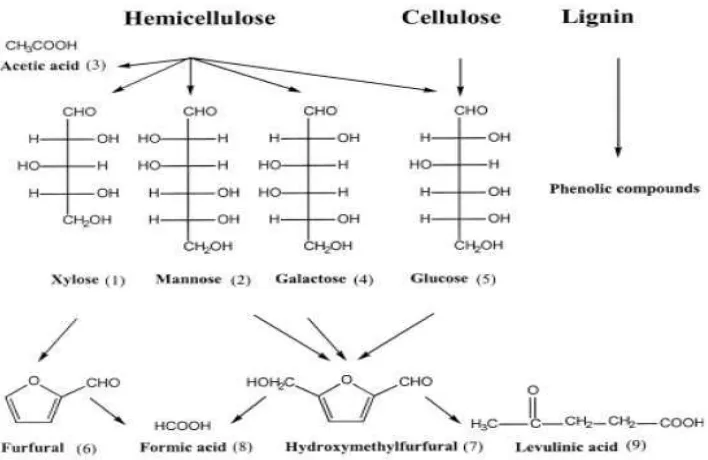
Lignoselulosa merupakan komponen utama penyusun dinding sel tanaman seperti jerami padi. Struktur lignoselulosa terdiri dari mikrofibril-mikrofibril selulosa yang membentuk kluster-kluster, dengan ruang antar mikrofibril terisi dengan hemiselulosa, dan kluster-kluster tersebut terikat kuat oleh lignin menjadi satu kesatuan (Soerawidjaja, 2009). Komponen mikrofibril-mikrofibril selulosa, hemiselulosa dan lignin menyatu dalam ikatan yang kompleks. Pada struktur lignoselulosa, mikrofibril-mikrofibril selulosa dikelilingi oleh hemiselulosa dan hemiselulosa kemudian dihubungkan oleh ikatan kovalen dengan lignin sehingga menjadi struktur kuat dan kokoh. Oleh karena itu, secara tidak langsung mikrofibril selulosa terproteksi dari degradasi dengan adanya komponen hemiselulosa dan lignin yang terikat kuat pada struktur lignoselulosa (Gambar 1). Masing-masing penjelasan mengenai selulosa, hemiselulosa dan lignin akan dibahas pada subbab-subbab berikut ini.
12 2.1.2.1 Selulosa
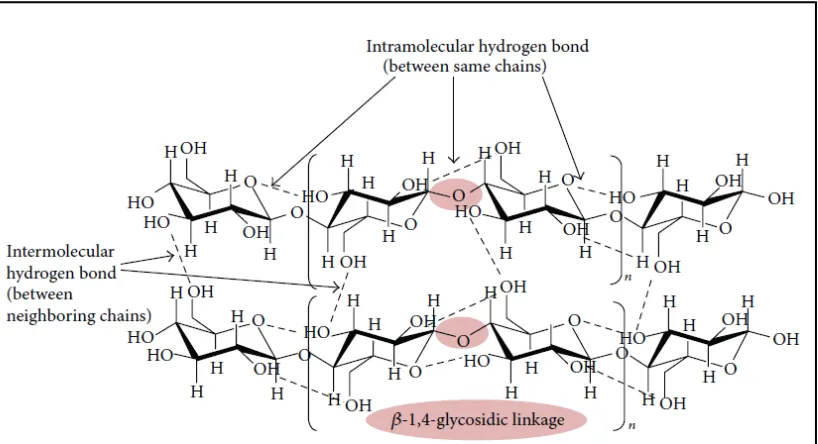
[image:30.595.116.525.347.569.2]Selulosa merupakan komponen utama pada struktur lignoselulosa. Selulosa ialah polimer glukosa yang dihubungkan dengan ikatan β-1,4 glukosida dalam rantai lurus. Selulosa mengandung sekitar 50-90% bagian kristal dan sisanya bagian amorf. Ikatan β-1,4 glukosida pada selulosa dapat diputus dengan cara hidrolisis secara asam ataupun enzimatis. Hidrolisis selulosa yang sempurna akan membentuk produk monomer selulosa yaitu glukosa, sedangkan hidrolisis selulosa tidak sempurna akan menghasilkan produk disakarida dari selulosa yaitu selobiosa (Lee et al., 2014). Struktur selulosa dapat dilihat pada Gambar 2.
Gambar 2. Struktur selulosa (Lee et al., 2014).
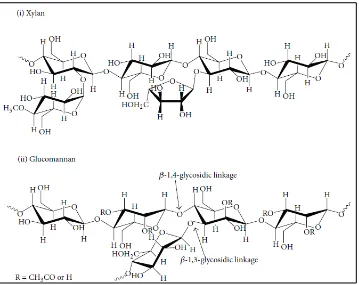
2.1.2.2 Hemiselulosa
13 pelarut alkali dan lebih mudah dihidrolisis dengan asam. Berbeda dengan selulosa, hemiselulosa lebih mudah larut dalam pelarut alkali namun sukar larut dalam pelarut asam, sedangkan selulosa adalah sebaliknya. Hemiselulosa juga bukan merupakan serat-serat panjang seperti selulosa. Hidrolisis hemiselulosa dapat dilakukan dengan menggunakan asam ataupun enzim. Enzim yang dapat menghidrolisis hemiselulosa salah satunya ialah xilanase. Hasil hidrolisis hemiselulosa yaitu terbentuknya produk monomer D-xilosa dan monosakarida lainnya. Struktur hemiselulosa dapat dilihat pada Gambar 3.
Gambar 3. Struktur hemiselulosa (Lee et al., 2014)
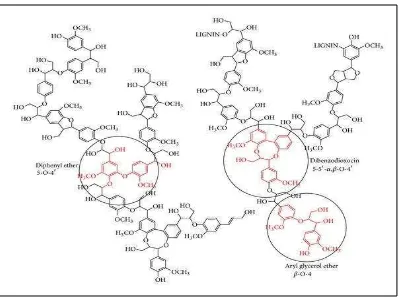
2.1.2.3 Lignin
14 sebagai perekat serat selulosa dan hemiselulosa sehingga struktur sel tanaman menjadi sangat kuat (Sun dan Cheng, 2002). Struktur kimia lignin sangat kompleks dan tidak berpola sama. Hal ini berbeda jika dibandingkan dengan selulosa yang terbentuk dari gugus karbohidrat yang cenderung membentuk rantai lurus. Struktur lignin dapat dilihat pada Gambar 4.
Gambar 4. Struktur lignin (Crestini et al., 2010).
15 2.2 Produksi Bioetanol
Bioetanol merupakan hasil metabolit mikroba seperti Saccharomyces cerevisiae pada substrat bahan nabati yang mengandung gula (nira tebu, aren, molase), pati (ubi kayu, ubi jalar, sorgum, jagung) atau bahan lignoselulosa (jerami padi, tongkol jagung, tandan kosong kelapa sawit, bambu, dan kayu). Bioetanol pada umumnya digunakan sebagai bahan baku berbagai industri turunan alkohol, misalnya sebagai campuran untuk minuman keras, farmasi, serta bahan baku kosmetika. Berdasarkan kadar alkoholnya, bioetanol dibagi menjadi tiga kelas yaitu kelas industri dengan kadar alkohol 90-94%, kelas netral dengan kadar alkohol 96-99.5% (umumnya digunakan untuk minuman keras atau bahan baku farmasi), dan kelas bahan bakar dengan kadar alkohol di atas 99.5% (Hambali et al., 2007).
16 Saat ini berbagai penelitian mengenai produksi bioetanol dari generasi kedua telah dilakukan, yaitu dengan menggunakan enzim pada hidrolisis dan mikroorganisme yang berbeda untuk produksi bioetanol. Namun pada perkembangannya, produksi bioetanol dari bahan yang mengandung lignoselulosa tersebut belum efektif secara biaya karena membutuhkan biaya yang besar dan secara teknis masih banyak hambatan yang harus dipecahkan (Gomez et al., 2008). Hambatan-hambatan tersebut antara lain yaitu diperlukannya proses pendahuluan berupa penghilangan lignin dari struktur lignoselulosa sebelum dilakukannya hidrolisis serta proses hidrolisisnya lebih rumit jika dibandingkan dengan substrat berbahan pati dan gula. Hal ini menyebabkan produksi bioetanol dari bahan berlignoselulosa belum dikembangkan secara luas (Miyafuji et al., 2003). Oleh karena itu, metode yang tepat perlu dicari pada pembuatan bioetanol generasi kedua sehingga dapat diaplikasikan secara massal dan bermanfaat bagi masyarakat.
Proses konversi substrat lignoselulosa menjadi etanol terdiri dari beberapa tahap. Menurut Howard et al. (2003), ada 4 tahap yang harus dilalui untuk pembuatan bioetanol, yaitu; (1) perlakuan awal (pretreatment) secara fisik, kimia, atau dan biologi; (2) hidrolisis polimer (selulosa, hemiselulosa) menjadi gula sederhana (heksosa, silosa); (3) fermentasi gula oleh mikroba untuk menghasilkan etanol, dan (4) pemisahan dan pemurnian etanol yang dihasilkan.
17 hasil hidrolisis saat ini telah berhasil ditingkatkan hingga mencapai 70%, namun rendemen total etanol dari bahan berlignoselulosa tetap hanya berkisar 21% (Kristensen et al., 2007). Rendahnya rendemen bioetanol dari bahan berlignoselulosa ini disebabkan oleh adanya zat penghambat sebagai hasil samping dari proses hidrolisis bahan berlignoselulosa tersebut seperti asam asetat, furan aldehid, vanilin, dan fenol yang dapat menghambat kerja mikroba fermentasi (Sun dan Cheng, 2002). Selain itu, adanya interaksi antara enzim dan substrat juga sangat mempengaruhi proses kerja enzim dalam proses hidrolisis dan fermentasi. Oleh karena itu, penemuan metode perlakuan pendahuluan dan teknologi enzim yang efektif dan efisien menjadi sangat penting pada proses biokonversi bahan berlignoselulosa menjadi bioetanol. Berikut akan diuraikan mengenai tahapan proses konversi substrat lignoselulosa menjadi etanol dari mulai tahap pretreatment hingga tahap fermentasi pada subbab di bawah ini.
2.2.1 Pretreatment
18 toksik/ inhibitor yang akan mengurangi kinerja enzim maupun mikroba. Saat ini metode pretreatment yang telah berkembang terdiri dari empat (4) jenis tipe pretreatment yaitu pretreatment secara biologis, fisik, kimia dan fisik-kimia. Macam-macam jenis metode pretreatment tersebut memiliki kelebihan dan kekurangan masing-masing dan aplikasinya juga akan bergantung pada bahan lignoselulosa yang digunakan. Oleh karena itu, metode pretreatment perlu dipertimbangkan terlebih dahulu supaya proses konversi dapat berjalan optimal.
Jenis pretreatment yang sering digunakan pada substrat jerami padi ialah pretreatment dengan menggunakan bahan kimia maupun pretreatment dengan kombinasi bahan kimia dan perlakuan panas (tipe fisik-kimia). Hasil penelitian Remli et al. (2014) menunjukkan bahwa metode pretreatment menggunakan basa akan meningkatkan efektifitas proses hidrolisis enzimatis dengan cara meningkatkan aksesibilitas enzim pada permukaan selulosa. Hasil penelitian tersebut diketahui bahwa pretreatment secara basa menggunakan 2% (b/v) KOH atau NaOH dan dikombinasikan dengan perlakuan panas pada suhu 121O C dan 15 psi akan meningkatkan 58,5-64,5% laju konversi terbentuknya gula reduksi dibandingkan dengan jerami padi tanpa pretreatment. Hal ini menunjukkan bahwa pretreatment secara basa dapat efektif digunakan untuk proses biokonversi jerami padi.
2.2.2 Hidrolisis
19 hemiselulosa dipecah menjadi gula-gula sederhana yang selanjutnya akan difermentasi oleh mikroba menjadi etanol. Gula-gula reduksi hasil pemecahan selulosa dan hemiselulosa memiliki perbedaan struktur. Gula reduksi hasil pemecahan selulosa cenderung memiliki struktur heksosa, sedangkan gula reduksi hasil pemecahan hemiselulasa cenderung memiliki struktur pentosa. Hal ini berdasarkan perbedaan dari senyawa-senyawa penyusun selulosa dan hemiselulosa (Mergner et al., 2013).
Terdapat dua metode hidrolisis yang sering digunakan pada proses konversi bahan berlignoselulosa menjadi gula reduksi untuk substrat fermentasi simultan. Metode tersebut ialah hidrolisis menggunakan asam dan hidrolisis menggunakan enzim. Selain itu, terdapat metode hidrolisis lainnya adalah metode ionic liquids (ILs), metode sinar-gamma dan metode electron-beam irridation. Namun, metode-metode tersebut jarang digunakan pada proses pembuatan bioetanol karena biaya prosesnya cukup mahal (Mergner et al., 2013).
20 senyawa-senyawa lain yang tidak diinginkan. Oleh karena itu, proses hidrolisis dengan penggunaan enzim dinilai lebih menguntungkan dan aman dibandingkan dengan penggunaan asam.
Proses hidrolisis secara enzimatis pada substrat selulosa dan hemiselulosa dilakukan oleh mikroba jenis jamur ataupun bakteri yang dapat menghasilkan enzim selulase dan hemiselulase. Proses hidrolisis secara enzimatis ini memerlukan kondisi yang khusus, biasanya kondisi optimum proses hidrolisis terdapat pada pH 5,0 dan suhu 45-55oC (Tengborg, 2001). Pada proses ini tidak menumbulkan korosi maupun pembentukan senyawa inhibitor. Namun proses ini memiliki beberapa kelemahan seperti proses yang sedikit lebih lambat dan mahalnya harga enzim murni yang digunakan.
Proses hidrolisis enzimatik enzim selulase memiliki mekanisme kerja yaitu penetrasi substrat sehingga terikat ke enzim secara reversible, kemudian membentuk suatu kompleks enzim-substrat. Kompleks ini disebut sebagai kompleks Michaelis. Setelah itu, enzim akan mengatalisis reaksi kimia dan melepaskan produk monomer glukosa (Poedjiadi, 1994). Menurut Poedjiadi (1994), reaksi kerja enzim dapat dipercepat hingga 108 sampai 1011 kali reaksi dengan cara menurunkan energi aktivasi reaksi kimia yaitu dengan kondisi proses pada suhu dan tekanan yang rendah.
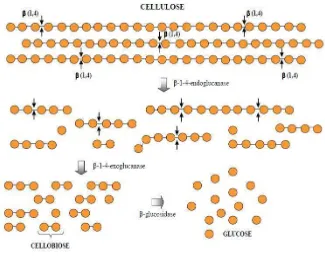
21 selulase kompleks dalam menghidrolisis substrat selulosa ialah sebagai berikut (Gambar 5).
1. Endo-1,4-β-D-glucanase (endoselulase, carboxymethylcellulase atau CMC ase), merupakan enzim yang bertugas untuk memecah ikatan internal pada struktur kristalin selulosa dan membuka rantai polisakarida.
2. Exo-1,4-β-D-glucanase (cellobiohydrolase), merupakan enzim yang bertugas untuk membelah 2-4 unit dari akhir rantai yang diproduksi oleh endoselulase dan menghasilkan tetrasakarida atau disakarida serta menghasilkan monosakarida berupa glukosa.
3. β–glucosidase (cellobiase), merupakan enzim yang jumlahnya relatif sedikit dalam selulase. Tugas beta-glukosidase ialah menghidrolisis produk dari enzim eksoselulase menjadi monosakarida,
22 Terdapat beberapa faktor yang dapat mempengaruhi kerja enzim (Poedjiadi, 1994), yang meliputi:
1. Peningkatan konsentrasi substrat dan konsentrasi enzim akan meningkatkan kecepatan reaksi.
2. Penurunan konsentrasi substrat dan konsentrasi enzim yang tetap akan menambah kecepatan reaksi.
3. Peningkatan suhu pada kondisi proses hidrolisis dapat menyebabkan denaturasi pada enzim, sehingga bagian sisi aktifnya terganggu dan kecepatan reaksinya menurun.
4. Tingkat keasaman (pH ) yang tinggi dapat menyebabkan proses denaturasi yang dapat mengakibatkan penurunan aktivitas enzim.
[image:40.595.137.491.490.720.2]5. Adanya inhibitor irreversibel maupun inhibitor reversibel yang dapat memurunkan kerja enzim (Gambar 6).
23 2.2.3 Fermentasi
Fermentasi merupakan suatu proses konversi gula reduksi menjadi etanol yang secara biologis dilakukan oleh mikroorganisme. Proses fermentasi yang sering terjadi pada industri maupun secara alami ialah proses perubahan satu mol glukosa menjadi dua mol etanol dan dua mol CO2. Selain itu, fermentasi dapat
terjadi pada monomer heksosa lainnya seperti galaktosa maupun fruktosa dengan proses konversi atau perubahan yang hampir sama. Proses fermentasi seperti ini merupakan proses konversi yang telah lama diaplikasikan pada industri seperti roti, minuman bir maupun bahan kimia murni (Mergner et al., 2013).
Kondisi proses fermentasi merupakan faktor penting yang akan mempengaruhi produk etanol yang dihasilkan. Proses konversi gula heksosa seperti glukosa umumnya memerlukan kondisi anaerobik untuk memaksimalkan pembentukan etanol. Sedangkan dengan kondisi aerobik, proses fermentasi akan menghasilkan gas CO2, H2O dan energi. Persamaan reaksi yang terjadi pada
proses fermentasi anaerobik dan aerobik dapat dilihat pada persamaan berikut. Reaksi anaerobik:
nC6H12O6 2nC2H5OH + 2nCO2
Reaksi aerobik:
C6H12O6 + 6O2 6CO2 + 6H2O + energi
24 peneliti yang menggunakan ragi ini untuk proses fermentasi etanol. Secara umum khamir dapat tumbuh dan memproduksi etanol secara optimal pada pH 3,5-6,0 dan suhu 28-350C. Selain itu, Saccharomyces cerevisiae juga toleran terhadapkadar etanol yang tinggi, mampu bertahan hidup pada suhu tinggi hingga 470C dan kondisi asam hingga pH 3 dan stabil selama proses fermentasi berlangsung (Frazier dan Westhoff, 1978).
Ada 2 jenis metode fermentasi untuk memproduksi etanol, yaitu Metode Separated Hydrolysis And Fermentation (SHF) dan Metode Simultaneous Saccharification and Fermentation (SSF). Separated Hydrolysis And Fermentation (SHF) ialah metode pembuatan bioetanol yang melakukan tahap hidrolisis enzimatik karbohidrat dan tahap fermentasi berlangsung secara terpisah. Keuntungan dari metode SHF adalah hidrolisis oleh enzim selulase dan fermentasi oleh mikroba dapat dilakukan pada masing-masing kondisi optimum (Taherzadeh and Karimi, 2007). Sedangkan metode Simultaneous Saccharification and Fermentation (SSF) adalah salah satu metode pembuatan bioetanol yang menggabungkan tahapan hidrolisis enzimatik dengan tahap fermentasi (Olofsson, et al., 2008). Metode SSF secara spesifik akan diuraikan pada subbab 2.3.
2.2.4 Pemurnian Etanol
25 penyulingan ini dapat menghasilkan kadar etanol hingga 95% (Sanyoto, 2013). Pada proses penyulingan, campuran zat dididihkan sehingga menguap, kemudian uap tersebut didinginkan ke dalam bentuk cairan. Zat yang menguap terlebih dahulu ialah zat yang memiliki titik didih lebih rendah. Penerapan proses ini berdasarkan pada teori yang menyebutkan bahwa masing-masing komponen pada suatu larutan akan menguap pada titik didihnya (Kister, 1992).
Pada produksi bioetanol yang bertujuan untuk digunakan sebagai bahan bakar, etanol hasil destilasi perlu dihilangkan air (dehidrasi) terlebih dahulu untuk meningkatkan kemurnian etanol hingga 99,55%. Proses dehidrasi tersebut dapat dilakukan dengan Metode purifikasi molecular sieve. Molecular sieve merupakan suatu absorben cairan dan gas yang memiliki pori-pori kecil sehingga mampu menyerap air hingga 20 %. Bahan-bahan absorben yang termasuk molecular sieve ialah karbon aktif, zeolit, lempung, dan porous glasses (Hambali, dkk., 2008). Bahan-bahan tersebut merupakan suatu absorben alami atau sintetis berbentuk pellet yang dapat secara selektif mengikat molekul air (Victor, 2010). Metode ini tergolong mudah dan ekonomis serta tidak meninggalkan residu pada etanol yang diperoleh (Victor, 2010).
2.3 Metode Simultaneous Saccharification and Fermentation
26 bioetanol dari kayu. Metode SSF ini lebih efisien dan efektif dibandingkan dengan metode Separate Hydrolysis and Fermentation (SHF) (Oloffson et al., 2008). Penggunaan SSF juga menghasilkan produktivitas yang lebih tinggi dibandingkan metode SHF. Pada kondisi substrat dan enzim selulase yang sama metode SHF menghasilkan derajat konversi glukosa menjadi etanol sekitar 40% sedangkan SSF dapat mencapai 60%.
Kelebihan utama dari metode Simultaneous Saccharification And Fermentation (SSF) ini ialah memecahkan masalah yang terdapat pada metode tahapan hidrolisis dan fermentasi secara terpisah, atau yang lebih dikenal dengan metode Separate Hydrolysis and Fermentation (SHF) yaitu mencegah adanya inhibisi kerja enzim hidrolisis oleh produk glukosa dan selubiosa. Selain itu, studi menunjukkan bahwa proses fermentasi simultan dapat memperpendek lamanya waktu yang dibutuhkan ragi untuk mengkonversi glukosa menjadi etanol. Proses ini membutuhkan jumlah enzim kurang dari yang dibutuhkan dalam hidrolisis enzimatik biasa karena SSF menggabungkan hidrolisis dan fermentasi, waktu reaksi keseluruhan untuk mengkonversi biomassa menjadi etanol dipersingkat (Gauss et al., 1976). Manfaat lainnya dari penggunaan metode SSF ialah efisiensi penggunaan peralatan dan investasi biaya produksi dapat ditekan sebesar 20% (Wingren, 2003).
27 suhu ekstrim selama fermentasi, baik tinggi maupun rendah akan menghasilkan rendemen etanol yang minim. Hal ini dikarenakan sebagian ragi tidak tumbuh baik pada suhu jauh lebih rendah dari 20 0C atau jauh lebih tinggi dari 40 0C. Oleh karena itu, agar proses SSF dapat berjalan secara maksimal, kondisi optimum enzim dan mikroba seharusnya berdekatan. Menurut Tengborg (2001) suhu optimum teknik ini terjadi pada suhu 38oC jika menggunakan enzim selulase yang optimum pada suhu 45-50oC sebagai enzim penghidrolisis dan S. cerevisae yang optimum pada suhu 30-35o sebagai mikroba penghasil etanol (Tengborg, 2001).
III. METODE PENELITIAN
3.1 Tempat dan Waktu
Penelitian ini dilaksanakan di Laboratorium Kimia dan Biokimia Hasil Pertanian, Laboratorium Mikrobiologi Hasil Pertanian, dan Laboratorium Instrumen Jurusan Teknologi Hasil Pertanian Fakultas Pertanian Universitas Lampung pada bulan Desember 2014 sampai dengan Mei 2015.
3.2 Bahan dan Alat
Bahan-bahan yang digunakan dalam penelitian ini adalah jerami padi yang diperoleh dari persawahan di Kabupaten Pringsewu, enzim selulase (SQzyme CSP-B) yang diperoleh dari Suntaq International Limited di Shenzhen, China, kultur Saccharomices cerevisiae komersial, ekstrak khamir, peptone, dekstrose, sodium hidroksida (NaOH), air suling, asam sulfat (H2SO4), Nelson A, Nelson B
dan arsenomolibdat yang didapatkan dari Jurusan Teknologi Hasil Pertanian, Fakultas Pertanian, Universitas Lampung.
29 porselin, desikator, hot plate (Cimerec3), sentrifuge (Thermo Electron Corporation, Model IEC Centra CL2, made in China), autoklaf (WiseclaveTM), dan spektrofotometer (Milton Ray Company).
3.3 Metode Penelitian
Penelitian ini dilakukan 3 tahap, yaitu tahap optimasi konsentrasi substrat, tahap optimasi konsentrasi enzim, dan tahap SSF. Tahap optimasi konsentrasi substrat dilakukan dengan perlakuan tunggal, yaitu konsentrasi 6; 8; 10 dan 12% (b/v). Setelah mendapatkan konsentrasi substrat optimal, selanjutnya dilakukan tahap optimasi konsentrasi enzim dengan perlakuan tunggal, yaitu konsentrasi 20; 25; 30 dan 35 FPU/g selulosa. Kedua tahapan perlakuan ini bertujuan untuk mengetahui konsentrasi substrat dan konsentrasi enzim yang optimal dalam menghasilkan kadar gula reduksi tertinggi untuk diaplikasikan pada tahap SSF. Selanjutnya, tahap SSF dilakukan dengan perlakuan tunggal, yaitu lama waktu prehidrolisis 0 jam (tanpa prehidrolisis), 12 jam, dan 24 jam sebelum SSF. Pada tahap SSF dilakukan pengamatan kadar gula reduksi awal sebelum SSF dan kadar etanol yang terbentuk. Semua tahap diulang sebanyak 3 kali. Kemudian data hasil pengamatan disajikan dalam bentuk tabel dan grafik serta dianalisis secara deskriptif.
3.4 Pelaksanaan Penelitian
30 lignin pada serat holoselulosa. Selanjutnya holoselulosa jerami padi hasil pretreatment tersebut akan dijadikan bahan baku pada tahap optimasi konsentrasi substrat, tahap optimasi konsentrasi enzim, dan tahap SSF. Tahapan-tahapan pada penelitian ini diuraikan pada subbab berikut.
3.4.1 Pretreatment Menggunakan Basa
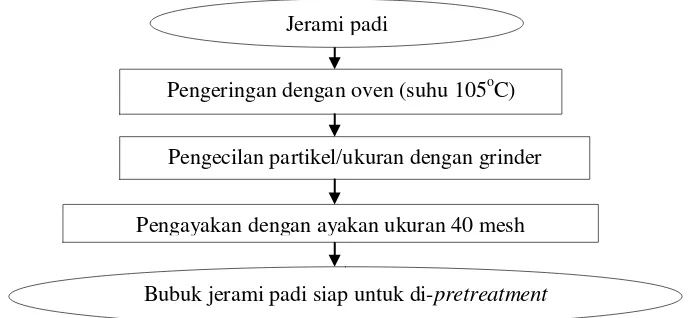
[image:48.595.144.489.426.585.2]Proses persiapan jerami padi dilakukan menurut metode Samsuri et al. (2007) (Gambar 8).. Jerami padi dikeringkan hingga kadar air 0% (berat konstan) menggunakan oven pada suhu 105oC. Jerami kering kemudian dibuat menjadi bubuk menggunakan grinder dan diayak dengan ayakan ukuran 40 mesh. Bubuk jerami padi yang sudah kering dengan ukuran 40 mesh selanjutnya disimpan pada kondisi kering dan wadah tertutup sebelum digunakan untuk tahap selanjutnya.
Gambar 8. Diagram alir proses persiapan bahan baku (Samsuri et al., 2007).
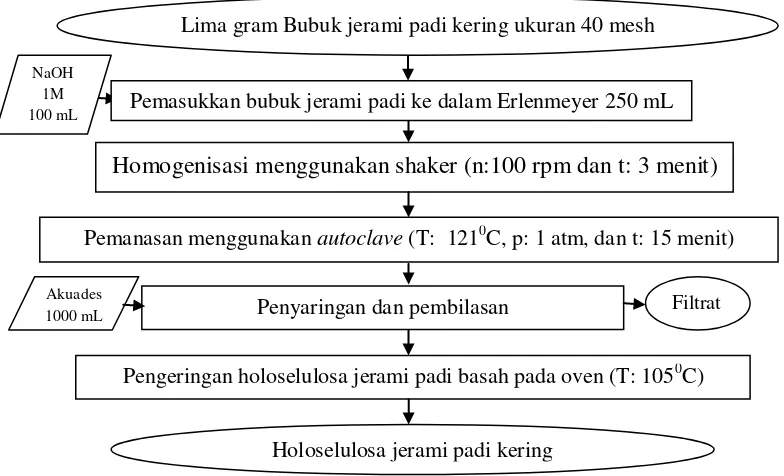
Pretreatment menggunakan basa dilakukan dengan menggunakan metode Sutikno et al. (2010) (Gambar 9). Pretreatment bertujuan untuk menghilangkan lignin pada struktur lignoselulosa sehingga selulosa mudah didegradasi oleh enzim selulase menjadi glukosa dan kemudian difermentasi oleh khamir menjadi etanol. Lima gram bubuk jerami kering dengan ukuran 40 mesh dimasukan dalam
Pengeringan dengan oven (suhu 105oC)
Pengecilan partikel/ukuran dengan grinder
Pengayakan dengan ayakan ukuran 40 mesh Jerami padi
31 Erlenmayer ukuran 250 mL dan kemudian ditambah 100 mL larutan NaOH 1 M. Setelah itu, sampel dihomogenisasi menggunakan shaker dengan kecepatan 100 rpm selama 3 menit dan dipanaskan dalam autoclave pada suhu 121oC selama 15 menit. Setelah selesai dipanaskan, sampel disaring dan dibilas dengan 1000 mL akuades untuk menghilangkan lignin. Bagian padat holoselulosa jerami padi dikeringkan dalam oven pada suhu 105oC sampai berat konstan.
Gambar 9. Diagram alir proses pretreatment menggunakan basa (Sutikno et al., 2010).
3.4.2 Tahap Optimasi Hidrolisis
Tahap optimasi hidrolisis terdiri atas 2 tahap dengan perlakuan tunggal yaitu: optimasi konsentrasi substrat (6; 8; 10 dan 12% (b/v)) dan optimasi konsentrasi enzim (20; 25; 30 dan 35 FPU/g selulosa). Tahap optimasi hidrolisis dilakukan menurut metode SSF Dowe dan McMillan (2008), namun pada metode ini dilakukan tanpa penggunaan media nutrisi dan ragi karena hanya akan dilakukan proses hidrolisis. Selain itu, metode ini dimodifikasi menggunakan
Pemanasan menggunakan autoclave (T: 1210C, p: 1 atm, dan t: 15 menit)
Penyaringan dan pembilasan
Pengeringan holoselulosa jerami padi basah pada oven (T: 1050C) Lima gram Bubuk jerami padi kering ukuran 40 mesh
Holoselulosa jerami padi kering
Homogenisasi menggunakan shaker (n:100 rpm dan t: 3 menit)
NaOH 1M
100 mL Pemasukkan bubuk jerami padi ke dalam Erlenmeyer 250 mL
Filtrat Akuades
[image:49.595.113.505.249.487.2]32 volume 5 mL untuk efisiensi bahan baku. Tahapan-tahapan tersebut masing-masing diuraikan sebagai berikut.
3.4.2.1 Optimasi Konsentrasi Substrat
Optimasi konsentrasi substrat dilakukan menurut metode SSF Dowe dan McMillan (2008) yang telah dimodifikasi (Gambar 10). Holoselulosa jerami padi kering hasil pretreatment disiapkan dengan berbagai konsentrasi substrat (6; 8; 10 dan 12% (b/v)). Sampel dimasukkan ke dalam tabung ulir dengan ukuran 15 mL, ditambahkan 0,25 mL buffer sitrat pH 4,8, 0,20 mL antibiotik tetracycline 2%, 0,128 mL; 0,169 mL; 0,209 mL; dan 0,250 mL enzim selulase dengan konsentrasi 25 FPU/g selulosa (perhitungan penggunaan enzim dapat dilihat pada Lampiran 2), dan akuades hingga total volume menjadi 5 mL. Setelah itu, sampel diinkubasi pada suhu 50oC dan kecepatan shaker 150 rpm selama 32 jam. Pada waktu inkubasi 8, 16, 24 dan 32 jam, filtrat diambil dan dianalisis gula reduksinya. Hasil pengamatan kadar gula reduksi tersebut dianalisis secara deskriptif untuk menentukan konsentrasi terbaik yang menghasilkan gula reduksi terbanyak.
Gambar 10. Diagram alir tahap optimasi konsentrasi substrat (Dowe dan McMillan, 2008 yang telah dimodifikasi).
Inkubasi pada shaker waterbath (T: 50o C dan n: 150 rpm) selama 32 jam Holoselulosa jerami padi 6; 8; 10 dan 12% (b/v)
Pemasukkan sampel ke dalam tabung ulir 15 mL
Pengamatan kadar gula reduksi
Hasil pengamatan
Buffer sitrat pH 4,8, antibiotik tetracycline2%,
enzim selulase 25 FPU/g selulosa, dan akuades
[image:50.595.96.534.546.718.2]33
3.4.2.2 Optimasi Konsentrasi Enzim
Optimasi konsentrasi enzim dilakukan menurut metode SSF Dowe dan McMillan (2008) yang telah dimodifikasi (Gambar 11). Holoselulosa jerami padi kering hasil pretreatment disiapkan pada konsentrasi substrat optimal yang telah diketahui pada pengujian sebelumnya. Kemudian holoselulosa jerami padi dimasukkan ke dalam tabung ulir dengan ukuran 15 mL dan ditambahkan enzim dengan konsentrasi 20; 25; 30; dan 35 FPU/g selulosa, 0,25 mL buffer sitrat pH 4,8, 0,20 mL antibiotik tetracycline 2%, dan akuades hingga total volume menjadi 5 mL. Setelah itu sampel diinkubasi pada suhu 50o C dan kecepatan shaker 150 rpm selama 32 jam. Pada waktu inkubasi 8, 16, 24 dan 32 jam, filtrat diambil dan dianalisis gula reduksinya. Hasil pengamatan kadar gula reduksi tersebut dianalisis secara deskriptif untuk menentukan konsentrasi terbaik yang menghasilkan gula reduksi terbanyak.
Gambar 11. Diagram alir tahap perlakuan konsentrasi enzim (Dowe dan McMillan, 2008 yang telah dimodifikasi).
Inkubasi pada shaker waterbath (T: 50o C dan n: 150 rpm) selama 32 jam
Holoselulosa jerami padi (konsentrasi substrat terbaik)
Pemasukkan sampel ke dalam tabung ulir 15 mL
Pengamatan kadar gula reduksi
Hasil pengamatan buffer sitrat pH 4,8,
antibiotik tetracycline 2%, enzim selulase (konsentrasi 20; 25; 30
dan 35 FPU/g selulosa) dan akuades
[image:51.595.89.496.460.690.2]34
3.4.3 Produksi Etanol dengan Metode SSF
3.4.3.1 Persiapan Inokulum Saccharomyces cerevisiae
Persiapan inokulum Saccharomyces cerevisiae dilakukan menurut metode yang diuraikan oleh Dowe and McMillan (2008) yang telah dimodifikasi. Satu gram tepung Saccharomices cerevisiae komersial ditumbuhkan pada 100 mL media nutrisi YPD (Yeast 1% b/v, Pepton 2% b/v dan Dekstrosa 5% b/v) dalam Erlenmeyer secara aseptik. Kemudian sampel diinkubasi selama 10 jam pada suhu 38oC dengan kecepatan shaker 130 rpm. Setelah inkubasi selesai, inokulum dianalisis Optical Density (OD) pada panjang gelombang 600 nm. Inokulum yang akan digunakan pada tahap SSF perlu diencerkan untuk mendapatkan OD sebesar 0,5. Setelah itu, 10 mL inokulum dengan OD 0,5 disentrifius pada kecepatan 3800 rpm selama 5 menit untuk memisahkan filtrat dan residu. Filtrat dibuang, kemudian residu diresuspensi dengan aquades hingga volume 10 mL. Selanjutnya inokulum siap untuk digunakan untuk SSF etanol.
3.4.3.2 Tahap Simultaneous Saccharification and Fermentation
35 sebelumnya) dan akuades sampai volume suspensi mencapai 80 mL. Selanjutnya sampel dihidrolisis pendahuluan (prehidrolisis) pada suhu 50oC, pH 4,8, dan kecepatan goyangan 150 rpm selama waktu 0 (tanpa prehidrolisis), 12, dan 24 jam. Setelah prehidrolisis selama 12 dan 24 jam, masing-masing sampel dikeluarkan dari alat shaker water bath dan kondisi suhu pada shaker water bath diturunkan hingga suhu 38oC. Kemudian sampel dengan prehidrolisis selama 12 dan 24 jam tersebut didinginkan hingga beberapa menit, lalu ditambahkan 10 % (v/v) starter Saccharomyces cerevisiae bersuhu 30 0C. Sampel tanpa prehidrolisis (suhu 300C) juga ditambahkan dengan 10 % (v/v) starter Saccharomyces cerevisiae bersuhu 300C. Setelah inkubasi selama 72 jam, sampel diukur kadar etanolnya.
Gambar 12. Diagram alir tahap SSF (Dowe dan McMillan, 2008 yang telah dimodifikasi).
Inkubasi pada shaker waterbath (T: 38o C dan n: 150 rpm) selama 72 jam
Pengamatan kadar etanol
Holoselulosa jerami padi
Pemasukkan sampel ke dalam Erlenmeyer 100 mL
Prehidrolisis pada shaker waterbath (T:50oC dan n:150 rpm) selama 0, 12, dan 24 jam
Hasil pengamatan Analisis kadar gula reduksi setelah prehidrolisis Penambahan buffer sitrat pH 4,8, antibiotik tetracycline
2%, media nutrisi (Yeast Peptone), enzim selulase dan
akuades hingga volume total 80 mL.
Starter S. Cerevisiae
[image:53.595.96.539.386.692.2]36
3.5 Pengamatan
Pengamatan yang dilakukan dalam penelitian ini terdiri atas pengamatan komposisi lignoselulosa sebelum dan setelah pretreatment, pengamatan kadar gula reduksi pada tahap optimasi hidrolisis, pengamatan kadar gula reduksi awal (hasil prehidrolisis) dan pengamatan kadar etanol yang terbentuk setelah SSF. Analisis kadar gula reduksi dilakukan di Laboratorium Biokimia Jurusan Pertanian, Fakultas Pertanian, Universitas Lampung. Analisis kadar etanol dilakukan di Laboratorium Terpadu, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Islam Indonesia, Yogyakarta.
3.5.1 Analisis Lignin, Selulosa dan Hemiselulosa Jerami Padi
Analisis komposisi lignoselulosa dalam jerami padi dilakukan menurut Metode Chesson dalam Datta (1981). Sampel yang dianalisis ialah jerami padi sebelum dan setelah pretreatment. Tahap pertama sampel dikeringkan dengan oven hingga berat konstan. Kemudian satu gram sampel dimasukkan ke dalam Erlenmayer 250 mL dan diberi penambahan 150 mL air suling. Lalu sampel dipanaskan pada suhu 100oC selama 2 jam. Selanjutnya, sampel disaring menggunakan kertas saring dan dibilas dengan 300 mL air suling. Setelah itu, residu dikeringkan dengan oven pada suhu 105oC sampai dengan berat konstan. Setelah residu memiliki berat konstan, maka berat a didapatkan.
Residu (a) dimasukkan ke dalam Erlenmeyer 250 mL lalu ditambahkan 150 mL H2SO4 1 N. Kemudian sampel dipanaskan pada suhu 100oC selama 1
37 dengan 300 mL air suling. Setelah itu, residu dikeringkan dengan suhu 105oC sampai berat konstan. Setelah residu memiliki berat konstan, maka berat b didapatkan.
Residu (b) dimasukkan ke dalam Erlenmeyer 250 mL dengan penambahan 10 mL H2SO4 72%. Lalu residu (b) direndam dan biarkan selama 4 jam pada suhu
ruang, kemudian residu (b) diberi penambahan 150 mL H2SO4 1 N dan
dipanaskan pada suhu 1000C selama 2 jam. Lalu sampel disaring menggunakan kertas saring dan dibilas dengan 400 mL air suling. Setelah itu, residu dikeringkan dalam oven pada suhu 105oC sampai berat konstan. Setelah residu memiliki berat konstan, maka berat c didapatkan.
Setelah berat c didapatkan, sampel dilakukan pengukuran kadar abu dengan memasukkan residu (c) ke dalam furnace pada 600oC selama 4 jam lalu ditimbang untuk mendapatkan berat d.
Kadar Hemiselulosa dihitung dengan rumus :
100 b -a (%) sa Hemiselulo x Sampel Berat
Kadar Selulosa dihitung dengan rumus:
100 c -b (%) Selulosa x Sampel Berat
Kadar Lignin dihitung dengan rumus:
100 d
-c (%)
Lignin x
Sampel Berat
3.5.2 Analisis Kadar Gula Reduksi
3.5.2.1 Penyiapan Kurva Standar
38 melarutkan 10 mg glukosa anhidrat dalam 100 mL air suling, dan dilakukan 6 pengenceran sehingga diperoleh larutan glukosa dengan konsetrasi 2, 4, 6, 8, dan 10 mg/100 mL. Lima tabung reaaksi disiapkan, masing-masing diisi dengan 1 mL larutan glukosa standar tersebut. Satu tabung diisi 1 mL air suling sebagai blanko. Kemudian masing-masing tabung ditambahkan 1 mL reagen Nelson. Selanjutnya tabung dipanaskan pada penangas air mendidih selama 20 menit. Setelah itu, tabung didinginkan secara bersama-sama dalam gelas piala yang berisi air dingin sehingga suhu tabung mencapai ruang. Setelah dingin, 1 mL reagen Arsenomolybdat ditambahkan dan dihomogenisasi sampai semua endapan CuSO4
yang ada larut kembali. Setelah semua endapan CuSO4 larut sempurna, 7 mL air
suling ditambahkan ke dalam tabung tersebut dan dihomogenkan kembali. Absorbansi masing-masing larutan tersebut diukur pada panjang gelombang 540 nm. Kemudian kurva standar dibuat untuk menunjukkan hubungan antara konsentrasi glukosa dan absorbansi (Sudarmadji et al., 1984).
3.5.2.2 Penentuan Kadar Gula Reduksi pada Sampel
39
3.5.2.3 Pembuatan Reagen
1. Reagen Nelson
Reagen Nelson dibuat dengan cara mencampurkan 25 bagian Reagen Nelson A dan 1 bagian Reagen Nelson B. Reagen Nelson A dibuat dengan melarutkan 12,5 g Natrium karbonat anhidrat, 12,5 g garam Rochelle, 10 g Natrium bikarbonat dan 100 g Natrium sulfat anhidrat ke dalam 350 mL air suling kemudian diencerkan sampai 500 mL. Sedangkan reagen Nelson B dibuat dengan melarutkan 7,5 g CuSO4. 5H2O ke dalam 50 mL air suling dan ditambahkan 1
tetes asam sulfat pekat.
2. Reagen Arsenomolibdat
Reagen arsenomolibdat dibuat dengan cara mencampurkan dua larutan kimia. Larutan pertama dibuat dengan melarutkan 25 g Ammonium molybdat ke dalam 450 mL air suling pada Erlenmeyer 500 mL serta menambahkan 25 mL asam sulfat pekat. Selanjutnya larutan kedua dibuat dengan melarutkan 3 g Na2HASO4.7H2O ke dalam 25 mL air suling pada Erlenmeyer yang berbeda,
40
3.5.3 Analisis Kadar Etanol dengan Gas Chromatograhy
Analisis kadar etanol dilakukan dengan menggunakan alat Gas Chromatography. Kolom yang digunakan pada alat ini ialah Carbowax Chromosorb W.HP 80/100 mesh dengan kondisi operasi suhu mula-mula 55oC kemudian dinaikan 4oC per menit selama 3 menit. Selanjutnya suhu dinaikan lagi 32 oC per menit sehingga suhu kolom menjadi 120 oC. Tekanan gas pembawa (N2)
1,7 kg/cm2, tekanan gas pembawa (H2) 16 kg/cm2dan tekanan udara 0,19 kg/cm2.
V. KESIMPULAN
5.1 Kesimpulan
Berdasarkan penelitian dan pembahasan yang telah dilakukan maka dapat diambil kesimpulan bahwa:
1. Konsentrasi substrat 12 % dan konsentrasi enzim 35 FPU/g selulosa merupakan konsentrasi optimal yang dapat menghasilkan gula reduksi (g/L) tertinggi sebesar 37,33 g/L pada proses hidrolisis.
2. Perlakuan dengan waktu prehidrolisis 0 jam (tanpa prehidrolisis) merupakan perlakuan yang menghasilkan kadar etanol tertinggi yaitu sebesar 16,19 g/L pada proses SSF jerami padi dengan suhu 389C selama 72 jam.
5.2 Saran
DAFTAR PUSTAKA
Badan Pusat Statistik. 2014. Produksi Padi Tahun 2014. http://www.bps.go.id/brs/view/id/1122. Diakses pada tanggal 13 Maret 2015.
Carere, Carlo, R., Sparling, R., Cicek, N., dan Levin, D.B. 2008. Third Generation Biofuels via Direct Cellulose Fermentation. Int Journal of Molecular Sciences. Canada. 9: 1342-1360.
Crestini, C., Crucianelli, M., Orlandi, M., Saladino, R. 2010. Oxidative Strategies In Lignin Chemistry: A New Environmental Friendly Approach For The Functionalisation Of Lignin And Lignocellulosic Fibers.Catalysis Today. 156: 8–22.
Datta, R. 1981. Acidogenic Fermentation Of Linocellulose Acid Yield And Convertion Of Components. Biotechno Bioeng. 23 : 2167-2170.
Dewi, K.H. 2002. Hidrolisis Biomasa Limbah Hasil Pertanian Secara Enzimatik. Akta Agrosia. 5: 67-71.
Direktorat Jendral Migas. 2009. Cadangan Minyak Bumi. http://statistik.migas.esdm.go.id. Diakses pada 14 Maret 2015.
Direktorat Jendral Migas. 2014. Cadangan Minyak Bumi. http://statistik.migas.esdm.go.id. Diakses pada 14 Maret 2015.
Dowe, N., dan McMillan, J. 2008. SSF Experimental Protocols — Lignocellulosic Biomass Hydrolysis and Fermentation: Laboratory Analytical Procedure. National Laboratory of the U.S. Department of Energy. http://www.nrel.gov/biomass/pdfs/42630.pdf. Diakses pada tanggal 17 Oktober 2014.
ESDM. 2015. Indonesia Energy Outlook.
56 Frazier, W. C. dan Westhoff, D. C. 1978. Food Microbiology 4th Edition.
McGraw-Hill Book. New York.
Gauss, W.F., Suzuki, S., dan Takagi, M. 1976. Manufacture of Alcohol from Celulosic Materials Using Plural Ferments. BioResearch Center Company Limited.
Gomez, L.D., Steel-King, C.G., and Mc Queen-Mason, J. 2008. Sustainable Liquid Biofuels From Biomass: The Writing’s On The Wall. New Phytologist. 178 : 473-485.
Lee, H. V., S. B. A. Hamid, dan S. K. Zain. 2014. Conversion of Lignocellulosic Biomass to Nanocellulose: Structure and Chemical Process. The Scientific World Journal2014.
Hambali, E., Prihandana, R., Mujdalipah, S., dan Hendroko, R. 2007. Meraup Untung dari Jarak Pagar. Agromedia Pustaka. Jakarta.
Hambali. E., Mujdalipah, S., Tambunan, A. H., Pattiwiri, A.W., dan Hendroko, R. 2008. Teknologi Bioenergi. Agromedia Pustaka. Jakarta.
Hohmann, S., Krantz, M., dan Nordlander, B. 2007. Yeast Osmoregulation. Methods in Enzymology. No. 428 : 29-45.
Howard R.L., Abotsi E., Jansen van Rensburg, E.L., dan Howard S. 2003. Lignocellulose Biotechnology: Issues Of Bioconversion And Enzyme Production. African Journal of Biotechnol. 2(12) : 602−619.
Hoyer, K., Galbe, M., dan Zacchi, G. 2013. The Effect Of Prehydrolysis And Improved Mixing On High-Solids Batch Simultaneous Saccharification And Fermentation Of Spruce To Ethanol. Process Biochemistry. 48 (2) : 289-293.
Humala, S. 2007. Analisa Logam Berat Timbal, Besi, Kadmium dan Zinkum dalam Lindi Hitam (Black Liquor) pada Industri Pulp Proses Kraft dengan Menggunakan Metode Spektrofotometri Serapan Atom (SSA). (Tesis) .Universitas Sumatera Utara. Medan.
Kementrian ESDM. 2006. Peraturan Presiden Republik Indonesia Nomor 5 Tahun 2006 tentang Kebijakan Energi Nasional. http://psdg.bgl.esdm.go.id/kepmen_pp_uu/perpres%20no5%20tahun%202 0 06.pdf. Diakses tanggal 15 Agustus 2014.
57 Kister, H. Z. 1992. Distillation Design. McGraw-Hill. California. USA.
Kristensen, J.B, Borjersson, B.,Bruun, M.H., Tjerneld, F., dan Jorgensen H., 2007. Use of Surface Active Additives in Enzymatic Hydrolysis of Wheat Straw Lignocelluloses. Enzyme and Microbial Technology Journal. 40 (4) : 888-895.
Kristensen, J.B., Felby, C., dan Jorgensen, H. 2009. Yield-Determining Factors In Highsolids Enzymatic Hydrolysis Of Lignocellulose. Biotechnol Biofuels 2.
Lu, Jie., Xue, Z., Jian, Z., dan Qu, Y. 2012. Enzymatic Saccharification and Ethanol Fermentation of Reed Pretreated with Liquid Hot Water. Journal of Biomedicine and Biotechnology2012.
Mandels, M., Andreotti, R., dan Roche, C. 1976. Measurement of Saccharifying Cellulase. Biotechnol Bioeng Symp. 6 : 21-23.
Masykuri. 2001. Identifikasi Mikroorganisme yang Memfermentasikan Susu Kerbau Lumpur Menjadi Dadih. Pengembangan Peternakan Tropis Edisi Khusus Seminar Nasional Ruminansia. 297-306.
Mensonides, F. I. C., Schuurmans, J. M., de Mattos, M. J. T., Hellingwerf, K. J., dan
Brul, S. 2002. The Metabolic Response Of Saccharomyces Cerevisiae To
Continuous Heat Stress. Molecular Biology Reports. 29 : 103-106.
Mergner, R., Janssen R., Rutz D., de Bari I., Sissot F., Chiaramonti D., Giovannini A., Pescarolo S., dan Nistri R. 2013. Lignocellulosic Ethanol Process and Demonstration. A Handbook Part I. WIP Renewable Energies. Munich.
Miyafuji, H., Danner, H., Neureiter, M., Thomasser, C., and Braun, R. 2003. Effect of Wood Ash treatment Improving the Fermentability of Wood Hydrolysate. Journal of Biotechnology and Bioengineerin. 84 (3) : 390-393.
Mulder, M. 1996, Basic Principles of Membrane. Technology, 2nd ed. Kluwer Academic Pub. Netherlands.
58 Odling-Smee, L. 2007. Biofuel Bandwagon Hits A Rut. Nature. 446:483.
Ohgren, K., Bura, R., Saddler, J., dan Zacchi, G. 2007. Effect Of Hemicellulose And Lignin Removal On Enzymatic Hydrolysis Of Steam Pretreated Corn Stover. Bioresource Technology. 98 : 2503-2510.
Olofsson, K., Bertilsson, M., dan Lidén, G. 2008. A Short Review on SSF- An Interesting Process Option For Ethanol Production From Lignocellulosic Feedstock. BioMed Central Ltd.
Ouyang, J., Li, Z., Xin Li., Ying, H., dan Yong, Q. 2009. Enhanced Enzymatic Conversion And Glucose Production Via Two Step Enzymatic Hydrolysis Of Corn Cob Residue From Xylooligosaccharides Producer’s Waste. BioResources. 4 : 1586–1599.
Palmqvist, E. dan Hahn-Haegerdal, B. 2000. Fermentation of Lignocellulosic Hydrolysates. II: Inhibitors and Mechanisms of Inhibition. Bioresource Technology. 74 : 25-33.
Perez, J., Munoz-Dorado, J., de la Rubia, T., dan Martınez, J. 2002. Biodegradation And Biological Treatment Of Cellulose, Hemicellulose, And Lignin: An Overview. Int Microbiol. 5: 53-63.
Poedjiadi, A.1994. Dasar-Dasar Biokimia. UI Press. Jakarta.
Rabinovich, M., Melnick, M.S. dan Bolobova, A.V. 2002. The Structure and Mechanism of Action of Cellulolytic Enzymes. Biochemistry. 67 : 850-871.
Remli, N.A.M., Md Shah, U.K., Mohamad, R., dan Abd Aziz., S. 2014. Effect Of Chemical And Thermal Pretreatments On The Enzymatic Saccharification Of Rice Straw For Sugar Production. BioResources. 9 (1) : 510–522. Rodhe, A.V., Sateesh, L., Sridevi, J., Venkateswarlu, B., dan Venkateswar, L.
2011. Enzymatic Hydrolysis of Sorghum Straw Using Native Cellulose Produced by T. Reesei NCIM 992 Under Solid State Fermentation Using Rice Straw. Biotech. 1: 207–215.
Safaria, S., Idiawati, N., dan Zaharah, T, A. 2013. Efektivitas Campuran Enzim Selulase Dari Aspergillus niger dan Trichoderma reesei dalam Menghidrolisis Substrat Sabut Kelapa.JKK. 2(1) : 46-51.
59 Sanyoto, S.A. 2013. Dehidrasi Bioetanol dengan Menggunakan Molecular Sieve untuk Mendapatkan Bioetanol Fuel Grade. (Thesis). Universitas Muhammadiyah Purwokerto. Purwokerto.
Samsuri, M., Gozan, M., Prasetya, B., dan Nasikin, M. 2009. Hydrolysis Of Bagassae By Cellulose And Xylanase For Bioethanol Production In Simultaneous Saccharification And Fermentation. Jurnal of Appl and Industrial Biotech at Tropical Region 2.
Samsuri, M., Gozan1, M., Mardias, R., Baiquni, M., Hermansyah1, Prasetya, B,
Nasikin, M., and Watanabe, T.. 2007. Ethanol Production From Bagasse
With Combination Of Cellulose-Cellubiase In Simultaneous Saccharification And Fermentation (SSF) Using White Rot Fungi Pre-Treatment. Journal of Chem and Nat Resources Engineering. 3 : 20-32. Septiyani, R. 2011. Pengaruh Konsentrasi dan Lama Inkubasi Enzim Selulase
terhadap Kadar Gula Reduksi Ampas Tebu. (Skripsi). Universitas Lampung. Bandar Lampung.
Soerawidjaja, H.T. 2009. Bioetanol Generasi Kedua. http:// www.majarimagazine.com/2009/02/bioetanol-generasi-kedua/. Diakses pada tanggal 20 November 2015.
Srinorakutara, T., Subkaree, Y., Bamrungchue, N., Suttikul, S., Panphan, V., Pripanpong, P., Burapatana, V. 2012. The Effect Of High Solid Loading And Sulfuric Acid Pretreatment Following Commercial Cellulose Saccharification In 5L Fermenter On Reducing Sugar Concentration For Cellulosic Ethanol Production. The 24th Annual Meeting of the Thai Society for Biotechnology Renewable Energy and Global Care. Thai Society for Biotechnology (TSB). Thailand.
Sudarmadji, S. 1984. Prosedur Analisa Untuk Bahan Makanan dan Pertanian. Edisi Ketiga. Liberty. Yogyakarta.
Sun, Y., dan Cheng, J. 2002. Hydrolysis of Lignocellulosic Materials for Ethanol Production: A Review. BioResource Technology Journal. 83 (1) : 1-11. Sutikno, Hidayati, S., Nawansih, O., Nurainy, F., Rizal, S., Marniza., dan Arion,
R. 2010. Tingkat Degradasi Lignin Bagas Tebu Akibat Perlakuan Basa
Pada Berbagai Kondisi.
60 Taherzadeh, M.J., dan Karimi, K. 2007. Acid-based hydrolysis processes for ethanol from lignocellulosic materials : A review. BioResources. 2 (3) : 472-499.
Tengborg, C., Galbe, M., dan Zacchi, G. 2001. Influence Of Enzyme Loading And Physical Parameters On The Enzymatic Hydrolysis Of Steam-Pretreated Softwood. Biotechnol. 17(1) : 110-117.
Teugjas, H. dan Valjamae, P.