KERAGAMAN GENETIK MUTAN KEDELAI (Glycine max L.) M2 DAN M3 BERDASARKAN MARKA RAPD SERTA PENGARUH NAUNGAN
TERHADAP PERTUMBUHAN DAN PRODUKSI M3 HASIL MUTASI KOLKISIN
THESIS
Oleh:
DWI YULIANA SARAGIH NIM : 117001015
PROGRAM MAGISTER AGROEKOTEKNOLOGI FAKULTAS PERTANIAN
UNIVERSITAS SUMATERA UTARA MEDAN
KERAGAMAN GENETIK MUTAN KEDELAI (Glycine max L.) M2 DAN M3 BERDASARKAN MARKA RAPD SERTA PENGARUH NAUNGAN
TERHADAP PERTUMBUHAN DAN PRODUKSI M3 HASIL MUTASI KOLKISIN
THESIS
Oleh:
DWI YULIANA SARAGIH NIM : 117001015
Diajukan Sebagai Salah Satu Syarat Untuk Memperoleh Gelar Magister Pertanian Dalam Program Studi Agroekoteknologi
Fakultas Pertanian Universitas Sumatera Utara
PROGRAM MAGISTER AGROEKOTEKNOLOGI FAKULTAS PERTANIAN
UNIVERSITAS SUMATERA UTARA MEDAN
LEMBAR PENGESAHAN
Judul Penelitian : KERAGAMAN GENETIK MUTAN KEDELAI (Glycine max L.) M2 DAN M3 BERDASARKAN
MARKA RAPD SERTA PENGARUH NAUNGAN TERHADAP PERTUMBUHAN DAN PRODUKSI M3 HASIL MUTASI KOLKISIN
Mahasiswa : Dwi Yuliana Saragih
N I M : 117001015
Program Studi : Agroekoteknologi
Menyetujui Komisi Pembimbing
Tanggal Lulus: 23 Januari 2014 Dr. Ir. Lollie Agustina P. Putri, MSi
Ketua
Dr. Dra. Ir. Chairani Hanum, MP Anggota
Ketua Program Studi
Prof. Dr. Ir. Abdul Rauf, MP
Dekan Fakultas Pertanian
Telah Diuji Pada :
Tanggal : 23 Januari 2014
PANITIA PENGUJI TESIS
Ketua : Dr. Ir. Lollie Agustina P. Putri, MSi Anggota : Dr. Dra. Ir. Chairani Hanum, MP
Prof. Dr. Ir. Rosmayati, MS
ABSTRAK
DWI YULIANA SARAGIH. Keragaman Genetik Mutan Kedelai (Glycine max L.) M2 dan M3 Berdasarkan Marka RAPD serta Pengaruh
Naungan Terhadap Pertumbuhan dan Produksi M3 Hasil Mutasi Kolkisin.
Dibimbing oleh LOLLIE AGUSTINA P.PUTRI sebagai ketua komisi pembimbing dan CHAIRANI HANUM sebagai anggota komisi pembimbing.
Tujuan penelitian ini adalah untuk mengetahui keragaman genetik kedelai generasi M2 dan M3 berdasarkan marka RAPD (Random Amplified Polymorphic
DNA) serta pertumbuhan dan perkembangan mutan kedelai generasi M3 hasil mutasi kolkisin pada kondisi naungan.
Sebanyak 13 genotip kedelai meliputi genotip Cikurai, Malikka; genotip mutan Cikurai generasi M2, M3; dan genotip mutan Malikka generasi M2, M3
dianalisis keragaman genetiknya dengan menggunakan marka RAPD dan dilihat pengaruh naungan 50% terhadap pertumbuhan dan produksi empat genotip kedelai meliputi genotip Cikurai, genotip Malikka, genotip mutan M3 Cikurai, dan
genotip mutan M3 Malikka.
Perhitungan koefisien keragaman genetik dan pembentukan dendogram dilakukan dengan bantuan program DARwin 5.05. Analisis data dengan menggunakan Rancangan Acak Kelompok (RAK) Non Faktorial.
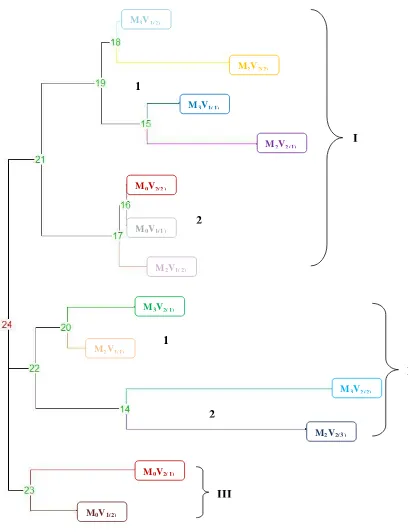
Dari 5 genotip M2 dan 4 genotip M3 diperoleh 8 genotip yang tidak mengelompok dengan genotip M0 yaitu genotip M2V1(2), M2V2(1), M2V2(2),
M2V2(3), M3V1(1), M3V1(2), M3V2(1), dan M3V2(2). Naungan 50% berpengaruh
nyata terhadap tinggi tanaman, jumlah buku, umur berbunga, rasio klorofil a/b 21 HST, kandungan klorofil b 56 HST, luas daun 56 HST, bobot daun spesifik 21 dan 56 HST, jumlah polong persampel, jumlah polong berisi persampel, bobot 100 biji, produksi persampel, dan produksi per plot. Genotip Cikurai dan mutan Cikurai generasi M3 memiliki produksi yang paling tinggi. Nilai duga heritabilitas
berkisar 0.12-1.00 dengan nilai KVG 0.5-29.51 dan nilai KVP 0.98-60.49.
ABSTRACT
DWI YULIANA SARAGIH. Genetic Diversity Analysis of Soybean Mutant M2 and M3 Based On RAPD Marker and Shading Effect on The Growth
and Production of M3 Colchicine Mutation. Supervised by LOLLIE AGUSTINA
P.PUTRI and CHAIRANI HANUM.
The objective of this research was to analysis genetic diversity of M2 and
M3 generation of soybean using RAPD and growth and production of M3
generation’s colchicine mutation on low light intensity.
A total of 13 soybean genotypes include Cikurai genotypes, Malikka; Cikurai M2 and M3 mutant generation; and Malikka M2 and M3 mutant
generation analyzed using RAPD. Shading effect on the growth and production of 4 soybean genotypes include Cikurai genotype, Malikka genotype, Cikurai M3
mutant generation, and Malikka M3 mutant generation.
The result of this research showed that from 5 M2 genotypes and 4 M3
genotypes was 8 genotypes that are not in a group with M0 genotypes is M2V1(2),
M2V2(1), M2V2(2), M2V2(3), M3V1(1), M3V1(2), M3V2(1), and M3V2(2) genotype.
Using non-factorial randomized block design showed that shading had significant effect on plant height, flowering, ratio of a/b chlorophyll 21 DAP, chlorophyll b 56 DAP, leaf area 56 DAP, specific leaf weight 21 and 56 DAP, number of pods per sample, number of pods containing per sample, 100 seed weight, production per sample, and production per ha. Cikurai genotype and Cikurai M3 mutant generation are the highest production. The estimation of the
heritability coefficientsfrom 0.12 – 1.00 with coefficient of genotypes variations about 0.5 – 29.51 and coefficient of phenotypic variation about 0.98 – 60.49
UCAPAN TERIMA KASIH
Puji dan Syukur penulis ucapkan kepada Tuhan Yang Maha Kuasa atas
segala rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan tesis dan
program studi Agroekoteknologi, Program Pascasarjana Fakultas Pertanian
Universitas Sumatera Utara.
Pada kesempatan ini penulis mengucapkan terima kasih kepada Ibu
Dr.Ir.Lollie Agustina P.Putri, MSi sebagai ketua komisi pembimbing dan Ibu
Dr.Dra.Ir.Chairani Hanum, MP sebagai anggota komisi pembimbing. Dan juga
kepada Prof.Dr.Ir.Rosmayati, MS; Lutfi Azis M Siregar, SP, MSc, PhD; Dr.Diana
Sofia, SP, MP sebagai komisi penguji yang telah banyak memberikan saran,
masukan dan bimbingan yang sangat berguna bagi penulis dalam menyelesaikan
tesis ini.
Terima kasih juga penulis sampaikan sebesar-besarnya kepada ayahanda
Agusman Saragih dan Ibunda Rosdiana br. Pardede, SPd yang telah membesarkan
dan mendidik penulis selama ini serta abang saya dr. Edwin Batara Saragih dan
kedua adik saya Mutiara Saragih dan Marry Inriani Saragih dan teman terdekat
saya Roni Vansaro Gulo, SP yang telah menjadi penyemangat selama masa
perkuliahan. Penulis juga mengucapkan terima kasih kepada dr. Tetty Aman
Nasution beserta staff Laboratorium Terpadu Fakultas Kedokteran Universitas
Sumatera Utara yang telah memberikan izin serta membantu didalam
menyelesaikan penelitian ini.
Terima kasih penulis sampaikan kepada Rektor Universitas Sumatera
Direktur Pascasarjana USU Bapak Prof. Dr. Ir. A. Rahim Matondang, MSIE.,
Dekan Fakultas Pertanian USU Bapak Prof. Dr. Ir. Darma Bakti, MS dan kepada
Ketua Program Studi Agroekoteknologi Bapak Prof. Dr. Ir. Abdul rauf, MP serta
segenap dosen Program Magister Agroekoteknologi dan staff tata usaha.
Tidak lupa juga penulis ucapkan terima kasih kepada Rintha Meylisa
Gulo, SE., Siti Hardiyanti SP., serta kawan-kawan program studi Magister
Agroekoteknologi angkatan 2011 Fakultas Pertanian USU.
Medan, Maret 2014
KATA PENGANTAR
Puji dan Syukur penulis ucapkan kepada Tuhan Yang Maha Esa karena
atas kehendakNya penulis dapat menyelesaikan tesis ini yang berjudul
“Keragaman Genetik Mutan Kedelai (Glycine max L.) M2 dan M3 Berdasarkan
Marka RAPD Serta Pengaruh Naungan Terhadap Pertumbuhan dan Produksi M3
Hasil Mutasi Kolkisin” yang merupakan salah satu syarat untuk dapat
memperoleh gelar magister pada Sekolah Pasca Sarjana Universitas Sumatera
Utara, Medan.
Pada kesempatan ini penulis mengucapkan terima kasih kepada dosen
pembimbing yang telah banyak membantu penulis untuk menyelesaikan Tesis ini
yaitu kepada Ibu Dr.Ir.Lollie Agustina P.Putri, MSi sebagai ketua komisi
pembimbing dan kepada Ibu Dr.Dra.Ir.Chairani Hanum, MP sebagai anggota
komisi pembimbing.
Akhir kata penulis mengucapkan terima kasih, dan semoga tulisan ini
dapat bermanfaat.
Medan, Maret 2014
RIWAYAT HIDUP
Dwi Yuliana Saragih, dilahirkan pada tanggal 2 Juli 1990 di Dolok Silau Simalungun Sumatera Utara Bapak bernama Agusman Saragih dan Ibu Rosdiana
Pardede merupakan anak kedua dari empat bersaudara.
Riwayat pendidikan yang telah dicapai penulis sampai saat ini adalah:
1. Tahun 1995 – 2001, bersekolah di Sekolah Dasar Sw. Sultan Agung
Pematangsiantar.
2. Tahun 2001 – 2004, bersekolah di Sekolah Menengah Pertama Sw.
Sultan Agung Pematangsiantar.
3. Tahun 2004 – 2007, bersekolah di Sekolah Menengah Atas Negeri 4
Pematangsiantar.
4. Tahun 2007 diterima di Fakultas Pertanian Universitas Sumatera
Utara, dan lulus tahun 2011 pada Jurusan Budidaya Pertanian Program
Studi Pemuliaan Tanaman.
5. Agustus 2011 Penulis diterima menjadi mahasiswa S2 di Sekolah
Pasca Sarjana Program Studi Agroekoteknologi, Universitas Sumatera
DAFTAR ISI
Penelitian I. Identifikasi Molekuler Mutan Kedelai Generasi M2 dan M3 ... 23
Uji Kualitas DNA ... 25
Analisis Data ... 26
Penelitian II. Pengaruh Naungan Terhadap Pertumbuhan dan Produksi Mutan Kedelai Generasi M3 Hasil Mutasi Kolkisin ... 28
Keragaman Genetik ... 29
Kandungan Klorofil a (mg/l) ... 34\
Jumlah Polong Berisi Persampel (polong) ... 35
Bobot 100 Biji (g) ... 35
Produksi Persampel (g) ... 35
Produksi Perplot (g) ... 36
HASIL DAN PEMBAHASAN Hasil Identifikasi Molekuler Mutan Kedelai Generasi M2 dan M3 Uji Kualitas DNA ... 37
Uji Kuantitas DNA ... 38
Hasil PCR dengan Marka RAPD ... 39
Pengaruh Naungan Terhadap Pertumbuhan dan Produksi Mutan Kedelai M3 Hasil Mutasi Kolkisin ... 46
Heritabilitas ... 58
Keragaman Genotip dan Fenotip ... 59
Pembahasan Identifikasi Molekuler Mutan Kedelai Generasi M2 dan M3 ... 61
DAFTAR TABEL
No. Hal
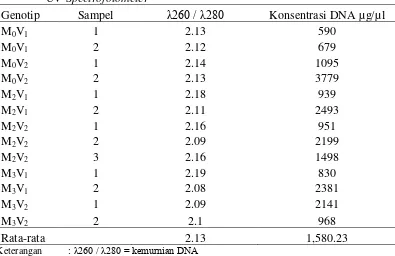
1. Kuantitas dan konsentrasi DNA genotip kedelai dengan uji
UV-Spectrofotometer ... 39
2. Persentase polimorfik primer RAPD ... 42
3. Tinggi tanaman beberapa genotip kedelai ... 46
4. Uji progenitas tinggi tanaman M3 dengan M0 ... 46
5. Jumlah buku beberapa genotip kedelai ... 47
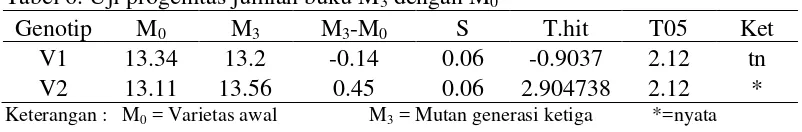
6. Uji progenitas jumlah buku M3 dengan M0 ... 47
7. Jumlah cabang beberapa genotip kedelai ... 48
8. Uji progenitas jumlah cabang M3 dengan M0 ... 48
9. Umur berbunga beberapa genotip kedelai ... 49
10. Uji progenitas berbunga M3 dengan M0 ... 49
11. Kandungan Klorofil a, b, dan rasio klorofil a/b 21 HST beberapa genotip kedelai ... 50
12. Uji progenitas kandungan klorofil a, b, dan rasio klorofil a/b 21 HST M3 dengan M0 ... 50
13. Kandungan Klorofil a, b, dan rasio klorofil a/b 56 HST beberapa genotip kedelai ... 51
14. Uji progenitas kandungan klorofil a, b, dan rasio klorofil a/b 56 HST M3 dengan M0 ... 51
15. Rasio tajuk/ akar 21 HST dan 56 HST beberapa genotip kedelai ... 52
16. Uji progenitas rasio tajuk/ akar 21 HST dan 56 HST M3 dengan M0 ... 52
17. Luas daun 21 HST dan 56 HST beberapa genotip kedelai ... 53
18. Uji progenitas luas daun 21 HST dan 56 HST M3 dengan M0 ... 53
19. Bobot daun spesifik 21 HST dan 56 HST beberapa genotip kedelai ... 54
20. Uji progenitas bobot daun spesifik 21 HST dan 56 HST M3 dengan M0 ... 55
22. Uji progenitas umur panen M3 dengan M0 ... 56
23. Jumlah polong persampel dan jumlah polong berisi persampel beberapa
genotip kedelai ... 56
24. Uji progenitas jumlah polong persampel dan jumlah polong berisi
persampel M3 dengan M0 ... 57
25. Bobot 100 biji, produksi persampel, dan produksi perplot beberapa
genotip kedelai ... 57
26. Uji progenitas bobot 100 biji, produksi persampel, dan produksi perplot
M3 dengan M0 ... 58
27. Nilai duga heritabilitas (h2
) masing-masing genotip per parameter ... 59
28. Koefisien Variabilitas Genotip (KVG) dan Koefisien Variabilitas
DAFTAR GAMBAR
No. Hal
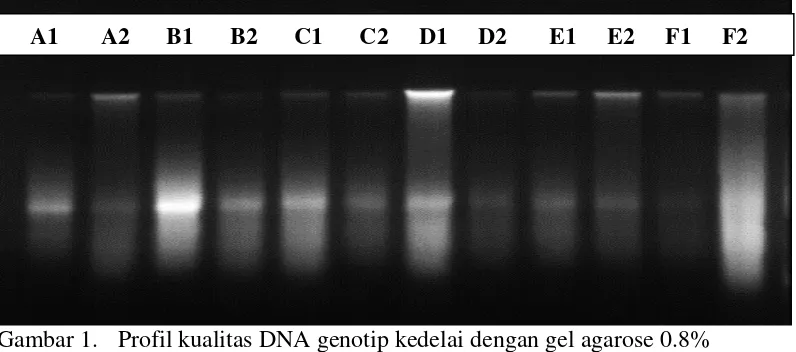
1. Profil kualitas DNA genotip kedelai dengan gel agarose 0.8% ... 38
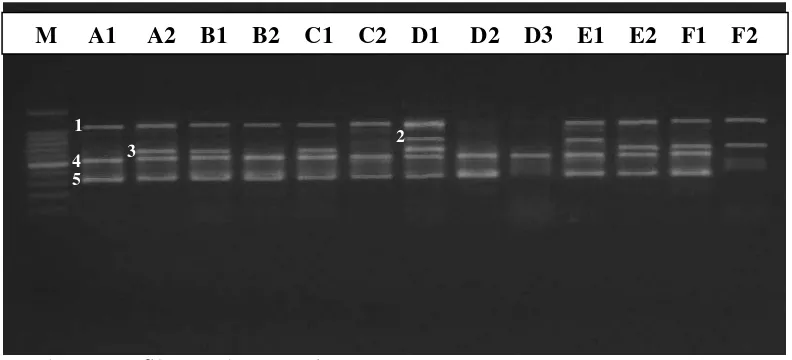
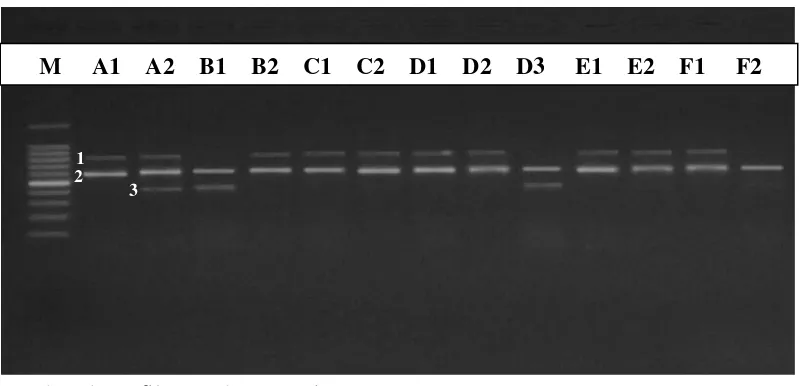
2. Profil PCR dengan primer OPD-03 ... 40
3. Profil PCR dengan primer OPD-20 ... 40
4. Profil PCR dengan primer OPH-06 ... 41
5. Profil PCR dengan primer OPH-09 ... 41
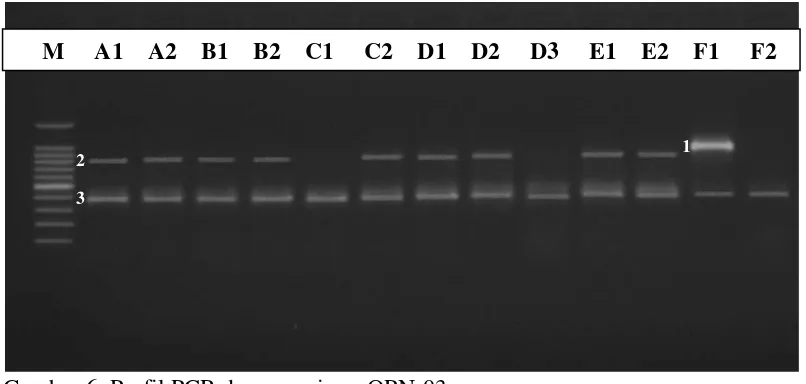
6. Profil PCR dengan primer OPN-03 ... 42
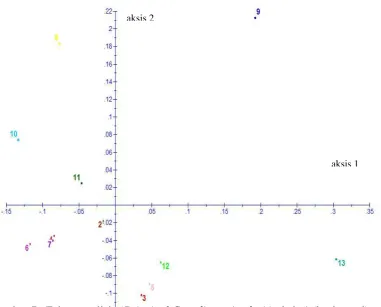
7. Faktor analisis (Principal Coordinate Analysis) aksis 1 (horizontal) dan aksis 2 (vertikal) dengan 5 Marka RAPD ... 43
DAFTAR LAMPIRAN
No. Hal
1. Deskripsi 2 varietas kedelai ... 82
2. Bagan lahan percobaan ... 84
3. Bagan plot tanaman ... 85
4. Data pengamatan tinggi tanaman pada 2 MST (cm) ... 86
5. Daftar sidik ragam tinggi tanaman pada 2 MST ... 86
6. Data pengamatan tinggi tanaman pada 4 MST (cm) ... 86
7. Daftar sidik ragam tinggi tanaman pada 4 MST ... 86
8. Data pengamatan tinggi tanaman pada 6 MST (cm) ... 87
9. Daftar sidik ragam tinggi tanaman pada 6 MST ... 87
10. Data pengamatan tinggi tanaman pada 8 MST (cm) ... 87
11. Daftar sidik ragam tinggi tanaman pada 8 MST ... 87
12. Data pengamatan jumlah buku 8 MST (buku) ... 88
13. Daftar sidik ragam jumlah buku 8 MST ... 88
14. Data pengamatan jumlah cabang (cabang) ... 88
15. Daftar sidik ragam jumlah cabang ... 88
16. Data pengamatan umur berbunga (HST) ... 89
17. Daftar sidik ragam umur berbunga ... 89
18. Data pengamatan jumlah klorofil a 21 HST (mg/l) ... 89
19. Daftar sidik ragam jumlah klorofil a 21 HST ... 89
20. Data pengamatan jumlah klorofil b 21 HST (mg/l) ... 90
21. Daftar sidik ragam jumlah klorofil b 21 HST ... 90
22. Data pengamatan rasio klorofil a/b 21 HST (mg/l) ... 90
24. Data pengamatan jumlah klorofil a 56 HST (mg/l) ... 91
38. Data pengamatan bobot daun spesifik 21 HST (g/cm2 ) ... 94
39. Daftar sidik ragam bobot daun spesifik 21HST ... 95
40. Data pengamatan bobot daun spesifik 56 HST (g/cm2 ) ... 95
41. Daftar sidik ragam bobot daun spesifik 56 HST ... 96
42. Data pengamatan umur panen (HST) ... 96
43. Daftar sidik ragam umur panen ... 96
44. Data pengamatan jumlah polong persampel (polong) ... 96
45. Daftar sidik ragam jumlah polong persampel ... 96
46. Data pengamatan jumlah polong berisi persampel (polong) ... 97
47. Daftar sidik ragam jumlah polong berisi persampel ... 97
48. Data pengamatan bobot 100 biji (g) ... 97
49. Daftar sidik ragam bobot 100 biji ... 97
51. Daftar sidik ragam produksi persampel ... 98
52. Data pengamatan produksi perplot (g) ... 98
53. Daftar sidik ragam produksi perplot ... 98
54. Foto lahan ... 99
55. Foto tanaman 2 MST – 9 MST ... 99
56. Data scoring ... 105
ABSTRAK
DWI YULIANA SARAGIH. Keragaman Genetik Mutan Kedelai (Glycine max L.) M2 dan M3 Berdasarkan Marka RAPD serta Pengaruh
Naungan Terhadap Pertumbuhan dan Produksi M3 Hasil Mutasi Kolkisin.
Dibimbing oleh LOLLIE AGUSTINA P.PUTRI sebagai ketua komisi pembimbing dan CHAIRANI HANUM sebagai anggota komisi pembimbing.
Tujuan penelitian ini adalah untuk mengetahui keragaman genetik kedelai generasi M2 dan M3 berdasarkan marka RAPD (Random Amplified Polymorphic
DNA) serta pertumbuhan dan perkembangan mutan kedelai generasi M3 hasil mutasi kolkisin pada kondisi naungan.
Sebanyak 13 genotip kedelai meliputi genotip Cikurai, Malikka; genotip mutan Cikurai generasi M2, M3; dan genotip mutan Malikka generasi M2, M3
dianalisis keragaman genetiknya dengan menggunakan marka RAPD dan dilihat pengaruh naungan 50% terhadap pertumbuhan dan produksi empat genotip kedelai meliputi genotip Cikurai, genotip Malikka, genotip mutan M3 Cikurai, dan
genotip mutan M3 Malikka.
Perhitungan koefisien keragaman genetik dan pembentukan dendogram dilakukan dengan bantuan program DARwin 5.05. Analisis data dengan menggunakan Rancangan Acak Kelompok (RAK) Non Faktorial.
Dari 5 genotip M2 dan 4 genotip M3 diperoleh 8 genotip yang tidak mengelompok dengan genotip M0 yaitu genotip M2V1(2), M2V2(1), M2V2(2),
M2V2(3), M3V1(1), M3V1(2), M3V2(1), dan M3V2(2). Naungan 50% berpengaruh
nyata terhadap tinggi tanaman, jumlah buku, umur berbunga, rasio klorofil a/b 21 HST, kandungan klorofil b 56 HST, luas daun 56 HST, bobot daun spesifik 21 dan 56 HST, jumlah polong persampel, jumlah polong berisi persampel, bobot 100 biji, produksi persampel, dan produksi per plot. Genotip Cikurai dan mutan Cikurai generasi M3 memiliki produksi yang paling tinggi. Nilai duga heritabilitas
berkisar 0.12-1.00 dengan nilai KVG 0.5-29.51 dan nilai KVP 0.98-60.49.
ABSTRACT
DWI YULIANA SARAGIH. Genetic Diversity Analysis of Soybean Mutant M2 and M3 Based On RAPD Marker and Shading Effect on The Growth
and Production of M3 Colchicine Mutation. Supervised by LOLLIE AGUSTINA
P.PUTRI and CHAIRANI HANUM.
The objective of this research was to analysis genetic diversity of M2 and
M3 generation of soybean using RAPD and growth and production of M3
generation’s colchicine mutation on low light intensity.
A total of 13 soybean genotypes include Cikurai genotypes, Malikka; Cikurai M2 and M3 mutant generation; and Malikka M2 and M3 mutant
generation analyzed using RAPD. Shading effect on the growth and production of 4 soybean genotypes include Cikurai genotype, Malikka genotype, Cikurai M3
mutant generation, and Malikka M3 mutant generation.
The result of this research showed that from 5 M2 genotypes and 4 M3
genotypes was 8 genotypes that are not in a group with M0 genotypes is M2V1(2),
M2V2(1), M2V2(2), M2V2(3), M3V1(1), M3V1(2), M3V2(1), and M3V2(2) genotype.
Using non-factorial randomized block design showed that shading had significant effect on plant height, flowering, ratio of a/b chlorophyll 21 DAP, chlorophyll b 56 DAP, leaf area 56 DAP, specific leaf weight 21 and 56 DAP, number of pods per sample, number of pods containing per sample, 100 seed weight, production per sample, and production per ha. Cikurai genotype and Cikurai M3 mutant generation are the highest production. The estimation of the
heritability coefficientsfrom 0.12 – 1.00 with coefficient of genotypes variations about 0.5 – 29.51 and coefficient of phenotypic variation about 0.98 – 60.49
PENDAHULUAN Latar Belakang
Peningkatan produksi kedelai nasional melalui perluasan areal tanam
memiliki potensi yang cukup besar, antara lain melalui penggunaan lahan dibawah
tegakan tanaman perkebunan karet dan kelapa sawit. Menurut Asadi dan Arsyad
(1991), intensitas cahaya berkurang hingga mencapai 75% dibawah tegakan
tanaman perkebunan karet. Kedelai memerlukan radiasi matahari yang optimum
(sekitar 0,3 – 0,8 kal/ cm2/ menit setara 431-1152 kal/ cm2/ hari) dengan spectrum
atau panjang gelombang berkisar 400 – 700 nm untuk mendapatkan hasil bersih
fotosintat yang tinggi. Anderson (2000) juga menjelaskan bahwa tanaman yang
tumbuh di lingkungan bercekaman tersebut sulit mengekspresikan potensial
genetiknya secara utuh untuk tumbuh, berkembang, dan berproduksi secara
maksimum. Sihar (1997) menyatakan bahwa intensitas penyinaran dibawah tajuk
tanaman karet berkisar 50 – 80 % pada umur 3 tahun, 25 – 40 % pada umur 4
tahun dan makin sedikit bila makin tua. Dilaporkan bahwa hasil kedelai menurun
rata-rata 30-60% pada kondisi cekaman naungan. Handayani (2003) juga
melaporkan bahwa akibat cekaman naungan 50%, hasil per hektar tanaman
kedelai menurun 10-40%. Oleh karena itu diperlakuan upaya pemuliaan untuk
memperoleh genotipe atau varietas unggul baru kedelai yang mampu beradaptasi
pada lingkungan bercekaman intensitas cahaya rendah.
Salah satu program pemuliaan tanaman yang dapat digunakan untuk
mendapatkan kultivar atau varietas unggul adalah dengan teknik pemuliaan
mutasi. Penggunaan teknik mutasi dalam program pemuliaan tanaman dilakukan
perubahan-perubahan genetik. Pada poliploid terjadi penggandaan set kromosom
(Welsh, 1991).
Menurut Hetharie (2003), pemuliaan poliploidi dapat memperbaiki sifat
tanaman dan menambah kejaguran. Tanaman poliploidi mempunyai penampilan
morfologi meliputi daun, bunga, batang, umbi lebih jagur atau vigor dibandingkan
dengan tanaman diploid. Suryo (1995) juga menjelaskan bahwa pemberian
kolkisin dapat meningkatkan bahan-bahan organik di dalam sel seperti protein dan
vitamin serta terjadi peningkatan berat total tanaman dan jumlah sel.
Keragaman genetik sesungguhnya mencerminkan kemampuan adaptasi
tanaman, sehingga dapat dikatakan populasi dengan keragaman genetik yang
tinggi memiliki kemampuan adaptasi yang tinggi pula. Menurut Stern dan Roche
(2004) nilai adaptasi populasi dari lingkungan yang berbeda-beda menjadi sumber
keragaman fenotip. Adaptasi secara evolusioner diikuti oleh perubahan struktur
genetik. Informasi genetik diubah melalui reaksi-reaksi terhadap seleksi dari
generasi ke generasi, adaptasi yang telah ada ditingkatkan atau mengembangkan
adaptasi yang baru. Menurut Finkeldey (2005), keragaman genetik pada suatu
populasi dipengaruhi oleh beberapa faktor yaitu mutasi dan aliran gen yang
meningkatkan keragaman genetik.
Marka molekuler merupakan alat yang sangat baik bagi pemulia dan ahli
genetik untuk menganalisis genom tanaman. Marka molekuler juga dapat
diartikan sebagai upaya untuk membedakan karakteristik tanaman pada tingkat
gen. Penggunaan marka molekuler utamanya untuk memonitor variasi susunan
DNA di dalam spesies. Penanda molekuler banyak digunakan dalam analisis
DNA (RAPD). RAPD digunakan untuk mengidentifikasi genotip tanaman karena memiliki kelebihan dalam pelaksanaan dan analisa.
Hasil penelitian terdahulu (Saragih, 2011) dari mutan M1 Cikurai (V1) dan
mutan M1 Malikka (V2) hasil mutasi kolkisin untuk data vegetatif tidak berbeda
nyata, sedangkan untuk data generatif berbeda nyata seperti pada V1 umur
berbunga lebih cepat dan data produksi jumlah polong berisi yang lebih banyak
pada V2, tetapi V1 memiliki bobot 100 butir yang lebih besar, dan produksi per ha
tertinggi pada V1. Dari hasil penelitian M1, berdasarkan produksi mutan yang
berpotensi sebagai genotip yang toleran pada kondisi naungan adalah V2 .
Selanjutnya (Rahmadani, 2012) pada mutan generasi M2 Cikurai (V1) dan
mutan generasi M2 Malikka (V2) hasil mutasi kolkisin untuk data vegetatif tidak
berbeda nyata, sedangkan data generatif umur berbunga berbeda nyata pada V1
lebih cepat. Umur panen yang paling cepat juga terdapat pada V1. Untuk data
produksi per plot tertinggi yaitu pada V2. Dari hasil penelitian generasi M2,
berdasarkan produksi mutan yang berpotensi sebagai genotip yang toleran pada
kondisi naungan adalah V2.
Berdasarkan latar belakang diatas penulis tertarik untuk melakukan
penelitian selanjutnya guna mengetahui kelanjutan pertumbuhan vegetatif,
generatif, dan produksi dari mutan kedelai generasi M3 serta keragaman genetik
mutan kedelai M2 dan M3 yang dianalisis berdasarkan RAPD.
Tujuan Penelitian
Untuk mengetahui keragaman genetik genotip mutan kedelai generasi M2
pertumbuhan dan perkembangan mutan kedelai generasi M3 hasil mutasi kolkisin
pada kondisi naungan 50%.
Hipotesis Penelitian
Ada keragaman genetik kedelai hasil mutasi kolkisin dan ada pengaruh
kondisi naungan 50% terhadap pertumbuhan dan perkembangan mutan generasi
M3.
Manfaat Penelitian
Manfaat yang dapat diperoleh dengan mengevaluasi keragaman fenotip dan
genotip beberapa genotip mutan generasi M3 serta mengetahui keragaman genetik
M2 dan M3 antara lain :
1. Mendapatkan keragaman fenotip dan genotip kedelai M3 yang ditanam pada
kondisi naungan.
TINJAUAN PUSTAKA
Kedelai (Glycine max L.)
Botani Tanaman
Kedelai (Glycine max (L.) Merr.) merupakan anggota dari famili Leguminosae, subfamili Papilionideae, dan termasuk ke dalam genus Glycine L. (Johnson dan Bernard, 1963). Bibit kedelai berkecambah dengan tipe
perkecambahan epigeal dengan kotiledon tebal dan berdaging, berwarna kuning
atau hijau. Tanaman ini biasanya tegak dan merupakan herba tahunan yang lebat
dengan tinggi mencapai dua meter dan kadang-kadang agak merambat. Sistem
perakaran tunggang bercabang dengan panjang akar mencapai dua meter. Akar
lateral menyebar secara horizontal hingga 2.5 meter (Giller dan Dashiell, 2010).
Bunga kedelai termasuk bunga sempurna, artinya dalam satu bunga
terdapat alat kelamin jantan dan betina. Bunga dapat melakukan penyerbukan
sendiri, yaitu kepala putik diserbuki oleh tepung sari dari bunga yang sama.
Penyerbukan terjadi sebelum bunga mekar sehingga disebut penyerbukan
kleistogami (penyerbukan tertutup). Karena cara penyerbukannya tertutup,
kemungkinan terjadinya persilangan alami kurang dari 0,5%. Akibatnya suatu
varietas dapat dipertahankan kemurniannya hingga bertahun-tahun
(Sumarno 1983).
Polong kedelai pertama kali terbentuk sekitar 7-10 hari setelah munculnya
bunga pertama. Panjang polong muda sekitar 1 cm. Jumlah polong yang terbentuk
pada setiap ketiak tangkai daun sangat beragam, antara 1-10 buah dalam setiap
bahkan ratusan. Kecepatan pembentukan polong dan pembesaran biji akan
semakin cepat setelah proses pembentukan bunga berhenti. Ukuran dan bentuk
polong menjadi maksimal pada saat awal periode pemasakan biji. Hal ini
kemudian diikuti oleh perubahan warna polong, dari hijau menjadi kuning
kecoklatan pada saat masak (Sumarno 1983).
Syarat Tumbuh Iklim
Suhu tanah yang optimal dalam proses perkecambahan yaitu 300 C. Bila
suhu lingkungan sekitar 400 C pada masa tanaman berbunga, bunga tersebut akan
rontok sehingga jumlah polong dan biji kedelai menjadi berkurang. Suhu yang
terlalu rendah (100 C), seperti pada daerah subtropik, dapat menghambat proses
pembungaan dan pembentukan polong kedelai. Suhu optimal untuk pembentukan
bunga yaitu 24 – 250 C (Tindall, 1983).
Kebutuhan cahaya bagi kedelai untuk mencapai fotosintesis maksimal
adalah berkisar antara 0.3 – 0.8 kal/cm2/menit atau setara dengan 432 – 1152
kal/cm2/hari (Salisbury dan Ross, 1992).
Kondisi iklim yang cocok umumnya adalah daerah dengan kelembaban
udara (RH) rata-rata 65% dan curah hujan paling optimum antara 100-200
mm/bulan. Kedelai membutuhkan setidaknya 500 mm air selama musim
pertumbuhan untuk perkembangan yang baik dengan konsumsi air dalam kondisi
Tanah
Pada umumnya kedelai menghendaki tanah yang berstruktur remah
dengan keasaman sedang (pH 5-7). Nilai pH ideal bagi pertumbuhan kedelai
6.0-6.8. Apabila pH diatas 7.0 kedelai mengalami klorosis sehingga tanaman
menjadi kerdil dan daunnya menguning. Sementara pada pH di bawah 5.0 kedelai
mengalami keracunan Al, Fe, dan Mn, sehingga pertumbuhannya terganggu
(Baharsjah, 1992).
Varietas
Untuk mempertahankan kemurnian agar seragam dan keunggulannya tetap
di miliki, perlu mempelajari sifat-sifat morfologis tanaman seperti tipe
tumbuh,warna hipokotil, warna bunga, warna bulu, umur berbunga, dan sifat-sifat
kuantitatif seperti tinggi tanaman, ukuran biji, dan ukuran daun. Pengenalan atau
identifikasi varietas unggul adalah suatu teknik untuk menentukan apakah yang
dihadapi tersebut adalah benar varietas unggul yang dimaksudkan.
Pelaksanaannya dapat dilakukan dengan mempergunakan alat pegangan berupa
deskripsi varietas (Gani, 2000).
Varitas unggul kedelai mempunyai keunggulan tertentu dibanding dengan
varietas lokal, keunggulan dapat berupa hasil yang lebih tinggi, batang lebih
pendek (genjah) lebih tahan terhadap hama/penyakit dan lain-lain. Kedelai yang
unggul untuk suatu daerah belum tentu unggul didaerah lain tergantung kepada
topografi, iklim dan cara tanam (Departemen Pertanian, 1990).
Tingkat hasil suatu tanaman ditentukan oleh interaksi faktor genetis
ketersediaan air, dan pengelolaan tanaman. Tingkat hasil varietas unggul yang
tercantum dalam deskripsi umumnya berupa angka rata-rata dari hasil yang
terendah dan tertinggi pada beberapa lokasi dan musim. Potensi hasil varietas
unggul dapat saja lebih tinggi atau lebih rendah pada lokasi tertentu dengan
penggunaan masukan dan pengelolaan tertentu pula (Gani, 2000).
Varietas atau klon introduksi perlu diuji adaptabilitasnya pada suatu
lingkungan untuk mendapatkan genotip unggul pada lingkungan tersebut. Pada
umumnya suatu daerah memiliki kondisi lingkungan yang berbeda terhadap
genotip. Respon genotip terhadap faktor lingkungan ini biasanya terlihat dalam
penampilan fenotipe dari tanaman bersangkutan (Darliah et. al, 2001).
Mutasi Kolkisin
Mutasi adalah perubahan yang terjadi secara struktural pada material
genetik yang merupakan bagian dari fenomena dasar kehidupan. Bila mutasi tidak
pernah terjadi, maka material kehidupan tidak akan mengalami perkembangan dan
beradaptasi terhadap berbagai kondisi ekologis yang ada. Berdasarkan sejarah,
mutasi telah terjadi secara spontan, yang disebabkan oleh sejumlah fenomena
alamiah seperti radiasi kosmik atau sinar ultraviolet (Nasir, 2002).
Pemuliaan mutasi adalah mutasi buatan untuk mendapatkan varietas
tanaman yang unggul. Istilah pemuliaan mutasi kadang-kadang digunakan untuk
menunjukkan pemakaian mutagen oleh pemulia tanaman dalam usahanya untuk
menciptakan keragaman dari mutasi buatan. Ini berlawanan dengan pemuliaan
konvensional dimana pemulia tanaman bergantung pada keragaman alami dan
keuntungannya diperoleh dari rekombinasi gen, kadang-kadang dibantu dengan
Kepekaan terhadap perlakuan kolkisin amat berbeda diantara species
tanaman. Oleh karena itu baik konsentrasi maupun waktu perlakuan akan berbeda
pula, bahkan untuk bagian tanaman yang berbeda akan lain pula dosis dan
waktunya. Untuk biji kedelai yang cepat berkecambah, biji direndam dalam
larutan selama 1 – 5 hari sebelum tanam (Poespodarsono, 1988).
Larutan kolkisin efektif pada konsentrasi 0,001-1,00 ppm dengan lama
perlakuan 3-24 jam, tetapi pada benih yang berkulit keras seperti benih
kacang-kacangan konsentrasi 0,2 ppm lebih dianjurkan. Konsentrasi 0,2 ppm yang lebih
umum dipakai untuk semua tanaman dengan lama perlakuan antara 24-96 jam
(Haryanti et. al,2009).
Apabila kolkisin digunakan pada konsentrasi yang tepat maka jumlah
kromosom akan meningkat, sehingga tanaman bersifat poliploid. Tanaman yang
bersifat poliploid menghasilkan ukuran morfologi lebih besar dibandingkan
tanaman diploid. Kolkisin akan bekerja efektif pada konsentrasi 0,01-1 ppm untuk
jangka waktu 6-72 jam, namun setiap jenis tanaman memiliki respon yang
berbeda-beda (Suryo, 1995).
Kolkisin berfungsi sebagai mutagen untuk individu poliploid. Adapun cara
kerja kolkisin yaitu kolkisin akan masuk kedalam biji (2n) dan menyebabkan
terhambatnya kerja mikrotubulus. Kerja mikrotubulus terhambat, berarti
menghambat terbentuknya benang spindel dan kromosom yang siap membelah
akan mengalami gagal berpisah sehingga sel tidak akan mengalami pembelahan.
Hal ini menyebabkan biji mempunyai genom 4n (Sadida et. al, 2010).
Sifat umum tanaman poliploid adalah memiliki ukuran bagian-bagian
Tanaman poliploid juga memiliki ukuran sel, diameter buluh-buluh pengangkutan,
dan ukuran stomata yang lebih besar. Bertambahnya diameter buluh-buluh
pengangkutan akibat pemberian kolkisin, menyebabkan diameter batang tanaman
yang lebih besar (Suryo, 1995).
Secara umum pengaruh poliploid bagi tanaman adalah sebagai berikut :
1. Inti dan isi sel lebih besar (stomata dan tepung sari)
2. Daun dan bunga bertambah besar. Pertambahan ukuran ini ada batasnya,
sehingga bila terjadi penambahan terus pada jumlah kromosom tidak
menyebabkan penambahan secara berlanjut.
3. Dapat terjadi perubahan senyawa kimia, termasuk peningkatan atau perubahan
pada macam atau proporsi karbohidrat, protein, vitamin, atau alkaloid.
4. Laju pertumbuhan menjadi lebih lambat dibanding dengan tanaman diploid dan
berbunganya juga terlambat.
5. Meiosis sering tidak teratur, sehingga terjadi kromosom yang tidak
berpasangan.
6. Menurunnya fertilitas pada poliploid merupakan hal penting untuk diperhatikan
pada pemuliaannya. Penurunan ini dapat terjadi pada daya hidup butir tepung
sari dan jumlah biji. Derajat penurunan tergantung dari spesies
(Poespodarsono, 1988).
Peranan poliploidi dalam pemuliaan tanaman sangat banyak, antara lain
untuk mendapatkan buah tanpa biji (seedless) seperti semangka tanpa biji dan
anggur tanpa biji yang menggunakan metode triploid (3x), memasukkan gen
ketahanan terhadap penyakit maupun stress lingkungan dengan metode
tertentu seperti dengan menggunakan metode trisomik yang dapat menentukan
kromosom mana yang membawa lokus karena suatu fenotip akan dipengaruhi
oleh kromosom yang terlibat dalam aneuploidi (Suryo, 1995).
Daun merupakan organ fotosintesis utama, sehingga menentukan jumlah
asimilat yang dihasilkan yang diperlukan selama pertumbuhan dan perkembangan
tanaman. Kloroplast pada tanaman berkembang dari struktur mikro yang
terdeferensiasi yang disebut proplastid. Menurut Adams et. al (1970) proplastid ikut membelah selama mitosis. Pada saat benih diperlakukan dengan kolkisin,
mitosis pada sel-sel embrio diikuti dengan pembelahan proplastid, meskipun
kromosom yang telah mengganda mungkin gagal berpisah pada anaphase akibat
rusaknya formasi mikrotubula penyusun benang-benang spindel oleh kolkisin,
sehingga menghasilkan tanaman yang mempunyai kadar klorofil yang lebih
tinggi.
Penelitian Abmelah (2013) pada pengamatan paremeter panjang tanaman,
bobot polong per tanaman dan diameter biji yang diperoleh pada perlakuan
kolkisin memberikan pengaruh yang nyata. Rataan tertinggi panjang tanaman
terdapat pada perlakuan tanpa kolkisin 0 ppm yakni sebesar 259.63 cm, sedangkan
yang terendah terdapat pada perlakuan 200 ppm yakni sebesar 166.32 cm, pada
parameter bobot polong per tanaman rataan tertinggi terdapat pada perlakuan
tanpa kolkisin 0 ppm yakni sebesar 103.24 g, sedangkan rataan terendah terdapat
pada perlakuan kolkisin 200 ppm yakni sebesar 41.82.
Penggunaan kolkisin untuk tujuan yang mempunyai arti penting, karena
harganya cukup mahal. Disamping untuk tujuan pemuliaan biasanya digunakan
karena merubah kromosom yang berakibat berubahnya sifat tanaman
(Poespodarsono, 1988).
Intensitas Cahaya
Cahaya matahari merupakan sumber utama energi bagi kehidupan, tanpa
adanya cahaya matahari kehidupan tidak akan ada. Bagi pertumbuhan tanaman
ternyata pengaruh cahaya selain ditentukan oleh kualitasnya ternyata ditentukan
intensitasnya. Intensitas cahaya adalah banyaknya energi yang diterima oleh suatu
tanaman per satuan luas dan per satuan waktu (kal/cm2/hari). Dengan demikian
pengertian intensitas yang dimaksud sudah termasuk lama penyinaran, yaitu lama
matahari bersinar dalam satu hari. Pada dasarnya intensitas cahaya matahari akan
berpengaruh nyata terhadap sifat morfologi tanaman. Hal ini dikarenakan
intensitas cahaya matahari dibutuhkan untuk berlangsungnya penyatuan CO2 dan
air untuk membentuk karbohidrat (Asadi et. al, 1997).
Tanaman yang mendapatkan cahaya matahari dengan intensitas yang
tinggi menyebabkan lilit batang tumbuh lebih cepat, susunan pembuluh kayu lebih
sempurna, internodia menjadi lebih pendek, daun lebih tebal tetapi ukurannya
lebih kecil dibanding dengan tanaman yang terlindung. Beberapa efek dari cahaya
matahari penuh yang melebihi kebutuhan optimum akan dapat menyebabkan layu,
fotosistesi lambat, laju respirasi meningkat tetapi kondisi tersebut cenderung
mempertinggi daya tahan tanaman (Lukitasari, 2005).
Tanaman hijau memanfaatkan cahaya matahari melalui proses fotosintesis.
Chozin (1998) melaporkan bahwa intensitas cahaya di bawah tegakan karet umur
50%, sedangkan pada tegakan karet berumur empat tahun sudah melebihi
intensitas cahaya dalam paranet 75%.
Pendapat di atas diperkuat oleh Baharsyah et. al, (1985) bahwa cahaya matahari sangat besar peranannya dalam proses fisiologis yaitu fotosintesis,
respirasi, pertumbuhan dan perkembangan, pembukaan dan penutupan stomata,
berbagai pergerakan tanaman dan perkecambahan. Penyinaran matahari
mempengaruhi pertumbuhan, reproduksi dan hasil tanaman melalui proses
fotosintesis. Hubungan antara penyinaran matahari dengan hasil adalah kompleks
terutama untuk kedelai yang memang pada dasarnya merupakan tanaman yang
menyukai cahaya matahari penuh.
Wrigley (1982) menyatakan bahwa ada keuntungan dan kerugian pada
kondisi ternaungi, yaitu:
1. Keuntungan
- Tanaman yang menaungi berperan sebagai pemecah angin, dimana angin
dengan hembusan udara panas dapat meningkatkan transpirasi dan berbahaya
bagi tanaman.
- Kisaran suhu daun dan tanah rendah dibawah naungan.
- Kelembaban relatif tinggi.
- Kelembaban permukaan tanah rendah dan sangat pentig bagi tanaman pada
saat musim kering.
- Penaung mengurangi dampak buruk dari air hujan.
2. Kerugian
- Naungan akan mengurangi intensitas sinar matahari, sehingga mengganggu
- Penaung menyebabkan intensitas cahaya yang diterima kanopi daun menjadi
lebih kecil. Akibatnya berpengaruh terhadap proses metabolisme tanaman
seperti fotosintesis
Perlakuan dengan pemberian naungan pada kedelai akan mempengaruhi
sifat morfologi tanaman. Morfologi kedelai yang bisa dipengaruhi oleh naungan
adalah batang tidak kokoh, karena garis tengah batang lebih kecil sehingga
tanaman menjadi mudah rebah seperti diungkapkan Adisarwanto (1999). Hal ini
tidak berlaku bagi tanaman yang toleran naungan karena cenderung lebih efisien
dalam pemanfaatan cahaya. Pada batas naungan tertentu proses fisiologis didalam
tanaman toleran tersebut tidak terlalu dipengaruhi naungan sehingga tanaman
tumbuh normal, tidak terjadi etiolasi dan kerebahan yang tentunya tidak
mempengaruhi hasil (Asadi dan Arsyad ,1991).
Asadi et. al (1997) menjelaskan bahwa adaptasi tanaman terhadap naungan dicirikan oleh: a) peningkatan luas daun dan penurunan penggunaan
metabolit, b) penurunan jumlah transmisi dan refleksi cahaya. Penurunan
intensitas cahaya akibat naungan juga akan menurunkan rasio klorofil a/b, tetapi
akan meningkatkan jumlah relatif klorofil. Pemberian naungan pada tanaman akan
berdampak terhadap proses metabolism dalam tubuh tanaman dan akhirnya akan
berdampak terhadap pertumbuhan dan produksi tanaman, terutama karena
kurangnya intensitas cahaya yang diterima tanaman tersebut (Baharsyah,1980).
Widiastuti et. al (2004) juga menyatakan bahwa pemberian perlakuan naungan pada berbagai stadi pertumbuhan berpengaruh nyata terhadap jumlah
bunga per tanaman, jumlah polong per tanaman, berat biji, dan produksi biji
memberikan hasil yang lebih baik apabila diaplikasikan pada awal pengisian
polong dibandingkan dengan awal tanam atau awal berbunga.
Tanaman yang mendapat cekaman naungan cenderung mempunyai jumlah
cabang sedikit dan batang yang lebih tinggi dibanding tanaman yang ditanam
dalam kondisi tanpa naungan. Perubahan tinggi batang tanaman pada beberapa
tanaman akibat naungan sudah tampak mengalami etiolasi pada naungan lebih
dari 25%. Etiolasi yang terjadi pada sebagian besar tanaman akibat naungan
disebabkan karena adanya produksi dan distribusi auksin yang tinggi,sehingga
merangsang pemanjangan sel yang mendorong meningkatnya tinggi tanaman
(Gatut, 2001).
Sel penutup memiliki klorofil di dalam selnya sehingga cahaya matahari
akan sangat berpengaruh buruk pada klorofil. Larutan klorofil yang dihadapkan
pada sinar kuat akan tampak berkurang hijaunya. Daun-daun yang terkena
langsung umumnya akan tampak kekuning-kuningan, salah satu cara untuk dapat
menentukan kadar klorofil adalah dengan metoda spektofotometri
(Dwijiseputro, 1981).
Menurut Praba et. al, dengan penurunan intensitas cahaya kandungan klorofil memperlihatkan peningkatan yang sama dengan peningkatan klorofil
dibawah naungan 10% sampai 50%, dilaporkan oleh Singh et. al (1988), Liu et. al (1984) bahwa peningkatan klorofil merupakan cara tanaman padi untuk
memperkaya sistem asimilasi dalam mempoduksi hasil fotosintesis dan
menyarankan bahwa total klorofil dan rasio klorofil a/b dapat digunakan menjadi
suatu parameter untuk menyeleksi varietas yang efisien fotosintesis pada cahaya
Kandungan klorofil pada tanaman sangat dipengaruhi oleh intensitas
cahaya. Tanaman yang ternaungi mempunyai klorofil lebih banyak dibandingkan
tanaman yang tidak ternaungi. Hasil penelitian pada kedelai menunjukkan bahwa
tanaman yang toleran terhadap intensitas cahaya rendah memiliki jumlah klorofil
lebih banyak dibandingkan dengan tanaman yang peka (Wirnas, 2005).
Genotipe yang toleran naungan mempunyai daun yang lebih lebar dan
tipis,kandungan klorofil b yang lebih tinggi dan rasio klorofil a/b yang lebih
rendah dari pada genotip peka. Perubahan karakter morfologi dan fisiologi daun
tersebut merupakan bentuk mekanisme adaptasi tanaman terhadap cekaman
naungan. Dengan demikian karakter morfologi daun dapat memberikan faktor
besar dalam perbaikan adaptasi kedelai terhadap cekaman naungan
(Kisman, 2008).
Marka RAPD
RAPD (Random Amplified Polymorphic DNA) merupakan metode perbanyakan genom yang paling sering digunakan karena sangat mudah dan
membutuhkan jumlah DNA genom yang tidak terlalu banyak. RAPD banyak
digunakan untuk menganalisis keanekaragaman karakter genetik dalam berbagai
penelitian dengan pertimbangan antara lain tidak membutuhkan latar belakang
pengetahuan tentang genom yang akan dianalisis, primer yang digunakan bersifat
universal (dapat digunakan untuk prokariot maupun eukariot), mampu
menghasilkan karakter yang relatif tidak terbatas jumlahnya, bahan-bahan yang
digunakan relatif lebih murah, preparasi lebih mudah, dan memberikan hasil lebih
cepat dibandingkan dengan analisis molekuler lainnya. Metode RAPD mampu
tersebut akan berikatan utas tunggal genom yang satu dan pada utas DNA
pasangannya dengan arah berlawanan. Selama situs penempelan primer masih
berada pada jarak yang dapat diamplifikasi pada umumnya tidak lebih dari 5000
pasangan basa (pb), maka akan diperoleh produk DNA amplifikasi
(Weising et. al, 1995).
Salah satu keuntungan pemakaian analisis keragaman genetik tanaman
dengan menggunakan teknik molekuler yang memanfaatkan teknologi amplifikasi
PCR adalah kuantitas DNA yang diperlukan hanya sedikit. Disamping itu, dalam
pelaksanaan teknik RAPD tingkat kemurnian DNA yang dibutuhkan tidak perlu
terlalu tinggi atau dengan kata lain teknik amplifikasi PCR relatif toleran terhadap
tingkat kemurnian DNA. Walaupun demikian, dalam suatu teknik isolasi DNA
masih diperlukan suatu tahapan untuk meminimalkan senyawa-senyawa
kontaminan yang dapat mengganggu reaksi PCR seperti polisakarida dan
metabolit sekunder. Hal ini disebabkan keberadaan polisakarida dan metabolit
sekunder dalam sel tanaman sering menyulitkan dalam isolasi asam nukleat.
Adanya polisakarida dan senyawa metabolit sekunder dalam sel tanaman sering
menyulitkan dalam proses isolasi adam nukleat. Struktur polisakarida yang mirip
dengan asam nukleat akan menyebabkan polisakarida tersebut akan mengendap
bersama dengan asam nukleat (Wilkins dan Smart, 1996).
Dalam program pemuliaan tanaman, diperlukan identifikasi baik karakter
morfologi maupun molekuler untuk menguji keragaman genotip klon-klon yang
akan dipilih untuk tetua persilangan. Pemakaian teknik RAPD memiliki resolusi
yang sebanding dengan RFLP dalam hal analisis kekerabatan antar genotip dan
membantu dalam analisis keragaman genteik tanaman yang tidak diketahui latar
belakang genomnya. Analisis RAPD hanya memerlukan sejumlah kecil DNA
sehingga sangat sesuai untuk spesies tanaman berkayu. RAPD memerlukan biaya
lebih rendah dibandingkan biaya untuk uji kekerabatan berdasarkan analisis DNA
yang lain. Metode RAPD menggunakan primer dengan ukuran sepuluh basa
sering digunakan untuk studi kekerabatan, identifikasi varietas, pemetaan genetik,
analisis struktur DNA organisme dan finger printing suatu individu organisme.
Teknik RAPD menggunakan primer acak maupun spesifik telah terbukti dapat
digunakan sebagai penanda molekuler untuk berbagai karakter agronomis penting.
Pemakaian marka molekuler RAPD banyak digunakan untuk menyusun
kekerabatan beberapa individu dalam spesies maupun kekerabatan antar spesies.
Penggunaan kekerabatan ini dapat dijadikan rujukan dalam pemuliaan persilangan
untuk mendapatkan keragaman yang tinggi dari hasil suatu persilangan penanda
RAPD yang efektif dalam mengevaluasi silsilah bahan, sementara SSR sangat
penting untuk mengenali perbedaan antara karakteristik kuantitatif
(Maftuchah, 2001).
Keragaman Genotip dan Fenotip
Keragaman genetik alami merupakan sumber bagi setiap program
pemuliaan tanaman. Variasi ini dapat dimanfaatkan, seperti semula dilakukan
manusia, dengan cara melakukan introduksi sederhana dan teknik seleksi atau
dapat dimanfaatkan dalam program persilangan yang canggih untuk mendapatkan
kombinasi genetik yang baru. Jika perbedaan antara dua individu yang
mempunyai faktor lingkungan yang sama dapat diukur, maka perbedaan ini
perhatian utama para pemulia tanaman, karena melalui pengelolaan yang tepat
dapat dihasilkan varietas baru yang lebih baik (Welsh, 1991).
Fenotip suatu karakter adalah hasil interaksi antara genotip dan
lingkungan. Dengan demikian, varians fenotip adalah penjumlahan varians
genotip dan varians lingkungan dalam suatu populasi adalah nol, maka varians
fenotip sama dengan varians genotip. Nilai yang diobservasi atau nilai suatu
karakter yang diukur pada suatu individu disebut nilai fenotip dari individu
tersebut. Fenotip adalah penampilan (dalam bentuk karakter fisik, biokimia,
fisiologi, dll) dari suatu individu tanaman yang merupakan hasil dari pengaruh
genotip dan lingkungan. Genotip adalah konstitusi genetik yang dimiliki oleh
suatu individu (Malau, 1995).
Gen-gen tidak dapat menyebabkan berkembangnya karakter terkecuali jika
mereka berada pada lingkungan yang sesuai, dan sebaliknya tidak ada pengaruh
terhadap berkembangnya karakteristik dengan mengubah tingkat keadaan
lingkungan terkecuali jika gen yang diperlukan ada. Namun, harus disadari bahwa
keragaman yang diamati terhadap sifat-sifat yang terutama disebabkan oleh
perbedaan gen yang dibawa oleh individu yang berlainan dan terhadap variabilitas
didalam sifat yang lain, pertama-tama disebabkan oleh perbedaan lingkungan
dimana individu berada (Allard, 2005).
Keragaman merupakan hal penting dalam pemuliaan karena dapat
ditemukan berbagai sumber gen untuk perbaikan suatu sifat tanaman. Gen-gen
tersebut dapat ditransfer ke tanaman dengan cara konvensional maupun rekayasa
poliploidi. Poliploidi adalah keadaan sel dengan penambahan satu atau lebih
genom dari genom normal 2n=2x (Hetharie, 2003).
Heritabilitas
Fehr (1987) menyebutkan bahwa heritabilitas adalah salah satu alat ukur
dalam sistem seleksi yang efisien yang dapat menggambarkan efektivitas seleksi
genotipe berdasarkan penampilan fenotipenya. Hanson (1963) menyatakan nilai
heritabilitas dalam arti luas menunjukkan genetik total dalam kaitannya
keragaman genotip, sedangkan menurut Poespodarsono (1988), bahwa makin
tinggi nilai heritabilitas satu sifat makin besar pengaruh genetiknya dibanding
lingkungan.
Variasi genetik akan membantu dalam mengefisienkan kegiatan seleksi.
Apabila variasi genetik dalam suatu populasi besar, ini menunjukkan individu
dalam populasi beragam sehingga peluang untuk memperoleh genotip yang
diharapkan akan besar. Sedangkan pendugaan nilai heritabilitas tinggi
menunjukkan bahwa faktor pengaruh genetik lebih besar terhadap penampilan
fenotip bila dibandingkan dengan lingkungan. Untuk itu informasi sifat tersebut
lebih diperankan oleh faktor genetik atau faktor lingkungan, sehingga dapat
diketahui sejauh mana sifat tersebut dapat diturunkan pada generasi berikutnya
(Mardjono dan Sudarmo, 2007).
Beberapa faktor yang mempengaruhi besarnya pengukuran heritabilitas
antara lain karakteristik populasi, sampel genotip yang diteliti, metode
perhitungan, seberapa luasnya evaluasi genotip, adanya ketidakseimbangan pautan
yang terjadi, dan tingkat ketelitian selama penelitian. Nilai duga heritabilitas
pengaruh genetik yang diwariskan kepada keturunannya. Nilai duga heritabilitas
berkisar antara 0,0 – 1,0, nilai duga heritabilitas sebesar 1,0 menunjukkan bahwa
semua variasi penampilan tanaman yang ditimbulkan disebabkan oleh faktor
genetik sedangkan nilai duga heritabilitas 0,0 menunjukkan bahwa tidak satupun
dari variasi tanaman yang muncul dalam populasi tersebut disebabkan oleh faktor
BAHAN DAN METODE PENELITIAN
Penelitian ini terdiri dari dua tahap yaitu penelitian di Laboratorium dan
penelitian di Lapangan.
Tempat dan Waktu
Penelitian ini dilaksanakan di Laboratorium Terpadu Fakultas Kedokteran
Universitas Sumatera Utara dan di Desa Tumpatan Nibung, Batang Kuis, Medan
dengan ketinggian tempat ± 25 m dpl yang dimulai pada bulan April 2013 hingga
November 2013.
Bahan dan Alat
Bahan yang digunakan untuk penelitian molekuler adalah daun yang
berasal dari kecambah mutan kedelai generasi M2 (M2), dan mutan kedelai
generasi M3 (M3), CTAB (Promega H6269), Polyvinil Polypirolidone (PVPP)
(Promega 77627) 0.1 g, buffer CTAB, buffer TAE, buffer TE, Kloroform
Isoamilalkohol 24:1 (KIAA), NaCl, NaOH, Na-EDTA, Hcl p.a, alcohol 100% dan
70%, Isopropanol dingin, aquades, ß-mercaptoetanol 2%, agarose (promega
V3121), primer oligonukleotida, master mix (promega M7122), DNA ladder
(G210A), kertas tissue, dan bahan yang digunakan untuk penelitian di lapangan
adalah kedelai Varietas Cikurai, Varietas Malikka, Mutan M3 Cikurai, Mutan M3
Malikka sebagai objek yang diamati.
Alat yang digunakan dalam penelitian di Laboratorium adalah centrifuge
(eppendorf 5415), vortex, frezer, tabung eppendorf 2.0 ml, 1.5 ml, dan 50 ul, mikropipet ukuran 1-50 µl, 100-500 µl, dan 200-1000 µl, sarung tangan karet, tip
BIOSAN), oven, pH meter, pengaduk magnetik, alat-alat gelas (gelas ukur, baker
glass, Erlenmeyer, dll), UV-transilluminator (UV Tec Cambridge 20 UV), elektroforesis (Power PAC 3000, BIO RAD), PCR (Therma Cycler), Gel-Doc (U Cambridge), power supply, dan alat yang digunakan pada penelitian di lapangan adalah cangkul, parang, meteran, handspryer, papan nama, papan perlakuan,pacak
sample, timbangan, buku tulis, kalkulator, penggaris, paranet 50 %, dan polybag.
Metode Penelitian
Penelitian I. Identifikasi Molekuler Mutan Kedelai Generasi M2 dan M3
Penelitian ini adalah untuk melihat perubahan genetik pada mutan kedelai
generasi M2 dan M3 varietas Cikurai dan Malikka akibat perlakuan kolkisin dan
mempermudah proses penapisan (screening) yang akan dilakukan pada generasi selanjutnya.
Pengambilan Sampel Daun
Sampel daun yang digunakan adalah daun yang berasal dari kecambah
genotip mutan kedelai generasi M2 dan M3.
Isolasi dan Pemurnian DNA
Isolasi DNA dilakukan dengan dengan metode CTAB yang dimodifikasi
memakai β-mercaptoethanol, PVPP, dan nitrogen cair saat penggerusan (Toruan dan Hutabarat, 1997).
Daun kedelai ditimbang masing-masing 0.2 g. Daun dipotong halus
dengan gunting secara melintang. Kemudian daun dimasukkan kedalam mortar
untuk digerus. Potongan daun yang ada dalam mortar ditambah buffer CTAB.
buffer CTAB, kemudian digerus kembali hingga benar-benar lumat. Daun
dipindahkan kedalam tabung mikro 2 ml, ditambah 1 ml buffer ekstrak CTAB dan
10 µl ß-mercapthoehtanol, kemudian divortex hingga rata. Tabung tersebut
diinkubasi kedalam penangas air bersuhu 650C selama 30 menit, setiap 10 menit
tabung dikocok perlahan secara regular. Setelah selesai dipanaskan dimasukkan
larutan KIAA 1 ml kedalam tabung. Kemudian tabung dikocok lagi hingga
homogen. Tabung disentrifugasi selama 10 menit dengan kecepatan 13.000 rpm.
Fase atas dipindahkan ke tabung mikro lain 2 ml dan ditambah larutan
KIAA 1 ml dan kembali disentrifugasi selama 5 menit pada kecepatan yang sama.
Supernatant dipindahkan ke tabung mikro 1.5 ml dan ditambah isopropanol dingin
1 ml. Tabung dikocok perlahan dan diperhatikan adanya benang-benang halus
putih yang muncul. Bila benang-benang halus putih sudah tampak jelas disimpan
pada suhu 40C selama 30 menit. Setelah 30 menit cairan isopropanol dibuang dan
benang-benang halus dalam tabung ditinggalkan lalu dikering anginkan.
Kemudian kedalam tabung ditambahkan 100 µl buffer TE dan dispin manual agar
terbentuk suspense antara pellet dengan buffer TE (Orozco-Castillo et. al, 1994). Bila masa inkubasi selesai, ke dalam tabung ditambahkan 1 ml etanol
dingin 100% yang berisi suspense DNA dalam buffer TE dan dikocok kembali
secara perlahan dan disimpan pada suhu 40C selama 30 menit. Tabung
disentrifugasi kembali selama 5 menit pada kecepatan 13.000 rpm. Selanjutnya
fase atas dibuang, tabung dikeringanginkan kemudian ditambah 100 µl buffer TE
dan pellet DNA disuspensikan ke dalam buffer. Stock DNA yang diperoleh
Uji Kualitas DNA
Uji kualitas DNA dilakukan dengan elektroforesis metode standar dengan
5 µl stok DNA ditambah 1 µl loading dye kedalam sumur gel agarose 0.8% yang
ditambahkan 1 µl etidium bromida.
Contoh DNA yang telah disiapkan dimasukkan kedalam sumur gel.
Setelah semua lubang sumur gel berisi selanjutnya dielektroforesis. Running
elektroforesis dilakukan pada kondisi 70 volt selama 60 menit. Visualisasi DNA
yang telah dielektroforesis dilakukan dengan UV transluminator dan
didokumentasikan.
Kualitas DNA dinyatakan baik bila hasil elektroforesis menunjukkan pola
pita yang terang dan focus. Artinya DNA yang dihasilkan cukup solid, utuh dan
mempunyai konsentrasi yang tinggi.
Amplifikasi/ Genotyping
Amplifikasi mengikuti prosedur baku analisis RAPD, sesuai prosedur
William et. al, (1990). Amplifikasi dilakukan dengan menggunakan 5 primer RAPD polimorfik yang digunakan berasal dari Sigma-Aldrich polimorfik.
Persiapan awal amplifikasi adalah mencairkan komponen untuk running
PCR yaitu paket PCR produksi Promega dalam kotak berisi pecahan es.
Kemudian dibuat larutan master yang terdiri atas : ddH2O 9,5 µl x 14 = 133 µl,
Go Green Tag 12,5 µl x 14 = 175 µl, Primer 1 µl x 14 = 14 µl. Dari tube diambil
23 µl ke tube yang lain sehingga diperoleh 13 tube untuk PCR dan ditambahkan
masing-masing DNA sebanyak 2 µl. Kemudian tabung dispin manual. Tabung
berisi stok DNA dan campuran master dimasukkan dalam blok sampel di mesin
Biosystems di desain waktu, suhu, dan jumlah siklus termal 45 kali (3 jam 51 menit). Proses amplifikasi PCR dapat dilihat pada tabel 1.
Setelah reaksi PCR selesai DNA hasil amplifikasi disimpan dalam suhu
40C bila sedang tidak digunakan.
Tabel 1. Proses Amplifikasi PCR
No Tahapan Suhu Waktu Jumlah Siklus
1 Denaturasi awal 940C 2 menit 1
2 Denaturasi 940C 1 menit 45
3 Annealing 370C 1 menit 45
4 Ekstension 720C 2 menit 45
5 Ekstension akhir 720C 10 menit 1
6 Kondisi akhir PCR 40C Tak terbatas 1
Elektroforesis
Sebelum dilakukan elektroforesis disiapkan gel agarose konsentrasi 1,5%
(b/v) dengan 2.5 µl etidium bromide.
Running elektroforesis dilakukan pada kondisi 70 volt selama 80 menit. Visualisasi DNA yang telah di elektroforesis dilakukan dengan UV transluminator
dengan cara meletakkan gel pada UV transluminator dan jika pita/ band molekul
DNA kelihatan terang maka didokumentasikan.
Analisis Data
Penentuan Skoring Marka RAPD
Untuk menentukan keragaman genetik, produk PCR-RAPD diskoring
berdasarkan muncul tidaknya pita DNA. Pita yang muncul pada gel diasumsikan
sebagai alel RAPD. Keragaman alel RAPD ditentukan dari perbedaan migrasi alel
profil pita diterjemahkan kedalam data biner. Pita yang muncul diberi kode l (ada)
dan 0 (tidak ada).
Penentuan Ukuran Pasangan Basa
Ukuran fragmen basa (pasangan basa = bp) produk PCR ditentukan
dengan log jarak menggunakan program regresi linier. Fragmen DNA standar
(DNA landder) digunakan sebagai absis (x) dan log jarak migrasi sebagai ordinat
(y). Dari persamaan ini ditentukan ukuran pasangan basa dari fragmen produk
PCR berdasarkan log jarak dari fragmen tersebut.
Matriks ketidaksamaan (dissimilarity) tiap kombinasi pasangan dihitung berdasarkan Dissmilarity Index Simple Matching pada bootsraps 1000, sesuai rumus :
ploidi dan m1 merupakan jumlah alel yang umum diantara I dan j untuk lokus l.
Matriks jarak atau ketidaksamaan genetik untuk semua kombinasi pasangan
individu dapat dilakukan dengan dua tipe analisis deskriptif dari keragaman : (1)
Principal Coordinates Analysis (PCoA), suatu jenis analisis faktorial pada tabel ketidaksamaan untuk mendapatkan group origin utama, dan (ii) Neighbour-Joining Tree (NJtree) berdasarkan Saitou dan Nei (1978) untuk memperoleh gambaran dari kekerabatan diantara individu-individu. Perhitungan dan analisis
deskriptif ini menggunakan software DARwin5.05 (Perrier dan
Penelitian II. Pengaruh Naungan Terhadap Pertumbuhan dan Produksi Mutan Kedelai Generasi M3 Hasil Mutasi Kolkisin
Penelitian ini menggunakan metode RAK (Rancangan Acak Kelompok)
Non Faktorial. Genotip yang diuji yaitu Genotip Cikurai, Genotip Malikka,
Genotip Mutan M3 Cikurai, dan Genotip Mutan M3 Malikka.
G1 (M0V1) : Genotip Cikurai
Jumlah seluruh tanaman : 200 tanaman
Jumlah polybag : 200 polybag
Data yang dikumpulkan , dianalisis dengan sidik ragam model linear
Rancangan Acak Kelompok (RAK) non faktorial yaitu sebagai berikut:
εij = Efek galat percobaan pada blok ke-i terhadap perlakuan genotip ke-j.
Jika data yang dianalisis dengan sidik ragam berbeda nyata, maka
dilanjutkan dengan Uji Jarak Berganda Duncan (DMRT) menggunakan software
SAS 9.1.
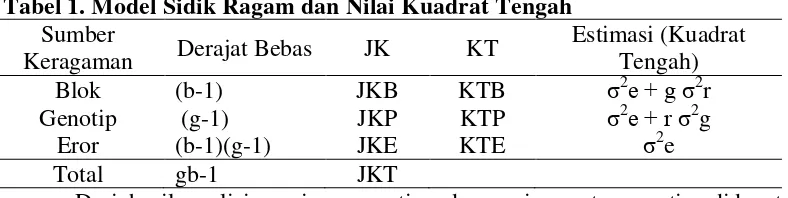
Keragaman Genetik
Keragaman dihitung setelah terlebih dahulu menghitung varians fenotip
(σ2P) dan varians genotip (σ2G). Untuk menghitung varians fenotip (σ2P) dan
varians genotip (σ2G) disajikan pada tabel 1.
Tabel 1. Model Sidik Ragam dan Nilai Kuadrat Tengah
Sumber
Dari hasil analisis varians genotipe dan varians antar genotipe didapat :
Koefisien Varians Genotipe (KVG) dan Koefisien Varians Penotip (KVP) dengan
menggunakan rumus :
Murdaningsih et. al (1990) mengatakan bahwa Koefisien Varians Genotipe (KVG) yang telah diperoleh dari keseluruhan sifat agronomi dan hasil
dapat diklasifikasikan rendah, sedang, tinggi dan sangat tinggi.
Kriteria rendah < 25% dari KVG yang terbesar
Kriteria sedang ≥ 25% - ≤ 50% dari KVG yang terbesar
Kriteria sangat tinggi ≥ 75% dari KVG yang terbesar
Untuk menentukan luas sempitnya variasi genetik suatu karakter yang
mempunyai koefisien variasi genetik relatif yang rendah dan sedang digolongkan
sebagai karakter yang bervariabilitas sempit, sedangkan koefisien variasi genetik
tinggi dan sangat tinggi digolongkan sebagai karakter yang bervariabilitas sedang.
Heritabilitas
Nilai heritabilitas dihitung dengan menggunakan rumus sebagai berikut :
p
e = varians lingkungan
Menurut Mangoendjojo (2003), heritabilitas dikatakan :
- tinggi --- bila nilai H > 50%
- sedang --- bila nilai H terletak antara 20%-50%, dan
- rendah --- bila nilai H < 20%.
Uji Progenitas
Untuk membedakan atau membandingkan dua macam perlakuan (uji beda
rata-rata) umumnya dilakukan uji t (t test) pada prinsipnya berbeda nyata atau
tidaknya perlakuan tersebut dapat diketahui dari perbandingan t hitung dengan t
t hitung = Y2−Y1
√ S²
�
jika: t hitung ≤ t.05 (dbe) → tn (H0 terima)
t hitung ≥ t.05 (dbe) → * (H1 tolak)
keterangan:
S² = KT eror
Y1 = nilai rata-rata pada Mutan 1 (M1)
Y2 = nilai rata-rata pada Mutan 2 (M2)
n = Ulangan
Pelaksanaan Penelitian
Persiapan Lahan
Areal pertanaman yang akan digunakan dibersihkan dari gulma yang
tumbuh pada areal tersebut. Kemudian dibuat plot percobaan dengan ukuran
200cm x 70cm. Parit drainase dibuat dengan jarak antar plot 30 cm dan jarak antar
ulangan 50 cm.
Persiapan Media Tanam
Media tanam yang digunakan adalah polybag yang berukuran 30 x 40 cm .
Polybag diisi dengan tanah top soil dan kompos dengan perbandingan 2 : 1.
Penanaman
Penanaman dilakukan dengan cara Genotip kacang kedelai dimasukkan
kedalam lubang tanam sedalam 2 cm sebanyak dua butir perlubang kemudian
Persiapan Naungan
Naungan yang digunakan yaitu paranet 50%, dengan ketinggian naungan
2 m dan total paranet yang dibutuhkan adalah 100 m3. Naungan di aplikasikan
pada saat tanaman berumur 21 HST sampai panen.
Pemupukan
Pemupukan dilakukan sesuai dengan dosis anjuran kebutuhan pupuk
kedelai yaitu 50 kg Urea/ha (0.6 g/lubang tanam), 100 Kg SP-36/ha (1.2 g/lubang
tanam), dan 50 kg KCl/ha (0.6 g/lubang tanam). Pemupukan Urea dilakukan
dalam 2 tahap yakni pada saat penanaman sebanyak setengah dosis anjuran dan
setengah dosis lagi diberikan pada saat tanaman berumur 30 hari setelah tanam
(hst) sedangkan pupuk SP-36 dan KCl diberikan pada saat penanaman.
Pemeliharaan Tanaman Penyiraman
Penyiraman dilakukan pagi atau sore hari. Apabila terjadi hujan maka tanaman tidak perlu disiram.
Penyulaman
Penyulaman dilakukan untuk menggantikan tanaman yang mati dengan tanaman cadangan yang masih hidup. Penyulaman dilakukan pada saat tanaman
berumur 2 minggu setelah tanam (MST).
Penjarangan
Penjarangan dilakukan pada saat tanaman berumur 2 minggu setelah tanam
(MST).
Penyiangan
Penyiangan dilakukan dengan tujuan untuk menghindari persaingan antara gulma dengan tanaman. Penyiangan gulma dilakukan secara manual atau
menggunakan cangkul dengan membersihkan gulma yang ada di lahan penelitian.
Penyiangan dilakukan sesuai dengan kondisi lapangan.
Pengendalian hama dan penyakit
Pengendalian hama dan penyakit dilakukan dengan menyemprotkan
insektisida Decis 2.5 EC dengan dosis 0.5 cc/liter air, sedangkan pengendalian
penyakit dilakukan dengan menyemprotkan fungisida Dithane M-4.5 dengan
dosis 1 cc/liter air. Masing- masing disemprotkan pada tanaman yang terserang.
Panen
Pemanenan dilakukan dengan cara mencabut batang tanaman tersebut
dengan menggunakan tangan. Adapun kriteria panennya adalah sebagian besar
daun telah menguning dan gugur, keadaan tanaman terlihat 99% telah menguning
atau kering.
Pengamatan Parameter Tinggi Tanaman (cm)
Pengukuran tinggi tanaman dilakukan dari pangkal sampai titik tumbuh dengan menggunakan meteran, pengamatan tinggi tanaman kedelai ini di mulai
setelah tanaman berumur 2 minggu setelah tanam (MST). Selang waktu 2 minggu
Jumlah Cabang (cabang)
Jumlah cabang ditetapkan dengan cara menghitung seluruh cabang utama yang ada pada setiap tanaman. Pengamatan jumlah cabang diamati pada akhir
pertumbuhan.
Umur Berbunga (HST)
Umur berbunga dihitung saat bunga pertama sudah muncul dalam satu tanaman.
Jumlah Buku (buku)
Pengamatan jumlah buku dimulai setelah tanaman berumur 2 MST sampai
tanaman berumur 8 MST.
Kandungan Klorofil a (mg/l)
Daun yang digunakan yaitu daun yang telah membuka sempurna (daun
kedua dan ketiga dari pucuk) dipanen pada saat tanaman berumur 21 HST dan 56
HST. Analisis kandungan klorofil dilakukan dengan metode Arnon (1949).
Kandungan Klorofil b (mg/l)
Daun yang digunakan yaitu daun yang telah membuka sempurna (daun
kedua dan ketiga dari pucuk) dipanen pada saat tanaman berumur 21 HST dan 56
HST. Analisis kandungan klorofil dilakukan dengan metode Arnon (1949).
Rasio Klorofil a dan b (mg/l)
Diperoleh dengan membagikan jumlah klorofil a dengan jumlah klorofil b.
Rasio Tajuk dan Akar (g)
Diperoleh dengan membagikan berat kering akar dengan berat kering tajuk.
Luas Daun (cm2)
Luas daun dihitung dengan menggunakan leaf area meter. Daun yang
diamati yaitu daun yang telah membuka sempurna (daun kedua dan ketiga dari
pucuk) dipanen pada saat tanaman berumur 21 HST dan 56 HST.
Bobot Daun Spesifik (g/ cm2)
Bobot daun spesifik dihitung dengan cara membagikan berat kering daun
dengan luas daun yang di ukur dengan menggunakan leaf area meter.
Umur Panen (HST)
Pengamatan umur panen dihitung ketika tanaman telah mencapai warna polong matang ± 95% yang ditandai dengan warna kecokelatan pada polong.
Jumlah Polong Persampel (polong)
Perhitungan jumlah polong dilakukan dengan menghitung semua polong
pada masing-masing tanaman sampel yang dilakukan setelah tanaman tersebut
dipanen.
Jumlah Polong Berisi Per sampel (polong )
Dihitung jumlah polong berisi tiap tanaman, yaitu polong yang berisi biji,
pada saat tanaman telah matang penuh, dihitung setelah panen.
Bobot 100 biji (g)
Penimbangan dilakukan dengan menimbang 100 biji dari masing masing
perlakuan dengan menggunakan timbangan analitik.
Produksi per Sampel (g)
Perhitungan produksi per sampel dilakukan dengan cara menimbang bobot
buah per tanaman sampel setiap perlakuan dengan menggunakan timbangan
Produksi per Plot (g)
Perhitungan produksi per plot dilakukan dengan cara menimbang bobot