ABSTRAK
Periodisitas Cahaya dan Asam Amino non Esensial pada Nannochloropsis sp.
Oleh
Rio Gusta Firtama
Nannochloropsis sp. adalah mikroalga yang biasa digunakan sebagai pakan alami dalam kegiatan kultur larva ikan dan udang karena memiliki kandungan asam amino yang tinggi. Ketersediaan asam amino dipengaruhi oleh cahaya dalam proses fotosintesis. Tingginya asam amino non esensial pada mikroalga akan meningkatkan nutrisi pakan alami bagi larva ikan dan udang. Tujuan penelitian adalah menganalisis kandungan asam amino non esensial Nannochloropsis sp. dengan periode penyinaran berbeda yaitu 18T dan 6T. Penelitian dilaksanakan pada bulan Januari 2012, bertempat di BBPBL Hanura Lampung. Parameter yang diamati adalah kandungan asam amino non esensial, laju pertumbuhan, dan kualitas air. Asam amino non esensial yang terdapat pada Nannochloropsis sp. pada penelitian antara lain asam aspartat, serin, asam glutamat, glisin, alanin, prolin, dan tirosin. Pengaturan periode penyinaran Nannochloropsis sp. pada kondisi 18T mempunyai kandungan asam amino non esensial 134% lebih tinggi dibandingkan 6T. Perubahan kelimpahan sel Nannochloropsis sp. pada kondisi 18T lebih fluktuatif dibandingkan kondisi 6T.
ABSTRACT
Light Periodicity and Non Essential Amino Acids on Nannochloropsis sp.
By
Rio Gusta Firtama
Nannochloropsis sp. is marine microalgae commonly used as natural food for fish larvae and shrimp culture because it has a high composition of amino acids. Amino acid availability in microalgae affected by light in the photosynthetic processes. The composition of non-essential amino acids in the microalgae would effect the quality of natural food for fish and shrimp larvae. The aim of the research was to analyze composition of the non-essential amino acid on Nannochloropsis sp. under different photoperiod namely 18T and 6T. The study conducted on January 2012, at BBPBL Hanura Lampung. The non-essential amino acid composition, growth rate, and water quality were observed during the research. The non-essential amino acid which are existed on Nannochloropsis sp. are L-aspartic acid, L-serine, L-glutamic acid, Glycine, L-alanine, L-proline, L-tyrosine. The composition of non-essential amino acid on 18T treatment was 134% higher than 6T treatment. Changes in cell abundance of Nannochloropsis sp. on 18T treatment was more volatile than the 18T treatment.
PERIODISITAS CAHAYA DAN ASAM AMINO
NON ESENSIAL PADA
Nannochloropsis sp.
( Skripsi )
Oleh
RIO GUSTA FIRTAMA
PROGRAM STUDI BUDIDAYA PERAIRAN
FAKULTAS PERTANIAN
PERIODISITAS CAHAYA DAN ASAM AMINO
NON ESENSIAL PADA
Nannochloropsis sp.
Oleh
RIO GUSTA FIRTAMA
Skripsi
Sebagai salah satu syarat untuk mencapai gelar Sarjana Perikanan
Pada
Program Studi Budidaya Perairan Fakultas Pertanian Universitas Lampung
PROGRAM STUDI BUDIDAYA PERAIRAN
FAKULTAS PERTANIAN
DAFTAR GAMBAR
Gambar Halaman
1. Kerangka pemikiran ... 6
2. Struktur sel Nannochloropsis sp... 8
3. Kurva pertumbuhan Nannochloropsis sp. ... 11
4. Bagan HPLC ... 33
5. Injektor ... 36
6. Rata-rata laju pertumbuhan Nannochloropsis sp. ... 40
7. Kromatogram sampel standar asam amino (100 pmol) ... 44
8. Kromatogram asam amino non esensial pada perlakuan fotoperiodesitas 18T ulangan pertama ... 45
9. Kromatogram asam amino non esensial pada perlakuan fotoperiodesitas 18T ulangan kedua... 45
10. Kromatogram asam amino non esensial pada perlakuan fotoperiodesitas 6T ulangan pertama ... 45
DAFTAR ISI
Halaman
DAFTAR TABEL ... iii
DAFTAR GAMBAR ... iv
DAFTAR LAMPIRAN ... v
I. PENDAHULUAN ... 1
1.1Latar Belakang ... 1
1.2Tujuan ... 4
1.3Manfaat ... 4
1.4Kerangka Pemikiran ... 5
II. TINJAUAN PUSTAKA ... 7
2.1 Klasifikasi Nannochloropsis sp. ... 7
2.2 Kandungan Nutrisi Nannochloropsis sp. ... 8
2.3 Pertumbuhan dan Reproduksi Nannochloropsis sp. ... 10
2.4 Faktor Lingkungan ... 11
2.4.1 pH ... 12
2.4.2 Salinitas ... 12
2.4.3 Suhu ... 12
2.4.4 Cahaya ... 13
2.4.5 Nutrien ... 13
2.4.6 Aerasi ... 14
2.4.7 Karbondioksida ... 14
2.5 Asam Amino ... 15
2.5.1 Struktur Asam Amino ... 16
2.5.2 Sifat-sifat Asam Amino ... 16
2.5.3 Klasifikasi Asam Amino ... 17
2.5.4 Asam Amino non Esensial ... 19
III METODE PENELITIAN ... 27
3.1Waktu dan Tempat ... 27
3.2Materi Penelitian ... 27
3.2.1 Biota Uji ... 27
3.2.2 Media Uji ... 27
3.2.3Alat dan Bahan ... 28
3.3 Prosedur Penelitian ... 29
3.3.1 Persiapan Penelitian ... 29
3.2.2 Penelitian Pendahuluan ... 30
3.3.3 Pelaksanaan Penelitian ... 31
3.4 Parameter ... 32
3.4.1 Pengujian Asam Amino dengan HPLC ... 32
3.4.2 Kualitas Air ... 38
3.4.3 Penghitungan Kepadatan Nannochloropsis sp. ... 38
3.4.4 Prosentase Peningkatan Asam Amino non Esensial ... 39
3.4.5 Rumus Identifikasi Menggunakan HPLC ... 39
IV. HASIL DAN PEMBAHASAN ... 40
4.1Pertumbuhan Nannochloropsis sp. ... 40
4.2Hasil Analisis Asam Amino non Esensial ... 44
V. KESIMPULAN DAN SARAN ... 51
5.1Kesimpulan ... 51
5.2 Saran ... 51
DAFTAR PUSTAKA
Adehoog. 2001. Chromophyta. http://www.thealgaesource.net/chromophyta. 21 Mei 2001.
Anonim. 2008. Nannochloropsis. <www.find-health-articles.com>. diakses pada tanggal 17 Januari 2011.
Basmi, J. 1999. Planktonologi: Chrysophyta-Diatom, Penuntun Identifikasi. Fakultas Perikanan dan Ilmu Kelautan. Institut Pertanian Bogor. Bogor. Basmi, J. 1999. Planktonologi: Plankton sebagai Bioindikator Kualitas Perairan. Fakultas Perikanan dan Ilmu Kelautan. Institut Pertanian Bogor.
Boef, G. dan Bail, P. L. 1999. Does have light an influence on fish growth. Aquaculture. Abstract.
Burlew, J. S. 1995. Alga Culture from Laboratories to Pilot Plant. Carnegie Institution of Washington. Washington.
Chen, J. and Sheety, H. P. C. 1991. Culture of Marine Feed Organisme. National Inland Fisheried Institute Kasetsart University Campus. Bangkhen. Bangkok. Thailand. 38p.
Cotteau, P. 1996. Microalgae. In: Manual on Production and Use of Live Food for Aquaculture. FAO Fisheries Technical Paper. Lavens, P and P. Sorgeloos Edition. Rome. Italia. Pp:8-47.
Departemen Kelautan dan Perikanan. 2005. Revitalisasi perikanan. Departemen Kelautan dan Perikanan Republik Indonesia. Jakarta.
Dewi, R. N. 2003. Teknik Kultur Nannochloropsis sp. Lampung.
Effendi, H. 2003. Telaah Kualitas Air Bagi Pengelolaan Sumberdaya dan Lingkungan Perairan. Yogyakarta.
Erlina, A. dan Hastuti, W. 1986. Kultur Plankton-BBAP. Dirjen Perikanan. Jepara.
Fogg, G. E. 1979. Algae Culture and Phytoplankton Ecology. Ed ke-2. London: The University of Winconsin Press.
Haryoto dan A. Wibowo. 2004. Kinetika Bioakumulasi Logam Berat Kadmium oleh Fitoplankton Chlorella sp Lingkungan Perairan Laut. Jurnal Penelitian Sains & Teknologi, Vol. 5, No. 2, 89 – 103.
Irizarry, L. 2010. Department of Emergency Medicine, Weill Cornell School of Medicine. http://emedicine.medscape.com/article/819692-overview. Diakses pada 24 Februari 2010.
Isnansetyo, A dan Kurniastuty. 1995. Teknik Kultur Phytoplankton dan
zooplankton: Pakan Alami Untuk Pembenihan Organisme Laut. Jakarta: PT Erlangga.
Kimball, J. W. 1994. Biologi Umum. Edisi kelima. Gajah mada university press. Yogyakarta. HLM 173-189.
Kumala, P. 1998. Kamus Kedokteran Dorland, ECG, Jakarta.
Mujiman, A. 1984. Makanan Ikan. Cetakan 14. Penebar Swadaya. Jakarta.
Murray, R. K., et all., 2002, Biokimia Harper, ECG, Jakarta.
Poedjiadi, A.1994. Dasar-dasar Biokimia, Universitas Indonesia, Jakarta.
Prescott, G. W. 1987. How to Know The Freshwater Algae. Wne. Brown Company Publisher.
Priyadi, A., Chumaidi dan Kusdiarti. 1991. Kultur Chlorella sp. dengan Menggunakan Pupuk Komersial yang Diperkaya Zat Pengatur Tumbuh dan Pupuk Daun. Bul. Penelitian Perikanan Darat. Vol. 10.2 : 60-63. Reed Mariculture Inc. 2001. Nannochloropsis. http://www.seafarm.com/
nannochloropsis.htm. 8 Mei 2001.
Senny, 2008. Bahan Ajar Budidaya Pakan Alami Jurusan Perikanan fakultas Pertanian UGM. Yogyakarta.
Sumarsih, 2007. Pertumbuhan Mikrobia.
< http://sumarsih07.files.wordpress.com/2008/11/i-pertumbuhan-mikroba.pdf.>. Diakses pada tanggal 20 Januari 2011.
Sunarto, 2002. Hubungan Intensitas Cahaya dan Nutrien dengan Produktivitas Primer Fitoplankton. Jurnal Akuatika. Vol. 2. No.1. Hal 24-28
Taw, N. 1990. Petunjuk Pemeliharaan Kultur Murni dan Massal Mikroalga. Proyek Pengembangan Udang, United nations development Programme, Food and Agriculture Organizations of the United Nations.
Wisnu, W. 1995. Prosiding Seminar Biologi (ke-14: Depok: 1995). Perhimpunan Biologi Indonesia, Vol. 2 1997 : p. 321 - 327 ; Fig., 0, 0, Ref.
Waggoner, B. dan Speer, B. 1999. Chromista.
KATA PENGANTAR
Puji syukur penulis ucapkan kehadirat Tuhan Yang Maha Pengasih dan Maha
Penyayang karena berkat ridha-Nya skripsi ini dapat penulis selesaikan. Skripsi ini diajukan sebagai tugas akhir mahasiswa untuk mencapai gelar Sarjana
Perikanan (S.Pi.) pada Program Studi Budidaya Perairan Fakultas Pertanian Universitas Lampung.
Penulis mendapatkan banyak pengalaman dan hal-hal yang berharga selama
melaksanakan penelitian, baik dari bidang keilmuan dan juga kerjasama dengan pembimbing penelitian. Berbagai kesulitan yang ditemui dalam melaksanakan
penelitian umumnya dapat diatasi berkat kerja keras, kesabaran dan bantuan dari berbagai pihak yang tidak dapat disebutkan satu persatu.
Dalam kesempatan ini penulis mengucapkan terima kasih yang sebesar-besarnya
kepada semua pihak yang telah ikut membantu sehingga skripsi ini dapat diselesaikan dengan baik dan tepat pada waktunya. Penulis berharap semoga skripsi ini dapat bermanfaat bagi kita semua. Akhir kata penulis menyadari
sepenuhnya bahwa tulisan ini jauh dari sempurna. Kritik dan saran senantiasa diharapkan demi ilmu yang berkembang.
Bandar Lampung, Oktober 2012
I. METODE PENELITIAN
1.1 Waktu dan Tempat
Penelitian akan dilaksanakan pada bulan Januari 2012 di Balai Besar Pengembangan
Budidaya Laut (BBPBL) Hanura, Lampung. Sebelum dilakukan penelitian, telah dilaksanakan terlebih dahulu uji pendahuluan pada bulan Mei-Juni 2011 di Laboratorium Bioteknologi Budidaya Perairan, Fakultas Pertanian, Universitas Lampung.
3.2 Materi Penelitian
3.2.1 Biota Uji
Biota uji yang digunakan dalam penelitian adalah Nannochloropsis sp. yang dikultur dengan
skala laboratorium di BBPBL dengan kepadatan awal 6-8 x 106 sel/ml.
3.2.2 Media Uji
Media yang dipergunakan dalam kultur Nannochloropsis sp. berbentuk cair atau larutan yang
tersusun dari senyawa kimia (pupuk) yang merupakan sumber nutrien untuk keperluan hidup. Pupuk yang akan digunakan dalam penelitian adalah Conway. Komposisi pupuk dan
komposisi trace metal pupuk Conway dapat dilihat pada Tabel 3 dan Tabel 4.
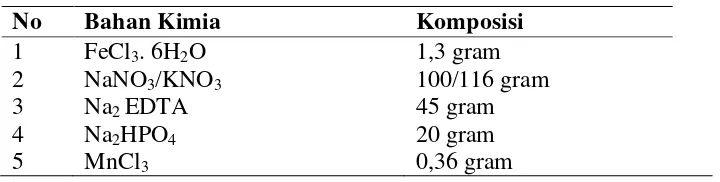
Tabel 3. Komposisi pupuk conway untuk skala semi massal (BBPBL, 2011)
No Bahan Kimia Komposisi
6 7 8 9 H2BO3 Vitamin Aquadest Trace metal* 33,6 gram 1 ml 1 liter 1 ml
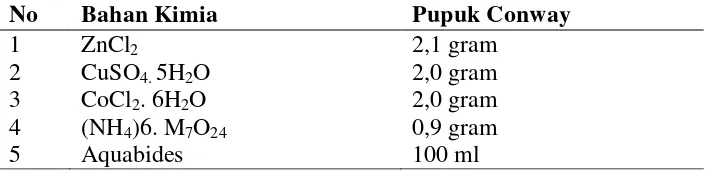
Tabel 4. Komposisi trace metal solution pada pupuk conway (BBPBL, 2007)
No Bahan Kimia Pupuk Conway
1 2 3 4 5 ZnCl2
CuSO4. 5H2O CoCl2. 6H2O (NH4)6. M7O24 Aquabides 2,1 gram 2,0 gram 2,0 gram 0,9 gram 100 ml
3.2.3 Alat dan Bahan
Alat-alat yang digunakan dalam penelitian ini adalah: 1. Selang dan aerasi
2. 6 buah, akuarium ukuran 100L 3. Saringan
4. Haemocytometer
5. Mikroskop 6. pH meter
7. Kain Satin
8. HPLC (High-Performance Liquid Chromatography).
Bahan yang digunakan adalah:
1. Fitoplankton Nannochloropsis sp
2. Air laut steril 3. Pupuk Conway
3.3 Prosedur Penelitian
3.3.1 Persiapan Penelitian
a. Sterilisasi Alat
Tahap awal dilakukan dengan menyiapkan dan melakukan sterilisasi pada perangkat alat dan
bahan yang akan digunakan selama penelitian. Sterilisasi peralatan dan bahan yang akan digunakan dapat dilakukan dengan cara:
1. Perebusan.
2. Perendaman dalam larutan kaporit/chlorine 150 ppm.
3. Pemberian alkohol, diautoklaf dengan temperatur 1000 C dengan tekanan 1 atm selama
20 menit atau dioven.
b. Sterilisasi Media (Air)
Tahapan kedua adalah pengadaan stok air laut yang dilakukan dengan mensterilkan air laut yang telah ditampung pada bak yang dilengkapi dengan perangkat ultra violet (UV). Air laut
yang akan digunakan telah melalui proses sterilisasi dengan berbagai cara diantaranya adalah air laut direbus sampai mendidih selama 10 menit, serta perlakuan sinar ultraviolet dan ozonisasi, penyaringan dengan menggunakan plankton net ukuran 15 mikron atau pemberian
larutan chlorine 60 ppm, kemudian diaduk rata selama beberapa menit dan dinetralkan dengan Natrium Thiosulfat 20 ppm (Sumber : BBPBL, Lampung 2011).
c. Pembuatan Media Kultur Nannochloropsis sp.
Menurut Chen dan Shety (1991), pertumbuhan dan perkembangbiakan Nannochloropsis sp. memerlukan berbagai nutrien yang diabsorbsi dari luar (media). Hal tersebut berarti
dan Ca sedangkan unsur mikro yang dibutuhkan H2BO3, MnCl3, ZnCl2, CoCl2, (NH4)6M7O244H2O dan CuSO45H2O.
3.3.2 Penelitian Pendahuluan
Penelitian pendahuluan dilakukan untuk mengetahui jenis dan kandungan asam amino non
esensial pada Nannochloropsis. Bibit didapatkan dari hasil kultur skala laboratorium, biota yang dibiakkan pada uji pendahuluan memiliki kepadatan awal sekitar 8-10 x 106 sel/ml.
Sebelum memulai proses kultur dilakukan sterilisasi terlebih dahulu pada air laut yang akan digunakan, setelah air disterilkan kemudian diberi aerasi selam 1-2 hari selanjutnya kultur dimulai dengan bibit yang berasal dari kultur skala laboratorium yang telah disiapkan
sebelumnya. Kemudian Nannochloropsis sp. yang akan dikultur, dimasukkan ke dalam aquarium volume 100 liter dan diletakkan dalam rak kultur lalu diberi pencahayaan dengan
lampu TL 36 watt. Dalam waktu 5 hari Nannochloropsis sp. akan mencapai puncak (fase stationer), sebelumnya akan dilihat perkembangan tiap hari yang dilalui saat kultur hingga siap di panen pada fase stasioner. Dari proses pemanenan akan diperoleh sample dalam
bantuk Natan yang akan di uji kandungan asam amino non esensial dari mikroalga Nannochloropsis sp. tersebut.
Cara pembuatan sample Natan ialah dengan mencampurkan larutan NaOH sebanyak 200ppm ke media kultur (dalam akurium volume 100L dengan kepadatan saat panen 20 juta sel/ml). Sesaat setelah dilakukan pencampuran larutan NaOH, dilakukan pengadukan pada media
endapan sel. Kemudian hasil endapan sel di saring lagi menggunakan penyaring (kain satin-yang diduga mempunyai ukuran mikron satin-yang tidak akan meloloskan sel dalam proses
penyaringan akhir sempel tersebut atau memiliki mesh size <1 mikron). Penyaringan akan menghasilkan padatan Natan untuk sample uji kandungan asam amino dengan menggunakan alat uji HPLC (High-Performance Liquid Chromatography), (Sumber : BBPBL, Lampung
2011).
3.3.3 Pelaksanaan Penelitian
Mikroalga Nannochloropsis sp. dikultur dengan menggunakan media Conway dalam toples bervolume 8L dan diberi pencahayaan dengan lampu TL 36 watt. Jumlah toples sesuai dengan dengan jumlah perlakuan dan ulangan dari penelitian yang akan dilakukan yaitu sebanyak empat buah toples dengan pembagian, sebagai berikut:
Perlakuan (dalam 24 jam) Ulangan P1(18 jam Terang - 6 jam Gelap) P1U1 P1U2 P2(6 jam Terang - 18 jam Gelap) P2U1 P2U2
Sesuai dengan uji pendahuluan yang telah dilakukan, dalam waktu 4-5 hari Nannochloropsis sp. akan mencapai puncak (fase stationer). Pada tiap ulangan dalam setiap satuan perlakuan akan diambil dua buah sampel yang akan dijadikan Natan untuk uji kandungan asam amino non esensial. Pengambilan sample untuk pembuatan natan dilakukan pada hari ke-4 dan pada hari ke-5 yang merupakan puncak (fase stasioner) mulai dari kenaikan awal sampai
penurunan fase. Pemilihan waktu pengambilan sample didasarkan pada nilai efektivitas dan kuantitas dari kandungan asam amino non esensial yang terkandung dalam mikroalga
Nannochloropsis. Parameter pengamatan berupa:
1. Uji kandungan asam amino non esensial
3. Kualitas air (Salinitas, pH, DO).
3.4 Parameter
3.4.1 Analisis Asam Amino dengan HPLC
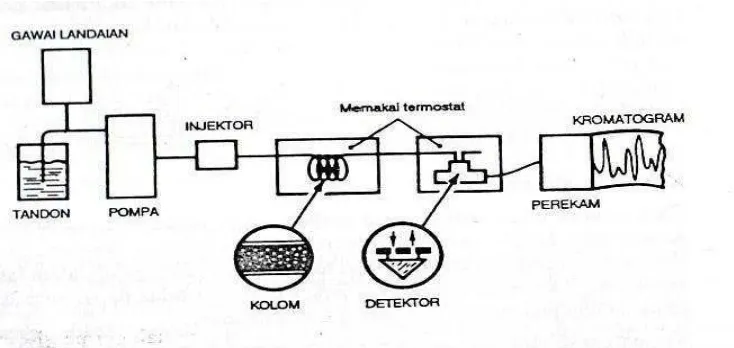
Teknik pemisahan peptida atau asam amino yang paling sering digunakan adalah dengan
menggunakan High Performance Liquid Chromatograpy (HPLC), yaitu suatu sistem yang secara efektif memisahkan campuran sejumlah peptida yang kecil (1 nanomol atau kurang)
dalam 1 hingga 2 jam (1 nanomol dari suatu polipeptida berat molekul-10.000 adalah 10 mikrogram). Suatu sistem HPLC merupakan suatu jenis kromatografi kolom yang memanfaatkan partikel berukuran kecil (biasanya silika) sebagai fase stasioner, yaitu alas
kolom. Partikel yang berukuran kecil (berdiameter 3 hingga 10 μm lawan 40-60 μm untuk kromatografi kolom tradisional) sangat meningkatkan daerah permukaan kromatografi, yang
pada gilirannya, menimbulkan pemisahan molekul yang lebih efektif yang khas pada saat bergerak melalui kolom. Karena ukuran yang kecil, partikel menghasilkan kolom terpaket ketat yang memerlukan penggunaan tekanan (biasanya 50-3500 psi) untuk mendapatkan
aliran pelarut melalui kolom. Dibawah ini adalah bagan HPLC.
Pengujian sampel dalam bentuk natan dilakukan di Laboratorium PT. Saraswanti Bogor, menggunakan pengujian:
Metode : HPLC
Spesifikasi alat : Waters
Kolom : Waters AccQ. Tag 3.9 mm × 150 mm
Detektor : Waters 2475, Flourescence Detector
(Exitation WL (nm) : 250, Emission WL (nm) : 395
Suhu : 37˚C
Pompa : Waters 1525 Binary Pump Volume injeksi : 10 μl (4000 ng)
Run Tim : 45 menit
Eluen : AccQtag Eluent A dalam H2O (Eluent A), Acetonitril 60% dalam H2O + 0.01% aseton (Eluen B)
System Eluen : Gradien
a. Komponen HPLC
Komponen-komponen yang penting dari kerja HPLC adalah sebagai berikut:
1. Wadah Fase Gerak dan Fase Gerak
Wadah fase harus bersih dan lembam (inert). Wadah pelarut kosong atau pun labu laboratorium dapat digunakan sebagai wadah fase gerak. Wadah ini biasanya dapat
menampung fase gerak antara1 sampai 2 liter pelarut. Fase gerak atau eluen biasanya terdiri atas campuran pelarut yang dapat bercampur yang secara keseluruhan berperan dalam daya
polaritas pelarut. Sementara untuk fase terbalik (fase diam kurang polar daripada fase gerak), kemampuan elusi menurun dengan meningkatnya polaritas pelarut.
Fase gerak sebelum digunakan harus disaring terlebih dahulu untuk menghindari partikel-partikel kecil ini. Selain itu, adanya gas dalam fase gerak juga harus dihilangkan, sebab adanya gas akan berkumpul dengan komponen lain terutama di pompa dan detektor sehingga
akan mengacaukan analisis.
Elusi dapat dilakukan dengan cara isokratik (komposisi fase gerak tetap selama elusi) atau
dengan cara bergradien (komposisi fase gerak berubah-ubah selama elusi) yang analog dengan pemrograman suhu pada kromatografi gas. Elusi bergradien digunakan untuk meningkatkan resolusi campuran yang kompleks terutama jika sampel mempunyai kisaran
polaritas yang luas.
Fase gerak yang paling sering digunakan untuk pemisahan dengan fase terbalik adalah
campuran larutan bufer dengan metanol atau campuran air dengan asetonitril. Untuk pemisahan dengan fase normal, fase gerak yang paling sering digunakan adalah campuran
pelarut hidrokarbon dengan pelarut yang terklorisasi atau menggunakan pelarut-pelarut jenis alkohol. Pemisahan dengan fase normal ini kurang umum dibanding dengan fase terbalik.
2. Pompa
Pompa yang cocok digunakan untuk HPLC adalah pompa yang mempunyai syarat
sebagaimana syarat wadah pelarut yakni: pompa harus inert terhadap fase gerak. Bahan yang umum dipakai untuk pompa adalah gelas, baja tahan karat, teflon, dan batu nilam. Pompa yang digunakan sebaiknya mampu memberikan tekanan sampai 5000 psi dan mampu
yang digunakan harus mampu mengalirkan fase gerak dengan kecepatan 20 ml/menit. Tujuan penggunaan pompa atau sistem penghantaran fase gerak adalah untuk menjamin proses
penghantaran fase gerak berlangsung secara tepat, reprodusibel, konstan, dan bebas dari gangguan. Ada 2 jenis pompa dalam HPLC yaitu: pompa dengan tekanan konstan, dan pompa dengan aliran fase gerak yang konstan. Tipe pompa dengan aliran fase gerak yang
konstan sejauh ini lebih umum dibandingkan dengan tipe pompa dengan tekanan konstan.
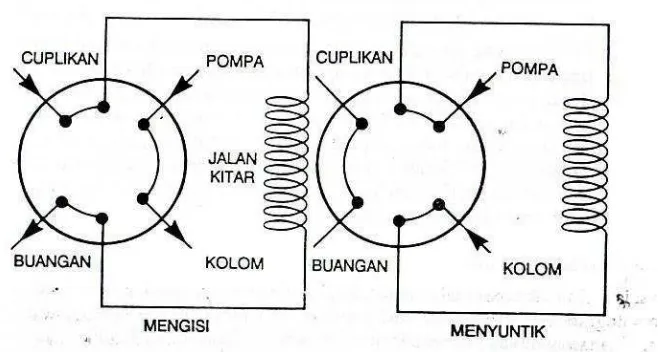
3. Tempat penyuntikan sampel
Sampel-sampel cair dan larutan disuntikkan secara langsung ke dalam fase gerak yang mengalir di bawah tekanan menuju kolom menggunakan alat penyuntik yang terbuat dari tembaga tahan karat dan katup teflon yang dilengkapi dengan keluk sampel (sampel loop)
internal atau eksternal. Dibawah ini adalah gambar penyuntikan sampel atau injektor.
Gambar 5. Injektor
Ada 2 jenis kolom pada HPLC yaitu kolom konvensional dan kolom mikrobor. Kolom merupakan bagian HPLC yang mana terdapat fase diam untuk berlangsungnya proses
pemisahan solute/analit.
Kolom mikrobor mempunyai 3 keuntungan yang utama dibanding dengan kolom konvensional, yakni:
- Konsumsi fase gerak olom mikrobor hanya 80% atau lebih kecil dibanding dengan kolom konvensional karena pada kolom mikrobor kecepatan alir fase gerak lebih lambat
(10-100 μl/menit).
- Adanya aliran fase gerak yang lebih lambat membuat kolom mikrobror lebih ideal jika digabung dengan spectrometer massa.
- Sensivitas kolom mikrobror ditingkatkan karena solute lebih pekat, karenanya jenis kolom tersebut sangat bermanfaat jika jumlah sampel terbatas misalkan sampel klinis.
Meskipun demikian, dalam prakteknya, kolom mikrobror tersebut tidak setahan kolom konvensional dan kurang bermanfaat untuk analisis rutin. Kebanyakan fase diam pada HPLC
berupa silika yang dimodifikasi secara kimiawi, silika yang tidak dimodifikasi, atau polimer-polimer stiren dan divinil benzen. Permukaan silika adalah polar dan sedikit asam karena residu gugus silanol (Si-OH). Silika dapat dimodifikasi secara kimiawi dengan menggunakan
reagen-reagen seperti klorosilan. Reagen-reagen tersebut akan bereaksi dengan silanol dan mengggantinya dengan gugus-gugus fungsional yang lain. Oktadesil silika (ODS atau C18)
merupakan fase diam yang paling banyak digunakan karena mampu memisahkan senyawa-senyawa dengan kepolaran yang rendah, sedang, maupun tinggi. Oktil atau rantai alkil yang lebih pendek lagi lebih sesuai untuk solut yang polar. Silika-silika aminopropil dan
sianopropil (nitril) lebih cocok sebagai pengganti silika yang tidak dimodifikasi. Silika yang tidak dimodifikasi akan memberikan waktu retensi yang bervariasi karena kandungan air
5. Detektor
Detektor pada HPLC dikelompokkan menjadi 2 golongan yaitu: detektor universal (yang
mampu mendeteksi zat secara umum, tidak besifat spesifik, dan tidak bersifat selektif) seperti detektor indeks bias dan detektor spektrometri massa sedangkan golongan detektor yang pesifik dan selektif, seperti detektor UV-Vis, detektor fluoresensi, dan elektrokimia. Pada uji
sebelumnya digunakan detektor Waters 2475, Flourescence Detector (Exitation WL (nm) :
250, Emission WL (nm) : 395, suhu detektor: 37˚.
3.4.2 Kualitas Air (Salinitas, pH, Suhu dan DO Media Kultur)
Pengukuran salinitas, pH, suhu dan DO media air menggunakan refraktometer, pH meter, Thermometer dan DO meter. Pengukuran parameter tersebut dilakukan 2 kali sehari sejak
biota di tempatkan di media kultur sampai beberapa saat sebelum panen dilakukan. Kualitas air dijaga tetap optimum selama penelitian, dan kualitas air hanya digunakan sebagai data pendukung.
3.4.3 Penghitungan Kepadatan Nannochloropsis sp.
Pertumbuhan fitoplankton ditandai dengan pertambahan kepadatan fitoplankton yang dikultur. Kepadatan umumnya dihitung dengan menggunakan Haemocytometer dengan bantuan mikroskop. Cara menghitung kepadatan Nannochloropsis sp. adalah sebagai berikut:
1. Sampel air media diambil sebanyak 1 ml dengan pipet
2. Sampel air diteteskan pada Haemacytometer, lalu amati dibawah mikroskop
Perhitungan jumlah Nannochloropsis sp. dilakukan dengan menggunakan haemocytometer dibawah microskop dengan pembesaran 10 x 10 dengan menggunakan rumus yang
dikembangkan oleh BBL:
K = jumlah Nannochloropsis sp. dalam kotak hitungan ke 1 s/d 5
3.4.4 Prosentase Peningkatan Kandungan Asan Amino non Esensial Rumus rata-rata persentase peningkatan kandungan asam amino
X 18T – X 6T X 6T
3.4.5 Rumus Identifikasi Asam Amino non Esensial Menggunakan HPLC (area komp/area AABA)spl × konsentrasi std × BM × fp
(area komp/area AABA)std × 1000000 × bobot sampel(g) × 1000
Keterangan:
BM : Berat molekul fp : Faktor pengenceran
K1+K2+K3+K4+K5 X 25 X104 sel/ml 5
“… Dan bahwasannya seseorang tiada
memperoleh selain apa yang telah diusahakannya.
Dan bahwasannya usahanya itu kelak akan
diperlihatkan …”
(Qs. An-Najm: 40).
“… Sesungguhnya sesudah kesulitan itu ada
kemudahan. Maka, apabila kamu selesai (Dari
suatu urusan) kerjakanlah dengan
sungguh-sungguh …”
(Qs. Al-Asr 6-7).
“
Banyak kegagalan dalam hidup ini dikarenakan
orang-orang tidak menyadari betapa dekatnya
mereka dengan keberhasilan saat mereka
menyerah”
(Thomas Alva Edison)
“
Setiap tindakan mempunyai tanggungan dan
terdapat hadiah didalamnya”
“
Bukanlah ilmu itu karena banyak
meriwayatkan, tetapi ilmu itu adalah cahaya yang
dimasukkan kedalam hati”
(Ibnu Mas’ud)
“
Jangan patah semangat walau apapun yang
terjadi, jika kita menyerah maka
habislah sudah”
(Ittipat Kulpongwanich)
“Kekuatan dalam diri lebih besar dari rintangan
didepan”
I. PENDAHULUAN
1.1 Latar Belakang
Pakan merupakan salah satu komponen yang sangat penting dalam budidaya perikanan. Pakan juga merupakan faktor penting karena mewakili 40-50% dari
biaya produksi. Pakan dapat digolongkan menjadi pakan alami dan pakan buatan. Pakan buatan adalah pakan yang dibuat dipabrik dengan bahan-bahan yang siap pakai. Berbeda dengan pakan alami, pakan buatan tidak memerlukan
pemeliharaan, sedangkan pakan alami ialah pakan hidup bagi larva ikan atau ikan konsumsi. Jenis pakan alami yang dimakan oleh ikan sangat bervariasi tergantung
jenis ikan dan ukurannya (Departemen Kelautan dan Perikanan, 2005).
Pakan alami dapat berasal dari jenis fitoplankton, zooplankton, invertebrata mikroskopik dan organisme renik lainnya. Pakan alami umumnya juga mudah
dicerna, terutama dari jenis mikroalga yang mengandung banyak serat, sehingga bagus untuk menjaga kesehatan pencernaan ikan. Mikroalga merupakan kelompok
tumbuhan yang berklorofil dan terdiri dari satu atau banyak sel yang berbentuk koloni. Mikroalga mengandung bahan-bahan organik seperti polisakarida, hormon, vitamin, mineral dan juga senyawa bioaktif. Pemanfaatan mikroalga sebagai
komoditi perdagangan atau bahan baku industri masih relatif kecil jika dibandingkan dengan keanekaragaman jenis mikroalga yang ada di Indonesia,
tinggi. Berbagai analisis yang telah dilakukan terbukti bahwa mikroalga
Nannochloropsis sp. memiliki rata-rata kandungan nutrisi berupa protein sebesar 52,11% dan lemak sebesar 27,64%. Kandungan pigmen berupa klorofil a sebanyak
26,03 mg/l dan klorofil b sebanyak 34,85 mg/l. Dibidang perikanan mikroalga Nannochloropsis sp. banyak digunakan dalam pakan utama pembenihan ikan air laut, udang, kerang-kerangan, kepiting, dan berbagai kultivan karena memiliki
syarat yang dibutuhkan sebagai pakan larva yaitu mudah dicerna, berukuran kecil, nutrisi tinggi mudah dibudidayakan dan cepat berkembang biak (Isnansetyo dan
Kurniastuty, 1995). Nannochloropsis sp. juga dilaporkan memiliki sejumlah kandungan pigmen dan nutrisi seperti protein (55,80%), karbohidrat (20,10%),
lemak (11,00%), vitamin C (0,85%), dan klorofil A (0,89%), (Reed Mariculture Inc., 2001).
Protein tersusun atas sejumlah asam amino. Asam amino ialah asam karboksilat
yang mempunyai gugus amino. Asam amino yang terdapat sebagai komponen protein mempunyai gugus –NH2 pada atom karbon α dari posisi gugus –COOH. Jenis-jenis asam amino, urutan cara asam amino tersebut terangkai, serta
hubungan spasial asam-asam amino tersebut akan menentukan struktur 3 dimensi dan sifat-sifat biologis protein sederhana. Asam amino diperlukan oleh makhluk
hidup sebagai penyusun protein atau sebagai kerangka molekul-molekul penting. Asam amino disebut esensial bagi suatu spesies organisme apabila spesies tersebut memerlukannya tetapi tidak mampu memproduksi sendiri atau selalu
kekurangan asam amino yang bersangkutan. Untuk memenuhi kebutuhan asam amino esensial, spesies harus memasoknya dari luar (lewat makanan). Sedangkan
diproduksi sendiri oleh tubuh (yang dapat disintesis didalam tubuh melalui
perombakan senyawa lain), sehingga memiliki prioritas konsumsi yang lebih rendah dibandingkan dengan asam amino esensial, yang termasuk dalam jenis
asam amino non esensial seperti alanin, asparagin, asam aspartat, asam glutamat, glutamin, prolin atau dua belas asam amino dari 20 jenis umum asam amino (kecuali dari jenis esensial) dan ada juga yang merumuskan asam amino non
esensial dengan jumlah lima belas jenis (Kumala, 1998).
Fitoplankton diketahui mengandung pigmen yang sensitif terhadap cahaya yang
menyebabkannya mampu mengubah karbondioksida dan air menjadi gula sederhana dengan memanfaatkan energi matahari dan melepaskan molekul oksigen ke air. Sel mikroalga memanfaatkan gula dari fotosintesis sebagai sumber
energi dalam respirasi. Selanjutnya, gula dioksidasi kembali menjadi menjadi karbondioksida dan air dengan melepaskan energi dalam bentuk tersedia secara
biologi. Pada dasarnya, secara ekologis respirasi merupakan kebalikan dari fotosintesa. Gula yang digunakan dalam respirasi dirubah secara biokimia menjadi senyawa organik seperti zat tepung, selulosa, asam amino, protein dan lemak yang
terkandung atau tersimpan dalam sel mikroalga. Senyawa ini menyediakan bahan organik yang dibutuhkan oleh bakteri heterotrof dan hewan pemakan fitoplankton
atau sisa-sisanya (Sunarto, 2004).
bantuan klorofil. Proses fotosintesis dapat dipengaruhi oleh faktor-faktor eksternal
maupun internal. Faktor eksternal yang berpengaruh adalah cahaya, karbon dioksida, air, suhu, dan mineral. Faktor internal yang dapat mempengaruhi proses
fotosintesis antara lain struktur sel, kondisi klorofil, dan produk fotosintesis serta enzim-enzim dalam organ fotosintesis. Fotosintesis merupakan proses biokimia penting pada Nannochloropsis sp. untuk mengubah energi matahari menjadi energi kimia. Energi kimia tersebut akan digunakan untuk menjalankan reaksi kimia, misalnya pada fiksasi nitrogen menjadi asam amino. Menurut Boef dan
Bail (1999), energi yang diberikan oleh cahaya bergantung pada spektrum warna, intensitas dan periode. Oleh karena itu, perlu dilakukan penelitian untuk
mengetahui peran cahaya (fotoperiodisitas) terhadap kandungan asam amino esensial pada Nannochloropsis sp.
1.2 Tujuan
Tujuan penelitian adalah untuk menganalisis kandungan asam amino non esensial Nannochloropsis sp. sebagai respon terhadap lama penyinaran (fotoperiode) yang berbeda.
1.3 Manfaat
1.4 Kerangka Pemikiran
Ketersediaan pakan alami merupakan faktor penting dalam kegiatan budidaya larva ikan dan udang. Salah satu fitoplankton yang banyak digunakan sebagai
pakan utama dalam pembenihan ikan air laut adalah Nannochloropsis sp. yang dikenal bermanfaat mengadsorpsi ion-ion logam. Kemampuan adsorpsinya cukup tinggi karena di dalam alga Nannochloropsis sp. terdapat gugus fungsi amina, amida, dan karboksilat yang dapat berikatan dengan ion logam. Nannochloropsis sp. mempunyai peranan penting dalam suatu kegiatan pembenihan karena kandungan nutrisinya yang tinggi dan memiliki kemampuan memproduksi bahan-bahan yang sangat penting seperti kandungan protein yang tinggi (Senny, 2008).
Protein adalah poliamida yang hidrolisisnya menghasilkan asam-asam amino. Protein yang terkandung pada mikroalga memiliki kandungan asam amino yang sangat kaya. Salah satu faktor yang mempengaruhi kandungan asam amino Nannochloropsis sp. adalah cahaya melalui proses metabolisme pada fotosintesis. Cahaya bergantung pada spektrum warna, intensitas dan periode. Dengan perlakuan periodisitas cahaya yang berbeda diharapkan terdapat perubahan
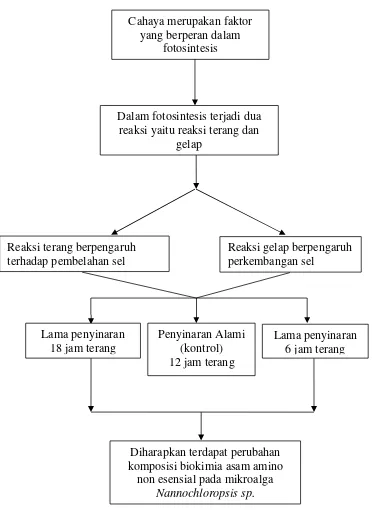
komposisi biokimia asam amino non esensial pada mikroalga Nannochloropsis sp., selain itu dapat diasumsikan kandungan protein juga bertambah seiring dengan pertambahaan jumlah sel atau fase pertumbuhan sel pada jumlah yang besar (fase logaritmik) berbanding lurus terhadap jumlah konsentrasi protein dalam mikroalga yang juga bertambah. Berikut adalah bagan kerangka fikir yang
Gambar 1. Kerangka pemikiran Cahaya merupakan faktor
yang berperan dalam fotosintesis
Dalam fotosintesis terjadi dua reaksi yaitu reaksi terang dan
gelap
Lama penyinaran 18 jam terang
Penyinaran Alami (kontrol) 12 jam terang
Lama penyinaran 6 jam terang
Diharapkan terdapat perubahan komposisi biokimia asam amino
non esensial pada mikroalga Nannochloropsis sp. Reaksi terang berpengaruh
terhadap pembelahan sel
Judul Skripsi : Periodisitas Cahaya dan Asam Amino
Non Esensial pada
Nannochloropsis sp.
Nama Mahasiswa
: Rio Gusta Firtama
No. Pokok Mahasiswa : 0614111055
Program Studi
: Budidaya Perairan
Fakultas : Pertanian
MENYETUJUI
1. Komisi Pembimbing
Moh. Muhaemin, S.Pi., M.Si. Henni Wijayanti M., S.Pi., M.Si. NIP. 197412122000031002 NIP. 198101012008012042
2. Ketua Program Studi Budidaya Perairan
MENGESAHKAN
1. Tim Penguji
Ketua : Moh. Muhaemin, S.Pi., M.Si. ...
Sekretaris : Henni Wijayanti M., S.Pi., M.Si. ...
Penguji
Bukan Pembimbing : Ir. Suparmono, M.T.A. ...
2. Dekan Fakultas Pertanian
Prof. Dr. Ir. Wan Abbas Zakaria, M.S.
NIP. 19610826 198702 1 001
PERSEMBAHAN
Ar Rahman Ar Rahim..
Kedua Orang tuaku “Ibu dan Ayah”
Adik-adikku, dodo Regi, abang/cik Rivan
dan adek Chintya
Datuk (Alm), Andung dan keluarga besar
di Liwa Lampung Barat
Teman-teman Generasi Muda Indonesia,
semoga karya ini dapat berguna bagi
sesama..
PERSEMBAHAN
Ar Rahman Ar Rahim..
Kedua Orang tuaku “Ibu dan Ayah”
Adik-adikku, dodo Regi, abang/cik Rivan
dan adek Chintya
Datuk (Alm), Andung dan keluarga besar
di Liwa Lampung Barat
Teman-teman Generasi Muda Indonesia,
semoga karya ini dapat berguna bagi
sesama..
RIWAYAT HIDUP
P
enulis dilahirkan di Bandar Lampung pada
tanggal 20 Agustus 1988. Penulis adalah anak
pertama dari empat bersaudara pasangan Bapak
Drs. Sony Sisnur, dan Ibu Dra. Metty Elizar.
Pendidikan di Sekolah Dasar Negeri 2 Liwa diselesaikan pada tahun 2000 di
lanjutkan ke Madrasah Tsanawiyah Negeri Liwa dan lulus pada tahun 2003.
Pendidikan Sekolah Menengah Atas (SMA) diselesaikan tahun 2006 di Sekolah
Menengah Atas Negeri 1 Liwa Lampung Barat. Pada tahun 2006 penulis
terdaftar sebagai mahasiswa di Fakultas Pertanian (FP) Program Studi
Budidaya Perairan, melalui Seleksi Penerimaan Mahasiswa Baru ( SPMB)
Universitas lampung.
Penulis melaksanakan Praktik Umum (PU) di Balai Pengembangan Benih Ikan
Air Payau dan Laut Pangandaran Jawa Barat, dengan
judul ”Pembenihan
Udang Windu (Panaeus monodon)” pada tahun 2010. Kemudian pada bulan
Januari 2012 penulis melaksanakan penelitian untuk tugas akhir dengan judul,
”Periodisitas Cahaya dan Asam Amino Non Esensial pada Nannochloropsis sp.”
di Balai Besar Pengembengan Budidaya Laut (BBPBL) Hanura Lampung.
Selama menjadi mahasiswa penulis juga aktif dalam berbagai organisasi. Penulis
pernah menjadi Ketua Bidang Minat dan Bakat HIDRILA pada periode
SANWACANA
Assalamu’alaikum Wr. Wb.
Alhamdulillah ya Allah puji dan syukur penulis panjatkan atas segala rahmat,
hidayah dan semua kenikmatan yang telah diberikan sehingga penulis dapat menyelesaikan skripsi dengan judul “Periodisitas Cahaya dan Asam Amino Non Esensial pada Nannochloropsis sp.” sebagai salah satu syarat untuk meraih gelar Sarjana Perikanan (S.Pi) pada Program Studi Budidaya Perairan, Fakultas Pertanian, Universitas Lampung.
Penulis menyadari bahwa penulisan skripsi ini dapat terwujud karena partisipasi banyak pihak. Dengan segala kerendahan hati dan rasa hormat, penulis mengucapkan banyak terima kasih atas kebaikan, kesabaran, dan kenangan
terindah kepada :
1. Yang tercinta Ibu, Ayah, Andung dan semua keluarga besar di Lampung
Barat terimakasih atas doa, semangat, serta tangan-tangan penuh kasih sayang telah membesarkan dan mengantarkan sampai pada pencapaian yang
baik ini.
2. Bapak Prof. Dr. Ir. Wan Abbas Zakaria, M.S., selaku Dekan Fakultas
3. Ibu Ir. Siti Hudaidah, M.Sc., selaku Ketua Program Studi Budidaya Perairan
Universitas Lampung.
4. Bapak Moh. Muhaemin, S.Pi., M.Si. selaku Pembimbing Utama atas
bimbingan, diskusi, waktu dan kesabarannya selama proses penulisan skripsi ini.
5. Ibu Henni Wijayanti M., S.Pi., M.Si., selaku Pembimbing II atas bimbingan, waktu, saran dan diskusi dalam proses penyusunan skripsi.
6. Bapak Ir. Suparmono, M.T.A., selaku pembahas dalam tugas akhir ini atas
saran, waktu dan semangatnya.
7. Ibu Munti Sarida, S.Pi., selaku Pembimbing Akademik atas segala nasehat
dan arahannya.
8. Bapak dan ibu Dosen serta Staff di Program Studi Budidaya Perairan yang telah mendidik dan memberikan ilmunya yang sangat berguna.
9. Sahabat-sahabatku, Leo Lamtim, Doni Lamtim, Alek, Agus Katinm, Aang, Bang Openg, Bang Nino, Ferri, Dwi, Budi, Mardi, Pevita, Estelle, dan Tatjana, terimakasih banyak dapat bertemu, mengenal, berbagi, setiap
kebersamaan dengan kalian adalah anugerah dalam hidup ini, ”you are my best... best… best… friends”. Pertemanan kita abadi selamanya, Amen..
kakak-kakak dan adik-adik tingkat di Hidrila untuk bang Bayu, bang Edo, mbak
Dudul, Dinar, Panca, Romaria dan semua yang tidak dapat disebutkan satu per satu terimakasih untuk senyum, motivasi, dan semuanya.
Semoga Allah SWT, memberikan rahmat dan ridho-Nya kepada seluruh pihak yang telah banyak membantu dan memberikan dukungan moril kepada penulis dalam menyelesaikan skripsi ini.
Wassalamu’alaikum Wr. Wb.
Bandar Lampung, Oktober 2012
Penulis,
I. TINJAUAN PUSTAKA
2.1 Klasifikasi Nannochloropsis sp.
Nannochloropsis sp. adalah alga bersel satu yang termasuk ke dalam kelas Eustigmatophyceae, yang biasa dikenal sebagai marine chlorella. Nannochloropsis sp. dapat dimanfaatkan untuk mengadsorpsi ion-ion logam. Kemampuan adsorpsinya cukup tinggi karena di dalam alga Nannochloropsis sp.. terdapat gugus fungsi amina, amida, dan karboksilat yang dapat berikatan dengan ion logam. Nannochloropsis sp. mempunyai peranan penting dalam suatu kegiatan pembenihan karena kandungan nutrisinya yang tinggi dan memiliki kemampuan memproduksi bahan-bahan yang sangat penting seperti pigmen
(zeaxanthin dan astaxanthin) dan Poly Unsaturated Fatty Acid (PUFA). Pembenihan membutuhkan Nannochloropsis sp. dengan kuantitas serta kualitas yang baik, dalam hal ini adalah kepadatan sel serta kandungan protein yang tinggi (Wisnu, 1995).
Fitoplankton Nannochloropsis sp., adalah salah satu jenis Chlorophyta yang dapat
melakukan fotosintesa. Klasifikasi Nannochloropsis sp. menurut Adehoog (2001), adalah sebagai berikut :
Divisi : Chroniophyta
Kelas : Eustigmatophyceae Genus : Nannochloropsis
Spesies : Nannochloropsis sp.
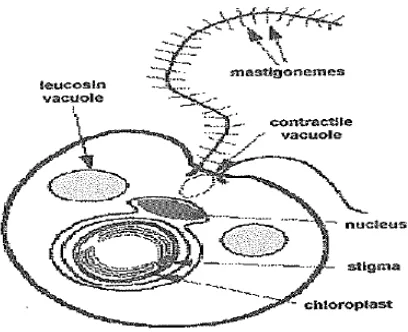
Sel Nannochloropsis sp. berbentuk bulat memanjang dengan diameter sel berkisar 2 – 4 µm. Mikroalga tersebut memiliki kloroplas yang mengandung klorofil-a
[image:43.595.210.414.333.499.2](Waggoner dan Speer, 1999). Bentuk dan Morfologi Nannochloropsis sp. Dapat dilihat pada Gambar 2.
Gambar 2. Sruktur sel Nannochloropsis sp.
Mikroalga yang banyak ditemukan di laut ini memiliki ukuran sebesar 1-2 µm.
Memiliki karakteristik tubuh yang berwarna hijau, bersel tunggal dan bukan termasuk golongan mikroalga yang beracun.
2.2 Kandungan Nutrisi Nannochloropsis sp.
kandungan pigmen dan nutrisi seperti protein (52,11%), karbohidrat (16%), lemak
(27,64%), vitamin C (0,85%), dan klorofil A (0,89%). Protein adalah poliamida yang hidrolisisnya menghasilkan asam-asam amino (Fessenden, 1994). Protein
yang terkandung pada mikroalga memiliki kandungan asam amino lebih kaya dibanding telur ayam. Demikian juga dengan kandungan beta karoten yang bisa 900 kali lebih banyak dibanding wortel. Sedangkan kandungan omega-3
mikroalga lebih banyak dibanding minyak ikan, biji rami, dan kedelai, yaitu 50-60 persen. Pada mikroalga Nannochloropsis sp. asam amino yang terkandung dalam
konsentrasi yang tinggi adalah jenis asam amino essensial yaitu berupa: Glutamic 15,48 %, Leucine 15,20%, Leucine 1,57% (Anonim, 2008).
Kandungan protein mikroalga Nannochloropsis sp. dapat dianalisis dengan menggunakan metode biuret (Burlew, 1995). Ialah dengan menambahkan reagen biuret (CuSO4 dan NaK-Tartat dalam NaOH). Mekanisme analisis ini adalah
pembentukan senyawa kompleks antara asam amino dari protein dengan logam Cu. Suatu ion kompleks ialah terdiri dari satu atom pusat (ion) pusat dan sejumlah ligan yang terikat erat dengan atom (ion) pusat itu. Jumlah relatif komponen-
komponen tersebut dalam kompleks yang stabil nampak mengikut aturan stokiometri (Prescott, 1987).
Dalam analisis protein pada mikroalga yang bertindak sebagai ion pusat adalah logam Cu dari reagen biuret yang digunakan. Sedangkan, ligan berasal dari asam-asam amino yang terkandung pada mikroalga. Mekanisme pembentukan
penelitian yang dilakukan. Untuk meningkatkan daya adsorpsi dari mikroalga
dilakukan mobilisasi. Penggunaan silika gel sebagai pegimobilisasi telah banyak dilakukan (Burlew, 1995).
2.3 Pertumbuhan dan Reproduksi Nannochloropsis sp.
Perkembangbiakan Nannochloropsis sp. terjadi secara aseksual yaitu dengan pembelahan sel atau pemisahan autospora dari sel induknya. Reproduksi sel diawali dengan pertumbuhan sel yang membesar, selanjutnya terjadi peningkatan aktifitas sintesis untuk persiapan pembentukan sel anak, yang merupakan tingkat
pemasakan awal (Kimball, 1994.) Tahap berikutnya terbentuk sel induk muda yang merupakan tingkat pemasakan akhir, yang akan disusul dengan pelepasan sel
anak ( Fogg, 1975 dalam Isnansetyo dan Kurniastuty, 1995).
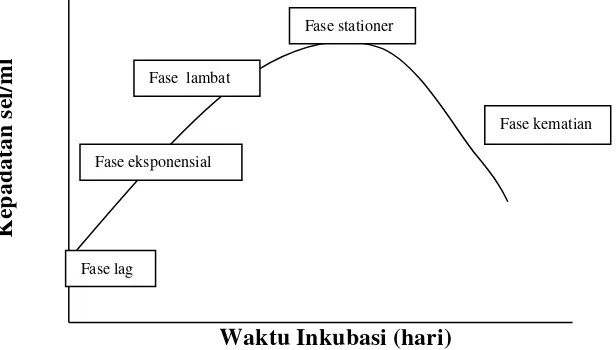
Menurut Dewi (2003) membagi pola pertumbuhan atau kurva pertumbuhan Nannochoropsis sp. menjadi lima fase pertumbuhan yaitu:
(1) Fase lag disebut sebagai fase adaptasi terhadap kondisi lingkungan yang
ditandai dengan peningkatan populasi yang tidak nyata.
(2) Fase eksponensial ditandai dengan pesatnya laju pertumbuhan hingga
kepadatan populasi meningkat beberapa kali lipat
(3) Fase pengurangan pertumbuhan ditandai dengan terjadinya penurunan pertumbuhan jika dibandingkan dengan fase eksponensial
(5) Fase kematian ditandai dengan laju kematian lebih tinggi dari laju
pertumbuhan sehingga kepadatan populasi berkurang.
Kurva pertumbuhan Nannochloropsis sp. dapat dilihat dalam Gambar 3.
[image:46.595.144.452.184.359.2]
Waktu Inkubasi (hari)
Gambar 3. Kurva pertumbuhan Nannochloropsis sp.
Media yang baik sangat diperlukan untuk pertumbuhan serta perkembangan Nannochloropsis sp. (Basmi, 1999). Media kultur harus mengandung semua nutrien yang diperlukan untuk perkembangan dan pertumbuhan. Media atau
pupuk yang digunakan dalam kultur Nannochloropsis sp. ini adalah Pupuk jenis Conway.
2.4 Faktor Lingkungan
Menurut Chen dan Sheety (1991), pertumbuhan dan perkembangbiakan Nannochloropsis sp. memerlukan berbagai nutrien yang diabsorbsi dari luar (media). Hal ini berarti ketersediaan unsur hara makro dan mikro dalam media tumbuhnya mutlak diperlukan, adapun makro nutrien yang diperlukan oleh Nannochloropsis sp. adalah N, P, Fe, K, Mg, S dan Ca sedangkan unsur mikro yang dibutuhkan H2BO3, MnCl3, ZnCl2, CoCl2, (NH4)6M7O244H2O dan
Kepad
atan sel/ml
Fase stationer
Fase kematian Fase lambat
Fase eksponensial
CuSO45H2O. Menurut (Dewi, 2003) selain unsur nutrien, faktor eksternal lain
yang mempengaruhi pertumbuhan Nannochloropsis sp. meliputi :
2.4.1 pH
Derajat keasaman atau pH digambarkan sebagai keberadaan ion hidrogen. pH akan mempengaruhi toksisitas semua senyawa kimia. Variasi pH dapat
mempengaruhi metabolisme dan pertumbuhan fitoplankton dalam beberapa hal, antara lain mengubah keseimbangan dari karbon organic, mengubah ketersediaan nutrient, dan dapat mempengaruhi fisiologis sel. Secara umum kisaran pH yang
optimum pada kultur Nannochloropsis sp. Antara 7–9 (Effendi, 2003).
2.4.2 Salinitas
Kisaran salinitas yang berubah-ubah dapat mempengaruhi dan menghambat pertumbuhan dari mikroalga. Beberapa mikroalga dapat tumbuh dalam kisaran salinitas yang tinggi tetapi ada juga mikroalga yang dapat tumbuh dalam kisaran
salinitas yang rendah. Namun, hampir semua jenis fitoplankton dapat tumbuh optimal pada salinitas sedikit dibawah habitat asal. Pengaturan salinitas pada medium yang diperkaya dapat dilakukan dengan pengenceran dengan
menggunakan air tawar. Kisaran salinitas yang dimiliki oleh Nannochloropsis sp. antara 32–36 ppt, tetapi salinitas paling optimum untk pertumbuhan
Nannochloropsis sp. adalah 33-35 ppt (Effendi, 2003).
2.4.3 Suhu
Suhu merupakan salah satu faktor penting yang mempengaruhi pertumbuhan
fisika, peningkatan suhu dapat menurunkan suatu kelarutan bahan dan dapat
menyebabkan peningkatan kecepatan metabolisme dan respirasi fitoplankton diperairan. Suhu optimal dalam kultur mikroalga Nannochloropsis sp. secara umum antara 20-24˚C. Suhu dalam kultur diatur sedemikian rupa bergantung pada medium yang digunakan. Suhu diatas dari 36˚C akan menyebabkan kematian
pada jenis fitoplankton tertentu, sedangkan apabila suhu kurang dari 16˚C akan
menyebabkan kecepatan dari pertumbuhan fitoplanton menurun. Fitoplankton tidak tahan terhadap suhu yang tinggi. Pengaturan suhu dalam kultur fitoplankton
dapat dilakukan dengan mengalirkan air dingin ke botol kultur atau dengan menggunakan alat pengatur suhu udara (Taw, 1990).
2.4.4 Cahaya
Cahaya merupakan sumber energi dalam proses fotosintetis yang berguna untuk pembentukan senyawa karbon organic. Kebutuhan akan cahaya bervariasi
tergantung kedalaman kultur dan kepadatannya. Intensitas cahaya yang terlalu tinggi dapat menyebabkan fotoinbihisi dan pemanasan. Intensitas cahaya 1000 lux cocok untuk kultur dalam Erlenmeyer, sedangkan intensitas 5000-10000 lux untuk
volume yang lebih besar (Coutteau, 1996). Intensitas cahaya sangat menentukan pertumbuhan fitoplankton yaitu dilihat dari lama penyinaran dan panjang
2.4.5 Nutrien
Mikroalga mendapatkan nutrien dari air laut yang sudah mengandung nutrien yang cukup lengkap. Namun pertumbuhan mikroalga dengan kultur dapat
mencapai optimum dengan mencampurkan air laut dengan nutrien yang tidak terkandung dalam air laut tersebut. Nutrien tersebut dibagi menjadi makronutrien dan mikronutrien, makronutrien meliputi nitrat dan fosfat. Makronutrien
merupakan pupuk dasar yang mempengaruhi pertumbuhan mikroalga. Mikronutrien organik merupakan kombinasi dari beberapa vitamin yang
berbeda-beda. Vitamin tersebut antara lain B12, B1 dan Biotin. Mikronurien tersebut digunakan mikroalga untuk berfotosintesis (Taw, 1990). Nitrat adalah sumber
nitrogen yang penting bagi fitoplankton baik di air laut maupun di air tawar. Bentuk kombinasi lain dari nitrogen seperti amonia, nitrit, dan senyawa organik dapat dapat digunakan apabila kekurangan nitrat.
2.4.6 Aerasi
Aerasi dalam kultur mikroalga diguanakan untuk proses pengadukan medium kultur. Pengadukan sangat penting dilakukan yang bertujuan untuk mencegah dari
pengendapan sel, nutrien dapat tersebar sehingga mikroalga dalam kultur mendapatkan nutrien yang sama, mencegah sratifikasi suhu, dan meningkatkan
pertukaran gas dari udara ke medium (Taw, 1990).
2.4.7 Karbondioksida
Karbondioksida diperlukan oleh fitoplankton untuk memenbantu proses
dalam kultur fitoplankton dengan intensitas cahaya yang rendah. Kadar
karbondioksida yang berlebih dapat menyebabkan pH kurang dari batas optimum sehingga akan berpengaruh terhadap pertumbuhan fitoplankton (Taw, 1990).
Pertumbuhan fitoplankton secara umum dapat dibagi menjadi lima fase yang meliputi fase lag, fase eksponensial, fase penurunan kecepatan pertumbuhan, fase stasioner dan fase kematian. Pada fase lag penambahan jumlah densitas
fitoplankton sangat rendah atau bahkan dapat dikatakan belum ada penambahan densitas. Hal tersebut disebabkan karena sel-sel fitoplankton masih dalam proses
adaptasi secara fisiologis terhadap medium tumbuh sehingga metabolisme untuk tumbuh manjadi lamban. Pada fase eksponensial, terjadi pertambahan kepadatan
sel fitoplankton (N) dalam waktu (t) dengan kecepatan tumbuh (µ) sesuai dengan rumus eksponensial. Pada fase penurunan kecepatan tumbuh pembelahan sel mulai melambat karena kondisi fisik dan kimia kultur mulai membatasi
pertumbuhan. Pada fase stasioner, faktor pembatas dan kecepatan tumbuh sama karena jumlah sel yang membelah dan yang mati seimbang. Sedangkan pada fase kematian, kualitas fisik dan kimia kultur berada pada titik dimana sel tidak
mampu lagi mengalami pembelahan. Keberhasilan kultur ditandai dengan pertumbuhan yang semakin meningkat dari kepadatan fitoplankton, hal tersebut
2.5 Asam Amino
Asam amino adalah senyawa organik yang memiliki gugus fungsional karboksil (-COOH) dan amina (biasanya –NH2). Gugus karboksil ini memberikan sifat asam
dan gugus amina memberikan sifat basa. Asam amino pembentuk protein akan saling berikatan dengan ikatan peptida, sehingga dalam satu molekul dipeptida mengandung satu ikatan peptida.
2.5.1 Struktur Asam Amino
Rumus umum asam amino :
Secara umum, pada asam amino sebuah atom C mengikat empat gugus yaitu : gugus karboksil, gugus amina, satu buah atom hydrogen dan satu gugus sisa
(rantai samping, gugus –R). Rantai samping pada asam amino (gugus –R) yang berbeda-beda pada asam amino menentukan struktur, ukuran, muatan elektrik dan sifat kelarutan dalam air (Irizarry, 2010).
2.5.2 Sifat - sifat Asam Amino
Sifat asam amino umumnya larut dalam air dan tidak larut dalam pelarut organik
aromatik yang terdiri dari beberapa atom karbon, umumnya kurang larut dalam air
tetapi larut dalam pelarut organik. Demikian pula amina, pada umumnya tidak larut dalam air, tetapi larut dalam pelarut organik (Poedjiadi, 1994).
Asam amino mempunyai titik lebur yang lebih tinggi dibandingkan dengan asam karboksilat atau amina (lebih besar dari 200ºC). Selain itu asam amino bersifat sebagai elektrolit, dalam larutan kondisi netral (pH isoelektrik), asam amino dapat
membentuk ion yang bermuatan positif dan juga bermuatan negative (zwitterion) atau ion amfoter, keadaan ion sangat tergantung pada pH larutan (Irizarry, 2010).
2.5.3 Klasifikasi Asam Amino
Terdapat 2 jenis asam amino berdasarkan kemampuan tubuh dalam sintesisnya,
yaitu asam amino esensial dan asam amino non esensial. Asam amino esensial adalah asam amino yang tidak dapat disintesis oleh tubuh, tetapi diperoleh dari luar misalnya melalui makanan. Contoh asam amino esensial adalah lisin, leusin,
isoleusin, treonin, metionin, valin, fenilalanin, histidin, dan arginin. Sedangkan asam amino non esensial adalah asam amino yang dapat disintesis di dalam tubuh melalui perombakan senyawa lain (Poedjiadi, 1994).
Klasifikasi asam amino dapat dilakukan berdasarkan rantai samping (gugus –R) dan sifat kelarutannya didalam air. Berdasarkan kelarutan didalam air dibagi atas
(1) Dengan rantai samping alifatik (asam amino non polar) : Glisin, Alanin, Valin, Leusin, Isoleusin.
(2) Dengan rantai samping yang mengandung gugus hidroksil (OH), (asam amino polar) : Serin, Treonin, Tirosin.
(3) Dengan rantai samping yang mengandung atom sulfur (asam amino polar) : Sistein dan metionin.
(4) Dengan rantai samping yang mengandung gugus asam atau amidanya(gugus R bermuatan negatif) : Asam aspartat, Aspargin, Asam glutamate, Glutamin.
(5) Dengan rantai samping yang mengandung gugus basa (gugus R bermuatan positif): Arginin, lisin, Histidin
(6) Mengandung cincin aromatik : Histidin, Fenilalanin, Tirosin, Triptofan.
(7) Asam amino jenis Prolin.
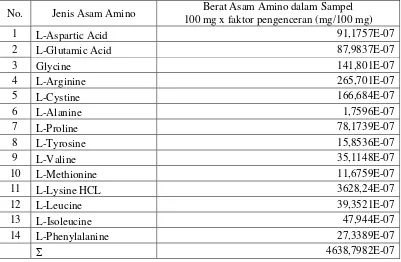
Berdasarkan uji yang dilakukan untuk mengetahui kandungan asam amino dalam
[image:53.595.114.515.445.707.2]mikroalga Nannochloropsis sp. didapatkan data dalam Tabel 1. Tabel 1. Kandungan asam amino pada Nannochloropsis sp.
No. Jenis Asam Amino Berat Asam Amino dalam Sampel
100 mg x faktor pengenceran (mg/100 mg)
1 L-Aspartic Acid 91,1757E-07
2 L-Glutamic Acid 87,9837E-07
3 Glycine 141,801E-07
4 L-Arginine 265,701E-07
5 L-Cystine 166,684E-07
6 L-Alanine 1,7596E-07
7 L-Proline 78,1739E-07
8 L-Tyrosine 15,8536E-07
9 L-Valine 35,1148E-07
10 L-Methionine 11,6759E-07
11 L-Lysine HCL 3628,24E-07
12 L-Leucine 39,3521E-07
13 L-Isoleucine 47,944E-07
14 L-Phenylalanine 27,3389E-07
2.5.4 Asam Amino Non Esensial
Dari sekitar 20 jenis asam amino yang dibutuhkan tubuh, beberapa di antaranya
disebut sebagai asam amino esensial atau penting karena tubuh tidak bisa membentuknya dan harus didapat dari makanan. Dan seperti yang telah dibahas sebelumnya asam amino yang lain disebut sebagai non-esensial karena tubuh
dapat membentuknya. Fungsinya antara lain untuk menjaga kesehatan fungsi ginjal dan fungsi seksual pria seperti arginine, berguna menjaga fungsi hati seperti
alanine, pengaturan tekanan darah dan fungsi seksual pria. Glutamic Acid dan Choline menjaga fungsi kesehatan otak. Proline untuk pembentukan kolagen dan penyerapan zat-zat gizi bagi tubuh (Poedjiadi, 1994).
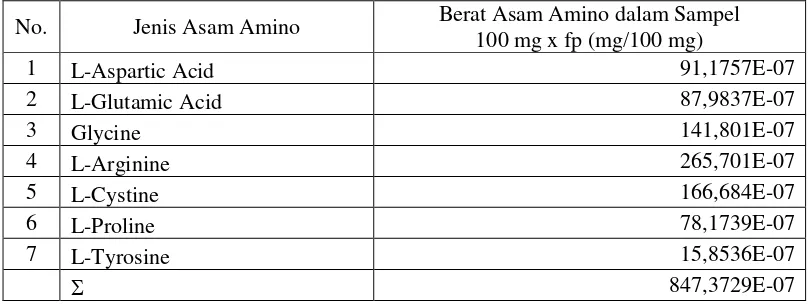
[image:54.595.111.515.483.636.2]Berdasarkan uji didapatkan 18,3% asam amino non esensial dari jumlah total asam amino, dengan spesifikasi jumlah dan jenis yang dapat dijelaskan pada Tabel 2. Jenis-jenis asam amino non esensial pada Nannochloropsis sp.
No. Jenis Asam Amino Berat Asam Amino dalam Sampel
100 mg x fp (mg/100 mg)
1 L-Aspartic Acid 91,1757E-07
2 L-Glutamic Acid 87,9837E-07
3 Glycine 141,801E-07
4 L-Arginine 265,701E-07
5 L-Cystine 166,684E-07
6 L-Proline 78,1739E-07
7 L-Tyrosine 15,8536E-07
847,3729E-07
Sumber: Lab. Badan Penelitian dan Pengembangan Kelautan dan Perikanan (2011)
(1) Arginin
setengah esensial bagi manusia dan mamalia lainnya, tergantung pada tingkat
perkembangan atau kondisi kesehatan. Bagi anak-anak, asam amino ini esensial. Pangan yang menjadi sumber utama arginin adalah produk-produk peternakan
(dairy products) seperti daging, susu (dan olahannya), dan telur. Dari produk tumbuhan dapat disebutkan cokelat dan biji kacang tanah. Arginin memiliki rumus kimia C6H14N4O2, titik leburnya 244°C, masa jenisnya 1,165 g/cm-3, titik
isoelktrik 10,76, nama sistematiknya adalah Asam S-2-amino-5-(diamino metilidenamino) pentanoat.
Struktur rangka L-arginine, dengan singkatan atau nama lain Arg (Irizarry, 2010).
(2) Asam aspartat
Asam aspartat (atau sering disebut aspartat saja, karena terionisasi di dalam sel), merupakan satu dari 20 asam amino penyusun protein. Asparagin merupakan
asam amino analognya karena terbentuk melalui aminasi aspartat pada satu gugus hidroksilnya.
Asam aspartat bersifat asam, dan dapat digolongkan sebagan asam karboksilat. Bagi mamalia aspartat tidaklah esensial. Fungsinya diketahui sebagai pembangkit neurotransmisi di otak dan saraf otot. Diduga, aspartat berperan dalam daya tahan
aspartat, Asam aspartat Memiliki rumus kimia C4H7NO4, titik leburnya
270-271°C, masa jenisnya 1,23 gcm-3, titik isoelektrik 2,77. Nama sistematiknya adalah Asam Asam 2S-2-aminobutandioat.
Struktur rangka L-aspartat, dengan singkatan atau nama lain Asp (Irizarry, 2010).
(3) Asam glutamat
Asam glutamat termasuk asam amino yang bermuatan (polar) bersama-sama dengan asam aspartat. Ini terlihat dari titik isoelektriknya yang rendah, yang
menandakan ia sangat mudah menangkap elektron (bersifat asam menurut Lewis). Asam glutamat dapat diproduksi sendiri oleh tubuh manusia sehingga tidak tergolong esensial. Ion glutamat merangsang beberapa tipe saraf yang ada di lidah
manusia. Sifat ini dimanfaatkan dalam industri penyedap. Garam turunan dari asam glutamat, yang dikenal sebagai mononatrium glutamat ( dikenal juga
sebagai monosodium glutamat, MSG, vetsin atau micin), sangat dikenal dalam dunia boga Indonesia maupun Asia Timur lainnya sebagai penyedap masakan. Berikut ini beberapa informasi tentang Asam glutamat, Asam glutamat Memiliki
Struktur rangka L-glutamat, dengan singkatan atau nama lain Glu (Irizarry, 2010).
(4) Glisin
Glisin (Gly, G) atau asam aminoetanoat adalah asam amino alami paling
sederhana. Rumus kimianya C2H5NO2. Asam amino ini bagi manusia bukan merupakan asam amino esensial karena tubuh manusia dapat mencukupi kebutuhannya. Glisin merupakan satu-satunya asam amino yang tidak memiliki
isomer optik karena gugus residu yang terikat pada atom karbon alpha adalah atom hidrogen sehingga terjadi simetri. Jadi, tidak ada L-glisin atau D-glisin.
Glisin merupakan asam amino yang mudah menyesuaikan diri dengan berbagai situasi karena strukturnya sederhana. Sebagai misal, glisin adalah satu- satunya asam amino internal pada heliks kolagen, suatu protein struktural. Pada sejumlah
protein penting tertentu, misalnya sitokrom c, mioglobin, dan hemoglobin, glisin selalu berada pada posisi yang sama sepanjang evolusi (terkonservasi).
Penggantian glisin dengan asam amino lain akan merusak struktur dan membuat protein tidak berfungsi dengan normal. Secara umum protein tidak banyak
pengandung glisin. Perkecualian ialah pada kolagen yang dua per tiga dari keseluruhan asam aminonya adalah glisin. Glisin merupakan asam amino nonesensial bagi manusia.. Glisin berperan dalam sistem saraf sebagai inhibitor
masa jenisnya 1,607 g cm-3, titik isoelektrik 10,76, nama sistematiknya adalah
Asam 2-aminoetanoat.
Struktur rangka L-glisina, dengan singkatan atau nama lain Gly (Irizarry, 2010).
(5) Prolin
Prolin merupakan satu-satunya asam amino dasar yang memiliki dua gugus samping yang terikat satu-sama lain (gugus amino melepaskan satu atom H untuk
berikatan dengan gugus sisa). Akibat strukturnya ini, prolin hanya memiliki gugus amina sekunder (-NH-). Beberapa pihak menganggap prolin bukanlah asam amino
karena tidak memiliki gugus amina namun imina namun pendapat ini tidak tepat. Adanya rantai siklik yang terbentuk antara gugus amina dan residu menyebabkan prolin memiliki karakter yang khas (relatif sangat kaku) dan menentukan
konformasi protein secara kuat. Prolin dapat berperan sebagai pengubah struktur
α-heliks dan juga sebagai titik belok bagi β-sheets.
Fungsi terpenting prolin tentunya adalah sebagai komponen protein. Sel tumbuh-tumbuhan tertentu yang terpapar kondisi lingkungan yang kurang cocok (misalnya kekeringan) akan menghasilkan prolin untuk menjaga keseimbangan osmotik sel.
Prolin dibuat dari asam L-glutamat dengan prekursor suatu asam imino. Prolin bukan merupakan asam amino esensial bagi manusia. Berikut ini beberapa
informasi tentang Prolin, Prolin Memiliki rumus kimia C5H9NO2, titik leburnya 221°C, titik isoelektrik 6,30, nama sistematiknya adalah Asam S-pirolidin-2-
Struktur rangka L-prolina, dengan singkatan atau nama lain Pro (Irizarry, 2010).
(6) Sistein
Sistein merupakan asam amino bukan esensial bagi manusia yang memiliki atom S, bersama-sama dengan metionin. Atom S ini terdapat pada gugus tiol (dikenal
juga sebagai sulfhidril atau merkaptan). Karena memiliki atom S, sistein menjadi sumber utama dalam sintesis senyawa-senyawa biologis lain yang mengandung belerang. Sistein dan metionin pada protein juga berperan dalam menentukan
konformasi protein karena adanya ikatan hidrogen pada gugus tiol. Sistein mudah teroksidasi oleh oksigen dan membentuk sistin, senyawa yang terbentuk dari dua
molekul sistein yang berikatan pada atom S masing-masing. Reaksi ini melepas satu molekul air (reaksi dehidrasi).
Sumber utama sistein pada makanan adalah cabai, bawang putih, bawang
bombay, brokoli, haver, dan inti bulir gandum (embrio). L-sistein juga diproduksi secara industri melalui hidrolisis rambut manusia dan babi serta bulu unggas,
namun sejak tahun 2001 juga telah dapat diproduksi melalui fermentasi mikroorganisme.
Serat wol dari domba juga banyak mengandung sistein. Bagi domba, sistein
domba transgenik yang memiliki enzim penghasil sistein (dari metionin) telah
berhasil dikembangkan sehingga ketergantungan akan rumput menjadi berkurang. Berikut ini beberapa informasi tentang Serin, Serin Memiliki rumus kimia
C3H7NO2S1, Titik leburnya 240°C, titik isoelektrik 5,07 , nama sistematiknya adalah Asam 2R-2-amino- 3-sulfanil-propanoat.
Struktur rangka L-seistina, dengan singkatan atau nama lain Cys (Irizarry, 2010).
(7) Tirosin
Tirosin (dari bahasa Yunani tyros, berarti keju, karena ditemukan pertama kali dari keju) merupakan satu dari 20 asam amino penyusun protein. Ia memiliki satu gugus fenol (fenil dengan satu tambahan gugus hidroksil). Bentuk yang umum
adalah L-tirosin (S-tirosin), yang juga ditemukan dalam tiga isomer struktur: para, meta, dan orto. Pembentukan tirosin menggunakan bahan baku fenilalanin oleh
enzim Phe-hidroksilase. Enzim ini hanya membuat para-tirosin. Dua isomer yang lain terbentuk apabila terjadi "serangan" dari radikal bebas pada kondisi oksidatif
tinggi (keadaan stress).
Dalam transduksi signal, tirosin memiliki peran kunci dalam pengaktifan beberapa enzim tertentu melalui proses fosforilasi (membentuk fosfotirosin). Bagi manusia,
Tirosin tidak bersifat esensial bagi manusia. Oleh enzim tirosin hidroksilase,
tirosin diubah menjadi DOPA yang merupakan bagian dari manajemen terhadap penyakit Parkinson. Tanaman opium (Papaver somniferum) menggunakan tirosin
sebagai bahan baku untuk menghasilkan morfin, suatu alkaloid. Berikut ini beberapa informasi tentang Tirosin, Tirosin Memiliki rumus kimia C9H11NO3, Titik leburnya 343°C, titik isoelektrik 5,66, nama sistematiknya adalah Asam
S-2-amino-3- (4-hidroksi-fenil)-propanoat.
Struktur rangka L-tirosina, dengan singkatan atau nama lain Tyr (Irizarry, 2010).
2.5.5 Fungsi Biologis Asam Amino
Fungsi biologis asam amino tentu saja sebagai penyusun protein, termasuk enzim.
V. KESIMPULAN DAN SARAN
5.1. Kesimpulan
Berdasarkan hasil penelitian yang telah dilakukan didapatkan kesimpulan bahwa: 1. Kandungan asam amino non esensial yang teridentifikasi pada mikroalga
Nannochloropsis sp. antara lain asam aspartat; serin; asam glutamat; glisin; alanin; prolin dan tirosin.
2. Periodisitas pencahayaan yang berbeda dalam kultur Nannochloropsis sp. memiliki pengaruh terhadap kandungan nutrisi asam amino non esensial. Rata-rata kenaikan asam amino non esensial sebesar 134%, sebagai efek dari
peningkatan periode terang.
5.2. Saran
Adapun saran yang diajukan antara lain :
1. Penelitian tersebut dapat dilanjutkan dengan kisaran periodisitas cahaya atau
dengan lama penyinaran yang lebih beragam.