Komposisi asam amino peptida γ-glutamilsistein yang diisolasi dari tajuk
selada (Lactuca sativa L.) dengan dan tanpa inokulasi
Azotobacter sp. LKM6
Safri Ishmayana
1), Yulia Kristina
1), Dian Siti Kamara
1),
Reginawanti Hindersah
2), Soetijoso Soemitro
1)1) Laboratorium Biokimia Jurusan Kimia FMIPA Universitas Padjadjaran,
Jl. Singaperbangsa No.2 Bandung 40133
2) Laboratorium Biologi dan Bioteknologi Tanah Jurusan Ilmu Tanah Fakultas Pertanian Universitas Padjadjaran,
Jl. Raya Bandung-Sumedang km. 21 Jatinangor 45363
e-mail [email protected]
Abstrak
Azotobacter, yang digunakan sebagai pupuk hayati, menghasilkan eksopolisakarida yang dapat
meningkatkan kelarutan logam berat kadmium (Cd) dalam tanah. Tanaman merespon paparan logam berat dengan beberapa cara. Peptida γ-glutamilsistein (γEC) disintesis secara enzimatis oleh tanaman sebagai salah satu respon terhadap paparan logam berat yang berperan sebagai pengkhelat pada proses pengasingan logam berat. Peptida ini disintesis dengan asam amino ujung karboksi yang berbeda, yaitu (γEC)nG, (γEC)nS, (γEC)nβA, (γEC)nE dan (γEC)n. Peptida ini dapat diisolasi dari daun selada (Lactuca sativa L.), namun hanya sedikit informasi yang ada. Penelitian ini bertujuan untuk menyelidiki keberadaan peptida γEC pada tajuk selada dengan menentukan bentuk peptida γEC. Kami juga menentukan komposisi asam aminonya setelah diinokulasi Azotobacter. Peptida diisolasi dengan metode ekstraksi menggunakan asam klorida, diikuti dengan kromatografi filtrasi gel Sephadex G25, pengendapan dengan amonium sulfat dan kromatografi filtrasi gel Sephadex G25. Keberadaan peptida (γEC)n dideteksi dengan metode kolorimetri dengan reagen natrium nitroprussida. Komposisi asam amino peptida yang diisolasi ditentukan dengan menggunakan kromatografi cair kinerja tinggi (KCKT) fasa terbalik dengan detektor fluoresensi, setelah hidrolisis dengan asam. Hasil penelitian menunjukan bahwa rasio mol asam amino asam glutamat (E), sistein (C), glisin (G) dan serin (S) relatif terhadap C dari peptida yang diisolasi dari tajuk selada yang tidak dan diinokulasi dengan Azotobacter masing-masing adalah 1,23 : 1,00 : 0,64 : 0,32 dan 1,22: 1,00: 0,63: 0,26. Hasil ini menujukan bahwa ada dua jenis peptida γEC yang diisolasi dari daun selada. Kami juga menemukan bahwa inokulasi selada dengan Azotobacter tidak berpengaruh terhadap komposisi asam amino peptida secara keseluruhan. Dari hasil penelitian ini dapat disimpulkan bahwa ada dua jenis peptida yang terdapat pada tajuk selada, yaitu (γEC)nG dan (γEC)nS.
Kata Kunci: Azotobacter, eksopolisakarida, peptida γ-glutamilsistein, logam berat
Abstract
Azotobacter, which used as biofertilizer, produces exopolysaccharide which can increase the solubility
of heavy metal cadmium (Cd) in soil. Plants may response to heavy metal exposure in several ways. γ-Glutamilsistein peptides (γEC) are enzymatically synthesized by plants as one of its response to heavy metals exposure that act as chelator in heavy metals sequestration. The peptide is synthesized with different carboxy terminal amino acids, which are (γEC)nG, (γEC)nS, (γEC)nβA, (γEC)nE and (γEC)n. These peptides can also be isolated from the lettuce leaf (Lactuca sativa L.), however, there is few information is available. Therefore, our research is directed to investigate the presence of γEC peptide in lettuce leaf by means of which form of γEC. We also determine its amino acids composition upon inoculation with Azotobacter. The peptides were isolated by extraction from the lettuce leaf with hydrochloric acid, followed by the Sephadex G25 gel filtration chromatography, ammonium sulfate precipitation, and finally the Sephadex G25 gel filtration chromatography. The (γEC)n peptide was detected by colorimetric method using sodium nitroprusside reagent. The composition of the isolated peptide was determined by reversed phase HPLC with fluorescence detector, after acid hydrolysis. The results showed that the mol ratio of E (glutamic acid), C (cystein), G (glysin), and S (serine) relative to C of the isolated peptides from the non- and inoculated lettuce are 1.23 : 1.00 : 0.64 : 0.32 and 1.22: 1.00: 0.63: 0.26, respectively. This indicated that there are two types of γEC peptides isolated from the lettuce. We also discover that the inoculation of the lettuce with Azotobacter did not influence the overall amino acid composition of the peptides. The results conclude that there are two types of γEC peptides in lettuce, which are (γEC)nG and (γEC)nS.
1. PENDAHULUAN
Penggunaan pupuk hayati adalah salah satu contoh aplikasi bioteknologi dalam bidang pertanian.
Azotobacter banyak dimanfaatkan sebagai pupuk
hayati karena memiliki sejumlah aktivitas biokimia yang berperan dalam kesehatan tanah dan selanjutnya mendorong pertumbuhan tanaman. Selain memfiksasi nitrogen dan menghasilkan hormon (1), bakteri ini dilaporkan dapat melarutkan fosfat anorganik (2), memproduksi asam pantotenat dan tiamin pada kondisi bebas nitrogen (3), melakukan dehalogenasi senyawa xenobiotik (4), dan memproduksi siderofor pada kondisi kahat besi (5).
Namun, kemampuan Azotobacter untuk memproduksi eksopolisakarida (EPS) berpotensi untuk meningkatkan mobilisasi logam berat dalam tanah sehingga lebih mudah untuk diserap oleh tumbuhan (6,7). Dengan semakin mudahnya penyerapan logam berat oleh tumbuhan, akan menyebabkan meningkatnya konsentrasi logam berat yang terdapat pada tumbuhan sehingga dapat membahayakan jika tumbuhan tersebut termasuk yang biasa dikonsumsi oleh manusia.
Kadmium (Cd) adalah logam berat yang secara fisiologis tidak diperlukan tanaman. Secara alami tanah mengandung Cd dengan konsentrasi yang tergantung pada batuan induk, proses terbentuknya tanah, dan translokasi logam berat di tanah (8). Namun kegiatan antropogenik menyebabkan konsentrasi Cd meningkat. Aktivitas industri dan penggunaan pupuk fosfat telah menambah kandungan logam ini di beberapa daerah (9,10). Tumbuhan dapat mengabsorpsi Cd dari tanah dan menyimpannya pada jaringan yang aman, memasukkan logam tersebut ke dalam jaring-jaring makanan, termasuk makanan manusia (10).
Sehubungan dengan transportasi dan penyimpanan Cd oleh tanaman, Cd berikatan dengan polipeptida fitokelatin (PC) dan protein metallothioneine (MT) di sitoplasma dan plastid (11,12). Kemampuan peptida ini dalam pengasingan (sequestration) Cd dapat memproteksi tanaman dari pengaruh racun Cd (12). Karena itu, tanaman yang tumbuh pada tanah yang terkontaminasi Cd jarang memperlihatkan gejala keracunan, kecuali jika konsentrasi Cd di tanaman telah mencapai batas kritis. Karena itu, bahaya peningkatan Cd di tanah pertanian adalah konsentrasi Cd berlebihan di tanaman konsumsi yang mengancam kesehatan manusia. Bahaya ini terutama jika bagian yang dikonsumsi adalah daun dari tanaman sayuran akumulator Cd seperti tanaman dari genus Lactucca dan Brassica, seperti selada dan pakcoy. Resiko terbesar keracunan Cd pada manusia adalah disfungsi ginjal jika asupan Cd melampaui 200 mg/kg berat badan (13).
PC merupakan peptida yang kaya akan sistein, disintesis secara enzimatis, berhubungan secara struktural dengan glutation dan memiliki struktur umum (γEC)nG, dengan n bervariasi antara dua sampai
sebelas (14), namun pada umumnya berkisar antara dua sampai lima (15). Pada beberapa tumbuhan, glisin dapat digantikan oleh asam amino lainnya. Beberapa variasi pada struktur peptida γEC yang telah ditemukan pada beberapa spesies tumbuhan antara lain (γEC)n, (γEC)nβA, (γEC)nS dan (γEC)nG (11,23).
Pengaruh inokulasi bakteri penghasil EPS terhadap pertumbuhan tanaman telah banyak diteliti (6,7,16,17), tetapi pengaruh pupuk hayati ini terhadap mobilisasi logam Cd tanah melalui mekanisme pembentukan EPS belum banyak diteliti. Sejumlah penelitian yang telah dilakukan memperlihatkan peningkatan akumulasi Cd di tajuk tanaman setelah inokulasi Azotobacter (18,19). Oleh karena itu, inokulasi Azotobacter harus dilakukan dengan memperhatikan konsentrasi inokulan agar akumulasi Cd berlebih di bagian tanaman konsumsi dapat dihindarkan. Sejalan dengan pertanian yang memperhatikan keamanan lingkungan dan pangan, kemampuan pupuk hayati Azotobacter untuk memobilisasi logam toksik seperti Cd perlu dikaji. Antisipasi ini perlu dilakukan terutama bila inokulasi
Azotobacter dilakukan di tanah pertanian yang kaya
Cd baik secara alami maupun akibat kegiatan antropogenik.
Belum banyak informasi mengenai peptida (γEC)n
yang terdapat pada selada. Oleh karena itu, penelitian ini dilakukan untuk menentukan komposisi asam amino yang terdapat pada peptida (γEC)n. Selain itu,
kami juga menentukan pengaruh inokulasi Azotobacter penghasil eksopolisakarida terhadap komposisi asam amino peptida (γEC)n yang terbentuk.
2. METODE PENELITIAN
2.1
Penanaman selada
Bibit tanaman selada umur 3 minggu ditanam pada tanah andisols dengan dan tanpa inokulasi selama 30 hari. Pada saat ditanam, bibit diberi 5 mL inokulan
Azotobacter sp. LKM6 dengan kepadatan 109 cfu/mL,
tanaman kontrol tidak diberi inokulan.
2.2 Pembuatan reagen nitroprussida (20)
Sebanyak 15 g amonium sulfat di gerus dan ditambahkan 0,15 g natrium nitroprussida, kemudian kedua zat tersebut digerus bersama-sama sampai tercampur (campuran 1). Sebanyak 15 g natrium karbonat digerus dan ditambahkan 0,125 g kalium sianida, kemudian kedua zat tersebut digerus bersama-sama sampai tercampur (campuran 2). Campuran 1 dan campuran 2 kemudian disatukan dan diaduk. Campuran ini kemudian dilarutkan dalam air dengan perbandingan 1:2 (berat:volume) dan diaduk menggunakan magnetic stirer sampai larut
2.3 Penentuan
panjang
gelombang
maksimum
Sebanyak 0,2 mL larutan sistein (100 mg/mL) ditambah dengan 1,8 mL reagen nitroprussida kemudian didiamkan selama 30 menit. Kemudian diukur serapannya dengan alat spektrofotometer UV/Vis pada panjang gelombang 400 sampai 800 nm.
2.4 Penentuan waktu optimum
Larutan sistein dibuat dengan variasi konsentrasi 100, 200, 300, dan 400 mg/mL. Sebanyak 0,2 mL larutan sistein kemudian diuji dengan 1,8 mL reagen nitroprussida. Campuran larutan tersebut kemudian diukur serapannya dengan alat Spektrofotometer UV/Vis pada panjang gelombang 520 nm pada berbagai waktu, yaitu 5, 10, 15, 20, 25, 30, 35, 40, dan 45 menit.
2.5 Isolasi dan pemurnian peptida γEC
2.5.1 Ekstraksi peptida γEC (21)
Daun selada dicuci dengan aquades, dikeringkan, kemudian dipotong-potong. Sebanyak 5 gram tajuk selada ditambahkan dengan 15 mL asam klorida 0,1 N kemudian dihaluskan dengan menggunakan potter
Elvehjem yang disimpan di atas es. Ekstrak tajuk
selada kemudian disentrifugasi selama 20 menit pada kecepatan 5000 rpm. Supernatan dipisahkan dari endapannya, ditambahkan 6 mL larutan yang mengandung 0,5 M tris, 30 mM 2-merkaptoetanol, dan 2 mM EDTA, kemudian disentrifugasi kembali selama 20 menit pada kecepatan 5000 rpm, dan diambil supernatannya. Supernatan yang diperoleh merupakan ekstrak peptida.
2.5.2 Kromatografi filtrasi gel
Pemurnian dilakukan dengan menggunakan kolom kromatografi filtrasi gel menggunakan matriks Sephadex G-25. Matriks yang digunakan dikemas dalam kolom gelas berdiameter 1 cm dan tinggi 60 cm. Eluen yang digunakan adalah bufer asetat 50 mM pH 5. Sebanyak 1,8 mL ekstrak peptida dimasukkan ke dalam matriks, dan fraksi-fraksi yang diperoleh ditampung dengan volume penampungan sebanyak 2 mL per fraksi dan kecepatan alir 1 mL per menit. Keberadaan peptida γEC pada fraksi-fraksi hasil pemisahan kromatografi filtrasi gel dideteksi dengan uji nitroprussida dan keberadaan protein dideteksi pada panjang gelombang 280 nm.
2.5.3 Fraksionasi protein dengan amonium
sulfat
Sebanyak 2 mL supernatan difraksionasi dengan amonium sulfat pada derajat kejenuhan 0-100%, disentrifugasi selama 30 menit pada kecepatan 12000 rpm. Supernatan yang diperoleh kemudian direkromatografi dengan kolom kromatografi filtrasi gel Sephadex G-25.
2.6 Penentuan komposisi asam amino
peptida γEC
2.6.1 Hidrolisis peptida γEC
Fraksi-fraksi yang mengandung peptida γEC ditambahkan dengan asam klorida 0,6 N yang mengandung 0,01 % fenol dalam ampul, kemudian dihidrolisis selama 20 jam pada suhu 110oC .
2.6.2 Kromatografi cair kinerja tinggi
Sebanyak 2 µL peptida γEC yang telah dihidrolisis, dianalisis dengan alat KCKT fasa terbalik dengan fasa diam kolom picotaq C-18, detektor flouresensi dengan panjang gelombang 440 nm. Fasa gerak asetonitril dan natrium asetat dengan kecepatan alir 1 mL/menit. Hasil KCKT fasa terbalik dari masing-masing sampel dibandingkan dengan standar asam amino.
3. HASIL DAN PEMBAHASAN
Deteksi peptida γEC
Untuk menentukan adanya peptida γEC, digunakan metode kolorimetri menggunakan reagen yang mengandung natrium nitroprussida. Prinsip uji ini adalah reaksi antara gugus tiol pada sistein dengan reagen nitroprussida menghasilkan senyawa kompleks berwarna merah muda (20). Reaksi yang terjadi pada deteksi peptida γEC pada sampel adalah adanya reaksi antara gugus tiol dari sistein, yang merupakan salah satu asam amino penyusun peptida γEC, dengan natrium nitroprussida.
Penggunaan metode kolorimetri menggunakan reagen nitroprussida merupakan metode yang pertama kali dilakukan untuk mendeteksi adanya peptida γEC. Untuk menentukan serapan senyawa kompleks yang terbentuk, dilakukan penentuan panjang gelombang maksimum senyawa kompleks yang terbentuk. Serapan senyawa kompleks yang terbentuk diukur menggunakan Spektrofotometer UV/Vis pada panjang gelombang 400-800 nm. Grafik hasil pengukuran menunjukkan bahwa senyawa kompleks yang
terbentuk memiliki serapan maksimum pada panjang gelombang 520 nm (Gambar 1).
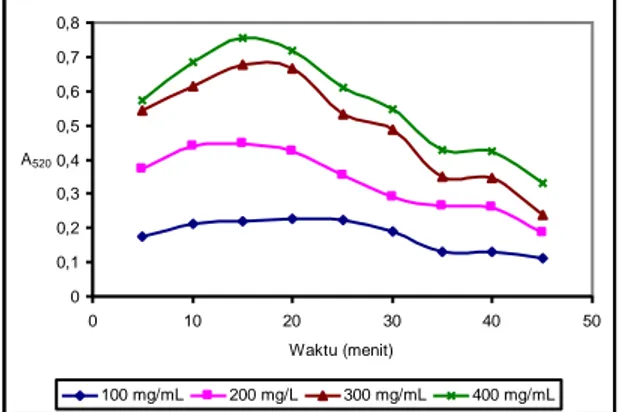
Gambar 1 Serapan kompleks hasil reaksi gugus tiol dengan reagen nitroprussida pada berbagai panjang gelombang. Campuran larutan sistein dan reagen nitroprussida didiamkan selama 30 menit. 0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0 10 20 30 40 50 Waktu (menit) A520 100 mg/mL 200 mg/L 300 mg/mL 400 mg/mL
Gambar 2 Serapan senyawa kompleks yang terbentuk antara sistein dan reagen nitroprussida pada berbagai variasi waktu.
Senyawa kompleks hasil reaksi antara gugus tiol dengan natrium nitroprussida merupakan senyawa yang tidak stabil, oleh karena itu dilakukan penentuan waktu optimum untuk menentukan waktu pada saat senyawa kompleks yang terbentuk relatif stabil. Untuk menentukan waktu optimum, dilakukan pengukuran serapan larutan sistein dengan berbagai variasi konsentrasi, yaitu 100, 200, 300, dan 400 mg/mL. Larutan sistein ditambah dengan reagen nitroprussida dan diukur serapannya dengan menggunakan Spektrofotometer UV/Vis pada panjang gelombang 520 nm pada berbagai variasi waktu, yaitu 5, 10, 15, 20, 25, 30, 35, 40, dan 45 menit. Pada Gambar 2 dapat dilihat bahwa senyawa kompleks yang terbentuk antara sistein pada berbagai konsentrasi dengan natrium nitroprussida, pada variasi waktu memiliki serapan yang relatif stabil pada waktu 35 menit.
Isolasi dan pemurnian peptida
γ-glutamilsistein
Setelah ditanam selama 30 hari, tanaman selada dipanen, tanaman selada segar dicuci bersih dan dikeringkan. Selanjutnya bagian tajuk tanaman selada dipotong kecil-kecil dengan menggunakan gunting untuk memudahkan saat proses penggerusan. Setelah dipotong, selada ditimbang masing-masing sebanyak 5 gram. Sampel tajuk selada diekstraksi menggunakan asam klorida dan dihomogenisasi dengan menggunakan potter Elvehjem yang diletakan di atas penangas es. Setelah halus, kemudian ekstrak tajuk selada disentrifugasi selama 20 menit pada kecepatan 5000 rpm untuk memisahkan supernatan yang mengandung peptida γ-glutamilsistein dengan endapan. Setelah disentrifugasi, kemudian supernatan ditambahkan dengan larutan campuran Tris, EDTA, dan 2-merkaptoetanol. Tris berfungsi sebagai bufer untuk mempertahankan pH agar peptida γEC yang terdapat pada supernatan tersebut tidak rusak. 2-merkaptoetanol berfungsi untuk mereduksi peptida γ-glutamilsistein yang mungkin telah mengalami oksidasi.
Untuk memisahkan peptida γEC dengan protein lain dilakukan pemisahan dengan menggunakan kromatografi filtrasi gel Sephadex G-25. Matriks Sephadex G-25 digunakan karena peptida γEC ini memuiliki ukuran molekul 300-1000 Da (21), sehingga peptida dapat masuk ke dalam pori-pori matriks Sephadex G-25 yang memiliki batas rentang fraksionasi 1000-5000 Da.
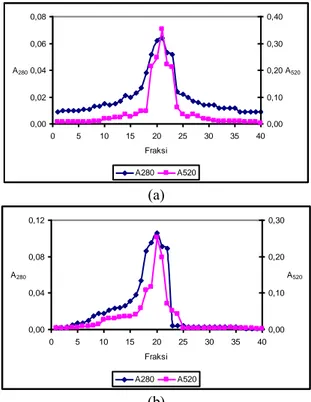
Setelah dilakukan pemisahan dengan kromatografi filtrasi gel Sephadex G-25, fraksi-fraksi yang ditampung, diukur serapannya pada panjang gelombang 280 nm untuk mendeteksi adanya protein pada sampel. Untuk mendeteksi fraksi yang mengandung peptida γEC, digunakan metode kolorimetri dengan menggunakan reagen nitroprussida. Fraksi yang mengandung peptida γEC akan menghasilkan larutan berwarna merah muda. Serapan pada panjang gelombang 280 nm dan 520 nm, kemudian diimpitkan untuk mengetahui profil protein sampel. Dari grafik yang diperoleh dari sampel a0 dan a1 dapat dilihat bahwa pada peptida γEC belum terpisah secara sempurna dengan protein lain, hal ini dapat dilihat dari puncak-puncak yang masih berimpit antara A280 dengan A520 (Gambar 3(a) dan 3(b)). A Panjang gelombang (nm) 400 .0 500 .0 600 .0 700 .0 800 .0 0.100 0.200 0.300
0,00 1,00 2,00 3,00 0 5 10 15 20 25 30 35 40 Fraksi A280 0,00 0,30 0,60 0,90 A520 A280 A520 (a) 0,00 1,00 2,00 3,00 4,00 5,00 0 5 10 15 20 25 30 35 40 Fraksi A280 0,00 0,10 0,20 0,30 0,40 A520 A280 A520 (b)
Gambar 3 Kromatogram pemisahan peptida γEC dengan protein yang terdapat pada daun selada (a) tanpa dan (b) dengan inokulasi
Azotobacter. Pemisahan dengan matriks
Sephadex G-25 dengan laju alir 1 mL/menit. Volume yang ditampung sebanyak 2 mL per fraksi. Setiap fraksi diukur serapannya pada λ 280 nm untuk deteksi protein dan λ 520 setelah direaksikan dengan reagen nitroprussida untuk deteksi peptida γEC
Karena hasil kromatografi filtrasi gel masih belum terpisah dengan baik, maka perlu dilakukan pemisahan lebih lanjut. Untuk memisahkan peptida γEC dengan protein lain, maka dilakukan fraksionasi dengan garam amonium sulfat dengan kejenuhan 0-100%. Pada uji pendahuluan, peptida γEC tidak mengendap pada kejenuhan 0-100% (data tidak ditampilkan). Dengan menggunakan kejenuhan 0-100% amonium sulfat, diharapkan semua protein dapat mengendap, sehingga akan terpisah dengan peptida γEC.
Untuk menghilangkan garam ammonium sulfat, maka sample hasil fraksionasi di rekromatografi untuk proses desalting dengan kromatografi filtrasi gel Sephadex G-25. Pada proses ini, hanya terbentuk satu puncak (Gambar 4 (a) dan 4 (b)). Fraksi-fraksi yang memberikan serapan pada panjang gelombang 520 nm setelah penambahan reagen nitroprussida, ternyata juga memberikan serapan pada panjang gelombang 280 nm. Namun, serapan pada panjang gelombang 280 nm jauh lebih kecil dibandingkan dengan serapan sebelum proses fraksionasi. Hal ini menunjukkan berkurangnya protein yang ada dalam sampel. Adanya
serapan tersebut dikonformasi dengan pendekatan bioinformatika dengan menggunakan program ProtParam dari ExPASy (www.expasy.ch). Hasil analisis menunjukkan bahwa peptida γEC memberikan serapan pada panjang gelombang 280 nm, dengan asumsi sistein yang ada pada peptida berada dalam keadaan tereduksi. Hal ini menyebebkan kesalahan yang besar (>10%), karena bukan merupakan panjang gelombang maksimum untuk peptida tersebut.
0,00 0,02 0,04 0,06 0,08 0 5 10 15 20 25 30 35 40 Fraksi A280 0,00 0,10 0,20 0,30 0,40 A520 A280 A520 (a) 0,00 0,04 0,08 0,12 0 5 10 15 20 25 30 35 40 Fraksi A280 0,00 0,10 0,20 0,30 A520 A280 A520 (b)
Gambar 4 Kromatogram proses desalting peptida γEC (a) tanpa dan (b) dengan inokulasi
Azotobacter. Pemisahan dengan matriks
Sephadex G-25 dengan laju alir 1 mL/menit. Volume yang ditampung sebanyak 2 mL per fraksi. Setiap fraksi diukur serapannya pada λ 280 nm untuk deteksi protein dan λ 520 setelah direaksikan dengan reagen nitroprussida untuk deteksi peptida γEC
Penentuan komposisi asam amino
Fraksi-fraksi yang positif dengan uji nitroprussida dikumpulkan dan dilakukan proses hidrolisis untuk analisis komposisi asam aminonya. Proses hidrolisis dilakukan dengan menggunakan asam klorida 6 N dan pemanasan selama 20 jam. Hidrolisat yang diperoleh berupa cairan pekat yang kemudian dianalisis kandungan asam amino nya dengan menggunakan metode KCKT fasa terbalik dengan detektor fluoresensi.
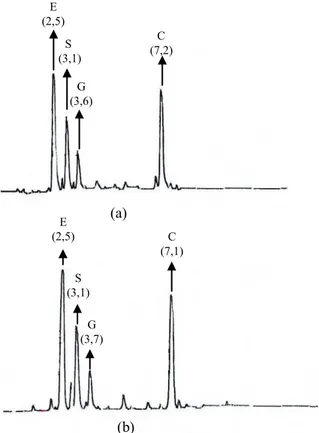
Gambar 5 Kromatogram hasil KCKT fasa terbalik hidrolisat peptida γEC dengan fasa diam kolom picotaq C-18, detektor flouresensi pada panjang gelombang 440 nm. Fasa gerak asetonitril dan natrium asetat gradien linear 0-15% asetonitril, kecepatan alir 1 mL/menit. Hidrolisat peptida dari selada (a) tanpa dan (b) dengan inokulasi
Azotobacter. Angka dalam kurung menunjukkan waktu retensi sampel. Masing-masing puncak menunjukkan asam amino utama yaitu: E= asam glutamat, S= serin, G= glisin dan C= sistein.
Hasil analisis KCKT menunjukkan bahwa baik peptida yang diisolasi dari selada tanpa maupun dengan inokulasi dengan Azotobacter ada empat asam amino utama yang terdeteksi, yaitu asam glutamat, sistein, glisin dan serin (Gambar 5 (a) dan 5 (b)).
Untuk menentukan jenis peptida yang terbentuk pada selada, dilakukan dengan menghitung perbandingan komposisi asam amino. Hasil perhitungan perbandingan asam amino dapat dilihat pada Tabel 1. Dari Tabel 1, dapat diketahui bahwa pada peptida yang diisolasi terdapat paling sedikit dua jenis peptida γEC, yaitu (γEC)nG atau fitokelatin dan (γEC)nS atau hidroksi metil fitokelatin.
Hasil-hasil penelitian sebelumnya (21,22,23) menunjukkan perbedaan kemampuan sintesis peptida γEC antara satu spesies dengan spesies yang lainnya. Hasil penelitian kami menunjukkan adanya indikasi kemampuan selada dalam menyinteseis dua jenis peptida γEC yaitu fitokelatin dan hidroksimetil fitokelatin.
Dengan memahami pembentukan peptida γEC pada daun selada merupakan dasar untuk memahami mekanisme molekular proses detoksifikasi logam berat yang terjadi pada suatu tanaman. Oleh karena itu, Penelitian lebih lanjut perlu dilakukan untuk menentukan struktur primer dari peptida γEC yang terdapat pada daun selada. Penentuan struktur primer ini dapat dilakukan dengan menentukan urutan asam amino peptida yang diisolasi atau dengan menggunakan teknik spektoskopi masa (21,23).
4. KESIMPULAN
Dari hasil yang diperoleh dapat disimpulkan bahwa peptida γEC yang terdapat pada daun selada terdiri atas asam glutamat, sistein, glisin dan serin. Hal ini menunjukkan adanya dua jenis peptida γEC, yaitu fitokelatin (γEC)nG dan hidroksimetil fitokelatin (γEC)nS. Inokulasi Azotobacter tidak mempengaruhi komposisi asam amino peptida γEC yang terbentuk.
Tabel 1 Komposisi asam amino peptida γEC yang diisolasi dari daun selada dan perbandingan masing-masing asam amino reltif terhadap asam amino sistein. Konsentrasi standar sebesar 5 μmol/mL.
Asam amino a0 a1 LA sampel LA standar [Sampel] (μmol/mL) [sampel] : [C] LA sampel LA standar [Sampel] (μmol/mL) [sampel] : [C] Glutamat 68939 144212 2,39 1,33 81950 144212 2,84 1,33 Sistein 54469 151016 1,80 1,00 64421 151016 2,13 1,00 Glisin 20322 194235 0,52 0,29 18995 194235 0,49 0,23 Serin 37407 157229 1,19 0,66 43386 157229 1,38 0,65 E (2,5) S (3,1) G (3,6) ) C (7,2) E (2,5) S (3,1) G (3,7) C (7,1) )
Waktu retensi (menit)
(a)
UCAPAN TERIMAKASIH
Penelitian ini didanai oleh project grant I-MHERE Universitas Padjadjaran. Oleh karena itu kami mengucapkan terimakasih kepada direktur eksekutif I-MHERE Universitas Padjadjaran atas pendanaan yang telah diberikan. Ucapan terima kasih juga kami sampaikan kepada Bapak Lalu Sukarno dari Balai Penelitian Pasca Panen, Departemen Pertanian atas bantuan teknis analisis asam amino beserta diskusi hasilnya.
DAFTAR ACUAN
[1] Hindersah, R,. Arief, D.H & Sumarni, Y. Kontribusi hormonal Azotobacter chroococcum pada pertumbuhan kecambah
jagung dalam kultur cair. Prosiding Seminar
Nasional Bioteknologi Pertanian, Yogyakarta
6-7 November 2000. hal. 141-151.
[2] Kumar, V. & Narula, N. Solubilization of Inorganic Phosphate and Growth Emergence of Wheat as Affected by Azotobacter
chroococcum Mutans. Biol. Fertil. Soil.
(1999). 28:301-307.
[3] Martinez-Toledo, M.V., Rodelas, B., Salmeron, V., Pozo, C. & Gonzalez-Lopez, J. Production of pantothenic acid and thiamine by Azotobacter vinelandii in a chemically defined medium and a dialyzed soil medium.
Biol. Fertil. Soil. (1996) 22:131-137.
[4] Zaborina, O., Latus, M., Eberspacher, J., Golovleva, L.A. & F. Lingens. Purification and characterization of 6-chlorohydroxyquinol 1,2-dioxygenase from Streptomyces rechei 303: Comparison with an analogous enzyme from Azotobacter sp. strain GP1. J. Bacteriol. (1995) 177:229-234.
[5] Page, W.J. Iron Dependent Production of Hydroxamate by Sodium-Dependent
Azotobacter chroococcum. Appl. Environ. Microbiol. (1987) 53:1418-1424
[6] Chen, J.H., L. W. Lion, W.C. Ghiorse, M. L. Shuler.. Mobilization of adsorbed cadmium and lead in aquifer material by bacterial extracellular polymers. Water Research. (1995a). 29: 421-430
[7] Chen, J-H., Czajka, D. R.,. Lion, L.W., Shuler, M.L. & Ghiorse, W.C.. Trace metal mobilization in soil by bacterial polymers.
Environ. Health Perspect. (1995b). 103
(Suppl 1): 53-58
[8] Alloway, B.J. The origin of heavy metals in soils. In Alloway, B.J (ed). Heavy metals in
soils. (1995a). Blackie Academic & Professional. Glasgow
[9] Nriagu, J.O. Global inventory of natural and anthtopogenic emissions of trace metals in the atmosphere. Nature. (1979). 279: 409-411.
[10] Wagner, G.J. Accumulation of cadmium in crop plants and its consequences to human health. Adv. Agron. (1993).51:173-212 [11] Rauser, W.A. Phytochelatin and related
peptides: Structure, biosynthesis and function.
Plant Physiol. (1995).109:1141-1149.
[12] Eapen, S. & D’Souza, S.F. Prospects of genetic engineering of plants for phytoremediation of toxic metals. Biotech.
Adv. (2004).23: 97-114.
[13] Alloway, B.J. Cadmium. In Alloway, B.J (ed).
Heavy metals in soils. (1995b). Blackie
Academic & Professional. Glasgow
[14] Grill, E., Gekeler, W., Winnacker E.L & Zenk, M.H . Homo-phytochelatins are heavy metal-binding peptides of homo-glutathione containing Fabales. FEBS Lett (1986). 205: 47–50
[15] Cobbett, C.S. Phytochelatins and their role in heavy metal detoxification. Plant Physiol. (2000).125:825– 832
[16] Emtiazi, G., Ethemadifar, Z. & Habibi, M.H. Production of extracellular polymer in
Azotobacter and biosorption of metal by
exopolymer. Afr. J. Biotech. (2004). 3:330-333.
[17] Zhou, L.X., Zhou, S.G. & Zhan, X.H.. Sorption and biodegradability of sludge bacterial extracelluar polymers in soil and their influence on soil copper bahavior. J. Environ.
Qual. (2004). 33:154-162
[18] Hindersah, R. D.H. Arief, A.M. Kalay. Rhizobacteria Azotobacter: Influence on Pb and Cd adsorption by roots of sweet corn. Makalah International Biotechnology Conference. Sanur 1-3 Desember 2004 [19] Hindersah, R., N. Komarudin, D. Amelia.
Cadmium Accumulation on Lettuce (Lactuca
sativa L.) Leaves Following Azotobacter
Inoculation. J.Budidaya Pertanian. (2006). 2:51-57
[20] Fischl, J., Sason, I. & Segal, S. A rapid test for the determination of cystinuria and aminoaciduria. Clin. Chem. (1961).7:674-677 [21] Klapheck, S., Fliegner, W. & Zimmer, I.
Hydroxymethyl-phytochelatin [(γ-glutamylcysteine)n-serine] are metal-induced peptides of poaceae. Plant Physiol.
(1994).104: 1325-1332.
[22] Klapheck, S., Schlunz, S & Bergmann, L . Synthesis of phytochelatins and homo-phytochelatins in Pisum sativum L. Plant
Physiol. (1995).107: 515–521
[23] Meuwly, P., Thibault, P., Schwan , A.L. & Rauser, W.E. Three families of thiol peptides are induced by cadmium in maize. Plant J. (1995).7:391-400