YANG MENGKATALISIS POLIMERISASI SILIKA
SITI NURJANAH
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
YANG MENGKATALISIS POLIMERISASI SILIKA
SITI NURJANAH
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Bioteknologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa tesis yang berjudul "Eksplorasi Protein dari Sponge Asal Perairan Pulau Nias dan Binuangeun yang Mengkatalisis Polimerisasi Silika" adalah karya sendiri di bawah bimbingan Prof. Dr. Ir. Maggy T. Suhartono dan Dr. Ir. Ekowati Chasanah, MSc., dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun yang tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, 11 Januari 2006
Nama : Siti Nurjanah NIM : P055030011
Disetujui
Komisi Pembimbing
Prof. Dr. Ir. Maggy T. Suhartono Dr. Ir. Ekowati Chasanah, M.Sc Ketua Anggota
Diketahui
Ketua Program Studi Bioteknologi Dekan Sekolah Pascasarjana
Dr. Ir. Muhammad Jusuf Prof. Dr. Ir. Sjafrida Manuwoto, M.Sc
© Hak cipta milik Siti Nurjanah, tahun 2006 Hak cipta dilindungi
SITI NURJANAH. Eksplorasi Protein dari Sponge Asal Perairan Pulau Nias dan Binuangeun yang Mengkatalisis Polimerisasi Silika. Dibimbing oleh MAGGY T. SUHARTONO dan EKOWATI CHASANAH.
Silika merupakan polimer dari silikon dioksida yang banyak digunakan sebagai bahan dasar untuk pembuatan peralatan, antara lain filter agent, cutter, polisher yang digunakan pada industri pangan; bahan pelapis alat-alat semikonduktor dan elektronik; biochips, biosensor, kit analisis, stateskop dan peralatan medis lainnya. Sponge (Filum porifera) merupakan organisme yang secara alamiah dapat membentuk struktur silika yang padat dan sangat teratur pada suhu kamar dan pH netral. Pembentukan silika ini terjadi dengan bantuan protein silicatein. Di industri, proses pembentukan silika memerlukan kondisi suhu dan tekanan tinggi, pH ekstrim dan penambahan bahan kimia yang dapat mencemari lingkungan. Isolasi protein yang terlibat dalam pembentukan silika pada sponge membuka peluang penggunaan katalis protein untuk membuat silika secara invitro pada suhu yang relatif rendah dan pH netral. Penelitian ini bertujuan untuk melakukan isolasi protein yang mengkatalisis polimerisasi silika dari beberapa spesies sponge asal perairan Pulau Nias dan Binuangeun serta menganalisis aktivitasnya terhadap substrat tetraethoxyorthosilicate (TEOS).
Isolasi protein dilakukan dengan memisahkan silika spikula dari sponge, kemudian melarutkan silika spikula dan membebaskan protein dengan perendaman silika dalam buffer HF/NH4F (pH 5,0). Protein dikumpulkan setelah didialisis dan disentrifugasi. Aktivitas protein dilihat dengan mereaksikannya dengan substrat TEOS membentuk polimer silika yang diukur dengan colorimetric molibdate assay dan analisis struktur dengan Scanning Electron Microscopy (SEM).
Protein dari Sponge ST1 dan Sponge ST3 mempunyai berat molekul yang sama (21,4 kDa), berbentuk filamen dengan panjang sekitar 0,1 mm dan diameter 10 µm. Kedua protein tersebut mampu melakukan polimerisasi silika dari substrat TEOS pada suhu kamar selama 12 jam. Protein Sponge ST1 sebanyak 250 µl (konsentrasi protein di bawah 5 µg/ml) dapat mempolimerisasi 15,9 µmol monomer TEOS dan protein Sponge ST3 pada kondisi yang sama dapat mempolimerisasi 3,0 µmol monomer TEOS. Polimer silika yang terbentuk dari hasil reaksi protein Sponge ST1 selama 48 jam, melapisi protein tersebut dan memperbesar diameter sekitar 4 kali lebih besar dari diameter protein semula.
Sponge ST5, ST6 dan ST7 mempunyai silika spikula berbentuk microscleres yang unik, sponge ini berpotensi untuk menghasilkan protein yang dapat membentuk struktur silika yang unik. Sponge ST8 dan ST9 yang mempunyai spikula bukan berasal dari silika, tetapi dari kalsium karbonat, tidak potensial untuk dijadikan sumber protein untuk katalis pembentukan silika.
SITI NURJANAH. Exploration of Protein Isolated from Nias Island and Binuangeun Sea Sponges Catalyze Silica Polymerization. Under the direction of MAGGY T. SUHARTONO and EKOWATI CHASANAH.
Silica, polymerized silicon dioxide, was widely used as raw materials for industries, such as food industry, semiconductor, electronic and medical equipment. Marine sponges (Phylum porifera) were living system that can produce a remarkable diversity of nanostructured silicates at ambient temperature and near-neutral pH. In contrast to living system, synthesis of these materials in industry require extreme of temperature, pressure, and pH with addition surfactant that can cause environmental pollution. Isolating protein that can catalyze nanostructured silica polymerization will make a new route for silica development under mild conditions using protein/enzyme biocatalyst.
This research was aimed to extract and analyze protein from Nias Island Sea sponges and Binuangeun Sea sponges and to study their activity to polymerize tetraethoxyorthosilicate (TEOS). Protein in silica spicule of sponge was isolated by collecting silica spicule and soaked in HF/NH4F buffer (pH 5,0) for dissolving silica and releasing this protein. Then, protein was dialyzed and centrifuged. Activity of this protein to polymerize substrate tetraethoxyorthosilicate was measured by colorimetric molybdate assay.
Alhamdulillah, puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Penelitian yang dilaksanakan sejak bulan September 2004 ini berjudul Eksplorasi Protein dari Sponge Asal Perairan Pulau Nias dan Binuangeun yang Mengkatalisis Polimerisasi Silika.
Penulis mengucapkan terima kasih kepada Prof. Dr. Ir. Maggy T. Suhartono dan Dr. Ir. Ekowati Chasanah, M.Sc sebagai komisi pembimbing, serta Dr. Ir. Hj. Utut Widyastuti, MSc sebagai penguji. Penulis juga mengucapkan terima kasih kepada Ketua Program Studi Bioteknologi, Dr. Ir. M. Jusuf, Kepala Pusat Studi Ilmu Hayat dan Bioteknologi, Dr. Ir. Suharsono, Pimpinan Badan Riset Kelautan dan Perikanan atas sampel sponge beserta datanya, serta kepada Kepala Laboratorium Material Science, FMIPA, UI, atas peralatan SEM.
Ungkapan terima kasih juga disampaikan kepada bapak dan mimi atas segala bantuan, doa dan kasih sayangnya; serta teteh, asep dan ende atas dukungannya. Ucapan terima kasih kepada suami, Dr. Mujahidin yang penuh cinta dan kesabaran telah mendukung dan membantu penulis selama penelitian dan penulisan tesis, serta orang tua dan keluarga aa, juga anak-anakku tercinta Zahid dan Izzul atas keceriaannya. Terima kasih juga kepada Ibu Ika yang telah membantu penelitian, juga Ibu Eni, Mbak Pepi, Pak Mulya dan teman-teman seperjuangan Rudi, Bu Ema, Bu Yuyun, Bu Tati, Bu Rika dan semuanya yang tidak bisa disebutkan satu persatu.
Semoga karya ilmiah ini bermanfaat.
RIWAYAT HIDUP
Penulis dilahirkan di Sukabumi, 31 Januari 1976 dari ayah Udi Suardi dan ibu Uum Umamah. Penulis merupakan putri kedua dari empat bersaudara.
Halaman
Struktur Biosilika ……….. 6
Fabrikasi Silika ……….. 10
Protein Silicatein ……… 12
Isolasi Protein dan Analisis Berat Molekul ……….. 16
BAHAN DAN METODE Tempat dan Waktu Penelitian ………. 19
Alat dan Bahan ……… 19
Metode Penelitian ………... 19
Pengumpulan dan Pemilahan Sampel Sponge ……… 19
Isolasi Silika Spikula dari Sponge ……….. 20
Isolasi Protein dari Silika ……… 20
Penentuan Konsentrasi Protein ……… 20
Penghitungan Jumlah Protein 21 Penentuan Berat Molekul dengan Teknik SDS-PAGE ……… 22
Reaksi Protein dengan Substrat TEOS ……… 22
Analisis Hasil Reaksi dengan Colorimetric Molybdate Assay ……… 22
HASIL DAN PEMBAHASAN Identitas dan Pemilahan Sponge ……… 24
Sponge ST1 ……….. 24
Pelarutan Silika dalam Buffer HF ……… 35
Dialisis ………. 36
Sentrifugasi ……….. 38
Bentuk Protein ………. 39
Jumlah Protein dalam Larutan ………. 40
Berat Molekul Protein ……….. 40
Reaksi Protein Silicatein dengan Substrat ………. 41
SIMPULAN DAN SARAN………. 51
Simpulan ……… 51
Saran ………. 51
DAFTAR PUSTAKA ………. 52
ix
Halaman
1 Hubungan Presentase Poliakrilamida dengan Berat Molekul Protein ... 17
2 Lokasi dan Ciri Fisik Sponge ……… … 25
3 Perbandingan Berat Silika antar Sponge ……… 31
4 Bentuk dan Ukuran Silika ……….. 34
5 Hasil Pengukuran Silikat pada Beberapa Tahapan ……… 44
6 Perbandingan Jumlah TEOS Terpolimerisasi ……… 45
x
8 Proses Kondensasi Silika dengan Menggunakan Template ... 11
9 Pembuatan Silika dengan Menggunakan Radiasi Ultraviolet ... 12
10 SEM dari Proses Sekresi Silika Spikula dengan Protein ... …….. 13
11 Susunan Filamen Protein dalam Silika Spikula ………... 14
12 Model Tiga Dimensi Silicatein ……… 15
20 Grafik Perbandingan Berat Silika Beberapa Sampel ………... 32
21 Silika Spikula dari Sponge : a. ST1, b. ST2, c.ST3 dan d.ST4 …….…... 33
22 a. Silika Spikula Sponge ST5, b. Bentuk Unik Microscleres ………….. 34
23 Silika Spikula dari Sponge : a. ST6, b. ST7, c. Bentuk Microscleres Starburst ………... 34
24 Dialisis Larutan Protein dan Buffer HF ... 37
25 Difusi yang Terjadi saat Dialisis ... 37
26 Penurunan Jumlah Silikat yang Diukur pada Cairan di Luar Tabung Dialisis ... 38
27 a. Protein filamen Sponge ST3 dan b. Protein filamen Sponge ST1 ... 40
28 Hasil SDS-PAGE Protein Silicatein ... 41
xi
ST1 dan ST3 ... 46 32 Perbandingan Ukuran Protein dan Silika Spikula dari Sponge ST1 ... 47 33 Hasil Scanning Electron Microscopy Protein ST1 ... 48 34 Hasil Scanning Electron Microscopy Protein ST1 yang Telah
Direaksikan dengan TEOS 48 Jam ... 48 35 Hasil SEM dari Polimerisasi Silika oleh Silicatein T. Aurantia ... 49 37 Perband ingan Ukuran Protein Sponge ST1 dan Silika yang Terbentuk
xii
Halaman 1 Peta Lokasi Pengambilan Sampel Sponge ……….. 56 2 Pereaksi Bradford, Pereaksi untuk SDS PAGE dan Pereaksi untuk
Colorimetric Molybdate Assay ……… 3 Komposisi Gel Penahan dan Pemisah SDS PAGE ……….. 4 Prosedur Silver Staining ……….. 5 Data Penghitungan Jumlah Protein dengan Haemacytometer …………. 6 Perhitungan Berat Marker dan Sampel Protein ……… 7 Absorbansi Hasil Colorimetric Molibdate Assay Cairan Hasil Dialisis
Latar Belakang
Silika merupakan bahan dasar bagi industri- industri besar. Penggunaan bahan berbasis silika sangat luas untuk industri- industri yang memproduksi perlengkapan sehari- hari, seperti pasta gigi, pengemas makanan, keramik sampai ke peralatan semikonduktor, elektronik dan peralatan medis.
Beberapa organisme secara alamiah dapat membentuk struktur silika, diantaranya biota laut seperti sponge (Filum porifera) dan diatom (Bacillariophyta). Pada sponge, pembentukan struktur silika ini melibatkan suatu protein yang dikenal dengan protein silicatein (Cha et al. 1998), yang pertama kali diisolasi dari sponge Tethya aurantia. Pada diatom, protein tersebut telah mengalami penambahan gugus karbohidrat, dan dikenal dengan nama silaffins (Poulsen et al. 2003). Struktur silika juga ditemukan pada dinding sel beberapa bakteri seperti Bacillus subtilis (Coradin dan Lopez 2003). Struktur yang hampir sama juga ditemukan pada tanaman dalam bentuk silikon katekolat (Perry dan Lu 1992).
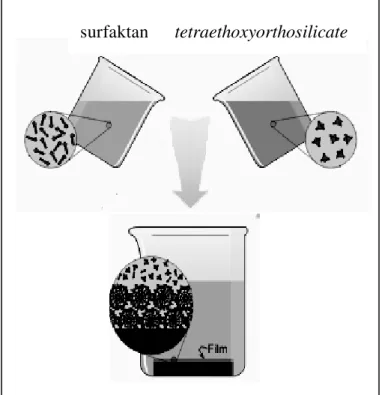
Kemampua n sponge dalam membentuk struktur padat silika mulai dari skala kecil (nano) dengan morfologi yang teratur dan spesifik merupakan hasil pengontrolan secara genetik. Mekanisme pengontrolan pembentukan biosilika ini sangat menarik para peneliti, tetapi masih belum banyak terungkap. Hal menarik lainnya adalah pada sistem biologis sponge, pembentukan biosilika berlangsung pada suhu ruang dan pH netral. Di industri, proses kondensasi prekursor silika menjadi struktur dengan pola dan morfologi yang spesifik memerlukan kondisi pH dan suhu ekstrim disertai penambahan surfaktan yang dapat mencemari lingkungan (Richardson 2001). Selain itu, pembuatan silika di industri memerlukan waktu preparasi dan reaksi yang lama, dan sulit untuk dilakukan dalam proses kontinu.
meminimumkan kondisi reaksi ekstrim, mempersingkat waktu reaksi dan aman untuk lingkungan. Hasil penelitian ini sangat diperlukan untuk industri- industri strategis yang memproduksi semikonduktor, biosensor, biochips, filter agent, pengemas makanan, kit analisis dan lain- lain.
Sebagai bagian dari wilayah Indopasifik, Indonesia merupakan salah satu negara dengan pusat keanekaragaman biota laut terbesar di dunia, termasuk mempunyai keragaman sponge. Sumber daya biota laut tersebut merupakan aset potensial yang dapat digunakan sebagai sumber genetik protein yang dapat mengkatalisis reaksi pembentukan struktur nanosilika. Isolasi protein yang terlibat dalam pembentukan biosilika saat ini belum pernah dilakukan di Indonesia. Isolasi berbagai protein yang terlibat dalam pembentukan biosilika pada berbagai sponge laut Indonesia beserta karakterisasinya sangat penting dilakukan untuk memanfaatkan sumberdaya genetik laut Indonesia.
Tujuan
TINJAUAN PUSTAKA
Sponge
Sponge merupakan organisme multiselluler yang dikelompokkan dalam Filum porifera (Kozloff 1990; Brusca dan Brusca 1990). Organisme ini tergolong hewan yang telah hidup jutaan tahun yang lalu, karena kemampuannya untuk bertahan dalam berbagai kondisi ekstrim. Beberapa spesies sponge telah hidup dari zaman Precambrian sekitar 600 juta tahun yang lalu (University of Stutgart Sponge Reef Project 2003). Hewan ini tidak bergerak, tetapi tinggal sepanjang hidupnya seperti tanaman, dan mampu menyaring air untuk memperoleh partikel makanan dari air dan substansi terlarut lainnya.
Struktur Sponge
Sponge tidak mempunyai struktur tubuh yang jelas, karena tidak mempunyai batas jaringan yang nyata (Brusca dan Brusca 1990; Hawking dan Smith 1997). Sponge ada yang berbentuk sederhana seperti tabung dengan dinding tipis seperti yang dijumpai pada marga Leucosolenia, segumpal jaringan yang tidak menentu bentuknya, membuat kerak pada batu, cangkang, tonggak atau tumbuh-tumbuhan. Kelompok sponge lain mempunyai bentuk yang lebih teratur dan melekat pada dasar perairan melalui sekumpulan spikula. Jenis-jenis tertentu nampak berbulu getar karena spikulanya menyembul keluar dari badan.
Selain bentuknya beragam, sponge juga mempunyai warna dan ukuran yang beragam. Warna sponge ada yang putih, abu-abu, kuning, orange, merah atau hijau. Sponge yang berwarna hijau umumnya disebabkan oleh adanya alga yang bersimbiotik (zoochlorellae) di dalam sponge. Sponge berukuran mulai dari sebesar kepala jarum pentul sampai berukuran diameter 0,9 m dan tebal 30,5 cm. Bagian tubuh sponge terdiri dari sistem saluran (canal), sistem kerangka dan sel somatik (Gambar 1). Sistem saluran ini bertindak seperti halnya sistem sirkulasi pada hewan tingkat tinggi. Sistem ini merupakan jalan untuk pemasukan makanan ke dalam tubuh dan untuk saluran pembuangan. Ada tiga macam sistem, yaitu askon, sikon dan ragon.
Spikula
Gambar 1 Struktur Tubuh Sponge.
Sel- sel sponge mempunyai fungsi-fungsi khusus dan pembagian kerja yang jelas (Brusca dan Brusca 1990; Hawking dan Smith 1997). Sel-sel ini dipisahkan menjadi tiga kelompok, yaitu 1). Sel yang menyusun lapisan kulit, 2). Sel yang membentuk organ skeleton, dan 3) sel yang terletak di dalam jaringan mesohyl (sel amoeboid), yang berdiferensiasi dan mempunyai fungsi tertentu.
Sel yang termasuk kelompok pertama terdiri dari sel pinacocyte, porocyte, dan choanocyte. Sel pinacocyte merupakan sel penyusun lapisan permukaan sponge (seperti sel epitel pada hewan) yang membentuk pinacoderm. Sel ini berbentuk datar dan saling overlap, yang diselingi juga sel pinacocyte berbentuk T. Porocytes merupakan sel yang berbentuk silinder seperti tabung, dapat membuka dan menutup porinya untuk mengatur diameter ostial. Choanocytes merupakan sel yang berflagel yang berbaris membentuk lapisan choanoderm. Sel ini mempunyai colar (tabung) yang menjadi tempat masuknya air yang membawa makanan. Makanan disimpan dalam vakuola makanan dan dikirim ke sel di sampingnya (sel ameboid) tempat mencerna makanan (Brusca dan Brusca 1990) .
memproduksi spikula silika atau spikula karbonat (Brusca dan Brusca 1990). Pada sel ini juga terbentuk protein aksial yang kemudian dikenal dengan silicatein (Shimizu et al. 1998). Sel tersebut, merupakan sel yang aktif, mempunyai sejumlah besar mitokondria, retikulum endoplasma kasar dan vakuola. Diketahui kemudian bahwa vakuola dalam sel ini merupakan tempat untuk mendepositkan asam silika yang diambil dari perairan. Sel collencytes dan lophocytes bentuknya hampir sama dengan pinacocytes, berfungsi untuk menghasilkan kolagen, sedangkan sel spongocytes memproduksi serat seperti kolagen yang disebut spongin.
Sel yang terletak di jaringan mesohyl adalah myocytes, archaeocytes dan rhabdiferous. Sel myocytes merupakan sel kontraktil. Sel archaeocytes berukuran besar, sangat motil dan mempunyai peranan penting dalam mencerna dan mentranspor makanan. Sel ini mempunyai sejumlah enzim pencernaan (seperti acid phospatase, amilase, protease, lipase) dan menerima bahan phagocyt dari choanocytes. Sel rhabdiferous merupakan sel dalam mesohyl yang berukuran paling besar mengandung mucopolisakarida (Brusca dan Brusca 1990).
Struktur Biosilika
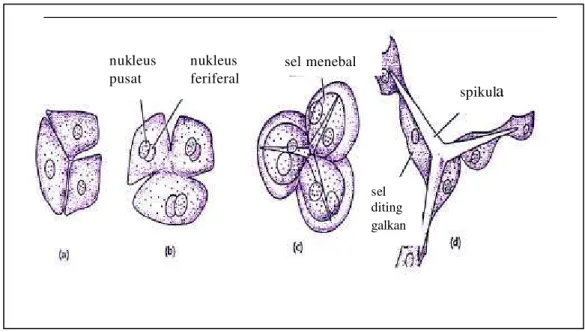
Sponge dan diatom serta beberapa organisme mensintesis giga ton silika pertahun dari asam silikat. Struktur biosilika yang dibuat mempunyai beragam struktur dengan ketepatan pengontrolan nanoarsitektur yang melebihi kemampuan manusia. Dalam sponge, biosilika ini terkumpul pada bagian yang bernama spikula.
menghasilkan 1 silika spikula atau beberapa sel bekerja sama untuk menghasilkan 1 silika spikula (Gambar 2).
Sumber : Kozloff (1990)
Gambar 2 Pembentukan Spikula oleh Sel Sclerocytes.
Berdasarkan ukurannya spikula dapat dibedakan menjadi dua jenis, yaitu microscleres dan megacleres (Gambar 3). Pada sponge kelas Hexactinellida umumnya kedua tipe ini ada, dengan bentuk hexactinal. Pada sponge kelas Demospongiae terdapat spikula tipe megacleres dan terkadang bersamaan dengan tipe microscleres (Brusca dan Brusca 1990).
Sumber : Kozloff (1990) Sumber: Black ( 2003)
Gambar 3 Tipe Spikula. a. Megascleres dan b. Microscleres c. Bentuk Microscleres, Starburst pada T.aurantia.
c
sel menebal
spikula
nukleus pusat
nukleus feriferal
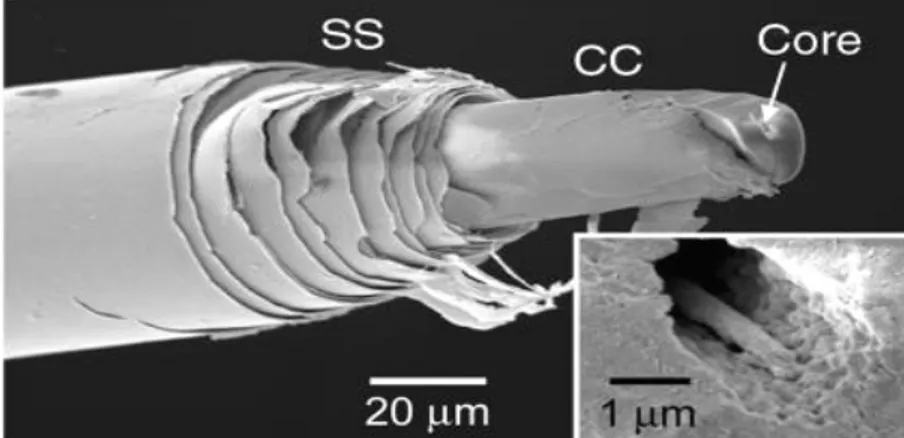
Spikula terdiri dari polimer silikon dioksida (SiO2) yang membentuk silika nanosphere (Gambar 4). Nanosphere ini tersusun secara berlapis (streated shell) dan di tengah terdapat pusat silinder (cylinder core). Pada pusat silinder inilah protein silicatein berada (Gambar 5) (Aizenberg 2004). Pada pusat silinder ini tersimpan kandungan silika yang paling tinggi dibandingkan dengan bagian di luarnya. Ukuran silika spikula yang dijumpai pada Tethya aurantia mempunyai diameter sekitar 30 µm (Shimizu et al. 1998).
Sumber : http://www.sciencedirect.com
Gambar 4 Bentuk Nanosphere dari Lapisan Silika Spikula (a,b dan c dari Beberapa Sudut Pandang).
Sumber : Aizenberg (2004)
Gambar 5. SEM dari Silika Spikula, SS= Streated Shell, CC=Cylinder Core
Si-Si). Struktur seperti ini dikenal dengan amorphous, dan struktur ini membuat beberapa ion anorganik penting, seperti Na+ dapat melewati lapisan silika.
.
Sumber: http://www.batnet.com/enigmatics/semiconductor_ processing/CVD_Fundamentals/films/SiO2_properties.html
Gambar 6 Jaringan Tiga Dimensi dari Silikon Dioksida.
Pembentukan biosilika dalam sponge dan diatom sangat dipengaruhi oleh keberadaan asam silikat, garam natrium dan adanya protein transporter. Krasko (2000) mempelajari ekspresi gen silicatein dengan meningkatkan konsentrasi asam silikat dari 1 µM menjadi sekitar 60 µM, dan ternyata menghasilkan ekspresi
gen yang sangat meningkat. Tidak adanya penambahan asam silikat dalam media, menyebabkan ekspresi gen yang sangat kecil. Begitupun halnya dengan ekspresi gen kolagen, gen yang sering dihubungkan dengan silicatein, meningkat dengan penambahan asam silikat tersebut.
Konsentrasi asam silikat di lautan berada pada level mikromolar per ml, sedangkan yang terdeposit dalam vakuola sponge terdapat 1000 kali lebih besar. Banyaknya asam silikat yang terdeposit ini diduga karena adanya protein transporter yang mengangkut asam silikat dari lingkungan ke dalam vakuola sel. Schroder et al. pada tahun 2004 mempelajari protein transporter yang mengangkut asam silikat ke dalam sponge Suberites domuncula; protein ini mirip dengan Na+ /HCO3– cotransporters. Coradin dan Lopez (2003) juga menemukan hal yang sama bahwa silika transporter mirip dengan Na+ /HCO3– cotransporters, karena sangat tergantung pada keberadaan natrium, dengan perbandingan antara silikat yang diangkut dengan natrium yang diperlukan (Si(OH)4 : Na+) sebesar 1:1.
Fabrikasi Silika
Silika merupakan bahan dasar untuk industri- industri besar. Produk intermediet silika yang umum digunakan adalah silica chips, fiber glass dan bahan keramik. Silica chips diaplikasikan untuk sparepart komputer, assay kit, dan lain-lain. Silica chips (Gambar 7) dibuat melalui beberapa langkah dan diawali dengan pembuatan lapisan- lapisan polisilikon (disebut wafer). Pembentukan wafer ini terdiri dari pembuatan polisilikon dari reaksi triklorosilane dengan hidrogen pada suhu 1000oC dan dikristalkan pada suhu 1200oC. Polikristalsilikon merupakan template untuk pembentukan lapisan-lapisan tipis silikon dioksida yang mampunyai ketebalan beberapa mikron. Melalui proses pemberian muatan dan pengemasan, wafer ini menjadi chips (Richardson 2001).
Sumber: Richardson (2001)
Gambar 7 Silica Chips.
Fiber glass merupakan bahan utama pembuatan peralatan medis, seperti statesteskop, alat pendeteksi, mikroskop serta peralatan elektronik (sebagai pelapis penghantar). Fiber glass dibuat dengan cara oksidasi termal dari silicon tetrachloride (SiCl4), pada suhu yang sangat tinggi (sekitar 2100°C), dengan formula: SiCl4 + O2 SiO2 + 2Cl2 (Fiber Tech 2004) .
memerlukan adanya template. Adamson (2004) menggambarkan proses kondensasi silika menjadi lapisan film pada industri keramik memerlukan adanya template (Gambar 8).
Sumber : Adamson (2004)
Gambar 8 Proses Kondensasi Slika dengan Menggunakan Template.
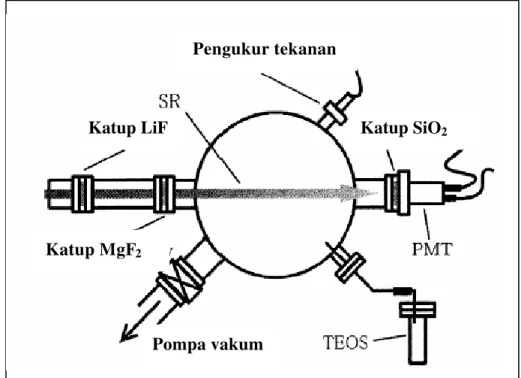
Dari uraian di atas, terdapat dua hal penting yang diperlukan dalam pembuatan polimer silika yaitu suhu yang sangat tinggi dan template. Para ilmuwan mulai memikirkan untuk mengganti cara pembuatan silika dengan cara yang lebih aman yaitu pada suhu rendah. Takezoe et al. (1999) mencoba melakukan pembuatan silika pada suhu kamar dengan menggunakan radiasi ultraviolet di bawah kondisi vakum dalam chamber yang terkontrol (Gambar 9). Proses ini menggunakan substrat murni tetraethoxyorthosilicate (TEOS) dengan katalis gas LiF dan MgF2.
Sumber: Takezoe et al (1999)
Gambar 9 Pembuatan Silika dengan Menggunakan Radiasi Ultraviolet.
Penggunaan katalis protein yang dapat melakukan kondensasi dan polimerisasi silika pada suhu rendah merupakan alternatif yang lebih aman. Shimizu et al. (1999) telah menunjukkan bahwa silicatein secara invitro dapat mengkatalisis hidrolisis tetraethoxyorthosilicate (TEOS) membentuk polimer silika pada pH netral, tekanan normal dan suhu kamar. Keistimewaan protein silicatein ini, selain berfungsi sebagai katalis juga dapat berfungsi sebagai template untuk penempelan silika.
Protein Silicatein
Tahun 1998, ditemukan protein yang menjadi katalis reaksi pembentukan biosilika dari sponge Tethya aurantia yang kemudian dikenal dengan silicatein oleh Shimizu et al. Protein silicatein diproduksi di dalam sel sclerocytes kemudian disekresikan ke membran vakuola tempat terdepositnya asam silikat. Di dalam vakuola protein terus memanjang dan dilapisi dengan silika yang terkondensasi dan terpolimerisasi olehnya, kemudian setelah membentuk spikula
Pompa vakum Katup MgF2
Katup LiF Katup SiO2
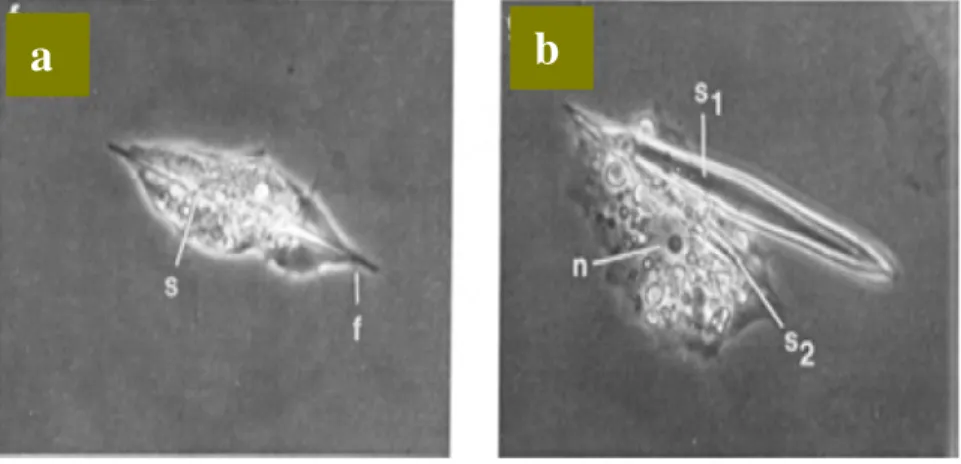
dengan panjang yang cukup protein dan spikula ini disekresikan ke luar sel. Sekresi protein ini dibuktikan dari foto mikroskop electron pada Gambar 10 (Aizenberg 2004). Pada Gambar 10a terlihat proses pemanjangan sel seiring dengan tumbuhnya protein dan silika spikula. Pada Gambar 10b, spikula pertama (s1) telah dikeluarkan dan sel siap membuat protein dan spikula berikutnya (s2). Dalam sel ini banyak ditemukan mitokondria yang mengindikasikan bahwa pembentukan protein ini memerlukan banyak energi.
Sumber : Aizenberg (2004)
Gambar 10 SEM dari Proses Sekresi Silika Spikula dengan Protein a. Protein dan Spikula Memanjang
b. Protein dan Spikula Keluar dari Sel.
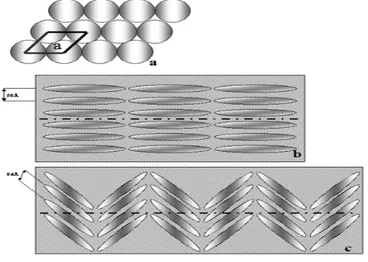
Susunan filamen protein di dalam silika spikula menjadi pertanyaan para peneliti. Croce (2004) meneliti hal ini dari spikula dua kelas sponge berbeda, yaitu sponge G. cydonium dan spikula dari Suberitus joubini dengan menggunakan X-ray fiber diffraction dengan SAXS beamline dari radiasi ELETTRA synchrotron. Digambarkan dalam dua dimensi, filamen protein ini menyusun hexagonal yang sangat teratur (Gambar 11a). Susunan filamen dari spikula G . cydonium, kelas Demospongiae (Gambar 11b) berbeda dengan model susunan filamen dari spikula S. joubini (Gambar 11c) dari kelas Hexactinellida.
Shimizu et al. (1998) yang mengisolasi protein ini, menemukan tiga pita protein dengan berat molekul 29, 28 dan 27 kDa yang kemudian menyebutnya
sebagai 3 subunit α,β dan γ. Peneliti lain menyebutnya sebagai 3 protein isomer, karena satu subunit saja mampu melakukan reaksi katalisis sendiri terlepas dari sub unit lainnya. Ketiga protein ini mempunyai susunan asam amino yang hampir
sama. Ketiganya tersusun secara berulang membentuk protein filamen, yang diduga melalui ikatan nonionik dan nonkovalen, karena ikatan antar subunit mudah putus oleh penambahan SDS atau urea. Hasil analisis densitomer memperlihatkan bahwa silicatein α merupakan bagian terbesar yaitu sekitar 70% dengan perbandingan silicateinα,β dan γ =12:6:1 (Shimizu et al. 1998).
Sumber : Croce (2004)
Gambar 11 Susunan Filamen Protein dalam Silika Spikula a. Susunan Protein Secara Hexagonal
b. Susunan Protein pada Spikula G. cydonium c. Susunan Protein padaSpikula S. joubini.
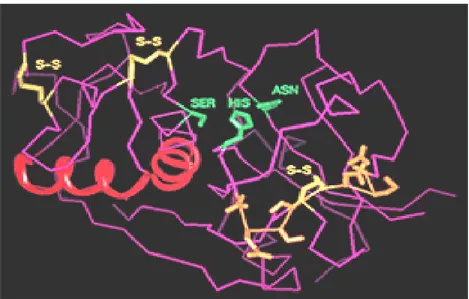
Shimizu et al. (1998) lebih lanjut mengemukakan bahwa sekuens dari silicatein α ini mempunyai similaritas yang tinggi dengan famili cathepsin-L dari grup cystein protease. Persamaan ini pertama terletak pada residu asam amino pada sisi aktif yaitu His dan Asn. Persamaan kedua, kedua protein ini mengandung 6 sistein yang membentuk jembatan disulfida; dan persamaan ketiga, pada kedua protein terdapat mekanisme pemotongan proprotein menjadi protein matang,. Berdasarkan kesamaan struktur ini diduga model tiga dimensi dari protein ini seperti pada Gambar 12.
matang. Kecepatan sponge dalam membentuk spikula dari silika sangat tinggi, sekitar 5 µm per jam.
Sumber: Shimizu et al. (1998)
Gambar 12 Model Tiga Dimensi Silicatein.
Mekanisme pembentukan biosilika oleh protein ini belum banyak dimengerti. Diduga banyaknya asam amino hidroksil (serin, tirosin, dan treonin) pada silicatein berpengaruh besar pada proses biosilification. Hal ini didasarkan pada penelitian Perry dan Lu (1992) yang meneliti pembentukan silikon catekolat pada tanaman, yang melibatkan protein yang banyak mengandung gugus hidroksil. Begitu pula protein yang diduga pembentuk silika pada diatom mengandung sejumlah besar asam amino hidroksil (Kroger 1997).
Penelitian selanjutnya, pada tahun 1999 oleh Cha et al., menunjukkan bahwa protein ini secara invitro mampu mengkatalisis reaksi kondensasi dan polimerisasi silika dari substrat tetraethoxyorthosilicate dan siloxane walaupun belum diketahui mekanisme reaksinya secara pasti. Mekanisme reaksi katalisis dari protein ini diduga berdasarkan mekanisme reaksi pada serine protease atau cysteine protease.
lingkungan yang berbeda diduga berpengaruh terhadap karakteristik proses katalisis dari protein tersebut.
Isolasi Protein dan Analisis Berat Molekul
Metode yang digunakan untuk isolasi protein tergantung dari sumber protein dan lokasi protein dalam sumber tersebut. Sumber protein dapat berasal dari hewan, tanaman atau bakteri. Sel hewan umumnya lebih mudah dipecah dibandingkan dengan sel tanaman, karena sel hewan tidak berdinding sel, sedangkan sel tanaman berdinding sel selulosa (Brummer dan Gunzer 1987). Lokasi protein mempengaruhi teknik pemisahan protein dari komponen lainnya. Ekstraksi dan isolasi protein ekstraseluler lebih mudah dibandingkan dengan protein intraseluler. Untuk isolasi protein ekstraseluler umumnya hanya dilakukan pemisahan berdasarkan sifat fisik (Thenawijaya 1989).
Masalah utama dalam isolasi protein adalah terjadinya denaturasi, kontaminasi protein oleh pirogen dan asam nukleat serta adanya proteolisis (Errson et al. 1998). Hal tersebut dapat diatasi dengan pemilihan larutan ekstraksi dan larutan penyangga yang tepat, waktu preparasi yang singkat dan suhu rendah. Faktor-faktor yang diperlukan dalam pemilihan larutan ekstraksi adalah pH, jenis larutan penyangga (anionik atau kationik), variasi pH dengan kekuatan ion atau suhu, reaktivitas, pengaruhnya terhadap aktivitas biologis protein yang diinginkan, kelarutan, pengaruh deterjen atau senyawa khaotropik, logam pengikat dan penghambatan proteolitik (Errson et al. 1998).
serta memisahkan spesies-spesies molekular yang berbeda secara kuantitatif dan kualitatif (Boyer 1986).
Pada elektroforesis harus digunakan media yang dapat mengurangi atau mencegah terjadinya konveksi dan tidak bereaksi dengan sampel atau menghambat pergerakan partikel sebagai akibat terjadinya ikatan antara sampel dengan matriks. Menurut Dunn (1989) elektroforesis dengan media gel poliakrilamida yang dikenal dengan PolyAcrilamide Gel Electrophoresis (PAGE) merupakan teknik yang paling banyak digunakan untuk memisahkan protein karena mempunyai kapasitas pemisahan yang tinggi. Gel poliakrilamida terbentuk melalui polimerisasi monomer akrilamida dan pembentukan ikatan silang kovalen antar rantai panjang akrilamida baik melalui reaksi kimia maupun fotokimia. Pembentukan gel melalui reaksi kimia dengan ammonium persulfat sebagai inisiator dan N,N,N’,N’-tetrametilendiamin (TEMED) sebagai katalis. Cross-linking agent yang digunakan adalah N,N’-metilen-bis- akrilamida (bis) (Perbal 1988)
Pembentukan ikatan silang antar rantai panjang akrilamida membuat struktur seperti pori-pori pada gel. Besar kecilnya pori-pori ini menentukan kecepatan pemisahan protein dalam gel. Ukuran pori-pori dapat diatur dengan mengubah persentase akrilamida. Persentasi akrilamida yang dibutuhkan untuk dapat memisahkan protein dengan berat molekul tertentu dapat dilihat pada Tabel 1.
Tabel 1 Hubungan Persentase Poliakrilamida dengan Berat Molekul Protein
% poliakrilamida Kisaran berat molekul
3-5 >100.000
5-12 20.000-150.000
15 10.000-80.000
>15 <150.000
Sumber :Dunn (1989)
jumlah yang setara dengan berat molekul protein tersebut (Dunn 1989). Denaturasi protein dilakukan dengan merebus sampel dalam buffer yang
BAHAN DAN METODA
Tempat dan Waktu Penelitian
Penelitian dilakukan di Laboratorium Mikrobiologi dan Biokimia, Pusat Penelitian Bioteknologi dan Ilmu Hayat, IPB, dari bulan September 2004 sampai September 2005.
Alat dan Bahan
Bahan yang digunakan dalam penelitian ini adalah 9 jenis sponge (Sponge ST1, ST2, ST3, ST4, ST5, ST6, ST7, ST8 dan ST9) yang diambil dari koleksi Balai Besar Riset Pengolahan Produk dan Bioteknologi Kelautan dan Perikanan, Badan Riset Kelautan dan Perikanan, Departemen Kelautan dan Perikanan. Sponge tersebut berasal dari perairan Pulau Nias dan Binuangeun (peta lokasi pada Lampiran 1). Bahan lainnya adalah tabung dialisis cut-off 10 kDa, substrat tetraethoxyorthosilicate (TEOS), buffer HF/ NH4F, buffer Tris-Cl, larutan natrium hipoklorit, larutan HNO3, H2SO4, etanol, standar protein BSA, pereaksi Bradford, bahan-bahan kimia untuk analisis, bahan-bahan kimia untuk SDS/PAGE dan pereaksi untuk colorimetric molybdate assay (konsentrasi bahan-bahan pada Lapmpiran 2).
Alat utama yang digunakan adalah oven, spektrofotometer, haemacytometer, mikroskop polarisasi, refrigerator, freezer, alat elektroforesis, sentrifugasi, alat dialisis, stirrer, shaker, pipet mikro, alat-alat gelas dan plastik .
Metode Penelitian
Pengumpulan dan Pemilahan Sampel Sponge
pengumpulan sampel dilakukan oleh Departemen Kelautan dan Perikanan. Pemilahan sampel sponge dilakukan berdasarkan struktur visual sponge.
Isolasi Silika Spikula dari Sponge
Isolasi silika spikula dari 7 sampel sponge yang berasal dari perairan Pulau Nias dan 2 sampel sponge dari perairan Binuangeun, dilakukan dengan menggunakan metoda Shimizu et al. (1998). Metode ini berdasarkan pada pemisahan silika spikula yang tidak larut asam dari komponen lainnya. Pertama kali, sponge dibersihkan dengan air laut, dipotong dengan ukuran 1 cm3, dibleaching dengan perendaman dalam larutan hipoklorit jenuh (7%) selama 1 jam. Potongan tersebut dicuci dengan air bebas ion, dibersihkan dengan air ± 10 kali dan direndam dalam HNO3:H2SO4 3 N (1:4) semalam.
Bagian yang tidak larut asam (yang mengendap) dibilas dengan air bebas ion beberapa kali sampai pH diatas 6, dihilangkan airnya dan dicuci dengan aseton. Setelah itu dikeringudarakan dalam refrigerator. Ini adalah silika spikula. Bentuk silika spikula diamati secara mikroskopis.
Isolasi Protein dari Silika (Shimizu et al. 1998)
Isolasi protein dilakukan dengan melarutkan silika dalam buffer, sehingga proteinnya terlarut dalam buffer tersebut. Silika spikula yang telah diisolasi di atas direndam dalam buffer HF 2 M /NH4F 8 M (pH 5,0) sambil diaduk untuk melarutkan silika, sampai tidak terlihat adanya endapan. Untuk menghilangkan buffer HF, larutan ini didialisis dalam air bebas ion bersuhu 4oC selama 36 jam (selama waktu tersebut, air bebas ion diganti 9 kali). Dialisat disentrifugasi pada 6.000 xg selama 40 menit pada 4oC. Protein yang mengendap disuspensikan dalam air bebas ion atau buffer Tris-Cl pH 6,8 dan disimpan pada 10oC. Protein filamen diamati secara mikroskopis.
Penentuan Konsentrasi Protein
direaksikan dengan 2 ml Bradford (Bradford stok : air =1:19) akan menghasilkan warna biru yang ditangkap oleh spektrofotometer pada panjang gelombang 595 nm. Selanjutnya konsentrasi protein ditentukan dengan menggunakan persamaan linier dari kurva standar protein BSA (Bovine Serum Albumin). Kurva standar protein BSA dibuat dengan mereaksikan 100 µl larutan BSA berbagai konsentrasi BSA (20, 40, 60, 80,100.120, 140, 160,180 dan 200 µg/ml) dengan pereaksi Bradford, kemudian diukur absorbansinya dengan spektrofotometer pada panjang gelombang 595 nm. Sebagai blanko digunakan 100 µl aquades yang direaksikan dengan 2 ml Bradford (1:19).
Penghitungan Jumlah Protein per ml dengan Haemacytometer
Metode penghitungan haemacytometer umumnya digunakan untuk menghitung jumlah sel bakteri atau spora kapang dengan pengamatan di bawah mikroskop (Fardiaz 1989). Metode penghitungan ini menggunakan gelas objek haemacytometer yang mempunyai garis- garis seperti terlihat pada Gambar 3.1. Kotak terbesar berukuran 1 mm2. Kotak 1 mm2 yang terdapat pada bagian tengah dibagi menjadi 25 kotak (0,2 mm x 0,2 mm) yang masing- masing berisi 16 kotak kecil (0,05 mm x 0,05 mm). Jika gelas objek ini ditutup dengan gelas penutup, kedalaman di bawah gelas penutup adalah 0,1 mm (tinggi sampel 0,1 mm).
Sampel larutan protein diteteskan dalam gelas objek tersebut, kemudian ditutup dengan gelas penutup. Jumlah filamen protein dihitung pada kotak yang berukuran 0,2 mm x 0,2 mm (0,04 mm2) dengan tinggi sampel 0,1 mm. Dilakukan 5 kali penghitungan pada tempat yang berbeda, kemudian dibuat rata-rata. Jumlah filamen protein dalam 1 ml (1 cm3) dihitung sebagai berikut :
Jumlah filamen protein/mm2 = Rata-rata jumlah protein/0,04 mm2 x 25 Jumlah filamen protein/mm3= Rata-rata jumlah protein/mm2 x 1
0,1 mm
Jumlah filamen protein/ml = Rata-rata jumlah protein/mm3x 1000
Penentuan Berat Molekul dengan Teknik SDS-PAGE
Berat molekul protein ditentukan dengan menggunakan SDS/PAGE
(Metode Laemmli 1970). Protein (10 – 15 µl) disuspens ikan dalam buffer sampel, diinkubasi pada 95oC selama 1 menit, dan dilarikan dalam gel poliakrilamid 10% (komposisi gel pada Lampiran 3), pada tegangan 100 V selama ±1 jam. Marker berat molekul LMW (Low molecular Weight) dari Amersham Bioscience yang tediri dari protein Phosphorylase b, albumin, ovalbumin, carbonic anhidrase, trypsin inhibitor, a-lactalbumin digunakan sebagai standar berat molekul yang juga dilarikan dalam gel. Gel diwarnani dengan silver staining untuk melihat protein yang terpisah dan kemudian ditentukan berat molekul berdasarkan standar protein. Prosedur silver staining secara lengkap pada Lampiran 4).
Reaksi Protein dengan Substrat TEOS (Cha et al. 1999)
Sebanyak 0,25 ml suspensi protein dalam buffer Tris-HCl pH 6,8 (dengan konsentrasi tris sebesar 25 mM) direaksikan dengan tetraethox yorthosilicate (TEOS, sebanyak 1ml; dengan konsentrasi 4,5 mmol/ml) sambil dishaker pada suhu kamar selama 12 jam, selanjutnya disentrifugasi untuk memisahkan produk silika (sebagai endapan).
Analisis Hasil Reaksi dengan Colorimetric Molybdate Assay (Strickland and Parsons 1972)
Pelet yang dihasilkan dari hasil reaksi dicuci minimal 3 kali dengan etanol untuk menghilangkan TEOS yang tidak bereaksi, kemudian disentrifugasi kembali. Pelet dilarutkan dalam 1 ml 1 M NaOH pada 85-95oC selama 30 menit untuk menghitung jumlah residu TEOS yang terpolimerisasi. Larutan dibiarkan selama 24 jam untuk membiarkan terjadinya pelarutan silika. Penghitungan asam silikat yang dilepaskan dilakukan dengan colorimetric molybdate assay yang dimodifikasi dengan pelarut Brzezinski dan Nelson (1986) yang dapat mendeteksi Si(OH)4 sampai dengan 50 mM.
menit. Setelah 10 menit, ditambahkan 0,6 ml reduction reagent (campuran metol sulfit, H2SO4 50%, asam oksalat jenuh dan air bebas ion), lalu divorteks. Setelah 3 jam, dilakukan pengukuran dengan spektrofotometer pada panjang gelombang 810 nm. Sebagai kurva standar digunakan berbagai konsentrasi Si (larutan TEOS dalam DMSO dengan konsentrasi TEOS 20, 40, 60, 80, 100, 120, 140, 160, 180, 200, 220 dan 225 µmol/ml DMSO) dan sebagai blanko digunakan 0,2 ml air bebas ion yang diberi perlakuan yang sama.
Hasil reaksi diamati dalam mikroskop, dan dilakukan foto dengan JEOL JSM-5310LV Scanning Electron Microscopy yang sebelumnya dicoating dengan JEOL JFC-1200 Fine Coater. Proses ini dilakukan di Laboratorium Material Science, Fakultas Matematika dan Ilmu Pengetahuan, Universitas Indonesia.
HASIL DAN PEMBAHASAN
Identitas dan Pemilahan Sponge
Sponge dalam penelitian ini diambil dari koleksi Departemen Kelautan dan Perikanan yang berasal dari dua lokasi yaitu perairan Pulau Nias (Sumatera Utara) dan perairan Binuangeun (Ujung Kulon, Banten) (Peta Lokasi di Lampiran 1). Kedua perairan ini termasuk dalam Samudera Hindia. Pada satu lokasi perairan dapat ditumbuhi beragam sponge, karena larva dan sponge muda kecil dapat bergerak bebas sepanjang lautan dan tumbuh di tempat dia menempel untuk menjadi sponge dewasa. Larva ini dapat berenang beberapa jam sampai beberapa hari di lautan bebas atau di dasar laut (Brusca dan Brusca 1990).
Dari perairan Binuangeun diambil dua sampel, yaitu Sponge ST1 dan ST2. Dari perairan Pulau Nias diambil 7 sampel sponge (Sponge ST3, ST4, ST5, ST6, ST7, ST8 dan ST9) (Tabel 2) yang diambil dari tiga lokasi yang berbeda. Sponge mempunyai spikula yang terdiri dari silika atau kalsium karbonat. Sponge ST1, ST2, ST3, ST4, ST5, ST6, ST7 mempunyai spikula dari silika, sedangkan Sponge ST8 dan ST9 mempunyai spikula dari kalsium karbonat. Pembahasan mengenai spikula ini akan ditemukan pada uraian selanjutnya.
Sponge ST1
Sponge ini berbentuk seperti bongkahan padat, berukuran relatif besar, berwarna abu-abu, berongga dan mempunyai struktur yang sangat keras sulit untuk dipotong. Dilihat dari strukturnya, sponge ini mirip dengan Sponge Tethya aurantia, sponge yang pertama kali dipelajari dan diisolasi protein yang terlibat dalam pembentukan silika spikula (Shimizu et al. 1998). Gambar 14 merupakan potongan sebagian dari badan sponge ST1.
Tabel 2 Lokasi dan Ciri Fisik Sponge
Sampel
Sponge Lokasi Ciri-ciri
Kondisi Perairan Tempat Tumbuh
ST1 Binuangeun Berbentuk seperti roti/ bongkahan, kaku/keras, berwarna abu-abu, berongga
pH :8,33 Suhu : 27,3oC Salinitas :33 ppm ST2 Binuangeun Berwarna orange, berserabut
halus, struktur lunak ST4 Pulau Lafau Berwarna warna hitam
kemerahan, bertekstur keras
Berwarna hijau dan bergerigi pH : 8,26 Suhu : 29,1oC
Gambar 14 Sebagian dari Sponge ST1; di Atas Permukaan Air.
Sponge ST2
Sponge ini diambil dari perairan Binuangeun; merupakan sponge yang terakhir kali terakhir diisolasi silikanya. Sponge ini berwarna merah oranye, berserabut halus dan strukturnya lunak (Gambar 15). Jumlah silika pada sponge ini relatif kecil, sehingga diduga sulit untuk melakukan isolasi dan pengendapan protein dari sponge ini. Sponge ini kurang potensial untuk menjadi sumber protein untuk pengembangan biosilika.
Sponge ST 3
Sponge ST3 (Gambar 16) diambil dari Perairan Pulau Nias, tepatnya di Lokasi Bagian Utara Gosong Lahewa pada kedalaman 13-15 m. Sponge ini berwarna merah orange, berbentuk memanjang dengan diameter yang relatif besar, berpori dan bercabang.
a b Gambar 16 Sponge ST3.a. di Bawah Permukaan Air
b. di Atas Permukaan Air.
Sponge ST3 mempunyai berat silika spikula yang relatif besar. Sama seperti Sponge ST1, sponge ini mempunyai potensi untuk menjadi sumber protein untuk pengembangan biosilika.
Sponge ST 4
Sponge ST4 berasal dari lokasi Pulau Lafau, perairan Pulau Nias, diambil pada kedalaman 3,1 m. Sponge ini tumbuh di karang vertikal dan mempunyai warna merah dan berongga (Gambar 17).
Gambar 17 Sponge ST4; di Bawah Permukaan Air.
Sponge ST5, ST6 dan ST7
Sponge ST5 dan ST7 (Gambar 18) diambil dari Perairan Pulau Nias, tepatnya di Lokasi Bagian Utara Gosong Lahewa pada kedalaman 13-15 m. Sponge ST5 berwarna kecoklatan, berduri dan bercabang. Sponge ST7 berwarna hijau, bentuk permukaan bergerigi dan bercabang dengan struktur yang sangat lunak. Sponge ST6 berasal dari lokasi Gosong Lahewa pada kedalaman 4 m,
a
b c
sponge ini tumbuh di karang vertikal, berbentuk bulat dengan permukaan seperti durian, berwarna kemerahan dan bagian dalamnya berwarna kuning. Ketiga sponge ini mempunyai berat silika yang relatif kecil, karena sebagian silikanya berbentuk microcleres (berukuran kecil) sehingga berat totalnya rendah. Isolasi protein silicatein pada Sponge ST5 dan ST6 tidak mendapatkan protein yang diharapkan.
Bentuk unik dari silikanya memungkinkan sponge ini mempunyai protein silicatein yang dapat mangkatalisis pembentukan biosilika dengan mempunyai morfologi tertentu. Walaupun sulit untuk memperoleh proteinnya, tetapi ketiga sponge ini potensial untuk dijadikan sumber protein untuk pengembangan biosilika dengan struktur yang unik.
Sponge ST 8 dan ST 9
Sponge ST8 dan ST9 (Gambar 19) diambil dari Perairan Pulau Nias, tepatnya di Lokasi Bagian Utara Gosong Lahewa pada kedalaman 13-15 m. Sponge ST8 berwarna kemerahan, panjang, dengan diamater yang relatif kecil dan bercabang dengan tekstur yang lunak. Sponge ST9 berwarna coklat kemerahan, berbentuk pipih dan berduri.
a b
silika spikula. Spikula yang membentuk tubuhnya kemungkinan tersusun dari kalsium karbonat atau kolagen saja. Sponge seperti ini tidak potensial untuk dijadikan sumber protein silicatein, walaupun berlaku sebaliknya protein silicatein diduga dapat melakukan polimerisasi ion kalsium.
Dari hasil penelitian awal ini diketahui bahwa struktur sponge dapat menjadi ciri adanya kandungan silika dan protein silicatein. Struktur sponge yang kaku dan keras seperti Sponge ST1 mempunyai potensi yang tinggi untuk menghasilkan jumlah silika dan protein silicatein yang tinggi. Sebaliknya struktur yang lunak seperti Sponge ST2 dan ST7 kurang berpotensi untuk menghasilkan protein silicatein dengan jumlah yang tinggi. Ciri fisik tersebut menjadi faktor pertimbangan dalam pemilahan sampel sponge yang telah dikoleksi oleh Departemen Kelautan dan Perikanan. Sehingga beberapa sponge yang bertekstur sangat lunak dan berbentuk seperti daun tidak digunakan untuk penelitian ini.
Seperti umumnya produk laut, sponge berbau amis dan cepat rusak, sehingga setelah diambil, sponge segera disimpan beku sampai dibawa ke laboratorium. Sebelum diisolasi proteinnya, sponge ini tetap dipertahankan dalam keadaan beku untuk menghindari adanya kerusakan protein yang menyebabkan hilangnya aktivitas.
Silika Spikula
Spikula merupakan organ skeleton dari sel sponge yang menopang struktur jaringan dan tubuh sponge. Pada sponge, spikula ini tersusun atas kalsium karbonat (calcareous spicule) atau silika (silica spicule) dan sebagian kecil kolagen. Walaupun pada beberapa sponge, skeleton hanya terdiri dari kolagen saja. Spikula ini dibentuk oleh sel yang terletak di bagian mesohyl yang disebut sclerocytes (Gambar 1). Sel yang terdiri dari mitokondria, mikrofilamen sitoplasma dan vakuola kecil ini dapat menyimpan kalsium karbonat atau silika dan menyusunnya menjadi spikula.
terpolimerisasi olehnya, kemudian setelah membentuk spikula dengan panjang yang cukup protein dan spikula ini disekresikan ke luar sel.
Untuk mengisolasi protein silicatein, perlu dilakukan pemisahan silika spikula dari sponge terlebih dahulu. Pemisahan silika spikula ini dilakukan berdasarkan ketahanan silika terhadap beberapa pelarut seperti larutan natrium hipoklorit jenuh dan larutan asam kuat. Larutan natrium hipoklorit dapat merusak jaringan sponge sehingga silika spikula terlepas dan mengendap pada dasar wadah. Pemisahan silika spikula dari debris sel, lemak dan protein lain dilakukan dengan perendaman oleh asam pekat, di mana bagian lainnya larut asam dan meninggalkan silika spikula sebagai endapan. Komposisi silika spikula yang merupakan lapisan dari polimer dioksida ini membuat beberapa senyawa berukuran besar tidak dapat menembus ke dalam lapisan silika. Komposisi dan struktur seperti inilah yang diinginkan untuk apilikasi polimer silika pada beberapa peralatan.
Sponge yang diamati mempunyai berat silika yang berbeda-beda (Tabel 3). Perbedaan berat relatif silika spikula pada beberapa sponge ini diduga tergantung pada faktor (terutama) jenis sponge dan umur. Habitat sponge dan kedalaman sponge mungkin tidak menjadi faktor dominan penyebab perbedaan jumlah silika spikula.
Tabel 3 Perbandingan Berat Silika antar Sponge
Sampel Asal
silika spikula ini berhubungan erat dengan berat protein yang dapat kita isolasi. Sponge Tethya aurantia mempunyai yield silika spikula yang besar, yaitu 75,3% dari berat kering sponge, dengan berat protein sekitar 0,1% dari berat silika spikula (Shimizu et al. 1998).
Sponge ST3 dan ST4 yang diambil dari perairan Pulau Nias mempunyai yield silika spikula di atas 1%, yaitu 1,8% dan 1,43%. Sponge dari perairan Kepulauan Nias lainnya mempunyai yield kurang dari 1%, sehingga sangat sulit untuk mengisolasi protein silicatein. Grafik perbandingan berat silika per berat kering sponge dapat dilihat pada Gambar 20. Pada dua sampel (ST8 dan ST9) tidak terdapat endapan silika spikula, sponge ini kemungkinan mempunyai spikula dari karbonat dan termasuk dalam kelas Calcareous atau hanya terdiri dari spongin seperti sebagian kecil kelas Demospongiae.
0
ST1 ST2 ST3 ST4 ST5 ST6 ST7
Gambar 20 Grafik Perbandingan Berat Silika Beberapa Sampel. Berdasarkan bentuknya, spikula dapat dibedakan menjadi dua jenis, yaitu microscleres dan megacleres (Gambar 3). Demospongiae dan hexactinellids mempunyai kedua tipe sel tersebut, sedangkan calcareous hanya mempunyai megascleres. Tipe spikula pada kelas hexactinellids, mempunyai ciri khas yaitu mempunyai 6 sudut, inilah yang menyebabkan struktur sponge ini seperti silinder gelas.
dimungkinkan semua sponge ini termasuk kelas Demospongiae. Ukuran spikula monakson yang ditemukan pada semua sampel bervariasi antara 1-2 mm (Tabel 4), variasi ukuran ini hampir sama dengan ukuran silika spikula dari Tethya aurantia yang mempunyai panjang sekitar 1-2 mm (Shimizu et al. 1998).
Sponge ST4 mempunyai silika spikula microscleres dengan struktur yang unik (Gambar 22). Sponge ST5 dan ST6 mempunyai bentuk silika spikula microscleres yang unik yaitu starburst, silika spikula berbentuk bintang yang sangat unik (Gambar 23) seperti yang juga ditemukan pada Sponge T. aurantia (Black 2003). Bentuk silika spikula ini mempunyai ukuran yang lebih kecil dari pada silika monakson.
1 mm 1 mm
a b
1 mm
1 mm 1 mm
c d
Tabel 4 Bentuk dan Ukuran Silika Spikula
Sampel Asal Bentuk silika
Panjang silika spikula monakson (mm)
ST1 Binuangeun Monakson 1,9-2,3
ST2 Binuangeun Monakson 2,1-2,4
ST3 Pulau Nias Monakson 1,4-1,5
ST4 Pulau Nias Monakson 1,1-1,3
ST5 Pulau Nias Monakson,
microscleres
1,1-1,2
ST6 Pulau Nias Monakson, starburst 1,1-1,8 ST7 Pulau Nias Monakson, starburst 1,2-2,3
0,1 mm b
1 mm a
Gambar 22 a. Silika Spikula Sponge ST5 (Pembesaran 100x) b. Bentuk Unik Microscleres (Pembesaran 1000x).
1 mm
0,1 mm
1 mm
a b
Gambar 23 Silika Spikula dari Sponge: a. ST6, b. ST7 (Pembesaran 100x) c. Bentuk microscleres starburst (pembesaran 1000x).
Pada Sponge ST6 hampir sebagian besar sponge ini adalah starburst. Belum ditemukan laporan penelitian yang menyebutkan bahwa silika berbentuk starburst dibentuk oleh protein yang sama (filamen silicatein), kemungkinan besar silika ini dibentuk oleh protein filamen yang berukuran lebih kecil.
Protein Silicatein
Isolasi Protein
Isolasi protein dari suatu bahan tergantung dari lokasi protein tersebut, dimana protein yang disekresikan lebih mudah diisolasi dibandingkan dengan protein intraselular. Seperti telah diungkap di atas, protein silicatein ini disekresikan ke luar sel dan diselimuti oleh silika spikula yang dikondensasi dan dipolimerisasi oleh protein ini sendiri. Isolasi protein diawali dengan isolasi silika spikula dari sponge. Silika spikula tidak larut dalam larutan hipoklorit, Na-hipoklorit merupakan senyawa pereduksi kuat yang biasanya digunakan sebagai pemutih (bleaching agent) pada industri kertas. Senyawa ini dapat mendegradasi karbohidrat kompleks, seperti selulosa atau lignin yang berada dalam tubuh sponge. Pencucian dilakukan untuk menghilangkan sisa-sisa sel sponge dan sisa larutan Na-hipoklorit.
Silika spikula tidak larut asam, pemisahan dengan komponen sponge lainnya terutama lemak dan protein dilakukan dengan melarutkan komponen tersebut dalam asam kuat HNO3/ H2SO4 (1:4). Kalsium karbonat larut dalam asam kuat tersebut, akan terbentuk ion Ca2+ dan CO32-. Spikula yang tersusun dari kalsium karbonat tidak akan mengendap setelah perendaman asam ini, seperti yang terjadi pada Sponge ST8 dan ST9. Perendaman dalam larutan asam ini juga sekaligus sebagai tahap awal pemurnian protein silicatein, hal ini terlihat dari hasil elektroforesis dengan SDS-PAGE hanya ada satu pita protein, yaitu protein silicatein dan tidak ada pita protein lainnya.
Pelarutan Silika dalam Buffer HF
distirrer selama lebih dari 1 jam. Kedua larutan ini merupakan pelarut silika yang sangat kuat. Hidrogen fluoride (HF) merupakan senyawa penting yang sering digunakan dalam industri. Senyawa ini dihasilkan dari reaksi antara senyawa fluorite (misalnya kalsium fluorite) dengan H2SO4 (Encyclopædia Britannica 1997) melalui reaksi double replacement (Chemtutor 1997). Aktivitas kimia dari senyawa ini dikenal dengan kemampuannya menyerang elektron yang sangat ekstrim (sangat elektronegatif) dan mempunyai ukuran atom (ion F-) yang sangat kecil. Karena ukurannya yang sangat kecil, ia dapat membentuk kompleks yang sangat stabil dengan beberapa ion positif seperti Si4+ dan Al3+ membentuk kompleks hexafluorosilicate(IV) (SiF62-) atau hexafluoroaluminate(III) (AlF63-) (Encyclopædia Britannica 1997).
Kemampuan senyawa HF tersebut, menyebabkan senyawa ini dapat menyerang ikatan antara Si dan Oksigen pada polimer SiO2 (dalam silika spikula) menyebabkan polimer silika terdegradasi dan atom Si membentuk kompleks dengan flourine dari HF membentuk hexafluorosilicate(IV) (SiF62-). Proses ini dibantu dengan gerakan pengadukan (stirrer).
Larutan HF 2M mempunyai pH yang sangat rendah sekali (kurang dari 1,0) sehingga protein silicatein yang terlepas dari polimer silika tentu akan rusak pada pH yang sangat asam ini. Untuk menjaga hal tersebut digunakan garam NH4F untuk menjaga keseimbangan pH sehingga pH larutan buffer ini sekitar pH 5. pH 5 ini diduga merupakan pH titik isoelekrik protein silicatein seperti pH isoelektrik kebanyakan protein cathepsin-L. Pada pH isoelektrik, umumnya protein enzim mempunyai kelarutan yang paling rendah (Chaplin 2004), sehingga protein mudah diendapkan.
Dialisis
konsentrasinya lebih rendah (luar tabung dialisis) (Blaber 1998) (Gambar 25). Dalam hal ini larutan di luar tabung digunakan air bebas ion.
Pada studi awal melalui literatur telah diketahui bahwa ukuran protein silicatein sekitar 27-29 kDa. Tabung dialisis yang digunakan selain harus dapat mengeluarkan senyawa hexafluorosilicate(IV) tadi, juga harus dapat mempertahankan protein agar tidak ikut keluar. Oleh karena itu, dialisis dilakukan dengan menggunakan kantung dialisis dengan cut-off 10 kDa.
Protein ±50 ml dalam Buffer HF
Tabung dialisis
Air bebas ion 2L
Gambar 24 Dialisis Larutan Protein dan Buffer HF.
Sumber :http://wine1.sb.fsu.edu/C:/My%20Documents/mailto:blaber@sb.fsu.edu
Gambar 25 Difusi yang Terjadi saat Dialisis.
Hexafluorosilicate(IV) dikeluarkan saat dialisis karena ukuran molekul lebih kecil dari cut-off membran. Pengeluaran kompleks silikat ini berlangsung terus sampai terjadi kesetimbangan di dalam dan di luar tabung. Oleh karena itu, larutan di luar tabung harus diganti berulang kali untuk menggeser lagi
Bagian dalam kantung dialisis
kesetimbangan, sehingga kompleks silikat di dalam tabung dialisis didifusikan lagi ke luar. Pengeluaran kompleks silikat saat dialisis ini diamati dengan pengukuran jumlah silikat pada larutan yang ada di luar tabung dialisis (pada pergantian air bebas ion ke-1, 2, 3 dan pada pergantian terakhir, ke-9) dengan menggunakan colorimetric molybdate assay.
Hasil assay ini menunjukkan adanya penurunan konsentrasi silikat pada larutan di luar tabung dialisis (dilihat pada Gambar 26) selama beberapa kali pergantian air bebas ion. Pada dialisis terakhir dan pada cairan enzim (dialisat) sudah tidak terdeteksi lagi adanya silikat dengan colorimetric molybdate assay (data absorbansi pada Lampiran 5).
Gambar 26 Penurunan Jumlah Silikat yang Diukur pada Cairan di Luar Tabung Dialisis.
Sentrifugasi
Sentrifugasi merupakan cara pengendapan melalui tenaga gravitasi buatan (Mangunwidjaja 1994). Metode ini digunakan untuk memisahkan partikel dari cairan suspensi.
Dialisat disentrifugasi pada kecepatan 6000xg (12.000 rpm pada sentrifugasi Merk TOMY) untuk mengendapkan protein silicatein. Proses ini termasuk dalam tahapan kritis dalm isolasi protein ini. Kecepatan pengendapan
dengan sentrifugasi tergantung banyak faktor, yang tergambar dalam fungsi
r = radius sampel ke pusat lingkaran
µ = kekentalan cairan
Dari fungsi tersebut, diketahui bahwa kecepatan pemisahan/ pengendapan sebanding dengan diameter partikel (dalam hal ini diameter protein) dan kerapatan protein. Sentrifugasi yang dilakukan terhadap Sponge ST1 dan ST3, menghasilkan endapan protein dengan jumlah endapan terbanyak ditemukan pada Sponge ST3. Hal ini sesuai dengan kerapatan filamen protein (jumlah protein / ml yang dihitung dengan haemacytometer) protein ST3 sebanyak 6,0 x 106/ ml, sedangkan protein ST1 sebanyak 2,25x106/ ml.
Sentrifugasi yang dilakukan pada Sponge ST4, ST5 dan ST6 tidak menghasilkan endapan protein. Hal ini kemungkinan karena jumlah protein per ml yang sangat kecil sehingga tidak terendapkan pada kondisi kecepatan dan waktu sentrifugasi tersebut. Kemudian untuk Sponge ST5 dan ST6 yang banyak mengandung silika spikula berbentuk microscleres kemungkinan protein pembentuknya merupakan filamen dengan ukuran dan diameter yang jauh lebih kecil dibandingkan dengan protein pembentuk silika spikula monakson, sehingga sulit untuk melakukan isolasi protein dengan sentrifugasi pada 6000xg. Perlu dicari kecepatan sentrifugasi untuk dapat mengendapkan protein tersebut dan mempelajari karakteristik proteinnya lebih lanjut.
Bentuk Protein
filamen protein yang dapat diamati secara mikroskopis dan berukuran panjang
sekitar 1 mm dan diameter 2 µm. Pada Sponge ST1 dan ST3 dapat teramati adanya filamen protein ini di bawah mikroskop, dengan ukuran yang hampir sama, yaitu panjang 0,1 mm dan diameter 10 µm.
0,1 mm 0,1 mm
a b
Gambar 27 a. Protein Filamen Sponge ST3 (Pembesaran 400x) dan b. Protein Filamen Sponge ST1 (Pembesaran 400x).
Jumlah Protein dalam Larutan
Konsentrasi protein diukur dengan menggunakan metode Bradford. Prinsip metode ini adalah pengikatan pewarna pada ikatan glikosidik dan gugus aromatik dari protein. Protein dari sponge ini sangat kecil konsentrasinya sehingga tidak terdeteksi oleh metode ini. Konsentrasi protein ini diperkirakan
dibawah 5 µg/ml yang merupakan batas bawah metode Bradford.
Untuk menghitung jumlah filamen protein per ml digunakan alat haemacytometer sebagai gelas objek dan diamati di bawah mikroskop. Metode ini biasanya digunakan untuk menghitung jumlah sel atau spora di bawah mikroskop (Fardiaz 1989). Jumlah filamen protein/ml dihitung dengan haemacytometer untuk protein Sponge ST1 sebanyak 2,25x106/ml dan Sponge ST3 sebanyak 6,0 x 106/ ml (cara perhitungan pada Lampiran 5).
Berat Molekul Protein
perbandingan jarak migrasinya dengan marker (Lampiran 6). Protein dari Sponge ST1 dan ST3 mempunyai berat molekul 21,4 kDa (Gambar 28), sedangkan protein dari Sponge ST4 dan ST5 tidak terdeteksi, kemungkinan protein dari kedua sponge ini tidak terisolasi atau konsentrasinya sangat kecil sekali berada di bawah 2 ng/ml yang merupakan batas deteksi oleh silver staining (Amersham Biorad).
M ST1 ST3 ST4 ST5
Gambar 28 Hasil SDS-PAGE Protein Silicatein
Reaksi Protein Silicatein dengan Substrat
Aktivitas protein diuji dengan menggunakan substrat tetraethoxyorthosilicate, yang merupakan senyawa Si dengan empat tangan mengikat O-Etanol. Substrat ini digunakan karena mempunyai kemiripan dengan substrat alami protein ini yaitu silicic acid (Si(OH)4) tetapi lebih stabil stabil pada pH netral (Cha et al. 1999) dibandingkan dengan silicic acid sendiri. Silisic acid kurang stabil karena gugus OH yang reaktif yang mampu melakukan reaksi kondensasi dan polimerisasi sendiri pada suhu kamar, tetapi sampai derajat polimerisasi tertentu polimer ini dapat terurai kembali (Coradin 2003). Selain itu, penambahan silisic acid selanjutnya dapat menurunkan pH medium sehingga terjadi pelarutan silika dan kembali membentuk monomer (Iler 1979).
Substrat lain yang dapat digunakan oleh protein ini, yaitu silicon triethoxide dan tetramethoxyorthosilicate (TMOS). Silicon triethoxide digunakan untuk membuat polimer silsesquixanes (Cha et al. 1999). TMOS merupakan
substrat yang digunakan pada pembuatan polimer silika oleh protein silaffin yang diisolasi dari diatom (Kroger 2002), tetapi TMOS ini mempunyai volatilitas yang tinggi (Awazu dan Onuki 1996).
Mekanisme reaksi kondensasi dan polimerisasi TEOS oleh silicatein yang diusulkan oleh Cha et al. (1999) seperti pada Gambar 29. Mekanisme reaksi ini diambil berdasarkan model struktur tiga dimensi silicatein yang mirip dengan protease dengan sisi aktif yang sama untuk His. Sedangkan sisi aktif sistein pada protease digantikan serin pada silicatein (Shimizu et al. 1998). Mekanisme reaksi diawali oleh atom N nukleofil pada gugus imidazole dari histidin menarik atom H dari gugus hidroksil serin, hal ini menyebabkan atom O bersifat reaktif dan memutuskan gugus etanol dari substrat TEOS. Proses ini disebut proses kondensasi substrat TEOS. Proses kondensasi ini diiringi dengan proses polimerisasi membentuk struktur tiga dimensi berbentuk "ring" (Gambar 6). Mekanisme polimerisasi secara detil belum diketahui, tetapi diduga proses ini dibantu oleh ion positif Na+; dimana ion ini banyak terdeposit di dalam silika spikula (Aizenberg 2004).
Protein yang diuji aktivitasnya hanya protein yang terdeteksi pada SDS PAGE, yaitu protein dari Sponge ST1 dan ST3. Reaksi ini dilakukan pada suhu kamar dan pH mendekati netral (pH 6,8); hasil reaksi berupa polimer silika diukur dengan colorimetric molybdate assay. Pada assay ini digunakan larutan ammonium molibdat ((NH)4. Mo7.O24.4H2O) dalam air bebas ion yang ditambah dengan larutan HCl pekat. Ammonium molibdat merupakan senyawa yang sering digunakan untuk pemberi warna (dye) pada beberapa assay terutama untuk logam (Mitchel 2003), karena kemampuannya untuk membentuk kompleks dengan beberapa logam tersebut. Si(OH)4 yang terbentuk dari pelarutan polimer silika, akan kehilangan gugus OH karena adanya atom H dari HCl pekat. Ammonium molibdat mengkelat Si yang terlepas dan membentuk kompleks berwarna kuning.
tetapi hanya warna hijau saja dan terukur sebagai nilai absorbansi yang kecil pada panjang gelombang 810 nm.
Gambar 29 Mekanisme Reaksi Silicatein terhadap Substrat TEOS.
Pelarutan Polimer Silika
Pada penelitian ini dilakukan pengukuran silikat pada tiga tahapan, yaitu 1) setelah pembentukan polimer 12 jam dan pencucian polimer dengan etanol, 2) setelah polimer tersebut diberi perlakuan perendaman basa dan suhu tinggi selama 30 menit dan 3) setelah proses 2 disertai pelarutan selama 24 jam. Hasil pengukuran silikat ditunjukkan oleh Tabel 5. Hasil ini memperlihatkan bahwa pada tahapan pertama belum ada atom silikat, sedangkan polimer silika tidak memperlihatkan reaksi dengan ammonium molibdat maupun pereduksi. Polimer silika memerlukan waktu untuk melarut menjadi monomernya kembali.
Tabel 5 Hasil Pengukuran Silikat pada Beberapa Tahapan Tahapan Kondisi Nilai absorbansi Interpretasi
1 Polimer silika < A blanko Tidak ada silikat 2 Perendaman basa
dan suhu tinggi
< A blanko Tidak ada silikat
3 Pelarutan 24 jam Jauh di atas A
Aktivitas Protein Sponge ST1 dan Protein Sponge ST3
Untuk menentukan jumlah monomer TEOS yang dapat terpolimerisasi oleh aktivitas protein Sponge ST1 dan ST3 diperlukan suatu kurva yang dapat menghubungkan antara nilai absorbansi yang terukur melalui colorimetric molybdate assay dengan konsentrasi TEOS. Kurva ini disebut kurva standar yang memuat hubungan antara nilai absorbansi (pada sumbu y) dengan konsentrasi TEOS (pada sumbu x) (Gambar 30). Kurva standar dibuat dengan menggunakan beberapa konsentrasi TEOS (20, 40, 60, 80, 100, 120, 140, 160, 180, 200, 220 dan
225 µmol TEOS /ml DMSO). Kurva standar yang dibuat mempunyai persamaan linier y=0,00181x+0,01167; dengan nilai r2 yang cukup tinggi sebesar 0,994, yang menunjukkan korelasi yang baik.
Sebanyak 0,25 ml protein Sponge ST1 (dengan konsentrasi protein di bawah 5 µg/ml) yang direaksikan selama 12 jam, pada suhu kamar menghasilkan
TEOS (Tabel 6) (data absorbansi dan perhitungan pada Lampiran 7). Bila dibuat dalam satuan menit, protein Sponge ST1, mampu melakukan polimerisasi dari 22,3 nmol monomer TEOS; sedangkan protein Sponge ST3 mampu melakukan polimerisasi dari 4,2 nmol monomer TEOS. Dari uji aktivitas ini, menunjukkan bahwa kedua protein tersebut mampu menjadi katalis dalam reaksi polimerisasi silika dari substrat TEOS. Protein ST1 menghasilkan polimer silika per menit yang lebih tinggi dibandingkan dengan protein ST3. Sebagai perbandingan, Cha et al. (1999) melakukan reaksi polimerisasi silika dengan menggunakan protein silicatein subunit α dari Sponge Tethya aurantia, protein rekombinan silicatein subunit α yang diekspresikan pada Eschericia coli, protein BSA, papain dan tripsin. Hasil pengukuran reaksi polimerisasi dari beberapa protein tersebut ditampilkan pada Tabel 7.
Gambar 30 Kurva Standar TEOS.
Tabel 6 Perbandingan Jumlah TEOS Terpolimerisasi Kondisi Reaksi Jumlah TEOS Terpolimer
*td= tidak terdeteksi (di bawah batas deteksi Bradford; 5 µg/ml)
Tabel 7 Perbandingan Jumlah TEOS Terpolimerisasi Beberapa Protein
Kondisi Reaksi Jumlah TEOS Terpolimer Jenis
Enzim Lama reaksi
Volume
protein Jumlah protein Total Per menit
Silicatein
Sumber : Cha et al. (1999) yang dimodifikasi
Dari Tabel 6 dan Tabel 7, terlihat bahwa protein dari Sponge ST1 dengan konsentrasi protein per ml (juga jumlah protein) yang lebih rendah dari protein yang digunakan dalam penelitian Cha et al. (1999), dapat melakukan polimerisasi silika dari monomer TEOS yang lebih banyak dibandingkan dengan protein lainnya. Perbandingan hasil reaksi polimerisasi silika dihitung dalam satuan menit digambarkan dalam bentuk grafik pada Gambar 31.
0
Gambar 31 Grafik Perbandingan Hasil Reaksi Polimerisasi Oleh Protein Sponge ST1 dan ST3.
Model Pembentukan Silika Spikula Sponge