PENYISIPAN GEN FITASE PADA GENOME BEBERAPA
KULTIVAR TEBU, REGENERASI, EKSPRESI DAN
AKLIMATISASI
Oleh SUSIYANTI
A361030111
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa disertasi ‘Penyisipan gen fitase pada genome beberapa kultivar tebu, regenerasi, ekspresi dan aklimatisasi’ belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebut dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Bogor, Juli 2008
SUSIYANTI. Insertion of phytase gene into genome of sugarcane cultivars, regeneration, expression and acclimatization. Under supervision of G.A. WATTIMENA, DWI ANDREAS SANTOSA, MEMEN SURAHMAN, AND AGUS PURWITO.
Sugarcane (Saccharum officinarum L.) is one of the important crops grown in marginal land in Indonesia. Phosphorus (P) is critical to the growth and development of plant in the marginal land. P is stored in plant as phytic acid (myo-inositolhexakisphosphate). Phytic acid is hydrolyzed by the activity of phytases to yield inositol and free phosphate. Genus Sacharum has low phytase activity, so it needs phytase gene insertion from other source. Genetic transformation of sugarcane holds promise to provide enough P during period of rapid cell division and growth of plant. The efficient insertion of phytase gene from other source requires plant transformation process through Agrobacterium tumefaciens. Plant transformation mediated by Agrobacterium tumefaciens, has become the most used method for the introduction foreign genes into plant cells and the sub sequens regeneration of transgenic plant. Successfulness of transformation process depends on regeneration, transformation, gene expression, and methode of acclimatization.
In vitro culture technique is needed to multiply clones of transgenic sugarcane. As the first step in many tissue culture experiment, it is necesssary to induce callus formation from the primary explant before regenerating to be plantlets. In general sugarcane transformed lines show chlorophyll content and leaf colour such as albino, discloration, lack of chlorophyll in the particular spot of leaves. The abnormal leaves showed low chloprophyll content. To increase the chlorophyll content of sugarcane transgenic line can be treated with putrescine. At the moment there is no data about the expression of phytase gene in form of phytase activity and its effect to phosphate and chloprophyll content in sugarcane. The transformed sugarcane plantlets should be able to acclimatize to field condition.
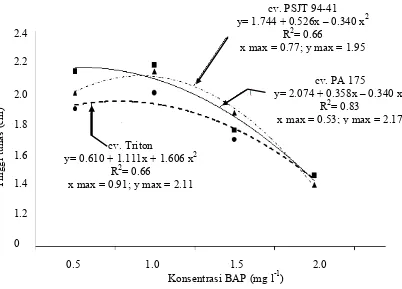
The appropriate callus induction from 3 clones of sugarcane was observed on medium containing 3 mg l-1 2.4 D. Shoot of sugarcane has able to induce by using modified MS medium + kinetin (0.1 mg l-1) + BAP (0.5; 1.0 ; 1.5; 2.0 mg l-1). Shoot started with the appeareance of green dot on callus within a week on regeneration medium. The best shootlet medium of three clones of sugarcane was MS + kinetin (0.1 mg l-1) + BAP (1.5 mg l-1). The best rooting medium of
The result indicated that the increasing of phytate concentration in culture media would increase phytase activity and P total in plantlet. Expression of phytase activity in sugarcane, signifincantly improved phosphorus absorption and chlorophyll content. Phytase activities in plant of the transgenic sugarcane were increased 67.04-75.40 %. Data showed that several transgenic varieties can increase P content in plant (2-29 %) and total chlorophyll.
From three transformed lines tested, two lines (cv. PSJT 94-41 and cv. PA 175) with green leaves grew well in the field condition, in contrary, the yellow leaves (cv. Triton) did not show similar result. The transformed line grew slowly in the first seven day after planting, however it grew normally in the next growing period. Total chlorophyll, chlorophyll a and chlorophyll b were (cv. PS 851) increased as the phytase activity increase.
SUSIYANTI. Penyisipan gen fitase pada genome beberapa kultivar tebu,
regenerasi, ekspresi dan aklimatisasinya. Dibimbing oleh G.A. WATTIMENA, DWI ANDREAS SANTOSA, MEMEN SURAHMAN,
DAN AGUS PURWITO.
Tebu (Saccharum officinarum L.) merupakan komoditas utama yang
banyak ditanaman dilahan marginal di Indonesia. Phosphor (P) merupakan unsur yang menjadi faktor pembatas dalam pertumbuhan tanaman di lahan marginal. P disimpan tanaman dalam bentuk asam fitat (myo-inositolhexakisphosphate). Asam fitat dihidrolisis oleh fitase menjadi inositol dan P yang dapat digunakan tanaman. Genus Sacharum memiliki aktivitas fitase yang rendah, sehingga perlu penyisipan gen fitase dari sumber lain. Guna mendapatkan tanaman yang memiliki kecukupan P selama proses pembelahan sel dan pertumbuhannya dapat dilakukan melalui transformasi genetik. Transformasi melalui Agrobacterium tumefaciens, merupakan metode yang paling sering digunakan untuk mengintroduksi gen asing ke dalam tanaman dan diregenerasikan sehingga menghasilkan tanaman transgenik. Proses transformasi yang berhasil harus melalui tahap regenerasi, transfrormasi, ekspresi gen, dan aklimatisasinya.
Salah satu metode yang banyak digunakan untuk perbanyakan klonal tebu transgenik adalah melalui kultur jaringan. Langkah pertama dalam kultur jaringan adalah menginduksi pembentukan kalus dari eksplan, sebelum diregenerasikan menjadi plantlet. Pada umumnya tebu hasil transformasi menunjukkan variasi kandungan klorofil berupa warna daun albino, kuning, hijau muda, hijau belang
putih, dan hijau. Pembentukkan daun yang abnormal mengindikasikan
kandungan klorofil yang rendah. Guna meningkatkan klorofil tanaman tebu hasil transformasi dapat dilkukan dengan penambahan putresina. Saat ini belum ada informasi secara lengkap mengenai ekspresi gen fitase berupa aktivitas fitase dan pengaruhnya terhadap kadar P dan klorofil tebu. Selanjutnya, tanaman tebu hasil transformasi perlu diaklimatisasi pada kondisi di lapangan.
Pembentukan kalus yang sesuai terdapat pada media yang mengandung 3 mg l-1 2.4 D. Pembentukan tunas tebu dengan menggunakan media MS + kinetin (0.1 mg l-1) + BAP (0.5; 1.0 ; 1.5; 2.0 mg l-1). Tunas mulai terbentuk dengan munculnya noktah hijau pada kalus setelah seminggu dalam media regenerasi. Media perakaran yang terbaik untuk 3 kultivar tebu terdapat pada media MS + kinetin (0,1 mg l-1) + BAP (1.5 mg l-1). Media perakaran yang terbaik untuk 3
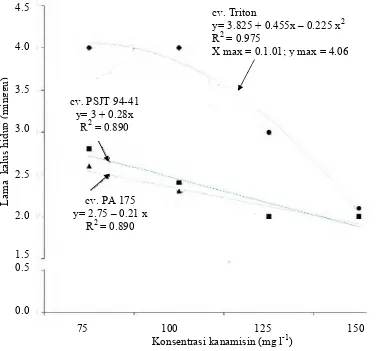
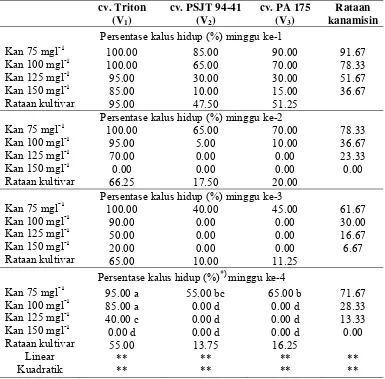
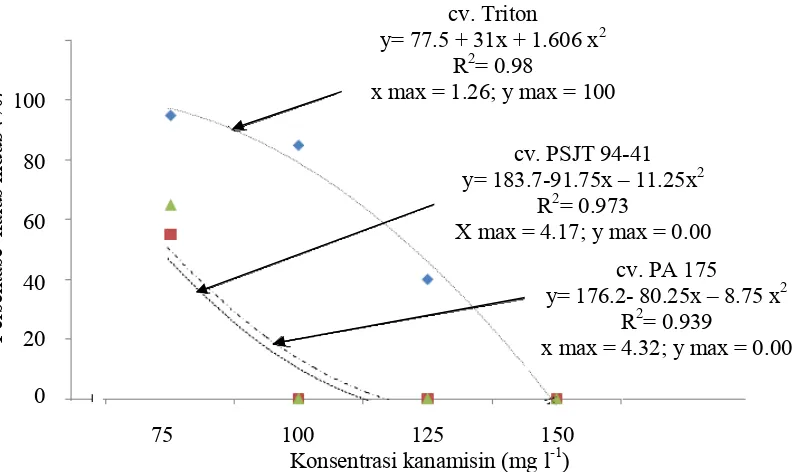
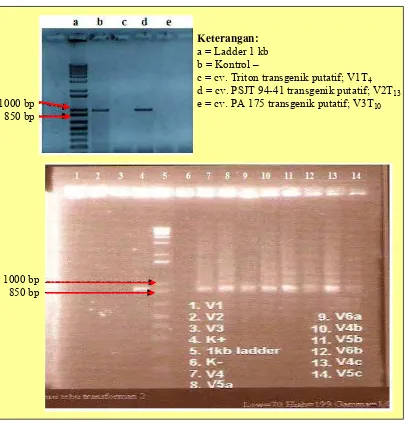
kultivar tebu adalah MS + kinetin (0,1 mg l-1) + IBA (1.0 mg l-1). Hasil penelitian menunjukkan kalus transgenik putatif dapat bertahan hidup pada media 150 mgl-1 kanamisin. Efisiensi regenerasi transgenik putatif: cv. Triton = 30 %; cv. PSJT 94-41= 25 %; dan cv. PA 175= 30 %. Efisiensi transformasi transgenik putatif cv. Triton = 21 %; cv. PSJT 94-41= 15 %; dan cv. PA 175= 24 %. Analisa integrasi gen fitase ditunjukkan dengan pemunculan pita PCR 900 bp.
Putresina 3.64 x 10 –4 M merupakan konsentrasi optimum untuk
memiliki peningkatan kadar P tanaman (2-29 %) dan total klorofil.
©Hak cipta milik IPB, tahun 2008 Hak cipta dilindungi
1 Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumber:
a Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penyusunan laporan, penulisan kritik atau tujuan suatu masalah
b Pengutipan tidak merugikan kepentingan wajar Institut Pertanian Bogor
AKLIMATISASI
Oleh SUSIYANTI
A361030111
DISERTASI
Sebagai salah satu syarat untuk memperoleh gelar Doktor pada Sekolah Pascasarjana, Institut Pertanian Bogor
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Penguji pada Ujian Tertutup : Dr Ir Darda Efeni, MSc
Penguji pada Ujian Terbuka : Dr Ir Gatot Irianto, MS
Nama : Susiyanti
NIM : A361030111
Disetujui
Komisi Pembimbing
Prof Dr Ir G.A. Wattimena, MSc Dr Ir Dwi Andreas Santosa, MSc Ketua Anggota
Dr Ir Memen Surahman, MSc Dr Ir Agus Purwito, MSc
Anggota Anggota
Mengetahui,
Ketua Program Studi Dekan Sekolah Pasca Sarjana
Agronomi
Dr Ir Munif Ghulamahdi, MS Prof Dr Ir Khairil Anwar Notodiputro, MS
Tanggal ujian: 25 Agustus 2008 Tanggal lulus:
Penulis merupakan anak kedua dari lima bersaudara yang lahir pada
tanggal 11 Maret 1971 di Manggopoh (Kabupaten Agam, Sumatera Barat)
dari pasangan: Ayahanda dr. Martibas Mara dan Ibunda Arnellys Arlina.
Pendidikan Sekolah Dasar Negeri I (Teladan) diselesaikan di Kotabumi
(Lampung Utara) pada tahun 1984, Sekolah Menengah Pertama Negeri 2 pada
tahun 1987 dan Sekolah Menengah Atas Negeri 2 pada tahun 1990 di
Tanjungkarang. Tahun 1996 penulis mendapatkan gelar Sarjana Pertanian dari
Universitas Lampung pada Jurusan Budidaya Pertanian dengan Program Studi
Agronomi. Tahun 2000 penulis mendapatkan gelas Magister Pertanian pada
program Pascasarjana Universitas Andalas (Program Studi Agronomi dengan
Pemusatan: Pemulian Tanaman). Pada tahun 2000 penulis bekerja sebagai dosen
Yayasan Universitas Tamansiswa, Padang. Pada tahun 2003 penulis tercatat
sebagai mahasiswa S3 Sekolah Pascasarjana IPB pada program Studi Agronomi
(Pemusatan: Pemulian Tanaman dan Bioteknologi) dengan dana BPPS. Pada
tahun 2005 penulis diterima menjadi dosen PNS pada Universitas Sultan Ageng
Tirtayasa (Untirta), Serang, Banten.
Karya ilmiah dengan judul: ’Transformasi gen fitase pada beberapa klon tebu melalui Agrobacterium tumefaciens GV 2260 dengan plasmid pBin dan
pMA’, telah disajikan pada Seminar Nasional Bioteknologi dan Pemuliaan Tanaman tanggal 1-2 Agustus 2006. Sebuah artikel dengan judul: ’Transformasi
tanaman tebu (cv. PSJT 94-41) dengan gen fitase menggunakan Agrobacterium tumefaciens GV 2260 (pBinPI-IIEC)’, diterbitkan pada Jurnal Buletin Agronomi, Vol. XXXV, No. Desember 2007. Karya ilmiah tersebut merupakan bagian dari
Puji dan syukur penulis persembahkan kehadirat Allah SWT yang telah
melimpahkan karunia-Nya sehingga penulis dapat menulis disertasi ini. Disertasi
ini adalah sebagai salah satu syarat untuk untuk memperoleh gelar Doktor pada
Sekolah Pascasarjana, Institut Pertanian Bogor.
Penelitian dilakukan pada bulan September 2004 sampai dengan
Desember 2007 di Laboratorium Bioteknologi-Kultur Jaringan-Departemen
Agronomi dan Hortikultura, IPB; Laboratorium Mikrobiologi dan Bioteknologi
PPLH, IPB; Laboratorium Saraswanti Indo-Genetech (SIG), Bogor; serta Laboratorium Indonesia Center for Biodiversity and Biotecnology (ICBB), Situgede-Bogor.
Penulis ingin mengungkapkan terimakasih yang setulus-tulusnya kepada:
Bapak Prof Ir G.A. Wattimena, MSc sebagai Ketua Komisi Pembimbing, Bapak
Dr. Ir. Dwi Andreas Santosa, MSc selaku pembimbing dan telah memberi
kesempatan berpartisipasi dalam penelitian yang didanai RAPID; Bapak Dr Ir
Memen Surahman, MSc dan Dr Ir Agus Purwito, MSc selaku anggota komisi
pembimbing yang telah memberikan bantuan dan pengarahan. Juga penulis tak
lupa mengucapkan terima kasih kepada Ibu Dr Ir Nurul Khumaida, MSc selaku
penguji di luar komisi pada ujian prakualifikasi program Doktor. Ucapan
terimakasih juga diucapkan untuk Dr Ir Darda Efendi, MSc selaku penguji di luar
komisi pada ujian tertutup, juga untuk Dr Ir Gatot Irianto, MS dan Dr Ir Desta
Wirnas, MSi selaku penguji di luar komisi pembimbing pada Ujian Terbuka.
Ucapan terimakasih dihaturkan juga Dr Ir Munif Ghulamahdi, MS selaku Ketua
Program Studi Agronomi, serta Bapak dan Ibu Dosen yang telah memberikan
ilmu dan bimbingan selama menuntut ilmu yang tidak bisa penulis sebutkan satu
persatu. Terimakasih untuk bapak Adhi yang telah membantu dalam pengolahan
statistik. Terima kasih juga dihaturkan kepada pihak Dikti yang telah
memberikan beasiswa BPPS serta Rektor Unitas dan Untirta beserta staf dan
karyawannya. Ucapan terima kasih juga untuk Reni, Ade, Uli, Neni, Nana, Dian,
teteh Tati, Salma, Mbak Lastri, Mbak Ayi, Mas Iwan, Mas Putra dan Adek-adek
atas kasih sayang beliau yang tak akan terbalas, serta Uni Meri, Evi, Nela, Rini,
Slamet, dan Kintan, Ega, Alika, Aza, Ica, Kevin dan Uda Al (Alm.) atas segala
bentuk perhatian dan kasih sayang yang diberikan.
Semoga ini bermanfaat bagi semua pihak yang membutuhkan dan menjadi
amal saleh bagi semua pihak yang terkait dengannya. Amin.
Bogor, Agustus 2008
Halaman
DAFTAR ISI ... i
DAFTAR TABEL ... iii
DAFTAR GAMBAR ... iv
DAFTAR LAMPIRAN ... vi
I PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan Penelitian ... 6
Manfaat Penelitian ... 7
BAB II TINJAUAN PUSTAKA ... 8
Tanaman tebu ... 8
Kultur jaringan tebu dan poliamin ... 10
Peranan phosphor pada pertumbuhan Tanaman ... 15
Fitat dan fitase ... 16
Plasmid dan gene cassette ... 20
Transformasi gen ... 22
Analisis PCR ... 24
BAB III REGENERASI TEBU SECARA IN VITRO ... 27
Abstrak ... 27
Pendahuluan ... 29
Bahan dan Metode ... 31
Hasil dan Pembahasan ... 34
Simpulan ... 52
BAB IV PENYISIPAN GEN FITASE PADATANAMAN TEBU MELALUI Agrobacterium tumefaciens GV 2260 ... 53
. Abstrak ... 53
Pendahuluan ... 55
Bahan dan Metode ... 57
Hasil dan Pembahasan ... 61
BAB V PENINGKATAN KLOROFIL PLANTLET
TEBU HASIL TRANSFORMASI DENGAN
PEMBERIAN PUTRESINA ... 78
Abstrak ... 77
Pendahuluan ... 79
Bahan dan Metode ... 81
Hasil dan Pembahasan ... 82
Simpulan ... 90
BAB VI .EKSPRESI GEN FITASE PADA BEBERAPA KULTIVAR TEBU HASIL TRANSFORMASI ... 89
Abstrak ... 90
Pendahuluan ... 93
Bahan dan Metode ... 94
Hasil dan Pembahasan ... 97
Simpulan ... 113
BAB VII AKLIMATISASI PLANTLET TEBU HASIL TRANSFORMASI ... 115
Abstrak ... 115
Pendahuluan ... 116
Bahan dan Metode ... 118
Hasil dan Pembahasan ... 119
Simpulan ... 129
BAB VIII PEMBAHASAN UMUM ... 130
BAB IX SIMPULAN DAN SARAN ... 135
DAFTAR PUSTAKA ... 138
Halaman
1 Pengaruh pemberian 2.4 D terhadap pdiameter kalus beberapa
kultivar tebu secara in vitro usia 6 minggu setelah tanam. ... 34 2 Pengaruh pemberian 2.4 D terhadap persentase membentuk
kalus ..beberapa kultivar ...tebu secara in vitro usia 6 minggu
setelah tanam. ... 35 3 Pengaruh pemberian 2.4 D terhadap struktur dan warna kalus..
beberapa kultivar ...tebu secara in vitro usia 6 minggu setelah
tanam ... 37
4 Rata-rata pengaruh pemberian BAP terhadap jumlah tunas .
kultivar .tebu secara in vitro usia 4minggu setelah tanam. ... 40
5 Pengaruh pemberian BAP terhadap tinggi tunas .kultivar tebu
secara in . vitro usia 4minggu setelah tanam ... 43
6 Pengaruh pemberian BAP terhadap persentase pembentukan tunas ..beberapa....kultivar tebu secara in vitro usia 4minggu
setelah tanam . ... 44
7 Pengaruh pemberian IBA terhadap jumlah akar..beberapa kultivar
tebu secara in vitro usia 4 minggu setelah tanam . ... 47
8 Pengaruh pemberian IBA terhadap panjang akar ..beberapa
kultivar tebu secara in vitro usia 4 minggu setelah tanam . ... 48
9 Pengaruh pemberian IBA terhadap persentase membentuk akar beberapa..kultivar tebu secara in vitro usia 4 minggu
setelah tanam ... 50 10 Data rata-rata lamanya kalus bertahan hidup dalam media
kanamisin (mg ml-1). ... 63
11 Data rata-rata persentase kalus hidup, lamanya kalus bertahan
hidup serta struktur dan bentuk kalus dalam media kanamisin... 65
12 Struktur dan warna kalus dalam media seleksi kanamisin
usia 4 minggu setelah tanam. ... 67
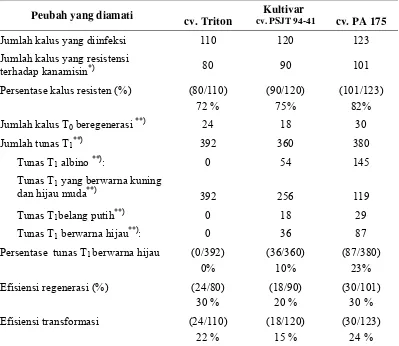
13 Jumlah dan persentase kalus resisten, jumlah kalus bergenerasi,
Efisiensi regenerasi, efisiensi transformasi, pada tanaman tebu. ... 69
14 Aktivitas fitase dan PCR plantlet non transgenik dan transgenik
putatif. ... 74
15 Rata-rata pengaruh putresina terhadap pembentukan klorofil
Halaman 16 Rata-rata pengaruh putresina terhadap klorofil b plantlet
tebu .transgenik usia 4 minggu setelah tanam. ... 84
17 Rata-rata pengaruh putresina terhadap total klorofil
plantlet tebu transgenik usia 4 minggu setelah tanam. ... 85
18 Data pengaruh pemberian fitat terhadap aktivitas fitase,
P total plantlet tebu. ... 97
19 Rata-rata pengaruh pemberian fitat terhadap P total plantlet
tebu. ... 99
20 Peningkatan P total dan aktivitas fitase tebu transgenik ...
dibanding non transgenik yang dikulturkan selama 1 minggu... pada media yang diberi fitat ... 108 21 Data pengaruh pemberian fitat terhadap kadar klorofil plantlet ...
tebu yang dikulturkan dalam media fitat . ... 110 22 Data pengamatan pada tebu transgenik yang diaklimatisasi
Halaman 1 Skema alur penelitian ’transformasi regenerasi, ekspresi
aklimatisasi beberapa kultivar tebu yang disisipi gen fitase bakteri .... 7
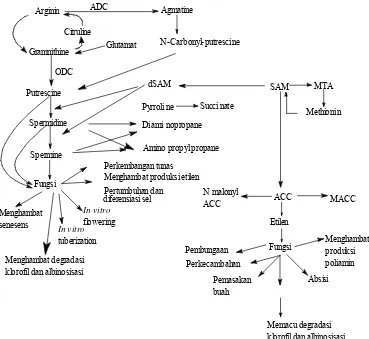
2 Biosintesis poliamina, metabolisme, fungsi dan interaksi dengan etilen ... 13
3 Struktur fitat ... 17
4 Lintasan biosintesis fitat ... 17
5 Skema sintesis dan penyimpanan fitin ... 18
6 Sekuen reaksi fitase dengan substrat myo-inositol heksakisphosphate ... 18
7 Konstruksi gene cassettepBinPI-IIEC. ... 22
8 Pengaruh pemberian 2.4 D terhadap diameter kalus beberapa kultivar tebu secara in vitro usia 6 minggu setelah tanam. .. 35
9 Pengaruh pemberian 2.4 D terhadap persentase membentuk kalus beberapa kultivar ...tebu secara in vitro usia 6 minggu setelah tanam. ... 36
10 Pengaruh pemberian 2.4 D terhadap pertumbuhan kalus beberapa kultivar tebu secara in vitro usia 6 minggu setelah tanam ... 38
11 Struktur dan bentuk kalus tebu. ... 39
12 Rata-rata pengaruh konsentrasi BAP terhadap jumlah tunas kultivar .tebu secara in vitro usia 4minggu setelah tanam... 41
13 Perkembangan eksplan tebu menjadi tunas... 42
14 Pengaruh pemberian BAP terhadap tinggi tunas .kultivar tebu secara in vitro usia 4minggu setelah tanam tanam. ... 43
15 Pengaruh pemberian BAP terhadap persentase pembentukan tunas beberapa....kultivar tebu secara in vitro usia 4minggu setelah. ... 45
16 Pengaruh pemberian BAP terhadap pertumbuhan tunas beberapa kultivar tebu secara in vitro usia 4 minggu setelah tanam ... 46
17 Pengaruh pemberian IBA terhadap pertumbuhan akar beberapa kultivar tebu secara in vitro usia 4 minggu setelah tanam ... 48
18 Pengaruh pemberian IBA terhadap panjang akar ..beberapa kultivar tebu secara in vitro usia 4 minggu setelah tanam. ... 49
19 Pengaruh pemberian IBA terhadap pertumbuhan akar beberapa kultivar tebu secara in vitro usia 4 minggu setelah tanam. ... 51
20 Kalus beberapa kultivar tebu yang dikulturkan dalam media Kanamisin usia 4 minggu ... 62
21 Rata-rata lamanya kalus bertahan hidup pada media kanamisin (mg ml-1) ... 64
22 Rata-rata persentase kalus hidup dalam media kanamisin. ... 66
23 Kalus hasil transformasi (usia 4 minggu) yang dikulturkan dalam media kanamisin 150 mgl-1 ... 68
24 Penampilan tunas tebu transgenik putatif . ... 71 25 Hasil elektroforesis PCR tebu (cv. PSJT 944-41)
dengan primer spesifik EC1 dan EC3 . ... 73 26 Grafik pengaruh putresina terhadap klorofil a plantlet
tebu.transgenik usia 4 minggu setelah tanam. ... 83 27 Penampilan plantlet tebu transgenik dalam media MS yang diberi
.konsentrasi putresina berbeda usia 4 minggu setelah tanam ... 86 28 Hubungan antara total klorofil dengan klorofil a pada ...
.
tebutransgenik yang ditanam pada media yang diberi putresina usia
4 minggu ..setelah tanam ... 87 29 Hubungan antara total klorofil dengan klorofil b pada .
.
tebutransgenik .yang ditanam pada media yang diberi putresina usia
4 minggu setelah tanam ... 88 30 Grafik pengaruh pemberian fitat terhadap aktivitas fitase ...
plantlet tebu ... 98 31 Grafik hubungan antara pengaruh pemberian fitat terhadap P...
total plantlet tebu.transgenik dan nn transgenik ... 100 32 Pengaruh fitat yang diberikan dalam media terhadap pertumbuhan
plantlet tebu ... 101
33 Korelasi antara pengaruh fitat yang diberikan dalam media terhadap aktivitas fitase plantlet tebu cv.Triton non transgenik dan
transgenik ... 103 34 Korelasi antara pengaruh fitat yang diberikan dalam media terhadap
aktivitas fitase transgenik dan non transgenik ... 103
35 Korelasi antara pengaruh fitat yang diberikan dalam media terhadap.aktivitas fitase plantlet tebu cv. PA 175 transgenik
dan non transgenik ... 104 36 Korelasi antara aktivitas fitase terhadap P total dalam jaringan ...
dan non transgenik ... 105 37 Korelasiantara aktivitas fitase terhadap P total dalam jaringan ...
plantlettebu cv. PSJT 94-41 non transgenik dan non transgenik ... 105
38 Korelasi antara aktivitas fitase terhadap P total dalam jaringan ...
plantlet tebu cv. PA 175 non transgenik dan non transgenik. ... 106 39 P yang diserap oleh plantlet tebu putatif transgenik dan non ...
trangenik usia 1 minggu setelah tanaman pada media fitat. ... 107 40 Korelasi antara aktivitas fitase terhadap total klorofil dalam ...
jaringan plantlet tebu cv. Triton non transgenik dan..transgenik ...
yang ditanam pada media fitat ... 111 41 Korelasi antara aktivitas fitase terhadap total klorofil dalam ...
jaringan ..plantlet tebu cv. PSJT 94-41 non transgenik dan. ...
transgenik ..putatif ..yang ditanam pada media fitat. ... 111 42 Korelasi antara aktivitas fitase terhadap total klorofil dalam...
jaringan plantlet tebu cv. PA 175 non transgenik dan..transgenik. ...
46 Korelasi antara aktivitas fitase dan klorofil a tebu transgenik ... (cv. PS ....851) di lapangan ... 126 47 Korelasi antara aktivitas fitase dan klorofil b tebu transgenik
(cv. PS 851) di lapangan ... 126 48 Korelasi antara aktivitas fitase dan total klorofil tebu transgenik...
Halaman
1 Komposisi bahan kimia dan media yang digunakan
dalam penelitian ... 145
2 Pembuatan media kultur... 147
3 Analisis kandungan klorofil ... 148
4 Deskripsi dan morfologi kultivar tebu ... 149
5 Analisis sidik ragam ... 152
Latar Belakang
Tanaman tebu Saccharum officinarum L. merupakan tanaman industri yang memiliki peran penting, karena 65% produksi gula dunia berasal dari tebu.
Tebu banyak digunakan sebagai bahan industri farmasi, sumber bahan bakar dan
produksi beberapa bahan kimia seperti furfural, dekstran, pakan ternak, industri
selulosa dan alkohol. Banyaknya produk yang memerlukan tebu sebagai bahan
baku, mengakibatkan permintaan akan komoditas tebu juga terus meningkat.
Gambaran kebutuhan gula nasional adalah sebesar 3 juta ton pada tahun 2002, dan
yang dapat dipenuhi hanya 1.7 juta ton gula dari produksi dalam negeri, sehingga
sisanya harus diimpor (Pakpahan dan Supriono, 2005).
Luas areal penanaman tebu pada tahun 1930 adalah 196.529 ha dengan
hablur 14.80 ton ha-1, yang bisa menghasilkan total gula 2.907.078 ton. Tahun
2002 dengan luas areal tanam 360.767.9 ha dan hablur 4.8 ton ha-1 hanya
menghasilkan 1.735.131.02 ton gula (Pakpahan dan Supriono 2005). Tahun 1999
dengan luas lahan tebu: 342.211 ha, produksi tebu Indonesia hanya 62.5 ton ha-1,
dengan hablur 4.36 ton ha-1 dan rendemen 6.97 % (Basuki, 2000). Tebu
sebenarnya memiliki potensi untuk ditingkatkan rendemennya menjadi 8-10%.
Rendahnya rendemen tebu tersebut disebabkan penggunaan kultivar tebu yang
telah mengalami degenerasi klonal atau peluruhan genetik. Kultivar Triton
(yang digunakan dalam penelitian ini) merupakan kultivar yang diintroduksi dari
Australia (Subarkat et al. 1988). Penanaman tebu cv. Triton di Indonesia mencapai 1438 ha, dengan produksi tebu 39.8 ton ha-1, dengan rendemen 6.31
serta hablur 2.51 ton ha-1 (Tjokrodirjo 2000). Tebu cv. PSJT 94-41 merupakan
klon tebu harapan koleksi P3GI dan belum dilepaskan (Hermono, komunikasi
pribadi 3 Desember 2007). Demikian pula halnya dengan tebu cv. PA 175 yang
merupakan klon koleksi Puslitagro PT Rajawali II, Cirebon.
Konversi lahan tebu dari lahan basah ke lahan kering turut memberikan
andil dalam rendahnya produksi tebu di Indonesia. Pada lahan kering umumnya
ketersediaan P rendah (P terikat). Penggunaan lahan kering ini membawa
tanaman tebu tergantung jenis tanah dan kultivar yang digunakan. Berdasarkan
hasil penelitian Glaz et al. (1997) dan Chen et al. (2002) rata-rata kultivar tebu dapat menyerap rata-rata 8.5 kg P ha-1 di tanah pertanian di Florida dan sekitar
30-85 % P tebu diambil dari tanah dalam bentuk P organik. Bentuk P organik dalam
tanah (Buckman dan Brady 1982; Anas et al. 1992) maupun dalam tanaman terfiksasi dalam bentuk fitat yang sukar digunakan oleh tanaman (Greiner 2005a).
Defisiensi P pada tanaman tebu akan menurunkan produksi tebu dan gula,
hal ini sejalan dengan penelitian Pawirosemadi (1980) yang membuktikan adanya
korelasi yang positif antara kandungan hara P2O5 dalam daun terhadap hasil dan
hablur gula tebu. Fungsi P adalah sebagai komponen penyusun struktur molekul
asam nukleat (DNA, RNA), gula fosfat (metabolisme intermediet tanaman),
nukleotida (ATP, CTP, UTP, GTP,TTP), koenzim, fosfolipid (membran sel).
Umumnya, Pi dalam banyak reaksi merupakan substrat dan atau produk yang
dihasilkan. Pi mengontrol beberapa reaksi enzim, serta penting dalam lintasan
metabolik di sitoplasma dan kloroplas (Marschner 1995).
Fitat (inositolhexakisphosphate, IP6) merupakan sumber fosfat dalam
tanaman yang mencapai lebih dari 80 % dari total fosfor pada tanaman sereal dan
legum (Keruvuo et al. 2000). Fitat diduga terkait dengan penyimpanan energi dan inisiasi dormansi pada benih. Sintesis fitat berlangsung saat pengisian biji dan
berhenti saat fase awal perkecambahan, namun peranannya pada jaringan tanaman
non reproduksi belum jelas.
P yang terdapat dalam fitat sukar untuk digunakan tanaman (Greiner
2005a) dan baru dapat dilepaskan bila ada aktivitas enzim fitase. Namun tidak
semua tanaman dapat menghasilkan fitase. Beberapa jenis tanaman yang
diketahui dapat menghasilkan fitase adalah kacang hijau, kedelai, gandum, dan
padi (Kyriakidis et al. 1998). Aktivitas fitase pada tanaman tebu (cv. PSJT 94-33, cv. PA 183, dan cv. Triton) secara alami sangat rendah yaitu kurang lebih
0.01 U/ml (Wulandari 2005). Guna menghasilkan tebu dengan aktivitas fitase
yang tinggi, maka perlu dilakukan rekayasa secara genetika melalui donor lain
selain genus dan spesies dari Saccharum. Transfer gen dari donor yang tidak satu spesies telah umum dilakukan secara non konvensional seperti fusi protoplas, fusi
injeksi, dan sonifikasi).
Upaya perbaikan genetik pada tanaman tebu secara konvensional sulit
dilakukan karena tingginya tingkat poliploid tanaman tebu (Gilbert et al. 2005). Dengan pertimbangan tersebut, maka lebih menjanjikan bila upaya perbaikan
genetik dilakukan melalui rekayasa genetika, misalnya dengan transformasi.
Proses transformasi dengan mediasi Agrobacterium tumefaciens paling sering digunakan untuk memasukan gen asing ke dalam sel tanaman dengan tingkat
keberhasilan dan kestabilan gen yang tinggi (Riva et al. 1999). Teknik transformasi Agrobacterium memiliki keunggulan, antara lain (1) efisiensi transformasi dengan salinan gen tunggal lebih tinggi dan (2) dapat dilakukan
dengan peralatan laboratorium yang sederhana. Gen dengan salinan tunggal lebih
mudah dianalisa dan biasanya bersegregasi mengikuti pola pewarisan Mendel
(Rahmawati 2006). Keberhasilan transformasi Agrobacterium masih terbatas pada genotipe tanaman tertentu. Saat ini transformasi pada tanaman monokotil
(seperti tebu) sangat mungkin untuk dilakukan. Keberhasilan transformasi pada
jaringan meristem tebu terkait dengan laju kemampuan bertahan hidup dari sel
target (Riva et al 1999). Santosa et al. (2004a), telah berhasil mengembangkan suatu metode yang tepat untuk transformasi gen fitase pada tanaman tebu dengan
menggunakan Agrobacterium tumefaciens GV 2260.
Beberapa peneliti dari IPB telah berhasil menyisipkan gen fitase asal bakteri
dengan menggunakan metode Santosa (2004a) melalui Agrobacterium tumefaciens GV 2260 (pBin1-ECS) pada kultivar tebu cv.PSJT 9443, cv. PA 183 cv. Triton (Wulandari 2005), cv. CB 6979, dan cv. PA 183 (Hayatyzul 2007).
Penyisipan gen fitase melalui Agrobacterium tumefaciens GV2260 dengan konstruksi gene cassette berbeda yaitu pBinPI-IIEC juga telah dilakukan pada tebu cv. PSJT 94-33, cv. BR 194 (Ananda 2004), cv. PSJT 94-33, cv.PSJT 94-41,
cv. PA117 (Pesik 2005), dan cv. PS 851 (Nurhasanah 2007).
Penyisipan gen fitase ini diharapkan mampu menghasilkan enzim yang
dapat mengubah fitat dalam jaringan maupun di sekitar perakaran menjadi fosfat
kadar fitat dalam tanaman menjadi rendah. P tersedia yang meningkat dalam
tanaman diharapkan dapat meningkatkan laju fotosintesis, serta berpengaruh
positif dalam proses pembentukan klorofil.
Keberhasilan penyisipan gen fitase ini dapat dideteksi secara dini dengan
menggunakan PCR. Ananda (2004) dan Nurhasanah (2007) telah melaporkan
pada tebu cv. PSJT 94-33, cv. BR 194; dan cv. PS 851 yang ditransformasi
Agrobacterium tumefaciens GV2260 dengan konstruksi gene cassettep BinPI-IIECdapat dideteksi dengan PCR yang menghasilkan pita ukuran 900 bp dengan
primer EC1 dan EC3.
Tanaman tebu yang berhasil disisipi gen fitase diharapkan dapat
mengekpresikan aktivitas fitase yang tinggi. Penelitian mengenai ekspresi gen
fitase pada tanaman tebu yang telah disisipi gen fitase belum banyak diketahui.
Ini merupakan pijakan penting untuk mengetahui ekspresi gen fitase pada
beberapa kultivar tanaman tebu hasil transformasi. Ekspresi berupa aktivitas
enzim fitase akan memberikan pengaruh langsung terhadap kadar P total dalam
jaringan tanaman plantlet tebu dan juga berpengaruh terhadap pembentukan
klorofil.
Selama ini regenerasi kalus tebu transforman yang disisipi gen fitase
umumnya menghasilkan plantlet yang memiliki kandungan klorofil sedikit bahkan
albino. Hasil regenerasi yang menghasilkan plantlet yang berwarna hijau hanya
sedikit. Dewi (2003) menyatakan pemberian poliamina (seperti: putresina) ke
dalam media kultur dapat meningkatkan regenerasi kalus menjadi tanaman hijau
pada kultur antera tanaman padi. Hal tersebut menjadi pertimbangan dan
diharapkan terjadi peningkatan tanaman hijau pada tebu hasil transformasi dengan
penambahan poliamina.
Plantlet tansgenik yang diperoleh pada akhirnya dilakukan aklimatisasi pada
lingkungan yang sesuai. Banyak faktor yang mempengaruhi keberhasilan dalam
aklimatisasi ini, seperti kadar klorofil plantlet, vigor plantlet, kelembaban, suhu,
dan lain-lain. Setiap individu memiliki kemampuan adaptasi terhadap lingkungan
baru yang berbeda. Diharapkan dengan metode aklimatisasi yang tepat, maka
penelitian yang lebih mendalam bagi pengembangan sistem regenerasi tanaman
tebu secara in vitro yang merupakan target transformasi, metode dan teknik yang tepat dalam melakukan transformasi, serta aklimatisasi yang tepat bagi tebu
transgenik di lapangan.
Tujuan Penelitian
Tujuan penelitian secara umum adalah untuk memperoleh tanaman tebu
yang memiliki aktivitas fitase yang tinggi dari gen fitase yang disisipkan melalui
proses transformasi. Tujuan penelitian secara khusus adalah: (1) mengembangkan
dan mempelajari regenerasi tanaman tebu secara in vitro yang meliputi induksi dan multiplikasi kalus, inisiasi dan multiplikasi tunas, induksi perakaran dengan
pemberian ZPT yang tepat; (2) mempelajari dan mengkaji proses transformasi
beberapa kultivar tebu yang disisipi gen fitase bakteri melalui Agrobacterium tumefacens GV 2260 (pBinPI-IIEC), serta mendeteksi keberadaan gen yang disisipkan dengan PCR; (3) mengkaji dan mempelajari pengaruh putresina
terhadap kadar klorofil plantlet tebu hasil transformasi; (4) mengkaji aktivitas
fitase serta pengaruhnya terhadap P total jaringan dan kadar klorofil plantlet tebu
hasil transformasi; serta (5) mengembangkan dan mempelajari teknik aklimatisasi
plantlet tebu hasil transformasi serta ekspresinya di lapangan.
Manfaat Penelitian
Secara umum manfaat penelitian ini adalah memperoleh tanaman tebu
transgenik yang memiliki aktivitas fitase yang tinggi. Manfaat penelitian secara
khusus adalah: (1) memberikan informasi berupa respon 3 kultivar tebu terhadap
pemberian ZPT yang tepat untuk menginduksi pembentukan kalus, tunas, dan
akar tebu, serta interaksi antara kultivar dan konsentrasi yang diberikan;
(2) memberikan kontribusi dalam bentuk sumber plasma nutfah yang berharga
bagi pemuliaan tanaman bila berhasil mendapatkan tanaman tebu yang
mengekspresikan aktivitas fitase tinggi; (3) mengetahui perbedaan variasi antara
tebu transgenik dan non transgenik; dan (4) diharapkan tanaman tebu hasil
Alur pemikiran
Hal yang menjadi alur pemikiran penelitian ini adalah:
(1) Salah satu masalah utama dalam perpindahan penanaman tebu dari lahan
basah ke lahan kering adalah keterikatan P. Keterikatan P bukan saja
terdapat pada tanah tetapi juga pada jaringan tanaman.
(2) Enzim fitase dapat melepaskan keterkaitan P baik pada lingkungan rizosfer
maupun pada jaringan tanaman
(3) Tanaman tebu dari genu Saccharum mempunyai aktivitas fitase yang
rendah sehingga perlu peningkatan enzim fitase melalui penyisipan gen
fitase yang berasl dari sumber lain
(4) Penyisipan gen fitase yang efisien dari sumber lain memerlukan proses
transformasi tanaman melalui Agrobacterium tumefaciens
(5) Proses transformasi yang berhasil harus melalui tahap regenerasi,
transformasi, ekspresi gen, dan aklimatisasi
(6) Kegagalan aklimatisasi tanaman tebu transgenik disebabkan oleh
albinisme atau kekurangan klorofil.
Strategi Penelitian
Berdasarkan alur penelitian tersebut, maka disusun strategi penelitian
sebagai berikut:
(1) Regenerasi tebu secara in vitro.
(2) Penyisipan gen fitase pada tanaman tebu melalui Agrobacterium tumefaciens GV 2260.
(3) Peningkatan klorofil plantlet tebu hasil transformasi dengan menggunakan
putresina.
(4) Ekspresi gen fitase pada beberapa kultivar tebu hasil transformasi
(5) Aklimatisasi plantlet tebu hasil transformasi.
Gambar 1 .Skema strategi penelitian ’Penyisipan gen fitase pada genome beberapa kultivar tebu, regenerasi, ekspresi dan aklimatisasinya’.
Tujuan:
1 menguji konsentrasi kanamisin sebagai penanda tebu transforman
2 mempelajari dan mengkaji proses transformasi 3 mendeteksi integrasi gen fitase dalam genom tebu. Output: kalus transgenik putatif
vitro
Tujuan: Mengkaji
konsentrasi ZPT 1 mengkaji
konsentrasi 2.4 D yang terbaik untuk pembentukan kalus 2 mengkaji konsentrasi BAP yang terbaik untuk pembentukan tunas 3 mengkaji konsentrasi IBA yang terbaik untuk pembentukan akar
Output: kalus dan plantlet tebu untuk materi penelitian dan informasi ZPT yang tepat untuk regenerasi tebu transgenik dan non transgenik
III. Peningkatan klorofil plantlet tebu hasil transformasi dengan pemberian putresina
Tujuan: meningkatkan klorofil tanaman tebu hasil transformasi dengan menggunakan putresina.
Output :
Plantlet tebu transgenik putatif dengan klorofil yang baik
IV. Ekspresi gen fitase bakteri pada beberapa kultivar tebu hasil transformasi.
Tujuan: mengkaji aktivitas fitase plantlet tebu hasil transformasi serta pengaruhnya terhadap P total jaringan dan kadar klorofil
Output: Informasi ekspresi gen fitase tebu transgenik putatif Plantlet transgenik putatif
Tujuan:
1 Mengembangkan dan mempelajari regenerasi tanaman tebu secara in vitro (induksi dan multiplikasi kalus, inisiasi dan multiplikasi tunas, induksi perakaran ) dengan pemberian ZPT yang tepat
2 Mempelajari dan mengkaji proses transformasi beberapa kultivar tebu yang disisipi gen fitase bakteri melalui Agrobacterium tumefacens GV 2260(pBinPI-IIEC), serta mendeteksi keberadaan gen yang disisipkan;
3 Mengkaji dan mempelajari pengaruh putresina terhadap kadar klorofil plantlet tebu hasil transformasi
4 Mengkaji aktivitas fitase serta pengaruhnya terhadap P total jaringan dan kadar klorofil plantlet tebu hasil transformasi
5 Mengembangkan dan mempelajari teknik aklimatisasi plantlet tebu hasil transformasi serta ekspresinya di lapangan.
V. Aklimatisasi plantlet tebu hasil transformasi. Tujuan:
1 mengkaji dan mempelajari aklimatisasi tebu hasil transformasi gen fitase bakteri
2 mengevaluasi ekspresi gen dan kadar klorofil tebu transgenik putatif di lapangan
BAB II TINJAUAN PUSTAKA
Tanaman Tebu
Tanaman tebu (Saccharum officinarum) dibudidayakan sebagai tanaman komersial pada hampir 60 negara di dunia. Negara penghasil tebu utama adalah
Brazil, Cuba, Fiji, India, Indonesia, Mauritius dan Amerika. Tanaman tebu
diklasifikasikan ke dalam famili Graminae; kelompok Andropogone; genus:
Saccharum. Hanya 3 genus dari 5 genus Saccharum yang dibudidayakan yaitu: (1) S. officinarum (yang merupakan penghasil gula utama); (2) S. sinensis, (3) S. barberi, dan wild type terdapat 2 genus yaitu: (4) S. spontaneum, dan (5) S. robustum. Tebu dari genus S. sinensis, S. barberi, dan S. spontaneum memiliki kadar gula sedang hingga rendah (Naik 2001).
Pusat asal dan perkembangan tebu dunia diduga berada di New Guinea
dan pulau-pulau di sekitar Indonesia untuk S. officinarum dan S. robustum; di India sampai ke perbatasan Utara-Timur China dan Myanmar untuk S. spontaneum dan kerabat rerumputan lainnya seperti Erianthus sp., Sclerostachya sp., Narenga sp. dan sebagainya (Sugiyarta 1993). Naik (2001) mengemukakan bahwa India adalah asal dari tebu-tebu yang dibudidayakan di Indonesia. Kata
‘sakara’ yang berarti gula berasal dari Bahasa Sansekerta telah ada dalam catatan
Budha pada 500 tahun SM.
Guna memperoleh genotipe baru dalam program pemuliaan tanaman tebu
sangat tergantung pada rekombinasi dan segregasi progeni dari individu
heterosigot. Tanaman tebu merupakan allopoliploid dengan n = 5,6,7,8,9
(Hetharie 2003). Berdasarkan penelitian para ahli, di India ditemukan tanaman
tebu oktoploid (2n = 80) dengan jumlah dasar x = 10 kromosom yang merupakan
hasil persilangan tipe liar Sclerostahya fusca dengan Saccharum officinarum. Kultivar tebu modern adalah aneuploids dan memiliki jumlah kromosom
100-125 dimana 5-10% merupakan hasil persilangan kerabat liar S. spontaneum dan
S. officinarum (Alexander 1973).
officinarum ditemukan sekitar 80 kromosom. Kromosom pada S. robustum
terdiri dari 2 tipe yaitu berkromosom 60 dan 80. Sementara tebu-tebu komersial
umumnya memiliki jumlah kromosom 80 – 120. Diduga kromosom dasar genus
Saccharum adalah 10 (Alexander 1973).
Total produktivitas gula Indonesia yang berasal dari tebu pada tahun 2002
yaitu 5.01 gula ton ha-1 (Pakpahan dan Supriono 2005), dan menurut BPS (2004)
produktivitas tebu di Indonesia rata-rata 5.5 gula ton ha-1. Produktivitas tersebut
masih memiliki potensi untuk dapat ditingkatkan menjadi 14.1 ton ha-1 (Pakpahan
dan Supriono 2005).
Penelitian dan pemanfaatan plasma nutfah tebu di Indonesia mulai
dilakukan sejak tahun 1888 ketika ledakan serangan penyakit sereh. Kultivar
Kasoer yang merupakan hasil persilangan alami S. officinarum dan S. spontaneum
yang memiliki keunggulan toleran terhadap penyakit sereh tersebut. Nobilasi
tebu-tebu komersial berasal dari S. officinarum dengan S. spontaneum dan atau S. robustum. Sejak tahun 1888 sampai tahun 1960, Indonesia sangat terkenal di dunia dalam pemuliaan tanaman tebu dengan Balai Penelitian Tebu di Pasuruan,
Jawa Timur (POJ = Proefstation Oost Java). Tahun 1940-1960, klon tebu POJ
terkenal di dunia dan dari turunan POJ 2878 tersebut dihasilkan klon tebu Hawai
yang terkenal seperti: H32-8650, H32-1063 dan H37-1933. POJ 2878 berupa
turunan dari asal silangan S. officinarum dengan S. spontaneum, sedangkan klon-klon tebu Hawai berasal dari silangan POJ 2878 dengan S. robustum ( Ochse et.al.
1961). Sesudah tahun 1960, keunggulan Indonesia dalam penelitian tebu maupun
produksi gula mengalami penurunan. Teknik pemuliaan konvensional telah
dikembangkan untuk meningkatkan hasil tanaman dengan menyeleksi
kultivar-kultivar yang lebih produktif dan tahan terhadap beberapa penyakit. Pemuliaan
konvensional memiliki beberapa kelemahan, diantaranya di dalam populasi
tanaman yang dinyatakan unggul ternyata tidak semuanya seperti yang
diharapkan.
Tebu cv. PS 851 merupakan salah satu varietas yang menonjol dari
beberapa varietas yang telah dilepas tahun 1998 dan menunjukkan rendemen yang
lapangan mulai terlihat dan produktivitasnya mulai menurun. Hal ini tampak dari
keragaan pada pertanaman keprasan kurang baik dan peka terhadap penyakit luka
api sehingga hasil tebunya menurun tajam. Keragaan tanaman tampak nyata
menurun apabila mengalami kekurangan air. Oleh karena itu perlu dicarikan suatu
kultivar pengganti mempunyai potensi rendemen yang setara namun dapat
mengatasi kelemahan cv. PS 851 (Budhisantosa et al. 2007).
Tebu cv. Triton memiliki sifat ketahanan yang intermediet terhadap
penyakit daun hangus yang disebabkan oleh cendawan Stagnospora saccari
(Irawan 1990). Hasil tebu cv. Triton pada tahun pertama adalah 117 ton ha-1;
dengan rendemen 7.04 %; dan merupakan kultivar yang diintroduksi dari
Australia (Subarkat et al. 1988). Kultivar tebu yang ditanam di Indonesia rata-rata memiliki rendemen 6.4 % (Basuki 2000). Tebu cv. PSJT 94-41 merupakan
klon tebu harapan koleksi dari P3GI hasil persilangan pada tahun 1994, klon
nomor 41 dan belum dirilis. Klon ini adalah turunan dari BT 1323 yang
merupakan hasil perilangan dari PS 56 dengan BT 809 (Hermono, komunikasi
pribadi 3 Desember 2007).
Tebu cv. PA 175 merupakan klon tebu koleksi dari Puslit Agro P.T.
Rajawali II, Cirebon. Deskripsi dan morfologi varietas tebu yang digunakan
dalam penelitian ini dapat dilihat pada Lampiran 4.
Kultur Jaringan Tebu dan Poliamina Kultur jaringan tebu
Teknik perbanyakan in vitro untuk pengadaan bahan tanaman perkebunan mempunyai beberapa keunggulan yaitu adanya perbaikan mutu genetis, fisiologis,
dan kemurnian yang cukup tinggi. Budidaya tebu menghendaki pengadaan benih
yang bebas hama dan penyakit untuk menghindari degradasi klonal yang
disebabkan oleh sistem keprasan berulang. Benih yang bermutu serta bebas hama
dan penyakit tersebut dapat diperoleh melalui teknik kultur jaringan. Keuntungan
lain dari kultur jaringan yaitu dapat dilakukan seleksi terhadap sifat-sifat tanaman
yang dikehendaki secara dini. Selain itu, kondisi lingkungan tempat tumbuh
individu mini tersebut dapat dikontrol sesuai dengan keperluan (Haris dan
peranan yang sangat menonjol dalam perbanyakan tanaman secara in vitro. Auksin berperan dalam mendorong perpanjangan sel, pembelahan sel, diferensiasi
jaringan xilem dan floem, pembentukan akar adventif, dan dominansi apikal.
Peran fisiologis sitokinin adalah mendorong pembelahan sel, morfogenesis,
pertunasan, pembentukan kloroplas, pematahan dormansi, pembentukan stomata,
menghambat senesence dan absisi (Tim Laboratorium Kultur Jaringan Tanaman 1991; Gunawan 1987; dan Pierik 1987).
Perimbangan auksin dan sitokinin pada eksplan akan menentukan jenis
organ yang terbentuk. Bila nisbah auksin dan sitokinin tinggi, maka organ akar
yang terbentuk; sedangkan bila sebaliknya maka tunas yang akan terbentuk.
Peranan penting auksin dan sitokinin adalah untuk memprogram kembali sel
somatik yang akan menentukan tahap dediferensiasi selanjutnya. Pemprograman
ulang menyebabkan dediferensiasi dan rediferensiasi menuju perkembangan
lintasan baru. Rediferensiasi menghasilkan sel-sel meristem yang akan
berkembang menjadi sel embriogenik dan embrio somatik (Gaba 2005).
Regenerasi melalui embrio somatik memberikan keuntungan: (1) waktu
perbanyakan cepat; (2) pencapaian hasil dalam mendukung program perbaikan
tanaman lebih cepat; dan (3) jumlah bibit yang dihasilkan tidak terbatas
jumlahnya (Mariska 1996). Pembentukan embriogenesis somatik dipengaruhi
oleh beberapa faktor, antara lain: formulasi media yang berbeda pada setiap
perkembangan embrio somatik serta jenis eksplan yang digunakan.
Penginduksi kalus tanaman tebu dapat dilakukan dengan menambahkan 3
mg l-1 2,4 D ke dalam media MS, dan kalus yang dihasilkan secara morfologi
menghasilkan 2 tipe kalus. Tipe kalus yang pertama adalah tipe A yang memiliki
ciri warna putih kekuningan, kompak, kering dan nodular; dan tipe kalus kedua
yaitu tipe B yang memiliki penampakan ‘globular’ yang agak putih, tidak kompak dan basah (Khatri et al. 2002). Kalus-kalus tersebut bisa diinduksi dari eksplan pucuk, jaringan daun dan bunga tebu yang akan terbentuk 1 bulan setelah
pemberian auksin 2.4 D (Alexander 1973).
Inisiasi tunas dan akar pada kultur tebu dapat dilakukan dengan secara
akar) atau secara bersamaan (menambahkan auksin dan sitokinin pada media yang
sama untuk merangsang inisiasi tunas dan akar secara bersamaan). Kelemahan
penginduksian tunas dan akar pada media yang sama yaitu tunas dan akar yang
terbentuk bisa saja tidak merupakan satu kesatuan plantlet. Penginduksian tunas
dan akar tidak pada media yang sama akan menghasilkan tunas dan akar yang
lengkap sebagai suatu kesatuan plantlet.
Gallo-Meagher (2000) meregenerasikan tunas tanaman tebu dari kalus
dengan menggunakan thidiazuron (TDZ) dalam media MS dengan kombinasi 2.3
μM 2,4-D, atau 9.3 μM kinetin dan 22.3 μM NAA dan dibandingkan dengan perlakuan pada media MS lainnya tetapi diberi tambahan 0.5, 1.0, 2.5, 5.0 atau
10.0 μM TDZ. Pemberian TDZ ternyata lebih cepat dalam merangsang
pembentukan tunas dibandingkan dengan kinetin atau NAA. Penelitian lain yang
dilakukan oleh Khatri et al. (2002), yaitu dengan menginduksi tunas tanaman tebu melalui pemberian 2 mg l-1 IBA + 2 mg l-1 IAA dan 2 mg l-1 kinetin pada
media MS. Regenerasi dimulai dengan tampaknya titik hijau dari kalus setelah
seminggu dalam media regenerasi dan umumnya menghasilkan batang dan daun
yang normal.
Guna menginduksi pembentukan akar, Gallo-Meagher (2000)
menambahkan 19.7 μM indole-3-butyric acid (IBA) ke dalam media. Sementara,
Khatri et al. (2002) melakukan penelitian dengan menggunakan media MS yang ditambahkan IBA 1 mg l-1 dan sukrosa 6 % untuk menginduksi perakaran
pada tebu. Baksha et al. (2002) menginduksi pembentukan akar pada tanaman tebu dengan menggunakan ½ MS yang ditambahkan 5.0 mg l-1 NAA, IBA and
IAA.
Regenerasi eksplan tanaman yang ditransformasi gen fitase selama ini
menghasilkan plantlet yang albino (putih) atau hijau muda. Regenerasi kalus
transforman tebu yang dilakukan oleh Pesik (2005) pada kultivar PSJT 9443
dengan menggunakan media R4 yang diberi IAA 1 mg l-1 dan Dalapon 61 mg l-1
dapat menginduksi pertumbuhan tunas dan daun transforman, namun
Poliamina yang biasanya terdapat dalam tumbuhan adalah
diamin-putresina, triamin-spermidina dan tetramin-spermina merupakan zat pengatur
tumbuh yang berperan dalam pertumbuhan dan perkembangan tanaman; misalnya
pada kultur jaringan wortel dan antera jagung, poliamina berperan dalam
menginduksi embrio somatik (Dewi 2003). Terdapat 2 lintasan dalam biosintesis
putresina yaitu melalui ODC (ornithine dekarboksilase) dan ADC (arginin
dekarboksilase). Adapun bagan biosintesis poliamina, metabolisme, fungsi dan
interaksi dengan etilen dapat dilihat pada Gambar 2.
Citruline Gramnithine Agmatine ADC Arginin ODC Putrescine Spermidine Spermine Fungsi Perkembangan tunas Menghambat produksi etilen Pertumbuhan dan
Glutamat N-Carbonyl-putresci ne
Pyrroli ne Succi nate
dSAM
Diaminopropane
Amino propyl propane
SAM MTA
Methionin
ACC
diferensiasi sel N malonyl
ACC
Etilen
MACC
Fungsi Menghambatproduksi
poliamin Absisi Si ntesis Pemasakan buah Perkecambahan Pembungaan Menghambat senesens Menghambat degradasi klorofil dan albinosisasi In vitro tuberization
In vitro flowering
[image:34.612.134.503.273.612.2]Memacu degradasi klorofil dan albinosisasi
Sepertinya, lintasan ADC lebih sering berperan dalam pembentukan
putresina dalam kondisi cekaman. Sebagai contoh: pada kalus jagung turunan
putresina dari arginin ditemukan dalam fraksi konjugasi larutan asam, sedangkan
ODC tampak aktif dalam biosintesis hydroxycinnamoyl amida pada kalus
tembakau. Tahap awal perkembangan putresina bebas umumnya diturunkan
melalui ADC, kemudian ODC terlibat pada tahap berikutnya (Smith 1990).
Menurut Setijorini et al. (2001), poliamina mampu mencegah degradasi klorofil dan sebagai senyawa kompetitor dalam biosintesis etilen. Sintesis poliamina
akan mampu menekan sintesis etilen karena adanya persaingan dalam pemakaian
substrat yang sama yaitu: S-adenosilmetionin (SAM). Poliamina juga
menghambat aktivitas enzim 1-aminosiklopropana-1-asam karboksilat (ACC)
sintase yang mengkatalisis perubahan SAM ke ACC dan enzim ACC oksidase
yang mengkatalisis konversi ACC ke etilen (Smith 1990).
Sumber kelompok propylamino untuk biosiontesis poliamin yaitu SAM
merupakan prekusor dari ACC yang merupakan sumber penting pembentukan
etilen. Kedua komponen tersebut (poliamin dan etilen) bersifat antagonis.
Poliamin akan memacu pertumbuhan dan menghambat senesens, sedangkan etilen
merupakan horman yang memicu senesens (Altman 1989, Galston dan
Kaur-Sawhney 1987; Wattimena 1988).
Dewi (2003) menyatakan bahwa putresina mampu meningkatkan kalus
dan regenerasi kultur anther padi secara efisien dibanding pemberian spermidina
atau spermina. Pemberian 10-3 M putresina pada media induksi kalus dan
regenersi akan meningkatkan androgenesis pada antera padi sub spesies indica.
Purwoko et al. (2000) melaporkan bahwa penambahan putresina 10-3 M pada media induksi kalus dan regenerasi yang digunakan dalam kultur antera padi
memberikan hasil induksi kalus dan regenerasi yang lebih baik. Hal sejalan juga
dilakukan oleh Hanarida et al. (2002) yang menginduksi pembentukan kalus dan melakukan regenerasi kultur antera pada silangan padi tipe baru. Santos et al.
(1996) menyatakan pula bahwa poliamina berperan dalam morfogenesis polen
Poliamina fungsinya berlawanan dengan etilen, yaitu menghambat senesens pada
jaringan tanaman tetapi tidak mempengaruhi respirasi. Poliamina berperan dalam
pembelahan sel, embriogenesis pada kultur in vitro, inisiasi akar, pembentukan tunas, inisiasi bunga, pembentukan dan pemasakan buah, respon terhadap stres
dan meningkatkan kompleks poliribosome. Selain itu, poliamina juga berperan
dalam sintesis protein pada beberapa organisme dan mendorong pembentukan
klorofil serta bersinergi dengan auksin (Wattimena 2002).
Peranan P pada pertumbuhan tanaman
Unsur P merupakan unsur esensial untuk setiap sel hidup, karena secara
langsung terlibat dalam sebagian besar proses-proses metabolisma. Fungsi P
adalah sebagai komponen penyusun struktur molekul asam nukleat (DNA, RNA),
gula fosfat (metabolisme intermediet tanaman), nukleotida (ATP, CTP, UTP,
GTP,TTP), koenzim, fosfolipid (membran sel). Umumnya, Pi dalam banyak
reaksi merupakan substrat dan atau produk yang dihasilkan. Pi mengontrol
beberapa reaksi enzim, serta penting dalam lintasan metabolik di sitoplasma dan
kloroplas (Marschner 1995).
Peranan P dalam tanaman adalah: (1) dalam pembentukan bunga, buah dan
biji, (2) pembelahan sel, pembentukan lemak dan albumin, (3) kematangan
tanaman dan mengimbangi pengaruh N, (4) perkembangan akar halus dan akar
rambut, (5) memperkuat tanaman sehingga tidak mudah rebah, (6) meningkatkan
kualitas tanaman terutama pada rumputan dan sayuran, (7) meningkatkan
ketahanan terhadap penyakit (Soepardi 1979).
Fosfor (P) bersama N, K digolongkan sebagai unsur-unsur utama walau P
diadsorbsi lebih kecil dari N dan K. Fosfor berperan dalam pemecahan
karbohidrat, protein dan lemak. Pembelahan sel serta pembentukan ATP dan
ADP yang berenergi tinggi sehingga dapat merangsang pertumbuhan tanaman. P
berperan dalam pembelahan sel melalui nukleoprotein yang ada dalam inti sel,
meneruskan sifat-sifat kebakaan dari generasi ke generasi melalui peranan DNA
dan mempengaruhi perkembangan akar khususnya akar lateral dan akar
Sutandi, 1999). Ketersediaan suatu unsur hara dengan unsur hara lainnya akan
saling mempengaruhi, sebagai contoh: di dalam tanah hara P dapat difiksasi oleh
Al di dalam larutan tanah sehingga menjadi bentuk tidak tersedia di dalam
jaringan sehingga tanaman mengalami defisiensi P.
Fosfor terdapat dalam sebagian besar tubuh tanaman dalam konsentrasi 0.1 –
0.4 %. Tanaman mengabsorbsi P dalam bentuk ion ortofosfat primer (H2PO4-);
H2PO42-; PO43-. Bentuk ion H2PO4- diserap paling banyak oleh tanaman karena
memiliki kelarutan yang paling tinggi sehingga menyebabkan fosfor menjadi
tersedia bagi tanaman. Kekurangan P akan menghasilkan tanaman yang
berukuran kecil-kecil, tulang daun menjadi ungu dan tepi daun menjadi hijau
kelabu (Hidayat 2005).
Tanaman jenis rumput-rumputan yang mengalami defisiensi P akan memiliki
pertumbuhan anakan yang terhambat, daun pendek dan kecil dengan warna daun
hijau tua, klorosis pada tulang daun, daun muda akan nampak sehat dibanding
daun tua yang akan berwarna coklat pada bagian bawah atau ujung daun; daun
berwarna kemerahan atau ungu pada varietas yang mengandung antosianin
(Leiwakbessy dan Sutandi, 1999).
Fitat dan Fitase
Mineral nutrisi dalam biji umumnya disimpan dalam bentuk fitat.
Kandungan fitat dari total berat kering pada biji tanaman mencapai 1-8 %, dan
dari 1-8 % fitat tersebut 90 % merupakan bentuk fosfor. Selain itu, Mg2+, K+,
Ca2+, Mn2+, Ba2+, dan Fe2+ juga berasosiasi dengan kelompok fosfat membentuk
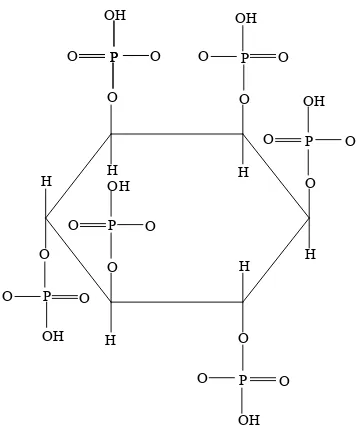
fitat. Adapun struktur dari fitat dapat dilihat pada Gambar 3. Lintasan biosintetik
fitat belum sepenuhnya diketahui (Gambar 4). Buchanan et al. (2006) menyatakan bahwa terdapat dugaan fitat disintesis pada retikulum endoplasma kasar (rough
ER) dan diakumulasi dalam lumen tilakoid. Kemudian fitat ditransportasi oleh
O O PP
O
O O P O
[image:38.612.230.409.77.290.2]O OH O O P P O OH O O OH O O P O O O OH P O H H H H H H
Gambar 3 Struktur fitat (Glick dan Pasternak 2003).
myo-inositol (mI)
myo-inositol phosphatase -1--inositol myo phosphatse synthase Glukosa 6-P -1-P -inositol myo Pi ATP myo-inositol kinase ADP
mI 1,3,4,5,6-P5 (IP5) mI P3
1 2 3
ATP ADP 2 ATP
ADP 'X' ? ? ? Phosphoinositol kinase mI-P-X mI P6-X ATP ADP ? 5 5 2
myo-inositol hexaphosphoric acid (phytic acid) ATP
ADP
? IP5 kinase
Chelation with cation
[image:38.612.135.505.151.668.2]Phytate 3 3 ? 'X' ATP ADP
Gambar 5 Skema sintesis dan penyimpanan fitin dalam protein bodies pada endosperm kacang castor. Fitin dilepaskan dalam vesicles (1,2) dari ER menuju vacuola/protein body, kemudian bergabung dengan membran (3,4). Fitin dilepaskan menuju vacuola/protein body (5) dimana akan bergabung membentuk globoid (Buchanan 2006).
P O3H2O
P O3H2O OP O3H2
OP O3H 2 OP O3H2
OP O3H2 OH OP O3H2 OH OP O3H2 P O3H2O P O3H2O Fitase HO P O3H2O OP O3H2 OH OH OH P O3H2O OP O3H2
OH OP O3H2 OH OH
P O3H2O
P O3H2O OP O3H2
OP O3H2 OP O3H2 OH
OH OH OH
OP O3H2
HO HO HO HO OH OH OH OH Fitase Fitase Fitase Fitase Fitase
mempunyai kemampuan untuk mengikat kation-kation multivalen seperti kalsium,
besi, seng dan sebagainya dalam suatu kompleks yang tidak larut membentuk
garam-garam fitat seperti Na2Mg5-fitat, K2Mg5-fitat atau CaMg5-fitat (fitin). Fitin
dalam tanah bertabiat fosfat an organik membentuk besi, aluminium dan kalsium
fitat. Dalam tanah asam, fitat berubah menjadi tidak larut, dan tidak tersedia
karena bereaksi dengan besi P Al. Dalam keadaan alkalin kalsium fitat
diendapkan dan fofor yang dikandung berubah menjadi tidak teredia (Buckman
dan Brady 1982). Adapun skema sintesis dan penyimpanan fitin dalam protein bodies pada endosperm kacang castor dapat dilihat pada Gambar 5.
Fitat sangat berperan dalam penurunan jumlah kation multivalen seperti
Ca2+, Mg 2+, Zn2+, dan Fe3+. Asam fitat juga terikat dengan beberapa mineral dan
protein sehingga membentuk suatu kompleks suatu fitat-protein-mineral yang
sukar larut yang mengakibatkan ketersediaan biologis mineral-mineral tersebut
rendah (Graf 1983; Indarwati 2000).
Fitat (inositolhexakisphosphate, IP6) merupakan sumber fosfat dalam
tanaman yang mencapai lebih dari 80 % dari total fosfor pada tanaman sereal dan
legum (Keruvuo et al. 2000). Fitat diduga terkait dengan penyimpanan energi dan inisiasi dorman pada benih (Hulke et al. 2004). Sintesis fitat berlangsung saat pengisian biji dan berhenti saat fase awal perkecambahan, namun peranannya
pada jaringan tanaman non reproduksi belum jelas.
Hidrolisis phosphomonoester berkaitan dengan metabolisme energi dan
regulasi metabolik serta lintasan sinyal transduksi pada tingkat sel. Hidrolisis
phosphomonoester dikatalisis oleh grup enzim yang beragam yang termasuk
dalam kelompok enzim phosphatase. Enzim tersebut dapat diklasifikasikan
antara lain: alkaline phosphatase, purple acid phosphatases, high molecular acid
phosphatases, low molecular acid phosphatases, dan protein phosphatase. Tetapi kelompok enzim ini tidak dapat menghidrolisis phosphomonodiester pada asam
fitat. Kelas enzim spesifik yang dapat menghidrolisa asam fitat adalah fitase
(Keruvuo, et al. 2000; Greiner 2005).
hexakisphosphate/InsP6) menghasilkan ortofotat dan myo-inositol
pentakisphosphate (Konietzny dan Greiner 2002), bahkan pada kondisi-kondisi
tertentu menjadi fosfat dan myo-inositol bebas dan dapat menghilangkan sifat pengkhelat dari asam fitat dan melepaskan Pi (Keruvuo et al. 2000). Gambar 6
menunjukkan sekuen reaksi fitase dengan substrat myo-inositol hexakisphosphate menurut Courtis dan Josef (Cosgrove 1980).
Menurut IUPAC-IUB terdapat 2 jenis enzim fitase:
a yang mengkatalis reaksi myo-inositol hexakisphosphate + H2O adalah 3 fitase
(EC.3.1.3.8) →myo-inositol-1,2,4,5,6-pentakisphosphate+ Pi
b yang mengkatalis reaksi myo-inositol hexakisphosphate + H2O adalah 6-fitase
(EC 3.1.3.26) →myo-inositol-1,2,3,5,- pentakisphosphate + Pi
Jenis 3-fitase umumnya terdapat pada mikrob, sedangkan 6-fitase umum terdapat
pada biji-bijian, meskipun demikian dilaporkan bahwa E. coli mampu memproduksi 6-fitase (Grainer et al. 1993)
Fitase pada akar berperan dalam pemanfaatan fitat dalam tanah yang baru
terbentuk. Lokasi fitase pada akar terdapat pada endodermis akar utama (Hubel
dan Beck, 1996). Beberapa jenis tanaman yang diketahui dapat menghasilkan
fitase adalah kacang hijau, kedelai, gandum, padi, dan lain-lain. Fitase juga dapat
ditemukan pada bagian benih atau biji tanaman serealia dan leguminosa,
(Kyriakidis et al. 1998).
Wilcox et al. (2000) berhasil mengembangkan galur mutan kedelai low phytate yang mengandung fitat 1.9 g/kg dan P inorganik 3.1 g/kg dibandingkan dengan kedelai (wild type) yang mengandung fitat ± 4,3 g/kg dan P inorganik 0.7 g/kg. Olthmans et al. (2004) mengemukakan bahwa pada persilangan kedelai antara galur yang memiliki fitat rendah dengan normal fitat (wild type) menunjukkan pewarisan alel wild type yang dominan penuh dan tidak ada efek maternal. Selanjutnya, sifat fitat yang rendah dikontrol oleh alel resesif ’pha1 dan
pha2’ pada dua lokus independent yang menunjukkan duplikat dominan epistasis, dimana untuk mengekspresikan fitat yang rendah alelnya harus resesif homozigot.
Menurut Santosa et al. (2002b) apabila gen fitase dapat ditransformasikan dan terekspresi dalam tanaman tebu, maka gen ini akan menghasilkan enzim yang
metabolisme tanaman tebu. Hasil fotosintesis ini diharapkan akan disimpan
menjadi gula tebu. Berdasarkan hasil penelitian Richardson et al. (2001), tanaman Arabidopsis (wild type) yang ditumbuhkan dalam media fitat memiliki kemampuan yang rendah dalam menggunakan fitat sebagai sumber nutrisi. Lain
halnya dengan tanaman transgenik Arabidopsis yang telah disisipi gen fitase dari cendawan (dibawah kendali konstitutif promotor 35 S CaMV) yang dapat
melepaskan P dari fitat pada media agar steril. Ekspresi fitase tergantung pada pH
media dan sumber C alami yang digunakan (Konietz dan Greiner 2004). Fitat
diperlukan untuk menginduksi aktivitas fitase. Seperti yang telah dilaporkan
Greiner (2005) pada E. coli, induksi fitase secara signifikan dipengaruhi oleh kehadiran myo-inositol sebagai sumber C. Selain itu, kehadiran gula sederhana dapat menjadi strong repression dalam sintesis enzim fitase.
Plasmid dan Konstruksi gene cassette
Konstruksi gene cassette pBinPI-IIEC dan pBinI-ECS yang diintroduksikan ke dalam Agrobacterium tumefaciens GV 2260 telah berhasil dikerjakan pada penelitian sebelumnya (Santosa et al. 2005).
Konstruksi gene cassettepBinPI-IIEC dapat dilihat pada Gambar 7. Plasmid
pBinPI-IIEC ini memiliki beberapa kelebihan diantaranya jumlah salinan dalam
E. coli besar, mempunyai ORI sehingga plasmid dapat bereplikasi pada E. coli
dan Agrobacterium serta membawa nptII yang menyandikan enzim neomycin phosfotransferase (pembawa resistensi terhadap antibiotik golong
aminoglikosida). Gen nptII berintegrasi dan mengendalikan sintesis enzim neomysin phosphotransferase yang menyebabkan sel resisten terhadap antibiotik
Gene cassette p
BinPI-IIEC
pBinPI-IIEC
Keterangan:
CaMV 35 S = Caulimozaic virusderived
SP = Proteinase inhibitor II signal peptide
OCS = Enhancer
Gambar 7 Konstruksi plasmid dan gene cassette pBinPI-IIEC (Santosa et al.
2005)
Terdapat 2 jenis vektor (plasmid tempat T-DNA dan gen) yang dipakai
dalam rekayasa genetika tanaman dengan bantuan Agrobacterium, yaitu:
1 Vektor kointegrasi: T-DNA pembawa gen yang akan ditransfer dan faktor
virulensi berada pada satu plasmid yang sama.
2 Vektor biner: gen yang akan ditransfer ada pada plasmid biner, dan faktor
virulensi berada pada plasmid lain, yaitu Ti atau Ri plasmid non disharmed
(dengan oncogene) atau Ti atau Ri plasmid disharmed (tanpa oncogene). Vektor kointegrasi biasanya sulit untuk direkayasa namun memiliki
kelebihan, yaitu: plasmidnya lebih stabil dalam Agrobacterium. Vektor binner mudah untuk direkayasa dan diintroduksi namun plasmidnya kurang stabil dalam
Promoter
Phy gene appA of E. coli ECL03375
OCS nptII SP
mempunyai ORI yang kompatibel dengan Agrobacterium sehingga memungkinkan plasmid ini mengganda dalam Agrobacterium (Klee et al. 1986).
Transformasi gen
Beberapa teknik yang sering digunakan untuk menyisipkan DNA ke dalam
sel adalah transformasi dengan Agrobacterium tumefaciens, elektroforasi, biolistik, serat silikon, makro dan mikro injeksi, dan sonifikasi. Terdapat
hambatan dalam melakukan transformasi secara fisik karena adanya dinding sel
dan membran plasma. Hambatan tersebut dapat diatasi dengan penggunaan bahan
kimia atau fisik. Efisiensi dari masing-masing teknik transformasi adalah berbeda.
Namun dalam semua teknik transformasi akan menempatkan transgen di bawah
kendali promoter yang sifatnya konstitutif atau yang bisa terekspresi pada
organ-organ spesifik (Skinner et al. 2004).
Kelebihan sistem transformasi melalui A. tumefaciens dibandingkan dengan cara lain secara langsung (misal: gene gun) yaitu, single bacterium dapat memindahkan banyak T-strand, baik dari plasmid binner maupun kointegrasi
(Ebinuma et al. 2001). Selain itu, transformasi melalui A. tumefaciens hanya mengintroduksi sejumlah kecil kopi dari gen asing dengan efisiensi kestabilan
transformasi yang lebih baik bila dibandingkan dengan particle bombartment
ataupun secara elektroforasi. Metode transformasi dengan mediasi A. tumefaciens
lebih sederhana, murah dan mudah diterapkan dalam rekayasa genetika tanaman
(Skinner et al. 2004).
A. tumefaciens adalah bakteri aerob obligat yang merupakan jenis gram negatif yang hidup alami di tanah dan menyebabkan timbulnya penyakit crown gall pada tanaman dikotil. Kemampuan untuk menyebabkan penyakit ini ada hubungannya dengan gen penginduksi tumor (tumor inducing/Ti) dalam sel bakteri tersebut (Sheng dan Citovsky 1996; Hiei et al. 1997). Bila menggunakan metoda transformasi melalui A. tumefaciens, gen-gen baru secara normal akan bergabung dalam genom inti (Skinner et al. 2004). Di inti, DNA tersisipi secara acak dengan potensi penyisipan yang berbeda yang dapat saja terjadi pada inti
yang sama. Penyisipan ini terjadi dalam urutan berpasangan dan dapat
Terdapat tiga komponen utama pada Agrobacterium yang berperan dalam transfer DNA ke dalam sel tanaman yaitu: (1) T-DNA; (2) gen virulensi; dan (3)
gen-gen penghasil protein yang terdapat pada kromosom Agrobacterium (Sheng dan Citovsky 1996). T-DNA, yaitu fragmen yang ditransfer ke sel tanaman.
Ukuran T-DNA berkisar 10-20 bp atau sekitar 5 – 10 % dari ukuran Ti plasmid (Zambrysky et al. 1989). T-DNA berisi dua tipe gen yaitu oncogene (menyandi enzim yang terlibat dalam aktivitas sintesis auksin dan sitokinin, serta
menyebabkan pembentukan tumor) dan gen yang menyandi sintesis opin. Asam
amino dan gula disintesis dan diekresikan melalui sel tumor dan dikonsumsi oleh
A. tumefaciens sebagai sumber karbon dan nitrogen (Riva 1999).
Daerah virulence (vir) pada Agrobacterium berukuran 30 kb yang berada pada plasmid Ti dan Ri dengan posisi bersebelahan dengan batas kiri (left border) T-DNA. Daerah virulence terdiri dari 6 lokus yaitu: virA, virB, virD, virG, virC, dan virE. Gen virA, virB, virD, virG mutlak diperlukan dalam proses transformasi. Jika ada inducer (seperti monosiklik fenolik acetosyringone, dan monosakarida seperti glukosa dan galaktosa), maka virA dan virG akan terekspresi, sehingga mampu mengaktifkan operon vir lain. Kondisi pH optimum untuk gen vir berkisar antara 5-5,8 (Hiei et al, 1997). Gen virC, dan virE diperlukan untuk meningkatkan efisiensi transformasi walau tidak mutlak
diperlukan. Produk dari berbagai gen vir berfungsi sebagai trans dalam proses transfer DNA (Stachel dan Zambrysky, 1986). Kontrol ekspresi gen dimediasi
oleh protein virA dan virG yang merupakan komponen regulatory system (Zupan dan Zambrasky 1995).
Senyawa fenolik saat kokultivasi mampu mengaktifkan gen vir pada Ti plasmid. Permasalahannya, senyawa fenolik jarang terjadi pada tanaman
monokotil, sehingga perlu penambahan acetosyringone. Hal ini seperti yang
dilakukan oleh Mulyaningsih (2001), dengan menambahkan acetosyringone 0,1 M
saat kokultivasi tanaman padi. Selain dengan penambahan acetosyringone,
optimasi kokultivasi dilakukan dengan penambahan monosakarida, pengaturan
suhu (22-28oC), serta pengaturan pH.
Gen chromosomal virulence (chv) terdiri dari chvA, chvB, pscA (ata