PENAPISAN
PSEUDOMONAS
SPP. DARI RIZOSFER
TANAMAN KEDELAI YANG BERPOTENSI SEBAGAI
RIZOBAKTERIA PEMACU PERTUMBUHAN TANAMAN
DAN BIOKONTROL FUNGI PATOGEN
RENELITA ARTATI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis yang berjudul Penapisan Pseudomonas spp. dari Rizosfer Tanaman Kedelai yang Berpotensi sebagai Rizobakteria Pemacu Pertumbuhan Tanaman dan Biokontrol Fungi Patogen adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber
informasi yang berasal atau dikutipkan dari karya yang diterbitkan maupun tidak
diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam
Daftar Pustaka di bagian akhir tesis ini.
Bogor, Mei 2008
Renelita Artati
ABSTRACT
RENELITA ARTATI. Screening of Pseudomonas spp. from Rhizosphere of Soybean Plant for Potential Plant Growth-Promoting Rhizobacteria and Biocontrol of Pathogenic Fungi. This thesis is advised by ARIS TRI WAHYUDI and GIYANTO.
Soybean is one of the most important crops in Indonesia. To explore the role of bacteria colonizing rhizosphere of soybean plant, we have isolated and identified 50 bacterial isolates from rhizosphere classified as Pseudomonas spp. after partially biochemical and physiological characterization. All these isolates produce indole acetic acid (IAA) after measurement by spectrophotometry using Salkowsky reagent. The ability for phosphate solubilization was tested quantitatively by plating the bacteria in Pikovskaya agar, 32 isolates were positively exhibited to solubilize phosphate, that have index of phosphate solubilization from 0.10 to 0.80. All of the isolates were inoculated on soybean seedlings and 8 among of them significantly induced elongation of primary root, numerous of lateral root and shoot growth. The Pseudomonas spp. isolates were further tested for studying antifungal activity against soil-borne fungal pathogens. Thirthteen isolates showed inhibition, in vitro, against Fusarium oxysporum. While 10 isolates inhibited Sclerotium rolfsii and 32 isolates inhibited Rhizoctonia solani. Hypersensitivity test revealed that 19 bacterial strains of Pseudomonas spp. were classified as non-pathogenic bacteria. According to these traits, 3 Pseudomonas spp. isolates (Crb 74, Crb 84, and Crb 95) can be recommended as plant growth promotion as well as biocontrol of pathogenic fungi causing rot root desease of soybean plant. 16S rRNA sequence analysis revealed that Crb 60, Crb 82 have similarity with P. fluorescens, while Crb 74 and Crb 93 have similarity with P. putida and Crb 84, Crb 94, and Crb 95 have similarity with P. plecoglossicida.
RENELITA ARTATI. Penapisan Pseudomonas spp. dari Rizosfer Tanaman Kedelai yang Berpotensi sebagai Rizobakteria Pemacu Pertumbuhan Tanaman dan Biokontrol Fungi Patogen. Dibimbing oleh ARIS TRI WAHYUDI dan GIYANTO.
Sejumlah bakteri mempunyai peranan penting di bidang pertanian karena berperan dalam berbagai proses kunci pada ekosistem seperti sebagai biokontrol patogen tanaman, pada siklus nutrisi, dan persemaian. Bakteri yang berperan di bidang pertanian tersebut mempunyai karakteristik mampu memacu pertumbuhan tanaman (Plant-Growth Promoting Rhizobacteria, PGPR), dengan karakter dapat berkoloni di rizosfer, mampu memproduksi berbagai hormon pertumbuhan, yaitu asam indol asetat (indol acetic acid, IAA), asam giberelin, sitokinin dan etilen; menambat N2, menekan pertumbuhan mikroorganisme fitopatogen dengan memproduksi siderofor, -1,3-glukanase, kitinase, antibiotik dan sianida; melarutkan fosfat; dan penyedia nutrien lainnya.
Salah satu bakteri yang ditemukan secara luas di dalam ekosistem tanah rizosfer adalah Pseudomonas spp., yangmampumendegradasi dan menggunakan sejumlah besar senyawa organik, berinteraksi dengan tanaman dan berasosiasi dalam rizosfer. Beberapa galur Pseudomonas mampu memproduksi siderofor dan IAA, melarutkan fosfat, dan menghambat pertumbuhan cendawan secara in vitro. Dengan adanya kemampuan ini, beberapa Pseudomonas spp. merupakan bakteri yang dapat berperan sebagai pemacu pertumbuhan tanaman dan sekaligus sebagai agen biokontrol mikroba patogen tanaman.
Penelitian mengenai peran Pseudomonas spp. sebagai PGPR telah dilaporkan pada banyak tanaman pangan, namun pada kedelai sangatlah terbatas. Kedelai merupakan komoditas pertanian penting di Indonesia yang hingga kini produksinya belum dapat mencukupi kebutuhan. Salah satu usaha untuk meningkatkan produksi kedelai adalah dengan memperbaiki kualitas pertumbuhan dan kesehatan tanaman. Sehubungan dengan hal tersebut, dilakukan penelitian untuk mengisolasi spesies Pseudomonas spp. dari rizosfer kedelai yang mempunyai karakteristik sebagai PGPR dan biokontrol fungi patogen akar tanaman kedelai. Isolat-isolat yang mempunyai karakter khusus diidentifikasi dan dianalisis secara molekuler berdasarkan gen penyandi 16S rRNA.
Isolasi dan karakterisasi fisiologi Pseudomonas spp. secara parsial dilakukan dengan menggunakan metode pengenceran berseri dan disebarkan diatas media agar-agar King’s B. Identifikasi Pseudomonas meliputi pewarnaan gram, uji katalase, dan uji oksidase, mengikuti Bergey’s Manual of Determinative Bacteriology.
Telaah Pemacuan Pertumbuhan Kecambah menggunakan kedelai varietas Slamet. Inokulasi kultur bakteri pada kecambah kedelai dilakukan pada kecambah berumur 1 hari. Setelah diinkubasi selama 7 hari pada suhu ruang dalam kondisi gelap, dilakukan pengukuran panjang batang, panjang akar primer, dan jumlah akar lateral. Hasil pengukuran dianalisis secara statistik dengan one-way Analysis of Variance (ANOVA) menggunakan program SPSS dan diuji lanjut dengan Duncan.
Uji antagonis terhadap cendawan patogen dilakukan dengan menggunakan metode standar kultur ganda. Cendawan yang diuji masing-masing adalah Rhizoctonia solani, Sclerotium rolsfii dan Fusarium oxysporum. Adanya interaksi antagonis ditandai dengan terbentuknya zona penghambatan antara isolat Pseudomonas dengan cendawan.
Reaksi hipersensitivitas isolat-isolat Pseudomonas spp. diujikan pada tanaman tembakau. Sebanyak 1 ml kultur Isolat Pseudomonas spp. yang ditumbuhkan pada media King’s B berumur 24-48 jam diinjeksikan ke ruang interseluler diantara vena-vena daun tembakau. Reaksi hipersensitif positif ditunjukkan dengan nekrosis kecoklatan dan kekeringan pada jaringan daun yang diinokulasi dalam 24 sampai 48 jam.
Analisis genetik secara parsial Pseudomonas spp. dilakukan menggunakan sekuen gen 16S rRNA yang diekstraksi terlebih dahulu, kemudian diamplifikasi dengan menggunakan mesin Gene Amp PCR 2400 (Perkin Elmer, USA). DNA hasil PCR dianalisis sekuennya menggunakan mesin DNA squencer ABI 310 (Perkin Elmer, USA) menggunakan jasa Charoen Phokphan, Jakarta. Hasil sekuensing dibandingkan dengan data pada GenBank menggunakan program BLASTN melalui layanan National Centre for Biotechnology Information (NCBI). Perbandingan sekuen dilakukan menggunakan program ClustalX, dendogram dibuat menggunakan metode neighbor-joining.
Penelitian ini telah berhasil mengisolasi 50 isolat Pseudomonas spp. yang berasal dari rizosfer kedelai asal Cirebon, Jawa Barat. Isolat-isolat ini mempunyai karakteristik Gram negatif, sel berbentuk batang, lurus, atau sedikit bengkok, dengan panjang 1,5 – 5,0 μm dengan ukuran dan penataan yang berbeda-beda. Reaksi katalase positif dan oksidase positif. Koloni isolat Pseudomonas spp. berwarna putih sampai krem, memiliki bentuk bervariasi antara bulat sampai bundar tak beraturan dengan tepian licin, dengan elevasi cembung, timbul dan berbukit. Lima puluh isolat Pseudomonas spp. menghasilkan IAA dengan konsentrasi berkisar antara 0.33 ppm sampai 23.04 ppm pada media pertumbuhan yang ditambah dengan triptofan. Pada bakteri produksi IAA tidak berfungsi nyata sebagai hormon pertumbuhan bagi selnya, hal ini memungkinkan peranannya menjadi penting dalam interaksi antara bakteri dengan tanaman.
Dari hasil uji kemampuan pemacuan pertumbuhan, didapatkan 8 isolat Pseudomonas spp. yang mampu memacu pertumbuhan kecambah kedelai pada taraf signifikansi 5%, yaitu Crb 60, 63, 74, 82 , 84, 93, 94, dan 95.
Sebanyak 32 (64%) isolat Pseudomonas spp. mampu melarutkan fosfat dalam bentuk trikalsium fosfat yang terkandung di dalam media Pikovskaya, ditandai dengan zona bening yang terbentuk di sekitar koloni isolat Pseudomonas spp. dengan indeks pelarutan fosfat berkisar antara 0.10 sampai 0.80.
(64%) isolat Pseudomonas spp. memiliki kemampuan dalam menghambat cendawan R. solani. Uji reaksi hipersensitif tanaman tembakau terhadap isolat Pseudomonas spp. memperlihatkan bahwa 19 (38%) isolat Pseudomonas spp. nonpatogen.
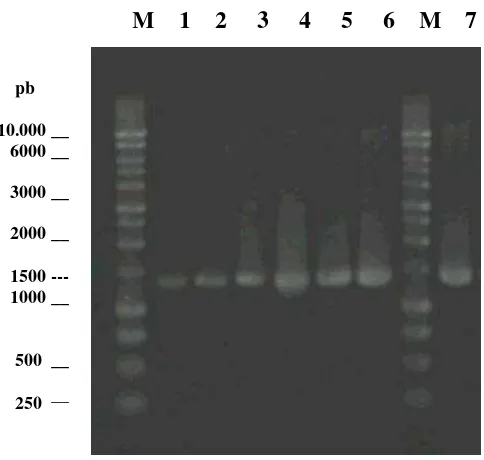
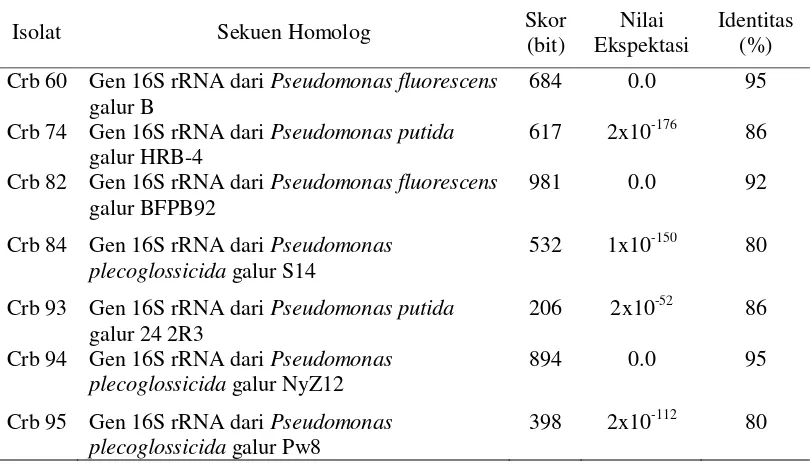
Hasil amplifikasi gen 16S rRNA pada isolat-isolat Pseudomonas spp. yang memacu pertumbuhan dengan PCR memperlihatkan pita-pita DNA berukuran sekitar 1300 pb. Hasil analisis homologinya menunjukkan bahwa isolat Crb 60 dan Crb 82 mempunyai kemiripan dengan Pseudomonas fluorescens, isolat Crb 74 dan Crb 93 mempunyai kemiripan dengan Pseudomonas putida , sedangkan isolat Crb 84, 94, dan 95 mempunyai kemiripan dengan Pseudomonas plecoglossicida. Perbandingan sekuen antara isolat-isolat Pseudomonas spp. yang memacu pertumbuhan dengan galur-galur Pseudomonas spp. lain yang telah diketahui bersifat PGPR menghasilkan dendogram filogenetik yang memperlihatkan bahwa isolat-isolat tersebut lebih dekat hubungan kekerabatannya dengan galur pf-5 dan CHAO dibandingkan hubungan kekerabatannya dengan galur pp-K31-3 dan pf-K30-2. Isolat Crb 82, 94, 74, dan 60 berada satu kelompok dengan galur pf-5 dan CHAO.
@Hak cipta milik IPB, tahun 2008
Hak cipta dilindungi Undang-undang,
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa
mencantumkan atau menyebutkan sumber
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian,
penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau
tinjauan suatu masalah
b. Pengutipan tidak merugikan kepentingan yang wajar IPB
2. Dilarang mengumumkan dan memperbanyak sebagian atau seluruh
TANAMAN KEDELAI YANG BERPOTENSI SEBAGAI
RIZOBAKTERIA PEMACU PERTUMBUHAN TANAMAN
DAN BIOKONTROL FUNGI PATOGEN
RENELITA ARTATI
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Departemen Biologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesia : Penapisan Pseudomonas spp. dari Rizosfer Tanaman Kedelai yang Berpotensi sebagai Rizobakteria Pemacu Pertumbuhan Tanaman dan Biokontrol Fungi Patogen Nama : Renelita Artati
NIM : G351060091
Disetujui
Komisi Pembimbing
Dr. Aris Tri Wahyudi, M.Si Dr. Ir. Giyanto, M.Si Ketua Anggota
Diketahui
Ketua Program Studi Biologi Dekan Sekolah Pascasarjana IPB
Dr. Ir. Dedy Duryadi S.,DEA Prof. Dr. Ir. Khairil A. Notodiputro, M.S.
PENAPISAN
PSEUDOMONAS
SPP. DARI RIZOSFER
TANAMAN KEDELAI YANG BERPOTENSI SEBAGAI
RIZOBAKTERIA PEMACU PERTUMBUHAN TANAMAN
DAN BIOKONTROL FUNGI PATOGEN
RENELITA ARTATI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis yang berjudul Penapisan Pseudomonas spp. dari Rizosfer Tanaman Kedelai yang Berpotensi sebagai Rizobakteria Pemacu Pertumbuhan Tanaman dan Biokontrol Fungi Patogen adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber
informasi yang berasal atau dikutipkan dari karya yang diterbitkan maupun tidak
diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam
Daftar Pustaka di bagian akhir tesis ini.
Bogor, Mei 2008
Renelita Artati
ABSTRACT
RENELITA ARTATI. Screening of Pseudomonas spp. from Rhizosphere of Soybean Plant for Potential Plant Growth-Promoting Rhizobacteria and Biocontrol of Pathogenic Fungi. This thesis is advised by ARIS TRI WAHYUDI and GIYANTO.
Soybean is one of the most important crops in Indonesia. To explore the role of bacteria colonizing rhizosphere of soybean plant, we have isolated and identified 50 bacterial isolates from rhizosphere classified as Pseudomonas spp. after partially biochemical and physiological characterization. All these isolates produce indole acetic acid (IAA) after measurement by spectrophotometry using Salkowsky reagent. The ability for phosphate solubilization was tested quantitatively by plating the bacteria in Pikovskaya agar, 32 isolates were positively exhibited to solubilize phosphate, that have index of phosphate solubilization from 0.10 to 0.80. All of the isolates were inoculated on soybean seedlings and 8 among of them significantly induced elongation of primary root, numerous of lateral root and shoot growth. The Pseudomonas spp. isolates were further tested for studying antifungal activity against soil-borne fungal pathogens. Thirthteen isolates showed inhibition, in vitro, against Fusarium oxysporum. While 10 isolates inhibited Sclerotium rolfsii and 32 isolates inhibited Rhizoctonia solani. Hypersensitivity test revealed that 19 bacterial strains of Pseudomonas spp. were classified as non-pathogenic bacteria. According to these traits, 3 Pseudomonas spp. isolates (Crb 74, Crb 84, and Crb 95) can be recommended as plant growth promotion as well as biocontrol of pathogenic fungi causing rot root desease of soybean plant. 16S rRNA sequence analysis revealed that Crb 60, Crb 82 have similarity with P. fluorescens, while Crb 74 and Crb 93 have similarity with P. putida and Crb 84, Crb 94, and Crb 95 have similarity with P. plecoglossicida.
RENELITA ARTATI. Penapisan Pseudomonas spp. dari Rizosfer Tanaman Kedelai yang Berpotensi sebagai Rizobakteria Pemacu Pertumbuhan Tanaman dan Biokontrol Fungi Patogen. Dibimbing oleh ARIS TRI WAHYUDI dan GIYANTO.
Sejumlah bakteri mempunyai peranan penting di bidang pertanian karena berperan dalam berbagai proses kunci pada ekosistem seperti sebagai biokontrol patogen tanaman, pada siklus nutrisi, dan persemaian. Bakteri yang berperan di bidang pertanian tersebut mempunyai karakteristik mampu memacu pertumbuhan tanaman (Plant-Growth Promoting Rhizobacteria, PGPR), dengan karakter dapat berkoloni di rizosfer, mampu memproduksi berbagai hormon pertumbuhan, yaitu asam indol asetat (indol acetic acid, IAA), asam giberelin, sitokinin dan etilen; menambat N2, menekan pertumbuhan mikroorganisme fitopatogen dengan memproduksi siderofor, -1,3-glukanase, kitinase, antibiotik dan sianida; melarutkan fosfat; dan penyedia nutrien lainnya.
Salah satu bakteri yang ditemukan secara luas di dalam ekosistem tanah rizosfer adalah Pseudomonas spp., yangmampumendegradasi dan menggunakan sejumlah besar senyawa organik, berinteraksi dengan tanaman dan berasosiasi dalam rizosfer. Beberapa galur Pseudomonas mampu memproduksi siderofor dan IAA, melarutkan fosfat, dan menghambat pertumbuhan cendawan secara in vitro. Dengan adanya kemampuan ini, beberapa Pseudomonas spp. merupakan bakteri yang dapat berperan sebagai pemacu pertumbuhan tanaman dan sekaligus sebagai agen biokontrol mikroba patogen tanaman.
Penelitian mengenai peran Pseudomonas spp. sebagai PGPR telah dilaporkan pada banyak tanaman pangan, namun pada kedelai sangatlah terbatas. Kedelai merupakan komoditas pertanian penting di Indonesia yang hingga kini produksinya belum dapat mencukupi kebutuhan. Salah satu usaha untuk meningkatkan produksi kedelai adalah dengan memperbaiki kualitas pertumbuhan dan kesehatan tanaman. Sehubungan dengan hal tersebut, dilakukan penelitian untuk mengisolasi spesies Pseudomonas spp. dari rizosfer kedelai yang mempunyai karakteristik sebagai PGPR dan biokontrol fungi patogen akar tanaman kedelai. Isolat-isolat yang mempunyai karakter khusus diidentifikasi dan dianalisis secara molekuler berdasarkan gen penyandi 16S rRNA.
Isolasi dan karakterisasi fisiologi Pseudomonas spp. secara parsial dilakukan dengan menggunakan metode pengenceran berseri dan disebarkan diatas media agar-agar King’s B. Identifikasi Pseudomonas meliputi pewarnaan gram, uji katalase, dan uji oksidase, mengikuti Bergey’s Manual of Determinative Bacteriology.
Telaah Pemacuan Pertumbuhan Kecambah menggunakan kedelai varietas Slamet. Inokulasi kultur bakteri pada kecambah kedelai dilakukan pada kecambah berumur 1 hari. Setelah diinkubasi selama 7 hari pada suhu ruang dalam kondisi gelap, dilakukan pengukuran panjang batang, panjang akar primer, dan jumlah akar lateral. Hasil pengukuran dianalisis secara statistik dengan one-way Analysis of Variance (ANOVA) menggunakan program SPSS dan diuji lanjut dengan Duncan.
Uji antagonis terhadap cendawan patogen dilakukan dengan menggunakan metode standar kultur ganda. Cendawan yang diuji masing-masing adalah Rhizoctonia solani, Sclerotium rolsfii dan Fusarium oxysporum. Adanya interaksi antagonis ditandai dengan terbentuknya zona penghambatan antara isolat Pseudomonas dengan cendawan.
Reaksi hipersensitivitas isolat-isolat Pseudomonas spp. diujikan pada tanaman tembakau. Sebanyak 1 ml kultur Isolat Pseudomonas spp. yang ditumbuhkan pada media King’s B berumur 24-48 jam diinjeksikan ke ruang interseluler diantara vena-vena daun tembakau. Reaksi hipersensitif positif ditunjukkan dengan nekrosis kecoklatan dan kekeringan pada jaringan daun yang diinokulasi dalam 24 sampai 48 jam.
Analisis genetik secara parsial Pseudomonas spp. dilakukan menggunakan sekuen gen 16S rRNA yang diekstraksi terlebih dahulu, kemudian diamplifikasi dengan menggunakan mesin Gene Amp PCR 2400 (Perkin Elmer, USA). DNA hasil PCR dianalisis sekuennya menggunakan mesin DNA squencer ABI 310 (Perkin Elmer, USA) menggunakan jasa Charoen Phokphan, Jakarta. Hasil sekuensing dibandingkan dengan data pada GenBank menggunakan program BLASTN melalui layanan National Centre for Biotechnology Information (NCBI). Perbandingan sekuen dilakukan menggunakan program ClustalX, dendogram dibuat menggunakan metode neighbor-joining.
Penelitian ini telah berhasil mengisolasi 50 isolat Pseudomonas spp. yang berasal dari rizosfer kedelai asal Cirebon, Jawa Barat. Isolat-isolat ini mempunyai karakteristik Gram negatif, sel berbentuk batang, lurus, atau sedikit bengkok, dengan panjang 1,5 – 5,0 μm dengan ukuran dan penataan yang berbeda-beda. Reaksi katalase positif dan oksidase positif. Koloni isolat Pseudomonas spp. berwarna putih sampai krem, memiliki bentuk bervariasi antara bulat sampai bundar tak beraturan dengan tepian licin, dengan elevasi cembung, timbul dan berbukit. Lima puluh isolat Pseudomonas spp. menghasilkan IAA dengan konsentrasi berkisar antara 0.33 ppm sampai 23.04 ppm pada media pertumbuhan yang ditambah dengan triptofan. Pada bakteri produksi IAA tidak berfungsi nyata sebagai hormon pertumbuhan bagi selnya, hal ini memungkinkan peranannya menjadi penting dalam interaksi antara bakteri dengan tanaman.
Dari hasil uji kemampuan pemacuan pertumbuhan, didapatkan 8 isolat Pseudomonas spp. yang mampu memacu pertumbuhan kecambah kedelai pada taraf signifikansi 5%, yaitu Crb 60, 63, 74, 82 , 84, 93, 94, dan 95.
Sebanyak 32 (64%) isolat Pseudomonas spp. mampu melarutkan fosfat dalam bentuk trikalsium fosfat yang terkandung di dalam media Pikovskaya, ditandai dengan zona bening yang terbentuk di sekitar koloni isolat Pseudomonas spp. dengan indeks pelarutan fosfat berkisar antara 0.10 sampai 0.80.
(64%) isolat Pseudomonas spp. memiliki kemampuan dalam menghambat cendawan R. solani. Uji reaksi hipersensitif tanaman tembakau terhadap isolat Pseudomonas spp. memperlihatkan bahwa 19 (38%) isolat Pseudomonas spp. nonpatogen.
Hasil amplifikasi gen 16S rRNA pada isolat-isolat Pseudomonas spp. yang memacu pertumbuhan dengan PCR memperlihatkan pita-pita DNA berukuran sekitar 1300 pb. Hasil analisis homologinya menunjukkan bahwa isolat Crb 60 dan Crb 82 mempunyai kemiripan dengan Pseudomonas fluorescens, isolat Crb 74 dan Crb 93 mempunyai kemiripan dengan Pseudomonas putida , sedangkan isolat Crb 84, 94, dan 95 mempunyai kemiripan dengan Pseudomonas plecoglossicida. Perbandingan sekuen antara isolat-isolat Pseudomonas spp. yang memacu pertumbuhan dengan galur-galur Pseudomonas spp. lain yang telah diketahui bersifat PGPR menghasilkan dendogram filogenetik yang memperlihatkan bahwa isolat-isolat tersebut lebih dekat hubungan kekerabatannya dengan galur pf-5 dan CHAO dibandingkan hubungan kekerabatannya dengan galur pp-K31-3 dan pf-K30-2. Isolat Crb 82, 94, 74, dan 60 berada satu kelompok dengan galur pf-5 dan CHAO.
@Hak cipta milik IPB, tahun 2008
Hak cipta dilindungi Undang-undang,
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa
mencantumkan atau menyebutkan sumber
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian,
penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau
tinjauan suatu masalah
b. Pengutipan tidak merugikan kepentingan yang wajar IPB
2. Dilarang mengumumkan dan memperbanyak sebagian atau seluruh
TANAMAN KEDELAI YANG BERPOTENSI SEBAGAI
RIZOBAKTERIA PEMACU PERTUMBUHAN TANAMAN
DAN BIOKONTROL FUNGI PATOGEN
RENELITA ARTATI
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Departemen Biologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesia : Penapisan Pseudomonas spp. dari Rizosfer Tanaman Kedelai yang Berpotensi sebagai Rizobakteria Pemacu Pertumbuhan Tanaman dan Biokontrol Fungi Patogen Nama : Renelita Artati
NIM : G351060091
Disetujui
Komisi Pembimbing
Dr. Aris Tri Wahyudi, M.Si Dr. Ir. Giyanto, M.Si Ketua Anggota
Diketahui
Ketua Program Studi Biologi Dekan Sekolah Pascasarjana IPB
Dr. Ir. Dedy Duryadi S.,DEA Prof. Dr. Ir. Khairil A. Notodiputro, M.S.
PRAKATA
Puji syukur penulis panjatkan kepada Allah SWT atas segala limpahan rahmat dan kemudahan-Nya sehingga tesis dengan judul Penapisan Pseudomonas spp. dari Rizosfer Tanaman Kedelai yang Berpotensi sebagai Rizobakteria Pemacu Pertumbuhan Tanaman dan Biokontrol Fungi Patogen ini berhasil diselesaikan.
Terima kasih penulis sampaikan kepada Dr. Aris Tri Wahyudi, M.Si dan Dr. Ir. Giyanto, M.Si selaku pembimbing atas bimbingan dan arahan yang diberikan. Kepada Dr. Anja Meryandini, MS selaku penguji luar komisi kami juga mengucapkan terima kasih atas saran yang diberikan. Penelitian ini didanai oleh Kerjasama Kemitraan Penelitian Pertanian dengan Perguruan Tinggi (KK3PT) Tahun 2007 kepada Dr. Aris Tri Wahyudi, M.Si dan kerjasama Departemen Agama RI-IPB, oleh karena itu kami mengucapkan terima kasih. Terima kasih kepada pengelola Laboratorium Mikrobiologi, Departemen Biologi FMIPA IPB atas segala fasilitas dan penggunaan alat pengujian.
Ungkapan terima kasih juga disampaikan kepada Bapak dan Ibu, suami dan anak-anak atas segala doa, curahan kasih sayang dan pengertiannya. Penulis mengucapkan terima kasih kepada Rika, mbak Ari, dan teman-teman di Laboratorium Mikrobiologi atas diskusi, saran, dukungan, dan bantuannya. Terima kasih kepada pimpinan MAN Insan Cendekia Serpong dan teman-teman sejawat atas dukungan moril dan materilnya sehingga dapat terselesaikannya tesis ini.
Semoga karya ilmiah ini bermanfaat.
Bogor, Mei 2008
Penulis dilahirkan di Jakarta pada tanggal 14 Maret 1965 dari ayah Suyadi dan Ibu Sudiyatmini. Penulis merupakan putri pertama dari tiga bersaudara. Pendidikan sarjana ditempuh di Jurusan Pendidikan Biologi, Fakultas Pendidikan Matematika dan Ilmu Pengetahuan Alam IKIP Negeri Jakarta, lulus tahun 1987. Pada tahun 2006 penulis mendapat kesempatan untuk melanjutkan studi pada Sekolah Pascasarjana IPB melalui program beasiswa dari Departemen Agama Republik Indonesia.
DAFTAR ISI
Halaman
DAFTAR TABEL ... xii
DAFTAR GAMBAR... ... ... xiii
PENDAHULUAN
Latar Belakang ... 1 Tujuan ... 2
TINJAUAN PUSTAKA
Rizobakteria Pemacu Pertumbuhan Tanaman ... 3 Fungi Patogen Akar ... 9 Pseudomonas spp ... 11 Analisis Sekuen Gen 16S rRNA ... 12
BAHAN DAN METODE
Isolasi dan Karakterisasi Fisiologi secara Parsial Pseudomonas spp. .. 14 Analisis Produksi Asam Indol Asetat (IAA) ... 14 Uji Pelarutan Fosfat ... 15 Uji Pemacuan Pertumbuhan Kecambah Kedelai ... 15 Uji Antagonisme Terhadap Cendawan Patogen. ... 16 Uji Reaksi Hipersensitivitas ... 16 Analisis Genetik secara Parsial Pseudomonas spp.Berdasarkan
Sekuen Gen 16S rRNA ... 17
HASIL
Isolasi dan Karakterisasi Fisiologi secara Parsial Pseudomonas spp ... 18 Karakteristik Pseudomonas spp. sebagai Pemacu Pertumbuhan ... 18 Karakteristik Pseudomonas spp sebagai Agen Biokontrol ... 25 Analisis Genetik secara Parsial Pseudomonas spp. Berdasarkan
Sekuen Gen 16S rRNA ... 27
PEMBAHASAN
Isolasi dan Karakterisasi Fisiologi secara Parsial Pseudomonas spp ... 29 Karakteristik Pseudomonas spp. sebagai PGPR ... 29 Analisis Genetik secara Parsial Pseudomonas spp. Berdasarkan
Sekuen Gen 16S rRNA ... 36
KESIMPULAN DAN SARAN
Kesimpulan ... 37 Saran ... 37
DAFTAR PUSTAKA ... 38
Halaman
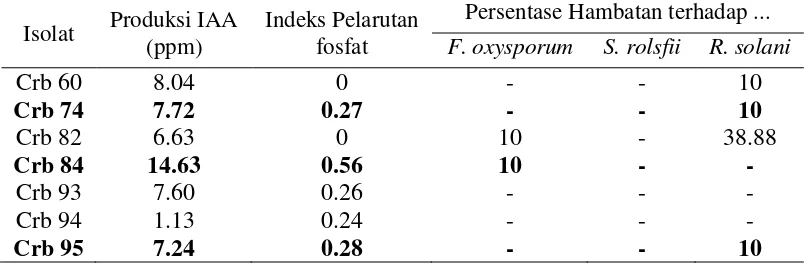
1. Potensi Pseudomonas spp. dalam memproduksi IAA dan melarutkan fosfat. ... 20
2. Hasil uji pemacuan pertumbuhan tanaman kedelai varietas Slamet yang diinokulasi dengan Pseudomonas spp. ... 22
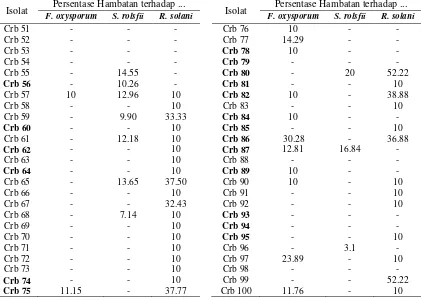
3. Penghambatan Pseudomonas spp. pada uji antagonisme terhadap cendawan patogen in vitro. ... 25
4. Hasil analisis homologi sekuen gen 16S rRNA dari isolat Pseudomonas spp. pemacu petumbuhan tanaman menggunakan program BLASTN ... 28
5. Potensi isolat Pseudomonas spp. yang mampu memacu pertumbuhan tanaman kedelai dan nonpatogen ... 35
DAFTAR GAMBAR
Halaman
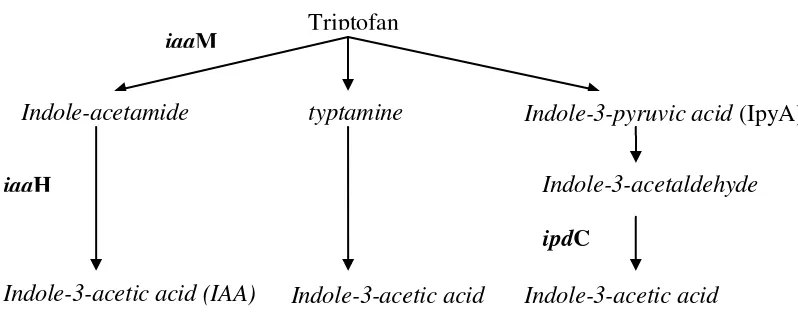
1. Diagram alir lintasan biosintesis IAA pada bakteri ... 5
2. Penampilan Isolat Pseudomonas spp ... 19
3. Zona bening pada uji pelarutan fosfat ... 20
4. Reaksi hipersensitivitas tanaman tembakau terhadap Pseudomonas spp .. 21
5. Pertumbuhan kecambah kedelai berumur tujuh hari ... 24
6. Antagonisme antara Pseudomonas spp. dengan cendawan patogen ... 26
7. Hasil amplifikasi PCR Gen 16S rRNA isolat Pseudomonas spp. ... 27
8. Dendogram filogenetik yang memperlihatkan hubungan kekerabatan antara isolat-isolat Pseudomonas spp. yang memacu pertumbuhan... 28
Latar Belakang
Penggunaan pupuk dan pestisida secara berlebihan dan terus-menerus pada
pertanian modern telah menimbulkan dampak negatif diantaranya terhadap
kondisi tanah dan lingkungan, yaitu pencemaran dan eutrofikasi. Penggunaan
pestisida juga dapat menimbulkan resistensi hama dan penyakit tumbuhan
terhadap bahan beracun tersebut.
Permasalahan yang timbul pada pertanian modern tersebut dan kesadaran
akan lingkungan yang sehat, mendorong penggalian berbagai potensi alam yang
ramah lingkungan. Perkembangan di bidang bioteknologi telah menunjukkan
hasil yang menggembirakan, diantaranya penggunaan mikroorganisme, terutama
bakteri dan cendawan, yang sangat potensial sebagai agen pupuk hayati dan
pengendali hayati (biocontrol).
Di bidang pertanian, penggunaan produk-produk mikroba mempunyai
beberapa keuntungan dibanding penggunaan bahan kimia karena: (i)
produk-produk mikroba lebih aman; (ii) senyawa kimia dan mikroba itu sendiri tidak
akan terakumulasi dalam rantai makanan; (iii) pengembangbiakan mikroba dapat
diatur untuk pemakaian berulang; (iv) organisme target jarang menjadi resisten
seperti pada kasus ketika agen-agen kimia digunakan untuk mengeliminasi hama
yang berbahaya; dan (v) sebagai agen pengembangan biokontrol tidak berbahaya
baik dalam proses ekologis maupun lingkungan (Gloud 1990).
Bakteri-bakteri tertentu berperan dalam bidang pertanian diantaranya
Azotobacter, Azospirillum, Pseudomonas, Acetobacter, Burkholderia dan
Bacillus; karena dapat berkoloni di rizosfer, di permukaan akar, atau bahkan di
ruang permukaan interseluler tanaman. Mikroorganisme ini mampu
memproduksi atau mengubah konsentrasi hormon pertumbuhan asam indol asetat
(indol acetic acid, IAA), asam giberelin, sitokinin dan etilen, menambat N2,
menekan pertumbuhan mikroorganisme fitopatogen dengan memproduksi
siderofor, -1,3-glukanase, kitinase, antibiotik dan sianida, melarutkan fosfat dan
dikelompokkan kedalam bakteri yang mampu memacu pertumbuhan tanaman
(Plant Growth promoting Rhizobacteria, PGPR) (Glick 1995).
Salah satu mikroorganisme yang ditemukan secara luas di dalam ekosistem
tanah rizosfer adalah Pseudomonas spp. Pseudomonas adalah bakteri berbentuk
batang, lurus, atau sedikit bengkok, berdiameter 0,5 – 1, 0 μm dengan panjang 1,5 – 5,0 μm, gram negatif, motil dengan satu atau beberapa flagel, aerob, dan tidak berspora. Beberapa galur Pseudomonas mampu meningkatkan panjang akar
tanaman kacang tanah secara signifikan, memproduksi siderofor dan IAA,
melarutkan fosfat, dan menghambat pertumbuhan cendawan secara in vitro (Dey
et al. 2004). Dengan adanya kemampuan ini, beberapa Pseudomonas spp.
merupakan bakteri yang dapat berperan sebagai pemacu pertumbuhan tanaman
dan sekaligus sebagai agen biokontrol mikroba patogen tanaman.
Penelitian mengenai peran Pseudomonas spp. sebagai PGPR telah
dilaporkan pada banyak tanaman pangan, namun pada kedelai sangatlah terbatas.
Kedelai merupakan komoditas pertanian penting di Indonesia yang hingga kini
produksinya belum dapat mencukupi kebutuhan. Salah satu usaha untuk
meningkatkan produksi kedelai adalah dengan memperbaiki kualitas
pertumbuhan dan kesehatan tanaman. Sehubungan dengan hal tersebut maka
perlu dilakukan penelitian untuk mengisolasi spesies Pseudomonas dari rizosfer
kedelai yang mempunyai karakteristik sebagai PGPR dan biokontrol fungi
patogen akar tanaman kedelai. Isolat-isolat yang mempunyai karakter khusus
diidentifikasi dan dianalisis secara molekuler berdasarkan gen penyandi 16S
rRNA.
Tujuan
Penelitian ini bertujuan mengisolasi dan mengkarakterisasi rizobakteria asal
rizosfer tanaman kedelai, Pseudomonas spp., yang diduga berpotensi sebagai
pemacu pertumbuhan tanaman dan biokontrol fungi patogen akar. Karakter yang
diteliti meliputi kemampuannya dalam produksi IAA, pemacuan pertumbuhan in
vitro, melarutkan fosfat, menghambat pertumbuhan fungi patogen, dan
mengidentifikasinya berdasarkan gen penyandi 16S rRNA.
Rizobakteria Pemacu Pertumbuhan (Plant Growth-Promoting Rhizobacteria)
Mikroorganisme tumbuh subur di tanah, terutama di daerah rizosfer
tanaman. Sejumlah spesies bakteri dan cendawan mempunyai hubungan dan
membentuk sistem holistik dengan tumbuhan (Wu et al. 2005). Interaksi mikroba
dengan tanaman di rizosfer dapat berupa hubungan yang menguntungkan, netral,
berubah-ubah, atau mengganggu pertumbuhan tanaman (Husen 2003). Interaksi
antara mikroorganisme tanah dan tumbuhan dapat berpengaruh terhadap
pertumbuhan tanaman baik secara langsung maupun tidak langsung dengan
menghasilkan metabolit yang memodifikasi keadaan rizosfer (Kapulnik & Okon
2002). Pengaruh secara tidak langsung terjadi ketika mikroorganisme tersebut
mengurangi atau mencegah perusakan satu atau lebih organisme fitopatogen,
sedangkan pengaruh langsung terjadi ketika mikroorganisme tersebut mesintesis
senyawa yang dibutuhkan tanaman atau memudahkan pengambilan nutrien
tertentu dari lingkungan (Glick 1995).
Sejumlah bakteri patut mendapat perhatian di bidang pertanian karena
berperan dalam berbagai proses kunci pada ekosistem seperti dalam biokontrol
patogen tanaman, siklus nutrisi dan persemaian. Bakteri tersebut mempunyai
karakteristik mampu memacu pertumbuhan (Plant-Growth Promoting
Rhizobacteria, PGPR). Terdapat dua istilah : PGPR interseluler (iPGPR) jika
bakteri terletak di dalam sel tanaman, menghasilkan bintil dan terletak dalam
struktur khusus, dan PGPR ekstraseluler (ePGPR) jika bakteri hidup di luar sel
tanaman dan tidak menghasilkan bintil, tetapi meningkatkan pertumbuhan
tanaman dengan menghasilkan senyawa yang secara langsung merangsang
pertumbuhan tanaman, menambah resistensi tanaman terhadap penyakit, atau
meningkatkan mobilisasi nutrien tanah. ePGPR dapat dibagi menjadi 3 tipe
berdasarkan tingkat hubungan dengan akar tanaman: yang hidup dekat akar,
tetapi tidak bersentuhan dengan akar; yang mengolonisasi permukaan akar; dan
yang hidup di ruang antar sel korteks akar (Gray & Smith 2005). Kelompok
Azotobacter, Azospirillum, Pseudomonas, Acetobacter, Burkholderia dan
Bacillus. (Glick 1995).
PGPR mampu memproduksi atau mengubah konsentrasi hormon
pertumbuhan asam indol asetat (indol acetic acid, IAA), asam giberelin, sitokinin
dan etilen, menambat N2, menekan pertumbuhan mikroorganisme fitopatogen
dengan memproduksi siderofor, -1,3-glukanase, kitinase, antibiotik dan sianida,
melarutkan fosfat dan menyediakan nutrien lainnya (Glick 1995).
Produksi IAA oleh PGPR
Bakteri PGPR umumnya menghasilkan fitohormon seperti auksin,
sitokinin, dan giberelin dengan auksin sebagai perhatian utama. Indol Acetic Acid
(IAA) merupakan hormon utama pada tanaman yang mengontrol berbagai proses
fisiologis penting termasuk pertumbuhan dan pembelahan sel, diferensiasi
jaringan, dan respon terhadap cahaya dan gravitasi (Leveau & Lindow 2005).
IAA terdapat di akar dan di bagian tumbuhan lainnya dalam konsentrasi yang
hampir sama. Karena tumbuhan mungkin tidak mensintesis IAA dalam jumlah
cukup untuk pertumbuhan optimalnya, maka pemberian auksin dapat memacu
pemanjangan akar, tetapi hanya pada konsentrasi yang sangat rendah (10-7 sampai
10-13 M, bergantung pada spesies dan umur akar tanaman) (Salisbury & Ross,
1992).
Bakteri penghasil IAA mempunyai kemampuan untuk membantu berbagai
proses tersebut di atas dengan memasukkan IAA ke dalam pool auksin tanaman.
Akar merupakan organ tanaman yang paling sensitif terhadap fluktuasi kadar
IAA, dan responnya pada peningkatan jumlah IAA eksogenus meluas dari
pemanjangan akar primer, pembentukan akar lateral dan akar adventif, sampai
penghentian pertumbuhan (Leveau & Lindow 2005).
Pada bakteri, triptofan (Trp) merupakan prekursor utama dalam biosintesis
IAA. Triptofan merupakan salah satu asam amino aromatik yang dihasilkan dari
senyawa berkarbon 7, yakni 3-deoksi-7-fosfo-D-asam arabinoheptulosonat yang
merupakan hasil kondensasi dari D-eritrosa-4-fosfat (senyawa berkarbon 4) dan
fosfo-enol-piruvat (senyawa berkarbon 3). Biosintesis triptofan melibatkan
banyak gen yang membentuk suatu kelompok di dalam kromosom. Manulis
melibatkan senyawa intermediet indole-3-pyruvate (IpyA), indole-3-acetamide
(IAM), tryptamine, indole-3-acetonitrile. Tetapi dua jalur utama yang ada pada
semua bakteri adalah lintasan IAM dan IpyA (Gambar 1). Lintasan IAM terdapat
pada semua bakteri pembentuk bintil akar (Bradyrhizobium japonicum,
Rhizobium fredii), Azospirillum brasilense dan Streptomyces. Menurut Brandl et
al (1996) biosintesis IAA melalui IPyA dijumpai pada tanaman tingkat tinggi dan
beberapa jenis bakteri meliputi Rhizobium spp, Azospirillum spp, Rolstonia
solanacearum dan Enterobacter cloacae.
Reaksi awal pengubahan triptofan menjadi indol-3-piruvat dikatalisis oleh
aminotransferase aromatik, dimana empat enzim berhasil diidentifikasi pada A.
lipoferum. Enzim-enzim yang ditemukan ini spesifik terhadap berbagai asam
amino aromatik dan tidak hanya pada triptofan, sehingga deteksi pada
protein-protein ini kurang membuktikan bahwa IAA disintesis melalui indole-3-piruvat
pada Azospirillum (Elmerich 1992). Produksi IAA meningkat sesuai dengan
peningkatan konsentrasi triptofan dari 1-100 g/ml (Ahmad et al. 2005)
Konsentrasi IAA juga meningkat seiring dengan umur kultur sampai bakteri
mencapai fase stasioner. Pengocokan lebih disukai untuk memproduksi IAA, Triptofan
Indole-acetamide typtamine Indole-3-pyruvic acid (IpyA)
Indole-3-acetic acid (IAA) Indole-3-acetic acid
Indole-3-acetaldehyde
Indole-3-acetic acid
Gambar. 1. Diagram alir lintasan biosintesis IAA pada bakteri (Brandl et al. 1996; Manulis 1998). Gen-gen iaaM, iaaH dan ipdC masing-masing menyandikan triptofan-2-monooksigenase, indol-3-asetamid hidrolase dan indol-piruvat dekarboksilase.
iaaM
iaaH
[image:30.595.121.520.292.452.2]terutama pada media yang mengandung nitrogen, sedangkan fitohormon lainnya
juga terdeteksi pada medium kultur, yakni giberelin dan senyawa serupa sitokinin
(Tien et al. 1979).
Produksi IAA tidak berfungsi nyata sebagai hormon dalam sel bakteri,
dimungkinkan terdapat dalam sel bakteri karena hormon tersebut berperan
penting dalam interaksi antara bakteri dan tanaman. Bakteri yang memproduksi
IAA akan menstimulasi pertumbuhan sistem perakaran inang. (Patten & Glick
2002).
Pengaruh IAA pada tanaman bergantung pada konsentrasi auksin yaitu,
konsentrasi IAA yang rendah dapat memacu pertumbuhan tanaman sedangkan
konsentrasi IAA yang tinggi dapat menghambat pertumbuhan tanaman. Tanaman
yang berbeda dapat memberi respon yang berbeda terhadap variasi konsentrasi
IAA dan tipe mikrooganisme (Ahmad et al. 2005). Campbell et al. (2006) pada
penelitian pengaruh auksin pada tanaman kacang tanah mengemukakan bahwa
IAA memacu pertumbuhan batang hanya dalam kisaran konsentrasi tertentu.
Konsentrasi IAA diatas 0.9 g/l dapat menghambat pemanjangan batang kacang
tanah, hal ini dimungkinkan karena konsentrasi IAA yang tinggi dapat
menginduksi produksi etilen, hormon yang biasanya mengakibatkan efek
berlawanan dengan auksin. Di lain pihak, konsentrasi auksin yang cukup tinggi
untuk dapat memacu pemanjangan batang adalah kisaran konsentrasi auksin
yang menghambat pemanjangan akar.
Pelarutan Fosfat oleh PGPR
Sejumlah besar fosfat anorganik terlarut yang ditambahkan ke tanah saat
pemberian pupuk di lahan pertanian dengan cepat berubah menjadi bentuk yang
tidak terlarut segera setelah ditaburkan dan menjadi tidak tersedia bagi tanaman.
Fosfor yang tersedia bagi tanaman ada di dalam larutan tanah sebagai
anion-anion ortofosfat, terutama H2PO4- dan HPO42-. Fosfat anorganik dan organik
padat ditemukan dalam bentuk yang labil dan sangat tidak larut di dalam tanah,
sehingga tingkat efektivitas penyediaan fosfat sangat bervariasi (Rodriguez &
Fraga 1999).
Mikroba pelarut fosfat adalah spesies bakteri dan cendawan yang
mempunyai kemampuan untuk melarutkan senyawa fosfat anorganik yang tidak
terlarut seperti trikalsium fosfat, dikalsium fosfat, hidroksiapatit, dan batuan
fosfat. Beberapa bakteri pelarut fosfat diantaranya adalah Pseudomonas,
Bacillus, dan Rhizobium, yang potensial dalam meningkatkan tersedianya fosfor
bagi tanaman, terutama di tanah yang mengandung banyak endapan fosfat
(Rodriguez & Fraga 1999). Ketika tanah kekurangan fosfat bagi tanaman dan pH
tanah sangat kondusif untuk pelarutan fosfat, mikroba pelarut fosfat berperan
penting dalam pertumbuhan tanaman, hasil panen dan pengambilan nutrien
(Altomare et al. 1999).
Mikroba pelarut fosfat yang hidup bebas selalu ada di dalam tanah. Fallah
(2006) menyatakan bahwa dari 50 sampel tanah yang dikoleksi dari bagian utara
Iran mengandung bakteri dan cendawan pelarut fosfat, dengan jumlah populasi
bakteri antara 106 sampai 109 sel/g tanah atau dengan rasio rata-rata bakteri
pelarut fosfat terhadap total populasi bakteri adalah 3,98%.
Mekanisme utama pelarutan fosfat pada bakteri adalah produksi asam
organik dan asam fosfatase. Asam glukonat dan asam 2-ketoglukonat adalah
asam-asam organik yang dihasilkan oleh Pseudomonas, Erwinia, Burkholderia,
Rhizobium, dan Bacillus (Igual et al. 2001). Asam-asam organik lain seperti asam
laktat, isovalerat, isobutirat, asetat, glikonat, oksalat, malonat, dan suksinat juga
dihasilkan oleh berbagai bakteri pelarut fosfat (Rodriguez & Fraga 1999).
Kemampuan asam organik dalam melarutkan fosfat dapat terjadi melalui
tiga mekanisme yaitu asidifikasi, pengkelatan, dan reaksi pertukaran ligan
(Arcand & Schneider 2006). Pada mekanisme asidifikasi, asam organik berperan
dalam menurunkan pH larutan, karena asam organik akan terdisosiasi dalam
suatu kesetimbangan yang tergantung pada pH menjadi anion atau kationnya. Ion
H+ akan melarutkan batuan fosfat dengan mengubah kesetimbangan. Mekanisme
kedua, anion asam organik dapat melarutkan fosfat melalui reaksi pengkelatan
yang melibatkan pembentukan dua atau lebih ikatan koordinat antara suatu anion
atau molekul polar dan suatu kation, sehingga menghasilkan struktur cincin yang
kompleks. Anion asam organik dengan hidroksil yang mengandung oksigen
kation-kation seperti Ca2+, Mg2+, Fe3+, dan Al3+ yang sering berikatan dengan fosfat.
Terbentuknya kompleks tersebut pada permukaan mineral mengakibatkan anion
asam organik kehilangan ikatan kation-oksigen dari struktur mineralnya dan
mengkatalisis pelepasan kation ke larutan. Anion asam organik secara
terus-menerus mengubah keseimbangan reaksi pemecahan dengan membentuk
kompleks dengan kation di larutan, yang secara efektif menurunkan titik jenuh
larutan. Mekanisme ketiga terjadi melalui kompetisi dengan anion-anion fosfat
yang terserap ke permukaan kristal Fe(OH)3 dan Al(OH)3. Anion asam organik
dapat berperan memobilisasi fosfor melalui reaksi pertukaran ligan. Hasil
penelitian menunjukkan bahwa mobilisasi fosfor berhubungan dengan pertukaran
ligan antara sitrat dan fosfat yang terserap ke sisi Fe dan Al daripada hasil
pemecahan dari presipitat Ca-P. Di tanah, sitrat dapat memobilisasi fosfat ketika
terserap pada tingkat yang lebih besar dari 10 mol/g tanah, tetapi di bawah nilai
kritis ini sitrat tidak akan mengalahkan kompetisi fosfat untuk sisi adsorbsi tanah.
Sejumlah besar fosfat yang diabsorbsi dari tanah digunakan untuk menghasilkan
ATP, salah satu di antaranya dibutuhkan dalam fiksasi nitrogen (Dey et al. 2004).
PGPR sebagai Agen Biokontrol yang Prospektif
Secara umum istilah biokontrol mengacu pada penggunaan organisme
hidup untuk membatasi pertumbuhan dan proliferasi organisme lainnya yang
tidak diinginkan. Mikrorganisme rizosfer dapat menjadi garis pertahanan
terdepan melawan serangan patogen sehingga ideal digunakan sebagai agen
biokontrol. Biokontrol melibatkan mikroorganisme penekan penyakit untuk
meningkatkan kesehatan tanaman. Penekanan penyakit oleh agen biokontrol
adalah manifestasi interaksi antara tanaman, patogen, agen biokontrol, komunitas
mikroba disekitar tanaman, dan lingkungan fisik (Siddiqui 2006).
Banyak PGPR yang menguntungkan karena meningkatkan produksi
pertanian melalui mekanisme antibiosis dan biokontrol; serta mampu menekan
sejumlah bakteri, cendawan, nematoda, dan virus yang bersifat patogen pada
tanaman ( Whipps 2001). Spesies Pseudomonas yang berfluoresen dan Bacillus
dapat mensekresi metabolit ekstraseluler yang berperan aktif dan sangat efektif
dalam menghambat dan menekan pertumbuhan mikroorganisme patogen.
PGPR Pseudomonas spp. menghasilkan berbagai antibiotik termasuk
antifungi (fenazin, pirolnitrin, pioluteorin, diasetil floroglusinol, ramnolipid, dll),
antibakteri (asam pseudomonat, azomisin), antitumor (FR901463, sepafungins),
dan anti virus (karalisin) (Fernando et al. 2006). Senyawa-senyawa tersebut dapat
menyebabkan modifikasi struktural dinding sel dan perubahan
biokimiawi/fisiologis pada sintesis protein yang terlibat dalam mekanisme
pertahanan tanaman. Lipopolisakarida, siderofor, dan asam salisilat adalah faktor
utama pada PGPR yang menginduksi sistem pertahanan (Antoun & Prevost 2006,
Siddiqui 2006). Whipps (2001) melaporkan bahwa galur P. fluorescence tipe liar
mampu melindungi tanaman ketimun dari Pythium ultimum. Pseudomonas spp.
dapat menghasilkan hidrogen sianida yang menghambat beberapa cendawan
fitopatogen. Strain PGPR lainnya dapat menghasilkan enzim hidrolase yang
menghidrolisis dinding sel cendawan. P. stutzeri menghasilkan kitinase dan
laminarinase ektraseluler yang mampu menghancurkan miselium cendawan
Fusarium solani (Lim et al. 1991).
Enzim kitinase yang diproduksi oleh Serratia marcescens digunakan
untuk melawan Sclerotium rolsfii. -1,3-glukanase yang disintesis oleh
Paenibacillus sp. galur 300 dan Streptomyces sp. galur 385 dapat melisis dinding
sel Fusarium oxysporum f. Sp. cucumerinum. Bacillus cepacia mensintesis
-1,3-glukanase untuk menghancurkan dinding sel Rizoctonia solani, S. rolsfii, dan
Pythium ultimum (Chompant et al. 2005).
Fungi Patogen Akar
Interaksi patogenik dapat terjadi antar mikroorganisme, seperti
parasitisme antara satu fungi dengan fungi lainnya (mikoparasitisme) maupun
produksi antibiotik oleh organisme yang menghambat atau membunuh
mikroorganisme lainnya. Interaksi patogenik lainnya melibatkan mikroorganisme
dan akar tanaman yang mengakibatkan penyakit tanaman. Penyakit tanaman yang
bersumber dari tanah dapat disebabkan oleh nematoda, kutu, bakteri, virus, dan
fungi. Beberapa fungi menyebabkan kerusakan lebih parah pada tanaman
pertanian dan interaksinya dengan patogen tanaman lainnya umumnya
Fusarium oxysporum adalah fungi saprofit yang tumbuh dan dapat
bertahan hidup dalam periode yang lama pada bahan organik, di dalam tanah dan
di rizosfer berbagai tanaman. Beberapa spesies Fusarium menyebabkan layu atau
busuk akar sedangkan yang lainnya nonpatogen. Baik yang patogen maupun yang
nonpatogen dapat melakukan penetrasi pada akar tanaman (Bolwerk &
Lugtenberg 2006). Fumonisin dan trikotekanes merupakan toksin utama yang
diproduksi oleh Fusarium. Cendawan ini menyerang tanaman pada bagian akar
tanaman dengan menggunakan pembuluh sporangia dan miseliumnya. Serangan
tersebut terjadi melalui ujung akar, luka pada akar, atau melalui akar lateral
(Gonsalves et al. 1993). Hasil penelitian terdahulu menyatakan bahwa
Pseudomonas flourescent dapat berperan sebagai agen biokontrol terhadap
Fusarium sp. pada tanaman tomat. B. cepacia dan B. gladioli di dalam rizosfer
memiliki kemampuan menyerang F. oxysporum f. sp cubense yang menginfeksi
tanaman tersebut dengan mengkolonisasi permukaan hifa dan makrospora (Dikin
et al. 2006).
Cendawan Sclerotium rolfsii dapat menyebabkan busuk akar pada
berbagai tanaman termasuk kedelai dengan gejala infeksi layu pada pucuk
tanaman akibat kerusakan pada pangkal batang dan akar. Fitopatogen ini
dicirikan dengan pertumbuhan miselia yang menyerupai kapas dan adanya
bulatan sklerotia berwarna coklat muda yang kemudian menjadi coklat gelap
ketika tua. S. rolsfii dapat bertahan hidup pada sisa tumbuhan yang mati di dalam
tanah dalam bentuk sklerotia, kemudian dapat tumbuh dan menyerang tanaman
inang, menyebabkan nekrosis pada dinding selnya. Enzim selulase dan kitinase
dihasilkan untuk mendukung kemampuannya menyerang tanaman inang.
Terdapat sejumlah mikroorganisme yang mampu melawan Sclerotium rolfsii,
diantaranya Trichoderma harzianum, T. viride, Bacillus subtilis, Penicillium spp
dan Glicodium virens (Moussa & Tharwat 2007).
Rhizoctonia solani adalah cendawan patogen yang dapat menyebabkan
penyakit busuk daun pada padi, busuk pangkal batang (damping-off) pada
tanaman gula bit, dan busuk akar pada kedelai. Menurut Bertagnolli et al. (1996)
cendawan ini mengeluarkan endoproteinase, eksokitinase, glukanase, dan
sel tanaman. Hasil penelitian Vidhyasekaran et al. (1997) menyatakan bahwa R.
solani menghasilkan toksin karbohidrat yang mengandung glukosa, manosa, N
-asetilgalaktosamin, dan N-asetilglukosamin. Beberapa agen biokontrol fungi
antagonis melawan Rhizoctonia diantaranya Trichoderma dan Bacillus
megaterium.
Pseudomonas spp.
Pseudomonas adalah bakteri berbentuk batang, lurus, atau sedikit bengkok,
tetapi tidak berpilin, berdiameter 0,5 – 1, 0 μm dengan panjang 1,5 – 5,0 μm. Bersifat Gram negatif. Motil dengan satu atau beberapa flagel polar; jarang yang
nonmotil. Aerob, mempunyai tipe metabolisme respirasi terbatas dengan oksigen
sebagai akseptor elektron terakhir; pada beberapa kasus nitrat dapat digunakan
sebagai alternatif akseptor elektron terakhir, yang memungkinkan pertumbuhan
pada keadaan anaerob (Pallroni & Moore 2004).
Menurut Madigan et al. (2000), Pseudomonas tidak berspora, bersel satu
atau bersel banyak, bertunas, respirasi metabolisme, tidak pernah fermentatif,
walaupun dapat menghasilkan sejumlah kecil asam dari glukosa aerobik;
menggunakan molekul berbobot rendah atau senyawa organik, bukan polimer,
beberapa kemolitotrof, menggunakan H2 atau CO2 sebagai satu-satunya donor
elektron, beberapa dapat menggunakan arginin sebagai sumber energi anaerob.
Melakukan metabolisme glukosa melalui jalur Entner-Doudoroff. Dua enzim
kunci pada jalur Entner-Doudoroff adalah 6-fosfoglukonat dehidrase dan
2-keto-3-deoksiglukosafosfat aldolase. Menghasilkan oksidase (tetapi bakteri usus tidak
menghasilkan oksidase); menghasilkan katalase; tidak mempunyai pigmen
fotosintetik (yang membedakannya dari bakteri ungu nonsulfur); tidak
menghasilkan senyawa indol; tidak dapat memfermentasi asam-asam campuran;
tidak dapat membentuk 2,3-butanadiol. Kebutuhan nutrisinya sederhana dan
tumbuh secara kemoorganotrof pada pH netral dan kisaran temperatur mesofilik.
Pseudomonas ditemukan secara luas di dalam ekosistem tanah dan air,
mendegradasi sejumlah besar senyawa organik, berinteraksi dengan tanaman dan
berasosiasi dalam rizosfer yang bersifat menguntungkan di bidang pertanian, dan
sebagian lainnya bersifat patogen yang berbahaya. Pseudomonas dan
organisme yang secara metabolik mampu menggunakan senyawa organik dan
anorganik dalam kisaran yang luas dan hidup di bawah kondisi lingkungan yang
beragam (Pallroni & Moore 2004).
Menurut Loccoz dan Defago (2004), banyak galur Pseudomonas
menguntungkan bagi tanaman secara langsung, yaitu melalui pemacuan
pertumbuhan dan peningkatan kesehatan tanaman, dan/atau secara tidak langsung
melalui penghambatan pada, atau kompetisi dengan patogen, parasit, atau
tumbuhan kompetitor. Tidak semua pseudomonad mampu berperan sebagai
biokontrol, dan diantaranya terlihat melakukan beberapa mekanisme biokontrol
yang berbeda. Interaksi biotik penting untuk menekan fitoparasit dan terjadi
ketika pseudomonad biokontrol berasosiasi dengan tanaman untuk mengurangi
fitoparasit dalam tanah.
Analisis Sekuen Gen 16S rRNA
Membandingkan gen atau genom dua spesies adalah cara paling tepat
untuk melacak nenek moyang. Pembandingan dapat dilakukan melalui analisis
sekuen DNA (DNA sequence analysis) yaitu, pembandingan urutan nukleotida
bagian dari DNA. Dalam hal ini digunakan alat polymerase chain reaction (PCR)
untuk mengklon bagian DNA, yang kemudian dilanjutkan dengan pengurutan
basa secara otomatis menggunakan mesin pengurut DNA (DNA sequencer). Para
ahli sistematika sekarang menggunakan data sekuen nukleotida dari DNA
nukleus, mtDNA atau keduanya untuk menarik kesimpulan filogeni, membentuk
pohon filogenetik, dan mengelompokkan organisme (Madigan 2000).
Woose (1987) menggunakan gen 16S rRNA untuk mengklasifikasikan
makhluk hidup ke dalam tiga kelompok yakni Archaea, Bacteria dan Eukarya.
Daerah gen 16S rRNA merupakan daerah terkonservatif pada makhluk hidup dan
menunjukkan ciri spesifik pada setiap spesies. Ribosomal RNA (rRNA) adalah
salah satu molekul RNA yang berperan dalam pembentukan kerangka ribosom
dan merupakan organel penting dalam proses translasi RNA untuk membentuk
asam amino (Glick & Pasternack 2003).
Molekul rRNA bersifat homolog baik secara fungsional ataupun
strukturnya terkonservatif. Ukuran molekul rRNA yang cukup besar
memudahkan proses isolasi terutama komponen 16S rRNA yang telah banyak
dijadikan sumber analisis filogeni dan pengklasifikasian makhluk hidup
BAHAN DAN METODE
Isolasi dan Karakterisasi Fisiologi Pseudomonas spp. secara Parsial
Sebanyak 1 gram tanah sampel tanah rizosfer dari perkebunan kedelai asal
Cirebon dimasukkan ke dalam 10 ml larutan garam fisiologis 0.85 % ( 2.55 g
NaCl dalam 300 ml akuades). Kemudian divortex, selanjutnya diencerkan berseri
hingga 10-2, 10-3, 10-4, dan 10-5. Dengan menggunakan pipet mikro 1 ml, diambil
0.1 ml dan disebarkan diatas media agar-agar King’s B (komposisi 4.5 g agar-agar, 6 g pepton, 0.45 g K2HPO4, 0.45 g MgSO4, 4.5 ml gliserol dalam 300 ml
aquades), menggunakan batang penyebar. Cawan selanjutnya diinkubasi pada
suhu 28 0C selama 24 jam. Koloni yang tumbuh kemudian dimurnikan dengan
menggunakan media yang sama. Identifikasi Pseudomonas spp. meliputi pewarnaan gram, uji katalase, dan uji oksidase, mengikuti Bergey’s Manual of Determinative Bacteriology.
Analisis Produksi Asam Indol Asetat (IAA)
IAA yang diproduksi oleh Pseudomonas spp. diukur dengan metode
colorimetry dengan reagen Salkowski (komposisi 150 ml H2SO4 pekat, 250 ml
Aquades, 7.5 ml FeCl3.6 H2O 0.5 M) menggunakan spektrofotometer pada
panjang gelombang 510 nm (Aryantha et al. 2004). Isolat diinokulasikan kedalam 5 ml media King’s B cair yang telah ditambahkan triptofan 0.1 mM (dari stok 20 mg/ml), diinkubasi dan dikocok pada kecepatan 110 rpm pada suhu ruang selama
48 jam dalam keadaan gelap. Masing-masing diambil 3 ml, kemudian
dimasukkan ke dalam 2 eppendorf, masing-masing 1.5 ml (dikerjakan secara
duplo), selanjutnya disentrifuse pada 10000 rpm selama 15 menit. Tiap eppendorf
diambil 1 ml supernatannya dimasukkan ke dalam tabung reaksi dan
ditambahkan ke dalamnya 4 ml reagen Salkowski lalu diinkubasi selama 30
menit dalam ruang gelap pada suhu ruang. Kandungan IAA diukur dengan
menggunakan spektrofotometer (spectronic 20) pada panjang gelombang 510 nm.
Konsentrasi IAA yang terdapat dalam kultur ditentukan berdasarkan kurva
Uji Pelarutan Fosfat
Uji pelarutan fosfat dilakukan menggunakan metode standar yaitu dengan
cara menumbuhkan isolat-isolat Pseudomonas spp. pada media agar-agar
Pikovskaya yang mengandung trikalsium fosfat (Rao & Sinha 1962; Rao 1999).
Komposisi media tersebut yaitu 5 g glukosa, 2.5 g Ca3(PO4)2, 0,1 g NaCl, 0.1 g
KCl, 0.05 g MgSO4.7H2O, 1.25 mg MnSO4.2H2O, 1.25 mg FeSO4.7H2O, 0.25 g
ekstrak khamir, 0.5 g (NH4)2SO4, 7.5 g agar-agar dalam 500 ml akuades. Isolat
Pseudomonas spp. digoreskan pada media tersebut, setelah inkubasi pada suhu 28
0
C selama 3 hari, zona bening yang terdapat di sekeliling koloni diamati dan
diukur indeks pelarutan fosfatnya berdasarkan rumus:
Indeks Pelarutan fosfat = diameter zona bening – diameter koloni diameter koloni
Uji Pemacuan Pertumbuhan Kecambah Kedelai
Uji perkecambahan biji menggunakan kedelai varietas Slamet. Biji
kedelai disterilisasi permukaannya dengan cara direndam dalam etanol 95%
selama 10 detik, kemudian direndam dalam H2O2 5% selama 5 menit dan dibilas
dengan aquades steril sebanyak 7 kali untuk menghilangkan residu peroksida.
Biji yang telah disteril diletakkan pada cawan yang dialasi kertas saring
yang telah dibasahi dengan aquades steril, kemudian diletakkan di ruang gelap
selama 24 jam. Isolat Pseudomonas ditumbuhkan dalam media agar-agar King’s B pada suhu ruang selama 24 jam, kemudian diresuspensikan dengan 5-8 ml NB.
Sembilan biji yang telah mulai berkecambah diletakkan dalam cawan dengan
media agar-agar 1% dan masing-masing biji diberi 100 μl kultur bakteri (± 8 x 109 sel/ml). Perkecambahan tanpa kultur bakteri digunakan sebagai kontrol.
Cawan tersebut diinkubasi selama 7 hari pada suhu ruang dalam kondisi gelap.
Kemudian dilakukan pengukuran panjang batang, panjang akar primer, dan
jumlah akar lateral. Setiap perlakuan diulang sebanyak tiga kali. Hasil
pengukuran dianalisis secara statistik dengan one-way Analysis of Variance
Uji Antagonisme terhadap Cendawan Patogen Akar
Uji antagonis dilakukan dengan menggunakan metode standar kultur ganda.
Pada bagian tengah dari medium Potato Dextrose Agar (PDA) dalam cawan petri
berdiameter 9 cm diinokulasi kultur cendawan Rhizoctonia solani, Sclerotium
rolsfii atau Fusarium oxysporum berdiameter 5 mm. Kemudian isolat
Pseudomonas spp. digores pada sisi lain dari medium tersebut dengan jarak 3 cm
dari kultur cendawan (Gambar 2). Kultur ini diinkubasi pada suhu 28 0C selama
3-5 hari dan diamati perkembangannya. Adanya interaksi antagonis ditandai
dengan terbentuknya zona penghambatan antara isolat Pseudomonas spp. dengan
cendawan (Dikin 2006). Radius zona penghambatan diukur dalam mm.
Persentase penghambatan diukur dengan rumus :
Persentase penghambatan =.
B A
1 x 100%
Keterangan:
A : Jarak pertumbuhan fungi pada sisi isolat bakteri
B : Jarak pertumbuhan fungi pada sisi lain pada cawan yang sama sebagai
kontrol
Uji Reaksi Hipersensitivitas
Suspensi isolat Pseudomonas spp. dari kultur berumur 24-48 jam dengan
kepadatan 108- 109 sel/ml diinjeksikan ke ruang interseluler diantara vena-vena
daun tembakau menggunakan siring berukuran 1 ml. Untuk setiap isolat yang
diuji dilakukan dengan ulangan sebanyak tiga kali. Pada sisi lain dari daun
tembakau juga disuntikkan akuades dan bakteri E. coli sebagai kontrol negatif,
serta bakteri Ralstonia solanacearum sebagai kontrol positif.
Reaksi hipersensitif positif ditunjukkan dengan kematian cepat,
kekeringan dan nekrosis kecoklatan pada jaringan daun yang diinokulasi dalam
24 sampai 48 jam. Jaringan yang berwarna kekuningan tidak menunjukkan reaksi
positif (Lelliott & Stead 1987).
Analisis Genetik secara Parsial Pseudomonas spp. Berdasarkan Sekuen Gen 16S rRNA
Ekstrasi DNA
Isolat Pseudomonas spp. yang telah diidentifikasi dapat memacu
pertumbuhan secara signifikan dan nonpatogenik, ditumbuhkan pada suhu ruang selama 24 jam di dalam medium cair King’s B dan dikocok pada kecepatan 110 rpm. Kemudian suspensi sel bakteri di masukkan ke dalam ependorf dan
disentrifus pada 12000 rpm selama 4 menit. Supernatan dibuang dan DNA dari
pelet bakteri diekstraksi menggunakan metode seperti yang dijelaskan dalam
Sambrook (1989).
Amplifikasi 16S rDNA
Reaksi PCR dilakukan dengan total volume reaksi 50 μl yang mengandung 0.5 μl Taq polimerase, 25 μl buffer GC, 8 μl dNTP, 10 μl DNA template, 1 μl primer forward (10 pmol), 1 l primer reverse (10 pmol) dan 2.5 l ddH2O steril. Primer yang digunakan untuk amplifikasi gen 16S rDNA adalah
63f : 5’-CAG GCC TAA CAC ATG CAA GTC-3’ dan 1387r : 5’- GGG CGG W(purin)GT GTA CAA GGC-3’ (Marchesi et al. 1998). PCR dilakukan menggunakan mesin Gene Amp PCR 2400 (Perkin Elmer, USA) dengan siklus
thermal diatur sebagai berikut: langkah denaturasi awal pada suhu 94 0C selama 2
menit, dilanjutkan dengan 30 siklus yang masing-masing terdiri dari: denaturasi
pada suhu 92 0C selama 30 detik, annealing pada suhu 55 0C selama 30 detik,
ekstensi pada suhu 75 0C selama 1 menit, dengan ekstensi akhir pada suhu 75 0C
selama 5 menit. Selanjutnya hasil PCR dilarikan pada elektroforesis gel agarosa
1% dan divisualisasi menggunakan pewarnaan dengan etidium bromida.
Analisis Sekuen DNA
DNA hasil amplifikasi dengan PCR dimurnikan dan dianalisis secara parsial
sekuennya menggunakan mesin DNA squencer ABI 310 (Perkin Elmer, USA) menggunakan jasa Charoen Phokphan Indonesia, Jakarta. Hasil sekuensing DNA
dibandingkan dengan data yang ada pada GenBank menggunakan program BLAST melalui layanan National Centre for Biotechnology Information (NCBI).
Perbandingan sekuen dilakukan menggunakan program ClustalX, dendogram dibuat
HASIL
Isolasi dan Karakterisasi Fisiologi secara Parsial Pseudomonas spp.
Telah berhasil diisolasi 50 isolat Pseudomonas spp. yang berasal dari
rizosfer kedelai asal Cirebon, Jawa Barat. Isolat-isolat ini diidentifikasi mengikuti
Bergey’s Manual of Determinative Bacteriology dan mempunyai karakteristik parsial Gram negatif, sel berbentuk batang, lurus, atau sedikit bengkok, dengan
panjang 1,5 – 5,0 μm dengan ukuran dan penataan yang berbeda-beda. Reaksi katalase positif dan reaksi oksidase positif. Koloni isolat Pseudomonas spp.
memiliki bentuk bervariasi antara bulat sampai bundar tak beraturan dengan
tepian licin, dengan elevasi cembung, timbul dan berbukit. Koloni memiliki
warna putih, krem muda sampai krem tua (Gambar 2).
Karakteristik Pseudomonas spp. sebagai Pemacu Pertumbuhan
Dari keseluruhan isolat yang diteliti, terdapat 50 isolat Pseudomonas spp.
yang memiliki kemampuan mensintesis IAA di dalam kultur medium yang
ditambahkan dengan triptofan. Pengukuran IAA dilakukan berdasarkan
perubahan warna supernatan setelah ditambah reagen Salkowski dan kemudian
diinkubasi. Perubahan warna terjadi dari kuning menjadi warna merah muda
sampai kecoklatan. Penghitungan konsentrasi IAA dilakukan melalui uji
kolorimetrik. Konsentrasi IAA yang dihasilkan berkisar antara 0.33 ppm sampai
23.04 ppm, yang dapat dikelompokkan menjadi tiga kelompok kisaran
konsentrasi IAA, yakni konsentrasi rendah (0.33-8.00 ppm), konsentrasi sedang
(8.01-16.00 ppm), dan konsentrasi tinggi (lebih dari 16.00). Sebanyak 20 (40%)
isolat menghasilkan IAA dengan konsentrasi rendah, 18 (36%) isolat
menghasilkan IAA dengan konsentrasi sedang, dan 12 (26%) isolat menghasilkan
IAA dengan konsentrasi tinggi. Diperoleh hasil bahwa isolat Pseudomonas sp.
Crb 90 adalah yang menghasilkan IAA dengan konsentrasi tertinggi yaitu 23.04
ppm.
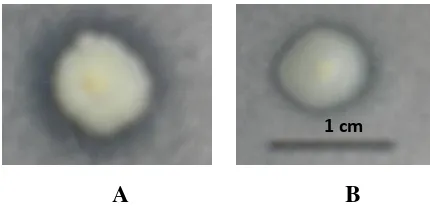
Sebanyak 32 (64%) isolat Pseudomonas spp. mampu melarutkan fosfat
yang terkandung di dalam media Pikovskaya. Media ini berwarna putih, zona
A B
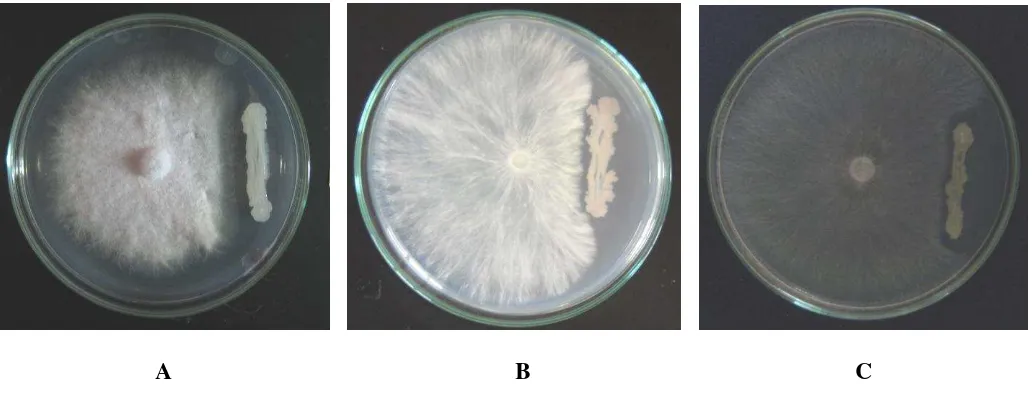
Gambar 2 Penampilan isolat Pseudomonas spp. (A) Koloni isolat Crb 83 pada media agar-agar King’s B
(B) Sel Pseudomonas spp. menunjukkan Gram negatif berbentuk batang (perbesaran 1000 kali).
__
menunjukkan adanya aktivitas pelarutan fosfat (Gambar 3). Indeks pelarutan
fosfat dihitung setelah kultur berumur tiga hari, dan diperoleh kisaran antara 0.06
sampai 0.80. Isolat Crb 53 mempunyai indeks pelarutan fosfat tertinggi, yaitu
0.80.
[image:45.595.203.418.188.291.2]
A B
Gambar 3 Zona bening pada uji pelarutan fosfat oleh : (A) isolat Crb 80 dan (B) isolat Crb 64
Data karakteristik isolat Pseudomonas spp. meliputi karakter kemampuan
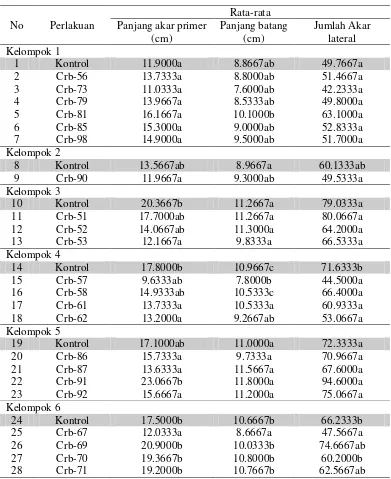
memproduksi IAA dan melarutkan fosfat secara rinci tertera pada Tabel 1.
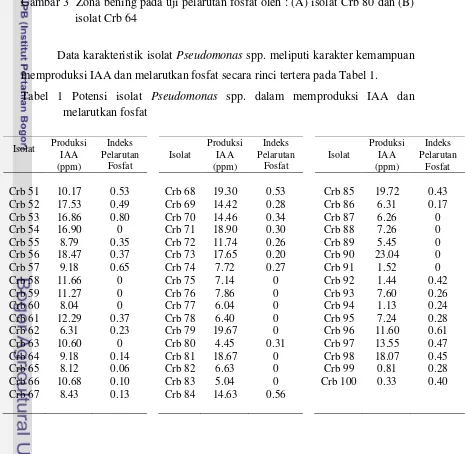
Tabel 1 Potensi isolat Pseudomonas spp. dalam memproduksi IAA dan melarutkan fosfat
Isolat Produksi IAA (ppm) Indeks Pelarutan Fosfat Isolat Produksi IAA (ppm) Indeks Pelarutan Fosfat Isolat Produksi IAA (ppm) Indeks Pelarutan Fosfat
Crb 51 10.17 0.53 Crb 68 19.30 0.53 Crb 85 19.72 0.43
Crb 52 17.53 0.49 Crb 69 14.42 0.28 Crb 86 6.31 0.17
Crb 53 16.86 0.80 Crb 70 14.46 0.34 Crb 87 6.26 0
Crb 54 16.90 0 Crb 71 18.90 0.30 Crb 88 7.26 0
Crb 55 8.79 0.35 Crb 72 11.74 0.26 Crb 89 5.45 0
Crb 56 18.47 0.37 Crb 73 17.65 0.20 Crb 90 23.04 0
Crb 57 9.18 0.65 Crb 74 7.72 0.27 Crb 91 1.52 0
Crb 58 11.66 0 Crb 75 7.14 0 Crb 92 1.44 0.42
Crb 59 11.27 0 Crb 76 7.86 0 Crb 93 7.60 0.26
Crb 60 8.04 0 Crb 77 6.04 0 Crb 94 1.13 0.24
Crb 61 12.29 0.37 Crb 78 6.40 0 Crb 95 7.24 0.28
Crb 62 6.31 0.23 Crb 79 19.67 0 Crb 96 11.60 0.61
Crb 63 10.60 0 Crb 80 4.45 0.31 Crb 97 13.55 0.47
Crb 64 9.18 0.14 Crb 81 18.67 0 Crb 98 18.07 0.45
Crb