SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2014
SERTA PENCIRIAN XILANASE
Dengan ini saya menyatakan bahwa tesis Penapisan Isolat Pendegradasi Xilan Bagas serta Pencirian Xilanase adalah karya saya dengan komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam daftar pustaka dibagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, September 2014
Gading Wilda Aniriani
pencirian xilanase. Dibimbing oleh ANJA MERYANDINI dan YOPI.
Xilanase merupakan enzim ekstraseluler yang dapat dihasilkan oleh mikroba. Enzim ini digunakan secara luas dalam aplikasi bioteknologi. Xilanase diproduksi menggunakan substrat xilan bagas. Penggunaan bagas sebagai biomassa tidak akan bersaing dengan ketahanan pangan. Hidrolisis xilan bagas tebu dapat menghasilkan produk xilooligosakarida. Xilan merupakan komponen hemiselulosa pada bagas. Xilanase dapat menjangkau xilan dan secara mudah mengkonversinya menjadi gula sederhana, oleh karena itu perlu dilakukan
pretreatment dan ekstraksi.
Selulosa secara alami diikat oleh hemiselulosa dan dilindungi oleh lignin, oleh karena itu disebut dengan lignoselulosa. Adanya senyawa pengikat lignin inilah yang menyebabkan bahan-bahan lignoselulosa sulit untuk dihidrolisa.
Pretreatment akan merusak dinding sel tanaman dan akan mempermudah akses enzim pada polisakarida bagas. Pretreatment meliputi delignifikasi dan ekstraksi xilan. Ekstraksi xilan bertujuan untuk memisahkan komponen xilan dengan selulosa.
Proses pretreatment bagas meliputi delignifikasi menggunakan sodium hipoklorit (NaOCl) 1% dan ekstraksi xilan menggunakan metode alkalin (NaOH 15%) sebagai pelarut. Terdapat tiga isolat bakteri xilanolitik yang berasal dari Taman Nasional Bukit Duabelas (TNBD) Jambi yaitu isolat XJ (Xilanolitik Jambi) no 17, 28 dan 30. Isolat tersebut kemudian diuji secara kualitatif dan kuantitatif pada substrat xilan bagas. Uji kualitatif menggunakan metode pewarnaan merah-kongo, sedangakan uji kuantitatif menggunakan metode DNS. Penelitian ini bertujuan untuk melakukan penapisan xilanase dari 3 bakteri xilanolitik, mengkarakterisai xilanase isolat potensial dan menghidrolisis xilan bagas. Isolat potensial pendegradasi xilan bagas diidentifikasi dengan 16S rRNA. Produk hidrolisis dianalisis menggunakan KLT (Kromatografi Lapis Tipis).
Hasil ekstraksi xilan dari bagas diperoleh 9,9% xilan dari bagas dan setelah pemurnian diperoleh 3,4 % xilan larut. Isolat yang dapat menggunakan substrat xilan bagas dalam uji kualitatif yaitu no XJ28 dan XJ30. Aktivitas xilanase tertinggi adalah isolat XJ28 pada xilan bagas diperoleh pada jam ke-96 masa inkubasi dengan aktivitas 11,3 ± 0,6 U/mL, sedangkan pada isolat XJ30 sebesar 0,3 ± 0,005 U/mL pada jam ke-3 masa inkubasi. Produk ekstraksi xilan bagas kemudian dibandingkan dengan produk komersial, xilanase XJ28 diproduksi dari substrat xilan beechwood komersial (Sigma) dan mendapatkan aktivitas enzim sebesar 11,5 ± 0,2 U/mL pada jam ke-48 masa inkubasi. Isolat XJ28 memiliki karakter xilanase optimum pada pH 7 dengan suhu 50 °C, stabil sampai inkubasi jam ke-72 pada suhu ruang maupun pada suhu 4 °C, dan bebas selulase. Berdasarkan hasil tersebut, hidrolisis xilan bagas 0,5 % oleh xilanase ekstrak kasar menghasilkan gula reduksi dengan BM yang sama dengan sukrosa.
Berdasarkan identifikasi 16S rRNA, isolat potensial XJ28 memiliki tingkat kemiripan 99 % dengan Bacillus subtilis.
and xylanases characteristic. Supervised by ANJA MERYANDINI and YOPI. Xylanase extracellular enzyme is produced by various microbes. The enzymes are widely used in biotechnology applications. Xylanase can produce used the bagasse xylan substrate. The use of bagasse as biomass will not compete with the food stability. Hydrolysis of bagasse xylan can produced xylooligosaccaride. The main components of hemicellulose was xylan at bagasse. Xylanase can reach xylan it easily convert into simple sugars, therefore it is necessary for pretreatment and extraction.
Cellulosa was naturally bound by hemicellulose and was protected by lignin, therefore called lignosellulose. The presence of lignin-binding compound that causes lignocellulosic materials difficult to hydrolized. Pretreatment will damage the cell walls of plants and will facilitate access to the enzyme of bagasse polysaccharides. Pretreatment includes delignification and xylan estraction. Xylan estraction aims to separate the compounents of xylan free cellulosa.
Pretreatment process included delignification using sodium hypochlorite 1% and xylans extraction using alkaline (NaOH 15%) as the solvent. There are three isolate xylanolytic bacteria from Taman Nasional Bukit Duabelas (TNBD) Jambi that is 17, 28 and 30 number isolate Xylanolytic Jambi (XJ). The isolate were then tested qualitative and quantitative of the bagasse xylan substrate. The qualitative test used Congo-Red stainning, whereas quantitative test used DNS methode. This research aims was to the screening xylanases from three xylanolytic bacteria, characterized the potential isolate xylanase and hidrolyzed the xylan bagasse. The potential isolate degrading of xylan bagasse identified with 16S rRNA. The hydrolysis product was analysis used TLC (Thin Layer Chromatography).
The result of the xylans extracted from bagasse was 9,9% xylan and after purification was obtained 3,4% soluble xylan. Isolate was used the xylan bagasse in qualitative test that is number XJ28 and XJ30. Xylanase activity isolate XJ28 has the highest activity at was 96 h of incubation time with activity at 11,3 U/mL, whereas of isolat XJ30 that is 0,3 U/mL at was 3 h of incubation time. The product of xylan bagasse extraction and than comparison with commercial product, xylanase XJ28 produced from xylan beechwood commercial (Sigma) and obtained enzyme activity that is 11,5 ± 0,2 U/mL at was 48 hour of incubation time. Xylanase is isolate 28 has the optimum condition at pH 7 and 50 ºC, stable up to 72 hr of incubation at room temperature and 4 ºC and free-cellulose. The hydrolysis product using xylanase isolate XJ28 was reducing sugar with the similiar molecular weight with sucrose. According identified 16S rRNA, isolate XJ28 has a degree of similarity with the Bacillus subtilis.
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
PENAPISAN ISOLAT PENDEGRADASI XILAN BAGAS
SERTA PENCIRIAN XILANASE
GADING WILDA ANIRIANI
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Bioteknologi
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Disetujui oleh Komisi Pembimbing
Prof Dr Anja Meryandini MS Ketua
Dr Yopi Anggota
Diketahui oleh
Ketua Program Studi Bioteknologi
Prof Dr Ir Suharsono DEA
Dekan Program Pascasarjana IPB
Dr Ir Dahrul Syah MSc Agr
Tanggal Ujian: ( 22 Agustus 2014)
Tanggal Lulus:
segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Maret 2013 ini ialah enzim, dengan judul Penapisan Isolat Pendegradasi Xilan Bagas serta Pencirian Xilanase.
Terima kasih penulis ucapkan kepada Ibu Prof Dr Anja Meryandini MS dan Bapak Dr Yopi selaku pembimbing yang telah banyak memberi saran, meluangkan waktu dan pikiran. Penulis juga tidak lupa berterima kasih kepada Ibu Dr. Nisa Rachmania Mubarik Msi selaku penguji pada sidang tesis yang telah memberikan kritik dan saran dalam penulisan. Di samping itu, penghargaan penulis sampaikan kepada Kepala Laboratorium Bioenergi dan Fermentasi Pusat Penelitian Bioteknologi Lembaga Ilmu Pengetahuan Indonesia (LIPI), Bapak Dr Yopi beserta staf yang telah memberikan fasilitas penelitian. Penulis juga menyampaikan terima kasih kepada Kepala Laboratorium Ilmu dan Teknologi Pakan dalam analisis komponen serat bagas dan Kepala Pusat Penelitian Sumberdaya Hayati dan Bioteknologi (PPSHB) yang telah membantu dalam analisis proksimat sampel limbah tebu (bagas). Ungkapan terima kasih juga disampaikan kepada ayah, ibu, empat adik perempuan penulis (Kasyafia, Mega, Su’aisyah, Aliyah), calon pendamping hidup penulis (Andaru) serta seluruh keluarga besar, sahabat, teman-teman Bioteknologi IPB 2011 atas segala doa, dukungan dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Mei 2014
LEMBAR PENGESAHAN DAFTAR TABEL
DAFTAR GAMBAR DAFTAR LAMPIRAN
1 PENDAHULUAN 1
Tujuan Penelitian 2
Hipotesis Penelitian 2
Manfaat Penelitian 2
Ruang Lingkup Penelitian 3
2 METODE 3 Waktu dan Tempat 3 Bahan dan Alat 3 Tahapan Penelitian 4 Pretreatment Substrat Bagas 5
Penentuan kemampuan delignifikasi substrat 6
Bakteri Penghasil Xilanase 6
Produksi Xilanase 6
Karakteristik Xilanase 7
Hidrolisis Xilan Bagas dengan Xilanase 8
Identifikasi Bakteri dengan Analisis Gen 16S rRNA 9
3 HASIL DAN PEMBAHASAN 11
Pretreatment Bagas 11
Bakteri Penghasil Xilanase 17
Produksi Xilanase menggunakan Xilan Bagas 18
Perbandingan Aktivitas Xilanase dari xilan bagas dan xilan beechwood (Sigma) 10
Karakteristik Enzim 22
Hidrolisis Xilan Bagas dengan Xilanase 25
Identifikasi Bakteri Potensial dengan Molekuler 27
4 KESIMPULAN DAN SARAN 29
DAFTAR PUSTAKA 29
LAMPIRAN 34
1 Kelarutan xilan dalam beberapa pelarut 5 2 Hasil dari neraca massa tahapan pretreatment substrat 12 3 Komposisi kimia hasil analisis komponen proksimat sebelum dan
setelah delignifikasi 13
4 Komposisi kimia hasil analisis komponen serat sebelum dan
setelah delignifikasi 14
5 Data hasil Indeks Xilanolitik (IX) dari uji kualitaif pewarnaan
merah-kongo pada masing-masing isolat 18
6 Aktivitas xilanase sebelum dan sesudah proses dialisis 25 7 Perbedaan hasil nilai Rf pada sampel hasil hidrolisis dan stdanar gula
hasil KLT 27
8 Persentase kemiripan sekuen gen 16S rRNA isolat XJ28 28
DAFTAR GAMBAR
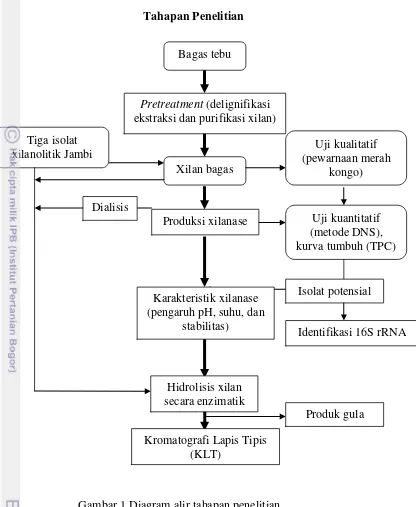
1 Diagram alir tahapan penelitian 4
2 Preparasi bagas secara fisik 11
3 Hasil pretreatment bagas tebu 16
4 Peremajaan tiga bakteri xilanolitik pada media xilan beechwood
(Sigma) selama 24 jam 17
5 Hasil analisis kualitatif bakteri xilanolitik pada substrat xilan bagas 0,5
% dengan metode pewarnaan merah-kongo 0,2 % 18
6 Grafik hubungan antara jumlah 10log TPC dengan aktivitas xilanase selama inkubasi jam ke-0 sampai jam ke-168 dalam medium xilan bagas 0,5 %.(pH 7) inkubasi pada suhu 28 °C dengan agitasi 150 g 19 7 Grafik perbedaan antara aktivitas xilanase isolat XJ28 yang diproduksi
dari xilan bagas dengan xilan beechwood (Sigma). Substrat uji xilan
beechwood (Sigma) 0,5 % pH 7 selama 30 menit. 20
8 Grafik pengaruh berbagai pH bufer terhadap aktivitas xilanase. Kondisi uji pada bufer sitrat (3-5,5), bufer fosfat (6-7,5) dan bufer glisin NaOH (8-10) masing-masing dengan konsentrasi 0,02 M, reaksi selama 30
menit 22
9 Grafik pengaruh berbagai suhu terhadap aktivitas xilanase 23 10 Grafik hubungan perbandingan lama waktu penyimpanan terhadap
aktivitas xilanase XJ28 pada kisaran suhu 24
11 Visualisasi KLT hasil hidrolisis xilanase XJ28 pada xilan bagas 26 12 Amplifikasi PCR terhadap gen 16S rRNA dengan primer 63 f dan
2 Nerasa massa ekstraksi xilan bagas tebu 37 3 Contoh penghitungan penurunan bobot komponen serat bagas 40
4 Analisis dan penghitungan aktivitas enzim 41
5 Hasil pensejajaran DNA isolat XJ 28 pada program MEGA 44 6 Hasil penghitungan TPC pada prekultur (pada OD620 = 0,7) 45 7 Surat Penerimaan artikel pada Jurnal Biologi Indonesia (JBI)
1
PENDAHULUAN
Enzim merupakan senyawa biokatalis berupa molekul polimer yang tersusun atas asam amino. Enzim merupakan protein yang diproduksi dan digunakan oleh sel hidup salah satunya untuk mengkonversi substrat menjadi molekul yang bermanfaat. Enzim yang memiliki kemampuan dalam mendegradasi hemiselulosa ialah xilanase, dalam hal ini xilan atau polimer dari xilosa dan xilo-oligosakarida. Xilanase merupakan jenis enzim yang digunakan secara luas dalam bidang aplikasi bioteknologi, misalnya pada peternakan sebagai campuran pakan ternak (Richana 2002), dikombinasikan dengan selulase dan pektinase dapat digunakan untuk menjernihkan juice dan likuifikasi buah dan sayur (Beg et al.
2001), pada proses pemutihan kertas (Wang et al. 2010), untuk peningkatkan kualitas roti (Zheng et al. 2011), dan produksi bioenergi seperti etanol (Samsuri et al. 2009). Sebagian besar xilanase mampu mendegradasi jenis xilan, dan hanya dibedakan dari produk akhir yang dihasilkan (Himmel 2008). Produk akhir yang diharapkan pada masing-masing aplikasi dibutuhkan jenis xilanase spesifik. Xilanase dapat diklasifikasikan berdasarkan spesifikasi pemecahan substrat pada proses degradasi yaitu -xilosidase, endoxilanase, dan eksoxilanase (Richana 2002), dan arabinofuranosidase, glukuronidase, dan asetilxilan esterase (Prakash
et al. 2012). Endo-1,4- -xilanases (EC 3.2.1.8) menghidrolisis rantai utama xilan, sedangkan -xilosidase (EC 3.2.1.37) memecah hasil oligomer menjadi monomer xilosa (Saleem et al. 2012). Jenis mikroorganisme yang sudah umum menghasilkan xilanase ialah bakteri. Sebagai sumber enzim, kelebihan bakteri memiliki laju pertumbuhan yang cepat, dapat tumbuh pada substrat yang murah. Berikut beberapa contoh bakteri yang telah diisolasi dan dapat menghasilkan xilanase yaitu, Clostridium absonum CFR-702 (Rani dan Nand 2000), Bacillus sp (Heck et al. 2006), Bacillus pumilus RXAIII-5 (Richana et al. 2007), dan
Alternaria sp. ND-16 (Li et al. 2009).
Xilosa atau xilo-oligisakarida merupakan produk komersial yang tidak murah. Salah satu cara untuk menekan biaya produksi xilanase ialah dengan memanfaatkan bahan dasar limbah sebagai medium tumbuh bakteri dan proses hidrolisis. Beberapa contoh lignoselulosa yang dapat digunakan antara lain limbah pertanian (rumput, alang-alang, sekam padi, jerami, batang gandum, tongkol, dan jagung) dan limbah hasil samping industri fermentasi (molase,bagas) (Iranmahboob et al. 2002; Campo et al. 2006). Salah satu bahan baku yang dapat digunakan ialah limbah ampas tebu (bagasse atau bagas). Selain ketersediannya yang melimpah juga tidak bersaing dengan bahan dasar pangan. Menurut Lavarack et al. (2002) bagas merupakan hasil samping proses pembuatan gula tebu (sugarcane) yang mengandung residu berupa serat. Minimal 50% serat bagas diperlukan sebagai bahan bakar (ketel) sedangkan 50% sisanya hanya ditimbun sebagai buangan yang memiliki nilai ekonomi rendah. Serat bagas umumnya mengandung polisakarida yang tersusun atas 50%-55% selulosa, 15%-20% hemiselulosa dan lignin sekitar 20-30%, selain itu sisanya disebut senyawa abu (Pandey et al. 2000; Samsuri et al. 2009). Komponen kimia dari bagas secara rinci meliputi 37,35 % glukan (selulosa), 23,66 % xilan (hemiselulosa), 2,1 % lignin, 3,25 % senyawa ekstraktif lain, dan 1,79 % senyawa abu (Sandra et al. 2007).
mengkonversinya menjadi gula sederhana, oleh karena itu perlu dilakukan
pretreatment dan ekstraksi. Pretreatment bertujuan untuk memecah lignin (delignifikasi) dan merusak struktur kristal yang mengikat selulosa (Sudiyani et al. 2010), selain itu juga bertujuan untuk memecah bahan-bahan lignoselulosa baik dari segi struktur dan ukuran. Himmel (2008) biomassa yang tidak dipretreatment akan bersifat recalcitrant bagi mikrob. Menurut Iranmahboob et al. (2002) adanya senyawa pengikat lignin itulah yang menyebabkan bahan-bahan lignoselulosa sulit untuk dihidrolisis. Taherzadeh dan Karimi (2007) menjelaskan bahwa hidrolisis enzimatis memiliki beberapa keuntungan dibandingkan hidrolisis asam, antara lain: kondisi proses yang lebih lunak (suhu rendah, pH netral) dan biaya pemeliharaan peralatan relatif rendah karena tidak ada bahan yang korosif.
Xilan merupakan komponen utama hemiselulosa pada tanaman. Struktur xilan yang beragam memberikan pengaruh pada aktivitas xilanase yang berbeda (Li et al. 2010). Keragaman xilanase disebabkan struktur yang beragam dari xilan, oleh karena itu dilakukan karakterisasi xilanase untuk mengetahui kondisi optimum dalam menghidrolisis xilan. Tseng et al. (2002) setiap aplikasi memerlukan jenis xilanase dengan sifat tertentu. Dalam penelitian ini akan diseleksi tiga isolat bakteri xilanolitik dari Taman Nasional Bukit Duabelas (TNBD) Jambi dalam mendegradasi xilan bagas. Penelitian sebelumnya (Kurrataa’yun β01γ), telah berhasil mengisolasi bakteri xilanolitik dari TNBD. Bakteri yang telah diisolasi merupakan mikrob indigenos yang belum diteliti dan belum diidentifikasi galurnya, terutama kemampuannya dalam menghasilkan xilanase pada substrat xilan bagas. Bakteri xilanolitik potensial dalam substrat xilan bagas akan dikarakterisasi xilanasenya untuk mendegradasi xilan bagas.
Tujuan Penelitian
Penelitian ini bertujuan untuk mendapatkan xilan hasil ekstraksi dari limbah ampas tebu (bagas) dan melakukan penapisan xilanase dari tiga isolat xilanolitik pada substrat xilan bagas untuk degradasi xilan bagas serta mengkarakteristik enzimnya, yang meliputi suhu, pH optimum, stabilitas dan produk hidrolisisnya.
Hipotesis Penelitian
Pretreatment bagas tebu mendapatkan ekstrak xilan dan bakteri xilanolitik hasil isolasi dari Taman Nasional Bukit Duabelas (TNBD) Jambi dapat menghasilkan enzim xilanase yang dihasilkan dari xilan bagas untuk proses hidrolisis substrat xilan bagas.
Manfaat Penelitian
Ruang Lingkup Penelitian
Penelitian ini memiliki tema tentang enzim xilanase, selama ini xilanase banyak digunakan dalam aplikasi bioteknologi. Penggunan xilanase dalam beberapa proses industri dinilai sangat mahal sehingga diperlukan substrat untuk produksi enzim berasal dari limbah bagas tebu. Ruang lingkup penelitian ini mencakup bagaimana cara memperlakukan dan mengekstraksi limbah bagas agar mudah digunakan oleh bakteri xilanolitik, mengkarakteristik xilanase agar mendapatkan spesifikasi jenis xilanase dan mendapatkan produk hidrolisis berupa gula sederhana (misalnya xilopentosa atau xilo-oligosakarida) dari hasil ekstraksi bagas oleh enzim xilanase yang dihasilkan sendiri dari substrat tersebut. Xilanase maupun produk gula sederhana yang dihasilkan merupakan penemuan baru dalam menentukan aplikasi bioteknologi, mengingat bakteri xilanolitik merupakan isolat
indigenous baru yang belum diteliti sebelumnya.
2
METODE
Waktu dan Tempat
Penelitian dilakukan pada bulan Maret 2013 sampai dengan Maret 2014 di Laboratorium Biokatalis dan Fermentasi (LBF) bidang bioproses pada Pusat Penelitian Bioteknologi Lembaga Ilmu Pengetahuan Indonesia (LIPI) Cibinong Bogor.
Bahan dan Alat
Tahapan Penelitian
Gambar 1 Diagram alir tahapan penelitian Bagas tebu
Pretreatment (delignifikasi ekstraksi dan purifikasi xilan)
Xilan bagas Tiga isolat
xilanolitik Jambi (pewarnaan merah Uji kualitatif kongo)
Produksi xilanase Uji kuantitatif (metode DNS), kurva tumbuh (TPC)
Isolat potensial Karakteristik xilanase
(pengaruh pH, suhu, dan stabilitas)
Identifikasi 16S rRNA
Hidrolisis xilan secara enzimatik
Kromatografi Lapis Tipis (KLT)
Dialisis s
Pretreatment Substrat Bagas
Preparasi Bagas
Limbah tebu yang berupa ampas tebu di keringkan dengan oven pada suhu 80 ºC sampai kering dan dihancurkan dengan mesing giling. Setelah menjadi serbuk bagas kemudian dilakukan pembubukan lolos saringan 40 mesh, hasil modifikasi dari Lee (2003). Kandungan total selulosa, hemiselulosa, lignin dan lain-lain pada bagas didapatkan dari analisis proksimat dan komponen serat. Tahapan proses analisis dapat dilihat pada Lampiran 1.
Delignifikasi
Delignifikasi serbuk bagas dilakukan berdasarkan penelitian Richana et al.
(2007) (yang telah dimodifikasi) dengan menggunakan pelarut natrium hipoklorit (NaOCl) 1%, proses delignifikasi dilakukan selama 5 jam pada suhu ruang. Hasilnya kemudian dicuci sampai bau NaOCl nya hilang, lalu dilakukan proses penyaringan untuk membuang air yang mengandung lignin. Bubuk bagas kemudian dikeringkan pada suhu 50 ºC selama 48 jam. Hasil delignifikasi dianalisis proksimat dan komponen serat kembali untuk mendapatkan kandungan selulosa, hemiselulosa dan lignin setelah delignifikasi. Tahapan neraca massa proses pretreatment dapat dilihat pada Lampiran 2.
Ekstraksi Xilan dari Bagas
Metode ekstraksi xilan menggunakan metode dari Richana et al. (2007). Ekstraksi xilan menggunakan NaOH sebagai larutan pengekstrak xilan dari bagas, karena sifat kelarutannya pada xilan (Tabel 1). Padatan hasil delignifikasi direndam dalam larutan natrium hidroksida (NaOH) 15% pada suhu 28ºC selama 24 jam untuk mendapatkan ekstrak xilan. Setelah 24 jam dilakukan penyaringan dengan menggunakan kain saring, filtrat (suspensi) yang dihasilkan dari proses ekstraksi diukur pH nya kemudian dinetralkan dengan menggunakan HCl 37% sampai netral (pH 7). Suspensi kemudian di sentrifuge pada 6000 g selama 15 menit. Supernatan mengandung ekstrak xilan, sedangkan endapan dibuang. Xilan yang larut dalam supernatan dibersihkan dengan menambahkan etanol 95%. Etanol ditambahkan pada supernatan dengan perbandingan supernatan-etanol ialah 1:3 kemudian dilakukan sentrifuge kembali dengan kecepatan 6000 g selama 15 menit. Hasil dari sentrifugasi tersebut ialah endapan yang mengandung xilan. Tabel 1 Kelarutan xilan dalam beberapa pelaruta
Penentuan Kemampuan Delignifikasi Substrat
Substrat hasil delignifikasi dengan NaOCl 1 % yang telah dikeringkan dalam oven 5 ºC selama 48 jam. Substrat ini selanjutnya digunakan untuk analisis kandungan selulosa, hemiselulosa dan lignin menggunakan metode Van Soest et al. (1991). Persentase kehilangan bobot substrat dihitung dengan persamaan berikut:
Susut bobot (%) = Keterangan :
BKO = Bobot Kering Oven (g)
Penurunan kadar komponen serat (sebagai lignin, selulosa, hemiselulosa) dihitung berdasarkan rumus:
Persentase penurunan komponen serat (%) = Keterangan :
x = kadar komponen serat sebelum delignifikasi (%) y = kadar kompnen serat setelah delignifikasi (%) z = susut bobot (%)
Bakteri Penghasil Xilanase Peremajaan Isolat
Isolat XJ (no. 17, 28 dan 30) masing-masing diremajakan dengan cara menumbuhkannya pada media padat xilan (beechwood, Sigma) 0,5%, kemudian cawan diinkubasi selama 24 jam pada suhu ruang.
Uji Kualitatif (Pewarnaan Merah-Kongo)
Uji kualitatif pertumbuhan masing-masing bakteri XJ (isolat 17, 28 dan 30) dilakukan dengan mengambil sebanyak 2 µL suspensi bakteri kemudian diinokulasikan pada media padat xilan bagas 0,5% dan diinkubasi selama 24-48 jam pada suhu ruang. Uji dilakukan dengan pewarna merah kongo 0,2% dalam media kultur bakteri sampai semua lapisan tergenang selama 15 menit. Kemudian dicuci (destainning) dengan NaCl 2%. Pengamatan zona bening dilakukan sebagai indikator aktivitas enzim.
Produksi Xilanase
Kurva pertumbuhan bakteri dan kurva aktivitas xilanase
suhu ruangdi 150 g (OD 620 nm antara 0,5-0,8). Pencawanan prekultur dilakukan pada pengenceran 10-6-10-8.
Sebanyak 15 mL (10%v/v) biakan hasil prekultur dimasukkan ke dalam 135 mL media cair xilan bagas 0,5% pH 7 dan suhu ruang.Inkubasi dilakukan selama 7 hari dalam suhu ruang pada 150 g. Sampling dilakukan setiap 3, 6, 9, 12, 18, 24, 30, 36,48, 60, 72, 96, 120, 144, dan 168 jam. Setiap sampling diambil sebanyak 3 mL ke dalam tabung eppendorf steril secara aseptik, sebanyak 1 mL diencerkan untuk dihitung koloni bakterinya dengan metode Total Plate Count
(TPC). Sebanyak 2 mL disentrifugasi suhu 4ºC pada 15.000 g selama 10 menit. Supernatan sebagai enzim ekstrak kasar diuji aktivitasnya.
Uji aktivitas enzim xilanase dilakukan berdasarkan metode DNS (Miller 1959) pada masing-masing bakteri. Nilai absorban yang diperoleh dikonversi menjadi konsentrasi gula pereduksi menggunakan persamaan yang didapat dari kurva standar xilosa. Pembuatan kurva standar xilosa dapat dilihat pada lampiran 1. Satu unit aktivitas enzim xilanase (U) didefinisikan sebagai sejumlah enzim yang dapat mengkatalisis konversi dari 1 µmol xilan menjadi xilosa dalam 1 menit (Prakash et al. 2012). Aktivitas xilanase dihitung menggunakan rumus sebagai berikut:
Aktivitas enzim = Gula reduksi (mg/mL) x FP x 1000 Waktu reaksi x BM xilosa
PerbandinganAktivitas Xilanase yang Diproduksi dari Xilan Bagas dengan Xilan Beechwood Komersial (Sigma)
Isolat potensial hasil penapisan kualitatif dan kuantitatif kemudian diproduksi xilanasenya dari medium produksi xilan komersial. Enzim ekstrak kasar yang dihasilkan, kemudian diuji aktivitas xilanase nya menggunakan metode DNS. Substrat uji aktivitas xilanase menggunakan xilan beechwood
(Sigma) 0,5 % dengan kondisi uji dalam bufer fosfat 0,02 M (pH 7) pada suhu ruang. Waktu produksi xilanase terbaik didapatkan dari aktivitas enzim tertinggi.
Karakteristik Xilanase
Pengaruh pH terhadap Aktivitas Xilanase
Pengaruh Suhu terhadap Aktivitas Xilanase
Pengaruh suhu terhadap aktivitas enzim xilanase dilakukan dengan mereaksikan enzim dengan substrat xilan bagas 0,5 % yang dilarutkan dalam bufer 0,02 M pada pH optimum di suhu γ0, 40, 50, 60, 70, 80, dan 90 ◦C. Sampel enzim yang dianalisa saat produksi tertinggi yang diperoleh dari kurva aktivitas enzim. Aktivitas xilanase dihitung berdasarkan gula pereduksi yang terbentuk menggunakan metode DNS.
Stabilitas Enzim
Stabilitas enzim didapatkan pada dua kondisi yaitu pada suhu optimum dan suhu ruang. Masing-masing crude enzymes hasil sentrifuge dipisahkan sebanyak 100 mL dan didiamkan pada suhu ruang dan pada suhu optimum. Pengamatan dilakukan per jam sampai 5 jam dan jika selama 5 jam aktivitas enzim masih tinggi maka diamati per 24 jam. Aktivitas xilanase dihitung berdasarkan gula pereduksi yang terbentuk menggunakan metode DNS. Uji aktivitas dilakukan pada kondisi optimum enzim.
Menentukan Xilanase Bebas-Selulase
Menentukan xilanase yang bebas-selulase, enzim ekstrak kasar isolat potensial diuji aktivitas selulase menggunakan metode DNS. Substrat uji aktivitas selulase menggunakan Carboxymethyl Cellulose (CMC) 0,5 % dengan kondisi uji dalam bufer fosfat 0,02 M (pH 7) pada suhu ruang. Waktu produksi xilanase fosfat 0,02 M pH 7 selama 5-6 jam pada suhu 4 °C. Perlakuan dikondisikan dalam keadaan teraduk dengan magnetik stirer. Penggantian bufer dilakukan satu kali. Aktivitas enzim diuji sebelum dan sesudah dialisis menggunakan metode DNS. Proses Hidrolisis
Hidrolisis dilakukan dengan mereaksikan substrat xilan bagas 0,5 % dalam enzim ekstrak kasar xilanase. Sampel dianalisis pada jam ke-0, 2.5, 5, dan 24 jam. Reaksi hidrolisis dihentikan dengan dipanaskan pada suhu 100 °C selama 15 menit, kemudian disentrifuge pada 12.000 g 15 menit. Supernatan sebagai sampel yang dianalisis.
Analisis Gula Pereduksi
konsentrasi xilosa yang telah diencerkan dari 1000 ppm, pembuatan standar gula pereduksi dapat dilihat pada lampiran 4.
Kromatografi Lapis Tipis (KLT)
Sampel hasil dari proses sakarifikasi diambil sebanyak 1 µL ditotolkan di kertas kromatografi. Larutan standart xilosa 1000 ppm dibuat sebagai kontrol pencapaian gula reduksi yang dihasilkan. Larutan eluen dibuat dengan komposisi 12 mL n- butanol: 6 mL asam asetat: 6 mL akuades, kemudian dijenuhkan selama 30 menit. Sampel dan standar ditotolkan padakertas kromatografi, kemudian kertas kromatografi direndam ke dalam eluen dan ditutup rapat sampai 1 jam. Pengeringan dengan hair dryer di dalam ruangan asam, kemudian disemprotkan larutan DAP yang terdiri dari 0,2 g difenilamin, 0,2 mL aniline, 10 mL aseton, dan 1,5 mL asam fosfat, keringkan kembali setelah itu panaskan pada suhu 100 ◦C selama 15 menit. Nilai Rf (Retention factor) dapat dihitung dengan rumus berikut.
Rf = Jarak yang ditempuh substansi Jarak yang ditempuh pelarut
Identifikasi Bakteri dengan Analisis Gen 16S rRNA
Ekstraksi DNA Genom Menggunakan Kit
Ekstraksi DNA genom menggunakan GenomicDNA mini Kit (Blood/ cultured cell). Tahap pertama (pre-lisis) yaitu dengan menumbuhkan isolat bakteri dalam media padat xilan. Koloni sel yang tumbuh kemudian disuspensikan ke dalam akuades steril. Suspensi disentrifugasi 14.000-16.000 g selama 1 menit. Endapan di suspensikan ke dalam 200 µL bufer GT, lalu diresuspensi dan divortex. Suspensi kemudian diinkubasi pada suhu 60 ºC selama 10 menit (swirling setiap 3 menit). Tahap kedua (pengikatan DNA), ditambahkan sebanyak 200 µL etanol absolut, kemudian divortex selama 10 menit. Apabila masih ada endapan, dihancurkan dengan pipeting. Semua campuran dituang ke kolom (filter) GD, kemudian disentrifugasi 14.000-16.000 g selama 2 menit (tabung koleksi dibuang/ tabung tampungan filtrat, menyisakan kolom). Tahap ketiga (pencucian), ditambahkan sebanyak 400 µL bufer W1 pada kolom GD kemudian sentrifugasi kembali 14.000-16.000 g selama 30-60 menit. Cairan yang ada ditabung koleksi dibuang dan diletakkan kembali kolom pada tabung reaksi. Sebanyak 600 µL
ddH2O 9.5 µL, dan DNA template 4 µL. Primer forward6γF (5′-CAG GCC TAA CAC ATG CAA GTC-γ′) danprimerreverse 1γ87R (5′-GGG CGG WGT GTA CAA GGC-γ′). Kondisi PCR yang digunakan yaitu pre-denaturasi (94ºC, 4 menit), denaturasi (94ºC, 45 detik), annealing (55ºC, 1 menit), elongation (72ºC, 1 menit 10 detik), dan post PCR (72ºC, 7 menit) dengan jumlah siklus sebanyak 30 siklus. Elektroforesis Hasil PCR
Setelah proses amplifikasi dengan PCR selesai maka dilakukan analisis elektroforesis untuk mendeteksi DNA ke dalam sumur gel agarose, sedangkan untuk marker sebanyak 0,5 µL ditambahkan 0,5 µL Loading dye Fermentas dan 2 µL milli-Q dan dicampur kemudian dimasukkan dalam sumur yang berbeda. Proses elektroforesis dilakukan selama 60 menit dengan voltase 50 V dalam larutan buffer TAE 0,5 %. DNA hasil amplifikasi yang telah dielektroforesis divisualisasikan dengan perendaman agarose yang mengandung DNA target ke dalam larutan etidium bromide selama 15 menit, kemudian setelah dibilas dengan akuades selama 10 menit. Dengan menggunakan UV transluminator, pita DNA akan terlihat dan dapat diketahui ukurannya berdasarkan pendana ukuran molekul yang dinyatakan dengan base pair (bp).
Identifikasi Bakteri Potensial
3
HASIL DAN PEMBAHASAN
PretreatmentBagas
Preparasi Bagas
Limbah bagas tebu didapatkan dari beberapa tempat yang berbeda, yakni berasal dari limbah industri minuman dan limbah restoran. Proses pretreatment
bagas membutuhkan sebanyak 1000 g serbuk bagas kering. Berikut ialah proses preparasi bagas secara bertahap sebelum dilakukan pretreatment yang disajikan dalam Gambar 2.
Gambar 2 Preparasi bagas secara fisik. Limbah ampas tebu (bagas) basah (a), pengeringan pada suhu 80 ºC selama ±24 jam sampai kering (b), penggilingan (c), bagas lolos mesh 40 (d)
Gula dari tanaman tebu dihasilkan melalui proses penggilingan atau ekstraksi dan meninggalkan bagas sebagai limbahnya. Bagas tebu masih mengandung gula sehingga dapat dimanfaatkan baik sebagai substrat untuk menghasilkan enzim maupun di degradasi hingga memiliki nilai ekonomi. Menurut Riyanti (2008), ketersediaan bagas sebagai substrat relatif melimpah, yaitu sekitar 30-40% dari total proses penggilingan tebu setiap produksi. Proses tersebut biasanya membutuhkan lima tahap, yaitu penggilingan, pengepresan, fermentasi, distilasi, dan dehidrasi. Limbah bagas yang digunakan dalam penelitian ini telah melewati dua proses yakni penggilingan dan pengepresan.
Pretreatment limbah ampas tebu (bagas) meliputi proses preparasi bagas secara fisik (Gambar5), delignifikasi, ekstraksi xilan, dan purifikasi xilan (pengujian berikutnya). Pretreatment akan merusak dinding sel tanaman dan akan mempermudah akses enzim pada polisakarida tanaman (Gray et al. 2006). Proses
pretreatment pada penelitian ini bertujuan untuk mempermudah proses untuk mencapai tahap hidrolisis menggunakan enzim. Gray et al. (2006) menyatakan bahwa biomassa yang tidak diperlakukant akan bersifat recalcitrant pada proses pemecahan oleh enzim. Pengeringan sampel dalam preparasi untuk memudahkan
(b) (a)
proses penggilingan karena bagas mengandung air 48 – 52%. Penggilingan bagas menjadi bubuk bagas dilakukan agar proses perendaman oleh larutan NaOCl (delignifikasi) dan NaOH (ekstraksi xilan) menjadi lebih mudah homogensehingga penetrasi pereaksi sempurna danreaksi seragam (Fengel dan Wegener 1995). Hasil dari proses penggilingan biasanya belum homogen dan masih kasar, maka sampel perlu diayak untuk menghilangkan bahan yang masih kasar sehingga dapat digiling kembali. Bubuk bagas hasil gilingan kemudian diayak pada saringan mesh 40. Fengel dan Weneger (1995), menjelaskan bahwa tidak ada aturan umum perihal ukuran partikel yang paling baik yang digunakan dalam analisis kayu, tetapi ukuran partikel yang lazim berkisar antara 40-80 mesh atau antara 0,05 dan 0,4 mm. Hasil dari proses preparasi fisik bagas kemudian dilakukan anailsis proksimat.
Hasil Neraca Massa Tahapan Pretreatment Bagas
Setiap melalui tahapan pretreatment terjadi pengurangan berat bagas dari 1000 g menjadi 34 g pada akhir pemurnian xilan. Rendemen bagas hasil delignifikasi sebanyak 704,74 g (29,74 %), dengan rendemen ekstraksi sebanyak 98,80 g xilan (9,9 %) dan setelah purifikasi didapatkan 3,4 % xilan murni (Tabel 2). Hasil serupa juga telah didapatkan dalam penelitian Richana et al. (1994), bahwa xilan hasil ekstraksi dari bagas tebu mencapai 9,6 %.
Tabel 2 Hasil dari neraca massa tahapan pretreatment bagas tebu
Tahap perlakuan Hasil
Berat (g) Penurunan persentase (%)
Bagas 1000 100
Delignifikasi 704,74 29,52
Ekstraksi xilan 98,8 9,9
Pemurnian xilan 34 3,4
Pemurnian hasil ekstraksi xilan menjadi penting karena masih terdapatnya komponen-komponen pengotor lain, seperti selulosa dan lignin. -selulosa ialah nama untuk bagian yang tetap larut meskipun dalam larutan yang dinetralkan (Cross dan Bevan 1912; Fengel dan Wegener 1995). Selama ekstraksi dengan larutan alkali kuat, maka bagian selulosa yang memiliki berat molekul rendah dapat terlarut bersama-sama dengan hemiselulosa.
Analisis Komponen Kimia Bagas
Analisis komponen kimia menggunakan uji proksimat dan analisis komponen serat. Tahapan pengujian ditampilkan pada lampiran 1. Hasil analisis komponen kimia terhadap bagas disajikan pada Tabel 3.
Tabel 3 Komposisi kimia hasil analisis komponen proksimat bagas sebelum dan setelah delignifikasi
Berdasarkan hasil pengujian Tabel 3, analisis proksimat bagas raw
(sebelum di delignifikasi) menghasilkan total persentase bobot basah 36,7 % (total persentase kadar air, protein, lemak, abu, dan serat kasar) dan menyisakan komponen karbohidrat (by difference) sebesar 63,3 %. Analisis proksimat untuk bagas terdelignifikasi menghasilkan persentase bobot basah sebesar 42,39 % dan menyisakan komponen karbohidrat sebesar 57,61 %. Penghitungan persentase kadar karbohidrat dapat dilihat pada Lampiran 1. Komponen karbohidrat terdiri atas komponen serat atau penyusun senyawa makromolekul. Oleh karena itu perlu diuji analisis kembali kandungan karbohidrat (Tabel 4). Menurut Fengel dan Wegener (1995), setiap komponen kimia kayu dapat dibedakan menjadi senyawa berberat molekul kecil yang terdiri atas bahan organik (ekstraktif) dan anorganik (abu), kemudian senyawa makromolekul yang terdiri atas polisakarida (selulosa, hemiselulosa) dan lignin.
selulosa Selulosa Lignin
Bagas raw 90,23 89,16 77,62 11,54 53,29 24,19
Bagas
terdelignifikasi 88,83 76,3 52,33 23,97 39,42 12,62
a
Bobot Kering.; bNeutral Detergent Fiber.; cAcid Detergent Fiber. Perlakuan
Hasil analisis (%)
kadarair protein lemak abu serat kasar
Bagas raw 2,45 1,97 0,39 1,55 30,34
Bagas
Berdasarkan rumus penghitungan Van Soest et al. (1991), penurunan kadar komponen serat terjadi pada lignin sebesar 15,29 % dan selulosa sebesar 25,5 %. Namun, peningkatan persentase terjadi pada hemiselulosa dari 11,54 % menjadi 23,97 %. Nilai persentase komponen serat setelah degradasi merupakan selisih antara persentase setelah dan sebelum delignifikasi terhadap nilai mutlak bobot (dengan perhitungan pada Lampiran 3).
Penelitian serupa dilakukan oleh Lee (2003), delignifikasi bagas dengan 1 % NaOCl mengalami penurunan persentase lignin sebesar 6,9 %. Penurunan persentase lignin diikuti oleh penurunan selulosa sebesar 25,5 %, namun terjadi kenaikan persentase pada hemiselulosa. Hal tersebut terjadi karena dalam proses delignifikasi ada komponen polisakarida yang terlarut di dalam pelarut. Menjelang akhir delignifikasi dapat terjadi kehilangan polisakarida (Fengel dan Wegener 1995), sehingga mengurangi rendemen. Beg et al. (2001) menyatakan bahwa xilan atau hemiselulosa berada diantara lignin dan kumpulan serat selulosa, lapisan xilan berikatan secara kovalen dengan lignin dan non-kovalen dengan selulosa melalui ikatan hidrogen. Pelarut sodium hipoklorit dalam penelitian ini diduga mampu memutus ikatan kovalen dan melarutkan selulosa, sehingga terjadi penurunan.
Penurunan lignin, selulosa, BK, NDF, ADF, protein, dan serat kasar akibat perlakuan delignifikasi mampu memutuskan ikatan-ikatan lignoselulosa dan lignohemiselulosa dengan efektif (Tabel 3,4). Fengel dan Wegener (1995) pengaruh hidrolitik yang menyebabkan pemecahan rantai polisakarida. Ghunu dan Tarmidi (2006) menyatakan bahwa akibat pemecahan polisakarida secara enzimatis maupun proses kimiawi yang semakin lama mengakibatkan degradasi NDF semakin bertambah banyak. Pada penelitian Ghunu dan Tarmidi (2006) menyatakan bahwa hasil penurunan kandungan NDF, ADF, dan lignin pada substrat rumput kering (Kume) terbaik ialah berdasarkan peningkatan kadar air substrat tertinggi yaitu 77,5%. Penurunan serupa terjadi pada protein sebesar 0,67 % merupakan protein terdegradasi selama proses delignifikasi. Fengel dan Wegener (1995) sel parenkim dalam bagian batang bukan kayu mengandung protein sekitar 1%, yaitu pada kambium dan bagian kulit terdalam. Protein tergolong senyawa ekstraktif pada bagas.
Hasil analisis sampel bebas air sering ditemukan perubahan berat kering karena melalui proses pengeringan dan karena kesukaran penimbangan sampel kering tanpa penyerapan uap air. Penurunan tersebut juga bisa disebabkan oleh konsentrasi pelarut delignifikasi yang digunakan. Hasil penelitian Lee (2003), pada konsentrasi NaOCl 1% terjadi kehilangan berat lebih sedikit yaitu 6,9 % dibandingkan konsentrasi NaOCl 5 % yaitu sebesar 51 %. Hubungan antara penurunan berat kering dengan konsentrasi pelarut dalam delignifikasi dikaitkan dengan ikatan komplek lignin-polisakarida, jika konsentrasi yang digunakan tinggi maka dapat terjadi kehilangan banyak polisakarida.
limbah ampas tebu. Fengel dan Wegener (1995) dijelaskan bahwa kesalahan menentukan kandungan abu kemungkinan disebabkan hilangnya sejumlah garam amonia dan logam klorida atau juga disebabkan kurang efisiennya oksidasi terhadap karbonat-karbonat dari logam-logam alkali. Peningkatan persentase yang terjadi berarti prosedur tidak mengalami kesalahan analisis, karena tidak terjadi pengurangan jumlah garam dan logam. Persentase penurunan serat kasar akan berbdaning lurus dengan NDF dan ADF, jadi serat kasar juga dipengaruhi oleh kadar air suatu bahan.
Hasil analisis proksimat dan komponen serat bagas sebelum diperlakukan sdi atas (Tabel 3,4) berbeda dengan hasil analisis proksimat oleh Sandra et al.
(2007) yang menyatakan bahwa bagas (raw) mengandung selulosa 37,35 %, hemiselulosa 23,66 %, lignin 25,10 %, senyawa ekstraktif lain 3,25 %, dan senyawa abu 1,79 %, perbedaan tersebut dipengaruhi beberapa faktor seperti perbedaan varietas tebu dan pengaruh pengambilan sampel acak di berbeda tempat. Faktor yang mempengaruhi tersebut tidak dapat dikontrol dan diseragamkan dikarenakan bahan dasar merupakan jenis limbah. Menurut Sun dan Cheng (2002), bahwa kandungan bagas sebagai bahan lignoselulosa jenis kayu lunak yang secara umum diketahui sebagai sisa hasil pertanian dan limbah mengandung selulosa (40-50 %), hemiselulosa (25-35 %), dan lignin (25-35 %). Delignifikasi Bagas
Lignin yang terdegradasi larut dalam media delignifikasi dalam bentuk senyawa keton. Penggunaan konsentrasi yang kecil yaitu 1% NaOCl dalam proses delignifikasi bertujuan untuk tidak banyak melarutkan hemiselulosa (xilan).
Pretreatment pada bahan lignoselulosa dapat menghilangkan lignin dan hemiselulosa, mengurangi kristal selulosa, dan meningkatkan porositas material (Sun dan Cheng 2002).
Ekstraksi Xilan
Hemiselulosa xilan memiliki kelarutan tinggi dalam alkali (Richana et al.
2007), oleh karena itu NaOH digunakan dalam mengekstraksi xilan dari bagas. Su
et al. (2012) hasil delignifikasi bagas dengan NaOH 10 % menghasilkan persentase lignin dari 19,32 % menjadi 7,32 %, dengan kehilangan hemiselulosa dari 23,12 % menjadi 17,12 %. Hasil penelitian Richana et al. (2007), konsentrasi NaOCl yang tinggi (7,5%) dapat membuat hemiselulosa hilang atau larut dalam proses delignifikasi dan sebaliknya pada konsentrasi yang rendah hanya sebagian hemiselulosa yang larut. Demikian pula dengan hasil penelitian Lee (2003), persentase penurunan lignin dengan konsentrasi NaOCl 1% hanya menghilangkan sebesar 24,4 % dibandingkan dengan konsentrasi NaOCl 5 % mencapai 63,3 %. Perbandingan hasil tersebut menyimpulkan bahwa penggunaan NaOCl lebih efektif dari pada NaOH sebagai pendegradasi lignin. Selain itu penggunaan NaOH sebagai pendegradasi lignin justru akan melarutkan xilan yang akan diekstraksi pada tahap selanjutnya.
Komponen-komponen hasil ekstraksi tidak dapat dipisahkan secara sempurna dengan perlakuan kimia secara selektif atau dengan teknik-teknik pemisahan. Fengel dan Wegener (1995), bahkan dalam hemiselulosa yang sangat murnipun masih terdapat sejumlah sisa selulosa dan lignin. Proses pemurnian xilan diawali dengan melarutkan serbuk ekstrak xilan dalam aquades dengan perbandingan (1:12,5 b/v), hal tersebut dilakukan untuk memudahkan proses perendaman kembali dengan NaOH 4% pada tahap pemurnian. Filtrat hasil sentrifugasi dinetralkan dengan HCl 37% mencapai pH 7. Pada tahap ini, endapan yang merupakan xilan dan supernatan dibuang. Konsentrasi NaOH 4% yang digunakan membuat xilan sedikit terlarut dalam filtrat yang dinetralkan.
Gambar 3 Hasil pretreatment bagas tebu. (a) Hasil ekstraksi xilan dan (b) hasil pemurnian xilan lolos mesh 40
Bakteri Penghasil Xilanase
Bakteri yang digunakan merupakan isolat yang telah diisolasi dari tanah TNBD Jambi. Bakteri xilanolitik terbaik didapatkan dari uji kualitatif pewarnaan merah kongo pada media xilan komersil (Sigma) (Kurrataa’yun β01γ), dan telah berhasil mendapatkan tiga isolat terbaik yaitu isolat XJ no. 17, 28, dan 30 (Gambar 4). Dalam penelitian ini, ketiga isolat tersebut kemudian digunakan dan diuji kembali pada substrat xilan bagas hasil pretreatment untuk proses hidrolisis.
Gambar 4 Peremajaan tiga bakteri xilanolitik pada media xilan beechwood
(Sigma) selama 24 jam yaitu: (a) isolat no. 17, (b) isolat no. 28, dan (c) isolat no. 30
Masing-masing isolat diuji dengan pewarnaan merah-kongo 0,2 % pada media agar xilan bagas 0,5 % selama 48 jam, penapisan tersebut dilakukan untuk mengetahui kemampuan isolat dalam menggunakan substrat. Zona degradasi xilan dapat dideteksi dengan pewarnaan merah-kongo (McKenzie dan Williams, 1984; Breccia et al. 1995). Zona bening akan terlihat lebih jelas ketika pewarna dibilas dan direndam dengan NaCl 2 % selama 15 menit. Selama fase inkubasi, bakteri akan mensekresikan enzim xilanase untuk mendegradasi substrat menjadi xilooligosakarida atau xilosa. Downie et al. (1994) pewarna merah-kongo dapat mengikat polisakarida dalam medium substrat padat. Degradasi xilanase pada substrat xilan akan membentuk zona bening (Gambar 8). Pada penelitian Silveira
et al. (1997), setelah inkubasi bakteri pada 37 °C selama 48 jam zona degradasi divisualisasi melalui pewarnaan merah-kongo 0,2 % (w/v) selama 15 menit, kemudian di bilas dengan 1 M NaCl. Prakash et al. (2012) hasil pewarnaan merah-kongo Bacillus halodurans PPKS-2 memperlihatkan zona bening pada substrat xilan beechwood 0,2 % melalui 1 % pewarnaan merah-kongo, hal tersebut mengindikasikan bahwa ada sejumlah xilanase yang dihasilkan. Downie et al.
(1994) pewarnaan merah-kongo akan menghasilkan zona bening karena substrat diikat oleh pewarna sehingga permukaan agar berwarna merah, sedangkan zona bening terjadi karena tidak adanya ikatan yang terbentuk pada pewarna dengan substrat.
Gambar 5 Hasil analisis kualitatif bakteri xilanolitik pada substrat xilan bagas 0,5% dengan metode pewarnaan merah-kongo 0,2 %. (a) isolat XJ17, (b) isolat XJ28, (c) isolat XJ30, (d) diameter koloni, dan (e) diameter zona bening.
Kemampuan isolat dalam mendegradasi xilan bagas diukur dengan menghitung Indeks Xilanolitik (IX). Nilai dari indeks dapat dihitung dengan mengukur diameter koloni dan diameter zona bening yang terbentuk (Downie et al. 1994). Berikut ialah cara penghitungan dalam menentukan nilai IX.
IX = Diameter zona bening (cm) – Diameter koloni (cm) Diameter koloni (cm)
Tabel 5 Data hasil IX dari uji kualitatif pewarnaan merah-kongopada masing-masing isolat
Kode isolat Diameter koloni (cm)
Diameter zona bening (cm)
Indeks xilanolitik
XJ17 - - -
XJ28 0,5 3 5
XJ30 0,7 1,2 0,7
Indeks xilanolitik tertinggi terjadi pada isolat XJ28 sebesar 5 (Tabel 5), sedangkan isolat XJ17 tidak terbentuk zona bening. Secara kualitatif isolat XJ28 dan XJ30 dapat mendegradasi xilan bagas 0,5 %. Hasil penapisan mendapatkan dua isolat potensial, namun perbedaan zona bening dan IX belum dapat menunjukkan aktivitas secara spesifik. Oleh karena itu perlu dilakukan produksi xilanase pada dua isolat potensial untuk mengukur aktivitas enzim secara kuantitatif agar data yang diperoleh lebih akurat.
Produksi Xilanase menggunakan Xilan Bagas
Penentuan Waktu Optimum Produksi Xilanase dan Kurva Pertumbuhan
Aktivitas xilanase terbaik didapatkan pada XJ28 sebesar 11,301± 0,691 U/mL pada jam ke-96 dengan jumlah TPC 2,870 CFU/mL, sedangkan pada XJ30 hanya 0,347 ± 0,005 U/mL pada inkubasi jam ke-3 dengan jumlah TPC 1,97 CFU/mL (Gambar 6A, 6B). Produksi xilanase XJ28 dari jam ke-0 sampai 48,
(a) (b) (c)
menunjukkan aktivitas yang kecil yaitu < 2,0 U/mL. Aktivitas tertinggi ditunjukkan pada akhir fase stasioner, kemudian aktivitas mulai mengalami penurunan pada fase kematian bakteri. Berdasarkan penelitian Yasinok et al.
(2010), waktu optimum pada jam ke-96 terjadi pula pada Bacillus pumilus SB-M13 yang diisolasi dari tanah dengan media produksi mengandung 0,3 % xilan bagas hasil treatmen fisik sebagai sumber karbon, dengan aktivitas xilanase sebesar 183 ± 11 U/mL. Aktivitas xilanase maksimum dalam penelitian tersebut dengan menggunakan beberapa sumber karbon seperti xilan bagas, xilan tongkol jagung, jerami padi, gandum dan lain-lain yang telah diperlakukan didapatkan setelah 3-4 hari fermentasi.
Gambar 6 Grafik hubungan antara jumlah 10log TPC dengan aktivitas xilanase selama inkubasi jam ke-0 sampai jam ke-168 dalam medium xilan bagas 0,5 % (pH 7) inkubasi pada suhu 28°C dengan agitasi 150 g.(A) isolat XJ28; (B) isolat XJ30; ( ) Aktivitas xilanase; ( ) TPC
Kemampuan XJ28 dalam menghasilkan xilanase membuktikan bahwa semakin besar nilai Indeks Xilanolitik (IX) maka semakin besar aktivitas enzimnya. Waktu optimum dalam memproduksi xilanase didukung oleh data hasil pertumbuhan bakteri. Metode penghitungan jumlah bakteri pada produksi xilanase menggunakan Total Plate Count (TPC), karena penghitungan jumlah koloni yang tumbuh pada cawan lebih akurat walaupun memiliki tingkat kesulitan yang lebih besar dari pada pengukuran turbiditas (kekeruhan). McKane dan Kdanel (1976) pengukuran yang paling akurat ialah menghitung jumlah sel mikroba yang dapat tumbuh. Fase kematian bakteri akan terlihat saat berkurangnya koloni pada waktu inkubasi tertentu, sedangkan pada pengukuran turbiditas tidak diketahui pasti fase kematiannya. Hal tersebut terjadi karena sel bakteri yang hidup dan mati maupun material yang masih terkandung di dalam kultur sama-sama terukur oleh mesin spektrofotometri. McKane dan Kandel (1976) menjelaskan bahwa metode pengukuran turbiditas kurang akurat jika dilakukan pada campuran sel dengan media kultur karena material yang terkandung dalam suspensi selain sel sangat mempengaruhi hasil pengukuran.
Data pada Gambar 9A, menunjukkan bahwa aktivitas tertinggi pada waktu optimum tidak didukung oleh jumlah TPC bakteri pada jam yang sama, pada jam ke-96 jumlah sel mengalami penurunan mencapai 2,87 (CFU/mL) dari 3,52 (CFU/mL) pada jam ke-48. Suhartono (1989) produksi dan peningkatan aktivitas enzim tidak selalu sejalan dengan tingkat pertumbuhan mikroba, ada yang mencapai maksimum setelah pertumbuhan sel optimum sudah dilalui. Hal ini
terjadi karena enzim ekstrakseluler telah dihasilkan secara berlebih saat fase pertumbuhan optimum, sebelum selnya mengalami kematian. Prakash et al. (2012) produksi xilanase Bacillus halodurans PPKS-2 pada media yang mengandung 0,2% oat speltxylan pada suhu 37 °C memiliki aktivitas xilanase optimum pada jam ke 48 dengan pertumbuhan sel optimum dijam sebelumnya yaitu jam ke-36.
Perbedaan hasil aktivitas xilanase pada XJ30 berbeda dengan XJ28 ditunjukkan dengan hasil aktivitasnya yang jauh lebih kecil yaitu 0,347 ± 0.005 U/mL (Gambar 6B). Data tersebut didukung oleh indeks xilanolitik yang kecil hanya sebesar 0,7 pada XJ30. Kemampuan dalam menghasilkan xilanase yang rendah tidak didukung dengan pertumbuhan yang rendah pula. Jumlah TPC tertinggi pada inkubasi jam ke-30 sebesar 3,49 CFU/mL. Jumlah tersebut hampir sama dengan jumlah TPC XJ28 (3,52 CFU/mL) pada jam ke-48, artinya XJ30 mampu tumbuh dalam medium xilan bagas namun tidak optimal dapat menghasilkan xilanase. Alves et al. (2009), didalam kultur yang sama
Neosartorya spinosa strain PAD19 telah diuji pada dua jenis aktivitas enzim yakni CMCase dan xilanase. Hasil menunjukkan bahwa aktivitas xilanase jauh lebih tinggi yaitu sebesar 15,10 U/mL dari pada aktivitas CMCase yang hanya sebesar 3,60 U/mL. Penelitian tersebut bisa terjadi sebaliknya pada XJ30, dengan aktivitas xilanase yang kecil. Pertumbuhan selXJ30 yang baik diduga dapat menghasilkan enzim lain seperti selulase dan lain sebagainya, apabila dicoba dilakukan pengukuran aktivitas enzim lainnya. Hal tersebut terjadi karena bakteri dapat memiliki kemampuan dalam menghasilkan enzim lebih dari satu dalam medium yang sama. Penapisan bakteri dan penentuan waktu optimum dari dua isolat, didapatkan XJ28 yang terbaik dalam menghasilkan xilanase.
Perbandingan Aktivitas Xilanase dari Xilan Bagas dan Xilan Beechwood
(Sigma)
Kemampuan isolat XJ28 yang potensial melalui aktivitas xilanase yang dihasilkan dari medium pertumbuhan xilan bagas, diuji kembali dalam medium komersial xilan beechwood (Sigma) sebagai kontrol positif substrat hasil ekstraksi (Gambar 7).
Gambar 7 Grafik perbedaan antara aktivitas xilanase isolat XJ28 yang diproduksi dari xilan bagas dengan xilan beechwood (Sigma). Substrat uji xilan
beechwood (Sigma) 0,5 % pH 7 selama 30 menit. Medium produksi mengandung; ( ) xilan beechwood; ( ) xilan bagas, pada pH 7 inkubasi pada suhu 30 ºC dengan agitasi 150 rpm
Hasil menunjukkan bahwa aktivitas xilanase yang dihasilkan dari medium xilan beechwood hampir sama dengan yang dihasilkan dari medium xilan bagas (11,301 U/mL, pada jam ke- 96) yaitu sebesar 11,553 ± 0,241 U/mL dengan jumlah TPC sebanyak 3,28 CFU/mL, namun dengan inkubasi lebih awal yaitu pada jam ke-48. Hal serupa terjadi pada penelitian Khandeparker dan Bhosle (2010), produksi xilanase dari xilan beechwood xilan (Sigma) pada Artrobacter sp MTCC 5214 membutuhkan waktu selama 48 jam untuk mencapai aktivitas optimum yaitu sebesar 120 U/mL. Namun pada substrat bagas tanpa diekstraksi,
Artrobacter sp MTCC 5214 hanya menghasilkan aktivitas xilanase mencapai 20 U/mL pada jam ke-96.
Aktivitas maksimum pada penelitian ini, keduanya didapatkan pada akhir fase stasioner. Aktivitas xilanase optimum keduanya didapatkan pada masa inkubasi jam ke-48 dan jam ke-96 (Gambar 7), waktu optimum yang berbeda diduga sebagai perbedaan kemampuan bakteri XJ28 dalam menggunakan masing-masing substrat, artinya xilan beechwood lebih cepat didegradasi daripada xilan bagas. Demikian pula pada penelitian Richana et al. (2008), perbandingan aktivitas xilanase Bacillus pumilus RXA-III5 dari substrat xilan hasil ekstraksi tongkol jagung secara alkali dengan substrat komersial oat spelt xylan (Sigma) menghasilkan yaitu secara berurutan 177,57 U/mL dan 160,65 U/mL. Perbedaan aktivitas xilanase yang enzimnya diproduksi dari xilan bagas dan xilan beechwood
diduga disebabkan karena struktur xilan yang berbeda antara keduanya. Himmel (2008) menyatakan bahwa polimer xilan yang dihasilkan dari biomassa dan proses
pretreatment (ekstraksi) yang berbeda akan menghasilkan struktur polimer yang berbeda. Xilan beechwood yang diekstraksi dari kayu beechwood lebih cepat menginduksi xilanase. Meryandini et al. (2009) xilan komersial (Sigma) memiliki struktur xilan yang sederhana karena mengandung 99% monomer xilosa sedangkan xilan hasil ekstraksi memiliki struktur yang lebih kompleks. Oleh karena itu, isolat XJ28 dalam medium produksi xilan beechwood memiliki aktivitas pada jam ke-48 lebih awal dibandingkan dalam medium xilan bagas.
Aktivitas xilanase optimum keduanya di atas jam ke-30, hal tersebut diduga karena kandungan medium produksi. Penggunaan ekstrak khamir dan bakto pepton sebagai sumber nitrogen terlebih dahulu digunakan oleh bakteri sebagai media pertumbuhannya. Konsentrasi nutrisi dalam medium pertumbuhan berpengaruh terhadap produksi xilanase oleh bakteri. Penelitian Subramaniyan et al. (2001), Bacillus SSP-34 memproduksi aktivitas xilanase maksimum (380 U/mL) saat pertumbuhan mencapai 96 jam inkubasi dengan kandungan sumber nitrogen medium ekstrak khamir dan pepton 0,5 %. Penelitian serupa dilakukan oleh Nagar et al. (2010) setelah 36 jam inkubasi aktivitas xilanase tertinggi
Bacillus pumilus SV-85S (594 U/mL), fermentasinya mengandung sumber karbon 1 % dan sumber nitrogen masing-masing 0,5 % termasuk pepton dan ekstrak khamir. Aktivitas tertinggi didapatkan setelah sumber karbon digunakan, yaitu saat bakteri menggunakan xilan sebagai sumber karbon.
diaplikasikan salah satunya dalam proses pembuatan kertas. Untuk memberikan efek pemutihan yang diinginkan, xilanase yang dihasilkan harus benar-benar bebas dari aktivitas selulase. Aktivitas selulase akan menyebabkan hilangnya selulosa, terdegradasinya kualitas pulp (bubur kertas) dan peningkatan biaya pengolahan limbah (Beg et al. 2001).
Karakteristik Enzim
Pengaruh pH terhadap Aktivitas Xilanase
Enzim ekstrak kasar dipanen pada waktu optimum kemudian dikarakteristik pH nya. Aktivitas xilanase diuji pada substrat xilan beechwood 0,5%. Hasil pengujian aktivitas xilanase dalam berbagai pH bufer dapat dilihat pada Gambar 8. konsentrasi bufer 0,02 M. Hasil pengujian menunjukkan bahwa semakin pH bufer mendekati normal maka semakin naik pula aktivitas xilanase yang dihasilkan. Reaksi enzimatik terbaik terjadi pada pH optimum 7 dengan aktivitas sebesar 2,29 U/mL. Aktivitas tertinggi didapat pula pada kisaran pH 5.5,7.5, 9, dan 10.Adanya beberapa peak dalam penelitian ini dapat menunjukkan ada lebih dari satu enzim atau isoenzim. Penelitian serupa dilakukan oleh Merydanini (2008) xilanase
Streptomyces SKK1-8 hasil pengendapan aseton menunjukkan aktivitas tertinggi pada pH 6 dan aktivitas cukup tinggi pada pH 3; 7,2 dan 8,5, adanya beberapa
peak pada pengujian pH menunjukkan bahwa perbedaan jumlah jenis xilanase yang terdapat dalam larutan enzim dan jenis bufer yang digunakan dalam pengujian.
Suhartono (1989) asam amino yang terdapat pada sisi aktif dan berpastisipasi dalam reaksi pengikatan antara enzim dan substrat, reaksi enzimnya kebanyakan terjadi pada pH netral 7 atau sedikit diatas atau dibawah pH netral. Berdasarkan penelitian Tseng et al. (2002), hasil karakteristik xilanase dari
pada kertas yang terjadi dalam kondisi netral. Xilanase yang telah diisolasi dari
Bacillus licheniformis A99 (Archana dan Satyanarayana 1997) optimum pada pH 7. Hal serupa terjadi pada xilanase yang diisolasi dari Bacillus coagulans BL69 tumbuh pada sisa susu kedelai (Heck et al. 2005), memperlihatkan pH optimum 7. Penurunan aktivitas drastis terjadi pada pH 8 yaitu 0,99 U/mL. Merydanini (2009) menurunnya aktivitas enzim dari pH optimum bisa disebabkan oleh berubahnya keadaan ion enzim dan seringkali juga keadaan ion substrat. Perubahan kondisi ion enzim dapat terjadi pada residu asam amino yang berfungsi katalitik mengikat substrat maupun pada residu asam amino yang berfungsi untuk mempertahankan struktur tersier dan kuartener enzim yang aktif. Namun dalam bufer pH alkali 9, xilanase menunjukkan aktivitas yang tinggi kembali. Hal tersebut diduga adanya spesifikasi jenis xilanase yang dapat melakukan reaksi enzim dalam kondisi alkali. Gibbs (2010) menyatakan bahwa jenis xilanase yang aktif pada pH yang tinggi diatas 8 diduga merupakan xilanase famili 11 yaitu kelompok glikosid hidrolase. Berdasarkan penelitian Wang et al. (2010), Bacillus pumils BYG optimum pada pH alkali 8-9 dalam reaksi suhu 50 °C, menyimpulkan bahwa xilanase yang dihasilkan merupakan alkalin xilanase yang termostabil. Aplikasi industri kertas, proses kondisi pemutihan pulp umumnya mendukung enzim yang aktif pada nilai pH yang tinggi. Peningkatan dan penurunan yang terjadi pada pengujian berbagai pH menunjukkan bahwa jenis pH bufer berpengaruh terhadap aktivitas xilanase. Pengaruh Suhu terhadap Aktivitas Xilanase
Reaksi xilanase yang optimum pada pH 7, digunakan sebagai acuan untuk menguji xilanase diberbagai suhu. Pengujian dilakukan pada dry block (pemanas kering) dengan kisaran suhu dari 30 sampai 100 ºC. Aktivitas xilanase diuji pada substrat xilan beechwood 0,5%. Hasil pengujian aktivitas xilanase pada berbagai suhudengan dua kondisi bufer dapat dlihat pada Gambar 9.
Gambar 9 Grafik pengaruh berbagai suhu terhadap aktivitas xilanase. Kondisi uji pada; (A) bufer fosfat 0,02 M pH 7; (B) bufer glisin NaOH 0,02 M pH 9, reaksi selama 30 menit
Aktivitas xilanase mengalami kenaikan seiring dengan kenaikan suhu mencapai optimum 50 ºC (6,802 U/mL), kemudian mengalami penurunan aktivitas sampai suhu 100 ºC (Gambar 9A). Peningkatan aktivitas yang terjadi bisa dikarenakan enzim bekerja semakin reaktif pada suhu diatas suhu ruang. Suhartono (1989) menjelaskan bahwa dengan bertambahnya suhu sampai mencapai suhu optimumnya maka terjadi kenaikan kecepatan reaksi enzim karena bertambahnya
energi kinetik yang mempercepat gerak vibrasi, translasi dan rotasi enzim dan substrat. Pada suhu yang lebih besar dari protein enzim mengalami perubahan konformasi yang bersifat detrimental, demikian pada substrat juga dapat mengalami perubahan konformasi sehingga gugus reaktifnya tidak dapat lagi, atau mengalami hambatan dalam “memasuki” sisi aktif enzim. Kondisi optimum dibutuhkan xilanase untuk membentuk kompleks enzim-substrat pada sisi aktif enzim sehingga mengaktifkan seluruh enzim untuk mengikat substrat dan mengubahnya menjadi produk. Menurut Sunna dan Antranikian (1997), xilanase
Bacillus subtilis mempunyai kisaran suhu optimum antara 50-70 ºC pada pH 6-10. Demikian juga pada penelitian Virupakshi et al. (2005) Bacillus sp. JB-99 yang tumbuh pada dedak padi dalam Solid State Fermentation (SSF) memproduksi xilanase dengan aktivitas optimum pada 50 ºC.
Dalam membuktikan adanya aktivitas xilanase yang naik pada pH 9 dari setelah penurunan yang terjadi sampai pH 8 (Gambar 9B), reaksi enzim pada pH alkali tersebut diuji kembali diberbagai suhu untuk mengetahui jenis optimasi suhunya. Hasil penelitian menunjukkan bahwa tidak ada perubahan suhu optimum (50 °C) pada reaksi di bufer alkali pH 9. Xilanase yang mampu bereaksi dengan baik pada pH netral 7 dapat bereaksi baik pula pada pH 9. Aktivitas xilanase pada pH alkali 9 yaitu sebesar 1,683 U/mL. Penelitian serupa terjadi pada xilanase yang diisolasi dari Arthrobacter sp menghasilkan aktivitas tertinggi pada pH 9, namun suhu optimumnya pada 100 °C (Khandeparkar dan Bhosle 2010). Sedangkan pada xilanase yang dihasilkan dari Streptomyces actuosus A-151 yang tumbuh dalam dedak padi memperlihatkan suhu optimumnya pada 60-70 ºC (Wang et al. 2003). Dalam kasus ini, berarti xilanase yang dihasilkan Bacillus subtilis XJ28 dapat diaplikasikan dalam proses pemutihan kertas, karena pada proses tersebut terjadi secara alkali.
Stabilitas Enzim
Gambar 10 Grafik hubungan perbandingan lama waktu penyimpanan terhadap aktivitas xilanase XJ28 pada kisaran suhu. ( ) suhu optimum 50 ˚C, ( ) suhu ruang 28 ˚C dan ( ) suhu refrigerator4 ˚C
Penyimpanan xilanase dalam suhu optimum terus mengalami penurunan aktivitas setiap jam. Namun pada penyimpanan xilanase dalam suhu 4 ˚C dan β8 ˚C relatif stabil sampai jam ke 7β. Stabilitas pada kedua kondisi suhu tersebut kemudian dibandingkan kembali, jika dilihat dari hasil pengujian penyimpanan pada suhu 4 ˚C lebih stabil dari pada suhu β8 ˚C. Pada suhu ruang cenderung fluktuatif sehingga penyimpanan pada suhu 4 ˚C yang paling baik selama 7β jam. Suhartono (1989) bahwa dalam suhu dingin enzim tidak akan mengalami perubahan konformasi, sehingga daya katalitik dalam mengikat substrat masih reaktif.
Hidrolisis Xilan Bagas dengan Xilanase
Preparasi Enzim dengan Dialisis
Dialisis xilanase dilakukan pada suhu 4 ˚C untuk mendapatkan keadaan stabilitas enzim yang reaktif. Xilanase ekstrak kasar didialisis untuk menghilangkan kontaminasi gula reduksi dan yang diduga masih terakumulasi di dalam enzim. Selain gula reduksi, garam ataupun ion pengotor akan desalting atau keluar melalui membran ke cairan bufer dengan konsentrasi yang lebih rendah rendah (Suhartono 1989). Hal tersebut dibuktikan dari hasil perubahan aktivitas xilanase sebelum dan sesudah dialisis, dan analisis gula reduksi (Tabel 6).
Tabel 6 Aktivitas xilanase sebelum dan sesudah proses dialisis
Perlakuan Aktivitas xilanase (U/mL) Gula Reduksi (mg/mL)
Sebelum dialisis 8,060 0,727
Setelah dialisis 6,446 0,633
Aktivitas xilanase sebelum dilakukan dialisis sebesar 8,0 U/mL, setelah dialisis dalam bufer fosfat 0,02 M pH 7 selama waktu 5 jam mengalami penurunan mencapai 6,44 U/mL. Proses dialisis xilanase bertujuan untuk
menghilangkan adanya garam, gula reduksi dan beberapa ion dari larutan enzim. Penurunan aktivitas Endo- -xilanase enzim pada penelitian Yamani et al. (2012) setelah dialisis dalam bufer fosfat pH 5 selama kurang lebih satu jam mengalami penurunan sebesar 0,199 U/mL. Setelah dialisis diharapkan gula reduksi banyak berkurang, penurunan hanya sebesar 0,094 mg/mL. Hal tersebut didukung oleh hasil visualisasi TLC sebagai berikut.
Hasil analisis KLT menunjukkan bahwa didalam enzim ekstrak kasar xilanase masih terdapat gula reduksi sebesar 0,727 mg/mL, setelah didialisis pun tidak banyak menghilangkan gula reduksi. Masih adanya gula reduksi setelah proses dialisis ditunjukkan oleh masih adanya spot yang muncul. Hal tersebut diduga karena inkubasi perendaman kurang lama, sehingga hanya sedikit gula reduksi yang keluar (desalting).
Kromatografi Lapis Tipis (KLT) hasil hidrolisis xilan bagas
Gambar 11 Visualisasi KLT hasil hidrolisis xilanase XJ28 pada xilan bagas. (H0) jam ke-0; (H2,5) jam ke 2,5; (H5) jam ke-5. Konsentrasi standar gula masing-masing 1000 ppm, (Xy) xilosa, (Glu) glukosa, (Suk) sukrosa, (Cello) selobiosa, dan (Ara) arabinosa. (E1) xilanase sebelum dialisis, (E2) xilanase setelah dialisis, dan (S) substrat xilan bagas 0,5 %
Hasil visualisasi KLT pada enzim sebelum didialisis (E1) dan sesudah dialisis (E2) menunjukkan masih adanya spot yang samar. Perubahan warna spot dari E1 ke E2 menunjukkan adanya gula reduksi yang terdialisis, hal tersebut didukung oleh hasil uji gula reduksi yang turun dari 0,727 mg/mL menjadi 0,633 mg/mL (Tabel 6). Hasil KLT substrat tidak menunjukkan adanya spot.
Produk hidrolisis menghasilkan gula berberat molekul mirip dengan sukrosa dan gula xilo-oligosakarida. Enzim sebelum dan sesudah dialisis mengandung sedikit gula xilo-oligosakarida, hal tersebut terlihat dari spot yang dihasilkan tidak sejelas hasil hidrolisis (Gambar 11). Polimer xilan pada bagas memiliki cabang L-arabinosa dan asam 4-O-metil-D-glukoronat (Brienzo et al. 2009). Adanya produk hidrolisis xilanase isolat XJ28 terhadap xilan bagas ditunjukkan dari adanya spot