PENGARUH PENAMBAHAN GARAM ANORGANIK,
PELARUT ALKOHOL DAN ALKALI TERHADAP FORMULA
“
SURFAKTAN MES
–
AIR FORMASI
–
MINYAK”
(STUDI KASUS LAPANGAN SANDSTONE)
RISTA FITRIA
DEPARTEMEN TEKNOLOGI INDUSTRI PERTANIAN FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Pengaruh Penambahan Garam Anorganik, Pelarut Alkohol dan Alkali Terhadap Formula “Surfaktan MES – Air Formasi – Minyak” adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari skripsi saya kepada Institut Pertanian Bogor.
Bogor, Desember 2014
Rista Fitria
ABSTRAK
RISTA FITRIA. Pengaruh Penambahan Garam Anorganik, Pelarut Alkohol, dan Alkali Terhadap Formula “Surfaktan MES – Air Formasi – Minyak” (studi kasus Lapangan Sandstone). Dibimbing oleh ANI SURYANI dan ERLIZA HAMBALI.
Penggunaan surfaktan metil ester sulfonat (MES) untuk keperluan enhance oil recovery (EOR) dikarenakan kemampuannya dalam menurunkan nilai IFT minyak bumi–air mencapai 10-3 dyne/cm. Kinerja surfaktan dapat diketahui melalui
metode penurunan nilai IFT dan metode kelakuan fasa. Tujuan dari penelitian ini adalah mengetahui kinerja surfaktan (MES) dengan penambahan garam anorganik,
co-surfactant dan alkali pada kondisi berbeda. Media pendispersi yang digunakan pada penelitian ini adalah air formasi dan air demineral. Metode penurunan nilai IFT menggunakan alat spinning drop tensiometer TX500D yang diuji pada suhu 40, 50, dan 60 oC. Pengujian menunjukkan bahwa penurunan nilai IFT dipengaruhi oleh konsentrasi surfaktan, garam anorganik, pelarut alkohol dan alkali pada media pendispersi air formasi dan air demineral. Metode kelakuan fasa dilakukan dengan metode uji tabung yang dilakukan pada suhu 50 oC. Hasil terbaik metode kelakuan fasa terjadi pada media pendispersi air formasi dengan penambahan 0,3% surfaktan MES.
Kata kunci : Alkali, garam anorganik, interfacial tention (IFT), kelakuan fasa, metil ester sulfonat (MES), pelarut alkohol
ABSTRACT
RISTA FITRIA. The Effect of Addition of Inorganic Salts, Solvents Alcohol, and Alkali to Formula "MES surfactant - Water Formation - Oil" (Sandstone Field case study). Supervised by ANI SURYANI and ERLIZA HAMBALI.
The application of methyl ester sulfonate (MES) surfactant for enhance oil recovery (EOR) was due to its ability to reduce interfacial tension in crude oil-water system that reaches 10-3 dyne/cm. Performance of methyl ester sulfonate (MES) surfactant can be identified with the spinning drop IFT method and phase behavior method. The objectives of this research were to determine of MES surfactant performance with addition of inorganic salt, alcohol, and alkaly in different conditions. The dispersing media used in this research is the formation water and demineralized water. The spinning drop IFT method was conducted using spinning drop tensiometer TX500C tested in 40, 50 and 60 oC. The researched showed that
reduction of IFT value was affected by surfactant, inorganic salt, solvent alcohol, and alkali in the formation water and demineralized water dispersion medium. The phase behavior method was conducted using test tube method performance at 50
oC. The best result of phase behavior methode was found in formation water
dispersion medium with the 0,3% of methyl esteer sulfonat (MES) addition.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Teknologi Pertanian
pada
Departemen Teknologi Industri Pertanian
PENGARUH PENAMBAHAN GARAM ANORGANIK,
PELARUT ALKOHOL DAN ALKALI TERHADAP FORMULA
“
SURFAKTAN MES
–
AIR FORMASI
–
MINYAK”
(STUDI KASUS LAPANGAN SANDSTONE)
RISTA FITRIA
DEPARTEMEN TEKNOLOGI INDUSTRI PERTANIAN FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga skripsi ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan April 2014 ini ialah kinerja surfaktan, dengan judul Pengaruh Penambahan Garam Anorganik, Pelarut Alkohol dan Alkali Terhadap Formula “Surfaktan MES – Air Formasi –Minyak”.
Terima kasih penulis ucapkan kepada Prof Dr Ir Ani Suryani DEA dan Prof Dr Erliza Hambali selaku pembimbing, serta para teknisi SBRC LPPM IPB dan teman-teman yang telah membantu jalannya penelitian. Ungkapan terima kasih juga disampaikan kepada ayah, ibu, serta seluruh keluarga, atas segala do’a dan kasih sayangnya. Semoga skripsi ini bermanfaat.
Bogor, Desember 2014
DAFTAR ISI
DAFTAR TABEL xi
DAFTAR GAMBAR xi
DAFTAR LAMPIRAN xiii
PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
Ruang Lingkup Penelitian 2
TINJAUAN PUSTAKA 3
Tegangan Antarmuka 3
Kelakuan Fasa 6
Pengaruh Garam Anorganik, Pelarut Alkohol dan Alkali terhadap Kinerja
Surfaktan 7
Metil Ester Sulfonat 11
Fluida Reservoir 13
METODE 15
Bahan 15
Alat 15
Prosedur Analisis Data 15
HASIL DAN PEMBAHASAN 17
Formulasi Larutan Surfaktan 17
Uji Densitas 19
Uji Nilai IFT 26
Uji Kelakuan Fasa 36
SIMPULAN DAN SARAN 39
Simpulan 39
Saran 40
DAFTAR PUSTAKA 40
DAFTAR TABEL
1 Sifat fisiko kimia alkohol 9
2 Komposisi minyak bumi secara umum 13
3 Sifat fisika kimia fluida minyak lapangan sandstone yang digunakan dalam
penelitian 14
4 Sifat fisika kimia fluida air lapangan sandstone yang digunakan dalam
penelitian 14
5 Data viskositas pada media pendispersi air formasi 31 6 Data viskositas pada media pendispersi air demineral 31
7 Hasil uji kelakuan fasa 37
DAFTAR GAMBAR
1 Hubungan capillary number dengan oil recovery 4
2 Kadar garam dan tegangan antarmuka 5
3 Diagram pseudoterner air formasi-surfaktan-minyak 6 4 Proses transesterifikasi trigliserida dengan metanol 12
5 Reaksi sulfonasi metil ester 13
6 Hubungan antara konsentrasi surfaktan MES dan suhu pengukuran terhadap nilai densitas larutan surfaktan dengan media pendispersi air formasi 20 7 Hubungan konsentrasi surfaktan MES dan suhu pengukuran terhadap nilai
densitas larutan surfaktan dengan media pendispersi air demineral 20 8 Hubungan konsentrasi NaCl dan suhu pengukuran terhadap nilai densitas
larutan surfaktan MES 0,3% dengan media pendispersi air formasi 21 9 Hubungan konsentrasi NaCl dan suhu pengukuran terhadap nilai densitas
larutan surfaktan MES 0,3% dengan media pendispersi air demineral 22 10 Hubungan konsentrasi dan jenis alkohol terhadap nilai densitas larutan
surfaktan MES 0,3% dengan media pendispersi air formasi pada suhu
pengukuran 40 oC 22
11 Hubungan konsentrasi dan jenis alkohol terhadap nilai densitas larutan surfaktan MES 0,3% dengan media pendispersi air formasi pada suhu
pengukuran 50 oC 23
12 Hubungan konsentrasi dan jenis alkohol terhadap nilai densitas larutan surfaktan MES 0,3% dengan media pendispersi air formasi pada suhu
pengukuran 60 oC 23
13 Hubungan konsentrasi dan jenis alkohol terhadap nilai densitas larutan surfaktan MES 0,3% dengan media pendispersi air demineral pada suhu
14 Hubungan konsentrasi dan jenis alkohol terhadap nilai densitas larutan surfaktan MES 0,3% dengan media pendispersi air demineral pada suhu
pengukuran 50 oC 24
15 Hubungan konsentrasi dan jenis alkohol terhadap nilai densitas larutan surfaktan MES 0,3% dengan media pendispersi air demineral pada suhu
pengukuran 60 oC 24
16 Hubungan antara pengaruh konsentrasi NaOH dan suhu pengukuran terhadap nilai densitas larutan surfaktan MES 0,3% dengan media pendispersi
air formasi 25
17 Hubungan antara pengaruh konsentrasi NaOH (%) dan suhu pengukuran terhadap nilai densitas larutan surfaktan MES 0,3% dengan media
pendispersi air demineral 25
18 Hubungan konsentrasi surfaktan MES dan suhu pengukuran terhadap nilai IFT larutan surfaktan dengan media pendispersi air demineral 26 19 Hubungan konsentrasi surfaktan MES dan suhu pengukuran terhadap nilai
IFT larutan surfaktan dengan media pendispersi air formasi 27 20 Hubungan pengaruh konsentrasi garam NaCl dan suhu pengukuran terhadap
nilai IFT larutan surfaktan MES 0,3% dengan media pendispersi air
demineral 29
21 Hubungan pengaruh konsentrasi garam NaCl dan suhu pengukuran terhadap nilai IFT larutan surfaktan MES 0,3% dengan media pendispersi air
formasi 29
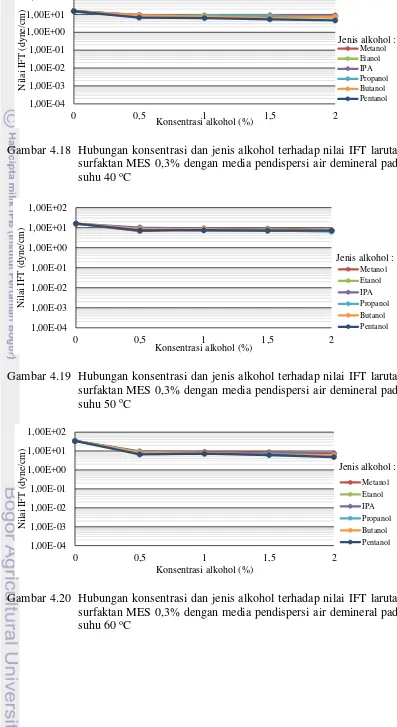
22 Mekanisme reaksi terbentuknya dinatrium karboksi sulfonat 30 23 Hubungan konsentrasi dan jenis alkohol terhadap nilai IFT larutan surfaktan
MES 0,3% dengan media pendispersi air demineral pada suhu 40 oC 33 24 Hubungan konsentrasi dan jenis alkohol terhadap nilai IFT larutan surfaktan
MES 0,3% dengan media pendispersi air demineral pada suhu 50 oC 33 25 Hubungan konsentrasi dan jenis alkohol terhadap nilai IFT larutan surfaktan
MES 0,3% dengan media pendispersi air demineral pada suhu 60 oC 33 26 Hubungan konsentrasi dan jenis alkohol terhadap nilai IFT larutan surfaktan
MES 0,3% dengan media pendispersi air formasi pada suhu 40 oC 34 27 Hubungan konsentrasi dan jenis alkohol terhadap nilai IFT larutan surfaktan
MES 0,3% dengan media pendispersi air formasi pada suhu 50 oC 34
28 Hubungan konsentrasi dan jenis alkohol terhadap nilai IFT larutan surfaktan MES 0,3% dengan media pendispersi air formasi pada suhu 60 oC 34 29 Hubungan konsentrasi NaOH dan suhu pengukuran terhadap nilai IFT larutan
surfaktan MES 0,3% dengan media pendispersi pada air demineral 35 30 Hubungan konsentrasi NaOH dan suhu pengukuran terhadap nilai IFT larutan surfaktan MES 0,3% dengan media pendispersi pada air formasi 35
31 Reaksi pembentukan petroleum soap 36
DAFTAR LAMPIRAN
1 Perhitungan total endapan kalsium karbonat 44
2 Prosedur pengujian formula surfaktan 44
3 Data hasil uji penurunan nilai IFT 46
4 Data hasil perhitungan standar deviasi 56
5 Dokumentasi sampel hasil formulasi 64
6 Data hasil uji kelakuan fasa 89
PENDAHULUAN
Latar Belakang
Pemanfaatan surfaktan untuk keperluan enhance oil recovery (EOR) memerlukan persyaratan yang lebih khusus meliputi: ultralow interfacial tension
(≤10-3 dyne/cm), kompatibel dengan air formasi dan stabil terhadap suhu reservoir,
pH berkisar 6 – 8, memiliki fasa III (fasa tengah) atau fasa II (-), dan oil recovery incremental berkisar 15 – 20% original oil in place (OOIP) (BPMIGAS 2009). Bila surfaktan mempunyai ultralow interfacial tension (<10-2 dyne/cm) dapat diduga mampu meningkatkan oilrecovery sekitar 10 - 20% (Aczo 2006).
Salah satu surfaktan yang penting untuk dikembangkan lebih lanjut untuk keperluan enhance oil recovery (EOR) adalah surfaktan metil ester sulfonat (MES) dari minyak sawit.Berdasarkan analisis IFT pada MES, diketahui bahwa nilai IFT yang diperoleh 7,7 × 10-3 dan stabil pada suhu reservoir, yaitu sampai suhu 80 °C.
Hal ini menjelaskan bahwa surfaktan MES sudah terbukti mampu menghasilkan IFT yang rendah 10-3 dyne/cm untuk lapangan sandstone di Indonesia dan tahan pada suhu reservoir.
Tegangan antarmuka (interfacial tension, IFT) antara minyak dan mikroemulsi merupakan salah satu parameter utama dalam EOR. Tegangan antarmuka tersebut harus dikontrol dan ditentukan sebelum slug mikroemulsi digunakan untuk proses EOR. Suatu keadaan IFT yang rendah antara minyak mentah dan air formasi dibutuhkan untuk mempermudah proses pengaliran tetesan-tetesan minyak yang terperangkap didalam pori-pori batuan. Hal ini karena kondisi tersebut akan mengurangi kerja deformasi yang dibutuhkan untuk menggerakkan minyak mentah yang terperangkap didalam pori-pori batuan.
Uji kelakuan fasa ditujukan untuk megetahui tipe fasa yang terbentuk dari campuran minyak, surfaktan dan air yaitu tipe II(-), tipe III, atau tipe II(+). Perubahan tipe fasa dari tipe II(-) ke tipe II(+) dapat terjadi dengan adanya peningkatan kadar garam. Dalam proses perubahan tipe fasa dari tipe II(-) ke tipe II(+) selalu melewati tipe III. Namun fasa mikroemulsi ini sulit sekali terlihat karena jumlah yang terbentuk biasanya sangat sedikit. Lebih dari satu tipe mikroemulsi dapat terbentuk diantaranya mikroemulsi fasa bawah terbentuk dari daerah tipe II(-) atau tipe III, mikroemulsi fasa atas terbentuk dari daerah tipe II(+) atau tipe III dan mikroemulsi fasa tengah yang selalu berasal dari tipe III (Sheng 2011). Nilai IFT terkecil dari suatu fluida tercapai sesaat sebelum terbentuknya mikroemulsi. Dengan semakin kecilnya nilai IFT, efektivitas surfaktan dalam meningkatkan oil recovery dapat tercapai.
Dalam penelitian ini digunakan media pendispersi air formasi dan air demineral yang dicampurkan dengan surfaktan metil ester sulfonat pada konsentrasi tertentu dengan penambahan garam anorganik, pelarut alkohol dan alkali dengan konsentrasi yang berbeda. Konsentrasi surfaktan yang ditambahkan berpengaruh terhadap nilai IFT, tipe fasa, dan volume mikroemulsi yang dihasilkan. Peningkatan kadar garam dapat merubah tipe fasa dari tipe II(-) ke tipe II(+) dan tipe III dapat terbentuk pada kadar garam optimum.
memformulasikan surfaktan karena dapat meminimalisasi kemunculan gels, kristal, emulsi yang terpisah dari larutan surfaktan, mengurangi waktu kesetimbangan, dan mengurangi viskositas mikroemulsi. Alkohol memiliki fungsi lain, yaitu menstabilkan mikroemulsi. Ketika sebuah mikroemulsi dihasilkan oleh suatu surfaktan tanpa ada alkohol di dalamnya, maka micelle tersebut memiliki kemampuan terlarut yang tidak terbatas. Menurut Eni (2007), penambahan alkali diharapkan mampu menurunkan nilai IFT, terbentuknya gejala emulsi dan terjadi perubahan wettability. Oleh karena itu, penting dilakukannya penelitian ini.
Perumusan Masalah
Suatu keadaan IFT yang rendah antara minyak mentah dan air formasi dibutuhkan dalam proses EOR. Selain itu, emulsi yang dihasilkan antara surfaktan yang memiliki ultralow interfacial tension(≤10-3 dyne/cm) dengan air formasi dan
minyak hanya mencapai fasa II (-). Penambahan garam anorganik, pelarut alkohol dan alkali diharapkan mampu menghasilkan nilai IFT yang rendah (≤10-3 dyne/cm) dan emulsi dengan fasa III. Penelitian ini diterapkan pada air formasi lapangan sandstone dan air demineral.
Pengujian kinerja surfaktan ini dilakukan melalui beberapa tahap, sebagai berikut: formulasi air dengan penambahan surfaktan MES, garam anorganik, berbagai jenis pelarut alkohol dan alkali pada konsentrasi yang berbeda. Selanjutnya dilakukan uji nilai densitas dan IFT serta uji kelakuan fasa.
Tujuan Penelitian
Tujuan kegiatan pelitian ini adalah untuk mendapatkan database uji nilai IFT dengan sampel air demineral dan air formasi lapangan sandstone. Selain itu, didapatkan formulasi yang terbaik yang memiliki nilai ultralow interfacial tension
(≤10-3 dyne/cm) dan mengetahui kelakuan fasa terhadap konsentrasi surfaktan metil
ester sulfonat (MES) dengan penambahan garam anorganik, pelarut alkohol, dan alkali.
Ruang Lingkup Penelitian
Fokus penelitian ini adalah formulasi air dengan penambahan surfaktan MES, garam anorganik, berbagai jenis alkohol dan alkali pada konsentrasi yang berbeda. Pengujian kinerja surfaktan dengan metode nilai IFT dan metode uji kelakuan fasa. Pemilihan formulasi terbaik yang memiliki nilai ultralow interfacial tension(≤10-3
TINJAUAN PUSTAKA
Tegangan Antarmuka
Tegangan antarmuka (Interfacial Tension) adalah ukuran gaya molekuler yang berada di batas antara dua fasa zat. Satuan gaya yang digunakan adalah dyne/cm. Teknik pengukuran tegangan antarmuka menggunakan spinning drop tensiometer dilakukan atas dasar percepatan gravitasi bumi memberikan pengaruh kecil pada bentuk drop fluida yang tersuspensi di dalam cairan, pada saat drop dan cairan berada di dalam tabung putar pada arah longitudinal. Pada saat kecepatan putaran rendah, drop fluida akan berbentuk elips dan jika kecepatan putar tinggi, maka drop fluida akan berbentuk silinder. Pada saat drop fluida berbentuk silinder tersebut dilakukan pengukuran jari-jari silinder (r), perbedaan densitas drop dan cairan di sekeliling drop (Δρ) dan kecepatan putar drop (ω). Alat spinning drop tensiometer mampu mengukur tegangan antarmuka (IFT) hingga 10-6 mN/m. Pada
akhirnya, tegangan permukaan dihitung ( ) dengan menggunakan persamaan berikut (Drelich et al. 2002).
� = � ∆��� Keterangan :
r : jari-jari
: tegangan antarmuka
Δρ : selisih densitas drop dan densitas cairan ω : kecepatan putar
Molekul surfaktan tersusun atas dua bagian yaitu hydrophilic (bagian kepala) dan hydrophobic (bagian ekor). Bagian hydrophilic mempunyai kelarutan yang baik dalam pelarut dan cenderung untuk membawa molekul surfaktan ke dalam larutan, sedangkan bagian hydrophobic cenderung tidak disukai oleh pelarut karena memiliki afinitas yang lebih kecil pada molekul-molekul pelarut. Struktur molekul tersebut menyebabkan konsentrasi surfaktan terkumpul pada permukaan dan menurunkan tegangan antarmuka larutan. Dalam sistem minyak-air, bagian
hydrophobic akan mengikat fasa minyak sementara bagian hydrophilic akan mengikat fasa air.
Penginjeksian surfaktan dalam sistem minyak-air akan membuat surfaktan terdispersi dalam minyak dan air yang kemudian diikuti dengan terbentuknya emulsi minyak dalam air. Di dalam pori-pori batuan (pore throat) droplet-droplet minyak yang terjebak didalamnya akibat adanya efek kapilaritas dan tingginya
dimodelkan oleh kurva capillary desaturation, dimana saturasi residual oil
berkorelasi dengan fungsi capillary number. Capillary number (Nc) didefinisikan sebagai rasio viskositas dan gaya kapiler. Capillary number secara umum dapat dihitung dari persamaan di bawah ini:
�� =� cos ���
Keterangan:
v = laju alir efektif (cm/s)
μ = viskositas larutan pendesak (cp) σ = tegangan antarmuka (dyne/cm) θ = sudut kontak kebasahan/wetting angle
Menurut Emegwalu (2009) peningkatan nilai capillary number
mengindikasikan peningkatan recovery minyak sisa/residual oil. Peningkatan viskositas dari fluida menyebabkan peningkatan kecepatan perpindahan yang tidak efektif. Namun, nilai Nc yang besar dapat dicapai dengan cara mengurangi tegangan antarmuka (IFT) antara air dan minyak dengan menggunakan surfaktan. Dan sebaliknya semakin besar nilai IFT menyebabkan capillary number semakin kecil. Dengan semakin kecilnya capillary number berdasarkan kurva capillary desaturation maka perolehan minyak yang dihasilkan semakin sedikit. Korelasi antara minyak yang dapat diperoleh dan nilai capillary number dapat dilihat pada Gambar 2.2.
Gambar 2.1 Hubungan capillary number dengan oil recovery (Chatzis dan Morrow 1994)
Waterflood pada kondisi water-wet biasanya memiliki nilai Nc berkisar antara 107-10-5. Critical capillary number berada pada kisaran 10-5-10-4 . Namun pada kondisi desaturasi oil-wet nilai Nc berada pada kisaran 10-2-10-1 (Emegwalu 2009). Peneliti sebelumnya, Al-Sahhaf (2002), menjelaskan terbentuknya ultra low IFT dipengaruhi beberapa parameter diantaranya, berat molekul rata-rata surfaktan, distribusi berat molekul surfaktan, struktur molekul surfaktan, konsentrasi surfaktan, berat rata-rata molekul minyak mentah beserta bentuk molekulnya,
Salah satu faktor yang memiliki pengaruh besar untuk mencapai nilai IFT minimum adalah konsentrasi surfaktan. Cayias et al. (1977), menjelaskan bahwa IFT menurun seiring bertambahnya konsentrasi surfaktan. Penurunan sampai pada sebuah nilai konsentrasi tertentu, nilai tegangan antarmuka akan mencapai nilai minimum. Ketika konsentrasi terus ditingkatkan hingga melebihi nilai konsentrasi kritis ini, nilai tegangan antarmuka justru meningkat. Chan dan Shah (1981) menjelaskan bahwa nilai konsentrasi surfaktan tertentu yang menunjukkan nilai tegangan antarmuka dan tegangan permukaan minimal merupakan nilai Critical Micelle Concentration (CMC) yang sebenarnya. Jumlah molekul suatu surfaktan dalam campuran minyak mentah dan air formasi meningkat seiring dengan peningkatan konsentrasi surfaktan. Ketika konsentrasi surfaktan pada fasa cair mendekati nilai CMC, nilai tegangan antarmuka dan tegangan permukaan akan mencapai nilai minimum.
Healy dan Reed (1974) mempelajari pengaruh konsentrasi garam NaCl terhadap tegangan antarmuka mo (mikroemulsi–minyak) dan mw (mikroemulsi–
air), serta pengaruh terhadap parameter kelarutan (solubilization paremeter) Vo/Vs dan Vw/Vs. Vs adalah volume surfaktan dalam mikroemulsi, sedangkan Vo dan Vw masing-masing adalah volume minyak dan volume air dalam fasa mikroemulsi.
Gambar 2.2 Kadar garam dan tegangan antarmuka (Sugiharjo et al. 2001)
Kelakuan Fasa
Kelakuan fasa dari mikroemulsi bersifat kompleks dan terikat pada beberapa parameter diantaranya tipe dan konsentrasi dari surfaktan, co-solvent, hidrokarbon, kadar garam air formasi, suhu dan tekanan. Dua sifat penting dari mikroemulsi tersebut adalah keseimbangan fasa dan proses kelarutan serta tegangan antarmuka. Keseimbangan fasa dan proses kelarutan dapat digambarkan dalam diagram ternery yang terdiri dari tiga komponen yaitu: minyak, larutan surfaktan dan kadar garam. Sebagai contoh, diagram ternery yang sederhana terdiri dari sistem tiga komponen (pseudoternary diagram): surfaktan-minyak-air formasi disajikan pada Gambar 2.3.
Dalam proses EOR, bagian penting diagram ternery adalah daerah tiga fasa. Bentuk umum diagram ternery tersebut dapat diklasifikasikan sebagai: tipe II(-), yaitu emulsi fasa bawah dan kelebihan fasa air; tipe II (+), yaitu emulsi fasa atas dengan kelebihan fasa minyak; dan tipe III, yaitu mikroemulsi fasa tengah yang memiliki komposisi fasa kaya minyak dan fasa kaya air yang sama. Pada gambar terlihat terjadi peningkatan kadar garam yaitu dari tipe II (-) dengan slope negatif ke tipe II (+) dengan slope positif. Nilai slope berharga nol ketika kelarutan dari surfaktan didalam fasa kaya air dan minyak adalah sama. Peningkatan kadar garam dalam air formasi menurunkan kelarutan surfaktan anionik dalam air formasi. Pada fasa tiga memiliki kadar garam optimum.
Gambar 2.3 Diagram pseudoterner air formasi-surfaktan-minyak (Sugiharjo et al. 2001)
Pada kondisi mikroemulsi, salah satu fasa menjadi fasa kontinyu (fasa external) dan yang lain membentuk butiran (fasa diskontinyu). Namun nilai IFT terendah suatu larutan terjadi sesaat sebelum terbentuk mikroemulsi. Hal ini karena setelah terbentuk mikroemulsi fasa larutan akan berubah ke fasa II (+) yang menyebabkan nilai IFT akan membesar kembali. Selain itu, di industri perminyakan fase mikroemulsi ini dihindari karena dibutuhkan biaya lebih untuk proses demulsifikasi yaitu memisahkan antara fasa minyak dan fasa airnya.
Pada pengamatan yang telah dilakukan sebelumnya oleh Sugiharjo et al.
berwarna translucent (jernih tembus cahaya) pada umumnya terbentuk pada kadar salinitas rendah, dan Vw/Vs>Vo/Vs. Mikroemulsi atau emulsi fasa tengah adalah emulsi terbentuk di fasa tengah, dalam kondisi tiga fasa (air-mikroemulsi-minyak), berwarna translucent, terbentuk pada kadar salinitas optimum, Vw/Vs=Vo/Vs. Emulsi fasa atas adalah emulsi yang terbentuk di fasa minyak, dalam kondisi dua fasa, berwarna jernih, pada kadar salinitas tinggi cenderung membentuk emulsi di fasa atas, Vw/Vs<Vo/Vs. Makroemulsi adalah emulsi yang terbentuk kental, berwarna putih susu (milky), ukuran makroemulsi sangat besar (2000 – 100.000 A). Endapan yang terbentuk tidak berbentuk emulsi, tetapi terjadi padatan yang sangat lunak.
Pengamatan di laboratorium terhadap kelakuan fasa fluida campuran antara surfaktan, air formasi dan minyak dilakukan dengan cara uji tabung, yaitu mencampurkan masing-masing fluida tersebut kedalam tabung reaksi dengan perbandingan volume dan kombinasi konsentrasi tertentu. Campuran yang terbentuk tersebut dikocok dan kemudian dipanaskan dalam oven hingga mencapai suhu reservoir, sehingga terbentuk fasa yang stabil, yang kemudian diamati kondisi fasanya (Sugihardjo et al. 2002).Pada beberapa industri perminyakan uji kelakuan fasa dilakukan terlebih dahulu sebelum uji tegangan antarmuka, hal ini karena keterbatasan alat spinning drop tensiometer yang dimiliki. Uji kelakuan fasa pada penelitian ini dilakukan pada suhu 50 oC karena suhu ini merupakan suhu yang paling mendekati dengan suhu reservoir.
Pengaruh Garam Anorganik, Pelarut Alkohol dan Alkali terhadap Kinerja Surfaktan
Surfaktan primer berperan dalam melarutkan sejumlah besar air dan minyak untuk membuat mikroemulsi yang menunjukkan tegangan antarmuka ultralow
dengan fase air dan minyak. Dengan begitu dapat memberikan rasio solubilisasi tinggi yang diinginkan, terutama pada salinitas optimum. Molekul surfaktan memiliki dua sifat sekaligus diantaranya mengandung kepala hidrofilik yang lebih menyukai air dan ekor hidrofobik yang lebih menyukai minyak. Jadi, ketika surfaktan ditambahkan ke sistem minyak dan air, campuran cenderung membentuk misel di mana molekul surfaktan terdapat pada antarmuka.
Surfaktan anionik mengandung cabang hydrophobic yang didesain sangat baik untuk tujuan EOR (Hirasaki et al. 2006; Hirasaki et al. 2008; Levitt et al.
2009). Surfaktan anionik lebih mirip dengan surfaktan non-ionik karena mereka menunjukkan adsorpsi signifikan lebih rendah pada batu pasir, dan karbonat bila digunakan dengan alkali. Kedua, dengan surfaktan anionik sangat mungkin untuk mengubah jenis fase mikroemulsi dengan konsentrasi elektrolit yang bervariasi seperti biasanya dilakukan dalam chemical flooding. Contoh surfaktan anionik diantaranya linear alkilbenzen sulfonat (ALS), alkohol sulfat (AS), alkohol eter sulfat (AES), alfa olefin sulfonat (AOS), dan parafin (secondary alkane sulfonate, SAS) dan metil ester sulfonat (MES).
60° C, sedangkan sulfonat dapat digunakan pada suhu tinggi (Barnes et al. 2008). Gugus hydrophobes bercabang lebih diinginkan karena dua alasan, pertama untuk memberikan rasio solubilisasi tinggi dan kedua untuk memberikan viskositas mikroemulsi yang rendah dibandingkan kental, gel atau fase kristal cair. Gugus EO dan PO dapat menambah fleksibilitas untuk surfaktan. Gugus EO dapat ditambahkan untuk meningkatkan hidrofilisitas surfaktan dan menggeser salinitas optimum yang lebih tinggi, dan mereka juga bertindak sebagai linker hidrofilik. Gugus PO menambah panjang dan cabang pada ekor surfaktan dan juga bertindak sebagai linker hidrofobik, hal ini membantu mencapai mikroemulsi viskositas rendah dan kelarutan yang lebih tinggi (Salager et al. 2005). Kedua gugus EO dan PO juga memungkinkan surfaktan untuk menjadi toleran terhadap kation divalen seperti Ca 2 + dan Mg 2 + ( Hirasaki et al. 2008).
Garam adalah senyawa ionik yang terdiri dari ion positif (kation) dan ion negatif (anion), sehingga membentuk senyawa netral (tanpa bermuatan). Garam terbentuk dari hasil reaksi penetralan asam dan basa. Garam anorganik terbentuk dari mineral. Unsur penting pada garam-garam anorganik adalah oksida, karbonat, sulfat dan halida. Banyak senyawa anorganik ditandai dengan titik leleh yang tinggi. Garam-garam anorganik biasanya adalah konduktor yang buruk dalam keadaan padat. Sifat lainnya adalah kelarutannya dalam air dan kemudahan kristalisasi. Sebagai contoh NaCl memiliki kelarutan yang sangat baik dalam air tetapi untuk SiO2 tidak memiliki kelarutan yang baik dalam air. Contoh garam
anorganik lainnya adalah MgCl2, CaCl2, SrCl2, Ca(NO3)2, CaBr2, CaCl2, Na2SO4,
K2SO4, KNO3, dan lainnya.
Kelakuan fasa larutan surfaktan sangat dipengaruhi oleh kadar garam dari air formasi. Secara umum, peningkatan kadar garam didalam air formasi akan menurunkan kelarutan surfaktan anionik didalam air formasi. Di daerah salinitas rendah hanya ada dua fase yaitu, mikroemulsi dengan fasa ekternal air di bagian bawah dan fase minyak berlebih di bagian atas. Ini disebut jenis Winsor perilaku I fase. Dengan meningkatnya salinitas, fasa bicontinous mikroemulsi terbentuk. Pada salinitas sedang, tiga fase hidup berdampingan secara bersamaan. Jenis fase ini dianggap sebagai Winsor tipe III. Ketika salinitas lebih meningkat, volume relatif dari fase menengah dikonversi ke Winsor tipe II dengan mikroemulsi minyak eksternal di atas dan kelebihan air di bagian bawah. Ketergantungan perilaku fase dari sistem surfaktan minyak-air pada garam dapat dijelaskan dengan energi antarmuka. Fenomena salt-out juga memainkan peran penting pada fase mikroemulsi. Ketika konsentrasi garam meningkat, beberapa molekul air tertarik oleh ion garam, yang menurunkan jumlah molekul air yang tersedia untuk berinteraksi dengan bagian surfaktan. Sebagai akibat dari meningkatnya permintaan molekul pelarut, interaksi antara gugus kepala hidrofilik menjadi lebih kuat daripada interaksi pelarut-zat terlarut, molekul surfaktan diendapkan dengan membentuk interaksi hidrofobik antar satu sama lain. Kurva lapisan antarmuka berubah dari nilai positif ke nol sampai yang negatif, sesuai dengan transisi dari fase o/w ke fase bicontinous lalu ke fase w/o.
kesetimbangan, dan menggurangi viskositas mikroemulsi. Rasio penambahan surfaktan dengan pelarut adalah 2:3 (Sheng 2011).
Alkohol berfungsi dalam menstabilkan mikroemulsi. Ketika sebuah emulsi dihasilkan oleh suatu surfaktan tanpa ada alkohol di dalamnya, maka micelle
tersebut memiliki kemampuan terlarut yang tidak terbatas. Selanjutnya, kondisi ini memungkinkan mikroemulsi untuk dibalik berdasarkan perkembangan fasa didalamnya (inner). Dengan adanya alkohol, mikroemulsi dapat dijaga pada jenis kondisi yang diinginkan, dan fasa inner tidak bisa berkembang bebas. Sebuah fasa tengah mikroemulsi dapat muncul pada kondisi konsentrasi yang sesuai. Alkohol kadang-kadang dapat membantu surfaktan untuk mengurangi nilai IFT dengan mengubah nilai HLB surfaktan tersebut. Oleh karena itu, ketika alkohol ditambahkan (walaupun kompatibilitas sistem dapat ditingkatkan), nilai IFT tetap menjadi lebih tinggi dari pada saat sistem belum ditambahkan alkohol (Sheng 2011).
Pada penelitian ini digunakan beberapa alkohol diantaranya etanol, metanol, propanol, isopropil alkohol, dan pentanol. Sifat dari setiap alkohol yang digunakan disajikan pada Tabel 2.1.
Tabel 2.1 Sifat fisiko kimia alkohol
Karakteristik Metanol Etanol Propanol IPA Butanol Pentanol Rumus kimia CH3OH C2H5OH C3H7OH C3H7OH C4H9OH C5H11OH
Sumber :a) Merck KgaA 2012; b) Fisher Scientific 2010; c) Science Lab.com 2005; d) Fisher Scientific 2004.
menghasilkan larutan asam. Alkohol yang berantai pendek seperti propanol meningkatkan nilai salinitas optimal untuk surfaktan sulfonat, sedangkan alkohol berantai panjang seperti pentanol dan hexanol akan mengurangi nilai salinitas optimal. Suatu bagian alkohol juga termasuk pada struktur batas fasa micellar
seperti sulfonat. Contohnya pada penambahan iso-propanol meningkatkan kelarutan sulfonat pada fasa cair lebih baik dari pada kelarutan pada fasa minyak. Alkohol berantai pendek yang hanya memiliki 3 atom karbon, tidak bisa membentuk micelle. Panjang rantai karbon setidaknya harus mencapai 8-10 buah. Selain itu, gugus OH pada alkohol tidak cukup polar untuk berlaku seperti sebuah gugus hidrofobik. (Sheng 2011).
Penambahan alkali pada larutan surfaktan dapat menurunkan nilai IFT. Penurunan nilai IFT ini disebabkan oleh ekstraksi asam dari minyak oleh alkali yang membuat gaya antarmuka minyak lebih reaktif. Sugihardjo et al. (2002) menyatakan bahwa alkali/aditif yang boleh dipergunakan adalah natrium hidroksida (NaOH) dan natrium karbonat (Na2CO3) dengan batas maksimal
penggunaan 1% untuk memaksimalkan kinerja surfaktan dalam menurunkan tegangan antarmuka. Menurut Jackson (2006) penggunaan alkali juga harus mempertimbangkan sifat kimia dari reservoir. Bahkan ketika natrium karbonat memiliki kinerja yang baik pada phase behaviour, tetap harus diuji dengan contoh batuan reservoir karena reaksi kimia yang rumit dapat terjadi dengan mineral-mineral batuan. Menurut Sheng (2011) terdapat 6 alkali yang dapat digunakan untuk menurunkan IFT adalah NaOH, Na2SiO3, Na4SiO4, Na3PO4, NaHCO3, dan
Na2CO3. Penambahan alkali seperti natrium karbonat meningkatkan kekuatan ion
(salinitas). Konsentrasi alkali meningkat, menyebabkan salinitas optimum menurun. Hal tesebut dilakukan untuk mengurangi salinitas optimal.
Pada penelitian ini hanya digunakan satu jenis alkali yaitu NaOH. Jenis alkali lain yang biasa digunakan pada pengujian kinerja formula surfaktan adalah natrium karbonat (Na2CO3), namun pada penelitian ini tidak digunakan. Penambahan
natrium karbonat diduga memicu terbentuknya endapan pada formula surfaktan karena sampel fluida yang digunakan berasal dari batuan pasir yang mengandung karbonat relatif tinggi. Penggunaan alkali pada suatu formula surfaktan didasarkan pada kandungan anion ( Cl-, HCO3-, SO4-, CO32-) dan kation (Na+, Ca2+, Mg2+, Ba2+,
Sr2+, dan Fe3+) air formasi atau air injeksi lapangan. Adanya ion-ion yang terlarut dalam air dapat bergabung dan membentuk suatu senyawa, salah satunya adalah pembentukan scale yang dapat mengurangi produktifitas minyak yangdihasilkan. Endapan scale yang sering terjadi pada sumur minyak adalah kalsium karbonat (CaCO3).
Air formasi yang digunakan memiliki kandungan ion bikarbonat yang besar yaitu 1989 mg/L (Tabel 2.4). Dalam sumur minyak, endapan kalsium karbonat biasanya disebabkan oleh penurunan tekanan yang menghasilkan CO2 dari ion
bikarbonat (HCO3-). Ketika CO2 dilepaskan, pH larutan meningkat, kelarutan
karbonat terlarut menurun dan bikarbonat yang lebih larut dikonversi menjadi karbonat yang kurang larut. Sebagai ilustrasi 100 mg bikarbonat perliter air bisa menghasilkan 12972,74 gr endapan kalsium karbonat per 1000 barel air. Dengan perbandingan tersebut kalsium karbonat yang dihasilkan adalah 1622,946 mg/L.
Tabel 2.4 ion kalsium air adalah 12,2 mg/L.Reaksi pembentukan kalsium karbonat adalah
Ca2+ + CO32- CaCO3
Dengan perbandingan stokiometri 1:1, maka dengan penambahan Na2CO3
sebanyak 1000 ppm akan menghasilkan CaCO3 sebesar 12,2 ppm. Berdasarkan
hasil penelitian Mohammed (2007), kelarutan CaCO3 pada salinitas 7000 ppm dan
suhu reservoir 40, 50 dan 60 oC adalah sebesar 6255 ppm, 5849 ppm, dan 4268 ppm. Berdasarkan perhitungan total endapan kalsium karbonat yang dihasilkan 1635 mg/L (Lampiran 1). Artinya kalsium karbonat yang dihasilkan mendekati ambang batas kelarutannya. Dengan alasan ini alkali natrium karbonat tidak digunakan.
Metil Ester Sulfonat
Menurut Warren S. Perkins (1998), istilah surfactant berasal dari kata surface active agent. Adanya gugus hidrofobik dan hidrofilik didalam satu molekul surfaktan menyebabkan surfaktan cenderung berada pada antarmuka antara fasa yang berbeda derajat polaritas dan ikatan hidrogennya seperti minyak/air atau udara/air. Adanya film pada antarmuka antara fasa yang berbeda mampu menurunkan energi antarmuka dan menyebabkan sifat-sifat khas pada molekul surfaktan. Surfaktan dapat mengurangi tegangan permukaan air dengan cara adsorbsi antarmuka cair-gas. Surfaktan juga dapat mengurangi tegangan antarmuka antara minyak dan air dengan cara adsorbsi pada antarmuka cair-cair. Gugus hidrofilik pada surfaktan bersifat polar dan dapat berupa ionik atau nonionik, hal ini dapat menyebabkan kelarutan molekul air (Myers 1987).
Adanya perbedaan muatan pada gugus hidrofilik juga digunakan sebagai dasar klasifikasi surfaktan. Surfaktan anionik adalah surfaktan yang gugus hidrofiliknya merupakan grup senyawa bermuatan negatif, contohnya karboksil (RCOO- M+), sulfonat (RSO3- M+), sulfat (ROSO3- M+) atau phospat (ROPO3- M+).
Surfaktan anionik secara luas digunakan dalam proses enhance oil recovery dengan metode injeksi kimia karena daya adsorpsi yang relatif rendah pada batuan sandstone yang memiliki muatan permukaan yang negatif. Oleh karena itu dalam penelitian ini digunakan surfaktan anionik yaitu metil ester sulfonat untuk menghasilkan nilai IFT yang rendah.
Metil ester sulfonat merupakan surfaktan anionik yang sudah banyak dikembangkan sebagai pengganti surfaktan petroleum sulfonat. Menurut Matheson (1996), MES memperlihatkan karakteristik dispersi yang baik, sifat deterjensi yang baik terutama pada air dengan tingkat kesadahan yang tinggi (hard water) dan tidak adanya fosfat, ester asam lemak C14, C16 dan C18 memberikan tingkat deterjensi
EOR yaitu sifat deterjensi yang baik terutama pada air dengan tingkat kesadahan yang tinggi (hard water) dan memberikan tingkat deterjensi yang baik.
Pembuatan surfaktan metil ester sulfonat dari minyak nabati membutuhkan beberapa tahapan diantaranya proses transesterifikasi untuk menghasilkan metil ester. Metil ester yang dihasilkan dilanjutkan dengan proses sulfonasi untuk menghasilkan metil ester sulfonat. Transesterifikasi (biasa disebut dengan alkoholisis) adalah tahap konversi dari trigliserida (minyak nabati) menjadi alkil ester, melalui reaksi dengan alkohol, dan menghasilkan produk samping yaitu gliserol. Di antara alkohol-alkohol monohidrik yang menjadi kandidat sumber/pemasok gugus alkil, metanol adalah yang paling umum digunakan, karena harganya murah dan reaktifitasnya paling tinggi (sehingga reaksi disebut metanolisis). Transesterifikasi merupakan reaksi kesetimbangan. Untuk mendorong reaksi bergerak ke kanan agar dihasilkan metil ester, perlu digunakan alkohol dalam jumlah berlebih atau salah satu produk yang dihasilkan harus dipisahkan. Pada Gambar 2.4 disajikan reaksi trigliserida dengan metanol yang menghasilkan metil ester.
Reaksi transesterifikasi juga menggunakan katalis dalam reaksinya. Tanpa adanya katalis, konversi yang dihasilkan maksimum namun reaksi berjalan dengan lambat (Mittlebatch 2006). Katalis yang biasa digunakan pada reaksi transesterifikasi adalah katalis basa, karena katalis ini dapat mempercepat reaksi.
Gambar 2.4 Proses transesterifikasi trigliserida dengan metanol
Proses transesterifikasi dipengaruhi oleh berbagai faktor bergantung pada kondisi reaksinya (Meher et al. 2004). Faktor tersebut diantaranya adalah kadar asam lemak bebas (FFA) dan kadar air minyak, jenis katalis dan konsentrasinya, nisbah molar antara alkohol dan minyak dan jenis alkoholnya, suhu dan lamanya reaksi, serta intensitas pencampuran dan penggunaan pelarut organik. Kualitas ME dipengaruhi oleh kualitas minyak (bahan baku), komposisi asam lemak dari minyak, proses produksi dan bahan lain yang digunakan dalam proses, serta parameter pasca-produksi seperti kontaminan. Kontaminan tersebut di antaranya adalah bahan tak tersabunkan, air, gliserin bebas, gliserin terikat, alkohol, FFA, sabun, dan residu katalis (Gerpen et al. 1996). Reaksi transesterifikasi secara batch
lebih sederhana dibandingkan dengan secara kontinyu, dan dapat mengubah minyak menjadi ME hingga 80–94% dalam waktu 30-60 menit. Reaktor transesterifikasi secara kontinyu telah dikembangkan untuk memperkecil ukuran reaktor dan waktu reaksi.
Proses selanjutnya adalah mereaksikan metil ester dengan agen sulfonasi. Menurut Bernardini (1983) dan Pore (1976), pereaksi yang dapat dipakai pada proses sulfonasi antara lain asam sulfat (H2SO4), oleum (larutan SO3 di dalam
kualitas produk MES terbaik, reaktan yang digunakan disarankan gas SO3.
Beberapa perlakuan penting yang harus dipertimbangkan adalah laju alir gas SO3
dan metil ester, suhu proses sulfonasi, lama proses aging, konsentrasi gas SO3, laju
proses netralisasi, konsentrasi NaOH, dan suhu netralisasi.
Reaksi sulfonasi merupakan suatu reaksi substitusi elektrofilik dengan menggunakan agen pensulfonasi yang bertujuan untuk mensubstitusi atom H dengan gugus –SO3H pada molekul organik melalui ikatan kimia pada atom
karbonnya (Clayden, Greeves and Wothers 2001).
Gambar 2.5 Reaksi sulfonasi metil ester(Foster dan Rollock 1997)
Fluida Reservoir
Menurut Rachmat (2009) fluida reservoir terdiri dari minyak, gas dan air formasi. Minyak dan gas kebanyakan merupakan campuran rumit dari berbagai senyawa hidrokarbon, yang terdiri dari golongan naftan, paraffin, aromatik dan sejumlah kecil gabungan oksigen, nitrogen, dan belerang. Sheng (2011) menambahkan bahwa komposisi minyak sangat penting untuk alkali-surfaktan
flooding karena surfaktan yang berbeda harus dipilih untuk minyak yang berbeda. Menurut Koesoemadinata (1980) dan Speight (2002) secara garis besar minyak bumi mempunyai komposisi seperti terlihat pada Tabel 2.2. Sifat fisika kimia minyak yang digunakan pada penelitian ini ditampilkan pada Tabel 2.3.
Tabel 2.2 Komposisi minyak bumi secara umum
Komponen % Bobot Karbon 83,9 – 86,8 Hidrogen 11,4 – 14,0 Belerang 0,06 – 0,08 Nitrogen 0,11 – 1,70 Oksigen ± 0,5
Logam ± 0,03
Air formasi merupakan fluida reservoir yang tercampur dan terangkat bersama minyak bumi kepermukaan, bersifat asin dengan salinitas rata-rata diatas air laut, kandungan utama air formasi adalah unsur Ca2+ (kalsium), Na+ (natrium), dan Cl- (Chlor) yang dapat ditemukan dalam jumlah besar. Air formasi hampir
minyak. Air formasi selalu menempati sebagian dari suatu reservoir, minimal 10 % dan maksimal 100 % dari keseluruhan pori. Sifat-sifat yang terkandung dalam air formasi meliputi sifat fisik dan sifat kimia. Sifat fisik itu sendiri meliputi kompresibilitas, kelarutan gas didalam air, viscositas air, berat jenis dan konduktifitas. Sedangkan untuk sifat kimia meliputi ion negatif (anion) dan ion-ion positif (kation-ion). Sifat fisika kimia air formasi yang digunakan pada penelitian disajikan pada Tabel 2.4.
Tabel 2.3 Sifat fisika kimia fluida minyak lapangan sandstone yang digunakan dalam penelitian
Parameter Suhu Pengukuran (
oC)
40 50 60
Density (g/cm3) 0,91483 0,90803 0,90142
Temperature 40,02 49,99 59,97
API Density (g/cm3) (15oC) 0,9314 0,9313 0,9313
API Gravity (15oC) 20,27 20,3 20,28
API Specific Grafity (15oC) 0,9323 0,9322 0,932
Viscosity (cP) 25,60 25,24 16,53 16,45 11,69 11,76
Speed (rpm) 60,00 90,00 60,00 90,00 60,00 90,00
Torque (%) 51,22 75,73 33,09 49,36 23,39 35,28
Shear Stress 20,27 29,98 13,10 19,54 9,26 13,97
Shear Rate (1/s) 79,20 118,80 79,20 118,80 79,20 118,80
Tabel 2.4 Sifat fisika kimia fluida air lapangan sandstone yang digunakan dalam penelitian
Salinity as NaCl mg/L 8417 5795 2520 B
Total Hardness as CaCO3 mg/L 117 67,9 2340 B
Total Suspended Solid mg/L 32 18 2540 D
Oil & Grace mg/L < 2 < 2 5520 B
METODE
Bahan
Bahan yang digunakan untuk formulasi surfaktan adalah metil ester sulfonat (MES), beberapa alkohol yaitu metanol, etanol, butanol, IPA, propanol, dan pentanol, garam NaCl, alkali (NaOH), air formasi dan air demineral. Untuk uji kelakuan fasa bahan yang digunakan adalah air formasi, air demineral, minyak bumi, dan formulasi surfaktan yang telah dibuat. Adapun bahan yang digunakan untuk pengujian kinerja surfaktan adalah aquades dan formulasi surfaktan pada proses sebelumnya.
Alat
Alat yang dibutuhkan dalam penelitian ini adalah tabung sampel sebanyak 20 tabung untuk formulasi, 20 tabung kelakuan fasa, neraca analitik, 2 buah sudip, 5 buah pipet, 2 buah gelas ukur 100 mL, 5 buah magnetik stirrer dengan panjang 3 cm, viscosimeter, 4 buah syringe, spinning drop tensiometer, density meter dan
oven dengan suhu 50 oC.
Prosedur Analisis Data
Pada penelitian ini dilakukan beberapa tahapan prosedur pengerjaan, prosedur pertama adalah melakukan formulasi larutan surfaktan untuk mendapatkan optimal konsentrasi surfaktan, optimal salinitas, optimal konsentrasi alkohol dan optimal konsentrasi alkali (NaOH). Setelah itu, hasil formulasi dilakukan pengujian nilai densitas dan nilai IFT. Hasil uji nilai IFT terbaik selanjutnya dilakukan uji kelakuan fasa. Formulasi larutan surfaktan ditujukan untuk memperoleh formula larutan surfaktan yang terbaik, yaitu formula yang memiliki nilai terbaik atau mencapai ultralow interfacial tension(≤10-3 dyne/cm).
Formulasi Air Formasi dengan Konsentrasi Surfaktan yang Berbeda
Pada tahap ini diformulasikan dahulu antara MES dan air formasi. Total berat hasil formulasi adalah 25 gram untuk satu kali formulasi namun dalam penelitian ini dibuat 2 sampel untuk satu formulasi. Prosedur percobaannya adalah berat total hasil formulasi ditetapkan sebesar 25 gram. Surfaktan MES ditambahkan dengan konsentrasi yang berbeda terdiri dari 0,1%, 0,3%, 0,5%, 0,7%, 1%, 1,5% dan 2%. Contoh perhitungan bobot (w/w) surfaktan yang digunakan :
0,3% x 25 gram = 0,075 gram
Formulasi Surfaktan MES dan Air Formasi dengan Konsentrasi Garam Anorganik yang Berbeda.
Pada tahap ini hasil formulasi surfaktan MES dan air formasi dengan hasil uji penurunan nilai IFT terbaik ditambahkan garam anorganik dengan variasi 0%, 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, dan 10%. Berdasarkan hasil uji penurunan nilai IFT, konsentrasi surfaktan MES optimum adalah 0,3%. Prosedur percobaannya adalah berat total hasil formulasi ditetapkan sebesar 25 gram untuk satu konsentrasi namun dalam penelitian ini dibuat 2 sampel untuk satu konsentrasi garam. Langkah pertama adalah formula garam anorganik dengan air formasi (formula 1) dibuat dengan cara garam anorganik (NaCl) ditimbang sebanyak 0%, 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, dan 10%.
Contoh perhitungan bobot (w/w) garam yang digunakan :
1% x 25 gram = 0,25 gram Lampiran 2. Sampel dibuat duplo dan hasil terbaik dari uji nilai IFT dilakukan uji kelakuan fasa. Perlakuan yang sama dilakukan pada sampel air demineral.
Formulasi Surfaktan MES dan Air Formasi dengan Jenis dan Konsentrasi Alkohol yang Berbeda.
Pada tahap ini dilakukan dua tahap formulasi. Formulasi pertama merupakan formulasi surfaktan MES dengan air formasi dan formulasi kedua adalah formulasi alkohol dengan hasil fomula pertama. Konsentrasi alkohol yang ditambahkan adalah 0,5%, 1%, 1,5%, dan 2%. Prosedur percobaan dilakukan dengan cara berat total formulasi ditetapkan sebesar 25 gram untuk satu konsentrasi alkohol namun dalam penelitian ini dibuat 2 sampel untuk satu konsentrasi. Surfaktan MES ditimbang dengan konsentrasi 0,3% dari 25 gram yaitu 0,075 gram. Setelah itu ditambahkan air formasi sampai bobot total mencapai 25 gram. Hasil formulasi pertama diaduk dengan magnetik stirrer pada suhu ruang (27 oC) hingga campuran homogen selama 1 jam.
Hasil formulasi pertama yang telah homogen ditambahkan alkohol dengan jenis yang berbeda-beda yaitu metanol, etanol, IPA, propanol, butanol dan pentanol. Pada masing-masing jenis dibuat dengan variasi konsentrasi 0,5%, 1%, 1,5%, dan 2%. Bobot total formulasi ini adalah 25 gram sehingga jika 0,5% alkohol yang ditambahkan maka bobot alkohol yang ditambahkan adalah 0,5% dari 25 gram yaitu 0,125 gram. Setelah itu, hasil formulasi pertama ditambahkan hingga mencapai 25 gram. Hasil formulasi kedua ini diaduk dengan magnetik stirrer
Formulasi Surfaktan MES dan Air Formasi dengan Alkali (NaOH)
Pada tahap ini dilakukan dua tahap formulasi. Formulasi pertama merupakan formulasi surfaktan MES dengan air formasi dan formulasi kedua adalah formulasi alkali dengan hasil fomula pertama. Konsentrasi alkali yang ditambahkan adalah 0,1 – 1% dengan selang 0,1%. Prosedur percobaan dilakukan dengan cara berat total formula ditetapkan sebesar 25 gram untuk satu konsentrasi alkali namun dalam penelitian ini dibuat 2 sampel untuk satu konsentrasi. Surfaktan MES ditimbang dengan konsentrasi 0,3% dari 25 gram yaitu 0,075 gram. Setelah itu ditambahkan air formasi sampai bobot total mencapai 25 gram. Hasil formulasi pertama diaduk dengan magnetik stirrer pada suhu ruang (27 oC) hingga campuran homogen selama 1 jam.
Hasil formulasi pertama ditambahkan alkali dengan konsentrasi 0,1 – 1% dengan selang 0,1%. Bobot total formulasi ini adalah 25 gram sehingga jika 0,1% alkali yang ditambahkan maka bobot alkali yang ditambahkan adalah 0,1% dari 25 gram yaitu 0,025 gram. Setelah itu, hasil formulasi pertama ditambahkan hingga mencapai 25 gram. Hasil formulasi kedua ini diaduk dengan magnetik stirrer
hingga campuran merata pada suhu ruang (27 oC) selama 1 jam. Setelah homogen, larutan dilakukan pengukuran densitas dan nilai IFT dengan prosedur yang terdapat pada Lampiran 2. Sampel larutan dibuat duplo. Hasil uji penurunan nilai IFT yang terbaik akan dilakukan uji kelakuan fasa. Perlakuan yang sama dilakukan pada air demineral.
Uji Kelakuan Fasa/Phase Behaviour
Uji kelakuan fasa dilakukan pada larutan surfaktan yang memberikan nilai IFT mencapai 10-3 dyne/cm. Metode yang digunakan pada metode ini adalah
metode tabung tertutup. Prosedur analisis yang dilakukan adalah 2 mL surfaktan dimasukkan ke dalam graduated pipette berukuran 5 mL lalu ditambahkan minyak mentah (crude oil) sebanyak 2 mL. Bagian bawah dan atas pipet diseal dengan bor api. Pipet ditempatkan pada rak dan disimpan pada suhu reservoir selama 30 menit. Sebagai data awal volume surfaktan dan minyak diamati dan dicatat. Setiap pipet dibolak-balikkan sebanyak 3 kali hingga cairan tercampur. Jangan dikocok. Selanjutnya, diamati perubahan pada antarmuka fluida setelah hari ke 7 dan 14 apakah terbentuk emulsi tipe II(-), III, atau II(+). Larutan dikatakan berada di titik keseimbangan ketika antarmuka fluida tidak berubah secara signifikan. Setelah itu, dilakukan perhitungan rasio kelarutan minyak dan ratio kelarutan air. Ratio kelarutan air ditentukan oleh volume air dari volume surfaktan dalam mikroemulsi. Ratio kelarutan minyak digunakan untuk kelakuan fasa tipe I dan tipe III. Ratio kelarutan air digunakan untuk kelakuan fasa tipe II dan tipe III.
HASIL DAN PEMBAHASAN
Formulasi Larutan Surfaktan
menurunkan tegangan antarmuka (IFT) antara minyak-larutan surfaktan dan merubah sifat batuan yang suka minyak (oil wet) menjadi suka air (water wet). Dengan performa terbaik tersebut diharapkan mampu memproduksi minyak secara optimal.
Formulasi dilakukan melalui tahapan terstruktur yaitu optimal surfaktan, optimal salinitas, optimal co-surfaktan dan optimal alkali. Tahapan terstruktur dilakukan untuk memperoleh data yang valid. Karakteristik utama yang harus dipenuhi untuk aplikasi EOR menggunakan surfaktan adalah nilai IFT dari fomula larutan surfaktan. Hal ini dikarenakan penggunaan surfaktan bertujuan untuk menurunkan tegangan antarmuka antara fasa minyak dan fasa air. Pada tahap formulasi ini dilakukan uji kinerja dari formula surfaktan yang dihasilkan berupa pengukuran densitas, uji IFT, dan uji kelakuan fasa. Pada uji kinerja tersebut, digunakan contoh fluida dan minyak dari Lapangan Sandstone di Sumatera untuk memperoleh nilai IFT dari larutan surfaktan.
Tahapan awal formulasi yaitu optimal konsentrasi surfaktan. Optimal konsentrasi surfaktan bertujuan untuk mengetahui konsentrasi optimum surfaktan. Pada tahapan ini, digunakan konsentrasi surfaktan MES yang berbeda yaitu 0,1%, 0,3%, 0,5%, 0,7%, 1%, 1,5% dan 2%. Setelah dilakukan pengadukan dan pemanasan pada suhu ruang (27 oC) selama 1 jam surfaktan MES dapat bercampur dengan baik pada air formasi dan air demineral. Pada konsentrasi surfaktan MES yang rendah, ketika dilarutkan dalam air formasi, larutan yang dihasilkan berwarna putih agak kekuningan sedangkan larutan yang dihasilkan pada air demineral berwarna putih. Pada kedua sampel semakin tinggi konsentrasi surfaktan MES yang ditambahkan semakin berwarna coklat. Perbedaan warna terjadi karena warna larutan awal yang digunakan juga berbeda dimana warna air formasi adalah jernih kekuningan sedangkan air demineral berwarna bening. Perubahan warna larutan dengan peningkatan konsentrasi surfaktan terdapat pada Lampiran 5.
Formulasi kedua adalah formulasi tahap optimal salinitas yang bertujuan untuk mengetahui performa terbaik dari larutan surfaktan pada kondisi salinitas yang optimum pada air demineral dan air formasi. Pada tahapan ini, digunakan NaCl dengan variasi konsentrasi yaitu 10000 sampai 100000 ppm dengan selang 10000 ppm. Tahapan awal formulasi ini adalah mencampurkan garam NaCl dengan air sampel sesuai dengan konsentrasi yang ditetapkan. Setelah itu, hasil formulasi awal dilakukan penambahan surfaktan MES sebanyak 0,3%. Larutan yang dihasilkan pada air formasi adalah larutan berwarna putih kekuningan namun surfaktan MES terlihat tidak tercampur sempurna. Hal ini terlihat pada bagian atas larutan terdapat gumpalan busa berwarna coklat. Semakin tinggi konsentrasi garam yang ditambahkan, gumpalan busa yang dihasilkan semakin banyak.
Formulasi ketiga adalah formulasi tahap optimal konsentrasi co-surfaktan yang bertujuan untuk mengetahui performa terbaik dari larutan surfaktan pada kondisi alkohol yang optimum pada air demineral dan air formasi. Pada tahapan ini, digunakan 6 jenis alkohol yaitu metanol, etanol, isopropil alkohol, propanol, butanol, dan pentanol dengan variasi konsentrasi yaitu 0%, 0,5%, 1%, 1,5% dan 2%. Pada tahap awal formulasi dilakukan pencampuran antara air sampel dan surfaktan MES, kemudian dilakukan pengadukan dengan suhu ruang (27 oC). Setelah itu hasil formulasi awal ditambahkan alkohol dengan jenis dan konsentrasi yang telah ditetapkan yang kemudian dilakukan pengadukan tanpa pemanasan. Pada tahapan kedua ini dilakukan pencampuran tanpa pemanasan untuk menghindari menguapnya alkohol pada larutan sehingga alkohol dapat tercampur dengan baik pada larutan.
Hasil pengamatan warna menunjukkan larutan dengan sampel air formasi adalah putih kecoklatan. Pada sampel air formasi terlihat adanya lapisan kuning kecoklatan dibagian atas larutan yang menunjukkan surfaktan MES tidak tercampur merata. Sedangkan warna sampel air demineral adalah putih susu. Peningkatan konsentrasi alkohol yang diberikan menyebabkan warna semakin pekat. Pencampuran antara air demineral, surfaktan MES dan alkohol menghasilkan larutan yang homogen. Perubahan warna larutan dan fenomena pembentukan lapisan busa dengan peningkatan konsentrasi alkohol terdapat pada Lampiran 5.
Formulasi keempat adalah formulasi tahap optimal alkali yang bertujuan untuk mengetahui performa terbaik dari larutan surfaktan pada kondisi alkali yang optimum pada air demineral dan air formasi. Pada tahapan ini, digunakan jenis alkali NaOH dengan konsentrasi 0,1 – 1% dengan selang 0,1%. Pada tahap awal formulasi dilakukan pencampuran antara air sampel dan surfaktan MES, kemudian dilakukan pengadukan dengan suhu ruang (27 oC). Setelah itu hasil formulasi awal ditambahkan alkali yaitu NaOH yang kemudian dilakukan pengadukan dengan suhu ruang (27 oC).
Hasil pengamatan warna menunjukkan pada larutan dengan sampel air formasi adalah putih kecoklatan. Peningkatan konsentrasi NaOH yang ditambahkan menyebabkan warna semakin pekat. Pada sampel air formasi terlihat adanya lapisan kuning kecoklatan dibagian atas larutan yang menunjukkan surfaktan MES tidak tercampur merata. Sedangkan warna sampel air demineral adalah putih susu. Peningkatan konsentrasi NaOH yang diberikan menyebabkan warna putih semakin pekat. Pencampuran antara air demineral, surfaktan MES dan alkohol menghasilkan larutan yang homogen. Perubahan warna larutan dan fenomena pembentukan lapisan busa dengan peningkatan konsentrasi alkali terdapat pada Lampiran 5.
Uji Densitas
disajikan grafik nilai densitas tahap optimal konsentrasi surfaktan dengan media pendispersi air formasi pada Gambar 4.1 dan air demineral pada Gambar 4.2.
Gambar 4.1 Hubungan antara konsentrasi surfaktan MES dan suhu pengukuran terhadap nilai densitas larutan surfaktan dengan media pendispersi air formasi
Gambar 4.2 Hubungan konsentrasi surfaktan MES dan suhu pengukuran terhadap nilai densitas larutan surfaktan dengan media pendispersi air demineral
Pada Gambar 4.1 dan 4.2 terlihat semakin besar konsentrasi surfaktan MES yang ditambahkan semakin kecil nilai densitas yang dihasilkan. Sehingga trend grafik yang dihasilkan memiliki slop negatif. Hasil yang berbeda akan didapatkan pada pengujian sampel optimal salinitas. Berikut akan disajikan grafik nilai densitas tahap optimal salinitas dengan media pendispersi air formasi pada Gambar 4.3 dan air demineral pada Gambar 4.4.
Gambar 4.3 Hubungan konsentrasi NaCl dan suhu pengukuran terhadap nilai densitas larutan surfaktan MES 0,3% dengan media pendispersi air formasi
Hasil pengujian densitas tahap optimal salinitas terlihat pada Gambar 4.3 dan 4.4 bahwa semakin besar konsentrasi garam yang ditambahkan pada larutan surfaktan MES 0,3 % akan semakin besar pula densitas yang dihasilkan. Sehingga trend grafik yang dihasilkan memiliki trend positif. Hal ini terjadi karena penambahan NaCl meningkatkan jumlah zat terlarut didalam larutan sehingga massa total didalam larutan meningkat. Selain itu, penambahan massa juga didapatkan dari garam-garam yang terbentuk antara ion-ion didalam air formasi misalnya antara ion Mg+ dan Cl- menjadi MgCl. Hal yang sama juga terjadi pada air demineral karena didalam air demineral masih terdapat ion H+ dan OH-.
Menurut Taylor (1997), air deionisasi atau air ultra- murni tidak memiliki ion asing, itu tidak berarti bahwa ia memiliki konduktivitas 0 uS/cm. Nilai konduktivitas akan sangat kecil, dan dalam kebanyakan situasi diabaikan, tetapi bahkan air deionisasi memiliki ion H+ dan ion OH-. Pada suhu kamar konsentrasi dari kedua ion H+ dan ion OH- adalah 10⁻⁷ M (berpikir pH air deionisasi akan
memiliki pH netral 7 tanpa kontak atmosfer) menciptakan nilai konduktivitas yang sangat kecil. Meskipun demikian nilai konduktivitas yang rendah, air deionisasi masih akan memiliki salinitas nol hanya H+ dan OH- yang secara alami ada dalam
air murni. Selama tidak memiliki kontak dengan udara ( terutama CO2 ), air
deionisasi harus memiliki konduktivitas 0.055 uS/cm, atau resistivitas 18 megohms pada 25 °C (Elert 2006). Jika air deionisasi telah diseimbangkan dengan udara, konduktivitas akan lebih dekat dengan 1 uS/cm (1 megohm) pada 25 °C (dan akan memiliki pH 5,56). Kebanyakan standar memiliki berbagai konduktivitas 0,5-3 uS/cm pada 25 °C untuk air suling, tergantung pada lamanya waktu yang telah terkena udara.
Pembuktian hal ini maka dilakukan pengukuran salinitas dengan menggunakan refraktometer beberapa sampel dengan media pendispersi air formasi dan air demineral. Refraktometer merupakan alat yang digunakan untuk mengukur semua garam yang terdapat pada larutan baik NaCl maupun garam lain. Berdasarkan pengujian pada sampel 1% NaCl dengan media pendispersi air formasi, total garam yang terdapat pada larutan adalah 17000 mg/L. Sedangkan bila
berdasarkan perhitungan manual bila garam NaCl saja hanya terdapat 5975 mg/L ditambah dengan 10000 mg/L sehingga 15975 mg/L. Pada media pendispersi air demineral nilai salinitas berdasarkan pengukuran adalah 3500 mg/L sedangkan menurut perhitungan adalah 2500 mg/L. Menurut Martinez (2014) setiap penambahan 100 g garam pada 1 kg air meningkatkan volume larutan sebanyak 34 ± 1 cm3. Berdasarkan data ini, peningkatan volume larutan yang dihasilkan dengan penambahan garam sangat sedikit bila dibandingkan dengan garam NaCl yang ditambahkan.
Gambar 4.4 Hubungan konsentrasi NaCl dan suhu pengukuran terhadap nilai densitas larutan surfaktan MES 0,3% dengan media pendispersi air demineral
Pengujian densitas selanjutnya pada formula tahapan optimal konsentrasi co-surfactant. Berikut disajikan grafik nilai densitas tahap optimal konsentrasi co-surfactant pada larutan surfaktan MES 0,3 % dengan media pendispersi air formasi dan air demineral.
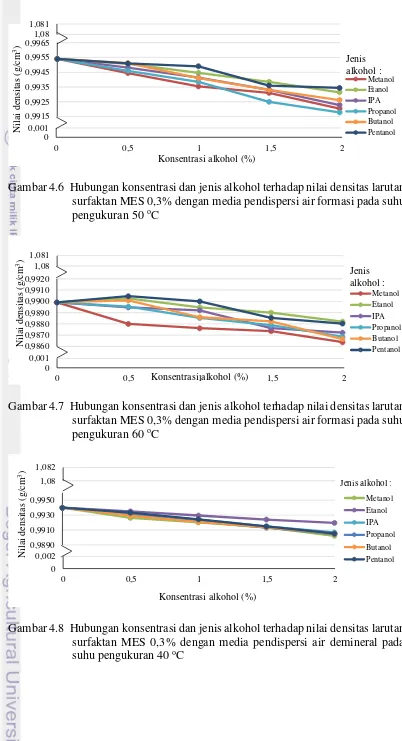
Gambar 4.6 Hubungan konsentrasi dan jenis alkohol terhadap nilai densitas larutan surfaktan MES 0,3% dengan media pendispersi air formasi pada suhu pengukuran 50 oC
Gambar 4.7 Hubungan konsentrasi dan jenis alkohol terhadap nilai densitas larutan surfaktan MES 0,3% dengan media pendispersi air formasi pada suhu pengukuran 60 oC
Gambar 4.9 Hubungan konsentrasi dan jenis alkohol terhadap nilai densitas larutan surfaktan MES 0,3% dengan media pendispersi air demineral pada suhu pengukuran 50 oC
Gambar 4.10 Hubungan konsentrasi dan jenis alkohol terhadap nilai densitas larutan surfaktan MES 0,3% dengan media pendispersi air demineral pada suhu pengukuran 60 oC
Hasil pengujian densitas tahap optimal konsentrasi co-surfactant terlihat pada gambar bahwa semakin besar konsentrasi alkohol yang ditambahkan pada larutan surfaktan MES 0,3% akan semakin kecil densitas yang dihasilkan. Sehingga trend grafik yang dihasilkan memiliki trend negatif. Menurut Martinez (2014), kepadatan larutan dapat didekati dengan cara berikut :
1. larutan air-methanol pada 15 ºC :
� = − � ��� − � ��� kg/m3
dengan �methanol menjadi fraksi massa , atau
� = − � ��� − � ��� kg/m3
dengan �methanol menjadi sekarang fraksi volume 2. larutan air-etanol pada 15 ºC :
untuk < 30 % vol , � = − ���� kg/m3, dan untuk > 30 % vol , � = + ���� kg/m3
�ethanol di sini adalah fraksi volume (misalnya 40 º wiski memiliki 40 % alkohol dalam volume, �ethanol = 0,40, sesuai untuk �ethanol = 0,35 berat). Pencampuran etanol dan air pada suhu dan tekanan konstan , mengurangi volume keseluruhan,
dengan penurunan maksimum 3,5 % untuk 60 % etanol dengan 40 % air. Berdasarkan persamaan diatas sudah jelas bahwa penambahan alkohol pada air pendispersi dapat menurunkan nilai densitas.
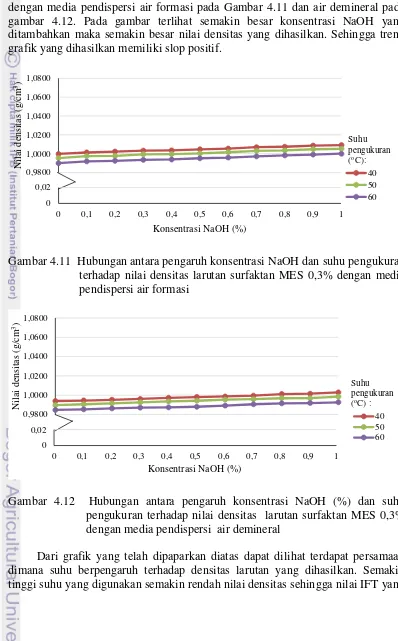
Pengujian densitas selanjutnya pada formula tahapan optimal konsentrasi alkali. Berikut disajikan grafik nilai densitas tahap optimal konsentrasi alkali dengan media pendispersi air formasi pada Gambar 4.11 dan air demineral pada gambar 4.12. Pada gambar terlihat semakin besar konsentrasi NaOH yang ditambahkan maka semakin besar nilai densitas yang dihasilkan. Sehingga trend grafik yang dihasilkan memiliki slop positif.
Gambar 4.11 Hubungan antara pengaruh konsentrasi NaOH dan suhu pengukuran terhadap nilai densitas larutan surfaktan MES 0,3% dengan media pendispersi air formasi
Gambar 4.12 Hubungan antara pengaruh konsentrasi NaOH (%) dan suhu pengukuran terhadap nilai densitas larutan surfaktan MES 0,3% dengan media pendispersi air demineral
Dari grafik yang telah dipaparkan diatas dapat dilihat terdapat persamaan dimana suhu berpengaruh terhadap densitas larutan yang dihasilkan. Semakin tinggi suhu yang digunakan semakin rendah nilai densitas sehingga nilai IFT yang
dihasilkan juga akan semakin kecil. Efek suhu terhadap densitas larutan tidak dapat diabaikan, hal ini karena cairan jika dipanaskan akan merenggang sehingga meningkatkan volume larutan namun massa larutan tetap. Berdasarkan grafik formulasi optimal konsentrasi surfaktan dan optimal konsentrasi alkohol, densitas larutan memiliki kecenderungan menurun dengan semakin meningkatnya konsentrasi surfaktan maupun alkohol. Hal ini terjadi karena fluida memiliki peningkatan volume yang lebih besar dibandingkan dengan peningkatan massa. Sedangkan untuk grafik formulasi optimal salinitas dan konsentrasi alkali, densitas larutan memiliki kecenderungan meningkat dengan peningkatan konsentrasi NaCl dan NaOH. Hal ini terjadi karena zat padat memiliki peningkatan massa yang lebih besar dibanding peningkatan volumenya.
Uji Nilai IFT
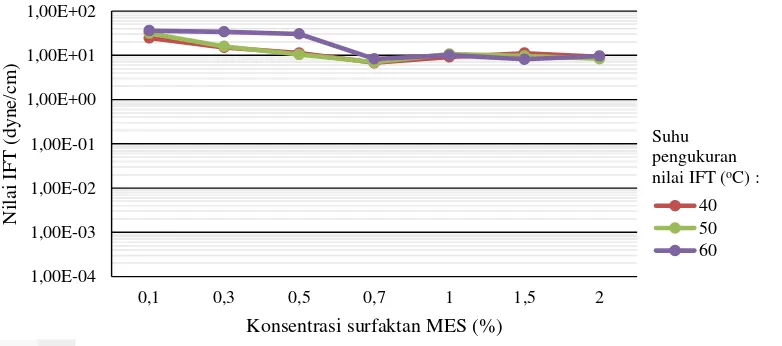
Pengujian nilai IFT menggunakan alat spinning drop tensiometer tipe TX 500 D. Pengujian nilai IFT dilakukan pada 3 suhu yaitu 40, 50 dan 60 oC dengan keceparan putaran 6000 rpm. Hasil pengujian IFT pada tahap optimal konsentrasi surfaktan digambarkan pada Gambar 4.13 untuk media pendispersi air demineral dan Gambar 4.14 untuk media pendispersi air formasi.
Gambar 4.13 Hubungan konsentrasi surfaktan MES dan suhu pengukuran terhadap nilai IFT larutan surfaktan dengan media pendispersi air demineral
Konsentrasi surfaktan yang optimum untuk formula air demineral sebagai media pendispersi adalah 0,7% surfaktan MES namun tidak memenuhi ultralow interfacial tension. Sedangkan konsentrasi surfaktan yang optimum untuk formula air formasi sebagai media pendispersi adalah 0,3% surfaktan MES. Hasil uji nilai IFT untuk media pendispersi air demineral pada suhu 40 oC adalah 6,75 x 100 dyne/cm, pada suhu 50 oC adalah 1,12 x 101 dyne/cm dan pada suhu 60 oC adalah
Gambar 4.14 Hubungan konsentrasi surfaktan MES dan suhu pengukuran terhadap nilai IFT larutan surfaktan dengan media pendispersi air formasi
Perbedaan hasil uji nilai IFT pada sampel larutan surfaktan dengan media pendispersi air demineral dan air formasi disebabkan karena perbedaan salinitas air dimana salinitas air formasi mencapai 5795 ppm sedangkan salinitas air demineral 0 ppm. Nilai minimum IFT terjadi pada kondisi salinitas optimum dan pada kondisi ini emulsi yang terbentuk bisa mencapai fasa III. Cayias et al. (1977), menjelaskan bahwa IFT menurun seiring bertambahnya konsentrasi surfaktan. Penurunan sampai pada sebuah nilai konsentrasi tertentu, nilai tegangan antarmuka akan mencapai nilai minimum. Ketika konsentrasi terus ditingkatkan hingga melebihi nilai konsentrasi kritis ini, nilai tegangan antarmuka justru meningkat. Hal ini seperti yang terlihat pada Gambar 4.13 dan 4.14.
Menurut Ajith et al. (1994) dan Sampath (1998), larutan garam (air formasi) berfungsi sebagai larutan elektrolit. Keberadaan elektrolit dalam sistem yang mengandung surfaktan akan mengurangi interaksi surfaktan-air. Gugus lipofilik surfaktan ionik akan berikatan sebagian atau seluruhnya dengan elektrolit, sehingga masing-masing molekul akan berikatan dengan molekul yang sesuai. Bila surfaktan anionik yang digunakan, maka muatan negatif pada gugus aktif (lipofilik) akan berinteraksi positif dengan muatan positif pada molekul garam, misalnya molekul Na+ pada larutan NaCl. Lain halnya dengan air demineral dimana didalamnya tidak terdapat larutan garam/elektrolit sehingga interaksi antara surfaktan air lebih besar dibandingkan dengan minyak.
Hasil pengujian nilai IFT menghasilkan gambaran respon minyak yang berbeda antara media pendispersi air formasi dan air demineral. Pada sampel dengan media pendispersi air formasi, contoh minyak dari lapangan sandstone yang digunakan akan berpilin memanjang selama pengujian nilai IFT sedangkan pada sampel dengan media pendispersi air demineral, minyak yang digunakan tetap berbentuk bulat selama pengujian nilai IFT. Hal ini menunjukkan minyak tidak dapat bercampur meskipun sudah ditambahkan surfaktan didalamnya karena tidak ada kandungan garam didalamnya.
Gaya tolak antar head group molekul surfaktan yang terjadi dalam larutan merupakan salah satu faktor yang paling berpengaruh terhadap self assembly
molekul-molekul surfaktan untuk membentuk misel. Pada larutan surfaktan