HIDROLISIS RUMPUT LAUT
Ulva lactuca
MENGGUNAKAN
KAPANG LAUT EN
RYANA TAMMI PUTRI
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Hidrolisis Rumput Laut
Ulva lactuca Menggunakan Kapang Laut EN adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Maret 2016
Ryana Tammi Putri
NIM C34110001
ABSTRAK
RYANA TAMMI PUTRI. Hidrolisis Rumput Laut Ulva lactuca Menggunakan Kapang Laut EN. Dibimbing oleh LINAWATI HARDJITO.
Ulva lactuca merupakan golongan rumput laut hijau yang tersebar di berbagai perairan dangkal di Indonesia, terutama di daerah pantai Sulawesi, Lombok, Banda, Solor, Sumba, Jawa Barat, dan juga Lampung Selatan yang pada umumnya dimanfaatkan sebagai bahan atau produk pangan dan juga sebagai biofilter. Ulva lactuca memiliki protein yang tinggi (10-25% dari bobot kering). Proses hidrolisis pada protein yang terdapat di dalam Ulva lactuca dilakukan untuk meningkatkan availabilitas asam amino sehingga dapat dimanfaatkan oleh tubuh dengan lebih efektif. Kapang EN digunakan sebagai agen penghidrolisis pada penelitian ini. Proses hidrolisis dilakukan selama 2 hari dengan pengadukan menggunakan magnetik stirer pada suhu ruang. Parameter yang diamati selama proses hidrolisis berlangsung adalah kadar asam amino, nilai pH, dan kandungan polisakarida. Kadar asam amino ditentukan menggunakan uji Ninhidrin dan diukur menggunakan spektrofotometer pada gelombang 570 nm. Kadar asam amino tertinggi dihasilkan pada jam ke-12 yaitu dengan nilai absorbansi sebesar ±0,8840. Nilai pH diukur menggunakan kertas indikator pH dan memiliki nilai antara 5-6. Kadar polisakarida diuji menggunakan presipitasi dengan isopropil alkohol kemudian dihasilkan kadar tertinggi pada jam ke-12 yaitu sebesar ±27,5 mg/mL. Kandungan asam asmino yang terdapat di dalam hasil hidrolisis dianalisis dengan UPLC. Asam amino yang memiliki nilai tinggi pada hidrolisat Ulva lactuca adalah serin, asam glutamat, dan glisin yaitu sebesar 366,66 mg/kg, 289,91 mg/kg, dan 261,37 mg/kg. Hidrolisis
Ulva lactuca berdasarkan hasil analisis fitokimia memiliki kandungan triterpenoid dan saponin.
Kata kunci: asam amino, hidrolisis, kapang EN, ulvan
ABSTRACT
RYANA TAMMI PUTRI. The Hydrolysis of Green Alga Ulva lactuca Using EN Marine Fungi. Supervised by LINAWATI HARDJITO.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
HIDROLISIS RUMPUT LAUT
Ulva lactuca
MENGGUNAKAN
KAPANG LAUT EN
RYANA TAMMI PUTRI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada
Departemen Teknologi Hasil Perairan
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
Judul Skripsi : Hidrolisis Rumput Laut Ulva lactuca Menggunakan Kapang Laut EN
Nama : Ryana Tammi Putri NIM : C34110001
Program Studi : Teknologi Hasil Perairan
Disetujui oleh
Prof Dr Ir Linawati Hardjito, MS Pembimbing
Diketahui oleh
Prof Dr Ir Joko Santoso, MSi Ketua Departemen
KATA PENGANTAR
Puji syukur penulis panjatkan ke hadirat Allah SWT atas limpahan rahmat dan hidayah-Nya sehingga penulis dapat menyelesaikan skripsi dengan judul “Hidrolisis Rumput Laut Ulva lactuca Menggunakan Kapang Laut EN” tepat pada waktunya. Skripsi ini disusun sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Penulis mengucapkan terima kasih kepada semua pihak yang telah membantu dalam penulisan skripsi ini:
1 Prof Dr Ir Linawati Hardjito, MS selaku dosen pembimbing, atas segala bimbingan, motivasi, dan pengarahan yang telah diberikan kepada penulis selama proses penelitian dan penyusunan skripsi.
2 Prof Dr Ir Joko Santoso, MSi, selaku dosen penguji dan Ketua Departemen Teknologi hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
3 Dr Ir Iriani Setyaningsih, MS, selaku Ketua Komisi Pendidikan Departemen Teknologi Hasil Perairan.
4 Dr Desniar, SPi, MSi, selaku perwakilan Komisi Pendidikan Gugus Kendali Mutu Departemen Teknologi Hasil Perairan.
5 Lina Yustikaningsih, Sara Christine Widowati, Krisye M Saogo, dan Christina Sonya Aleyda, dan segenap mahasiswa THP angkatan 48.
6 Semua pihak yg telah membantu proses penelitian dan penyusunan skripsi ini. Penulis menyadari bahwa masih terdapat kekurangan dalam penulisan skripsi ini, sehingga penulis mengharapkan masukan, kritik dan saran agar dapat digunakan sebagai bahan perbaikan.
Bogor, Maret 2016
DAFTAR ISI
DAFTAR TABEL ... xvi
DAFTAR GAMBAR ... xvi
DAFTAR LAMPIRAN ... xvi
PENDAHULUAN Latar Belakang ... 1
Tujuan ... 2
Manfaat Penelitian ... 2
Ruang Lingkup Penelitian ... 2
METODE PENELITIAN Waktu dan Tempat Penelitian ... 2
Bahan Penelitian ... 2
Peralatan Penelitian ... 3
Prosedur Penelitian ... 3
Prosedur Analisis ... 4
Analisis Data ... 7
HASIL DAN PEMBAHASAN Hidrolisat Ulva lactuca ... 8
Nilai pH ... 9
Kadar Polisakarida ... 10
Kandungan Asam Amino ... 12
Kandungan Fitokimia ... 15
KESIMPULAN DAN SARAN ... 16
UCAPAN TERIMA KASIH ... 17
DAFTAR PUSTAKA ... 17
DAFTAR TABEL
1 Perbandingan kandungan asam amino pada hidrolisat Ulva lactuca dengan hidrolisat Ulva lactuca yang berasal dari Kumar dan
Khaladaran (2007) ... 12
2 Efek terapeutik dari beberapa asam amino esensial dan nonesensial... 14
3 Kandungan fitokimia pada hidrolisat Ulva lactuca ... 15
DAFTAR GAMBAR
1 Diagram alir pembuatan inokulum ... 42 Diagram alir hidrolisis Ulva lactuca ... 5
3 Nilai OD570nm hasil hidrolisis Ulva lactuca selama 48 jam ... 8
4 Nilai pH selama proses hidrolisis ... 9
5 Rendemen Polisakarda ... 10
6 Asam Ulvanobioronic ... 11
DAFTAR LAMPIRAN
1 Nilai OD570nm hasil hidrolisis Ulva lactuca selama 48 jam ... 232 Nilai pH selama proses hidrolisis ... 23
3 Rendemen Polisakarda ... 23
1
PENDAHULUAN
Latar Belakang
Rumput laut merupakan salah satu sumber devisa negara, sumber pendapatan bagi masyarakat pesisir, serta merupakan komoditas laut yang sangat populer dalam perdagangan dunia. Hal ini disebabkan oleh pemanfaatannya yang demikian luas dalam kehidupan sehari-hari, baik sebagai sumber pangan, obat-obatan, kosmetik, dan bahan baku industri (Kordi dan Gufran 2010). Rumput laut yang digunakan dalam penelitian ini adalah Ulva lactuca. Rumput laut ini merupakan tanaman makroalga dari divisi Chlorophyta. Rumput laut ini memiliki bentuk hampir menyerupai tumbuhan tingkat tinggi, warnanya hijau, karena memiliki pigmen klorofil dan dapat berfotosintesis, helaian dan tepinya memiliki bentuk bergelombang. Ulva lactuca memiliki habitat di daerah pantai, air laut, dan karang (SIA 2014).
Ulva sp. oleh para ahli dianggap sebagai sumber makanan yang sehat bagi manusia karena mengandung serat yang dapat membantu memperlancar pencernaan. Ulva sp. yang telah dikeringkan mengandung nutrisi yaitu 18,7% air, 14,9% protein, 0,04% lemak, 50,6% karbohidrat, dan 0,2% serat. Vitamin dan mineral yang terdapat dalamnya antara lain vitamin A, vitamin B1, vitamin C, serta iodin (sebesar 31 mg/kg). Ulva sp.tersebar di berbagai wilayah perairan dangkal di seluruh Indonesia, terutama di daerah pantai Sulawesi, Lombok, Banda, Solor, Sumba, Jawa Barat, Lampung Selatan (Anggadiredja et al. 2008).
Ulva sp. pada umumnya dimanfaatkan sebagai bahan atau produk pangan dan juga sebagai biofilter (Silva et al. 2013). Pemanfaatan Ulva lactuca di Indonesia adalah sebagai salad, sayur, antipiretik, obat bisul, obat penyakit kantong kemih dan obat mimisan (Anggadiredja et al. 2008). Ulva lactuca memiliki protein yang tinggi (10-25% dari bobot kering) (Silva et al. 2013) sehingga cocok digunakan sebagai bahan baku hidrolisat protein.
Hidrolisat protein merupakan protein yang mengalami degradasi hidrolitik dengan asam, basa, atau enzim proteolitik yang hasilnya berupa asam amino dan peptida. Hidrolisat protein memiliki beberapa kegunaan pada industri pangan maupun farmasi. Beberapa penelitian menunjukkan bahwa hidrolisat protein ikan digunakan sebagai bahan makanan tambahan dalam sup, kuah daging, penyedap sosis, biskuit, dan crackers. Selain itu hidrolisat protein juga dapat disertakan untuk diet pada penderita gangguan pencernaan (Imandira 2012).
Metode hidrolisis telah banyak digunakan dalam pengolahan rumput laut. Pengolahan rumput laut Ulva lactuca menggunakan metode hidrolisis juga telah dilakukan, akan tetapi metode tersebut baru diaplikasikan dalam pembuatan bioetanol melalui hidrolisis polisakarida enzimatis (Trivedi et al. 2013) dan fermentasi menggunakan Saccharomyces cerevisiae (Poespowati et al. 2014).
2
Tujuan Penelitian
Penelitian ini bertujuan untuk mendapatkan hidrolisat rumput laut Ulva lactuca menggunakan kapang laut EN, menentukan kadar asam amino total, perubahan pH, rendemen polisakarida, profil asam amino dan kelompok senyawa kimia yang terdapat pada hidrolisat.
Manfaat Penelitian
Penelitian ini diharapkan dapat memberikan informasi mengenai metode hidrolisis, waktu optimum hidrolisis asam amino, dan komponen bioaktif yang terdapat pada Ulva lactuca.
Ruang Lingkup Penelitian
Ruang lingkup penelitian ini adalah hidrolisis rumput laut Ulva lactuca
menggunakan kapang EN. Pengamatan perubahan yang terjadi pada parameter pH, asam amino, dan polisakarida. Pengamatan waktu yang paling optimum untuk hidrolisis asam amino. Analisis jenis asam amino yang terdapat di dalam hidrolisat menggunakan UPLC. Analisis Fitokimia pada hidrolisat (Alkaloid, Saponin, Flavonoid, Tanin, Fenol, Terpenoid, dan Steroid).
METODE PENELITIAN
Waktu dan Tempat Penelitian
Penelitian ini telah dilaksanakan pada bulan September 2014 hingga November 2015. Hidrolisis Ulva lactuca, pengukuran nilai pH, analisis polisakarida dilakukan di Laboratorium Bioteknologi Hasil Perairan, Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan. Analisis fitokimia dilakukan di Laboratorium Kimia Analitik, Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor. Analisis profil asam amino dilakukan di Laboratorium Saraswati, PT Saraswati Indo Genetech.
Bahan Penelitian
3
Mayer, Wagner, Dragendroff, magnesium, alkohol klorhidrat, amil alkohol, FeCl3,
etanol, eter, anhidrida asam asetat, dan H2SO4 pekat.
Peralatan Penelitian
Peralatan yang digunakan untuk hidrolisis Ulva lactuca antara lain, neraca analitik (Sartorius TE 214S; German), Erlenmeyer, magnetic stirrer (Jenwey 1200; German), sentrifuse (Sorvall; US), tabung reaksi, mikro pipet, vortex dan spektrofotometer (UV-VIS Jenwey 2030; German). Alat yang digunakan dalam analisis fitokimia antara lain tabung reaksi, batang pengaduk, timbangan, lempeng tetes, pipet tetes, pinggan porselen, dan beaker glass.
Prosedur Penelitian
Penelitian ini dilaksanakan dalam dua tahap, yaitu pembuatan inokulum dan pembuatan hidrolisat Ulva lactuca kemudian dilakukan uji pada hidrolisat hasil sentrifugasi yaitu dengan pengukuran OD570nm, pengukuran pH, analisis
polisakarida, analisis profil asam amino, dan kandungan fitokimia.
Pembuatan Inokulum (Modifikasi Obata et al. 2015)
Isolat yang digunakan untuk pembuatan inokulum adalah isolat koleksi dari Kustiariyah Tarman (Andhikawati et al. 2014) dengan kode (EN) yang disimpan dalam media cair (akuades) dengan substrat rumput laut Sargassum sp. Aklimatisasi dilakukan pada kapang EN dengan substrat baru berupa rumput laut
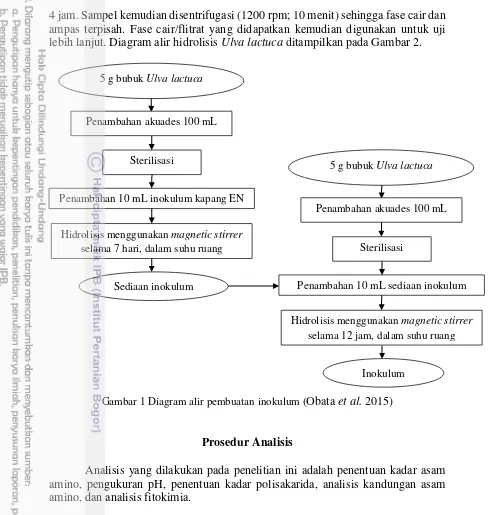
Ulva lactuca. Aklimatisasi dilakukan dengan cara Ulva lactuca sebanyak 5 g dilarutkan ke dalam akuades sebanyak 100 mL di dalam Erlenmeyer yang berukuran 250 mL. Kemudian dilakukan sterilisasi menggunakan autoclave, setelah itu sampel didinginkan di suhu ruang. Isolat kapang yang telah disiapkan kemudian diinokulasi ke dalam sampel sebanyak 10 mL. Proses aklimatisasi dilakukan dengan bantuan magnetic stirer yang berlangsung selama 7 hari pada suhu ruang. Penyegaran inokulum dilakukan dengan cara Ulva lactuca sebanyak 5 g dilarutkan ke dalam akuades sebanyak 100 mL di dalam Erlenmeyer yang berukuran 250 mL. Kemudian dilakukan sterilisasi menggunakan autoclave, setelah itu sampel didinginkan di suhu ruang. Kapang yang telah disiapkan kemudian diinokulasi ke dalam sampel sebanyak 10 mL. Proses hidrolisis dilakukan dengan bantuan magnetic stirer yang berlangsung selama 12 jam pada suhu ruang. Diagram alir pembuatan inokulum ditampilkan pada Gambar 1.
Hidrolisis Ulva (Modifikasi Obata et al. 2015)
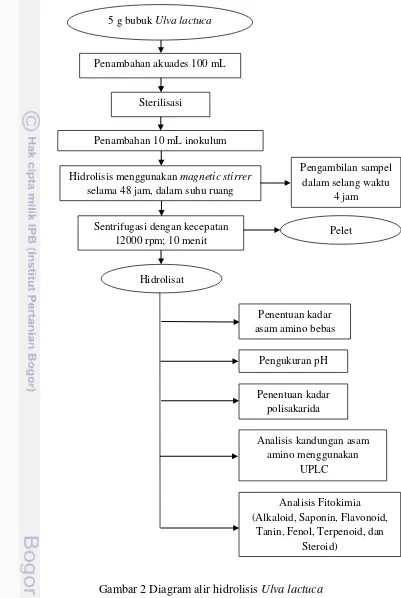
Hidrolisis Ulva lactuca dilakukan menggunakan kapang EN. Ulva lactuca
4
4 jam. Sampel kemudian disentrifugasi (1200 rpm; 10 menit) sehingga fase cair dan ampas terpisah. Fase cair/flitrat yang didapatkan kemudian digunakan untuk uji lebih lanjut. Diagram alir hidrolisis Ulva lactuca ditampilkan pada Gambar 2.
Gambar 1 Diagram alir pembuatan inokulum (Obata et al. 2015)
Prosedur Analisis
Analisis yang dilakukan pada penelitian ini adalah penentuan kadar asam amino, pengukuran pH, penentuan kadar polisakarida, analisis kandungan asam amino, dan analisis fitokimia.
Penentuan Kadar Asam Amino Total Menggunakan Uji Ninhidrin (Bintang 2010)
Analisis kadar asam amino dilakukan menggunakan pereaksi ninhidrin dan diukur menggunakan spektrofotometer. Filtrat sebanyak 2 mL dimasukkan ke dalam tabung reaksi kemudian dilanjutkan dengan meneteskan 0,5 ml larutan ninhidrin 0,1% dan dipanaskan menggunakan penangas air pada suhu 80-90 °C selama 20 menit. Warna biru violet yang terbentuk menunjukan hasil positif adanya asam amino bebas. Peningkatan kadar asam amino bebas sejalan dengan peningkatan intensitas warna biru violet. Pengukuran tingkat kepekatan warna biru violet pada sampel dilakukan menggunakan spektrofotometer pada gelombang
5 g bubuk Ulva lactuca
Penambahan akuades 100 mL
Penambahan 10 mL inokulum kapang EN Sterilisasi
Hidrolisis menggunakan magnetic stirrer
selama 7 hari, dalam suhu ruang
Sediaan inokulum
5 g bubuk Ulva lactuca
Penambahan akuades 100 mL
Penambahan 10 mL sediaan inokulum Sterilisasi
Hidrolisis menggunakan magnetic stirrer
selama 12 jam, dalam suhu ruang
5
570 nm. Analisis asam amino total dilakukan dalam rentang waktu 4 jam dengan 2 kali ulangan.
Gambar 2 Diagram alir hidrolisis Ulva lactuca
5 g bubuk Ulva lactuca
Penambahan akuades 100 mL
Penambahan 10 mL inokulum Sterilisasi
Hidrolisis menggunakan magnetic stirrer
selama 48 jam, dalam suhu ruang
Hidrolisat
Penentuan kadar asam amino bebas
Pengukuran pH
Penentuan kadar polisakarida
Analisis kandungan asam amino menggunakan
UPLC
Analisis Fitokimia (Alkaloid, Saponin, Flavonoid,
Tanin, Fenol, Terpenoid, dan Steroid)
Pelet
Pengambilan sampel dalam selang waktu
4 jam
6
Pengukuran pH
Pengukuran pH dilakukan untuk mengetahui perubahan pH pada saat proses hidrolisis terjadi. Besarnya nilai pH diukur menggunakan kertas indikator pH. Pengukuran pH dilakukan dalam rentang waktu 12 jam dengan 2 kali ulangan.
Penentuan Kadar Polisakarida (Modifikasi Mathur 2012)
Analisis polisakarida dilakukan untuk mengetahui jumlah polisakarida yang terdapat dalam sampel. Sampel sebanyak 1 mL ditambahkan dengan 1 mL isopropil alkohol (IPA). Polisakarida kemudian akan membentuk endapan berwarna putih dan diendapan selama 15 menit, kemudian sampel disaring dan residu sampel dikeringkan menggunakan oven selama 4 jam pada suhu 50 °C. Sampel yang telah kering dimasukkan ke dalam desikartor selama 15 menit kemudian ditimbang. Analisis polisakarida dilakukan dalam rentang waktu 12 jam dengan 2 kali ulangan.
Analisis Kandungan Asam Amino Bebas (Modifikasi Nollet 1996)
Kandungan asam amino bebas ditentukan menggunakan UPLC (Ultra Performance Liquid Chromatography). Pembuatan larutan sampel dilakukan dengan cara sampel yang telah dihidrolisis menggunakan kapang EN disaring menggunakan filter 0,45 µm. Filtrat sebanyak 500 µL ditambah dengan (α -aminobutyric acid) AABA sebanyak 40 µL dan akuabides sebanyak 460 µL, kemudian dihomogenkan. Larutan sebanyak 10 µL dipipet kemudian ditambakan dengan 70 µL larutan bufer (0,2 M bufer borate) kemudian di-vortex. Reagen
AccQ-Fluor Borate sebanyak 20 µL ditambah ke dalam larutan tersebut kemudian di-vortex dan didiamkan selama 1 menit. Larutan sampel kemudian diinkubasi selama 10 menit pada suhu 55 °C, kemudian disuntikkan ke dalam UPLC. Pembuatan larutan standar dilakukan dengan cara pemipetan standar asam amino sebanyak 40 µL dan ditambahkan dengan 40 µL internal standar AABA dan 920 µL akuabides, kemudian dihomogenkan. Larutan standar sebanyak 10 µL ditambahkan dengan 70 µL larutan bufer (0,2 M bufer borate) kemudian di-vortex.
Reagen AccQ-Fluor Borate sebanyak 20 µL ditambah ke dalam larutan tersebut
Detektor = PDA, panjang gelombang 260 nm Volume penyuntikan = 1 µL
Kandungan asam amino kemudian dihitung dengan rumus:
Asam amino (mg/kg) =
7
Keterangan :
Rasio = Luas area analit/ luas area AABA C = Konsentrasi
BM = Berat molekul masing-masing asam amino Fp = volume 1 (µL)/ pemipetan (µL) x volume 2 (µL)
Analisis Fitokimia (Harborne 1997)
Uji alkaloid
Uji alkaloid dilakukan dengan cara, sebanyak 2 mL filtrat ditambahkan 3 tetes H2SO4 2N lalu dikocok kemudian diuji menggunakan reagen Mayer, Wagner,
dan Dragendroff. Hasil positif dari uji alkaoid dengan ketiga reagen ialah terbentuknya endapan berturut-turut berwarna coklat, putih, dan merah-jingga. Uji saponin
Uji saponin dilakukan dengan cara, sebanyak 10 mL filtrat dimasukkan ke dalam tabung reaksi dan dikocok kuat selama 10 detik, setelah itu larutan didiamkan selama 10 menit. Hasil positif uji saponin adalah dengan terbentuknya buih yang stabil pada larutan.
Uji flavonoid
Uji flavonoid dilakukan dengan cara, sebanyak 10 mL filtrat ditambahkan 0,5 g magnesium, 2 mL alkohol klorhidrat (HCl 37% dan etanol 95% dengan volume yang sama), dan 20 mL amil alkohol kemudian dikocok kuat. Hasil positif uji flavonoid ditunjukkan dengan perubahan warna menjadi merah, kuning, atau jingga pada lapisan amil alkohol.
Uji tanin dan fenol
Uji tanin dan fenol dilakukan dengan cara, sebanyak 2 mL filtrat ditambahkan 1 tetes larutan FeCl3 1%. Hasil positif tanin menunjukkan perubahan
warna menjadi hitam kehijauan, sedangkan hasil positif fenol ditunjukkan dengan timbulnya warna ungu, biru, atau hijau.
Uji terpenoid dan steroid
Uji terpenoid dan steroid dilakukan dengan cara, sebanyak 2 mL filtrat ditambahkan 3 tetes anhidrida asam asetat dan 1 tetes H2SO4 pekat (Uji
Lieberman-Buchard). Hasil positif uji terpenoid ditunjukkan dengan adanya perubahan warna menjadi merah sementara hasil positif uji steroid ditunjukkan dengan perubahan warna menjadi hijau atau biru.
Analisis Data
8
HASIL DAN PEMBAHASAN
Hidrolisis merupakan reaksi kimia yang memerlukan H2O (air) dalam
membentuk suatu senyawa baru atau lebih. Contoh dari hidrolisis adalah hidrolisis pati menjadi glukosa, sukrosa menjadi glukosa dan fruktosa, gliserida menjadi asam lemak dan gliserol, protein menjadi asam amino (Boundless 2015). Hidrolisis yang dilakukan pada penelitian ini mengutamakan pembentukan produk hidrolisat asam amino dari hidrolisis protein yang terdapat pada Ulva lactuca.
Hidrolisat Ulva lactuca
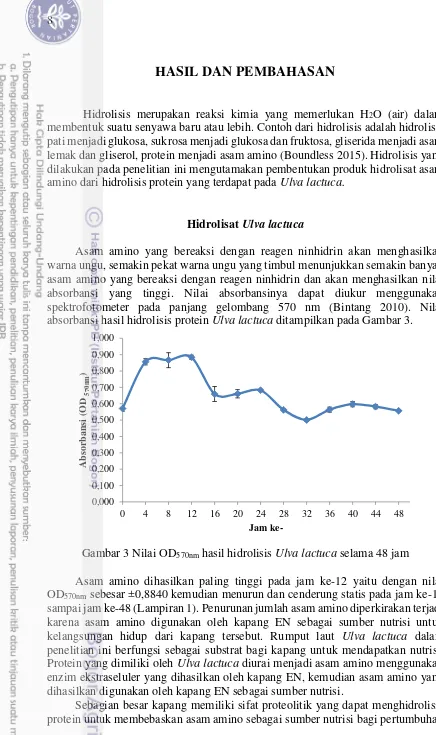
Asam amino yang bereaksi dengan reagen ninhidrin akan menghasilkan warna ungu, semakin pekat warna ungu yang timbul menunjukkan semakin banyak asam amino yang bereaksi dengan reagen ninhidrin dan akan menghasilkan nilai absorbansi yang tinggi. Nilai absorbansinya dapat diukur menggunakan spektrofotometer pada panjang gelombang 570 nm (Bintang 2010). Nilai absorbansi hasil hidrolisis protein Ulva lactuca ditampilkan pada Gambar 3.
Gambar 3 Nilai OD570nm hasil hidrolisis Ulva lactuca selama 48 jam
Asam amino dihasilkan paling tinggi pada jam ke-12 yaitu dengan nilai OD570nm sebesar ±0,8840 kemudian menurun dan cenderung statis pada jam ke-16
sampai jam ke-48 (Lampiran 1). Penurunan jumlah asam amino diperkirakan terjadi karena asam amino digunakan oleh kapang EN sebagai sumber nutrisi untuk kelangsungan hidup dari kapang tersebut. Rumput laut Ulva lactuca dalam penelitian ini berfungsi sebagai substrat bagi kapang untuk mendapatkan nutrisi. Protein yang dimiliki oleh Ulva lactuca diurai menjadi asam amino menggunakan enzim ekstraseluler yang dihasilkan oleh kapang EN, kemudian asam amino yang dihasilkan digunakan oleh kapang EN sebagai sumber nutrisi.
Sebagian besar kapang memiliki sifat proteolitik yang dapat menghidrolisis protein untuk membebaskan asam amino sebagai sumber nutrisi bagi pertumbuhan
9
kapang sehingga sebagian besar kapang dapat memanfaatkan asam amino, amina, dan amida sebagai sumber nitrogen (Kavanagh 2011). Read dan Abuzinadah (2015) juga menyatakan bahwa asam amino dapat digunakan sebagai sumber nitrogen dalam pertumbuhan kapang.
Penambahan sumber nitrogen lain perlu dilakukan agar asam amino yang dihasilkan selama proses hidrolisis tidak dimanfaatkan oleh kapang sebagai sumber nitrogen. Osorno dan Osorio (2014) menyatakan bahwa penambahan sumber nitrogen pada kapang dapat dilakukan dengan penambahan NH4Cl, NH4NO3, atau
KNO3 pada media pertumbuhan kapang.
Metode lain juga dapat diaplikasikan sehingga asam amino yang ada di dalam hidrolisat Ulva lactuca tidak dimanfaatkan oleh kapang sebagai nutrisi atau sumber nitrogen. Metode yang berpotensi untuk diaplikasikan pada hidrolisis Ulva lactuca
ini adalah metode hidrolisis asam yang telah dilakukan oleh Yaich et al. (2011; 2015) dan hidrolisis enzimatis menggunakan enzim bromelin yang telah dilakukan oleh Laohakunjit et al. (2014), akan tetapi metode tersebut masih perlu diteliti lebih lanjut, karena diperlukan penyesuaian pada tingkat konsentrasi asam dan substrat yang digunakan.
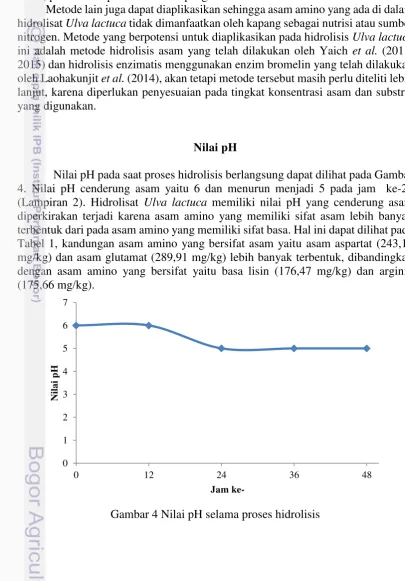
Nilai pH
Nilai pH pada saat proses hidrolisis berlangsung dapat dilihat pada Gambar 4. Nilai pH cenderung asam yaitu 6 dan menurun menjadi 5 pada jam ke-24 (Lampiran 2). Hidrolisat Ulva lactuca memiliki nilai pH yang cenderung asam diperkirakan terjadi karena asam amino yang memiliki sifat asam lebih banyak terbentuk dari pada asam amino yang memiliki sifat basa. Hal ini dapat dilihat pada Tabel 1, kandungan asam amino yang bersifat asam yaitu asam aspartat (243,10 mg/kg) dan asam glutamat (289,91 mg/kg) lebih banyak terbentuk, dibandingkan dengan asam amino yang bersifat yaitu basa lisin (176,47 mg/kg) dan arginin (175,66 mg/kg).
Gambar 4 Nilai pH selama proses hidrolisis
10
Perubahan pH pada proses hidrolisis dapat terjadi seiring dengan perubahan protein menjadi asam amino. Asam amino memiliki gugus aktif amina (-NH2) dan
karboksil (-COOH), sehingga memiliki sifat asam sekaligus basa (pH alaminya ditentukan oleh gugus-R yang dimiliki). Asam amino yang memiliki sifat netral adalah alanin, valin, serin, treonin. Asam amino yang bersifat asam adalah asam aspartat dan asam glutamat. Asam amino yang bersifat basa adalah lisin dan arginin (Sumardjo 2009). Ulva lactuca selain memiliki protein yang tinggi juga kaya akan polisakarida ulvan yang merupakan polisakarida bercabang dan bersifat asam dengan struktur utama terdiri dari gula L-ramnosa dan asam glukuronat (Kim 2013). Sifat asam dari polisakarida ini yang juga menyebabkan hidrolisat memiliki pH asam.
Kadar Polisakarida
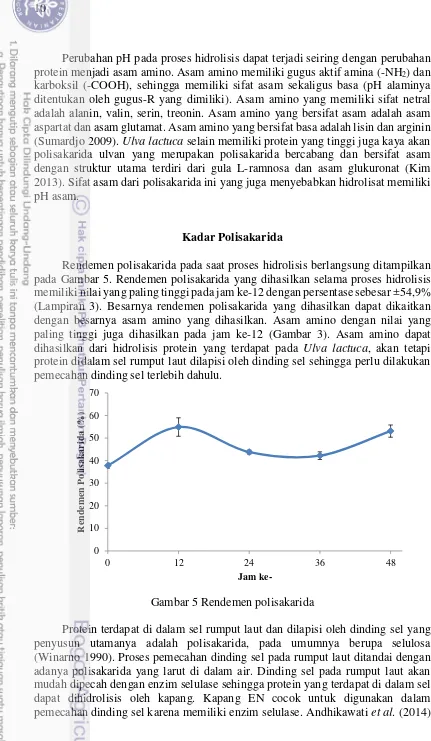
Rendemen polisakarida pada saat proses hidrolisis berlangsung ditampilkan pada Gambar 5. Rendemen polisakarida yang dihasilkan selama proses hidrolisis memiliki nilai yang paling tinggi pada jam ke-12 dengan persentase sebesar ±54,9% (Lampiran 3). Besarnya rendemen polisakarida yang dihasilkan dapat dikaitkan dengan besarnya asam amino yang dihasilkan. Asam amino dengan nilai yang paling tinggi juga dihasilkan pada jam ke-12 (Gambar 3). Asam amino dapat dihasilkan dari hidrolisis protein yang terdapat pada Ulva lactuca, akan tetapi protein didalam sel rumput laut dilapisi oleh dinding sel sehingga perlu dilakukan pemecahan dinding sel terlebih dahulu.
Gambar 5 Rendemen polisakarida
Protein terdapat di dalam sel rumput laut dan dilapisi oleh dinding sel yang penyusun utamanya adalah polisakarida, pada umumnya berupa selulosa (Winarno 1990). Proses pemecahan dinding sel pada rumput laut ditandai dengan adanya polisakarida yang larut di dalam air. Dinding sel pada rumput laut akan mudah dipecah dengan enzim selulase sehingga protein yang terdapat di dalam sel dapat dihidrolisis oleh kapang. Kapang EN cocok untuk digunakan dalam pemecahan dinding sel karena memiliki enzim selulase. Andhikawati et al. (2014)
11
menyatakan bahwa kapang EN memiliki indeks selulotik yang tertinggi dengan nilai 1,36 dibandingkan dengan isolat kapang yang diisolasi dari rumput laut, daun mangrove, lamun, dan spons.
Polisakarida pada Ulva sp. umumnya dalam bentuk dinding sel yang merepresentasikan 38-54% dari berat kering, termasuk di dalamnya adalah ulvan larut air, selulosa tidak larut air, linear xyloglucan larut basa, dan glucuronan tidak larut air. Ekstraksi ulvan dapat dilakukan menggunakan larutan air yang mengandung kation divalen salah satu contohnya adalah ammonium oksalat, pada suhu 80-90 °C. Rendemen yang dihasilkan berkisar antara 8-29% bergantung kepada prosedur ekstraksi dan purifikasi yang digunakan. Ulva sp. pada umumnya memiliki komposisi berupa ramnosa (16,8-45%), xilosa (2,1-12%), glukosa (0,5-6,4%), asam uronat (6,5-19%), sulfat (16-23,2%), asam iduronat (1,1-9,1%), arabinosa, dan 3-O-metil L-ramnosa. Struktur disakarida yang berulang yang merupakan penyusun utama pada ulvan disebut asam ulvabioronic (Gambar 6). Variasi dari komposisi gula pada ulvan dapat terjadi dikarenakan oleh metode ekstraksi, taksonomi, dan/atau ecophysiological dari tempat asalnya (Lahaye dan Robic 2007; Kim 2013).
[→ 4)–β– D –GlcрA –(1 → 4) –α– L –Rhaр(1→]
Gambar 6 Asam Ulvanobioronic (struktur disakarida yang berulang dan utama pada ulvan) (Lahaye dan Robic 2007)
Kandungan kimia dan sifat fisikokimia yang unik dari ulvan menyebabkan ulvan termasuk ke dalam kandidat polisakarida yang dapat menjadi komponen fungsional dan polimer aktif secara biologis dalam pembuatan bahan pangan/pakan, farmasi, bahan kimia untuk budidaya perairaan dan pertanian. Biomasa dari ulvan dapat digunakan sebagai sumber prekursor gula yang langka untuk sintesis bahan kimia. Kandungan di dalam ulvan yaitu ramnosa dapat digunakan untuk sintesis aroma. Ramnosa juga dapat dimanfaatkan dalam bidang farmasi, karena L-ramnosa merupakan komponen utama dari antigen dari banyak organisme, khususnya lectin
dari mamalia. Ulvan juga potensial sebagai sumber penghasil asam ioduronat yang dibutuhkan dalam sintesis heparin dengan aktivitas antitrombotik (Lahaye dan Robic 2007; Gvista 2012).
12
Kandungan Asam Amino
Hidrolisat Ulva lactuca yang berumur 12 jam dianalisis kandungan asam aminonya menggunakan UPLC. Tabel 1 menampilkan kandungan asam amino yang terdapat pada hidrolisat Ulva lactuca dan kromatogram hasil analisis asam amino dapat dilihat pada Lampiran 4. Total asam amino yang dihasilkan dari proses hidrolisis Ulva lactuca adalah sebesar 2605,23 mg/kg dengan serin, asam glutamat, dan glisin memiliki nilai yang tinggi masing-masing sebesar 366,66 mg/kg, 289,91 mg/kg, dan 261,37 mg/kg, sedangkan tirosin memiliki nilai yang terendah yaitu sebesar 69,24 mg/kg.
Ulva lactuca yang telah dihidrolisis oleh Kumar dan Khaladaran (2007) menggunakan HCl 6N di tabung tertutup selama 24 jam pada suhu 110 °C memiliki kandungan asam amino sebesar 113000 mg/kg dengan kandungan asam amino esensial sebesar 45000 mg/kg. Asam amino pada spesies ini sebagian besar terdiri dari asam asam aspartat, asam glutamat, serin, glisin, arginin, treonin, alanin, dan leusin. Sistein, triptofan, dan metionin memiliki nilai yang rendah yaitu sebesar 1000 mg/kg, 1300 mg/kg, dan 1900 mg/kg. Asam aspartat, asam glutamat, dan treonin memiliki nilai yang tinggi yaitu sebesar 1590 mg/kg, 1400 mg/kg, dan 9900 mg/kg. Asam amino total yang dihasilkan adalah sebesar 113000 mg/kg.
Tabel 1 Perbandingan kandungan asam amino pada hidrolisat Ulva lactuca dengan hidrolisat Ulva lactuca yang berasal dari Kumar dan Khaladaran (2007)
Asam amino Kandungan asam amino (mg/kg)
Kandungan asam amino (mg/kg)*
Asam glutamat 289,91 14000
Fenilalanin 95,62 6000
Asam aspartat 243,10 15900
Lisin 176,47 4600
Keterangan: * Kumar dan Khaladaran (2007)
13
sedangkan proteolisis sebagian menghasilkan peptida, sehingga total asam amino bebas yang dihasilkan dari proteolisis suatu protein yang sama akan berbeda bergantung kepada efektivitas proses proteolisis yang terjadi.
Protein tidak mengeluarkan flavour, oleh karena itu untuk mendapatkan
flavour protein dihidrolisis menjadi asam amino. Asam amino merupakan prekursor senyawa-senyawa flavour yang mudah menguap. Asam amino dapat dikonversi oleh berbagai enzim, seperti deaminase, transaminase (aminotransferase) menjadi senyawa-senyawa seperti α-asam keto yang dikonversi menjadi senyawa aldehida dan selanjutnya dikonversi menjadi alkohol atau asam karboksilat. Banyak senyawa jenis ini menghasilkan aroma yang menyumbang flavor pada produk secara keseluruhan (Antara 2011). Asam amino itu sendiri pada umumnya memiliki rasa yang berbeda. Asam amino memiliki rasa manis, pahit, dan kompleks (gabungan antara manis dan pahit). Asam amino yang memiliki rasa manis adalah L-alanin, asam amino yang memiliki rasa pahit adalah L-triptofan, L-leusin, L-isoleusin, dan asam amino yang memiliki rasa kompleks adalah L-metionin (Akitomi et al. 2013). Asam amino yang memiliki rasa umami adalah asam glutamat dan asam aspartat (Jinab dan Hajeb 2010). Asam glutamat memiliki rasa umami sehingga pada umumnya digunakan sebagai penguat rasa pada produk pangan. Salah satu contoh penguat rasa yang berasal dari produk perikanan adalah kecap ikan. Asam glutamat bebas yang terdapat di dalam produk kecap ikan yang berasal dari Indonesia adalah sebesar 7270 mg/kg (Jinab dan Hajeb 2010). Asam glutamat bebas yang terdapat dalam hidrolisat Ulva lactuca masih jauh lebih kecil dibandingkan dengan asam glutamat bebas yang dihasilkan dari produk kecap ikan yang telah dilaporkan oleh Jinab dan Hajeb (2010) yaitu sebesar 289,91 mg/kg.
Asam amino esensial yang terdapat di dalam hidrolisat ini memiliki potensi untuk pakan ternak, salah satunya dalam pembuatan pakan ikan. Pakan yang diberikan kepada ikan harus memenuhi persyaratan nutrisi seperti energi, protein (asam amino), lemak, vitamin, dan mineral. Pakan yang memiliki kualitas yang tinggi adalah pakan yang mengandung asam amino dalam perbandingan optimal, sesuai dengan kebutuhan sintesis protein ikan. Ikan membutuhkan sepuluh asam amino esensial yang sangat penting peranannnya bagi pertumbuhan. Asam amino tersebut adalah arginin, histidin, leusin, isoleusin, triptofan, lisin, metionin, fenilalanin, treonin, dan valin. Asam amino pada bahan pakan yang paling sulit untuk dilengkapi dalam jumlah seimbang adalah lisin, metionin, sistein dan triptofan. Konsep asam amino pembatas merupakan alasan terjadinya hal ini. Asam amino yang tidak seimbang dalam pakan dapat menyebabkan gangguan dalam pertumbuhan dan nafsu makan ikan (Afrianto dan Liviawaty 2009). Penambahan tepung Ulva lactuca pada pakan ikan lele (Clarias gariepinus) sebanyak 10% lebih baik dibandingkan dengan penambahan tepung Ulva lactuca sebanyak 20-30%.
Penambahan tepung Ulva lactuca dibawah 10% perlu diteliti lebih lanjut agar didapatkan bobot penambahan yang optimum (Warith et al. 2015).
14
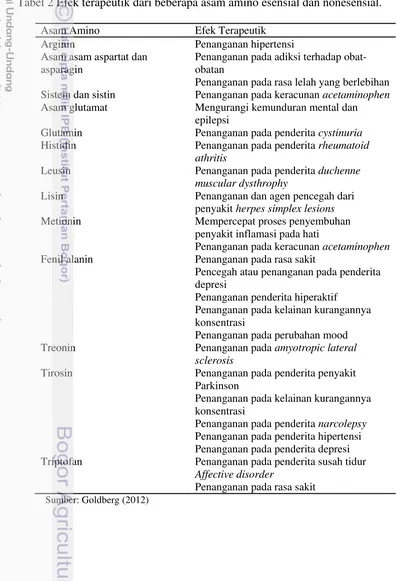
Tubuh yang mengalami stres akan disusul dengan keadaan metabolisme yang abnormal yang dapat menyebabkan peningkatan pemanfaatan asam lemak dan glukosa. Katabolisme rantai cabang asam amino yang berada didalam jaringan tubuh pada kondisi ini akan menggantikan kekurangan dari simpanan asam lemak dan glukosa, khususnya di jaringan otot, dan akan membantu mempertahankan proses metabolisme pada kondisi normal. Asam amino dalam bentuk suplemen terbukti dapat digunakan untuk terapi pada penderita penyakit tertentu, akan tetapi penggunaan suplemen asam amino sebaiknya tetap dilakukan dalam pengawasan dokter (Goldberg 2012). Efek lainnya dari asam amino dapat dilihat pada Tabel 2. Tabel 2 Efek terapeutik dari beberapa asam amino esensial dan nonesensial.
Asam Amino Efek Terapeutik
Penanganan pada rasa lelah yang berlebihan Sistein dan sistin Penanganan pada keracunan acetaminophen
Asam glutamat Mengurangi kemunduran mental dan epilepsi
Glutamin Penanganan pada penderita cystinuria
Histidin Penanganan pada penderita rheumatoid athritis
Leusin Penanganan pada penderita duchenne muscular dysthrophy
Lisin Penanganan dan agen pencegah dari
penyakit herpes simplex lesions
Metionin Mempercepat proses penyembuhan
penyakit inflamasi pada hati
Penanganan pada keracunan acetaminophen
Fenil alanin Penanganan pada rasa sakit
Pencegah atau penanganan pada penderita Treonin Penanganan pada amyotropic lateral
sclerosis
Tirosin Penanganan pada penderita penyakit Parkinson Triptofan Penanganan pada penderita susah tidur
Affective disorder
Penanganan pada rasa sakit
15
Kandungan Fitokimia
Tumbuhan memiliki kandungan fitokimia yang melimpah dan telah dimanfaatkan secara tradisional sebagai obat-obatan herbal. Fitokimia merupakan metabolitme sekunder yang memiliki aktivitas biologis dan disintesis oleh tumbuhan. Fitokimia dapat dibedakan dalam beberapa kelas utama berdasarkan pada struktur kimia, asal tumbuhan, jalaur biosintesis, atau biological properties
yang dimiliki oleh tumbuhan. Pembagian fitokimia yang paling umum adalah berdasarkan pada struktur kimia yang dimiliki yaitu alkaloid, saponin, terpenoid, fenol, dan lainnya (Patra 2012).
Kandungan fitokimia yang dianalisis dari hasil hidrolisat Ulva lactuca
adalah alkaloid, flavonoid, fenol, steroid, triterpenoid, tanin, dan saponin. Hasil analisis kandungan fitokimia ditampilkan pada Tabel 3. Hasil hidrolisis Ulva lactuca berdasarkan hasil analisis fitokimia memiliki kandungan triterpenoid dan saponin. Triterpenoid adalah senyawa yang memiliki kerangka karbon yang berasal dari enam satuan isoprena yang secara biosintesis diturunkan dari senyawa hidrokarbon C-30 asiklik (skualena), senyawa ini memiliki ciri umum tidak berwarna, berbentuk kristal, bersifat optis aktif, dan memiliki titik leleh tinggi. Senyawa tirtepenoid dapat dibagi menjadi empat golongan, yaitu: triterpen yang sebenarnya, saponin, steroid, dan glikosida. Saponin adalah senyawa glikosida triterpenoida atau glikosida steroida yang merupakan senyawa aktif permukaan dan memiliki sifat seperti sabun. Saponin dapat dideteksi berdasarkan kemampuan suatu zat dalam membentuk busa dan menghemolisa sel darah merah. Triterpenoid dan saponin juga memiliki ciri lainnya yaitu rasa pahit (Harborne 1997). Ghareeb
et al. (2014) melakukan ekstraksi pada Ulva lactuca menggunakan metode ekstraksi bertingkat dengan larutan metanol dan etanol. Uji fitokimia dilakukan pada ekstrak tersebut. Ekstrak tersebut mengandung komponen alkaloid, flavonoid, dan saponin masing-masing sebesar 79,58; 2,36; dan 0,03 mg/100 g dan konsentrasi dari total fenol sebesar 14,22 mg/100g. Ekstrak tersebut juga memperlihatkan aktivitas antioksidan yang tinggi dan aktivitas antikoagulan.
Tabel 3 Kandungan fitokimia pada hidrolisat Ulva lactuca
Fitokimia Hasil Pembanding*
Alkaloid - +
Flavonoid - +
Fenol - +
Steroid - (tidak dianalisis)
Triterpenoid + +
Tanin - -
Saponin + +
Keterangan: * Ghareeb et al. (2014)
(+/-) menunjukkan ada tidaknya senyawa fitokimia
16
terjadi karena kelarutan sebagian besar disebabkan oleh polaritas atau momen dipol dari pelarut, namun pertimbangan tentang kepolaran saja tidak cukup untuk menerangkan kelarutan zat dalam air. Senyawa triterpenoid yang bersifat nonpolar dapat larut dalam air yang bersifat polar, hal ini diduga disebabkan oleh gaya antarmolekul yaitu gaya dipol-dipol induksian dan ikatan hidrogen. Molekul polar yang memiliki dipol permanen akan menginduksi molekul nonpolar yang tidak memiliki dipol, sehingga akan terjadi gaya elektrostatik di antara keduanya atau yang disebut gaya dipol-dipol induksi, sehingga molekul nonpolar yaitu triterpenoid dapat larut dalam air yang bersifat polar.
Triterpenoid banyak ditemukan di dalam tumbuhan yang dikonsumsi oleh manusia (pangan atau tanaman obat). Triterpenoid saat ini sedang banyak diteliti dalam penggunaannya sebagai makanan, obat-obatan, kosmetik, dan produk kesehatan. Triterpenoid memiliki banyak fungsi biologis dan efektivitas dalam farmakologi seperti antiinflamasi, anti-ulcer, antibakteri, antivirus, hepatoprotektif, imunomodulator, hipolipidemik, antikoagulan, antiaterosklerosis (anti penyakit
arteriosclerotic vascular disease), dan antikarsinogenik. Triterpenoid memiliki banyak fungsi sehingga berpotensi sebagai agen multi-target dalam perawatan kanker tertentu dan penyakit inflamasi (radang). Triterpenoid memiliki aktivitas pada berbagai tingkatan fase dalam proses pembentukan karsinogen, yaitu dalam proses aktivasi NF-kB (Nuclear factor-kappaB) untuk penghentian daur sel, induksi apoptosis, inhibisi proliferasi, invasi, metastatis dan angiogenesis, sehingga berpotensi dimanfaatkan dalam hal chemoprevention dan pada saat perawatan
chemotherapy untuk penderita penyakit kanker (Szakiel et al. 2012).
Saponin tidak hanya dihasilkan oleh tumbuhan tetapi juga hewan (paling banyak dihasilkan oleh teripang dan bintang laut). Saponin memiliki ciri-ciri dapat membentuk busa karena memiliki sifat sebagai surfaktan. Saponin memiliki aktivitas biologis seperti hemolitik, expectorative, antiinflamasi, dan aktivitas
immune-stimulating. Saponin juga memperlihatkan aktivitas antimikroba yang secara spesifik dapat menghambat kapang, tetapi juga dapat menghambat bakteri dan protozoa (Sahelian 2014).
KESIMPULAN DAN SARAN
Kesimpulan
Hidrolisat Ulva lactuca didapatkan melalui proses hidrolisis menggunakan kapang EN dengan OD570nm paling tinggi pada jam ke-12 yaitu sebesar ±0,884.
Nilai pH cenderung asam dengan nilai 5 pada jam ke-24 sampai jam ke-48. Rendemen polisakarida paling tinggi pada jam ke-12 yaitu dengan nilai sebesar ±54,9% dari berat kering Ulva lactuca. Asam amino yang memiliki nilai tinggi pada hidrolisat Ulva lactuca adalah serin, asam glutamat, dan glisin yang memiliki nilai sebesar 366,66 mg/kg, 289,91 mg/kg, dan 261,37 mg/kg. Hidrolisat Ulva lactuca
17
Saran
Penelitian lebih lanjut untuk optimasi jumlah asam amino yang dapat dihasilkan dari hidrolisis Ulva lactuca menggunakan metode enzimatis atau asam basa, dan penelitian komposisi dari polisakarida yang dihasilkan perlu dilakukan.
UCAPAN TERIMA KASIH
Penelitian ini didanai oleh Kementrian Riset, Teknologi dan Pendidikan Tinggi (Kemenristekdikti) melalui program Hibah Kompetensi (HIKOM) atas nama Prof Dr Ir Linawati Hardjito, MS.
DAFTAR PUSTAKA
[SIA] Seaweed Industry Association. 2015. Ulva lactuca.
http://www.seaweedindustry.com/ [14 Januari 2016]
Afrianto E, Liviawaty E. 2009. Pakan Ikan. Yogyakarta (ID): Kanisius.
Akitomi H, Tahara Y, Yasuura M, Kobayashi Y, Ikezaki H, Toko K. 2013. Quantification of tastes of amino acids using taste senseors. Sensor and Actuators B: Chemical 179: 276-281.
Andhikawati A, Oktavia Y, Ibrahim B, Tarman K. 2014. Isolasi dan penapisan kapang laut endofit penghasil selulase. Jurnal Ilmu dan Teknologi Kelautan Tropis 6(1): 219-227.
Anggadiredja JT, Zatnika A, Purwoto H, Istini S. 2008. Rumput Laut: Pembudidayaan, Pengolahan, & Pemasaran Komoditas Perikanan Potensial. Jakarta (ID) : Penebar Swadaya.
Antara NS. 2011. Flavour produk pangan terfermentasi. http://foodreview.co.id/
[27 Desember 2015].
Balafif RAR, Andayani Y, Gunawan ER. 2013. Analisis senyawa triterpenoid dari hasil fraksinasi ekstrak air buah buncis (Phaseolus vulgaris Linn). Chem. Prog 6(2): 57-61.
Bintang M. 2010. Biokimia Teknik Penelitian. Jakarta (ID): Erlangga.
Boundless. 2015. Proteolytic degradation. http://boundless.com/ [14 Januari 2016] Ghareeb DA, Elmegeed DFA, Elsyed M, El-Shaadani M. 2014. Phytochemical constituents and bioscreening activities of green alga (Ulva lactuca).
International Journal of Agricultural Policy and Research 2(11): 373-378. Goldberg I. 2012. Functional Food: Designer Foods, Pharmafoods,
Neautraceutical. London (UK): Chapman & Hall.
18
Harborne JB. 1997. Phytochemical Methods. New York (US): Champan and Hall. Imandira PAN. 2012. Pengaruh substitusi tepung daging ikan lele dumbo (Clarias gariepinus) dan tepung ubi jalar kuning (Ipomoea batatas L.) terhadap
Kavanagh K. 2011. Fungi: Biology and Applications (Second Edition). Maynooth (IE): A John Wiley & Sons, Ltd. Publication.
Kim SK. 2013. Marine Neutraceuticals: Prospects and Prespectives. Florida (US): CRC Press.
Kordi M, Gufran H. 2010. A to Z Budidaya Biota Akuatik untuk Pangan, Kosmetik dan Obat-Obatan.Yogyakarta (ID): Lily Publisher.
Kumar VV, Khaladaran P. 2007. Amino acids in the seaweeds as an alternate source of protein for animal feed. J. Mar. Biol. Ass. India 49(1): 35-40.
Lahaye M, Robic A. 2007. Structure and functional properties of ulvan, a polysaccharide from green seaweed. Biomacromolecules 8(6): 1765-17764 Laohakunjit N, Selamassakul O, Kerdchoechuen O. 2014. Seafood-like flavour
obtained from the enzymatic hydrolysis of the protein by-products of seaweed (Gracilaria sp.). Food Chemistry 158: 162-170.
Mathur NK. 2012. Industrial Galactomannan Polysaccharides. Florida (US): CRC Press.
Nollet L, Toldra F. 1996. Handbook of Seafood and Seafood Products Analysis. Boca Raton (US): CRC Press.
Obata O, Joseph CA, Graeme W. 2015. Hydrolytic effects of acid and enzimatic pre-treatment on the anaerobic biodegradability of Ascophyllum nodusum
and Laminaria digitata species of brown seaweed. Biomass and Bioenergy.
80: 140-146.
Osorno L, Osorio NW. 2014. Effect of carbon and nitrogen source and concentration on rock phosphate dissolution induced by fungi. Journal of Applied Biotechnology 2(2): 32-42.
Patra AK. 2012. Dietary Phytochemicals and Microbes. New York (US): Springer Netherlands.
Poespowati T, Marsyahyo E, Kartika DR. 2014. Bioethanol: Indonesian macro-algae as a renewable feedstock for liquid fuel. International Journal of Chemical, Nuclear, Materials and Metallurgical Engineering 8 (12): 1248-1251.
19
Sahelian R. 2014. Saponin in plants benefit and side effects, glycosides and extraction. http://www.Raysahelian.com/ [14 Januari 2016].
Silva M, Vieira L Almeida AP, Kijjoa A. 2013. The marine macroalgae of the genus ulva: chemistry, biological activities and potential applications.
Oceanography 1(1): 1-6.
Sumardjo D. 2009. Pengantar Kimia: Buku Panduan Kuliah Mahasiswa Kedokteran dan Program Strata I Fakultas Bioeksakta. Jakarta (ID): EGC. Szakiel A, Paczkowski C, Pensec F, Bertsch C. 2012. Fruit culticular waxes as source of biologically active triterpenoids. Phytochem. Rev. 11(2-3): 263-284.
Tjitrosoepomo G. 1989. Taksonomi Tumbuhan. Yogyakarta (ID): Gadjah Mada University Press.
Trivedi N, Gupta V, Reddy CRK, Jha B. 2013. Enzymatic hydrolysis and production of bioethanol from common macrophytic green alga Ulva fasciata Delile. Bioresource Technology 150 (2013): 106–112.
Varki A, Cummings R, Esko J, Freeze H, Stanley P, Bertozzi C, Hart G, Etzler M. 2008. Essentials of Glycobiology. New York (US): Cold Spring Harbor Laboratory Press.
Warith AWAA, Younis ESMI, Asgah NAA. 2015. Potential use of green macroalgae Ulva lactuca as a feed supplement in diets on growth performance, feed utilization and body composition of the African catfish, Clarias gariepinus. Saudi Journal of Biological Science DOI 10.1016. in press.
Yaich H, Garna H, Besbes S, Paquot M, Blecker C, Attia H. 2011. Chemical compositon and functional properties of Ulva lactuca seaweed collected in Tunisia. Food Chemistry 128: 895-901.
21
23
Lampiran 1 Nilai OD570nm hasil hidrolisis Ulva lactuca selama 48 jam Jam ke- Rata-rata absorbansi
Lampiran 2 Nilai pH selama proses hidrolisis
24
26
RIWAYAT HIDUP
Penulis dilahirkan di Tanjung Karang, pada tanggal 15 Mei 1993. Penulis merupakan anak pertama dari dua bersudara dari pasangan Tamrin dan Emi Asmawati. Tahun 2011 penulis lulus dari SMA Al-Kautsar, Lampung Selatan dan pada tahun yang sama penulis lulus seleksi masuk Institut Pertanian Bogor (IPB) melalui jalur Seleksi Nasional Masuk Perguruan Tinggi Negeri (SNMPTN) Undangan dan diterima di Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan.