ANALISIS KESTABILAN GENETIK ORTET KELAPA SAWIT
(
Elaeis guineensis
Jacq
.
) DAN KLON-KLON TURUNANNYA
MENGGUNAKAN PENANDA MIKROSATELIT
WULAN ARTUTININGSIH
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis yang berjudul Analisis Kestabilan Genetik Ortet Kelapa Sawit (Elaeis guineensis Jacq.) dan Klon-klon Turunannya menggunakan Penanda Mikrosatelit adalah karya saya sendiri dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Juli 2012
ABSTRACT
WULAN ARTUTININGSIH. Analysis of Genetic Stability from Oil Palm Ortets (Elaeis guineensis Jacq.) and Their Clones Using Microsatellite Marker. Under direction of UTUT WIDYASTUTI and NURITA TORUAN MATHIUS
Propagation of oil palm by tissue culture techniques was capable of producing uniform clones. However, clones indicated the existence of genetic variability. The aims of this study were to determine the genetic similarity between ortets, ortet and clones, and to analyze correlation between period to get embryoid and allele stability of clones. This studies were used 90 samples consisting of 9 ortets, 27 plantlets from embryoid I (E1), 27 plantlets from embryoid II (E2), and 27 plantlets from embryoid III (E3). Leave from samples were collected and used for DNA isolation, amplification using 14 microsatellite markers, visualized using QIAxcel system, and transformed the allele data into binary data. Data analysis was performed using Distance Method (DM) in Phylogenetic Analysis Using Parsimony (PAUP) ver. 4b.10. The result showed that the genetic stability of ortets as explants in the propagation of oil palm using tissue culture techniques were different based on 14 microsatellite markers. Ortet 10, 16, 36, 51, and 120 have a high degree of genetic stability, and ortet 228 have clones with variation of allele changes. Correlation between period to get embryoid and allele stability of clones showed a very low value (0,11), so allele stability of clones wasn’t affected by period to get embryoid but was influenced by genotype of ortet.
RINGKASAN
WULAN ARTUTININGSIH. Analisis Kestabilan Genetik Ortet Kelapa Sawit (Elaeis guineensis Jacq.) dan Klon-klon Turunannya Menggunakan Penanda Mikrosatelit. Dibimbing oleh UTUT WIDYASTUTI dan NURITA TORUAN MATHIUS.
Teknik kultur jaringan merupakan salah satu cara untuk memperoleh tanaman klonal dalam jumlah banyak dan sifatnya identik dengan induknya. Perbanyakan tanaman klon kelapa sawit melalui pembentukan tanaman lengkap dari sumber eksplan berupa daun kelapa sawit dengan karakter-karakter agronomi penting, seperti produktivitas tinggi, resisten terhadap penyakit, dan toleran kekeringan. Salah satu kendala dalam pengembangan teknologi penyediaan bibit melalui kultur jaringan pada tanaman kelapa sawit adalah timbulnya variasi somaklonal. Variasi somaklonal merupakan keragaman tanaman yang dihasilkan melalui kultur sel, baik sel somatik maupun sel gamet. Faktor-faktor yang dapat menginduksi munculnya variasi somaklonal pada tanaman kelapa sawit, antara lain genotipe tanaman, komposisi medium, lama waktu pengkulturan, dan kondisi ruang kultur.
Beberapa penelitian menunjukkan bahwa penanda mikrosatelit lebih efektif dalam menganalisis keragaman genetik, karena mampu mengidentifikasi tanaman klonal dan memonitor keseragaman tanaman klonal. Hal tersebut berdasarkan pada sifat polimorfis dan kodominan yang dimiliki penanda mikrosatelit.
DNA genom seluruh sampel diisolasi menggunakan kit GenElute (Sigma), kemudian diamplifikasi dengan 14 pasang primer mikrosatelit menggunakan mesin Polymerase Chain Reaction (PCR) sebanyak 35 siklus reaksi. Sekuen mikrosatelit hasil amplifikasi dielektroforesis menggunakan sistem QIAxcel. Pita-pita DNA mikrosatelit yang muncul sebagai hasil elektroforesis, kemudian ditabulasi dan dirubah dalam bentuk data biner. Data tersebut digunakan untuk analisis kemiripan genetik mengikuti Distance Method (DM) dari program
Phylogenetic Analysis of Using Parsimony (PAUP) versi 4b.10, dan analisis korelasi digunakan untuk mengetahui hubungan antara tahap panen embrioid dengan kestabilan alel.
Hasil analisis pola pita DNA dari semua sampel menggunakan 14 pasang primer mikrosatelit, diperoleh sebanyak 44 alel dengan 1 sampai 5 alel untuk setiap primer yang digunakan. Dari total 14 pasang primer mikrosatelit yang digunakan dalam penelitian, hanya sepasang primer (7%) yang monomorfis, yaitu primer mEgCIR3555. Sedangkan 13 pasang primer yang lain (93%) merupakan primer polimorfis.
yang dihasilkan, yaitu kelompok ortet yang sebagian besar turunannya memiliki kemiripan genetik lebih besar atau sama dengan 90% dan kelompok ortet dengan sebagian besar turunannya memiliki variasi genetik.
Analisis kemiripan genetik antara ortet kelapa sawit dan klon-klon turunannya menunjukkan bahwa lima dari sembilan ortet yang diuji, sebagian besar klon-klonnya memiliki kemiripan genetik lebih besar atau sama dengan 90%, yaitu ortet 10, 16, 36, 51, dan 120.
Penelitian ini menunjukkan bahwa kestabilan genetik tanaman klon tidak dipengaruhi oleh waktu panen embrioid yang berbeda dengan nilai korelasi -0,11. Kestabilan genetik antara ortet dan klon-klon turunannya dipengaruhi oleh genotipe ortet yang berpengaruh terhadap respon eksplan selama pengkulturan. Tanaman ortet yang memiliki klon-klon dengan kestabilan genetik tinggi memiliki potensi untuk menghasilkan tanaman klon yang identik dengan induknya. Berdasarkan hasil analisis kestabilan genetik antara ortet dan klon-klon turunannya ternyata tanaman ortet 10, 36, 51, dan 120 memiliki kestabilan genetik tinggi.
© Hak cipta milik IPB dan PT.SMART Tbk, tahun 2012
Hak cipta dilindungi Undang-Undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya.
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah
b. Pengutipan tidak merugikan kepentingan yang wajar IPB.
ANALISIS KESTABILAN GENETIK ORTET KELAPA SAWIT
(
Elaeis guineensis
Jacq
.
) DAN KLON-KLON TURUNANNYA
MENGGUNAKAN PENANDA MIKROSATELIT
WULAN ARTUTININGSIH
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Bioteknologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Analisis Kestabilan Genetik Ortet Kelapa Sawit (Elaeis guineensis Jacq.) dan Klon-klon Turunannya Menggunakan Penanda Mikrosatelit
Nama : Wulan Artutiningsih NIM : P051090131
Disetujui Komisi Pembimbing
Dr. Utut Widyastuti, MSi. Dr. Nurita Toruan-Mathius, MS
Ketua Anggota
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana Bioteknologi
Prof. Dr. Suharsono DEA. Dr. Dahrul Syah MSc. Agr.
PRAKATA
Puji syukur penulis panjatkan kehadirat Allah SWT atas segala karunia-Nya sehingga penulis dapat menyelesaikan penelitian dengan judul “Analisis Kestabilan Genetik Ortet Kelapa Sawit (Elaeis guineensis Jacq.) dan Klon-klon Turunanya Menggunakan Penanda Mikrosatelit”.
Ucapan terima kasih yang tulus ingin penulis sampaikan kepada:
1. Dr. Ir. Utut Widyastuti MSi, dan Dr. Nurita Toruan-Mathius MS. selaku pembimbing yang telah banyak memberikan masukan dan arahan sejak penyusunan rencana penelitian sampai penyusunan tesis ini.
2. Bapak Jo Daud Dharsono selaku Senior Managing Director Operational
(SMDOps) PT SMART Tbk, Dr. Tony Liwang, dan Dr. Nurita Toruan-Mathius MS. sebagai pimpinan divisi Plant production and Biotechnology atas dorongan dan izin yang diberikan untuk mengikuti pendidikan S2 di IPB, serta bantuan secara moril dan materiil.
3. Bapak Yong Yit Yuan, bapak Yopy Dediwiryanto, Staf dan karyawan divisi Plant Production and Biotechnology SMART Bogor yang telah membantu dalam penyediaan bahan tanam, sumbang saran, dan tenaga sehingga penelitian ini dapat diselesaikan dengan baik.
4. Teman dan sahabat seperjuangan BTK’09: Ophie, Kabe, mbaIk, Mas Hendra, Mas Acep, Ballek, Mama Fikri, dkk yang telah memberi semangat dalam menyelesaikan penelitian ini.
5. Motivator terbesar penulis, Bapak Sugeng Wiro Sudarno, Ibu Wiwiek Rudyartati, dan Kakak Wisaksono Sudrajat yang selalu memberi dukungan
dan kekuatan dalam setiap doa.
Penulis menyadari bahwa tesis ini masih jauh dari sempurna, terutama keterbatasan informasi dan waktu penelitian, namun penulis berharap semoga tesis ini dapat bermanfaat bagi semua pihak yang membutuhkan.
Bogor, Juli 2012
RIWAYAT HIDUP
Penulis dilahirkan di Salatiga, Jawa Tengah pada tanggal 3 April 1984 dari
ayah Sugeng Wiro Sudarno dan ibu Wiwiek Rudyartati. Penulis merupakan putri bungsu dari dua bersaudara.
Pendidikan sekolah dasar sampai menengah diselesaikan di Propinsi Jawa Tengah. Pendidikan Sekolah Dasar diselesaikan pada tahun 1996 di SD Negeri
Sidorejo Lor 1 Salatiga, dan pendidikan menengah pertama di SLTP Negeri 1 Salatiga selesai pada tahun 1999. Pada tahun 2002 penulis lulus dari SMU Negeri 1 Salatiga dan pada tahun yang sama menempuh pendidikan sarjana yang diselesaikan tahun 2007 pada jurusan Biologi, Fakultas MIPA Universitas Negeri Semarang (UNNES).
Pada tahun 2007, penulis diterima bekerja di perusahaan perkebunan kelapa sawit Sinarmas Group, PT SMART Tbk, sebagai staf laboratorium pada Plant Production and Biotechnology Division, Bogor.
DAFTAR ISI
4.4 Analisis Kemiripan Genetik antara Ortet dan Klon-klon Turunannya. 28
4.5 Korelasi antara Tahap Panen Embrioid terhadap Kestabilan Alel . 34
V KESIMPULAN DAN SARAN ... 5.1 Kesimpulan ... 39
5.2 Saran ... 39
DAFTAR TABEL
Halaman
1 Jenis kultur, frekuensi subkultur, total waktu subkultur, dan tahap
perkembangan dalam proses kultur jaringan ... 9
2 Progeny ortet, kode ortet, dan kode klon yang digunakan dalam
penelitian ... 16
3 Kode primer, sekuen primer, dan suhu penempelan primer
mikrosatelit yang digunakan dalam penelitian ... 21
4 Kode primer mikrosatelit, jumlah alel total, dan alel polimorfis
dalam identifikasi mikrosatelit dari semua sampel penelitian ... 26
5 Kode primer mikrosatelit, jumlah alel total, dan alel polimorfis dari
sembilan ortet kelapa sawit ... 27
6 Tetua betina Dura dan jantan Pisifera dari progeny ortet kelapa sawit 29
7 Kestabilan alel tiap fase embrioid berdasarkan pola pita DNA hasil
DAFTAR GAMBAR
6 Pola pita DNA mikrosatelit dari 10 individu sampel hasil amplifikasi primer mEgCIR 3886 dengan elektroforesis QIAxcel ... 24
7 Pola pita DNA mikrosatelit dari 10 individu sampel hasil amplifikasi primer mEgCIR 2414 dengan elektroforesis QIAxcel ... 25
8 Keragaman genetik ortet kelapa sawit Tenera (DxP) berdasarkan 14 pasang primer mikrosatelit dengan program PAUP ver. 4b.10. ... 28
9 Keragaman genetik kelapa sawit Tenera (DxP) ortet 10 dan klon-klon turunannya berdasarkan 14 pasang primer mikrosatelit dengan program PAUP ver. 4b.10 ... 29
10 Keragaman genetik kelapa sawit Tenera (DxP) ortet 16 dan klon-klon turunannya berdasarkan 14 pasang primer mikrosatelit dengan program PAUP ver. 4b.10 ... 30
11 Keragaman genetik kelapa sawit Tenera (DxP) ortet 90 dan klon-klon turunannya berdasarkan 14 pasang primer mikrosatelit dengan program PAUP ver. 4b.10 ... 32
DAFTAR LAMPIRAN
Halaman
1 Posisi primer mikrosatelit yang digunakan dalam kromosom kelapa
sawit ... 47
2 Hasil isolasi DNA ... 51
3 Pita-pita hasil elektroforesis menggunakan QIAxcel... 54
4 Hasil skoring sekuen DNA mikrosatelit ... 58
5 Keragaman genetik sembilan ortet dan klon-klon turunannya dengan PAUP 4b.10 ... 63
BAB I PENDAHULUAN
1.1 Latar Belakang
Kelapa sawit merupakan tanaman penghasil minyak nabati yang produktivitasnya lebih tinggi di bandingkan dengan tanaman yang lain, seperti kedelai, bunga matahari, dan canola (TAMSI- DMSI, 2010). Data dari Direktorat Perbenihan menyatakan bahwa pada tahun 2006, permintaan bibit kelapa sawit unggul mencapai 220 juta bibit per tahun. Penyediaan bibit unggul kelapa sawit
untuk memenuhi permintaan konsumen dilakukan dengan dua cara, yaitu perbanyakan konvensional bibit Tenera F1 yang dihasilkan melalui persilangan antara Dura dan Pisifera (DxP) dan bibit kelapa sawit yang dihasilkan melalui teknik kultur jaringan. Berbeda dengan hasil perbanyakan secara konvensional yang menghasilkan tanaman yang beragam akibat adanya segregasi sifat kedua induk, bibit kelapa sawit melalui teknik kultur jaringan memiliki sifat yang sama dengan induknya (Sipayung & Liwang 2011).
Perbanyakan tanaman melalui teknik embriogenesis somatik dapat meningkatkan efisiensi perbanyakan kelapa sawit (Morcillo et al. 2006). Waktu yang diperlukan untuk satu siklus produksi tanaman lengkap (ramet) melalui kultur jaringan sekitar 2-3 tahun. Salah satu kendala yang dalam pengembangan teknologi penyediaan bahan tanam klonal kelapa sawit adalah timbulnya variasi somaklonal (Corley & Tinker 2003).
Variasi somaklonal merupakan keragaman tanaman yang dihasilkan melalui
kultur sel, baik sel somatik seperti sel daun, akar, batang, maupun sel gamet
(Larkin & Scowcroft 1981). Menurut Corley et al. (1986), variasi somaklonal
penanda genetik, diantaranya adalah mikrosatelit atau simple sequence repeat
(SSR).
Menurut Rival et al. (1999), faktor-faktor yang menginduksi munculnya
variasi somaklonal pada tanaman kelapa sawit selama proses kultur, yaitu komposisi media, lama waktu pengkulturan, dan kondisi ruang kultur.
Mikrosatelit atau simple sequence repeat (SSR) merupakan sekuen DNA yang bermotif pendek dengan 2 sampai 5 unit basa nukleotida dan diulang secara
berurutan dan melimpah tersebar di seluruh genom eukariotik (Powell et al.
1996). Menurut Cheah et al. (1995) beberapa pertimbangan untuk penggunaan penanda mikrosatelit dalam studi genetik yaitu, penanda mikrosatelit terdistribusi secara melimpah dalam genom, variabilitasnya sangat tinggi (multi alel), sifatnya kodominan dan dapat diketahui lokasinya pada DNA genom. Mikrosatelit merupakan alat uji yang memiliki reproduksibilitas dan ketepatan yang sangat tinggi, merupakan alat yang sangat akurat untuk membedakan genotipe, evaluasi kemurnian benih, pemetaan, dan seleksi genotipe untuk karakter yang di inginkan/
Quantitative Trait Loci (QTL).
Billotte et al. (2001) melaporkan keberhasilan penyusunan pustaka genom SSR kelapa sawit dengan 72% klon memiliki motif SSR. Billotte et al. (2005) berhasil melakukan pemetaan QTL kelapa sawit menggunakan mikrosatelit. Hatorangan et al. (2010) menggunakan penanda mikrosatelit untuk pembuatan sidik jari ortet sumber eksplan kelapa sawit di PT SMART Tbk. Zulhermana (2009) dan Nchu (2010) juga telah berhasil menggunakan penanda mikrosatelit analisis keragaman genetik dan karakterisasi populasi serta plasma nutfah kelapa
sawit, sedangkan McCouch et al. (2002) menggunakan penanda mikrosatelit untuk pemetaan analisis genetik dan program perbaikan tanaman Oryza sativa L.
Singh et al. (2007) menjelaskan bahwa penanda mikrosatelit dapat digunakan untuk pengendalian mutu dalam memproduksi klon kelapa sawit melalui teknik
kultur jaringan untuk skala komersial. Penerapan penanda mikrosatelit sebagai
pelacak DNA sangat efektif untuk mengidentifikasi klon, mendeteksi tercampurnya
1.2 Tujuan penelitian
Tujuan penelitian ini secara umum adalah mempelajari kestabilan genetik ortet kelapa sawit dan klon-klon turunannya. Secara khusus penelitian ini bertujuan untuk:
1. Menentukan hubungan kekerabatan antara ortet yang digunakan dalam penelitian
2. Menetapkan kestabilan genetik klon-klon yang dihasilkan dari satu ortet yang sama, namun berasal dari perkembangan embrioid yang berbeda masa panen 3. Menetapkan ortet dan klon turunannya yang memiliki kestabilan genetik
tinggi
1.3 Manfaat penelitian
Penelitian ini diharapkan memberikan manfaat sebagai:
1. Dasar bagi industri bibit klonal kelapa sawit komersial dalam menentukan batas waktu panen embrioid yang sesuai dengan kontrol mutu yang telah di tetapkan
BAB II
TINJAUAN PUSTAKA
2.1 Kelapa Sawit (Elaeis guineensis Jacq.)
Tanaman kelapa sawit (Elaeis guineensis Jacq.) berasal dari Afrika Barat. Nama Elaeis guineensis Jacq. berasal dari bahasa Yunani, yaitu elaion yang berarti minyak, guineensis yang menunjukkan bahwa tanaman kelapa sawit berasal dari pantai Guinea Afrika Barat, dan Jacq. merupakan singkatan dari nama belakang Nicolaus Josef von Jacquin, orang yang memberi nama kelapa sawit
secara botani (Hartley 1987). Pada tahun 1848, tanaman kelapa sawit mulai masuk ke Indonesia yaitu, 4 tanaman kelapa sawit pertama yang ditanam di Kebun Raya Bogor. Keempat bibit kelapa sawit tersebut berasal dari Bourbon pada bulan Februari dan Amsterdam pada bulan Maret (Pamin 1998).
Tanaman kelapa sawit tergolong tanaman monokotil, akarnya terdiri atas akar primer, sekunder, tersier, dan kuarter yang merupakan akar serabut dan sebagian besar berada dekat di permukaan tanah dengan kedalaman 15-30 cm. Batangnya tegak tidak bercabang, berdiameter 40-75 cm dan tinggi batang dalam pembudidayaan tidak lebih dari 15-18 m. Daunnya majemuk dengan pelepah daun tersusun melingkari batang berbentuk spiral (Corley & Tinker 2003).
Menurut Latiff (2000), kelapa sawit dibedakan menjadi tiga jenis berdasarkan ketebalan cangkangnya, yaitu Dura, Pisifera, dan Tenera. Ciri masing-masing jenis kelapa sawit tersebut adalah sebagai berikut:
a) Dura: cangkang tebal (2-8mm), tidak mempunyai lingkaran serabut pada bagian luar cangkang, daging buah relatif tipis yaitu 35-50% terdapat buah, kernel (daging biji) besar dengan kandungan minyak rendah dan dan
digunakan sebagai induk betina dalam produksi benih komersial.
gugur pada awal perkembangannya sehingga digunakan sebagai induk jantan dalam produksi benih komersial.
c) Tenera: merupakan hasil persilangan Dura dengan Pisifera, cangkang tipis
(0,5-4mm), terdapat lingkaran serabut sekeliling tempurung, daging buah sangat tebal (60-95% dari buah), tandan buah lebih banyak tetapi ukuran relatif lebih kecil. Tenera merupakan tanaman kelapa sawit komersial yang ditanam untuk menghasilkan minyak sawit.
2.2 Kultur Jaringan Kelapa Sawit
Perbanyakan kelapa sawit dengan teknik kultur jaringan telah dimulai pada tahun 1960-an sampai tahun 1977, diperoleh klon kelapa sawit pertama yang ditanam di Malaysia. Sejak saat itu perbanyakan kelapa sawit mulai berkembang pesat sampai memasuki tahun 1990-an, teknik kultur jaringan kelapa sawit mulai dimanfaatkan untuk perbanyakan klon komersial (Corley & Tinker 2003).
Teknik kultur jaringan merupakan proses memperoleh kelapa sawit terpilih yang identik atau true-to-type melalui perkembangan tanaman lengkap (ramet) dari sumber eksplan berupa daun kelapa sawit dengan karakter- karakter agronomi penting, seperti: produktivitas tinggi, resisten penyakit, toleran kekeringan (Mutert & Fairhust 1999).
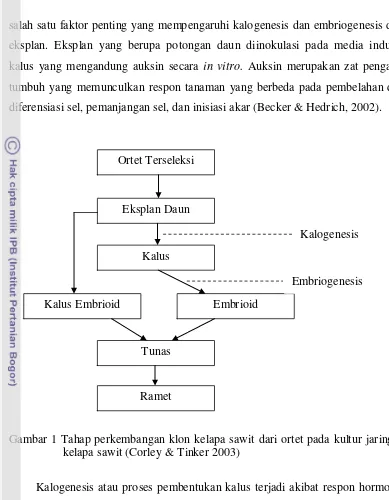
Proses kultur jaringan kelapa sawit dimulai dengan proses seleksi ortet dengan karakter yang diinginkan, diikuti dengan induksi kalus (kalogenesis), pembentukan dan perbanyakan embrioid (embriogenesis), perkembangan tunas, dan pembentukan akar (Gambar 1). Dua proses penting yang terjadi selama kultur
jaringan adalah kalogenesis dan embriogenesis dalam media tanam dengan penambahan zat pengatur tumbuh (Mutert & Fairhust 1999; Wong et al. 1999).
salah satu faktor penting yang mempengaruhi kalogenesis dan embriogenesis dari eksplan. Eksplan yang berupa potongan daun diinokulasi pada media induksi kalus yang mengandung auksin secara in vitro. Auksin merupakan zat pengatur
tumbuh yang memunculkan respon tanaman yang berbeda pada pembelahan dan diferensiasi sel, pemanjangan sel, dan inisiasi akar (Becker & Hedrich, 2002).
Gambar 1 Tahap perkembangan klon kelapa sawit dari ortet pada kultur jaringan kelapa sawit (Corley & Tinker 2003)
Kalogenesis atau proses pembentukan kalus terjadi akibat respon hormonal eksplan terhadap media yang mengandung zat pengatur tumbuh auksin, seperti
2,4-Dichlorophenoxyacetic acid (2,4-D). Menurut Chawla (2002) hanya sebagian kecil sel eksplan yang memiliki kemampuan membentuk kalus. Kalus adalah sekumpulan sel amorphous (tidak berbentuk atau belum terdiferensiasi) yang terbentuk dari sel-sel yang membelah terus menerus secara in vitro. Menurut Gunawan (1992), kalus berasal dari pembelahan sel-sel parenkim dan dapat dihasilkan dari potongan organ di dalam media yang mengandung auksin dan sitokinin.
Kalus Embrioid Embrioid
Tunas
Ramet Eksplan Daun
Kalus Ortet Terseleksi
Kalogenesis
Menurut Corley dan Tinker (2003), embriogenesis atau proses pembentukan embrioid terjadi melalui dua cara, yaitu secara langsung maupun tidak langsung. Embriogenesis langsung adalah pembentukan embrioid secara langsung dari
eksplan tanpa melalui pembentukan kalus. Sedangkan embrioid yang umum terbentuk menggunakan metode tidak langsung melalui tahap pembentukan kalus. Perbanyakan embrioid merupakan tahap yang sangat penting dalam upaya mendapatkan klon-klon kelapa sawit dengan teknik kultur jaringan melalui
subkultur berulang.
Sekelompok embrioid dengan pemberian kode yang sama dapat disebut sebagai embryoid line, berasal dari perbanyakan atau proliferasi sel embriogenik pada satu kultur kalus. Embrioid yang muncul pertama kali pada satu kultur kalus disebut dengan embrioid panen pertama (E1). Embrioid yang muncul berikutnya pada kultur kalus yang sama setelah melalui subkultur disebut embrioid panen kedua (E2), dan embrioid panen ketiga (E3). Banyaknya subkultur tiap embryoid
line memiliki batas tertentu untuk mengurangi kemungkinan terjadinya
abnormalitas akibat lamanya eksplan dalam media kultur (Corley & Tinker 2003). Pembentukan tunas terjadi pada tahap perbanyakan embrioid. Setiap tunas yang terbentuk dipindahkan ke dalam media kultur yang berbeda, yaitu media perkembangan tunas dan induksi akar dengan pengurangan konsentrasi zat pengatur tumbuh. Subkultur dilakukan berulang sampai tunas membentuk tanaman lengkap (ramet). Ramet pada media kultur belum memiliki kutikula daun normal, sehingga cepat kering pada saat terkena udara luar. Pengaturan kelembaban media aklimatisasi sangat penting dilakukan dengan pengurangan
kelembaban secara bertahap, sampai kutikula daun terbentuk dan tanaman mampu hidup pada kondisi lapang (Corley & Tinker 2003). Proses pembentukan tanaman lengkap dari eksplan daun kelapa sawit terjadi melalui beberapa tahap perkembangan dengan waktu dan jumlah subkultur yang berbeda (Tabel 1).
Menurut Karami et al. (2009), pembentukan embrioid melalui somatic embryogenesis (SE) berhubungan dengan hipermetilasi dan hipometilasi DNA akibat pengaruh 2,4 D pada sel somatik. Pada tahap awal embrioid, ditemukan
tingkat metilasi DNA tertinggi dan menurun selama proses pematangan embrioid. Menurut Xiao et al. (2006), metilasi DNA mempengaruhi ekspresi gen selama embriogenesis pada Arabidopsis. Perubahan struktur kromatin yang termetilasi akibat pengaruh 2,4 D menyebabkan sel somatik mengalami pengaturan ulang
membentuk embrioid (Gambar 2).
Tabel 1 Jenis kultur, frekuensi subkultur, total waktu subkultur, dan tahap perkembangan dalam proses kultur jaringan *
No. Jenis
2.3 Variasi Somaklonal dan Kestabilan Genetik
Menurut Larkin dan Scowcorf (1981), variasi somaklonal didefinisikan sebagai keragaman dari tanaman yang dihasilkan melalui kultur sel, baik sel
somatik maupun sel gamet secara in vitro. Rival et al. (1999) dan Bairu et al.
(2011) mengemukakan bahwa variasi somaklonal yang ditemukan pada tanaman klonal disebabkan oleh beberapa faktor, yaitu: metode yang digunakan, genotipe, jenis eksplan, tipe dan konsentrasi zat pengatur tumbuh (ZPT), banyak dan lama
subkultur.
Kondisi perkembangan in vitro dapat merupakan cekaman abiotik pada sel tanaman, bahkan menurut Sherpherd dan Dos Santos (1996), kondisi tersebut dapat merangsang proses mutagenik. Wattimena dan Mattjik (1992), menyatakan bahwa adanya fase pertumbuhan yang tidak teratur dan kondisi in vitro yang memberikan cekaman abiotik yang ekstrim pada sel tanaman dapat meningkatkan proses mutagenesis. Keragaman genetik pada kultur jaringan dapat muncul pada fase tak berdiferensiasi yang relatif lebih lama, yaitu fase kalus dan embrioid. Kestabilan genetik tanaman klonal melalui teknik kultur jaringan diperoleh dengan cara menginduksi sesingkat mungkin fase kalus dan embrioid.
Menurut Skoog dan Miller (1957), efisiensi perbanyakan tanaman in vitro
ditentukan oleh penggunaan ZPT dengan konsentrasi yang tepat. Komposisi zat pengatur tumbuh dalam media kultur dapat menyebabkan perubahan frekuensi kariotipik dalam kultur sel (Chawla 2002). Penambahan zat pengatur tumbuh, seperti NAA dan 2,4 D pada media pembentukan tunas dari kultur kalus tanaman kelapa sawit menyebabkan terjadinya variasi somaklonal (Skirvin et al. 1993; Jain
2001). Penelitian Rodrigues et al. (1997), menunjukkan bahwa variasi somaklonal meningkat dari 1,3% pada subkultur kelima menjadi 3,8% setelah subkultur kesebelas pada perbanyakan tanaman pisang Brazil “nanicao”.
ekspresi gen yang salah satunya dipengaruhi oleh peningkatan atau penghambatan ekspresi gen akibat metilasi DNA.
Penelitian yang dilakukan Jaligot (2000), menunjukkan adanya korelasi
antara hipometilasi DNA dan variasi somaklonal yang berupa buah mantel pada tanaman klon kelapa sawit. Konsentrasi 5-methyl deoxycytidine pada daun tanaman abnormal lebih rendah 0,5-2,5% dibandingkan pada daun normal dan kalus dengan pertumbuhan yang cepat menghasilkan 100% tanaman mantel,
sedangkan kalus nodular yang hanya menghasilkan 5% tanaman mantel.
Tanaman klon yang berasal dari perbanyakan in vitro dengan teknik kultur jaringan memperlihatkan adanya fenomena variasi somaklonal. Menurut Bairu et al. (2011), variasi somaklonal dapat dideteksi dengan beberapa pendekatan yaitu, morfologi, biokimia, dan molekular. Variasi somaklonal dilakukan dengan mengamati karakter fenotipe setiap bagian tanaman pada fase vegetatif dan generatif. Kelemahan pengamatan karakter morfologi membutuhkan waktu yang lama sampai tanaman berbunga dan berbuah. Sebagai contoh tanaman kelapa sawit dengan variasi somaklonal buah mantel yang harus menunggu tanaman berbuah. Pendekatan morfologi memiliki kelemahan lain, yaitu adanya pengaruh lingkungan.
Pendekatan biokimia dapat digunakan untuk membandingkan tanaman normal dan abnormal karena lebih bersifat diskriminatif dengan menggunakan analisis enzim dan isozim. Sifat biokimia seringkali hanya diekspresikan pada waktu dan organ tertentu (Peyvandi et al. 2009).
Berdasarkan kelemahan-kelemahan penanda morfologi dan biokimia,
digunakan penanda molekular sebagai alat untuk mendeteksi variasi somaklonal. Perubahan yang terjadi pada tingkat molekular dilakukan dengan membandingkan sekuen DNA tanaman normal dan abnormal merupakan dasar yang digunakan dalam analisis molekular (Bairu et al. 2011).
Beberapa penelitian telah menggunakan penanda molekular untuk menganalisis variasi somaklonal yang ditemukan pada tanaman klonal kelapa sawit yang dihasilkan melalui kultur jaringan, seperti penanda AFLP atau
Random Amplification of Polymorphic DNA (Munir et al. 2011; Sianipar 2008), dan SSR atau Simple Sequence Repeat (Singh et al. 2007; Zulhermana 2009). Prado et al. (2010), mengemukakan terjadinya perubahan pada lokus mikrosatelit
sebagai konsekuensi variasi somaklonal pada Vitis vinifera.
2.4 Mikrosatelit atau Simple Sequence Repeat (SSR)
Mikrosatelit atau Simple Sequence Repeat (SSR) merupakan sekuen DNA
yang bermotif pendek dengan 2 sampai 5 unit basa nukleotida dan diulang secara berurutan dan melimpah tersebar di seluruh genom eukariotik (Powell et al.
1996). Misalnya, sekuen DNA dengan motif (ATT)10 berarti terdapat sekuen tiga nukleotida ATT yang berulang sebanyak 10 kali sehingga diperoleh sekuen DNA ATTATTATTATTATTATTATTATTATTATT. Beberapa alasan pemakaian mikrosatelit sebagai penanda genetik untuk analisis molekular, yaitu: ditemukan melimpah dalam genom (Saghai-Maroof et al. 1994; Cheah et al. 1995), bersifat kodominan sehingga tingkat heterozigositasnya tinggi yang berarti memiliki daya pembeda antar individu sangat tinggi, diketahui lokasinya pada DNA sehingga dapat mendeteksi keragaman alel, dihasilkan dengan cepat melalui PCR, relatif sederhana untuk dianalisis, dan mudah diakses oleh laboratorium lain melalui publikasi sekuen primer (Saghai-Maroof et al. 1994). Bahkan Powell et al. (1996) membuktikan bahwa dari empat penanda molekular yang diuji (RFLP, RAPD, AFLP, dan mikrosatelit), marka mikrosatelit memiliki kemampuan untuk membedakan genotipe yang paling tinggi untuk mengevaluasi plasma nutfah kedelai dibandingkan dengan marka molekular yang lain.
Penanda Mikrosatelit telah digunakan pada tanaman kelapa sawit. Billotte et al. (2001) melaporkan hasil pengembangan marka SSR kelapa sawit mulai dari penapisan pustaka SSR yang diperkaya dengan unit pengulangan (GA)n, (GT)n, dan (CCG)n, sampai kepada karakterisasi akhir 21 lokus SSR.
mengemukakan bahwa penanda mikrosatelit mampu mengidentifikasi tanaman klonal dan memonitor keseragaman tanaman klonal.
2.5 Analisis Korelasi
Analisis korelasi merupakan teknik analisis pengukuran tingkat kekuatan hubungan antar dua variabel atau lebih. Kuat lemah hubungan variabel diukur pada nilai antara selang 0 sampai 1, sedangkan tanda positif (+) dan negatif (–)
hanya menunjukkan arah hubungan. Korelasi antara tahap panen embrioid dan perubahan alel dihitung menggunakan rumus:
Interpretasi kekuatan hubungan dua peubah dapat dikelaskan sebagai: tidak ada korelasi (r = 0), korelasi sangat lemah (0 – 0.25), korelasi cukup (0.25 – 0.5), korelasi kuat (0.5 – 0.75), korelasi sangat kuat (0.75 – 0.99), korelasi sempurna (r = 1) (Wibisono 2009).
2.6 Analisis Kemiripan Genetik
Analisis pada kemiripan genetik berdasarkan pola pita hasil amplifikasi DNA digunakan untuk memperoleh pohon filogenetik. Program yang umum digunakan berdasarkan Distance Method (DM) dengan indek DICE. Analisis
BAB III
BAHAN DAN METODE
3.1 Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Juli 2011-Januari 2012 di Laboratorium Bioteknologi PT. SMART Tbk, Bogor. Sampel daun ortet diambil dari Kebun Produksi Kandista, Riau.
3.2 Bahan Tanaman
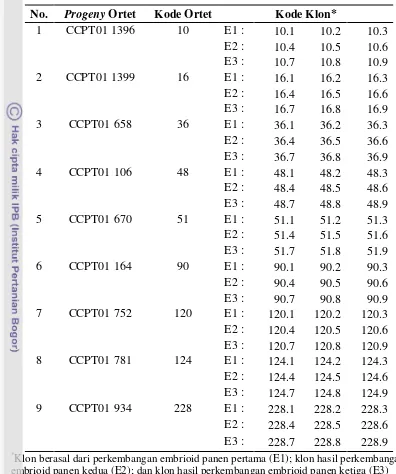
Bahan tanaman yang digunakan dalam penelitian sebanyak 90 sampel yang berupa sembilan daun ortet Tenera (DxP) yang masih muda dari genotipe CCPT01 1396, 1399, 658, 106, 670, 164, 752, 781, 934, dan 81 daun tanaman klon yang berasal dari perkembangan embrioid panen pertama, kedua, dan ketiga pada masing-masing ortet yang digunakan (Tabel 2).
3.3 Bahan dan Alat
Bahan yang digunakan dalam penelitian diantaranya: Nitrogen cair, larutan ekstraksi DNA yang berasal dari kit isolasi DNA GenElute (Sigma), yaitu lysis solution A, lysis solution B, presipitation solution (PPT), binding solution, column preparation solution, wash solution, elusion solution (TE), larutan bufer PCR, larutan MgCl2, dNTP mix, 14 pasang primer mikrosatelit 1 µM, ddH2O, kit QIAxcel DNA high-resolution, mineral oil, larutan marker DNA 100 bp, 400 bp, dan 1500 bp.
Alat yang digunakan dalam penelitian, diantaranya lumpang porselin (mortar), pipet mikro P-10, P-20, P-100, P-200, dan P-1000, tip pipet biru, tip
pipet kuning, tip pipet putih, gunting, spatula stainless, tabung mikro 2 mL,
filtration column in tube (kolom merah), nucleic acid binding column in tube
Tabel 2 Progeny Ortet, kode ortet dan kode klon yang digunakan dalam penelitian
Metode Penelitian
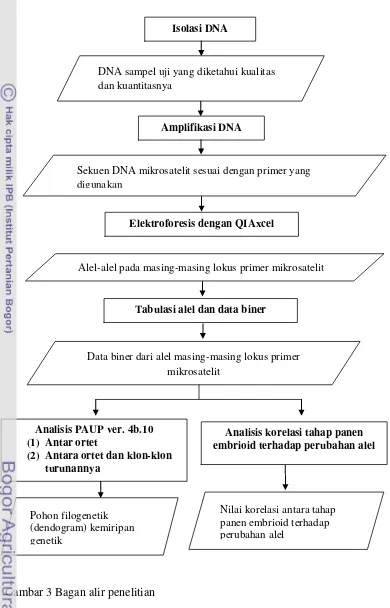
Penelitian ini dilakukan melalui beberapa tahap (Gambar 3).
Gambar 3 Bagan alir penelitian
Isolasi DNA
DNA sampel uji yang diketahui kualitas dan kuantitasnya
Amplifikasi DNA
Elektroforesis dengan QIAxcel
Tabulasi alel dan data biner
Sekuen DNA mikrosatelit sesuai dengan primer yang digunakan
Alel-alel pada masing-masing lokus primer mikrosatelit
3.4 Isolasi DNA
DNA genom diisolasi menggunakan metode kit GenElute (Meloscia et al.
2001). Sebanyak 100 mg daun sawit digerus dengan bantuan Nitrogen cair dalam
mortar, sampai menjadi bubuk halus. Bubuk sampel dimasukkan ke dalam tabung mikro 2 mL yang telah diisi 350 µ L larutan lisis A dan 50 µL lisis B, kemudian divorteks. Campuran diinkubasi pada suhu 65°C selama 10 menit, kemudian ditambahkan 130 µ L larutan PPT dan divorteks, kemudian diinkubasi pada suhu
- 20°C selama 5 menit.
Campuran disentrifugasi pada kecepatan 14.000 x g selama 5 menit untuk memperoleh supernatan. Supernatan dipindahkan ke dalam kolom biru dan disentrifugasi dengan kecepatan 14.000 x g selama 1 menit. Kolom biru dibuang, sedangkan supernatan ditambahkan 700 µL binding solution kemudian divorteks.
Kolom merah digunakan untuk mengikat DNA dalam membran. Sebanyak 500 µL column preparation solution ditambahkan ke dalam tabung merah, kemudian disentrifugasi pada 12.000 x g selama 30 menit. Selanjutnya larutan bagian bawah dibuang. Sebanyak 700 µL campuran DNA dimasukkan ke dalam kolom merah dan disentrifugasi pada 14.000 x g selama 1 menit. Kegiatan ini diulangi sampai campuran DNA dan binding solution habis. Pada tahap ini dihasilkan DNA yang terikat pada membran kolom merah.
Kolom merah kemudian dibilas dengan menambahkan 500 µ L wash solution dan disentrifugasi pada 14.000 x g selama 1 menit. Pembilasan diulangi dengan menambahkan 500 µ L wash solution dan disentrifugasi pada 14.000 x g selama 3 menit. Kolom merah yang sudah dibilas dipindahkan dalam tabung
mikro 2 mL yang baru. DNA yang terikat pada membran dilarutkan dengan menambahkan 100 µL larutan TE hangat dan disentrifugasi pada 14.000 x g selama 1 menit. Kegiatan melarutkan DNA dengan TEdilakukan sebanyak 2 kali, sehingga volume akhir larutan DNA yang di peroleh sebanyak 200 µL.
dipasangkan sisir. Setelah membeku, gel agarosa dimasukkan ke dalam alat elektroforesis yang telah berisi larutan bufer TAE 1x. Sebanyak 5 µL larutan DNA dicampur dengan 1 µ L 6x loading dye, dihomogenkan dengan bantuan
mikropipet, kemudian dimasukkan ke dalam sumur gel agarosa. Elektroforesis dilakukan selama 30 menit pada 100 volt. Pewarnaan dilakukan dengan cara merendam gel agarosa dalam larutan ethidium bromida (50 µL/L) selama 10 menit, kemudian dibilas dengan merendam gel agarosa dalam akuades selama 10
menit. Hasil elektroforesis dilihat dan sidokumentasi menggunakan alat Gel doc Universal Hood (Biorad).
Konsentrasi DNA hasil isolasi diuji dengan Nanodrop 2000c (Thermo Scientific). Larutan yang digunakan sebagai blank dalam mengukur konsentrasi DNA hasil isolasi adalah larutan yang sama yang digunakan sebagai pelarut DNA, yaitu elute solution (TE) dari GenElute kit. Sebanyak 1 µL TE diteteskan pada bagian pedestal (bagian dari alat tempat meletakkan sampel). Konsentrasi DNA akan muncul dalam satuan ng/µL.
3.5 Amplifikasi DNA
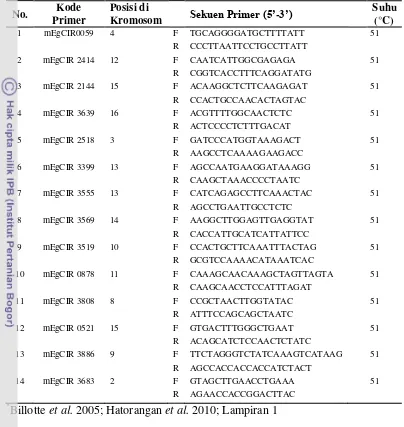
Amplifikasi DNA dilakukan terhadap seluruh sampel dengan 14 pasang primer mikrosatelit (Tabel 3, Lampiran 1). Amplifikasi DNA menggunakan volume larutan 15 µL yang mengandung 1x larutan bufer PCR, 0.3 mM untuk setiap primer, 100 µM dNTP mix, 1.5 unit enzim Taq polimerase, 2.5 mM larutan MgCl2, 2µ L DNA sampel 10 ng/µL, dan ddH2O sebagai penyesuai volume. Campuran dimasukkan dalam tabung mikro PCR 0.2 mL, kemudian ditambahkan
3.6 Elektroforesis DNA Hasil Amplifikasi
Elektroforesis dilakukan menggunakan QIAxcel Sistem. Prinsip pemisahan QIAxcel dilakukan dalam kapiler cartridge gel, dimana setiap sampel otomatis
masuk di dalam kapiler. DNA yang bermuatan negatif bermigrasi melalui kapiler ke ujung bermuatan positif melewati detektor yang mendeteksi dan mengukur sinyal serta mengubah sinyal emisi ke data elektronik yang kemudian ditampilkan sebagai gambar gel (Gambar 4).
Alat QIAxcel dan komputer yang akan digunakan dihidupkan, kemudian memasukkan QX alignment marker ke dalam tray alat. Sampel hasil amplifikasi dalam tabung mikro PCR 0.2 mL atau plate 96 well diletakkan dalam sampel tray alat. Pada tampilan “Instrumen Control” memerlukan beberapa informasi yang
perlu diisi. Proses elektroforesis akan dimulai setelah mengklik “Run”. Hasil dari elektroforesis dengan alat QIAxcel diperoleh elektrogram dan hasil amplifikasi ditampilkan dalam gambar gel.
3.7 Analisis Data
Data penelitian yang diperoleh berupa pita-pita DNA hasil amplifikasi menggunakan primer mikrosatelit tanpa adanya ulangan. Setiap pita yang muncul pada gel merupakan satu alel tertentu. Profil DNA merupakan data alel yang teramati dengan ketentuan adanya pita DNA berdasarkan ukuran produk PCR pada satu lokus yang sama dari beberapa bahan tanam yang digunakan. Alel-alel tersebut diterjemahkan menjadi data biner. Setiap alel dianggap mewakili satu karakter dan diberi nilai berdasarkan ada tidaknya suatu alel. Nilai 1 diberikan
bila ada alel dan nilai 0 bila tidak ada alel.
Hasil skoring pita-pita yang muncul maupun yang tidak ditabulasikan ke dalam bentuk excel dan diubah dalam data biner untuk memudahkan proses pada
software. Dianalisis menggunakan analisis parsimony dengan Distance Method
Tabel 3 Kode primer, sekuen primer, dan suhu penempelan primer mikrosatelit yang digunakan dalam penelitian *
No. Kode Primer
Posisi di
Kromosom Sekuen Primer (5’-3’)
Suhu (°C)
1 mEgCIR0059 4 F TGCAGGGGATGCTTTTATT 51
R CCCTTAATTCCTGCCTTATT
7 mEgCIR 3555 13 F CATCAGAGCCTTCAAACTAC 51
R AGCCTGAATTGCCTCTC
8 mEgCIR 3569 14 F AAGGCTTGGAGTTGAGGTAT 51
R CACCATTGCATCATTATTCC
9 mEgCIR 3519 10 F CCACTGCTTCAAATTTACTAG 51
R GCGTCCAAAACATAAATCAC
10 mEgCIR 0878 11 F CAAAGCAACAAAGCTAGTTAGTA 51
R CAAGCAACCTCCATTTAGAT
11 mEgCIR 3808 8 F CCGCTAACTTGGTATAC 51
R ATTTCCAGCAGCTAATC
12 mEgCIR 0521 15 F GTGACTTTGGGCTGAAT 51
R ACAGCATCTCCAACTCTATC
13 mEgCIR 3886 9 F TTCTAGGGTCTATCAAAGTCATAAG 51
R AGCCACCACCACCATCTACT
14 mEgCIR 3683 2 F GTAGCTTGAACCTGAAA 51
R AGAACCACCGGACTTAC
*
Billotte et al. 2005; Hatorangan et al. 2010; Lampiran 1
Tingkat kekuatan hubungan antara perubahan alel yang terjadi pada tanaman klon yang berasal dari tahap panen embrioid pertama, kedua, dan ketiga dianalisis menggunakan analisis korelasi Pearson. Persentase perubahan alel yang
muncul pada setiap tanaman klon dibandingkan dengan semua alel yang muncul pada tanaman ortet. Setiap pita yang muncul pada tanaman klon diasumsikan sebagai alel yang dimiliki oleh tanaman klon tersebut. Alel-alel tersebut dibandingkan dengan alel yang muncul pada tanaman ortet kelapa sawit Tenera
BAB IV
HASIL DAN PEMBAHASAN
4.1 Hasil Isolasi DNA
Hasil isolasi DNA sampel penelitian menggunakan GenElute menghasilkan pita-pita yang tegas dan murni. DNA genom yang murni atau tidak terdapat kontaminan adalah DNA dapat bermigrasi melalui pori-pori gel agarosa dalam larutan bufer, tidak tertinggal pada sumur dan memperlihatkan pita yang tegas (Gambar 5, Lampiran 2).
Gambar 5 Visualisasi hasil isolasi DNA pada gel agarosa 0.8%. M = marker DNA 1 Kb; 106, 164, 658, 670, 752, 781, dan 934 = nomor sampel.
4.2 Identifikasi Primer
Penanda mikrosatelit digunakan dalam analisis kestabilan genetik ortet kelapa sawit dan klon-klon turunannya karena memiliki sifat polimorfis dan kodominan (Saghai-Maroof et al. 1994). Suatu primer mikrosatelit dikatakan
bersifat polimorfis apabila hasil amplifikasi primer tersebut memiliki pita-pita yang mampu membedakan populasi sampel. Setiap primer mikrosatelit yang digunakan dalam mengamplifiksi DNA sampel mewakili satu lokus tertentu. Pita DNA yang muncul diasumsikan sebagai satu alel dari suatu lokus tersebut. Pola pita DNA mikrosatelit dari sepuluh individu sampel hasil amplifikasi primer
mEgCIR3886 menghasilkan 2 alel yang berbeda ukurannya, yaitu alel berukuran 244 bp dan 217 bp (Gambar 6, Lampiran 3).
Gambar 6 Pola pita DNA mikrosatelit 10 individu sampel hasil elektroforesis QIAxcel dengan amplifikasi primer mEgCIR 3886. 90.6 – 90.9 adalah tanaman klon dari ortet 90; 228.5 tanaman klon ortet 228; 120 tanaman ortet; 120.1-120.4 tanaman klon dari ortet 120; Marker 100 bp.
Skoring dilakukan dengan membandingkan pita-pita yang muncul pada masing-masing individu dan primer. Berdasarkan primer mEgCIR 3886 hasil skoring individu 90.6, 90.7, 90.8, dan 90.9 adalah (1,1), sedangkan individu 228.5, 120, 120.1, 120.2, 120.3, dan 120.4 adalah (1,0) (Gambar 6, Lampiran 4). Penanda mikrosatelit bersifat kodominan sehingga memiliki tingkat heterozigositas yang tinggi, berarti mampu membedakan individu satu dengan yang lain (Park et al. 2009). Tanaman klon 90.5 memiliki 2 alel, yaitu alel berukuran 363 bp dan 373 bp pada lokus mEgCIR3886. Sedangkan tanaman klon 10.6 hanya memiliki 2 alel yang berukuran sama, yaitu 369 bp pada lokus mEgCIR3886 sehingga terlihat sebagai satu alel (Gambar 7, Lampiran 3).
Lokus mEgCIR2414 pada tanaman klon 90.3 tidak menunjukkan adanya
pita yang berhasil diamplifikasi oleh primer mEgCIR2414. Hal tersebut dapat disebabkan oleh kondisi amplifikasi yang kurang optimal atau terjadi perubahan sekuen pada daerah penempelan primer yang menyebabkan primer mEgCIR2414 tidak mengenali daerah tersebut.
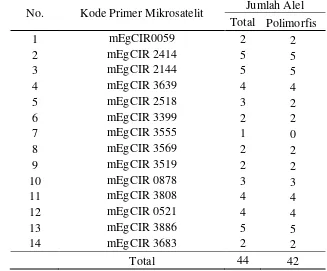
Berdasarkan hasil analisis pola pita DNA mikrosatelit diperoleh total alel 44 dari seluruh sampel penelitian berdasarkan amplifikasi 14 pasang primer mikrosatelit. Setiap primer mikrosatelit menghasilkan 1 sampai 5 alel (Tabel 4). Dari total 14 pasang primer mikrosatelit yang digunakan dalam penelitian, ditemukan hanya sepasang primer (7%) yang monomorfis, yaitu primer mEgCIR
244 bp 217 bp
100 bp
1
3555. Sedangkan 13 pasang primer yang lain (93%) merupakan primer polimorfis. Menurut Zulhermana et al. (2009), primer yang bersifat polimorfis diperlukan untuk menganalisis keragaman genetik populasi dan memperlihatkan keragaman
pola pita DNA yang diperoleh dari hasil amplifikasi primer tersebut.
Gambar 7 Pola pita DNA mikrosatelit 10 individu sampel hasil elektroforesis QIAxcel dengan amplifikasi primer mEgCIR2414. 90.5, 90.4, 90.3, 90.2, 90.1, dan 90.9 adalah tanaman klon dari ortet 90; 10.6, 10.5, 10.4, dan 10.3 adalah tanaman klon dari ortet 10; Marker 400 bp.
Menurut Kaidah et al. (1999), perbedaan tingkat polimorfisme penanda molekular antar tanaman uji disebabkan oleh: (1) perbedaan jumlah dan jenis primer, semakin banyak primer polimorfik yang digunakan dalam analisis maka tingkat polimorfisme yang dihasilkan juga semakin tinggi. Sedangkan jenis primer monomorfik tidak merubah tingkat polimorfisme penanda molecular, (2) jenis dan jumlah populasi tanaman yang diuji. Sehingga pemilihan primer yang dapat menampilkan polimorfisme pita-pita DNA diantara populasi tanaman yang diuji, diperlukan untuk memudahkan interpretasi data.
Polimorfisme yang terjadi dalam populasi dapat disebabkan oleh: (1) perubahan ukuran sekuen DNA yang diamplifikasi sebagai akibat dari insersi atau
delesi, (2) tidak munculnya sekuen DNA, sebagai akibat dari substitusi nukleotida yang mengubah homologi primer dan DNA genom sehingga tidak terjadi amplifikasi (Singh et al. 2007; Setiyo et al. 2001).
4.3 Analisis Kemiripan Genetik antar Ortet
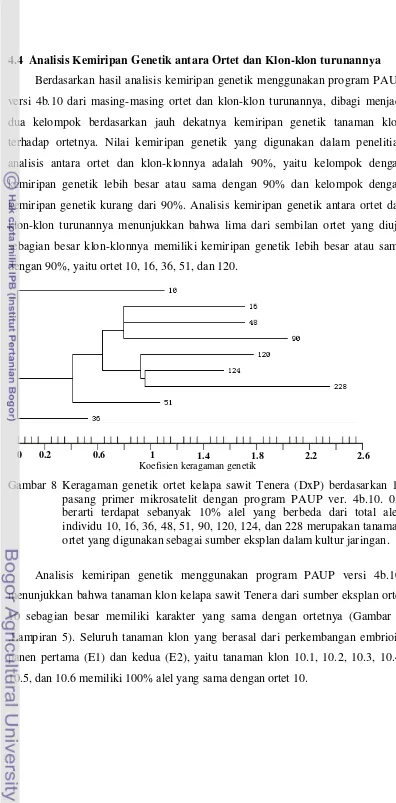
jaringan dilakukan menggunakan program Phylogenetic Analysis of Using Parsimony (PAUP) versi 4b.10 dengan Distance Method (DM). Hasil analisis kemiripan genetik menunjukkan bahwa kesembilan ortet kelapa sawit Tenera
(DxP) yang digunakan sebagai sumber eksplan melalui teknik kultur jaringan merupakan individu dengan jarak genetik yang berbeda (Gambar 8, Lampiran 5). Analisis kemiripan genetik antar ortet dilakukan untuk membuktikan bahwa kesembilan ortet kelapa sawit Tenera (DxP) yang digunakan sebagai sumber
eksplan merupakan progeny yang berbeda. Sehingga analisis kemiripan genetik tanaman klon yang merupakan hasil perbanyakan dari eksplan tanaman ortet melalui kultur jaringan akan dilakukan untuk masing-masing ortet dan klon-klonnya.
Tabel 4 Kode primer mikrosatelit, jumlah alel total, dan alel polimorfis dalam identifikasi mikrosatelit pada semua sampel penelitian
6). Keempat ortet ini meskipun berasal dari persilangan progeni induk betina dan induk jantan dengan kode yang sama, namun keempat ortet tersebut memiliki keragaman genetik yang ditunjukkan dengan jarak pada pohon filogenetik
(Gambar 8, Lampiran 5). Hal tersebut dikarenakan induk betina Dura dan induk jantan Pisifera merupakan anggota populasi dalam kode blok progeny yang sama, sehingga masing-masing induk betina dan induk jantan merupakan individu yang berbeda.
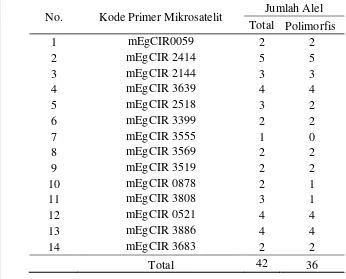
Tabel 5 Kode primer mikrosatelit, jumlah alel total, dan alel polimorfis dari sembilan ortet kelapa sawit
No. Kode Primer Mikrosatelit Jumlah Alel Total Polimorfis
4.4 Analisis Kemiripan Genetik antara Ortet dan Klon-klon turunannya Berdasarkan hasil analisis kemiripan genetik menggunakan program PAUP versi 4b.10 dari masing-masing ortet dan klon-klon turunannya, dibagi menjadi
dua kelompok berdasarkan jauh dekatnya kemiripan genetik tanaman klon terhadap ortetnya. Nilai kemiripan genetik yang digunakan dalam penelitian analisis antara ortet dan klon-klonnya adalah 90%, yaitu kelompok dengan kemiripan genetik lebih besar atau sama dengan 90% dan kelompok dengan
kemiripan genetik kurang dari 90%. Analisis kemiripan genetik antara ortet dan klon-klon turunannya menunjukkan bahwa lima dari sembilan ortet yang diuji, sebagian besar klon-klonnya memiliki kemiripan genetik lebih besar atau sama dengan 90%, yaitu ortet 10, 16, 36, 51, dan 120.
Gambar 8 Keragaman genetik ortet kelapa sawit Tenera (DxP) berdasarkan 14 pasang primer mikrosatelit dengan program PAUP ver. 4b.10. 0,2 berarti terdapat sebanyak 10% alel yang berbeda dari total alel; individu 10, 16, 36, 48, 51, 90, 120, 124, dan 228 merupakan tanaman ortet yang digunakan sebagai sumber eksplan dalam kultur jaringan.
Analisis kemiripan genetik menggunakan program PAUP versi 4b.10, menunjukkan bahwa tanaman klon kelapa sawit Tenera dari sumber eksplan ortet 10 sebagian besar memiliki karakter yang sama dengan ortetnya (Gambar 9 ,Lampiran 5). Seluruh tanaman klon yang berasal dari perkembangan embrioid panen pertama (E1) dan kedua (E2), yaitu tanaman klon 10.1, 10.2, 10.3, 10.4, 10.5, dan 10.6 memiliki 100% alel yang sama dengan ortet 10.
0.2
0 0.6 1 1.4 1.8 2.2 2.6
Tabel 6 Tetua betina Dura dan jantan Pisifera dari Progeny ortet kelapa sawit
Gambar 9 Keragaman genetik kelapa sawit Tenera (DxP) ortet 10 dan klon-klon turunannya berdasarkan 14 pasang primer mikrosatelit dengan program PAUP ver. 4b.10. 0,02 berarti terdapat sebanyak 2% alel yang berbeda dari total alel.
Tanaman klon 10.7, 10.8, dan 10.9 merupakan tanaman klon yang berasal dari perkembangan embrioid panen ketiga. Hanya tanaman klon 10.8 yang memiliki jarak genetik terhadap tanaman ortet 10, yaitu sebesar 0,02 yang berarti terdapat 2% alel yang berbeda dibandingkan alel-alel yang muncul pada tanaman ortet 10. Embrioid panen ketiga (E3) merupakan embrioid yang muncul setelah beberapa kali proses subkultur pada tahap embriogenesis dari embryoid line yang sama. Hal tersebut sesuai dengan Wattimena dan Mattjik (1992) yang menyatakan
0.02
0 0.06 0.1 0.14 0.18 0.22 0.26
bahwa keragaman genetik dalam kultur jaringan dapat disebabkan oleh fase tak berdiferensiasi yang lama. Semakin lama waktu yang dibutuhkan eksplan dalam media kultur dapat menyebabkan terjadinya perubahan genetik pada tanaman.
Kelapa sawit Tenera (DxP) ortet 16 memiliki sebagian besar tanaman klon identik dengan ortetnya, sehingga dimasukkan ke dalam kelompok ortet dengan kemiripan genetik lebih besar dari 90%. Dibandingkan dengan ketiga tanaman klon yang merupakan perkembangan dari embrioid panen kedua (16.4; 16.5; dan
16.6), hanya tanaman klon 16.4 memiliki jarak genetik 0,3 yang berarti bahwa tanaman klon ini memiliki perbedaan alel sebanyak 30% dari total alel pada ke-14 lokus mikrosatelit yang diamati (Gambar 10, Lampiran 5). Sedangkan kedua tanaman klon yang lain, yaitu tanaman klon 16.5 dan 16.6 identik dengan ortet 16.
Gambar 10 Keragaman genetik kelapa sawit Tenera (DxP) ortet 16 dan klon-klon turunannya berdasarkan 14 pasang primer mikrosatelit dengan program PAUP ver. 4b.10. 0,02 berarti terdapat sebanyak 2% alel yang berbeda dari total alel.
Tanaman klon yang merupakan perkembangan dari embrioid panen ketiga, yaitu 16.7, 16.8 dan 16.9 memiliki jarak genetik yang lebih dekat dengan tanaman ortet 16. Tanaman klon 16.8 dan 16.9 memiliki perbedaan alel sebesar 2% dari
0.02 0.26
Koefisien keragaman genetik
total alel yang diperoleh pada ke-14 lokus mikrosatelit yang diamati, sedangkan tanaman klon 16.7 identik terhadap tanaman ortet 16.
Berdasarkan kasus dari tiga tanaman klon yang merupakan perkembangan
dari eksplan tanaman ortet 16, yaitu tanaman klon 16.4, 16.8 dan 16.9 menunjukkan bahwa perubahan genetik terjadi pada tanaman klon yang berkembang dari embrioid panen kedua (E2) dan ketiga (E3). Perbedaan alel pada tanaman klon 16.4 (30%) lebih banyak dibandingkan tanaman klon 16.8 dan 16.9
(2%). Hal tersebut tidak sesuai dengan Wattimena dan Mattjik (1992), yang menyatakan bahwa semakin lama waktu yang diperlukan eksplan untuk membentuk embrioid pada media kultur berpengaruh terhadap perubahan genetik tanaman klon.
Menurut Gunawan (1992), pembelahan sel tidak terjadi pada semua sel dalam jaringan asal tetapi hanya sel-sel di lapisan tepi. Kalus yang berkembang dari satu eksplan akan menghasilkan kalus yang seragam. Lebih lanjut dikengemukakan bahwa eksplan batang, akar, dan daun dapat menghasilkan kalus yang heterogenous. Pada tembakau, jaringan dengan histologi yang seragam menghasilkan kalus dengan sel yang memiliki level ploidi yang berbeda. Corley dan Tinker (2003), menambahkan faktor genotipe eksplan sebagai salah satu penyebab terjadinya keragaman genetik klon-klon hasil perbanyakan dengan teknik kultur jaringan. Pada tanaman klon 16.4, 16.8, dan 16.9 diduga munculnya keragaman karena pengaruh dari faktor genotipe eksplan.
Hasil analisis kemiripan genetik ortet kelapa sawit dan klon-klon turunannya berdasarkan 14 pasang primer mikrosatelit, menemukan empat dari sembilan
tanaman ortet kelapa sawit Tenera (DxP) yang klon-klonnya memiliki kemiripan genetik kurang dari 90%, yaitu kelapa sawit ortet 48, 90, 124, dan 228.
11, Lampiran 5). Tanaman klon yang dihasilkan dari perkembangan embrioid panen pertama (90.1) dan tanaman klon yang dihasilkan dari perkembangan embrioid panen kedua (90.4 dan 90.6) memiliki jarak genetik yang sama. Hal ini
menunjukkan bahwa ketiga tanaman klon, yaitu 90.1, 90.4, dan 90.6 memiliki karakter yang sama berdasarkan 14 pasang primer mikrosatelit yang digunakan sebagai alat analisis.
Gambar 11 Keragaman genetik kelapa sawit Tenera (DxP) ortet 90 dan klon-klon turunannya berdasarkan 14 pasang primer mikrosatelit dengan program PAUP ver. 4b.10. 0,02 berarti terdapat sebanyak 2% alel yang berbeda dari total alel.
Analisis kemiripan genetik menggunakan program PAUP versi 4b.10 berdasarkan 14 pasang primer mikrosatelit, diketahui bahwa tanaman kelapa sawit
Tenera (DxP) ortet 228 memiliki tanaman klon yang paling beragam. Seluruh tanaman klon yang merupakan hasil perkembangan embrioid panen pertama (E1), kedua (E2), dan ketiga (E3) dari kelapa sawit Tenera (DxP) ortet 228 tidak ditemukan tanaman klon yang memiliki jarak genetik yang sama. Hanya tanaman klon 228.7 yang identik dengan tanaman ortet 228 (Gambar 12, Lampiran 5).
Perbanyakan tanaman melalui teknik kultur jaringan berpotensi menghasilkan tanaman klon yang identik dengan ortetnya dengan cara menginduksi embriogenesis sel somatik dari eksplan. Embrioid yang berasal dari perkembangan eksplan yang sama seharusnya memiliki sifat genotipe yang sama
Koefisien keragaman genetik
0.02 0.26
pula, namun pada kenyataannya terdapat keragaman genetik antar tanaman klon yang berasal dari perkembangan embrioid dengan periode panen yang berbeda.
Pada kasus yang terjadi pada penelitian ini, keragaman genetik yang terjadi
diperkiraan sebagai akibat dari faktor genetik eksplan. Sifat genetik tanaman yang digunakan sebagai sumber eksplan memiliki respon yang berbeda terhadap pemberian zat pengatur tumbuh yang sama. Respon tersebut berhubungan dengan adanya bagian eksplan yang bersentuhan langsung dan tidak bersentuhan
langsung dengan media kultur. Menurut George dan Sherrington (1984), faktor yang mempengaruhi pertumbuhan selama proses kultur jaringan, yaitu (1) genotipe, yang berhubungan dengan sifat genetik tanaman, (2) substrat, meliputi media kultur dan komposisi zat pengatur tumbuh, (3) lingkungan kultur, dan (4) eksplan.
Gambar 12 Keragaman genetik kelapa sawit Tenera (DxP) ortet 228 dan klon-klon turunannya berdasarkan 14 pasang primer mikrosatelit dengan program PAUP ver. 4b.10. 0,02 berarti terdapat sebanyak 2% alel yang berbeda dari total alel.
Analisis kemiripan genetik tanaman klon kelapa sawit terhadap ortetnya dilakukan sebagai deteksi awal terjadinya variasi somaklonal dalam proses kultur jaringan kelapa sawit. Perubahan sekuen mikrosatelit yang ditemukan pada tanaman klon kelapa sawit berupa perbedaan ukuran alel, muncul tidaknya alel
0,02
Koefisien keragaman genetik
0.26
dibandingkan sekuen mikrosatelit pada tanaman ortet diasumsikan berpotensi terhadap terjadinya variasi somaklonal.
Yunita (2009) mengemukakan bahwa kasus variasi somatik yang terjadi
dalam kultur jaringan, dipengaruhi oleh keadaan sel itu sendiri. Sel yang mengalami perubahan genetik akan membelah dan membentuk sekumpulan sel yang berbeda dengan induknya. Selanjutnya membentuk klon baru yang berbeda induknya.
Berdasarkan hasil analisis kemiripan genetik yang telah dilakukan terhadap sembilan tanaman ortet dan klon-klonnya, menemukan bahwa keragaman genetik pada tanaman klon sebagian besar dipengaruhi oleh genotipe ortet. Beberapa ortet menunjukkan adanya kemiripan genetik yang tinggi pada tanaman klon, seperti pada tanaman ortet 10, 16, 36, 51, dan 120.
Menurut Hutami et al. (2006), keragaman genetik merupakan faktor penting dalam pemuliaan tanaman untuk merakit varietas baru misalnya, varietas dengan peningkatan ketahanan terhadap kondisi abiotik. Kondisi tersebut berbeda dengan harapan penyedia bibit. Pada industri penyedia bibit kelapa sawit, keragaman genetik yang muncul melalui proses kultur jaringan perlu diminimalkan karena tuntutan true-to-type yang merupakan salah satu kontrol kualitas mutu bibit yang diproduksi.
4.5 Korelasi antara Tahap Panen Embrioid terhadap Kestabilan Alel
Analisis korelasi dilakukan untuk menyatakan besarnya pengaruh perbedaan tahap panen embrioid terhadap kestabilan alel tanaman klon. Hubungan antara
tahap panen embrioid dengan kestabilan alel tanaman klon dianalisis dengan membandingkan alel DNA tanaman klon dan ortet kelapa sawit Tenera (DxP) pada 14 lokus mikrosatelit yang digunakan dalam penelitian (Tabel 7).
tersebut menjelaskan bahwa hubungan kedua variabel tersebut sangat lemah (Wibisono 2009). Penelitian ini menjelaskan pengaruh subkultur berulang dan lama waktu eksplan dalam media kultur memiliki pengaruh yang kecil terhadap
kestabilan genetik. Salah satu penyebab terjadinya ketidakstabilan genetik pada tanaman klon kelapa sawit adalah perbedaan genotipe sumber eksplan yang mempengaruhi perbedaan respon terhadap kondisi kultur.
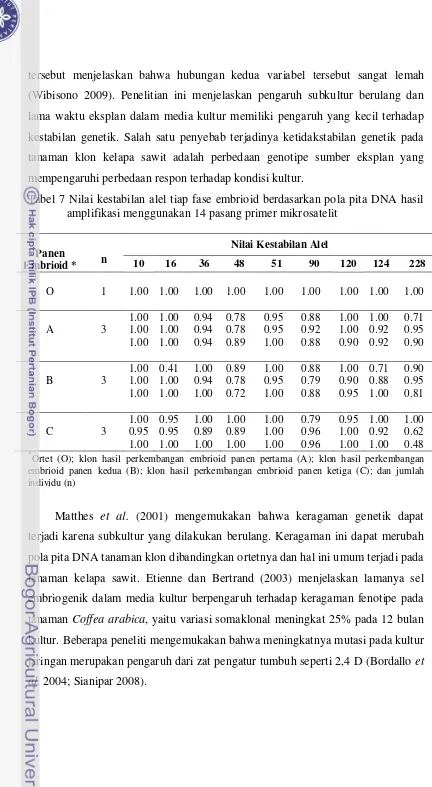
Tabel 7 Nilai kestabilan alel tiap fase embrioid berdasarkan pola pita DNA hasil amplifikasi menggunakan 14 pasang primer mikrosatelit
terjadi karena subkultur yang dilakukan berulang. Keragaman ini dapat merubah pola pita DNA tanaman klon dibandingkan ortetnya dan hal ini umum terjadi pada tanaman kelapa sawit. Etienne dan Bertrand (2003) menjelaskan lamanya sel embriogenik dalam media kultur berpengaruh terhadap keragaman fenotipe pada tanaman Coffea arabica, yaitu variasi somaklonal meningkat 25% pada 12 bulan kultur. Beberapa peneliti mengemukakan bahwa meningkatnya mutasi pada kultur
Menurut Singh et al. (2007), perubahan genetik yang terjadi dapat berupa mutasi titik, insersi, delesi, dan insersi yang merubah ukuran DNA target. Pada penelitian ini, perubahan genetik yang terjadi belum dapat diketahui.
Terdapat 4 ortet yang memiliki klon-klon dengan perubahan alel yang stabil pada ketiga tahap panen embrioid, yaitu ortet 10, 36, 51, dan 120. Ortet 10 memiliki kestabilan genetik yang tinggi, klon-klon yang berkembang dari hasil embrioid panen pertama dan kedua memiliki alel-alel yang sama dengan ortetnya
dengan nilai kestabilan 1, dan pada klon-klon yang berkembang dari embrioid panen ketiga dengan nilai kestabilan 0.98. Demikian pula yang ditemukan pada ortet 36, 51, dan 120. Alel-alel yang muncul pada klon-klon hasil perkembangan dari embrioid panen pertama hingga ketiga, memiliki nilai kestabilan lebih atau sama dengan 0.95.
Kestabilan genetik nampaknya merupakan kunci yang harus dapat dipertahankan bagi industri produksi bibit kelapa sawit komersial dengan teknik kultur jaringan. Marum et al. (2009) menemukan adanya variasi genetik yang terjadi pada tujuh lokus mikrosatelit tanaman Pinus panaster selama embriogenesis somatik.
Perubahan fenotipik yang terlihat pada tingkat morfologi diperkirakan berhubungan dengan perubahan genetik, seperti keragaman genetik yang terdeteksi pada lokus mikrosatelit dalam penelitian ini. Penelitian lanjutan diperlukan untuk memperkuat atau menyangkal hubungan tersebut. Kemungkinan lain yang terjadi adalah pengaruh faktor epigenetik, atau kombinasi perubahan genetik dan epigenetik. Faktor epigenetik dapat mencakup perubahan reversibel
dalam metilasi DNA protein histon yang terjadi selama embriogenesis somatik (Karami et al 2009).
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Berdasarkan hasil analisis dan pembahasan dapat disimpulkan bahwa: 5.2.1 Sembilan ortet kelapa sawit Tenera (DxP) yang digunakan sebagai sumber
eksplan dalam perbanyakan bibit kelapa sawit dengan teknik kultur jaringan, merupakan individu berbeda dengan jarak genetik yang berbeda pula.
5.2.2 Lima dari sembilan ortet kelapa sawit progeny 10 (CCPT01-1396), 16 1399), 36 658), 51 670), dan 120 (CCPT01-752) memiliki tanaman klon dengan kemiripan genetik lebih atau sama dengan 90%.
5.2.3 Kestabilan genetik antara klon-klon turunan kelapa sawit hasil perbanyakan dengan kultur jaringan dari sembilan ortet yang berbeda dipengaruhi oleh genotipe ortet. Semakin lama waktu yang diperlukan untuk menghasilkan
embrioid memiliki korelasi yang lemah terhadap ketidakstabilan genetik tanaman klon-klon turunannya dengan nilai korelasi -0,11. Berdasarkan hasil analisis kestabilan genetik antara ortet dan klon-klon turunannya, diperoleh 4 progeny ortet dengan kestabilan genetik yang tinggi yaitu: 10 1396), 36 658), 51 670), 120 (CCPT01-752).
5.2 Saran
Berdasarkan hasil penelitian, maka diperlukan:
5.2.1 Penelitian lebih lanjut menggunakan jumlah tanaman klon dan primer mikrosatelit yang lebih banyak untuk menguji kestabilan genetik.
5.2.2 Pengujian terhadap pengaruh lamanya waktu memperoleh embrioid dengan kestabilan genetik dapat dilakukan dengan membedakan jumlah subkultur. 5.2.3 Progeny ortet yang memiliki kestabilan genetik tinggi dapat digunakan
DAFTAR PUSTAKA
Bairu MW, Aremu AO, Staden JV. 2011. Somaclonal variation in plants: causes and detection methods. Plant Growth Regul 63:147-173
Becker D, Hedrich R. Channelling auxin action: modulation of ion transport by indole-3-acetic acid. Plant Mol Biol 49:349-356
Bernatavichute YV, Zhang X, Cokus S, Pellegrini M, Jacobsen SE. 2008. Genome wide association of Histone H3 Lysine Nine Methylation with CHG DNA Methylation in Arabidopsis thaliana. PlosOne 3(9):e3156
Billotte N et al. 2001. Development, characterization and across-taxa utility of oil palm (Elaeis guineensis Jacq.) microsattelite markers. Genome 44:413-435
Billotte N et al. 2005. Microsatellite-based high density linkage map in oil palm (Elaeis guineensis Jacq.). Theor Appl Genet 110: 754-765.
Bordallo PN, Silva DH, Maria J, Cruz CD, Fontes EP. 2004. Somaclonal variation on in vitro callus culture potato cultivars. Hortic Bras 22(2):300-304
Chawla HS. 2002. Introduction to Plant Biotechnology. 2nd edition. New Hampshire: Science Publishers, Inc
Cheah SC, Ooi LCL, Rahimah AR. 1995. Polymorphic DNA in oil palm amplified by simple sequence repeat (SSR) primed polymerase chain reactions. Prosiding Seminar Bioteknologi Kebangsaan ke VII; Langkawi Island, Malaysia, 20-22 November 1995.
Corley RHV, Lee CH, Law LH, Wong CY. 1986. Abnormal flower development in oil palm clones. Planter 62(1):233-240.
Corley RHV, Tinker PB. 2003. The Oil Palm. Ed ke-4. USA: Blackwell Science Ltd.
Etienne H, Bertrand B. 2003. Somaclonal variation in Coffea arabica: effects of genotype and embryogenic cell suspension age on frequency and phenotype of variants. Tree Physiol 23:419–426
George EF, Sherrington PD. 1984. Plant propagation by tissue culture. England: Exegetics Ltd.
Harrison CJ, Langdale JA. 2006. Techniques for molecular analysis. A step by step guide to phylogeny reconstruction.J The Plant 45:561-572
Hartley CWS. 1977. The oil palm (Elaeis guineensis Jacq.). New York:Longman and Scientific Technical
Hatorangan MR, Kusnandar AS, Toruan-Mathius N. 2010. Sidik jari DNA kelapa sawit dengan menggunakan marka mikrosatelit. Ann Prog Rep. Plant Production and Biotecnology Div. PT SMART Tbk.
Hutami S, Mariska I, Supriati Y. 2006. Peningkatan keragaman genetik tanaman melalui keragaman somaklonal. J AgroBiogen 2(2):81-88
Jain SM. 2001. Tissue culture-derived variation in crop improvement. Euphytica
118:153−156.
Jaligot E, Rival E, Beulé T, Dussert S, Verdeil JL. 2000. Somaclonal variation in oil palm (Elaeis guineensis Jacq.): the DNA methylation hypothesis. Plant Cell Rep 19:684–690.
Jullien PE, Berger F. 2010. Parental genome dosage imbalance deregulates imprinting in Arabidopsis. PlosGenet 6(3):1000885.
Kaidah S, Sudarsono, Ilyas S, Toruan-Mathius N. 1999. Analisis keragaman genetik tanaman salak (Salacca sp) Indonesia dengan teknik Random
Amplified Polymorphic DNA (RAPD) [Tesis]. Bogor:Program
Pascasarjana, Institut Pertanian Bogor.
Karami O, Aghavaisi B, Pour AM. 2009. Molecular aspects of somatic to embryogenic transition in plants. J Chem Biol 2:177–190.
Larkin PJ, Scowcroft WR. 1981. Somaclonal variation: a new source of variability from cell cultures for plant improvement. Theor Appl Genet 60:197–214. Latiff A. 2000. The biology of the genus Elaeis. In “Advances in oil palm
research vol 1”. Malaysian Palm Oil Board pp.119 – 38.
Marum L, Rocheta M, Maroco J, Oliveira M, Migue C. 2009. Analisis of genetic stability at SSR loci during somatic embryogenesis in maritime pine (Pinus pinaster). Plant Cell Rep 28:673–682