APLIKASI MARKA MOLEKULER DALAM SELEKSI
POPULASI SILANG BALIK IR64/HAWARA BUNAR UNTUK
MENDAPATKAN GALUR PADI TOLERAN ALUMINIUM
ANDIK WIJAYANTO
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Aplikasi Marka Molekuler dalam Seleksi Populasi Silang Balik IR64/Hawara Bunar untuk Mendapatkan Galur Padi Toleran Aluminium adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
RINGKASAN
ANDIK WIJAYANTO. Aplikasi Marka Molekuler dalam Seleksi Populasi Silang Balik IR64/Hawara Bunar untuk Mendapatkan Galur Padi Toleran Aluminium. Dibimbing oleh MIFTAHUDIN dan DWINITA WIKAN UTAMI.
Pada periode antara tahun 1971 sampai 2012, peningkatan kebutuhan pangan terutama padi (181.6%) jauh lebih besar daripada peningkatan jumlah penduduk Indonesia (108%), sehingga diperlukan usaha peningkatan produksi padi yang berkelanjutan. Peningkatan kebutuhan terhadap padi ini tidak seiring dengan kemampuan penyediaan lahan pertanian yang cenderung menurun dari tahun ke tahun karena terjadi alih fungsi lahan produktif menjadi kawasan industri dan pemukiman sehingga memaksa penggunaan lahan-lahan marginal seperti lahan kering masam untuk usaha pertanian termasuk budidaya padi. Namun perluasan lahan pertanian ke lahan kering masam tersebut mengalami hambatan utama yaitu tingkat kelarutan aluminium (Al) yang tinggi yang merupakan faktor pembatas utama produksi padi di tanah masam, sehingga diperlukan penggunaan varietas padi yang toleran terhadap cekaman Al dan mempunyai produktivitas yang tinggi.
Di Indonesia, terdapat genotipe padi lokal yang toleran terhadap cekaman Al seperti varietas Hawara Bunar tetapi produktivitasnya tidak seunggul varietas IR64. Oleh sebab itu, perlu dilakukan silang balik antara padi var. IR64/Hawara Bunar dengan IR64 sebagai tetua pemulih (recurrent parent) untuk mendapatkan sifat-sifat unggul seperti IR64 tetapi toleran terhadap cekaman Al. Penelitian sebelumnya, Miftahudin et al. (2008) dan Akhmad (2009), telah memperoleh populasi BC2F1 hasil silang balik padi var. IR64/Hawara Bunar dan peta genetik tentatif QTL toleran Al pada posisi antara marka RM489 dan RM517 pada kromosom 3.
Penelitian ini bertujuan untuk (1) meningkatkan kerapatan marka molekuler pada daerah Quantitative Trait Loci (QTL) untuk sifat toleransi terhadap cekaman Al pada kromosom 3 padi yang diapit oleh dua marka SSR RM489 dan RM517, (2) mengidentifikasi kembali keberadaan QTL untuk sifat toleransi Al pada daerah tersebut, (3) dan menggunakan marka molekular untuk seleksi populasi silang balik IR64/Hawara Bunar untuk mendapatkan galur padi yang toleran Al dan memiliki sifat agronomis yang unggul.
Penelitian dilakukan mulai September 2009-Mei 2012 di Laboratorium Fisiologi dan Biologi Molekuler Tumbuhan, Departemen Biologi, IPB dan di Balai Penelitian Bioteknologi dan Sumberdaya Genetik Pertanian (Biogen) Bogor. Populasi BC2F1 yang telah dihasilkan pada penelitian sebelumnya, diseleksi berdasarkan karakter fisiologi dan agronomi serta konstitusi alel dari marka foreground maupun background, ditanam, dan dianalisis hingga mendapatkan individu BC2F3 yang toleran terhadap cekaman Al dan mempunyai sifat agronomis yang unggul.
RM14535, RM14543, dan RM14552; serta mengidentifikasi kembali keberadaan QTL untuk sifat toleransi Al pada daerah tersebut. Hasil penelitian menunjukkan bahwa terdeteksi QTL untuk sifat toleransi tanaman terhadap cekaman Al berdasarkan karakter Pertambahan Panjang Akar (PPA) di daerah antara marka RM2790 dan RM14552 pada lengan pendek kromosom 3 padi (LOD 3.4) dengan puncak ada pada posisi di antara marka RM2790 dan RM545.
Dengan menggunakan pendekatan Marker Assisted Backcross Selection (MABS), seleksi foreground dan background dari populasi silang balik telah berhasil mendapatkan dua individu padi BC2F3 yang toleran Al dan memiliki sifat agronomis yang unggul yaitu galur 175-63-34 dan -119.
SUMMARY
ANDIK WIJAYANTO. Molecular Marker Application on Selection of A Rice Backcross Population derived from a Cross between IR64/Hawara Bunar to Obtain Aluminum-Tolerant Rice Lines. Supervised by MIFTAHUDIN and DWINITA WIKAN UTAMI.
Since 1971 the increase of food demand in Indonesia, especially rice is much greater (181.6%) than the increase of population (108%), therefore an effort to increase rice production is unavoidable. Currently, the ability of agricultural land to provide area for rice cultivation tends to decline from year to year due to massive conversion of productive lands into industrial and residential uses. The situation leads to expand rice cultivation into the utilization of marginal lands, such as acid soils for rice cultivation. However, rice cultivation in acid soils will face many constraints, which mainly due to the aluminum (Al) toxicity. The use of Al-tolerant rice varieties with high productivity will be an alternative solution to overcome the Al toxicity problem in acid soils.
There is an Indonesian local rice genotype named Hawara Bunar that tolerant to Al stress and can be used as a Al-tolerant donor parent in rice breeding program. However, the potential productivity of the genotype is not as high as rice cv IR64. The use of a backcross population derived from a cross between both genotypes with cv IR64 as a recurrent parent is an approach to develop Al-tolerant rice cultivar with high productivity. It has been identified that a Quantitative Trait Loci (QTL) for Al-tolerance trait is located on the short arm of rice chromosome 3 flanked by markers RM489 and RM517 (Miftahudin et al. 2008; Akhmad 2009).
The objectives of the study were to (1) increase molecular markers density in the area of QTL for Al-tolerance trait on rice chromosome 3 flanked by two SSR markers RM489 and RM517, (2) re-identify QTLs for Al tolerance trait in the previous Al-tolerance QTL area on rice chromosome 3, (3) and carry out marker assisted backcross selection (MABS) ob a rice backcross population derived from a cross between IR64/Hawara Bunar to obtain Al-tolerant rice lines with superior agronomic traits.
The research was conducted from September 2009 to May 2012 at the Laboratory of Plant Physiology and Molecular Biology, Department of Biology, Bogor Agricultural University and at the Research Institute for Agricultural Biotechnology and Genetic Resources (Biogen) Bogor. An F2 population derived from a cross between rice cv IR64 and Hawara Bunar were used to increase marker density and re-identify Al-tolerance QTL, while BC2F1 plants and BC2F2 populations that have been developed from the previous and this studies, respectively, were selected through MABS combined with physiological and agronomic characters based selection.
were identified in the previous QTL location between markers RM2790 and RM14552 (LOD 3.4) based on the Main Root Elongation characters.
Foreground and background selections were successfully carried out on BC2F1, BC2F2 and BC2F3 populations using five foreground and 50 background SSR markers. The MABS obtained two BC2F3 rice lines (number 175-63-34 and 175-63-119) carrying 90% background alleles from the recurrent parent. Both lines were tolerant to Al stress and showed good agronomic characters. However, those lines need to be further evaluated in acid soils to verify that those lines are true Al-tolerant lines that can be used to develop Al-tolerant rice variety.
© Hak Cipta Milik IPB, Tahun 2013
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Biologi Tumbuhan
APLIKASI MARKA MOLEKULER DALAM SELEKSI
POPULASI SILANG BALIK IR64/HAWARA BUNAR UNTUK
MENDAPATKAN GALUR PADI TOLERAN ALUMINIUM
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2013
Judul Tesis : Aplikasi Marka Molekuler dalam Seleksi Populasi Silang Balik IR64/Hawara Bunar untuk Mendapatkan Galur Padi Toleran Aluminium
Nama : Andik Wijayanto NIM : G353090261
Disetujui oleh Komisi Pembimbing
Dr Ir Miftahudin, MSi Ketua
Dr Dwinita W Utami, MSi Anggota
Diketahui oleh
Ketua Program Studi Biologi Tumbuhan
Dr Ir Miftahudin, MSi
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Alhamdulillah, segala puji bagi Allah. Tiada sekutu bagi-Nya. Dia-lah yang maha berkehendak atas segala sesuatu. Sholawat dan salam kepada hamba dan utusan-Nya, Muhammad SAW, penutup para nabi dan rasul. Penelitian ini dilaksanakan dari bulan September 2009 sampai Mei 2012 dengan judul Aplikasi Marka Molekuler dalam Seleksi Populasi Silang Balik IR64/Hawara Bunar untuk Mendapatkan Galur Padi Toleran Aluminium.
Penulis menyampaikan terima kasih kepada:
1. Keluarga tercinta yang telah memberikan doa, semangat, dan pengorbanannya selama ini: Ayahanda Drs Soetjipto dan Dwi Irianto SPd, Ibunda Harni Suprihatin dan Sudarmini SPd, istri dr. Megawati Dharma Iriani, kakak Nita Purwanishiwi SH beserta suami Fary Setiawan SH, dan adik Putri Dwi Novitasari.
2. Dr Ir Miftahudin, MSi dan Dr Dwinita Wikan Utami, MSi. yang telah membimbing dan memberikan kesempatan ikut serta dalam Proyek Penelitian Kerjasama Kemitraan Penelitian Pertanian dengan Perguruan Tinggi (KKP3T) Departemen Kementrian Pertanian tahun anggaran 2009 - 2010. 3. Dr Ir Ida Hanarida Somantri, MS selaku penguji yang telah memberikan
saran dan kritik serta bantuan penanaman padi di rumah kaca Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumberdaya Genetik Pertanian Bogor.
4. Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumberdaya Genetik Pertanian Bogor yang telah memberikan fasilitas untuk menunjang pelaksanaan penelitian beserta Ibu Yuri, SSi dan Bapak Iman yang telah membantu penelitian ini.
5. Rekan-rekan di laboratorium Fisiologi dan Biologi Molekuler Tumbuhan IPB: Dr Dewi Indriyani Roslim MSi, Akhmad MSi, Hariyanto MSi, Arief Pambudi MSi, Dedy Suryadi MSi, Turati MSi, Syasti Hastriani, dan rekan-rekan lain yang tidak dapat disebutkan satu per satu.
6. Dan teman-teman di mayor Biologi Tumbuhan Pascasarjana IPB tahun angkatan 2009 yang terus memberikan semangat.
Semoga karya ilmiah ini bermanfaat. Mohon maaf atas segala kekurangan.
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vii
PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
Manfaat Penelitian 2
Ruang Lingkup Penelitian 2
TINJAUAN PUSTAKA 3
Tanah Masam dan Toksisitas Aluminium 3
Mekanisme Toleransi Tanaman terhadap Cekaman Aluminium 5
Botani Padi 6
Silang Balik dan Marker Assisted Backcross Selection (MABS) 9 Pemanfaatan Marka Molekuler Simple Sequence Repeats (SSR) dalam
Proses Seleksi Pemuliaan Tanaman 10
METODE 12
Bagan Alir Penelitian 12
Bahan 12
Pembentukan Populasi BC2F2 dan BC2F3 13
Perlakuan Cekaman Al 13
Analisis Pertambahan Panjang Akar (PPA) dan Root Re-Growth (RRG) 13
Analisis Marka Molekuler 14
Pengamatan Karakter Morfologi dan Agronomi 15
Prosedur Analisis Data 15
HASIL DAN PEMBAHASAN 15
Hasil 15
Pembahasan 23
SIMPULAN DAN SARAN 34
Simpulan 34
Saran 34
DAFTAR PUSTAKA 34
LAMPIRAN 45
DAFTAR TABEL
1 Karakteristik O. sativa ssp. indica, ssp. japonica, dan ssp. javanica 8 2 Pola genotipe individu rekombinan BC2F1 dengan seleksi empat marka 18 3 Pola genotipe individu rekombinan BC2F1 dengan seleksi enam marka 18 4 Nilai statistik sifat toleransi cekaman Al berdasarkan karakter PPA dan
RRG pada populasi BC2F2 19
5 Nomor individu terpilih BC2F2 beserta nilai RRG dan konfigurasinya 22 6 Perbandingan karateristik individu padi BC2F3 175-63-34 dan -119
dengan tetua IR64 dan Hawara Bunar 30
DAFTAR GAMBAR
1 Tahapan seleksi menggunakan MABS, target lokus ada di kromosom 4. Seleksi foreground, seleksi rekombinan, seleksi background 10 2 Bagian alur kerja dalam penelitian aplikasi marka molekuler pada
populasi silang balik IR64/Hawara Bunar 12
3 Contoh hasil survei polimorfisme marka SSR berdasarkan analisis PCR pada tanaman tetua (HB: Hawara Bunar, IR: IR64) dan tanaman F1 turunannya menggunakan marka SSR: RM19, RM252, RM278, dan
RM556 16
4 Contoh elektroforesis hasil PCR marka SSR RM14543 dan RM14552 pada gel agarose SFR 3% dalam buffer TBE 1x pada populasi F2 17 5 Posisi QTL untuk karakater PPA sebagai parameter toleransi Al pada
populasi F2 hasil persilangan tetua padi var. IR64 x var. Hawara Bunar 17 6 Contoh elektroforesis hasil PCR marka SSR RM14535, RM14543, dan
RM14552 pada gel agarose SFR 3% dalam buffer TBE 1x pada
populasi BC2F1. 18
7 Distribusi nilai PPA dan RRG pada populasi BC2F2 175 dan 180 20 8 Contoh elektroforesis hasil PCR marka SSR : RM14535, RM14543 dan
RM14552 pada gel agarose SFR 3% dalam buffer TBE 1x pada
populasi BC2F2 175 21
9 Contoh elektroforesis hasil amplifikasi DNA populasi BC2F3 175-63 dengan primer RM14543 pada suhu annealing 550C 24 10 Contoh elektroforesis hasil amplifikasi DNA tanaman BC2F2 175-63
dengan beberapa primer background 25
11 Konstitusi background galur BC2F2 175-63 26 12 Contoh elektroforesis hasil amplifikasi DNA populasi BC2F3 175-63
DAFTAR LAMPIRAN
1 Diskripsi padi varietas IR64 45
2 Beberapa karakter padi varietas lokal Hawara Bunar 46
3 Komposisi larutan hara minimum 47
4 Primer-primer SSR yang digunakan untuk seleksi foreground dan
background 48
5 Karakter fisiologi, agronomi, dan introgresi marka foreground dan
background BC2F3 175-63 65
6 Marka-marka atau gen- gen pada kromosom 1, 3, 5, dan 6 pada padi 75 7 Genotipe individu rekombinan BC2F1 dengan seleksi empat marka 76
8 Seleksi foreground BC2 F2175 78
9 Seleksi foreground BC2 F2180 79
10 Distribusi nilai PPA, RRG dan Akar Samping pada populasi BC2F3
175-63 80
11 Distribusi nilai karakter agronomi tinggi tanaman vegetatif, jumlah anakan vegetatif, rata-rata panjang malai, jumlah malai, total biji isi, dan total bobot biji isi pada populasi BC2F3 175-63 81 12 Hasil elektroforesis 50 marka background dengan DNA tanaman BC2F2
175-63 83
13 Hasil elektroforesis marka background RM130 dan RM168 dengan
1
PENDAHULUAN
Latar Belakang
Jumlah penduduk di Indonesia terus meningkat dari tahun ke tahun. Pada bulan Juli 2012 jumlah penduduk Indonesia sebesar 248.216.193 orang, meningkat 129.007.964 orang atau sekitar 108 % dari jumlah penduduk tahun 1971 (CIA 2012). Peningkatan jumlah penduduk ini diiringi dengan peningkatan kebutuhan pangan terutama padi yang jauh lebih besar dari kebutuhan pangan pada periode yang sama, yaitu sebesar 181.6% (USDA 2012a), sehingga diperlukan usaha peningkatan produksi padi yang berkelanjutan.
Kemampuan lahan pertanian di Indonesia dalam menyediakan beras cenderung menurun dari tahun ke tahun, selain karena area persawahan yang sempit yaitu 7.469.796 ha (USDA 2012b) atau sekitar 6.4% dari total luas Indonesia, juga dikarenakan terjadi alih fungsi lahan produktif menjadi kawasan industri dan pemukiman sehingga memaksa penggunaan lahan-lahan marginal untuk usaha pertanian termasuk budidaya padi, termasuk lahan kering masam dengan luas lahan 102.8 ha (Mulyani et al. 2009) atau sekitar 54.6% dari total luas lahan di Indonesia. Namun perluasan lahan pertanian ke lahan kering masam ini mengalami kendala utama yaitu tingkat kelarutan Al yang tinggi, kadar hara makro dan mikro yang tidak mencukupi kebutuhan tanaman, dan kandungan bahan organik yang rendah (Roesmarkam et al. 1992; Sanchez 1992). Pada tanah-tanah masam seperti tanah-tanah Podsolik Merah Kuning, bentuk Al3+ merupakan bentuk yang paling dominan dan sangat beracun bagi akar tanaman sehingga pertumbuhan akar dan tajuk terhambat, akar pendek, tebal dan menggulung, tudung akar rusak dan berwarna merah kecokelatan, yang pada akhirnya sistem perakaran rusak dan penyerapan hara oleh tanaman terganggu (Delhaize dan Ryan 1995; Ma et al. 2005). Salah satu cara untuk menanggulangi masalah tersebut adalah menggunakan varietas padi yang toleran Al dengan produktivitas yang tinggi.
Di Indonesia, terdapat genotipe padi lokal yang toleran terhadap cekaman Al seperti Hawara Bunar. Namun produktivitasnya tidak seunggul varietas yang telah banyak dibudidayakan oleh petani di Indonesia, seperti padi varietas IR64 dan Ciherang. Oleh sebab itu, perlu dilakukan silang balik antara padi var. IR64/Hawara Bunar dengan IR64 sebagai tetua pemulih (recurrent parent) untuk mendapatkan sifat-sifat unggul seperti IR64 tetapi toleran terhadap cekaman Al.
2
Pada penelitian sebelumnya, Miftahudin et al. (2008) dan Akhmad (2009) telah menyilangkan padi var. IR64/Hawara Bunar hingga menghasilkan populasi F2 dan BC2F1 serta mendapatkan lokasi QTL untuk sifat toleransi Al yaitu pada kromosom 3 yang diapit oleh marka RM489 dan RM517. Penelitian ini telah melakukan peningkatan kerapatan marka molekular pada daerah kromosom di antara kedua marka tersebut, serta menggunakan marka-marka tersebut untuk melakukan seleksi populasi silang balik hasil persilangan antara padi var. IR64/Hawara Bunar.
Perumusan Masalah
Bagaimana cara mendapatkan varietas padi yang toleran cekaman Al dengan produktivitas yang tinggi dalam waktu yang singkat? Di manakah letak gen-gen yang mengendalikan sifat toleransi terhadap aluminium pada padi?
.
Tujuan Penelitian
Penelitian ini bertujuan untuk (1) meningkatkan kerapatan marka molekuler pada daerah antara marka RM489 dan RM517 pada kromosom 3 padi, (2) mengidentifikasi kembali keberadaan QTL untuk sifat toleransi Al pada daerah tersebut, (3) dan menyeleksi populasi silang balik BC2F2 dan BC2F3 hasil persilangan IR64/Hawara Bunar berdasarkan marka SSR dan karakter fisiologi Root Regrowth (RRG) dan Pertambahan Panjang Akar (PPA) untuk mendapatkan galur padi yang toleran Al dan memiliki sifat agronomis yang unggul seperti var. IR64.
Manfaat Penelitian
Beberapa manfaat dari penelitian ini antara lain (1) diperoleh populasi BC2F2 dan tanaman BC2F3 yang toleran Al dan memiliki karakter agronomi yang unggul seperti tetua penerima (IR64) serta mempunyai karakter toleran Al (membawa alel homozigot atau heterozigot) dari tetua donor (Hawara Bunar) sehingga berpotensi untuk dikembangkan menjadi Varietas Unggul Spesifik Lokasi (VUSL) tanah masam berkelarutan Al tinggi, (2) memperkaya materi pemuliaan tanaman padi, (3) dapat mendukung penelitian pemetaan genetik tanaman padi terkait sifat toleransinya terhadap cekaman Al, dan (4) dalam jangka panjang, galur baru toleran terhadap cekaman Al yang dihasilkan, diharapkan mampu meningkatkan produksi beras nasional.
Ruang Lingkup Penelitian
3 Bunar berdasarkan marka SSR dan karakter fisiologi Root Regrowth (RRG) dan Pertambahan Panjang Akar (PPA) untuk mendapatkan galur padi yang toleran Al dan memiliki sifat agronomis yang unggul seperti var. IR64.
TINJAUAN PUSTAKA
Tanah Masam dan Toksisitas Aluminium
Tanah masam adalah tanah yang mempunyai pH ≤ 5.5 yang merupakan
faktor pembatas penting dalam produksi pertanian di dunia terutama di Indonesia (Muchtar 2011). Menurut von Uexkull dan Mutert (1995), luas tanah masam di dunia sebesar 3.950 juta Ha atau sekitar 30% dari total luas lahan di dunia. Di Indonesia, terdapat sekitar 102.8 juta Ha atau sekitar 54.6% dari total luas lahan berupa tanah masam (Mulyani et al. 2009). Tanah masam di Indonesia tersebar luas di pulau Kalimantan, Sumatera, dan beberapa wilayah di Sulawesi, Jawa, dan Papua (Lynch dan St. Clair 2004). Pada kelompok tanah andosol, acrisol, podsol, ferralsol, fluvisol, dan planasol; toksisitas Al sangat dominan mempengaruhi pertumbuhan dan produksi tanaman (Baligar et al. 2001).
Pada pH netral, Al membentuk kompleks dengan ion hidroksida yang tidak larut, tetapi pada pH asam akibat terjadi penumpukan ion H+ yang tinggi di dalam tanah atau media tumbuh, Al berada dalam bentuk Al3+ yang toksik karena sifatnya yang larut dan mempunyai kemampuan mengkelat yang tinggi seperti pada reaksi berikut (Harter 2002):
Al(OH)3 + 3H+↔ Al3+ + 3H2O
Pada larutan dengan pH < 5.0 ion Al berbentuk oktahedral Al(H2O)63+ yang sering disingkat Al3+. Dengan semakin berkurangnya tingkat kemasaman, Al(H2O)63+ mengalami deprotonisasi menjadi Al(OH)2+ dan Al(OH)2+ yang tidak beracun bagi tanaman (Mossor-Pietraszewska 2001).
Terdapat tiga faktor penghambat pertumbuhan tanaman di lahan masam, yaitu (1) konsentrasi H+, Al, dan Mn yang tinggi menyebabkan cekaman pada tanaman, (2) rendahnya konsentrasi Ca, Mg, K, P, M, dan Mo sehingga terjadi defisiensi hara mineral pada tanaman, (3) terjadi penghambatan pertumbuhan akar dan penyerapan air sehingga menyebabkan defisiensi hara mineral pada tanaman dan terjadi cekaman kekeringan. Dari semua faktor tersebut, cekaman Al merupakan faktor penghambat utama pertumbuhan tanaman di tanah masam (Marschner 1995), termasuk tanaman padi.
Cekaman Al dapat menurunkan 25 sampai 80% produksi tanaman pangan (Herrera-Estrella 2003), termasuk padi, yang ditanam di tanah masam yang mencakup 40% dari tanah yang bisa ditanami di dunia (Kochian 1995; Ma et al. 1997a). Rendahnya produktivitas menyebabkan tanah masam yang masih cukup luas belum dimanfaatkan secara optimal sebagai lahan pertanian.
4
(Triticum aestivum L.) dan tembakau (Nicotina tabacum L.) (Papernik dan Kochian 1997; Sivaguru et al 2005; Takabatake dan Shimmen 1997), serta produksi spesien oksigen reaktif (ROS) yang dapat berupa peningkatan kandungan Fe2+ atau Fe3+ sebagai perantara peroksidasi lipid yang menyebabkan cekaman oksidatif pada jagung dan tembakau (Jones et al. 2006; Ono et al. 1995; Yamamoto et al. 1997). Menurut Sharma dan Dubey (2007) dan Ma et al. (2007), cekaman Al berhubungan dengan induksi cekaman oksidatif di akar maupun di tajuk seperti anion superoksida (O2-), hidrogen peroksida (H2O2), peroksidasi lipid membran yang diiringi pelepasan gugus thiol, glutation, dan askorbat. Pemberian 160 µM Al dapat meningkatkan anion superoksida (O2-), hidrogen peroksida (H2O2), malondialdehyde (MDA), dan glutation oksida yang diikuti peningkatan enzim oksidatif seperti superoksida dismutase (SOD), guaiacol peroksidase, askorbat peroksidase, monodehidroaskorbat resduktase, dan glutation reduktase serta diikuti dengan penurunan konsentrasi thiol, asam askorbat, chloroplastic dan aktivitas katalase. Namun menurut Yamamoto et al. (2001), peroksidasi lipid memang gejala awal yang diinduksi cekaman Al tetapi bukan penyebab utama penghambatan pertumbuhan akar pada tanaman kacang tanah (Pisum sativum).
Pada tanaman padi, keracunan Al mengakibatkan penurunan beberapa karakter fisiologi seperti akumulasi bahan-bahan kering, konsentrasi dan penyerapan unsur Ca, P, K dan Mg di ujung tajuk (Macedo dan Jan 2008), nilai panjang akar relatif (Nasution dan Suhartini 1992; Sivaguru dan Paliwal 1993), dan penurunan konsentrasi tiol (-SH) dan asam askorbat (Sharma dan Dubey 2007). Selain itu terjadi peningkatan pada beberapa karakter fisiologi lain seperti konsentrasi anion superoksida (O2-), hydrogen peroksida (H2O2), jumlah malondialdehid, dan glutation teroksidasi (Sharma dan Dubey2007).
Aluminium dapat membentuk ikatan elektrostatik dengan ligan donor oksigen seperti kelompok karboksil atau fosfat, sehingga pektin dinding sel dan lapisan luar membran plasma menjadi target utama Al. Al dapat mengikat kuat komponen lipid pada membran plasma (Akeson et al. 1989) dengan kekuatan ikatan bergantung pada muatan fosfolipid yang diikatnya (Jones dan Kochian 1997). Pengikatan Al pada lipid membran mengakibatkan membran plasma menjadi kaku (Deleers et al. 1986).
Berdasarkan beberapa hasil penelitian, target utama cekaman Al adalah jaringan akar tanaman terutama pada ujung akar (Sasaki et al. 1992; Ryan et al. diabsorbsi oleh tanaman berada pada daerah apoplas (Taylor et al. 2000; Rengel 1996) meskipun juga ditemukan terdapat pada daerah simplas (Vazquez et al. 1999; Yamamoto et al. 2001).
5
Mekanisme Toleransi Tanaman terhadap Cekaman Aluminium
Mekanisme toleransi, kontrol genetik, dan lokasi gen pengendali toleransi tanaman terhadap cekaman Al berbeda-beda antar spesies dan varietas (Yahya dan Setiyati 1988; Hede et al. 2001). Kriteria tanaman yang toleran terhadap cekaman Al antara lain ujung akar tidak rusak dan akar terus tumbuh ketika mendapat cekaman Al, terdapat mekanisme dalam penetralan pengaruh toksik Al setelah diserap tanaman maupun mekanisme pengkondisian kurang asam di daerah perakaran seperti sekresi asam malat dan asam sitrat; serta memiliki mekanisme tertentu yang mengakibatkan ion Al tidak menghambat serapan Ca, Mg, dan K (Delhaize dan Ryan 1995; Taylor 1991).
Menurut Taylor (1991) dan Marschner (1995), mekanisme toleransi tanaman terhadap cekaman Al meliputi mekanisme detoksifikasi internal dan mekanisme eksklusi atau penghindaran. Mekanisme detoksifikasi internal dilakukan oleh tanaman dengan membiarkan Al memasuki jaringan dan tanaman akan mengurangi atau menghilangkan pengaruh cekaman tersebut dengan detoksifikasi atau inaktivasi Al yang berada dalam sel dan menimbunnya, sedangkan mekanisme eksklusi atau penghindaran dilakukan oleh tanaman dengan mencegah atau mengurangi penetrasi Al ke dalam jaringan dengan cara mengeluarkan Al atau senyawa organik dari ujung akar sehingga ion Al tidak mencapai daerah metabolik atau protoplasma.
Beberapa penelitian menunjukkan bahwa dalam kondisi tercekam Al, tanaman mensekresikan asam organik seperti asam sitrat, asam malat, dan oksalat dari akar sebagai bentuk mekanisme toleransi (Delhaize et al. 1993; Ryan et al. 2008). Namun beberapa publikasi menyebutkan bahwa sekresi asam organik bukanlah mekanisme utama toleransi terhadap cekaman Al seperti pada rumput (Brachiaria decumbens) (Wenzl et al. 2001) dan bayam (Amaranthus sp) (Yang et al. 2005) atau hal ini bukanlah satu-satunya mekanisme toleransi Al seperti pada jagung (Pineros et al. 2005) dan soba (Zheng et al. 2005). Terdapat dua pola sekresi asam organik terkait waktu pelepasannya. Pertama, tanpa penundaan sekresi, yaitu asam organik akan disekresikan sesaat setelah perlakuan cekaman seperti pada tanaman tembakau (Delhaize et al. 2001), gandum (Ryan et al. 1995), dan buckwheat (Fygopyrum esculentum Moench) (Zheng et al. 2005). Kedua, asam organik disekresikan beberapa jam setelah perlakuan cekaman. Hal ini terjadi pada tanaman rye (Secale cerealea L.) (Li et al. 2000) dan triticale (Ma et al. 2000). Menurut Li et al. (2000), asam organik yang disekresikan sebagai respon toleransi terhadap cekaman Al, berbeda antar tanaman. Aktivitas sitrat sintase meningkat pada tanaman rye saat tercekam Al tetapi tidak terjadi pada gandum. Sekresi asam malat pada gandum tidak dihambat oleh suhu rendah tetapi hal ini mengakibatkan terjadinya penghambatan sekresi asam sitrat pada rye. Rye merupakan spesies anggota Triticeae paling toleran cekaman Al, memiliki beberapa lokus yang mengendalikan sifat toleransi Al, salah satunya adalah lokus yang mempunyai efek cukup besar terhadap toleransi terhadap Al yaitu lokus pada lengan panjang kromosom 4 yang disebut Alt3. Lokus ini memiliki keterkaitan erat dengan gen AltBH yang ditemukan pada gandum. Hal ini menunjukkan bahwa
6
dan terkait dengan penanda yang sama dengan gen AltBHpada gandum (Ma et al.
1997a). Pada gandum telah diketahui gen pengendali toleransi aluminium yaitu TaALMT1 (Alt1) pada kromosom 4DL yang mengontrol sekresi asam malat (Delhaize et al. 1993) dan TaMATE1 (kelompok gen MATE) pada kromosom 4BL yang mengontrol sekresi asam sitrat.dari akar (Ryan et al. 2008).
Mekanisme toleransi terhadap cekaman Al pada padi terjadi secara internal dan eksternal, secara internal terjadi transport Al ke dalam vakuola sel melalui mekanisme simplas (Huang et al. 2009, 2012) dan secara eksternal melalui eksudasi asam sitrat (Yakhoso et al. 2011). Huang et al. 2009 melaporkan bahwa terdapat dua gen, yaitu STAR1 dan STAR2 yang berfungsi sebagai ABC transporter. Selain itu menurut Huang et al. 2012, tranport Al ke dalam vakuola sel ini dikendalikan oleh ekspresi gen OsALS1 (Os03g0755100) yang diinduksi spesifik oleh Al di dalam akar. Gen ini mengkode setengah dari ABC transporter yang merupakan kelompok TAP (Transporter Associated with Antigen Processing). Secara eksternal, terdapat gen OsFRDL4 (Os01g0919100) yang termasuk kelompok MATE efflux protein yang berperan dalam sekresi asam sitrat (Yakhoso et al. 2011).
Selain pada padi, toleransi terhadap Al juga telah dipelajari pada tanaman lainnya, seperti barley (Ma et al. 1997b, 2004a; Matsumoto et al. 1992), gandum (Huang et al. 1992; Jones dan Kochian 1997; Ma et al. 2004b), rye (Miftahudin et al. 2002), jagung (Ma et al. 1997a; Pineros et al. 2005; Wang et al. 2004), kedelai (Cakmak dan Horst 1991; Kataoka dan Nakanishi 2001; Lazof et al. 1996), tembakau (Ono et al. 1995; Yamamoto et al. 2001), sorghum (Sorghum bicolor L.) (Galvez et al. 1987; Keltjens dan Ulden 1987; Tan et al. 1993), kacang tanah (Yamamoto et al. 2001), Arabidopsis thaliana (Ezaki et al. 2000; Richards et al. 1998; Toda et al. 1999), Melastoma malabatricum (Wanatabe et al. 1998), kopi (Coffea sp) (Arroyo-Serralta et al. 2005), labu kuning (Cucurbita moschata Durch) (Dipierro et al. 2005), Alfalfa (Medicago sativa) (Tasfaye et al. 2001), rumput (Wenzl et al. 2001), buckwheat (Zheng et al. 2005), dan bayam (Yang et al. 2005).
Botani Padi
7 banyak dibudidayakan terutama di daerah tropis, subtropis, dan daerah beriklim sedang antara lain di benua Asia, Afrika, Eropa, Timur Tengah, Amerika Utara dan Selatan, sedangkan O. glaberrima hanya dibudidayakan di Afrika Barat (Tripathi et al. 2011). Pusat asal dan pusat keanekaragaman dua spesies ini juga telah diidentifikasi berdasarkan studi keanekaragaman genetik, bukti sejarah dan arkeologi, dan distribusi geografis disepakati bahwa lembah sungai Yangtze dan sungai Mekong merupakan daerah pusat asal O. sativa dan delta sungai Niger di Afrika merupakan daerah pusat asal O. glaberrima (Porteres 1956; OECD 1999). Kaki bukit Himalaya, Chhattisgarh, Jeypore Tract di Orissa, timur laut India, bagian utara Myanmar dan Thailand, dan provinsi Yunnan di China merupakan beberapa daerah pusat keanekaragaman O. sativa dan delta sungai Niger dan beberapa daerah sekitar pantai Guinea Afrika dianggap sebagai pusat keanekaragaman O. glaberrima (Chang 1976; Oka 1988).
Oryza sativa mempunyai beraneka ragam habitus tetapi biasanya berdaun sempit, anter biasanya lebih pendek dari 2,1 mm, panjang gabah biasanya 4-8,5 mm dan lebarnya 2-4 mm, embrio biasanya lebih pendek dari 2,1 mm. Berbeda dengan O. sativa, O. glaberrima mempunyai daun glabrous, malai utama umumnya tanpa cabang sekunder atau tersier, lemna dan palea hampir sempurna glabrous, lebar gabah 2,9 - 3,6 mm, ujung lemma tajam (Vaughan 1989).
Oryza sativa terdiri dari tiga subspesies, yang merupakan hasil seleksi manusia dan alam untuk meningkatkan kualitas dan daya adaptasi pada lingkungan sekitar, yaitu O. sativa ssp. indica, ssp. japonica, dan ssp. javanica (Herrera et al. 2008; Tripathi et al. 2011). Karakter masing-masing subspesies O.sativa disajikan pada Tabel 1.
Padi sering dijadikan tanaman model dalam kajian genetika tumbuhan karena padi mempunyai ukuran genom yang lebih kecil daripada tanaman serealia lainnya, yaitu 389 Mb (IRGSP 2005). Ukuran genom ini 5 kali lebih kecil daripada genom jagung dan 40 kali lebih kecil daripada genom gandum (Genoscope 2012; Moore et al. 1995). Genom padi juga telah disekuen (Kurata dan Yamazaki 2006), sehingga dapat menjadi bahan baku utama dalam usaha pemuliaan padi menggunakan rekayasa genetika. Selain itu, dalam kaitannya dengan analisis toleransi cekaman aluminium, padi juga merupakan tanaman serealia yang mempunyai kemampuan 6-10 kali lebih toleran cekaman Al daripada tanaman serealia lainnya (Famoso et al. 2011).
8
t/ha), tahan hama dan penyakit utama, mutu giling baik, dan rasa nasi enak. Karakter agronomi padi varietas IR64 lebih detail disajikan pada Lampiran 1. Tabel 1 Karakteristik O. sativa ssp. indica, ssp. japonica, dan ssp. javanica
(Matsuo dan Hoshikawa 1993; Tripathi et al. 2011)
Karakater O. sativa spp
indica japonica javanica
Daun sempit dan berwarna hijau terang
sempit dan berwarna hijau tua
sempit dan berwarna hijau
Biji ramping, tipis membulat, lebar, dan tebal
membulat tebal
Anakan banyak sedikit sedikit
Tinggi tanaman
tinggi sedang tinggi
Penanaman mudah tidak mudah tidak mudah
Pelepasan kulit biji
mudah tidak mudah tidak mudah
Suhu rendah
sensitif toleran toleran
Penyebaran daerah beriklim
Beberapa genotipe padi subspesies indica yang dapat dipilih sebagai sumber toleransi terhadap cekaman Al antara lain Hawara Bunar, Sigundil, Grogol, Seratus Malam, Krowal, Ketombol, Jambu, Sigiliti, Ketan Gudel, Mendali, Banih Kuning, Bakka Turuy, Cempo, TB154-TB1, ITA 24764, IRAT144, dan CT 6510-24-1-3 (Asfarudin 1997; Farid 1997; Syakhril 1997; Suparto 1999; Jagau 2000; Purwoko et al. 2005). Roslim (2011) telah meneliti daya toleransi terhadap cekaman Al pada padi varietas Hawara Bunar, Grogol, Krowal, dan IR64 pada konsentrasi Al sebesar 9, 12, 15, 45 dan 60 ppm dan dicekam selama 24 jam, pH 4.00 ± 0.02, dan masa pemulihan (recovery) selama 48 jam. Penelitian tersebut menunjukkan bahwa padi Hawara Bunar mempunyai nilai RRG tertinggi dengan nilai berbeda nyata dengan varietas lain yang diuji, sehingga padi varietas Hawara Bunar dijadikan sebagai tetua donor pada penelitian ini.
9
Silang Balik dan Marker Assisted Backcross Selection (MABS)
Keanekaragaman dan ketersediaan sumber daya genetik padi merupakan faktor penting dalam perakitan varietas padi unggul dengan sifat-sifat yang diinginkan. Sumber genetik padi dapat digolongkan menjadi: (1) sumber gen utama (primary gene pool), yang terdiri atas varietas unggul, lokal, dan
keturunannya. Persilangan antara O. sativa (indica dan japonica) dan O. glaberrima relatif mudah menghasilkan keturunan pertama (F1) yang fertil.
Kromosom dari kedua tetua berpasangan dengan normal dan mewariskan sifat mengikuti hukum Mendel (2) sumber gen kedua (secondary gene pool), terdiri atas spesies liar dari genom yang sama. Misal padi liar yang mempunyai genom dan jumlah kromosom yang sama, yaitu AA dan 2n = 24 (diploid) yang merupakan kerabat dekat padi budi daya (O. sativa) seperti O. perennis, O. nivara, O. rufipogon, O. longistaminata, dan O. barthii. Persilangan antar kelompok tanaman ini relatif sulit, karena keturunan F1 yang dihasilkan cenderung steril atau bahkan dapat mati sebelum mencapai fase generatif. Kromosom kedua tetuanya tidak berpasangan dengan baik. Transfer gen dilakukan dengan tingkat kesulitan dan keseriusan yang tinggi. (3) Sumber gen ketiga (tertiary gene pool) terdiri dari spesies liar dengan genom yang berbeda. Spesies kerabat jauh yang mempunyai genom berbeda, baik yang diploid maupun tetraploid, seperti O. officinalis (CC), O. australiensis (EE), O. minuta (BBCC), O. alta (CCDD), O. brachyantha (FF), O. granulata (GG), O. longiglumis (HHJJ), dan O. schlechteri (HHKK) (Vaughan 1989). Persilangan dapat dilakukan dengan perlakuan khusus. Biji F1 memiliki bentuk yang abnormal dan tanaman F1 cenderung lethal (mati). Transfer gen tidak dapat dilakukan tanpa menggunakan teknik tertentu, seperti penyelamatan embrio, silang balik, penggandaan kromosom dan/atau persilangan perantara dengan spesies lain (bridging species hybridization) (Abdullah 2006).
Kompleksitas masalah yang dihadapi dalam peningkatan produksi padi menuntut perlunya perakitan varietas unggul yang berdaya hasil tinggi, tahan dan toleran terhadap cekaman biotik dan abiotik, serta memiliki beras dengan kualitas yang baik. Dibandingkan dengan cara-cara lainnya, penggunaan varietas unggul merupakan cara yang paling efisien dan ramah lingkungan dalam sistem produksi (Abdullah dan Sularjo 1988). Silang balik (backcross) cukup populer dan telah lama digunakan oleh para pemulia tanaman. Persilangan ini bertujuan mentransfer satu atau beberapa alel dari tetua donor (donor parent) kepada tetua pemulih (recurrent parent) yang mempunyai sifat-sifat yang unggul. Persilangan ini dapat digunakan untuk membuktikan bahwa individu-individu dengan fenotipe yang sama belum tentu memiliki genotype yang sama. Dengan metode persilangan ini, proporsi genom recurrent parent akan kembali 50% tiap generasi atau (1/2)t+1 setiap t generasi backcross (Babu et al. 2004). Hal ini berarti setelah generasi keenam backcross, maka pemulihan genom hasil persilangan yang mewarisi genom recurrent parent sebesar 99.2% atau disebut near-isogenic.
10
Marka molekuler merupakan alat yang dapat digunakan sebagai landmark kromosom untuk memfasilitasi analisis introgresi segmen-segmen kromosom (gen) terkait dengan sifat-sifat yang menguntungkan. Saat ini, selain pada padi, telah banyak penelitian yang menggunakan MABS pada beberapa spesies tanaman, seperti jagung (Babu et al. 2005), gandum (Salina et al. 2003), barley (Jefferies et al. 2003), tomat (Young dan Tanksley 1989), dan kacang (Oliveira et al. 2008). Marka molekuler tidak dipengaruhi oleh lingkungan (tidak terpengaruh oleh kondisi di mana tanaman tumbuh) dan terdeteksi pada setiap tahap pertumbuhan tanaman. Dengan tersedianya database marka molekuler yang melimpah dan peta genetik tiap kromosom, MABS dapat digunakan dengan baik untuk menyeleksi suatu populasi yang terkait sifat kuantitatif (QTL) (Francia et al. 2005).
Ada tiga langkah untuk melakukan prosedur MABS (Gambar 1), yaitu (1) seleksi foreground, yaitu menyeleksi individu-individu dalam populasi yang membawa alel dari tetua donor pada daerah target (daerah QTL). (2) Menyeleksi individu-individu dalam populasi yang membawa alel homozigot dari recurrent parent yang mengapit marka-marka di daerah QTL (daerah target) dan pada semua daerah pada kromosom yang sama dengan kromosom target. (3) Memilih satu atau beberapa individu terpilih yang memiliki genotipe homozigot terbanyak untuk alel recurrent parent pada semua marka di seluruh genom (Collard dan Mackill 2008).
Gambar 1 Tahapan seleksi menggunakan MABS, target lokus ada di kromosom 4. (a) Seleksi foreground, (b) seleksi rekombinan, (c) seleksi background (Collard dan Mackill 2008).
Pemanfaatan Marka Molekuler Simple Sequence Repeats (SSR) dalam Proses Seleksi Pemuliaan Tanaman
Marka molekular penting untuk mengetahui gen-gen yang mengendalikan sifat ketahanan terhadap penyakit, hama, dan cekaman abiotik (Brar dan Kush 2003). Pemanfaatan marka DNA sebagai alat bantu seleksi lebih menguntungkan daripada seleksi secara fenotipik (Azrai 2005). Seleksi berdasarkan fenotipik tanaman di lapang mempunyai beberapa kelemahan antara lain perlu waktu cukup lama, kesulitan memilih dengan tepat gen-gen yang menjadi target seleksi untuk diekspresikan pada sifat-sifat morfologi atau agronomi, frekuensi individu yang diinginkan rendah, dan fenomena pautan gen dengan sifat yang tidak diinginkan sulit dipisahkan saat melakukan persilangan (Lamadji et al. 1999).
Marka SSR, pertama kali diperkenalkan oleh Litt dan Luty (1989), merupakan sekuen DNA bermotif pendek dan berulang secara tandem dengan 2-5
6
11 unit nukleotida yang tersebar dan meliputi seluruh genom terutama pada organisme eukariotik (Powell et al. 1996). SSR banyak digunakan untuk karakterisasi dan pemetaan genetik tanaman termasuk padi (Mc Couch et al. 2002; Powell et al. 1996; Wang et al. 2006). Polimorfisme marka SSR dapat dideteksi dengan PCR (Kumar et al. 2009). Beberapa kelebihan penggunaan marka SSR antara lain distribusi marka melimpah dan merata dalam genom, variabilitas tinggi (banyak alel dalam lokus) dan tingkat polimorfismenya tinggi, dan bersifat kodominan (Mc Couch et al. 1997; Rongwen et al. 1995). Tingkat polimorfisme marka SSR yang tinggi, baik digunakan untuk analisis populasi genetik, pemetaan genetik, keanekaragaman dan hubungan kekerabatan antar individu (Hearne et al. 1992; Morgante et al. 2002; Jarne dan Lagoda 1996). Selain itu, marka SSR juga dapat digunakan untuk estimasi hubungan genetik dengan fenotipik dan fungsi biologis sebagai respon dari berbagai variasi kemampuan adaptif (Ayers et al.1997; Eujayl et al. 2001; Russell et al. 2004), sehingga marka SSR dapat digunakan untuk estimasi lokasi QTL suatu sifat pada tanaman termasuk QTL untuk toleransi Al pada tanaman padi.
Quantitative Trait Loci (QTL) dapat didefinisakan sebagai daerah pada genom yang berhubungan atau bertanggungjawab terhadap sifat kuantitatif, diukur dengan membandingkan variasi genotipe dengan variasi fenotipe. QTL dapat berupa gen tunggal atau sekelompok gen (poligenik) tetapi pada umumnya poligenik yang mempunyai pengaruh berbeda-beda terhadap variasi fenotipe (Joehanes 2009). Pemetaan QTL dapat dilakukan dengan tahapan (1) memilih dan menyilangkan dua tetua yang memiliki fenotipe yang berbeda untuk menghasilkan populasi segregasi, (2) membuat peta genetik dari populasi hasil persilangan tersebut, (3) melakukan analisis fenotip dari tetua dan populasi untuk karakter yang dipelajari, (4) membuat hubungan/asosiasi antara karakter fenotip dan marka genetik/molekular (Joehanes 2009). Analisis QTL dapat dilakukan pada populasi segregasi, seperti populasi silang balik (backcross), populasi F2, Recombinant Inbred Lines (RILs), Near Isogenic Lines (NILs), dan double haploid lines. Pada populasi backcross, analisis QTL dapat digunakan untuk mengevaluasi introgresi alel-alel ke dalam genom tetua pemulih (recurrent parent) (Joehanes 2009).
12
(Wu et al. 2000), kromosom 6 yang diapit marka R1954 dan G200 (Famoso et al. 2011); kromosom 7 yang diapit marka RZ626 dan RG650 (Nguyen et al. 2001a, 2003), kromosom 8 yang diapit marka RG28 dan RM223 (Nguyen et al. 2001a, 2003), kromosom 9 yang diapit marka RM257 dan RM160 (Famoso et al. 2011), RM201 dan WAL17 (Nguyen et al. 2001a, 2003), RZ698 dan ACA-CTA1 (Mao et al. 2004), RG141 dan RG667 (Wu et al. 2000), C609 dan C1260 (Xue et al. 2006); kromosom 11 yang diapit marka C496 dan C410 (Xue et al. 2006), dan kromosom 12 yang diapit marka RM453 dan RM512, R1709 dan G2140 (Famoso et al. 2011), ACA-CTT1 dan RM117 (Mao et al. 2004), RG9 dan RG457 (Wu et al. 2000).
METODE
Bagan Alir Penelitian
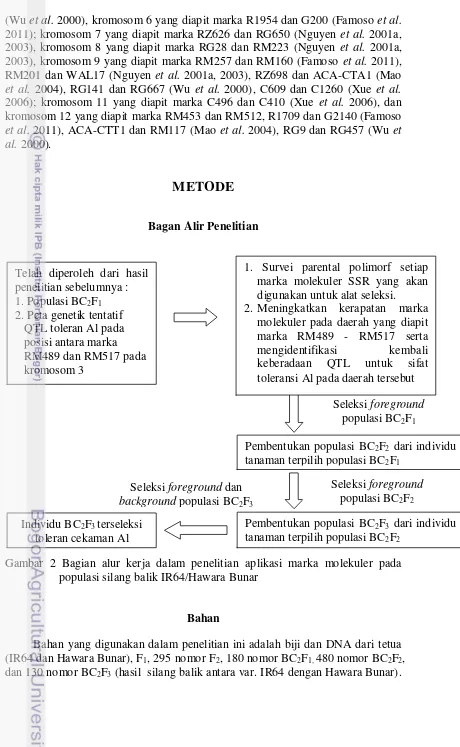
Gambar 2 Bagian alur kerja dalam penelitian aplikasi marka molekuler pada populasi silang balik IR64/Hawara Bunar
Bahan
Bahan yang digunakan dalam penelitian ini adalah biji dan DNA dari tetua (IR64 dan Hawara Bunar), F1, 295 nomor F2, 180 nomor BC2F1, 480 nomor BC2F2, dan 130 nomor BC2F3 (hasil silang balik antara var. IR64 dengan Hawara Bunar).
Seleksi foreground populasi BC2F1 Telah diperoleh dari hasil
penelitian sebelumnya : 1. Populasi BC2F1 2. Peta genetik tentatif
QTL toleran Al pada posisi antara marka RM489 dan RM517 pada kromosom 3
Pembentukan populasi BC2F2 dari individu tanaman terpilih populasi BC2F1
Pembentukan populasi BC2F3 dari individu tanaman terpilih populasi BC2F2
Seleksi foreground dan background populasi BC2F3 Individu BC2F3 terseleksi
toleran cekaman Al
1. Survei parental polimorf setiap marka molekuler SSR yang akan digunakan untuk alat seleksi. 2. Meningkatkan kerapatan marka
molekuler pada daerah yang diapit marka RM489 - RM517 serta mengidentifikasi kembali keberadaan QTL untuk sifat toleransi Al pada daerah tersebut
13 DNA dan biji populasi tersebut merupakan koleksi Laboratorium Fisiologi dan Biologi Molekuler, Departemen Biologi, FMIPA, IPB.
Pembentukan Populasi BC2F2 dan BC2F3
Tanaman BC2F1 dan BC2F2 terseleksi ditanam di rumah kaca dan dibiarkan menyerbuk sendiri untuk mendapatkan tanaman turunannya. Penanaman dilakukan pada media tanah yang dicampur dengan pupuk kandang (kotoran kambing) dengan perbandingan tanah:pupuk kandang 3:1 di dalam wadah ember. Satu ember satu benih padi. Pemeliharaan tanaman padi meliputi penyiraman, pengendalian hama dan penyakit,sertapemupukan NPK 1:1:1 dengan dosis 0.8 g/tanaman diberikan pada saat 30 dan 60 hari setelah tanam.
Perlakuan Cekaman Al
Benih padi yang akan dianalisis, disterilisasi dalam larutan NaOCl 0.5% (v/v) selama 15 menit. Kemudian dicuci tiga kali dengan air destilata. Benih selanjutnya direndam dalam air destilata selama 24 jam pada suhu ruang, kemudian dikecambahkan pada kertas koran yang lembab selama 3-4 hari pada suhu ruang dan disimpan di tempat yang gelap.
Setelah berkecambah, ditanam di atas net plastik yang diapungkan di atas media kultur hara minimum tanpa Al dengan pH 4.0 yang diberi aerasi (Miftahudin et al. 2002) untuk adaptasi selama 24 jam. Perlakuan cekaman Al dilakukan dengan pemberian Al3+ dalam bentuk AlCl3.6H2O sebanyak 15 ppm selama 72 jam. Setelah 72 jam perlakuan cekaman Al dilanjutkan dengan tahap recovery, yaitu pemberian larutan hara minimum tanpa Al selama 48 jam (Miftahudin et al. 2002).
Perlakuan adaptasi, cekaman Al, dan recovery dilakukan di ruang tumbuh (growth chamber) pada suhu ruang dan pencahayaan 300 PPFD (Photo Proton Fluk Density) selama 12 jam setiap hari. Larutan hara minimum dipertahankan pada pH 4.0 dengan cara mengganti larutan hara minimum setiap hari. Komposisi larutan hara minimum mengikuti Miftahudin et al. (2002) (Lampiran 3).
Analisis Pertambahan Panjang Akar (PPA) dan Root Re-Growth (RRG)
14
Analisis Marka Molekuler Isolasi DNA Tanaman Padi
Isolasi DNA dilakukan dengan mengikuti prosedur teknik isolasi cepat (Miftahudin et al. 2004). DNA diisolasi dari daun muda tanaman padi yang berumur sekitar 3-4 minggu dan minimal telah mempunyai 3 helai daun. Daun diambil 1-2 helai kemudian digerus di dalam N2-cair. Kemudian ditambah buffer lisis (SDS 2%, glisin 0.1M, NaCl 0.05M, EDTA pH 8 0.01M) dan disentrifugasi dengan kecepatan 13000 rpm selama 10 menit. Supernatan dipipet, ditambah PCIAA (Phenol, Chloroform dan Iso Amyl Alchohol) dan disentrifugasi dengan kecepatan 13000 rpm selama 10 menit. Selanjutnya supernatan dipipet, ditambah CIAA (Chloroform dan Iso Amyl Alchohol), dan disentrifugasi dengan kecepatan 13000 rpm selama 10 menit. Lalu supernatan dipipet kembali dan ditambah isopropanol, kemudian disentrifugasi dengan kecepatan 15000 rpm selama 5 menit. Pelet DNA dibilas dengan Etanol 70% dan sentrifugasi kemudian dikeringanginkan. Kuantitas DNA diukur menggunakan spektrofotometer UV, sedangkan kualitas DNA diamati dengan menggunakan teknik elektroforesis pada 1% gel agarose dalam 1x buffer TBE (Tris-Borate-EDTA pH 8.0), dengan tegangan 85 volt selama 30 menit. Larutan DNA yang telah diperoleh dilarutkan pada larutan TAE steril dan disimpan pada suhu -200C.
Seleksi Marka Molekuler
Marka molekuler yang digunakan diambil dari marka molekuler tanaman padi dari situs http://www.gramene.org. Marka molekuler tersebut merupakan marka SSR (Simple Sequence Repeats). Jumlah keseluruhan marka yang digunakan adalah 5 marka dari 13 marka untuk seleksi foreground dan 50 marka dari 100 marka untuk seleksi background (Lampiran 4).
Sebelum digunakan untuk seleksi populasi, setiap marka dilakukan optimasi suhu annealing dan seleksi polimorfisme. Optimasi suhu annealing dilakukan pada rentang suhu antara 50-600C dan seleksi polimorfisme dilakukan dengan cara membandingkan pita hasil amplifikasi PCR pada kedua tetua (IR64 dan Hawara Bunar) dan F1 serta mencocokkan ukuran pita dengan perkiraan ukuran pita yang ada di database.
Teknik PCR (Polymerase Chain Reaction)
Mesin PCR yang digunakan adalah Thermocycle ESCO Swift Maxi. Kondisi PCR yang digunakan adalah suhu 94oC selama 5 menit untuk denaturasi permulaan (pra PCR). Dilanjutkan pada suhu 94oC selama 45 detik untuk denaturasi, suhu 55oC selama 45 detik untuk proses penempelan primer (annealing), suhu 72oC selama 1.5 menit untuk proses pemanjangan (extension). Proses denaturasi, annealing, dan extension dilakukan sebanyak 35 siklus. Pasca 35 siklus PCR dilakukan pemanjangan akhir pada suhu 72oC selama 10 menit (Akhmad 2009).
15 Produk hasil amplifikasi dengan PCR diamati dengan elektroforesis pada 80 volt 200 mA dengan waktu berbeda-beda menyesuaikan ukuran dan jarak antar pita polimorfisme yang teramplifikasi, menggunakan 2.5-3.0% gel SFR (Super Fine Resolution) (Amrecso, USA) dalam 1 xlarutan penyangga TBE (0.89 M Tris, 0.89 M asam borat, dan 2 mM EDTA). Visualisasi pita DNA menggunakan larutan EtBr (Etidium Bromida) 0.5 µg/ml dan diamati dengan menggunakan UV transiluminator dan didokumentasikan menggunakan foto gel WiseDoc©Gel Documentation System.
Pengamatan Karakter Morfologi dan Agronomi
Karakter Morfologi dan Agronomi yang diamati adalah tinggi tanaman vegetatif, jumlah anakan, umur berbunga, umur panen, jumlah malai, rata-rata panjang malai, total biji isi, rata-rata biji isi/malai, total biji hampa, rata-rata biji hampa/malai, total bobot biji isi, dan rata-rata bobot biji isi/malai.
Prosedur Analisis Data
Primer yang menghasilkan pita yang berbeda posisi pada kedua tetua (IR64 dan Hawara Bunar) dan menunjukkan dua pita kodominan pada F1 pada tahap optimasi dan seleksi marka SSR, dipilih sebagai primer untuk analisis segregasi pada F2 dan seleksi BC2F2. Skoring pita yang terbentuk disimbolkan dengan A (pola pita sama dengan tetua IR64), B (pola pita sama dengan tetua Hawara Bunar), dan H (pola pita mempunyai kedua tetua). Analisis QTL menggunakan software MAPMAKER/QTL ver. 3.0 (Lander dan Botstein 1989) dan MapChart 2.2 (Voorrips 2002) untuk visualisasi konstitusi alel pada seleksi background individu BC2F2 175-63.
HASIL DAN PEMBAHASAN
Hasil
Survei Polimorfisme dari Marka Molekuler SSR
16
RM19 RM252 M RM278 RM556
Gambar 3 Contoh hasil survei polimorfisme marka SSR berdasarkan analisis PCR pada tanaman tetua (HB: Hawara Bunar, IR: IR64) dan tanaman F1 turunannya menggunakan marka SSR: RM19, RM252, RM278, dan RM556. Sebagai standar digunakan DNA standard 100bp (M).
Berdasarkan hasil survei parental marka polimorfisme, maka telah dilakukan survey dan penapisan terhadap 17 marka SSR yang terpetakan pada posisi di antara 2 marka RM489 dan RM517. Hasil penapisan menggunakan teknik PCR dengan template DNA dari kedua tetua dan tanaman F1 hasil persilangan kedua tetua tersebut diperoleh empat marka SSR yang polimorfisme, yaitu RM2790, RM14535, RM14543, dan RM14552.
Untuk dapat melakukan seleksi foreground dan background pada populasi BC2F3 175-63, terlebih dahulu dilakukan seleksi 110 marka SSR yang akan digunakan untuk memperoleh marka-marka yang polimorfisme. Tingkat polimorfisme marka SSR pada padi IR64 dan Hawara Bunar tiap kromosom berbeda-beda dengan total tingkat polimorfisme yang cukup tinggi yaitu sebesar 50% (Lampiran 4).
Peningkatan Kerapatan Marka Molekuler dan Identifikasi QTL
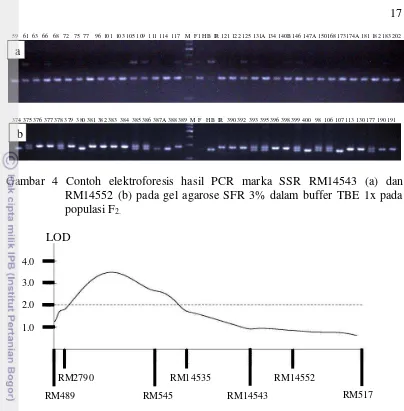
Keempat marka SSR yang yang terpetakan pada posisi diantara 2 marka RM489 dan RM517 pada kromosom 3 padi yaitu marka RM2790, RM14535, RM14543, dan RM14552, digunakan untuk mengamplifikasi DNA dari populasi F2 (Gambar 4).
Data skoring pita DNA dari keempat marka SSR tersebut bersama-sama dengan marka RM489, RM545, dan RM517, serta data karakter RRG dan PPA dari populasi F2 yang berjumlah 364 tanaman digunakan untuk analisis pemetaan daerah QTL menggunakan software MAPMAKER/QTL ver. 3.0 (Lander dan Botstein 1989). Hasil dari analisis QTL untuk karakter PPA disajikan pada Gambar 5.
IR HB F1
100 bp
17
59 61 63 66 68 72 75 77 96 101 103 105 109 111 114 117 M F1 HB IR 121 122 125 131A 134 140B 146 147A 150168 173174A 181 182 183 202
374 375 376 377 378 379 380 381 382 383 384 385 386 387A 388 389 M F HB IR 390 392 393 395 396 398 399 400 98 106 107 113 130 177 190 191
Gambar 4 Contoh elektroforesis hasil PCR marka SSR RM14543 (a) dan RM14552 (b) pada gel agarose SFR 3% dalam buffer TBE 1x pada populasi F2.
Gambar 5 Posisi QTL untuk karakater PPA sebagai parameter toleransi Al pada populasi F2 hasil persilangan tetua padi var. IR64 x var. Hawara Bunar.
Seleksi foreground Populasi BC2F1
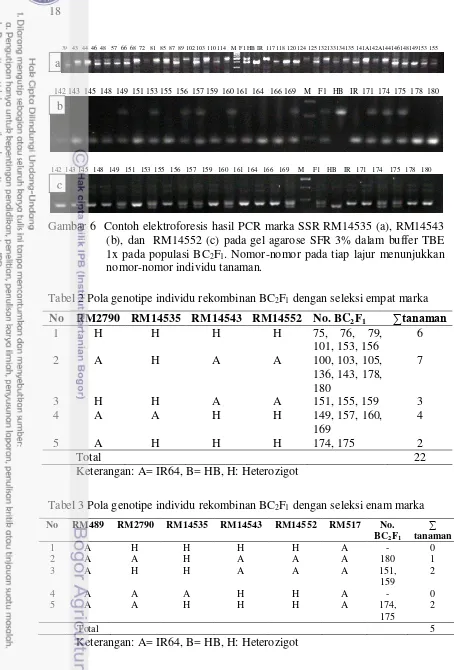
Seleksi foreground populasi BC2F1 dilakukan dengan analisis PCR untuk amplifikasi DNA dari masing-masing individu BC2F1 menggunakan primer-primer polimorfisme yang telah didapatkan sebelumnya dari analisis QTL pada populasi F2, yaitu RM2790, RM14535, RM14543, dan RM14552. Di antara hasil analisis di atas ditampilkan pada Gambar 6. Hasil skoring pita DNA pada analisis tersebut disajikan pada Tabel 2. Untuk meningkatkan efisiensi seleksi, maka seleksi foreground diperluas dengan menganalisis kedua marka pengapit lokasi QTL, yaitu RM489 dan RM517. Hasil dari analisis tersebut disajikan pada Tabel 3.
Dari 5 tipe konstitusi alel BC2F1 tersebut di atas (Tabel 3), diambil masing-masing satu nomor, yaitu 159, 175, dan 180 untuk ditanam dan digunakan untuk membentuk populasi BC2F2. Pemilihan nomor 159, 175 dan 180 didasarkan pada pola genotipe HH dan AH untuk marka RM2790 dan RM14535. Diharapkan dari individu tersebut akan dihasilkan individu BC2F2 yang diinginkan.
a
b
LOD
RM489 RM545 RM14543 RM517
RM2790 RM14535 RM14552
18
39 43 44 46 48 57 66 68 72 81 85 87 89 102 103 110 114 M F1 HB IR 117 118 120 124 125 132133134135 141A142A144146148149153 155
142 143 145 148 149 151 153 155 156 157 159 160 161 164 166 169 M F1 HB IR 171 174 175 178 180
142 143 145 148 149 151 153 155 156 157 159 160 161 164 166 169 M F1 HB IR 171 174 175 178 180
Gambar 6 Contoh elektroforesis hasil PCR marka SSR RM14535 (a), RM14543 (b), dan RM14552 (c) pada gel agarose SFR 3% dalam buffer TBE 1x pada populasi BC2F1. Nomor-nomor pada tiap lajur menunjukkan nomor-nomor individu tanaman.
Tabel 2 Pola genotipe individu rekombinan BC2F1 dengan seleksi empat marka
No RM2790 RM14535 RM14543 RM14552 No. BC2F1 ∑tanaman
1 H H H H 75, 76, 79,
101, 153, 156
6
2 A H A A 100, 103, 105,
136, 143, 178, 180
7
3 H H A A 151, 155, 159 3
4 A A H H 149, 157, 160,
169
4
5 A H H H 174, 175 2
Total 22
Keterangan: A= IR64, B= HB, H: Heterozigot
Tabel 3 Pola genotipe individu rekombinan BC2F1 dengan seleksi enam marka
No RM489 RM2790 RM14535 RM14543 RM14552 RM517 No. BC2F1
∑
tanaman
1 A H H H H A - 0
2 A A H A A A 180 1
3 A H H A A A 151,
159
2
4 A A A H H A - 0
5 A A H H H A 174,
175
2
Total 5
Keterangan: A= IR64, B= HB, H: Heterozigot a
b
19
Seleksi foreground Populasi BC2F2
Pengujian daya berkecambah biji dari 3 nomor BC2F1 yang terpilih, yaitu BC2F1 159, 175, dan 180 menunjukkan daya berkecambah biji yang berbeda-beda. Daya berkecambah BC2F1 159, 175, dan 180 berturut-turut sebesar 5%, 64.2%, dan 97.5%. Kecilnya daya kecambah BC2F1 159, menjadi alasan diikutsertakan juga BC2F1 151 dalam pengujian daya perkecambahan. Daya berkecambah BC2F1 151 sama dengan BC2F1 159 yaitu 5%, sehingga hanya biji BC2F1 175 dan 180 yang dipilih untuk seleksi lebih lanjut karena mempunyai daya berkecambah yang baik.
Populasi BC2F2 175 dan 180 digunakan untuk analisis nilai PPA dan RRG (Tabel 4; Gambar 7a dan 7b) bersamaan dengan mempersiapkan penanaman di rumah kaca. Masing-masing tanaman BC2F2 kemudian diseleksi dengan marka
foreground (Gambar 8).
Tabel 4 Nilai statistik sifat toleransi cekaman Al berdasarkan karakter PPA dan RRG pada populasi BC2F2
Karakter BC2F2 151 BC2F2 159 BC2F2 175 BC2F2 180
PPA RRG PPA RRG PPA RRG PPA RRG
Minimum 0.35 0.40 0.7 0.6 0.00 0.00 0.55 0.00 Maksimum 2.00 2.40 2.15 2.45 1.95 3.15 2.45 4.00 Rata-rata 0.98 1.76 1.57 1.41 1.11 1.83 1.59 2.09 Deviasi 0.57 0.78 0.77 0.68 0.53 0.97 0.55 0.90 Berdasarkan nilai RRG dan konfigurasi alel pada marka RM14535, RM14543, dan RM14552, pada populasi 175 terpilih nomor 63 dan 68, sedangkan pada populasi 180 terpilih nomor 14, 18, 26, 50, 51, 53, 59, 60, 62, 63, 64, 85, dan 97. Untuk menyeleksi individu dari galur BC2F2 175, dan 180 maka dilakukan analisis gabungan antara profil introgresi masing-masing individu tanaman dengan karakter RRG, seperti pada Tabel 5.
20
21
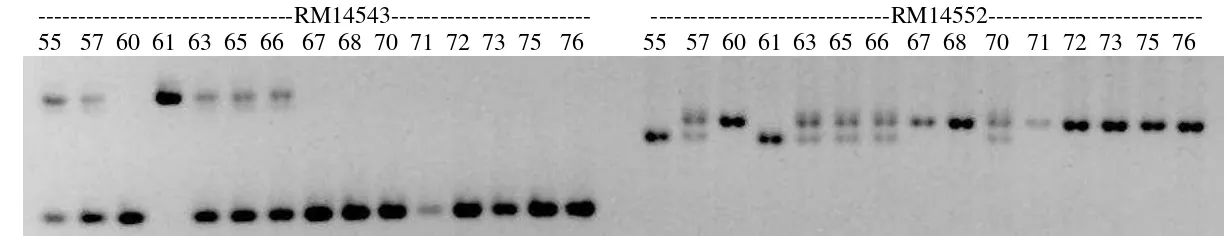
---RM14535--- M F1 HB IR 43 45 50 51 53 59 60 62 63 64 85 97
---RM14543--- ---RM14552--- 55 57 60 61 63 65 66 67 68 70 71 72 73 75 76 55 57 60 61 63 65 66 67 68 70 71 72 73 75 76
22
Tabel 5 Nomor individu terpilih BC2F2 beserta nilai RRG dan konfigurasinya
No. Individu BC2F2 RM14535 RM14543 RM14552 RRG
1 175-63 H H H 3.15
2 175-68 H A A 3.10
3 180-14 H A A 3.30
4 180-18 H A A 3.00
5 180-26 A A A 3.10
6 180-50 A A A 3.65
7 180-51 H A A 3.00
8 180-53 A A A 3.50
9 180-59 A A A 3.50
10 180-60 H A A 3.20
11 180-62 A A A 3.00
12 180-63 A A A 4.00
13 180-64 A A A 3.30
14 180-85 A A A 3.50
15 180-97 H A A 3.00
Keterangan: A= IR, B= HB, H: Heterozigot
Seleksi Foreground dan Background Populasi BC2F3
Total 130 individu tanaman pada populasi BC2F3 yang merupakan turunan dari tanaman BC2F2 nomor 175-63 digunakan untuk analisis karakter RRG, PPA, dan daya tumbuh akar samping serta tinggi tanaman vegetatif, jumlah anakan vegetatif, umur berbunga, rata-rata panjang malai, jumlah malai, umur panen, total biji isi, rata-rata biji isi per malai, total biji hampa, rata-rata biji hampa per malai, total bobot biji isi, dan rata-rata bobot biji isi per malai (Lampiran 5). Selain itu juga dilakukan isolasi DNA untuk digunakan sebagai template pada analisis foreground dan background.
Analisis foreground menggunakan marka RM2790, RM545, RM14535, RM14543, dan RM14552 yang terpetakan pada posisi target. Contoh hasil PCR dari marka RM14543 pada populasi BC2F3 yang diturunkan dari BC2F2 175-63 disajikan seperti pada Gambar 9. Disamping seleksi foreground, galur-galur BC2F3 terpilih juga dilakukan seleksi background. Seleksi ini dilakukan menggunakan 50 marka SSR polimorfisme yang terdapat di luar daerah QTL pada kromosom 1 sampai 12. Untuk efisiensi, sebelum melakukan seleksi background pada populasi BC2F3 175-63, terlebih dahulu dilakukan amplifikasi marka-marka
background dengan DNA generasi sebelumnya yaitu individu BC2F2 175-63 seperti diperlihatkan pada Gambar 10 dan 11. Hasil amplifikasi tersebut menunjukkan 44 marka mengikuti alel homozigot tetua IR64, 4 marka yaitu RM5, RM218, RM421, dan RM7434 mengikuti alel homozigot tetua Hawara Bunar, dan 2 marka yaitu RM168 dan RM130 mengikuti alel kedua tetua (heterozigot). Kedua marka yang bersifat heterozigot, RM168 dan RM130, selanjutnya dilakukan seleksi background pada populasi BC2F3 175-63 (Gambar 12). Analisis
23 Masing-masing mempunyai karakter yang berbeda. Kandidat individu toleran cekaman Al yang terpilih ini didasarkan pada nilai karakter RRG, PPA, dan karakter agronomi yang lain (Tabel 6).
Pembahasan Survei polimorfisme marka molekuler SSR
Hasil survei parental diperoleh 55 marka SSR yang bersifat polimorfisme dari total 113 marka yang digunakan yang berarti 48.7% marka bersifat polimorfisme. Diantara hasil PCR untuk tujuan survei parental ini seperti ditampilkan pada Gambar 3. Hasil pada Gambar 3 menunjukkan beberapa marka SSR yang bersifat monomorf dan polimorfisme. Marka yang bersifat polimorfisme seperti marka RM278 dan RM556 yang memiliki dua pita dengan ukuran pita yang sama antara kedua tetua Hawara Bunar (HB) dan IR64 (IR). Marka yang bersifat polimorfisme adalah marka RM19 dan RM252, terlihat adanya perbedaan ukuran pita DNA hasil amplifikasi PCR antara tetua Hawara Bunar (HB) dan IR64 (IR) dengan ukuran 200 bp. Polimorfisme ini terlihat juga pada sampel tanaman F1-nya, yaitu diperolehnya 2 pita DNA hasil amplifikasi. Dengan diperolehnya profil polimorfisme beberapa marka SSR pada tanaman tetua maka marka-marka tersebut dapat digunakan untuk membantu seleksi foreground dan background pada populasi silang balik selanjutnya yang diperoleh.
Peningkatan Kerapatan Marka Molekuler dan Identifikasi QTL
Menurut Akhmad (2009), Hariyanto (2009), dan Miftahudin et al. (2008), QTL untuk karakter toleransi Al pada populasi F2 hasil persilangan padi var. IR64 dengan Hawara Bunar berada pada kromosom 3 yang diapit oleh marka RM231, RM514, dan RM517. Marka RM231 dan RM517 terpaut dengan karakter RRG dan marka RM514 terpaut dengan karakter PPA. Dengan tim peneliti yang sama, Miftahudin et al. 2009, menyebutkan bahwa posisi QTL untuk toleransi Al terletak pada kromosom 3 di daerah yang diapit oleh marka RM489 dan RM517 yang berjarak 13.7 cM pada lengan pendek kromosom 3 padi. Hal ini sejalan dengan Nguyen (2001a) yang menyebutkan bahwa terdapat QTL toleransi cekaman Al pada kromosom 3 padi yang diapit oleh marka CDO1395 dan RG391. Kedua marka ini terpaut dengan karakter panjang akar selama cekaman Al dan panjang akar relatif sebagai parameter toleransi Al pada tanaman. Jarak antara marka RM517 dengan RG391 cukup dekat yaitu 1.082.580 bp (Lampiran 6).
Hasil analisis menunjukkan bahwa lima marka SSR yaitu RM2790, RM545, RM14535, RM14543, dan RM14552 dapat dipetakan di antara marka RM489 dan RM517 dengan rata-rata jarak antar marka menjadi 3 cM. QTL untuk karakter toleransi terhadap cekaman Al dapat dipetakan di daerah antara marka RM2790 dan RM14552. Analisis QTL menunjukkan bahwa pada daerah tersebut tidak dijumpai QTL untuk karakter RRG (LOD=1.2), tetapi telah ditemukan daerah QTL untuk karakter PPA (LOD=3.4) dengan puncak QTL berada pada daerah antara marka RM2790 dan RM545. QTL tersebut menjelaskan sekitar 21% dari variasi fenotip populasi F2 yang dipelajari (Gambar 5).
24
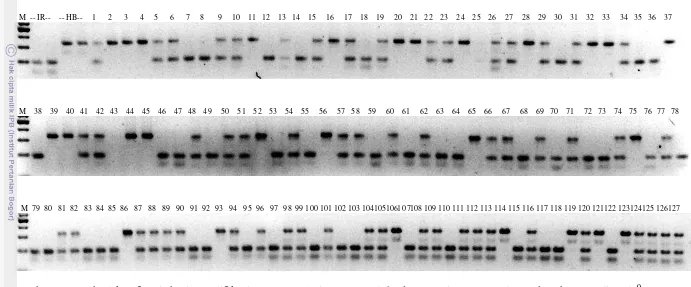
M -- IR-- -- HB-- 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37
M 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 5 8 59 60 61 62 63 64 65 66 67 68 69 70 71 72 73 74 75 76 77 78
M 79 80 81 82 83 84 85 86 87 88 89 90 91 92 93 94 95 96 97 98 99 100 101 102 103 10410510610 7108 109 110 111 112 113 114 115 116 117 118 119 120 121122 123124125 126127
25
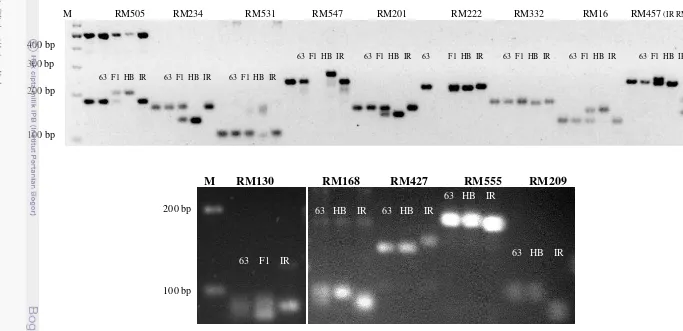
M RM505 RM234 RM531 RM547 RM201 RM222 RM332 RM16 RM457 (IR RM106)
M RM130 RM168 RM427 RM555 RM209
Gambar 10 Contoh elektroforesis hasil amplifikasi DNA tanaman BC2F2 175-63 dengan beberapa primer background. 63 F1 HB IR
300 bp
200 bp 400 bp
63 F1 HB IR 63 F1 HB IR
63 F1 HB IR 63 F1 HB IR 63 F1 HB IR 63 F1 HB IR 63 F1 HB IR 63 F1 HB IR
100 bp
200 bp
100 bp
63 HB IR 63 HB IR
63 HB IR
63 F1 IR
63 HB IR
26
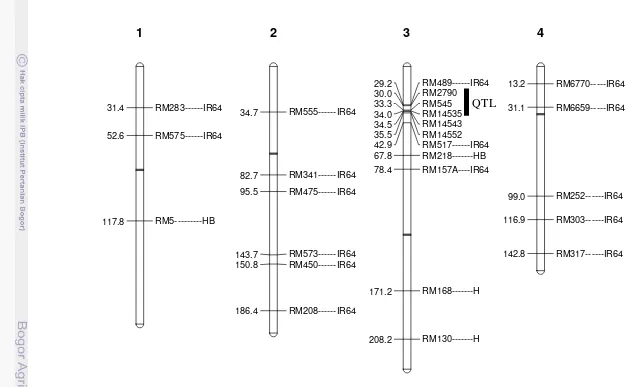
Gambar 11 Konstitusi background galur BC2F2 175-63 (jarak genetik didapatkan dari Mc Couch 2001 dan CIAT 2006).
27
Gambar 11 Lanjutan
RM413---IR64 10.4
RM548---IR64 28.6
RM289---IR64 36.2
RM459---IR64 93.7
RM421---HB 111.2
5
RM204---IR64 25.1
RM7434---HB 114.4
6
RM5752----IR64 10.9
RM427---IR64 11.4
RM336---IR64 61.0
RM505---IR64 78.6
RM234---IR64 124.7
7
RM1376---IR64 15.2
RM547---IR64 27.3
RM38---IR64 28.0
RM531---IR64 90.3
28
Gambar 11 Lanjutan
RM409---IR64 45.6
RM201---IR64 81.2
9
RM222---IR64 11.3
RM304---IR64 73.0
10
RM332---IR64 27.9
RM167---IR64 37.5
RM457---IR64 83.0
RM206---IR64 102.9
11
RM19---IR64 20.9
RM247---IR64 32.3
RM1036---IR64 40.1
RM309---IR64 74.5
RM463---IR64 75.5