DWI UTAMI
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
2
ABSTRAK
DWI UTAMI. Sintesis Krisin dari Floroglusinol. Dibimbing oleh BUDI ARIFIN
dan PURWANTININGSIH SUGITA.
Flavon merupakan golongan flavonoid yang banyak ditemukan dalam
tumbuhan berpembuluh. Flavon yang mengandung gugus hidroksil pada posisi 5
dan 7 sangat penting dalam hal aktivitas biologis dan keberadaannya di alam yang
cukup banyak. Senyawa flavon yang hanya mengandung gugus hidroksil pada
posisi 5 dan 7 atau 5,7-dihidroksiflavon dikenal dengan nama krisin. Dalam
penelitian ini, krisin kasar telah berhasil disintesis dengan 3 tahap dari bahan awal
floroglusinol. Floroglusinol diasetilasi dengan asetonitril dan gas HCl
menghasilkan floroasetofenon dengan rendemen mencapai 74%. Benzoilasi
floroasetofenon dengan 4.5 ekuivalen benzoil klorida menghasilkan tribenzoil
floroasetofenon dengan rendemen 103
–
107% dan penataan-ulang
Baker-Venkataraman produk ester dengan KOH dalam piridina kering menghasilkan
krisin kasar, dengan persen konversi 71.62%. Semua produk sintesis dalam
penelitian ini telah dicirikan dengan titik leleh, dan secara spektroskopi.
ABSTRACT
DWI UTAMI. Synthesis of Chrysin from Phloroglucinol. Supervised by BUDI
ARIFIN and PURWANTININGSIH SUGITA
.
SINTESIS KRISIN DARI FLOROGLUSINOL
DWI UTAMI
Skripsi
sebagai salah satu syarat memperoleh gelar
Sarjana Sains pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul Skripsi : Sintesis Krisin dari Floroglusinol
Nama
: Dwi Utami
NIM
: G44080103
Disetujui
Pembimbing I
Budi Arifin, SSi, MSi
NIP 19830109 200604 1 004
Pembimbing II
Prof Dr Purwantiningsih Sugita, MS
NIP 19631217 198803 2 002
Diketahui
Ketua Departemen Kimia
Prof Dr Ir Tun Tedja Irawadi, MS
NIP 19501227 197603 2 002
iv
PRAKATA
Bismillahirrahmaanirrahiim...
Alhamdulillah
, puji syukur ke hadirat Allah SWT dengan rahmat dan
hidayah-Nya penulis dapat dapat menyelesaikan karya ilmiah yang berjudul
Sintesis Krisin dari Floroglusinol. Shalawat serta salam semoga selalu tercurahkan
kepada Nabi Muhammad SAW, keluarganya, dan semoga kita semua menjadi
pengikutnya hingga akhir zaman.
Karya ilmiah ini dapat terselesaikan tidak terlepas dari bantuan berbagai
pihak, baik moral maupun spiritual. Oleh karena itu, penulis mengucapkan terima
kasih kepada Budi Arifin, SSi, MSi dan Prof Dr Purwantiningsih Sugita, MS
selaku pembimbing yang telah memberikan bimbingan, arahan, dan waktu.
Penulis juga mengucapkan terima kasih kepada Ayah, Ibu, Adik, dan Kakak atas
doa, nasihat, dan bantuan materi yang telah diberikan. Ucapan terima kasih juga
disampaikan kepada Bapak Sabur, Bapak Muhammad Farid, Ibu Yenni, Mba Nia,
Kak Luthfan, Fadli, Dumas, Egi, Itoh, Ade, Livia, Dwi Artha, Kak Wahyu, Bani,
dan teman-teman Kimceu 45 atas diskusi dan kebersamaan selama penulis
menempuh studi dan menjalankan penelitian.
Akhir kata penulis berharap skripsi ini dapat bermanfaat bagi penulis
khususnya dan pembaca umumnya.
Bogor, September 2012
RIWAYAT HIDUP
Penulis dilahirkan di Bogor pada tanggal 18 Maret 1988, merupakan putri
kedua dari tiga bersaudara dari pasangan Suparno dan Darwati.
Penulis menyelesaikan pendidikan di Sekolah Menengah Analis Kimia
Bogor (SMAKBo) pada tahun 2007 dan kemudian bekerja di PT Liwayway
Jababeka, Cikarang hingga bulan Mei 2008. Pada bulan Agustus 2008, penulis
lulus seleksi masuk Institut Pertanian Bogor (IPB) melalui jalur Seleksi Nasional
Mahasiswa Perguruan Tinggi Negeri (SNMPTN).
vi
DAFTAR ISI
Halaman
DAFTAR TABEL
………..
vii
DAFTAR GAMBAR
..………..
viii
DAFTAR LAMPIRAN
………...
ix
PENDAHULUAN ... 1
BAHAN DAN METODE ... 2
Alat dan Bahan ... 2
Langkah Kerja ... 2
Sintesis Floroasetofenon
... 2Sintesis Krisin (5,7-Dihidroksiflavon)
... 3HASIL ... 3
Floroasetofenon ... 3
Krisin (5,7-Dihidroksiflavon) ... 4
PEMBAHASAN ... 6
Floroasetofenon ... 6
Krisin (5,7-Dihidroksiflavon) ... 8
SIMPULAN DAN SARAN ... 10
Simpulan ... 10
Saran ... 11
DAFTAR PUSTAKA ... 11
LAMPIRAN ... 13
DAFTAR TABEL
Halaman
1
Rendemen sintesis produk metode Gulati
et al.
(1943) ... 4
2
Rendemen sintesis produk metode Ruttimann
et al.
(2010) ... 4
3
Rendemen sintesis produk metode Panda
et al
. (2010)... 4
4
Rendemen sintesis ester benzoil floroasetofenon dengan 4.5 ekuivalen benzoil
klorida ... 6
5
Analisis sinyal NMR floroasetofenon metode Gulati
et al.
(1943) (pelarut
aseton-
d
6) ... 76
Sinyal
1H-NMR produk metode Ruttimann
et al.
(2010) (pelarut aseton-
d
6) .... 77
Suhu dan waktu untuk pengeringan sampel ester benzoil ulangan 1 ... 8
8
Posisi sinyal-sinyal NMR ester tribenzoil floroasetofenon dalam pelarut CDCl
3... 9
viii
DAFTAR GAMBAR
Halaman
1
Retrosintesis krisin. ... 1
2
Kromatogram lapis tipis floroglusinol (kiri), produk metode Gulati
et al.
(1943)
(tengah) dan produk metode Ruttimann
et al.
(2010) (kanan)... 4
3
Uji kualitatif FeCl3 1% pada kontrol negatif (a), floroglusinol (b), produk
metode Gulati
et al.
(1943) (c), dan produk metode Ruttimann
et al.
(2010) (d).
... 4
4
Kromatogram lapis tipis produk metode Panda
et al.
(2010). ... 4
5
Uji kualitatif FeCl3 1% pada kontrol negatif (a), produk metode Panda
et al.
(2010) (b), dan fraksi ke-4 metode Tang
et al.
(2005) (c). ... 4
6
Kromatogram lapis tipis produk metode Tang
et al.
(2005). ... 5
7
Kromatogram lapis tipis produk metode Panda
et al.
(2010) (kiri) dan Tang
et
al.
(2005) (kanan). ... 5
8
Kromatogram lapis tipis produk ester dari floroasetofenon dengan 1.5
ekuivalen benzoil klorida (kiri) dan filtrat etanol (kanan). ... 5
9
Kromatogram lapis tipis ester benzoil floroasetofenon dengan 4.5 ekuivalen
benzoil klorida... 5
10
Uji kualitatif FeCl3 1% pada kontrol negatif (kiri) dan ester benzoil
floroasetofenon dengan 4.5 ekuivalen benzoil klorida (kanan). ... 5
11
Kromatogram lapis tipis diketon. ... 6
12
Uji kualitatif FeCl3 1% terhadap fraksi atas (kiri) dan fraksi bawah (kanan)... 6
13
Kromatogram lapis tipis diketon (kiri) dan flavon (kanan). ... 6
14
Reaksi asetilasi floroglusinol. ... 6
15
Dugaan produk Ruttimann
et al.
(2010). ... 7
16
Kromatogram lapis tipis berturut-turut dari kiri ke kanan, yaitu triester benzoil,
diketon (1.5, 3, 4.5, 6, 7.5, 9 ekuivalen piridina, 9 ekuivalen
KOH-piridina setelah ditambah CH
3COOH), filtrat diketon kasar, dan diketon kasar
7.5 ekuivalen KOH-piridina pembanding ... 10
DAFTAR LAMPIRAN
Halaman
1
Bagan alir penelitian ... 14
2
Radas sintesis floroasetofenon ... 15
3
Elusidasi struktur produk sintesis metode Gulati
et al.
(1943) ... 16
4
Elusidasi struktur produk sintesis metode Ruttimann
et al.
(2010) ... 18
5
Elusidasi struktur produk sintesis metode Panda
et al.
(2010) ... 20
6
Elusidasi struktur produk sintesis modifikasi metode Tang
et al.
(2005) ... 22
7
Elusidasi struktur ester benzoil floroasetofenon metode Wheeler (1963)... 23
PENDAHULUAN
Flavonoid merupakan kelompok senyawa polifenolik terbesar di alam dan ditemukan pada tumbuhan tingkat tinggi. Kerangka
dasarnya berupa 2 cincin benzena (C6) yang
terikat pada 1 rantai propana (C3) membentuk
kerangka 1,3-diarilpropana (C6-C3-C6).
Flavonoid memiliki berbagai bioaktivitas, seperti antiradang, antivirus, antimalaria, antibakteri, antidiabetes, dan yang paling luas penggunaannya ialah sebagai antioksidan.
Aneka bioaktivitas senyawa flavonoid
menarik untuk dikaji lebih lanjut. Upaya mengisolasi dari tumbuhan dilakukan, tetapi kandungan yang terbatas dan proses isolasi yang biasanya cukup panjang menjadi salah satu kendala utama. Oleh karena itu, dikembangkan upaya menyintesis senyawa tersebut.
Salah satu kelompok flavonoid yang telah dilaporkan memiliki bioaktivitas sebagai antikanker ialah flavon atau 2-fenilkromon
(Hong et al. 2010 dan Liu et al. 2010). Flavon
banyak terdapat pada tumbuhan berpembuluh, umumnya pada serealia dan tumbuhan perdu. Flavon yang mengandung gugus hidroksil pada posisi 5 dan 7 sangat penting dalam hal aktivitas biologis dan keberadaannya di alam yang cukup banyak. Flavon yang hanya mengandung gugus hidroksil pada posisi 5 dan 7 atau 5,7-dihidroksiflavon dikenal
dengan nama krisin. Do et al. (2009)
melaporkan bahwa krisin memiliki aktivitas biologis sebagai antioksidan, antimikrob, antispasmodik, anksiolitik, dan antiradang. Aktivitas lainnya seperti antikanker juga telah
dilaporkan oleh Zheng et al. (2003),
Sanderson et al. (2004), serta Wang dan
Morris (2007).
Metode utama sintesis flavon meliputi siklodehidrasi senyawa 1,3-diketon, siklisasi oksidatif kalkon, dan sintesis melalui reaksi
Wittig intramolekul (Lee et al. 2005). Dalam
penelitian ini, krisin disintesis dengan metode siklodehidrasi senyawa 1,3-diketon yang
diperoleh dari penataan-ulang Baker
Venkataraman (BV) floroasetofenon
terbenzoilasi. Metode ini pertama kali dikemukakan oleh Baker (1933) serta Bhalla
et al. (1935) dan telah dilaporkan juga oleh
Wheeler (1963), Ares et al. (1993), Romanelli
et al. (2010), dan Liu et al. (2010) dalam upaya menyintesis flavon. Metode BV pada
dasarnya merupakan reaksi kondensasi
Claisen intramolekul, yaitu pembentukan anion enolat keton oleh basa kuat yang kemudian bertindak sebagai nukleofili karbon
dan mengadisi gugus karbonil ester. Berbagai macam basa dapat digunakan antara lain KOH
(Wheeler 1963 dan Marder et al. 1997),
K2CO3 (Bois et al. 1999), NaOH (Hauteville
et al. 1996), KOtBu (Ares et al. 1993), LiHMDS (Nagarathnam & Cushman 1991),
dan LiN(i-Pr)2 (Lee et al. 2004).
Sintesis 1,3-diketon dengan penataan-ulang BV telah digunakan antara lain oleh Septiani (2011) dan Aryani (2011) dengan memodifikasi prosedur Wheeler (1963) dan menghasilkan senyawa prekursor dari flavon dan 7-hidroksiflavon berturut-turut 12.1 dan 4.3% dari bahan awal fenol dan resorsinol. Pembentukan flavon melalui penataan-ulang BV senyawa 1,3-diketon lazim digunakan karena metodenya relatif sederhana dan pereaksinya relatif mudah didapat (Aryani 2011). Oleh karena itu, sintesis krisin pada penelitian ini dilakukan dengan penataan-ulang BV dari bahan awal floroglusinol.
Sintesis krisin telah dilakukan oleh Panda
et al. (2010), Chee et al. (2011), dan Tang et
al. (2005) dari floroasetofenon dan benzoil
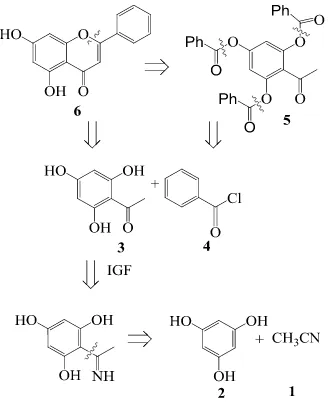
klorida melalui reaksi 1 tahap. Dalam penelitian ini, krisin diperoleh dalam 3 tahap. Tahap pertama ialah sintesis floroasetofenon
(3) dari floroglusinol (2) dan asetonitril (1).
Selanjutnya floroasetofenon dibenzoilasi
dengan benzoil klorida (4). Ester benzoil (5)
yang terbentuk mengalami penataan-ulang BV
yang selanjutnya membentuk krisin (6)
melalui modifikasi Wheeler (1963). Gambar 1 menunjukkan jalur retrosintesis krisin dalam penelitian ini.
2
BAHAN DAN METODE
Alat dan Bahan
Bahan-bahan p.a yang digunakan untuk sintesis ialah floroglusinol anhidrat, NaCl,
H2SO4 95–97%, asetonitril, dietil eter, KOH,
piridina kering (<0.0075%), CH3COOH
glasial, etil asetat, aseton, K2CO3, ZnCl2,
metanol, etanol, benzoil klorida (Merck®), dan
p-hidroksifenilasetonitril (Sigma Aldrich®).
Digunakan pula akuades, arang aktif, gas N2,
NaOH 28%, metilena klorida (MTC) teknis yang didistilasi 2 kali, etil asetat, dan aseton.
Alat-alat yang digunakan ialah radas distilasi dan radas penentuan titik leleh
Mel-Temp Model 1202D Barnstead® (tanpa
koreksi). Spektrum ultraviolet-tampak (UV-Vis) direkam dengan spektrometer Shimadzu
UV-1601 di Laboratorium Bersama,
Departemen Kimia IPB. Spektrum inframerah transformasi Fourier (FTIR) dianalisis dengan pelat KBr di Laboratorium Bidang Pangan,
Gedung Pusat Laboratorium Terpadu,
Universitas Islam Negeri Syarif Hidayatullah Jakarta. Spektrum NMR diperoleh dengan spektrometer JEOL ECA 500 yang bekerja
pada frekuensi 500 MHz (1H) dan 125 MHz
(13C) di Pusat Penelitian Kimia LIPI,
Puspiptek Serpong dan spektrometer Agilent DD2 500 yang bekerja pada frekuensi 500
MHz (1H) di Laboratorium NMR, Gedung
Basic Science A, Institut Teknologi Bandung.
Langkah Kerja
Tahapan penelitian terdiri atas sintesis
floroasetofenon dari floroglusinol dan
asetonitril, benzoilasi floroasetofenon,
penataan-ulang BV ester tribenzoil
floroasetofenon membentuk 1,3-diketon, dan siklisasi intramolekul senyawa 1,3-diketon dalam suasana asam membentuk krisin. Produk yang diperoleh dicirikan titik leleh, serta spektrum UV-Vis, FTIR, dan NMR (Lampiran 1).
Sintesis Floroasetofenon
Sintesis floroasetofenon pada penelitian ini menggunakan 2 metode. Metode pertama
mengadaptasi prosedur Gulati et al. (1943).
Sebanyak 10 mmol floroglusinol kering
(dikeringkan pada 120 C selama semalam),
20 mmol asetonitril, 5 mL dietil eter, dan 2
mmol serbuk halus ZnCl2 dimasukkan ke
dalam labu leher 3 (labu 1) yang telah
dirangkai dengan labu tempat sintesis gas HCl
(labu 2), pendingin, dan aliran gas N2
(Lampiran 2). Ke dalam labu 1 dialirkan secara cepat gas HCl dari labu 2 selama 2 jam dengan sesekali labu 1 diaduk dengan pengaduk magnetik. Gas HCl berasal dari
reaksi antara H2SO4 95–97% dan NaCl.
Setelah 2 jam, aliran gas HCl dihentikan. Labu 1 dilepaskan dari rangkaian alat, ditutp rapat dengan plastik, dan dibiarkan dalam
pendingin (freezer) selama 24 jam. Radas
dirangkaikan kembali, lalu gas HCl dialirkan selama 2 jam lagi, terbentuk warna jingga pucat. Labu 1 lalu dilepaskan dari rangkaian alat, ditutup rapat dengan plastik, dan didiamkan dalam pendingin selama 3 hari.
Endapan berwarna jingga-kuning yang terbentuk didekantasi dan dicuci dengan 2×10 mL dietil eter anhidrat. Endapan kemudian dipindahkan secara kuantitatif ke labu leher tunggal yang berisi 75 mL air panas dan direfluks hingga mendidih selama 2 jam. Sebanyak ±0.15 g arang aktif ditambahkan, lalu refluks dilanjutkan kembali hingga mendidih selama 15 menit. Campuran segera disaring panas-panas untuk mengambil filtrat. Arang aktif pada kertas saring dicuci dengan 2×25 mL air panas dan air cucian digabungkan dengan filtrat. Filtrat lalu didiamkan selama semalam dan terbentuk endapan floroasetofenon kasar yang tidak berwarna atau kuning pucat. Endapan ini disaring-vakum, dikeringkan pada suhu 120
C, dan direkristalisasi menggunakan air
panas.
Metode kedua mengadaptasi prosedur
Ruttimann et al. (2010). Disiapkan labu leher
3 yang dilengkapi dengan pengaduk magnetik,
aliran gas N2, dan termometer, terangkai
dengan labu tempat sintesis gas HCl, dan diletakkan di atas penangas es. Ke dalam labu tersebut sebanyak 5 mmol floroglusinol kering
(dikeringkan pada 120 C selama semalam)
dan 5.50 mmol p-hidroksifenilasetonitril
dilarutkan dalam 2.5 mL etil asetat pada suhu
kamar. Larutan didinginkan ke 5 C,
kemudian 19 mmol gas HCl ditambahkan dalam rentang waktu 1 menit dengan suhu
dijaga tetap 5–10 C. Campuran diaduk
selama 18 jam, lalu dituangkan ke dalam 5 mL air dan pH dijadikan 4 dengan larutan
NaOH/KOH 28%. Larutan selanjutnya
dipanaskan hingga 75 C untuk
menghilangkan etil asetat. Saat suhu naik
menjadi 101 C, campuran didinginkan ke 80
C dan suspensi yang terbentuk ditambahkan
selama 5 jam, didiamkan selama 4 jam, dan dihasilkan larutan kuning tua. Larutan ini
didistilasi untuk menghilangkan etanol,
didinginkan ke 20 C, dan didiamkan
semalam untuk pembentukan endapan
floroasetofenon. Endapan disaring, dicuci dengan 10 mL air, dan dikeringkan pada suhu
120 C selama 4 jam.
Sintesis Krisin (5,7-Dihidroksiflavon)
Sintesis krisin dari floroasetofenon
dilakukan dengan 3 metode. Metode pertama
mengadaptasi reaksi 1 tahap Panda et al.
(2010). Sebanyak 2.5 mmol floroasetofenon,
2.5 g K2CO3 anhidrat (baru ditanur 600 ºC
selama 1 jam dan didinginkan dalam desikator), 15 mL aseton, dan 1 mL benzoil klorida dimasukkan ke dalam labu leher 2
dengan atmosfer gas N2, lalu diaduk cepat
dengan pengaduk magnetik sambil direfluks
di atas penangas air suhu 50–60 ºC. Warna
putih terbentuk saat reaksi berlangsung dan akhirnya menjadi merah. Setelah 20 jam, aseton diuapkan seluruhnya dan 50 mL akuades ditambahkan ke dalam larutan, terbentuk endapan kuning. Endapan disaring,
dicuci dengan 10 mL akuades, lalu
dikeringkan pada suhu 60 ºC selama 15 jam. Metode kedua memodifikasi prosedur
Tang et al. (2005). Metode ini mirip dengan
metode Panda et al. (2010), namun campuran
floroasetofenon, K2CO3, dan aseton diaduk
dulu 10 menit sebelum benzoil klorida ditambahkan tetes demi tetes. Proses refluks
berlangsung hingga 24 jam, tanpa
menggunakan gas N2, dalam sintesis. Selain
itu, K2CO3 yang digunakan tidak mengalami
perlakuan pemanasan terlebih dahulu.
Pada metode ketiga, krisin disintesis dalam 3 tahap dengan memodifikasi prosedur Wheeler (1963). Tahap pertama ialah sintesis ester benzoil dari floroasetofenon. Sebanyak 10 mmol floroasetofenon ditambahkan 6 mL piridina kering dalam gelas piala 100 mL,.
Kemudian sambil diaduk, larutan
ditambahkan 45 mmol benzoil klorida. Reaksi berjalan eksoterm. Campuran didiamkan hingga tidak terbentuk kalor lagi (sekitar 25 menit), lalu ditambahkan 60 mL HCl 3% dan
20 g es batu secara bersamaan sambil diaduk
kuat. Terbentuk lapisan minyak kental berwarna putih yang dapat dipisahkan dari air. Endapan putih terbentuk setelah 3 hari didiamkan pada suhu kamar. Endapan disaring dan dicuci dengan 10 mL akuades
serta 10 mL metanol, lalu dikeringkan pada
suhu 70 C.
Tahap kedua ialah sintesis 1,3-diketon. Lima mmol ester benzoil floroasetofenon dilarutkan dengan 0.90 mL piridina kering dalam gelas piala 100 mL, kemudian larutan dipanaskan hingga 50 ºC. Sementara itu, 38 mmol KOH digerus dalam mortar yang sebelumnya telah dipanaskan dalam oven 105 ºC selama 1 jam. Serbuk KOH segera dituang ke dalam gelas piala, lalu campuran diaduk kuat menggunakan batang pengaduk selama 15 menit. Selama pengadukan, larutan mengental dan membentuk minyak berwarna cokelat. Setelah didinginkan ke suhu kamar,
larutan diasamkan dengan 1.20 mL
CH3COOH 10% tetes demi tetes. Minyak
yang terbentuk dipisahkan dari filtrat dan dikeringkan pada suhu kamar.
Tahap ketiga ialah sintesis krisin.
Sebanyak 2.5 mmol diketon kasar dilarutkan
dengan 3.3 mL CH3COOH glasial dalam labu
100 mL. Kemudian sambil diaduk, larutan
ditambahkan 0.18 mL H2SO4 95–97%. Labu
dirangkai dengan pendingin refluks dan dipanaskan dalam penangas air pada suhu 82
C selama 3 jam sambil sesekali diaduk.
Produk reaksi dituang panas-panas ke dalam 18 g es yang telah dihancurkan. Setelah es mencair, produk reaksi disaring. Terbentuk lapisan minyak berwarna cokelat, yang kemudian didiamkan pada suhu kamar selama 40 jam. Endapan cokelat yang terbentuk disaring, dan dicuci dengan air sampai bebas-asam. Endapan dikeringkan di dalam oven pada suhu 55 °C.
HASIL
Floroasetofenon
Sintesis floroasetofenon metode Gulati et
al. (1943) menghasilkan endapan berwarna
kuning pucat (Lampiran 3a) dengan Rf~ 0.71
(Gambar 2) pada eluen n-heksana-EtOAc
(2:3), dengan titik leleh 217–219 ºC sesuai
dengan yang dilaporkan Gulati et al. (1943).
Rendemen berkisar 33–75% (Tabel 1). Uji
kualitatif dengan FeCl3 1% menghasilkan
warna merah-cokelat, berbeda dengan hasil uji floroglusinol yang berwarna biru (Gambar 3). Spektrum UV-Vis menunjukkan serapan pada 226 dan 285.8 nm dengan efek batokromik
teramati pada penambahan NaOH dan AlCl3
(Lampiran 3a dan 3b). Spektrum 1H-NMR
4
13
C-NMR (Lampiran 3d) menunjukkan 1
sinyal karbon-sp3 (30.05 ppm), 4 sinyal
karbon-sp2 aromatik (95.76, 105.49, 165.46,
dan 165.52 ppm), dan 1 sinyal karbon-sp2
keton (203.70 ppm).
Gambar 2 Kromatogram lapis tipis floroglusinol (kiri), produk
metode Gulati et al. (1943)
(tengah) dan produk metode
Ruttimann et al. (2010)
(kanan) (eluen n
-heksana-EtOAc 2:3).
Tabel 1 Rendemen sintesis produk metode
Gulati et al. (1943)
Ulangan Floroglusinol (mmol)
Produk (mmol)
Rendemen (%)
1 10.06 6.51 64.71
2 10.13 6.58 64.96
3 89.39 29.66 33.18
4 50.02 37.09 74.15
Metode Ruttimann et al. (2010)
menghasilkan endapan cokelat (Lampiran 4a)
dengan Rf~ 0.57 pada eluen n-heksana-EtOAc
(2:3) (Gambar 2), dengan titik leleh 244–250
ºC. Rendemen yang diperoleh sebesar 0.2–
75% (Tabel 2). Uji kualitatif dengan FeCl3 1%
juga menghasilkan warna merah-cokelat (Gambar 3). Spektrum UV-Vis menunjukkan serapan pada 224.4 dan 287 nm dengan efek batokromik teramati pada penambahan NaOH
dan AlCl3 (Lampiran 4a dan 4b). Spektrum
1
H-NMR menunjukkan sinyal singlet di 3.02, 4.30, 5.93, 8.11, 9.21, dan 11.71 ppm, serta 2
buah sinyal triplet dari doblet di 6.74 dan 7.1
ppm (Lampiran 4c).
Tabel 2 Rendemen sintesis produk metode
Ruttimann et al. (2010)
Ulangan Floroglusinol (mmol)
Produk (mmol)
Rendemen (%)
1 5.00 3.77 75.4
2 5.02 0.43 8.57
3 5.01 0.01 0.30
(a) (b) (c) (d)
Gambar 3 Uji kualitatif FeCl3 1% pada
kontrol negatif (a), floroglusinol
(b), produk metode Gulati et al.
(1943) (c), dan produk metode
Ruttimann et al. (2010) (d).
Krisin (5,7-Dihidroksiflavon)
Sintesis krisin metode Panda et al. (2010)
menghasilkan endapan kuning (Lampiran 5a),
dengan Rf ~ 0.80 (Gambar 4) pada eluen n
-heksana-EtOAc (2:3). Titik lelehnya 145–155
ºC, jauh di bawah titik leleh krisin yang
dilaporkan Panda et al. (2010), yaitu 275–276
ºC. Rendemen yang diperoleh 45.67% dan
91% (Tabel 3). Uji kualitatif dengan FeCl3 1%
menghasilkan warna cokelat (Gambar 5). Spektrum UV-Vis menunjukkan serapan pada 263 nm dan tidak terjadi efek batokromik
pada penambahan NaOH dan AlCl3
(Lampiran 5a, 5b, 5c). Spektrum 1H-NMR
ditunjukkan pada Lampiran 5d dan hasilnya tidak dapat diinterpretasikan.
Gambar 4 Kromatogram lapis tipis produk
metode Panda et al. (2010) (eluen
n-heksana-EtOAc 2:3).
Tabel 3 Rendemen sintesis produk metode
Panda et al. (2010)
Ulangan F1 (mmol)
Produk (mmol)
Rendemen (%)
1 1 0.91 91
2 2.54 1.16 45.67
Ket: F1 = Produk metode Gulati et al. (1943)
(a) (b) (c)
Gambar 5 Uji kualitatif FeCl3 1% pada
kontrol negatif (a), produk
metode Panda et al. (2010) (b),
dan fraksi ke-4 metode Tang et
al. (2005) (c).
Metode modifikasi Tang et al. (2005)
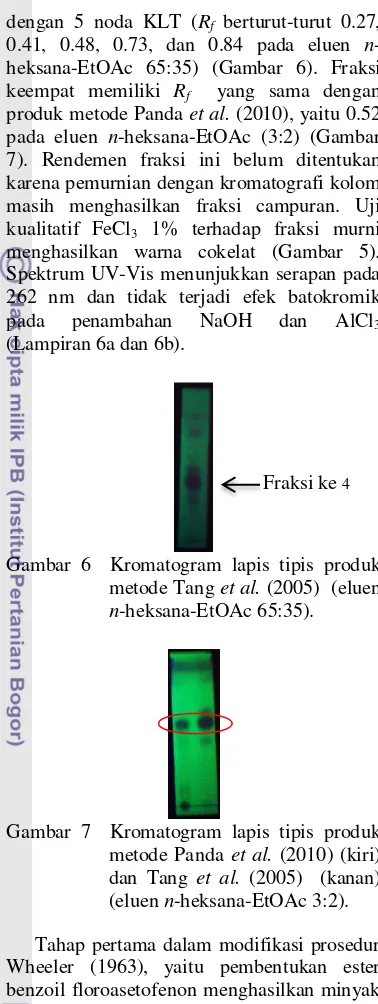
dengan 5 noda KLT (Rf berturut-turut 0.27,
0.41, 0.48, 0.73, dan 0.84 pada eluen n
-heksana-EtOAc 65:35) (Gambar 6). Fraksi
keempat memiliki Rf yang sama dengan
produk metode Panda et al. (2010), yaitu 0.52
pada eluen n-heksana-EtOAc (3:2) (Gambar
7). Rendemen fraksi ini belum ditentukan karena pemurnian dengan kromatografi kolom masih menghasilkan fraksi campuran. Uji
kualitatif FeCl3 1% terhadap fraksi murni
menghasilkan warna cokelat (Gambar 5). Spektrum UV-Vis menunjukkan serapan pada 262 nm dan tidak terjadi efek batokromik
pada penambahan NaOH dan AlCl3
(Lampiran 6a dan 6b).
Gambar 6 Kromatogram lapis tipis produk
metode Tang et al. (2005) (eluen
n-heksana-EtOAc 65:35).
Gambar 7 Kromatogram lapis tipis produk
metode Panda et al. (2010) (kiri)
dan Tang et al. (2005) (kanan)
(eluen n-heksana-EtOAc 3:2).
Tahap pertama dalam modifikasi prosedur Wheeler (1963), yaitu pembentukan ester benzoil floroasetofenon menghasilkan minyak tidak berwarna dengan 1.5 ekuivalen benzoil
klorida, yang bila didiamkan 6 hari
membentuk endapan putih (Lampiran 7a).
Persen konversi produk 135.45% dan
menghasilkan 4 noda KLT dengan Rf 0.02,
0.11, 0.22, dan 0.37 pada eluen n
-heksana-EtOAc (9:1). Rekristalisasi dengan etanol tidak mengurangi jumlah noda (Gambar 8). Pemurnian produk tidak dilakukan.
Gambar 8 Kromatogram lapis tipis produk ester dari floroasetofenon dengan 1.5 ekuivalen benzoil klorida (kiri) dan filtrat etanol (kanan)
(eluen n-heksana-EtOAc 9:1).
Dengan 4.5 ekuivalen benzoil klorida, dihasilkan endapan putih (Lampiran 7b) dengan rendemen 103% dan 107% (Tabel 4),
Rf ~ 0.72 pada eluen n-heksana-EtOAc (8:3)
(Gambar 9), serta titik leleh 86–90 ºC.
Identifikasi dengan FeCl3 memberikan warna
kuning yang sama dengan kontrol negatif (Gambar 10). Spektrum UV-Vis menunjukkan serapan pada 235 nm yang tidak memberikan efek batokromik pada penambahan NaOH
(Lampiran 7b dan 7c). Spektrum 1H-NMR
menunjukkan 2 sinyal singlet di daerah 2.50 dan 7.24 ppm, 2 sinyal triplet di daerah 7.52 dan 7.65 ppm, dan 1 sinyal doblet di daerah
8.17 ppm (Lampiran 7d). Spektrum 13C-NMR
menunjukkan 1 sinyal karbon-sp3 (31.4 ppm),
1 sinyal karbon-keton (197.5 ppm), 2 sinyal karbon-ester (164.1 dan 164.2 ppm), 4 sinyal karbon-aromatik kuartener (125.9, 134.2, 148.6 dan 152.1 ppm), 4 sinyal karbon-aromatik (114.6, 128.5, 128.7, dan 130.4 ppm)
dan 1 sinyal pelarut CDCl3 (77 ppm)
(Lampiran 7e).
Gambar 9 Kromatogram lapis tipis ester benzoil floroasetofenon dengan 4.5 ekuivalen benzoil klorida
(eluen n-heksana-EtOAc 8:3).
Gambar 10 Uji kualitatif FeCl3 1% pada
kontrol negatif (kiri) dan ester benzoil floroasetofenon dengan 4.5 ekuivalen benzoil klorida (kanan).
6
Tabel 4 Rendemen sintesis ester benzoil
floroasetofenon dengan 4.5
ekuivalen benzoil klorida
Ulangan Floroglusinol (mmol)
Ester (mmol)
Rendemen (%)
1 10 10.31 103.1
2 10 10.65 106.5
Tahap kedua adalah pembentukan diketon dari ester benzoil floroasetofenon. Sintesis dengan 7.5 ekuivalen KOH-piridina kering menghasilkan minyak berwarna kuning-cokelat (Lampiran 8a) yang setelah 6 hari membentuk endapan cokelat dengan persen konversi produk sebesar 71.62%. Uji KLT
menghasilkan 2 noda dengan Rf~ 0.34 dan ~
0.42 pada eluen n-heksana-EtOAc (8:3)
(Gambar 11). Pemisahan dengan KLTP dan
kromatografi kolom belum berhasil
memisahkan keseluruhan produk. Spektrum UV-Vis fraksi atas menunjukkan serapan di 268 dan 312 nm dengan efek batokromik pada
penambahan NaOH dan AlCl3 (Lampiran 8b,
8c, dan 8d), sedangkan fraksi bawah menunjukkan serapan di 264 nm tanpa efek batokromik serupa (Lampiran 8e dan 8f).
Identifikasi dengan FeCl3 memberikan warna
merah-cokelat (fraksi atas) dan cokelat (fraksi
bawah) (Gambar 12). Spektrum FTIR
(Lampiran 8g) menunjukkan puncak-puncak khas krisin di 3000an, 1651.35, 1612.08,
1577.34, dan 1555.91 cm-1. Spektrum 1
H-NMR (Lampiran 8h) menunjukkan 3 sinyal singlet di 1.28, 6.78, dan 12.88 ppm, 2 sinyal doblet di 6.27 dan 6.57 ppm, sinyal multiplet di sekitar 7.6 ppm, 1 sinyal doblet dari doblet di 8.05 ppm, serta 3 sinyal pengotor (2.05, 2.95, dan 5.61 ppm).
Gambar 11 Kromatogram lapis tipis diketon
(n-heksana-EtOAc 8:3).
Gambar 12 Uji kualitatif FeCl3 1% terhadap
fraksi atas (kiri) dan fraksi bawah (kanan).
Tahap ketiga adalah sintesis krisin dari campuran produk tahap kedua. Dihasilkan
endapan berwarna cokelat (Lampiran 9), dengan persen konversi sebesar 41.31%. Uji KLT menghasilkan noda yang sama dengan produk diketon, namun intensitas pendaran fraksi atas terlihat lebih nyata dibandingkan pada diketon (Gambar 13).
Gambar 13 Kromatogram lapis tipis diketon
(kiri) dan flavon (kanan) (n
-heksana-EtOAc 8:3).
PEMBAHASAN
Floroasetofenon
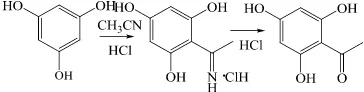
Floroasetofenon disintesis dari
floroglusinol menggunakan reaksi Houben-Hoesch. Reaksi ini termasuk asilasi Friedel-Crafts, dengan asetonitril atau turunannya menjadi penyumbang kation asil pada
floroglusinol, membentuk senyawa
ketiminium klorida sebagai produk antara
(Gulati et al. 1943, Liu et al. 2007, Ruttimann
et al. 2010) (Gambar 14). Dalam penelitian
ini, asetonitril (Gulati et al. 1943) dan p
-hidroksifenilasetonitril (Ruttimann et al.
2010) dibandingkan efektivitasnya sebagai penyumbang kation asil.
Gambar 14 Reaksi asetilasi floroglusinol.
Produk metode Gulati et al. (1943) berupa
endapan kuning pucat yang menghasilkan
noda KLT tunggal dengan Rf ~ 0.71. Titik
lelehnya 217–219 ºC, sesuai dengan titik leleh
floroasetofenon yang dilaporkan Gulati et al.
efek batokromik. Penambahan AlCl3 juga
menggeser puncak serapan 285.8 ke 303.6 nm dan tidak kembali ke panjang gelombang semula setelah penambahan HCl. Hal ini
mengindikasikan gugus fenolik berposisi
o-terhadap gugus asil (Markham 1988).
Spektrum 1H-NMR hanya menunjukkan
sinyal proton asetil di 2.59 ppm dan proton aromatik di 5.92 ppm. Disekitar 12 ppm tidak
terdapat sinyal khas fenolik yang berposisi o-
terhadap gugus asil. Diduga pelarut aseton-d6
membentuk ikatan hidrogen antar molekul dengan OH tersebut sehingga tidak berikatan
hidrogen intramolekul dengan gugus o- asil.
Spektum 13C-NMR menunjukkan 6 sinyal
karbon yang melengkapi analisis spektrum
1
H-NMR. Satu sinyal di 30.05 ppm
menunjukkan karbon-sp3 metil dan sinyal di
203.70 ppm menunjukkan karbon karbonil terkonjugasi. Sinyal di 165.46 dan 165.52 yang sangat ke medan bawah berasal dari karbon-karbon yang mengikat OH dan secara langsung mengalami tarikan-elektron yang
kuat. Sebaliknya karbon aromatik orto
terhadap OH mengalami pergeseran ke medan atas (95.76 ppm) karena sumbangan-elektron dari atom oksigen meningkatkan pemerisaian pada atom-atom karbon tersebut. Sinyal di 105.49 ppm berasal dari karbon yang mengikat gugus asil,. Tarikan-elektron gugus asil tidak sekuat gugus hidroksil dan mengalami efek sumbangan-elektron yang
kuat dari 2 gugus OH di posisi orto. Oleh
karena itu, geseran kimianya lebih ke medan atas daripada sinyal karbon oksiaril.
Spektrum NMR telah membuktikan
terbentuknya floroasetofenon dengan metode
Gulati et al. (1943). Tabel 5 meringkaskan
analisis spektrum tersebut. Rendemen
tertinggi mencapai 74.15%, sesuai dengan
yang dilaporkan Gulati et al. (1943), yaitu 74–
87%. Rendemen terendah 33.18% diakibatkan penggunaan mol gas HCl yang terlalu sedikit. Sintesis dilakukan dalam sistem radas
tertutup, bebas-H2O, dengan suhu reaksi
dijaga tetap dalam kisaran 0–10 ºC.
Tabel 5 Analisis sinyal NMR floroasetofenon
metode Gulati et al. (1943) (pelarut
aseton-d6)
Atom C/H
H 500 MHz (ppm) (multiplisitas, H)
C 125 MHz (ppm)
1 - 203.70
2 2.59 (s, 3H) 30.05
1’ - 105.49
2’/6’ - 165.46
4’ - 165.52
3’/5’ 5.92 (s, 2H) 95.76
.
Metode Ruttimann et al. (2010
menghasilkan endapan cokelat pada ulangan 1, namun tidak terulang (Tabel 2). Titik
lelehnya 244–250 ºC, lebih tinggi daripada
titik leleh floroasetofenon yang dilaporkan
Gulati et al. (1943) dan menghasilkan 1 noda
KLT dengan Rf ~ 0.57 pada eluen n
-heksana-EtOAc (2:3). Spektrum UV-Vis (Lampiran 4) menunjukkan 2 puncak serapan di 224 dan 287 nm. Penambahan NaOH menggeser
puncak 287 ke 321 nm. Penambahan AlCl3
juga menggeser puncak serapan 287 ke 308 nm dan tidak kembali ke panjang gelombang semula setelah penambahan HCl. Hasil ini mengindikasikan senyawa yang diperoleh
juga memiliki gugus fenolik berposisi
o-terhadap gugus asil (Markham 1988). Dugaan
produk Ruttimann et al. (2010) berdasarkan
mekanismenya ditunjukkan pada Gambar 15.
Gambar 15 Dugaan produk Ruttimann et al.
(2010).
Spektrum 1H-NMR menunjukkan 8 sinyal
yang tidak cocok dengan dugaan produk
Ruttimann et al. (2010). Struktur molekul
belum dapat ditentukan dari sinyal-sinyal 1
H-NMR yang didapat (Tabel 6). Diduga juga terdapat pengotor, dengan angka banding proton yang tidak bulat.
Tabel 6 Sinyal 1H-NMR produk metode
Ruttimann et al. (2010) (pelarut
aseton-d6)
H 500 MHz (ppm)
multiplisitas, J
(Hz)
3.02 s
4.30 s
5.93 s
6.74 td, 8.4
7.1 td, 8.4
8.11 s
9.21 s
8
Ruttimann et al. (2010) menggunakan
p-hidroksifenilasetonitril sebagai penyumbang kation asil. Garam ketiminium klorida terbentuk dengan keberadaan gas HCl. Hidrolisis terhadap garam ini dilakukan menggunakan KOH/NaOH 28% hingga pH 4
guna meminimumkan kelarutan garam
ketinium klorida dalam keberadaan etil asetat
(Ruttimann et al. (2010). Penentuan pH 4
dalam metode ini menjadi kendala utama, karena setelah penambahan KOH/NaOH 28% terjadi perubahan pH 4 menjadi 2 selama penguapan pelarut etil asetat. Hidrolisis yang terjadi tidak sempurna, produk masih dalam bentuk garam ketiminium klorida. Hal ini yang diduga rendemen ulangan kedua dan ketiga rendah yaitu 8.57 dan 0.30%.
Berdasarkan analisis di atas, hanya metode
Gulati et al. (1943) yang berhasil
mendapatkan floroasetofenon. Oleh karena itu, penelitian ini menunjukkan bahwa metode
Gulati et al. (1943) paling baik untuk
menyintesis floroasetofenon dan digunakan dalam penelitian selanjutnya.
Krisin (5,7-Dihidroksiflavon)
Metode Panda et al. (2010) dan modifikasi
Tang et al. (2005) secara garis besar memiliki
prinsip kerja yang sama. Perbedaannya terletak pada pada tahapan prosedur dan lamanya refluks. Selain itu, pada modifikasi
Tang et al. (2005), K2CO3 yang digunakan
tidak dipanaskan terlebih dahulu dan sintesis
dilakukan tanpa penggunaan gas N2.
Produk sintesis kedua metode sama-sama
menghasilkan noda dengan Rf ~ 0.52 pada
eluen n-heksana-EtOAc 3:2 (Gambar 7), dan
kemungkinan menunjukkan senyawa yang sama. Akan tetapi, terjadi reaksi samping
dengan modifikasi Tang et al. (2005),
ditunjukkan dengan terbentuknya 4 noda lain
pada eluen n-heksana-EtOAc 65:35 (Gambar
6). Pemisahan dengan kromatografi kolom dilakukan untuk memperoleh noda tunggal
dengan Rfyang sama dengan produk metode
Panda et al. (2010).
Pemisahan dilakukan dengan teknik elusi
gradien. Eluen yang digunakan ialah n
-heksana-MTC (3:5), n-heksana-EtOAc (3:2),
dan etil asetat. Pemisahan dengan teknik elusi gradien dipilih karena 3 fraksi teratas dapat
dipisahkan dengan baik menggunakan n
-heksana-MTC (3:5), sedangkan fraksi 4 dan 5
terpisah baik dengan n-heksana-EtOAc (3:2).
Dari proses pemisahan ini, sebanyak 32 dari 175 tabung murni mengandung fraksi 4 dan
beberapa tabung masih mengandung
campuran fraksi 4 dan 5. Pemisahan fraksi campuran ini memerlukan teknik pemisahan dengan KLTP.
Spektrum UV-Vis noda dengan Rf ~ 0.52
memiliki puncak serapan yang tidak berbeda nyata, yaitu 263 dan 262 nm, berturut-turut
untuk metode Panda et al. (2010) dan
modifikasi Tang et al. (2005) (Lampiran 5a
dan 6a). Penambahan NaOH dan AlCl3 tidak
menggeser puncak serapan tersebut,
menunjukkan tidak adanya hidroksil fenolik. Dugaan sementara, seluruh gugus hidroksil floroasetofenon membentuk ester benzoil,
maka analisis 1H-NMR dilakukan untuk
menentukan struktur produk. Produk metode
Panda et al. (2010) yang memiliki noda
tunggal dipilih untuk pencirian. Hasilnya ditunjukkan pada Lampiran 5d dan tidak dapat
diinterpretasikan. Berdasarkan hasil ini,
modifikasi Tang et al. (2005) tidak dianalisis
lebih lanjut.
Sintesis krisin selanjutnya menggunakan
modifikasi prosedur Wheeler (1963).
Benzoilasi floroasetofenon menggunakan 1.5
ekuivalen benzoil klorida menghasilkan
minyak tidak berwarna yang setelah
didiamkan 6 hari membentuk endapan putih (Lampiran 7a). Persen konversi produk 83.73%, menghasilkan 4 noda KLT pada
eluen n-heksana-EtOAc (9:1). Rekristalisasi
dengan etanol tidak mengurangi jumlah noda (Gambar 8). Pemurnian lebih lanjut terhadap produk belum dilakukan karena tidak adanya
noda yang dominan sebagai produk utama.
Benzoilasi dengan 4.5 ekuivalen benzoil klorida menghasilkan endapan berwarna putih dengan rendemen 103% dan 107%, titik leleh
86–90 ºC. Besarnya rendemen yang diperoleh
awalnya diduga karena endapan masih mengandung air. Upaya mengeringkan telah dilakukan terhadap sampel ulangan 1 (Tabel 7), tetapi rendemen yang diperoleh tetap di atas 100%.
Tabel 7 Suhu dan waktu untuk pengeringan sampel ester benzoil ulangan 1
Suhu (ºC) Waktu (jam) Rendemen (%) Selisih rendemen (%)
40 48 108 -
60 6 107 1
60 6 106 1
69 5 103 3
Produk menghasilkan noda tunggal KLT
dengan Rf ~ 0.72. Spektrum UV-Vis
senyawa tersebut tidak mengandung atom hidroksil fenolik, maka diduga merupakan ester tribenzoil floroasetofenon.
Spektrum 1H-NMR (Lampiran 7d)
menghasilkan 5 sinyal yang terbedakan,
sementara spektrum 13C-NMR (Lampiran 7e)
menghasilkan 10 sinyal. Tidak terdeteksi
sinyal pengotor H2O sehingga belum dapat
dipastikan sebagai penyebab rendemen
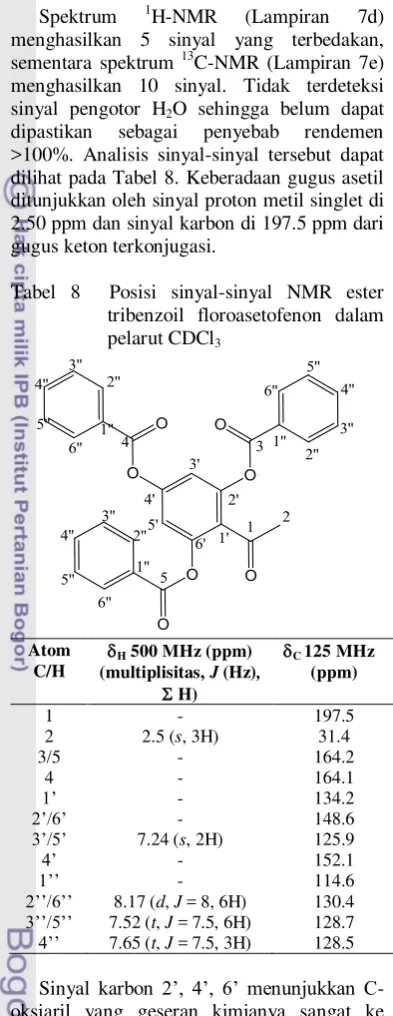
>100%. Analisis sinyal-sinyal tersebut dapat dilihat pada Tabel 8. Keberadaan gugus asetil ditunjukkan oleh sinyal proton metil singlet di 2.50 ppm dan sinyal karbon di 197.5 ppm dari gugus keton terkonjugasi.
Tabel 8 Posisi sinyal-sinyal NMR ester tribenzoil floroasetofenon dalam
pelarut CDCl3
Atom C/H
H 500 MHz (ppm) (multiplisitas, J (Hz),
H)
C 125 MHz (ppm)
1 - 197.5
2 2.5 (s, 3H) 31.4
3/5 - 164.2
4 - 164.1
1’ - 134.2
2’/6’ - 148.6
3’/5’ 7.24 (s,2H) 125.9
4’ - 152.1
1’’ - 114.6
2’’/6’’ 8.17 (d, J = 8, 6H) 130.4
3’’/5’’ 7.52 (t, J = 7.5, 6H) 128.7
4’’ 7.65 (t, J = 7.5, 3H) 128.5
Sinyal karbon 2’, 4’, 6’ menunjukkan C
-oksiaril yang geseran kimianya sangat ke medan bawah, dibandingkan dengan karbon
1’. Hal ini disebabkan tarikan-elektron C=O
tidak sekuat O. Sinyal karbon 3’, 5’ yang
o-terhadap 2 O bergeser ke medan atas karena efek resonans penyumbang-elektron. Sinyal
karbon 1’’ dipengaruhi tarikan-elektron ester yang lebih lemah dari keton, menyebabkan geseran kimianya lebih ke medan atas
dibandingkan karbon 1’. Posisi sinyal karbon
2’’, 4’’, 6’’ dipengaruhi oleh efek resonans
penarik elektron C=O o- / p-, yang tidak
terjadi pada 3’’, 5’’ (m-).
Ester tribenzoil floroasetofenon diubah menjadi 1,3-diketon melalui penataan-ulang BV menggunakan KOH-piridina dengan 7.5 ekuivalen benzoil klorida. Endapan cokelat diperoleh setelah 6 hari dibiarkan pada suhu kamar. Persen konversi produk sebesar
71.62% dan memperlihatkan 2 noda KLT Rf ~
0.34 dan ~ 0.42 pada eluen n-heksana-EtOAc
(8:3) (Gambar 11). Pemisahan 2 noda menggunakan KLTP dan kromatografi kolom
hanya berhasil memisahkan sebagian
campuran. Spektrum UV-Vis dari fraksi atas
(Rf~ 0.42) menghasilkan 2 puncak serapan di
268 dan 312 nm. Puncak pertama bergeser +8 nm pada penambahan NaOH (Lampiran 8b
dan 8c). Penambahan AlCl3 menggeser
puncak kedua sejauh +70 nm, dan tidak teramati pergeseran kedua puncak setelah penambahan HCl (Lampiran 8d). Disimpulkan bahwa fraksi atas memiliki gugus hidroksil
fenolik dengan posisi orto terhadap asil.
Puncak serapan dan pergeseran yang teramati ini menyerupai puncak serapan krisin
menurut Coleska et al. (1995) dan
Sundaraganesan et al. (2012). Serapan
UV-Vis dilaporkan terjadi di sekitar 270 dan 314 nm. Pergeseran sejauh +6 nm terjadi pada serapan 270 nm setelah penambahan NaOAc, mengindikasikan keberadaan hidroksil fenolik pada posisi 7. Pergeseran sejauh +66 nm
teramati pada serapan 314 nm
mengindikasikan keberadaan hidroksil fenolik pada posisi 5. Tidak ada pergeseran kembali setelah penambahan HCl. Kesesuaian ini menunjukkan bahwa kemungkinan besar fraksi atas adalah krisin.
Spektrum FTIR fraksi atas (Lampiran 8g) menunjukkan puncak-puncak serapan sangat menyerupai spektrum krisin standar yang
dilaporkan di literatur (Coleska et al. 1995).
Bilangan gelombang di sekitar 3000 cm-1
menunjukkan gugus hidroksil. Pita serapan
kuat di 1651.35 cm-1 dihasilkan oleh gugus
keton yang terkonjugasi dengan gugus alkena dan benzena. Bilangan gelombang di 1612.08,
1577.34, dan 1555.91 cm-1 berasal dari vibrasi
ulur C=C aromatik. Hasil ini memperkuat bahwa fraksi atas adalah krisin.
Spektrum 1H-NMR fraksi atas terangkum
pada Tabel 9, menunjukkan 10 sinyal dengan 3 sinyal pengotor (2.05, 2.95, dan 5.61 ppm) (Lampiran 8h). Sinyal di 12.88 ppm menunjukkan keberadaan gugus hidroksil fenolik yang berikatan hidrogen intramolekul
dengan gugus o- asil. Sinyal gugus hidroksil
10
Tabel 9 Analisis sinyal 1H-NMR krisin
(pelarut aseton-d6)
Atom C/H
H 500 MHz (ppm) (multiplisitas, J(Hz), Σ H)
3 6.78 (s, 1H)
5 12.88 (s, 1H)
6 6.27 (d, J = 1.95, 1H)
7 1.28 (s, 1H)
8 6.57 (d, J = 1.95, 1H)
2’/6’ 8.05 (dd, J = 6.5, 2H)
3’/4’/5’ 7.57 (m, 3H)
Proton aromatik pada cincin A
memberikan 2 sinyal, yaitu 6.27 dan 6.57 ppm. Sinyal pertama berasal dari proton yang
orto dengan 2-OH (C6) dan sinyal kedua
berasal dari proton yang orto dengan OH dan
substituen oksigen eter penyumbang-elektron (C8). Proton aromatik pada cincin B menghasilkan 2 sinyal di 8.05 dan 7.57 ppm.
Dua proton di posisi orto merasakan tarikan
elektron dari sistem keton tak jenuh-α,β
sehingga sinyalnya lebih ke medan bawah
(8.05 ppm) (C2’, C6’). Sementara sinyal di
7.57 ppm merupakan tumpang-tindih sinyal
yang berasal dari 3 proton di posisi meta dan
para (C3’, C4’, C5’). Sinyal di 6.78 ppm berasal dari proton vinilik di cincin C.
Spektrum UV-Vis fraksi bawah (Rf ~ 0.34)
menunjukkan serapan di 264 nm yang tidak
mengalami efek batokromik pada
penambahan NaOH dan AlCl3 (Lampiran 8e
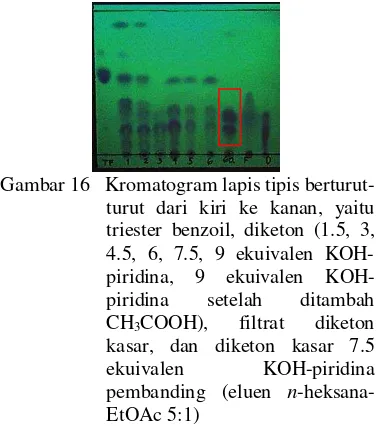
dan 8f). Hasil ini menunjukkan bahwa senyawa yang dihasilkan tidak mengandung gugus hidroksil fenolik, maka diduga bukan termasuk senyawa 1,3-diketon maupun krisin. Penggunaan 7.5 ekuivalen KOH-piridina Wheeler (1963) terhadap ester tribenzoil floroasetofenon telah membentuk krisin tanpa melalui senyawa 1,3-diketon sebagai zat antara. Krisin telah didapatkan pada tahap sintesis 1,3-diketon bercampur dengan produk lain. Gambar 16 menjelaskan bagaimana 2 noda diketon kasar diperoleh.
Gambar 16 Kromatogram lapis tipis berturut-turut dari kiri ke kanan, yaitu triester benzoil, diketon (1.5, 3, 4.5, 6, 7.5, 9 ekuivalen piridina, 9 ekuivalen
KOH-piridina setelah ditambah
CH3COOH), filtrat diketon
kasar, dan diketon kasar 7.5
ekuivalen KOH-piridina
pembanding (eluen n
-heksana-EtOAc 5:1)
Berdasarkan Gambar 16, diduga bahwa krisin sudah terbentuk pada penggunaan 3
ekuivalen KOH-piridina. Jumlah noda
terbanyak dihasilkan dari penggunaan 1.5 ekuivalen KOH-piridina, yaitu 7 noda, dan paling sedikit dengan 7.5 dan 9 ekuivalen KOH-piridina yaitu 3 noda yang berkurang
setelah diasamkan dengan CH3COOH. Hasil
ini mengindikasikan reaksi mengarah ke
pembentukan 2 noda dengan Rf ~ 0.34 dan ~
0.42 meskipun anomali terjadi pada noda diketon dengan 4.5 ekuivalen KOH-piridina.
Usaha untuk mendapatkan krisin murni dilakukan dengan melanjutkan tahap ketiga metode Wheeler (1963) pada produk krisin kasar. Produk yang didapat berupa endapan cokelat (Lampiran 8i) dengan persen konversi sebesar 41.31%. Pencirian dengan KLT tidak
menunjukkan perubahan noda, namun
intensitas pendarfluor fraksi atas terlihat lebih kuat dibandingkan dengan senyawa awal (Gambar 13). Diduga reaksi pembentukan krisin meningkat. Diperlukan pemurnian lebih lanjut terhadap produk ini baik dengan KLT maupun kromatografi kolom.
SIMPULAN DAN SARAN
Simpulan
Saran
Krisin kasar perlu dimurnikan lebih lanjut
untuk memperoleh krisin murni, dan
menentukan rendemen.
DAFTAR PUSTAKA
Ares JJ et al. 1993. A convenient large-scale
synthesis of 5-methoxyflavone and its
application to analog preparation. J Org
Chem 58:7903-7905.
Aryani L. 2011. Sintesis prekursor 1,3-diketon
untuk 7-hidroksiflavon dari resorsinol
[skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Baker WJ. 1933. Molecular rearrangement of
some o-acyloxyacetophenones and the
mechanism of the production of
3-acylchromones. J Chem Soc 1381-1389.
Bhalla DC, Mahal HS, Venkataraman K. 1935. Synthetical experiments in the chromone group. Part X VII. Further observations on the action of sodamide on
o-acyloxyacetophenones. J Chem Soc
868-870.
Bois F, Beney F, Mariotte AM, Bounmendjel.
1999. A one-step synthesis of
hydroxyflavones. Synlett 9:1480-1482.
Chee CF, Buckle MJC, Rahman NA. 2011. An efficient one-pot synthesis of flavones.
Tetrahedron Lett 52:3120-3123.
Coleska Z, Dorevski K, Klisarova L, Milosevic LS. 1995. Identification of
phenolic constituents isolated from
Macedonian propolis. Bull Chem Tech
Macedonia 14: 13-17.
Do TH, Vo PN, Tran TD. 2009. Synthesis and
inhibitory activity against COX‐2
catalyzed prostaglandin production of
chrysin derivatives. Bioorg Med Chem Lett
14:1165‐1167.
Gulati KC, Seth SR, Venkataraman. 1943.
Phloroacetophenone. Org Syn Coll 2:522.
Hauteville M, Gaillard P, Kaouadji M, Duclos MP. 1996. Synthesis of novel C-
methylflavones. Liebigs Ann 1217-1222.
Hong TB, Rahumatullah A, Yogarajah T, Ahmad M, Yin KB. 2010. Potential effects
of chrysin on MDA-MB-231 cells. Int J
Mol Sci 11:1057-1069.
Lee JI, Son HS, Park H. 2004. An efficient
synthesis of flavones from 2-
hydroxybenzoic acids. Bull Korean Chem
Soc 25:1945-1947.
Lee JI, Son HS, Jung MG. 2005. A novel
synthesis of flavone from
2-methoxybenzoic acids. Bull Korean Chem
Soc 9:1461-1463.
Liu et al. 2010. New synthetic flavone
derivatives induce apoptosis of
hepatocarcinoma cells. Bioorg Med Chem
18:6322-6328.
Marder M et al. 1997. Synthesis of
halogenated/nitrated flavones derivatives and evaluation of their affinity for the
central benzodiazepine receptor. Bioorg
Med Chem Lett 7:2003-2008.
Markham KR. 1988. Cara Mengidentifikasi
Flavonoid. Padmawinata K, penerjemah.
Bandung: ITB Pr. Terjemahan dari:
Techniques of Flavonoid Identification.
Nagarathnam D, Cushman M. 1991. A practical synthesis of flavones from
methyl salicylate. Tetrahedron
28:5071-5076.
Panda AK et al. 2010. Simple synthetic
processes for chrysin, norwogonin and
their derivatives. Int J Res in Ayurveda &
Pharm 1:225-233.
Romanelli GP et al. 2010. Sustainable
synthesis of flavonoid derivatives, QSAR study and insecticidal activity against the
fall armyworm, Spodoptera frugiperda
(Lep.: Noctuidae). J Agric Food Chem
58:6290-6295.
Ruttimann A et al., penemu; DSM IP Assets
BV. 26 Okt 2010. Process for the manufacture of hydroxylated isoflavones. ID US 7820836 B2.
Septiani D. 2011. Sintesis
1-(2-hidroksifenil)-3-fenilpropana-1,3-dion dari o
-hidroksiasetofenon dan benzoil klorida [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian
Bogor.
Sanderson JT et al. 2004. Induction and
inhibition of aromatase (CYP19) activity by natural and synthetic flavonoid
12
adrenocortical carcinoma cell. Toxicol Sci
82:70-79.
Sundaraganesan N, Mariappan G, Manoharan
S. 2012. Molecular structure and
vibrational spectroscopic studies of
chrysin using HF and density functional
theory. Spectrochimica Acta Part A
87:67-76.
Tang L et al. 2005. Novel and convenient
one-pot synthesis of
3-aroyl-7-hydroxy-6-nitroflavones. Synth Commun
2(35):315-323.
Wang X, Morris ME. 2007. Effects of the
flavonoid chrysin on nitrofurantoin
pharmacokinetics in rats: Potential
involvements of ABCG2. Drug Metab
Dispos 35:268-274.
Wheeler TS. 1963. Flavone. Org Synth Coll
4:478.
Zheng X, Meng WD, Xu YY, Cao JG, Qing
FL. 2003. Synthesis and anticancer effect
of chrysin derivatives. Bioorg Med Chem
14
Lampiran 1 Bagan alir penelitian
Asetilasi floroglusinol
menjadi floroasetofenon
(Gulati
et al.
1943 dan
Ruttimann
et al.
2010)
Benzoilasi floroasetofenon
menjadi ester benzoil
(Wheeler 1963)
Penataan-ulang BV
menjadi 1,3-diketon
(Wheeler 1963)
Siklisasi intramolekul
senyawa 1,3-diketon
menjadi krisin
(Wheeler 1963)
Cara langsung
(Panda
et al.
2010
dan modifikasi Tang
et al.
2005)
Pencirian dengan titik
leleh, UV-Vis, FTIR, dan
Lampiran 2 Radas sintesis floroasetofenon
H
2SO
495
–
97%
NaCl p.a
Floroglusinol, eter,
16
Lampiran 3 Elusidasi struktur produk sintesis metode Gulati
et al.
(1943)
(a)
Endapan dan spektrum UV-Vis produk dalam pelarut metanol.
(b)
Spektrum UV-Vis produk sebelum (1) dan sesudah penambahan NaOH (2)
dan AlCl3 (3) (pelarut metanol).
(c)
Spektrum
1H-NMR (500 MHz, aseton-
d
6).
18
Lampiran 4 Elusidasi struktur produk sintesis metode Ruttimann
et al.
(2010)
(a)
Endapan dan spektrum UV-Vis produk dalam pelarut metanol.
(b)
Spektrum UV-Vis produk sebelum (1) dan sesudah penambahan NaOH (2)
dan AlCl
3(3) (pelarut metanol).
20
Lampiran 5 Elusidasi struktur produk sintesis metode Panda
et al.
(2010)
(a)
Endapan dan spektrum UV-Vis dalam pelarut metanol.
(b)
Spektrum UV-Vis produk sebelum (1) dan sesudah penambahan NaOH (2)
(pelarut metanol).
(c)
Spektrum UV-Vis produk sebelum (1) dan sesudah penambahan AlCl
3(2)
(pelarut metanol).
1&2
22
Lampiran 6 Elusidasi struktur produk sintesis modifikasi metode Tang
et al.
(2005)
(a)
Produk dan spektrum UV-Vis dalam pelarut metanol.
(b)
Spektrum UV-Vis produk sebelum (1) dan sesudah penambahan NaOH (2)
(pelarut metanol).
Lampiran 7 Elusidasi struktur ester benzoil floroasetofenon metode Wheeler
(1963)
(a)
Endapan produk ester benzoil floroasetofenon dengan 1,5 ekuivalen benzoil
klorida.
(b)
Endapan dan Spektrum UV-Vis ester benzoil floroasetofenon dengan 4.5
ekuivalen benzoil klorida dalam pelarut metanol.
(c)
Spektrum UV-Vis ester benzoil floroasetofenon dengan 4.5 ekuivalen benzoil
klorida sebelum (1) dan sesudah penambahan NaOH (2) (pelarut metanol).
Setelah
6 hari
1
24
26
Lampiran 8 Elusidasi struktur krisin metode Wheeler (1963)
(a)
Produk hasil sintesis diketon.
(b)
Spektrum UV-Vis fraksi atas diketon (pelarut metanol).
(c)
Spektrum UV-Vis sebelum (1) dan sesudah penambahan NaOH (2) pada
fraksi atas diketon (pelarut metanol).
(d)
Spektrum UV-Vis sebelum dan sesudah penambahan AlCl3 (2) dan HCl (3)
pada fraksi atas diketon (pelarut metanol).
(e)
Spektrum UV-Vis fraksi bawah diketon (pelarut metanol).
(f)
Spektrum UV-Vis sebelum (1) dan sesudah penambahan NaOH (2) dan AlCl3
(3) pada fraksi bawah diketon (pelarut metanol).
1 2
3
1
28
30