IDENTIFIKASI Telosma mosaic virus PENYEBAB PENYAKIT
MOSAIK PADA TANAMAN NILAM (Pogostemon cablin Benth.)
RITA KURNIA APINDIATI
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
RITA KURNIA APINDIATI. Identifikasi Telosma mosaic virus Penyebab Penyakit Mosaik pada Tanaman Nilam (Pogostemon cablin Benth.). Dibimbing oleh GEDE SUASTIKA.
Nilam (Pogostemon cablin Benth.) adalah satu dari sekian banyak tanaman penting yang digunakan untuk minyak esensial sebagai material dasar pada industri yang berbeda. Tanaman nilam terinfeksi oleh virus yang menyebabkan penyakit pada daun dengan gejala mosaik ditemukan di daerah Bogor, Jawa Barat. Setelah dideteksi melalui enzyme-linked immunosorbent assay (ELISA) menggunakan antiserum terhadap Broad bean wilt virus, Cucumber mosaic virus,
Tobacco mosaic virus, dan Potyvirus terlihat bahwa sampel tanaman nilam bergejala mosaik tersebut bereaksi kuat terhadap antiserum Potyvirus dan tidak terhadap antiserum lainnya. Oleh karena itu, identifikasi terfokus pada Potyvirus.
Reverse transcription-polymerase chain reaction (RT-PCR) menggunakan primer spesifik untuk genus Potyvirus berhasil mengamplifikasi RNA genom virus pada gen coat proteinnya. Analisis sikuen nukleotida pada produk RT-PCR mengindikasikan bahwa virus tersebut adalah Potyvirus seperti yang telah dilaporkan sebelumnya. Berdasarkan homologi sikuen nukleotida, Potyvirus
IDENTIFIKASI Telosma mosaic virus PENYEBAB PENYAKIT
MOSAIK PADA TANAMAN NILAM (Pogostemon cablin Benth.)
RITA KURNIA APINDIATI
A34070035
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian di Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
NRP : A34070035
Disetujui,
Diketahui,
Ketua Departemen Proteksi Tanaman
Dr. Ir. Abdjad Asih Nawangsih, M.Si. NIP. 19650621 198910 2 001
Tanggal Lulus :
Dosen Pembimbing
RIWAYAT HIDUP
Penulis dilahirkan di Kebumen pada tanggal 1 Juli 1989 dari pasangan Sodikin, S.Sos dan Jumirah, S.Spd.SD. Penulis merupakan anak pertama dari tiga bersaudara.
Penulis menyelesaikan pendidikan menengah umum di SMA Negeri 2 Kebumen pada tahun 2007. Pada tahun yang sama penulis diterima sebagai mahasiswa program studi Departemen Proteksi Tanaman Fakultas Pertanian Institut Pertanian Bogor melalui jalur Undangan Seleksi Masuk IPB pada kurikulum berbasis mayor-minor. Pada tahun pertama di IPB penulis mengikuti masa Tingkat Persiapan Bersama selama satu tahun. Penulis mengambil mata kuliah sebagai supporting course antara lain Bisnis Internasional, Sistem Informasi Bisnis, dan Pengembangan Bisnis Kecil (Departemen Agribisnis, Fakultas Ekonomi dan Manajemen); Dasar-dasar Komunikasi (Departemen Komunikasi dan Pengembangan Masyarakat, Fakultas Ekologi Manusia); serta Dasar-dasar Arsitektur Lanskap (Departemen Arsitektur Lanskap, Fakultas Pertanian).
Selama kuliah, penulis mengikuti kegiatan kepanitiaan dan organisasi di IPB, yaitu Anggota Forum Komunikasi Mahasiswa Kebumen (Forkoma Kebumen) periode 2007 sampai sekarang, Himpunan Mahasiswa Proteksi Tanaman (HIMASITA) sebagai Staf Divisi Communication and Information
(Cominfo) periode 2008 sampai 2009, Panitia Divisi Acara Agriculture Creativity Festival (ACFest) tahun 2008, Panitia Divisi Konsumsi OMI (Olimpiade Mahasiswa IPB) tahun 2009, Panitia Divisi Umum Green Competition tahun 2009, Himpunan Mahasiswa Proteksi Tanaman (HIMASITA) sebagai Staf Divisi
Puji dan syukur penulis panjatkan ke hadirat Allah SWT atas limpahan rahmat dan karunia-Nya, sehingga penulis dapat menyelesaikan penulisan skripsi yang berjudul “Identifikasi Telosma mosaic virus Penyebab Penyakit Mosaik pada Tanaman Nilam (Pogostemon cablin Benth.)”. Skripsi ini disusun sebagai syarat untuk memperoleh gelar Sarjana Pertanian pada program studi Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor. Penelitian dilaksanakan di rumah kaca Balai Penelitian Tanaman Obat dan Aromatik (Balittro) Cimanggu, Bogor, Jawa Barat serta deteksi virus dilaksanakan di Laboratorium Virologi, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor dari Februari sampai Juni 2011.
Penulis mengucapkan terima kasih yang sebesar-besarnya kepada Dr. Ir. Gede Suastika, M.Sc. selaku dosen pembimbing yang senantiasa memberikan bimbingan, dukungan, arahan, nasehat, dan ilmu selama penelitian hingga terselesaikannya skripsi ini. Ucapan terima kasih yang sebesar-besarnya juga penulis haturkan kepada Dra. Rita Noveriza, M.Sc. dan Dra. Dewi Sartiami, M.Si. yang telah memberikan arahan serta bimbingan dalam penelitian ini hingga terselesaikannya skripsi ini.
Penulis juga mengucapkan terima kasih kepada Dr. Ir. Nina Maryana, M.Si. selaku dosen penguji tamu yang telah menyediakan waktu dan perhatiannya serta memberikan kritik, saran, dan nasehatnya. Penulis juga mengucapkan terima kasih kepada Dr. Ir. Abdjad Asih Nawangsih, M.Si. selaku dosen pembimbing akademik yang telah membimbing penulis selama belajar di Departemen Proteksi Tanaman.
Penulis menyampaikan rasa terimakasih yang tulus untuk kedua orang tua yaitu Sodikin, S.Sos dan Jumirah, S.Spd.SD serta adik-adik penulis yaitu Amin Nur Hidayat dan Arina Nur Khotimah, keluarga tercinta yang selalu memberikan kasih sayang, semangat, nasihat, dan doa bagi putrinya. Skripsi ini penulis dedikasikan untuk Ayah saya yang senantiasa berjuang untuk mendukung setiap langkah dalam kehidupan saya. Terima kasih kepada Ibu saya yang selalu memberikan motivasi dan senantiasa selalu berdoa agar penulis selalu diberikan yang terbaik. Skripsi ini sebagai bukti rasa cinta dan sayang penulis kepada kedua orang tua penulis.
Pada kesempatan ini, penulis mengucapkan terima kasih kepada rekan-rekan Laboratorium Virologi Tumbuhan Mba Tuti, Mba Pipiet, Mba Miftah, Mba Dwi, Mba Melinda, Kak Aceu, Mba Dama, Pak Irwan, Ibu Ifa, Harwan, Sherly, Santi, Erika, Fitriani, Rizki, Avanty yang telah membantu penulis selama di laboratorium virologi. Terima kasih juga untuk sahabat-sahabat saya tercinta, Lutfi Afifah, Ida Parida, Vishora Satyani, dan Irma Utami Siagian serta teman-teman wisma melati yang setia menemani dan membantu penulis serta senantiasa memberikan motivasi, doa, dan kasih sayang yang tulus. Terima kasih juga kepada teman-teman DPT angkatan 42, 43, 44, 45, 46 serta pihak-pihak lain yang tidak dapat penulis sajikan satu persatu. Semoga penelitian ini dapat bermanfaat bagi kita semua.
Bogor, Januari 2012
DAFTAR ISI
Analisis Similaritas dan Filogenetika Potyvirus pada Tanaman Nilam ... 20
KESIMPULAN DAN SARAN ... 22
Kesimpulan ... 22
Saran ... 22
Halaman 1 Daerah Penyebaran Tanaman Nilam di Indonesia ... 4 2 Komposisi reaktan reverse transcription (RT) (Promega, USA)
sintesis complementary DNA terhadap RNA genom
Potyvirus isolat nilam Bogor ... 11
3 Komposisi reaktan polymerase chain reaction (PCR) (Promega, USA) amplifikasi gen coat protein (CP) Potyvirus isolat
nilam Bogor ... 12 4 Gejala yang muncul pada berbagai tanaman indikator ... 17 5 Tingkat kesamaan sikuen nukleotida sebagian gen coat protein
DAFTAR GAMBAR
Halaman 1 Genom Potyvirus monopartit menampilkan potongan-potongan
fragmen tersintesis ... 5 2 Hasil enzyme-linked immunosorbent assay menggunakan beberapa
antiserum terhadap sampel tanaman nilam dari daerah Bogor ... 15 3 Gejala yang muncul pada tanaman nilam N21 (a), C. amaranticolor
(b), dan C. quinoa (c) ... 16
4 Hasil amplifikasi DNA genom virus pada daerah gen coat protein
dengan metode RT-PCR menggunakan pasangan primer
CPUP(F) dan CP9502(R) ... 18 5 Alignment sikuen nukleotida sebagian gen coat protein (CP)
beberapa isolat menggunakan program ClustalW ... 19
6 Filogenetika kekerabatan bebrapa isolat berdasarkan sikuen nukleotida sebagian gen coat protein (CP) menggunakan
Latar belakang
Nilam (Pogostemon cablin Benth.) adalah satu dari sekian banyak tanaman penting yang digunakan untuk minyak esensial sebagai material dasar di industri yang berbeda. Minyak nilam banyak digunakan dalam industri kosmetika dan banyak dicari konsumen dari luar negeri (Sudaryani & Sugiharti 1990). Nilam merupakan salah satu komoditas ekspor penting di Indonesia yang memasok sekitar 70% kebutuhan dunia akan minyak nilam dengan volume ekspor rata-rata di atas 1.000 ton per tahun. Pada tahun 2009 Indonesia dapat mengekspor minyak nilam sebesar 1.000 ton atau 66,66% dari kebutuhan dunia yang mencapai 1.500 ton. Minyak nilam Indonesia diekspor ke Eropa sebanyak 30%, Amerika Serikat sebanyak 35%-40%, dan sisanya ke beragam negara di dunia
(Nando 2010).
Indonesia adalah salah satu penghasil minyak nilam terbesar di dunia, tetapi kualitas dari minyak nilamnya masih di bawah negara-negara pengekspor minyak nilam lainnya. Hal itu disebabkan oleh faktor-faktor yang kurang mendukung dalam budidaya nilam baik pra panen maupun pasca panen. Pengembangan nilam mengalami kendala akibat adanya serangan penyakit yang disebabkan salah satunya oleh virus. Tanaman nilam ditanam secara vegetatif melalui penyetekkan. Tanaman nilam yang terserang virus menunjukkan gejala mosaik kekuningan (Sukamto et al. 2007).
Potyvirus pada tanaman nilam telah dideteksi dan dilaporkan di beberapa kebun botani dan penelitian pertanian di Jepang. Gejala pada tanaman nilam terinfeksi Potyvirus dari hampir tidak ada atau hanya sedikit belang sampai mosaik. Tanaman nilam dengan gejala tersebut dapat diketahui terinfeksi
Potyvirus atau Fabavirus (Natsuaki et al. 1994). Potyvirus dapat ditularkan melalui inokulasi mekanik, tetapi di lapangan dapat ditularkan secara non persisten oleh kutu daun. Selain menyerang tanaman nilam, Potyvirus juga mempunyai kisaran inang yang luas. Tanaman nilam di Jepang dan Brazil telah dilaporkan dapat terinfeksi oleh Patchouli mild mosaic virus (PatMMV) genus
2
virus X genus Potexvirus (Natsuaki et al. 1994; Filho et al. 2002 dalam Sukamto
et al. 2007). Virus menginfeksi tanaman dan menyebabkan penurunan biomassa dan kandungan minyak esensial. Hasil penelitian di Indonesia menyebutkan bahwa virus yang terdapat pada tanaman nilam di Indonesia adalah Potyvirus. Penyakit tanaman nilam di daerah Cianjur dan Bogor yang terinfeksi Potyvirus
dilaporkan mempunyai gejala mosaik (Sukamto et al. 2007). Noveriza et al. (2010) mendeteksi adanya Potyvirus pada tanaman nilam yang bergejala mosaik dari beberapa sampel yang diperoleh dari Bogor. Namun, spesies Potyvirus
tersebut belum terindentifikasi.
Tujuan Penelitian
Penelitian ini bertujuan untuk mengidentifikasi Potyvirus yang menyebabkan penyakit mosaik pada tanaman nilam.
Manfaat Penelitian
Tanaman Nilam (Pogostemon cablin Benth.)
Tanaman nilam dikenal dengan berbagai nama di beberapa daerah antara lain, yaitu dilem (Sumatera dan Jawa), rei (Sumba), pisak (Alor), dan ungapa (Timor). Nama dagang dikenal dengan pathcouli sedangkan pada kalangan ilmiawan nilam lebih dikenal dengan Pogostemon sp. Berdasarkan informasi dari Direktorat Jendral Perkebunan terdapat berbagai spesies nilam yang dikenal adalah Pogostemon cablin Benth., Pogostemon hortensis Backer., Pogostemon heyneanus Benth. P. cablin Benth. sering disebut dengan nama nilam Aceh, ciri utamanya adalah daunnya membulat seperti jantung dan di permukaan bagian bawahnya terdapat bulu-bulu rambut, dan jarang berbunga. P. hortensis Backer. yang dikenal dengan nama nilam sabun memiliki ciri-ciri lembaran daun lebih tipis, tidak berbulu, permukaan daun tampak mengkilat, dan warnanya hijau.
P. heyneanus Benth. yang sering disebut nilam hutan atau nilam jawa memiliki ciri-ciri yaitu ujung daun agak runcing, lembaran daun tipis dengan warna hijau tua, dan berbunga lebihcepat. Dari ketiga jenis nilam tersebut, yang paling tinggi kandungan minyaknya adalah nilam Aceh (2,5–5,0%), sedangkan nilam lainnya rata-rata hanya mengandung0,5–1,5% (Ditjenbun 2007). P. cablin Benth. berasal dari Filipina yang kemudian dibudidayakan di Malaysia, Madagaskar, Paraguay, Brasil, dan Indonesia. Perbedaan lain dari ketiga nilam tersebut adalah nilam Aceh (P. cablin Benth.) dan nilam sabun (P. hortensis Backer.) tidak berbunga, sedangkan nilam Jawa (P. heyneanus Benth.) berbunga (Yusron & Wiratno 2001).
Tanaman nilam dapat tumbuh pada dataran rendah hingga tinggi sampai 2.000 m dpl baik di lahan datar, miring, maupun berbukit-bukit.
4
Tabel 1 Daerah Penyebaran Tanaman Nilam di Indonesia (Ditjenbun 2007)
No. Propinsi Kabupaten
1 Nangroe Aceh Darusalam
Aceh Utara, Gayo Lues, Aceh Selatan, Aceh Jaya, Aceh Barat Daya, Aceh Tenggara, Aceh Barat, Nagan Raya, Aceh Tengah, Aceh Singkil, Pidie, dan Aceh Besar 2 Sumatera Utara Nias, Toba Samosir, Tapanuli Selatan, Tapanuli Utara,
Dairi, dan Tapanuli Tengah
3 Sumatera Barat Pasaman, Pesisir Selatan, Mentawai, Sawahlunto/Sijunjung, Tanah Datar, Solok, Pasaman Barat, dan Pariaman
4 Riau Indragiri Hilir, Bengkalis, Indragiri Hulu, Rokan Hulu, dan Kepulauan Riau
5 Sumatera Selatan Muara Enim, OKU Selatan
6 Bengkulu Rejang lebong, Bengkulu Selatan, dan Bengkulu Utara 7 Lampung Lampung Barat, Tanggamus, dan Lampung Selatan 8 Jawa Barat Majalengka, Garut, Kuningan, Tasikmalaya, Sukabumi,
dan Sumedang
9 Jawa Tengah Purbalingga, Brebes, Banyumas, Banjarnegara, Pemalang, Pekalongan, Batang, dan Cilacap
10 Jawa Timur Bondowoso, Situbondo, Jember, dan Tulungagung 11 Kalimantan
Tengah
Lamandau, Kotawaringin Barat, Kota-waringin Timur, Katingan, Seruyan, Gunung Mas, dan Sukamara
Minyak nilam diperoleh dari bagian daun dan minyak nilam asal Indonesia sudah diekspor ke berbagai negara seperti Hongkong, Jepang, India, Prancis, Belanda, Inggris, Jerman, Kanada, Mesir, Swiss, Saudi Arabia, dan Amerika Serikat (AS). Sebagai pembeli utama adalah AS. Komponen dalam minyak nilam adalah patchouli alcohol, patchouli camphor, eugenol, benzaldehyde,
minyak, daun nilam juga berguna untuk bahan pelembab kulit, menghilangkan bau badan, dan gatal-gatal pada kulit (Ditjenbun 2007).
Potyvirus
Potyvirus sangat luas kisaran inangnya serta menyebabkan kerugian dalam jumlah besar pada tanaman ekonomis penting. Potyvirus termasuk anggota famili Potyviridae. Kelompok Potyvirus (dinamai dari anggota prototipikalnya, Potato Virus Y (PVY)) merupakan yang terbesar dari 34 kelompok virus tanaman dan famili yang diakui saat ini (Ward & Shukla 1991 dalam Winterhalter 2005). Berdasarkan Matthews (1982) tercatat 48 anggota yang pasti dan 67 anggota lainnya. Partikel Potyvirus berupa batang lentur dengan diameter sekitar 11 nm dan panjang 680-900 nm (Francki et al. 1985). Nukleokapsid berisi sekitar 2000 subunit protein. Simetri nukleokapsid heliks berukuran 3,4 nm. Genom
Potyvirus adalah ssRNA linear positif berukuran mulai dari 9000-12000 bp. Ekspresi genom Potyvirus berupa genom monopartit terjadi melalui translasi poliprotein dari genom virus yang menampilkan potongan-potongan fragmen tersintesis (Gambar 1).
Gambar 1 Organisasi genom Potyvirus 5’UTR: 5’-untranslated region; P1: protein 1: HC-pro: helper component proteinase; P3: protein 3; 6K1: peptida 1; CI: cylindrical inclusion protein; 6K2: peptida 2; VPg: viral genome-linked protein; NIa: nuclear inclusion a (proteinase); NIb: nuclear inclusion b (viral replicase); CP: coat protein; 3’UTR: 3’-untranslated region (Winterhalter 2005)
Potyvirus ditularkan oleh kutu daun secara non persisten. Infeksi Potyvirus
6
dengan hijau muda (Akin 2006). Gejala dari infeksi Potyvirus merupakan pengembangan pola terang dan gelap dari warna hijau yang memberikan efek mosaik pada daun yang terinfeksi. Sifat dari pola yang tergambar akibat serangan
Potyvirus berbeda-beda tergantung dari tanaman inang dan jenis virus yang terlibat. Gejala mosaik yang ditimbulkan merupakan gejala yang muncul secara sistemik (Matthews 1970).
Reverse Transcription-Polymerase Chain Reaction (RT-PCR)
Teknik RT-PCR ini sangat berguna untuk mendeteksi ekspresi gen, amplifikasi RNA sebelum dilakukan kloning dan analisis, maupun diagnosis agensia infektif maupun penyakit genetik (Yuwono 2006). Teknik RT-PCR merupakan teknik yang digunakan untuk mendeteksi virus yang memiliki genom RNA seperti sebagian besar virus tumbuhan sehingga diperlukan modifikasi teknik PCR karena molekul sasarannya adalah RNA. RT-PCR merupakan teknik PCR yang dapat menggandakan RNA menjadi DNA. Teknik RT-PCR terdiri atas dua reaksi yaitu reaksi transkripsi balik (reverse transcription) yang menggunakan genom RNA virus sebagai cetakan dan menghasilkan cDNA primer (untai tunggal) serta reaksi penggandaan PCR. Primer yang digunakan sesuai dengan virus yang akan dideteksi (Akin 2006). PCR merupakan teknik yang relatif sederhana dan merupakan teknik penggandaan (amplifikasi) dengan menggunakan DNA primer yang memiliki runutan nukleotida khas untuk molekul asam nukleat yang akan dideteksi. Primer merupakan molekul oligonukleotida yang disintesis
in vitro dan runutan nukleotidanya disesuaikan dengan genom virus yang akan dideteksi. PCR hanya akan menggandakan asam nukleat yang sesuai dengan primer.
dalam kaitannya dengan proses PCR untuk amplifikasi DNA dengan bantuan DNA polymerase sebab DNA polymerase hanya dapat bekerja pada template
yang berupa DNA. Tahapan RT dapat dilakukan dalam tabung yang sama dengan PCR (one-step PCR) atau pada tabung yang terpisah (two-step PCR) menggunakan suhu berkisar 40 °C sampai 50 °C, tergantung pada karakteristik
reverse transcriptase yang digunakan. Tahap berikutnya adalah denaturasi
dsDNA pada 95 °C, pada tahap ini dua untai DNA akan terpisah dan primer dapat mengikat pada untai tersebut jika temperaturnya diturunkan kemudian yang selanjutnya akan dimulai rantai reaksi baru. Kemudian suhu diturunkan hingga mencapai suhu annealing yang bervariasi tergantung primer yang digunakan. Temperatur annealing dipilih untuk PCR tergantung langsung pada panjang dan komposisi dari primer tersebut. Hal ini merupakan hasil dari perbedaan ikatan hidrokarbon antara A-T (2 ikatan) dan G-C (3 ikatan). Temperatur annealing
BAHAN DAN METODE
Tempat dan Waktu Penelitian
Penelitian dilaksanakan di rumah kaca Balai Penelitian Tanaman Obat dan Aromatik (Balittro) Cimanggu, Bogor, Jawa Barat. Deteksi virus dilaksanakan di Laboratorium Virologi, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor. Penelitian dilakukan dari Februari sampai Juni 2011.
Persiapan Tanaman Nilam sebagai Tanaman Uji
Bibit tanaman nilam diperoleh dengan cara stek pucuk tanaman nilam nomor 21 hasil kultur jaringan laboratorium di Balittro. Pucuk yang telah distek kemudian direndam di dalam air bertujuan untuk menyegarkan tanaman nilam yang telah distek tersebut. Stek pucuk tersebut ditanam dalam polybag berisi media tanah yang telah dicampur dengan pupuk kandang (2:1) kemudian disungkup dengan plastik untuk menjaga kelembaban. Dua minggu sungkup dibuka, tanaman dipelihara dalam rumah kasa kedap serangga sampai umur satu bulan siap diinokulasi virus.
Tanaman Indikator untuk Kisaran Inang
Terdapat sepuluh macam benih sebagai kisaran inang yaitu benih
Chenopodium amaranticolor, Chenopodium quinoa, Gomphrena globosa, kacang panjang (Vigna sinensis), Nicotiana benthamiana, cabai (Capsicum annum),
Datura metel, kedelai (Glycine max), mentimun (Cucumis sativus), dan tomat (Lycopersicon esculentum). Masing-masing tanaman indikator dengan 10 ulangan untuk perlakuan yang sama disertai kontrol untuk masing masing tanaman indikator. Pesemaian dilakukan dengan menanam benih-benih tanaman yang telah ditentukan sebelumnya sebagai tanaman indikator. Penyiraman juga
dipindahkan ke polybag yang berisi media tanah yang telah tercampur dengan pupuk kandang (2:1).
Inokulasi Potyvirus
Sumber virus adalah tanaman nilam N2A1 hasil kultur jaringan yang terinfeksi Potyvirus koleksi rumah kaca Balittro, Bogor. Daun nilam tersebut ditimbang dan ditambahkan phosphate buffer sebanyak lima kali bobot daun kemudian digerus dengan mortar di dalam wadah yang berisi es. Kemudian tambahkan mercaptoethanol sebanyak 1% dari phosphate buffer dan digerus hingga lumat. Sap yang diperoleh dioleskan dengan cotton bud pada permukaan daun uji yang telah ditaburi carborundum dan kemudian dicuci dengan air agar bersih. Inokulasi dilakukan pada tanaman nilam nomor 21 sebagai tanaman uji dan tanaman-tanaman indikator sebagai kisaran inang. Pengamatan dilakukan setiap hari selama satu bulan.
Antigen CoatedPlate-Enzyme Linked Immunosorbent Assay (ACP-ELISA)
Penyiapan daun yang akan dideteksi menggunakan uji serologi ELISA dilakukan dengan menimbang daun masing-masing 0,1 gram ke dalam plastik. Daun yang telah diberi buffer (coating buffer pH 9,6 + 0,05 M DIECA) sebanyak lima kali dari bobot daun digerus hingga halus. Ekstrak tanaman dimasukkan ke dalam masing-masing sumuran pada plate ELISA yang telah disediakan dan diinkubasi selama satu malam (overnight). Setelah inkubasi, dilakukan pencucian
10
pada suhu 37 °C. Setelah dilakukan pencucian menggunakan buffer PBST,
dimasukkan 10 ml substrate buffer pH 9,8 yang telah ditambahkan 10 mg p-nitrophenyl phosphate (PNP [Sigma 104-105]) ke dalam sumuran plate.
Setiap 30 menit dilakukan pembacaan nilai absorbansi menggunakan ELISA
reader pada absorbance 405 nm.
Ekstraksi RNA Total
Sebanyak 0,1 gram daun bergejala digerus menggunakan mortar dan pistil dengan nitrogen cair dan ditambahkan 450 μl buffer ekstraksi yang mengandung 1% mercaptoethanol. Hasil gerusan dimasukkan ke dalam tabung mikro 2 ml dan diinkubasi pada suhu 56 °C selama 10 menit. Sampel yang telah diinkubasi kemudian dimasukkan menggunakan pipet mikro ke dalam QIA shredder spin colomn yang berwarna ungu dan disentrifugasi dengan kecepatan 13.000 rpm selama 2 menit. Supernatan yang diperoleh dipindahkan ke dalam tabung mikro baru dan ditambahkan ethanol 96% sebanyak 0,5 volume (±225 μl). Setelah tercampur, sebanyak ±650 μl suspensi dimasukan ke dalam QIA shredder spin colomn pink dan disentrifugasi dengan kecepatan 10.000 rpm selama 15 detik. Sebanyak 700 μl buffer RW1 kemudian ditambahkan ke dalam QIA shredder spin colomn pink tersebut kemudian disentrifugasi kembali dengan kecepatan 10.000 rpm selama 15 detik untuk mencuci kolom. Setelah itu, colomn
dipindahkan ke tabung koleksi baru, kemudian ditambahkan 500 μl buffer RPE dan disentrifugasi dengan kecepatan 10.000 rpm selama 15 detik. Tanpa menggunakan tabung koleksi baru, sebanyak 500 μl buffer RPE ditambahkan pada colomn dan disentrifugasi selama 2 menit dengan kecepatan 10.000 rpm.
Sintesis Complementary(c)DNA
Reaksi reverse transcription (RT) atau transkripsi balik merupakan proses yang digunakan untuk merubah RNA menjadi DNA. Proses RT-PCR dilakukan menggunakan kit komersial Access RT-PCR System (Promega, USA). Total RNA diekstraksi dari 100 mg jaringan daun tanaman nilam menggunakan Rneasy Plant Mini Kits (Qiagen Inc., Chatsworth, CA., USA). Sampel RNA yang telah dimurnikan diresuspensikan dengan 450 µl Rnase free water, kemudian disimpan pada suhu -80 °C sampai akan digunakan dalam RT-PCR. Adapun komposisi yang digunakan dalam reaksi RT terdapat pada Tabel 2.
Tabel 2 Komposisi reaktan reverse transcription (RT) (Promega, USA) untuk satu kali reaksi sintesis complementary DNA terhadap RNA genom
Potyvirus isolat nilam Bogor
Komponen Volume (µl)
H2O 2,20
Buffer RT 5x 2,00
DTT 50 mM 0,35
dNTP 10 mM 2,00
MMuLV Rev 0,35
RNAse Inhibitor 0,35
Oligo d(T) 10 mM 0,75
RNA template 2,00
Total volume (µl) 10,00
Reaksi RT sebanyak 10 μl untuk setiap reaksi dijalankan dengan program
RT yaitu 25 °C selama 5 menit, 42 °C selama 60 menit, dan 70 °C selama 15 menit. Hasil dari RT berupa cDNA yang selanjutnya digunakan dalam
proses PCR. Reaksi RT dilakukan dalam sebuah Automated Thermal Cycler
12
Amplifikasi DNA
Reaksi PCR untuk memperbanyak pita DNA menggunakan cDNA hasil dari proses RT yang telah dilakukan. Adapun komposisi bahan yang digunakan dalam PCR terdapat pada Tabel 3.
Tabel 3 Komposisi reaktan polymerase chain reaction (PCR) (Promega, USA) untuk satu kali reaksi amplifikasi gen coat protein (CP) Potyvirus isolat nilam Bogor
Reaksi PCR dilakukan pada volume 50 µl menggunakan Go Tag Green Master Mix 2x (Promega, Madison, USA). Amplifikasi genom Potyvirus
dilakukan menggunakan sepasang primer CPUP-F (5’-TGAGGATCCTGGTGYA THGARAAYGG-3’, Y = C/T, H = A/T/C, R = A/G), spesifik untuk coat protein
pada Potyvirus dan CP9502-R (5’-GCGGATCCTTTTTTTTTTTTTTTTT-3’) spesifik untuk ujung 3’ genom Potyvirus. Program PCR yang dijalankan untuk
Potyvirus pada tanaman nilam yaitu denaturasi pada suhu 94 °C selama 5 menit, kemudian dilanjutkan dengan 45 siklus pada suhu 94 °C selama 1 menit, 54 °C selama 2 menit, dan 72 °C selama 1 menit, serta diikuti perpanjangan pada 72 °C selama 10 menit dan siklus berakhir pada suhu 4 °C menggunakan mesin PCR
Automated Thermal Cycler (Gene Amp PCR System 9700; PE Applied Biosystem, USA).
Elektroforesis
selama 2 menit hingga tercampur rata dan didapatkan larutan tersebut jernih. Setelah larutan Agarosa tersebut hangat, kemudian ditambahkan ethidium bromide
sebanyak 0,5 kali volume larutan yaitu 1,5 μl. Larutan tersebut kemudian dituang ke dalam pencetak gel. Setelah itu, sisir ditempatkan di dekat tepian gel dan gel didiamkan hingga mengeras selama satu jam. Setelah gel siap, maka sebanyak 5 μl marker DNA dan 5 μl DNA Potyvirus hasil PCR dimasukkan masing-masing ke dalam sumur gel dan dilakukan elektroforesis. Elektroforesis dilakukan selama 25 menit dengan voltase sebesar 100 V. DNA yang telah dielektroforesis kemudian divisualisasi di bawah UV transiluminator. Pita DNA yang terbentuk pada hasil elektroforesis tersebut diambil gambarnya menggunakan kamera digital yang telah tersedia.
Analisa Sikuen NukleotidaPotyvirus
Sampel yang telah terdeteksi positif terinfeksi Potyvirus pada tanaman nilam uji kemudian dilakukan analisa sikuen nukleotida Potyvirus tersebut. Sikuen nukleotida tersebut kemudian di blast pada web National Center for Biotechnology Information (www.ncbi.nlm.nih.gov) untuk memperoleh kesamaan nukleotida yang didapatkan dari hasil sikuen sebelumnya kemudian untuk mendapatkan fasta berupa database nukleotida dari virus yang diindikasikan sama dengan virus yang dianalisa. Basic Local Alignment Search Tool (BLAST) seringkali menggunakan program yang telah diimplementasi pada cara umum untuk perlakuan dengan tipe-tipe berbeda pada data sikuen. BLAST merupakan alat yang tersedia untuk mencari database untuk menemukan sikuen yang sama pada sebuah penggunaan sequence query supplied.
Analisa sikuen dilakukan setelah mendapatkan database nukleotida dari virus tersebut kemudian dianalisa menggunakan BioEdit Sequence Alignment Editor untuk mendapatkan database nukleotida dari Potyvirus yang dianalisa berdasarkan coat protein Potyvirus tersebut. Sequence alignment merupakan landasan bioinformatika berupa variabel yang telah dikonversi dan digunakan sebagai dasar database metode filogeni (Higgs & Attwood 2005).
14
Kisaran Inang Potyvirus Isolat Nilam Bogor
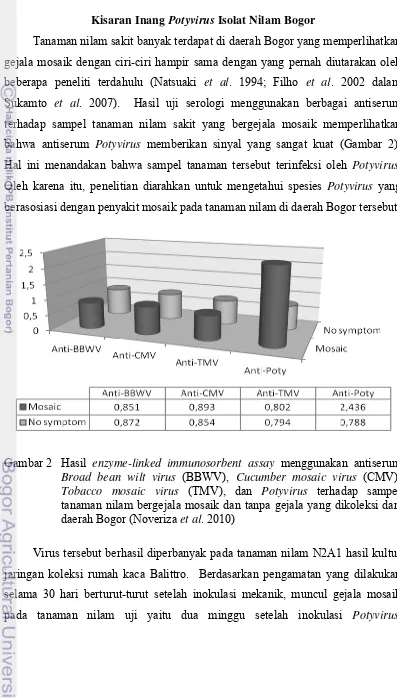
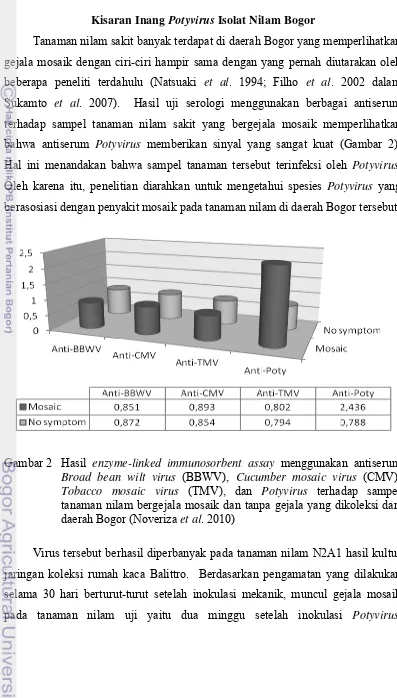
Tanaman nilam sakit banyak terdapat di daerah Bogor yang memperlihatkan gejala mosaik dengan ciri-ciri hampir sama dengan yang pernah diutarakan oleh beberapa peneliti terdahulu (Natsuaki et al. 1994; Filho et al. 2002 dalam Sukamto et al. 2007). Hasil uji serologi menggunakan berbagai antiserum terhadap sampel tanaman nilam sakit yang bergejala mosaik memperlihatkan bahwa antiserum Potyvirus memberikan sinyal yang sangat kuat (Gambar 2). Hal ini menandakan bahwa sampel tanaman tersebut terinfeksi oleh Potyvirus. Oleh karena itu, penelitian diarahkan untuk mengetahui spesies Potyvirus yang berasosiasi dengan penyakit mosaik pada tanaman nilam di daerah Bogor tersebut.
Gambar 2 Hasil enzyme-linked immunosorbent assay menggunakan antiserum
Broad bean wilt virus (BBWV), Cucumber mosaic virus (CMV),
Tobacco mosaic virus (TMV), dan Potyvirus terhadap sampel tanaman nilam bergejala mosaik dan tanpa gejala yang dikoleksi dari daerah Bogor (Noveriza et al. 2010)
16
Gejala yang tampak dari daun yang diinokulasi berupa gradasi warna hijau tua dan hijau muda (mosaik), klorosis, serta berkerut. Sedangkan, gejala yang tampak pada daun pucuk berupa gradasi warna hijau tua dan hijau muda (mosaik), mengeras, berubah bentuk (malformasi), serta terpilin. Dengan demikian, dapat dikatakan bahwa gejala awal berupa mosaik ringan yang kemudian menjadi mosaik parah, terpilin, maupun malformasi daun. Gejala penyakit merupakan aspek yang sangat penting untuk menentukan tindakan pengendalian penyakit (Akin 2006). Pada penelitian ini, telah dilakukan ELISA untuk mendeteksi adanya Potyvirus pada tanaman nilam asal Bogor menggunakan antiserum
Potyvirus. Hasil yang diperoleh dari deteksi dengan ELISA tersebut menunjukkan bahwa sepuluh sampel tanaman nilam yang diuji menunjukkan gejala positif terinfeksi Potyvirus berupa gejala mosaik (Gambar 3a).
Gambar 3 Gejala yang muncul pada tanaman nilam N21 (a), C. amaranticolor
(b), dan C. quinoa (c) setelah diinokulasi mekanik dengan Potyvirus
isolat nilam Bogor
Pengetahuan tentang keragaman gejala yang ditimbulkan oleh suatu virus pada beberapa spesies tanaman diperlukan untuk mempermudah identifikasinya (Akin 2006). Spesies tanaman yang sering digunakan sebagai tanaman indikator tersebut antara lain C. quinoa, C. amaranticolor, mentimun (C. sativus), kacang panjang (V. sinensis), kedelai (G. max), D. metel, G. globosa, cabai (C. annum),
N. benthamiana, dan tomat (L. esculentum). Pada penelitian ini, terdapat beberapa tanaman indikator yang menunjukkan gejala positif terinfeksi Potyvirus
setelah diinokulasi mekanik, yaitu C. amaranticolor, C. quinoa, dan
N. benthamiana. Setelah dua minggu diinokulasi gejala yang tampak pada
diinokulasi (Gambar 3b). Gejala yang tampak pada C. quinoa berupa gejala lesio lokal klorotik pada daun yang diinokulasi (Gambar 3c). Sedangkan, gejala yang tampak pada N. benthamiana berupa daun yang kekuningan disertai klorosis secara sistemik. Sedangkan tanaman mentimun, kacang panjang, kedelai,
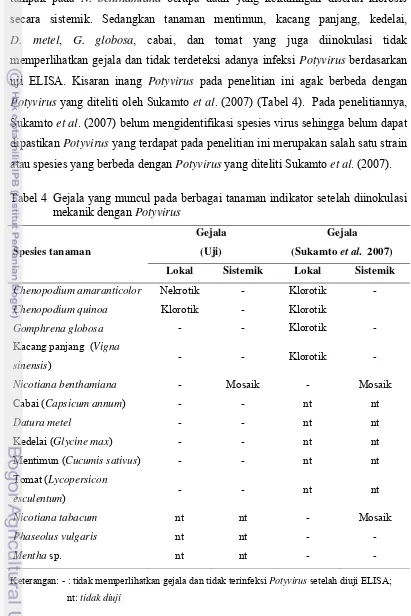
D. metel, G. globosa, cabai, dan tomat yang juga diinokulasi tidak memperlihatkan gejala dan tidak terdeteksi adanya infeksi Potyvirus berdasarkan uji ELISA. Kisaran inang Potyvirus pada penelitian ini agak berbeda dengan
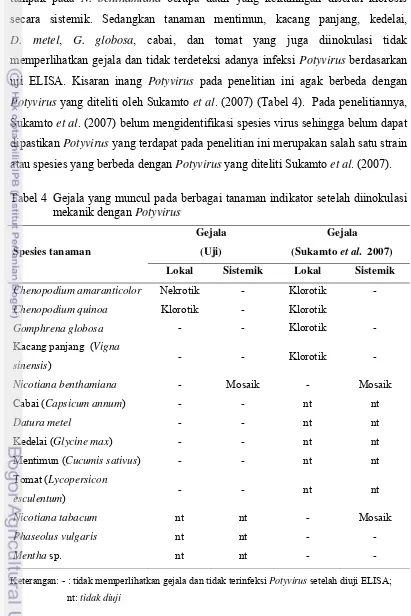
Potyvirus yang diteliti oleh Sukamto et al. (2007) (Tabel 4). Pada penelitiannya, Sukamto et al. (2007) belum mengidentifikasi spesies virus sehingga belum dapat dipastikan Potyvirus yang terdapat pada penelitian ini merupakan salah satu strain atau spesies yang berbeda dengan Potyvirus yang diteliti Sukamto et al. (2007).
Tabel 4 Gejala yang muncul pada berbagai tanaman indikator setelah diinokulasi mekanik dengan Potyvirus
Chenopodium amaranticolor Nekrotik - Klorotik -
Chenopodium quinoa Klorotik - Klorotik
Gomphrena globosa - - Klorotik -
Kacang panjang (Vigna
sinensis) - - Klorotik -
Nicotiana benthamiana - Mosaik - Mosaik
Cabai (Capsicum annum) - - nt nt
Keterangan: - : tidak memperlihatkan gejala dan tidak terinfeksi Potyvirus setelah diuji ELISA;
18
Amplifikasi Gen Coat Protein Virus
Tanaman nilam asal Bogor dengan nomor sampel N4, N5, dan N6 merupakan sampel nilam yang mempunyai nilai absorbansi ELISA tinggi (data tidak diperlihatkan) sehingga digunakan sebagai sampel untuk amplifikasi gen CP Potyvirus. Amplifikasi dengan teknik RT-PCR menggunakan pasangan primer CPUP-F dan CP9502-R berhasil mendapatkan fragmen nukleotida
Potyvirus dengan ukuran sekitar 800 bp (Gambar 3; lajur N4, N5, dan N6). Fragmen DNA hasil PCR selanjutnya digunakan dalam sikuen nukleotida.
M K(-) K(+) N4 N5 N6
Gambar 4 Hasil amplifikasi DNA genom virus pada daerah gen coat protein
dengan metode RT-PCR menggunakan pasangan primer CPUP(F) dan CP9502(R) terhadap sampel daun tanaman nilam (lajur N4, N5, dan N6) yang bergejala mosaik, lajur K(-) dan K(+) adalah masing-masing kontrol negatif dari tanaman sehat dan kontrol positif dari tanaman sakit (Noveriza et al. 2010) dan lajur M adalah marker 100 bp DNA
ladder
Sikuen Nukleotida Gen Coat Protein Virus
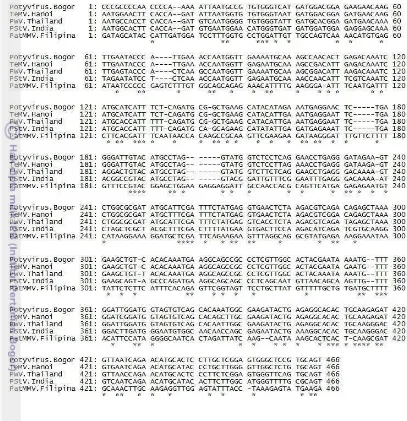
Produk RT-PCR (Gambar 4; lajur N5) berhasil disikuen dan sebagian sikuen nukleotida gen CP Potyvirus asal Bogor tersebut disajikan pada Gambar 5.
500 bp
Gambar 5 Alignment sikuen nukleotida sebagian gen coat protein (CP) Potyvirus
asal Bogor, Telosma mosaic virus (TeMV) asal Hanoi, Passionfruit woodiness virus (PWV) asal Thailand, Peanut stripe virus (PStV) asal India, dan Patchouli mild mosaic virus (PatMMV) asal Filipina menggunakan program ClustalW [tanda * menunjukkan nukleotida yang identik]
Terhadap hasil sikuen nukleotida tersebut kemudian dilakukan blast pada www.ncbi.nlm.nih.gov untuk memetakan spesies-spesies Potyvirus yang mempunyai kedekatan dengan Potyvirus isolat nilam Bogor. Berdasarkan www.ncbi.nlm.nih.gov terdapat beberapa spesies dari Potyvirus yang kemiripannya mendekati hasil sikuen tersebut antara lain, yaitu Telosma mosaic virus (TeMV) asal Hanoi, Passionfruit woodiness virus (PWV) asal Thailand,
20
asal Filipina. Alignment sikuen nukleotida dengan Clustal W menunjukkan bahwa gen CP virus tanaman nilam asal Bogor memiliki homologi dengan virus-virus tersebut dan beberapa perbedaan nukleotida pada beberapa lokasi diperlihatkan pada Gambar 5.
Analisis Similaritas dan Filogenetika Potyvirus pada Tanaman Nilam
Analisis similaritas nilai penjajaran (alignment score) juga dilakukan untuk mengindikasikan kesamaan urutan nukleotida antar isolat virus. Hasil analisis tersebut menunjukkan bahwa sikuen gen CP isolat Potyvirus asal Bogor memiliki tingkat homologi dengan TeMV asal Hanoi, Vietnam sebesar 91,1% (Tabel 5).
Tabel 5 Tingkat kesamaan sikuen nukleotida sebagian gen coat protein (CP)
Potyvirus isolat nilam Bogor dengan Telosma mosaic virus (TeMV)
asal Hanoi, Passionfruit woodiness virus (PWV) asal Thailand,
Peanut stripe virus (PStV) asal India, dan Patchouli mild mosaic virus
(PatMMV) asal Filipina menggunakan program Bioedit V.7.0.5
Berdasarkan data pada www.ncbi.nlm.nih.gov, TeMV adalah Potyvirus
yang ditemukan menginfeksi secara alami Telosma cordata (famili Apocynaceae,
ordo Gentianales) yang merupakan tanaman hias asli Cina. Sedangkan tingkat homologi sikuen nukleotida gen CP Potyvirus asal Bogor
dengan PWV asal Thailand, PStV asal India, dan PatMMV asal Filipina masing-masing sebesar 89,1; 71,4; dan 37,3%. Menurut Fauquet et al. (2005) apabila terdapat persamaan sikuen nukleotida dari gen CP antara satu virus dengan virus yang lain dengan nilai lebih dari 90%, maka virus-virus tersebut merupakan
Isolat Virus No. Aksesi
TeMV.Hanoi DQ851493.1 91,1 100
PWV.Thailand AM409188.1 89,1 88,9 100
PStV.India AJ851894.1 71,4 74,8 76,2 100
spesies virus yang sama. Dengan demikian, dapat dikatakan bahwa Potyvirus asal Bogor ini merupakan salah satu isolat TeMV.
Analisis filogenetika pada kladogram menunjukkan kejelasan hubungan kekerabatan kelima Potyvirus tersebut (Gambar 6). Potyvirus asal Bogor paling dekat dengan TeMV asal Hanoi kemudian PWV asal Thailand, dan paling jauh dengan PStV asal India. PatMMV asal Filipina yang tergolong ke dalam genus
Fabavirus dan digunakan sebagai outgroup dalam analisis ini. Berdasarkan data dari NCBI, PatMMV asal Filipina ini dilaporkan juga dapat menginfeksi tanaman nilam secara alami.
Gambar 6 Filogenetika kekerabatan Potyvirus isolat nilam Bogor, Telosma mosaic virus (TeMV) asal Hanoi, Passionfruit woodiness virus
(PWV) asal Thailand, Peanut stripe virus (PStV) asal India, dan
KESIMPULAN DAN SARAN
Kesimpulan
Berdasarkan analisa kisaran inang dan sikuen nukleotida gen CP dapat disimpulkan bahwa Potyvirus yang berasosiasi dengan penyakit mosaik pada tanaman nilam di daerah Bogor adalah Telosma mosaic virus (TeMV). Hasil penelitian ini merupakan laporan pertama (first report) tentang infeksi alami TeMV pada tanaman nilam di Indonesia.
Saran
Addy HS.2009. Biotechnology molecular. http://tophotnews.wordpress.com/2009/ 11/25/reverse-transcription-pcr-rt-pcr/ [21 September 2011].
Akin HM. 2006. Virologi Tumbuhan. Yogyakarta: Kanisius
Barani AM. 2008. Strategi perkembangan nilam di Indonesia. Di dalam: Rizal M
et al., editor. Pengendalian Terpadu Organisme Penganggu Tnaman Jahe dan Nilam. Prosiding Seminar Nasional.; Bogor, 4 November 2008. Bogor: Balittro. Hlm 7-14.
Ditjenbun. 2007. Komoditan tanaman nilam. Deptan http://ditjenbun.deptan.go.id /budtansim/images/pdf/nilam.pdf [18 September 2011].
Fauquet CM, Mayo MA, Maniloff J, Desselberger U, Ball LA, editor. 2005. Virus Taxonomy Eight Report of the International Committee on Taxonomy of Viruses. San Diego: Virol Div Int Union of Microb Soc.
Filho PEM, Resende RDO, Lima MI, Kitajiam EW. 2002. Patchouli virus X, a new potexvirus from Pogostemon cablin. Annals of Applied Biology 141(3): 267-274.
Francki RIB, Milne RG, Hatta T. 1985. Atlas of plant viruses. CRCpress Boca Raton ,FL vol II.
Higgs PG, Attwood TK. 2005. Bioinformatics and Molecular Evolution. UK: Blackwell Publishing.
Hollings M, Brunt AA. 1981. Potyvirus Group CMI/Aab. Descriptions of plant viruses 245.
Matthews REF. 1970. Plant Virology. New York: Academic Press Inc.. Muladno. 2010. Teknologi Rekayasa Genetika. Ed ke-2. Bogor: IPB Press. Nando. 2010. 2011, Harga Minyak Nilam Berpotensi Tembus Rp 1 Juta Per Kg.
http://pekanbaru.tribunnews.com/2010/11/19/2011-harga-minyak-nilam-berpotensi-tembus-rp-1-juta-per-kg [15 November 2011].
Natsuaki KT, Tomaru K, Ushiku S, Ichikawa Y, Sugimura Y, Natsuaki T, Okuda S, Teranak M. 1994. Characterization of two viruses isolated from Patchouli in Japan. Plant Disease 78(11):1094-1097.
Noveriza R, Suastika G, Hidayat SH, Kartosuwondo U. 2010. Identification of A
Potyvirus Associated with Mosaic Disease on Patchouli Plants in Indonesia (Abstract). ISSAAS International Congress 2010 “Agricultural Adaptation in Response to Climate Change”; Denpasar, 14-18 November 2010: 227-273(17).
24
Sukamto, Rahardjo IB, Sulyo Y. 2007. Detection of Potyvirus on Patchouli plant (Pogostemon cablin Benth) from Indonesia. Proceeding of International Seminar on Essensial Oil; Jakarta, 7-9 November 2007: 72-77.
Winterhalter AC. 2005. Potyvirus (Virology down under). http://www.uq.edu.au/ vdu/VDUPotyvirus.htm [5 Agustus 2011].
Yusron M, Wiratno. 2001. Budidaya tanaman nilam (Pogostemon cablin Benth). Bogor: Balai Penelitian Tanaman Rempah dan Obat.
RITA KURNIA APINDIATI. Identifikasi Telosma mosaic virus Penyebab Penyakit Mosaik pada Tanaman Nilam (Pogostemon cablin Benth.). Dibimbing oleh GEDE SUASTIKA.
Nilam (Pogostemon cablin Benth.) adalah satu dari sekian banyak tanaman penting yang digunakan untuk minyak esensial sebagai material dasar pada industri yang berbeda. Tanaman nilam terinfeksi oleh virus yang menyebabkan penyakit pada daun dengan gejala mosaik ditemukan di daerah Bogor, Jawa Barat. Setelah dideteksi melalui enzyme-linked immunosorbent assay (ELISA) menggunakan antiserum terhadap Broad bean wilt virus, Cucumber mosaic virus,
Tobacco mosaic virus, dan Potyvirus terlihat bahwa sampel tanaman nilam bergejala mosaik tersebut bereaksi kuat terhadap antiserum Potyvirus dan tidak terhadap antiserum lainnya. Oleh karena itu, identifikasi terfokus pada Potyvirus.
Reverse transcription-polymerase chain reaction (RT-PCR) menggunakan primer spesifik untuk genus Potyvirus berhasil mengamplifikasi RNA genom virus pada gen coat proteinnya. Analisis sikuen nukleotida pada produk RT-PCR mengindikasikan bahwa virus tersebut adalah Potyvirus seperti yang telah dilaporkan sebelumnya. Berdasarkan homologi sikuen nukleotida, Potyvirus
PENDAHULUAN
Latar belakang
Nilam (Pogostemon cablin Benth.) adalah satu dari sekian banyak tanaman penting yang digunakan untuk minyak esensial sebagai material dasar di industri yang berbeda. Minyak nilam banyak digunakan dalam industri kosmetika dan banyak dicari konsumen dari luar negeri (Sudaryani & Sugiharti 1990). Nilam merupakan salah satu komoditas ekspor penting di Indonesia yang memasok sekitar 70% kebutuhan dunia akan minyak nilam dengan volume ekspor rata-rata di atas 1.000 ton per tahun. Pada tahun 2009 Indonesia dapat mengekspor minyak nilam sebesar 1.000 ton atau 66,66% dari kebutuhan dunia yang mencapai 1.500 ton. Minyak nilam Indonesia diekspor ke Eropa sebanyak 30%, Amerika Serikat sebanyak 35%-40%, dan sisanya ke beragam negara di dunia
(Nando 2010).
Indonesia adalah salah satu penghasil minyak nilam terbesar di dunia, tetapi kualitas dari minyak nilamnya masih di bawah negara-negara pengekspor minyak nilam lainnya. Hal itu disebabkan oleh faktor-faktor yang kurang mendukung dalam budidaya nilam baik pra panen maupun pasca panen. Pengembangan nilam mengalami kendala akibat adanya serangan penyakit yang disebabkan salah satunya oleh virus. Tanaman nilam ditanam secara vegetatif melalui penyetekkan. Tanaman nilam yang terserang virus menunjukkan gejala mosaik kekuningan (Sukamto et al. 2007).
Potyvirus pada tanaman nilam telah dideteksi dan dilaporkan di beberapa kebun botani dan penelitian pertanian di Jepang. Gejala pada tanaman nilam terinfeksi Potyvirus dari hampir tidak ada atau hanya sedikit belang sampai mosaik. Tanaman nilam dengan gejala tersebut dapat diketahui terinfeksi
Potyvirus atau Fabavirus (Natsuaki et al. 1994). Potyvirus dapat ditularkan melalui inokulasi mekanik, tetapi di lapangan dapat ditularkan secara non persisten oleh kutu daun. Selain menyerang tanaman nilam, Potyvirus juga mempunyai kisaran inang yang luas. Tanaman nilam di Jepang dan Brazil telah dilaporkan dapat terinfeksi oleh Patchouli mild mosaic virus (PatMMV) genus
virus X genus Potexvirus (Natsuaki et al. 1994; Filho et al. 2002 dalam Sukamto
et al. 2007). Virus menginfeksi tanaman dan menyebabkan penurunan biomassa dan kandungan minyak esensial. Hasil penelitian di Indonesia menyebutkan bahwa virus yang terdapat pada tanaman nilam di Indonesia adalah Potyvirus. Penyakit tanaman nilam di daerah Cianjur dan Bogor yang terinfeksi Potyvirus
dilaporkan mempunyai gejala mosaik (Sukamto et al. 2007). Noveriza et al. (2010) mendeteksi adanya Potyvirus pada tanaman nilam yang bergejala mosaik dari beberapa sampel yang diperoleh dari Bogor. Namun, spesies Potyvirus
tersebut belum terindentifikasi.
Tujuan Penelitian
Penelitian ini bertujuan untuk mengidentifikasi Potyvirus yang menyebabkan penyakit mosaik pada tanaman nilam.
Manfaat Penelitian
TINJAUAN PUSTAKA
Tanaman Nilam (Pogostemon cablin Benth.)
Tanaman nilam dikenal dengan berbagai nama di beberapa daerah antara lain, yaitu dilem (Sumatera dan Jawa), rei (Sumba), pisak (Alor), dan ungapa (Timor). Nama dagang dikenal dengan pathcouli sedangkan pada kalangan ilmiawan nilam lebih dikenal dengan Pogostemon sp. Berdasarkan informasi dari Direktorat Jendral Perkebunan terdapat berbagai spesies nilam yang dikenal adalah Pogostemon cablin Benth., Pogostemon hortensis Backer., Pogostemon heyneanus Benth. P. cablin Benth. sering disebut dengan nama nilam Aceh, ciri utamanya adalah daunnya membulat seperti jantung dan di permukaan bagian bawahnya terdapat bulu-bulu rambut, dan jarang berbunga. P. hortensis Backer. yang dikenal dengan nama nilam sabun memiliki ciri-ciri lembaran daun lebih tipis, tidak berbulu, permukaan daun tampak mengkilat, dan warnanya hijau.
P. heyneanus Benth. yang sering disebut nilam hutan atau nilam jawa memiliki ciri-ciri yaitu ujung daun agak runcing, lembaran daun tipis dengan warna hijau tua, dan berbunga lebihcepat. Dari ketiga jenis nilam tersebut, yang paling tinggi kandungan minyaknya adalah nilam Aceh (2,5–5,0%), sedangkan nilam lainnya rata-rata hanya mengandung0,5–1,5% (Ditjenbun 2007). P. cablin Benth. berasal dari Filipina yang kemudian dibudidayakan di Malaysia, Madagaskar, Paraguay, Brasil, dan Indonesia. Perbedaan lain dari ketiga nilam tersebut adalah nilam Aceh (P. cablin Benth.) dan nilam sabun (P. hortensis Backer.) tidak berbunga, sedangkan nilam Jawa (P. heyneanus Benth.) berbunga (Yusron & Wiratno 2001).
Tanaman nilam dapat tumbuh pada dataran rendah hingga tinggi sampai 2.000 m dpl baik di lahan datar, miring, maupun berbukit-bukit.
Tabel 1 Daerah Penyebaran Tanaman Nilam di Indonesia (Ditjenbun 2007)
No. Propinsi Kabupaten
1 Nangroe Aceh Darusalam
Aceh Utara, Gayo Lues, Aceh Selatan, Aceh Jaya, Aceh Barat Daya, Aceh Tenggara, Aceh Barat, Nagan Raya, Aceh Tengah, Aceh Singkil, Pidie, dan Aceh Besar 2 Sumatera Utara Nias, Toba Samosir, Tapanuli Selatan, Tapanuli Utara,
Dairi, dan Tapanuli Tengah
3 Sumatera Barat Pasaman, Pesisir Selatan, Mentawai, Sawahlunto/Sijunjung, Tanah Datar, Solok, Pasaman Barat, dan Pariaman
4 Riau Indragiri Hilir, Bengkalis, Indragiri Hulu, Rokan Hulu, dan Kepulauan Riau
5 Sumatera Selatan Muara Enim, OKU Selatan
6 Bengkulu Rejang lebong, Bengkulu Selatan, dan Bengkulu Utara 7 Lampung Lampung Barat, Tanggamus, dan Lampung Selatan 8 Jawa Barat Majalengka, Garut, Kuningan, Tasikmalaya, Sukabumi,
dan Sumedang
9 Jawa Tengah Purbalingga, Brebes, Banyumas, Banjarnegara, Pemalang, Pekalongan, Batang, dan Cilacap
10 Jawa Timur Bondowoso, Situbondo, Jember, dan Tulungagung 11 Kalimantan
Tengah
Lamandau, Kotawaringin Barat, Kota-waringin Timur, Katingan, Seruyan, Gunung Mas, dan Sukamara
Minyak nilam diperoleh dari bagian daun dan minyak nilam asal Indonesia sudah diekspor ke berbagai negara seperti Hongkong, Jepang, India, Prancis, Belanda, Inggris, Jerman, Kanada, Mesir, Swiss, Saudi Arabia, dan Amerika Serikat (AS). Sebagai pembeli utama adalah AS. Komponen dalam minyak nilam adalah patchouli alcohol, patchouli camphor, eugenol, benzaldehyde,
5
minyak, daun nilam juga berguna untuk bahan pelembab kulit, menghilangkan bau badan, dan gatal-gatal pada kulit (Ditjenbun 2007).
Potyvirus
Potyvirus sangat luas kisaran inangnya serta menyebabkan kerugian dalam jumlah besar pada tanaman ekonomis penting. Potyvirus termasuk anggota famili Potyviridae. Kelompok Potyvirus (dinamai dari anggota prototipikalnya, Potato Virus Y (PVY)) merupakan yang terbesar dari 34 kelompok virus tanaman dan famili yang diakui saat ini (Ward & Shukla 1991 dalam Winterhalter 2005). Berdasarkan Matthews (1982) tercatat 48 anggota yang pasti dan 67 anggota lainnya. Partikel Potyvirus berupa batang lentur dengan diameter sekitar 11 nm dan panjang 680-900 nm (Francki et al. 1985). Nukleokapsid berisi sekitar 2000 subunit protein. Simetri nukleokapsid heliks berukuran 3,4 nm. Genom
Potyvirus adalah ssRNA linear positif berukuran mulai dari 9000-12000 bp. Ekspresi genom Potyvirus berupa genom monopartit terjadi melalui translasi poliprotein dari genom virus yang menampilkan potongan-potongan fragmen tersintesis (Gambar 1).
Gambar 1 Organisasi genom Potyvirus 5’UTR: 5’-untranslated region; P1: protein 1: HC-pro: helper component proteinase; P3: protein 3; 6K1: peptida 1; CI: cylindrical inclusion protein; 6K2: peptida 2; VPg: viral genome-linked protein; NIa: nuclear inclusion a (proteinase); NIb: nuclear inclusion b (viral replicase); CP: coat protein; 3’UTR: 3’-untranslated region (Winterhalter 2005)
Potyvirus ditularkan oleh kutu daun secara non persisten. Infeksi Potyvirus
dengan hijau muda (Akin 2006). Gejala dari infeksi Potyvirus merupakan pengembangan pola terang dan gelap dari warna hijau yang memberikan efek mosaik pada daun yang terinfeksi. Sifat dari pola yang tergambar akibat serangan
Potyvirus berbeda-beda tergantung dari tanaman inang dan jenis virus yang terlibat. Gejala mosaik yang ditimbulkan merupakan gejala yang muncul secara sistemik (Matthews 1970).
Reverse Transcription-Polymerase Chain Reaction (RT-PCR)
Teknik RT-PCR ini sangat berguna untuk mendeteksi ekspresi gen, amplifikasi RNA sebelum dilakukan kloning dan analisis, maupun diagnosis agensia infektif maupun penyakit genetik (Yuwono 2006). Teknik RT-PCR merupakan teknik yang digunakan untuk mendeteksi virus yang memiliki genom RNA seperti sebagian besar virus tumbuhan sehingga diperlukan modifikasi teknik PCR karena molekul sasarannya adalah RNA. RT-PCR merupakan teknik PCR yang dapat menggandakan RNA menjadi DNA. Teknik RT-PCR terdiri atas dua reaksi yaitu reaksi transkripsi balik (reverse transcription) yang menggunakan genom RNA virus sebagai cetakan dan menghasilkan cDNA primer (untai tunggal) serta reaksi penggandaan PCR. Primer yang digunakan sesuai dengan virus yang akan dideteksi (Akin 2006). PCR merupakan teknik yang relatif sederhana dan merupakan teknik penggandaan (amplifikasi) dengan menggunakan DNA primer yang memiliki runutan nukleotida khas untuk molekul asam nukleat yang akan dideteksi. Primer merupakan molekul oligonukleotida yang disintesis
in vitro dan runutan nukleotidanya disesuaikan dengan genom virus yang akan dideteksi. PCR hanya akan menggandakan asam nukleat yang sesuai dengan primer.
7
dalam kaitannya dengan proses PCR untuk amplifikasi DNA dengan bantuan DNA polymerase sebab DNA polymerase hanya dapat bekerja pada template
yang berupa DNA. Tahapan RT dapat dilakukan dalam tabung yang sama dengan PCR (one-step PCR) atau pada tabung yang terpisah (two-step PCR) menggunakan suhu berkisar 40 °C sampai 50 °C, tergantung pada karakteristik
reverse transcriptase yang digunakan. Tahap berikutnya adalah denaturasi
dsDNA pada 95 °C, pada tahap ini dua untai DNA akan terpisah dan primer dapat mengikat pada untai tersebut jika temperaturnya diturunkan kemudian yang selanjutnya akan dimulai rantai reaksi baru. Kemudian suhu diturunkan hingga mencapai suhu annealing yang bervariasi tergantung primer yang digunakan. Temperatur annealing dipilih untuk PCR tergantung langsung pada panjang dan komposisi dari primer tersebut. Hal ini merupakan hasil dari perbedaan ikatan hidrokarbon antara A-T (2 ikatan) dan G-C (3 ikatan). Temperatur annealing
Tempat dan Waktu Penelitian
Penelitian dilaksanakan di rumah kaca Balai Penelitian Tanaman Obat dan Aromatik (Balittro) Cimanggu, Bogor, Jawa Barat. Deteksi virus dilaksanakan di Laboratorium Virologi, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor. Penelitian dilakukan dari Februari sampai Juni 2011.
Persiapan Tanaman Nilam sebagai Tanaman Uji
Bibit tanaman nilam diperoleh dengan cara stek pucuk tanaman nilam nomor 21 hasil kultur jaringan laboratorium di Balittro. Pucuk yang telah distek kemudian direndam di dalam air bertujuan untuk menyegarkan tanaman nilam yang telah distek tersebut. Stek pucuk tersebut ditanam dalam polybag berisi media tanah yang telah dicampur dengan pupuk kandang (2:1) kemudian disungkup dengan plastik untuk menjaga kelembaban. Dua minggu sungkup dibuka, tanaman dipelihara dalam rumah kasa kedap serangga sampai umur satu bulan siap diinokulasi virus.
Tanaman Indikator untuk Kisaran Inang
Terdapat sepuluh macam benih sebagai kisaran inang yaitu benih
Chenopodium amaranticolor, Chenopodium quinoa, Gomphrena globosa, kacang panjang (Vigna sinensis), Nicotiana benthamiana, cabai (Capsicum annum),
Datura metel, kedelai (Glycine max), mentimun (Cucumis sativus), dan tomat (Lycopersicon esculentum). Masing-masing tanaman indikator dengan 10 ulangan untuk perlakuan yang sama disertai kontrol untuk masing masing tanaman indikator. Pesemaian dilakukan dengan menanam benih-benih tanaman yang telah ditentukan sebelumnya sebagai tanaman indikator. Penyiraman juga
9
dipindahkan ke polybag yang berisi media tanah yang telah tercampur dengan pupuk kandang (2:1).
Inokulasi Potyvirus
Sumber virus adalah tanaman nilam N2A1 hasil kultur jaringan yang terinfeksi Potyvirus koleksi rumah kaca Balittro, Bogor. Daun nilam tersebut ditimbang dan ditambahkan phosphate buffer sebanyak lima kali bobot daun kemudian digerus dengan mortar di dalam wadah yang berisi es. Kemudian tambahkan mercaptoethanol sebanyak 1% dari phosphate buffer dan digerus hingga lumat. Sap yang diperoleh dioleskan dengan cotton bud pada permukaan daun uji yang telah ditaburi carborundum dan kemudian dicuci dengan air agar bersih. Inokulasi dilakukan pada tanaman nilam nomor 21 sebagai tanaman uji dan tanaman-tanaman indikator sebagai kisaran inang. Pengamatan dilakukan setiap hari selama satu bulan.
Antigen CoatedPlate-Enzyme Linked Immunosorbent Assay (ACP-ELISA)
Penyiapan daun yang akan dideteksi menggunakan uji serologi ELISA dilakukan dengan menimbang daun masing-masing 0,1 gram ke dalam plastik. Daun yang telah diberi buffer (coating buffer pH 9,6 + 0,05 M DIECA) sebanyak lima kali dari bobot daun digerus hingga halus. Ekstrak tanaman dimasukkan ke dalam masing-masing sumuran pada plate ELISA yang telah disediakan dan diinkubasi selama satu malam (overnight). Setelah inkubasi, dilakukan pencucian
pada suhu 37 °C. Setelah dilakukan pencucian menggunakan buffer PBST,
dimasukkan 10 ml substrate buffer pH 9,8 yang telah ditambahkan 10 mg p-nitrophenyl phosphate (PNP [Sigma 104-105]) ke dalam sumuran plate.
Setiap 30 menit dilakukan pembacaan nilai absorbansi menggunakan ELISA
reader pada absorbance 405 nm.
Ekstraksi RNA Total
Sebanyak 0,1 gram daun bergejala digerus menggunakan mortar dan pistil dengan nitrogen cair dan ditambahkan 450 μl buffer ekstraksi yang mengandung 1% mercaptoethanol. Hasil gerusan dimasukkan ke dalam tabung mikro 2 ml dan diinkubasi pada suhu 56 °C selama 10 menit. Sampel yang telah diinkubasi kemudian dimasukkan menggunakan pipet mikro ke dalam QIA shredder spin colomn yang berwarna ungu dan disentrifugasi dengan kecepatan 13.000 rpm selama 2 menit. Supernatan yang diperoleh dipindahkan ke dalam tabung mikro baru dan ditambahkan ethanol 96% sebanyak 0,5 volume (±225 μl). Setelah tercampur, sebanyak ±650 μl suspensi dimasukan ke dalam QIA shredder spin colomn pink dan disentrifugasi dengan kecepatan 10.000 rpm selama 15 detik. Sebanyak 700 μl buffer RW1 kemudian ditambahkan ke dalam QIA shredder spin colomn pink tersebut kemudian disentrifugasi kembali dengan kecepatan 10.000 rpm selama 15 detik untuk mencuci kolom. Setelah itu, colomn
dipindahkan ke tabung koleksi baru, kemudian ditambahkan 500 μl buffer RPE dan disentrifugasi dengan kecepatan 10.000 rpm selama 15 detik. Tanpa menggunakan tabung koleksi baru, sebanyak 500 μl buffer RPE ditambahkan pada colomn dan disentrifugasi selama 2 menit dengan kecepatan 10.000 rpm.
11
Sintesis Complementary(c)DNA
Reaksi reverse transcription (RT) atau transkripsi balik merupakan proses yang digunakan untuk merubah RNA menjadi DNA. Proses RT-PCR dilakukan menggunakan kit komersial Access RT-PCR System (Promega, USA). Total RNA diekstraksi dari 100 mg jaringan daun tanaman nilam menggunakan Rneasy Plant Mini Kits (Qiagen Inc., Chatsworth, CA., USA). Sampel RNA yang telah dimurnikan diresuspensikan dengan 450 µl Rnase free water, kemudian disimpan pada suhu -80 °C sampai akan digunakan dalam RT-PCR. Adapun komposisi yang digunakan dalam reaksi RT terdapat pada Tabel 2.
Tabel 2 Komposisi reaktan reverse transcription (RT) (Promega, USA) untuk satu kali reaksi sintesis complementary DNA terhadap RNA genom
Potyvirus isolat nilam Bogor
Komponen Volume (µl)
Reaksi RT sebanyak 10 μl untuk setiap reaksi dijalankan dengan program
RT yaitu 25 °C selama 5 menit, 42 °C selama 60 menit, dan 70 °C selama 15 menit. Hasil dari RT berupa cDNA yang selanjutnya digunakan dalam
proses PCR. Reaksi RT dilakukan dalam sebuah Automated Thermal Cycler
Amplifikasi DNA
Reaksi PCR untuk memperbanyak pita DNA menggunakan cDNA hasil dari proses RT yang telah dilakukan. Adapun komposisi bahan yang digunakan dalam PCR terdapat pada Tabel 3.
Tabel 3 Komposisi reaktan polymerase chain reaction (PCR) (Promega, USA) untuk satu kali reaksi amplifikasi gen coat protein (CP) Potyvirus isolat nilam Bogor
Reaksi PCR dilakukan pada volume 50 µl menggunakan Go Tag Green Master Mix 2x (Promega, Madison, USA). Amplifikasi genom Potyvirus
dilakukan menggunakan sepasang primer CPUP-F (5’-TGAGGATCCTGGTGYA THGARAAYGG-3’, Y = C/T, H = A/T/C, R = A/G), spesifik untuk coat protein
pada Potyvirus dan CP9502-R (5’-GCGGATCCTTTTTTTTTTTTTTTTT-3’) spesifik untuk ujung 3’ genom Potyvirus. Program PCR yang dijalankan untuk
Potyvirus pada tanaman nilam yaitu denaturasi pada suhu 94 °C selama 5 menit, kemudian dilanjutkan dengan 45 siklus pada suhu 94 °C selama 1 menit, 54 °C selama 2 menit, dan 72 °C selama 1 menit, serta diikuti perpanjangan pada 72 °C selama 10 menit dan siklus berakhir pada suhu 4 °C menggunakan mesin PCR
Automated Thermal Cycler (Gene Amp PCR System 9700; PE Applied Biosystem, USA).
Elektroforesis
13
selama 2 menit hingga tercampur rata dan didapatkan larutan tersebut jernih. Setelah larutan Agarosa tersebut hangat, kemudian ditambahkan ethidium bromide
sebanyak 0,5 kali volume larutan yaitu 1,5 μl. Larutan tersebut kemudian dituang ke dalam pencetak gel. Setelah itu, sisir ditempatkan di dekat tepian gel dan gel didiamkan hingga mengeras selama satu jam. Setelah gel siap, maka sebanyak 5 μl marker DNA dan 5 μl DNA Potyvirus hasil PCR dimasukkan masing-masing ke dalam sumur gel dan dilakukan elektroforesis. Elektroforesis dilakukan selama 25 menit dengan voltase sebesar 100 V. DNA yang telah dielektroforesis kemudian divisualisasi di bawah UV transiluminator. Pita DNA yang terbentuk pada hasil elektroforesis tersebut diambil gambarnya menggunakan kamera digital yang telah tersedia.
Analisa Sikuen NukleotidaPotyvirus
Sampel yang telah terdeteksi positif terinfeksi Potyvirus pada tanaman nilam uji kemudian dilakukan analisa sikuen nukleotida Potyvirus tersebut. Sikuen nukleotida tersebut kemudian di blast pada web National Center for Biotechnology Information (www.ncbi.nlm.nih.gov) untuk memperoleh kesamaan nukleotida yang didapatkan dari hasil sikuen sebelumnya kemudian untuk mendapatkan fasta berupa database nukleotida dari virus yang diindikasikan sama dengan virus yang dianalisa. Basic Local Alignment Search Tool (BLAST) seringkali menggunakan program yang telah diimplementasi pada cara umum untuk perlakuan dengan tipe-tipe berbeda pada data sikuen. BLAST merupakan alat yang tersedia untuk mencari database untuk menemukan sikuen yang sama pada sebuah penggunaan sequence query supplied.
Analisa sikuen dilakukan setelah mendapatkan database nukleotida dari virus tersebut kemudian dianalisa menggunakan BioEdit Sequence Alignment Editor untuk mendapatkan database nukleotida dari Potyvirus yang dianalisa berdasarkan coat protein Potyvirus tersebut. Sequence alignment merupakan landasan bioinformatika berupa variabel yang telah dikonversi dan digunakan sebagai dasar database metode filogeni (Higgs & Attwood 2005).
HASIL DAN PEMBAHASAN
Kisaran Inang Potyvirus Isolat Nilam Bogor
Tanaman nilam sakit banyak terdapat di daerah Bogor yang memperlihatkan gejala mosaik dengan ciri-ciri hampir sama dengan yang pernah diutarakan oleh beberapa peneliti terdahulu (Natsuaki et al. 1994; Filho et al. 2002 dalam Sukamto et al. 2007). Hasil uji serologi menggunakan berbagai antiserum terhadap sampel tanaman nilam sakit yang bergejala mosaik memperlihatkan bahwa antiserum Potyvirus memberikan sinyal yang sangat kuat (Gambar 2). Hal ini menandakan bahwa sampel tanaman tersebut terinfeksi oleh Potyvirus. Oleh karena itu, penelitian diarahkan untuk mengetahui spesies Potyvirus yang berasosiasi dengan penyakit mosaik pada tanaman nilam di daerah Bogor tersebut.
Gambar 2 Hasil enzyme-linked immunosorbent assay menggunakan antiserum
Broad bean wilt virus (BBWV), Cucumber mosaic virus (CMV),
Tobacco mosaic virus (TMV), dan Potyvirus terhadap sampel tanaman nilam bergejala mosaik dan tanpa gejala yang dikoleksi dari daerah Bogor (Noveriza et al. 2010)
Gejala yang tampak dari daun yang diinokulasi berupa gradasi warna hijau tua dan hijau muda (mosaik), klorosis, serta berkerut. Sedangkan, gejala yang tampak pada daun pucuk berupa gradasi warna hijau tua dan hijau muda (mosaik), mengeras, berubah bentuk (malformasi), serta terpilin. Dengan demikian, dapat dikatakan bahwa gejala awal berupa mosaik ringan yang kemudian menjadi mosaik parah, terpilin, maupun malformasi daun. Gejala penyakit merupakan aspek yang sangat penting untuk menentukan tindakan pengendalian penyakit (Akin 2006). Pada penelitian ini, telah dilakukan ELISA untuk mendeteksi adanya Potyvirus pada tanaman nilam asal Bogor menggunakan antiserum
Potyvirus. Hasil yang diperoleh dari deteksi dengan ELISA tersebut menunjukkan bahwa sepuluh sampel tanaman nilam yang diuji menunjukkan gejala positif terinfeksi Potyvirus berupa gejala mosaik (Gambar 3a).
Gambar 3 Gejala yang muncul pada tanaman nilam N21 (a), C. amaranticolor
(b), dan C. quinoa (c) setelah diinokulasi mekanik dengan Potyvirus
isolat nilam Bogor
Pengetahuan tentang keragaman gejala yang ditimbulkan oleh suatu virus pada beberapa spesies tanaman diperlukan untuk mempermudah identifikasinya (Akin 2006). Spesies tanaman yang sering digunakan sebagai tanaman indikator tersebut antara lain C. quinoa, C. amaranticolor, mentimun (C. sativus), kacang panjang (V. sinensis), kedelai (G. max), D. metel, G. globosa, cabai (C. annum),
N. benthamiana, dan tomat (L. esculentum). Pada penelitian ini, terdapat beberapa tanaman indikator yang menunjukkan gejala positif terinfeksi Potyvirus
setelah diinokulasi mekanik, yaitu C. amaranticolor, C. quinoa, dan
N. benthamiana. Setelah dua minggu diinokulasi gejala yang tampak pada
17
diinokulasi (Gambar 3b). Gejala yang tampak pada C. quinoa berupa gejala lesio lokal klorotik pada daun yang diinokulasi (Gambar 3c). Sedangkan, gejala yang tampak pada N. benthamiana berupa daun yang kekuningan disertai klorosis secara sistemik. Sedangkan tanaman mentimun, kacang panjang, kedelai,
D. metel, G. globosa, cabai, dan tomat yang juga diinokulasi tidak memperlihatkan gejala dan tidak terdeteksi adanya infeksi Potyvirus berdasarkan uji ELISA. Kisaran inang Potyvirus pada penelitian ini agak berbeda dengan
Potyvirus yang diteliti oleh Sukamto et al. (2007) (Tabel 4). Pada penelitiannya, Sukamto et al. (2007) belum mengidentifikasi spesies virus sehingga belum dapat dipastikan Potyvirus yang terdapat pada penelitian ini merupakan salah satu strain atau spesies yang berbeda dengan Potyvirus yang diteliti Sukamto et al. (2007).
Tabel 4 Gejala yang muncul pada berbagai tanaman indikator setelah diinokulasi mekanik dengan Potyvirus
Chenopodium amaranticolor Nekrotik - Klorotik -
Chenopodium quinoa Klorotik - Klorotik
Gomphrena globosa - - Klorotik -
Kacang panjang (Vigna
sinensis) - - Klorotik -
Nicotiana benthamiana - Mosaik - Mosaik
Cabai (Capsicum annum) - - nt nt
Keterangan: - : tidak memperlihatkan gejala dan tidak terinfeksi Potyvirus setelah diuji ELISA;
Amplifikasi Gen Coat Protein Virus
Tanaman nilam asal Bogor dengan nomor sampel N4, N5, dan N6 merupakan sampel nilam yang mempunyai nilai absorbansi ELISA tinggi (data tidak diperlihatkan) sehingga digunakan sebagai sampel untuk amplifikasi gen CP Potyvirus. Amplifikasi dengan teknik RT-PCR menggunakan pasangan primer CPUP-F dan CP9502-R berhasil mendapatkan fragmen nukleotida
Potyvirus dengan ukuran sekitar 800 bp (Gambar 3; lajur N4, N5, dan N6). Fragmen DNA hasil PCR selanjutnya digunakan dalam sikuen nukleotida.
M K(-) K(+) N4 N5 N6
Gambar 4 Hasil amplifikasi DNA genom virus pada daerah gen coat protein
dengan metode RT-PCR menggunakan pasangan primer CPUP(F) dan CP9502(R) terhadap sampel daun tanaman nilam (lajur N4, N5, dan N6) yang bergejala mosaik, lajur K(-) dan K(+) adalah masing-masing kontrol negatif dari tanaman sehat dan kontrol positif dari tanaman sakit (Noveriza et al. 2010) dan lajur M adalah marker 100 bp DNA
ladder
Sikuen Nukleotida Gen Coat Protein Virus
Produk RT-PCR (Gambar 4; lajur N5) berhasil disikuen dan sebagian sikuen nukleotida gen CP Potyvirus asal Bogor tersebut disajikan pada Gambar 5.
500 bp
19
Gambar 5 Alignment sikuen nukleotida sebagian gen coat protein (CP) Potyvirus
asal Bogor, Telosma mosaic virus (TeMV) asal Hanoi, Passionfruit woodiness virus (PWV) asal Thailand, Peanut stripe virus (PStV) asal India, dan Patchouli mild mosaic virus (PatMMV) asal Filipina menggunakan program ClustalW [tanda * menunjukkan nukleotida yang identik]
Terhadap hasil sikuen nukleotida tersebut kemudian dilakukan blast pada www.ncbi.nlm.nih.gov untuk memetakan spesies-spesies Potyvirus yang mempunyai kedekatan dengan Potyvirus isolat nilam Bogor. Berdasarkan www.ncbi.nlm.nih.gov terdapat beberapa spesies dari Potyvirus yang kemiripannya mendekati hasil sikuen tersebut antara lain, yaitu Telosma mosaic virus (TeMV) asal Hanoi, Passionfruit woodiness virus (PWV) asal Thailand,