PENGARUH PERENDAMAN DENGAN LARUTAN CUKA 5% DAN AIR PANAS TERHADAP PELEPASAN KADAR FORMALIN PADA CUMI –
CUMI, IKAN GEMBUNG, UDANG DAN IKAN DENCIS SECARA SPEKTROFOTOMETRI SINAR TAMPAK
SKRIPSI
OLEH:
ANDIEN HAPSARI NIM 050804037
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
PENGARUH PERENDAMAN DENGAN LARUTAN CUKA 5% DAN AIR PANAS TERHADAP PELEPASAN KADAR FORMALIN PADA
CUMI-CUMI, IKAN GEMBUNG, UDANG DAN IKAN DENCIS SECARA SPEKTROFOTOMETRI SINAR TAMPAK
SKRIPSI
Diajukan untuk Melengkapi Salah Satu Syarat untuk Mencapai Gelar Sarjana Farmasi pada
Fakultas Farmasi Universitas Sumatera Utara
OLEH:
ANDIEN HAPSARI NIM 050804037
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
HALAMAN PENGESAHAN SKRIPSI Judul:
PENGARUH PERENDAMAN DENGAN LARUTAN CUKA 5% DAN AIR PANAS TERHADAP PELEPASAN KADAR FORMALIN PADA
CUMI-CUMI, IKAN GEMBUNG, UDANG DAN IKAN DENCIS SECARA SPEKTROFOTOMETRI SINAR TAMPAK
Oleh:
ANDIEN HAPSARI NIM 050804037
Dipertahankakan di Hadapan Panitia Penguji Skripsi Fakultas Farmasi
Universitas Sumatera Utara Pada Tanggal: Februari 2010
Pembimbing I, Panitia Penguji:
(Dra. Masfria, M.S., Apt.) (Drs. Muchlisyam, M.Si., Apt.) NIP 195707231986012001 NIP 195006221980021001
Pembimbing II, (Dra. Masfria, M.S., Apt.) NIP 195707231986012001
(Drs. Fathur Rahman H., M.Si., Apt.) (Drs. Syafruddin,M.S,Apt.) NIP 195201041980031002 NIP 194811111976031003
(Drs. Immanuel S. Meliala, M.Si.,Apt.) NIP 195001261983031002
Disahkan Oleh: Dekan,
KATA PENGANTAR
Puii dan syukur penulis haturkan ke hadirat Allah SWT Yang Maha Agung yang telah melimpahkan rahmat, hidayah dan kemudahan kepada penulis sehingga dapat menyelesaikan penelitian dan penyusunan skripsi yang berjudul “Pengaruh Perendaman Dengan larutan Cuka 5% dan Air Panas Terhadap Perlepasan Kadar Formalin Pada Cumi-cumi, Ikan Gembung, Udang dan Ikan Dencis Secara Spektrofotometri Sinar Tampak” sebagai salah satu syarat untuk mencapai gelar Sarjana Farmasi di Fakultas Farmasi Universitas Sumatera Utara.
Penulis mempersembahkan rasa terima kasih yang tak terhingga kepada Ayahandaku Suherman dan Ibundaku Sri Nur Wati yang telah memberikan semangat dan cinta yang teramat tulus, untuk kakakku Adi Prananto, adikku Andes Herviana dan Arfhan Nugroho, Keluarga Besar Danu Diharjo serta Keluarga Besar Suprat atas semua doa, kasih sayang, semangat dan pengorbanan baik moril maupun materil. Semoga Allah SWT selalu melindungi kalian semua.
Pada kesempatan ini, penulis juga mengucapkan terima kasih yang sebesar-besarnya kepada:
1. Ibu Dra. Masfria, M.S., Apt. dan Drs. Fathur Rahman Harun , M.Si., Apt. selaku pembimbing yang telah memberikan waktu, bimbingan dan nasehat selama penelitian hingga selesainya penyusunan skripsi ini.
dan Ibu Saleha Salbi, M.Si., Apt., selaku penasehat akademik yang telah memberikan arahan dan bimbingan kepada penulis selama ini.
3. Bapak Drs. Muchlisyam, M.Si., Apt., Ibu Dra. Masfria, M.S., Apt., Bapak Drs. Syafruddin, M.S., Apt. dan Bapak Drs. Immanuel S. Meliala, M.Si., Apt., selaku dosen penguji yang telah memberikan saran, arahan dan kritik kepada penulis dalam penyelesaian skripsi ini.
4. Bapak dan Ibu staf Laboratorium Kimia Farmasi Kualitatif yang telah memberikan arahan dan fasilitas selama penulis melakukan penelitian.
5. Sahabat-sahabat penulis : Devit Aprizal, Aulia Sumantri, Fathul Jannah, Syafridah dan rekan-rekan mahasiswa Farmasi khususnya stambuk 2005 atas dukungan, semangat, bantuan dan persahabatan yang indah selama ini serta seluruh pihak yang telah, memberikan kasih sayang, bantuan, motivasi dan inspirasi bagi penulis selama masa perkuliahan sampai penyusunan skripsi ini.
Semoga Allah SWT memberikan balasan yang berlipat ganda dan pahala yang sebesar-besarnya kepada semua pihak yang telah membantu penyelesaian skripsi ini.
Penulis mengharapkan kritik dan saran yang membangun dari semua pihak guna perbaikan skripsi ini. Akhir kata penulis berharap semoga skripsi ini dapat bermanfaat bagi ilmu pengetahuan khususnya di bidang farmasi.
Medan, Februari 2010 Penulis,
DAFTAR ISI
Halaman
JUDUL ... i
HALAMAN PENGESAHAN ... ii
KATA PENGANTAR. ... iii
ABSTRAK ... iv
ABSTRACT ... v
DAFTAR ISI ... vi
DAFTAR TABEL ... viii
DAFTAR GAMBAR ... ix
DAFTAR LAMPIRAN ... x
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 4
1.3 Hipotesis ... 4
1.4 Tujuan Penelitian ... 5
1.5 Manfaat Penelitian ... 5
BAB II METODOLOGI PENELITIAN ... 6
2.1 Alat-Alat ... 6
2.2 Bahan-Bahan ... 6
2.3 Sampel ... 6
2.4 Pembuatan Pereaksi ... 7
2.4.1 Larutan Asam Kromatropat 0,05% ... 7
2.4.2 Pereaksi Nash ... 7
2.4.3 Natrium Hidroksida 1 N ... 7
2.4.4 Asam Klorida 1 N ... 7
2.4.5 Larutan Fenolftalein 0,2% ... 7
2.4.6 Larutan Merah Metil 0,1% ... 7
2.4.7 Hidrogen Peroksida 6% ... 7
2.5 Prosedur Penelitian ... 8
2.5.1 Pembakuan Natrium Hidroksida 1 N ... 8
2.5.3 Penetapan Kadar Formalin Baku Pembanding ... 8
2.5.4 Pemeriksaan Kualitatif Formalin pada Sampel ... 9
2.5.5 Penetapan Kadar Formalin ... 9
2.5.5.1 Pembuatan Larutan Formalin 1000 ppm ... 9
2.5.5.2 Pembuatan Larutan Kerja Formalin 40 ppm .. 9
2.5.5.3 Penentuan Panjang gelombang Maksimum Larutan Formalin ... 10
2.5.5.4 Penentuan Waktu Kerja Larutan Formalin ... 10
2.5.5.5 Penentuan Liniearitas Kurva Kalibrasi Larutan Formalin ... 10
2.5.6 Penentuan Kadar Formalin pada Sampel ... 11
2.6 Uji Validasi Metode Analisis ... 12
2.6.1 Penentuan Uji Perolehan Kembali ... 12
2.6.2 Penentuan Batas Deteksi dan Batas Kuantitasi ... 13
2.7 Analisa Data Secara Statistik ... 13
BAB III HASIL DAN PEMBAHASAN ... 15
3.1 Penentuan Kadar Formalin secara Titrasi Asam-Basa ... 15
3.2 Pemeriksaan Kualitatif Formalin pada Sampel ... 15
3.3 Penetapan Kadar ... 16
3.3.1 Panjang Gelombang Maksimum Larutan Formalin 16 3.3.2 Kurva Waktu Kerja Larutan Formalin ... 18
3.3.3 Linearitas Kurva KalibrasiLarutan Formalin ... 18
3.3.4 Kadar Formalin pada Sampel ... 18
3.4 Uji Validasi Metode Analisis ... 21
BAB IV KESIMPULAN DAN SARAN ... 23
4.1. Kesimpulan... 23
4.2. Saran... 23
DAFTAR PUSTAKA ... 24
DAFTAR TABEL
Halaman Tabel 1. Hasil Pemeriksaan Kualitatif Formalin pada Sampel dengan
pencucian menggunakan larutan cuka 5% dan air panas ... 16 Tabel 2. Kadar Formalin pada Sampel dengan perendaman selama 5 menit.. .. 19 Tabel 3. Kadar Formalin pada Sampel dengan perendaman selama 10 menit....19 Tabel 4. Kadar Formalin pada Sampel dengan perendaman selama 15 menit....20 Tabel 5. Kadar Formalin pada Sampel dengan perendaman selama 20 menit....20 Tabel 6. Hasil Pengujian Parameter Uji Validasi pada Ikan Dencis yang
DAFTAR LAMPIRAN
Halaman Lampiran 1. Perhitungan Pembakuan Natrium Hidroksida 1 N ... 26 Lampiran 2. Perhitungan Pembakuan Asam Klorida 1 N ... 27 Lampiran 3. Perhitungan Pembakuan Larutan Formalin
secara Titrasi Asam- Basa ... 28 Lampiran 4. Perhitungan Pembuatan Larutan Formalin 1000 ppm ... 29 Lampiran 5. Data Pengukuran Waktu Kerja Larutan Formalin ... 30 Lampiran 6. Kurva dan Data Kurva Kalibrasi Larutan Formalin pada Panjang Gelombang 412 nm dan Nilai Koefisien Determinasi (r2) ... 31 Lampiran 7. Perhitungan Persamaan Regresi ... 32 Lampiran 8. Contoh Perhitungan Kadar Formalin dalam Sampel ... 33 Lampiran 9. Analisa Data Statistik untuk Menghitung Kadar Formalin
dalam air Rendaman cumi–cumi dengan larutan cuka 5%
selama 5 menit... 34 Lampiran 10. Analisa Data Statistik untuk Menghitung Kadar Formalin
dalam air Rendaman cumi–cumi dengan larutan cuka 5%
selama 10 menit... 36 Lampiran 11. Analisa Data Statistik untuk Menghitung Kadar Formalin
dalam air Rendaman cumi–cumi dengan larutan cuka 5%
selama 15 menit... 38 Lampiran 12. Analisa Data Statistik untuk Menghitung Kadar Formalin
dalam air Rendaman cumi–cumi dengan larutan cuka 5%
selama 20 menit... 41 Lampiran 13. Analisa Data Statistik untuk Menghitung Kadar Formalin
dalam air Rendaman cumi–cumi dengan Air panas
selama 5 menit... 43 Lampiran 14. Analisa Data Statistik untuk Menghitung Kadar Formalin
dalam air Rendaman cumi–cumi dengan Air panas
Lampiran 15. Analisa Data Statistik untuk Menghitung Kadar Formalin dalam air Rendaman cumi–cumi dengan Air panas
selama 15 menit... 48 Lampiran 16. Analisa Data Statistik untuk Menghitung Kadar Formalin
dalam air Rendaman cumi–cumi dengan Air panas
selama 20 menit... 50 Lampiran 17. Analisa Data Statistik untuk Menghitung Kadar Formalin
dalam air Rendaman Ikan Gembung dengan larutan cuka 5% selama 5 menit... 52 Lampiran 18. Analisa Data Statistik untuk Menghitung Kadar Formalin
dalam air Rendaman Ikan Gembung dengan larutan cuka 5% selama 10 menit... 54 Lampiran 19. Analisa Data Statistik untuk Menghitung Kadar Formalin
dalam air Rendaman Ikan Gembung dengan As.cuka 5%
selama 15 menit... 56 Lampiran 20.Analisa Data Statistik untuk Menghitung Kadar Formalin
dalam air Rendaman Ikan Gembung dengan larutan cuka 5% selama 20 menit... 58 Lampiran 21.Analisa Data Statistik untuk Menghitung Kadar Formalin
dalam air Rendaman Ikan Gembung dengan Air panas
selama 5 menit... 61 Lampiran 22.Analisa Data Statistik untuk Menghitung Kadar Formalin
dalam air Rendaman Ikan Gembung dengan Air panas
selama 10 menit... 63 Lampiran 23.Analisa Data Statistik untuk Menghitung Kadar Formalin
dalam air Rendaman Ikan Gembung dengan Air panas
selama 15 menit... 66 Lampiran 24.Analisa Data Statistik untuk Menghitung Kadar Formalin
dalam air Rendaman Ikan Gembung dengan Air panas
Lampiran 25. Analisa Data Statistik untuk Menghitung Kadar Formalin dalam air Rendaman Ikan Dencis dengan larutan cuka 5%
selama 5 menit... 71
Lampiran 26. Analisa Data Statistik untuk Menghitung Kadar Formalin dalam air Rendaman Ikan Dencis dengan larutan cuka 5% selama 10 menit... 74
Lampiran 27. Analisa Data Statistik untuk Menghitung Kadar Formalin dalam air Rendaman Ikan Dencis dengan larutan cuka 5% selama 15 menit... 76
Lampiran 28. Analisa Data Statistik untuk Menghitung Kadar Formalin dalam air Rendaman Ikan Dencis dengan larutan cuka 5% selama 20 menit... 79
Lampiran 29.Analisa Data Statistik untuk Menghitung Kadar Formalin dalam air Rendaman Ikan Dencis dengan Air panas selama 5 menit... 82
Lampiran 30.Analisa Data Statistik untuk Menghitung Kadar Formalin dalam air Rendaman Ikan Dencis dengan Air panas selama 10 menit... 84
Lampiran 31.Analisa Data Statistik untuk Menghitung Kadar Formalin dalam air Rendaman Ikan Dencis dengan Air panas selama 15 menit... 87
Lampiran 32.Analisa Data Statistik untuk Menghitung Kadar Formalin dalam air Rendaman Ikan Dencis dengan Air panas selama 20 menit... 90
Lampiran 33. Hasil Analisa Kadar Formalin dalam Sampel ... .. 93
Lampiran 34. Perhitungan Perolehan Kembali (%) ... 101
Lampiran 35. Perhitungan Batas Deteksi dan Batas Kuantitasi ... 103
Lampiran 36. Nilai Distribusi t ... 104
Lampiran 37. Gambar Alat Destilasi Untuk Formalin ... 105
Lampiran 38. Foto Hasil Uji Kualitatif dengan Pereaksi Asam Kromatropat... 106
BAB I PENDAHULUAN
1.1Latar Belakang
Sejak beberapa abad yang lalu manusia telah memanfaatkan ikan,cumi– cumi dan udang sebagai salah satu bahan pangan yang banyak mengandung protein. Kebutuhan setiap manusia akan protein hewani sangat bervariasi, tergantung pada umur, jenis kelamin dan aktivitas yang dilakukan. Bagi tubuh manusia, protein hewani mempunyai beberapa fungsi, diantaranya : Menjadi sumber energi yang dibutuhkan dalam menunjang aktifitas kehidupan sehari-hari, membantu pertumbuhan dan pemeliharaan tubuh, mempertinggi daya tahan tubuh terhadap serangan penyakit dan juga memperlancar proses-proses fisiologis di dalam tubuh (Afrianto, 1989).
Penanganan ikan segar merupakan salah satu bagian penting dari mata rantai industri perikanan karena dapat mempengaruhi mutu. Baik buruknya penanganan ikan segar akan mempengaruhi mutu ikan sebagai bahan makanan (Afrianto, 1989).
Beberapa produk racun seperti ammonia (NH3) sebagai hasil proses perombakan oleh mikroba ikut pula mempercepat pembusukan. Dalam kondisi demikian, ikan berubah dari bahan pangan bergizi menjadi bahan racun (ammonia) bila dimakan (Sukesi, 2007).
Proses pembusukan ikan bisa dihambat, salah satunya dengan menekan perkembangan mikroba–mikroba pembusuknya. Mikroba ini akan berkembang biak lambat bila kondisi lingkungannya tidak optimal. Salah satu cara untuk menciptakan kondisi lingkungan yang bisa mematikan mikroba adalah dengan penambahan larutan formalin (Sukesi, 2007).
Dalam peraturan Menteri Kesehatan RI No. 722/Men.Kes/Per/IX/88 mengenai bahan tambahan makanan menegaskan bahwa formalin merupakan salah satu bahan tambahan yang dilarang digunakan dalam makanan.
Sifat formalin yang dapat larut dalam air (Ditjen POM, 1995), mempermudah pemanfaatan formalin dalam bidang industri. Sehingga banyak disalahgunakan sebagai pengawet makanan. Selain harganya murah dan mudah diperoleh, produsen seringkali tidak mengetahui penggunaan formalin sebagai pengawet makanan tidaklah tepat karena bisa menimbulkan berbagai masalah kesehatan bagi konsumen seperti gangguan pada pencernaan, hati, ginjal, pankreas dan sistem saraf pusat. Hal ini bertentangan dengan penggunaan formalin yang sebenarnya sebagai antiseptik, germisida dan desinfektan (Yuliarti, 2007).
juga dapat menghilangkan bau amis khas ikan serta dapat diperoleh dengan mudah dan murah (Sukesi, 2007).
Pemeriksaan formalin secara kualitatif dapat dilakukan dengan menambahkan asam kromatropat dalam asam sulfat pekat dengan pemanasan beberapa menit akan terjadi warna violet ( Schunack, 1990). Penentuan kadar formalin dapat dilakukan dengan beberapa metode, antara lain titrasi volumetri asam-basa (Ditjen POM, 1979) ; spektrofotometri sinar tampak menggunakan pereaksi Nash ( Herlich, 1990) dan Kromatografi Cair Kinerja Tinggi (Voncina, 2005). Dalam penelitian ini digunakan spektrofotometri sinar tampak karena metode tersebut sederhana dan juga memiliki tingkat ketelitian yang baik.
Cumi-cumi dan sotong mempunyai bagian-bagian tubuh yang sama, yang dibedakan atas kepala, leher dan badan. Keduanya termasuk hewan kelas Cephalopoda (Mollusca yang mempunyai kaki di kepala). Cumi-cumi dan sotong memiliki 10 tentakel yang terdiri dari 2 tentakel panjang dan 8 tentakel lebih pendek (Anonima, 2009).
Berdasarkan hal tersebut di atas, peneliti memeriksa ada atau tidaknya kandungan formalin dan seberapa besar kadar formalin dalam makanan laut seperti cumi–cumi, udang, ikan gembung dan ikan dencis setelah dibersihkan dari isi perutnya serta bagaimana cara untuk menurunkan kadar formalin dalam makanan–makanan tersebut sebelum mengalami proses pengolahan lebih lanjut. 1.2Perumusan Masalah
- Apakah cumi-cumi, ikan gembung, udang dan ikan dencis yang beredar di pasaran menggunakan formalin sebagai bahan pengawet
- Apakah proses perendaman dengan larutan cuka 5% dan air panas akan mempengaruhi pelepasan kadar formalin dari cumi–cumi, ikan gembung, udang dan ikan dencis
- Apakah waktu perendaman berpengaruh terhadap pelepasan kadar formalin dari cumi–cumi, ikan gembung, udang dan ikan dencis
1.3 Hipotesis
- Cumi–cumi, ikan gembung, udang dan ikan dencis yang beredar di pasaran menggunakan formalin sebagai bahan pengawet
- Proses perendaman larutan cuka 5% dan air panas akan mempengaruhi pelepasan kadar formalin dari cumi–cumi, ikan gembung, udang dan ikan dencis
1.4 Tujuan Penelitian
- Mengidentifikasi formalin pada cumi–cumi, ikan gembung, udang dan ikan dencis
- Menentukan kadar formalin yang terlarut dalam rendaman dengan larutan cuka 5% dan air panas
- Menentukan pengaruh waktu perendaman sampel terhadap kadar formalin yang terlarut dalam rendaman dengan larutan cuka 5% dan air panas 1.5 Manfaat Penelitian
BAB II
TINJAUAN PUSTAKA 2.1 Ikan dan Pengawetan
Ikan merupakan bahan makanan yang banyak dikonsumsi masyarakat sebagai salah satu sumber protein hewani disamping sumber protein nabati. Ikan cepat mengalami proses pembusukan dibandingkan dengan bahan makanan lain. Bakteri dan perubahan kimiawi pada ikan mati menyebabkan pembusukan (Anonimb, 2000).
2.1.1 Fungsi Ikan
Ikan merupakan salah satu bahan makanan yang mengandung berbagai macam zat nutrisi. Sebagai salah satu sumber protein hewani, ikan mengandung asam lemak tak jenuh , yodium, selenium, flourida, zat besi, magnesium, zink, taurin. Secara keseluruhan protein, vitamin, mineral dan asam lemak omega-3 yang dikandung dalam ikan mempunyai peran dalam kesehatan tubuh manusia baik di bagian otak, mata, jantung, paru-paru, otot, pencernaan, kulit maupun persendian (Anonimc, 2009).
2.1.2 Fungsi Cumi - cumi
semua jenis asam amino esensial yang diperlukan oleh tubuh. Asam amino esensial yang dominan adalah leusin, lisin, dan fenilalanin. Sementara kadar asam amino nonesensial yang dominan adalah asam glutamat dan asam aspartat.
Cumi-cumi juga mengandung beberapa jenis mineral mikro dan makro dalam jumlah yang sangat tinggi. Mineral penting pada cumi-cumi adalah natrium, kalium, fosfor, kalsium, magnesium, dan selenium. Fosfor dan kalsium berguna untuk pertumbuhan kerangka tulang, sehingga penting untuk pertumbuhan anak-anak dan mencegah osteoporosis di masa tua. Selain kaya akan protein, cumi-cumi juga merupakan sumber vitamin yang baik, seperti vitamin B1 (tiamin), B2 (riboflavin), B12, niasin, asam folat, serta vitamin larut lemak (A, D, E, K) (Anonim d, 2009).
2.1.3 Fungsi Udang
Udang termasuk dalam sumber protein hewani yang berfungsi, antara lain: a. Menjaga kesehatan kardiovaskular (jantung) karena mencegah
penggumpalan kepingan darah atau ateroskeloris
b. Memenuhi kebutuhan protein dengan asam amino berprofil lengkap yang mudah diserap tubuh
c. Memaksimalkan berbagai fungsi organ-organ vital tubuh karena berbagai kandungan vitaminnya
d. Sebagai antioksidan yang mampu menjaga kesehatan fungsi kekebalan tubuh, anti radikal bebas penyebab 50 macam penyakit degeneratif dan membantu produksi antibodi dengan kandungan selenium yang sangat tinggi
f. Mencegah penyakit darah rendah (anemia) dan berperan dalam
pembentukan sel darah merah karena kandungan besi dan zinc-nya yang tinggi
g. Menjaga kesehatan mata dengan kandungan vitamin A
h. Menjaga kesehatan kulit dan mencegah penyakit pellagra (bersisik) dengan kandungan vitamin E (alpha tocopherol) dan niasin yang tinggi i. Menjaga kesehatan tulang, gigi dan sendi dengan kandungan vitamin D,
kalsium dan potassium yang tinggi (Anonime, 2009). 2.1.4 Pengawetan Ikan
Penanganan ikan segar merupakan salah satu bagian penting dari mata rantai industri perikanan karena dapat mempengaruhi mutu. Baik buruknya penanganan ikan segar akan mempengaruhi mutu ikan sebagai bahan makanan atau sebagai bahan mentah untuk proses pengolahan lebih lanjut.
Dengan kandungan air cukup tinggi tubuh ikan merupakan media yang cocok untuk kehidupan bakteri pembusuk atau mikroorganisme yang lain, sehingga ikan sangat cepat mengalami proses pembusukan. Kondisi ini sangat merugikan karena dengan kondisi demikian banyak ikan tidak dapat dimanfaatkan dan terpaksa harus dibuang, terutama pada saat produksi melimpah. Oleh karena itu, untuk mencegah proses pembusukan perlu dikembangkan berbagai cara pengawetan dan pengolahan yang cepat dan cermat agar sebagian ikan yang diproduksi dapat dimanfaatkan.
Cara-cara pengawetan dan pengolahan pada pascapanen perikanan dilakukan berdasarkan pertimbangan sebagai berikut :
1. Tubuh ikan mengandung protein dan air cukup tinggi, sehingga merupakan media yang baik bagi pertumbuhan bakteri pembusuk dan mikroorganisme yang lain.
2. Produksi ikan bersifat musiman, terutama ikan laut. Dengan kondisi demikian pada suatu saat produksi ikan sangat melimpah sedangkan pada saat lain sangat rendah. Oleh karena itu diperlukan cara-cara pengawetan dan pengolahan yang mampu memproses ikan dengan cepat dan cermat terutama pada saat produksi sedang melimpah.
3. Kebutuhan manusia akan ikan tidak pernah mengenal musim. Setiap saat manusia dapat membutuhkan ikan. Dengan dikembangkannya cara-cara pengawetan dan pengolahan yang cepat dan cermat, daya tahan dan daya simpan ikan dapat lebih lama sehingga dapat memenuhi kebutuhan manusia setiap saat.
Proses pengolahan dan pengawetan ikan dapat dilakukan dengan berbagai cara seperti :
a. Menggunakan suhu tinggi. b. Menggunakan suhu rendah c. Mengurangi kadar air
d. Menggunakan zat antiseptik (Afrianto, 1989). 2.2 Formalin
(Moffat, 1986). Formalin merupakan cairan jernih tidak berwarna atau hampir berwarna, bau menusuk, uap merangsang selaput lendir hidung dan tenggorokan. Formalin larut dalam air atau etanol 95% (Ditjen POM, 1979).
2.2.1 Rumus Bangun
2.2.2 Sifat Fisika dan Kimia
Formaldehid ( HCOH) merupakan suatu bahan kimia dengan berat molekul 30,03 yang pada suhu kamar dan tekanan atmosfer berbentuk gas tidak berwarna, berbau pedas (menusuk) dan sangat reaktif (mudah terbakar). Bahan ini larut dalam air dan sangat mudah larut dalam etanol dan eter (Moffat, 1986).
Penyimpanan dilakukan pada wadah tertutup baik, terlindung dari cahaya dan sebaiknya pada suhu diatas 20˚C (Ditjen POM, 1979).
2.2.2 Penggunaan Formalin
digunakan sebagai bahan perekat untuk produk kayu lapis (polywood). Dalam kosentrasi yang sangat kecil ( < 1 persen ) digunakan sebagai pengawet untuk berbagai barang konsumen seperti pembersih rumah tangga, cairan pencuci piring, pelembut, perawat sepatu, shampoo mobil, lilin dan karpet (Yuliarti, 2007).
2.2.3 Bahaya Penggunaan Formalin Pada Makanan
Formalin bukan merupakan zat pengawet untuk makanan tetapi disalahgunakan untuk pengawetan industri makanan. Biasanya hal ini sering ditemukan dalam industri rumahan karena mereka tidak terdaftar dan tidak terpantau oleh Depkes dan Badan POM setempat. Produsen sering kali tidak tahu kalau penggunaan formalin sebagai bahan pengawet makanan tidaklah tepat karena bisa menimbulkan berbagai gangguan kesehatan bagi konsumen yang memakannya.
Beberapa penelitian terhadap tikus dan anjing menunjukkan bahwa pemberian formalin dalam dosis tertentu pada jangka panjang bisa mengakibatkan kanker saluran cerna. Penelitian lainnya menyebutkan peningkatan risiko kanker faring (tenggorokan), sinus dan cavum nasal (hidung) pada pekerja tekstil akibat paparan formalin melalui hirupan (Yuliarti, 2007).
2.3 Asam Cuka
Asam Asetat mengandung tidak kurang dari 36,0% dan tidak lebih dari 37,0% b/b C2H4O2. Pemerian berupa cairan jernih; tidak berwarna dan berbau khas, menusuk; rasa asam yang tajam. Kelarutan dapat bercampur dengan air, dengan etanol dan dengan gliserol (Ditjen POM, 1995).
diperoleh dari industrf,2009).
2.4 Pemeriksaan Kualitatif Formalin
Formalin dengan adanya asam kromatropat dalam asam sulfat pekat disertai pemanasan beberapa menit akan terjadi pewarnaan violet. Reaksi ini mengikuti prinsip kondensasi senyawa fenol dengan formaldehid membentuk senyawa berwarna (3,4,5,6-dibenzoxanthylium) (Schunack, 1990).
2.5Pemeriksaan Kuantitatif Formalin dengan Metode Spektrofotometri Sinar Tampak
Metode ini dapat dilakukan dengan penambahan pereaksi Nash (ammonium asetat dan asetil aseton) disertai pemanasan selama 30 menit akan membentuk kompleks berwarna kuning yang mantap, sehingga dapat diukur serapannya pada panjang gelombang maksimum 415 nm (Herlich, 1990).
harus dikalibrasi. Pada pengukuran serapan suatu larutan hampir semua digunakan blanko untuk spektrofotometer agar panjang gelombang pengukuran mempunyai serapan nol. Kegunaan blanko adalah mengoreksi serapan yang disebabkan oleh pelarut, pereaksi, sel ataupun pengaturan alat. Blanko dapat berupa pelarut yang sama seperti yang digunakan untuk melarutkan zat atau blanko pereaksi menyiapkan larutan zat (Ditjen POM, 1995).
2.6 Spektrofotometri
Spektrofotometri adalah pengukuran absorbsi energi cahaya oleh suatu atom atau molekul pada panjang gelombang tertentu (Day, 2002).
Rentang spektrum sinar ultraviolet mempunyai panjang gelombang 200-400 nm, sementara sinar tampak mempunyai panjang gelombang 400-750 nm (Rohman, 2007).
Menurut Day (2002) dan Rohman (2007), hukum Lambert-Beer menyatakan bahwa intensitas yang diteruskan oleh larutan zat penyerap berbanding lurus dengan tebal dan konsentrasi larutan dan berbanding terbalik dengan transmitan. Menurut Day (2002), hukum tersebut dituliskan dengan :
A = abc = log 1/T
Keterangan : A = absorbans
Pada spektrofotometri sinar tampak, pengamatan mata terhadap warna timbul dari penyerapan selektif panjang gelombang tertentu dari sinar masuk oleh objek yang berwarna (Vogel, 1994).
Ada beberapa hal yang harus diperhatikan dalam analisis dengan spektrofotometri ultraviolet dan cahaya tampak terutama untuk senyawa yang tidak berwarna yang akan dianalisis yaitu :
1. Pembentukan molekul yang dapat menyerap sinar UV-Vis
Cara yang digunakan adalah dengan merubahnya menjadi senyawa lain atau direaksikan dengan pereaksi tertentu sehingga dapat menyerap sinar UV-Vis.
2. Waktu kerja (operating time)
Tujuannya ialah untuk mengetahui waktu pengukuran yang stabil. Waktu kerja ditentukan dengan mengukur hubungan antara waktu pengukuran dengan absorbansi larutan.
3. Pemilihan panjang gelombang
Panjang gelombang yang digunakan untuk analisis kuantitatif adalah panjang gelombang yang mempunyai absorbansi maksimal.
4. Pembuatan kurva baku
Dilakukan dengan membuat seri larutan baku dalam berbagai konsentrasi kemudian absorbansi tiap konsentrasi diukur lalu dibuat kurva yang merupakan hubungan antara absorbansi dengan konsentrasi.
5. Pembacaan absorbansi sampel
2.7 Validasi
Validasi adalah suatu tindakan penilaian terhadap parameter tertentu pada prosedur penetapan yang dipakai untuk membuktikan bahwa parameter tersebut memenuhi persyaratan untuk penggunaannya (WHO, 1992). Validasi dilakukan untuk menjamin bahwa metode analisis yang dilakukan akurat, spesifik dan tahan pada kisaran analit yang akan dianalisis (Rohman, 2007).
2.7.1 Perolehan Kembali
Persen perolehan kembali digunakan untuk menyatakan kecermatan. Kecermatan merupakan ukuran yang menunjukkan derajat kedekatan hasil analisis dengan kadar analit sebenarnya. Kecermatan dapat ditentukan dengan dua cara yaitu metode simulasi (spiked-placebo recovery) dan metode penambahan baku (standard addition method). Dalam metode simulasi, sejumlah analit bahan murni pembanding kimia ditambahkan ke dalam campuran bahan pembawa sediaan farmasi (plasebo) lalu campuran tersebut dianalisis dan hasilnya dibandingkan dengan kadar analit yang ditambahkan. Metode adisi dapat dilakukan dengan menambahkan sejumlah analit dengan konsentrasi tertentu pada sampel yang diperiksa lalu dianalisis lagi dengan metode tersebut (WHO, 1992). % Perolehan kembali =
A A F
C C C
*
− x 100%
Keterangan : CF = konsentrasi sampel yang diperoleh setelah penambahan larutan baku
CA = konsentrasi sampel awal
2.7.2 Batas Deteksi
Batas deteksi adalah jumlah terkecil analit dalam sampel yang dapat dideteksi yang masih memberikan respon signifikan dibandingkan dengan blangko (WHO, 1992). Batas deteksi dapat dihitung dengan rumus sebagai berikut:
Batas Deteksi = Slope
SB 3
2.7.3 Batas Kuantitasi
Batas kuantitasi adalah jumlah terkecil analit dalam sampel yang masih dapat diukur dalam kondisi percobaan yang sama dan masih memenuhi kriteria cermat dan seksama (WHO, 1992).
Batas Kuantitasi = Slope
BAB III
METODOLOGI PENELITIAN
Metode penelitian yang dilakukan adalah metode eksperimental. Penelitian ini dilaksanakan di Laboratorium Kimia Farmasi Kualitatif Fakultas Farmasi Universitas Sumatera Utara.
3.1 Alat–Alat
Alat-alat yang digunakan dalam penelitian ini adalah satu unit Spektrofotometer UV-Vis (Shimadzu mini 1240), neraca analitis (AND GF-200), thermometer, dan alat-alat gelas seperti labu takar, gelas ukur, erlenmeyer, buret tabung reaksi dan beaker glass.
3.2 Bahan-bahan
Semua bahan yang digunakan dalam penelitian ini berkualitas pro analisis keluaran E-Merck yaitu Formalin 37 %, Asam kromatropat, Asam sulfat 98 %, Ammonium asetat, Asetil aseton, Natrium hidroksida, Hidrogen peroksida 30 %, Asam klorida 37 %, Fenolftalein, Kalium bifthalat, Natrium karbonat anhidrat, Merah metil, terkecuali Etanol 90 %, aquadest (Laboratorium Kimia Farmasi Kuantitatif).
3.3 Sampel
yang akan dianalisis dianggap sebagai sampel yang representative (Sudjana, 1996).
3.4 Pembuatan pereaksi
3.4.1 Larutan Asam Kromatropat 0,05 %
Dilarutkan 5 mg asam kromatropat dalam 10 ml campuran 9 ml asam sulfat 98% dan 4 ml air ( Ditjen POM, 1979).
3.4.2 Pereaksi Nash
Dilarutkan 30 g ammonim asetat dan 0,4 ml asetil aseton lalu ditambahkan air hingga 100 ml ( Gibson dan Skett, 1991).
3.4.3 Natrium Hidroksida 1 N
Dilarutkan 40 g natrium hidroksida dengan air bebas CO2 dalam labu 1000 ml. Setelah larut sempurna dicukupkan volumenya dengan air bebas CO2 sampai garis tanda (Ditjen POM, 1979).
3.4.4 Asam Klorida 1 N
Diencerkan 9,8 ml HCl 37 % dengan air secukupnya hingga 100 ml ( Ditjen POM, 1995).
3.4.5 Larutan Fenolftalein 0,2 % (b/v)
Dilarutkan 200 mg fenolftalein dalam 60 ml etanol 90 % dan tambahkan aquadest hingga 100 ml (Ditjen POM, 1979).
3.4.6 Larutan Merah Metil 0,1 % (b/v)
3.4.7 Hidrogen Peroksida 6 % (v/v)
Diencerkan 20 ml H2O2 30 % dengan air suling sampai garis tanda hingga 100 ml (Ditjen POM, 1979).
3.5 Prosedur Penelitian
3.5.1 Pembakuan Natrium Hidroksida 1 N
Ditimbang seksama 300 mg kalium bifthalat kemudian dilarutkan dalam air bebas CO2 sebanyak 30 ml. Ditambah 2 tetes indikator fenolftalein, dititrasi dengan NaOH hingga terjadi warna merah muda mantap (Ditjen POM, 1995). Dilakukan perlakuan yang sama tiga kali dan dihitung normalitas larutan.
1 ml natrium hidroksida 1 N setara dengan 204,2 mg kalium biftalat. Data dapat dilihat pada Lampiran 1.
3.5.2 Pembakuan Asam Klorida 1 N
Ditimbang seksama 150 mg natrium karbonat anhidrat, kemudian dilarutkan dalam 15 ml air. Ditambah 2 tetes indikator metil merah, ditambahkan asam klorida perlahan dari buret sambil diaduk hingga larutan berwarna merah muda pucat. Dipanaskan larutan hingga mendidih, dinginkan, dititrasi kembali bila perlu hingga warna merah muda pucat tidak hilang dengan pendidihan lebih lanjut (Ditjen POM, 1995 ). Dilakukan perlakuan yang sama tiga kali dan dihitung normalitas larutan.
1 ml asam klorida 1 N setara dengan 52,99 mg natrium karbonat anhidrat Data dapat dilihat pada lampiran 2.
3.5.3 Penetapan Kadar Formalin Baku Pembanding
penangas air hingga pembuihan berhenti. Dititrasi dengan asam klorida 1 N menggunakan indikator fenolftalein. Dilakukan titrasi blanko (Ditjen POM, 1979). Dilakukan perlakuan yang sama tiga kali dan dihitung normalitas larutan.
1 ml natrium hidroksida 1 N setara dengan 30,03 mg formalin Data dapat dilihat pada lampiran 3.
3.5.4 Pemeriksaan Kualitatif formalin pada sampel
Sampel ikan gembung yang telah dibuang isi perutnya dan dibersihkan sebanyak 100 g direndam dengan 200 ml larutan cuka 5% dan dengan 200 ml air panas, kemudian disaring. Ikan gembung disisihkan dan dilakukan pengujian pada filtrat. Diambil sebanyak 1 ml filtrat dimasukkan ke dalam tabung reaksi lalu ditambahkan dengan 5 ml larutan asam kromatropat 0,05 %. Larutan kemudian dipanaskan di dalam penangas air selama 15 menit. Diamati selama pemanasan, jika terbentuk warna violet menunjukkan adanya formalin (Herlich, 1990). Dilakukan pemeriksaan kualitatif pada cumi–cumi, udang dan ikan dencis dengan cara yang sama.
3.5.5 Penetapan Kadar Formalin
3.5.5.1 Pembuatan Larutan Induk Baku I (LIB I)
3.5.5.2 Pembuatan Larutan Induk Baku II (LIB II)
Dipipet 10 ml larutan induk baku I lalu dimasukkan ke dalam labu tentukur 250 ml. Ditambahkan air suling secukupnya dan dikocok hingga homogen. Kemudian larutan dicukupkan dengan air suling hingga garis tanda dan dihomogenkan.
3.5.5.3 Penentuan Panjang Gelombang Maksimum Larutan Formalin
Dipipet 5 ml larutan induk baku II dan dimasukkan ke dalam labu tentukur 100 ml ( konsentrasi 2,16 ppm), lalu ditambahkan 10 ml Pereaksi Nash. Selanjutnya ditambahkan air suling hingga garis tanda lalu larutan dihomogenkan. Larutan kemudian dipanaskan di dalam penangas air pada suhu 37˚C ±1˚C selama 30 menit hingga terbentuk warna kuning yang mantap. Diukur serapan maksimum pada panjang gelombang 360-460 nm dengan menggunakan blanko yaitu air suling yang dimasukkan ke dalam labu tentukur 100 ml, lalu ditambahkan 10 ml pereaksi Nash dan dicukupkan dengan air suling hingga garis tanda (Widyastuti, 2006).
3.5.5.4 Penentuan Waktu Kerja Larutan Formalin
Dipipet 5 ml larutan induk baku II dan dimasukkan ke dalam labu tentukur 100 ml ( konsentrasi 2,16 ppm), lalu ditambahkan 10 ml pereaksi Nash. Selanjutnya ditambahkan air suling hingga garis tanda dan larutan dihomogenkan. Larutan kemudian dipanaskan di dalam penangas air pada suhu 37˚C ±1˚C selama 30 menit hingga terbentuk warna kuning yang mantap. Diukur serapan pada panjang gelombang maksimum yang diperoleh (Widyastuti, 2006).
3.5.5.5 Penentuan Linieritas Kurva Kalibrasi Larutan Formalin
Dipipet larutan kerja formalin 40 ppm ke dalam labu tentukur 100 ml berturut-turut 2,5 ml; 3,75 ml; 5,0 ml; 6,25 ml; dan 7,5 ml (1,08; 1,62; 2,16; 2,7; dan 3,24 ppm). Ke dalam masing-masing labu tentukur tersebut ditambahkan 10 ml pereaksi Nash, lalu ditambahkan air suling hingga garis tanda dan dikocok hingga homogen. Kemudian masing-masing larutan ini dipanaskan di dalam penangas air pada suhu 37˚C ±1˚C selama 30 menit hingga terbentuk warna kuning yang mantap. Kemudian diukur serapannya pada panjang gelombang maksimum yang diperoleh, serta menggunakan larutan blanko (Widyastuti, 2006). Data dapat dilihat pada Lampiran 6 dan 7.
3.5.6 Penentuan Kadar Formalin Pada Sampel
Masing – masing sampel yang ditentukan sebanyak ±100 g direndam dalam 200 ml larutan cuka 5% dan 200 ml air panas (±1000C) dengan variasi waktu perendaman 5 menit, 10 menit, 15 menit dan 20 menit, kemudian disaring. Pada filtrat dilakukan pengujian kadar formalin. Filtrat diambil sebanyak 30 ml lalu dimasukkan ke dalam labu tentukur 50 ml. Selanjutnya larutan tersebut ditambahkan 10 ml reagen Nash 30% b/v. Lalu dicukupkan dengan air suling hingga garis tanda dan dihomogenkan. Larutan dipanaskan di penangas air pada suhu 37˚C ±1˚C selama 30 menit hingga terbentuk warna kuning yang mantap. Kemudian diukur serapannya pada panjang gelombang 412 nm. Perlakuan ini diulang sebanyak 6 kali.
Konsentrasi Formalin dapat diketahui dengan mensubstitusikan serapan yang didapat kedalam persamaan regresi (Y). Kadar Formalin dapat dihitung
dengan Rumus : K = BS
Dimana K = kadar total formalin dalam sampel (mcg/g) x = kadar formalin sesudah pengenceran V = volume sampel (ml)
Fp = faktor pengenceran BS = Berat sampel 3.6 Uji Validasi Metode Analisis
Uji validasi yang digunakan yaitu uji akurasi dengan parameter % perolehan kembali dan uji presisi dengan parameter SD (Standar Deviasi), RSD (Relative Standar Deviasi), batas deteksi dan batas kuantitasi.
3.6.1 Penentuan Uji Perolehan Kembali
Uji perolehan kembali dilakukan dengan menambahkan 1 ml larutan baku formalin 250 ppm ke dalam sampel kemudian dianalisis dengan perlakuan yang sama seperti pada sampel.
Menurut WHO (1992), perolehan kembali dapat dihitung dengan rumus sebagai berikut :
% Perolehan kembali =
A A F
C C C
*
− x 100%
SD (Simpangan Deviasi) =
1 )
( 2
− −
∑
n C CA A
RSD (Relative Standar Deviasi) = ×100%
A
C SD
Keterangan : CF = konsentrasi sampel yang diperoleh setelah penambahan larutan baku
A
C = konsentrasi sampel sebelum penambahan larutan baku
A
C = Rata–rata konsentrasi sampel sebelum penambahan
larutan baku n = jumlah perlakuan
Data dapat dilihat pada Lampiran 34. 3.6.2 Penentuan Batas Deteksi dan Batas Kuantitasi
Batas deteksi adalah jumlah terkecil analit dalam sampel yang dapat dideteksi yang masih memberikan respon signifikan dibandingkan dengan blangko (WHO, 1992). Batas deteksi dapat dihitung dengan rumus sebagai berikut:
Batas Deteksi = Slope
SB 3
Batas kuantitasi adalah jumlah terkecil analit dalam sampel yang masih dapat diukur dalam kondisi percobaan yang sama dan masih memenuhi kriteria cermat dan seksama (WHO, 1992).
Batas kuantitasi dapat dihitung dengan rumus sebagai berikut :
Batas Kuantitasi = Slope
SB 10
Keterangan : SB = simpangan baku 3.7 Analisa Data secara Statistik
Rumus yang digunakan untuk menentukan Standart Deviasi yaitu :
SD =
1 )
( 2
− −
∑
n X Xi
t hitung =
n SD
X Xi
/
−
Keterangan : Xi = kadar formalin dalam satu perlakuan X = kadar rata-rata formalin dalam sampel
n = jumlah perlakuan SD = standar deviasi α = tingkat kepercayaan
Untuk menghitung rentang kadar formalin secara statistik dalam sampel digunakan rumus:
Rentang Kadar Formalin (μ) = X ± (t α/2,dk xSD / n) Keterangan : SD = standar deviasi
X = kadar rata-rata formalin dalam sampel μ = rentang kadar formalin
BAB IV
HASIL DAN PEMBAHASAN
4.1Penentuan Kadar Formalin secara Titrasi Asam-Basa
Larutan formalin yang digunakan sebagai baku pembanding pada penelitian ini diperoleh dari distributor dengan kadar 37%. Maka sebelum digunakan sebagai baku pembanding, terlebih dahulu ditentukan kadarnya secara titrasi asam basa.
Berdasarkan hasil penetapan kadar secara titrasi asam basa, diperoleh kadar baku pembanding formalin 35,25%. Penurunan kadar ini dikarenakan formalin mengalami perubahan kadar selama penyimpanan, akibat dari sifat fisika-kimia formalin yang mudah menguap (Ditjen POM, 1979).
Data hasil penetapan kadar dapat dilihat pada Lampiran 3. 4.2Pemeriksaan Kualitatif Formalin pada Sampel
Sampel terlebih dahulu dibuang isi perutnya dan dibersihkan sebelum dilakukan analisa kualitatif dan kuantitatif. Hal ini disesuaikan dengan perlakuan dalam rumah tangga.
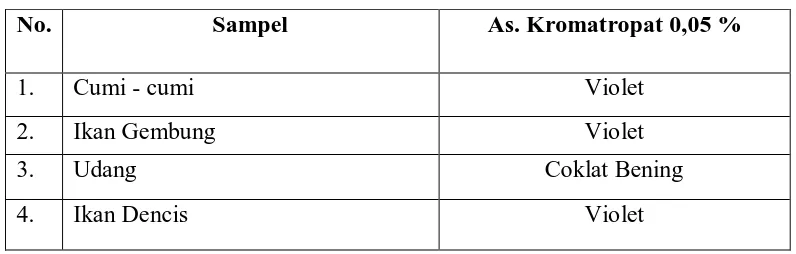
Tabel 1. Hasil Pemeriksaan Kualitatif Formalin pada Sampel Makanan Laut dengan Perendaman Menggunakan Larutan Cuka 5% dan Air Panas
Dari tabel diatas, dapat dilihat bahwa terdapat 3 sampel yang memberikan hasil positif terhadap pereaksi asam kromatropat yaitu cumi – cumi, ikan gembung dan ikan dencis. Dan 1 sampel tidak memberikan hasil yang positif terhadap pereaksi asam kromatropat yaitu udang. Oleh karena itu, penetuan kadar hanya dilakukan terhadap sampel cumi – cumi, ikan gembung dan ikan dencis Foto hasil uji kualitatif sampel dapat dilihat pada Lampiran 38.
4.3 Penetapan Kadar
4.3.1 Penentuan Panjang Gelombang Maksimum Larutan Formalin
Hasil penentuan panjang gelombang maksimum larutan formalin dengan konsentrasi 2 ppm, diperoleh panjang gelombang maksimum pada 412 nm.
Kurva serapan larutan formalin dapat dilihat pada Gambar 1.
Panjang gelombang maksimum yang diperoleh ini berbeda dengan yang terdapat dalam literatur yaitu 415 nm (Herlich, 1990). Perbedaan panjang gelombang 3 nm ini masih dalam batas toleransi yang diperkenankan menurut Farmakope Indonesia Edisi IV yaitu lebih kurang 3 nm. Hal ini berarti bahwa panjang gelombang maksimum ini dapat digunakan untuk analisis formalin pada sampel.
No. Sampel As. Kromatropat 0,05 %
1. Cumi - cumi Violet
2. Ikan Gembung Violet
3. Udang Coklat Bening
Gambar 1. Kurva serapan Maksimum Larutan Formalin dengan Konsentrasi 2 ppm secara spektrofotometri sinar tampak
[image:39.595.161.460.427.629.2]4.3.2 Penentuan Kurva Waktu Kerja Larutan Formalin
Penentuan waktu kerja (kestabilan warna) dilakukan terhadap larutan formalin baku dengan pereaksi Nash secara spektrofotometri sinar tampak, pengukuran dilakukan setelah 1 menit larutan formalin diangkat dari penangas air.
Dari data yang diperoleh tidak didapatkan serapan yang mempunyai kesamaan angka 4 desimal. Hal ini kemungkinan disebabkan kondisi alat dan arus listrik yang tidak stabil. Maka untuk itu diambil ketentuan yang memberikan kesamaan angka 2 desimal.
Dari data serapan yang diperoleh, waktu pengukuran yang stabil dimulai dari menit ke-7 sampai menit ke-16. (Data Pengamatan pada Lampiran 5)
4.3.3 Penentuan Linearitas Kurva Kalibrasi Larutan Formalin
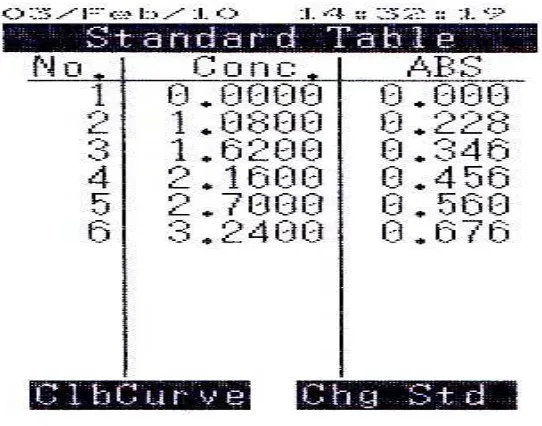
Pembuatan kurva kalibrasi larutan formalin dilakukan dengan membuat berbagai konsentrasi pengukuran yaitu 1,08; 1,62; 2,16; 2,7; dan 3,24 ppm, kemudian diukur serapannya pada panjang gelombang 412 nm. Gambar Linearitas kurva kalibrasi larutan formalin dapat dilihat pada Lampiran 6.
Hasil perhitungan persamaan regresi dari kurva kalibrasi diperoleh persamaan garis Y = 0,2255X + 0,0024 dengan koefisien korelasi (r) sebesar 0,9999. Menurut Badan POM, koefisien korelasi dari hasil pengukuran tidak boleh kurang dari 0,995. Sehingga hasil koefisien korelasi yang diperoleh dapat dikatakan mempunyai korelasi yang positif antara kadar dengan serapan.
4.3.4 Kadar Formalin pada Sampel
trioksimetilen (1,3,5-trioxan) yang larut dalam air (Schunack, 1990). Hal ini tidak dapat dilakukan karena fasilitas alat yang tidak memadai. Gambar alat destilasi yang seharusnya digunakan dapat dilihat pada Lampiran 37.
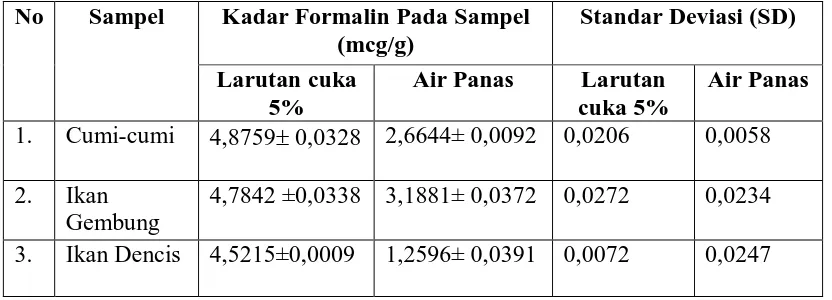
[image:41.595.106.522.305.455.2]Hasil penetapan kadar formalin pada air rendaman sampel dalam waktu 5 menit, 10 menit, 15 menit dan 20 menit dapat dilihat pada Tabel 2, Tabel 3, Tabel 4 dan Tabel 5. (Hasil perhitungan kadar, analisa statistik dan analisa kadar formalin dalam sampel dapat dilihat pada Lampiran 9-33).
Tabel 2. Kadar Formalin pada Sampel Dengan Perendaman selama 5 menit No Sampel Kadar Formalin Pada Sampel
(mcg/g)
Standar Deviasi (SD) Larutan cuka
5%
Air Panas Larutan cuka 5%
Air Panas 1. Cumi-cumi 4,8759± 0,0328 2,6644± 0,0092 0,0206 0,0058 2. Ikan
Gembung
4,7842 ±0,0338 3,1881± 0,0372 0,0272 0,0234 3. Ikan Dencis 4,5215±0,0009 1,2596± 0,0391 0,0072 0,0247 Keterangan : Untuk setiap sampel dilakukan 6 kali perulangan
Tabel 3. Kadar Formalin pada Sampel Dengan Perendaman selama 10 menit No Sampel Kadar Formalin Pada Sampel
(mcg/g)
Standar Deviasi (SD) Larutan cuka
5%
Air Panas Larutan cuka 5%
Air Panas 1. Cumi-cumi 5,8977±0,0296 3,0133± ,0280 0,0187 0,0176 2. Ikan
Gembung
Tabel 4. Kadar Formalin pada Sampel Dengan Perendaman selama 15 menit No Sampel Kadar Formalin Pada Sampel
(mcg/g)
Standar Deviasi (SD) Larutan cuka
5%
Air Panas Larutan cuka 5%
Air Panas 1. Cumi-cumi 9,5639±0,0156 3,5747±0,0191 0,0099 0,0120 2. Ikan
Gembung
9,8636±0,0471 4,8052±0,0248 0,0297 0,0156 3. Ikan Dencis 6,7779±0,0012 2,5195±0,0274 0,0074 0,0173 Keterangan : Untuk setiap sampel dilakukan 6 kali perulangan
Tabel 5. Kadar Formalin pada Sampel Dengan Perendaman selama 20 menit No Sampel Kadar Formalin Pada Sampel
(mcg/g)
Standar Deviasi (SD) Larutan cuka
5%
Air Panas Larutan cuka 5%
Air Panas 1. Cumi-cumi 10,0423±0,0955 3,8254±0,0249 0,0060 0,0101 2. Ikan
Gembung
10,2453±0,0450 4,9671±0,0153 0,0284 0,0096 3. Ikan Dencis 6,9382±0,0075 2,8257±0,0299 0,0048 0,0189 Keterangan : Untuk setiap sampel dilakukan 6 kali perulangan
[image:42.595.109.520.113.268.2]Perendaman dengan air panas menunjukkan kadar formalin tertinggi terdapat pada sampel ikan gembung, kemudian cumi – cumi, dan ikan dencis untuk semua variasi waktu. Ikatan antara protein yang terdapat pada ikan dengan formalin, lebih mudah terputus dengan perendaman menggunakan larutan cuka 5%, sehingga kadar formalin yang terlarut dalam rendaman larutan cuka 5% lebih tinggi dibandingkan dalam air panas. Pelepasan formalin pada larutan cuka 5% lebih tinggi dari pada dalam air panas (Sukesi, 2007).
Proses perendaman dengan larutan cuka 5% dan air panas selama 20 menit merupakan waktu yang maksimum untuk pelepasan kadar formalin pada semua sampel, karena pada orientasi dengan perendaman selama 25 menit dan 30 menit menunjukkan hasil yang sama dengan perendaman selama 20 menit.
Dari data-data yang ditunjukkan pada tabel-tabel diatas, dapat dilihat peningkatan kadar sampel seperti ditunjukkan dengan kurva dibawah ini :
Kurva Kadar Formalin Vs Waktu
0 2 4 6 8 10 12
0 5 10 15 20 25
sampel cumi dengan perendaman larutan cuka 5%
Sampel cumi dengan perendaman air panas
Sampel ikan gembung dengan perendaman larutan cuka 5%
Sampel ikan gembung dengan perendaman air panas
Sampel ikan dencis dengan perendaman larutan cuka 5%
Dari kurva diatas, dapat dilihat bahwa kadar sampel pada perendaman dengan larutan cuka 5% dan air panas menunjukkan peningkatan kadar sampel berbanding lurus dengan peningkatan waktu. Semakin lama waktu perendaman, maka kadar sampel semakin meningkat. Kadar sampel maksimum ditunjukkan pada perendaman selama 20 menit.
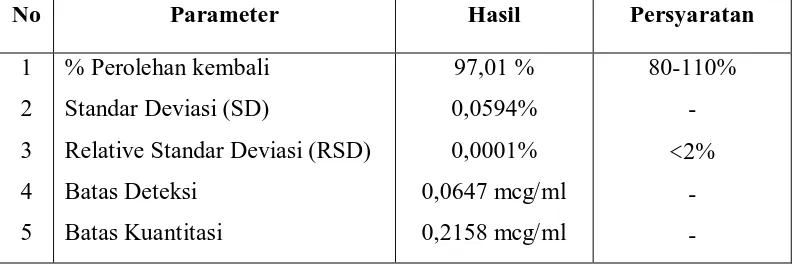
4.4 Uji Validasi Metode Analisis
Pada penelitian ini dilakukan juga validasi metode analisis dengan cara penambahan baku (standard addition method) dengan maksud untuk melihat sejauh mana kebenaran metode yang digunakan. Adapun uji validasi yang digunakan yaitu uji akurasi dengan parameter % perolehan kembali dan uji presisi dengan parameter SD (Standar Deviasi) dan RSD (Relative Standar Deviasi), batas deteksi dan batas kuantitasi.
Uji perolehan kembali dilakukan terhadap sampel ikan dencis pada perendaman menggunakan larutan cuka 5% selama 5 menit dengan penambahan baku formalin 1 ppm. Dari hasil percobaan didapatkan nilai uji perolehan kembali rata sebesar 86,45% (Hasil perhitungan pada Lampiran 34). Rentang rata-rata hasil uji perolehan kembali yang diizinkan untuk 1 ppm ialah 80-110% (WHO, 1992). Dari hasil yang diperoleh menunjukkan bahwa persen perolehan kembali memenuhi persyaratan uji validasi dan dapat disimpulkan bahwa metode yang dilakukan memiliki kecermatan yang baik.
diperoleh dari penelitian ini ialah berturut-turut 0,0003 mcg/ml dan 0,0011 mcg/ml ( Hasil perhitungan pada Lampiran 35).
Tabel 6. Hasil Pengujian Parameter Uji Validasi pada Ikan Dencis yang direndam dengan larutan cuka 5% selama 5 menit
No Parameter Hasil Persyaratan
1 2 3 4 5
% Perolehan kembali Standar Deviasi (SD)
Relative Standar Deviasi (RSD) Batas Deteksi
Batas Kuantitasi
97,01 % 0,0594% 0,0001% 0,0647 mcg/ml 0,2158 mcg/ml
80-110% -
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
- Hasil identifikasi formalin memberikan hasil positif terhadap 3 sampel yaitu cumi – cumi, ikan gembung dan ikan dencis. Sedangkan 1 sampel memberikan hasil yang negatif, yaitu sampel udang.
- Kadar formalin yang terlarut dalam air rendaman larutan cuka 5% lebih tinggi dibandingkan dengan air panas.
- Waktu perendaman mempengaruhi pelepasan kadar formalin, semakin lama waktu perendaman maka kadar formalin yang terlarut akan semakin meningkat.
5.2. Saran
- Disarankan kepada masyarakat untuk melakukan perendaman dengan larutan cuka 5% selama 20 menit terhadap cumi – cumi dan ikan segar sebelum pengolahan lebih lanjut
DAFTAR PUSTAKA
Afrianto, E dan Evi, L. (1989). Pengawetan Dan Pengolahan Ikan. Yogyakarta. Penerbit Kanius. Halaman 11-16, 24-25.
Anonima. (2009). Klasifikasi. Tanggal akses 02 Februari 2010.
Anonimb. (2008). Ikan Dan Fungsinya Dalam Tubuh. Tanggal akses 02 Februari 2010.
Anonimc. (2009). Keunggulan Nutrisi Ikan dan Fungsinya bagi Kesehatan. http:// aagos.ristek.go.id
Tanggal akses 04 Januari 2010.
Anonimd. (2007). Khasiat Cumi-cumi. Tanggal akses 27 Desember 2009.
Anonime. (2010). Udang Kaya Protein. Tanggal akses 01 Februari 2010.
Anonimf. (2009). Asam Asetat. Tanggal akses 01 Februari 2010.
Day, R. A. and A. L. Underwood. (2002). Analisis Kimia Kuantitatif. Edisi Keenam. Jakarta: Penerbit Erlangga. Hal 394, 396-404
Ditjen POM. (1979). Farmakope Indonesia. Edisi Ketiga. Jakarta. Departemen Kesehatan RI. Hal 58, 648, 650, 653, 675, 743-744, 748.
Dreisbach, R.H., and Robertson, W.O.. (1982). Handbook of Poisoning : Prevention, Diagnosis & Treatment. Twelfth Edition. California.
Appleton & Lange. Pages 181-182.
Gibson, G.G., dan Skett, P.. (1991). Pengantar Metabolisme Obat. Penerjemah : Iis Aisyah. Jakarta. Penerbit Universitas Indonesia. Hal 275.
Herlich, K. (1990). Official Methods Of Analysis. 15th edition. Virginia. AOAC Inc. Page 934.
Kirk – Othmer. (1981). Encyclopedia of Chemical Technology. Volume 11 : Fluorine Compound, Organics to Gold and Gold Compound, 3rd ed.. John Wiley and Sons. Inc. NewYork. Page 76.
Moffat, A.C.. (1986). Clarke’s Isolation and Identification of Drugs. Second Edition. London. The Pharmaceutical Press. Page 633.
Rohman, A. (2007). Kimia Farmasi Analisis. Cetakan I.Yogyakarta.Penerbit PustakaPelajar. Hal 255.
Roth, J.H., et al. (1991). Pharmaceutical Chemistry. First Edition. Singapore. Ellis Horwood. Page 119-12.
Schunack, W., Mayer, K., dan Haake, M.. (1990). Senyawa Obat. Edisi kedua. Penerjemah: Joke Wattimena dan Sriewoelan Soebito. Yogyakarta. Penerbit Universitas Gadjah Mada. Hal 768.
Sudjana . (2002). Metode Statistika. Edisi Statistika. Edisi Keenam. Bandung. Penerbit Tarsito. Hal 168, 371.
Vogel, A.I.. (1994). Kimia Analisis Kuantitatif Anorganik. Cetakan Pertama. Jakarta. Penerbit EGC. Hal 809-810.
Voncina, B.. (2005). Determination of Free Formaldehyde on Textile Substrate by HPLC. Slovenia. ITSAPT Seminar.
WHO. (1992). Validation of Analytical Procedures Used in the Examination of Pharmaceutical Materials. WHO Technical Report Series. No. 823. Page
117.
Widyaningsih, T.D., dan Erni Sofia M.. (2006). Alternatif Pengganti Formalin Pada Produk Pangan. Surabaya. Penerbit Trubus Agrisarana.
Hal 45-46.
Widyastuti, A.. (2006). Pengaruh Pencucian dan Pemanasan Terhadap Penurunan Kadar Formalin pada Ikan yang Diawetkan Secara
Spektrofotometri Sinar Tampak. Skripsi Jurusan Farmasi FMIPA USU.
Lampiran 1. Perhitungan Pembakuan Natrium Hidroksida 1 N
No. Berat K-Bifthalat (mg) Volume NaOH (ml)
1. 309 1,55
2. 310 1,65
3. 314 1,68
Normalitas NaOH =
bifthalat xBEk ml NaOH Vol mg Bifthalat BeratK − − ) ( . ) (
BE K-Bifthalat = 204,2 N1 = 0,9763 N
N2 = 0,9201 N N3 = 0,9153 N
Normalitas rata-rata (Nr) dan persen deviasi (% d)
Nr = 0,9482
2 9201 , 0 9763 , 0 2 2
1+N = + =
N
N
% d1 = 100% 2,96%
9482 , 0 9482 , 0 9201 , 0 % 100 ( 1 ) 1 2 = − = − x x Nr Nr N
Nr2 = 0,9458
2 9153 , 0 9763 , 0 2 3
1+N = + =
N
N
% d2= 100% 3,22%
9458 , 0 9458 , 0 9153 , 0 % 100 ) ( 2 2
3− x = − x =
Nr Nr N
Nr3 = 0,9177
2 9153 , 0 9201 , 0 2 3
2 +N = + =
N
N
% d3 = 100% 0,26%
9177 , 0 9177 , 0 9201 , 0 % 100 ( 3 ) 3 2 = − = − x x Nr Nr N
Lampiran 2. Perhitungan Pembakuan Asam Klorida 1 N
No. Berat Na2CO3 anhidrat (mg) Volume HCl (ml)
1. 152 2,75
2. 154 2,94
3. 158 2,95
Normalitas HCl =
anhidrat CO xBENa ml Hcl Vol mg anhidrat CO BeratNa 3 2 3 2 ) ( . ) (
BE Na2CO3 anhidrat = 52, 99 N1 = 1,0431 N
N2 = 0,9885 N N3 = 1,0107 N
Normalitas rata-rata (Nr) dan persen deviasi (% d)
Nr1= 1,0158
2 9885 , 0 0431 , 1 2 2
1+N = + =
N
N
% d1= 100% 2,68%
0158 , 1 0158 , 1 9885 , 0 % 100 ) ( 1 1
2 − x = − x =
Nr Nr N
Nr2= 1,0269
2 0107 , 1 0431 , 1 2 3
1 +N = + =
N
N
% d2= 100% 1,57%
0269 , 1 0269 , 1 0107 , 1 % 100 2 2
3 − = − =
x x
Nr Nr N
Nr3= 0,9996
2 0107 , 1 9885 , 0 2 3
2 +N = + =
N
N
% d3= 100% 1,11%
9996 , 0 9996 , 0 9885 , 0 % 100 3 3
2 − = − =
x x
Nr Nr N
Lampiran 3. Perhitungan Penetapan Kadar Larutan Formalin secara Titrasi Asam- Basa
Kadar = 100%
) ( . _ _ x mg formalin lar Berat formalin sHClxBE xNormalita Vb Vt−
Keterangan : Vt = Volume HCl (ml)
Vb = Volume blanko = 21,6 ml Normalitas HCl = 1,2211 N BE Formalin = 30,03 Kadar rata-rata (Kr) dan persen deviasi (% d)
Kr1= 35,0437%
2 % 3444 , 35 % 7430 , 34 2 2
1+K = + =
K
% d1= 100% 0,8581%
% 0437 , 35 % 0437 , 35 % 7430 , 34 % 100 1 1 1 = − = − x x Kr Kr K
Kr2= 34,9541%
2 % 1651 , 35 % 7430 , 34 2 3
1+K = + =
K
% d2= 100% 0,6039%
% 9541 , 34 % 9541 , 34 % 7430 , 34 % 100 2 2 1 = − = − x x Kr Kr K
Kr3= 35,2548%
2 % 1651 , 35 % 3444 , 35 2 3
2 +K = + =
K
% d3= 100% 0,2541%
% 2548 , 35 2548 , 35 3444 , 35 % 100 3 3 2 = − = − x x Kr Kr K
Kadar larutan formalin adalah kadar rata-rata dengan persen deviasi terkecil, yaitu % d3 = 0,2541% dengan Kadar 35,2548 %
No Berat Formalin (mg) Volume NaOH (ml) Volume HCl (ml) Kadar Formalin (%)
1. 1512 25 8,5 34,7430
2. 1516 25 8,15 35,3444
Lampiran 4. Perhitungan Pembuatan Larutan Induk Baku I (LIB I)
Kadar larutan Formalin yang diperoleh yaitu 35,2548% Berat Formalin yang di timbang = 3,0634 gr
Kadar Formalin dalam LIB I : x3,0634gr 1,0800gr/L 100
2548 , 35
=
Lampiran 5. Data Pengukuran Waktu Kerja Larutan Formalin
No. Menit ke- Serapan (A)
1. 1 0,4528
2. 2 0,4548
3. 3 0,4558
4. 4 0,4575
5. 5 0,4575
6. 6 0,4584
7. 7 0,4602
8. 8 0,4620
9. 9 0,4637
10. 10 0,4633
11. 11 0,4641
12. 12 0,4656
13. 13 0,4668
14. 14 0,4678
15. 15 0,4691
16. 16 0,4696
17. 17 0,4718
18. 18 0,4728
19. 19 0,4736
20. 20 0,4746
21. 21 0,4768
22. 22 0,4760
23. 23 0,4783
24. 24 0,4788
25. 25 0,4792
26. 26 0,4800
27. 27 0,4819
28. 28 0,4819
29. 29 0,4834
30. 30 0,4839
Keterangan :
Lampiran 6. Kurva Kalibrasi Larutan Formalin pada Panjang Gelombang 412 nm
Lampiran 7. Perhitungan Persamaan Regresi
No X Y XY X2 Y2
1 0,0000 0,0000 0,0000 0,0000 0,0000
2 1,0800 0,2280 0,2462 1,1664 0,0520
3 1,6200 0,3460 0,5605 2,6244 0,1197
4 2,1600 0,4560 0,9850 4,6656 0,2079
5 2,7000 0,5600 1,5120 7,2900 0,3136
6 3,2400 0,6760 2,1902 10,4976 0,4570
n= 6 ΣX= 10,8000 X = 1,8000
Σ Y = 2,2660 Y = 0,3777
ΣXY= 5,4940 ΣX2 = 26,2440 ΣY2 = 1,1502
a =
∑
∑
∑
∑ ∑
− − n X X n Y X XY / ) ( ) ( / ) )( ( ) ( 2 2 a = 6 / ) 8 , 10 ( 244 , 26 6 / ) 266 , 2 )( 8 , 10 ( 5,4940 2 − −a = 0,2079
b = Y- aX
b = 0,3777 – (0,2079)( 1,8) b = 0,0035
Maka, persamaan regresinya adalah : y = 0,2079x + 0,0035
r =
[
∑
−∑
∑
∑ ∑
][
∑
−∑
]
− n y y n x x n y x xy / ) ( ) ( . / ) ( ) ( / ) )( ( 2 2 2 2 r =[
(26,244) (10,8) /6][
.(1,1502) (2,266) /6]
6 / ) 266 , 2 )( 8 , 10 ( 4940 , 5 2 2 − − −
Lampiran 8. Contoh Perhitungan Kadar Formalin dalam Sampel Berat sampel yang ditimbang = 100,536 gram
Serapan (y) = 0,3066
Persamaan regresi : y = 0,2079 x + 0,0035
Konsentrasi formalin(x) 0,3066 = 0,2079 x + 0,0035
x =
2079 , 0
0035 , 0 3066 ,
0 −
x = 1,4579 mcg/ml
Rumus Perhitungan Kadar Formalin : K = BS
Fp V x× ×
Dimana K = kadar total formalin dalam sampel (mcg/g) x = kadar formalin sesudah pengenceran V = volume sampel (ml)
Fp = faktor pengenceran BS = Berat sampel
Kadar total formalin =
g ml ml
mcg
536 , 100
30 / 50 200
/ 4579 ,
1 × ×
= 4,834 mcg/g
Lampiran 9. Analisa Data Statistik untuk Menghitung Kadar Formalin Dalam Air Rendaman Cumi – cumi dengan Larutan Cuka 5% Selama 5 menit
No Xi Xi-X (Xi-X )
2
1 4,8338 -0,0402 0,00161604
2 4,8516 -0,0224 0,00050176
3 4,8684 -0,0056 0,00003136
4 4,8837 0,0097 0,00009409
5 4,8998 0,0258 0,00066564
6 4,9068 0,0328 0,00107584
n = 6 X = 4,8740 Σ (Xi-X)2
=
0,00398473
SD =
1 )
( 2
− −
∑
n X Xi
=
5 00398473 ,
0
= 0,0282
Pada interval kepercayaan 95% dengan nilai α = 0,05, dk = 5 diperoleh nilai t tabel = 2,57 Data diterima jika t hitung‹ t tabel.
t hitung =
n SD
X Xi
/
−
t hitung data 1 = 3,4956 ( data ditolak) t hitung data 2 = 1,9478
t hitung data 3 = 0,4869 t hitung data 4 = 0,8435 t hitung data 5 = 2,2435
t hitung data 6 = 2,8522 (data ditolak)
No Xi Xi-X (Xi-X) 2
2 4,8516 -0,0243 0,00059049
3 4,8684 -0,0075 0,00005625
4 4,8837 0,0078 0,00006084
5 4,8998 0,0239 0,00057121
N=4 X = 4,8759 Σ (Xi-X )2
= 0,00127879
SD =
1 )
( 2
− −
∑
n X Xi
=
3 00127879 ,
0
= 0,0206
Pada interval kepercayaan 95% dengan nilai α = 0,05, dk = 3 diperoleh nilai t tabel = 3,1824 Data diterima jika t hitung ‹ t tabel.
t hitung =
n SD
X Xi
/
−
t hitung data 2 = 2,3592 t hitung data 3 = 0,7281 t hitung data 4 = 0,7573 t hitung data 5 = 2,3204
(Semua data diterima) Kadar Formalin (μ) = X ± (t α/2,dk xSD / n) = 4,8759± (3,1824 x 0,0103)
Lampiran 10.Analisa Data Statistik untuk Menghitung Kadar Formalin Dalam Air Rendaman Cumi – cumi dengan Larutan Cuka 5% Selama 10 Menit
No Xi Xi-X (Xi-X )
2
1 6,3291 -0,0449 0,00201601
2 6,3530 -0,0210 0,00044100
3 6,3651 -0,0089 0,00007921
4 6,3733 -0,0007 0,00000049
5 6,3973 0,0239 0,00057121
6 6,4263 0,0523 0,00273529
n = 6 X = 6,3740 Σ (Xi-X )2
=
0,00584321
SD =
1 )
( 2
− −
∑
n X Xi
=
5 00584321 ,
0
= 0,0342
Pada interval kepercayaan 95% dengan nilai α = 0,05, dk = 5 diperoleh nilai t tabel = 2,57 Data diterima jika t hitung‹ t tabel.
t hitung =
n SD
X Xi
/
−
t hitung data 1 = 3,2302 ( data ditolak) t hitung data 2 = 1,5108
t hitung data 3 = 0,6403 t hitung data 4 = 0,0504 t hitung data 5 = 1,7194
t hitung data 6 = 3,7626 (data ditolak)
No Xi Xi-X (Xi-X) 2
2 6,3530 -0,0192 0,00036864
3 6,3651 -0,0071 0,00005041
4 6,3733 0,0011 0,00000121
5 6,3973 0,0251 0,00063001
N=4 X = 6,3722 Σ (Xi-X )2
= 0,00105027
SD =
1 )
( 2
− −
∑
n X Xi
=
3 00105027 ,
0
= 0,0187
Pada interval kepercayaan 95% dengan nilai α = 0,05, dk = 3 diperoleh nilai t tabel = 3,1824 Data diterima jika t hitung ‹ t tabel.
t hitung =
n SD
X Xi
/
−
t hitung data 2 = 2,0645 t hitung data 3 = 0,7634 t hitung data 4 = 0,1183 t hitung data 5 = 2,6989
(Semua data diterima) Kadar Formalin (μ) = X ± (t α/2,dk xSD / n) = 6,3722± (3,1824 x 0,0093)
Lampiran 11.Analisa Data Statistik untuk Menghitung Kadar Formalin Dalam Air Rendaman Cumi – cumi dengan Larutan Cuka 5% Selama 15 Menit
No Xi Xi-X (Xi-X )
2
1 9,5551 -0,0207 0,00042849
2 9,5583 -0,0169 0,00028561
3 9,5647 -0,0111 0,00012321
4 9,5774 0,0016 0,00000256
5 9,5896 0,0138 0,00019044
6 9,6095 0,0337 0,00113569
n = 6 X = 9,5758 Σ (Xi-X)2
=
0,002166
SD =
1 )
( 2
− −
∑
n X Xi
=
5 002166 ,
0
= 0,0208
Pada interval kepercayaan 95% dengan nilai α = 0,05, dk = 5 diperoleh nilai t tabel = 2,57 Data diterima jika t hitung‹ t tabel.
t hitung =
n SD
X Xi
/
−
t hitung data 1 = 2,4353 t hitung data 2 = 1,9882 t hitung data 3 = 1,3059 t hitung data 4 = 0,1882 t hitung data 5 = 1,6235
t hitung data 6 = 3,9647 (data ditolak)
No Xi Xi-X (Xi-X) 2
1 9,5551 -0,0139 0,00019321
2 9,5583 -0,0107 0,00011449
3 9,5647 -0,0043 0,00001849
4 9,5774 0,0084 0,00007056
5 9,5896 0,0206 0,00042436
n = 5 X = 9,5690 Σ (Xi-X )2
= 0,00082111
SD =
1 )
( 2
− −
∑
n X Xi
=
4 00082111 ,
0
= 0,0143
Pada interval kepercayaan 95% dengan nilai α = 0,05, dk = 4 diperoleh nilai t tabel = 2,7706 Data diterima jika t hitung ‹ t tabel.
t hitung =
n SD
X Xi
/
−
t hitung data 1 = 2,1719 t hitung data 2 = 1,6719 t hitung data 3 = 0,6719 t hitung data 4 = 1,3125
t hitung data 5 = 3,2187 (data ditolak)
No Xi Xi-X (Xi-X) 2
1 9,5551 -0,0088 0,00007744
2 9,5583 -0,0056 0,00003136
3 9,5647 0,0008 0,00000064
4 9,5774 0,0135 0,00018225
n = 5 X = 9,5639 Σ (Xi-X )2
= 0,00029169
SD =
1 )
( 2
− −
∑
n X Xi
=
3 00025633 ,
0
= 0,0099
Pada interval kepercayaan 95% dengan nilai α = 0,05, dk = 3 diperoleh nilai t tabel = 3,1824 Data diterima jika t hitung‹ t tabel.
t hitung =
n SD
X Xi
/
−
t hitung data 1 = 1,7959 t hitung data 2 = 1,1429 t hitung data 3 = 0,1633 t hitung data 4 = 2,7551
(Semua data diterima) Kadar Formalin (μ) = X ± (t α/2,dk xSD / n) = 9,5639± (3,1824 x 0,0049)
Lampiran 12.Analisa Data Statistik untuk Menghitung Kadar Formalin Dalam Air Rendaman Cumi – cumi dengan Larutan Cuka 5% Selama 20 Menit
No Xi Xi-X (Xi-X )
2
1 10,0346 -0,0083 0,00006889
2 10,0325 -0,0104 0,00010816
3 10,0409 -0,0020 0,00000400
4 10,0455 0,0026 0,00000676
5 10,0484 0,0055 0,00003025
6 10,0560 0,0131 0,00017161
n = 6 X = 10,0429 Σ (Xi-X )2
=
0,00038967
SD =
1 )
( 2
− −
∑
n X Xi
=
5 00038967 ,
0
= 0,0088
Pada interval kepercayaan 95% dengan nilai α = 0,05, dk = 5 diperoleh nilai t tabel = 2,57 Data diterima jika t hitung‹ t tabel.
t hitung =
n SD
X Xi
/
−
t hitung data 1 = 2,3056
t hitung data 2 = 2,8889 ( data ditolak) t hitung data 3 = 0,5555
t hitung data 4 = 0,7222 t hitung data