ABSTRAK
PENENTUAN KADAR GLUKOSAMIN DARI FERMENTASI KULIT UDANG OLEHMucor mieheiDENGAN METODE UJI NINHIDRIN DAN
SPEKTROFOTOMETRI UV-VIS
Oleh
Maria Ulfa
Pada penelitian ini dilakukan pembuatan glukosamin dengan fermentasi kulit udang dengan bantuan Mucor miehei. Mucor mieheimemproduksi kitinase untuk mendegradasi kitin yang terkandung pada kulit udang menjadi glukosamin. Penelitian ini bertujuan untuk mengetahui jumlah glukosamin maksimum yang dihasilkanMucor miehei dalam mendegradasi kulit udang setiap hari selama lima hari waktu fermentasi. Kadar glukosamin ditentukan dengan analisis spektrofotometri UV-Vis dan uji kualitatif dengan reagen ninhidrin. Hasil uji menunjukkan filtrat hasil fermentasi memberikan hasil positif warna ungu terhadap reagen ninhidri. Larutan ini lalu di analisis menggunakan spektrofotometer UV-Vis pada panjang gelombang (λ) 570 nm. Waktu optimum Mucor miehei untuk mendegradasi kulit udang adalah pada hari keempat dengan kadar kemurnian sebesar 4,14 % dari 1 gram kulit udang yang digunakan.
ABSTRACT
DETERMINATION OF GLUCOSAMINE CONTENT FROM FERMENTATION OF THE SHRIMP SHELLS BYMucor mieheiUSING NINHYDRIN TEST AND UV-VIS SPECTROPHOTOMETRY METHOD
By Maria Ulfa
This research was conducted to make glucosamine from fermentation of shirmp shells by usingMucor miehei.Mucor mieheiproduces chitinase to degrade chitin that contained in shrimp shells to glucosamine. This research aims to determine the maximum amount of glucosamine produced byMucor mieheito degrade shrimp shells every day for five days fermentation process. Glucosamine level was determined using UV-Vis spectrophotometer and ninhydrin reagent. The results showed the filtrate from fermentation gave a positive result in purple to ninhydrin reagent. This solution was analyzed using UV-Vis spectrophotometer at wavelenght (λ) 570 nm. Optimum time ofMucor miehei to degrade the shrimp shells is on the fourth day with purity level 4.14 % of 1 gram of shrimp shells were used.
PENENTUAN KADAR GLUKOSAMIN DARI FERMENTASI KULIT UDANG OLEHMucor mieheiDENGAN METODE UJI NINHIDRIN DAN
SPEKTROFOTOMETRI UV-VIS (Skripsi)
Oleh MARIA ULFA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS LAMPUNG
ABSTRAK
PENENTUAN KADAR GLUKOSAMIN DARI FERMENTASI KULIT UDANG OLEHMucor mieheiDENGAN METODE UJI NINHIDRIN DAN
SPEKTROFOTOMETRI UV-VIS
Oleh
Maria Ulfa
Pada penelitian ini dilakukan pembuatan glukosamin dengan fermentasi kulit udang dengan bantuan Mucor miehei. Mucor mieheimemproduksi kitinase untuk mendegradasi kitin yang terkandung pada kulit udang menjadi glukosamin. Penelitian ini bertujuan untuk mengetahui jumlah glukosamin maksimum yang dihasilkanMucor miehei dalam mendegradasi kulit udang setiap hari selama lima hari waktu fermentasi. Kadar glukosamin ditentukan dengan analisis spektrofotometri UV-Vis dan uji kualitatif dengan reagen ninhidrin. Hasil uji menunjukkan filtrat hasil fermentasi memberikan hasil positif warna ungu terhadap reagen ninhidri. Larutan ini lalu di analisis menggunakan spektrofotometer UV-Vis pada panjang gelombang (λ) 570 nm. Waktu optimum Mucor miehei untuk mendegradasi kulit udang adalah pada hari keempat dengan kadar kemurnian sebesar 4,14 % dari 1 gram kulit udang yang digunakan.
ABSTRACT
DETERMINATION OF GLUCOSAMINE CONTENT FROM FERMENTATION OF THE SHRIMP SHELLS BYMucor mieheiUSING NINHYDRIN TEST AND UV-VIS SPECTROPHOTOMETRY METHOD
By Maria Ulfa
This research was conducted to make glucosamine from fermentation of shirmp shells by usingMucor miehei.Mucor mieheiproduces chitinase to degrade chitin that contained in shrimp shells to glucosamine. This research aims to determine the maximum amount of glucosamine produced byMucor mieheito degrade shrimp shells every day for five days fermentation process. Glucosamine level was determined using UV-Vis spectrophotometer and ninhydrin reagent. The results showed the filtrate from fermentation gave a positive result in purple to ninhydrin reagent. This solution was analyzed using UV-Vis spectrophotometer at wavelenght (λ) 570 nm. Optimum time ofMucor miehei to degrade the shrimp shells is on the fourth day with purity level 4.14 % of 1 gram of shrimp shells were used.
PENENTUAN KADAR GLUKOSAMIN DARI FERMENTASI KULIT UDANG OLEHMucor mieheiDENGAN METODE UJI NINHIDRIN DAN
SPEKTROFOTOMETRI UV-VIS
Oleh MARIA ULFA
Skripsi
Sebagai Salah Satu Syarat Untuk Mencapai Gelar SARJANA SAINS
Pada
Jurusan Kimia
Fakultas Matematika dan Ilmu Pengetahuan Alam
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS LAMPUNG
RIWAYAT HIDUP
Penulis dilahirkan di Indramayu, provinsi Jawa Barat pada
tanggal 1 Juni 1994, yang merupakan anak kedua dari empat
bersaudara dari pasangan Bapak Rema dan Ibu Khasanah.
Penulis menyelesaikan pendidikan di TK Melati Puspa pada
tahun 2000, Sekolah Dasar di SDN 3 Perumnas Way Kandis
pada tahun 2006, Sekolah Menengah Pertama di SMP Negeri 19 Bandar Lampung
pada tahun 2009, dan Sekolah Menengah Atas di SMA Negeri 9 Bandar Lampung
pada tahun 2012. Penulis terdaftar sebagai mahasiswa Jurusan Kimia Fakultas
Matematika dan Ilmu Pengetahuan Alam (FMIPA) Universitas Lampung pada
tahun 2012 melalui jalur Seleksi Nasional Masuk Perguruan Tinggi Negeri
(SNMPTN) Tertulis.
Selama menjadi mahasiswa pernah menjadi anggota Bidang Kaderisasi dan
Pengembangan Oranisasi (KPO) Himpunan Mahasiswa Kimia (HIMAKI) periode
2013-2014 dan anggota Biro Kesekretariatan Himaki tahun 2014-2015. Penulis
juga pernah menjadi asisten praktikum Sains Dasar, Kimia Dasar, dan Biokimia.
Pada tahun 2015 dan 2016 penulis melakukan Praktek Kerja Lapangan dan
Bismillahirrohmaanirrohiim
Dengan mengucap Alhamdulillahirobbil
’alamin kepada Allah SWT
Yang Maha Segalanya
Kupersembahkan karya kecil ini sebagai wujud tanda cinta, bakti dan
tanggung jawabku kepada:
AYAH DAN IBU TERSAYANG
Yang senantiasa memberikan kasih sayang, perhatian, dukungan,
kesabaran, dan motivasi
Serta selalu mendoakan keberhasilan
Pengorbanan dan kasih sayang yang tidak tergantikan
Seluruh keluarga besar yang selalu memberikan kebersamaan, doa dan
motivasi
Sahabat dan teman-temanku yang selalu ada disisiku, berbagi
kebahagiaan dan kebersamaan
Jurusan Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam
Happines can be found in even the darkest of times if
only one remembers to turn on the light.
(Prof. Albus Dumbledore)
Segala sesuatu yang hebat itu sederhana dan banyak
yang bisa diungkapkan dengan satu kata: kebebasan,
keadilan, kehormatan, kewajiban, rahmat, harapan
(Winston Churchill)
You cannot do something just for the money. You
have to do things you believe in and eventually you willl
make money
(Miuccia Prada)
...Niscaya Allah akan meninggikan orang-orang
yang beriman di antaramu dan orang-orang yang diberi
ilmu pengetahuan beberapa derajat. Dan Allah Maha
Mengetahui apa yang kamu kerjakan
ひとりでは生きていないこと 時にまた忘れがちだけど (hitori de wa ikiteinai koto toki ni mata wasuregachi dakedo)
You may forget sometimes that I’m not living alone
苦しい時もすぐそばで 誰かがそばで (kurushii toki mo sugu soba de dareka ga soba de)
but in hard times, someone near you 君に手を差し延べてる きっと (kimi ni te wo sashinobeteru kitto)
will surely reach out a hand
世界の涙 集めたら それぞれの道に撒こう (sekai no namida atsumetara sorezore no michi ni makou) Let’s collect the world’s tears and sprinkle them on the roads
誰かの足元にいつか 花となり咲くだろう (dare ka no ashimoto ni itsuka hana to nari saku darou)
Someday someone’s footsteps will bloom as flowers
綺麗な花を集めたら 幸せがあふれだして (kirei na hana wo atsumetara shiawase ga afuredashite)
If we could collect the beautiful flower, we would overflow with happiness 僕らはひとつになれるよ それをいま 信じよう
(bokura wa hitotsu ni nareru yo sore wo ima shinjiyou) and become one. Let’s believe in that now.
SANWACANA
Alhamduliillahirobbil’alamin, segala puji dan syukur bagi Allah SWT atas segala
nikmat dan karunia-Nya, sehingga penulis dapat menyelesaikan skripsi yang
berjudul“Penentuan Kadar Glukosamin Dari Fermentasi Kulit Udang Oleh Mucor MieheiDengan Metode Uji Ninhidrin dan Spektrofotometri UV-Vis”
sebagai syarat untuk mencapai gelas Sarjana Sains pada Jurusan Kimia, Fakultas
matematika dan Ilmu Pengetahuan Alam, Universitas Lampung.
Penulis menyadari bahwa penyelesaian skripsi ini tidak terlepas dari bimbingan,
arahan, serta bantuan dari berbagai pihak. Oleh karena itu, penulis mengucapkan
terimakasih kepada:
1. Kedua orang tuaku tercinta, Bapak Rema dan Ibu Khasanah, atas segala kasih
sayang, doa, waktu, kesabaran, dukungan, nasihat, keikhlasan, dan ketulusan
doa yang sangat berharga bagi penulis.
2. Ibu Dra. Aspita Laila, M.S., selaku pembimbing I atas segala bimbingan,
motivasi, kesabaran,perhatian, dan ilmunya sehingga penelitian dan skripsi
ini dapat terselesaikan dengan baik.
3. Bapak Prof. Dr. John Hendri, M.S., selaku pembimbing II yang telah
hingga penyusunan skripsi ini, sehingga penulis dapat menyelesaikannya
dengan baik.
4. Bapak Andi Setiawan, Ph. D., selaku pembahas yang telah memberikan
banyak ilmu pengetahuan, arahan, dan saran demi terselesainya skripsi ini.
5. Bapak Dr. Eng. Suripto Dwi Yuwono, M.T. selaku Ketua Jurusan Kimia
Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Lampung.
6. Bapak Mulyono, Ph. D., selaku pembimbing akademik dan Sekretaris Jurusan
Kimia FMIPA Unila atas bimbingan, nasehat, dan motivasi yang telah
diberikan kepada penulis.
7. Bapak Prof. Dr. Warsito, DEA., selaku Dekan Fakultas Matematika dan Ilmu
Pengetahuan Alam Universitas Lampung.
8. Bapak dan Ibu Dosen Jurusan Kimia FMIPA Universitas Lampung atas
seluruh ilmu yang telah diberikan kepada penulis selama mengikuti
perkuliahan dikampus, semoga ilmu yang diberikan dapat bermanfaat.
9. Keluargaku tercinta, Ang Ano, Mba Okta,Alia, Fi’i, Ang Mu danAng Tina,
atas kebersamaannya.
10. Sahabat-sahabat terbaikku, Feiga Maharani (Ndut) dan Nindya Indah Pertiwi
(Acil) atas persahatannya selama 10 tahun ini. Terima kasih sudah menjadi
sahabat yang selalu ada disaat susah maupun senang, yang selalu menjadi
tempat berbagi segala macam cerita dan selalu memberikan kepercayaan,
motivasi, dorongan, bantuan, keceriaan, kegilaan, serta kenangan yang sangat
berharga selama ini. Semoga Allah memberikan pertolongan dan membalas
11. Partner-ku, Erlita Aisyah dan Ruwaidah Muliana, atas kerja sama, kebersamaan, bantuan, dukungan, kegilaan dan motivasi yang sangat
berharga selama penelitian.
12. Teman-teman Laboraturium Biokimia: Mba Windi, Kak Jeje, Mba Putri, Mba
April, Mba Ana, Mba Uswatun, Kak Azis, Diani, Ayu Imani, Putri, Tira, Fifi,
Meta, dan Rizal, atas kebersamaan, bantuan, dan kerja samanya selama
penelitian.
13. Glucosamine’s group (Sofian, Edi, Arya, Dela, Kak Jeje, Mba Windi, Lita,
dan Ruwai) atas kerjasama, bantuan, dan motivasinya.
14. Sahabat-sahabat Kak Fiona, Dewi, model Dwi, Lita, Ruwai, Ulfatun, Fenty,
Ajeng, dan Intan atas kebersamaan, bantuan, dan motivasinya yang sangat
berharga selama ini.
15. Teman-teman se-angkatan 2012: Adi setiawan, Aditian Sulung, Agus
Ardiansyah, Ajeng Wulandari, Ana Maria Kristiani, Apri Welda, Arif
Nurhidayat, Arya Rifansyah, S.Si, Atma Istanami, Ayu Imani, Ayu
Setianingrum, Deborah Jovita, Derry Vardella, Dewi Aniatul Fatimah, Diani
Iska Miranti, Dwi Anggraini, Edi Suryadi, Eka Hurwaningsih, Elsa Zulha,
Erlita Aisyah, Febita Glysenda, Feby Rinaldo Pratama, Fenti Visiamah, S.Si,
Ferdinand Haryanto Simangunsong, Fifi Adriyanthi, Handri Sanjaya, Indah
Wahyu Purnama Sari, Indriyani Saney, Intan Mailani, Ismi Khomsiah, Jean
Pitaloka, Jenny Jessica, Khoirul Anwar, Meta Fosfi Berliana, Muhamad Rizal
Robani, Murni Fitria S.Si, Nila Amalin Nabila, Putri Ramadhona, Radius Uly
Artha, Riandra Pratama Usman, Rifki Husnul Khuluk, Rizal Rio Saputra,
Halimah, Sofian Sumilat Rizki, S.Si, Sukamto, S.Si., Susy Isnaini Hasanah,
Suwarda Dua Imatu Dela, S.Si, Syathira Assegaf, Tazkia Nurul, S.Si, Tiand
Reno, Tiara Dewi Astuti, Tiurma Debora Simatupang,S.Si, Tri Marital,
Ulfatun Nurun, Wiwin Esty Sarwita, Yepi Triapriani, Yunsi’u Nasyah,
Zubaidi.
16. Seluruh Staff dan Karyawan di Jurusan Kimia FMIPA, terima kasih atas
seluruh bantuan yang diberikan kepada penulis.
17. KKN Desa Mulya Jaya, Tulang Bawang Barat.
18. Seluruh keluarga besar Jurusan Kimia Angkatan 2011-2015.
19. Almamater tercinta, Universitas Lampung.
20. Semua pihak yang telah membantu penulis dalam menyelesaikan skripsi ini.
Bandar Lampung, September 2016
DAFTAR ISI
Halaman
DAFTAR TABEL ... iii
DAFTAR GAMBAR ... iv
I. PENDAHULUAN A. Latar Belakang ... 1
B. Tujuan Penelitian... 4
E. Enzim Kitin Deasetilase (CDA) ... 13
F. Glukosamin ... 15
G. JamurMucor miehei... 16
H. Fermentasi... 17
I. Fermentasi Fase Cair Sistem Tertutup (Batch) ... 19
J. Ninhidrin ... 23
K. Spektrofotometri UV-Vis ... 24
III. METODOLOGI PENELITIAN A.Waktu dan Tempat Penelitian ... 27
B. Alat dan Bahan ... 27
C. Prosedur Penelitian... 28
1. Persiapan Sampel ... 28
2. Pembuatan Media ... 28
2.1. Pembuatan Potato Extract ... 28
2.3. Media PDL (Potato Dextrose Liquid)dan pertumbuhanMucor
mieheipada Media PDL ... 29
3. Larutan Buffer Sitrat pH 4 ... 29
4. Pembuatan Media InokulumMucor miehei ... 30
5. Fermentasi Fase Cair Sistem Tertutup (Batch) denganMucor miehei ... 31
6. Analisis Glukosamin dengan Spektrofotometer UV-Vis ... 32
6.1 Pembuatan Standar Glukosamin ... 32
6.2. Pembuatan Sampel Glukosamin ... 32
6.3 Pemilihan Panjang Gelombang Maksimum ... 33
6.4 Kalibrasi Glukosamin Sampel... 33
IV. HASIL DAN PEMBAHASAN A. Peremajaan JamurMucor miehei... 34
B. Fermentasi Kulit Udang denganMucor miehei ... 36
C. Uji Kualitatif Glukosamin dengan Ninhidrin ... 38
D. Analisis Glukosamin dengan Spektrofototmeter UV-Vis ... 40
V. SIMPULAN DAN SARAN A. Simpulan ... 46
B. Saran ... 47
DAFTAR PUSTAKA ... 48
DAFTAR TABEL
Tabel Halaman
1. Absorbansi Larutan Glukosamin Standar ... 57
2. Absorbasni Larutan Glukosamin Hasil Fermentasi ... 57
3. Konsentrasi Terukur Glukosamin Hasil Fermentasi ... 58
4. Jumlah Bobot Glukosamin Hasil Fermentasi ... 59
DAFTAR GAMBAR
Gambar Halaman
1. Struktur Kitin ... 9
2. Reaksi pemutusan ikatan β-1,4 pada bagian internal mikrofibril kitin ... 11
3. Reaksi pembebasan unit-unit diasetilkitobiose oleh enzim eksokitinase ... 12
4. Reaksi pemutusan diasetilkitobiose, kitotriose dan kitotetraose dan menghasilkan monomer-monomer N-setilglukosmin ... 12
5. Struktur glukosamin ... 15
6. Reaksi antara ninhidrin dan asam amino ... 23
7. Skema kerja spektrofotometri UV-Vis ... 24
8. Hasil PeremajaanMucor miehei ... 35
9. Hasil uji FeSO2.7H2O dan pepton dalam buffer sitrat pH 4 ... 38
10. Mekanisme reaksi ninhidrin-glukosamin membentuk kompleks ungu ... 39
11. Hasil uji sampel dengan ninhidrin ... 40
12. Hasilscanningpanjang gelombang maksimum larutan glukosamin standar dan sampel ... 41
13. Kurva standar glukosamin ... 41
14. Struktur pepton ... 42
1
I. PENDAHULUAN
A. Latar Belakang
Udang adalah salah satu komoditas ekspor hasil perikanan terbesar di Indonesia.
Udang biasanya diekspor dalam bentuk beku tanpa kulit dan kepala. Kulit dan
kepala udang yang dibuang ini akan menumpuk dan menjadi sampah yang dapat
merugikan lingkungan dan kesehatan. Padahal di dalam kulit dan kepala terdapat
banyak kandungan-kandungan kimia yang dapat dimanfaatkan, seperti pembuatan
glukosamin. Glukosamin dapat dibuat dari pemprosesan awal limbah kulit udang
menjadi kitin.
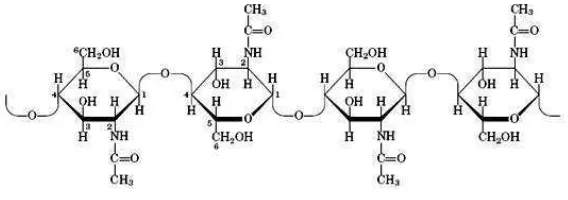
Kitin adalah homopolimer dari β-1,4 N-asetil-D-glukosamin (GlcNAc) dan
merupakan polimer yang terbanyak kedua di alam setelah selulosa. Senyawa ini
ditemukan pada cangkang udang, kepiting, molusca, serangga, annelida, dan
dinding sel alga dan jamur (Yurnaliza, 2002).
Monomer dari kitin adalah N-asetilglukosamin yang dihubungkan dengan ikatan
glikosida pada posisi β-(1,4). Kitin mempunyai stuktur molekul berupa rantai
2
larut dalam air, pelarut organik, alkali pekat, asam lemah dan larut dalam
asam-asam mineral pekat dan flouroalkohol.
Kitin dapat dihasilkan dari kulit udang melalui proses enzimatik, kimiawi, dan
gabungan dari keduanya. Proses kimiawi dilakukan dengan menghilangkan
mineralnya menggunakan asam dan penghilangkan protein menggunakan alkali
yang dipanaskan. Proses enzimatik dapat dilakukan dengan reaksi enzimatik yang
ramah lingkungan (Wibowo, 2006). Polisakarida ini dapat didegradasi secara
enzimatik menjadi glukosamin dengan menggunakan enzim kitinase.
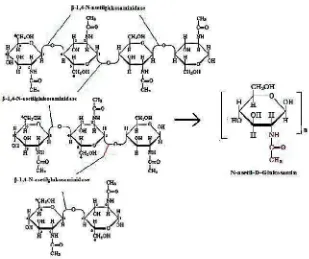
Kitinase disebut sebagai poli (1,4-β[2-asetamido-2-deoksi-glukosaminide] glikano
hidrolase, adalah enzim yang mendegradasi kitin menjadi monomernya
N-asetilglukosamin. Terdapat dua jalur degradasi kitin di alam oleh enzim kitinase.
Jalur degradasi kitin yang pertama dimulai dengan hidrolisis ikatan β-(1,4)
glikosida oleh enzim endokitinase sehingga terbentuk oligomer kitin. Oligomer
kitin lalu dipecah menjadi dimer N-asetilglukosamin oleh enzim kitobiosidase dan
menghasilkan monomer N-asetilglukosamin oleh enzim N-asetilglukosaminidase
(kitobiase). Monomen N-asetilglukosamin mengalami deasetilasi menjadi
glukosamin oleh enzim N-asetil-glukosamin-deasetilase. Jalur degradasi yang
kedua adalah deasetilasi kitin menjadi kitosan oleh enzim kitin-deasetilase.
Kitosan terdegradasi menjadi oligomer kitosan oleh enzim kitosanase. Setelah itu
oligomer kitosan akan terdegrasi oleh enzim glukosaminidase menghasilkan
3
Enzim kitinase dihasilkan oleh mikroorganisme kitinolitik. Menurut Schomburg
dkk (1991), mikroorganisme yang dapat menghasilkan enzim kitinolitik adalah
MucordanActinomycetes. Mucormerupakan fungsi tipikal saprotrop pada tanah dan serasah tumbuhan yang mampu menghasilkan enzim kitindeasetilase pada
substrat kitin atau kulitcrustaceadan media cair yang mengandung nutrient yang diperlukan (Ratledge, 1993). Sedangkan padaActinomycetes,enzim kitinolitik yang dikeluarkan berupa kitinase untuk mensintesis metabolit senyawa yang
memiliki aktivitas biologis dan spora dariActinomycetessangan esensial untuk biokonversi (Xu et al., 1996).
Menurut penelitian tentang uji efektivitas fermentasi kitin menggunakanMucor mieheiyang dilakukan oleh Siti Oktavia R (2012), menjelaskan bahwa untuk pembuatan glukosamin dilakukan fermentasi selama 5 hari menghasilkan
glukosamin sebesar 55 %. Penelitian yang dilakukan oleh Yahya Arianta (2014)
tentang pengaruh penambahan konsentrasi inokulum dan media terhadap
efektivitas fermentasi kitin denganMucor mieheiuntuk pembuatan glukosamin, menghasilkan glukosamin dengan kadar 92 % dalam waktu fermentasi 5 hari.
Sedangkan berdasarkan penelitian yang dilakukan oleh Chintia Yolanda (2014),
yaitu penetapan waktu inkubasi optimum degradasi kitin denganMucor miehei untuk pembuatan glukosamin yang dilakukan selama 24 jam menghasilkan
rendemen maksimum sebesar 90 %. Hal ini menunjukkan bahwa untuk membuat
glukosamin, substrat kulit udang harus diproses menjadi polimer kitin terlebih
4
Berdasarkan hal tersebut maka pada penelitian ini akan dilakukan isolasi
glukosamin dari kulit udang tanpa proses pengubahan menjadi kitin dengan cara
fermentasi olehMucor mieheidengan waktu inkubasi 24 jam. Glukosamin mempunyai gugus amina bebas sehingga akan bereaksi positif dengan reagen
ninhidrin. Filtrat yang dihasilkan tersebut kemudian diuji dengan reagen ninhidrin
dan dianalisis menggunakan spektrofotometer UV-Vis.
B. Tujuan Penelitian
Adapun tujuan dari dilakukannya penelitian ini adalah:
1. Menguji glukosamin dari fermentasi serbuk kulit udang olehMucor miehei dengan reagen ninhidrin.
2. Menentukan kadar glukosamin yang terbentuk setiap selang waktu 1 hari
fermentasi.
C. Manfaat Penelitian
Penelitian ini diharapkan dapat memberikan informasi tentang kadar glukosamin
yang terkandung dalam larutan hasil fermentasi kulit udang yang dibantu oleh
1
II. TINJAUAN PUSTAKA
A. Udang
Udang termasuk hewan kelas Crustacea yang terdiri atas tiga bagian tubuh, yaitu
kepala, dada, dan perut. Sebagian besar udang yang dihasilkan, diekspor ke luar
negeri dalam bentuk udang beku yang telah dihilangkan kulitnya. Selama ini kulit
udang tersebut hanya dimanfaatkan sebagai pakan ternak mengingat kandungan
proteinnya masih cukup tinggi (Elsawati, 1994).
Kulit udang mengandung protein (25% - 40%), kalsium karbonat (45% - 50%),
dan kitin (15% - 20%), tetapi besarnya kandungan komponen tersebut tergantung
pada jenis udangnya (Foucheret al., 2009). Hal ini menyebabkan limbah kulit udang berpotensi sebagai bahan baku dalam memproduksi kitin. Selain itu,
besarnya kandungan protein dan mineral ini dapat menurunkan kualitas dari kitin,
sehingga dalam pemurnian kitin komponen tersebut perlu dihilangkan.
Komponen-komponen tersebut perlu dihilangkan untuk menghasilkan produk
kitin yang bermutu tinggi sehingga molekul-molekulnya menjadi lebih halus
6
B. Enzim
Enzim adalah protein yang mengkatalisa reaksi kimiawi spesifik. Enzim
merupakan unit fungsional dari metabolisme sel. Enzim mengikat molekul
substrat membentuk kompleks enzim-substrat yang bersifat sementara, yang
terurai membentuk enzim bebas dan produknya. Bekerja dengan urut-urutan yang
teratur, enzim mengkatalisis ratusan reaksi bertahap yang menguraikan molekul
nutrien, reaksi yang menyimpan dan mengubah energi kimiawi, dan yang
membuat makromolekul sel dari prekursor sederhana. Diantara sejumlah enzim
yang berpartisipasi didalam metabolisme, terdapat sekelompok khusus yang
dikenal sebagai enzim pengatur, yang dapat mengenali berbagai isyarat metabolik
dan mengubah kecepatan katalitiknya sesuai dengan isyarat yang diterima.
Melalui aktivitasnya, sistem enzim terkoordinasi dengan baik, menghasilkan suatu
hubungan yang harmonis di antara sejumlah aktivitas metabolik yang berbeda,
yang diperlukan untuk menunjang kehidupan (Lehninger, 1982). Enzim akan
terdenaturasi pada suhu tinggi dan kondisi ekstrim lainnya seperti tinggi
rendahnya pH atau tekanan, (Suhartono, 1989).
Enzim berperan sebagai biokatalisator dalam proses biokimia, baik yang terjadi di
dalam sel maupun di luar sel (Poedjiadi, 1994). Lehninger (1982) menambahkan
bahwa enzim adalah katalisator sejati. Molekul ini meningkatkan dengan nyata
kecepatan reaksi kimia spesifik yang tanpa enzim akan berlangsung amat lambat.
Enzim tak dapat mengubah kesetimbangan reaksi yang dikatalisisnya; enzim juga
7
Menurut Manitto (1981), bahwa tiga sifat utama dari biokatalisator yaitu : dapat
menaikkan kecepatan reaksi, memiliki kekhususan dalam reagen dan produk,
dapat mengontrol kinetika reaksi.
Enzim yang diperoleh dari mikroorganisme lebih menguntungkan karena
mikroorganisme dapat berkembang biak dengan cepat, tidak memerlukan lahan
yang luas, biaya produksi relatif murah dan mudah dikontrol (Maggy, 1990).
Fungsi terpenting dari enzim adalah kemampuannya menurunkan energi aktivasi
suatu reaksi kimia. Kemampuan enzim mendegradasi substrat dipengaruhi oleh
beberapa faktor, antara lain konsentrasi enzim, konsentrasi substrat, pH, serta
suhu (Lehninger, 1982).
Protein adalah bagian utama enzim yang dihasilkan sel, maka semua yang dapat
mempengaruhi protein dan sel akan berpengaruh terhadap reaksi enzimatik.
Beberapa faktor penting yang mempengaruhi aktivitas enzim antara lain :
1. Substrat (reaktan)
Pada konsentrasi substrat rendah, kecepatan reaksi yang terjadi rendah.
Kecepatan reaksi akan meningkat dengan meningkatnya konsentrasi substrat.
Akan tetapi setelah peningkatan substrat lebih lanjut akan tercapai suatu laju
maksimum. Pada keadaan substrat yang berlebih akan terjadi kejenuhan
pembentukan kompleks enzim substrat sehingga sebagian besar substrat tidak
diubah menjadi produk. Penambahan substrat lebih lanjut tidak berakibat
8
2. Suhu
Seperti reaksi kimia pada umumnya, maka reaksi enzimatik dipengaruhi oleh
suhu. Jika suhu meningkat, maka laju reaksi juga akan meningkat. Karena
enzim adalah protein, maka semakin tinggi suhu mengakibatkan proses enzim
tidak aktif meningkat. Umumnya enzim mengalami kerusakan (denaturasi)
pada suhu di atas 50oC.
3. Derajat keasaman ( pH )
Reaksi suatu enzim dipengaruhi oleh perubahan pH karena akan berakibat
langsung terhadap sifat ion dari gugus–gugus amino dan karboksilat, sehingga
akan mempengaruhi bagian aktif enzim dan konformasi dari enzim. pH yang
terlalu rendah atau terlalu tinggi akan mengakibatkan denaturasi dari protein
enzim.
4. Penghambat enzim (inhibitor)
Inhibitor dapat meminimalkan kerja enzim karena akan membentuk ikatan
dengan sisi aktif enzim sehingga mengganggu proses pembentukan dan
kestabilan ikatan kompleks enzim substrat. Ada beberapa cara penghambatan
enzim, seperti penghambat secara bersaing (kompetitif), penghambat tidak
bersaing (non–kompetitif ), penghambat umpan balik (feed back inhibitor), dan
9
C. Kitin
Kitin merupakan suatu polimer linier yang sebagian besar tersusun dari unit-unit
β-(1→4)-2-asetamida-2-deoksi-β-D-glukopiranosa dan sebagian dari β-(1→4)
-2-amino-2-deoksi-β-D-glukopiranosa (Kumirskaet al., 2010). Kitin terdistribusi luas di lingkungan biosfer seperti pada kulit crustacea (kepiting, udang, dan
lobster), ubur-ubur, komponen struktur eksternal insekta, dinding sel fungi
(22-40%), alga, nematoda ataupun tumbuhan (Gohelet al., 2004). Rantai kitin antara satu dengan yang lainnya berasosiasi melalui ikatan hidrogen yang sangat kuat
antara gugus N-H dari satu rantai dengan gugus C=O dari rantai lain yang
berdekatan. Ikatan hidrogen ini menyebabkan kitin tidak larut dalam air dan
membentuk serabut (fibril) (Suryanto dan Yurnaliza, 2005).
Gambar 1. Struktur kitin (Murrayet al., 2003)
Kitin berbentuk padatan amorf atau kristal, berwarna putih, dan dapat terurai
secara hayati (biodegradable). Kitin bersifat tidak larut dalam air, asam anorganik encer, asam organik, alkali pekat dan pelarut organik tetapi larut dalam asam
pekat seperti asam sulfat, asam nitrit, asam fosfat, dan asam format anhidrat. Kitin
10
gugus asetil (Einbu, 2007). Ketika derajat N-asetilasi (didefinisikan sebagai
rata-rata jumlah unit N-asetil-D-glukosamin per 100 monomer yang dituliskan sebagai
persentase) kurang dari 50%, maka kitin dapat larut dalam larutan asam dan
kemudian disebut kitosan (Pillaiet al., 2009).
Kitin dapat diproduksi secara komersial dari limbah kulit udang dan cangkang
kepiting (Noet all., 2000). Kulit udang mengandung protein 25- 40 %, kalsium karbonat 45-50 %, dan kitin 15-20 %, tetapi besarnya kandungan komponen
tersebut tergantung pada jenis udang dan tempat hidupnya. Cangkang kepiting
mengandung protein 15,60-23,90 %, kalsium karbonat 53,70- 78,40 %, dan kitin
18,70-32,20 % yang juga tergantung pada jenis kepiting dan tempat hidupnya
(Marganof, 2003).
D. Enzim Kitinase
Kitinase adalah enzim yang dapat mendegradasi kitin dengan memotong ikatan
glikosidik dari polimer β-1,4 N-asetil-D-glukosamin. Proses degradasi ini
menghasilkan monomer-monomer N-asetilglukosamin. Di alam, proses degradasi
kitin dilakukan oleh mahluk hidup penghasil kitinase seperti jamur, bakteri,
Actinomycetes, tumbuhan (Matsumoto, 2006), vertebrata, moluska, arthropoda, alga dan beberapa jenis cendawan (FunkhouserandAronson 2007). Pada jamur, kitinase berperan dalam pengaturan fisiologis saat pembelahan sel, diferensiasi,
11
itu, kitinase juga digunakan hewan untuk mengkonversi kitin menjadi monomer
dan oligomernya, dan tumbuhan untuk mendegradasi dinding sel fungi patogen
(Gohelet al., 2006).
Harmanet al.,(1993) dan Sahaiet al.,(1993) membagi kitinase dalam tiga tipe yaitu :
1. Endokitinase (EC 3.2.1.14) yaitu kitinase yang memotong secara acak ikatan β
-1,4 bagian internal mikrofibril kitin. Produk akhir yang terbentuk bersifat
mudah larut berupa oligomer pendek N-asetilglukosamin (GIcNAc) yang
mempunyai berat molekul rendah seperti kitotetraose.
Gambar 2. Reaksi pemutusan ikatan β-1,4 pada bagian internal mikrofibril kitin
2. Eksokitinase (EC 3.2.1.14) dinamakan juga kitobiodase atau kitin 1,4-β
-kitobiodase, yaitu enzim yang mengatalisis secara aktif pembebasan unit-unit
diasetilkitobiose tanpa ada unit-unit monosakarida atau polisakarida yang
dibentuk. Pemotongan hanya terjadi pada ujung non reduksi mikrofibril kitin
12
Gambar 3.Reaksi pembebasan unit-unit diasetilkitobiose oleh enzim eksokitinase
3. β-1,4-N-asetilglukosaminidase (EC 3.2.1.30) merupakan suatu kitinase yang
bekerja pada pemutusan diasetilkitobiose, kitotriose dan kitotetraose dengan
menghasilkan monomer-monomer GIcNAc.
Gambar 4. Reaksi pemutusan diasetilkitobiose, kitotriose dan kitotetraose dan menghasilkan monomer-monomer N-asetilglukosamin.
Kitinase berguna dalam produksi kitooligosakarida. Kitooligosakarida berperan
13
contoh, kitoheksosa dan kitoheptosa memperlihatkan aktivitas anti tumor.
N-asetilglukosamin berguna sebagai obat anti inflamasi. Senyawa ini dalam tubuh
manusia disintesis dari glukosa dan digabungkan dengan glikoprotein dan
glikosaminoglikan (Patilet al.,(2000). Kitinase juga berperan dalam produksi protein sel tunggal dari limbah kitin untuk makanan hewan. Kitinase juga dapat
digunakan dalam pertanian sebagai pengendalian jamur patogen tanaman dan
hama serangga. Kombinasi σ-toksin dan kitinase dilaporkan lebih efektif dalam
membunuh hama serangga (Patilet al.,(2000).
E. Enzim Kitin Deasetilase (CDA)
Kitin deasetilase (CDA) merupakan salah satu enzim pendegradasi kitin selain
kitinase. Perbedaanya yaitu, kitinase adalah enzim yang dapat menghidrolisis kitin
secara acak pada ikatan glikosidiknya, sedangkan kitin deasetilase adalah enzim
yang dapat mengkonversi kitin menjadi kitosan. Degradasi kitin untuk
menghasilkan kitosan dapat dilakukan secara termokimia dengan menggunakan
alkali kuat pada suhu tinggi. Dengan menggunakan proses ini, hasil yang
diperoleh belum memuaskan karena mutu kitosan yang dihasilkan masih beragam.
Selain itu, proses termokimia juga menghasilkan limbah dan produk samping
yang berpotensi menjadi toksikan bagi lingkungan.
Degradasi kitin untuk menghasilkan kitosan juga dapat dilakukan secara enzimatis
yaitu menggunakan enzim kitin deasetilase (CDA). Keunggulan dari teknik ini
14
lingkungan (biocompatible) dan dapat membentuk oligomer atau polimer (Tsigos et al.,2000).
Enzim kitin deasetilase (CDA) dapat ditemukan pada bakteri, kapang, kamir,
cacing dan serangga yang mempunyai kandungan kitosan pada dinding sel atau
eksoskeletonnya. Proses enzimatis diharapkan akan lebih mudah dikendalikan,
lebih efisien, spesifik dan meminimalkan produk samping. Sejumlah penelitian
telah dilakukan untuk mengisolasi, mempurifikasi dan mengkarakterisasi kitin
deasetilase dari sejumlah mikroba. Aplikasi enzim ini pada berbagai jenis dan
kondisi substrat masih memberikan hasil yang beragam dengan parameter hasil
yang belum memuaskan (Tsigoset al., 2000).
Menurut Copeland ( 2000), kultur bakteri difermentasi dalam media produksi
enzim selama 2 hari pada 55oC. Enzim dipanen dengan cara sentrifugasi pada
8000 rpm selama 15 menit pada suhu 4oC untuk memisahkan dari sel bakteri dan
sisa media. Supernatan ditambahkan amonium sulfat sampai kejenuhan 80 %
sambil distirrer. Selanjutnya campuran diendapkan selama semalam pada suhu 4
o
C, lalu disentrifugasi pada 8000 rpm selama 15 menit. Filtrat dilarutkan dalam
0,02 M buffer borat pH 8 dan disimpan pada suhu 4oC. Kadar protein enzim diuji
15
F. Glukosamin
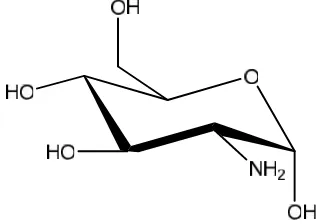
Glukosamin (C6H13NO5) adalah gula mengandung amina yang diperoleh dari
hasil hidrolisis kitin. Di alam, glukosamin tersebar luas sebagai komponen utama
dari rangka luarCrustacea, Antropoda,dan cendawan. Glukosamin juga ditemukan di matriks tulang rawan sendi dan cairan sendi manusia, bahkan di
hampir semua jaringan lunak dalam tubuh manusia, konsentrasi tertinggi di tulang
rawan ( Miller, 2011). Pada manusia, glukosamin sebagai salah satu komponen
biosintesis glikosaminoglikan (GAG). GAG ini akan berikatan secara kovalen
pada inti protein proteoglikan, salah satu komponen matriks jaringan kartilago
yang akan menjaga integritas struktur dan fungsi jaringan kartilago. Glukosamin
yang diproduksi oleh tubuh berada dalam bentuk glukosamin-6-fosfat dan
dihasilkan dari glukosa yang mengikuti jalur biosintesis heksosamin (Oegemaet al.,2002). Keberadaan glukosamin di dalam tubuh memiliki peranan penting untuk kesehatan dan kelenturan sendi (EFSA, 2009).
Gambar 5.Struktur glukosamin
Glukosamin merupakan prekusor utama untuk biosintesis berbagai makromolekul
16
glikoprotein. Secara struktural glukosamin adalah basa lemah sehingga sediaan
glukosamin yang beredar harus distabilkan dalam bentuk garam. Glukosamin
ditemukan dalam berbagai bentuk seperti glukosamin sulfat, hidroklorida,
N-asetilglukosamin atau garam klorohidrat, dan isomer dekstraoratorik ( Persianiet al.,2005). Glukosamin juga ditemukan dipasaran dalam bentuk glukosamin hidroklorida (HCl),cocrystalsataucoprecipitates glukosamin sulfatdan kalium atau natrium klorida ( Dahmer, 2008).
G. JamurMucor miehei
Jamur adalah sekelompok organisme yang digabungkan dalam takson Kingdom
Fungi berdasarkan sistem Whitaker. Kingdom fungi mempunyai ciri khas yaitu
bersifat heterotrof yang mengabsorbsi nutrien dan memiliki kitin pada dinding
selnya. Jamur benang atau kapang adalah golongan fungi yang membentuk
lapisan jaringan miselium dan spora yang tampak. Miseliumnya terdiri dari
filamen tubular yang tumbuh yaitu hifa (Singleton dan Sainsbury, 2006).
Jamur dapat bersifat sapotrof yaitu dengan mendapatkan nutrisi dari organisme
lain yang telah mati, ada juga yang bersifat parasit dengan mengisap nutrisi dari
organisme lain yang hidup, atau dengan bersimbiosis mutualisme dengan satu
organisme (Sadava, 2003).
Fungi mempunyai penggunaan kitin yang berbeda dengan hewan. Hewan hanya
memproduksi kitin pada bagian tertentu, misalnya sebagai rangka luar, rambut,
17
seluruh selnya. Adanya kitin juga membantu membedakan antara fungi dan
eukariota lainnya, seperti protista (Sadava, 2003).
Mucoradalah genus fungi yang berasal dari ordo Mucorales yang merupakan fungi tipikal saprotrop pada tanah dan serasah tumbuhan yang mampu
menghasilkan enzim kitindeasetilase pada substrat kitin atau kulitCrustaceaedan media cair yang mengandung nutrien yang diperlukan.Mucorberkembang biak secara aseksual dengan membentuk sporangium yang ditunjang oleh batang yang
disebut sporangiofor. Hifa vegetatifnya bercabang-cabang, bersifat senositik dan
tidak bersepta. Ciri khas padaMucoradalah memiliki sporangium yang berkolom-kolom atau kolumela (Singleton dan Sainsbury, 2006).
Mucor mieheisebagai salah satu anggota ordo Mucorales mempunyai talus yang berupa miselium yang lebat. Pembiakkan aseksual dilakukan dengan spora tak
berflagel (Aplanospora). Aplanospora terbentuk dalam sporangium dan
sporangium terletak pada ujung sporangiofor atau pada ujung cabang-cabangnya.
Pembiakkan seksual pada Mucorales berlangsung dengan bersatunya dua
gametangium yang berinti banyak. Gametangium terbentuk pada ujung hifa atau
ujung cabang hifa (Dwidjoseputro, 1976).
H. Fermentasi
Fermentasi merupakan suatu proses yang melibatkan mikroorganisme untuk
18
fermentasi yaitu bakteri, khamir dan kapang. Fermentasi pada bahan makanan,
dapat meningkatkan nilai gizi bahan yang berkualitas rendah dan berfungsi dalam
antinutrisi atau racun yang terkandung dalam suatu bahan makanan.
Fermentasi merupakan reaksi oksidasi reduksi yang menggunakan sumber energi
dan sumber karbon, nitrogen dan pospor untuk membentuk senyawa yang
mempunyai nilai ekonomi lebih tinggi serta terakumulasi dalam medium. Proses
fermentasi disebabkan oleh organisme atau hasil metabolisme (Rao, 2009).
Menurut Pujaningsih (2005) faktor-faktor yang mempengaruhi pemilihan substrat
fermentasi, adalah :
a. Kontinyuitas ketersediaan, yaitu tersedia substrat sepanjang tahun sehingga
dapat disimpan dalam beberapa bulan, mutu dan komposisi relatif tetap.
b. Sifat fermentasi substrat harus dapat difermentasikan, contoh padaTichoderma viridaeyang hanya tumbuh baik pada substrat selulosa (jerami padi), tetapi tidak dapat tumbuh pada bungkil kelapa.
c. Harga substrat ekonomis dan dapat digunakan sesuai kebutuhan.
Menurut Rusmana (2008), fermentasi dibedakan menjadi dua berdasarkan cara
19
1. Fermentasi media cair
Fermentasi media cair merupakan fermentasi yang melibatkan air sebagai fase
kontinyu dari sistem pertumbuhan sel yang bersangkutan atau substrat baik
sumber karbon maupun mineral terlarut atau tersuspensi sebagai
partikel-partikel dalam fase cair. Contoh produk dari fermentasi media cair, seperti
etanol, sel tunggal, antibiotik, pelarut organik, kulturstarter, dekomposisi selulosa, beer, glukosa isomerase, pengolahan limbah cair dan sebagainya.
2. Fermentasi media padat
Fermentasi media padat merupakan proses fermentasi yang berlangsung dalam
substrat yang tidak terlarut dan tidak mengandung air. Contoh produk
fermentasi media padat yaitu tape, tempe, oncom, koji, berbagai olahan ikan
fermentasi dan sebagainya.
I. Fermentasi Fase cair Sistem Tertutup (Batch)
Fermentasi merupakan proses dimana komponen-komponen kimiawi dihasilkan
sebagai akibat adanya pertumbuhan maupun metabolisme mikroba yang
mencakup proses aerob dan anaerob. Fermentasi dapat meningkatkan nilai gizi
bahan yang berkualitas rendah sehingga berfungsi dalam pengawetan bahan dan
merupakan suatu cara untuk menghilangkan zat antinutrisi atau racun yang
terkandung dalam suatu bahan makanan. Fermentasi dapat dilakukan dengan
20
terendam dilakukan dalam media cair menggunakan bioreaktor yang dapat berupa
labu yang diberi aerasi, labu yang digoyang denganshakerataufermentor.
Kondisi yang optimum untuk fermentasi tergantung pada jenis mikroorganisme
yang digunakan. Pengendalian faktor-faktor fermentasi bertujuan untuk
menciptakan kondisi yang optimum bagi pertumbuhan dan produksi metabolit
yang diinginkan dari suatu mikroorganisme tertentu. Fermentasi medium cair
lebih memungkinkan adanya pengendalian faktor-faktor fisik dan kimia yang
mempengaruhi proses fermentasi seperti suhu, pH, dan kebutuhan oksigen (Tonet al.,2010).
Fermentasi medium cair dapat dilakukan dengan dua cara, yaitu fermentasi
tertutup (batch culture) dan fermentasi kontinyu (fed batch). Pada fermentasi tertutup, setelah inokulasi tidak dilakukan lagi penambahan medium kedalam
fermentor, kecuali pemberian oksigen (udara steril), antibuih dan asam atau basa yang mengatur pH. Karena itu pada sistem tertutup ini, dengan sekian lamanya
waktu fermentasi, laju pertumbuhan spesifik mikroorganisme semakin menurun
sampai akhirnya pertumbuhan terhenti. Penurunan dan berhentinya pertumbuhan
disebabkan karena dengan semakin bertambahnya waktu fermentasi
nutrien-nutrien esensial dalam medium semakin berkurang atau terjadi akumulasi
autotoksin yang mempengaruhi laju pertumbuhan atau kombinasi dari keduanya.
21
1. Proses Fermentasi Fase Cair Sistem Tertutup (Batch)
Menurut Mitchelet al., (2006) tahapan–tahapan proses secara umum, antara lain :
a. Persiapan substrat, dimana substrat harus dipotong, digiling, dipecahkan,
atau dibuat menjadi butiran kecil. Dengan penambahan air dan nutrisi
disebut dengan pra-perawatan substrat untuk menambah ketersediaan gizi.
b. Persiapan inokulum, tipe dan persiapan inokulum tergantung pada
mikroorganisme yang digunakan. Banyak proses fermentasibatch melibatkan bakteri, jamur dan salah satunyaActinomycetesmaka digunakan spora hasil inokulasi. Tujuan dari langkah ini untuk
mengembangkan sebuah inokulum dengan tingkat kelangsungan hidup
mikoorganisme yang tinggi.
c. Persiapan wadah, dimana wadah harus dibersihkan setelah fermentasi
sebelumnya dan perlu disterilkan sebelum penambahan substrat.
d. Inokulasi dan pengerjaan, pengerjaan tahapan ini dengan menyebarkan
substrat pada media yang telah disterilkan secara hati–hati untuk
menghindari kontaminasi dari mikroorganisme yang tidak diinginkan.
e. Proses fermentasibatch, pada proses ini banyak hal yang harus diperhatikan antara lain pH medium, suhu, dan waktu inkubasi.
f. Kultivasi, pada tahapan ini memerlukan bantuan mekanis untuk
memisahkan substrat padat dari medium. Penggunaan kertas saring dan
22
2. Keuntungan Fermentasi Fase Cair Sistem Tertutup (Batch)
Dibandingkan dengan medium padat, medium cair memiliki beberapa
kelebihan, yaitu (Weiteset al.,2001):
a. Jenis dan konsentrasi komponen-komponen dapat diatur sesuai dengan
yang diinginkan.
b. Dapat memberikan kondisi yang optimum untuk pertumbuhan.
c. Pemakaian medium lebih efisien.
3. Aplikasi Fermentasi Fase Cair Sistem Tertutup (Batch)
Menurut Holkeret al.(2004) dan Pandey (2000) dapat menguraikan aplikasi dari fermentasibatchsecara tradisional, antara lain :
a. Bir, minuman beralkohol. Sari buah yang diberiSaccaromyces cereviciae kemudian diinkubasikan didapatkan minuman beralkohol.
b. Yoghurt,diproduksi dengan cara memfermentasikan air susu dengan bakteri bukan khamir. Biasanya menggunakan campuranLactobacillus bulgaricusdanStreptococcus thermophillus. Bakteri mengubah laktosa (gula susu) pada kondisi anaerobik. Laktosa diubah menjadi asam laktat
yang bersifat menggumpalkan kasein (protein susu).
c. Keju, berbagai jenis bakteri dapat digunakan untuk fermentasi susu
menjadi keju, tergantung dari jenis keju yang dihasilkan. Biasanya
23
J. Ninhidrin
Uji Ninhidrin digunakan untuk identifikasi asam amino bebas yang terdapat dalam
sampel. Asam amino bebas adalah asam amino yang gugus aminonya tidak
terikat. Ninhidrin adalah reagen yang berguna untuk mendeteksi asam amino dan
menetapkan konsentrasinya dalam larutan. Senyawa ini merupakan hidrat dari
triketon siklik dan bila bereaksi dengan asam amino akan menghasilkan zat warna
ungu. Hanya atom nitrogen dari zat warna ungu yang berasal dari asam amino,
selebihnya terkonversi menjadi aldehid dan karbondioksida. Jadi, zat warna ungu
yang sama dihasilkan dari semua asam amino α dengan gugus amino primer dan
intensitas warnanya berbanding lurus dengan konsentrasi asam amino yang ada
(Hart 2003).
24
K. Spektrofotometri UV-Vis
Spektrofotometer terdiri atas spektrometer dan fotometer. Spektrofotometer
menghasilkan sinar dari spektrum dengan panjang gelombang tertentu dan
fotometer adalah alat pengukur intensitas cahaya yang ditranmisikan atau yang
diabsorpsi. Spektrofotometer tersusun atas sumber spektrum yang kontinyu,
monokromator, sel pengabsorpsi untuk larutan sampel atau blangko dan suatu alat
untuk mengukur pebedaan absorpsi antara sampel dan blangko ataupun
pembanding (Khopkar, 2002).
Spektroskopi UV-Vis melibatkan absorpsi radiasi elektromagnetik dari kisaran
200-800 nm dan kemudian eksitasi elektron ke tingkat energi lebih tinggi.
Absorpsi cahaya ultraviolet/tampak oleh molekul organik terbatas hanya untuk
beberapa gugus fungsi (kromofor) yang mengandung elektron valensi dari energi
eksitasi yang rendah. Spektrum UV-Vis merupakan spektrum yang kompleks dan
nampak seperti pita absorpsi berlanjut, hal ini dikarenakan gangguan yang besar
dari transisi rotasi dan vibrasi pada transisi elektronik memberikan kombinasi
garis yang tumpang tindih (overlapping) (Hunger and Weitkamp, 2001).
25
Ada beberapa hal yang harus diperhatikan dalam analisis dengan spektrofotometri
ultraviolet (Rohman, 2007), yaitu:
1. Penentuan panjang gelombang serapan maksimum
Panjang gelombang yang digunakn untuk analisis kuantitatif adalah panjang
gelombang dimana terjadi absorbansi maksimum. Untuk memperoleh panjang
gelombang serapan maksimum dapat diperoleh dengan membuat kurva
hubungan antara absorbansi dengan panjang gelombang dari suatu larutan baku
dengan konsentrasi tertentu.
2. Pembuatan kurva kalibrasi
Dilakukan dengan membuat seri larutan baku dalam berbagai konsentrasi
kemudian asorbansi tiap konsentrasi di ukur lalu dibuat kurva yang merupakan
hubungan antara absorbansi dengan konsentrasi. Kurva kalibrasi yang lurus
menandakan bahwa hukum Lambert-Beer terpenuhi.
3. Pembacaan absorbansi sampel
Absorbansi yang terbaca pada spektrofotometer hendaknya antara 0,2 sampai
0,8 atau 15% sampai 70% jika dibaca sebagai transmitan. Hal ini disebabkan
karena pada kisaran nilai absorbansi tersebut kesalahan fotometrik yang terjadi
adalah paling minimal.
Spektrofotometer UV-Vis dapat melakukan penentuan terhadap sampel yang
berupa larutan, gas, atau uap. Untuk sampel yang berupa larutan perlu
26
1. Pelarut yang dipakai tidak mengandung sistem ikatan rangkap terkonjugasi
pada struktur molekulnya dan tidak berwarna.
2. Tidak berinteraksi dengan molekul senyawa yang dianalisis.
27
III. METODOLOGI PENELITIAN
A. Waktu dan Tempat
Penelitian ini telah dilaksanakan pada Februari sampai dengan Juni 2016, dengan
tahapan kegiatan, yaitu: pengambilan sampel limbah kulit udang dari pengumpul
udang di kecamatan Teluk Betung, Bandar Lampung, analisis glukosamin
dilakukan di Laboratorium Biokimia, Universitas Lampung.
B. Alat dan Bahan
Dalam penelitian ini alat-alat yang akan digunakan adalah peralatan gelasPyrex, termometer, neraca digitalWiggen Houser,Laminar Air Flow,autoclave,
IncubatorMemmer-Germany/INCO2,Shaker IncubatorBiosan/ES-20/60, Centrifuge Hitachi/CF 16 RX II, dan spektrofotometer UV-Vis.
Adapun bahan-bahan yang akan digunakan adalah serbuk kulit udang, glukosamin
standar produk WAKO Jepang, kentang,agar for microbiology, dekstrosa, laktosa, bakto pepton, amonium sulfat ((NH4)2SO4), urea, kalium hidrogen sulfat
(KHSO4), besi (II) sulfat heptahidrat (FeSO4.7H2O), kalsium klorida
28
sitrat, isolatMucor miehei, kertas saring, aquades, ninhidrin, NaH2PO4.7H2O dan
Na2HPO4.
C. Prosedur Penelitian
1. Persiapan Sampel
Limbah kulit dan kepala udang dipisahkan dari badannya, dibersihkan dan dicuci
dengan menggunakan air. Kulit dan kepala udang direbus selama ± 15 menit, lalu
ditiriskan. Selanjutnya kulit dan kepala udang dijemur dibawah sinar matahari
hingga kering, lalu dihancurkan hingga menjadi bubuk halus dan siap digunakan.
2. Pembuatan Media
2.1 PembuatanPotato Extract
Sebanyak 200 gram kentang dikupas kulitnya lalu dipotong seperti dadu dan
direbus dalam 1000 mL akuades selama 1 jam setelah mendidih. Setelah kondisi
tercapai, disaring dengan kertas saring sehingga diperoleh ekstrak kentang yang
bening. Ekstrak kentang disimpan dalam botol reagen lalu disterilisasi dengan
autoclavepada suhu 121˚C dan tekanan 2 atm selama 20 menit. Ekstrak kentang yang telah disterilisasi, didinginkan pada suhu kamar kemudian disimpan dalam
29
2.2 Media PDA (Potato Dextrose Agar) dan PertumbuhanMucor miehei pada Media PDA
Sebanyak 100 mLpotato extractditambahkan 4 gram dekstrosa dan 3 gram agar dalam labu Erlenmeyer 250 mL lalu disterilisasikan denganautoclavepada suhu 121˚C dan tekanan 2atm selama 20 menit (DSMZ, 2015). Setelah itu media PDA
ini di-UVselama 10 menit dalamLaminar Air Flowdan dituang ke dalam cawan petri. Strain jamurMucor mieheiditumbuhkan kurang lebih selama 5 hari sampai spora jamur ini tumbuh (Alveset al., 2005).
2.3 Media PDL (Potato Dextrose Liquid) dan PertumbuhanMucor miehei pada Media PDL
Sebanyak 100 mLpotato extractditambahkan 4 gram dekstrosa dalam labu Erlenmeyer 250 mL lalu disterilisasikan denganautoclavepada suhu 121˚C dan tekanan 2 atm selama 20 menit. Setelah itu media PDL ini di-UVselama 10 menit dalamLaminar Air Flow. Spora kultur 5 hari dipisahkan dan dimasukkan dalam media PDL dan diletakkan dalamshaker incubator dengan kecepatan 175 rpm pada suhu 30˚C selama ± 5 hari (Alves et al., 2005).
3. Larutan Buffer Sitrat pH 4
Sebanyak 0,96 gram asam sitrat dilarutkan dalam 50 mL akuades dalam labu takar
50 mL dan dikocok hingga homogen. Larutan ini merupakan larutan stok A.
30
dalam labu volumetrik 25 mL dan dikocok hingga homogen. Larutan ini
merupakan larutan stok B.
Sebanyak 33 mL larutan stok A (asam sitrat 0,10 M) dan 17 mL larutan stok B
(natrium sitrat 0,10 M) dilarutkan dalam 100 mL akuades dalam labu volumetrik
100 mL dan kemudian dicek pH-nya. Ini merupakan larutan buffer sitrat pH 4
(Mardiana, 2002).
4. Pembuatan Media InokulumMucor miehei
Sebanyak 0,1 gram serbuk kulit udang dimasukan ke dalam labu Erlenmeyer 100
mL, kemudian ditambahkan 0,01 gram laktosa; 0,03 gram bakto pepton; 0,14
gram amonium sulfat; 0,03 gram urea; 0,2 gram kalium dihidrogen sulfat; 0,03
gram besi (II) sulfat heptahidrat; 0,03 gram kalsium klorida; dan 0,029 gram seng
(II) sulfat heptahidrat, serta dilarutkan dalam 10 mL buffer sitrat pH 4.
Selanjutnya campuran diaduk sampai homogen lalu disterilisasi dalamautoclave pada suhu 121˚C dan tekanan 2 atm selama 20 menit. Kemudian media
didinginkan pada suhu ruang dalamLaminar Air Flow.Sebanyak 1 mL kultur awal dari media PDL diinokulasikan ke dalam media ini dan difermentasi pada
31
5. Fermentasi Fase Cair Sistem Tertutup (Batch) denganMucor miehei
Fermentasibatchdilakukan dengan menggunakanShaker Incubatorsistem tertutup. Substrat yang digunakan adalah serbuk kulit udang. Sebanyak 1 gram
serbuk kulit udang dimasukkan dalam labu erlenmeyer 100 ml yang berisi 0,01
gram laktosa; 0,03 gram bakto pepton; 0,14 gram amonium sulfat; 0,03 gram urea,
0,2 gram kalium dihidrogen sulfat; 0,03 gram besi (II) sulfat heptahidrat; 0,03
gram kalsium klorida; dan 0,029 gram seng (II) sulfat heptahidrat, serta dilarutkan
dalam 10 mL buffer sitrat pH 4. Media fermentasi ini dibuat 5 replikat.
Selanjutnya media disterilisasi dengan autoklaf pada 2 atm temperatur 121oC
selama 20 menit. Kemudian media didinginkan pada suhu ruang dalamLaminar Air Flow.Sebanyak 10 mLstarterdiinokulasikan ke dalam media ini dan difermentasi pada 30˚C dalam shaker-incubatordengan kecepatan 250 rpm selama 1-5 hari (Chahalet al., 2001).
Sejumlah hasil dari fermentasi batch, pada tiap selang waktu 1 hari, dipanaskan
denganwaterbathpada suhu 70oC selama 45 menit. Kemudian dicampurkan dengan 5 ml akuades dengan membiarkan labu erlenmeyer padarotary shaker selama 1 jam pada 200 rpm. Campuran disaring menggunakan kertas saring dan
filtrat disentrifugasi dengan kecepatan 10.000 rpm selama 20 menit pada suhu
32
6. Analisis Glukosamin dengan Spektrometer UV-Vis
Analisis glukosamin menggunakan spektromoter ultraviolet-visible (UV-Vis)
dilakukan setelah didapat filtrat hasil fermentasi.
6.1 Pembuatan Standar Glukosamin
Sebanyak 0,05 gram glukosamin (Glc) standar WAKO dilarutkan dalam 50 ml
akuades dalam labu ukur diperoleh konsentrasi akhir 1000 mg/L. Kemudian
larutan glukosamin standar 1000 mg/L ini diencerkan hingga diperoleh konsentasi
akhir msing-masing 50, 60, 70, 80, 90, 100, 110, 120, 130, 140, dan 150 mg/L.
Dari berbagai konsentrasi larutan standar ini, masing-masing diambil 4 ml lalu
ditambahkan 0,5 ml larutan ninhidrin 0,8 % dan 0,5 ml larutan buffer fosfat pH 6.
Larutan ini kemudian dipanaskan pada 100oC dalam penangas selama 15 menit.
Setelah terbentuk warna ungu, larutan didiamkan dalam suhu kamar dan diukur
dengan spektrofotomer UV-Vis pada panjang gelombang 570 nm (Wuet al., 2005).
6.2 Pembuatan Sampel Glukosamin
Filtrat hasil fermentasi masing-masing diambil dan diencerkan sebanyak 30 kali
dengan akuades. Larutan tersebut diambil 4 ml lalu ditambahkan 0,5 ml larutan
ninhidrin 0,8 % dan 0,5 ml larutan buffer fosfat pH 6. Larutan ini kemudian
dipanaskan pada 100oC dalam penangas selama 15 menit. Reaksi antar
33
suhu kamar dan diukur dengan spektrofotomer UV-Vis pada panjang gelombang
570 nm.
6.3 Pemilihan Panjang Gelombang Maksimum
Pemilihan panjang gelombang (λ) maksimumdilakukan menggunakan larutan
glukosamin standar dan hasil fermentasi yang telah direaksikan dengan larutan
ninhidrin 0,8% dan buffer fosfat pH 6. Kemudian dilakukanscanning
menggunakan spektrofotometer UV-Vis pada rentang panjang gelombang (λ)
450-600 nm.
6.4 Kalibrasi Glukosamin Sampel
Absorbansi glukosamin dalam sampel dikalibrasikan dengan kurva glukosamin
(Glc) standar menggunakan persamaan regresi linear. Hasil yang diperoleh
dikalikan dengan faktor pengenceran sehingga diperoleh konsentrasi glukosamin
47
V. SIMPULAN DAN SARAN
A. Simpulan
Berdasarkan penelitian yang telah dilakukan, dapat diambil kesimpulan sebagai
berikut.
1. Mucor mieheimemiliki potensi untuk mendegradasi kulit udang menjadi glukosamin tanpa harus merubahnya menjadi kitin.
2. Waktu inkubasi optimum fermentasi kulit udang denganMucor mieheiadalah hari keempat dengan kadar kemurnian glukosamin dalam sampel kulit udang,
yaitu pada hari keempat sebesar 4,1442 %.
3. Kadar kemurnian glukosamin yang dihasilkan dengan menggunakan substrat
kulit udang lebih rendah dibandingkan dengan kitin karena masih terkandung
protein dan mineral lain.
4. Reagen ninhidrin memberikan reaksi positif terhadap glukosamin sehingga
47
B. Saran
Dari hasil penelitian yang diperoleh, maka disarankan untuk memvalidasi adanya
glukosamin dalam produk fermentasi menggunakan HPLC-ELSD agar didapat
hasil kromatogram kemurnian glukosamin, serta melakukan proses deproteinasi
44
DAFTAR PUSTAKA
Acumedia Manufacture. 2011.Potato Dextrose Agar (7149). Technical Service or questions involving dehydrated culture media preparation.
Alves, Maria Helena, Galba M. De Campos-Takaki, Kaoru Okada, Ines Helena Ferreira Pessoa, and Adauto Ivo Milanez. 2005. Detection of extracellular protease inMucorspecies.Rev Iberoam Micol. Vol. 22, pp. 114-117.
Anonim. 2015.Spektrofotometri UV-Vis.
http://www.valdisreinaldo.blogspot.com. Diakses pada tanggal 10 Desember 2015.
Anonim. 2016.Does the Size of a Substrate Affect How Quickly an Enzyme Acts?. http://education.seattlepi.com/size-substrate-affect-quickly-enzyme-acts-5333.html. Diakses pada tanggal 16 Agustus 2016.
Ariyanta, Yahya. 2014.Pengaruh Penambahan Konsentrasi Inokulum dan Media Fermentasi terhadap Efektivitas Fermentasi Kitin dengan Mucor miehei untuk Pembuatan Glukosamin(Skripsi). Universitas Lampung. Bandar Lampung.
Chahal, P. S., D. S. Chahal, and G. B. B. Lee. 2001. Production of Cellulose in Solid State Fermentation withTrichorderma reesiMCG 80 on Wheat Straw. Applied Biochemistry and Biotechnology. Vol. 57-58, pp. 433-441.
49
Dahmer, M., and Schiller, R. M. 2008. Glucosamine. American Family Physician Ann Intern Med. 2008;78:470-476.Dinter, S., U. Bunger, and E. Siefert. 2000. Enzymatic Degradation of Chitin by Microorganisms. In:Advances in Chitin Science.Universitat Potsdam Druckhaus Schmergow. Germany.
Dwidjoseputro, D. 1976.Pengantar Mikologi. Alumni. Bandung. 70 halaman.
DSMZ. 2015. DSMZ: List of Media for Microorganisms.
https://www.dsmz.de/catalogues/catalogue-microorganisms/culture-technology/list-of-media-for-microorganisms.html. Diakses pada 1 Desember 2015.
EFSA [European Food Safety Authority]. 2009.Scietific Opinion on the substantion of a health claim related to glucosamine hydrochloride and reduced rate of cartilage degeneration and reduced risk of development of osteoarthritis pursuant. Parma, Italy. European Food Safety Authority 7(10): 1358.
Elsawati, E. 1994. Limbah Udang Dibuang Sayang. Techner12. Bogor. Hlm. 19.
Einbu, A. 2007.Characterisation of Chitin and a Study of Its Acid-Catalyzed Hydrolysis, Thesis for The Degree of Philosophiae Doctor. Norwegian University of Science and Technology. Dept. of Biotechnology. Noorwegian.
Foucher, J.P., G.K. Westbrook, A. Boetius, S. Ceramicola, S. Dupre, J. Mascle, J. Mienert, O. Pfannkuche, C. Pierre, and D. Praeg. 2009. Structure and Drivers of Cold Seep Ecosystems.Oceanography,22: 92-109.
Funkhouser, J., D. & Aronson, N., N. 2007. Chitinase family GH18: Evolutionary Insights From The Genomic History Of A Diverse Protein Family.BMC Evol Biol7: 96-111.
50
Harman, G.E., Crown K.H., Mitchel L., Ray M.B., Alexander D.P., Candy P., and Andrew T.. 1993. Chitinolitic Enzyme ofTrichoderma hazianum:
Purification of Chitobiosidase and Endochitinase Phytopathology, 2(83):313-318.
Hart, H., Craine, L.E. and Hart.D.J., 2003.Kimia Organik Edisi Kesebelas. Erlangga. Jakarta.
Holker, U., M. Hofer, and J. Lenz. 2004. Biotechnological Advantages of Laboratory-Scale Solid State Fermentation with Fungi.Journal of Applied Microbiology and Biotechnology,64:175–186.
Hunger, M. and J. Weitkamp. 2001. In situ IR, NMR, EPR, and UV/Vis
Spectroscopy: Tool for New Insight into the Mechanisms of Heterogeneous Catalysis.Angew-Chem Int Ed Engl. Vol. 49, pp. 2954-2971.
Khopkar, S. M. 2002.Konsep Dasar Kimia Analitik. Penerbit Swadaya. Jakarta.
Kumirska, J., M. X. Weinhold, J. Thoming, and P. Stepnowski. 2011. Biomedical activity of chitin/chitosan based materials influence of physicochemical properties apart from molecular weight and degree of acetylation.Polymers. Vol 3, pp. 1875-1901.
Lehninger, A.L. 1982.Dasar-Dasar Biokimia. Erlangga. Jakarta. Hlm. 84-89.
Maggy, L.T. 1990.Dasar-Dasar Biokimia. Erlangga. Jakarta.
Manitto, P. 1981.Biosintesis Produk Alami. Terjemahan Koensoemardiyah. Ellis Horwood Limited Publishers, Chichester.
Mardiana. 2002.Studi Pendahuluan Kitosans Secara Fermentasi Menggunakan Mucor miehei pada Media Kitin dari Kulit Udang Windu (Penaeus monodon) (Skripsi). Universitas Lampung. Bandar Lampung.
51
http://www.prodiikelautanunirow.blogspot.com. Diakses pada 15 nopember 2015.
Mas’ud, Fajriyati. 2013.Media, Isolasi, Sterilisasi, Peremajaan, dan Penyimpanan Mikroba. PPT.
Matsumoto, K.S. 2006. Fungal Chitinases, In : Guevara-Gonzales R.G and Torres-Pacheco I (Eds). Advances in Agricultural and Food Biotechnology. Reseach Signpost, India. 289-304.
Miller, K.L., and Clegg, D.O. 2011. Glucosamine and chondroitin sulfate. Rheum Dis Clin N Am. 2011; 37:103–18.
Mitchel, D., N. Krieger, and M. Berovic. 2006.Solid-State Fermentation Bioreactors. Springer-Verlag Berlin. Heidelberg.
Mulja, M. dan Suharman. 1995.Analisis Instrumental. Airlangga University Press. Surabaya. Hlm.121-123.
Murray, T. A. and Sandford. 2003. Chitin and Chitosan: Sources, Chemistry, Biochemistry, Physical Properties and Application.Elsevier Applied Science. London, pp. 561.
No, H.K., Meyers, S.P., and Lee, K.S. 2000. Isolation and Characterization of Chitin from Crawfish Shell Waste,Journal of Agricultural and Food Chemistry,1989,37(3), 575-579.
Oegema, Theodore R.,et al.2002. Effect of Oral Glucosamin on Cartilage and Meniscus in Normal and Chymopapain-Injected Knees of Young Rabbits. Arthritis and Rheumatism. 46 (9) : 2495-2503.
Pandey, A., C. Soccoll, and D. Mitchell.2000.New Developments in Solid-State Fermentation: I–Bioprocesses and Products.Journal of Process
52
Patil, R.S., V. Ghormade, and M.V. Deshpande. 2000. Chitinolytic Enzymes: An Exploration.Journal of Enzyme and Microbial Technology, 26: 473-483.
Persiani, S., Roda, E., Rovati, L.C., Locatelli, M., Giacovelli, G., and Roda, A. 2005. Glucosamine oral bioavailability and plasma pharmacokinetics after increasing doses of crystalline glucosamine sulfate in man. Osteoarthritis Cartilage. 2005;13:1041-46.
Pillai, C.K.S., Paul W., Sharma, C.P. 2009. Chitin and Chitosan Polymers: Chemistry, Solubility and Fiber Formation.Program Polymer Science. 34: 641-678.
Poedjiadi, A. 1994.Dasar-Dasar Biokimia. UI Press. Jakarta. Hlm. 472.
Pujaningsih, R. 2005.Teknologi Fermentasi dan Peningkatan Kualitas Pakan.(Skripsi). Universitas Diponogoro. Semarang.
Rao, K. 2009.Fermentation Biotechnology.http://www.fbae.org.Diakses pada 15 Nopember 2015.
Ratledge, C. 1993.Biochemistry of Microbial Degradation. Kluwer Academic.
Rohani, N. 2000. Deproteinasi Kulit Udang Windu Menggunakan Isolat Bakteri Bacillussp. (Skripsi). Institut Pertanian Bogor. Bogor.
Rohman, A. 2007.Kimia Farmasi Analisis : Spektrofotometri UV dan Tampak (visibel). Pustaka Pelajar. Yogyakarta.
Rumapea, Siti O. 2012.Uji Efektivitas Fermentasi Kitin Bertahap Menggunakan Mucor miehei dan Actinomycetes ANL-4 untuk Pembuatan Glukosamin (Skripsi). Universitas Lampung. Bandar Lampung.
53
Sadava, Purves. 2003.Life The Science of Biology Seventh Edition,Taylor and Francis Group LLC. USA.
Sahai, A.S. and S.M. Manocha. 1993. Chitinases of Fungi and Plants : Their Involvement in Morphogenesis and Host-Parasite Interaction.Journal of FEMS Microbiology,3(11): 317–338.
Schomburg, D. dan M. Salzmann. 1991.Enzyme Handbook 4(Hydrolase Lisozim).Spinger-Verlay Berlin Heidelberg. Jerman, pp. 307-310. Singleton, Paul dan Diana Sainsbury. 2006.Dictionary of Microbiology and
Molecular Biology Third Edition. John Wiley & Sons, Ltd. England.
Suhartono, M.T. 1989. Enzim dan Bioteknologi. Antar Universitas Bioteknologi. IPB. Bogor.
Suryanto, D. dan Yurnaliza. 2005.Eksplorasi Bakteri Kitinolitik : Keragaman Genetik Gen Penyandi Kitinase pada Berbagai Jenis Bakteri dan
Pemanfaatannya. USU. Medan.
Ton, N.M.N., M.D. Nguyen, T.T.H. Pham and V.V.M. Le. 2010. Influence of initial pH and sulfur dioxide content in must on wine fermentation by immobilized yeast in bacterial cellulose.International Food Research Journal, 6(3): 743-749.
Tsigos, I., dan V. Bouriotis. 2000. Purification and Characterization of Chitin Deacetylase fromColletotrichum lindemuthianum.J. Biol. Chem., 270: 26286-26291.
Weites, A.M., D.R. Gondim, and L.R.B. Gonçalves. 2001. Ethanol production by fermentation using immobilized cells ofSaccharomyces cerevisiaein cashew apple bagasse.Journal of Biochemistry and Biotechnology, 1(8): 209–217.
Wu, M.L., Y.C. Chuang, J.P.Chen, C. S. Chen, and M.C. Chang. 2001.
54
Wu, Y., Hussain, M., and Fassihi R. 2005. Development of A Simple Analytical Methodology For Determination of Glucosamine Release From Modified Release Matrix Tablets.Journal of Pharmaceutical and Biomedical Analysis. 38 (2005) 263-269.
Xu, L., Q. Li, and C. Jiang. 1996. Diversity of SoilActinomycetesin Yunnan, China.Journal of Applied Environmental Microbiology,62 (1): 244-248.
Yanming, D., Congyi, X.U., Jianwei, W., Mian,W., Yusong, W.U., and
Yonghong, R. 2001. Determination of degree of substitution for N-acylated chitosan using IR spectra.Science in Chine. Vol. 44, pp. 216-224.
Yolanda, C. 2014.Penetapan Waktu Inkubasi Optimum Degradasi Kitin Secara Enzimatik Oleh Mucor miehei Dengan Metode Ultraviolet-Visible
Spectrophotometry(Skripsi). Universitas Lampung. Bandar Lampung.