ABSTRAK
DEGRADASI EKSTRAK KASAR KULIT UDANG OLEH Mucor miehei MENJADI GLUKOSAMIN DENGAN METODE SPEKTROFOTOMETRI
UV-Vis
Oleh
Ruwaidah Muliana
Kitin merupakan suatu polimer tak larut yang tersusun dari residu β-1,4-N-asetil- D-glukosamin (GlcNAc). Kitin dapat diisolasi dari kulit udang melalui dua tahapan proses, yaitu deproteinasi dan demineralisasi. Selanjutnya kitin hasil isolasi dapat didegradasi dengan enzim kitinase menjadi monomer-monomer dan oligomernya oleh Mucor miehei. Tujuan dari penelitian ini adalah untuk mendapatkan rendemen maksimum dari ekstrak kulit udang yang sudah dihilangkan proteinnya dengan cara deproteinasi. Fermentasi selama 2 hari dengan waktu pengambilan sampel 8, 16, 24, 32, 40, dan 48 jam. Glukosamin dalam rendemen hasil fermentasi direaksikan menggunakan senyawa ninhidrin 0,8% dan buffer fosfat pH 6, akan membentuk Ruhemann purple (diketohidrindamin–diketohidrindiliden) bila dipanaskan pada temperatur 1000C. Absorbansi glukosamin dan ninhidrin diukur menggunakan spektrofotometri UV-Vis pada λ maks 567 nm. Hasil pengukuran diplotkan ke dalam persamaan regresi linear y = 0,0094x – 0,1238. Dari persamaan linear ini didapatkan hasilkan glukosamin tertinggi pada fermentasi 8 jam yaitu sebesar 2,431%. Kandungan mineral yang masih ada pada glukosamin seperti Mg2+ dan Na+ mengakibatkan aktivitas enzim kitinase menurun, oleh sebab itu rendemen yang dihasilkan sedikit.
ABSTRACK
DEGRADATION SHRIMP SHELLS ROUGH EXTRACT BY Mucor miehei BE GLUCOSAMINE WITH SPECTROPHOTOMETRY UV-Vis METHOD
By
Ruwaidah Muliana
Chitin is an insoluble polymer which composed by β-1,4-N-asetil-D-glucosamine (GlcNAc) residues. Chitin can be isolated from shirmp shells through two processes, namely deproteinization and demineralization. Furthermore, chitin can be hidrolyzed as its monomers and oligomers by chitinase enzyme from Mucor miehei. The aim of this research is to obtain maximum yield from shrimp shells removed protein by deproteinization process. Fermentation during 2 days, with sampling every 8, 16, 24, 32, 40 and 48 hours. Glucosamine from fermentation reacted with 0.8% ninhydrin solution and phosphate buffer pH 6, resulting in a so called Ruhemann purple color (diketohydrindamine–diketohydrindylidene) when heated at a temperature of 1000C. Glucosamine and ninhydrin absorbance was measured using UV-Vis spectrophotometry a maximum absorbance at 567 nm. The measurement results were plotted in a linear regression equation y = 0,0094x - 0.1238. The highest glucosamine yields during 2 days fermentation at 8 hours is equal to 2,431%. Mineral still exist in glucosamine such as Mg2+ and Na+, to work on chitinase enzyme activity declined, therefore glucosamine yields gained slightly.
DEGRADASI EKSTRAK KASAR KULIT UDANG OLEH Mucor miehei MENJADI GLUKOSAMIN DENGAN METODE SPEKTROFOTOMETRI
UV-Vis (Skripsi)
Oleh
RUWAIDAH MULIANA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS LAMPUNG
ABSTRAK
DEGRADASI EKSTRAK KASAR KULIT UDANG OLEH Mucor miehei MENJADI GLUKOSAMIN DENGAN METODE SPEKTROFOTOMETRI
UV-Vis
Oleh
Ruwaidah Muliana
Kitin merupakan suatu polimer tak larut yang tersusun dari residu β-1,4-N-asetil- D-glukosamin (GlcNAc). Kitin dapat diisolasi dari kulit udang melalui dua tahapan proses, yaitu deproteinasi dan demineralisasi. Selanjutnya kitin hasil isolasi dapat didegradasi dengan enzim kitinase menjadi monomer-monomer dan oligomernya oleh Mucor miehei. Tujuan dari penelitian ini adalah untuk mendapatkan rendemen maksimum dari ekstrak kulit udang yang sudah dihilangkan proteinnya dengan cara deproteinasi. Fermentasi selama 2 hari dengan waktu pengambilan sampel 8, 16, 24, 32, 40, dan 48 jam. Glukosamin dalam rendemen hasil fermentasi direaksikan menggunakan senyawa ninhidrin 0,8% dan buffer fosfat pH 6, akan membentuk Ruhemann purple (diketohidrindamin–diketohidrindiliden) bila dipanaskan pada temperatur 1000C. Absorbansi glukosamin dan ninhidrin diukur menggunakan spektrofotometri UV-Vis pada λ maks 567 nm. Hasil pengukuran diplotkan ke dalam persamaan regresi linear y = 0,0094x – 0,1238. Dari persamaan linear ini didapatkan hasilkan glukosamin tertinggi pada fermentasi 8 jam yaitu sebesar 2,431%. Kandungan mineral yang masih ada pada glukosamin seperti Mg2+ dan Na+ mengakibatkan aktivitas enzim kitinase menurun, oleh sebab itu rendemen yang dihasilkan sedikit.
ABSTRACK
DEGRADATION SHRIMP SHELLS ROUGH EXTRACT BY Mucor miehei BE GLUCOSAMINE WITH SPECTROPHOTOMETRY UV-Vis METHOD
By
Ruwaidah Muliana
Chitin is an insoluble polymer which composed by β-1,4-N-asetil-D-glucosamine (GlcNAc) residues. Chitin can be isolated from shirmp shells through two processes, namely deproteinization and demineralization. Furthermore, chitin can be hidrolyzed as its monomers and oligomers by chitinase enzyme from Mucor miehei. The aim of this research is to obtain maximum yield from shrimp shells removed protein by deproteinization process. Fermentation during 2 days, with sampling every 8, 16, 24, 32, 40 and 48 hours. Glucosamine from fermentation reacted with 0.8% ninhydrin solution and phosphate buffer pH 6, resulting in a so called Ruhemann purple color (diketohydrindamine–diketohydrindylidene) when heated at a temperature of 1000C. Glucosamine and ninhydrin absorbance was measured using UV-Vis spectrophotometry a maximum absorbance at 567 nm. The measurement results were plotted in a linear regression equation y = 0,0094x - 0.1238. The highest glucosamine yields during 2 days fermentation at 8 hours is equal to 2,431%. Mineral still exist in glucosamine such as Mg2+ and Na+, to work on chitinase enzyme activity declined, therefore glucosamine yields gained slightly.
DEGRADASI EKSTRAK KASAR KULIT UDANG OLEH Mucor miehei MENJADI GLUKOSAMIN DENGAN METODE SPEKTROFOTOMETRI
UV-Vis
Oleh
Ruwaidah Muliana
Skripsi
Sebagai salah satu syarat untuk mencapai gelar SARJANA SAINS
Pada Jurusan Kimia
Fakultas Matematika dan Ilmu Pengetahuan Alam
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS LAMPUNG
RIWAYAT HIDUP
Menengah Pertama di SMP Negeri 1 Metro selama 1 tahun kemudian
melanjutkan di SMP Negeri 2 Bandar Lampung kelas VIII dan IX pada tahun
2008 dan 2009, Sekolah Menengah Kejuruan (SMK) di Sekolah Menengah Teknologi Industri (SMTI) Bandar Lampung jurusan kimia analis pada tahun
2012. Pengalaman organisasi selama SMA adalah anggota Karya Ilmiah Remaja (KIR) dan anggota Rohis pada tahun 2010. Tahun 2011 melakukan Praktek Kerja Lapangan di PTPN VII Unit Usaha Bekri, Lampung Tengah.
Penulis terdaftar sebagai mahasiswa Jurusan Kimia Fakultas Matematika dan Ilmu
Pengetahuan Alam (FMIPA) Universitas Lampung pada tahun 2012 melalui jalur Seleksi Bersama Masuk Perguruan Tinggi Negeri (SBMPTN), dan merupakan salah satu penerima beasiswa PT. Sumber Indah Perkasa, Kecamatan Katibung,
Penulis dilahirkan di Palembang, Provinsi Sumatera
Selatan pada tanggal 13 April 1994, sebagai anak kedua dari tiga bersaudara pasangan Bapak Muslim Rachman
Lampung Selatan, dan juga pernah mendapatkan beasiswa Peningkatan Prestasi
Akademik (PPA) 2012/2013, 2014/2015 dan 2015/2016.
Selama menjadi mahasiswa pernah menjadi asisten prakitum Kimia Dasar Jurusan Agroteknologi 2014/2015, asisten pratikum Kimia Dalam Kehidupan Jurusan
Kimia 2015/2016 serta asisten pratikum Biokimia Jurusan THP dan TEP 2015/2016. Pengalaman organisasi penulis menjadi anggota bidang Sains Dan Penalaran Ilmu Kimia (SPIK) 2013-2015, bendahara umum Rohani Islam (ROIS)
FMIPA Universitas Lampung periode 2014/2015, dan bendahara departemen PSDM Badan Eksekutif Mahasiswa (BEM) FMIPA Universitas Lampung
periode 2015/2016. Pada tahun 2014 dan 2016 penulis melakukan Praktek Kerja Lapangan dan Penelitian di Laboratorium Biokimia, Jurusan Kimia, Universitas Lampung. Penulis melakukan Kuliah Kerja Nyata (KKN) Tematik di Tiyuh
PERSEMBAHAN
Puji Syukur kepada Allah SWT, atas segala karunia yang telah menganugerahkan nikmat iman dan islam, serta sholawat beriring salam untuk murabbi terbaik nabi Muhammad SAW.
Dengan mengharap berkah dari Allah SWT, ku persembahkan karya ini sebagai tanda bakti, cinta dan kasihku kepada :
Ibunda tercinta (Zaitun) dan ayahanda tercinta (Muslim Rachman)
Yang telah bersabar dalam membesarkan dan mendidikku serta selalu medoakan, menguatkan dan mendukung segala
langkahku dalam menuju kesuksesan.
Kakak tersayang (Syafadan Muza Perdana) dan adik tersayang (Muthiah Sari)
Yang telah menjadi penyemangat ku.
Rasa hormatku kepada
Ibu Dra Aspita Laila, M.S, Bapak Prof. Dr. John Hendri, M.S., dan Bapak Andi Setiawan, Ph.D.
Semua Bapak dan Ibu Guru yang telah memberikan ilmu, bimbingan dan selalu mengingatkan tentang pentingnya ilmu
dalam kehidupan ini.
Semua teman-temanku yang telah mengajarkan arti kebersamaan, kekeluargaan, cinta dan kebahagiaan.
Dan katakanlah : “Bekerjalah kamu, maka Allah
dan
Rasul-Nya serta orang-orang mukmin akan melihat pekerjaanmu itu,
dan kamu akan dikembalikan kepada Allah Yang Mengetahui
akan yang ghaib dan yang nyata, lalu diberitakan-Nya kepada
kamu apa yang telah kamu kerjakan. (QS. At-taubah : 105)
“A
pabila manusia telah meninggal dunia maka terputuslah
semua amalannya kecuali tiga amalan : shadaqah jariyah, ilmu
yang bermanfaat dan anak shalih yang mendoakan d
ia.”
(HR.
Muslim)
Ilmu lebih utama daripada harta. Sebab ilmu warisan para
nabi adapun harta adalah warisan Qorun, Firaun dan
lainnya. Ilmu lebih utama dari harta karena ilmu itu menjaga
SANWACANA
Alhamdulillahirobbil’alamin, segala puji dan syukur bagi Allah SWT tuhan
semesta alam atas segala nikmat dan karunianya, serta rahmatnya sehingga penulis dapat menyelesaikan skripsi dengan judul “Degradasi Ekstrak Kasar Kulit Udang Oleh Mucor miehei Menjadi Glukosamin Dengan Metode Spektrofotometri UV-Vis” sebagai syarat untuk mencapai gelar Sarjana Sains pada Jurusan Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam
Universitas Lampung.
Penulis menyadari bahwa terselesaikannya skripsi ini tidak terlepas dari bantuan berbagai pihak. Oleh karena itu, penulis mengucapkan terimakasih
kepada:
1. Ibu Dra. Aspita Laila, M.S. selaku pembimbing I atas segala bimbingan,
motivasi, kesabaran, keikhlasan, dan ilmunya sehingga penelitian dan skripsi ini dapat terselesaikan dengan baik. Atas semua yang telah beliau berikan semoga Allah SWT memberikan keberkahan dan kemudahan kepada beliau.
Semoga Allah SWT selalu memberikan keberkahan dan kemudahan kepada
beliau.
3. Bapak Andi Setiawan, Ph.D selaku pembahas atas bimbingan, arahan, dan
semua ilmu yang telah diberikan. Semoga Allah SWT selalu memberikan pertolongan dan membalas semua kebaikan.
4. Bapak Dr. Eng. Suripto Dwi Yuwono, M.T selaku ketua jurusan kimia
FMIPA Unila.
5. Bapak Prof. Dr. Warsito, DEA. selaku Dekan Fakultas Matematika dan Ilmu
Pengetahuan Alam Universitas Lampung.
6. Ibu Dr. Noviany, M.Si. selaku pembimbing akademik atas bimbingan,
nasehat, dan motivasi yang telah diberikan kepada penulis.
7. Bapak dan Ibu Dosen Jurusan Kimia FMIPA Universitas Lampung atas seluruh ilmu yang telah diberikan kepada penulis selama mengikuti
perkuliahan dikampus, semoga ilmu yang diberikan dapat bermanfaat. 8. Seluruh staf administrasi Universitas Lampung dan Jurusan Kimia
Fakultas Matematika dan Ilmu Pengetahuan Alam Universita Lampung
9. Bapak Muslim Rachman dan Ibu Zaitun atas segala cinta, kasih sayang, waktu, kesabaran, keikhlasan, dan ketulusan doa yang selalu beliau
panjatkan.
10.Kakak dan Adikku atas motivasinya, semoga Allah memberikan kemudahan dan pertolongan disetiap jalanmu.
12.Mbak Erlita, Maul, mbak Windi dan kak Jeje sebagai rekan kerja yang telah
banyak bersabar dalam membantu menyelesaikan penelitian ini. 13.Mbak Noe atas saran, motivasi dan pembelajarannya.
14.Andi research group (Edi, Arya, Dela, Tri, Intan, Dewi dan Sofian) atas kerjasama, bantuan, motivasi, dan kebersamaannya.
15.Penghuni Laboratorium biokimia mbak putri, mbak ana, mbak april, mbak
uswa, kak azies, pak john dan ibu john yang telah banyak membantu. 16.Sahabat hijrah jeje jean, elsa, yundadari dona, dan dedew.
17.Murni, ismi, upeh, encop, tri, arif, dan adi alay sebagai teman cerita. 18.Keluarga Kimia 2012 : Adi Setiawan, Aditian Sulung S, Agus Ardiansyah,
Ajeng Wulandari, Ana Maria K, Apri Welda, Arif Nurhidayat, Arya
Rifansyah, Atma Istanami, Ayu Imani, Ayu Setianungrum, Deborah Jovita, Derry Vardella, Dewi Aniatul Fatimah, Diani Iska M, Dwi Anggraini, Edi
Suryadi, Eka Hurwaningsih, Elsa Zulha, Erlita Aisah, Febita Glysenda, Feby Rinaldo Pratama K, Fenti Visiamah, Ferdinand Haryanto S, Fifi Adriyanthi, Handri Sanjaya, Indah Wahyu P, Indri Yani Saney, Intan Mailani, Ismi
Khomsiah, Jean Pitaloka, Jenny Jesica S, Khoirul Anwar, Maria Ulfa, Meta Fosfi B, Muhamad Rizal R, Murni Fitria, Nila Amalin N, Putri Ramadhona,
Radius Uly Artha, Riandra Pratama Usman, Rifki Husnul Khuluk, Rizal Rio S, Rizki Putriyana, Ruliana Juni Anita, Ruwaidah Muliana, Siti Aisah, Siti Nur Halimah, Sukamto, Susy Isnaini Hasanah, Suwarda Dua Imatu Dela,
Syathira Assegaf, Tazkiya Nurul, Tiand Reno, Tiara Dewi Astuti, Tiurma Debora S, Tri Marital, Ulfatun Nurun, Wiwin Esty Sawita, Yepi Triapriani,
persahabatan, dan kekeluargaannya. Semoga tali silaturahmi ini tetap ada
sampai kapanpun.
19.Para pejuang pimpinan rois periode 2014/2015, dan pimpinan BEM periode
2015/2016, semoga selalu istiqomah.
20.Teman-teman SMK (asih, tika, isma, vina, yesi, puput, ayuda, ratna, zamal, radit, dan karel) dan SMP (fai, muti, ais, arika, christin, tia) atas semua
motivasi dan dukungannya.
21.Teman KKN tiyuh Waysido, kecamatan Tulang Bawang Udik, anak abi (lina),
dedek iyut, iin, ocha, abang ogut dan ihsan.
22.Keluarga besar Kimia 2011, 2013, 2014, dan 2015 atas kebersamaan dan
persaudaraannya selama ini.
23.Semua pihak yang tidak dapat penulis sebutkan satu persatu yang secara tulus dan ikhlas memberikan bantuan moril dan materil kepada penulis.
Bandar Lampung, September 2016
Penulis
1
2. Demineralisasi ... 10
F. Enzim ... 11
G. Kitinase ... 11
H. Kitindeasetilase ... 14
I. N-asetilglukosamin ... 15
J. Glukosamin ... 16
K. Fermentasi Fase cair Sistem Tertutup (Batch) ... 17
L. Spektrofotometri UV-Vis ... 19
III. METODOLOGI A. Waktu dan Tempat ... 22
B. Alat dan Bahan ... 22
iii
2. Isolasi Kitin ... 23
D. Persiapan Isolat Mucor miehei ... 24
1. Pembuatan Potato Extract... 24
2. Media PDA (Potato Dextrose Agar) dan Pertumbuhan Mucor miehei pada Media PDA ... 24
3. Media PDL (Potato Dextrose Liquid) dan Pertumbuhan Mucor miehei pada Media PDL ... 25
4. Larutan Buffer Sitrat pH 4 ... 25
5. Pembuatan Inokulum Mucor miehei ... 26
6. Fermentasi Fase Cair Tertutup Pada Kulit Udang Tanpa Protein Dengan Mucor miehei ... 26
E. Karakterisasi Glukosamin ... 27
1. Analisa Glukosamin dengan Spektrofotometer UV-Vis ... 27
IV. HASIL DAN PEMBAHASAN A. Pembuatan Kulit Udang Bebas Protein ... 30
B. Peremajaan Mucor miehei ... 31
C. Fermentasi Fase cair Sistem Tertutup (Batch) ... 32
D. Spektrofotometri UV-Vis ... 33
V. KESIMPULAN DAN SARAN A. Kesimpulan ... 39
B. Saran ... 40
DAFTAR PUSTAKA ... 41
4
DAFTAR TABEL
Tabel Halaman
1. Absorbansi Deret Standar Glukosamin ... 49
2. Absorbansi Sampel Hasil Fermentasi ... 49
3. Kosentrasi Glukosamin Sebenarnya Dalam Hasil Fermentasi ... 49
5
DAFTAR GAMBAR
Gambar Halaman
1. Struktur kitin ... 7
2. Struktur Kitosan ... 9
3. Kerja Enzim Endokitinase dan Eksokitinase ... 12
4. Reaksi pemutusan diasetilkitobiose, kitotriose dan kitotetraose dan menghasilkan monomer-monomer GIcNAc ... 13
5. Jalur degradasi kitin secara enzimatik ... 13
6. Struktur N-asetilglukosamin ... 16
7. Struktur D-glukosamin ... 17
8. Skema Kerja Spektrofotometri UV-Vis... ... 20
9. Kurva Standar Glukosamin ... 33
10.Kurva Sampel Hasil Fermentasi ... 34
11.Persentase Rendemen Glukosamin Hasil Fermentasi ... 36
12.Warna biru α standar Glc, warna merah α sampel ... 37
13.Struktur pepton ... 38
14.Filtrat hasil deproteinasi (a), filtrat deproteinasi direaksikan dengan CUSO4 (b) ... 47
vi
16.Bentuk Spora Mucor ... 47
17.Isolat Mucor murni (a) isolate Mucor terkontaminasi (b) ... 48 18.Fermentasi Kulit Udang Tanpa Protein ... 48
19.Hasil Fermentasi 8, 16, 24 jam (a) Hasil Fermentasi 32, 40, 48 jam (b) 52 20.Perubahan Warna Ruhemann Purple ... 52
1
I. PENDAHULUAN
A. Latar Belakang
Peluang bisnis di sektor ekspor non migas seperti ekspor udang merupakan bisnis yang cukup menjanjikan. Ditambah lagi dengan permintaan konsumen
dari tahun ke tahun selalu meningkat. Menurut data dari Direktorat Jenderal Perikanan Budidaya, Kementerian Kelautan dan Perikanan produksi udang terus meningkat dengan kenaikan rata-rata selama lima tahun terakhir sebesar
13,83% per tahun. Hal ini akan menimbulkan masalah yaitu banyaknya limbah yang dihasilkan dari kepala dan cangkang udang.
Pengolahan limbah udang di Indonesia hanya dimanfaatkan sebagai bahan baku utama pembuatan terasi dan kerupuk udang. Namun memanfaatkan
limbah udang menjadi glukosamin dapat meningkatkan nilai jual yang lebih tinggi. Glukosamin merupakan monomer penyusun membentuk polimer kitin.
Limbah kulit udang terdiri dari tiga komponen utama yaitu protein (25-44%), kalsium karbonat (45-50%), kitin (15-20%) (Fohcher, 2009). Kitin dapat didegradasi menjadi glukosamin dengan menggunakan mikroorganisme
2
Pembuatan glukosamin dari kitin dalam waktu fermentasi 7 hari dengan
pengambilan sampel setiap satu hari menggunakanMucor mieheididapatkan hasil optimum sebanyak 88% glukosamin pada hari ke empat dengan
kemurnian sebesar 97,3% (Yolanda, 2014). Kemudian dilakukan penelitian fermentasi denganActinomycetesANL-4 selama 4 jam dengan pengambilan sampel setiap 1 jam sekali, didapatkan hasil optimum sebanyak 69%
glukosamin pada fermentasi 3 jam dengan kemurnian sebesar 99,7% (Robiah, 2015).
Berdasarkan referensi tersebut akan dilakukan penelitian yaitu melihat berapa lama waktu yang dibutuhkan enzim kitinase dan deasetilase tersebut mulai
bekerja mendegradasi ekstrak kasar kulit udang menjadi glukosamin serta lama waktu yang dibutuhkan untuk menghasilkan jumlah optimum
glukosamin. Pemetaan ataumappingakan dilakukan dengan waktu fermentasi
selama 2 hari dalam pengambilan sampel setiap 1 hari (replikat 8, 16 dan 24 jam), dimana sampel yang digunakan adalah serbuk kulit udang yang telah
dihilangkan kandungan proteinnya dengan cara menambahkan NaOH 20% (deproteinasi).
B. Tujuan
Adapun tujuan dilakukannya penelitian ini adalah :
1. Mendapatkan rendemen glukosamin optimum pada fermentasi dalam waktu
3
2. Menentukan waktu optimum yang dibutuhkan enzim kitinase dalam
bekerja mendegradasi ekstrak kasar kulit udang menjadi glukosamin. 3. Menentukan pengaruh proses demineralisasi terhadap glukosamin yang
diperoleh.
4. Mengkarakterisasi glukosamin yang diperoleh dengan Spektrofotometer UV-Vis.
C. Manfaat
Penelitian ini diharapkan dapat memberikan informasi tentang potensiMucor
mieheidalam menghasilkan enzim kitinase, serta pemanfaatan limbah kulit udang deprotein sebagai bahan baku utama pembuatan glukosamin yang lebih
1
II. TINJAUAN PUSTAKA
A. Udang
Bagian udang yang dimanfaatkan sebagai pangan terutama adalah daging udang. Bagian udang yang tidak dikonsumsi manusia dapat menjadi limbah udang. Limbah udang berasal dari kulit, kepala dan ekor udang. Limbah kepala
udang mencapai 35% -50% dari total berat udang. Di Indonesia sebagian limbah udang telah dimanfaatkan untuk pembuatan kerupuk udang, terasi, dan
bahan pencampur pakan ternak. Pada negara maju seperti Amerika dan Jepang, limbah udang telah dimanfaatkan antara lain pada industri farmasi, biokimia, biomedikal, pangan, pertanian, dan kesehatan. Hal ini karena limbah udang
dapat dimanfaatkan sebagai zat pembuat kitosan. Limbah udang memiliki potensi yang besar untuk diolah menjadi kitosan karena ketersediaan limbah
udang sebagai bahan baku cukup besar dan mudah diperoleh (Widodo, 2006).
Produksi udang Indonesia rata-rata meningkat sebesar 7,4% pertahun. Pada
5
Melalui proses demineralisasi dan deproteinisasi dengan rendemen 20% akan
dihasilkan kitin sebesar 157.005 ton. Pada proses deasetilasi kitin dengan rendemen 80% akan diperoleh kitosan sebesar 125.604 ton (Widodo, 2006).
Dengan demikian limbah udang sangat potensial untuk dimanfaatkan. Limbah kulit udang terdiri dari tiga komponen utama yaitu protein (25%-44%),
kalsium karbonat (45%-50%), dan kitin (15%-20%) (Fohcher, 2009). Kitin mempunyai struktur yang sama walaupun berasal dari sumber yang berbeda,
tetapi assosiasinya dengan protein dan kalsium karbonat berbeda kadarnya.
B. Mucor miehei
Jamur adalah sekelompok organisme yang digabungkan dalam takson
Kingdom Fungi berdasarkan sistem Whitaker. Kingdom fungi mempunyai ciri
khas yaitu bersifat heterotrof yang mengabsorbsi nutrien dan memiliki kitin pada dinding selnya. Jamur benang atau kapang adalah golongan fungi yang membentuk lapisan jaringan miselium dan spora yang tampak. Miseliumnya
terdiri dari filamen tubular yang tumbuh yaitu hifa (Singleton dan Sainsbury, 2006). Jamur dapat bersifat sapotrof yaitu dengan mendapatkan nutrisi dari
organisme lain yang telah mati, ada juga yang bersifat parasit dengan mengisap nutrisi dari organisme lain yang hidup, atau dengan bersimbiosis mutualisme dengan satu organisme (Sadava, 2003).
Mucoradalah genus fungi yang berasal dari ordo Mucorales yang merupakan
6
menghasilkan enzim kitindeasetilase pada substrat kitin atau kulitCrustaceae
dan media cair yang mengandung nutrien yang diperlukan.Mucorberkembang biak secara aseksual dengan membentuk sporangium yang ditunjang oleh
batang yang disebut sporangiofor. Hifa vegetatifnya bercabang-cabang, bersifat senositik dan tidak bersepta. Ciri khas padaMucoradalah memiliki
sporangium yang berkolom-kolom atau kolumela.
Mucor mieheisebagai salah satu anggota ordo Mucorales mempunyai talus
yang berupa miselium yang lebat. Pembiakkan aseksual dilakukan dengan spora tak berflagel (Aplanospora). Aplanospora terbentuk dalam sporangium dan sporangium terletak pada ujung sporangiofor atau pada ujung
cabang-cabangnya. Pembiakkan seksual pada Mucorales berlangsung dengan bersatunya dua gametangium yang berinti banyak. Gametangium terbentuk pada ujung hifa atau ujung cabang hifa (Singleton dan Sainsbury, 2006).
C. Kitin
Kitin merupakan suatu polimer linier yang sebagian besar tersusun dari
unit-unit β-(1→4)-2-asetamida-2-deoksi-β-D-glukopiranosa dan sebagian dari β
-(1→4)-2-amino-2-deoksi-β-D-glukopiranosa (Kumirskaet al., 2010). Kitin terdistribusi luas di lingkungan biosfer seperti pada kulit crustacea (kepiting, udang, dan lobster), ubur-ubur, komponen struktur eksternal insekta, dinding
sel fungi (22-40%), alga, nematoda ataupun tumbuhan (Gohelet al., 2004). Rantai kitin antara satu dengan yang lainnya berasosiasi melalui ikatan
7
C=O dari rantai lain yang berdekatan. Ikatan hidrogen ini menyebabkan kitin tidak larut dalam air dan membentuk serabut (fibril) (Suryanto dan Yurnaliza,
2005).
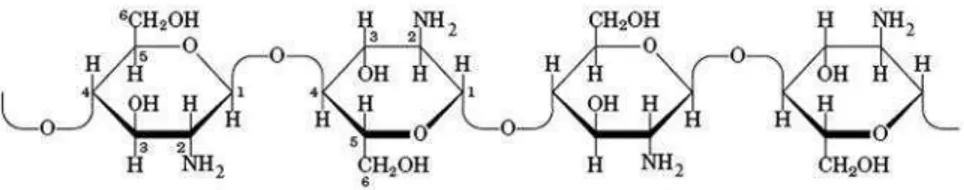
Gambar 1. Struktur kitin (Murrayet al., 2003)
Dalam hal kelarutan kitin berbeda dengan selulosa karena kitin merupakan senyawa yang stabil terhadap pereaksi kimia. Kitin bersifat hidrofobik, tidak larut dalam air, alkohol dan hampir semua pelarut organik. Kitin dapat larut
dalam asam klorida, asam sulfat dan asam fosfat pekat. Aplikasi kitin yang utama adalah sebagai senyawa pengkelat logam dalam instalasi pengolahan air bersih atau limbah, kosmetik sebagai fungisida dan fungistatik
penyembuh luka.Kitin bersifatbiodegradable, biocompatible,
citocompatible, danmempunyaibioaktivitas serta daya adsorpsi yang
ditentukan oleh sifat biologi dan fisikokimiawinya (Kumirska,et al.,2010).
Proses isolasi kitin biasanya terdiri dari demineralisasi, deproteinisasi dan pemutihan (bleaching). Dua tahap pertama dapat dilakukan dengan urutan
8
akan digunakan untuk absorben atau penjerat enzim harus didahului oleh
didemineralisasi, karena pemisahan garam akan mengisi dan melindungi struktur materi kitin menjamin deasetilasi polisakarida pada penembahan alkali selama depeoteinisasi. Akan tetapi deprotenisasi harus dilakukan lebih
dulu untuk memproses cangkang yang sebelumnya telah diekstraksi dengan minyak untuk memisahkan karotenoidnya (SynoweieckyandAl-Khateeb, 2003).
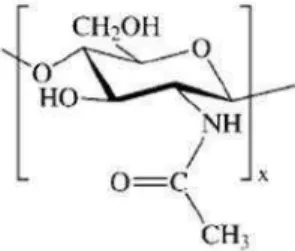
D. Kitosan
Kitosan disebut juga denganβ-1,4-2-amino-2-dioksi-D-glukosa. Senyawa
ini memiliki bentuk seperti lembaran tipis dan berserat, berwarna putih atau kuning, tidak berbau, dan memiliki sifat tidak larut dalam air, sedikit larut dalam HCl, HNO3, dan H3PO4serta tidak larut dalam H2SO4. Kitosan
memiliki struktur yang mirip dengan kitin, hanya saja gugus asetilnya telah dihilangkan dengan menggunakan basa kuat. Adanya gugus amina dan hidroksil pada kitosan menjadikan sifatnya lebih aktif dan bersifat
polikationik (Murrayet al., 2003).
Di alam kitosan banyak terdapat pada dinding sel jamur, terutama pada
ordo Mucorales, dimana sebagian besar penyusun komponen dinding selnya adalah kitosan dan padaSaccharomyces cerevisiae, kitosan merupakan penyusun utama pada askospora. Struktur kitosan dapat dilihat pada
9
Gambar 2. Struktur Kitosan (Murrayet al., 2003)
Dewasa ini, kitosan telah banyak digunakan dalam banyak bidang, dalam kosmetik, farmasi, tambahan makanan, dan pertanian (Kannan et al., 2010). Kitosan berfungsi menyerap zat racun, mencegah plak dan kerusakan gigi,
membantu mengontrol tekanan darah, memebantu menjaga pengayaan kalsium (Ca) atau memperkuat tulang, dan bersifat anti tumor.
E. Ekstraksi Kitin
Kulit udang mengandung protein (25-40 %), kalsium karbonat (45-50%), dan
kitin (15-20%), namun besarnya kandungan tersebut bergantung pada jenis udangnya (Foucheret al., 2009). Ekstraksi kitin dari kulit udang dilakukan
melalui dua tahapan proses yaitu penyisihan protein (deproteinasi) dan penyisihan kalsium karbonat (demineralisasi). Kedua tahapan proses dalam ekstraksi kitin tersebut dapat dilakukan secara kimia maupun biologi (Beaney
et al., 2005).
1. Deproteinasi
10
protein yang terikat secara kovalen dapat dihilangkan dengan perlakuan
kimia yaitu pelarutan dalam larutan basa kuat atau dengan perlakuan biologis (SynowieckiandAl-Khateeb, 2003). Namun, deproteinasi
menggunakan basa kuat NaOH lebih sering digunakan karena lebih mudah dan efektif. NaOH mampu memperbesar volume partikel bahan (substrat), sehingga ikatan antar komponen menjadi renggang, juga mampu
menghidrolisis gugus asetil pada kitin sehingga kitin akan mengalami deasetilasi dan berubah menjadi kitosan yang menyebabkan kadar kitin
berkurang.
2. Demineralisasi
Kulit udang mengandung mineral 30-35% (berat kering), komposisi yang utama adalah kalsium karbonat. Komponen mineral ini dapat dilarutkan dengan penambahan asam seperti asam klorida, asam sulfat, atau asam
laktat (SynowieckiandAl-Khateeb, 2003). Demineralisasi optimum dapat diperoleh dengan ekstraksi menggunakan HCl 1,0 M yang diinkubasi pada
suhu 750C selama 1 jam (Bahariah, 2005).
Proses demineralisasi sebaiknya dilakukan setelah proses ekstraksi protein
karena penambahan larutan alkali pada proses sebelumnya akan
memberikan efek penstabil pada kulit udang dan memaksimalkan produk
11
F. Enzim
Enzim adalah golongan protein yang paling banyak terdapat dalam sel hidup, dan mempunyai fungsi penting sebagai biokatalisator reaksi biokimia yang
secara kolektif membentuk metabolisme-perantara dari sel. Enzim dapat mempercepat reaksi dengan cara menurunkan energi bebas pengaktifan. Katalis bergabung dengan reaktan sedemikian rupa sehingga dihasilkan
keadaan transisi yang mempunyai energi bebas pengaktifan yang lebih rendah dari pada keadaan transisi tanpa katalis. Setelah reaksi terbentuk, katalis
dibebaskan kembali ke keadaan semula (Lehninger, 2005). Kelebihan enzim dibandingkan katalis biasa adalah (1) dapat meningkatkan produk lebih tinggi; (2) bekerja pada pH yang relatif netral dan suhu yang relatif rendah; dan (3)
bersifat spesifik dan selektif terhadap substrat tertentu. Enzim telah banyak digunakan dalam bidang industri pangan, farmasi, dan industri kimia lainnya.
Enzim dapat diisolasi dari hewan, tumbuha, dan mikroorganisme (Azmi, 2006).
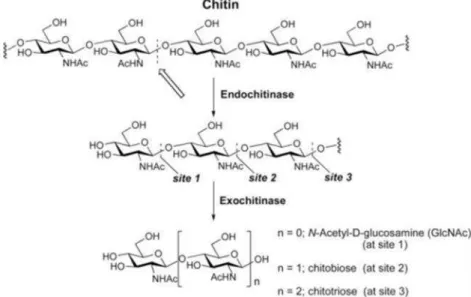
G. Kitinase
Kitinase merupakan glikosil hidrolase yang mengkatalisis degradasi kitin. Enzim
ini ditemukan dalam berbagai organisme, termasuk organisme yang tidak
mengandung kitin dan mempunyai peran penting dalam fisiologi dan ekologi
(Tomokazuet al., 2004). Suryantoet al.,(2005) membagi kitinase dalam tiga tipe
12
1. Endokitinase yaitu kitinase yang memotong secara acak ikatan β-1,4 bagian
internal mikrofibril kitin. Produk akhir yang terbentuk bersifat mudah larut
berupa oligomer pendek N-asetilglukosamin (GIcNAc) yang mempunyai berat
molekul rendah seperti kitotetraose.
2. Eksokitinase dinamakan juga kitobiodase atau kitin 1,4-β-kitobiodase, yaitu
enzim yang mengatalisis secara aktif pembebasan unit-unit diasetilkitobiose tanpa
ada unit-unit monosakarida atau polisakarida yang dibentuk. Pemotongan hanya
terjadi pada ujung non reduksi mikrofibril kitin dan tidak secara acak.
Gambar 3. Kerja Enzim Endokitinase dan Eksokitinase (Suryantoet al.,2005)
3. β-1,4-N-asetilglukosaminidase merupakan suatu kitinase yang bekerja pada
pemutusan diasetilkitobiose, kitotriose dan kitotetraose dengan menghasilkan
13
Gambar 4. Reaksi pemutusan diasetilkitobiose, kitotriose dan kitotetraose
dan menghasilkan monomer-monomer GIcNAc (Suryantoet al.,2005)
Gambar 5. Jalur degradasi kitin secara enzimatik (Gooday, 1994).
Enzim kitinase banyak dihasilkan oleh organisme seperti bakteri, fungi,
khamir, tumbuhan, insekta, protozoa, manusia, dan hewan (Gohel et al., 2004). Kitinase oleh bakteri dihasilkan secara ekstraseluler dan digunakan
14
dan aktivitas mikoparasit. Khamir menggunakan kitinase untuk proses
pembagian sel selama pertunasan dan untuk mekanisme perlawanan terhadap fungi lain. Tumbuhan menggunakan kitinase untuk mendegradasi dinding sel
fungi patogen. Insekta menggunakan kitinase untuk perkembangannya (Gohel et al., 2004).
H. Kitindeasetilase
Enzim kitin deasetilase terdapat bakteri laut, beberapa jamur dan beberapa
serangga, yang mengkatalisis proses deasetilasi kitin, suatu biopolimer struktural
yang ditemukan mikroorganisme laut, sel jamur dan dinding spora serta kutikula
dan peritrofik matriks serangga (Zhaoet al., 2010). Kitin deasetilase pertama kali
ditemukan dari ekstrak jamurMucor rouxii(Arakiet al., 1975) dan lebih lanjut
diketahui bahwa enzim tersebut dikaitkan dengan sintesis dinding sel dengan
mengubah kitin menjadi kitosan.
Sampai saat ini sudah banyak dilakukan penelitian mengenai enzim kitin
deasetilase. Penelitian ini pada umumnya bertujuan untuk mempelajari sifat-sifat
yang dimiliki oleh enzim kitin deasetilase (Zhaoet al., 2010), antara lain yaitu:
1. Masa Molekular
Massa molekul untuk sebagian besar kitin deasetilase adalah dalam kisaran 25
sampai 80 kDa.
2. Suhu dan pH Optimum
Menurut hasil yang dilaporkan, pH optimum untuk kitin deasetilase
15
kitin deasetilase intraseluler yang nilai pH optimal berada dalam kisaran
4,5-6. Suhu optimal adalah 50-60 °C.
3. Substrat Spesifik
Caufrieret al.(2003) menguji asetil xilan, peptidoglikan dan kitin sebagai
substrat untuk kitin deasetilase dariM. rouxiidan asetil xilan esterase dari
Streptomyces lividans.Semua enzim diuji untuk menentukan aktif tidaknya
pada asetil xilan, peptidoglikan, dan kitin. Hasil menunjukkan bahwa enzim
kitin deasetilase tidak aktif pada peptidoglikan tetapi aktif pada asetil xilan.
Hal ini menjelaskan bahwa baik kitin deasetilase dan asetil xilan esterase
memiliki domain katalitik yang sama.
I. N-asetilglukosamin
N-asetilglukosamin adalah suatu bagian monosakarida dari glukosa. Secara kimia merupakan amida antara glukosamin dan asam asetat. Struktur
molekulnya adalah C8H15NO6, massa molar 221,21 g/mol dan zat ini merupakan bagian penting dalam sistem biologi.
Gambar 6. Struktur N-asetilglukosamin
N-asetilglukosamin (C6H13NO5) merupakan gula amino dan di negara maju telah diproduksi secara komersial mengingat manfaatnya di berbagai industri,
16
biomedika, pangan, tekstil, kertas, dan lain-lain. Pemanfaatan tersebut
didasarkan atas sifat-sifatnya yang dapat digunakan sebagai pengemulsi, koagulasi, pengkhelat, dan penebal emulsi. Berbeda dengan kitin,
N-asetilglukosamin bersifat mudah larut dalam air, sedikit larut dalam metanol yang dipanaskan dan tidak larut dalam dietileter. N-asetilglukosamin sering ditemukan sebagai komponen utama pada rangka luarCrustacea,Arthropoda,
dan cendawan (Horton, 2009).
J. Glukosamin
Glukosamin (2-amino-2-deoxyglucose, chitosamin) adalah gula amino yang
diperoleh dari proses hidrolisis kitin (Shantoshet al.2007). Glukosamin pertama
kali diidentifikasi oleh Dr. Georg Ledderhose pada tahun 1876, tetapi struktur
stereokimia tidak sepenuhnya diketahui sampai ditemukan oleh Walter Haworth
pada tahun 1939 (Hortonet al, 2009). Glukosamin merupakan salah satu senyawa
gula amino yang ditemukan secara luas pada tulang rawan dan memiliki peranan
yang sangat penting untuk kesehatan dan kelenturan sendi (EFSA 2009).
Glukosamin (C6H13NO5) merupakan gula amino dan prekursor penting dalam
sintesis biokimia dari protein glikosilasi dan lipid. Glukosamin ditemukan sebagai
komponen utama dari rangka luarCrustacea,Arthropoda, dan cendawan.
Glukosamin merupakan salah satu monosakarida yang banyak dijumpai. Dalam
17
Gambar 7. Struktur D-glukosamin
Golongan hewan dan jamur tersebut tersusun atas kitin, dimana kitin merupakan
prekusor kitosan, dan kitosan sendiri merupakan polimer dari glukosamin
(D-glukosamin). Glukosamin dapat berfungsi sebagai pengemulsi, koagulasi,
pengkhelat dan penebal emulsi (Anonim, 2007).
K. Fermentasi Fase cair Sistem Tertutup (Batch)
Fermentasi merupakan proses dimana komponen-komponen kimiawi
dihasilkan sebagai akibat adanya pertumbuhan maupun metabolisme mikroba yang mencakup proses aerob dan anaerob. Fermentasi dapat meningkatkan
nilai gizi bahan yang berkualitas rendah sehingga berfungsi dalam pengawetan bahan dan merupakan suatu cara untuk menghilangkan zat antinutrisi atau racun yang terkandung dalam suatu bahan makanan. Fermentasi dapat
dilakukan dengan metode kultur permukaan dan kultur terendam (submerged). Medium kultur permukaan dapat berupa medium padat maupun medium cair.
18
Kondisi yang optimum untuk fermentasi tergantung pada jenis
mikroorganisme yang digunakan. Pengendalian faktor-faktor fermentasi bertujuan untuk menciptakan kondisi yang optimum bagi pertumbuhan dan
produksi metabolit yang diinginkan dari suatu mikroorganisme tertentu. Fermentasi medium cair lebih memungkinkan adanya pengendalian faktor-faktor fisik dan kimia yang mempengaruhi proses fermentasi seperti suhu, pH,
dan kebutuhan oksigen (Tonet al.,2010).
Fermentasi medium cair dapat dilakukan dengan dua cara, yaitu fermentasi tertutup (batch culture) dan fermentasi kontinyu (fed batch). Pada fermentasi tertutup, setelah inokulasi tidak dilakukan lagi penambahan medium kedalam
fermentor, kecuali pemberian oksigen (udara steril), antibuih dan asam atau
basa yang mengatur pH. Karena itu pada sistem tertutup ini, dengan sekian lamanyawaktu fermentasi, laju pertumbuhan spesifik mikroorganisme semakin
menurun sampai akhirnya pertumbuhan terhenti. Penurunan dan berhentinya
pertumbuhan disebabkan karena dengan semakin bertambahnya waktu fermentasi
nutrien-nutrien esensial dalam medium semakin berkurang atau terjadi akumulasi
autotoksin yang mempengaruhi laju pertumbuhan atau kombinasi dari keduanya.
Dengan demikian pada fermentasi tertutup jumlah sel pada fasestationer
merupakan jumlah sel maksimum.
Keuntungan Fermentasi Fase Cair Sistem Tertutup (Batch)
Dibandingkan dengan medium padat, medium cair memiliki beberapa kelebihan,
19
a. Jenis dan konsentrasi komponen-komponen dapat diatur sesuai dengan yang
diinginkan.
b. Dapat memberikan kondisi yang optimum untuk pertumbuhan.
c. Pemakaian medium lebih efisien.
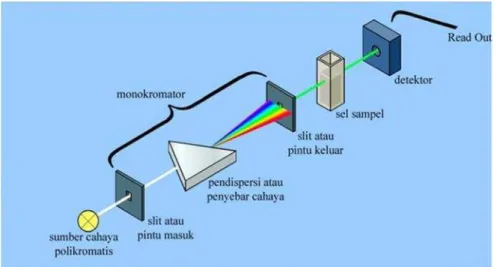
L. Spektrofotometri UV-Vis
Spektrofotometer terdiri atas spektrometer dan fotometer. Spektrofotometer
menghasilkan sinar dari spektrum dengan panjang gelombang tertentu dan fotometer adalah alat pengukur intensitas cahaya yang ditranmisikan atau yang diabsorpsi. Spektrofotometer tersusun atas sumber spektrum yang
kontinyu, monokromator, sel pengabsorpsi untuk larutan sampel atau blangko dan suatu alat untuk mengukur pebedaan absorpsi antara sampel dan blangko
ataupun pembanding (Khopkar, 2002).
Spektroskopi UV-Vis melibatkan absorpsi radiasi elektromagnetik dari
kisaran 200-800 nm dan kemudian eksitasi elektron ke tingkat energi lebih tinggi. Absorpsi cahaya ultraviolet/tampak oleh molekul organik terbatas
hanya untuk beberapa gugus fungsi (kromofor) yang mengandung elektron valensi dari energi eksitasi yang rendah. Spektrum UV-Vis merupakan spektrum yang kompleks dan nampak seperti pita absorpsi berlanjut, hal ini
dikarenakan gangguan yang besar dari transisi rotasi dan vibrasi pada transisi elektronik memberikan kombinasi garis yang tumpang tindih (overlapping)
20
Gambar 8. Skema kerja spektrofotometri UV-Vis (Anonim, 2014)
Ada beberapa hal yang harus diperhatikan dalam analisis dengan spektrofotometri ultraviolet (Rohman, 2007), yaitu:
1. Penentuan panjang gelombang serapan maksimum
Panjang gelombang yang digunakn untuk analisis kuantitatif adalah panjang
gelombang dimana terjadi absorbansi maksimum. Untuk memperoleh panjang gelombang serapan maksimum dapat diperoleh dengan membuat kurva hubungan antara absorbansi dengan panjang gelombang dari suatu larutan
baku dengan konsentrasi tertentu.
2. Pembuatan kurva kalibrasi
Dilakukan dengan membuat seri larutan baku dalam berbagai konsentrasi kemudian asorbansi tiap konsentrasi di ukur lalu dibuat kurva yang merupakan hubungan antara absorbansi dengan konsentrasi. Kurva kalibrasi yang lurus
21
3. Pembacaan absorbansi sampel
Absorbansi yang terbaca pada spektrofotometer hendaknya antara 0,2 sampai 0,8 atau 15% sampai 70% jika dibaca sebagai transmitan. Hal ini disebabkan
karena pada kisaran nilai absorbansi tersebut kesalahan fotometrik yang terjadi adalah paling minimal.
Spektrofotometer UV-Vis dapat melakukan penentuan terhadap sampel yang berupa larutan, gas, atau uap. Untuk sampel yang berupa larutan perlu
diperhatikan pelarut yang dipakai (Mulja dan Suharman, 1995), antara lain: 1. Pelarut yang dipakai tidak mengandung sistem ikatan rangkap terkonjugasi
pada struktur molekulnya dan tidak berwarna.
23
III. METODELOGI PENELITIAN
A. Waktu dan Tempat
Penelitian ini dilakukan pada tanggal Maret 2016 hingga Juni 2016 di Laboratorium Biokimia, Jurusan Kimia, Fakultas Matematika dan Ilmu
Pengetahuan Alam, Universitas Lampung.
B. Alat dan Bahan
Peralatan yang digunakan dalam penelitian ini adalah peralatan gelas, shaker,
Heating Magnetic Strirer, pH meter, mikropipet,Laminar air flow, Inkubator
Memmer-Germany/INCO2,centrifugeHitachi/ CF 16 RX II, digital
waterbathWiggen Houser,autoclave,Frezeer,neraca digital Wiggen Houser, termometer,mortar, oven,Shaker Incubator, penangas air dan
Spektofotometer UV-Vis.
Adapun bahan-bahan yang digunakan adalah standar Glukosamin WAKO
23
Kalsium klorida (CaCl2.2H2O), seng (II) sulfat heptahidrat (ZnSO4.7H2O), asam sitrat, natrium sitrat, ninhidrin, natrium hidrogen fosfat (Na2HPO4.2H2O), natrium dihidrogen fosfat (NaH2PO4.2H2O), isolatMucor miehei, NaOH, kertas saring, aquades, dan indikator universal.
C. Prosedur Penelitian
1. Persiapan Sampel
Cangkang kulit udang dibersihkan, direbus dan dikeringkan, kemudian dihaluskan menggunakan blender kering hingga ukuran 10-40meshyang selanjutnya disebut sampel.
2. Isolasi Kitin
Proses Isolasi kitin terdiri atas tiga tahap, yaitu: deproteinasi yang
merupakan proses pemisahan protein dari sampel, demineralisasi yang merupakan proses pemisahan mineral, dan depigmentasi yang merupakan
tahap pemutihan kitin. Depigmentasi ini bertujuan untuk menghilangkan zat warna (pigmen) yang terdapat pada sampel dari kitin. Untuk kerja praktik ini pembuatan kitin secara kimia hanya dilakukan sampai tahap
deproteinasi.
a. Deproteinasi
24
1 L NaOH 20%. Setelah itu sampel diletakkan dalam penangas air dan
didiamkan selama 1 jam pada suhu 90oC (Pareira, 2004). Setelah itu dilakukan penyaringan sehingga diperoleh residu dan filtrat. Filtrat diuji
dengan CuSO4, protein dengan CuSO4 akan membentuk senyawa kompleks berwarna ungu untuk membuktikan bahwa protein berhasil dipisahkan dari kitin melalui deproteinasi. Residunya dicuci dengan
akuades hingga pH netral yang diukur dengan indikator universal. Kemudian residu dikeringkan dalam oven pada suhu 60oC selama 24 jam, sehingga diperoleh kitin kering.
D. Persiapan IsolatMucor miehei
1. PembuatanPotato Extract
Sebanyak 200 gram kentang dikupas kulitnya lalu dipotong seperti dadu dan direbus dalam 1000 mL akuades selama 1 jam setelah mendidih.
Setelah kondisi tercapai, disaring dengan kertas saring sehingga diperoleh ekstrak kentang yang bening. Ekstrak kentang disimpan dalam botol reagen lalu disterilisasi denganautoclavepada suhu 121˚C dan tekanan 1atm
selama 20 menit. Ekstrak kentang yang telah disterilisasi, didinginkan pada suhu kamar kemudian disimpan dalam lemari pendingin (kulkas) (DZMZ,
25
2. Media PDA (Potato Dextrose Agar) dan PertumbuhanMucor mieheipada Media PDA
Sebanyak 100 mLpotato extractditambahkan 4 gram dekstrosa dan 3
gram agar dalam labu Erlenmeyer 250 mL lalu disterilisasikan dengan autoclavepada suhu 121˚C dan tekanan 1 atm selama 20 menit (DSMZ, 2013). Setelah itu media PDA ini di-UVselama 10 menit dalamLaminar
Air Flowdan dituang ke dalam cawan petri. Strain jamurMucor miehei ditumbuhkan kurang lebih selama 5 hari sampai spora jamur ini tumbuh
(Alveset al., 2005).
3. Media PDL (Potato Dextrose Liquid) dan PertumbuhanMucor miehei
pada Media PDL
Sebanyak 100 mLpotato extractditambahkan 4 gram dekstrosa dalam labu Erlenmeyer 250 mL lalu disterilisasikan denganautoclavepada suhu
121˚C dan tekanan 2 atm selama 20 menit. Setelah itu media PDL ini di
-UVselama 10 menit dalamLaminar Air Flow. Spora kultur 5 hari
dipisahkan dan dimasukkan dalam media PDL dan diletakkan dalam shaker incubatordengan kecepatan 175 rpm pada suhu 30˚C selama ± 5
hari (Alveset al., 2005).
4. Larutan Buffer Sitrat pH 4
26
dalam 25 mL akuades dalam labu volumetrik 25 mL dan dikocok hingga
homogen. Larutan ini merupakan larutan stok B. Sebanyak 33 mL larutan stok A (asam sitrat 0,10 M) dan 17 mL larutan stok B (natrium sitrat 0,10
M) dilarutkan dalam 100 mL akuades dalam labu volumetrik 100 mL (Mardiana, 2002).
5. Pembuatan Media InokulumMucor miehei
Substrat yang digunakan adalah kitin yang telah dicuci terlebih dahulu
dengan 0,5% NaOH selama satu jam berdasarkan metode Grayet al. (1978). Selanjutnya kitin disaring, dibilas dengan akuades, dan
dikeringkan dalam oven pada suhu 60˚C selama 24 jam. Sebanyak 0,1
gram substrat kitin dimasukan ke dalam 7 labu Erlenmeyer 100 mL, kemudian ditambahkan 0,01 gram laktosa; 0,03 gram bakto pepton; 0,14 gram amonium sulfat; 0,03 gram urea; 0,2 gram kalium dihidrogen sulfat;
0,03 gram besi (II) sulfat heptahidrat; 0,03 gram kalsium klorida; dan 0,029 gram seng (II) sulfat heptahidrat, serta dilarutkan dalam 10 mL
buffer sitrat pH 4. Selanjutnya campuran diaduk sampai homogen lalu disterilisasi dalamautoclavepada suhu 121˚C dan tekanan1 atm selama 20 menit. Kemudian media didinginkan pada suhu ruang dalamLaminar
Air Flow.Sebanyak 1 mL kultur awal dari media PDL diinokulasikan ke dalam media ini dan difermentasi pada 30˚C dalamshaker-incubator
27
6. Fermentasi Fase Cair Sistem Tertututp (Batch) Kulit Udang Bebas Protein
denganMucor miehei
Fermentasibatchdilakukan dengan menggunakanshaker incubatordengan
sistem tertutup. Substrat yang digunakan adalah kulit udang tanpa protein. Sebanyak 1 g substrat kitin dimasukkan dalam Labu Duran 250 mL. Substrat kemudian direndam dengan larutan mineral garam sebagai media dan pH
larutan dikondisikan pada 7,0 dengan menggunakan buffer fospat pH 7 kemudian media disterilisasi denganautoclavepada 1 atm temperatur 1210C selama 20 menit. Kultur awal diinokulasikan dalam media kitin dengan perbandingan 1 : 1 (Tabel 2), lalu difermentasikan pada 30oC denganshaking 250 rpm selama 2 hari dengan pengambilan glukosamin setiap 1 hari (replikat
8, 16 dan 24 jam) waktu fermentasi (Chahalet al, 1996).
Sejumlah hasil dari fermentasibatchdipanaskan denganwaterbatchpada
suhu 70oC selama 45 menit. Kemudian dicampur dengan 5 mL air destilasi dengan membiarkan tabung padarotary shaker selama 1 jam pada 200 rpm.
Campuran disaring menggunakan kain katun dan filtrat disentrifugasi dengan kecepatan 13.000 rpm selama 20 menit pada suhu 40C. Semua filtrat yang diperoleh dibekukan di dalamfrezeerselama 24 jam, kemudian diliofilasi
dengan menggunakanfreezer dryersampai terbentuk kristal glukosamin.
E. Karakterisasi Glukosamin
28
Sampel yang digunakan merupakan rendemen hasil fermentasi tiap selang
waktu. Analisis dilakukan dengan senyawa ninhidrin dan buffer posfat.
a. Pembuatan larutan standar glukosamin
Konsentrasi larutan glukosamin yang dibuat masing-masing adalah 50, 60, 70, 80, 90, 100, 110, 120, 130, 140, dan 150 mg/L. Mula-mula
ditimbang 0,1 gram glukosamin standar, lalu dilarutkan dalam labu ukur 100 ml dengan akuades. Larutan standar induk ini kemudian
diencerkan secara bertahap menjadi 50, 60, 70, 80, 90, 100, 110, 120, 130, 140, dan 150 mg/L dibuat dengan dipipet secara teliti 0,5; 0,6; 0,7; 0,8; 0,9; 1,0; 1,1; 1,2; 1,3; 1,4; dan 1,5 ml larutan standar 1000 mg/L,
masing-masing diencerkan dengan pelarut akuades dalam labu takar 10 ml hingga tanda batas tera, lalu dihomogenkan. Kemudian masing-masing standar ini direaksikan dengan 0,5 ml ninhidrin 0,8% dan 0,5
ml buffer fosfat pH 6, lalu dipanaskan pada water bath suhu 1000C selama 30 menit. Perubahan warna ungu kompleks akan terjadi bila
sampel mengandung glukosamin (Yunqiet al, 2005).
b. Penentuan Panjang Gelombang Maksimum
Penentuan panjang gelombang maksimum untuk analisis dengan spektrofotometer UV-Vis dilakukan dengan menggunakan larutan
29
c. Kalibrasi Sampel Glukosamin
Hasil fermentasi glukosamin di ambil 4 ml sebagai sampel yang akan
dianalisis menggunakan spektrofotometer UV-Vis. Sampel ini
dilarutkan dengan akuades dalam labu ukur 10 ml. Kemudian masing-masing sampel ini direaksikan dengan 0,5 ml ninhidrin 0,8% dan 0,5
ml buffer fosfat pH 6, lalu dipanaskan pada water bath suhu 1000C selama 30 menit. Absorbansi glukosamin dalam sampel dikalibrasikan
39
V. KESIMPULAN DAN SARAN
A. KESIMPULAN
Dari hasil penelitian yang telah dilakukan, maka dapat disimpulkan bahwa :
1. Fermentasi dalam 2 hari didapatkan rendemen maksimum sebesar 2,431 % dari 1 gram bobot kulit udang bebas protein awal.
2. Fermentasi selama 2 hari, waktu optimum dihasilkan glukosamin terbanyak yaitu pada 8 jam inkubasi.
3. Glukosamin yang didapatkan bewarna coklat dan berair (bersifat higrokopis)
bila disimpan dalam keadaan tertutup selama 2 minggu, hal ini disebabkan masih terdapatnya mineral-mineral seperti Ca2+, Mg2+, dan Na+.
40
B. SARAN
Berdasarkan hasil penelitian yang diperoleh, maka pada penelitian selanjutnya disarankan untuk :
1. Menelusuri kinerja enzim kitinase dariMucor mieheidalam mendegradasi kulit udang menjadi glukosamin.
2. Mengidentifikasi karakteristik morfologi dari isolatMucor miehei
dengan SEM (Scanning Electron Microscope).
3. Membandingkan karakterisasi menggunakan spektrofotometri
UV-Vis antara pereaksi ninhidrin dengan pereaksi fenil isotiosianat (PITC).
4. Melakukan tahap demineralisasi tanpa tahap deproteinasi pada kulit
42
DAFTAR PUSTAKA
Alves, Maria Helena, Galba M. De Campos-Takaki, Kaoru Okada, Ines Helena Ferreira Pessoa, and Adauto Ivo Milanez. 2005. Detection of extracellular protease inMucorspecies.Rev Iberoam Micol. Vol. 22, pp. 114-117.
Angka, S.L. dan M.T. Suhartono. 2000.Bioteknologi Hasil Laut. PKSPL-IPB.Bogor.
Anonim. 2007.Glukosamin Untuk Osteoartitis.http://www.halalguide.info. Diakses pada 10 Januari 2013.
Anonim. 2014.Spektrofotometri UV-Vis.
http://www.valdisreinaldo.blogspot.com. Diakses pada tanggal 21 Juni 2014.
Araki, Y. and E. Ito. 1975. A pathway of chitosan formation inMucor rouxii.Eur. J. Biochem.Vol 55, pp. 71–78.
Azmi, J. 2006. Penentuan Kondisi Optimum FermentasiAspergillus oryzae Untuk Isolasi Enzim Amilase Pada Medium Pati Biji Nangka
(Arthocarphus heterophilus Lmk).Jurnal Biogenesis. 2(2): 55-58.
Bahariah. 2005. Pengaruh Konsentrasi NaOH dan Suhu pada Proses Deproteinasi Untuk Produksi Kitin dari Limbah Kulit Udang Putih (Penaeus merguensis).Skripsi. Universitas Hasanuddin. Makassar.
Beaney, P., J Lizardi-Mendoza, and M Healy. 2005. Comparison of Chitins Produced by Chemical and Bioprocessing Methods.J. Chem. Technol. Biotechnol. (80): 145-150.
42
Chahal, P. S., D. S. Chahal, and G. B. B. Lee. 2001. Production of Cellulose in Solid State Fermentation withTrichorderma reesiMCG 80 on Wheat Straw. Applied Biochemistry and Biotechnology. Vol. 57-58, pp. 433-441.
Clark, K. 2007.Kromatografi Cair Kinerja Tinggi (HPLC). http://www.chem-is-try.org.Diakses pada 28 Januari 2013.
DSMZ. 2013. DSMZ: List of Media for Microorganisms.
https://www.dsmz.de/catalogues/catalogue-microorganisms/culture-technology/list-of-media-for-microorganisms.html. Diakses pada 1 Desember 2013.
EFSA [European Food Safety Authority]. 2009. Scientific Opinion on the substantiation of a health claim related to glucosamine hydrochloride and reduced rate of cartilage degeneration and reduced risk of development of osteoarthritis pursuant. Parma, Italy.European Food Safety Authority, 7(10): 1358.
Foucher, J.P., G.K. Westbrook, A. Boetius, S. Ceramicola, S. Dupre, J. Mascle, J. Mienert, O. Pfannkuche, C. Pierre, and D. Praeg. 2009. Structure and Drivers of Cold Seep Ecosystems.Oceanography,22: 92-109. Gohel, V., P. Vyas, and H. S. Chhatpar. 2004. Activity staining method of
chitinase on chitin agar plate through polyacrylamide gel
electrophoresis.African Journal of Biotechnology. Vol. 4, pp. 87-90. Gooday, G.W., W.Y. Zhu, and R.W. O'Donnell. 1994. What are the roles of
chitinases in the growing fungus.Microbiology Letters,100(3): 387-391. Gray, P., N. Hendy, and W. Dunn. 1978. Digestion by Cellulolytic Enzymes of
Alkali Pretreated Bagasse.J. Aust. Inst. Agric. Sci, pp. 210-212.
Gritter, R.J., J.M. Bobbitt, and A.E. Schwarting. 1991.Intoduction to Chromatography. Halden Day Inc Oakland. USA.
Harman, G.E., Crown K.H., Mitchel L., Ray M.B., Alexander D.P., Candy P., and Andrew T.. 1993. Chitinolitic Enzyme ofTrichoderma hazianum:
Purification of Chitobiosidase and Endochitinase Phytopathology, 2(83):313-318.
Holker, U., M. Hofer, and J. Lenz. 2004. Biotechnological Advantages of Laboratory-Scale Solid State Fermentation with Fungi.Journal of Applied Microbiology and Biotechnology,64:175–186.
43
Instrumental Techniques for Analytical Chemistry. Hualingan. Shanghai. Hlm. 123-126.
Hunger, M. and J. Weitkamp. 2001. In situ IR, NMR, EPR, and UV/Vis
Spectroscopy: Tool for New Insight into the Mechanisms of Heterogeneous Catalysis.Angew-Chem Int Ed Engl. Vol. 49, pp. 2954-2971.
Kannan M., Nesakumari M., Rajarathinam K., Singh AJAR. 2010. Production and Characterization of Mushroom Chitosan Under Solid-State
Fermentation Conditions.Adv Biol Res. Vol. 4(1), pp. 10-13.
Khopkar, S. M. 2002.Konsep Dasar Kimia Analitik. Penerbit Swadaya. Jakarta.
Kumirska, J., M. X. Weinhold, J. Thoming, and P. Stepnowski. 2010. Biomedical activity of chitin/chitosan based materials influence of physicochemical properties apart from molecular weight and degree of acetylation. Polymers. Vol 3, pp. 1875-1901.
Lee, J.P. and B.Y. Hwang, 2002. Diversity of Antifungal Actinomycetes in Various Vegetative Soils of Korea.Canadian Journal of Microbiology, 48(5): 407–17.
Lehninger, A.L. 2005.Dasar-Dasar Biokimia. Erlangga. Jakarta. Hlm. 84-89. Mardiana. 2002.Studi Pendahuluan Kitosans Secara Fermentasi Menggunakan
Mucor miehei pada Media Kitin dari Kulit Udang Windu (Penaeus monodon)(Skripsi). Universitas Lampung. Bandar Lampung. Mitchel, D., N. Krieger, and M. Berovic. 2006.Solid-State Fermentation
Bioreactors. Springer-Verlag Berlin. Heidelberg.
Mulja, M. dan Suharman. 1995.Analisis Instrumental. Airlangga University Press. Surabaya. Hlm.121-123.
Murray, A.T. and P.T. Sandford. 2003. Chitin and Chitosan: Sources, Chemistry, Biochemistry, Physical Properties and Applications.Journal of Elsevier Applied Science, 12(6): 561.
Noviendri, D., Fauzya, Y.N., Chasanah, E. 2008. Karateristik dan Sifat Kinetika Enzim Kitinase Dari Isolat Bakteri T5a1 Asal Terasi.Jurnal Pascapanen Bioteknologi Kelautan dan Perikanan, Vol 3, no 2.
Pariera, B. M. 2004.Limbah Cangkang Udang menjadi Kitosan. http://www.chem-is-try.org. Diakses pada 24 Oktober 2013.
Pandey, A., C. Soccoll, and D. Mitchell.2000.New Developments in Solid-State Fermentation: I–Bioprocesses and Products.Journal of Process
44
Patil, R.S., V. Ghormade, and M.V. Deshpande. 2000. Chitinolytic Enzymes: An Exploration.Journal of Enzyme and Microbial Technology, 26: 473-483.
Poedjiadi, A. 1994.Dasar-Dasar Biokimia. UI Press. Jakarta. Hlm. 472. Pujaningsih, R. 2005.Teknologi Fermentasi dan Peningkatan Kualitas Pakan
(Skripsi). Universitas Diponogoro. Semarang.
Robiah Nur. 2015. Mapping Aktivitas Enzim Kitinase Dan Kitin Deasetilase Dari Isolat Actinomycetes ANL-4 Dalam Degradasi Kitin Selama 24 Jam Waktu Inkubasi(Skripsi). Universitas Lampung. Bandar Lampung
Rohman, A. 2007.Kimia Farmasi Analisis : Spektrofotometri UV dan Tampak (visibel). Pustaka Pelajar. Yogyakarta.
Sadava, Purves. 2003. Life The Science of Biology Seventh Edition,Taylor and Francis Group LLC. USA.
Shantosh, S., and P.T. Mathew. 2007. Preparation of glucosamine and carboxymethylchitin from shrimp shell.Journal of Applied Polymer Science,107: 280-285.
Silverstein, R.M., G.C. Bassler, dan T.C. Morril. 1986.Penyelidikan
Spektromerik Senyawa Organik. Edisi keempat. Alih bahasa A.J. Hartono dan Purba A.V. Erlangga. Jakarta. Hlm. 17-33.
Singleton, Paul dan Diana Sainsbury. 2006.Dictionary of Microbiology and Molecular Biology Third Edition. John Wiley & Sons, Ltd. England.
Suhartono, M.T. 1989. Enzim dan Bioteknologi. Antar Universitas Bioteknologi. IPB. Bogor.
Suryanto, D. dan Yurnaliza. 2005.Eksplorasi Bakteri Kitinolitik : Keragaman Genetik Gen Penyandi Kitinase pada Berbagai Jenis Bakteri dan
Pemanfaatannya.[http:repository.usu.ac.id] diakses pada 25 februari 2013 Syahmani dan A. Slohahuddin. 2009.Interaksi Cd (II) dengan Kitin dan Kitosan
Isolat Limbah Kulit Udang. http://ptp2007.wordpress.compemanfaatan-kitosan.Diakses pada 25 Januari 2013.
Synowiecki, J. and Al-Khateeb, N. A. 2003. Production, Properties, and Some New Applications of Chitin and its Derivatives. Critical Reviews in Food Science and Nutrition, 43,no. 2, 145-171.
45
Ton, N.M.N., M.D. Nguyen, T.T.H. Pham and V.V.M. Le. 2010. Influence of initial pH and sulfur dioxide content in must on wine fermentation by immobilized yeast in bacterial cellulose.International Food Research Journal, 6(3): 743-749.
Weites, A.M., D.R. Gondim, and L.R.B. Gonçalves. 2001. Ethanol production by fermentation using immobilized cells ofSaccharomyces cerevisiaein cashew apple bagasse.Journal of Biochemistry and Biotechnology, 1(8): 209–217.
Widodo, A., Mardiah, dan Prasetyo, A., (2006), Potensi Kitosan Dari Sisa Udang Sebagai Koagulan Logam Berat Limbah Cair Industri Tekstil, Jurusan Teknik Kimia, Institut Sepuluh Nopember (ITS), Surabaya. Yolanda, Chintia. 2014.Penetapan Waktu Inkubasi Optimum Degradasi Kitin
Secara Enzimatik Oleh Mucor Miehei Dengan Metode Ultraviolet-Visible Spectrophotometry(Skripsi). Universitas Lampung. Bandar Lampung. Yunqi, W., Munnir, H., and Reza, F,. 2005. Development of a simple analytical
methodology for determination of Glucosamine release from modified release matrix tablets.Journal of Pharmaceutical and Biomedical Analysis, pp 263-269.
Yurnaliza. 2002.Senyawa Kitin dan Kajian Aktivitas Enzim Mikrobial Pendegradasinya. (Skripsi). Universitas Sumatera Utara. Medan.
Yuwono, Triwibowo. 2010.Biologi Molekular. Erlangga. Jakarta. Hlm 19.