ABSTRAK
PENETAPAN WAKTU INKUBASI OPTIMUM DEGRADASI KITIN SECARA ENZIMATIK OLEHMucor miehei DENGAN METODE
ULTRAVIOLET-VISIBLE SPECTROPHOTOMETRY
Oleh
Chintia Yolanda
Penelitian ini dilakukan untuk mempelajari potensi enzim kitinase dan kitindeasetilase yang dihasilkan Mucor miehei dalam mendegradasi kitin menjadi glukosamin setiap hari selama tujuh hari proses fermentasi. Kadar glukosamin ditentukan berdasarkan metode spektrofotometri UV-Vis dan analisis kemurnian glukosamin dengan metode HPLC-ELSD. Hasil penelitian menunjukkan fermentasi kitin dengan Mucor miehei menghasilkan rendemen glukosamin sejak hari pertama fermentasi dan mencapai rendemen maksimum sebesar 90 % berdasarkan penimbangan dan 88 % berdasarkan pengukuran spektrofotometri UV-Vis pada hari keempat dengan kemurnian sebesar 97,342 %. Produksi glukosamin dikonfirmasi dengan analisis HPLC-ELSD. Hasil analisis menunjukkan adanya puncak pada rentang waktu retensi 2-3 menit yang sama seperti pada kromatogram glukosamin standar produksi WAKO, Jepang.
ABSTRACT
DETERMINATION OF THE OPTIMUM INCUBATION TIME ENZYMATIC DEGRADATION OF CHITIN BY Mucor miehei USING
ULTRAVIOLET-VISIBLE SPECTROPHOTOMETRY METHOD
By
Chintia Yolanda
This research was conducted to study the potential of chitinase and chitin deacetylase produced by Mucor miehei to degrade chitin into glucosamine every day for seven days fermentation process. Glucosamine was determined using the method of UV-Vis spectrophotometry and the purity of the glucosamine was analysed using HPLC-ELSD method. The results show chitin fermentation with Mucor miehei was produced glucosamine from the first day of fermentation and reached the maximum yield of 90 % by mass and 88 % according to UV-Vis spectrophotometry measurement on the fourth day with the purity of 97,342 %. The production of glucosamine was confirmed by HPLC-ELSD analysis. The results show the presence of peak at retention time of 2-3 min, which is similar to the chromatogram of standard glucosamine produced by WAKO, Japan.
RIWAYAT HIDUP
Penulis dilahirkan di Tanjung Karang, pada tanggal 12 Mei 1992, yang merupakan anak pertama dari tiga bersaudara dari bapak Pungut dan ibu Sulia.
Penulis menyelesaikan pendidikan dasar di Sekolah Dasar di SD Kristen 3 Terbanggi Besar pada tahun 2004, pendidikan tingkat menengah di SMP Negeri 3 Terbanggi Besar pada tahun 2007. Kemudian penulis melanjutkan pendidikan di SMA Negeri 1 Terbanggi Besar dan menyelesaikannya tahun 2010. Pada tahun yang sama, penulis diterima sebagai mahasiswa Jurusan Kimia FMIPA Universitas Lampung melalui jalur Penelusuran Kemampuan Akademik dan Bakat (PKAB).
Selama menempuh pendidikan di kampus, penulis memperoleh Beasiswa Bidik Misi pada tahun 2010-2014. Aktivitas organisasi penulis dimulai sejak menjadi Kader Muda Himaki tahun 2010–2011. Penulis juga pernah menjadi Anggota Biro
Salam Sejahtera,
Segala Puji dan Syukur Kepada Tuhan Yang Maha Esa
Kupersembahkan karya kecil ini sebagai wujud tanda cinta, kasih,
bakti dan tanggung jawabku
Kepada
Orang-orang yang aku sayangi:
Papa dan Mama tersayang
yang senantiasa memberikan kasih sayang,
perhatian, dukungan, dan motivasi,
serta selalu mendoakan keberhasilanku
Adik-adikku, Cindy Gabrela dan William Cipta Wijaya
yang selalu berbagi kebersamaan, perhatian, dukungan, dan motivasi
Seluruh keluarga besarku yang selalu mendoaakan keberhasilanku
Sahabat dan teman-temanku yang selalu berbagi kebersamaan serta
kebahagiaan
Seseorang yang kelak akan mendampingi hidupku
Dan
MOTO
“
Banyak kegagalan dalam hidup ini dikarenakan orang-orang tidak
menyadari betapa dekatnya mereka dengan keberhasilan saat mereka
menyerah”
(Thomas Alfa Edison)
“Tugas kita bukanlah untuk berhasil. Tugas kita adalah untuk mencoba, karena di dalam mencoba itulah kita menemukan dan belajar
membangun kesempatan untuk berhasil” (Mario Teguh)
“
Keberuntungan adalah sesuatu yang terjadi ketika
kesempatan bertemu dengan kesiapan
”
SANWACANA
Puji dan syukur penulis panjatkan kepada Tuhan Yesus Kristus yang telah mencurahkan kasih dan karunia-Nya, sehingga penulis dapat menyelesaikan skripsi yang berjudul “Penetapan Waktu Inkubasi Optimum Degradasi Kitin secara Enzimatik oleh Mucor miehei dengan Metode Ultraviolet-Visible Spectrophotometry”. Skripsi ini merupakan salah satu syarat untuk memperoleh gelar Sarjana Sains di Universitas Lampung.
Penulis menyadari bahwa penyelesaian skripsi ini tidak terlepas dari bimbingan, arahan, serta bantuan dari berbagai pihak, untuk itu pada kesempatan ini penulis mengucapkan terima kasih dan penghargaan yang tulus kepada :
1. Ibu Dra. Aspita Laila, M.S., selaku Pembimbing Utama yang telah
membimbing penulis dengan sabar, memberikan banyak ilmu pengetahuan, saran, dan arahan selama penyusunan skripsi ini, terutama untuk perhatiannya yang seperti ibu sendiri sehingga penulis dapat menyelesaikan skripsi ini. 2. Bapak Prof. Dr. John Hendri, M.S., selaku Pembimbing Kedua yang telah
membimbing penulis dengan sabar, memberikan banyak ilmu pengetahuan, saran, nasihat dan terutama untuk motivasi selama penelitian hingga
3. Bapak Andi Setiawan, Ph. D., selaku Pembahas yang telah memberikan banyak ilmu pengetahuan, arahan, dan saran demi terselesainya skripsi ini. 4. Bapak Heri Satria, S. Si., M. Si., selaku Pembimbing Akademik atas saran
dan dorongan semangat bagi penulis selama ini.
5. Bapak Prof. Dr. Suharso, Ph. D., selaku Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Lampung.
6. Bapak Dr. Eng. Suripto Dwi Yuwono, M. T., selaku Ketua Jurusan Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Lampung. 7. Seluruh dosen dan staf di Jurusan Kimia Fakultas Matematika dan Ilmu
Pengetahuan Alam Universitas Lampung.
8. Kedua orang tuaku tercinta, Bapak Pungut dan Ibu Sulia, atas segala kasih sayang, doa, motivasi, dukungan, nasihat, serta saran dan kritik yang sangat berharga bagi penulis.
9. Kedua adikku, Cindy Gabrela dan William Cipta Wijaya atas kebersamaannya yang sangat berharga selama ini.
10. Apo, Asuk Nyanko, Asuk Ho, Kuku Apung, Kuku Te’in, Kuku Amoy, Kuku
Anyo, Asuk Kucai yang telah memberikan perhatian, semangat, nasihat, motivasi, dan kebersamaannya selama ini.
11. Bram Wijaya yang selalu menemani dan memberikan dukungan serta motivasinya yang sangat berharga bagi penulis.
13. Sahabat terbaikku, Faradilla Syani, S.Si., yang selalu menjadi teman disaat susah maupun senang. Terima kasih atas semua bantuan dan motivasinya yang sangat berharga selama ini.
14. Teman-teman terbaikku Funda Elisyia, S. Si., Leni Astuti, S.Si., Lailatul Hasanah, dan Fauzziyah Mu’min Shidiq, S.Si terima kasih atas kebersamaan dan bantuannya selama ini.
15. Teman-teman se-angkatan 2010, Hanif Amrulloh ZA, S. Si., Rani Anggraini, Adetia Fatmawati, Agung Supriyanto, Rahmat Kurniawan, S. Si., Purniawati, S. Si., Wynda Dwi Anggraini, S.Si, Hapin Afriyani, S.Si, Rina Rachmawati S., S.Si, Ariyanti, Kristi Arina, Fajria Faiza, Syifa Kusuma Wardani, Lolita Napatilova A. K., Surtini Karlina. S, M. Prasetio Ersa, M. Nurul Fajri, Widya Afriliani W., S.Si, Sevina Silvi, S.Si, Martha Selvina Gultom, Rini Handayani Rotua. P, Chyntia Gustianda .P, Nur Robiah, Putri Sari Dewi, Silvana Maya P., Elly Setiawati, Rully Prayetno, Indah Aprianti, Maria Anggraini, dan Juni Zulhijah, terima kasih untuk persaudaraan, cerita dan kenangan yang dibina selama menempuh pendidikan di kampus.
16. Rekan-rekan Laboratorium Biomassa, Mbak Diah, S.Si, Mbak Reni, S.Si, Mbak Tuti, S.Si, Kak Viqqi, S.Si., Mbak Widya, S. Si., Mbak Tri, Amd., Putri Heriyani Utami, S. Si., Fafai, Sifa, Noe, Indah, dan Ely terima kasih untuk semua bantuan dan kebersamaannya selama penelitian.
17. Mb Liza, Mb Nora, Paman, Mas Nomo dan Pak Gani terima kasih atas seluruh bantuan yang diberikan kepada penulis.
19. Almamater tercinta, Universitas Lampung.
20. Semua pihak yang telah membantu penulis selama kuliah, penelitian, hingga penulisan skripsi ini.
Semoga Tuhan Yang Maha Esa membalas segala kebaikan yang telah diberikan kepada penulis. Penulis sangat menyadari bahwa skripsi ini masih banyak terdapat kekurangan, namun penulis berharap skripsi ini dapat bermanfaat bagi diri penulis secara pribadi, maupun bagi pembaca.
Bandar Lampung, September 2014 Penulis
DAFTAR ISI
F. Enzim Kitindeasetilase ... 14
G. Jamur Mucor miehei ... 15
H. Fermentasi Fasa Cair Sistem Tertutup ... 17
I. Phenylisothiocyanate ... 21
J. Fourier Transform Infrared (FTIR) ... 21
K. Ultraviolet-Visible Spectrofotometry ... 23
L. High Performance Liquid Chromatography ... 27
3.1 Pembuatan Potato Extract ... 33
3.2 Media PDA (Potato Dextrose Agar) dan Pertumbuhan Mucor miehei pada Media PDA ... 34
3.3 Media PDL (Potato Dextrose Liquid) dan Pertumbuhan Mucor miehei pada Media PDL ... 34
4. Pembuatan Larutan Buffer Sitrat pH 4 ... 34
5. Pembuatan Media Inokulum Mucor miehei ... 35
6. Fermentasi Cair Sistem Tertutup (Batch) ... 36
7. Analisis Hasil Fermentasi dengan Spektrometri UV-VIS ... 36
7.1 Persiapan Standar dan Sampel Glukosamin ... 37
7.1.1 Pembuatan Standar Glukosamin ... 37
7.1.2 Pembuatan sampel Glukosamin ... 37
7.1.3 Pembuatan Larutan Stok Phenyl isothiocyanate ... 37
7.2 Pemilihan Panjang Gelombang Maksimum ... 38
7.3 Pembuatan Kurva Standar Glukosamin ... 38
7.4 Analisis Kadar Glukosamin dalam Sampel ... 38
8. Analisis Glukosamin dengan HPLC ... 39
8.1 Persiapan Standar dan Sampel Glukosamin ... 39
8.1.1 Pembuatan Standar Glukosamin ... 39
8.1.2 Pembuatan Sampel Glukosamin ... 39
8.2 Pemeriksaan Standar dan Sampel ... 39
9. Pengaruh Penambahan Jumlah Substrat Kitin, Volume Media Inokulum, dan Media Fermentasi terhadap Produksi Glukosamin ... 40
9.1 Pembuatan Media Inokulum Mucor miehei ... 40
9.2 Fermentasi Cair Sistem Tertutup (Batch) ... 41
IV. HASIL DAN PEMBAHASAN A. Pembuatan Kitin ... 42
1. Deproteinasi ... 42
2. Demineralisasi ... 43
B. Karakterisasi Kitin dengan FTIR ... 45
C. Fermentasi Kitin dengan Mucor miehei ... 47
D. Analisis Glukosamin dengan Spektrometri UV-Vis ... 52
E. Analisis Kemurnian Glukosamin dengan HPLC ... 58
DAFTAR TABEL
Tabel Halaman
1. Hasil fermentasi dengan total media 20 mL ... 73
2. Hasil fermentasi dengan total media 40 mL ... 73
3. Absorbansi larutan glukosamin standar ... 74
4. Absorbansi larutan glukosamin hasil fermentasi 20 mL ... 74
5. Absorbansi larutan glukosamin hasil fermentasi 40 mL ... 74
6. Konsentrasi terukur glukosamin hasil fermentasi 20 mL ... 75
7. Konsentrasi terukur glukosamin hasil fermentasi 40 mL ... 76
8. Jumlah bobot glukosamin hasil fermentasi 20 mL ... 77
9. Jumlah bobot glukosamin hasil fermentasi 40 mL ... 78
10. Rendemen glukosamin hasil fermentasi 20 mL ... 79
11. Rendemen glukosamin hasil fermentasi 40 mL ... 80
12. Kadar kemurnian glukosamin hasil fermentasi 20 mL ... 81
13. Kadar kemurnian glukosamin hasil fermentasi 40 mL ... 82
DAFTAR GAMBAR
Gambar Halaman
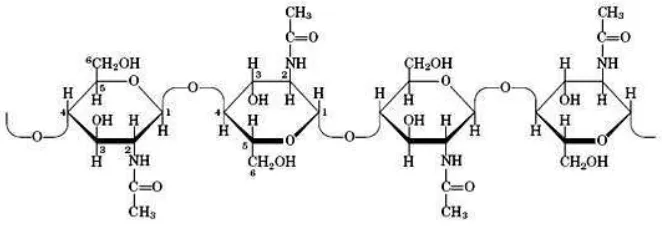
1. Struktur Kitin ... 5
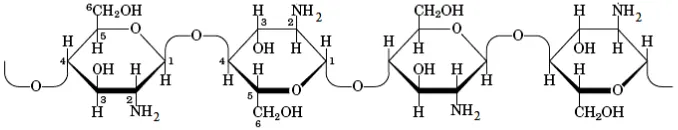
2. Struktur Kitosan ... 7
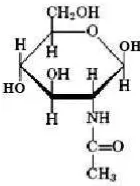
3. Struktur N-asetil glukosamin ... 8
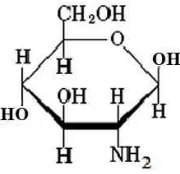
4. Struktur D-Glukosamin ... 10
5. Reaksi pemutusan ikatan β-1,4 pada bagian internal mikrofibril kitin .... 11
6. Reaksi pembebasan unit-unit diasetilkitobiose oleh enzim eksokitinase ... 11
7. Reaksi pemutusan diasetilkitobiodase, kitotriose, dan kitotetraose oleh β-1,4-N-acetylheksosaminidase ... 12
8. Jalur degradasi kitin secara enzimatik ... 13
9. Struktur fenil isotiosianat ... 21
10. Skema kerja spektrofotometri UV-Vis ... 25
11. Filtrat hasil deproteinasi ... 43
12. Filtrat hasil demineralisasi ... 44
13. Kitin hasil isolasi ... 45
14. Spektrum IR kitin standar (a) dan kitin hasil isolasi (b) ... 46
15. Reaksi pemutusan ikatan β-1,4 pada polimer kitin dengan kitinase menghasilkan N-asetilglukosamin ... 48
17. Reaksi pemutusan ikatan β-1,4 dan gugus asetil pada polimer kitin ... 48
18. Grafik hasil fermentasi (berat produk vs waktu inkubasi) ... 49
19. Glukosamin hasil fermentasi ... 50
20. Hasil uji FeSO4.7H2O dan pepton dalam buffer sitrat pH 4 ... 51
21. Hasil uji FeSO4.7H2O dan pepton dalam buffer sitrat pH 4 setelah didiamkan selama 24 jam ... 52
22. Reaksi antara glukosamin dan phenyl isothiocyanate ... 53
23. Hasil scanning panjang gelombang maksimum larutan glukosamin, phenyl isothiocyanate, dan larutan phenyl thiourea ... 54
24. Kurva standar glukosamin ... 55
25. Grafik kadar rendemen glukosamin vs waktu inkubasi ... 56
26. Grafik kadar kemurnian glukosamin vs waktu inkubasi ... 57
27. Kromatogram glukosamin ... 58
28. Grafik hasil fermentasi 40 mL (berat produk vs waktu inkubasi) ... 59
29. Grafik kadar rendemen glukosamin hasil fermentasi 40 mL ... 59
30. Isolat Mucor miehei pada media PDA ... 84
31. Isolat Mucor miehei pada media PDL ... 84
32. Isolat Mucor miehei dilihat secara mikroskopis (perbesaran 40x) ... 84
33. Isolat Mucor miehei dilihat secara mikroskopis dengan pewarnaan (perbesaran 40x) ... 85
34. Starter Mucor miehei (media inokulum) ... 85
35. Glukosamin hasil fermentasi 20 mL ... 86
I. PENDAHULUAN
A. Latar Belakang
Kitin merupakan polisakarida utama yang terdapat pada kulit udang dan cangkang kepiting, selain itu kitin juga terdapat pada fungi dan kerangka luar serangga. Kitin dapat diisolasi serta ditransformasi menjadi kitosan melalui proses deasetilasi (Cervera et al., 2004).
Kitin terdiri dari monomer N-asetilglukosamin yang dihubungkan melalui ikatan
β-(1,4)-glikosida. Struktur molekul kitin berupa rantai lurus panjang. Kitin
merupakan polimer alam terbanyak di dunia setelah selulosa (Yanming et al., 2001).
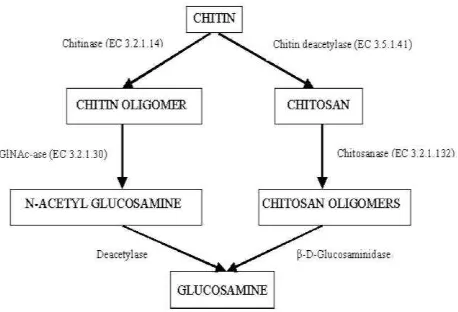
Kitin dapat didegradasi menghasilkan turunannya seperti kitosan dan glukosamin. Untuk mendegradasi kitin dapat dilakukan dengan dua metode, yaitu metode konvensional atau secara kimia dan metode enzimatik. Metode konvensional seringkali menyisahkan limbah berbahaya, sedangkan metode enzimatik lebih aman dan efektif karena menggunakan enzim spesifik, misalnya enzim kitinase dan enzim kitindeasetilase.
2
kitin deasetilase merupakan enzim kitinase. Enzim kitinase dihasilkan oleh berbagai organisme, antara lain bakteri, khamir, fungi, serangga, tumbuhan, dan vertebrata (Green et al., 2005; Gohel et al.,2006). Enzim kitinase termasuk ke dalam kelompok enzim hidrolase yang dapat mendegradasi kitin secara langsung menjadi produk dengan berat molekul kecil, yang dihasilkan oleh
mikroorganisme, baik secara intra maupun ekstraseluler (Noviendri et al., 2008). Enzim kitinase merupakan salah satu enzim kitinolitik yang dapat mendegradasi kitin, menjadi oligomer hingga dimernya (Patil et al., 2000).
Proses degradasi kitin merupakan suatu proses reaksi enzimatik yang berlangsung dalam dua jalur. Jalur pertama melibatkan enzim kitinase yang menghidrolisis
kitin secara acak pada ikatan β-(1,4) glikosida menjadi oligomer hingga dimer.
Kemudian pada jalur lain melibatkan enzim kitin deasetilase yang dapat mengkonversi kitin menjadi kitosan. Kombinasi kerja dari kedua enzim secara bersamaan akan mengkonversi kitin menjadi glukosamin.
Menurut Schomburg, dkk. (1991), Mucor merupakan salah satu mikroorganisme penghasil enzim kitinolitik. Mucor merupakan fungi tipikal saprotrop pada tanah dan serasah tumbuhan yang mampu menghasilkan enzim kitindeasetilase pada substrat kitin atau kulit Crustaceae dan media cair yang mengandung nutrien yang diperlukan (Ratledge, 1993).
Pada penelitian sebelumnya yang dilakukan oleh Siti Oktavia R. (2012), yaitu uji efektivitas fermentasi kitin menggunakan Mucor miehei untuk pembuatan
glukosamin yang dilakukan selama 5 hari waktu fermentasi menghasilkan
3
Arianta (2014), yaitu pengaruh penambahan konsentrasi inokulum dan media terhadap efektivitas fermentasi kitin dengan Mucor miehei untuk pembuatan glukosamin yang dilakukan selama 5 hari waktu fermentasi menghasilkan glukosamin sebesar 92 %. Hal ini menandakan bahwa substrat kitin yang digunakan tidak sepenuhnya terdegradasi menjadi glukosamin melainkan juga dapat menghasilkan produk oligomer kitin lainnya, seperti kitosan dan
N-asetilglukosamin. Selain itu, dalam waktu 5 hari fermentasi kitin, aktivitas enzim dalam mendegradasi kitin tidak diketahui secara tepat pada hari ke berapa bekerja lebih efektif untuk menghasilkan glukosamin dalam jumlah maksimum.
Berdasarkan hal tersebut maka pada penelitian ini akan dilakukan penetapan waktu inkubasi optimum fermentasi kitin oleh Mucor miehei berdasarkan jumlah glukosamin yang terbentuk setiap hari selama 7 hari proses fermentasi dengan harapan dapat diketahui lebih akurat jumlah rendemen glukosamin yang diperoleh serta mengetahui waktu efektif enzim kitinolitik (kitinase dan kitindeasetilase) yang dihasilkan oleh Mucor miehei bekerja dalam rentang 7 hari tersebut. Glukosamin hasil fermentasi tersebut kemudian dianalisis menggunakan spektofotometri ultraviolet-sinar tampak untuk mengetahui kadar glukosamin yang terbentuk dari masing-masing produk fermentasi setiap harinya dan analisis kemurnian glukosamin dengan menggunakan HPLC-ELSD.
B. Tujuan Penelitian
4
berdasarkan jumlah glukosamin yang terbentuk selama 7 hari proses fermentasi dan menetapkan waktu optimum degradasi kitin secara enzimatik dengan Mucor miehei.
C. Manfaat Penelitian
Penelitian ini diharapkan dapat memberikan informasi tentang waktu efektif enzim kitinase dan kitindeastilase yang dihasilkan Mucor miehei dalam
mendegradasi kitin dan waktu optimum degradasi kitin secara enzimatik dengan Mucor miehei, sehingga dapat dilakukan proses fermentasi yang lebih singkat
II. TINJAUAN PUSTAKA
A. Kitin
Kitin merupakan polimer alam terbanyak di dunia setelah selulosa (Yanming, et al. 2001). Struktur molekul kitin juga mirip selulosa. Persamaan antara selulosa
dengan kitin adalah ikatan antara monomernya yaitu ikatan glikosida pada posisi
β-(1,4). Perbedaan antara kitin dengan selulosa terletak pada atom C nomor 2
setiap monomernya. Pada selulosa terikat gugus hidroksil (–OH), sedangkan pada kitin berupa gugus asetamida (–NHCOCH3). Kitin merupakan biopolimer alam paling melimpah kedua setelah selulosa. Senyawa kitin atau ( (1-4)-N-asetil-D-glukosamin) dapat dipertimbangkan sebagai suatu senyawa turunan selulosa, dimana gugus hidroksil pada atom C-2 digantikan oleh gugus asetamido (Pujiastuti, 2001). Struktur kitin dapat dilihat pada Gambar 1.
6
Dalam hal kelarutan kitin berbeda dengan selulosa karena kitin merupakan
senyawa yang stabil terhadap pereaksi kimia. Kitin bersifat hidrofobik, tidak larut dalam air, alkohol dan hampir semua pelarut organik. Kitin dapat larut dalam asam klorida, asam sulfat dan asam fosfat pekat. Aplikasi kitin yang utama adalah sebagai senyawa pengkelat logam dalam instalasi pengolahan air bersih atau limbah, kosmetik sebagai fungisida dan fungistatik penyembuh luka. Kitin bersifat biodegradable, biocompatible, citocompatible, dan mempunyai
bioaktivitas serta daya adsorpsi yang ditentukan oleh sifat biologi dan
fisikokimiawinya (Kumirska, et al., 2011).
Proses isolasi kitin biasanya terdiri dari demineralisasi, deproteinisasi dan pemutihan (bleaching). Dua tahap pertama dapat dilakukan dengan urutan yang sebaliknya atau saling dipertukarkan tergantung kepada pemisahan karotenida dan protein dan penggunaan kitin yang dihasilkan. Kitin yang akan digunakan untuk absorben atau penjerat enzim harus didahului oleh didemineralisasi, karena pemisahan garam akan mengisi dan melindungi struktur materi kitin menjamin deasetilasi polisakarida pada penembahan alkali selama depeoteinisasi. Akan tetapi deprotenisasi harus dilakukan lebih dulu untuk memproses cangkang yang sebelumnya telah diekstraksi dengan minyak untuk memisahkan karotenoidnya (Synoweiecky and Al-Khateeb, 2003).
B. Kitosan
Kitosan disebut juga dengan β-1,4-2-amino-2-dioksi-D-glukosa. Senyawa ini
7
tidak berbau, dan memiliki sifat tidak larut dalam air, sedikit larut dalam HCl, HNO3, dan H3PO4 serta tidak larut dalam H2SO4. Kitosan memiliki struktur yang mirip dengan kitin, hanya saja gugus asetilnya telah dihilangkan dengan
menggunakan basa kuat. Adanya gugus amina dan hidroksil pada kitosan menjadikan sifatnya lebih aktif dan bersifat polikationik (Murray et al., 2003).
Di alam kitosan banyak terdapat pada dinding sel jamur, terutama pada ordo Mucorales, dimana sebagian besar penyusun komponen dinding selnya adalah kitosan dan pada Saccharomyces cerevisiae, kitosan merupakan penyusun utama pada askospora. Struktur kitosan dapat dilihat pada Gambar 2.
Gambar 2. Struktur kitosan (Murray et al., 2003)
Dewasa ini, kitosan telah banyak digunakan dalam banyak bidang, dalam kosmetik, farmasi, tambahan makanan, dan pertanian (Kannan et al., 2010). Kitosan berfungsi menyerap zat racun, mencegah plak dan kerusakan gigi, membantu mengontrol tekanan darah, memebantu menjaga pengayaan kalsium (Ca) atau memperkuat tulang, dan bersifat anti tumor (Shahidi et al., 1999).
C. N-asetilglukosamin
8
Glikosaminoglikan dan glikoprotein berperan sebagai substrat untuk perbaikan jaringan dan reaksi anti-inflamasi (Chen et al., 2010). N-asetilglukosamin atau nama lainnya adalah 2-asetamino-2-deoksi-β-D-glukosa atau 2-(asetilamino)-2-deoksi-D-glukosa memiliki rumus molekul C8H15NO6 dan bobot molekulnya 221,21 g mol-1. Secara umum, berbentuk serbuk berwarna putih dengan rasa
sedikit manis. Titik leleh nya 221 ˚C, larut dalam air dan membentuk larutan 1%
jernih (Chen et. al., 2010). N-asetilglukosamin atau GlcNac berisi campuran murni 6,9% nitrogen dengan struktur kimia yang sama dengan selulosa yang diganti oleh suatu unit asetil amino (CH3COONH2) (Pasaribu, 2004). Struktur N-asetilglukosamin dapat dilihat pada Gambar 3.
Gambar 3. Struktur N-asetilglukosamin (Anonim, 2014)
Produksi GlcNAc dari kitin melalui dua tahap. Pada awalnya kitin dipecah secara perlahan oleh endokitinase menjadi oligosakarida, selanjutnya oligosakarida dipecah secara cepat oleh eksokitinase menjadi GlcNAc (Sashiwa et al., 2002).
N-9
asetilglukosamin juga digunakan sebagai agen pemutih wajah berdasarkan mekanisme penghambatan aktivitas tirosinase, yaitu enzim utama dalam pembentukan melanin di melanosit. Sifatnya yang stabil dibandingkan glukosamin menjadikan N-asetilglukosamin berpotensi untuk dibuat dalam sediaan topikal (Shatalebi et al., 2010).
D. Glukosamin
Glukosamin (C6H13NO5) atau gula amino merupakan prekursor penting dalam sintesis biokimia dari protein glikosilasi dan lipid. Glukosamin sebagai komponen utama dari rangka luar Crustaceae, Artropoda, dan cendawan juga merupakan salah satu monosakarida yang banyak dijumpai, misalnya dalam industri,
glukosamin diproduksi dengan cara hidrolisis rangka luar crustaceae atau hirolisis kitin (Shantosh et al., 2007).
Golongan Crustaceae yang memiliki kandungan glukosamin yaitu seperti rajungan, kepiting, udang, dan cumi-cumi. Tidak hanya itu, terdapat juga pada invertebrata, seperti Artopoda, Molusca, Coelenterata, dan Nematoda serta beberapa kelas serangga dan jamur. Rangka luar golongan hewan dan jamur tersebut tersusun atas kitin. Kitin merupakan dasar pembentuk kitosan, dimana kitosan sendiri merupakan polimer dari glukosamin (D-glukosamin). Glukosamin berfungsi sebagai pengemulsi, koagulasi, pengkhelat, dan penebal emulsi
(Anonim, 2007).
10
merupakan senyawa alami yang terdapat dalam tubuh manusia yang terdiri dari glukosa dan asam amino glutamin. Selain itu glukosamin adalah unsur pokok dari GAG pada tulang rawan kartilago dan cairan sinovial. Fungsi glukosamin dalam tubuh adalah untuk memproduksi cairan sinovial yang berfungsi sebagai pelumas pada tulang rawan, sehingga pergerakan tulang menjadi baik. Kekurangan cairan sinovial dalam tubuh akan menyebabkan terjadinya gangguan sendi, seperti gerakan sendi yang kaku sehingga akan berakibat terkena penyakit osteoarthritis (Williams, 2004). Struktur glukosamin dapat dilihat pada Gambar 4.
Gambar 4. Struktur D-glukosamin (Anonim, 2014)
E. Enzim Kitinase
Kitinase (EC 3.2.1.14) merupakan enzim yang mampu menghidrolisa polimer kitin menjadi kitin oligosakarida atau monomer N-asetilglukosamin. Enzim ini dihasilkan oleh bakteri, fungi, tanaman, dan hewan. Atas dasar cara kerjanya dalam mendegradasi substrat, kitinase dibedakan ke dalam 2 kelompok utama, yaitu endokitinase dan eksokitinase. Endokitinase memotong polimer kitin secara
acak ikatan β-1,4 bagian internal mikrofibril kitin dan menghasilkan dimer,
11
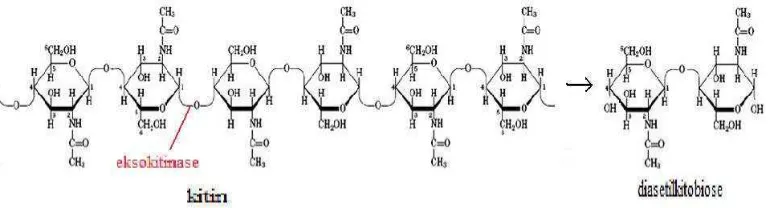
Gambar 5. Reaksi pemutusan ikatan β-1,4 pada bagian internal mikrofibril kitin oleh endokitinase (Suryanto et al., 2005)
Eksokitinase disebut juga kitobiodase atau kitin β-1,4-kitobiodase yang
memotong kitin hanya dari ujung non reduksi dan tidak secara acak serta tanpa adanya pembentukan unit-unit monosakarida atau polisakarida.
Gambar 6. Reaksi pembebasan unit-unit diasetilkitobiose oleh enzim eksokitinase (Suryanto et al., 2005)
12
Gambar 7. Reaksi pemutusan diasetilkitobiodase, kitotriose, dan kitotetraose oleh
β-1,4-N-acetylheksosaminidase menghasilkan N-asetil-D-glukosamin (Suryanto et al., 2005)
Berdasarkan homologi sekuen asam aminonya, kitinase dibedakan atas famili 18 dan 19. Famili 18 meliputi kitinase dari bakteri, fungi, serangga, tanaman (kelas III dan V), hewan (Gijzen et al., 2001) dan satu kitinase dari Streptomyces griseus (Ohno et al., 1996). Kitinase tanaman kelas I tersusun atas sekuen yang conserved pada struktur utamanya, serta domain kaya sistein pada ujung N. Kitinase kelas II secara struktural homolog dengan kelas I, tetapi tidak memiliki domain kaya sistein. Sementara, kitinase kelas III dan V tidak memiliki homologi dengan kitinase kelas I, II dan IV (Fukamizo, 2000).
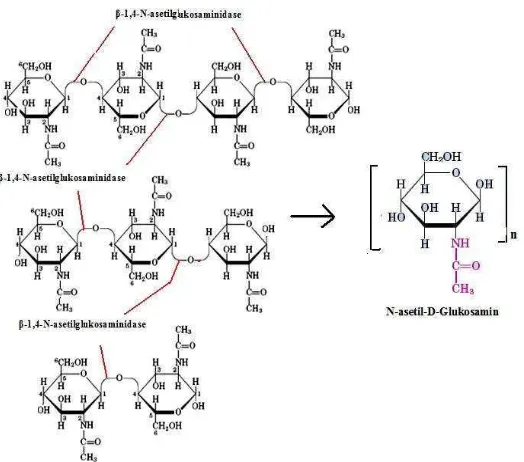
Selain oleh kitinase, polimer kitin juga bisa didegradasi oleh enzim kitin
13
kitosan kemudian dipotong-potong lagi oleh β-D-glukosaminidase menghasilkan monomer glukosamin (Patil et al., 2000).
Gambar 8. Jalur degradasi kitin secara enzimatik (Gooday, 1994)
Actinomycetes, bakteri, dan jamur merupakan organisme yang mampu
memanfaatkan kitin sebagai sumber karbon dan nitrogen. Genus bakteri yang sudah banyak dilaporkan memiliki kitinase antara lain Aeoromonas, Alteromonas, Chromobacterium, Enterobacter, Ewingella, Pseudoalteromonas, Pseudomonas,
Serratia, Vibrio, Bacillus, Pyrococcus (Suryanto et al., 2005).
14
F. Enzim Kitindeasetilase
Enzim kitin deasetilase terdapat bakteri laut, beberapa jamur dan beberapa serangga, yang mengkatalisis proses deasetilasi kitin, suatu biopolimer struktural yang ditemukan mikroorganisme laut, sel jamur dan dinding spora serta kutikula dan peritrofik matriks serangga (Zhao et al., 2010). Kitin deasetilase pertama kali ditemukan dari ekstrak jamur Mucor rouxii (Araki et al., 1975) dan lebih lanjut diketahui bahwa enzim tersebut dikaitkan dengan sintesis dinding sel dengan mengubah kitin menjadi kitosan.
Sampai saat ini sudah banyak dilakukan penelitian mengenai enzim kitin
deasetilase. Penelitian ini pada umumnya bertujuan untuk mempelajari sifat-sifat yang dimiliki oleh enzim kitin deasetilase (Zhao et al., 2010), antara lain yaitu: 1. Masa Molekular
Massa molekul untuk sebagian besar kitin deasetilase adalah dalam kisaran 25 sampai 80 kDa.
2. Suhu dan pH Optimum
Menurut hasil yang dilaporkan, pH optimum untuk kitin deasetilase
ekstraseluler adalah netral atau dalam kisaran basa 7-12, sementara sebagian kitin deasetilase intraseluler yang nilai pH optimal berada dalam kisaran 4,5-6. Suhu optimal adalah 50-60 °C.
3. Substrat Spesifik
15
pada asetil xilan, peptidoglikan, dan kitin. Hasil menunjukkan bahwa enzim kitin deasetilase tidak aktif pada peptidoglikan tetapi aktif pada asetil xilan. Hal ini menjelaskan bahwa baik kitin deasetilase dan asetil xilan esterase memiliki domain katalitik yang sama.
G. Jamur Mucor miehei
Jamur adalah sekelompok organisme yang digabungkan dalam takson Kingdom Fungi berdasarkan sistem Whitaker. Kingdom fungi mempunyai ciri khas yaitu bersifat heterotrof yang mengabsorbsi nutrien dan memiliki kitin pada dinding selnya. Jamur benang atau kapang adalah golongan fungi yang membentuk lapisan jaringan miselium dan spora yang tampak. Miseliumnya terdiri dari filamen tubular yang tumbuh yaitu hifa (Singleton dan Sainsbury, 2006).
Jamur dapat bersifat sapotrof yaitu dengan mendapatkan nutrisi dari organisme lain yang telah mati, ada juga yang bersifat parasit dengan mengisap nutrisi dari organisme lain yang hidup, atau dengan bersimbiosis mutualisme dengan satu organisme (Sadava, 2003).
16
Mucor adalah genus fungi yang berasal dari ordo Mucorales yang merupakan
fungi tipikal saprotrop pada tanah dan serasah tumbuhan yang mampu
menghasilkan enzim kitindeasetilase pada substrat kitin atau kulit Crustaceae dan media cair yang mengandung nutrien yang diperlukan (Ratledge, 1993). Mucor berkembang biak secara aseksual dengan membentuk sporangium yang ditunjang oleh batang yang disebut sporangiofor. Hifa vegetatifnya bercabang-cabang, bersifat senositik dan tidak bersepta. Ciri khas pada Mucor adalah memiliki sporangium yang berkolom-kolom atau kolumela (Singleton dan Sainsbury, 2006).
Mucor miehei sebagai salah satu anggota ordo Mucorales mempunyai talus yang
berupa miselium yang lebat. Pembiakkan aseksual dilakukan dengan spora tak berflagel (Aplanospora). Aplanospora terbentuk dalam sporangium dan
sporangium terletak pada ujung sporangiofor atau pada ujung cabang-cabangnya. Pembiakkan seksual pada Mucorales berlangsung dengan bersatunya dua
gametangium yang berinti banyak. Gametangium terbentuk pada ujung hifa atau ujung cabang hifa (Dwidjoseputro, 1976). Berikut ini merupakan taksonomi Mucor miehei (Singleton dan Sainsbury, 2006).
Kingdom : Fungi Divisi : Zygomycota Kelas : Zygomycetes Ordo : Mucorales Famili : Mucoraceae Genus : Mucor
17
H. Fermentasi Fasa Cair Sistem Tertutup (Batch)
Fermentasi merupakan suatu reaksi oksidasi reduksi yang memanfaatkan sumber energi karbon, nitrogen, dan pospor untuk membentuk senyawa dengan nilai ekonomi yang lebih tinggi serta terakumulasi dalam medium. Proses fermentasi terjadi disebabkan oleh hasil metabolisme dari organisme (Rao, 2009). Medium dalam suatu fermentasi harus mengandung substrat yang kaya akan nutrisi. Nutrisi utama yang digunakan untuk pertumbuhan mikroba adalah karbon, nitrogen, hidrogen, oksigen, dan fosfor. Faktor-faktor yang mempengaruhi pemilihan substrat untuk fermentasi (Pujaningsih, 2005) adalah:
a. Ketersediaan yang kontinyu, yaitu substrat tersedia sepanjang tahun sehingga saat disimpan dalam beberapa bulan, mutu dan komposisi relatif tetap. b. Sifat substrat harus dapat difermentasikan, contoh pada Trichoderma viridae
yang tumbuh baik hanya pada substrat selulosa (jerami padi), tetapi tidak dapat tumbuh pada bungkil kelapa.
c. Harga substrat ekonomis atau terjangkau dan dapat digunakan sesuai kebutuhan.
18
1. Jenis dan konsentrasi komponen-komponen medium dapat diatur sesuai dengan yang diinginkan.
2. Dapat memberikan kondisi yang optimum untuk pertumbuhan. 3. Pemakaian medium lebih efisien.
Kondisi yang optimum untuk suatu proses fermentasi tergantung pada jenis organismenya. Pengendalian faktor-faktor fermentasi bertujuan untuk
menciptakan kondisi yang optimum bagi pertumbuhan dan produksi metabolit yang diinginkan dari suatu organisme tertentu. Fermentasi medium cair lebih memungkinkan untuk mengendalikan faktor-faktor fisik dan kimia yang mempengaruhi proses fermentasi, seperti suhu, pH, dan kebutuhan oksigen (Rahman, 1992).
Pada fermentasi skala laboratorium yang menggunakan labu goyang (shake flask), pengendalian suhu dapat dilakukan melalui penggunaan inkubator yang
dilengkapi dengan thermostat pengatur suhu atau menggunakan penangas air (waterbath). Penambahan asam atau basa untuk mengatur pH medium pada fermentasi yang menggunakan labu goyang, dilakukan secara manual. Ke dalam medium ditambahkan larutan indikator pH yang akan menunjukkan pada saat diperlukannya penambahan asam atau basa ke dalam medium (Ton et al., 2010).
Fermentasi medium cair dapat dilakukan dengan cara fermentasi tertutup (batch culture), fermentasi kontinyu, dan fermentasi “fed batch”. Pada fermentasi
19
dengan sekian lamanya waktu fermentasi yang ditentukan maka laju pertumbuhan spesifik mikroorganisme semakin menurun sampai akhirnya pertumbuhan
terhenti. Hal ini disebabkan karena dengan semakin bertambahnya waktu
fermentasi, nutrien-nutrien esensial dalam medium semakin berkurang dan terjadi akumulasi autotoksin yang mempengaruhi laju pertumbuhan dan kombinasi dari keduanya. Dengan demikian pada fermentasi tertutup jumlah sel maksimum terletak pada saat fase stationer (Ton et al., 2010).
Menurut Mitchel et al. (2006), tahapan proses umum dalam fermentasi batch ini antara lain sebagai berikut.
1. Persiapan substrat
Substrat dapat dibuat menjadi butiran kecil. Untuk menambah ketersediaan gizi dilakukan penambahan air dan nutrisi yang disebut dengan pra-perawatan substrat.
2. Persiapan inokulum
Persiapan inokulum tergantung pada jenis mikroorganisme yang digunakan. Proses fermentasi batch ini dapat melibatkan bakteri dan jamur dengan spora merupakan hasil inokulasi. Tujuannya untuk menciptakan inokulum dengan tingkat kelangsungan hidup mikroorganisme yang tinggi.
3. Persiapan wadah
Wadah harus benar-benar bersih dan steril sebelum penambahan substrat dilakukan.
4. Inokulasi
20
5. Proses fermentasi batch
Sebelum memulai proses ini, hal yang harus diperhatikan adalah pH medium, suhu, dan waktu inkubasi.
6. Kultivasi
Tahap ini merupakan tahap pemisahan substrat padat dari medium yang dapat dilakukan dengan menggunakan kertas saring dan sentrifugasi.
Pemanfaatan fermentasi batch secara tradisional (Holker et al., 2004 dan Pandey, 2000) antara lain sebagai berikut.
1. Pembuatan minuman beralkohol seperti bir dengan cara sari buah yang diberi Saccaromyces cereviciae kemudian diinkubasikan.
2. Pembuatan Yoghurt dengan cara menfermentasikan air susu dengan bakteri bukan khamir. Biasanya menggunakan Lactobacillus bulgaricus dan Streptococcus thermopillus. Bakteri ini akan mengubah laktosa (gula susu)
menjadi asam laktat pada kondisi anaerob yang bersifat menggumpalkan kasein.
3. Keju, biasanya menggunakan bakteri dengan spesies Lactobacillus bulgaricus dan Streptococcus thermopillus. Enzim yang diperlukan untuk menghasilkan keju adalah rennet yang mengandung cymosin yang bersifat menggumpalkan kasein.
21
fermentasi batch sebagai bagian dari proses perantara, yaitu pewarnaan zat warna, biobleaching, biopulping, dan bioremediation.
I. Phenylisothiocyanate (PITC)
Rumus Kimia : C7H5NS Formulasi Kimia : C6H5NCS Massa molar : 135,18 g/mol
Kelarutan dalam air : 20 ˚C (tidak larut, penguraian) Titik leleh : -21 ˚C
Densitas : 1,13 g/cm3(20 ˚C) Titik didih : 221 ˚C
Tekanan uap : 10 hPa (20 ˚C) Titik nyala : 87 ˚C
Indeks refraktif : 1,6497 (20 ˚C, 589 nm) (Anonim, 2014)
Gambar 9. Struktur fenil isotiosianat (Anonim, 2014)
J. Fourier Transform Infrared (FTIR)
Fourier Transform Infra Red (FTIR) merupakan suatu teknik spektroskopi
unsur-22
unsur penyusunnya. Prinsip kerja dari metode ini adalah sinar yang diserap menyebabkan molekul dari senyawa tervibrasi dan energi vibrasi diukur oleh detektor serta energi vibrasi dari gugus fungsi tertentu akan menghasilkan frekuensi secara spesifik. Ada dua jenis energi vibrasi yaitu vibrasi bending dan vibrasi stretching. Vibrasi bending yaitu pergerakan atom yang menyebabkan perubahan sudut ikatan antara dua ikatan atom atau pergerakan dari seluruh atom terhadap atom lainnya. Sedangkan vibrasi stretching adalah pergerakan atom yang teratur sepanjang sumbu ikatan antara dua atom sehingga jarak antara dua atom dapat bertambah atau berkurang (Samsiah, 2009).
Spektrofotometer FTIR memiliki kesamaan dengan spektrofotometer Infrared dispersi hanya saja pengembangan pada sistem optiknya sebelum berkas sinar inframerah melewati contoh. Spektrofotometer FTIR memiliki dasar pemikiran dari persamaan gelombang yang dirumuskan oleh seorang ahli matematika dari Perancis, Jean Baptiste Joseph Fourier (1768-1830). Dari deret Fourier tersebut intensitas gelombang digambarkan sebagai daerah frekuensi atau daerah waktu. Perubahan gambaran intensitas gelombang radiasi elektromagnetik dari derah frekuensi ke daerah waktu atau sebaliknya disebut Transformasi Fourier (Fourier Transform). Pada sistem optik peralatan instrumen Fourier Transform Infrared
memiliki dasar daerah waktu yang non dispersif. Secara keseluruhan, analisis menggunakan spektrofotometer ini lebih unggul dibandingkan spektrofotometer infrared dispersi (Hsu, 1994), yaitu:
23
2. metode spektrometri FTIR memiliki sensitifitas lebih besar dibandingkan cara dispersi, karena radiasi yang masuk ke sistem detektor lebih banyak tanpa harus melalui celah.
Sebagai contoh, senyawa kitin memberikan data serapan IR pada v = 3448,5 cm-1 yang menunjukan vibrasi ulur NH amida (NH amina) dan OH; v = 2920-2873,7 cm-1 yang menunjukan vibrasi ulur CH, CH2, dan CH3; v = 1450,4 cm-1 yang menunjukan vibrasi tekuk NH; v = 1153,4 cm-1 yang menunjukan vibrasi ulur C-N; v = 1033,8 cm-1 yang menunjukan vibrasi ulur C-O; dan v = 871,8 cm-1 yang menunjukan vibrasi tekuk keluar bidang N-H (Syahmani and Sholahuddin, 2009).
K. Spektrofotometri Ultraviolet-Visible
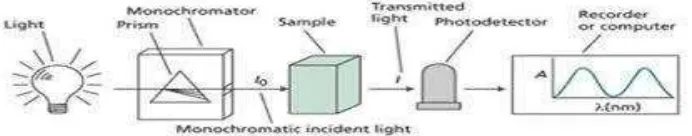
Spektrofotometer terdiri atas spektrometer dan fotometer. Spektrofotometer menghasilkan sinar dari spektrum dengan panjang gelombang tertentu dan fotometer adalah alat pengukur intensitas cahaya yang ditranmisikan atau yang diabsorpsi. Spektrofotometer tersusun atas sumber spektrum yang kontinyu, monokromator, sel pengabsorpsi untuk larutan sampel atau blangko dan suatu alat untuk mengukur pebedaan absorpsi antara sampel dan blangko ataupun
pembanding (Khopkar, 2002).
24
nampak seperti pita absorpsi berlanjut, hal ini dikarenakan gangguan yang besar dari transisi rotasi dan vibrasi pada transisi elektronik memberikan kombinasi garis yang tumpang tindih (overlapping) (Hunger and Weitkamp, 2001).
Sinar ultraviolet dan cahaya tampak memiliki energi yang cukup untuk
mempromosikan elektron pada kulit terluar ke tingkat energi yang lebih tinggi. Spektrum UV-Vis mempunyai bentuk yang lebar dan hanya sedikit informasi tentang struktur yang bisa didapatkan dari spektrum ini. Tetapi spektrum ini sangat berguna untuk pengukuran secara kuantitatif. Konsentrasi dari analit di dalam larutan bisa ditentukan dengan mengukur absorban pada panjang
gelombang tertentu dengan menggunakan hukum Lambert-Beer (Dachriyanus, 2004).
Untuk mendapatkan hasil pengukuran yang optimum, setiap komponen dari instrumen yang dipakai harus berfungsi dengan baik. Komponen-komponen spektrofotometri UV-Vis meliputi sumber sinar, monokromator, dan sistem optik (Rohman, 2007).
a. Sebagai sumber sinar; lampu deuterium atau lampu hidrogen untuk pengukuran UV dan lampu tungsten digunakan untuk daerah cahaya tampak (visible). b. Monokromator; digunakan untuk mendispersikan sinar ke dalam
komponen-komponen panjang gelombangnya yang selanjutnya akan dipilih oleh celah (slit). Monokromator berputar sedemikian rupa sehingga kisaran panjang
25
c. Optik-optik; dapat didesain untuk memecah sumber sinar sehingga sumber sinar melewati dua kompartemen, dan sebagai mana dalam spektrometer berkas ganda (double beam), suatu larutan blanko dapat digunakan dalam satu kompartemen untuk mengkoreksi pembacaan atau spektrum sampel. Yang paling sering digunakan sebagai blanko dalam spektrofotometri adalah semua pelarut yang digunakan untuk melarutkan sampel atau pereaksi.
Gambar 10. Skema kerja spektrofotometri UV-Vis (Anonim, 2014)
Ada beberapa hal yang harus diperhatikan dalam analisis dengan spektrofotometri ultraviolet (Rohman, 2007), yaitu:
1. Penentuan panjang gelombang serapan maksimum
Panjang gelombang yang digunakn untuk analisis kuantitatif adalah panjang gelombang dimana terjadi absorbansi maksimum. Untuk memperoleh panjang gelombang serapan maksimum dapat diperoleh dengan membuat kurva hubungan antara absorbansi dengan panjang gelombang dari suatu larutan baku dengan konsentrasi tertentu.
2. Pembuatan kurva kalibrasi
Dilakukan dengan membuat seri larutan baku dalam berbagai konsentrasi kemudian asorbansi tiap konsentrasi di ukur lalu dibuat kurva yang
26
3. Pembacaan absorbansi sampel
Absorbansi yang terbaca pada spektrofotometer hendaknya antara 0,2 sampai 0,8 atau 15% sampai 70% jika dibaca sebagai transmitan. Hal ini disebabkan karena pada kisaran nilai absorbansi tersebut kesalahan fotometrik yang terjadi adalah paling minimal.
Serapan cahaya oleh molekul dalam daerah spektrum ultraviolet dan visibel tergantung pada struktur elektronik dari molekul. Serapan ultraviolet dan visibel dari senyawa-senyawa organik berkaitan erat transisi-transisi diantara tingkatan-tingkatan tenaga elektronik. Disebabkan karena hal ini, maka serapan radiasi ultraviolet atau terlihat sering dikenal sebagai spektroskopi elektronik. Transisi-transisi tersebut biasanya antara orbital ikatan antara orbital ikatan atau orbital pasangan bebas dan orbital non ikatan tak jenuh atau orbital anti ikatan. Panjang gelombang serapan merupakan ukuran dari pemisahan tingkatan-tingkatan tenaga dari orbital yang bersangkutan. Spektrum ultraviolet adalah gambar antara
panjang gelombang atau frekuensi serapan lawan intensitas serapan (transmitasi atau absorbansi). Sering juga data ditunjukkan sebagai gambar grafik atau tabel yang menyatakan panjang gelombang lawan serapan molar atau log dari serapan molar, Emax atau log Emax (Sastrohamidjojo, 2001).
Spektrofotometer UV-Vis dapat melakukan penentuan terhadap sampel yang berupa larutan, gas, atau uap. Untuk sampel yang berupa larutan perlu diperhatikan pelarut yang dipakai (Mulja dan Suharman, 1995), antara lain: 1. Pelarut yang dipakai tidak mengandung sisvtem ikatan rangkap terkonjugasi
27
2. Tidak berinteraksi dengan molekul senyawa yang dianalisis. 3. Kemurniannya harus tinggi untuk analisis.
L. High Pergormance Liquid Chromatography (HPLC)
Kromatografi dapat didefinisikan sebagai pemisahan campuran berdasarkan perbedaan distribusi antara dua atau lebih fase terlarut. Contoh beberapa fase terlarut diantaranya adalah gas-cair, gas-padat, cair-cair, cair-padat, gas-cair-padat, dan cair-cair-padat. Bila fase diam berupa zat padat yang aktif, maka dikenal istilah kromatografi penyerapan (adsorption chromatography). Bila fase diam berupa zat cair, maka teknik ini disebut kromatografi pembagian (partition chromatography). Berdasarkan fase gerak yang digunakan, kromatografi
dibedakan menjadi dua golongan besar yaitu kromatografi gas (gas
chromatography) dan kromatografi cair (liquid chromatography) (Harmita, 2006).
28
Prinsip pemisahan senyawa menggunakan HPLC adalah perbedaan distribusi komponen diantara fasa diam dan fasa geraknya. Semakin lama terdistribusi dalam fasa diam, maka semakin lama waktu retensinya (Clark, 2007).
Cara yang praktis dan efisien untuk menganalisis glukosamin adalah dengan HPLC yang dilenkapi dengan ELSD (Evaportive Light Scattering Detection). Metode HPLC dengan menggunakan evaporasi detektor hamburan cahaya (ELSD) dapat meningkatkan sensitifitas, serta digunakan kolom HPLC yang sangat stabil, mudah, dan cepat (Jacyno and Dean, 2004). Detektor evaporasi hamburan cahaya ideal untuk mendeteksi analit tanpa gugus kromofor UV, karena analisis tidak bergantung pada sifat optik dari suatu senyawa. Prinsip kerja dari detektor evaporasi hamburan cahaya adalah sampel yang berasal dari HPLC dalam bentuk cair mengalami nebulisasi menjadi bentuk aerosolnya. Kemudian pelarut yang digunakan akan mengalami evaporasi (penguapan) sehingga terpisah dari sampel. Sampel yang telah terpisah ditembaki dengan sinar pada semua panjang gelombang (LS) kemudian jumlah cahaya yang dipantulkan kembali akan memberikan sinyal untuk detektor. Sinyal yang terdeteksi akan memberikan data output berupa kromatogram (Gritter et al., 1991). Adapun keunggulan dari ELSD, yaitu:
1. Sensitivitas tinggi yang memberikan respon luar biasa untuk semua senyawa, sampai ke tingkat nanogram rendah.
29
3. Real-time kontrol selama injeksi melalui software dimensi yang diprogram untuk mempertahankan sensitivitas maksimum pada pengoperasian alat. 4. Real-time pemograman gas yang menghilangkan efek peningkatan pelarut
selama elusi gradien, sangat baik untuk analisis kation.
5. Dispersi rendah dan kecepatan data output-tingkat tinggi adalah pasangan yang cocok untuk aplikasi LC cepat.
6. Reprodusibilitas super di bawah 2% memberikan hasil yang dapat diandalkan dan akurat.
7. Pemanasan dan pendinginan tabung evaporator cepat, meminimalkan waktu keseimbangan dan sampel yang lewat.
III. METODOLOGI PENELITIAN
A. Waktu dan Tempat
Penelitian ini dilaksanakan dari bulan Februari 2014 sampai dengan bulan Juni 2014 dengan tahapan kegiatan, yaitu pengambilan sampel di Gudang Lelang; Teluk Betung; pembuatan serta karakterisasi kitin dengan FTIR; dan fermentasi kitin serta analisis produk fermentasi menggunakan SpektrometerUV-VIS dan HPLC-ELSD di Laboratorium Biomassa Terpadu, Universitas Lampung.
B. Alat dan Bahan
Dalam penelitian ini alat-alat yang akan digunakan adalah peralatan gelas Pyrex, termometer, oven, neraca digital Wiggen Houser, Heating Magnetic Stirer, Laminar Air Flow, autoclave, IncubatorMemmer-Germany/INCO2, Shaker
Incubator Biosan/ES-20/60, FT-IR Varian 2000 Scimitar Series, Centrifuge
Hitachi/CF 16 RX II, Freezer dry Scanvac Coolsafe,Spektrofotometer
Ultraviolet-Visible Varian 50 Probe, HPLC (High Performance Liquid Chromatographic)
Varian 940-LC, detektor ELS Varian 385-LC, dan kolom Varian Pursuit C18 (125mm x 4,6mm).
31
kentang, agar for microbiology, dekstrosa, laktosa, bakto pepton, amonium sulfat ((NH4)2SO4), urea, kalium hidrogen sulfat (KHSO4), besi (II) sulfat heptahidrat (FeSO4.7H2O), kalsium klorida (CaCl2.2H2O), seng (II) sulfat heptahidrat (ZnSO4.7H2O), asam sitrat, natrium sitrat, isolat Mucor miehei, NaOH, HCl, kertas saring, aquades, akuabides, natrium asetat, metanol, phenyl isothiocyanate, dan indikator universal.
C. Prosedur Penelitian
1. Pembuatan Kitin
Proses pembuatan kitin dari serbuk kulit udang dilakukan secara kimiawi melalui tahapan deproteinasi yang menggunakan basa kuat dan demineralisasi yang menggunakan asam kuat (Sari, 2010).
1.1 Persiapan Sampel
32
1.2 Deproteinasi
Sebanyak 100 gram sampel serbuk kulit udang ditambahkan 1000 mL NaOH 20% ditempatkan dalam bejana tahan asam dan basa yang dilengkapi pengaduk dan termometer lalu diletakkan dalam penangas air dan dipanaskan selama 1 jam pada suhu 90 ˚C (Pariera, 2004). Setelah kondisi tercapai, dilakukan penyaringan sehingga diperoleh filtrat dan residu. Filtrat yang diperoleh kemudian diuji dengan CuSO4. Protein yang berhasil terpisahkan akan berikatan dengan Cu membentuk senyawa kompleks berwarna ungu. Adapun residunya dicuci dengan akuades hingga pH 7 yang diukur dengan indikator universal dan dikeringkan dalam oven pada suhu 60 ˚C selama 24 jam (Sari, 2010).
1.3 Demineralisasi
Kitin kasar hasil deproteinasi ditambahkan HCl 1,25 N dengan perbandingan 1:10 (w/v) dalam bejana tahan asam dan basa yang dilengkapi dengan pengaduk dan termometer dan dipanaskan di atas penangas air selama 1 jam pada suhu 90 ˚C (Pariera, 2004). Terjadinya pemisahan mineral ditunjukkan dengan terbentuknya gas CO2 yang berupa gelembung-gelembung udara pada saat penambahan larutan HCl pada sampel. Setelah kondisi tercapai, dilakukan penyaringan sehingga diperoleh filtrat dan residu. Filtrat yang diperoleh kemudian diuji dengan (NH4)2C2O4. Mineral kalsium yang berhasil terpisahkan ditandai dengan
33
universal dan dikeringkan dalam oven pada suhu 60 ºC selama 24 jam (Sari, 2010).
2. Karakterisasi Kitin dengan FT-IR
Kitin yang diperoleh setelah melalui kedua tahapan tersebut dikarakterisasi gugus fungsinya dengan spektrofotometer Fourier Transform Infrared (FT-IR). Kitin dibuat pelet dengan KBr, kemudian dilakukan scanning pada daerah bilangan gelombang antara 4000 cm-1 sampai dengan 400 cm-1 (Mardiana, 2002; Limam, 2010).
3. Persiapan Isolat Mucor miehei
3.1 Pembuatan Potato Extract
34
3.2 Media PDA (Potato Dextrose Agar) dan Pertumbuhan Mucor miehei pada Media PDA
Sebanyak 100 mLpotato extract ditambahkan 4 gram dekstrosa dan 3 gram agar dalam labu Erlenmeyer 250 mL lalu disterilisasikan dengan autoclave pada suhu
121˚C dan tekanan 2 atm selama 20 menit (DSMZ, 2013). Setelah itu media PDA
ini di-UV selama 10 menit dalam Laminar Air Flow dan dituang ke dalam cawan petri. Strain jamur Mucor miehei ditumbuhkan kurang lebih selama 5 hari sampai spora jamur ini tumbuh (Alves et al., 2005).
3.3 Media PDL (Potato Dextrose Liquid) dan Pertumbuhan Mucor miehei pada Media PDL
Sebanyak 100 mL potato extract ditambahkan 4 gram dekstrosa dalam labu Erlenmeyer 250 mL lalu disterilisasikan dengan autoclave pada suhu 121˚C dan tekanan 2 atm selama 20 menit. Setelah itu media PDL ini di-UV selama 10 menit dalam Laminar Air Flow. Spora kultur 5 hari dipisahkan dan dimasukkan dalam media PDL dan diletakkan dalam shaker incubator dengan kecepatan 175 rpm
pada suhu 30˚C selama ± 5 hari (Alves et al., 2005).
4. Larutan Buffer Sitrat pH 4
35
Sebanyak 33 mL larutan stok A (asam sitrat 0,10 M) dan 17 mL larutan stok B (natrium sitrat 0,10 M) dilarutkan dalam 100 mL akuades dalam labu volumetrik 100 mL dan kemudian dicek pH-nya. Ini merupakan larutan buffer sitrat pH 4 (Mardiana, 2002).
5. Pembuatan Media Inokulum Mucor miehei
Substrat yang digunakan adalah kitin yang telah dicuci terlebih dahulu dengan 0,5% NaOH selama satu jam berdasarkan metode Gray et al. (1978). Selanjutnya kitin disaring, dibilas dengan akuades, dan dikeringkan dalam oven pada suhu 60˚C selama 24 jam.
Sebanyak 0,1 gram substrat kitin dimasukan ke dalam 7 labu Erlenmeyer 100 mL, kemudian ditambahkan 0,01 gram laktosa; 0,03 gram bakto pepton; 0,14 gram amonium sulfat; 0,03 gram urea; 0,2 gram kalium dihidrogen sulfat; 0,03 gram besi (II) sulfat heptahidrat; 0,03 gram kalsium klorida; dan 0,029 gram seng (II) sulfat heptahidrat, serta dilarutkan dalam 10 mL buffer sitrat pH 4. Selanjutnya campuran diaduk sampai homogen lalu disterilisasi dalam autoclave pada suhu
121˚C dan tekanan 2 atm selama 20 menit. Kemudian media didinginkan pada
36
6. Fermentasi Cair Tertutup (Batch)
Sebanyak 1,00 gram substrat kitin dimasukkan masing-masing ke dalam 7labu Erlenmeyer 100 mL, kemudian ditambahkan 0,02 gram laktosa; 0,06 gram bakto pepton; 0,28 gram amonium sulfat; 0,06 gram urea, 0,4 gram kalium dihidrogen sulfat; 0,06 gram besi (II) sulfat heptahidrat; 0,06 gram kalsium klorida; dan 0,057 gram seng (II) sulfat heptahidrat, serta dilarutkan dalam 10 mL buffer sitrat pH 4. Selanjutnya campuran diaduk sampai homogen lalu disterilisasi dalam autoclave
pada suhu 121˚C dan tekanan 2 atm selama 20 menit. Kemudian media
didinginkan pada suhu ruang dalam Laminar Air Flow. Sebanyak 10 mL starter diinokulasikan ke dalam media ini dan difermentasi pada 30˚C dalam shaker-incubator dengan kecepatan 250 rpm selama 1-7 hari (Chahal et al., 2001).
Hasil dari fermentasi batch setiap 1 hari sekali dipanaskan dengan waterbath pada
suhu 70 ˚C selama 45 menit. Kemudian dicampurkan dengan 5 mL akuades
dengan membiarkan labu Erlenmeyer pada rotary shaker selama 1 jam pada 200 rpm. Campuran disaring menggunakan kertas saring dan filtrat disentrifugasi dengan kecepatan 10.000 rpm selama 20 menit pada suhu 4 ˚C. Semua supernatan (filtrat) yang diperoleh dibekukan di dalam lemari pendingin frezeer selama 24 jam, kemudian diliofilisasi dengan menggunakan frezee-dryer sampai terbentuk kristal glukosamin.
7. Analisis Glukosamin dengan Spektrometer UV-Vis
37
7.1 Persiapan Standar dan Sampel Glukosamin
7.1.1 Pembuatan Standar Glukosamin
Sebanyak 10 mg glukosamin standar dilarutkan dalam 100 mL natrium asetat 0,10 M dan didiamkan selama ±24 jam sehingga diperoleh konsentrasi akhir 100 mg/L. Kemudian larutan glukosamin standar 100 mg/L ini diencerkan hingga diperoleh konsentrasi akhir masing-masing 3 , 6 , 9 , 12 , dan 15 mg/L.
7.1.2 Pembuatan Sampel Glukosamin
Kristal-kristal glukosamin yang diperoleh dari proses fermentasi yang telah dikeringkan dengan freezedryer masing-masing dilarutkan sebanyak 10 mg dalam 10 mL natrium asetat 0,10 M dan didiamkan selama ± 24 jam sehingga diperoleh konsentrasi akhir 1000 mg/L. Kemudian larutan sampel ini masing-masing diencerkan hingga diperoleh konsentrasi akhir 100 mg/L. Kemudian masing-masing larutan sampel glukosamin 100 mg/L diencerkan dan didiamkan hingga selama 24 jam diperoleh konsentrasi akhir 12 mg/L.
7.1.3 Pembuatan Larutan Stok Phenyl isothiocyante (PITC) 100 mg/L
Sebanyak 0,92 mL phenyl isothiocyanate (PITC) pekat dimasukkan dalam labu volumetrik 10 mL dan ditambahkan metanol sampai tanda batas sehingga diperoleh konsentrasi 10.000 mg/L. Lalu 1 mL larutan PITC 10.000 mg/L diencerkan lagi dalam 10 mL metanol dalam labu volumetrik 10 mL. Kemudian 10 mL larutan PITC 1.000 mg/L diencerkan lagi dengan metanol hingga
38
7.2 Pemilihan Panjang Gelombang Maksimum
Pemilihan panjang gelombang (λ) dilakukan dengan menggunakan larutan glukosamin standar, larutan phenyl isothiocyanate, dan larutan phenyl thiourea hasil derivatisasi glukosamin dengan phenyl isothiocyanate pada konsetrasi 10 mg/L lalu dilakukan scanning menggunakan spektrofotometer UV-Vis pada rentang panjang gelombang (λ) 200-350 nm.
7.3 Pembuatan Kurva Standar Glukosamin
Larutan glukosamin standar dengan konsentrasi 3 , 6 , 9 , 12 , dan 15 mg/L
masing-masing ditambahkan phenyl isothiocyanate (konsentrasi 3 , 6 , 9 , 12 , dan 15 mg/L) dengan perbandingan campuran 1:1. Kemudian campuran larutan dikocok hingga homogen dan diukur absorbansinya dengan spektrometri UV-Vis pada panjang gelombang 273 nm.Kemudian nilai absorbansi tersebut diplot terhadap konsentrasi untuk mendapatkan kurva standar dan persamaan garis yang menunjukkan hubungan antara absorbansi dengan konsentrasi glukosamin.
7.4 Analisis Kadar Glukosamin
39
8. Analisis Glukosamin dengan HPLC
Analisis glukosamin menggunakan HPLC dilakukan untuk menguji kemurnian glukosamin yang diperoleh.
8.1 Persiapan Standar dan Sampel Glukosamin
8.1.1 Pembuatan Standar Glukosamin
Sebanyak 50 mg glukosamin standar dilarutkan dalam 25 mL akuabides. Kemudian didiamkan selama ±24 jam dan diperoleh konsentrasi akhir 2.000 mg/L.
8.1.2 Pembuatan Sampel Glukosamin
Sampel yang digunakan dalam analisis ini adalah glukosamin hasil fermentasi hari pertama dan hari keempat. Sebanyak 50 mg glukosamin hasil fermentasi hari ke-1 dan hari ke-4 masing-masing dilarutkan dalam 25 mL akuabides. Kemudian didiamkan selama ±24 jam dan diperoleh konsentrasi akhir 2.000 mg/L.
8.2 Pemeriksaan Standar dan Sampel
40
L/menit, suhu nebulisasi 40 °C, suhu evaporasi 30 °C, dan waktu run 6 menit (Jacyno and Dean, 2004).
9. Pengaruh Penambahan Jumlah Substrat Kitin, Volume Media Inokulum, dan Media Fermentasi terhadap Produksi Glukosamin
Metode yang digunakan sama seperti metode fermentasi awal. Hanya pada fermentasi ini dilakukan penambahan substrat kitin, volume media inokulum, dan media fermentasi sebanyak 2 kali fermentasi awal.
Substrat yang digunakan adalah kitin yang telah dicuci terlebih dahulu dengan 0,5% NaOH selama satu jam berdasarkan metode Gray et al. (1978). Selanjutnya kitin disaring, dibilas dengan akuades, dan dikeringkan dalam oven pada suhu
60˚C selama 24 jam.
9.1 Media Inokulum Mucor miehei
Sebanyak 0,2 gram substrat kitin dimasukan ke dalam 7 labu Erlenmeyer 100 mL, kemudian ditambahkan 0,02 gram laktosa; 0,06 gram bakto pepton; 0,28 gram amonium sulfat; 0,06 gram urea; 0,4 gram kalium dihidrogen sulfat; 0,06 gram besi (II) sulfat heptahidrat; 0,06 gram kalsium klorida; dan 0,0547 gram seng (II) sulfat heptahidrat, serta dilarutkan dalam 20 mL buffer sitrat pH 4. Selanjutnya campuran diaduk sampai homogen lalu disterilisasi dalam autoclave pada suhu
121˚C dan tekanan 2 atm selama 20 menit. Kemudian media didinginkan pada
suhu ruang dalam Laminar Air Flow. Sebanyak 1 mL kultur awal dari media PDL
diinokulasikan ke dalam media ini dan difermentasi pada 30 ˚C dalam
41
9.2 Fermentasi Cair Tertutup (Batch)
Sebanyak 2,00 gram substrat kitin dimasukkan masing-masing ke dalam 7 labu Erlenmeyer 100 mL, kemudian ditambahkan 0,04 gram laktosa, 0,12 gram bakto pepton, 0,54 gram amonium sulfat, 0,12 gram urea, 0,80 gram kalium dihidrogen sulfat, 0,12 gram besi (II) sulfat heptahidrat, 0,12 gram kalsium klorida, dan 0,11 gram seng (II) sulfat heptahidrat, serta dilarutkan dalam 20 mL buffer sitrat pH 4. Selanjutnya campuran diaduk sampai homogen lalu disterilisasi dalam autoclave
pada suhu 121˚C dan tekanan 2 atm selama 20 menit. Kemudian media
didinginkan pada suhu ruang dalam Laminar Air Flow. Sebanyak 20 mL starter
diinokulasikan ke dalam media ini dan difermentasi pada 30˚C dalam
shaker-incubator dengan kecepatan 250 rpm selama 1-7 hari (Chahal et al., 2001).
Hasil dari fermentasi batch setiap 1 hari sekali dipanaskan dengan waterbath pada
suhu 70 ˚C selama 45 menit. Kemudian dicampurkan dengan 5 mL akuades
dengan membiarkan labu Erlenmeyer pada rotary shaker selama 1 jam pada 200 rpm. Campuran disaring menggunakan kertas saring dan filtrat disentrifugasi
dengan kecepatan 10.000 rpm selama 20 menit pada suhu 4 ˚C. Semua supernatan
(filtrat) yang diperoleh dibekukan di dalam lemari pendingin frezeer selama 24 jam, kemudian diliofilisasi dengan menggunakan frezee-dryer sampai terbentuk kristal glukosamin. Setelah itu dianalisis lebih lanjut menggunakan
V. SIMPULAN DAN SARAN
A. Simpulan
Berdasarkan penelitian yang telah dilakukan, dapat diambil kesimpulan sebagai berikut.
1. Mucor miehei memiliki potensi untuk mendegradasi kitin menjadi glukosamin.
2. Efektivitas Mucor miehei dalam mendegradasi kitin dapat dilakukan selama 24 jam dengan hasil sebesar 78 %.
3. Waktu inkubasi optimum fermentasi kitin dengan Mucor miehei adalah hari keempat berdasarkan hasil setelah freeze dried dan analisis dengan
spektrofotometer UV-Vis masing-masing dengan rendemen sebesar 90 % dan 88 %.
4. Kadar kemurnian glukosamin hasil fermentasi tertinggi diperoleh pada hari kedua waktu inkubasi, yaitu sebesar 99 %.
5. Pembuktian adanya glukosamin dalam produk fermentasi dapat diamati dengan HPLC-ELSD yang menghasilkan kromatogram pada rentang waktu retensi 2-3 menit yang sama seperti pada glukosamin standar WAKO Jepang. 6. Penambahan jumlah substrat kitin, volume media inokulum, dan volume
62
7. Rata-rata kenaikan rendemen glukosamin hasil fermentasi akibat penambahan jumlah substrat kitin, volume media inokulum, dan volume media fermentasi pada penelitian ini sebesar 2 % selama 7 hari proses fermentasi.
B. Saran
Dari hasil penelitian yang diperoleh, maka pada penelitian selanjutnya disarankan: 1. Menelusuri kurva pertumbuhan Mucor miehei.
2. Perlu dicari pengganti komponen FeSO4.7H2O dan pepton pada media inokulum dan media fermentasi agar diperoleh glukosamin berwarna putih seperti glukosamin standar.
3. Perlu dilakukan penelitian lebih lanjut untuk mengetahui aktivitas enzim kitinase dan kitindeasetilase dalam rentang waktu setiap jam selama 24 jam waktu fermentasi.
4. Perlu dilakukan pengembangan proses fermentasi dengan metode isolasi dan pemurnian enzim terlebih dahulu agar diperoleh glukosamin yang lebih optimal.
5. Perlu dilakukan pengembangan metode analisis, misal dengan
DAFTAR PUSTAKA
Alves, Maria Helena, Galba M. De Campos-Takaki, Kaoru Okada, Ines Helena Ferreira Pessoa, and Adauto Ivo Milanez. 2005. Detection of extracellular protease in Mucor species. Rev Iberoam Micol. Vol. 22, pp. 114-117.
Anonim, 2014. Glucosamine and/or Chondroitin Not Effective at Reducing Radiographic Progression of Osteoarthritis of the Knee.
http://www.hopkinsarthritis.org. Diakses pada 23 Oktober 2013.
Anonim. 2007. Glukosamin untuk Osteoartritis. http://www.halalguide.info. Diakses pada 19 Oktober 2013.
Anonim. 2014. Phenyl isothiocyanate for Synthesis. http://merckmillipore.com. Diakses pada tanggal 01 Juni 2014.
Anonim. 2014. Spektrofotometri UV-Vis.
http://www.valdisreinaldo.blogspot.com. Diakses pada tanggal 21 Juni 2014.
Araki, Y. and E. Ito. 1975. A pathway of chitosan formation in Mucor rouxii. Eur. J. Biochem. Vol 55, pp. 71–78.
Ariyanta, Yahya. 2014. Pengaruh Penambahan Konsentrasi Inokulum dan Media Fermentasi terhadap Efektivitas Fermentasi Kitin dengan Mucor miehei untuk Pembuatan Glukosamin (Skripsi). Universitas Lampung. Bandar Lampung.
64
Caufrier, F., A. Martinou, C. Dupont, and V. Bouriotis. 2003. Carbohydrate esterase family 4 enzymes:Substrate specificity. Carbohydrate. Res.Vol 338, pp 687–692.
Cervera, M.F., et.al., 2004. Solid-state characterization derived from lobster chitin. Carbohydrate Polymers. Vol. 58, pp. 401-408.
Chahal, P. S., D. S. Chahal, and G. B. B. Lee. 2001. Production of Cellulose in Solid State Fermentation with Trichorderma reesi MCG 80 on Wheat Straw. Applied Biochemistry and Biotechnology. Vol. 57-58, pp. 433-441.
Chen, J. K., C. R. Shen, and C. L. Liu. 2010. N-acetylglucosamine: Production and application. Journal of Marine Drugs. Vol. 8, pp. 2493-2516.
Clark, K. 2007. Kromatografi Cair Kinerja Tinggi (HPLC). http://www.chem-is-try.org. Diakses pada tanggal 20 Juni 2014.
Cohen-Kupiec R., Chet I. 1998. The molecular biology of chitin digestion. Curr Opinion Biotechnol. Vol. 9, pp. 270-277.
Dachriyanus. 2004. Analisis Struktur Senyawa Organik secara Spektrofotometri. CV. Trianda Anugrah Pratama. Padang.
DSMZ. 2013. DSMZ: List of Media for Microorganisms.
https://www.dsmz.de/catalogues/catalogue-microorganisms/culture-technology/list-of-media-for-microorganisms.html. Diakses pada 1 Desember 2013.
Dwidjoseputro, D. 1976. Pengantar Mikologi. Alumni. Bandung. 70 halaman.
EFSA. 2009. Scientific opinion on substantiation of a health claim related to glucosamine hydrochloride and reduced rate of cartilage degeneration and reduced risk of develovment of osteoarthritis pursuant. Parma, Italy. European Food Safety Authority. Vol. 7, pp. 1358.
65
Gadgoli, C. 2006. Spectrophotometric Method for Determination of Glucosamine in Tablets. Saraswathi Vidya Bhavan’s College of Pharmacy. Sonarpada. Dombivli (East) 421-201, pp. 83-84.
Green, A. T., M. G. Healy, and A. Healy. 2005. Production of chitinolytic by Serratia marcescens QMB1466 using various chitinous substrates. Journal of Chemical Technology and Biotechnology. Vol. 80, pp. 28-34.
Gijzen M., Kuflu K., Qutob D., Chernys J. T. 2001. A Class I Chitinase From Soybean Seed Coat. J Exp Bot. Vol. 52, pp. 2283-2289.
Gohel, V., P. Vyas, and H. S. Chhatpar. 2006. Activity staining method of chitinase on chitin agar plate through polyacrylamide gel electrophoresis. African Journal of Biotechnology. Vol. 4, pp. 87-90.
Gooday, GW. 1994. The Ecology of Chitin Degradation. Plenum Press. New York. Vol. 2, pp. 387-430.
Gray, P., N. Hendy, and W. Dunn. 1978. Digestion by Cellulolytic Enzymes of Alkali Pretreated Bagasse. J. Aust. Inst. Agric. Sci, pp. 210-212.
Gritter, R. J., J. M. Bobbit, and A. E. Schwarting. 1991. Introduction to Chromatography. Halden Day Inc. Oakaland, USA.
Harmita. 2006. Buku Ajar Analisis Fisikokimia. Departemen Farmasi FMIPA Universitas Indonesia. Depok, pp. 144-161.
Holker, U., M. Hofer, and J. Lenz. 2004. Biotechnological Advantages of Laboraotory-Scale Solid State Fermentation with Fungi. Applied Microbiology and Biotechnology. Vol. 64, pp. 175-186.
Hsu, C. P. S. 1994. Infrared Spectroscopy. Handbook of Instrumental Techniques for Analytical Chemistry, pp. 123-126.
Hunger, M. and J. Weitkamp. 2001. In situ IR, NMR, EPR, and UV/Vis
66
Ismail, Ilmir A. Jutti Levita, dan Ida Musfiroh. 2010. Analisis Kuantitatif kitosan dan Hasil Hidrolisisnya Dihitung sebagai Glukosamin dengan
Spektrofotometri Ultraviolet Orde Nol dan Orde Dua. Fakultas Farmasi Universitas Padjajaran. Bandung.
Jacyno, M. and C. T. Dean. 2004. New Hight Sensitivity HPLC Assay for Glucosamine Using ELSD. http://www.dongmyung.co.kr. Diakses pada tanggal 20 Juni 2014.
Kannan M., Nesakumari M., Rajarathinam K., Singh AJAR. 2010. Production and Characterization of Mushroom Chitosan Under Solid-State Fermentation Conditions. Adv Biol Res. Vol. 4(1), pp. 10-13.
Khopkar, S. M. 2002. Konsep Dasar Kimia Analitik. Penerbit Swadaya. Jakarta.
Kumirska, J., M. X. Weinhold, J. Thoming, and P. Stepnowski. 2011. Biomedical activity of chitin/chitosan based materials influence of physicochemical properties apart from molecular weight and degree of acetylation. Polymers. Vol 3, pp. 1875-1901.
Limam, Z., Salah Selmi, Saloua Sadok, and Amor El Abed. 2010. Extraction and characterization of chitin and chitosan from crustecean by-products:
Biological and physicochemical properties. African Journal of Biotechnology. Vol. 10, pp. 640-647.
Mardiana. 2002. Studi Pendahuluan Kitosans Secara Fermentasi Menggunakan Mucor miehei pada Media Kitin dari Kulit Udang Windu (Penaeus monodon) (Skripsi). Universitas Lampung. Bandar Lampung.
Marganov. 2003. Potensi Limbah Udang sebagai Penyerap Logam Berat (Timbal, Kadmium dan Tembaga) di Perairan. Makalah Pribadi Pengantar ke Falsafah Sains (PP702). Program Pasca Sarjana S3 ITB. Bandung.
Mitchel, D., N. Krieger, and M. Berovic. 2006. Solid-State Fermentation Bioreactors. Springer-Verlag Berlin. Heidelberg.