PENGARUH FREKUENSI PERENDAMAN DALAM AIR
TAWAR TERHADAP KINERJA PERTUMBUHAN
IKAN KERAPU BEBEK Cromileptes altivelis
RISSA MARITSA OKTARINA
DEPARTEMEN BUDIDAYA PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa Skripsi yang berjudul :
PENGARUH FREKUENSI PERENDAMAN DALAM AIR TAWAR TERHADAP KINERJA PERTUMBUHAN IKAN KERAPU BEBEK Cromileptes altivelis
adalah benar merupakan hasil karya yang belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Semua sumber data dan informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir Skripsi ini.
Bogor, Januari 2009
RINGKASAN
RISSA MARITSA OKTARINA. Pengaruh Frekuensi Perendaman dalam Air Tawar terhadap Kinerja Pertumbuhan Ikan Kerapu Bebek Cromileptes altivelis. Dibimbing oleh MIA SETIAWATI dan ING MOKOGINTA.
Kegiatan dipping (perendaman) ikan kerapu bebek dalam air tawar merupakan salah satu kegiatan penanganan yang dilakukan untuk mengurangi parasit pada tubuh ikan dan diduga dapat meningkatkan nafsu makan pada ikan. Kegiatan ini dapat menyebabkan stres pada ikan yang dapat meningkatkan kebutuhan energi sehingga mengurangi tingkat pertumbuhan ikan. Oleh karena itu, penelitian ini bertujuan untuk mengetahui pengaruh frekuensi perendaman dalam air tawar yang berbeda terhadap kinerja pertumbuhan ikan kerapu bebek
Cromileptes altivelis serta mengetahui frekuensi perendaman optimum yang tidak menghambat pertumbuhan ikan.
Perlakuan yang diberikan pada penelitian ini yaitu perlakuan A : ikan direndam air tawar sebanyak 1x30 hari, perlakuan B : ikan direndam air tawar sebanyak 2x30 hari, perlakuan C : ikan direndam air tawar sebanyak 3x30 hari, dan perlakuan D : kontrol yaitu tidak direndam air tawar. Perendaman dalam air tawar dilakukan selama 20 menit. Enam ekor ikan dengan bobot berkisar 25,49 ± 0,78 gram, dipelihara dalam akuarium berukuran 40 x 60 x 45 cm yang diisi air laut dengan kisaran salinitas 29 - 31 ppt dan ketinggian air 35 cm. Ikan diberi pakan 3 kali sehari secara at satiation selama 67 hari masa pemeliharaan. Pakan yang digunakan mengandung kadar protein sebesar 46,1 % bobot kering dan energi sebesar 3148,42 kkal/kg.
PENGARUH FREKUENSI PERENDAMAN DALAM AIR
TAWAR TERHADAP KINERJA PERTUMBUHAN
IKAN KERAPU BEBEK Cromileptes altivelis
RISSA MARITSA OKTARINA
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada Fakultas Perikanan dan Ilmu Kelautan
Institut Pertanian Bogor
DEPARTEMEN BUDIDAYA PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
Judul Skripsi : Pengaruh Frekuensi Perendaman dalam Air Tawar terhadap Kinerja Pertumbuhan Ikan Kerapu Bebek
Cromileptes altivelis
Nama Mahasiswa : Rissa Maritsa Oktarina
Nomor Pokok : C 14104057
Disetujui,
Pembimbing I Pembimbing II
Ir. Mia Setiawati, M.Si. Prof. Dr. Ing Mokoginta
NIP. 131 999 588 NIP. 131 284 821
Diketahui,
Dekan Fakultas Perikanan dan Ilmu Kelautan
Prof. Dr. Ir. Indra Jaya, M.Sc. NIP. 131 578 799
KATA PENGANTAR
Puji syukur penulis panjatkan ke hadirat Allah SWT yang telah
memberikan karunia-Nya sehingga skripsi dengan judul “Pengaruh Frekuensi
Perendaman dalam Air Tawar terhadap Kinerja Pertumbuhan Ikan Kerapu Bebek
Cromileptes altivelis” ini dapat diselesaikan. Skripsi ini disusun sebagai salah satu syarat untuk memperoleh gelar sarjana pada Fakultas Perikanan dan Ilmu
Kelautan.
Penulis ingin mengucapkan terima kasih banyak kepada :
1. Ir. Mia Setiawati, M.Si. selaku dosen pembimbing I dan pembimbing
akademik, atas kesabarannya dalam memberikan bimbingan, dorongan
semangat dan pengarahannya serta saran selama penelitian dan penyusunan
skripsi.
2. Prof. Dr. Ing Mokoginta selaku dosen pembimbing II yang telah memberikan
pengarahan serta saran selama penulisan skripsi.
3. Dr. M. Agus Suprayudi dan Dr. Dinamella Wahjuningrum selaku penguji
tamu yang telah memberikan banyak saran dan kritik dalam penulisan skripsi.
4. Pak Wasjan dan Mbak Retno atas bimbingannya selama penelitian.
5. Mama, Papa, Mbak Pipit, Mas Nanda, Bu Tuti, Om Priy, dan Mas Ongko atas
dukungan dan doanya.
6. Muhammad Firly Talib yang telah memberikan dukungan, bantuan, dan kasih
sayangnya.
7. Teman-teman seperjuangan BDP’41, Agnis, Dyah, Martha, Deby, Dewi,
Nafisah, Fiska, Sarah, Ema, Andy, Hendy, Yuli, dan yang lainnya.
8. Keluarga besar BDP serta semua pihak yang telah mendukung dan membantu
dalam pelaksanaan penelitian dan penyusunan skripsi.
Penulisan skripsi ini masih jauh dari sempurna oleh karena itu saran dan
kritik penulis harapkan. Semoga skripsi ini bermanfaat dan memberikan informasi
bagi pihak yang membutuhkan.
Bogor, Januari 2009
RIWAYAT HIDUP
Penulis dilahirkan di Tangerang, Banten tanggal 31 Oktober 1986 dari
pasangan Bapak Suwarto dan Ibu Marlina. Penulis merupakan anak ketiga dari
tiga bersaudara. Pendidikan formal yang dilalui penulis adalah SMU Negeri 1
Purbalingga dan lulus tahun 2004. Pada tahun yang sama penulis lulus seleksi
masuk IPB melalui jalur Seleksi Penerimaan Mahasiswa Baru Institut Pertanian
Bogor dan memilih Program Studi Teknologi dan Manajemen Akuakultur,
Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan.
Selama mengikuti perkuliahan, penulis pernah melakukan magang di
Yohanes Fish Farm di Ciseeng, Bogor. Penulis pernah melakukan kegiatan
praktek lapang udang vaname Litopenaeus vannamei di PT. Centralpertiwi Bahari Rembang, Jawa Tengah dan PT. Surya Windu Kartika Banyuwangi, Jawa Timur.
Penulis juga pernah menjadi asisten mata kuliah Nutrisi Ikan semester genap
2008, dan mata kuliah Teknologi Pemberian dan Pembuatan Pakan semester
ganjil 2008. Selain itu, penulis juga aktif menjadi pengurus Himpunan Mahasiswa
Akuakultur (HIMAKUA) periode 2006/2007. Tugas akhir dalam pendidikan
tinggi diselesaikan dengan menulis skripsi yang berjudul “Pengaruh Frekuensi
Perendaman dalam Air Tawar terhadap Kinerja Pertumbuhan Ikan Kerapu
vii
II. TINJAUAN PUSTAKA ... 3
2.1 Kebutuhan Nutrien Ikan Kerapu Bebek ... 3
2.2 Perendaman Air Tawar ... 4
2.3 Nafsu Makan dan Lingkungan ... 6
2.3 Osmoregulasi dan Energi ... 7
2.4 Gambaran Darah Ikan ... 8
III. BAHAN DAN METODE ... 10
3.1 Waktu dan Tempat ... 10
3.2 Pemeliharaan Ikan Uji dan Pengumpulan Data ... 10
3.3 Parameter Uji ... 11
3.4 Analisa Statistik ... 13
DAFTAR TABEL
Halaman
1. Bobot rata-rata awal (Wo), Bobot rata-rata akhir (Wt), Konsumsi Pakan (KP), Laju Pertumbuhan Harian (LPH), Efisiensi Pakan (EP), Retensi Protein (RP), Retensi Lemak (RL), danSurvival Rate (SR)... 15
DAFTAR GAMBAR
Halaman
DAFTAR LAMPIRAN
Halaman
1. Hasil analisa kualitas air... 25
2. Hasil analisa proksimat bahan penyusun pakan... 25
3. Komposisi pakan uji ikan kerapu bebek Cromileptis altivelis... 25
4. Prosedur analisis proksimat (Takeuchi, 1988) ... 26
5. Prosedur analisa gambaran darah... 30
6. Prosedur pembuatan pakan uji ... 32
7. Hasil analisa proksimat ikan perlakuan... 33
8. Bobot rata-rata ikan awal dan ikan akhir ... 33
9. Konsumsi pakan selama pemeliharaan ... 33
10. Laju pertumbuhan harian ... 34
11. Efisiensi pakan ... 34
12. Retensi protein ... 34
13. Retensi lemak ... 36
14. Survival Rate... 37
PENGARUH FREKUENSI PERENDAMAN DALAM AIR
TAWAR TERHADAP KINERJA PERTUMBUHAN
IKAN KERAPU BEBEK Cromileptes altivelis
RISSA MARITSA OKTARINA
DEPARTEMEN BUDIDAYA PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa Skripsi yang berjudul :
PENGARUH FREKUENSI PERENDAMAN DALAM AIR TAWAR TERHADAP KINERJA PERTUMBUHAN IKAN KERAPU BEBEK Cromileptes altivelis
adalah benar merupakan hasil karya yang belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Semua sumber data dan informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir Skripsi ini.
Bogor, Januari 2009
RINGKASAN
RISSA MARITSA OKTARINA. Pengaruh Frekuensi Perendaman dalam Air Tawar terhadap Kinerja Pertumbuhan Ikan Kerapu Bebek Cromileptes altivelis. Dibimbing oleh MIA SETIAWATI dan ING MOKOGINTA.
Kegiatan dipping (perendaman) ikan kerapu bebek dalam air tawar merupakan salah satu kegiatan penanganan yang dilakukan untuk mengurangi parasit pada tubuh ikan dan diduga dapat meningkatkan nafsu makan pada ikan. Kegiatan ini dapat menyebabkan stres pada ikan yang dapat meningkatkan kebutuhan energi sehingga mengurangi tingkat pertumbuhan ikan. Oleh karena itu, penelitian ini bertujuan untuk mengetahui pengaruh frekuensi perendaman dalam air tawar yang berbeda terhadap kinerja pertumbuhan ikan kerapu bebek
Cromileptes altivelis serta mengetahui frekuensi perendaman optimum yang tidak menghambat pertumbuhan ikan.
Perlakuan yang diberikan pada penelitian ini yaitu perlakuan A : ikan direndam air tawar sebanyak 1x30 hari, perlakuan B : ikan direndam air tawar sebanyak 2x30 hari, perlakuan C : ikan direndam air tawar sebanyak 3x30 hari, dan perlakuan D : kontrol yaitu tidak direndam air tawar. Perendaman dalam air tawar dilakukan selama 20 menit. Enam ekor ikan dengan bobot berkisar 25,49 ± 0,78 gram, dipelihara dalam akuarium berukuran 40 x 60 x 45 cm yang diisi air laut dengan kisaran salinitas 29 - 31 ppt dan ketinggian air 35 cm. Ikan diberi pakan 3 kali sehari secara at satiation selama 67 hari masa pemeliharaan. Pakan yang digunakan mengandung kadar protein sebesar 46,1 % bobot kering dan energi sebesar 3148,42 kkal/kg.
PENGARUH FREKUENSI PERENDAMAN DALAM AIR
TAWAR TERHADAP KINERJA PERTUMBUHAN
IKAN KERAPU BEBEK Cromileptes altivelis
RISSA MARITSA OKTARINA
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada Fakultas Perikanan dan Ilmu Kelautan
Institut Pertanian Bogor
DEPARTEMEN BUDIDAYA PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
Judul Skripsi : Pengaruh Frekuensi Perendaman dalam Air Tawar terhadap Kinerja Pertumbuhan Ikan Kerapu Bebek
Cromileptes altivelis
Nama Mahasiswa : Rissa Maritsa Oktarina
Nomor Pokok : C 14104057
Disetujui,
Pembimbing I Pembimbing II
Ir. Mia Setiawati, M.Si. Prof. Dr. Ing Mokoginta
NIP. 131 999 588 NIP. 131 284 821
Diketahui,
Dekan Fakultas Perikanan dan Ilmu Kelautan
Prof. Dr. Ir. Indra Jaya, M.Sc. NIP. 131 578 799
KATA PENGANTAR
Puji syukur penulis panjatkan ke hadirat Allah SWT yang telah
memberikan karunia-Nya sehingga skripsi dengan judul “Pengaruh Frekuensi
Perendaman dalam Air Tawar terhadap Kinerja Pertumbuhan Ikan Kerapu Bebek
Cromileptes altivelis” ini dapat diselesaikan. Skripsi ini disusun sebagai salah satu syarat untuk memperoleh gelar sarjana pada Fakultas Perikanan dan Ilmu
Kelautan.
Penulis ingin mengucapkan terima kasih banyak kepada :
1. Ir. Mia Setiawati, M.Si. selaku dosen pembimbing I dan pembimbing
akademik, atas kesabarannya dalam memberikan bimbingan, dorongan
semangat dan pengarahannya serta saran selama penelitian dan penyusunan
skripsi.
2. Prof. Dr. Ing Mokoginta selaku dosen pembimbing II yang telah memberikan
pengarahan serta saran selama penulisan skripsi.
3. Dr. M. Agus Suprayudi dan Dr. Dinamella Wahjuningrum selaku penguji
tamu yang telah memberikan banyak saran dan kritik dalam penulisan skripsi.
4. Pak Wasjan dan Mbak Retno atas bimbingannya selama penelitian.
5. Mama, Papa, Mbak Pipit, Mas Nanda, Bu Tuti, Om Priy, dan Mas Ongko atas
dukungan dan doanya.
6. Muhammad Firly Talib yang telah memberikan dukungan, bantuan, dan kasih
sayangnya.
7. Teman-teman seperjuangan BDP’41, Agnis, Dyah, Martha, Deby, Dewi,
Nafisah, Fiska, Sarah, Ema, Andy, Hendy, Yuli, dan yang lainnya.
8. Keluarga besar BDP serta semua pihak yang telah mendukung dan membantu
dalam pelaksanaan penelitian dan penyusunan skripsi.
Penulisan skripsi ini masih jauh dari sempurna oleh karena itu saran dan
kritik penulis harapkan. Semoga skripsi ini bermanfaat dan memberikan informasi
bagi pihak yang membutuhkan.
Bogor, Januari 2009
RIWAYAT HIDUP
Penulis dilahirkan di Tangerang, Banten tanggal 31 Oktober 1986 dari
pasangan Bapak Suwarto dan Ibu Marlina. Penulis merupakan anak ketiga dari
tiga bersaudara. Pendidikan formal yang dilalui penulis adalah SMU Negeri 1
Purbalingga dan lulus tahun 2004. Pada tahun yang sama penulis lulus seleksi
masuk IPB melalui jalur Seleksi Penerimaan Mahasiswa Baru Institut Pertanian
Bogor dan memilih Program Studi Teknologi dan Manajemen Akuakultur,
Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan.
Selama mengikuti perkuliahan, penulis pernah melakukan magang di
Yohanes Fish Farm di Ciseeng, Bogor. Penulis pernah melakukan kegiatan
praktek lapang udang vaname Litopenaeus vannamei di PT. Centralpertiwi Bahari Rembang, Jawa Tengah dan PT. Surya Windu Kartika Banyuwangi, Jawa Timur.
Penulis juga pernah menjadi asisten mata kuliah Nutrisi Ikan semester genap
2008, dan mata kuliah Teknologi Pemberian dan Pembuatan Pakan semester
ganjil 2008. Selain itu, penulis juga aktif menjadi pengurus Himpunan Mahasiswa
Akuakultur (HIMAKUA) periode 2006/2007. Tugas akhir dalam pendidikan
tinggi diselesaikan dengan menulis skripsi yang berjudul “Pengaruh Frekuensi
Perendaman dalam Air Tawar terhadap Kinerja Pertumbuhan Ikan Kerapu
vii
II. TINJAUAN PUSTAKA ... 3
2.1 Kebutuhan Nutrien Ikan Kerapu Bebek ... 3
2.2 Perendaman Air Tawar ... 4
2.3 Nafsu Makan dan Lingkungan ... 6
2.3 Osmoregulasi dan Energi ... 7
2.4 Gambaran Darah Ikan ... 8
III. BAHAN DAN METODE ... 10
3.1 Waktu dan Tempat ... 10
3.2 Pemeliharaan Ikan Uji dan Pengumpulan Data ... 10
3.3 Parameter Uji ... 11
3.4 Analisa Statistik ... 13
DAFTAR TABEL
Halaman
1. Bobot rata-rata awal (Wo), Bobot rata-rata akhir (Wt), Konsumsi Pakan (KP), Laju Pertumbuhan Harian (LPH), Efisiensi Pakan (EP), Retensi Protein (RP), Retensi Lemak (RL), danSurvival Rate (SR)... 15
DAFTAR GAMBAR
Halaman
DAFTAR LAMPIRAN
Halaman
1. Hasil analisa kualitas air... 25
2. Hasil analisa proksimat bahan penyusun pakan... 25
3. Komposisi pakan uji ikan kerapu bebek Cromileptis altivelis... 25
4. Prosedur analisis proksimat (Takeuchi, 1988) ... 26
5. Prosedur analisa gambaran darah... 30
6. Prosedur pembuatan pakan uji ... 32
7. Hasil analisa proksimat ikan perlakuan... 33
8. Bobot rata-rata ikan awal dan ikan akhir ... 33
9. Konsumsi pakan selama pemeliharaan ... 33
10. Laju pertumbuhan harian ... 34
11. Efisiensi pakan ... 34
12. Retensi protein ... 34
13. Retensi lemak ... 36
14. Survival Rate... 37
I. PENDAHULUAN
1.1 Latar Belakang
Ikan kerapu bebek Cromileptes altivelis merupakan salah satu jenis ikan karang yang populer dan digemari konsumen, ikan ini juga memiliki nilai jual
tinggi terutama di pasar Asia. Berdasarkan informasi pasar, diperoleh data bahwa
harga kerapu bebek hidup ukuran konsumsi Rp. 350.000,00 per kilogram
(Anonimous, 2008). Permintaan ikan kerapu yang terus meningkat tidak dapat
mengandalkan hasil penangkapan dari alam, tetapi harus diupayakan melalui
usaha budidaya. Sampai saat ini usaha pembesaran budidaya ikan kerapu telah
banyak dilakukan, khususnya dalam keramba jaring apung (KJA).
Pemeliharaan ikan kerapu bertujuan untuk mencapai produksi maksimal
secara berkesinambungan, baik dalam jumlah, mutu maupun ukuran. Sebagai
salah satu spesies ikan yang dibudidayakan di perairan laut, kerapu bebek
berpotensi menghadapi masalah hama dan penyakit. Berdasarkan kondisi tersebut,
perlu diperhatikan beberapa hal yaitu pakan dan pengendalian hama dan penyakit.
Pemberian pakan yang tidak sesuai, membuat ikan mudah terserang penyakit
sehingga produksi rendah. Oleh karena itu, keseimbangan formulasi pakan serta
pemberian pakan yang sesuai dengan kebutuhan ikan sangat penting bagi
keberhasilan pemeliharaan ikan (Watanabe, 1988). Pengendalian berbagai jenis
hama dan penyakit akan membantu menunjang kelangsungan hidup dan
peningkatan produksi, kegiatan yang sering dilakukan adalah dipping
(perendaman) di air tawar. Kegiatan ini selain dapat menghilangkan parasit yang
menempel pada tubuh ikan juga diduga dapat meningkatkan nafsu makan ikan.
Perubahan salinitas media hidup ikan yang terjadi saat perendaman juga
mempengaruhi tekanan osmotik ikan secara langsung dan melibatkan penggunaan
energi yang besar untuk melakukan pengaturan kerja osmotik (Sucipto et al., 2008).
Kegiatan pemindahan ikan pada saat perendaman dalam air tawar sangat
berpengaruh terhadap keseimbangan antara air dan garam dalam tubuh ikan.
Keseimbangan ini berkaitan dengan proses osmoregulasi. Menurut Fujaya (2002),
osmoregulasi dapat terjadi karena adanya penyesuaian keseimbangan antara
2
tubuh dengan lingkungannya, dimana cairan akan mengalir dari tekanan osmosis
rendah ke tekanan osmosis yang lebih tinggi. Kegiatan perendaman dalam air
tawar dapat menyebabkan ikan laut menjadi stres karena terjadi perubahan kondisi
lingkungan yang ekstrim, dalam hal ini adalah perubahan salinitas yang drastis.
Perubahan ini mengakibatkan berubahnya pola osmoregulasi pada ikan. Pola
osmoregulasi yang terjadi pada ikan air laut adalah cairan dalam tubuh ikan akan
mengalir keluar menuju lingkungannya karena tekanan osmosis pada air laut lebih
tinggi dibandingkan dengan tekanan osmosis cairan dalam tubuh ikan, jika ikan
air laut dipindahkan pada media air tawar maka pola osmoregulasi akan terjadi
sebaliknya. Hal inilah yang menyebabkan ikan menjadi stres. Sebagai respon dari
stres ikan akan mengalami peningkatan plasma katekholamin dan kortikosteroid
yang berdampak pada penurunan kadar protein otot, peningkatan glukosa darah,
serta kandungan elektrolit tubuh menjadi tidak stabil. (Mazeaud and Mazeaud,
1977 dalam Pickering, 1981). Untuk mengatasi stres, ikan melakukan adaptasi
terhadap perubahan lingkungan dengan cara meningkatkan metabolisme tubuh.
Proses adaptasi dengan cara meningkatkan metabolisme tubuh memerlukan
banyak energi, sehingga menyebabkan pertumbuhan ikan rendah serta mudah
terserang penyakit karena sebagian besar energi digunakan untuk beradaptasi.
Perendaman ikan air laut pada air tawar diduga dapat meningkatkan nafsu
makan ikan, sehingga dapat memacu kinerja pertumbuhan ikan jika dilakukan
pada frekuensi yang tepat. Oleh karena itu, penelitian untuk melihat kinerja
pertumbuhan ikan akibat perendaman dalam air tawar perlu dilakukan.
1.2 Tujuan
Penelitian ini bertujuan untuk mengetahui pengaruh frekuensi perendaman
dalam air tawar yang berbeda terhadap kinerja pertumbuhan ikan kerapu bebek
II. TINJAUAN PUSTAKA
2.1 Kebutuhan Nutrien Ikan Kerapu Bebek
Ikan membutuhkan nutrien untuk pertumbuhan dan mendukung
kelangsungan hidupnya sama halnya seperti hewan lainnya. Nutrien dapat
diperoleh dari makanan yang dimakan oleh ikan. Makanan mengandung nutrien
(protein, lemak, karbohidrat, mineral, dan vitamin) dan merupakan sumber energi
esensial bagi pertumbuhan, reproduksi, dan kesehatan ikan. Kekurangan dari
bahan di atas dapat menyebabkan rendahnya tingkat pertumbuhan atau ikan
mudah terkena penyakit (NRC, 1993).
Kualitas dari pakan dipengaruhi oleh tingkat nutrisi yang dibutuhkan oleh
ikan karena ikan memerlukan makanan untuk mendapatkan energi, jumlah energi
berkaitan dengan efisiensi pakan (Milamena et al., 2002). Protein memegang peranan paling penting dari jaringan dan organ tubuh hewan termasuk senyawa
nitrogen seperti asam nukleat, enzim, hormon, vitamin, dan lain sebagainya.
Kebutuhan protein ikan dipengaruhi oleh berbagai faktor seperti ukuran ikan, suhu
air, feeding rate, ketersediaan dan kualitas pakan alami, kandungan energi yang dapat dicerna dari pakan dan kualitas dari protein secara keseluruhan (Furuichi,
1988). Protein yang dibutuhkan untuk pertumbuhan maksimal pada juvenil ikan
estuary grouper adalah 40 – 50% (NRC, 1993). Hal ini didukung dengan hasil penelitian yang dilakukan Williams et al (2004), bahwa kadar protein pada pakan untuk kerapu bebek ukuran fingerlings sebaiknya tidak kurang dari 44 % bobot kering.
Lemak merupakan senyawa organik kompleks yang tidak larut dalam air
namun larut dalam pelarut organik seperti eter, benzena, dan kloroform. Ikan
memanfaatkan lemak untuk energi, struktur sel, dan memelihara keutuhan dari
biomembran (Furuichi, 1988). Kadar lemak yang dibutuhkan dalam pakan kerapu
bebek berkisar antara 9 – 11 % (Laining et al., 2002 dalam Laining et al., 2004). Pada pakan, keseimbangan antara protein dan lemak sangat penting untuk
mengurangi pemanfaatan protein sebagai sumber energi sehingga dapat membuat
4
Ikan sama halnya seperti hewan lain memanfaatkan karbohidrat sebagai
salah satu sumber energi. Kemampuan ikan untuk memanfaatkan karbohidrat
sebagai sumber energi masih lebih rendah dibandingkan hewan lain dan
kemampuan ikan omnivora untuk memanfaatkan karbohidrat lebih tinggi
dibandingkan dengan ikan karnivora seperti ikan kerapu. Kebutuhan karbohidrat
yang optimal pada ikan omnivora berkisar 30 – 40% sedangkan ikan karnivora
berkisar 10 – 20% (Furuichi, 1988). Namun, kerapu bebek mampu memanfaatkan
glukosa sebagai sumber karbohidrat sebesar 16 % (Usman, 2002 dalam Laining et al., 2004).
Vitamin penting untuk pertumbuhan, kesehatan, reproduksi, dan
pemeliharaan, namun dalam pakan dibutuhkan dengan jumlah yang sedikit
berkisar antara 0,2 – 0,5 % (Lovell, 1989). Secara umum, mineral bermanfaat
untuk menjalankan struktur komponen jaringan, berfungsi sebagai metabolisme
sel, dan mempunyai peran yang penting dalam osmoregulasi dan mempertahankan
keseimbangan asam basa (Jobling, 2001).
2.2 Perendaman dalam Air Tawar
Kegiatan dipping (perendaman) merupakan salah satu kegiatan penanganan yang dilakukan dengan cara merendam ikan ke dalam air tawar yang
bertujuan untuk mengurangi parasit pada tubuh ikan. Kegiatan ini biasa dilakukan
di keramba jaring apung (KJA) secara rutin, pada umumnya setiap seminggu
sekali. Lamanya perendaman ikan disesuaikan dengan kepadatan ikan serta
penggunaan aerasi. Ikan yang akan direndam diangkat dari wadah
pemeliharaannya dan ditempatkan pada wadah berupa ember atau sterofoam yang
diisi air tawar. Berdasarkan informasi dari petani ikan di Kepulauan Seribu, ikan
dengan kepadatan tinggi dan direndam tanpa aerasi dilakukan selama ± 3 menit,
sedangkan jika menggunakan aerasi direndam selama ± 5 menit. Namun jika
dilakukan pada kepadatan rendah perendaman dapat dilakukan lebih lama.
Kegiatan perendaman sangat berkaitan dengan handling (penanganan) seperti penangkapan dan pemindahan ikan serta pembiusan ikan yang
berpengaruh terhadap keseimbangan antara air dan garam dalam tubuh ikan
5
secara fisiologi dengan meningkatnya plasma katekholamin dan kortikosteroid
yang berdampak pada kadar protein otot rendah, glukosa darah meningkat, serta
kandungan elektrolit tubuh tidak stabil. (Mazeaud dan Mazeaud, 1981). Stres
dalam bentuk apapun dapat meningkatkan kebutuhan energi ikan serta
mengurangi tingkat pertumbuhan ikan. Energi yang digunakan untuk mengatasi
stres tidak dapat digunakan lagi untuk pertumbuhan. Stres secara kimia maupun
fisik dapat disebabkan oleh akumulasi sisa feses, oksigen rendah, kepadatan,
penanganan, polusi air, kualitas pakan yang kurang baik, dan lain-lain (Halver,
1988).
Respon hematologi yang terjadi pada saat ikan air laut ditangkap dan
diberikan perlakuan stres terjadi sangat cepat. Pada kondisi stres, ikan ini
cenderung untuk meningkatkan ion-ion dan cairan osmolaritas (Wells et al, 1984 dalam Montgomery dan Wells, 1993). Beberapa indikator stres dini dapat dilihat
dari kadar glukosa darah, persentase hemoglobin (Smith dan Ramos, 1976 dalam
Mazeaud dan Mazeaud, 1981). Semua hal di atas dapat menyebabkan
pertumbuhan ikan rendah serta mudah terserang penyakit serta kematian
(Mazeaud dan Mazeaud, 1981).
Perpindahan ikan salmon dari air laut ke air tawar tentu saja meningkatkan
afinitas oksigen dari darah (Maxime et al, 1990 dalam Jensen, 1993). Air laut memiliki massa jenis oksigen yang lebih rendah dibandingkan dengan air tawar
disebabkan karena adanya stimulus ventilasi yang meningkat. Perubahan salinitas
juga dapat menimbulkan efek terhadap konduksi difusi dari insang. Pemindahan
ikan dari air laut ke air tawar secara cepat telah dipelajari secara intensif pada
beberapa jenis ikan stenohaline dengan tujuan untuk mengetahui perpindahan garam yang terjadi di dalam tubuh yang ditandai dengan berkurangnya kadar ion
Na+ dan Cl-. Sebagai contoh, ikan laut stenohaline, Holocanthus ciliaris dapat bertahan hidup selama beberapa minggu pada air tawar yang telah ditingkatkan
konsentrasi kalsiumnya sekitar 5 – 25 mm/liter (Evans, 1975 dalam Eddy, 1981).
Pengembangan dan pengaplikasian uji perendaman ikan air laut pada air tawar
dilakukan untuk melihat kondisi akibat pengaruh dari stressor terhadap
kemampuan osmoregulasi ikan. Kegunaan perendaman air tawar dengan adanya
6
untuk menentukan kondisi yang lebih baik serta meningkatkan kelangsungan
hidup ikan dalam menghadapi perubahan lingkungan (Wedemeyer dan McLeay,
1981).
2.3 Nafsu Makan dan lingkungan
Nafsu makan merupakan keinginan untuk memuaskan atau memenuhi
kebutuhan yang diperlukan oleh tubuh untuk memakan suatu makanan. Nafsu
makan berkaitan erat dengan pertumbuhan. Pada ikan, nafsu makan dipengaruhi
oleh faktor abiotik dan biotik. Faktor abiotik yang berpengaruh terhadap nafsu
makan ikan antara lain cahaya, suhu, oksigen, pH, salinitas, senyawa nitrogen,
polutan, dan zat yang beracun. Sedangkan faktor biotik antara lain kepadatan
populasi, struktur sosial seperti keseragaman ukuran serta seks rasio, predator, dan
gangguan dari manusia (Kestemont dan Baras, 2001).
Faktor suhu sangat penting berperan dalam meningkatkan nafsu makan
ikan, makanan yang dimakan oleh ikan akan meningkat seiring dengan
peningkatan suhu dan akan mencapai puncaknya lalu turun secara dramatis
kurang lebih sebelum mencapai suhu optimal (Brett, 1979 dalam Kestemont dan
Baras, 2001). Ikan sangat didominasi oleh metabolisme aerob, maka kandungan
oksigen terlarut merupakan faktor pembatas lingkungan yang paling potensial
(Fry, 1971 dalam Kestemont dan Baras, 2001), khususnya pada suhu tinggi
(Jobling, 1997 dalam Kestemont dan Baras, 2001). Konsentrasi yang tidak
mematikan dari senyawa nitrogen (nitrit), bergantung pada suhu, oksigen, dan pH
yang dapat berpengaruh terhadap struktur insang dan epidermal mucus (Kamstra
et al, 1996 dalam Kestemont dan Baras, 2001), namun efeknya terhadap pakan masih jarang ditemukan. Sedangkan efek yang disebabkan oleh pH tergantung
pada penyesuaian diri ikan. Efek langsung dari kepadatan yaitu perubahan tingkah
laku yang disebabkan kebutuhan energi yang sangat diperlukan untuk pertahanan
terhadap kompetitor.
Faktor biotik seperti struktur sosial tidak hanya dipengaruhi oleh
kepadatan populasi ikan tetapi juga keseragaman ukuran ikan dan seks rasio
7
dipengaruhi oleh hal yang rutin dilakukan, seperti penanganan ikan, pembersihan
wadah pemeliharaan, tindakan pencegahan dan pengobatan penyakit, serta
pengadaan pakan.
2.4 Osmoregulasi dan energi
Perubahan lingkungan yang terjadi secara tiba-tiba dapat menimbulkan
stres. Salah satunya dilihat dari keseimbangan air dan garam dalam tubuh ikan
yang mempengaruhi kondisi fisiologi yang menyebabkan stres. Sebagian besar
hewan akuatik mempertahankan keseimbangan antara air dan garam dalam tubuh
agar tetap stabil dengan melakukan osmoregulasi. Osmoregulasi merupakan upaya
hewan air untuk mengontrol keseimbangan air dan ion antara di dalam tubuh dan
lingkungannya melalui mekanisme pengaturan tekanan osmose (Fujaya, 2002).
Jika kandungan elektrolit didalam tubuhnya berbeda dengan lingkungan, maka
dilakukan beberapa mekanisme regulasi untuk mempertahankan keseimbangan air
dan garam tersebut. Perpindahan ikan air laut ke air tawar secara cepat dapat
menyebabkan stres. Efek dari stres dapat membuat proses osmoregulasi
mengalami gangguan karena perubahan keseimbangan air dan garam (Irianto,
2005). Perubahan yang terjadi pada proses osmoregulasi menyebabkan
peningkatan kebutuhan energi ikan untuk beradaptasi dengan perubahan
lingkungan dan mengurangi alokasi energi untuk pertumbuhan (Halver, 1988).
Energi tersebut digunakan untuk mengatur menjaga agar osmoregulasi berjalan
normal.
Ikan air laut yang kehilangan banyak air secara osmotik melalui insang,
harus melepaskan garam banyak meminum air laut dan memproduksi sedikit urine
sebagai cara beradaptasi. Mekanisme pengaturan garam dan ion bagi ikan
stenohaline sangat tidak fleksibel karena dibatasi oleh media hidupnya, baik ikan air laut maupun air tawar. Ikan air laut biasanya dapat mentolerir salinitas
dibawah media hidupnya namun harus lebih tinggi dibandingkan dengan salinitas
darahnya. Sedangkan ikan air tawar biasanya dapat mentolerir salinitas dibawah
salinitas darahnya. Beberapa ikan estuari dan ikan yang bermigrasi, seperti
salmon, mampu beradaptasi terhadap perubahan salinitas dari air tawar ke air laut
8
2.4 Gambaran Darah Ikan
Parameter darah merupakan salah satu indikator adanya perubahan kondisi
pada kesehatan ikan, baik karena faktor infeksi akibat mikroorganisme atau
karena faktor non infeksi oleh lingkungan, nutrisi, dan genetik. Darah ikan
tersusun dari sel-sel darah yang tersuspensi dalam plasma dan diedarkan ke
seluruh jaringan tubuh melalui sistem sirkulasi tertutup. Pada tubuh ikan, darah
berfungsi untuk mengedarkan nutrien yang berasal dari pencernaan makanan ke
sel-sel tubuh, menyuplai oksigen ke sel-sel dan jaringan tubuh serta mengangkut
hormon dan enzim ke organ yang membutuhkan (Lagler et al., 1977 dalam Indriastuti, 2006). Menurut Fujaya (2002), darah berfungsi sebagai pembawa
oksigen, karbondioksida, sari-sari makanan maupun hasil metabolisme. Pada ikan,
darah mengalir dengan membawa oksigen dari insang ke jaringan dan ion seperti
Na+ dan Cl- yang berperan dalam osmoregulasi. Selain itu, darah juga membawa
hormon dan vitamin, terutama dalam plasma.
Sel-sel darah ikan terdiri dari sel darah merah (eritrosit), sel darah putih
(leukosit), dan keping darah (trombosit). Jumlah dan proporsi komponen
masing-masing darah relatif stabil bila ikan dalam keadaan sehat. Menurut Amlacher
(1970) dalam Setiawati dkk (2007), darah dapat mengalami perubahan yang serius
khususnya bila terkena infeksi. Selain itu, kekurangan atau kelebihan makanan
dapat mempengaruhi komposisi darah (perubahan pada level protein total, kadar
hemoglobin, dan total eritrosit).
Eritrosit pada ikan merupakan sel darah dengan jumlah terbanyak. Eritrosit
ikan berbentuk oval sampai bundar berukuran 7-36 mikron dengan inti bulat telur
yang berfungsi mengikat oksigen dan sitoplasma merah muda (Lagler et al., 1977 dalam Indriastuti, 2006). Umumnya, ikan memiliki jumlah eritrosit berkisar 1,05 x
106– 3,0 x 106 sel/mm3(Roberts (1978) dalam Irianto (2005)). Rendahnya jumlah
eritrosit menunjukkan ikan menderita anemia atau kerusakan ginjal. Sedangkan
tingginya jumlah eritrosit menandakan ikan dalam kondisi stres (Nabib dan
Pasaribu, 1989). Menurut Dellman dan Brown (1989) dalam Ashry (2007),
faktor-faktor yang mempengaruhi jumlah eritrosit adalah jenis kelamin, perbedaan induk
9
Hemoglobin merupakan suatu molekul protein di dalam eritrosit yang
terdiri atas protoporfirin, globin, dan besi bervalensi 2 (ferro). Hemoglobin dalam
darah merupakan alat transportasi oksigen dan karbondioksida. Fungsi utama dari
hemoglobin adalah mengikat oksigen yang kemudian digunakan untuk proses
katabolisme sehingga dihasilkan energi serta mencegah keasaman darah yang
terlalu tinggi (Lagler et al., 1977 dalam Indriastuti, 2006). Kadar hemoglobin normal pada ikan menurut Nabib dan Pasaribu (1989) berkisar antara 8 – 9 gr %,
III. BAHAN DAN METODE
3.1 Waktu dan Tempat
Penelitian ini dilaksanakan mulai bulan Februari 2008 sampai Juni 2008.
Analisis proksimat ikan dan pakan uji dilakukan di Laboratorium Nutrisi Ikan dan
analisis kualitas air dilakukan di Laboratorium Lingkungan, Departemen
Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian
Bogor. Sedangkan pemeliharaan ikan dan perlakuan perendaman dalam air tawar
dilakukan di Pusat Studi Ilmu Kelautan (PSIK) IPB, Ancol, Jakarta Utara.
3.2 Pemeliharaan Ikan Uji dan Pengumpulan Data
Ikan uji yang digunakan adalah ikan kerapu bebek berasal dari Balai
Budidaya Laut Lampung dengan bobot berkisar 25,49 ± 0,78 gram. Setelah masa
aklimatisasi untuk adaptasi, ikan dipuasakan selama 24 jam untuk menghilangkan
sisa pakan dalam saluran pencernaan, kemudian ikan ditimbang dan dimasukkan
ke dalam akuarium uji. Jumlah ikan per akuarium adalah 6 ekor. Ikan dipelihara
dalam 12 akuarium yang berukuran 40 x 60 x 45 cm yang diisi air laut dengan
kisaran salinitas 29 - 31 ppt dan ketinggian air 35 cm. Wadah pemeliharaan
disusun dalam satu sistem resirkulasi dan satu buah bak tandon. Suhu air dijaga
dengan menggunakan thermostat yang dipasang pada tandon dan kondisi air di akuarium diukur setiap hari dengan thermometer, yaitu kisaran suhu 28 - 32oC. Hasil analisa kualitas air terdapat pada Lampiran 1.
Ikan diberi pakan berbentuk pellet sebanyak 3 kali sehari pada pukul
06.00, 12.00, dan 18.00 secara at satiation selama masa pemeliharaan. Pakan yang digunakan mengandung kadar protein sebesar 46,1 %, lemak 13,82 %, abu 13,14
%, serat kasar 0,64 %, BETN 16,62 %, energi sebesar 3148,42 kkal/kg, serta C/P
rasio sebesar 6,83 kkal/gr protein. Komposisi pakan uji didasarkan atas kebutuhan
dasar nutrisi ikan kerapu. Hasil analisa bahan penyusun pakan dan komposisi
pakan uji masing-masing terdapat pada Lampiran 2 dan Lampiran 3. Selain itu,
untuk menjaga kualitas air tetap baik dilakukan penyiponan setiap hari dan
pergantian air sebanyak 25 % dari volume air akuarium secara teratur setiap 2 hari
11
Terdapat 3 macam perlakuan perendaman ikan uji di air tawar selama 20
menit, masing-masing yaitu perlakuan A dengan frekuensi perendaman air tawar
sebanyak 1x30 hari, perlakuan B dengan frekuensi perendaman air tawar
sebanyak 2x30 hari, setiap 15 hari sekali, dan perlakuan C dengan frekuensi
perendaman air tawar sebanyak 3x30 hari setiap 10 hari sekali, serta D sebagai
kontrol yang tidak diberikan perlakuan perendaman air tawar selama
pemeliharaan. Perendaman ikan dilakukan dengan air tawar sebanyak 5 liter.
Pemeliharaan ikan dilakukan selama 67 hari. Penimbangan jumlah pakan
yang diberikan dilakukan per 10 hari atau sesudah diberikan perlakuan untuk
mengetahui nafsu makan ikan. Sampling dilakukan pada awal dan akhir
pemeliharaan dengan cara menimbang bobot ikan dan menghitung bobot
biomassa pada masing-masing perlakuan. Pada akhir perlakuan diambil ikan
sampel untuk analisa proksimat guna mengetahui komposisi tubuh ikan untuk
mengetahui retensi protein dan retensi lemak. Prosedur analisa terdapat pada
Lampiran 4.
Pengambilan sampel darah dilakukan pada akhir masa pemeliharaan untuk
mengetahui gambaran darah ikan pada ikan sampel dari setiap perlakuan.
Prosedur analisa gambaran darah terdapat pada Lampiran 5.
3.3 Parameter Uji
3.3.1 Konsumsi Pakan
Konsumsi pakan dihitung dengan cara menimbang total pakan yang
dikonsumsi oleh ikan selama perlakuan pemberian pakan.
3.3.2 Laju Pertumbuhan Harian
Laju pertumbuhan harian dihitung berdasarkan persamaan :
LPH (%) =
Keterangan : Wt = bobot rata-rata individu pada waktu t (gram)
o
W = bobot rata-rata individu pada waktu awal (gram)
12
3.3.3 Survival Rate (SR)
Tingkat Kelangsungan Hidup dihitung dengan menggunakan rumus :
%
Keterangan : Nt = jumlah ikan uji pada akhir pengamatan (ekor)
No = jumlah ikan uji pada awal pengamatan (ekor)
3.3.4 Efisiensi Pakan (EP)
Efisiensi pakan dihitung dengan menggunakan rumus :
EP =
Keterangan : Wt = bobot total ikan pada akhir pemeliharaan
Wo= bobot total ikan pada awal pemeliharaan
Wd = bobot total ikan yang mati selama masa pemeliharaan
(gram)
F = jumlah pakan yang diberikan (gram) 3.3.5 Retensi Lemak
Retensi lemak dihitung dengan menggunakan rumus :
RL (%) =
LI F
x 100%
Keterangan : F = jumlah lemak tubuh pada akhir pemeliharaan
I = jumlah lemak tubuh pada awal pemeliharaan
L = jumlah lemak yang dikonsumsi ikan 3.3.6 Retensi Protein
Retensi protein dihitung dengan menggunakan rumus :
RP (%) =
PI F
x 100%
Keterangan : F = jumlah protein tubuh pada akhir pemeliharaan
I = jumlah protein tubuh pada awal pemeliharaan
13
3.3.7 Gambaran Darah
Parameter gambaran darah yang diamati adalah total eritrosit dan kadar
hemoglobin.
3.4 Analisa Statistik
Data yang diperoleh dianalisis menggunakan Rancangan Acak Lengkap
(RAL) dengan 4 perlakuan dan masing-masing perlakuan memiliki 3 ulangan.
Sebagai perlakuan yaitu frekuensi perendaman dalam air tawar yang berbeda.
Parameter yang diuji yaitu konsumsi pakan, laju pertumbuhan harian, survival rate, efisiensi pakan, retensi lemak, dan retensi protein. Pengaruh perlakuan terhadap parameter uji diketahui dengan menggunakan analisis ragam dengan
tingkat kepercayaan 95% dan dilanjutkan dengan uji Duncan.
3.5 Analisa Kimia
Analisa kimia yang dilakukan adalah analisa proksimat. Analisa proksimat
dilakukan terhadap pakan, tubuh ikan sebelum perlakuan, dan tubuh ikan setelah
perlakuan. Analisa proksimat pakan yang dilakukan yaitu analisa kadar protein,
kadar air, kadar abu, kadar lemak, serat kasar. Sedangkan analisa proksimat ikan
yang dilakukan antara lain analisa kadar protein, kadar lemak, dan kadar air
(Takeuchi, 1988). Parameter kualitas air yang diukur meliputi suhu, salinitas, pH,
IV. HASIL DAN PEMBAHASAN
4.1 Hasil
Hasil yang diperoleh selama pemeliharaan ikan kerapu bebek yang
diberikan perlakuan perendaman dalam air tawar dilihat dari status total eritrosit
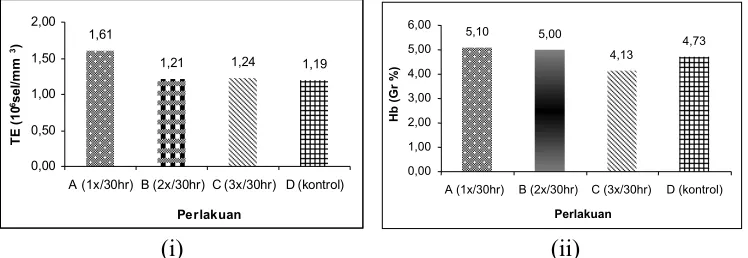
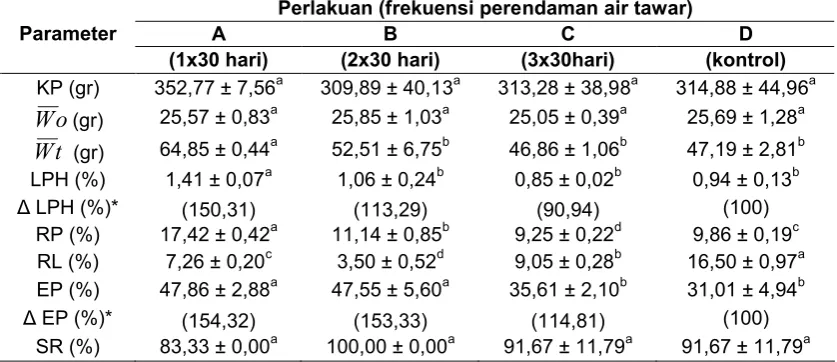
dan kadar hemoglobin dalam darah terdapat pada Gambar 1.
1,61
A (1x/30hr) B (2x/30hr) C (3x/30hr) D (kontrol)
Perlakuan
Gambar 1. Nilai rataan gambaran darah selama pemeliharaan (i) total eritrosit (106sel/mm3)
(ii) kadar hemoglobin (Gr %)
Pengamatan yang dilakukan pada saat ikan kerapu bebek Cromileptes altivelis diberikan perlakuan perendaman air tawar yaitu keluarnya lendir ikan yang berlebih serta tingkah laku ikan yang diam tidak banyak bergerak. Hasil
pengamatan darah yang terdapat pada Gambar 1 (i), dapat dilihat bahwa total
eritrosit setelah pemeliharaan, baik yang diberikan perlakuan perendaman air
tawar dengan frekuensi 1x30 hari, 2x30 hari, 3x30 hari, dan kontrol memiliki
kisaran nilai rataan yang berbeda. Total eritrosit tertinggi terdapat pada perlakuan
dengan frekuensi 1x30 hari dan total eritrosit paling rendah terdapat pada
perlakuan kontrol. Kadar hemoglobin pada Gambar 1 (ii) memiliki nilai tertinggi
pada perlakuan perendaman air tawar dengan frekuensi 1x30 hari dan kadar
hemoglobin terendah terdapat pada perlakuan perendaman air tawar dengan
frekuensi 3x30 hari.
Hasil yang didapat setelah pemeliharaan ikan uji selama 67 hari yang
diberikan perlakuan perendaman dalam air tawar terhadap parameter kinerja
pertumbuhan terdapat pada Tabel 1.
5,10 5,00
15
Tabel 1. Bobot rata-rata awal (Wo), Bobot rata-rata akhir (Wt), Konsumsi Pakan (KP), Laju Pertumbuhan Harian (LPH), Efisiensi Pakan (EP), Retensi Protein (RP), Retensi Lemak (RL), danSurvival Rate (SR)
Ket : Huruf superscript dibelakang nilai standar deviasi yang sama menunjukkan pengaruh perlakuan yang tidak berbeda nyata (P>0,05) dengan selang kepercayaan 95%.
* menunjukkan perbandingan prosentase perubahan nilai rataan (Δ) perlakuan terhadap kontrol pada parameter uji laju pertumbuhan harian (LPH) dan efisiensi pakan (EP)
Perlakuan perendaman ikan kerapu bebek di air tawar memberikan
pengaruh yang tidak berbeda nyata (P>0,05) terhadap parameter konsumsi pakan
(KP), namun memberikan pengaruh yang berbeda nyata (P<0,05) terhadap bobot
rata-rata akhir, Wt(Tabel 1). Berdasarkan hasil tersebut dapat dilihat bahwa
perlakuan perendaman ikan uji di air tawar dengan frekuensi 1x30 hari memiliki
bobot rata-rata yang lebih tinggi dibandingkan dengan perlakuan frekuensi
perendaman ikan uji di air tawar 2x30 hari dan 3x30 hari, begitu juga jika
dibandingkan dengan kontrol. Selain itu, nilai laju pertumbuhan harian (LPH)
lebih tinggi pada perlakuan dengan frekuensi perendaman dalam air tawar 1x30
hari dibandingkan dengan perlakuan lainnya dan kontrol. Retensi protein (RP)
antar perlakuan perendaman dalam air tawar dengan frekuensi 1x30 hari, 2x30
hari, dan 3x30 hari serta kontrol memiliki nilai yang berbeda nyata (P<0,05).
Begitu juga dengan nilai retensi lemak (RL) yang berbeda nyata antar perlakuan
(P<0,05). Nilai efisiensi pakan (EP) antara perlakuan perendaman dalam air tawar
dengan frekuensi 1x30 hari dan 2x30 hari lebih tinggi daripada perlakuan 3x30
hari dan kontrol.
Perlakuan (frekuensi perendaman air tawar)
A B C D
Parameter
(1x30 hari) (2x30 hari) (3x30hari) (kontrol)
16
Prosentase peningkatan pertumbuhan (ΔLPH)pada perlakuan perendaman
ikan uji di air tawar dibandingkan dengan kontrol menunjukkan peningkatan
pertumbuhan yang lebih cepat. Nilai prosentase ini dapat dilihat pada Tabel 1.
Nilai terkecil untuk laju pertumbuhan harian maupun efisiensi pakan terdapat
pada perlakuan dengan frekuensi perendaman ikan uji di air tawar 3x30 hari.
Perbandingan prosentase perubahan nilai rataan antara perlakuan dibandingkan
dengan kontrol memiliki perbedaan nilai paling tinggi pada perlakuan perendaman
ikan uji di air tawar dengan frekuensi 1x30 hari yaitu sebesar 150,31% untuk laju
pertumbuhan harian (ΔLPH) dan 154,32% untuk efisiensi pakan (ΔEP).
4.2 Pembahasan
Perlakuan perendaman ikan uji di air tawar merupakan salah satu
perlakuan untuk menghilangkan parasit pada ikan kerapu bebek Cromileptes altivelis. Perlakuan perendaman dalam air tawar tersebut dapat menyebabkan ikan stres sehingga dapat meningkatkan kebutuhan energi pada ikan dan mengurangi
tingkat pertumbuhan ikan. Pengukuran total eritrosit dan kadar hemoglobin
bertujuan untuk melihat kemampuan pengikatan oksigen yang dimanfaatkan
dalam pembakaran untuk menghasilkan energi (Lagler et al., 1977 dalam Indriastuti, 2006).
Berdasarkan parameter darah yang diamati yaitu total eritrosit dan kadar
hemoglobin, status kesehatan ikan yang ditunjukkan pada Gambar 1 (i),
merupakan kondisi setelah pemberian perlakuan selama pemeliharaan. Total
eritrosit yang lebih rendah dibandingkan perlakuan lainnya terdapat pada
perlakuan dengan frekuensi perendaman ikan uji di air tawar 3x30 hari dengan
jumlah eritrosit 1,24x106 sel/mm3, sedangkan perlakuan dengan frekuensi
perendaman dalam air tawar 1x30 hari memiliki jumlah eritrosit 1,61x106
sel/mm3. Jumlah eritrosit yang didapatkan pada perlakuan perendaman dalam air
tawar maupun kontrol masih berada dalam kisaran normal yaitu 1,05 x 106– 3,0 x
106 sel/mm3 (Roberts (1978) dalam Irianto (2005)). Namun, ikan pada perlakuan
perendaman dalam air tawar dengan frekuensi 2x30 hari dan 3x30 hari
menunjukkan total eritrosit yang lebih rendah dibandingkan dengan frekuensi
17
tawar dengan frekuensi 2x30 hari maupun 3x30 hari diduga dipengaruhi oleh
aktivitas fisik ikan yang diberikan perlakuan perendaman dalam air tawar karena
faktor-faktor yang mempengaruhi jumlah eritrosit adalah jenis kelamin, perbedaan
induk (genetik), kondisi nutrisi, aktivitas fisik, dan umur (Dellman dan Brown
(1989) dalam Ashry (2007)). Aktivitas fisik yang terjadi dalam tubuh ikan diduga
mempengaruhi proses pembentukan sel darah menjadi terganggu. Sistem
pembentukan eritrosit terkait dengan umur sel darah tersebut yaitu pada hewan
umurnya kurang lebih 25 – 140 hari (Guyton, 1986 dalam Feylana, 2008).
Kadar hemoglobin yang diperoleh menunjukkan bahwa ikan mampu
mengikat oksigen dengan baik dilihat dari kadar hemoglobin yang masih berada
dalam kisaran kadar hemoglobin normal pada ikan teleostei yaitu 3,7- 7 gr %.
Selain itu, perpindahan yang terjadi pada ikan air laut dari media air laut ke air
tawar dapat meningkatkan afinitas oksigen dari darah (Maxime et al (1990) dalam Jensen et al.(1993)). Berdasarkan hasil tersebut, ikan yang diberikan perlakuan perendaman dalam air tawar mempunyai kemampuan melakukan proses
pembakaran untuk menghasilkan energi yang dibutuhkan oleh tubuh untuk
mengatasi stres.
Berdasarkan pengamatan visual selama pemeliharaan, respon makan ikan
setelah diberikan perlakuan perendaman di air tawar mengalami peningkatan
namun nafsu makan menurun kembali pada hari berikutnya. Salah satu indikator
nafsu makan ikan adalah jumlah pakan yang dikonsumsi oleh ikan uji. Konsumsi
pakan sangat erat kaitannya dengan penyediaan nutrien yang merupakan sumber
energi untuk mendukung kelangsungan hidup dan pertumbuhan. Secara statistik
konsumsi pakan ikan yang diberikan perlakuan perendaman dalam air tawar
dibandingkan dengan kontrol tidak berbeda nyata (P>0,05) (Tabel 1).
Pertambahan bobot rata-rata pada akhir pemeliharaan yang ditunjukkan
oleh Tabel 1, menunjukkan bahwa energi pakan cukup memenuhi kebutuhan ikan
untuk tumbuh karena pada awalnya energi dalam pakan digunakan untuk
pemeliharaan tubuh lalu kelebihan energi untuk pertumbuhan. Namun, jumlah
konsumsi pakan yang sama pada perlakuan perendaman ikan uji dalam air tawar
sebanyak 3x30 hari tidak diikuti laju pertumbuhan harian yang tinggi seperti pada
18
hari. Hal ini diduga karena frekuensi perlakuan perendaman ikan uji di air tawar
menyebabkan ikan stres dan membutuhkan waktu untuk recovery (pemulihan), sehingga mempengaruhi kondisi ikan dalam memanfaatkan energi untuk
beradaptasi menjadi lebih besar dibandingkan untuk pertumbuhan. Sedangkan
untuk perlakuan dengan frekuensi 1x30 hari memiliki jumlah konsumsi pakan
yang sama, namun diikuti dengan nilai laju pertumbuhan yang lebih tinggi
dibandingkan perlakuan lainnya. Hal ini disebabkan frekuensi perendaman ikan
uji di air tawar yang lebih sedikit membuat ikan cenderung lebih banyak dapat
mengalokasikan energinya untuk pertumbuhan. Sesuai dengan pernyataan Halver
(1988) bahwa perubahan lingkungan yang tiba-tiba dapat menyebabkan stres yang
pada akhirnya dapat meningkatkan kebutuhan energi ikan untuk beradaptasi dan
mengurangi alokasi energi untuk pertumbuhan.
Pemakaian nutrien dari pakan yang tercerna dapat diketahui langsung
dipakai atau disimpan dalam tubuh. Jumlah nutrien yang mampu disimpan dalam
tubuh adalah retensi. Protein sebagai sumber nutrien utama karena memegang
peranan paling penting dalam jaringan serta organ tubuh hewan dan merupakan
sumber energi yang lebih efisien. Pada perlakuan dengan frekuensi perendaman
ikan uji di air tawar 1x30 hari menunjukkan hasil retensi protein yang tertinggi
dan retensi lemak yang rendah. Nilai retensi protein terendah terdapat pada
perlakuan dengan frekuensi perendaman dalam air tawar 3x30 hari sedangkan
retensi lemak menunjukkan nilai yang cukup tinggi. Berdasarkan hasil tersebut
diketahui bahwa sumber energi yang digunakan sebagian besar berasal dari
protein.
Perlakuan dengan frekuensi perendaman 3x30 hari lebih banyak
memerlukan energi untuk beradaptasi terhadap perubahan lingkungan yang
ekstrim. Jika perlakuan perendaman dalam air tawar terlalu sering, akan
menyebabkan energi cadangan menipis dan membuat ikan menjadi lemah
sehingga mudah terserang penyakit. Hal tersebut terjadi karena waktu yang
dibutuhkan untuk pemulihan total ikan akibat stres adalah selama 10 – 14 hari
(Schreck, 1981) sehingga pada perlakuan yang sering direndam membuat ikan
terus menerus membutuhkan energi untuk beradaptasi dan pemulihan yang
19
pada perlakuan perendaman ikan uji di air tawar 1x30 hari menunjukkan ikan uji
tersebut cenderung lebih baik memanfaatkan energi dari pakan dibandingkan
perlakuan lainnya.
Berdasarkan nilai yang paling tinggi pada status darah (total eritrosit dan
kadar hemoglobin) yaitu perlakuan dengan frekuensi perendaman ikan uji di air
tawar 1x30 hari memberikan hasil kinerja pertumbuhan ikan yang baik karena
diduga berkaitan dengan penggunaan energi yang lebih efisien dibandingkan
perlakuan lainnya. Hal tersebut membuat perlakuan dengan frekuensi perendaman
ikan uji di air tawar 1x30 hari memiliki bobot rata-rata akhir paling tinggi sebesar
64,85 ± 0,44 gram, nilai rataan laju pertumbuhan harian paling tinggi sebesar
1,41± 0,07 %, retensi protein paling tinggi sebesar 17,42 ± 0,42 %, dan nilai
V. KESIMPULAN
5.1 Kesimpulan
Hasil penelitian menunjukkan bahwa ikan kerapu bebek Cromileptes altivelis yang diberikan perlakuan perendaman dalam air tawar 1x30 hari memberikan pengaruh terhadap kinerja pertumbuhan ikan kerapu bebek.
Perlakuan dengan frekuensi perendaman ikan uji di air tawar satu kali selama 20
menit dalam masa pemeliharaan 30 hari merupakan frekuensi perendaman air
tawar optimum yang cenderung tidak menghambat pertumbuhan ikan.
5.2 Saran
Saran yang dapat diberikan adalah perlakuan perendaman ikan kerapu
DAFTAR PUSTAKA
Anonimous. 2008. http://www.indosiar.com/news/kisi-kisi/69769_budidaya-ikan-kerapu-bebek [2 Agustus 2008]
Ashry, N. 2007. Pemanfaatan Ekstrak Daun Ketapang Terminalia cattapu untuk Pencegahan dan Pengobatan Ikan Patin Pangansionodon hypophtalmus Pangansionodon hypophtalmus yang Terinfeksi Bakteri Aeromonas hydrophila. [Skripsi]. Fakultas Perikanan dan Ilmu Kelautan. Institut, Pertanian Bogor, Bogor.
Eddy, F. B. 1981. Effects of Stress on Osmotic and Ionic Regulation in Fish. Didalam : Pickering, A. D. (editor). Stress and Fish. Academic Press, Inc. London. hlm. 77-102.
Feylana. 2008. Sel Darah Merah. http://feylana.wordpress.com/2008/06/21/sel-darah-merah/ [22 Januari 2009]
Fujaya, Y. 2002. Fisiologi Ikan : Dasar Pengembangan Teknologi Perikanan. Penerbit Rineka Cipta. Jakarta
Furuichi, M. 1988. Fish Nutrition. Didalam : Watanabe, T. (editor). Fish Nutrition and Mariculture. Departemen of Aquatic Biosciences, Tokyo University of Fisheries. Tokyo. hlm. 79-229
Halver, J. E. 1989. Fish Nutrition. Second Edition. Academic Press, Inc. University of Washington. Seattle. Washington
Indriastuti, L. 2006. Pengaruh Penambahan Bahan-bahan Immunostimulan dalam Formulasi Pakan Buatan terhadap Respon Imunitas dan Pertumbuhan Ikan Kerapu Bebek Cromileptis altivelis. [Skripsi]. Fakultas Perikanan dan Ilmu Kelautan. Institut, Pertanian Bogor, Bogor.
Irianto, A. 2005. Patologi Ikan Teleostei. Gajah Mada University Press. Yogyakarta.
Jensen, F. B., M. Nikinmaa and R. E. Weber. 1993. Environmental Pertubation of Oxygen Transport in Teleost Fishes: Causes, Consequences, and Compensations. Didalam : J. C. Rankin dan F. B. Jensen (editors). Fish Eciphysiology. Chapman and Hall. London. hlm. 161-179.
22
Kestemont, P. and E. Baras. 2001. Environmental Factors and Feed Intake : Mechanism and Interaction. Didalam : D. Houlihan, T. Boujard dan M. Jobling (editors). Food Intake in Fish. Blackwell Science Publishing. hlm. 131-156.
Laining, A., N. Kabangnga and Usman. 2004. Dietary Optimum Protein for Tiger Grouper Epinephelus fuscoguttatus Diet Reared in Floating Net Cages. Didalam : Rimmers, M. A., S. McBride dan K. C. Williams (editors). Advanced in Grouper Aquaculture. ACIAR, Canberra. hlm. 95-97
Lovell, T. 1989. Nutrition and Feeding of Fish. New York : Auburn University
Mazeaud, M.M. and F. Mazeaud. 1981. Adrenergic Responses to Stress in Fish. Didalam : Pickering, A. D. (editor). Stress and Fish. Academic Press, Inc. London. hlm. 49-76.
Milamena, O. M., R. M. Coloso and F. P. Pascual. 2002. Nutrition in Tropical Aquaculture. Aquaculture Departemen : Southeast Asian Fisheries Development Center, Tighatian, Iloilo, Philippines
Montgomery, J. C. and R. M. G. Wells. 1993. Recent Advances in the Ecophysiology of Antarctic Notothenioid Fishes : Metabolic Capacity and Sensory Performance. Didalam: J. C. Rankin dan F. B. Jensen (editors). Fish Ecophysiology. Chapman and Hall. London. hlm. 341-374.
Nabib, R. dan Pasaribu, F. H. 1989. Patologi dan Penyakit Ikan. Departemen Pendidikan dan Kebudayaan, Direktorat Jenderal Pendidikan Tinggi, Pusat Antar Universitas Boiteknologi, Institut Pertanian Bogor
National Research Council. 1993. Nutrient Requirements of Fish. Washington D.C. : National Academic Press
Pickering, A. D. 1981. Stress and Fish. Academic Press, Inc. London.
Royce, W. F. 1972. Introduction to the Fishery Sciences. Academic Press, Inc. College of University, University of Washington, Seattle, Washington
Schreck, C. B. 1981. Stress and Compensation Teleostean Fishes : Response to Social and Physical Factors. Didalam : Pickering, A. D. (editor). Stress and Fish. Academic Press, Inc. London. hlm. 295-315
23
Sucipto, A., M. Ahmad, E. Kusrini, N. H. Kharisma. 2008. Pengaruh Salinitas dalam Proses Osmoregulasi Ikan. Aquaculture – Physiology.
http://naksara.net/index.php?view=article&catid=38:physiology&id=85:pe
ngaruh-salinitas-dalam-proses-ormoregulasi-ikan&tmpl=component&print=1&page [30 juli 2008]
Takeuchi, T. 1988. Laboratory Work Chemical Evaluation of Dietary Nutrients. Didalam : Watanabe, T. (editor). Fish Nutrition and Mariculture. Departemen of Aquatic Biosciences, Tokyo University of Fisheries. Tokyo. hlm. 79-229
Watanabe, T 1988. Fish Nutrition and Mariculture. Departemen of Aquatic Biosciences, Tokyo University of Fisheries. Tokyo
Wedemeyer, G. A. and D. J. McLeay. 1981. Methods for Determining the Tolerance of Fishes to Environtmental Stressor. Didalam : Pickering, A. D. (editor). Stress and Fish. Academic Press, Inc. London. hlm. 247-276
25
Lampiran 1. Hasil analisa kualitas air
Perlakuan Parameter
A B C D
Suhu (oC) 28,8 - 32,5 28,8 - 32,5 28,8 - 32,5 28,8 - 32,5 Salinitas (ppt) 29 - 31,5 29 - 31,5 29 - 31,5 29 - 31,5
Alkalinitas 59,7 - 74,63 56,72 - 77,61 55,72 - 78,61 57,71 - 77,61 pH 7,64 - 8,26 7,69 - 8,23 7,69 - 8,23 7,58 - 8,25 DO (mg O2/L) 4,4 - 5,7 4,4 - 5,9 4,2 - 5,9 4,2 - 5,8
TAN (ppm) 0,157 - 0,536 0,138 - 0,550 0,157 - 0,445 0,167 - 0,582 TOM 29,7 - 36,02 31,60 - 34,13 24,65 - 37,29 29,70 - 38,55
Lampiran 2. Hasil analisa proksimat bahan penyusun pakan
Kadar Proksimat Bahan Kering Bahan
Protein Lemak Abu BETN Energi/Kg
Tepung Ikan 69,459 9,746 13,817 4,824 3341,087 Tepung Bungkil Kedelai 45,189 3,197 6,303 37,621 2781,130 Tepung rebon 66,944 14,804 3,081 13,126 3870,285 tepung teligu 13,702 2,422 0,508 69,305 2408,380
Lampiran 3. Komposisi pakan uji ikan kerapu bebek Cromileptis altivelis
26
Lampiran 4. Prosedur analisis proksimat (Takeuchi, 1988)
A. Kadar protein
Tahap Oksidasi
1. Sampel ditimbang sebanyak 0,5 gram dan dimasukkan ke dalam labu
Kjedahl.
2. Katalis (K2SO4+CuSO4.5H2O) dengan rasio 9 : 1 ditimbang sebanyak 3
gram dan dimasukkan ke dalam labu Kjedahl.
3. Tambahkan 10 ml H2SO4 pekat ke dalam labu Kjedahl kemudian panaskan
labu tersebut dalam rak oksidatif/digestion pada suhu 400oC selama 3 - 4
jam sampai terjadi perubahan warna cairan pada labu menjadi hijau
bening.
4. Dinginkan larutan lalu tambahkan lakukan pengenceran dengan larutan
akuades hingga 100 ml. Larutan sampel siap untuk didestilasi.
Tahap Destilasi
1. Erlenmeyer diisi dengan 10 ml H2SO4 0,05 N dan ditambahkan 2 tetes
indikator methyl red. Letakkan Erlenmeyer tersebut dibawah pipa pembuangan kondensor.
2. 5 ml larutan sampel dimasukkan ke dalam tabung destilasi melalui corong
yang kemudian dibilas dengan akuades dan tambahkan 10 ml NaOH 30%
lalu masukkan melalui corong tersebut dan tutup.
3. Campuran alkaline dalam labu tersebut kemudian didestilasi selama 10
menit setelah adanya tetesan pertama pada pipa pembuangan kondensor.
4. Labu Erlenmeyer diturunkan hingga ujung pipa kondensor berada dileher
labu, diatas permukaan larutan. Kondensor dibilas dengan akuades selama
1-2 menit.
Tahap Titrasi
1. Lakukan titrasi dengan NaOH 0,05 N hingga satu tetes setelah larutan
berwarna bening
2. Titrasi dilakukan pada larutan blanko dan larutan sampel.
27
Vb = Volume hasil titrasi blanko (ml)
Vs = Volume hasil titrasi larutan sampel (ml)
A = Bobot sampel (gram)
* = setiap ml 0,05 NaOH ekivalen dengan 0,0007 gram Nitrogen
** = faktor nitrogen
B. Kadar lemak
a. Metode ekstraksi dengan Soxhlet
1. panaskan labu ekstraksi pada oven dengan suhu 110oC selama 1 jam.
Labu kemudian didinginkan di dalam desikator selama 30 menit lalu
timbang berat labu awal tersebut (X1)
2. sampel ditimbang sebanyak 1-2 gram (A) dan dimasukkan ke dalam
tabung filter lalu dipanaskan pada suhu 90 - 100oC selama 2-3 jam.
3. Tabung filter ditempatkan ke dalam ekstrak dari alat soxhlet. Kemudian
disambungkan kondensor dengan labu ekstraksi yang telah diisi 100 ml
petrolium eter.
4. Eter dipanaskan pada labu ekstraksi dengan menggunakan water bath
pada suhu 70oC selama 16 jam.
5. Labu ekstraksi dipanaskan pada suhu 100oC kemudian ditimbang (X2)
b. Metode ekstraksi dengan Folch
1. Labu silinder dioven terlebih dahulu pada suhu 110oC selama 1 jam,
didinginkan dalam desikator selama 30 menit kemudian ditimbang (X1)
2. Sampel ditimbang sebanyak 2-3 gram (A) dan dimasukkan ke dalam
gelas homogenize dan ditambahkan larutan kloroform/methanol (20xA),
sebagian disisakan untuk membilas pada saat penyaringan.
3. Sampel dihomogenize selama 5 menit, setelah itu disaring dengan
28
5. lapisan bawah yang terdapat pada labu pemisah disaring ke dalam labu
silinder, kemudian dievaporasi sampai kering. Sisa kloroform/methanol
yang terdapat pada labu ditiup menggunakan vacuum. Setelah itu
ditimbang (X2).
kemudian dimasukkan ke dalam desikator selama 30 menit dan ditimbang
(X1).
2. Bahan ditimbang 2-3 gram (A).
3. Cawan dan bahan dimasukkan ke dalam oven pada suhu 110oC selama 4
jam kemudian dimasukkan ke dalam desikator selama 30 menit kemudian
ditimbang (X2).
kemudian dimasukkan ke dalam desikator selama 30 menit dan ditimbang
(X1).
2. Bahan ditimbang 2-3 gram (A).
3. Cawan dan bahan dimasukkan ke dalam tanur pada suhu 600oC sampai
bahan menjadi abu atau hingga mencapai berat konstan, kemudian
dimasukkan ke dalam desikator selama 30 menit kemudian ditimbang
29
1. Kertas filter dipanaskan dalam oven pada pada suhu 110oC selama 1 jam
kemudian dimasukkan ke dalam desikator selama 15 menit dan ditimbang
(X1).
2. Sampel ditimbang sebanyak 0,5 gram (A) dan dimasukkan ke dalam
erlenmeyer 250 ml.
3. H2SO4 0,3 N sebanyak 50 ml ditambahkan ke dalam erlenmeyer kemudian
dipanaskan di atas penangas selama 30 menit. Setelah itu NaOH 1,5 N
sebanyak 25 ml ditambahkan ke dalam erlenmeyer dan dipanaskan selama
30 menit.
4. larutan dan bahan yang telah dipanaskan kemudian disaring dalam corong
Buchner dan dihubungkan pada vacuum pump untuk mempercepat filtrasi. 5. larutan dan bahan yang ada pada corong Buchner dibilas secara
berturut-turut dengan 50 ml air panas, 50 ml H2SO4 0,3 N, 50 ml air panas, dan 25
ml aseton.
6. Kertas saring dan isinya dimasukkan ke dalam cawan porselin, lalu
dipanaskan dalam oven bersuhu selama 1 jam kemudian didinginkan
dalam desikator selama 30 menit dan ditimbang (X2).
7. setelah itu dipanaskan di dalam tanur pada suhu 600oC hingga berwarna
putih atau menjadi abu (± 4 jam), lalu dimasukkan ke dalam oven bersuhu
110oC selama 15 menit, didinginkan dalam desikator selama 30 menit dan
30
Lampiran 5. Prosedur analisa gambaran darah
Pengambilan darah dilakukan dengan menggunakan syringe melalui vena caudalis yang berada di bawah vertebre. Syringe dan tabung eppendorf yang digunakan sebelumnya dibilas terlebih dahulu dengan menggunakan Na-sitrat
3,8% (anti koagulan) untuk mencegah pembekuan darah. Pengambilan dan
penyimpanan darah dalam eppendorf dilakukan secara perlahan-lahan untuk
mengurangi resiko kerusakan sel darah.
a.) Penghitungan sel darah merah (eritrosit) menurut Nabib dan Pasaribu
(1989)
Penghitungan dilakukan dengan mengencerkan darah dengan larutan
Hayem di dalam pipet pencampur berskala maksimum 101. Pada pipet ini, di
dalamnya terdapat bulir berwarna merah yang berfungsi sebagai pengaduk.
Sampel darah dihisap dengan pipet pencampur hingga skala 1, lalu dengan pipet
yang sama dihisap larutan Hayem hingga skala 101. pipet kemudian digoyang
dengan membentuk angka delapan selama 3-5 menit agar darah tercampur secara
merata. Sebelum dilakukan penghitungan, larutan yang berada di ujung yang tidak
teraduk dibuang.
Darah yang telah teraduk kemudian diteteskan ke dalam hemasitometer
tipe Neubauer Improved yang telah ditutupi gelas penutup melalui bagian yang berlekuk hingga memenuhi semua bagian yang berskala. Agar volume darah yang
dihitung tepat, kelebihan darah dihisap dengan menggunakan kertas tissue.
Penghitungan dilakukan di bawah mikroskop dengan perbesaran 400 kali pada 10
kotak kecil hemasitometer.
= jumlah sel terhitung x
31
Lanjutan Lampiran 5.
b.) Penghitungan hemoglobin menurut Wedemeyer dan Yasutake (1977)
dalam Indriastuti (2006)
Pengukuran kadar hemoglobin dilakukan dengan menggunakan metode
Sahli. Prinsip metode ini adalah dengan mengkonversikan hemoglobin dalam
darah ke dalam bentuk asam hematin oleh asam klorida. Darah dihisap dengan
menggunakan pipet Sahli sampai skala 20 mm3, ujung pipet yang telah digunakan
dibersihkan dengan menggunakan kertas tissue. Darah kemudian dipindahkan ke
dalam tabung hemoglobin yang berisi HCl 0,1 N sampai skala 10 (warna kuning),
lalu didiamkan 3-5 menit agar hemoglobin bereaksi dengan HCl membentuk asam
hematin. Darah kemudian diaduk dan ditambahkan akuades sedikit demi sedikit
hingga warnanya sama dengan warna standar. Pembacaan skala dilakukan dengan
melihat tinggi permukaan larutan yang dicocokkan dengan skala lajur Gr % yang