VIBRIOSIS PADA PENDEDERAN IKAN KERAPU BEBEK
Cromileptes altivelis
DI PULAU PAYUNG
KEPULAUAN SERIBU
PERNYATAAN MENGENAI SKRIPSI
DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa skripsi yang berjudul :
VIBRIOSIS PADA PENDEDERAN IKAN KERAPU BEBEK
Cromileptes altivelis
di PULAU PAYUNG KEPULAUAN SERIBU
adalah benar merupakan hasil karya yang belum diajukan dalam bentuk apa pun
kepada perguruan tinggi mana pun. Semua sumber data dan informasi yang
berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari
penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di
bagian akhir skripsi ini.
Bogor, Maret 2011
FARIQ AZHAR
ABSTRAK
FARIQ AZHAR Vibriosis pada Pendederan Ikan Kerapu Bebek Cromileptes altivelisdi Pulau Payung Kepulauan Seribu. Dibimbing oleh Dr. Sukenda dan Dr. Sri Nuryati.
Vibriosis merupakan penyakit yang terjadi pada budidaya ikan kerapu bebek
Cromileptes altivelis. Penelitian ini dilakukan untuk mengisolasi agen penyebab vibriosis pada pendederan ikan kerapu bebek, sebagai isolat bakteri yang patogen pada benih ikan kerapu bebek. Isolat yang diperoleh ada tiga jenis Vibrio, dengan nama Vibrio sp. 1, Vibrio sp. 2. dan Vibrio sp. 3. Semua isolat Vibrio merupakan patogen pada benih ikan kerapu sejak dilakukan uji tantang dari Vibrio sp. 1, 2, dan 3 yang menyebabkan kematian 100% pada masing-masing isolat setelah diinfeksi 10 hari. Tanda klinis yang terlihat pada ikan kerapu yakni pendarahan operkulum, pembengkakan anus, dan pengeroposan sirip. Hasil analisis histopatologi menunjukkan kerusakan pada ginjal. Kerusakan yang terjadi antara lain nekrosis, degenerasi, hemorragi, dan hipertropi.
ABSTRACT
FARIQ AZHAR Vibriosis in Grouper Cromileptes altivelis Nursery at Payung Island Kepulauan Seribu. Supervised by Dr. Sukenda and Dr. Sri Nuryati.
Vibriosis is a major disease occurred in grouper Cromileptes altivelis culture. This research was conducted s to isolate causative agents of vibriosis in nursery of grouper, as well as the pathogenecity of isolated bacteria in juvenile of grouper. We isolated three Vibrio, namely Vibrio sp. 1, Vibrio sp. 2, and Vibrio sp. 3. All isolatedVibrioare pathogenic to juvenile of grouper since challenge test of Vibrio sp. 1, 2 and 3 caused mortality of 100%, respectively after 10 days of infection. The clinical signs that appear on grouper are bleeding operculum, swelling of anus, and porous of fin. The results of histopathological analysis showed damage of the kidneys. The damage suffered were necrosis, degeneration, hemorrhage, and hyperthropy.
VIBRIOSIS PADA PENDEDERAN IKAN KERAPU BEBEK
Cromileptes altivelis
DI PULAU PAYUNG
KEPULAUAN SERIBU
FARIQ AZHAR
SKRIPSI
sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada Program Studi Teknologi & Manajemen Perikanan Budidaya
Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan,
Judul Skripsi : Vibriosis pada Pendederan Ikan Kerapu Bebek
Cromileptes altivelis di Pulau Payung Kepulauan Seribu
Nama Mahasiswa : Fariq Azhar
Nomor Pokok : C14061370
Disetujui
Dosen Pembimbing I
Dr. Ir. Sukenda, M.Sc. NIP. 19671013 199302 1 001
Dosen Pembimbing II
Dr. Sri Nuryati, S.Pi., M.Si. NIP. 19710606 199512 2 001
Mengetahui:
Ketua Departemen Budidaya Perairan
Dr. Ir. Odang Carman, M.Sc. NIP. 19591222 198601 1 001
KATA PENGANTAR
Ucapan puji syukur yang sebesarnya kepada Allah SWT yang telah
memberikan kesempatan kepada kita dalam menjalani hidup hingga detik ini
sehingga pembuatan skripsi ini dapat diselesaikan dengan baik. Penelitian yang
telah dilaksanakan pada bulan April 2010 s.d. Agustus 2010 di Laboratorium
Kesehatan Ikan, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu
Kelautan, Institut Pertanian Bogor berjudul Vibriosis pada Pendederan Ikan
Kerapu BebekCromileptes altivelisdi Pulau Payung Kepulauan Seribu .
Penulis mengucapkan terima kasih yang sebesar-besarnya kepada Dr.
Sukenda selaku Dosen Pembimbing I dan Dr. Sri Nuryati selaku Dosen
Pembimbing II atas bimbingan dan arahannya hingga selesainya penyusunan
skripsi. Ungkapan terima kasih juga ditujukan kepada kedua orang tua penulis
yakni bapak Akhmad Supriyanto dan ibu Yasminah yang selalu memberikan doa,
motivasi, dan kasih sayangnya serta adek Fajriyana Nur Wulansari yang telah
memberikan semangat dan doanya. Selain itu, penulis juga menyampaikan terima
kasih kepada saudari Fany Nur Fiana yang telah memberi motivasi, doa serta
cintanya kepada penulis selama berlangsungnya penelitian. Terima kasih juga
buat Pak Ranta, Ewa, Puguh, Mbok De, Pak De, Ngarso, Inul, Dwi, serta seluruh
teman-teman dari BDP yang selalu memberikan semangat dan dukungan selama
penelitian hingga penelitian ini selesai.
Bogor, Maret 2011
DAFTAR RIWAYAT HIDUP
Penulis dilahirkan di Rembang pada tanggal 2 Maret 1988 sebagai anak
pertama dari dua bersaudara, dari pasangan Bapak Akhmad Supriyanto, S.Pd. dan
Ibu Yasminah, S.Pd.
Penulis telah menyelesaikan jenjang pendidikan pada SDN 1 Lasem lulus
tahun 2000, SMPN 1 Lasem lulus tahun 2003, dan SMA N 2 Rembang lulus
tahun 2006. Tahun 2006, penulis lulus seleksi masuk IPB melalui jalur Undangan
Seleksi Mahasiswa IPB (USMI). Melalui program mayor-minor tahun 2007
penulis memilih mayor Teknologi dan Manajemen Perikanan Budidaya,
Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut
Pertanian Bogor.
Selama masa perkuliahan, penulis aktif pada beberapa organisasi
kemahasiswaan, Himpunan Mahasiswa Akuakultur (HIMAKUA) periode
2007/2008. Penulis juga aktif menjadi Asisten Praktikum pada beberapa mata
kuliah yaitu Ikhtiologi (2008), Fisiologi Hewan Air (2009), dan Penyakit
Organisme Akuatik (2010).
Untuk meningkatkan pengetahuan di bidang perikanan budidaya, penulis
mengikuti kegiatan magang liburan di PT. Citra Pertiwi Bahari (2007) dan PT.
Anugrah Bahari Mulia (2010) dan Praktek Lapangan Akuakultur di Isaku Koi
Farm Blitar (2009). Tugas akhir dalam pendidikan tinggi diselesaikan penulis
dengan menulis skripsi berjudul Vibriosis pada Pendederan Ikan Kerapu
DAFTAR ISI
3.1.2 Hasil Uji Patogenitas.. ... 6
3.1.3 Hasil Histopatologi ... 8
3.1.4. Kualitas Air . 10
3.2 Pembahasan . 10
IV. KESIMPULAN DAN SARAN ... 15
4.1 Kesimpulan ... 15
4.2 Saran . 15
DAFTAR PUSTAKA .. 16
DAFTAR TABEL
Halaman
1 Jumlah total bakteriVibriopada organ ginjal... 5
2 Hasil uji pewarnaan gram, uji fisiologis dan biokimia... 5
3 Gejala klinis ikan setelah proses penyuntikan... 7
4 Mortalitas ikan kerapu pasca infeksi bakteriVibrio... 8
DAFTAR GAMBAR
Halaman
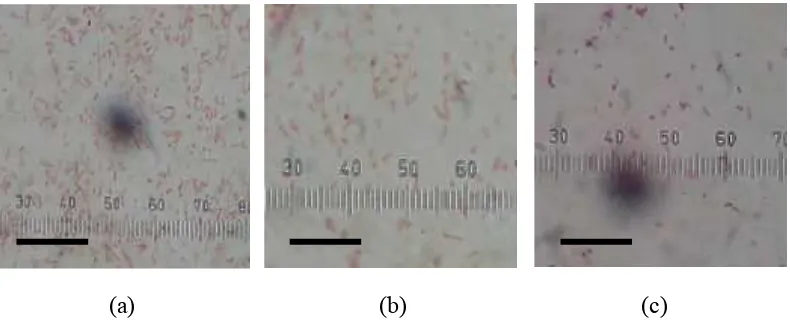
1 Vibrio sp.1 (a),Vibrio sp. 2 (b),Vibrio sp.3 (c)... 5
2 Gejala klinis pasca injeksi... 7
3 Ginjal ikan kerapu bebek pra infeksi dalam kondisi normal... 8
4 Histopatologi ginjal yang terserangVibriosp. 1... 8
5 Histopatologi ginjal yang terserangVibriosp. 2... 8
DAFTAR LAMPIRAN
Halaman
1 Pertumbuhan panjang dan berat ikan kerapu bebek Cromileptes altivelis...
18
2 Hasil pengukuran kualitas air pada media ikan kerapu bebek... 20
3 Tahapan Pembuatan Preparat Histopatologi... 21
4 Komposisi media yang digunakan untuk kultur bakteri patogen... 25
5 Prosedur pewarnaan gram... 26
6 Prosedur uji oksidatif/fermentatif... 27
7 Prosedur uji motilitas... 28
8 Prosedur uji katalase... 29
9 Prosedur uji oksidase... 30
I. PENDAHULUAN
Ikan kerapu bebek Cromileptes altivelis merupakan salah satu jenis ikan karang yang sudah dapat dibudidayakan di keramba jaring apung. Selain itu, ikan
kerapu bebek juga merupakan salah satu komoditas unggulan ekspor hasil
perikanan dengan potensi pengembangan yang masih cukup besar. Besarnya
permintaan dan tingginya harga jual ikan kerapu menjadi alasan utama
pengembangan usaha budidaya kerapu. Ikan kerapu bebek mempunyai harga yang
paling tinggi di antara ikan kerapu jenis yang lain yaitu berkisar Rp 450.0000,00
sampai dengan Rp 500.000,00 pada ukuran konsumsi (Anonim 2011).
Salah satu wilayah yang mempunyai kontribusi dalam produksi ikan kerapu
adalah perairan Kepulauan Seribu, berada di Teluk Jakarta. Wilayah ini memiliki
banyak potensi di bidang kelautan dan perikanan, antara lain ikan konsumsi, ikan
hias, terumbu karang, rumput laut, dan mangrove. Pengembangan ikan kerapu di
keramba jaring apung (KJA) mempunyai kendala dalam proses kegiatan
budidayanya. Permasalahan yang timbul dalam proses pemeliharaan benih ikan
kerapu dalam keramba jaring apung (KJA) adalah timbulnya penyakit. Beberapa
jenis penyakit yang ditemukan pada kegiatan pemeliharaan tersebut antara lain
borok pada pangkal sirip ekor, sirip yang busuk, dan mulut merah. Selain itu, ikan
kerapu juga sering terserang penyakit parasitik, yang diakibatkan karena infeksi
dari jenis crustacean (Nerocilla Sp.), cacing (Diplectanum Sp.), protozoa (Cryptocaryon Sp.) serta bakteri dari genus Vibrio (Rahayu 2009). Hal ini mendorong perlu diadakan pengkajian tentang penyakit yang menyerang ikan
kerapu.
Penelitian ini bertujuan untuk mengidentifikasi keragaman dan keberadaan
bakteri penyebab vibriosis pada benih ikan kerapu bebek di Pulau Payung,
II. BAHAN DAN METODE
2.1. Prosedur Pengambilan Sampel
Pengambilan sampel dilakukan seminggu sekali selama empat minggu. Ikan
berasal dari 3 jaring yang berbeda pada KJA. Ikan diambil sebanyak 3 ekor dari
satu jaring setiap minggunya dengan ukuran 9-10 cm. Ikan yang dipakai
merupakan ikan yang memiliki gejala sakit terutama gejala vibriosis seperti tubuh
lemah, timbul borok, atau nafsu makan menurun. Data pendukung berupa data
kualitas air dicatat untuk memberikan informasi kisaran minimum dan maksimum
kualitas air pada waktu pengambilan sampel.
Proses transportasi dilakukan dengan memasukkan ikan sampel ke dalam
kantong plastik packing berisi air dan diberi oksigen. Kepadatan ikan adalah 2-3 ekor tiap kantong berukuran 2 kg. Untuk menghindari peningkatan suhu dan
goncangan yang dapat mempengaruhi kondisi ikan selama transportasi, maka
kantong plastik yang telah berisi ikan dimasukkan ke dalam kotak sterofoam.
Setelah sampai di tempat pemeriksaaan, ikan diaklimatisasi dahulu lalu
dimasukkan ke dalam akuarium penampungan dengan aerasi yang cukup.
Pemeriksaan bakteri dilakukan di laboratorium kesehatan ikan. Sebelum
dilakukan pemeriksaan parasit dan bakteri, ikan diukur panjangnya dengan
menggunakan penggaris dan beratnya dengan menggunakan timbangan digital
terlebih dahulu. Kemudian ikan dimatikan dengan cara menusukkan jarum tepat
pada bagian medulla oblongatanya.
2.2. Isolasi dan Identifikasi Bakteri
Organ tubuh yang dijadikan sumber isolat bakteri adalah ginjal. Pemilihan
organ berupa ginjal karena mempunyai fungsi retikulo endotelial, yaitu kemampuan suatu organ untuk menyerap bakteri dari darah. Isolasi bakteri
dilakukan dengan menggunakan media TCBS untuk mencari keberadaan Vibrio
dalam sampel tersebut. Tahapan yang dilakukan dalam isolasi bakteri yakni
dengan dihomogenkan terlebih dahulu ginjal yang telah diperoleh. Ginjal tersebut
kemudian disuspensikan. Pengenceran berulang dilakukan setelah mendapatkan
ginjal yang telah dihancurkan pada permukaan agar dalam cawan dengan
menggunakan ose steril. Setelah itu, bakteri diinkubasi pada suhu kamar selama
24-48 jam.
Identifikasi bakteri dilakukan dengan tahap awal berupa pemisahan jenis
koloni yang tumbuh berdasarkan warna, bentuk, tepian, dan elevasinya. Setiap
jenis koloni yang berbeda selanjutnya diuji dengan menggunakan uji gram,
Sulfide Indol Motil (SIM), Oksidase, Katalase, dan uji Oksidatif/Fermentatif
(O/F). Selanjutnya, berdasarkan hasil uji bakteri tersebut, dilakukan identifikasi
genus bakteri dengan mengunakan tabel Cowan (1974). Tahapan uji yang
dilakukan dapat dilihat pada lampiran.
2.3. Uji Patogenisitas
Uji Patogenisitas dilakukan untuk menguji ketahanan ikan setelah dilakukan
injeksi isolat bakteri dari hasil isolasi sebelumnya. Tahap yang dilakukan antara
lain pengulturan bakteri. Bakteri yang telah diperoleh dikultur kembali untuk
mendapatkan bakteri yang lebih muda dan virulen. Tahap pengenceran bakteri
dilakukan sampai mencapai kepadatan bakteri 107cfu/ml. Proses penyuntikan
bakteri dilakukan secara intramuskular pada tubuh ikan. Dosis yang disuntikkan
pada masing-masing ikan sebanyak 107cfu/ekor. Peliharaan ikan dilakukan
selama 10 hari untuk mengetahui kelangsungan hidup ikan tersebut. Kemudian
dilakukan reisolasi bakteri yang terdapat dalam ginjal ikan yang telah diinfeksi.
2.4. Pembuatan Preparat Histopatologi
Pembuatan preparat histopatologi terdiri dari tiga tahapan besar yaitu fiksasi
jaringan dan parafinasi, pemotongan jaringan serta pewarnaan jaringan (Angka
et.al.1990.). Tahapan fiksasi dapat dilihat pada lampiran.
2.6. Analisis Data
Data yang diperoleh diidentifikasi secara kualitatif dan kuantitatif. Analisis
data secara kualitatif berdasarkan pada bentuk morfologi bakteri serta melihat
preparat histopatologi dengan bantuan mikroskop. Analisis data secara kuantitatif
III.
HASIL DAN PEMBAHASAN
3.1. Hasil
3.1.1. Identifikasi Bakteri
Dari pemeriksaaan bakteri pada organ ginjal diperoleh hasil adanya bakteri
berupaVibriosp.Penggolongan dan jumlah total bakteri yang terdapat pada organ ginjal ditunjukkan pada Tabel 1.
Tabel 1. Jumlah total bakteriVibriopada organ ginjal
Tanggal Kode lokasi Jumlah totalVibrio(cfu/ml)
26/4/2010 A 2,03 x106
Jumlah total bakteriVibrioyang terdapat pada organ ginjal mempunyai hasil yang berbeda-beda (Tabel 1). Jumlah total bakteri Vibrio yang terbanyak ditemukan pada kode lokasi A dengan jumlah sebesar2,03 x106cfu/ml, kode lokasi
B menunjukkan jumlah total bakteri sebanyak 0,33 x106 cfu/ml, dan jumlah total
bakteri yang diperoleh pada kode lokasi C sebesar 1,30 x106cfu/ml.
Identifikasi untuk mengetahui bakteri yang menyerang ikan kerapu bebek
dilakukan dengan menggunakan uji pewarnaan gram, uji fisiologis, serta uji
biokimia. Hasil yang diperoleh dalam uji tersebut ditunjukkan pada Tabel 2.
Tabel 2. Hasil uji pewarnaan gram, uji fisiologis, dan uji biokimia
Jenis uji Hasil
Vibriosp. 1 Vibriosp. 2 Vibriosp. 3
Pewarnaan gram Negatif, batang Negatif, batang Negatif, batang
O/F Fermentatif Fermentatif Fermentatif
-(a) (b) (c)
Gambar 1.Vibriosp.1 (a),Vibriosp. 2 (b),Vibriosp.3 (c) (bar = 20µm). Tabel 2 menunjukkan hasil uji pewarnaan gram, uji fisiologis dan uji
biokimia pada isolat bakteri yang kemudian dapat digolongkan dalam berbagai
jenis. Penggolongan tersebut diantaranya Vibrio sp.1, Vibrio sp. 2,Vibrio sp. 3. Ciri dari Vibrio sp.1 yaitu berbentuk batang, warna koloni kuning, berupa gram negatif, fermentatif, oksidase negatif, katalase positif, dan SIM positif. Untuk
Vibrio sp. 2 mempunyai ciri sebagai berikut: berbentuk batang, warna koloni hijau, berupa gram negatif, fermentatif, oksidase negatif, katalase positif, dan SIM
positif. Sedangkan Vibrio sp. 3 mempunyai ciri yaitu yakni berbentuk batang, warna koloni kuning, berupa gram negatif, fermentatif, oksidase negatif, katalase
negatif, dan SIM positif.
3.1.2. Uji Patogenitas
Penyuntikan isolat bakteri Vibrio ke dalam tubuh ikan dilakukan untuk mengetahui patogenitas bakteri yang ditemukan. Pengamatan ikan dilakukan 10
Tabel 3. Gejala klinis ikan setelah proses penyuntikan
Hari ke-Pascainfeksi
Perlakuan
Vibriosp. 1 Vibriosp. 2 Vibriosp. 3
1 - -
-Keterangan: - = tidak ada gejala klinis + = adanya pendarahan operkulum ++ = adanya pembengkakan anus +++ = adanya pengeroposan sirip
Ikan yang telah diinfeksi dengan menggunakan isolat Vibrio menunjukkan adanya tanda gejala klinis (Tabel 3). Gejala klinis tersebut terlihat pada hari ke-7
untuk ikan yang telah diinfeksi dengan menggunakanVibrio sp.1 danVibriosp.3. Sedangkan untuk Vibrio sp.2 gejala klinis yang terlihat pada hari ke-8 pasca penyuntikan. Gejala klinis yang terlihat yakni adanya pendarahan pada
operkulum, pembengkakan pada anus, serta penggeroposan sirip.
Ikan yang menunjukkan gejala klinis yang terinfeksi oleh bakteri Vibrio
terlihat pada Gambar 2.
(a) (b) (c)
Gambar 2. Gejala klinis pasca injeksi, (a) pendarahan pada operkulum, (b)
Tabel 4. Mortalitas ikan kerapu pasca infeksi bakteriVibrio Perlakuan infeksi Ikan sampel Jumlah ikan mati
Vibriosp. 1 8 8
Vibriosp. 2 8 8
Vibriosp. 3 8 8
Hasil yang diperoleh setelah ikan diinjeksi dengan menggunakan isolat
Vibrio menunjukkan tingkat kematian di akhir pemeliharaan pada hari ke-10 mortalitas ikan yang diperoleh mencapai 100%.
3.1.3. Hasil Pemeriksaan Histopatologi
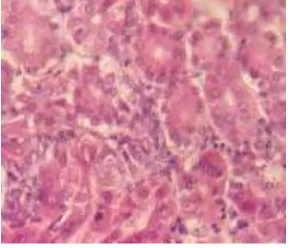
Pemeriksaan pra infeksi sel dan jaringan organ ginjal ikan kerapu bebek
normal yang disajikan pada Gambar 3.
Gambar 3. Ginjal ikan kerapu bebek pra infeksi dalam kondisi normal.
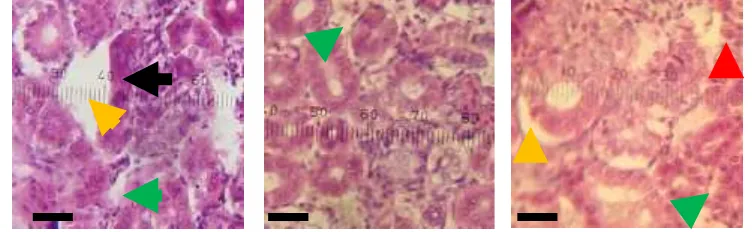
Pemeriksaan pasca infeksi Vibrio sel dan jaringan organ ginjal memperlihatkan adanya kelainan. Kelainan yang terlihat ditunjukkan oleh
Gambar 4.
Gambar 5. Histopatologi ginjal yang terserangVibriosp.2 : ( ) nekrosis, ( ) hipertropi, ( ) hemoragi, ( ) degenerasi (bar = 20µm).
Gambar 6. Histopatologi ginjal yang terserangVibriosp.3 : ( ) nekrosis, ( ) hipertropi, ( ) hemoragi, ( ) degenerasi (bar = 20µm).
Hasil histopatologi menunjukkan bahwa ginjal ikan kerapu yang diinfeksi
dengan bakteri Vibrio memperlihatkan adanya kelainan. Kelainan yang terlihat pada hasil histologi menunjukkan hasil yang sama pada jenis bakteri yang
berbeda. Kelainan berupa nekrosis, hipertropi, hemoragi, dan degenerasi
didapatkan pada hasil histopatologi untuk organ yang diinfeksi dengan
menggunakan isolatVibriosp. 1,Vibrio sp. 2, danVibriosp. 3.
3.1.4. Kualitas air
Pengambilan sampel air dilakukan sebanyak empat kali dalam sehari. Hasil
yang diperoleh ditunjukkan pada Tabel 5.
Kualitas air yang terdapat pada Tabel 5 menunjukkan bahwa media
pemeliharaan untuk ikan kerapu bebek berada pada kisaran yang ideal bagi
pertumbuhan ikan.
3.2. Pembahasan
Ditemukannya bakteriVibriopada benih ikan kerapu bebek yang terdapat di Pulau Payung Kepulauan Seribu merupakan indikasi lemahnya ketahanan tubuh
ikan kerapu bebek tersebut. Bakteri yang menginfeksi benih ikan kerapu bebek
dapat digolongkan menjadi tiga jenis berdasarkan warna koloninya, antara lain
Vibrio sp.1 dengan warna koloni kuning, Vibrio sp.2 dengan warna hijau, dan
Vibrio sp.3 dengan warna kuning. Adanya bakteri yang ditemukan pada benih tersebut berpengaruh pada ketahanan tubuh ikan. Ikan yang dijadikan sampel
penelitian merupakan ikan yang masih mempunyai panjang 8,8-11 cm. Ukuran
benih tersebut merupakan titik rawan untuk terjadinya infeksi vibriosis.
Vibrio sp. merupakan salah satu bakteri patogen yang tergolong dalam divisi Bacteria, klas Schizomicetes, ordo Eubacteriales, Famili Vibrionaceae.
Bakteri ini bersifat gram negatif, fakultatif anaerobik, fermentatif, bentuk sel
batang dengan ukuran panjang antara 2-3 µm, menghasilkan katalase dan
oksidase dan bergerak dengan satu flagella pada ujung sel (Austin 1993). Vibrio
merupakan patogen oportunistik yang dalam keadaan normal ada dalam
lingkungan pemeliharaan, kemudian berkembang dari sifat yang saprofitik
menjadi patogenik jika kondisi lingkungannya memungkinkan. Bakteri Vibrio
yang patogen dapat hidup di bagian tubuh organisme lain baik di luar tubuh
dengan jalan menempel, maupun pada organ tubuh bagian dalam seperti hati,
usus, ginjal, dan sebagainya.
Hasil yang diperoleh dari Tabel 1 menunjukkan bahwa jumlah total bakteri
Vibrio yang terdapat pada organ ginjal mempunyai hasil yang berbeda-beda. Jumlah total bakteri yang terbanyak ditemukan pada sampling pertama dengan
kode ikan A yang mempunyai koloni sebanyak 2,03 x106 cfu/ml. Kode lokasi B
mempunyai jumlah total bakteri sebanyak 0,33 x106 cfu/ml, sedangkan kode
lokasi C mempunyai jumlah total bakteri yang ditemukan sebanyak 1,30 x106
Ikan yang telah diinfeksi dengan menggunakan isolat Vibrio menunjukkan
adanya gejala klinis. Gejala klinis tersebut terlihat pada hari ke-7 untuk ikan yang
telah diinfeksi dengan menggunakan Vibrio sp. 1 dan Vibrio sp. 3, sedangkan untuk Vibrio sp. 2 gejala klinis yang terlihat pada hari ke-8 pasca penyuntikan. Gejala klinis yang terlihat yakni adanya pendarahan pada operkulum,
pembengkakan pada anus, serta penggeroposan sirip. Infeksi V. alginoluticus, V. parahaemolyticua, V. anguilarum dan V. harveyi dengan cara infeksi secara injeksi intramuscular dan juga secara perendaman menunjukkan bahwa kepadatan
bakteri hingga 10 8-10 CFU/ml pada ikan kerapu pasca infeksi terjadi kematian
ikan pada jam ke- 8, dengan gejala terjadinya luka borok terbuka, perubahan
perilaku, pergerakan lamban, keseimbangan terganggu, yaitu berputar-putar
(whirling) dan nafsu makan berkurang, akan tetapi ikan pada perlakuan perendaman ikan bertahan hingga 24 jam-96 jam dengan injeksi bakteri V. alginolyticus 1010 CFU/ml menunjukkan kematian hingga 5 jam pertama pasca injeksi dengan perubahan warna morfologi ikan menjadi lebih gelap,
inflamasi, sampai abses pada bekas injeksi, timbul bercak merah pada pangkal
sirip, timbul perdarahan pada insang dan mulut, perut menggelembung hingga
terjadi kematian ( Yanuhar 2008).
Mortalitas ikan kerapu yang telah ditunjukkan oleh Tabel 4 mencapai 100%
pada akhir pengamatan. Penginfeksian ikan kerapu dengan menggunakan isolat
Vibrio dengan kepadatan 107cfu/ml dilakukan untuk menguji tingkat daya tahan tubuh ikan kerapu dalam menanggulangi serangan penyakit yang masuk ke dalam
tubuh. Kematian yang terjadi merupakan akibat dari banyaknya jumlah bakteri
Vibrio yang telah menyerang tubuh ikan kerapu. Patogenitas dari penyakit Vibriosis masih belum sepenuhnya diketahui. Tetapi faktor-faktor yang mungkin
dihubungkan dengan adanya endotoksin, sifat adhesi yang membantu melekatkan
berbeda. Kelainan berupa nekrosis, hipertropi, hemoragi, dan degenerasi
didapatkan pada hasil histopatologi untuk organ yang diinfeksi dengan
menggunakan isolatVibriosp. 1,Vibrio sp. 2, danVibriosp. 3.
Nekrosis merupakan jenis kematian sel ireversibel yang terjadi ketika
terdapat luka berat atau lama hingga suatu saat sel tidak dapat beradaptasi atau
memperbaiki dirinya sendiri. Umumnya perubahan-perubahan lisis yang terjadi
dalam jaringan nekrosis dapat melibatkan sitoplasma sel, perubahan-perubahan
paling jelas bermanifestasi pada inti. Inti sel yang nekrosis akan menyusut,
memiliki batas yang tidak teratur dan berwarna gelap. Proses ini dinamakan
piknosis. Kemungkinan lain inti dapat hancur dan membentuk fragmen-fragmen
materi kromatin yang tersebar di dalam sel, proses ini disebut sebagai karioreksis.
Pada beberapa keadaan, inti sel tidak dapat diwarnai lagi dan benar-benar hilang,
proses ini disebut sebagai kariolisis (Prince & Wilson 2004).
Pengaruh nekrosis mengakibatkan hilangnya fungsi pada daerah yang
nekrosis. Pada beberapa keadaan daerah nekrosis dapat menjadi fokus infeksi
yang merupakan medium pembiakan yang sangat baik. Bagi pertumbuhan
organisme tertentu yang kemudian dapat menyebar ke tempat lain di dalam tubuh,
bahkan tanpa infeksi pun adanya jaringan nekrosis di dalam tubuh dapat memicu
perubahan sistemik tertentu misalnya peningkatan jumlah leukosit di dalam
sirkulasi. Jaringan yang mengalami nekrosis dapat menginduksi respon
peradangan dari jaringan yang berdekatan. Jaringan yang nekrosis akan hancur
dan hilang memberi jalan bagi perbaikan yang mengganti daerah nekrosis dengan
sel-sel yang beregenarasi, pada beberapa keadaan dengan terbentuknya jaringan
luka (Prince & Wilson 2004).
Degenerasi dapat disebabkan oleh kekurangan material esensial (misalnya
oksigen atau nutrisi yang vital), kekurangan sumber energi yang mengganggu
metabolisme, pemanasan mekanik atau dapat disebabkan oleh luka akibat
akumulasi substansi yang abnormal di dalam sel-sel yang disebabkan oleh virus,
bakteri, atau patogen-patogen lain seperti parasit dan toksin yang dihasilkan atau
oleh bahan kimia beracun, ketidakseimbangan nutrisi dan zat-zat irritasi yang
ringan (Pazra 2008). Degenerasi hialin merupakan perubahan yang mengikuti
berkondensasi dan menyebabkan lurik pada serabut otot menghilang. Serabut
memperlihatkan satu penampilan homogen dan efektif terhadap pewarna eosin.
Serabut-serabut otot terhialinasi menjadi lebih rapuh dibandingkan
serabut-serabut yang tetap utuh. Degenerasi hialin yang hanya terjadi pada sebagian dari
serabut otot menyebabkan nukleus dekat dengan batas bagian terhialinasi dan
bagian yang tetap utuh sering kali mengalami hiperplasia (Takashima & Hibiya
1995).
Hipertropi merupakan proses bertambahnya ukuran atau volume dari suatu
bagian tubuh karena suatu peningkatan ukuran dari sel-sel individu. Hipertropi
biasanya disebabkan oleh peningkatan permintaan terhadap fungsi tetapi dapat
juga diiniasiasikan oleh agen infeksi (Pazra 2008). Hemoragi merupakan
keluarnya darah dari pembuluh darah dan banyak terdapat di kulit, membran
mukosa, di dalam rongga-rongga yang mengandung serous dan di antara sel-sel,
jaringan, atau organ. Darah keluar dari pembuluh darah karena adanya lubang
pada dinding atau darah menerobos dinding yang utuh karena peningkatan
porositas dari pembuluh darah tersebut.
Kebocoran dinding dapat terjadi melalui kerobekan (per reksis) dan
perenggangan jarak antara sel-sel dinding vaskula (per dipedisis). Hemoragi dapat
disebabkan oleh trauma yaitu kerusakan dalam bentuk fisik yang merusak sistem
vaskula jaringan di daerah benturan/kontak, infeksi agen infeksius terutama
menyebabkan septisemia, bahan toksik yang merusak endotel kapiler dan faktor
lain yang menyebabkan dinding vaskula lemah sehingga pembuluh darah rentan
untuk bocor (Pazra 2008).
Kualitas air media budidaya yang diperoleh selama pengambilan sampel
menunjukkan kisaran kualitas air yang ideal untuk pertumbuhan kerapu. Tabel 4
menunjukkan bahwa suhu, salinitas, kelarutan oksigen, dan amoniak berada pada
Salinitas yang diukur menunjukkan bahwa media air yang digunakan dalam
pemeliharaan menunjukkan kisaran antara 31-34 ppt. Menurut Ghufran dan
Tancung (2005), kisaran ideal salinitas buat ikan kerapu bebek berkisar antara
33-35 ppt. Tingkat salinitas yang terlampau tinggi dapat mengakibatkan respon stres
dari akut hingga kronis pada ikan budidaya ( Noga 2000). Perubahan salinitas
yang signifikan dapat mempengaruhi sistem osmoregulasi ikan.
Kelarutan oksigen yang diukur menunjukkan kisaran antara 6,10-8,12 mg/l.
Kisaran oksigen terlarut yang ideal untuk budidaya kerapu bebek berkisar antara
>5 mg/l (Ghufran dan Tancung 2005). Rendahnya kadar oksigen di suatu perairan
dapat menyebabkan ikan menjadi stres sehingga sistem imun menjadi menurun.
Pada saat itu, serangan penyakit akan mudah masuk ke dalam tubuh ikan, baik
berupa bakteri ataupun parasit.
Amoniak yang diperoleh pada pengambilan sampel menunjukkan kisaran
0,005-0,012 mg/l. Menurut Boyd (1982), kadar amoniak yang terdapat dalam
budidaya ikan kerapu bebek yang ideal yakni <0,5 mg/l. Kadar amoniak yang
meningkat di perairan menyebabkan ekskresi amoniak oleh ikan menurun dan
kadar amoniak dalam darah dan jaringan meningkat. Amoniak juga dapat
menyebabkan peningkatan konsumsi oksigen oleh jaringan, merusak insang dan
mengurangi kemampuan darah untuk mengangkut oksigen. Selain itu, terjadi
perubahan histologi pada ginjal, empedu ddan jaringan tiroid serta darah ikan
IV.
KESIMPULAN DAN SARAN
4.1. Kesimpulan
Berdasarkan hasil pemeriksaan bakteri yang terdapat pada ginjal ikan
kerapu tikus Cromileptes altivelis diperoleh 3 isolat bakteri Vibrio. Isolat bakteri tersebut dapat dibedakan dari warna koloni yang terlihat yaitu warna kuning
menunjukkan bakteri Vibrio sp. 1 dan Vibrio sp. 3, warna hijau menunjukkan bakteriVibriosp.2.
4.2. Saran
Perlu dilakukan penelitian untuk pengobatan vibriosis pada ikan kerapu
DAFTAR PUSTAKA
Angka, S.L., Mokoginta, I., dan Hamid, H. 1990. Anatomi dan Histologi Banding Bebeapa Ikan Air Tawar yang Dibudidayakan di Indonesia. Departemen Pendidikan dan Kebudayaan. Direktorat Jendral Pendidikan Tinggi. Institut Pertanian Bogor.
Austin B. dan Austin D.A. 1993. Bacterial fish pathogens. Di- sease in farmed and wild fish. Second edition. Ellis Horword limited. Chichester, England. 383 p.
Anonim. 2011. Cetak Rupiah dari Kerapu. www.trubus-online.co.id. [10 Januari 2011].
Boyd, C.E., 1982. Water Quality in Ponds for Aquaculture. Auburn: Auburn University, Internasional Centre for Aquaculture Experiment Station.
Cowan, S T. 1974. Manual for Identification of Medical Bacteria. Second Edition. Cambrige University. Cambridge. 283p.
Effendi, H., 2003. Telaah Kualitas Air bagi Pengelolaan Sumber Daya dan Lingkungan Perairan. Yogyakarta: Kanisius.
Ghufran, M. dan Tancung, A.B. 2005. Pengelolaan Kualitas Air Dalam Budidaya Perairan. Rineka Cipta. Jakarta.
Latama, G.2002. Cestoda: Parasit Cacing Pada Ikan dan ke Manusia. Makalah Pengantar Falsafah Sains. Program Pasca Sarjana. Institut Pertanian Bogor.
Nabib R, dan Pasaribu F.H. 1989. Patologi dan Penyakit Ikan. Deptartemen Pendidikan dan Keudayaan, Dirjen. Pendidikan Tinggi, P.A.U. Bioteknologi, IPB. Bogor. 158p.
Noga, E.J. 2000. Fish Disease: Diagnosis and Treatment. Iowa State University Press.
Pazra, D.F. 2008. Gambaran Histopatologi Insang, Otot, dan Usus pada Ikan Lele
Clarias spp. Asal Dari Daerah Bogor. [Skripsi]. Fakultas Kedokteran Hewan. Institut Pertanian Bogor.
Prince, S.A. dan Wilson, L.M. 2006. Patofisiologi. Edisi VI. Volume 1. EGC, Philadelphia.
Rahayu, A.M., 2009. Keragaman dan Keberadaan Penyakit Bacterial dan Parasitik Benih Kerapu Macan Epinephelus fuscoguttatus di Karamba Jaring Apung Balai Sea Farming Kepulauan Seribu, Jakarta. [Skripsi]. Departemen Budidaya Perairan. Fakultas Perikanan dan Ilmu Kelautan. Isntitut Pertanian Bogor.
Takashima, F. Dan Hibiya,T. 1995. An Atlas of Fish Histology Normal and Pathological Feature. Edisi II. Kodansha Ltd, Tokyo. 195p.
Yanuhar, U. 2008. The role of Haemagglutinin Protein as Adhesin Molecule of Fimbriae Vibrio alginolyticus That Recognized by Receptor Membrane Protein of IntestineCromileptes altivelis Within Pathomechanism Infection of Vibriosis.Pressented on International Seminar Management Strategy on Animal Health and Production Control in the Anticipation of Global Warming for the Achievement of Millennium Developmental Goals, Surabaya.
LAMPIRAN
Lampiran 1. Pertumbuhan panjang dan berat ikan kerapu bebek Cromileptes altivelis
Tanggal Kode Ikan Panjang (cm) Berat(gr)
Tanggal Kode Ikan Panjang (cm) Berat(gr)
C3 9,7 13,39
22/5/2010 A1 10,1 15,56
A2 10,2 14,89
A3 9,9 15,56
B1 10,8 16,48
B2 10,4 17,59
B3 10,6 16,89
C1 11 18,78
C2 10,6 15,94
Lampiran 2. Hasil pengukuran kualitas air pada media ikan kerapu bebek
Tanggal Waktu Suhu (oC) DO (mg/l) Salinitas (ppt) Amoniak (mg/l)
25/4/2010 06.00 29 6,45 31 0,009
12.00 28 7,12 32 0,012
18.00 29 6,87 31 0,005
23.00 29 8,12 32 0,010
4/5/2010 06.00 28 6,23 32 0,007
12.00 29 7,56 32 0,009
18.00 29 7,47 33 0,010
23.00 29 6,64 32 0,006
13/5/2010 06.00 29 6,31 33 0,005
12.00 28 7,97 32 0,010
18.00 28 7,64 31 0,009
23.00 29 6,98 33 0,011
21/5/2010 06.00 29 6,10 32 0,006
12.00 28 8,19 33 0,009
18.00 29 7,73 34 0,011
Lampiran 3. Tahapan Pembuatan Preparat Histopatologi
1. Fiksasi jaringan dan parafinasi a. Fiksasi
Fiksasi merupakan tahapan yang dilakukan untuk mencegah autolisis
dan dekomposisi post-mortem dari suatu jaringan atau organ. Larutan
fiksasi yang digunakan yaitu larutan Bouin s yang memiliki komposisi
asam pikrat, formalin, dan asam glasial dengan perbandingan 15:5:1.
Jaringan tersebut direndam dalam larutan fiksatif selama 48 jam.
Perendaman dilakukan di dalam botol film dengan volume larutan
fiksatif sebanyak 15-20 kali volume jaringan.
b. Dehidrasi
Dehidrasi dilakukan untuk mengeluarkan cairan dari dalam sel dengan
cara merendam jaringan yang telah difiksasi ke dalam alkohol mulai
dari konsentrasi rendah ke konsentrasi tinggi. Tahap pertama yaitu
perendaman di dalam alkohol 70% selama 24 jam. Perendaman
dilakukan di dalam botol film yang sebelumnya telah digunakan untuk
perendaman larutan fiksatif yang telah dibuang terlebih dahulu.
Kemudian organ dibungkus dengan menggunakan kain kasa dan diikat
dengan benang seperti teh celup. Setelah 24 jam organ tersebut
ditiriskan dan dimasukkan kembali ke dalam botol alkohol 80%, 90%,
95% masing-masing 2 jam. Selanjutnya dimasukkan lagi ke dalam
alkohol 100% selama 12 jam pada suhu ruang.
c. Clearing
Clearing merupakan proses penjernihan yang bertujuan untuk
menggantikan alkohol dan penambahan clearing agent (xylol) yang
berfungsi sebagai pelarut parafin. Tahap pertama jaringan tersebut
d. Impregnasi
Impregnasi dilakukan untuk penggantian xylol dengan parafin cair
yang berlangsung dalam oven pada suhu 600C. Tahapan yang
dilakukan yaitu dengan melakukan perendaman jaringan ke dalam
xylol-parafin (1:1) pada gelas piala selama 45 menit.
e. Embedding
Embedding merupakan proses untuk memasukkan parafin cair ke
dalam sel. Proses ini berlangsung di dalam oven pada suhu 600C untuk
mencairkan parafin, karena titik cair parafin yaitu 54-580C. Tahap
tersebut dilakukan untuk menyusupkan parafin ke dalam seluruh celah
antar sel maupun ke dalam sel agar lebih tahan pada saat proses
pemotongan. Proses perendaman dilakukan di dalam gelas piala yang
berisi parafin I, parafin II, dan parafin III secara berturut-turut
masing-masing selama 45 menit.
f. Blocking
Blocking dilakukan untuk mencetak jaringan yang telah diembedding
dalam parafin cair yang kemudian dibekukan. Proses pencetakan
dilakukan pada kertas yang kaku dengan ukuran 2x2x2 cm3. Parafin
cair dituang hingga 1/8 bagian cetakan dan dibiarkan hingga agak
membeku. Kemudian jaringan disusun dengan bagian sayatan yang
diperlukan menghadap dasar cetakan dan dituang lagi dengan parafin
cair hingga jaringan terendam. Selanjutnya dibiarkan menmbeku pada
suhu ruang selama 24 jam.
g. Trimming
Trimming merupakan proses pencetakan blok parafin yang telah
membeku dengan sempurna yang sebelumnya kertas cetakan dilepas
terlebih dahulu. Kemudian blok parafin tersebut dipotong
menggunakan silet agar dapat disesuaikan dengan tempat blok pada
2. Pemotongan jaringan
Pemotongan jaringan dilakukan dengan menggunakan mikrotom.
Ketebalan untuk tiap sayatan yaitu 4 mikrometer. Teknik pemotongan
parafin adalah sebagai berikut.
a. Blok parafin yang telah dipotong dengan silet diletakkan pada tempat
duduknya di mikrotom. Tempat duduk blok parafin beserta blok
parafinnya kemudian diletakkan pada holder mikrotom dan dikunci
dengan kuat. Mata pisau yang digunakan harus yang tajam agar proses
pemotongan parafin dapat dilakukan dengan sempurna.
b. Ketebalan potongan diatur dengan cara menggeser bagian pengatur
ketebalan hingga yang diinginkan. Ketebalan sayatan yang digunakan
untuk pengamatan adalah 4 mikrometer.
c. Blok preparat digerakkan ke arah pisau sedekat mungkin lalu blok
preparat tersebut dipotong secara teratur dan berkelanjutan. Pita-pita
parafin yang terpotong diawal dibuang terlebih dahulu hingga
diperoleh potongan yang mengandung preparat jaringan.
d. Hasil irisan tersebut diambil dengan menggunakan jarum lalu
diletakkan dalam waterbath dengan suhu 45-500C hingga mengembang.
e. Pita parafin yang sudah mengembang selanjutnya ditempelkan pada
gelas objek yang telah diberi zat perekat seperti albumin dengan cara
memasukkan gelas parafin ke dalamwaterbathdan digerakkan ke arah pita parafin hingga melekat pada gelas objek. Kemudian dibiarkan
kering.
3. Pewarnaan jaringan a. Dewaxing
b. Hidrasi
Hidrasi merupakan proses pemasukan air ke dalam preparat jaringan
pada gelas objek. Tahapan yang dilakukan dalam proses hidrasi yaitu
dengan merendam gelas objek tersebut ke dalam alkohol 100%
sebanyak dua kali, selanjutnya direndam dalam alkohol 95%, 90%,
80%, 70%, dan 50% masing-masing selama 2 menit. Setelah proses
tersebut preparat jaringan direndam dalam akuades selama dua menit.
c. Pewarnaan hematoksilin-eosin
Setelah hidrasi, preparat jaringan tersebut diberi pewarna
hematoksilin-eosin. Tahapan yang dilakukan dalam proses tersebut
yaitu perendaman preparat jaringan dengan pewarna hematoksilin
selama 7 menit kemudian dicuci dengan air mengalir selama 7 menit
untuk menghilangkan kelebihan zat pewarna yang tidak diserap.
Kemudian preparat jaringan tersebut direndam dengan pewarna eosin
selama 3 menit lalu dicuci dengan akuades.
d. Dehidrasi
Preparat jaringan tersebut selanjutnya direndam dalam alkohol 70%,
85%, 90%, dan 100% masing-masing selama dua menit. Lalu preparat
jaringan direndam dalam xylol I dan xylol II masing-masing selama
dua menit.
e. Mounting
Preparat yang telah diwarnai dapat dibuat menjadi preparat yag lebih
awet dengan cara mounting menggunakan mounting agent seperti
enthellan. Selanjutnya preparat tersebut ditutup dengan menggunakan
gelas penutup. Dalam proses penutupan diusahakan agar tidak timbul
gelembung udara. Preparat dikeringkan pada suhu ruang selama 24
jam. Tahap akhir setelah hasil preparat kering yaitu pengamatan
Lampiran 4. Komposisi media yang digunakan untuk kultur bakteri patogen
Sea Water Complete(SWC) untuk 100 ml
Bacto peptone 0,5 gram
Yeast extract 0,1 gram
Bacto agar 2 gram
Glycerol 0,3 ml
Air laut 75 ml
Akuades 25 ml
Thiosulphate Citrate Bile-salt Sucrose(TCBS) untuk 100 ml
TCBS 8,9 gram
Akuades steril 100 ml
Sulfide Indol Motil(SIM) untuk 100 ml
SIM medium 3 gram
Akuades 100 ml
Oksidatif/Fermentatif (O/F) untuk 100 ml
O/F medium 0,94
Akuades 100 ml
Media katalase
H2O2 1 tetes
Media oksidase
Lampiran 5. Prosedur Pewarnaan Gram
1.Siapkan gelas objek yang bersih dari lemak dengan menggunakan alkohol
70% dan diberi label
2.Teteskan satu tetes akuades
3.Isolat diambil secara aseptik dengan jarum ose steril sebanyak 1 ose biakan,
suspensikan secara homogen
4.Dilakukan fiksasi diatas nyala api hingga terlihat kering
5.Larutan Kristal Violet diteteskan diatas preparat dan dibiarkan selama 1
menit, cuci preparat dengan air mengalir
6.Larutan Iodine lugol diteteskan diatas preparat dan dibiarkan selama 1
menit, cuci preparat dengan air mengalir
7.Larutan alkohol aseton diteteskan diatas preparat dan dibiarkan selama 30
detik, cuci preparat dengan air mengalir
8.Larutan Safranin diteteskan diatas preparat dan dibiarkan selama 30 detik,
cuci preparat dengan air mengalir
9.Preparat dapat diamati dibawah mikroskop dengan perbesaran 400x atau
1000x yang sebelumnya telah ditetesi dengan minyak imersi.
10. Hasil yang diperoleh berupa warna ungu untuk bakteri gram positif dan
Lampiran 6. Prosedur uji Oksidatif/Fermentatif
1.Koloni bakteri diambil sebanyak 1 ose dengan menggunakan jarum ose
steril
2.Ditusukkan secara vertikal hingga ¾ pada kedua medium O/F
3.Ditambahkan 0,5 ml parafin cair steril pada salah satu medium
4.Diinkubasi pada suhu kamar selama 24 jam
5.Diamati perubahan warna yang terjadi, reaksi oksidatif bila media yang
tidak ditutup dengan parafin berubah warna menjadi kuning dan yang
tertutup parafin tetap berwarna hijau, sedangkan reaksi fermentatif bila
Lampiran 7. Prosedur uji Motilitas
1.Koloni bakteri diambil sebanyak 1 ose dengan menggunakan jarum ose
steril.
2.Ditusukkan secara vertikal hingga ¾ medium SIM
3.Diinkubasi pada suhu kamar selama 24 jam
4.Diamati pertumbuhan bakteri pada medium, hasil uji tersebut digunakan
untuk mengetahui motilitas bakteri (ada tidaknya alat gerak/flagel), bakteri
yang bersifat motil akan tumbuh menyebar pada permukaan media,
sedangkan bakteri yang bersifat non motil hanya tumbuh pada bekas
Lampiran 8. Prosedur uji Katalase
1.H2O2 diteteskan pada gelas objek sebanyak satu tetes
2.Bakteri diambil sebanyak satu ose biakan bakteri
3.Diamati perubahan yang terjadi, jika terdapat gelembung menunjukkan
reaksi positif, sedangkan uji dikatakan negatif jika tidak terdapat
Lampiran 9. Prosedur uji Oksidase
1.p-aminodimethylaniline-oxalat 1% diteteskan pada kertas saring
2.1 ose biakan bakteri diambil dan dioleskan secara merata pada
p-aminodimethylaniline-oxalat
3.Diamati perubahan warna yang terjadi, reaksi menunjukkan hasil positif jika
kertas saring yang ditetesi p-aminodimethylaniline-oxalat 1% dan diolesi
dengan bakteri berubah warna menjadi merah, sedangkan reaksi
menunjukkan hasil negatif jika kertas saring yang ditetesi
p-aminodimethylaniline-oxalat 1% dan diolesi dengan bakteri tidak
Lampiran 10. Hasil Histologi - = tidak ada kerusakan organ