PERBANDINGAN SISTEM EKSTRAKSI DAN VALIDASI
PENENTUAN XANTORRHIZOL DARI TEMULAWAK
SECARA KROMATOGRAFI CAIR KINERJA TINGGI
SRI WAHYUNI NUR
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
SRI WAHYUNI NUR. Perbandingan Sistem Ekstraksi dan Validasi Penentuan Xantorrhizol dari Temulawak. Dibimbing oleh LATIFAH KOSIM DARUSMAN dan IRMANIDA BATUBARA.
Xantorrhizol merupakan salah satu komponen minyak atsiri yang terdapat pada temulawak dan memiliki aktivitas antioksidan, antikanker, dan antibakteri. Sistem ekstraksi yang efektif dan efesien diperlukan untuk mengekstraksi xantorrhizol dari temulawak sehingga dapat diterapkan dalam industri. Analisis kadar xantorrhizol dilakukan dengan kromatografi cair kinerja tinggi (KCKT). Untuk meyakinkan bahwa metode analisis KCKT dapat digunakan sesuai dengan tujuan yang diinginkan maka metode tersebut divalidasi. Tujuan penelitian ini adalah membandingkan sistem ekstraksi xantorrhizol dan membuktikan bahwa metode KCKT memenuhi persyaratan validasi. Ekstraksi xantorrhizol dilakukan dengan menggunakan empat sistem ekstraksi yang berbeda. Parameter validasi yang dievaluasi terdiri atas limit deteksi, limit kuantifikasi, linearitas, ketelitian, dan ketepatan.
Sistem ekstraksi yang menggunakan rimpang temulawak yang tidak dikupas kulitnya dan dimaserasi selama 24 jam dengan etanol adalah yang terbaik. Kadar xantorrhizol dalam ekstrak ialah 107.92 ppm atau 1.11%b/b. Analisis KCKT standar xantorrhizol menghasilkan puncak dengan waktu retensi 7.910 ± 0.092 menit. Limit deteksi dan limit kuantitasi metode adalah 9.83 ppm dan 65.79 ppm. Persamaan regresi y = 165608 + 104355x dan nilai koefisien korelasi 0.9998 menunjukkan analisis ini memiliki linearitas yang tinggi. Metode analisis ini memiliki ketelitian dan ketepatan yang baik dengan nilai simpangan baku relatif 1.52% dan rerata perolehan kembali sebesar 106.27 ± 1.79%. Metode ini dapat digunakan untuk menentukan kadar xantorrhizol secara kuantitatif.
ABSTRACT
SRI WAHYUNI NUR. Comparison of Extraction Systems and Validation of Xanthorrhizol Determination from Java Turmeric. Supervised by LATIFAH KOSIM DARUSMAN and IRMANIDA BATUBARA.
Xanthorrhizol is one component of volatile oils in java turmeric (Curcuma xanthorrhiza Roxb.) and shows antioxidant, anticancer, and antibacterial activities. An effective and efficient extraction system is needed to extract xanthorrhizol from java turmeric so that it can be applied in industry. Xanthorrhizol content analysis was done by high performance liquid chromatography (HPLC). To make sure that HPLC analysis method can be used for the intended purpose then the method was validated. The objectives of this research were to compare xanthorrhizol extraction systems and prove that HPLC method fulfill the terms of validation. Xanthorrhizol extraction was done by four different extraction systems. Parameters of validation consisted of limit of detection (LOD), limit of quantification (LOQ), linearity, precision, and accuracy.
The system using rhizome of java turmeric without peeling and macerated for 24 hours using ethanol was the best. Xanthorrhizol content in the extract was 107.92 ppm or 1.11%w/w. HPLC identification of xanthorrhizol standard showing peaks with retention time 7.910 ± 0.092 minutes. LOD and LOQ of this method were 9.83 ppm and 65.79 ppm, respectively. Regression equation y = 165608 + 104355x and with coefficient correlation value 0.9998 showed the high linearity of this analysis. The method had good precision and accuracy with relative standard deviation 1.52% and average recovery 106.27 ± 1.79%. This method is valid to be used for determining xanthorrhizol content quantitatively.
PERBANDINGAN SISTEM EKSTRAKSI DAN VALIDASI
PENENTUAN XANTORRHIZOL DARI TEMULAWAK
SECARA KROMATOGRAFI KINERJA TINGGI
SRI WAHYUNI NUR
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul :
Perbandingan Sistem Ekstraksi dan Validasi Penentuan Xantorrhizol dari Temulawak secara Kromatografi Cair Kinerja Tinggi
Nama : Sri Wahyuni Nur NIM : G44201007
Menyetujui:
Pembimbing I, Pembimbing II,
Prof. Dr. Ir. Latifah K. Darusman,
M
.S. Irmanida Batubara, S.Si., M.Si.NIP 130536681 NIP 132312528
Mengetahui:
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam Institut Pertanian Bogor
Dr. Ir. Yonny Koesmaryono, M.S.
NIP 131473999
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala rahmat dan hidayah-Nya sehingga karya ilmiah ini dapat diselesaikan. Skripsi ini disusun berdasarkan hasil penelitian dengan judul Perbandingan Sistem Ekstraksi dan Validasi Penentuan Xantorrhizol dari Temulawak yang dilaksanakan mulai Juli 2005 sampai Februari 2006 di Laboratorium Kimia Analitik dan Pusat Studi Biofarmaka, Institut Pertanian Bogor.
Ucapan terima kasih penulis sampaikan kepada Ibu Prof. Dr. Ir. Latifah K. Darusman, MS, dan Ibu Irmanida Batubara, MSi. selaku pembimbing yang telah memberikan bimbingan, saran, dan ilmu selama penelitian dan penyusunan karya ilmiah ini. Terima kasih penulis ucapkan kepada Pusat Studi Biofarmaka LPPM IPB atas bantuan dana penelitian yang merupakan kerjasama dengan University of Yonsei, Korea Selatan. Penulis mengucapkan terima kasih kepada kedua orang tua tercinta, adik-adik tersayang (Ardi dan Irwan) dan seluruh keluarga atas segala doa, dukungan semangat, perhatian, dan kasih sayangnya.
Penulis berterima kasih kepada Om Eman, Ibu Enung, dan seluruh staf serta laboran Kimia Analitik atas fasilitas dan bantuan yang telah diberikan. Terima kasih kepada Ibu Nunuk, Zaim, dan rekan-rekan dari Pusat Studi Biofarmaka atas bantuannya selama penelitian. Ungkapan terima kasih juga penulis ucapkan kepada Sekar, Nersy, Aning, Nita, Lia, Wulan, Anis, Rehan, Pipit, Green House Family, D5, rekan-rekan seperjuangan di Laboratorium Kimia Analitik, dan teman-teman Kimia angkatan 38 atas saran, semangat, kerja sama, dan kebersamaannya selama ini.
Semoga karya ilmiah ini bermanfaat.
Bogor, Februari 2006
RIWAYAT HIDUP
Penulis dilahirkan di Bekasi pada tanggal 18 Februari 1984 dari ayah Saleh Waluya Nur dan ibu Rohanah. Penulis merupakan putri pertama dari tiga bersaudara.
Tahun 2001 penulis lulus dari SMU Negeri 1 Cikarang dan pada tahun yang sama lulus seleksi masuk Institut Pertanian Bogor (IPB) melalui jalur Undangan Seleksi Masuk IPB. Penulis memilih Program Studi Kimia, Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam. Pada tahun 2004 penulis melakukan praktik lapangan di PT Indofarma (Persero) Tbk di Cibitung, Bekasi.
DAFTAR ISI
Halaman
DAFTAR TABEL... viii
DAFTAR GAMBAR ... viii
DAFTAR LAMPIRAN... viii
PENDAHULUAN ... 1
TINJAUAN PUSTAKA Temulawak... 1
Komposisi Kimia Temulawak... 2
Xantorrhizol ... 2
Ekstraksi... 2
Uji Kesesuaian Sistem... 3
Validasi ... 3
Parameter-parameter Validasi ... 3
Kromatografi Cair Kinerja Tinggi (KCKT) ... 4
BAHAN DAN METODE Bahan dan Alat ... 4
Metode Penelitian ... 4
HASIL DAN PEMBAHASAN Uji Pendahuluan ... 7
Ekstraksi Xantorrhizol ... 8
Analisis dengan KLT... 9
Uji Kesesuaian Sistem... 10
Validasi Metode Penentuan Xantorrhizol dengan KCKT ... 10
Pengukuran Kadar Xantorrhizol dengan KCKT ... 12
SIMPULAN DAN SARAN Simpulan ... 12
Saran ... 13
DAFTAR PUSTAKA ... 13
DAFTAR TABEL
Halaman
1 Kadar air dan kadar abu temulawak... 7
2 Uji fitokimia pendahuluan rimpang temulawak ... 8
3 Rendemen hasil ekstraksi rimpang temulawak ... 9
4 Uji fitokimia ekstrak temulawak... 9
5 Hasil uji kesesuaian sistem ... 10
6 Waktu retensi dan luas puncak larutan standar xantorrhizol ... 11
7 Hasil uji ketelitian ... 11
8 Data perolehan kembali ... 11
9 Konsentrasi dan kadar xantorrhizol pada ekstrak ... 12
DAFTAR GAMBAR
Halaman 1 Tanaman temulawak ... 22 Rimpang temulawak ... 2
3 Xantorrhizol ... 2
4 Kromatogram hasil KLT standar xantorrhizol (s), ekstrak sistem ekstraksi 1 (1), ekstrak sistem ekstraksi 2 (2), ekstrak sistem ekstraksi 3 (3), dan ekstrak sistem ekstraksi 4 (4)... 9
5 Kurva standar xantorrhizol ... 11
DAFTAR LAMPIRAN
Halaman
1 Bagan alir penelitian ... 16
2 Bagan alir ekstraksi xantorrhizol ... 17
3 Bagan persiapan larutan dengan metode penambahan standar ... 18
4 Hasil analisis kadar air rimpang temulawak ... 18
5 Hasil analisis kadar abu rimpang temulawak... 19
6 Data rendemen hasil ekstraksi rimpang temulawak... 19
7 Nilai Rf dan warna bercak hasil KLT ... 20
8 Kromatogram larutan standar xantorrhizol 122.82 ppm ... 20
9 Perhitungan faktor ikutan (T)... 22
10 Kromatogram larutan standar xantorrhizol konsentrasi (a) 9.83 ppm (b) 24.56 ppm (c) 73.69 ppm (d) 98.26 ppm (e) 147.39 ppm... 23
11 Kromatogram larutan blanko ... 24
PENDAHULUAN
Indonesia merupakan salah satu negara tropis yang kaya akan keanekaragaman tumbuhan. Jumlah spesies tumbuhan yang ada di Indonesia lebih dari 30.000 spesies dan tidak kurang dari 7.000 spesies di antaranya diketahui memiliki khasiat sebagai obat. Namun dari 7.000 spesies tersebut, hanya sekitar 300 spesies atau 4.5% yang telah dimanfaatkan dan diolah (Deptan 2004). Data tersebut menunjukkan bahwa Indonesia memiliki potensi kekayaan tanaman obat yang sangat besar tetapi belum dimanfaatkan secara optimal.
Temulawak (Curcuma xanthorrhiza
Roxb.) adalah tanaman asli Indonesia yang tumbuh berumpun. Tanaman ini telah lama dimanfaatkan oleh sebagian besar masyarakat Indonesia sebagai obat tradisonal, zat warna, maupun sebagai bahan pangan. Temulawak merupakan salah satu tanaman obat unggulan Departemen Pertanian (Deptan) dan Badan Pengawas Obat dan Makanan (BPOM) tahun 2004 (Deptan 2004).
Kandungan kimia rimpang temulawak adalah zat pati (sebagai kandungan terbanyak, biasanya digunakan sebagai bahan makanan), kurkuminoid, dan minyak atsiri (Sidik et al. 1992). Berdasarkan hasil penelitian, diketahui bahwa khasiat temulawak terutama disebabkan oleh dua kandungan utamanya, yaitu kurkuminoid dan minyak atsiri. Kurkuminoid memberikan warna kuning pada rimpang temulawak, yang terdiri atas kurkumin dan desmetoksikurkumin. Minyak atsiri temulawak mempunyai rasa yang tajam dengan bau khas aromatik, terdiri atas 32 komponen yang secara umum bersifat meningkatkan produksi getah empedu dan antiinflamatori. Kandungan utama dalam minyak atsiri temulawak adalah xantorrhizol, germakren, trisiklin, dan afla-aromadendren (Oei et al. 1985).
Xantorrhizol merupakan suatu senyawa yang khas dari temulawak dan memiliki aktivitas antibakteri, antiseptik, dan antibiotik (Sirait et al. 1985). Industri yang mengolah temulawak umumnya menggunakan metode penggodokan untuk mendapatkan campuran yang berkhasiat. Metode yang digunakan sebagian besar menggunakan air sebagai pelarut. Hal ini kurang efektif karena banyak senyawa aktif termasuk xantorrhizol yang tidak larut dengan baik di dalam air. Oleh karena itu perlu dicari metode ekstraksi yang lebih baik untuk mengambil xantorrhizol
dalam temulawak sehingga dapat diterapkan dalam industri.
Xantorrhizol dari temulawak dapat dianalisis dengan berbagai macam cara, yaitu dengan menggunakan kromatografi gas (KG), kromatografi gas-spektrometri massa, kromatografi cair kinerja tinggi (KCKT), spektrofotometri ultraviolet (UV), dan kromatografi lapis tipis (KLT). Analisis kadar xantorrhizol pada penelitian ini menggunakan KCKT karena metode tersebut memiliki sensitivitas yang lebih tinggi dibandingkan dengan yang lain. Selain itu KCKT hanya memerlukan jumlah sampel yang sedikit (beberapa mikroliter), dapat digunakan untuk sampel yang bersifat volatil maupun nonvolatil, dan waktu analisis yang lebih cepat (Hendayana et al. 1994). Hasil analisis yang akurat dan absah akan diperoleh apabila metode yang digunakan telah tervalidasi.
Validasi merupakan suatu kegiatan untuk membuktikan bahwa metode analisis telah dilakukan dengan benar sesuai dengan tujuan yang diinginkan (Green 1996). Untuk meyakinkan bahwa metode analisis dapat digunakan dan menjamin mutu produk yang dihasilkan sesuai persyaratan, maka metode tersebut harus divalidasi. Pada umumnya, metode analisis tersebut harus memenuhi syarat penerimaan parameter validasi, yaitu ketelitian, ketepatan, linearitas, dan spesifisitas.
Tujuan penelitian ini adalah membandingkan sistem ekstraksi yang berbeda terhadap kadar xantorrhizol yang terekstraksi dari rimpang temulawak dan memperoleh hasil validasi metode analisis xantorrhizol dengan KCKT. Penelitian ini dilaksanakan di Laboratorium Kimia Analitik dan Pusat Studi Biofarmaka, Institut Pertanian Bogor dan berlangsung dari bulan Juli 2005 sampai Februari 2006.
TINJAUAN PUSTAKA
Temulawak
Curcuma xanthorrhiza Roxb. atau yang dikenal dengan nama temulawak menurut Oei
et al. (1985) merupakan salah satu tumbuhan dari 16 jenis temu-temuan yang tumbuh di Indonesia dan sudah lama digunakan dalam pengobatan tradisional (Gambar 1). Curcuma
berarti akar. Temulawak dikenal juga dengan nama geelwortel (Belanda), Javanischer gelbwurzel (Jerman), koneng gede (Sunda), dan temolobak (Madura) (Oei et al. 1985).
Sesuai dengan klasifikasi botani, temulawak termasuk dalam
Divisi : Spermatophyta Sub Divisi : Angiospermae Kelas : Monocotyledonae Bangsa : Zingiberales Suku : Zingiberaceae Marga : Curcuma
Spesies : Curcuma xanthorrhiza Roxb.
Gambar 1 Tanaman temulawak.
Temulawak dapat digunakan sebagai jamu untuk obat demam (malaria), pegal-pegal, dan sembelit. Air perasan atau rebusannya dapat dipakai sebagai alternatif pengobatan gangguan hati dan penyakit kuning. Selain itu, ekstrak temulawak juga dapat menambah nafsu makan, menurunkan kadar kolesterol dan trigliserida darah, menghambat kerja enzim yang penting untuk pertumbuhan sel tumor, serta mencegah dan menyembuhkan jerawat (Sidik et al.1992).
Komposisi Kimia Temulawak
Semua bagian dari temulawak berkhasiat, namun bagian yang paling berharga adalah rimpangnya atau umbinya (Gambar 2). Rimpang temulawak ini mengandung lebih dari 100 macam senyawa seperti pati, protein, serat, kurkumin, glikosida, toluil metil karbinol, kalium oksalat, essoil, L-sikloiprenmirsen, dan minyak atsiri (Wijayakusuma 2001).
Gambar 2 Rimpang temulawak.
Kandungan kimia rimpang temulawak yang memberi arti pada penggunaannya
sebagai bahan pangan, bahan baku industri, dan bahan baku obat ialah pati, minyak atsiri, dan kurkuminoid (Sidik et al. 1992). Minyak atsiri atau minyak menguap merupakan komponen dalam temulawak yang memberikan bau yang khas, sedangkan kurkuminoid yang memberikan warna kuning pada temulawak terdiri atas kurkumin dan desmetoksikurkumin.
Xantorrhizol
Xantorrhizol merupakan komponen minyak atsiri rimpang temulawak yang termasuk ke dalam kelompok terpen teroksigenasi (Setijadi 1985). Xantorrhizol merupakan komponen yang khas dalam minyak atsiri rimpang temulawak.
Gambar 3 menunjukkan struktur kimia xantorrhizol. Rumus molekulnya ialah C15H22O dengan bobot molekul 218.3 g/mol (Sidik 1992). Nama IUPAC (International Union of Pure and Applied Chemistry) dari xantorrhizol adalah 5-(1,5-dimetil-heks-4-enil)-2-metil-fenol. Xantorrhizol merupakan minyak yang tidak berwarna serta larut dalam DMSO (dimetilsulfatoksida) dan etanol 100%. CH3 OH C H3 CH3 CH3 Gambar 3 Xantorrhizol.
Xantorrhizol memiliki banyak kegunaan, salah satunya dalam bidang farmasi. Senyawa ini memiliki aktivitas antikanker. Selain itu, xantorrhizol juga dapat digunakan sebagai antiseptik atau antibiotik pada pengobatan gigi dengan cara mematikan Streptococcus mutans
yang merupakan salah satu bakteri penyebab sakit gigi (Hwang et al. 2000).
Ekstraksi
eter, alkohol, benzena, toluena, atau kombinasi pelarut-pelarut tersebut (Oei et al. 1985). Hasil ekstraksi antara bahan kering dan bahan basah dengan air atau alkohol menunjukkan bahwa kadar minyak atsiri tertinggi ternyata diperoleh dari ekstraksi bahan kering dengan menggunakan alkohol. Cara lain untuk mengekstraksi minyak atsiri, yaitu dengan menggunakan metode maserasi dan pelarut etanol. Cara ini mungkin akan memberi hasil yang lebih baik karena akan mengurangi terjadinya dekomposisi atau degradasi komponen karena pengaruh suhu (Sidik 1992).
Setijadi (1985) melakukan ekstraksi minyak atsiri rimpang temulawak dengan menggunakan gas karbondioksida superkritik sebagai pelarut. Gas karbondioksida pada keadaan superkritik berada dalam bentuk fluida superkritik sehingga dapat digunakan sebagai pelarut. Keuntungan metode ini ialah ekstraksi dapat dilakukan pada suhu kritik karbondioksida yang relatif rendah, yaitu 31.3 ºC, sehingga dekomposisi dan degradasi komponen-komponen yang tidak tahan pemanasan tidak akan terjadi. Polaritas karbondioksida superkritik dapat diatur melalui pengaturan tekanan sehingga dapat digunakan untuk mengekstraksi seluruh komponen yang berbeda-beda kepolarannya.
Uji Kesesuaian Sistem
Uji kesesuaian sistem adalah pengujian yang dimaksudkan untuk memastikan kesesuaian dan keefektifan sistem operasional yang digunakan (Depkes 2001). Uji ini diperlukan jika metode analisis yang dilakukan digunakan secara rutin. Proses pengerjaan uji kesesuaian sistem ini yaitu dengan mengukur larutan standar sebanyak lima kali dan menghitung faktor ikutan (T) puncak kromatogram yang dihasilkan. Kriteria penerimaan uji kesesuaian sistem yaitu jika 0.5 ≤T ≤ 2.0 (Levin 2002; FDA 1994).
Validasi
Validasi menurut SK Menkes RI No.43/ MENKES/SK/II/1988 tentang CPOB merupakan suatu tindakan pembuktian dengan cara yang sesuai bahwa tiap bahan, prosedur, kegiatan, sistem, perlengkapan atau mekanisme yang digunakan dalam produksi dan pengawasan akan senantiasa mencapai hasil yang diinginkan (Depkes 2001). ASEAN GMP (Association of South East Asian Nation
Good Manufacturing Practice) menyatakan bahwa validasi adalah kegiatan membuktikan dengan pasti bahwa material, proses, prosedur, aktifitas, sistem, peralatan atau mekanisme yang digunakan di pabrik akan mencapai hasil yang diharapkan pada standar yang konsisten (ASEAN 1996).
Validasi menurut Levin (2002) dibagi menjadi empat kelas, yaitu kelas A, B, C, dan D. Kelas A digunakan untuk identifikasi suatu senyawa. Kelas B untuk mendeteksi dan menentukan adanya pengotor. Kelas C dapat menentukan senyawa secara kuantitatif dan kelas D untuk mencari ciri suatu senyawa.
Parameter-parameter Validasi
Parameter-parameter validasi yang diuji pada penelitian ini adalah limit deteksi, limit kuantifikasi, linearitas, ketelitian, dan ketepatan.
Limit Deteksi
Limit deteksi merupakan konsentrasi analit terendah yang menghasilkan respons yang masih dapat dideteksi oleh sistem, pada umumnya perbandingan respons antara analit:derau adalah 3:1. Penentuan limit deteksi harus dilakukan terlebih dahulu sebelum memulai proses validasi (Depkes 2001; Green 1996).
Limit Kuantifikasi
Limit kuantifikasi adalah konsentrasi analit terendah yang terdapat dalam sampel yang dapat diukur secara tepat dan teliti. Limit kuantifikasi dapat dihitung sebagai konsentrasi analit yang memiliki respons analit:derau sebesar 10:1 (Green 1996; ICH 1994).
Linearitas
Linearitas suatu metode analisis adalah ukuran yang menunjukkan tingkat kesesuaian atau korelasi antara kadar analit dengan respons detektor. Linearitas diukur dengan menghitung koefisien korelasi (r) yang didapat dari kurva hubungan antara kadar analit dengan respons detektor (Depkes 2001). Respons detektor yang digunakan ialah luas puncak. r yang didapat harus lebih besar dari 0.990 (ICH 1994). Secara matematis, nilai r
dapat dihitung dengan menggunakan rumus:
Keterangan:
r = koefisien korelasi
xi = konsentrasi analit setiap ulangan x = konsentrasi analit rata-rata
yi = luas puncak setiap ulangan
y = luas puncak rata-rata
Ketelitian
Ketelitian suatu metode analisis adalah ukuran yang menunjukkan tingkat kesesuaian atau kedekatan setiap hasil analisis yang dilakukan berulang pada sampel yang homogen pada kondisi analisis yang sama (Depkes 2001). Ketelitian diukur dengan menghitung simpangan baku relatif (SBR) dari enam kali pengukuran ulang, yang dihitung dengan menggunakan rumus:
1 ) ( 2 1 − − Σ = = n x x SB i n i SBR (%) = 100 . SB
x
Keterangan:SB = simpangan baku
xi = kadar analit pada setiap ulangan
x
= kadar analit rata-ratan = jumlah pengulangan
SBR = simpangan baku relatif
Syarat penerimaan parameter validasi ini, yaitu nilai SBR harus lebih kecil dari 2.0% (ASEAN 1996, ICH 1994).
Ketepatan
Ketepatan merupakan ukuran yang me- nunjukkan tingkat kedekatan hasil analisis (kadar) suatu analit dengan nilai yang sebe- narnya (Depkes 2001). Ketepatan diukur dengan menghitung perolehan kembali (PK) menggunakan metode penambahan standar. Perolehan kembali ditentukan menggunakan rumus:
PK (%) = − ×100%
c b
a
Peralatan yang dperlukan ialah maserator, radas penguap berputar, neraca analitik Precisa XT 220A, eksikator, tanur, oven, sonikator Branson 1510, perangkat KCKT Hitachi dengan detektor UV-Vis L-2420, dan filter 0.2 µm.
Keterangan:
a = konsentrasi sampel + konsentrasi standar yang terukur
b = konsentrasi sampel
c = konsentrasi standar teoretis yang ditambahkan
Nilai PK bergantung pada matriks sampel, prosedur proses sampel, dan konsentrasi analit. Batas penerimaan PK menurut ICH (1994) adalah 80-110%.
Kromatografi Cair Kinerja Tinggi (KCKT)
Kromatografi merupakan salah satu metode pemisahan komponen-komponen campuran dalam keadaan kesetimbangan diantara dua fase yaitu fase diam yang dapat menahan cuplikan dan fase gerak yang dapat membawa cuplikan. Kromatografi berdasarkan fase geraknya dapat dibedakan menjadi dua, yaitu kromatografi gas dan kromatografi cair (Day & Underwood 2002). KCKT merupakan salah satu contoh kromatografi cair yang menggunakan zat cair sebagai fase gerak. Selain untuk pemisahan, metode ini juga dapat digunakan untuk analisis kualitatif dan kuantitatif. Keuntungan menggunakan KCKT antara lain jumlah sampel yang diperlukan sangat sedikit (beberapa mikroliter), waktu yang diperlukan oleh suatu komponen untuk mencapai detektor atau waktu retensinya hanya dalam beberapa menit, dan batas deteksinya sampai nanogram perliter. Instrumen dasar KCKT terdiri dari pompa, sistem pemasukan sampel, kolom, detektor,f dan rekorder (Hendayana et al. 1994).
BAHAN DAN METODE
Bahan dan Alat
Bahan-bahan yang digunakan ialah rimpang temulawak, standar xantorrhizol dengan kemurnian 98.259%, NaOH 0.1N, etanol, indikator universal, karbon aktif, kloroform, NH4OH, H2SO4, pereaksi Mayer, pereaksi Wagner, pereaksi Dragendorf, serbuk Mg, amil alkohol, FeCl3, dietil eter, etil asetat, toluena, lempeng KLT, dan air distilata.
Metode Penelitian
kadar xantorrhizol dalam rimpang temulawak menggunakan KCKT. Bagan alir penelitian terdapat pada Lampiran 1.
Persiapan Bahan Baku
Rimpang temulawak segar yang berasal dari Kabupaten Semarang, hasil penelitian lapangan Pusat Studi Biofarmaka IPB, dibagi menjadi dua bagian yaitu dikupas dan tanpa dikupas kulitnya. Rimpang tersebut dicuci hingga bersih, kemudian diiris dan dikeringkan pada suhu 40 oC. Temulawak yang kering tersebut kemudian dihaluskan dan disimpan.
Analisis Pendahuluan
Penetapan Kadar Air. Cawan porselin dikeringkan pada temperatur 105 oC selama 30 menit, lalu ditempatkan di dalam eksikator dan ditimbang. Rimpang temulawak yang telah dihaluskan ditimbang sekitar 3 g dan dimasukkan ke dalam cawan porselin. Sampel beserta cawannya dikeringkan pada suhu 105 o
C selama 3 jam dan selanjutnya dimasukkan ke dalam eksikator, lalu ditimbang. Prosedur dilakukan berulang kali sampai didapatkan bobot yang tetap dengan selisih kurang lebih 0.001 g. Pekerjaan dilakukan rangkap tiga (Depkes 1995).
Kadar air = a – b x 100% a
Keterangan:
a = bobot sampel sebelum dikeringkan b = bobot sampel setelah dikeringkan
Penetapan Kadar Abu. Cawan porselin dikeringkan pada temperatur 600 ºC selama 30 menit, lalu didinginkan dalam eksikator dan ditimbang. Rimpang temulawak yang telah dihaluskan ditimbang sekitar 3 g dan dimasukkan ke dalam cawan porselin. Sampel beserta cawannya dipanaskan dengan pembakar bunsen sampai tidak berasap lagi. Cawan yang berisi sampel tersebut dimasukkan ke dalam tanur listrik dengan suhu 600 ºC selama 30 menit, lalu didinginkan dalam eksikator, kemudian ditimbang. Prosedur dilakukan berulang kali sampai didapatkan bobot yang tetap dengan selisih kurang lebih 0.001 g. Pekerjaan dilakukan rangkap tiga (Depkes 1995)
Kadar abu =
b
a x 100%
Keterangan:
a = bobot abu sampel b = bobot sampel
Uji Fitokimia. Uji yang dilakukan terdiri atas uji flavonoid, alkaloid, steroid, terpenoid, tanin, dan saponin (Harborne 1996).
Uji Flavonoid dan Saponin. Sebanyak 10 mL ekstrak ditambah 0.5 g serbuk Mg, 0.2 mL HCl dan 2 mL amil alkohol lalu dikocok. Jika lapisan amil alkohol menjadi berwarna cokelat maka positif terdapat flavonoid. Uji saponin dilakukan dengan pengocokan 10 mL filtrat dalam tabung reaksi tertutup selama 10 detik. Adanya saponin ditunjukkan dengan terbentuknya buih yang stabil.
Uji Alkaloid. Sebanyak 1 g ekstrak ditam-bah 10 mL CHCl3 dan beberapa tetes NH4OH. Kemudian larutan disaring dan ekstrak yang dihasilkan dikocok dengan 10 tetes H2SO4 2M. Lapisan asamnya diambil dan ditambah pereaksi Mayer, Wagner, dan Dragendorf. Hasil uji akan positif apabila terbentuk endapan putih ketika direaksikan dengan pereaksi Mayer, endapan cokelat dengan pereaksi Wagner, dan endapan merah jingga dengan pereaksi Dragendorf.
Uji Tanin. Sebanyak 4 mL ekstrak dipanaskan selama 10 menit lalu disaring. Filtrat yang diperoleh ditambah FeCl3 1%, jika dihasilkan warna biru tua atau hijau maka hasil uji positif terhadap tanin.
Uji Steroid dan Terpenoid. Bahan diekstraksi dengan 10 mL etanol panas lalu disaring dan diuapkan sampai kering. Residu yang diperoleh dilarutkan dalam eter dan disaring kembali sehingga diperoleh dua bagian larut eter dan residu. Bagian yang larut eter langsung diuji dengan dua tetes asam asetat anhidrat dan H2SO4. Residu dilarutkan kembali ke dalam HCl 2N dan disaring lagi, residu yang diperoleh ditambah eter dan dilakukan uji yang sama. Uji positif ditunjukkan dengan warna biru atau hijau untuk steroid dan merah ungu untuk terpenoid.
Ekstraksi
Sistem ekstraksi xantorrhizol yang dilakukan ada empat:
1. Ekstraksi xantorrhizol dari rimpang temulawak tanpa kupas dengan perendaman dalam NaOH.
dikeringkan lalu diekstraksi dengan 50 mL etanol selama 5 jam. Ekstrak yang dihasilkan kemudian dipekatkan dengan radas penguap berputar. Ekstrak ini kemudian dipanaskan pada suhu 50 ºC, ditambahkan 0.1 g karbon aktif, lalu disaring dan diambil filtratnya. Filtrat yang diperoleh diuji secara kualitatif dengan KLT dan uji fitokimia.
2. Ekstraksi xantorrhizol dari temulawak tanpa kupas dan tanpa perendaman dalam NaOH.
Serbuk temulawak yang tidak dikupas kulitnya sebanyak 10 g dimasukkan ke dalam erlenmeyer dan diekstraksi dengan 100 mL etanol selama 5 jam. Ekstrak yang dihasilkan kemudian dipekatkan dengan radas penguap berputar. Ekstrak tersebut kemudian dipanaskan pada suhu 50 ºC, ditambahkan 0.1 g karbon aktif, lalu disaring. Filtrat yang dihasilkan lalu diuji secara kualitatif dengan KLT dan uji fitokimia.
3. Ekstraksi xantorrhizol dari temulawak yang dikupas kulitnya.
Sebanyak 10 g serbuk temulawak yang dikupas kulitnya ditambah 100 mL etanol dan diaduk selama 24 jam. Ekstrak yang dihasilkan kemudian disaring dan diambil filtratnya untuk diuji secara kualitatif dengan KLT dan uji fitokimia.
4. Ekstraksi xantorrhizol dari temulawak tanpa dikupas kulitnya.
Sebanyak 10 g serbuk temulawak yang kulitnya tidak dikupas ditambah 100 mL etanol dan diaduk selama 24 jam. Ekstrak yang diperoleh kemudian disaring dan diambil filtratnya untuk diuji secara kualitatif dengan KLT dan uji fitokimia.
Bagan alir ekstraksi xantorrhizol disajikan pada Lampiran 2.
Analisis dengan Kromatografi Lapis Tipis
(KLT)
Empat ekstrak yang dihasilkan dari empat sistem ekstraksi yang berbeda dan standar xantorrhizol ditotolkan pada lempeng silika gel GF254 sebagai fase diam. Fase gerak yang digunakan yaitu toluena:etil asetat (95:5). Lempeng silika gel dimasukkan ke dalam bejana pengembang yang berisi fase gerak yang telah dijenuhkan. Lempeng tersebut setelah selesai kemudian dikeringudarakan dan dilakukan pengamatan bercak dengan menggunakan lampu UV pada panjang gelombang 254 nm.
Persiapan Injeksi KCKT
Persiapan injeksi KCKT terdiri atas beberapa tahap, yaitu persiapan larutan stok standar xantorrhizol, persiapan larutan standar xantorrhizol, persiapan larutan ekstrak temulawak, dan persiapan larutan ekstrak temulawak dengan penambahan standar xantorrhizol.
Persiapan Larutan Stok Standar Xantorrhizol. Larutan stok standar xantorrhizol dibuat dengan menimbang 0.020 mg standar xantorrhizol dengan kemurnian 98.259%. Standar lalu dilarutkan dalam etanol sampai volumenya 10 mL. Larutan tersebut diambil 5.0 mL dan diencerkan sampai volumenya 10 mL. Konsentrasi larutan stok standar yang diperoleh yaitu 1000 ppm, sedangkan konsentrasi standar xantorrhizol yang sebenarnya adalah 982.59 ppm.
Persiapan Larutan Standar Xantorrhizol. Larutan stok standar xantorrhizol 982.59 ppm diambil sebanyak 0.50, 0.75, 1.00, 1.25, dan 1.50 mL dan dilarutkan dengan etanol sehingga volumenya 10 mL. Konsentrasi larutan standar yang diperoleh sebesar 48.13, 73.69, 98.26, 122.82, dan 147.39 ppm. Larutan ini kemudian disaring dengan menggunakan filter 0.2 μm.
Persiapan Larutan Ekstrak Temulawak. Filtrat ekstrak temulawak yang dhasilkan dari proses ekstraksi ditepatkan volumenya menjadi 100 mL dengan menambahkan etanol. Larutan ekstrak diambil 10 mL dan dilarutkan dengan 90 mL sehingga diperoleh 100 mL larutan ekstrak dengan pengenceran sepuluh kali. Larutan ini kemudian disaring dengan menggunakan filter 0.2 μm.
Persiapan Larutan Campuran Ekstrak Temulawak dengan Standar Xantorrhizol (Metode Penambahan Standar). Larutan ini dibuat dengan menambahkan larutan stok standar xantorrhizol 982.59 ppm sebesar 0.75, 1.00, dan 1.25 mL masing-masing ke dalam 1 mL larutan ekstrak temulawak awal yang belum diencerkan. Campuran tersebut ditepatkan volumenya menjadi 10 mL dengan etanol dan disaring dengan filter 0.2 μm sehingga diperoleh konsentrasi standar 73.69, 98.26, dan 122.82 ppm. Bagan persiapan terdapat pada Lampiran 3.
Uji Kesesuaian Sistem
Validasi Metode Penentuan Xantorrhizol
Kadar xantorrhizol dianalisis dengan menggunakan KCKT. Kolom yang digunakan adalah kolom C18 yang berbahan pengisi silika dengan detektor ultraviolet (UV). Rincian metode yang diperoleh dari Pusat Studi Biofarmaka hasil kerjasama dengan LG
Company, Korea Selatan, belum dapat diberikan.
Limit deteksi dan Limit Kuantifikasi.
Larutan standar xantorrhizol dengan konsentrasi 9.83, 24.56, 48.13, 73.69, dan 98.26 ppm diinjeksikan langsung ke dalam kolom KCKT. Limit deteksi pengukuran ini merupakan konsentrasi xantorrhizol terendah yang menghasilkan respons analat:derau sebesar 3:1, sedangkan limit kuantifikasi 10:1.
Linearitas. Larutan standar xantorrhizol dengan konsentrasi 48.13, 73.69, 98.26, 122.82, dan 147.39 ppm diinjeksikan ke dalam KCKT masing-masing sebanyak 3 kali.
Ketelitian. Uji ketelitian menggunakan larutan ekstrak temulawak metode ekstraksi yang dapat mengekstraksi xantorrhizol terbesar dibandingkan dengan metode yang lain. Larutan ini diinjeksikan sebanyak 6 kali.
Ketepatan. Ketepatan metode ini diuji dengan menggunakan metode penambahan standar. Larutan ekstrak temulawak yang akan diukur langsung diinjeksikan ke dalam KCKT sebanyak 3 kali. Kemudian larutan campuran ekstrak temulawak dan standar xantorrhizol konsentrasi 73.69, 98.26, dan 122.82 ppm diinjeksikan masing-masing sebanyak 3 kali.
Pengukuran Kadar Xantorrhizol
Larutan ekstrak temulawak yang diperoleh dari proses ekstraksi kemudian diukur kadar xantorrhizolnya dengan menggunakan KCKT. Kadar xantorrhizol ditentukan berdasarkan kurva standar yang merupakan hubungan antara konsentrasi standar dengan luas puncak xantorrhizol.
HASIL DAN PEMBAHASAN
Uji Pendahuluan
Penentuan kadar air berguna untuk mengetahui ketahanan suatu bahan yang akan disimpan agak lama, karena kandungan air di dalam suatu bahan merupakan media tumbuh bakteri dan mikroorganisme. Hasil analisis kadar air dapat dilihat pada Lampiran 4 dan rerata kadar air ditampilkan dalam Tabel 1. Kadar air rimpang temulawak yang segar
adalah sebesar 64.66%. Kandungan air rimpang temulawak segar cukup besar, sehingga tidak baik untuk disimpan dalam waktu yang lama. Untuk menanggulanginya maka rimpang temulawak segar harus dikeringkan terlebih dahulu karena kadar air yang kecil memungkinkan untuk penyimpanan bahan yang lama. Rimpang temulawak yang telah dikeringkan mempunyai kadar air yang lebih kecil, yaitu 3.69%, artinya rimpang temulawak kering lebih tahan lama untuk disimpan. Hal ini sesuai dengan pernyataan Winarno (1997), yaitu bila kadar air yang terkandung dalam suatu bahan berkisar antara 3-7%, maka kestabilan optimum bahan akan tercapai dan pertumbuhan mikroba dapat dikurangi. Di samping itu, kadar air rimpang temulawak segar berguna untuk mengetahui berapa banyak rimpang temulawak kering yang diperoleh setelah proses pengeringan.
Kadar air juga dapat dipakai untuk menentukan kadar zat aktif berdasarkan bobot keringnya karena jumlah air yang terkandung bergantung pada perlakuan yang telah dialami bahan dan kelembaban udara tempat penyimpanan. Bahan yang sama jika dianalisis pada waktu yang berbeda dapat menghasilkan kadar zat aktif yang berbeda pula bila kelembaban bahan tersebut berubah. Jika kadar air bahan diketahui maka bobot kering bahan juga akan dapat ditentukan, dan bobot kering itu tetap. Jadi, apabila zat aktif bahan tidak rusak dan bahan juga tidak mengalami perubahan kecuali kadar airnya, maka kadar zat aktif yang ditentukan berdasarkan bobot keringnya akan konstan nilainya (Harjadi 1986).
Penentuan kadar abu dilakukan untuk menentukan kandungan bahan-bahan anorganik atau mineral dalam suatu bahan. Hasil analisis kadar abu rimpang temulawak disajikan pada Lampiran 5. Tabel 1 menunjukkan rerata kadar abu rimpang temulawak segar berdasarkan bobot kering adalah 6.20% dan rimpang temulawak kering 5.30%. Kadar abu rimpang temulawak segar lebih besar daripada yang kering, artinya kandungan bahan anorganik dalam rimpang temulawak yang segar lebih besar dari yang telah dikeringkan.
Tabel 1 Kadar air dan kadar abu temulawak
Temulawak Kadar air* (%)
Kadar abu* (%)
Kering 3.69 5.30 Segar 64.66 6.20
Uji fitokimia dilakukan sebagai uji awal untuk mengetahui kandungan senyawa metabolit sekunder dalam temulawak dan pengaruh proses pengeringan rimpang temulawak dari segar menjadi kering. Uji ini meliputi uji flavonoid, alkaloid, steroid, terpenoid, tanin, dan saponin. Uji terpenoid penting dilakukan karena xantorrhizol merupakan salah satu senyawa terpenoid, yaitu seskuiterpen. Uji yang lain dilakukan untuk mengetahui adanya senyawa lain yang dapat menggangu analisis berikutnya.
Hasil uji fitokimia pendahuluan rimpang temulawak disajikan pada Tabel 2. Berdasarkan pada hasil tersebut diketahui bahwa proses pengeringan temulawak pada suhu 40 oC tidak merusak kandungan senyawa terpenoid yang ada dalam rimpang temulawak. Selain terpenoid, semua rimpang temulawak mengandung senyawa yang lain, yaitu flavonoid, alkaloid, dan steroid. Senyawa inilah yang diduga akan menggangu analisis selanjutnya dengan menggunakan KCKT.
Tabel 2 Uji fitokimia pendahuluan rimpang temulawak Uji Tanpa kupas segar Kupas segar Tanpa kupas kering Kupas kering
Flavonoid ++ ++ ++ ++
Dragendorf + + + +
Mayer - - - - Wagner + + + + Steroid +++ +++ +++ +++ Terpenoid +++ +++ +++ +++ Tanin - - - -
Saponin - - - -
*tanda (-) menyatakan hasil uji negatif, tanda (+) menyatakan hasil uji positif dan intensitas warnanya.
Ekstraksi Xantorrhizol
Proses ekstraksi dilakukan dengan menggunakan empat sistem ekstraksi yang berbeda. Penggunaan empat sistem ekstraksi dimaksudkan untuk mendapatkan satu sistem ekstraksi yang dapat mengekstraksi kadar xantorrhizol terbesar. Semua sistem ekstraksi menggunakan etanol sebagai pelarut karena xantorrhizol memiliki kelarutan yang tinggi dalam etanol. Selain itu, sampai saat ini di Indonesia hanya air dan etanol yang diperbolehkan sebagai pelarut dalam bidang farmasi karena tidak berbahaya bagi tubuh.
Metode maserasi digunakan pada semua sistem ekstraksi. Hal tersebut dilakukan untuk
mencegah terjadinya dekomposisi komponen-komponen yang tidak tahan pemanasan (Sidik 1992). Di samping itu, untuk skala industri metode ini cukup praktis dan tidak memerlukan dana yang besar.
Sistem ekstraksi 1 menggunakan rimpang temulawak kering yang tidak dikupas kulitnya dan kemudian direndam dalam NaOH. Proses perendaman ini bertujuan menghilangkan pengotor atau senyawa yang berbobot molekul besar seperti lemak (Robinson 1995). Residu kemudian dikeringkan, lalu diekstraksi dengan menggunakan pelarut etanol. Setelah itu ekstrak dipanaskan dan ditambahkan karbon aktif untuk menghilangkan pengotor yang ikut terekstraksi. Sistem ekstraksi 2 hampir sama dengan sistem 1, tetapi pada sistem 2 rimpang temulawak tidak direndam dahulu dalam NaOH. Dua sistem ekstraksi ini dapat menunjukkan pengaruh proses perendaman dalam NaOH terhadap rendemen dan kadar xanthorrhizol hasil ekstraksi.
Sampel yang digunakan pada sistem ekstraksi 3 adalah rimpang temulawak kering yang sudah dikupas kulitnya dan langsung diekstraksi dengan etanol tanpa perendaman dalam NaOH, pemanasan, dan penambahan karbon aktif. Sistem ekstraksi 4 sama dengan yang ketiga, hanya sampel yang digunakan rimpang temulawak kering yang tidak dikupas kulitnya. Kedua sistem ini memperlihatkan pengaruh dari sampel, antara yang dikupas kulitnya dan tidak, terhadap rendemen serta kadar xantorrhizol yang terekstraksi.
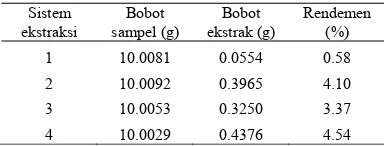
Sistem ekstraksi 1 memiliki rendemen terkecil, yaitu 0.55%, sedangkan rendemen sistem ekstraksi 2 sebesar 4.10%. Ekstrak kedua sistem ini mengalami proses pemanasan pada suhu 50 °C dan penambahan karbon aktif yang diperkirakan dapat menghilangkan pengotor yang ikut terekstraksi, namun perbedaan rendemen yang dihasilkan cukup besar. Hal ini dikarenakan oleh rimpang temulawak sistem 1 sebelum diekstraksi dengan etanol direndam terlebih dahulu dalam NaOH yang dapat menghilangkan pengotor sehingga rendemen ekstraksi akan berkurang dan ekstrak yang dihasilkan diperkirakan akan lebih murni. Rendemen kedua sistem ini lebih kecil dibandingkan dengan sistem ekstraksi 4 karena waktu ekstraksinya yang lebih singkat dari sistem 4, yaitu 5 jam.
Tabel 3 Rendemen hasil ekstraksi rimpang temulawak* Sistem ekstraksi Bobot sampel (g) Bobot ekstrak (g) Rendemen (%)
1 10.0081 0.0554 0.58
2 10.0092 0.3965 4.10
3 10.0053 0.3250 3.37
4 10.0029 0.4376 4.54
* rerata dari tiga kali ulangan
Uji fitokimia dilakukan kembali terhadap ekstrak yang dihasilkan untuk mengetahui senyawa lain yang ikut terekstraksi yang dapat berpengaruh terhadap analisis selanjutnya dengan menggunakan KCKT. Hasil uji fitokimia ekstrak disajikan pada Tabel 4. Semua ekstrak mengandung senyawa-senyawa yang sama seperti sebelum diekstraksi, yaitu flavonoid, alkaloid, steroid, dan terpenoid dengan intensitas warna yang sama, kecuali sistem ekstraksi 1. Ekstrak ini diperkirakan mengalami penurunan kandungan flavonoid, steroid, dan terpenoid yang ditunjukkan dengan berkurangnya intensitas warna yang terbentuk.
Tabel 4 Uji fitokimia ekstrak temulawak
Uji 1* 2* 3* 4*
Flavonoid + ++ ++ ++
Dragendorf + + + +
Mayer - - - -
Wagner + + + +
Steroid + +++ +++ +++
Terpenoid ++ +++ +++ +++
Tanin - - - -
Saponin - - - -
*1: sistem ekstraksi 1, 2: sistem ekstraksi 2, 3: sistem ekstraksi 3, 4: sistem ekstraksi 4, tanda (-) menyatakan hasil uji negatif, tanda (+) menyatakan hasil uji positif dan intensitas warnanya.
Analisis dengan KLT
Analisis dengan KLT dilakukan untuk menentukan adanya kandungan xantorrhizol dalam ekstrak dan menentukan ekstrak yang akan dianalisis dengan menggunakan KCKT. Eluen pengembang yang digunakan yaitu toluena:etil asetat (95:5) yang merupakan eluen yang khas untuk xantorrhizol. Lempeng KLT yang digunakan adalah silika gel GF254 karena lempeng ini mengandung indikator fluorosensi yang akan membuatnya bersinar jika dikenai sinar yang memiliki panjang gelombang yang tepat pada daerah UV (Gritter et al. 1991). Hal ini diperlukan untuk penampakan bercak yang tidak terlihat oleh mata.
Gambar 4 merupakan kromatogram hasil KLT ekstrak rimpang temulawak setelah disinari oleh sinar UV pada panjang gelombang 254 nm. Lempeng KLT tampak berwarna hijau dan semua bercak muncul dengan warna kuning, kecuali bercak yang dapat diamati secara langsung berwarna jingga. Nilai Rf dan warna bercak standar xantorrhizol dan ekstrak hasil ekstraksi dapat dilihat pada Lampiran 7. Standar xantorrhizol muncul dengan bercak tunggal berwarna kuning yang berekor, menunjukkan adanya ketidakmurnian standar. Standar xantorrhizol yang digunakan memiliki kemurnian 98.259%. Nilai Rf standar xanthorrhizol 0.5311 maka bercak yang memiliki nilai Rf ± 0.5311 dan warna bercak yang sama diduga merupakan xantorrhizol.
S 1 2 3 4
Gambar 4 Kromatogram hasil KLT standar xantorrhizol (s), ekstrak sistem ekstraksi 1 (1), ekstrak sistem ekstraksi 2 (2), ekstrak sistem ekstraksi 3 (3), dan ekstrak sistem ekstraksi 4 (4).
Ekstrak sistem ekstraksi 2 tidak memiliki bercak dengan nilai Rf yang sama dengan standar atau bercak xantorrhizol. Hal ini dikarenakan oleh waktu ekstraksi sistem 2 hanya 5 jam, sehingga xantorrhizol dalam rimpang temulawak tidak ikut terekstraksi atau hanya sedikit sekali yang terekstraksi. Proses pemanasan dan penambahan karbon aktif terhadap ekstrak sistem 2 yang bertujuan untuk menghilangkan pengotor, juga diduga menghilangkan xantorrhizol sehingga analisis KLT menunjukkan bahwa ekstrak ini tidak mengandung xantorrhizol.
Ekstrak dengan jumlah bercak paling banyak adalah ekstrak sistem ekstraksi 4 dengan tujuh bercak dan ekstrak yang mempunyai bercak paling sedikit ialah ekstrak sistem ekstraksi 1 dan 2. Menurut Gritter et al.
(1991) bercak tunggal pada KLT menandakan tingkat kemurnian yang baik. Banyaknya bercak menunjukkan adanya senyawa selain xantorrhizol yang ikut terekstrak yang diduga akan mengganggu analisis KCKT. Hal tersebut menunjukkan bahwa hasil ekstraksi rimpang temulawak yang dihasilkan tidak murni.
Ekstrak yang akan dianalisis kadar xantorrhizolnya dengan KCKT berdasarkan rendemen hasil ekstraksi, hasil KLT, dan uji fitokimia adalah ekstrak sistem ekstraksi 1 dan 4. Ekstrak sistem 4 dipilih karena menghasilkan rendemen terbesar dibandingkan dengan yang lain dan hasil analisis KLT menunjukkan bahwa ekstrak 4 mengandung xantorrhizol. Ekstrak 1 dipilih berdasarkan analisis KLT yang memperlihatkan bahwa ekstrak 1 memiliki jumlah senyawa dan pengotor paling sedikit dan mengandung xantorrhizol walaupun rendemennya paling kecil.
Uji Kesesuaian Sistem
Analisis kadar xantorrhizol dilakukan dengan KCKT menggunakan kolom C18, dengan detektor UV. Sistem elusi yang digunakan adalah gradien, yaitu adanya perubahan komposisi eluen selama elusi berlangsung. Sistem ini dapat meningkatkan efisiensi pemisahan komponen-komponen sampel, mempercepat waktu pemisahan tanpa mengurangi resolusi puncak yang muncul di awal (Skoog et al. 1992). Analisis KCKT ini menggunakan metode fase terbalik, yaitu eluen yang digunakan bersifat lebih polar dibandingkan dengan kolom. Metode ini
cocok untuk menganalisis senyawa nonpolar sampai semipolar.
Uji kesesuaian sistem dilakukan dengan menginjeksi larutan standar 122.82 ppm sebanyak lima kali ulangan. Rerata faktor ikutan yang dihasilkan adalah 1.16 (Tabel 5). Kromatogram standar xantorrhizol 122.82 ppm dan cara perhitungan faktor ikutan dapat dilihat pada Lampiran 8 dan 9. Nilai faktor ikutan masuk ke dalam kriteria penerimaan 0.5 ≤ T ≤ 2.0, artinya sistem kromatografi dan kolom yang digunakan sesuai untuk analisis xantorrhizol.
Tabel 5 Hasil uji kesesuaian sistem
Ulangan Faktor ikutan (T)
1 1.22
2 1.16
3 1.20
4 1.16
5 1.04
x* 1.16
*x: nilai rerata faktor ikutan
Validasi Metode Penentuan Xantorrhizol dengan KCKT
Metode analisis penentuan kadar xantorrhizol setelah diuji kesesuaian sistem dinyatakan bahwa sistem tersebut merupakan suatu kesatuan yang utuh dan sesuai serta efektif untuk digunakan secara rutin. Supaya hasil pengukuran bersifat sah dan diakui, selanjutnya metode itu harus divalidasi. Suatu metode dikatakan valid jika memenuhi batas penerimaan parameter-parameter validasi yang berlaku.
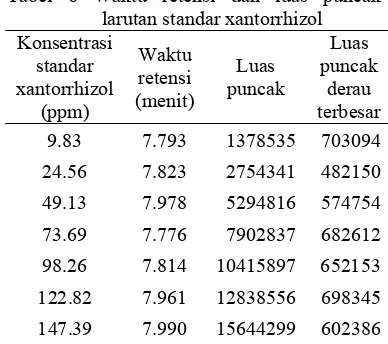
Tabel 6 Waktu retensi dan luas puncak larutan standar xantorrhizol
Konsentrasi standar xantorrhizol (ppm) Waktu retensi (menit) Luas puncak Luas puncak derau terbesar 9.83 7.793 1378535 703094
24.56 7.823 2754341 482150 49.13 7.978 5294816 574754
73.69 7.776 7902837 682612
98.26 7.814 10415897 652153 122.82 7.961 12838556 698345
147.39 7.990 15644299 602386
Limit kuantifikasi merupakan konsentrasi analit terendah yang terdapat dalam sampel yang dapat diukur secara tepat dan teliti. Menurut Green (1996), limit kuantifikasi memiliki perbandingan sinyal analit:derau sebesar 10:1, sedangkan menurut Levin (2002) 4:1. Limit kuantifikasi yang memenuhi persyaratan Green adalah 65.79 ppm, sedangkan larutan standar dengan konsentrasi 24.56 ppm memenuhi persyaratan Levin sebagai limit kuantifikasi karena memiliki luas puncak empat kali derau.
Linearitas ditentukan dengan membuat sebuah kurva kalibrasi hubungan antara konsentrasi standar xantorrhizol dan luas puncak. Kurva standar yang diperoleh dari Tabel 6 memiliki persamaan garis y = 165608 + 104355x dan koefisien korelasi (r) 0.9998 (Gambar 5) untuk kisaran konsentrasi standar xantorrhizol 49.13-147.39 ppm. Kromatogram standar xanthorrhizol konsentrasi 9.83-147.39 ppm ditampilkan pada Lampiran 10. Nilai r
yang diperoleh mendekati satu sehingga dapat dikatakan bahwa kurva memiliki kelinearan yang tinggi, artinya dengan meningkatnya konsentrasi xantorrhizol maka luas puncak juga akan mengalami kenaikan yang linear. Menurut ICH (1994), nilai r yang dihasilkan telah memenuhi persyaratan, yaitu harus lebih besar dari 0.990.
y = 104355x + 165608 r = 0.9998
0 5000000 10000000 15000000 20000000
0 50 100 150 200
konsentrasi standar xanthorrhizol (ppm)
Luas
puncak
Gambar 5 Kurva standar xantorrhizol.
Ketelitian dapat diketahui berdasarkan nilai SBR dari enam kali pengukuran. Larutan yang digunakan pada uji ketelitian adalah ekstrak dari sistem ekstraksi 4 karena ekstrak ini memiliki kadar xanthorrhizol terbesar, yaitu 107.29 ppm. Rerata luas puncak xantorrhizol dan konsentrasi xantorrhizol yang dihasilkan sebesar 11361611.83 dan 107.29 ppm (Tabel 7). Nilai SBR hasil pengukuran adalah 1.52% dan memenuhi kriteria penerimaan parameter ketelitian menurut ICH (1994) dan ASEAN (1996), yaitu SBR harus lebih kecil atau sama dengan 2.0%. Metode ini berdasarkan nilai SBR yang diperoleh termasuk teliti, artinya setiap hasil analisis yang dilakukan secara berulang memiliki nilai yang tidak jauh berbeda.
Tabel 7 Hasil uji ketelitian
Ulangan Luas puncak
Konsentrasi xantorrhizol
(ppm)
1 11260976 106.32
2 11122944 105.00
3 11628502 109.85
4 11381955 107.48
5 11332791 107.01
6 11442503 108.06
x
* 11361611.83 107.29SB* 170943.34 1.64
SBR* (%) 1.50 1.52
* x: nilai rerata, SB: simpangan baku, SBR: simpangan
baku relatif
Ketepatan dapat dilihat berdasarkan nilai perolehan kembali (PK) standar yang ditambahkan ke dalam contoh dengan menggunakan metode penambahan standar. Batas penerimaan ketepatan berdasarkan ICH (1994), yaitu PK berkisar antara 80 dan 110%. Data hasil uji ketepatan dapat dilihat pada Tabel 8. Rerata PK xanthorrizol yang ditambahkan untuk tiga konsentrasi berada di antara kisaran tersebut, yaitu 106.27 ± 1.79%. Hal ini menunjukkan bahwa metode ini tepat untuk menganalisis kadar xantorrhizol karena memenuhi persyaratan ICH.
Tabel 8 Data perolehan kembali
Konsentrasi xantorrhizol (ppm)*
Ekstrak 4 Ditambahkan Diperoleh
PK* (%)
107.29 73.69 78.46 106.48
107.29 98.26 102.57 104.39
107.29 122.82 132.58 107.95
Validasi metode analisis yang dilakukan termasuk ke dalam kelas C, yaitu dapat menentukan kadar xantorrhizol secara kuantitatif. Hal ini dikarenakan hasil validasi metode analisis xantorrhizol dengan menggunakan KCKT memiliki ketepatan dan ketelitian yang baik dan memenuhi persyaratan ICH (1994).
Pengukuran Kadar Xantorrhizol dengan KCKT
Kadar xantorrhizol dalam ekstrak dihitung dengan metode analisis KCKT yang telah divalidasi. Ekstrak dari sistem ekstraksi 1 dan 4 dipilih untuk dianalisis kadarnya dengan KCKT karena beberapa alasan yang telah dijelaskan sebelumnya, antara lain berdasarkan hasil KLT yang menunjukkan bahwa kedua ekstrak positif mengandung xantorrhizol.
Sebelum dilakukan analisis kadar xantorrhizol dalam ekstrak, terlebih dahulu dilakukan analisis terhadap larutan blanko. Larutan blanko merupakan larutan yang tidak mengandung komponen sampel, tetapi hanya berisi pelarut. Larutan blanko yang digunakan untuk analisis ialah etanol. Analisis larutan blanko ini bermanfaat untuk faktor koreksi dan membedakan kromatogram pelarut dengan kromatogram ekstrak dan standar xantorrhizol. Kromatogram hasil analisis blanko disajikan pada Lampiran 11. Hasil analisis blanko menunjukkan bahwa pelarut etanol hanya memiliki puncak pada waktu retensi awal dan tidak memiliki serapan pada waktu retensi 7.910 ± 0.092 menit yang menunjukkan puncak serapan xantorrhizol. Hal ini menunjukkan bahwa etanol sebagai pelarut tidak menggangu analisis penentuan kadar xantorrhizol dalam standar maupun ekstrak dengan menggunakan KCKT.
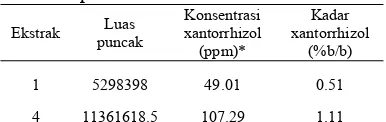
Ekstrak sistem ekstraksi 1 dan 4 setelah dianalisis dengan KCKT terbukti mengandung xantorrhizol karena memiliki puncak serapan pada kisaran waktu retensi standar xantorrhizol, yaitu 7.910 ± 0.092 menit. Berdasarkan perhitungan yang terdapat pada Lampiran 12 diperoleh rerata kadar xantorrhizol berdasarkan bobot kering dalam ekstrak sistem 1 dan 4 masing-masing sebesar 0.51% dan 1.11%b/b (Tabel 9). Hasil ini menunjukkan bahwa sistem 4 dapat mengekstraksi xantorrhizol dengan kadar lebih besar.
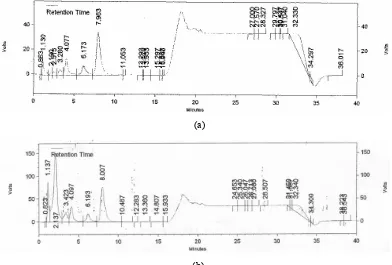
Kromatogram ekstrak sistem 1 dan 4 menunjukkan bahwa kedua ekstrak memiliki
Tabel 9 Konsentrasi dan kadar xantorrhizol pada ekstrak
Ekstrak Luas
puncak Konsentrasi xantorrhizol (ppm)* Kadar xantorrhizol (%b/b)
1 5298398 49.01 0.51
4 11361618.5 107.29 1.11
*Konsentrasi xantorrhizol dalam ekstrak yang mengalami pengenceran 10 kali.
senyawa yang sama karena keduanya mempunyai puncak-puncak dalam waktu retensi yang serupa (Gambar 6). Luas dan tinggi puncak pada kromatogram ekstrak 1 lebih kecil dari ekstrak 4, artinya konsentrasi senyawa-senyawa tersebut lebih sedikit. Hal ini disebabkan oleh proses ekstraksi yang telah dilakukan, diantaranya pada tahap perendaman dalam NaOH, pemanasan, dan penambahan karbon aktif. Tahap tersebut diduga akan menghilangkan pengotor dan juga xantorrhizol. Adanya pengotor yang lebih banyak pada ekstrak 4 dapat dilihat dari lebih banyaknya puncak yang muncul pada kromatogram. Senyawa-senyawa tersebut selain xantorrhizol adalah senyawa pengganggu analisis. Berdasarkan hasil uji fitokimia, kemungkinan senyawa tersebut termasuk ke dalam kelompok flavonoid, alkaloid, dan steroid. Sistem ekstraksi 4 tidak melalui tahap-tahap ekstraksi seperti sistem ekstraksi 1, tetapi sistem ini jauh lebih sederhana dan dapat mengekstraksi xantorrhizol dengan kadar yang lebih besar sehingga lebih mudah jika diterapkan di dalam industri yang menggunakan ekstrak sebagai bahan baku.
SIMPULAN DAN SARAN
Simpulan
(a)
(b)
Gambar 6 Kromatogram ekstrak (a) sistem ekstraksi 1 (b) sistem ekstraksi 4.
atau 1.11%b/b. Analisis KCKT standar xantorrhizol menghasilkan puncak dengan waktu retensi 7.910 ± 0.092 menit. Limit deteksi dan limit kuantifikasi metode adalah 9.83 ppm dan 65.79 ppm. Linearitas yang dihasilkan termasuk tinggi dengan persamaan garis y = 165608 + 104355x dan nilai koefisien korelasi 0.9998. Metode analisis ini memiliki ketelitian dan ketepatan yang baik dengan nilai simpangan baku relatif 1.52% dan rerata perolehan kembali yang dihasilkan sebesar 106.27 ± 1.79%. Validasi metode ini tergolong dalam kelas C, yaitu dapat digunakan untuk menentukan kadar xantorrhizol secara kuantitatif.
Saran
Perlu dilakukan uji terhadap parameter validasi selektivitas dan sensitivitas dari metode analisis penentuan xantorrhizol dengan KCKT. Selain itu, uji ketahanan (robustness) dan ketidakrataan (ruggedness) juga perlu dilakukan. Uji ini dilakukan untuk mengetahui pengaruh dari analis, kondisi instrumen yang digunakan, dan waktu analisis yang berbeda dalam laboratorium yang sama maupun berbeda terhadap hasil akhir.
DAFTAR PUSTAKA
[ASEAN] Association of South East Asian Nation. 1996. Good Manufacturing Practice Guidelines. Ed ke-3. Jakarta: ASEAN.
Day RA, Underwood AL. 2002. Analisis Kimia Kuantitatif. Ed ke-5. Pudjaatmaka AH, penerjemah; Jakarta: Erlangga. Terjemahan dari: Quantitative Analysis.
[Depkes] Departemen Kesehatan, Ditjen POM. 2001. Petunjuk Operasional Penerapan CPOB. Ed ke-2. Jakarta: Depkes.
[Depkes] Departemen Kesehatan. 1995.
Farmakope Indonesia. Ed ke-5. Jakarta: Depkes.
[Deptan] Departemen Pertanian, Ditjen Bina Produksi Hortikultura. 2004. Informasi Pengembangan Agribisnis Tanaman Biofarmaka. Jakarta: Deptan.
Green JM. 1996. A Practical Guide to Analytical Methode Validation. Anal Chem 68:305A-309A.
Gritter RJ, Bobbitt JM, Schwarting AE. 1991.
Pengantar Kromatografi. Ed ke-2. Padmawinata K, Soediro I, penerjemah;
Bandung: Penerbit ITB. Terjemahan dari:
Introduction to Chromatography.
Harborne JB. 1996. Metode Fitokimia. Edisi ke-2. Padmawinata K, Soediro I, penerjemah; Bandung: Penerbit ITB. Terjemahan dari: Phytochemical Method.
Harjadi W. 1986. Ilmu Kimia Analitik Dasar. Jakarta: PT Gramedia.
Hendayana S, Kadarohman A, Sumarna AA, Supriatna A. Kimia Analitik Instrumen. Semarang: IKIP Semarang Press.
Hwang JK, Pyun YR, Shim JS. 2000. Antibacterial activity of xantorrhizol from Curcuma xanthorrhiza against oral pathogens. Fitoterapia 71:321-323.
[ICH] International Conference on Harmonisation. 1994. Validation of Analytical Procedures: Definitions and Terminology. WWW ICH. [terhubung berkala]. http://www.ich.org [9 Jan 2006].
Levin S. 2002. Quantitatif Work in HPLC. WWW Forumsci [terhubung berkala]. http://www.forumsci.co.il/HPLC [2 Feb 2006].
Oei BL, Apsarton Y, Puspa S, Widjaja T. 1985. Beberapa Aspek Isolasi, Identifikasi, dan penggunaan komponen Curcuma xanthorrhiza Roxb. dan Curcuma domestica Vahl. Bandung: PT Darya Varia Laboratoria.
Robinson T. 1995. Kandungan Organik Tumbuhan Tingkat Tinggi. Ed ke-6. Padmawinata K, penerjemah; Bandung: Penerbit ITB. Terjemahan dari: Organic Constituent of Higher Plants.
Setijadi T. 1985. The Identification of the Active Ingredients of Curcuma xanthorrhiza Roxb. and Curcuma longa
Vahl. After Extraction With Supercritical Carbondioxide. Bogor: PT Darya Varia Laboratoria.
Sidik, Muhtadi A, Mulyono MW. 1992.
Temulawak (Curcuma xanthorrhiza
Roxb.). Bandung: Yayasan Pengembangan Obat Bahan Alam.
Sirait M, Gana A, Moesdarsono, Nor KM. 1985. Pemeriksaan Kadar Xantorisol dalam Curcuma xanthorrhiza Roxb.
Simposium Nasional temulawak. Bandung. Penerbit ITB.
Skoog DA, Leary JJ. 1992. Principles of Instrumental Analysis. Ed ke-4. Portland: Saunders College Publishing.
Wijayakusuma H. 2001. Tumbuhan Berkhasiat Obat: Rempah, Rimpang, dan Umbi. Jakarta: Milenia Popular.
Lampiran 1 Bagan alir penelitian
Rimpang temulawak segar
dikupas kulitnya tidak dikupas kulitnya
dicuci, diiris, dicuci, diiris, dikeringkan, Uji Fitokimia, Kadar Air dikeringkan,
dan dihaluskan dan Kadar Abu dan dihaluskan
Rimpang temulawak kering Rimpang temulawak kering yang dikupas kulitnya yang tidak dikupas kulitnya
Ekstraksi
Filtrat
KLT Uji Fitokimia
Pengenceran 10x
Larutan ekstrak temulawak
Pengukuran kadar xantorrhizol dengan KCKT
Uji kesesuaian sistem metode analisis KCKT
Validasi metode penentuan kadar xantorrhizol dengan KCKT (Limit Deteksi, Limit Kuantifikasi,
Lampiran 2 Bagan alir ekstraksi xantorrhizol
Rimpang temulawak
Rimpang temulawak yang Rimpang temulawak yang tidak dikupas kulitnya dikupas kulitnya
Perendaman dalam NaOH Tanpa perendaman dalam NaOH serbuk temulawak + etanol
Aduk 24 jam,
saring
serbuk temulawak + NaOH serbuk temulawak + etanol serbuk temulawak + etanol Filtrat
rendam 5 jam aduk 5 jam, aduk 24 jam,
Ekstrak sistem ekstraksi 1 Ekstrak sistem ekstraksi 2 Ekstrak sistem ekstraksi 4 Ekstrak sistem ekstraksi 3
cuci, saring saring, pekatkan saring Ekstrak Filtrat
rendam dalam NaOH 1 jam, panaskan 50 °C saring, cuci, keringkan + karbon aktif, saring
serbuk kering + etanol Filtrat
aduk 5 jam, saring, pekatkan
Ekstrak
panaskan 50 °C, saring, pekatkan
Lampiran 3 Bagan persiapan larutan dengan menggunakan metode penambahan standar
Larutan stok standar xantorrhizol 982.59 ppm
diambil sebanyak
0.75 mL 1.00 mL 1.25 mL
+ 1.00 mL ekstrak awal rimpang temulawak
+ 8.25 mL etanol + 8.00 mL etanol + 7.75 mL etanol
larutan ekstrak + standar
73.69 ppm 98.26 ppm 122.82 ppm
Lampiran 4 Hasil analisis kadar air rimpang temulawak
Rimpang temulawak
Ulangan Bobot cawan kosong (g)
Bobot sampel (g)
Bobot cawan + sampel setelah dikeringkan (g)
Kadar air (%)
Kering 1 34.4816 3.0132 35.4937 66.23
2 30.3891 3.0084 31.5014 63.03
3 30.4426 3.037 31.5105 64.72
* 64.66
Segar 1 27.4462 3.0038 30.34 3.65
2 27.6070 3.0151 30.5136 3.53
3 30.1987 3.0246 33.1045 3.89
* 3.69
x
*x: nilai rerata dari tiga kali ulangan
Lampiran 5 Hasil analisis kadar abu rimpang temulawak
Rimpang temulawak
Ulangan Bobot cawan kosong (g)
Bobot sampel (g)
Bobot abu
Kadar abu (%)
Kering 1 19.6794 2.0182 0.0461 6.46
2 19.658 2.0143 0.0413 5.80
3 20.5413 2.0022 0.0449 6.35
* 6.20
Segar 1 31.9777 2.0159 0.1037 5.34
2 28.7789 2.0054 0.1024 5.30
3 17.5782 2.0045 0.1016 5.26
* 5.30
x
*x: rerata nilai dari tiga kali ulangan
x
Lampiran 6 Data rendemen hasil ekstraksi rimpang temulawak
Sistem ekstraksi
Sampel Ulangan Bobot
sampel (g)
Bobot ekstrak
(g)
Rendemen (%)
Warna ekstrak
1 Direndam NaOH, diekstrak 1 10.0046 0.0575 0.60 kuning
dengan etanol, dipanaskan, 2 10.0108 0.0514 0.53
dan ditambah karbon aktif 3 10.0088 0.0574 0.60
x 10.0081 0.0554 0.58
2 Tanpa direndam NaOH 1 10.0007 0.401 4.16 cokelat
(diekstraksi, lalu dipanaskan, 2 10.0023 0.3854 4.00 kekuningan
dan ditambah karbon aktif 3 10.0246 0.4004 4.15
x 10.0092 0.3956 4.10
3 Dikupas kulitnya, diekstraksi 1 10.0031 0.3248 3.37 jingga
dengan etanol selama 24 2 10.0092 0.3256 3.38
jam 3 10.0037 0.3246 3.37
10.0053 0.325 3.37
4 Tanpa dikupas kulitnya, 1 10.0012 0.4428 4.6 jingga
langsung diekstraksi 2 10.0061 0.4348 4.51
dengan etanol selama 24 3 10.0013 0.4352 4.52
jam 10.0029 0.4376 4.54
x
Lampiran 7 Nilai Rf dan warna bercak hasil KLT
Sampel Bercak Jarak tempuh
bercak (mm) Rf Warna bercak standar xantorrhizol tunggal 53.11 0.5311 Kuning
ekstrak 1 1 19.85 0.1985 Kuning
2 54.50 0.5450 Kuning
3 64.52 0.6452 Kuning
ekstrak 2 1 0.00 0.0000 Jingga
2 3.63 0.0363 Kuning
3 8.21 0.0821 Kuning
ekstrak 3 1 0.00 0.0000 Jingga
2 2.93 0.0293 Jingga
3 7.38 0.0738 Jingga
4 53.89 0.5389 Kuning
5 60.46 0.6046 Kuning
6 92.34 0.9243 Kuning
ekstrak 4 1 0.00 0.0000 Jingga
2 2.62 0.0262 Jingga
3 6.20 0.0620 Jingga
4 49.67 0.4967 Kuning
5 54.89 0.5489 Kuning
6 60.37 0.6037 Kuning
7 69.20 0.6920 Kuning
Jarak tempuh eluen = 100,00 mm
Contoh perhitungan: Rf standar xantorrhizol = Jarak tempuh bercak Jarak tempuh eluen
= 53.11 mm
100.00 mm
= 0.5311
Lampiran 8 Kromatogram larutan standar xantorrhizol 122.82 ppm
Ulangan 2
Ulangan 3
Ulangan 4
Lampiran 9 Perhitungan faktor ikutan (T)
h h h
A
B
A
T
% 5
% 5 % 5
2
×
+
=
Keterangan:
T = faktor ikutan
A5%h = lebar setengah pertama puncak
(A) pada 5% tinggi puncak B5%h = lebar setengah kedua puncak (B)
pada 5% tinggi puncak
Ulangan A5%h B5%h T
1 0.52 0.75 1.22
2 0.57 0.75 1.16
3 0.57 0.8 1.20
4 0.57 0.75 1.16
5 0.57 0.61 1.04
x = 1.16
Contoh perhitungan:
h h h
A B A T
% 5
% 5 % 5
2×
+ =
=
52
.
0
2
75
.
0
52
.
0
×
+
Lampiran 10 Kromatogram larutan standar xantorrhizol konsentrasi (a) 9.83 ppm (b) 24.56 ppm (c) 49.13 ppm (d)73.69 ppm (e) 98.26 ppm (f) 147.39 ppm
(a)
(b)
(c)
(e)
(f)
Lampiran 11 Kromatogram larutan blanko
Waktu retensi
Luas puncak
Lampiran 12 Perhitungan kadar xantorrhizol dalam ekstrak rimpang temulawak
Persamaan kurva standar: y = 165608 + 104355x Ekstrak sistem ekstraksi 1
Bobot sampel : 10.0081 g Luas puncak xantorrhizol : 5298398
y = 165608 + 104355x 5298398 = 165608 + 104355x
x = 49.01 ppm
[xantorrhizol] dalam ekstrak = 49.01 ppm
×
100 mL = 490.1 ppm 10 mLBobot xantorrhizol = 490.1 mg/L
×
100 mL×
mL 1000
L
1 = 49.01 mg
Kadar xantorrhizol (%b/b) = 100%
air) kadar 1
( sampel bobot
horrhizol
bobot xant ×
−
=
100
%
0.0369)
-(1
mg
10.0081
mg
01
.
49
×
= 0.51%
Ekstrak sistem ekstraksi 4
Bobot sampel : 10.0029 g Luas puncak xantorrhizol : 11361618.5
y = 165608 + 104355x 11361618.5 = 165608 + 104355x
x = 107.29 ppm
[xantorrhizol] dalam ekstrak = 107.29 ppm
×
100 mL = 1072.9 ppm 10 mLBobot xantorrhizol = 1072.9 mg/L
×
100 mL×
mL 1000
L
1 = 107.29 mg
Kadar xantorrhizol (%b/b) = 100%
air) kadar 1
( sampel bobot
horrhizol
bobot xant ×
−
=
100
%
0.0369)
-(1
mg
10.0029
mg
29
.
107
×
= 1.11%