SAUD RICHY JUARA
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
SETYANINGSIH and INDAH YULIASIH.
Cassava is one of natural resources for carbohydrate that also available for bioethanol production. Starch and fibers hydrolysis maybe conducted on acid condition. The restriction in acid hydrolysis is 5-hydroxymethyl furfural (HMF) and furfural formation, which inhibit yeast fermentation. This study applied two stages of detoxification, which are overliming and activated carbon adsorption methods for lowering HMF and furfural concentrations. In order to obtain tolerable amount in sugar solution, detoxification by activated carbon adsorption was done by concentration of 1%, 2.5%, 5% and 10% and duration of contact are 30 45 and 60 minutes. The results showed that overliming method decreased HMF and furfural concentrations 34.38% and 60.81%, respectively. Overliming followed by 5% activated carbon adsorption for 30 minutes produced the best sugar solution which has a lower HMF and furfural concentrations by 72.03% and 89.11%, respectively. Adsorption constants of HMF and furfural by 5% activated carbon were 0.044 g/min and 3,7 x 10-5 g/min, respectively. The concentration of ethanol produced was 5.00% (b/v) or 63.22% higher than obtained from detoxification by neutralization (NH4OH) which produced ethanol
only 3.06%.
Metode Arang Aktif untuk Produksi Bioetanol. Dibimbing oleh DWI SETYANINGSIH dan INDAH YULIASIH.
Minyak mentah merupakan bahan baku utama untuk memenuhi kebutuhan energi, namun bahan ini berasal dari bahan baku fosil yang tidak terbaharukan. Oleh sebab itu, diperlukan suatu alternatif untuk memecahkan permasalahan kebutuhan energi tersebut. Salah satu alternatifnya adalah bioetanol. Bioetanol diperoleh melalui proses fermentasi menggunakan galur khamir Saccharomyces cerevisiae yang mampu mengkonversi gula sederhana seperti sukrosa, glukosa, fruktosa, maltosa dan rafinosa menjadi etanol. Pada penelitian ini bahan baku yang digunakan untuk menghasilkan bioetanol adalah ubi kayu. Hidrolisis ubi kayu untuk pembuatan bioetanol dapat dilakukan dengan metode hidrolisis asam ataupun hidrolisis enzimatis. Metode yang digunakan pada penelitian ini yaitu hidrolisis asam menggunakan H2SO4. Metode hidrolisis asam diharapkan bahan
baku seperti pati, selulosa dan hemiselulosa dapat terhidrolisis.
Keuntungan metode hidrolisis secara asam adalah waktu proses lebih singkat, teknologi sederhana, pengaturan kondisi proses yang lebih mudah dan biaya yang lebih murah karena tidak melibatkan enzim (Chaplin dan Bucke 1990). Selain itu, hidrolisat asam yang dihasilkan dapat disimpan dalam jangka waktu lama. Semua keuntungan dari proses hidrolisis asam telah banyak dikaji sebelumnya kecuali proses penyimpanan hidrolisat asam sehingga penulis merasa perlu untuk melakukan penelitian tersebut untuk mengetahui pengaruh penyimpanan terhadap konsentrasi gula di dalam hidrolisat asam. Namun metode hidrolisis asam memiliki kelemahan yaitu timbulnya inhibitor seperti furfural, dan 5-hidroksimetil furfural (HMF) yang menghambat pertumbuhan mikroorganisme dalam proses fermentasi untuk menghasilkan etanol.
Detoksifikasi merupakan suatu metode yang dapat digunakan untuk mengurangi konsentrasi inhibitor (HMF dan furfural) di dalam hidrolisat. Pada penelitian ini dilakukan dua tahap detoksifikasi yaitu metode overliming dilanjutkan metode adsorpsi arang aktif. Diharapkan dari hasil proses detoksifikasi yang dilakukan didapat konsentrasi inhibitor (HMF dan furfural) di dalam hirolisat asam sesuai bagi pertumbuhan mikroorganisme pada proses fermentasi.
Penelitian ini bertujuan untuk mengetahui pengaruh penyimpanan terhadap karakteristik hidrolisat dan mendapatkan metode detoksifikasi terbaik menggunakan kombinasi metode overliming dan adsorpsi arang aktif, dengan berbagai konsentrasi dan lama waktu kontak arang aktif sehingga didapatkan konsentrasi inhibitor (HMF dan furfural) terendah pada hidrolisat.
10,44% dan 9,91% dan pada minggu ke dua masing-masing sebesar 12,49% dan 12,11%.
Metode overliming menurunkan konsentrasi HMF dan furfural sebesar 34,38% dan 60,81%. Overliming cukup efektif menurunkan konsentrasi HMF, furfural dan total asam tanpa menurunkan konsentrasi gula pereduksi terlalu besar. Namun, konsentrasi HMF di dalam hidrolisat masih cukup besar yaitu 2,48 g/l. Hal ini menunjukkan hidrolisat yang dihasilkan masih perlu pemurnian lebih lanjut dengan detoksifikasi arang aktif.
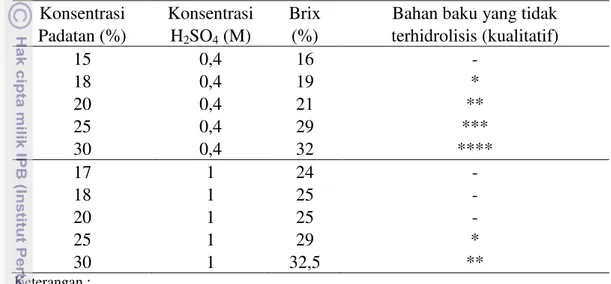
Arang aktif yang digunakan pada penelitian ini memiliki ukuran pori pada permukaan luar 0,54 – 1,08 µm. Semakin besar konsentrasi arang aktif yang digunakan akan menyebabkan semakin besar penurunan konsentrasi total gula, gula pereduksi, HMF, furfural dan total asam di dalam hidrolisat. Hal ini diduga karena ukuran molekul-molekul gula-gula sederhana, HMF, furfural dan total asam yang lebih kecil dari ukuran pori arang aktif yang digunakan sehingga semakin besar konsentrasi arang aktif yang ditambahkan akan menyebabkan semakin besar penurunan konsentrasi senyawa-senyawa tersebut. Setelah dilakukan detoksifikasi arang aktif, dihasilkan kondisi hidrolisat terbaik yaitu pada perlakuan dengan konsentrasi arang aktif 5% dan lama waktu kontak 30 menit. yang menghasilkan konsentrasi HMF dan furfural di dalam hidrolisat sebesar 0,76 g/l dan 0,0014 g/l terjadi penurunan konsentrasi HMF dan furfural sebesar 72,03% dan 89,11%.
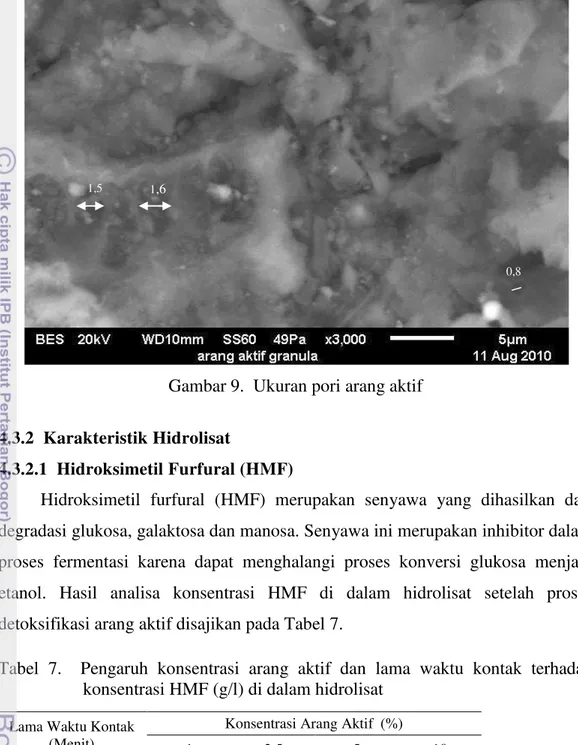
Pada penentuan konstanta laju adsorpsi arang aktif digunakan persamaan Langmuir dan Freundlich. Persamaan Freundlich memiliki nilai koefisien determinasi (R2) lebih besar dari model persamaan Langmuir dan nilai kesesuaian
terbaik dari data percobaan yang telah dilakukan. Hasil analisa dengan model persamaan Freundlich dengan konsentrasi arang aktif 5% dengan waktu kontak 60 menit didapat nilai konstanta laju adsorpsi arang aktif terhadap HMF sebesar 0,044 g/menit dan pada konstanta laju adsorpsi arang aktif terhadap furfural sebesar 3,7 x 10-5 g/menit.
Pada proses detoksifikasi overliming dilanjutkan arang aktif dihasilkan persentase kadar etanol lebih besar bila dibandingkan dengan detoksifikasi netralisasi. Kadar etanol yang dihasilkan pada perlakuan hidrolisat yang disimpan selama minggu ke-0, ke-1 dan ke-2 kemudian dilanjutkan detosifikasi overliming dan arang aktif sebesar 5,00%, 4,96% dan 4,91 %. Pada proses fermentasi dengan hidrolisat proses netralisasi, etanol yang dihasilkan sebesar 3,06%.
SAUD RICHY JUARA
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Teknologi Industri Pertanian
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Arang Aktif untuk Produksi Bioetanol Nama : Saud Richy Juara
NRP : F351080141
Disetujui
Komisi Pembimbing
Dr. Ir. Dwi Setyaningsih, M.Si Dr. Indah Yuliasih, S.TP, M.Si
Ketua Anggota
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana Teknologi Industri Pertanian
Dr. Ir. Machfud, MS Dr. Ir. Dahrul Syah, M.Sc.Agr
Puji syukur penulis ucapakan kepada Tuhan Yang Maha Esa, karena atas berkat dan rahmatNya dapat menyelesaikan tesis ini dengan judul “Detoksifikasi Hidrolisat Asam dari Ubi Kayu dengan Metode Arang Aktif untuk Produksi Bioetanol”. Penulisan tesis ini dilakukan sabagai salah satu syarat untuk memperoleh gelar Magister Sains pada program Studi Teknologi Industri Pertanian, Fakultas Teknologi Pertanian Institut Pertanian Bogor. Ucapan terima kasih penulis sampaikan kepada semua pihak yang telah membantu antara lain :
1. Dr. Ir. Macfud, Ms., selaku Ketua Program Studi
2. Dr. Ir. Dwi Setyaningsih, M.Si., selaku Ketua Komisi Pembimbing 3. Dr. Indah Yuliasih, S.TP., M.Si., selaku Anggota Komisi Pembimbing 4. Dr.Ir Mulyorini Rahayuningsih, M.Si., selaku Dosen Penguji
5. Bapak, Mama dan Kristin Devi Yanti atas kesabaran, motivasi dan doanya 6. Siti Romlah atas kasih sayang, motivasi, kesabaran dan doanya
7. Teknisi Laboratorium TIP dan SBRC : Ibu Rini, Ibu Ega, Ibu Sri, Pak Edi, Pak Sugiarto, Pak Dicky, Pak Gun, Saiful serta Otto. Terima kasih bantuannya.
8. Februadi Bastian, Donna Imelda, Siti Aisyah, Andrew Setiawan, Dessy, Niken, Fatma, Deli, Renny dan Yuana yang banyak membantu selama penelitian.
9. Teman-teman TIP IPB angakatan 2008 dan teman-teman di Dewi Sartika 10.Dan semua yang telah membantu penulisan hasil penelitian
Penulis menyadari sepenuhnya bahwa tesis ini masih jauh dari sempurna. Oleh karena itu dengan segala ketulusan dan kerendahan hati, saran, kritik dan masukan yang konstruktif sangat diharapkan untuk perbaikan dan penyempurnaan dimasa mendatang. Semoga karya tulis ini dapat bermanfaat.
Bogor, April 2011
Purba dan Ibu Lena Simatupang. Penulis merupakan anak kedua dari dua bersaudara.
DAFTAR ISI
Halaman
DAFTAR TABEL ... iii
DAFTAR GAMBAR ... iv
DAFTAR LAMPIRAN ... v
I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Tujuan Penelitian ... 3
II TINJAUAN PUSTAKA ... 5
2.1 Ubi Kayu (Singkong) ... 5
2.2 Hidrolisis Asam ... 8
2.3 Proses Detoksifikasi ... 10
2.4 Arang Aktif ... 13
2.5 Bioetanol ... 15
III METODOLOGI PENELITIAN ... 19
3.1 Alat dan Bahan Penelitian ... 19
3.2 Waktu dan Tempat Penelitian ... 19
3.3 Tahapan Penelitian ... 19
IV HASIL DAN PEMABAHASAN ... 27
4.1 Karakteristik Ubi Kayu Tahapan Penelitian ... 27
4.2 Konsentrasi Bahan Baku Ubi Kayu dan Asam Sulfat (H2SO4) ... 28
4.3 Pengaruh Detoksifikasi terhadap Karakteristik Larutan Gula ... 32
4.3.1 Proses Detoksifikasi ... 32
4.3.2 Karakteristik Larutan Gula ... 35
4.4 Laju Adsorpsi Arang Aktif ... 44
4.5 Kondisi Hidrolisat Asam terhadap Konsentrasi Etanol ... 49
V KESIMPULAN DAN SARAN ... 55
5.1 Kesimpulan ... 55
DAFTAR TABEL
Halaman
1. Luas panen, produksi dan produktivitas ubikayu di Indonesia ... 6
2. Komposisi kimia ubi kayu ... 6
3. Karakteristik hidrolisat untuk fermentasi ... 16
4. Karateristik ubi kayu segar ... 27
5. Karakteristik hidrolisat asam pada konsentrasi bahan baku dan asam sulfat (H2SO4) yang berbeda ... 29
6. Karakteristik hidrolisat sebelum dan sesudah proses detoksifikasi overliming ... 32
7. Pengaruh konsentrasi arang aktif dan lama waktu kontak terhadap konsentrasi HMF di dalam hidrolisat ... 35
8. Pengaruh konsentrasi arang aktif dan lama waktu kontak terhadap konsentrasi furfural di dalam hidrolisat ... 37
9. Pengaruh konsentrasi arang aktif dan lama waktu kontak terhadap konsentrasi total gula di dalam hidrolisat ... 38
10. Pengaruh konsentrasi arang aktif dan lama waktu kontak terhadap konsentrasi gula pereduksi di dalam hidrolisat ... 40
11. Pengaruh konsentrasi arang aktif dan lama waktu kontak terhadap konsentrasi total asam di dalam hidrolisat ... 41
12. Karakteristik hidrolisat hasil detoksifikasi arang aktif dengan konsentrasi 5 % dan lama waktu kontak 30 menit ... 44
DAFTAR GAMBAR
Halaman
1. Struktur kimia selulosa ... 7
2. Struktur kimia hemiselulosa ... 8
3. Ukuran pori arang aktif ... 14
4. Pengaruh ukran pori terhadap bahan yang dijerap ... 14
5. Proses hidrolisis asam ... 20
6. Proses detoksifikasi hidrolisat asam ... 22
7. Proses pembuatan bioetanol dari bahan baku ubi kayu ... 25
8. Bahan terhidrolisis (a) Ubi kayu tidak terhidrolisis sempurna (b) ubi kayu terhidrolisis sempurna ... 30
9. Ukuran pori arang aktif ... 35
10.Laju adsorpsi HMF dan furfural di dalam hidrolisat selama proses detoksifikasi dengan konsentrasi arang aktif 5 % ... 45
11.Nilai persamaan Langmuir dan Freundlich dari adsorpsi HMF (a) dan furfural (b) oleh arang aktif dengan konsentrasi 5% ... 47
12.Laju adsorpsi total gula dan gula pereduksi di dalam hidrolisat selama proses detoksifikasi dengan konsentrasi arang aktif 5 % ... 48
13.Penurunan (a) total gula dan (b) gula pereduksi selama proses penyimpanan, detoksifikasi dan fermentasi ... 50
14.Persentase efisiensi penggunaan substrat, rendemen etanol dan kadar etanol ... 51
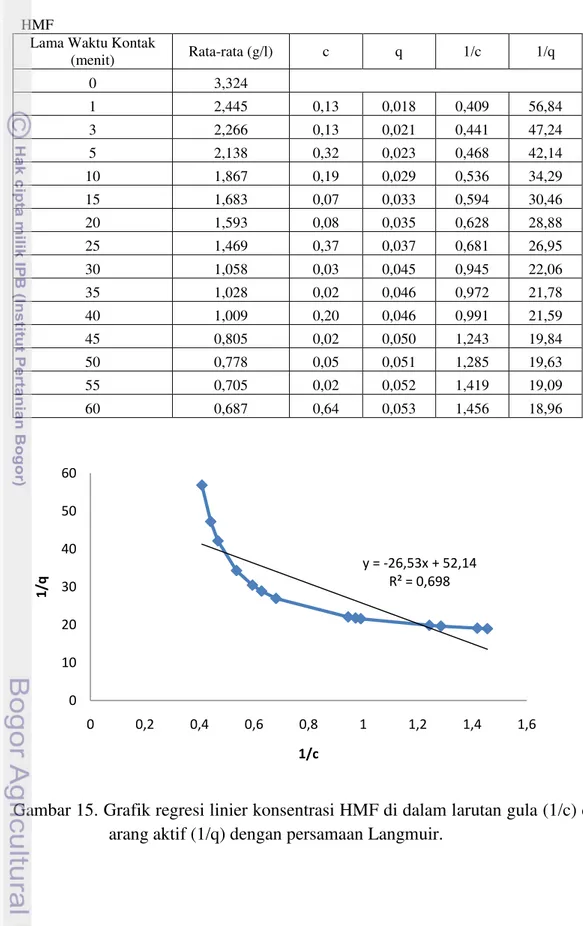
15.Grafik regresi linier konsentrasi HMF di dalam larutan gula (1/c) dan arang aktif (1/q) dengan persamaan Langmuir ... 79
16.Grafik regresi linier konsentrasi furfural di dalam larutan gula (1/c) dan arang aktif (1/q) dengan persamaan Langmuir ... 80
17.Grafik regresi linier konsentrasi HMF di dalam larutan gula (log c) dan arang aktif (log q) dengan persamaan Freundlich ... 81
DAFTAR LAMPIRAN
Halaman
1. Prosedur Analisis ... 63 2. Kromatogram HMF dan Furfural di dalam hidrolisat asam yang diukur
dengan alat HPLC ... 71 3. Data hasil analisa konsentrasi HMF (g/l) di dalam hidrolisat setelah
proses detoksifikasi arang aktif ... 72 4. Data hasil analisa konsentrasi furfural (g/l) di dalam hidrolisat setelah
proses detoksifikasi arang aktif ... 73 5. Data hasil analisa konsentrasi total gula (g/l) di dalam hidrolisat setelah
proses detoksifikasi arang aktif ... 74 6. Data hasil analisa konsentrasi gula pereduksi (g/l) di dalam hidrolisat
setelah proses detoksifikasi arang aktif ... 76 7. Data hasil analisa konsentrasi total asam (ml NaOH 1 N /g bahan) di
dalam hidrolisat setelah proses detoksifikasi arang aktif ... 77 8. Data hasil analisa laju adsorpsi arang aktif terhadap konsentrasi HMF
dan furfural dengan konsentrasi arang aktif 5% ... 78 9. Data hasil analisa laju adsorpsi arang aktif terhadap HMF dan furfural
dengan persamaan Langmuir dengan konsentrasi arang aktif 5% ... 79 10.Data hasil analisa laju adsorpsi arang aktif terhadap HMF dan furfural
I PENDAHULUAN
1.1 Latar Belakang
Energi merupakan salah satu sumber kehidupan makhluk hidup. Jumlah energi yang dibutuhkan akan meningkat seiring dengan meningkatnya jumlah penduduk. Konsumsi energi telah meningkat dengan cepat karena populasi penduduk dunia telah berkembang, begitu juga konsumsi energi untuk kebutuhan di bidang industri. Minyak mentah telah menjadi sumber utama untuk memenuhi kebutuhan energi namun sumber energi ini berasal dari bahan baku fosil yang tidak terbaharukan. Oleh sebab itu, diperlukan suatu alternatif untuk memecahkan permasalahan kebutuhan energi tersebut. Salah satu alternatifnya adalah bioetanol. Bioetanol merupakan senyawa alkohol yang diperoleh melalui proses fermentasi biomassa dengan bantuan mikroorganisme. Bahan baku pembuatan bioetanol adalah semua bahan yang mengandung gula (seperti nira), bahan yang mengandung pati (seperti jagung, ubi kayu, ubi jalar dan lain-lain) serta bahan berselulosa (seperti kayu, baggase, tongkol jagung dan lain-lain). Bioetanol diperoleh melalui proses fermentasi menggunakan galur khamir Saccharomyces
cerevisiae yang mampu mengkonversi gula-gula pereduksi seperti glukosa menjadi etanol.
Pada penelitian ini bahan baku yang digunakan untuk menghasilkan bioetanol adalah ubi kayu. Ubi kayu atau singkong merupakan salah satu tanaman umbi yang mengandung pati, selulosa, hemiselulosa dan bahan lainnya. Selama ini penggunaan ubi kayu untuk pembuatan bioetanol sering hanya menggunakan patinya. Padahal di dalam ubi kayu terkandung bahan selulosa dan hemiselulosa yang dapat dimanfaatkan untuk menghasilkan bioetanol.
Hidrolisis ubi kayu untuk pembuatan bioetanol dapat dilakukan dengan metode hidrolisis asam ataupun enzimatis. Hidrolisis enzimatis dilakukan dengan menggunakan enzim α-amilase dan amiloglukosidase, sedangkan hidrolisis asam menggunakan asam sulfat (H2SO4) dan asam klorida (HCl).
Pada penelitian ini metode yang digunakan adalah hidrolisis asam menggunakan H2SO4. Diharapkan dengan proses tersebut bahan baku seperti pati,
pengaturan kondisi proses yang lebih mudah dan biaya yang lebih murah karena tidak melibatkan enzim (Chaplin dan Bucke 1990).
Proses hidrolisis asam juga memiliki kelemahan yaitu timbulnya senyawa inhibitor seperti hidroksimetil furfural (HMF) dan furfural yang menghambat pertumbuhan mikroorganisme dalam proses fermentasi untuk menghasilkan etanol. Suhu, waktu dan konsentrasi asam yang digunakan selama proses hidrolisis sangat mempengaruhi proses terbentuknya komponen HMF dan furfural (Palmqvist dan Hagerdal 2000).
Detoksifikasi merupakan suatu metode untuk mengurangi senyawa yang bersifat toksik (HMF dan furfural) di dalam hidrolisat dan meningkatkan kemampuan fermentasi dengan mengkonversi derivatif furan menjadi senyawa lain (Purwadi 2006). Banyak metode yang dapat dilakukan pada proses detoksifikasi hidrolisat hasil hidrolisis asam, seperti ion exchange (Van Zyl et al. 1998), overliming (Purwadi 2006), netralisasi (Roberto et al. 1991), penggunaan enzim laccase (Jonsson et al. 1998) dan arang aktif (Converti et al. 1999). Cara yang digunakan pada penelitian ini menggunakan kombinasi metode overliming dan adsorpsi arang aktif.
Proses detoksifikasi overliming merupakan proses penetralan hidrolisat asam sebelum dilakukan proses detoksifikasi lanjutan, proses ini cukup efektif mengurangi konsentrasi asam di dalam hidrolisat setelah proses hidrolisis, selain itu sebagian senyawa inhibitor diubah menjadi bentuk senyawa baru yang tidak bersifat toksik (Purwadi 2006). Namun proses detoksifikasi overliming kurang efektif menurunkan kosentrasi inhibitor di dalam hidrolisat oleh karena itu diperlukan metode detoksifikasi lanjutan. Pada penelitian ini proses detoksifikasi lanjutan yang digunakan adalah arang aktif.
Menurut Chandel et al. (2006), arang aktif dapat digunakan untuk mengurangi kandungan inhibitor pada hidrolisat. Diharapkan dengan semakin sedikit inhibitor (HMF dan furfural) di dalam hidrolisat pada proses fermentasi, maka semakin banyak etanol yang dihasilkan
Pada penelitian ini, penulis juga merasa perlu untuk melakukan penelitian mengenai pengaruh penyimpanan terhadap hidrolisat asam. Hal ini dikarenakan, bahan baku ubi kayu untuk pembuatan bioetanol tidak dapat disimpan dalam jangka waktu lama sehingga ubi kayu yang dihasilkan diproses menjadi hidrolisat asam supaya dapat disimpan dalam waktu yang lama. Namun pengaruh penyimpanan hidrolisat asam belum banyak dikaji sehingga penulis merasa perlu untuk melakukan penelitian tersebut untuk mengetahui pengaruh penyimpanan terhadap konsentrasi gula di dalam hidrolisat asam.
1.2 Tujuan Penelitian
Tujuan penelitian ini adalah
1. Mendapatkan metode detoksifikasi terbaik menggunakan kombinasi metode
overliming dan adsorpsi arang aktif, dengan berbagai konsentrasi dan lama waktu kontak arang aktif sehingga didapatkan konsentrasi inhibitor (HMF dan furfural) terendah pada hidrolisat.
Ubi kayu atau singkong berasal dari Brazilia. Dalam sistematika tumbuhan, ubi kayu termasuk ke dalam kelas Dicotyledoneae. Ubi kayu berada dalam famili Euphorbiaceae yang mempunyai sekitar 7.200 spesies, beberapa diantaranya adalah tanaman yang mempunyai nilai komersial, seperti karet (Hevea
brasiliensis), jarak (Ricinus comunis dan Jatropha curcas), umbi-umbian (Manihot spp), dan tanaman hias (Euphorbia spp) (Ekanayake et al. 1997). Klasifikasi tanaman ubi kayu adalah sebagai berikut:
Kelas : Dicotyledoneae Sub Kelas : Arhichlamydeae Ordo : Euphorbiales Famili : Euphorbiaceae Sub Famili : Manihotae Genus : Manihot
Spesies : Manihot esculenta Crantz
Ubi kayu merupakan salah satu jenis umbi-umbian yang menjadi sumber bahan baku utama pembuatan bioetanol karena mempunyai kemampuan untuk tumbuh di tanah yang tidak subur, tahan terhadap serangan hama penyakit dan dapat diatur masa panennya. Beberapa alasan digunakannya ubi kayu sebagai bahan baku bioenergi, khususnya bioetanol, diantaranya adalah sudah lama dikenal oleh petani di Indonesia, tersebar di 55 kabupaten dan 33 provinsi, merupakan sumber karbohidrat karena kandungan patinya yang cukup tinggi, harga di saat panen raya seringkali sangat rendah sehingga dengan mengolahnya menjadi etanol diharapkan harga menjadi lebih stabil, dan menguatkan security of
Tabel 1. Luas panen dan produksi ubikayu di Indonesia
Tahun Luas Panen (ha) Produksi (ton)
2000 1.284.040 16.089.020
Pemanfaatan ubi kayu dikelompokkan menjadi dua kelompok, yaitu sebagai bahan baku tapioka (tepung tapioka atau gaplek) dan sebagai pangan langsung. Ubi kayu sebagai pangan langsung harus memenuhi syarat utama, yaitu tidak mengandung racun HCN (< 50 mg per kg umbi basah). Sementara itu, umbi ubi kayu untuk bahan baku industri tidak disyaratkan adanya kandungan protein maupun ambang batas HCN, tapi yang diutamakan adalah kandungan karbohidrat yang tinggi (Muchtadi dan Sugiyono 1992).
Ubi kayu sebagai bahan baku energi alternatif hanya memiliki kadar karbohidrat sekitar 32-37% dan kadar pati sekitar 83,8% setelah diproses menjadi tepung. Jenis polisakarida yang menyusun umbi ubi kayu antara lain pati, selulosa dan hemiselulosa (Winarno 1992). Komposisi kimia ubi kayu disajikan pada Tabel 2.
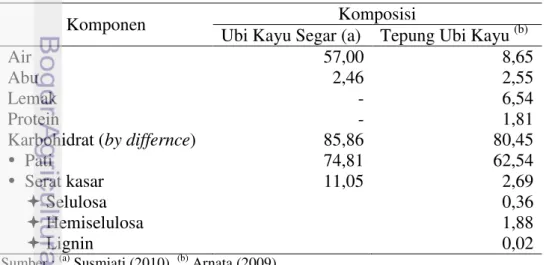
Tabel 2. Komposisi kimia ubi kayu
Komponen Komposisi
Karbohidrat (by differnce) 85,86 80,45
Karbohidrat yang terkandung dalam ubi kayu terdiri dari serat kasar dan pati. Serat kasar terdiri dari selulosa, hemiselulosa dan lignin yang berfungsi sebagai penguat tekstur. Komponen karbohidrat merupakan bahan baku utama yang dapat digunakan sebagai bahan baku pembuatan etanol adalah pati yang berfungsi sebagai sumber energi (Winarno 1992).
Pati terdiri dari dua fraksi yaitu fraksi amilosa dan amilopektin. Fraksi amilosa mempunyai struktur lurus dengan ikatan α-(1,4)-D-glukosa, sedangkan
amilopektin mempunyai cabang dengan ikatan α-(1,6)-D-glukosa sebanyak 4 – 5
% berat total. Molekul-molekul glukosa di dalam amilosa saling berikatan melalui
gugus glukopiranosa β-1,4. Pada amilopektin sebagian dari molekul-molekul glukosa di dalam rantai percabangannya saling berikatan melalui gugus α-1,6. Ikatan α-1,6 sangat sukar diputuskan, apalagi jika dihidrolisis menggunakan katalisator asam.
Selulosa merupakan serat-serat panjang yang secara bersama-sama dengan hemiselulosa dan lignin mebentuk struktur jaringan yang memperkuat dinding sel tanaman. Selulosa tidak dapat dicerna oleh manusia dan tidak larut dalam air. Selulosa pada tumbuhan terdapat di dalam dinding sel pelindung tanaman, terutama pada tangkai, batang, dahan, dan semua bagian berkayu dari jaringan tumbuhan.
Gambar 1. Struktur kimia selulosa (Anonim 2010a)
Selulosa terdiri dari 10.000 atau lebih unit D-glukosa yang dihubungkan oleh ikatan (1,4) glikosida, sama seperti amilosa. Perbedaannya adalah pada
selulosa, ikatan (1,4) berada dalam posisi β, sedangkan pada amilosa, ikatan (1,4) berbentuk α. Ikatan α (1,4) pada amilosa mudah dihidrolisis oleh enzim α-amilase,
tetapi tidak demikian untuk β(1,4) (Tjokroadikoesoemo 1986).
dengan asam menjadi komponen-komponen monomernya yang terdiri dari D-glukosa, D-manosa, D-galaktosa, D-xilosa, dan sejumlah kecil L-ramnosa disamping menjadi asam glukuronat, asam 4-0-metil-glukuronat dan asam D-galakturonat (Sastrohamidjojo dan Prawirohatmodjo 1995)
Hemiselulosa merupakan polisakarida dengan bobot molekul lebih kecil dibandingkan selulosa. Molekul hemiselulosa lebih mudah menyerap air, bersifat plastis dan mempunyai permukaan kontak antar molekul lebih luas dibandingkan dengan selulosa (Judoamidjojo et al. 1989). Ikatan di dalam rantai hemiselulosa banyak bercabang karena gugus β-glukosida di dalam molekul yang satu berikatan dengan gugus hidroksil C2, C3 dan C4 dari molekul yang lain. Berbeda dengan selulosa, hemiselulosa berbentuk amorf (Tjokroadikoesoemo 1986).
Gambar 2. Struktur kimia hemiselulosa (Anonim 2010b)
Berbeda dengan selulosa, hemiselulosa mempunyai derajat polimerisasi lebih rendah dan mudah larut dalam alkali tetapi sukar larut dalam asam, sedangkan selulosa sebaliknya. Hidrolisis hemiselulosa menghasilkan empat jenis monosakarida yaitu xilosa, manosa, galaktosa dan glukosa dalam jumlah sedikit (Gonzalez et al.1986). Hidrolisis lebih lanjut akan menghasilkan hidroksimetil furfural (HMF), furfural dan produk dekomposisi lainnya (Gong et al. 1981).
2.2 Hidrolisis Asam
Hidrolisis asam dapat digunakan untuk memecah komponen polisakarida menjadi monomer-monomer. Proses hidrolisis yang sempurna akan memecah selulosa dan pati menjadi glukosa, sedangkan hemiselulosa akan terpecah menjadi pentosa dan heksosa. Asam sulfat (H2SO4) dan asam klorida (HCl) merupakan
Keuntungan hidrolisis menggunakan konsentrasi tinggi adalah proses hidrolisis dapat dilakukan pada suhu yang rendah. Namun penggunaan asam konsentrasi tinggi mempunyai kelemahan antara lain jumlah asam yang digunakan sangat banyak, potensi korosi pada peralatan produksi, penggunaan energi yang tinggi untuk proses daur ulang asam dan terbentuk produk samping yang tidak diharapkan seperti furfural dan hidroksimetil furfural (HMF). Hidrolisis menggunakan asam dengan konsentrasi rendah mempunyai keuntungan yaitu jumlah asam yang digunakan sedikit. Namun kerugian dalam penggunaan asam dengan konsentrasi rendah antara lain membutuhkan suhu tinggi dalam proses operasinya, potensi korosi pada peralatan produksi terutama alat yang terbuat dari besi dan pembentukan produk samping yang tidak diharapkan seperti furfural dan hidroksimetil furfural (HMF) (Tahezadeh dan Karimi 2007).
Hidrolisis asam dengan konsentrasi rendah dapat dilakukan dalam dua tahap yaitu tahap pertama menggunakan asam dengan konsentrasi rendah untuk menghidrolisis gula dari golongan pentosa yang umumnya terdapat dalam fraksi hemiselulosa. Tahap ini biasanya menggunakan H2SO4 1 M pada suhu 80-120oC
selama 30-240 menit. Tahap kedua menggunakan asam dengan konsentrasi lebih tinggi untuk menghidrolisis gula yang berasal dari golongan heksosa seperti selulosa, biasanya dilakukan dengan konsentrasi asam 5-20 M H2SO4 dengan
suhu 180oC. Proses hidrolisis bertahap ini dapat memaksimalkan hasil glukosa
yang dihasilkan dan meminimumkan hasil samping yang tidak diinginkan (Purwadi 2006).
Penentuan konsentrasi asam tergantung pada ukuran, bentuk dan kadar air pada partikel lignoselulosa. Asam sulfat biasanya digunakan pada bahan terlarut dengan konsentrasi tidak melebihi 10% berat (H2SO4 umum digunakan tidak lebih
dari 5%). Penggunaan katalis asam dengan konsentrasi rendah selalu terjadi penambahan air yang banyak pada bahan lignoselulosa dan hal itu membutuhkan energi panas yang lebih banyak selama proses pemanasan (Taherzadeh dan Karimi 2007).
adalah hidroksimetil furfural (HMF) dan furfural (Taherzadeh dan Karimi 2007). Hidrolisis asam pada bahan lignoselulosa, hemiselulosa merupakan komponen yang paling mudah terhidrolisis oleh asam yang akan terdegradasi menjadi xilosa, manosa, asam asetat, galaktosa dan sejumlah kecil ramnosa, asam glukuronat, asam metal glukuronat dan asam galakturonat (Sjostrom 1993). Selulosa akan terdegradasi menjadi glukosa. Pada suhu dan tekanan yang tinggi glukosa, galaktosa dan manosa terdegradsi menjadi hidroksimetil furfural (HMF) dan xilosa menjadi furfural. Komponen fenol terbentuk dari lignin yang terpecah sebagian dan juga selama proses degradasi karbohidrat. Lignin merupakan komponen komplek yang tersusun oleh phenylpropane yang terikat di dalam struktur tiga dimensi. Ikatan kimia terjadi di antara lignin dan hemiselulosa bahkan terkadang juga dengan selulosa. Lignin sangat tahan terhadap reaksi kimia dan enzimatik (Palmqvist dan Hagerdal 2000).
2.3 Proses Detoksifikasi
Metode detoksifikasi dilakukan untuk meningkatkan kemampuan fermentasi dengan mengkonversi derivatif furan menjadi senyawa lain dan mengurangi senyawa-senyawa yang bersifat toksik (Purwadi 2006). Identifikasi senyawa toksik dalam hidrolisat dan menentukan metode detoksifikasi adalah sangat penting untuk meningkatkan efisiensi dari proses fermentasi. Berbagai metode detoksifikasi seperti biologis, kimia dan fisik telah digunakan untuk mengurangi konsentrasi toksik di dalam hidrolisat. Namun, efisiensi dari setiap metode detoksifikasi tergantung pada komposisi hidrolisat menurut bahan baku yang digunakan dan pada kondisi hidrolisisnya.
Nigam (2001), menemukan bahwa konsentrasi furfural dari 0,25 g/l dalam media fermentasi tidak cukup untuk mengurangi konsentrasi etanol yang dihasilkan, tetapi konsentrasi melebihi 1,5 g/l akan mengurangi produktifitas etanol yang dihasilkan dalam proses fementasi. Asam asetat menghambat ragi pada tingkat sekitar 2,0-5,0 g/l (Van Zyl et al. 1998). Alves et al. (1998), menyatakan bahwa hidroksimetil furfural (HMF), pada konsentrasi 1 g/l, sudah cukup untuk menghambat pertumbuhan S. cerevisiae pada proses fermentasi.
terbentuknya inhibitor selama hidrolisis, (2) detoksifikasi hidrolisat sebelum fermentasi, (3) mengembangkan spesies mikroorganisme yang mampu melawan inhibitor dan (4) mengubah senyawa beracun menjadi produk yang tidak mengganggu proses fermentasi.
Perlakuan metode detoksifikasi biologis melibatkan penggunaan enzim spesifik atau mikroorganisme yang bekerja pada senyawa toksik yang ada pada hidrolisat dan mengubah senyawa toksik tersebut. Detoksifikasi biologis dapat mengggunakan enzim Laccase yang dihasilkan dari beberapa mikroorganisme seperti : Candida shehatae, Coriolopsis rigida, Trametes villosa. dan jamur lignolitik Trametes versicolor (Jonsson et al. 1998). Metode detoksifikasi secara kimia dapat dilakukan dengan senyawa Ca(OH)2 (Purwadi 2006) dan ion
exchange (Van Zyl et al. 1998). Perlakukan metode detoksifikasi fisik dalam proses detoksifikasi dilakukan dengan cara arang aktif, evaporasi dan ekstraksi (Converti et al. 1999). Evaporasi dilakukan pada hidrolisat untuk mengurangi atau menghilangkan sebagian besar fraksi folatil, sehingga produksi etanol meningkat. Diantara metode-metode fisik yang di gunakan pada hidrolisat, detoksifikasi arang aktif sangat baik karena merupakan bahan berbiaya rendah dengan kapasitas menyerap senyawa yang tinggi (Mussato dan Roberto 2003).
2.3.1 Detoksifikasi dengan Overliming
Detoksifikasi overliming merupakan proses yang diadaptasi dari proses
liming pada pabrik gula. Detoksifikasi overliming dilakukan dengan penambahan kapur tohor (Ca(OH)2) ke dalam hidrolisat untuk meningkatkan pH larutan hingga
9-11 diikuti dengan penetralan kembali menggunakan H2SO4. Besarnya
konsentrasi kapur tohor (Ca(OH)2) yang ditambahkan akan menyebabkan
penurunan konsentrasi gula-gula, HMF dan furfural yang semakin besar (Purwadi 2006).
Reaksi yang terbentuk dalam proses detoksifikasi overliming adalah pembentukan garam-garam dari reaksi asam basa antara H2SO4 hasil hidrolisis
dengan Ca(OH)2 yang ditambakan. Selain itu, sebagian ion Ca2+ beraksi dengan
1. H2SO4 + Ca(OH)2 CaSO4 + 2H2O
2. C6H12O6 + Ca2+ [C6H12O6Ca]+
3. C6H6O3 + Ca2+ [C6H6O3Ca]+
4. C5H4O2 + Ca2+ [C5H4O2Ca]+
4.3.2 Detoksifikasi dengan Arang Aktif
Detoksifikasi arang aktif merupakan pemanfaatan sifat adsorpsi pada arang aktif. Adsorpsi (penjerapan) adalah suatu proses pemisahan dimana komponen dari suatu fase fluida berpindah ke permukaan zat padat yang menjerap (adsorben). Adsorben adalah padatan atau cairan yang mengadsorpsi sedang adsorbat adalah padatan, cairan atau gas yang diadsorpsi. Jadi proses adsorpsi dapat terjadi antara padatan dengan padatan, gas dengan padatan, gas dengan cairan dan cairan dengan padatan (Ketaren 1986). Sedangkan menurut Setyaningsih (1995), adsorpsi adalah proses terjadinya perpindahan massa adsorbat dari fasa gerak (fluida pembawa adsorbat) ke permukaan adsorben. Adsorpsi terjadi karena adanya gaya tarik menarik antara molekul adsorbat dengan tempat-tempat aktif di permukaan adsorben.
Kirk dan Othmer (1964), mengemukakan bahwa faktor-faktor yang mempengaruhi adsorpsi pada arang aktif adalah :
1. Sifat fisika adsorben seperti luas permukaan, dan ukuran pori-pori 2. Konsentrasi adsorban dalam fase cair (larutan)
3. Sifat fase cair meliputi pH dan suhu 4. Lamanya proses adsorpsi berlangsung
Menurut Azah dan Rudyanto (1984), daya jerap arang aktif dapat terjadi karena (1) adanya pori-pori mikro yang sangat banyak yang dapat menimbulkan gejala kapiler yang menyebabkan timbulnya daya jerap, (2) permukaan yang luas dari arang aktif, (3) pada kondisi bervariasi hanya sebagian permukaan yang mempunyai daya jerap, hal ini karena permukaan arang aktif yang bersifat heterogen, penjerapannya hanya terjadi pada permukaan yang aktif saja.
adsorben (disebut difusi internal). Proses adsorpsi pada arang aktif terjadi melalui tiga tahap dasar, yaitu : zat terjerap pada bagian luar, zat bergerak menuju pori-pori arang aktif dan zat terjerap ke dinding bagian dalam dari arang aktif. Walstra (2003)mendefinisikan adsorpsi sebagai proses difusi suatu komponen pada suatu permukaan atau antar partikel. Komponen yang terserap disebut adsorbat dan bahan yang dapat menyerap disebut adsorben. Adsorben dapat berupa padatan atau cairan.
Menurut beberapa peneliti, konsentrasi arang aktif yang digunakan sangat mempengaruhi penurunan konsentrasi inhibitor dan gula sederhana di dalam hidrolisat (Parajo et al. 1995; Silva et al. 1998). Parajo et al. (1996) mengamati bahwa konsentrasi arang aktif hingga 400 g/g dapat mengurangi konsentrasi inhibitor hingga 75%. Silva et al. (1998) arang aktif dengan konsentrasi 1% dapat mengurangi senyawa inhibitor 1-30%. Menurut Chandel et al. (2006), detoksifikasi dengan konsentrasi arang aktif 5% dapat menghilangkan furan (38,7 %), total fenolik (57%) dan asam asetat (46,8%). Metode detoksifikasi dengan arang aktif terbukti merupakan metode yang terbaik, karena memberikan produksi etanol yang baik sebesar 4,03% (b/v) dan biayanya relatif lebih rendah (Mussatto dan Roberto 2003).
2.4 Arang Aktif
Arang aktif adalah arang yang diproses lebih lanjut sehingga pori-porinya terbuka dan luas permukaannya bertambah besar dari 2 m2/g menjadi 300-3000 m2/g, dengan kadar karbon dan keaktifan yang bervariasi, tergantung pada suhu aktivasi dan lamanya waktu aktivasi yang diberikan (Kirk dan Othmer 1964).
Menurut Hartoyo dan Pari (1993), sifat fisik arang aktif dibagi menjadi dua macam :
1. Sifatnya keras dan bobot jenis tinggi, sesuai untuk bahan adsorpsi gas 2. Sifatnya lunak dan bobot jenis rendah, sesuai untuk bahan adsorpsi cairan.
Beukens et al. (1997) membagi besarnya ukuran pori kedalam tiga kategori :
1. Makropori = ukuran pori >250 Å 2. Mesopori = ukuran pori 50 – 250 Å
3. Mikropori = ukuran pori 50 Å dan terbagi atas tiga bagian : a. Maksi mikropori = 25 - 50 Å
b. Mesi mikropori = 15 - 25 Å c. Mini mikropori = < 15 Å
Pengaruh dari ukuran pori terhadap bahan yang dijerap dapat dilihat pada Gambar 3 dan 4.
Gambar 3. Ukuran pori arang aktif (Anonim 2010c)
2.5 Bioetanol
Etanol merupakan produk fermentasi yang dapat diproduksi dari substrat yang mengandung karbohidrat (gula, pati atau selulosa). Etanol merupakan kependekan dari etil alkohol (C2H5OH), sering pula disebut grain alcohol atau
alkohol saja. Bentuknya berupa cairan yang tidak berwana dan mempunyai bau yang khas. Etanol atau etil alkohol merupakan senyawa yang memiliki gugus hidroksil (-OH) yang terikat pada atom karbon. Etanol mempunyai sifat mudah terbakar dan mudah menguap. Etanol dapat dihasilkan melalui sintesa dari minyak bumi ataupun dengan fermentasi bahan yang mengandung gula. Bioetanol adalah etanol yang diproduksi dari sumber daya hayati dengan cara fermentasi menggunakan bantuan S. cerevisiae. Etanol memiliki berat jenis 0,7937 g/ml (t = 150C); titik didih 78,32oC pada tekanan 766 mmHg. Sifat kimia dari etanol adalah larut dalam air dan eter; mempunyai panas pembakaran 328 Kkal. Penggunaan etanol selama ini adalah untuk pelarut (40%), bahan pembuatan asetaldehid (36%), penggunaan kimiawi (15%) dan lain-lain (9%) (Patarau 1981).
Pada proses pembuatan bioetanol terdapat tiga tahapan diantaranya : proses persiapan bahan baku, fermentasi dan destilasi. Pada proses persiapan bahan baku yaitu liquifikasi dan sakarifikasi, bahan baku yang berupa padatan terlebih dahulu dikonversi menjadi larutan gula sebelum difermentasi. Pada bahan-bahan yang sudah berada dalam bentuk larutan seperti mollase dan nira dapat langsung
dilakukan fermentasi. Proses liquifikasi dilakukan penambahan enzim α-amilase
dan air, dan pada proses sakarifikasi dilakukan penambahan enzim glukosidase. Pada tahapan ini proses liquifikasi dan sakarifikasi dengan enzim digantikan dengan asam seperti asam sulfat (H2SO4) dan asam klorida (HCl) dengan
konsentrasi tertentu. Pada tahapan ini larutan hidrolisat yang dihasilkan dilakukan hidrolisis untuk merubah polimer-polimer selulosa dan hemiselulosa menjadi monomer-monomer. Pada proses ini selulosa dipecah mejadi glukosa dan hemiselulosa menjadi pentose dan hexosa (Arnata 2009).
enzim yang dihasilkan oleh jenis mikroba spesifik (Presscot dan Dunn 1981). Fermentasi dapat terjadi secara aerob (memerlukan oksigen) maupun anaerob (tidak memerlukan oksigen). Menurut Hidayat et al. (2006), fermentasi dapat didefinisikan sebagai perubahan gradual oleh aktivitas enzim dari beberapa bakteri, kapang dan khamir.
Etanol dapat diproduksi dari gula yang difermentasikan oleh khamir pada kondisi yang sesuai. Penambahan khamir dapat dilakukan dalam bentuk kering sebagai suspensi. Bahan-bahan yang mengandung monosakarida (C6H12O6
sebagai glukosa) dapat langsung difermentasikan, sedangkan pati selulosa dan hemiselulosa harus dihidrolisis terlebih dahulu menjadi komponen sederhana (monosakarida), untuk kemudian dapat difermentasi (Sa’id 1987).
Mikroba yang digunakan pada fermentasi etanol adalah khamir. Khamir berbentuk menyerupai kapang dari kelompok Ascomycetes yang tidak berfilamen tetapi uniseluler, umumnya berbentuk oval silinder, bulat dan batang. Pemilihan mikroba biasanya didasarkan pada jenis karbohidrat yang digunakan sebagai medium. Untuk memproduksi alkohol dari pati dan gula digunakan
Saccaharomyces cerevisiae yang merupakan khamir yang paling populer dalam pengolahan makanan (Patarau 1981). Menurut Rehm dan Reed (1981), S.
cerevisiae sering dipakai pada fermentasi etanol karena menghasilkan kadar etanol yang tinggi, toleran terhadap kadar etanol yang tinggi, maupun pada suhu tinggi, tetap stabil selama kondisi fermentasi dan dapat bertahan hidup pada pH rendah.
Faktor-faktor yang mempengaruhi hasil etanol dari proses fermentasi adalah suhu fermentasi, derajat keasaman, oksigen, medium fermentasi, kebutuhan nutrien dan kadar etanol (Purwadi 2006). Selain hal tersebut, karakteristik dari hidrolisat juga mempengaruhi kadar etanol yang dihasilkan proses fermentasi. Karakteristik hidrolisat yang baik untuk proses fermentasi disajikan pada Tabel 3.
Tabel 3. Karakteristik hidrolisat untuk fermentasi
No Senyawa Konsentrasi Sumber
1. HMF < 1 g/l Alves et al. (1998)
2. Furfural < 1,5 g/l Nigam (2001)
3. Total Gula 10 – 18% Frazier dan Weshoff (1978)
4. Gula Pereduksi < 30 % Mangunwidjaja dan Suryani (1994)
Tahap ketiga yaitu tahap pemurnian etanol. Pada tahap ini hidrolisat yang dihasilkan dari proses fermentasi didestilasi untuk memurnikan kandungan etanol. Destilasi dilakukan untuk memisahkan etanol dari beer (sebagian besar adalah air dan etanol). Titik didih etanol murni adalah 78o C sedangkan air adalah 100o C (kondisi standar). Pemanasan larutan pada rentang suhu 78-100oC akan mengakibatkan sebagian besar etanol menguap, dan melalui unit kondensasi dapat dihasilkan etanol (Arnata 2009).
Purwadi (2006), membagi kualitas alkohol dengan beberapa tingkatan : 1. Alkohol Teknis (96,5%)
Digunakan terutama untuk kepentingan industri sebagai bahan pelarut organik, bahan baku maupun bahan antara produksi berbagai senyawa organik lainnya.
2. Alkohol Murni (96,0 – 96,5%)
Digunakan terutama untuk kepentingan farmasi dan konsumsi misal untuk minuman keras.
3. Alkohol Absolut ( 99,7 – 99,8%)
III METODOLOGI PENELITIAN
3.1 Bahan dan Alat 3.1.1 Bahan
Bahan baku utama yang digunakan dalam penelitian ini adalah ubi kayu. Bahan kimia yang digunakan di dalam penelitian ini antara lain arang aktif teknis, H2SO4 pekat, Ca(OH)2, NH4OH, etanol dan bahan kimia untuk analisa.
Mikroorganisme yang digunakan untuk fermentasi adalah S. cerevisiae dalam betuk dry baker yeast komersial dengan merk dagang Fermipan. Bahan yang digunakan sebagai bahan tambahan untuk pertumbuhan mikroorganisme adalah pupuk NPK dan urea.
3.1.2 Alat
Peralatan utama yang digunakan di dalam penelitian ini antara lain peralatan gelas, refraktometer merk Atago tipe Master-53M, HPLC merk Hewlett-packard, spektrofotometer merk Hach, otoklaf, pH meter merk Beckman, vortex mixer, desity meter DMA 4500 merk Anton Paar dan seperangkat alat produksi bioetanol skala laboratorium.
3.2 Tempat dan Waktu Penelitian
Penelitian ini dilakukan di SBRC (Surfactant and Bioenergy Research
Center) dan laboratorium–laboratorium di Departemen Teknologi Industri Pertanian, Institut Pertanian Bogor. Penelitian ini dilaksakan pada bulan April – Oktober 2010.
3.3 Tahapan Penelitian
3.3.1 Karakterisasi Ubi Kayu
kadar serat kasar, kadar selulosa, kadar hemiselulosa dan kadar lignin. Prosedur analisa karakterisasi bahan baku dapat dilihat pada Lampiran 1.
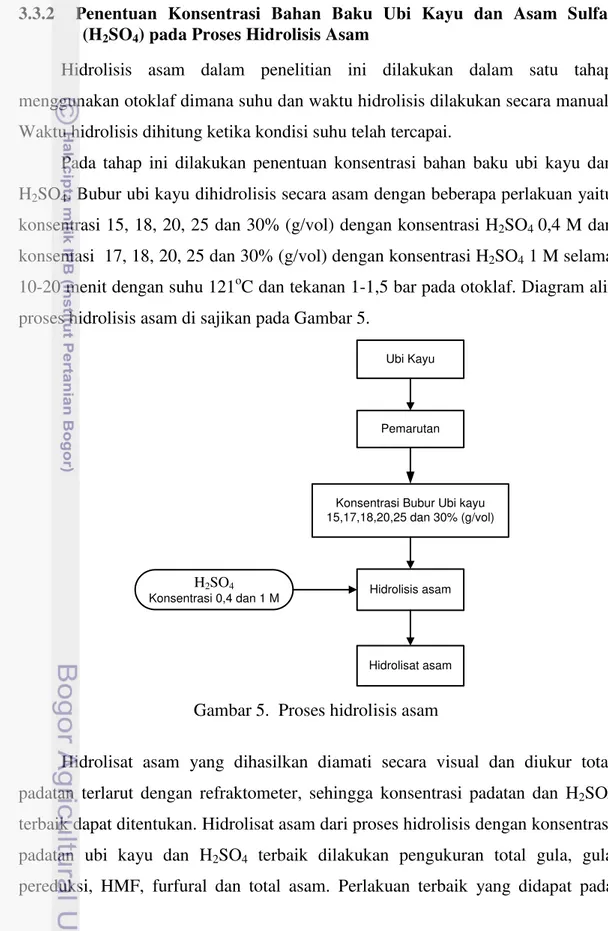
3.3.2 Penentuan Konsentrasi Bahan Baku Ubi Kayu dan Asam Sulfat (H2SO4) pada Proses Hidrolisis Asam
Hidrolisis asam dalam penelitian ini dilakukan dalam satu tahap menggunakan otoklafdimana suhu dan waktu hidrolisis dilakukan secara manual. Waktu hidrolisis dihitung ketika kondisi suhu telah tercapai.
Pada tahap ini dilakukan penentuan konsentrasi bahan baku ubi kayu dan H2SO4. Bubur ubi kayu dihidrolisis secara asam dengan beberapa perlakuan yaitu
konsentrasi 15, 18, 20, 25 dan 30% (g/vol) dengan konsentrasi H2SO4 0,4 M dan
konsentasi 17, 18, 20, 25 dan 30% (g/vol) dengan konsentrasi H2SO4 1 M selama
10-20 menit dengan suhu 121oC dan tekanan 1-1,5 bar pada otoklaf. Diagram alir proses hidrolisis asam di sajikan pada Gambar 5.
Ubi Kayu
Pemarutan
Hidrolisis asam
Hidrolisat asam
H2SO4
Konsentrasi 0,4 dan 1 M
Konsentrasi Bubur Ubi kayu 15,17,18,20,25 dan 30% (g/vol)
Gambar 5. Proses hidrolisis asam
Hidrolisat asam yang dihasilkan diamati secara visual dan diukur total padatan terlarut dengan refraktometer, sehingga konsentrasi padatan dan H2SO4
terbaik dapat ditentukan. Hidrolisat asam dari proses hidrolisis dengan konsentrasi padatan ubi kayu dan H2SO4 terbaik dilakukan pengukuran total gula, gula
tahapan ini digunakan sebagai bahan baku pada penelitian tahap berikutnya dengan proses detoksifikasi.
3.3.3 Penentuan Konsentrasi Arang Aktif dan Lama Waktu Kontak pada Proses Detoksifikasi Arang Aktif
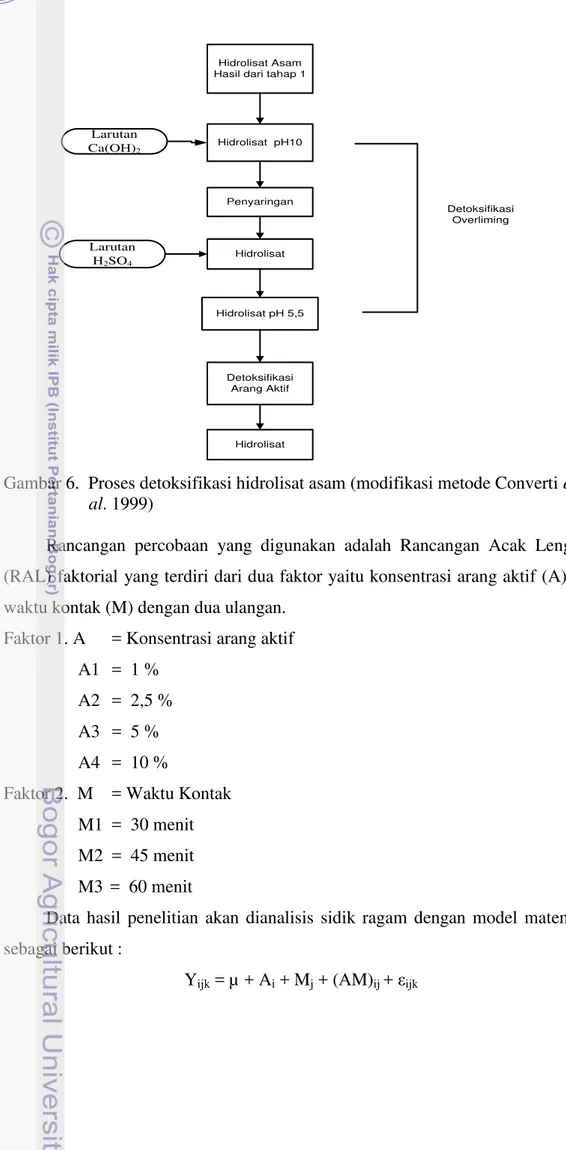
Pada penelitian ini, sistem detoksifikasi dilakukan dalam 2 tahapan yaitu metode overliming dan arang aktif (modifikasi metode Converti et al. 1999). Pada tahap overliming, hidrolisat asam yang dihasilkan dari proses hidrolisis dengan konsentrasi ubi kayu dan asam sulfat (H2SO4) terbaik ditambahkan larutan kapur
tohor (Ca(OH)2) untuk menaikkan pH menjadi pH 10. Konsentrasi larutan
Ca(OH)2 yang digunakan sebesar 16,77% (Jenkins 1966). Larutan ini didapat dari
hasil penambahan kapur tohor (CaO) dengan air (H2O), dengan perbadingan 1 : 5.
Setelah ditambahkan Ca(OH)2, kemudian hidrolisat diaduk selama 30 menit dan
dilakukan penyaringan untuk menghilangkan kandungan kapur dan senyawa lain yang mengendap. Selanjutnya asam sulfat (H2SO4) ditambahkan pada hidrolisat
untuk menurunkan pH hidrolisat hingga mencapai pH 5,5 – 6. Asam sulfat (H2SO4) yang digunakan untuk menurunkan pH hidrolisat memiliki konsentrasi
0,4 M. Karena pada metode overliming kandungan HMF dan furfural di dalam hidrolisat masih cukup tinggi. Maka diperlukan metode lanjutan untuk mengurangi kandungan HMF dan furfural yaitu adsorpsi arang aktif.
Hidrolisat Asam Hasil dari tahap 1
Hidrolisat pH10
Hidrolisat pH 5,5
Detoksifikasi Overliming
Detoksifikasi Arang Aktif
Hidrolisat Penyaringan
Hidrolisat Larutan
H2SO4 Larutan Ca(OH)2
Gambar 6. Proses detoksifikasi hidrolisat asam (modifikasi metode Converti et al. 1999)
Rancangan percobaan yang digunakan adalah Rancangan Acak Lengkap (RAL) faktorial yang terdiri dari dua faktor yaitu konsentrasi arang aktif (A) dan waktu kontak (M) dengan dua ulangan.
Faktor 1. A = Konsentrasi arang aktif A1 = 1 %
A2 = 2,5 % A3 = 5 % A4 = 10 %
Faktor 2. M = Waktu Kontak M1 = 30 menit M2 = 45 menit M3 = 60 menit
Data hasil penelitian akan dianalisis sidik ragam dengan model matematis sebagai berikut :
Keterangan:
Yijk : Nilai pengamatan pada faktor konsentrasi arang aktif taraf ke-i,
faktor waktu kontak taraf ke-j dan ulangan ke-k µ : Nilai rata-rata umum
Ai : Pengaruh konsentrasi arang aktif taraf ke-i
Mj : Pengaruh lama waktu kontak taraf ke-j
(AM)ij : Pengaruh interaksi konsentrasi arang aktif taraf ke-i dan waktu
kontak taraf ke-j
εijk : Galat percobaan pada faktor konsentrasi arang aktif taraf ke-i, pada
faktor waktu kontak taraf ke-j dan ulangan ke-k i : Konsentrasi arang aktif ( i = 1, 2,5, 5 dan 10%) j : Lama waktu kontak ( j = 30, 45 dan 60 menit)
Parameter yang diamati meliputi kadar total gula, gula pereduksi HMF, furfural, dan total asam. Uji lanjut dengan Newman-keuls dilakukan untuk menentukan pengaruh perlakuan terhadap parameter.
3.3.4 Penentuan Laju Adsorpsi Arang Aktif
Setelah didapat konsentrasi arang aktif yang terbaik dari hasil proses detoksifikasi dengan berbagai konsentrasi dilakukan pengukuran laju adsorpsi arang aktif terhadap kandungan total gula, gula pereduksi, HMF dan furfural di dalam hidrolisat. Proses ini dilakukan untuk mengetahui pada menit ke berapa, arang aktif yang ada di dalam hidrolisat telah mencapai waktu terbaik dalam proses penjerapan senyawa inhibitor (HMF dan furfural).
Pada tahapan ini, konsentrasi bahan baku ubi kayu dan H2SO4 terbaik
dilakukan proses hidrolisis, kemudian didetoksifikasi dengan overliming terlebih dahulu sebelum ditambahkan konsentrasi arang aktif terbaik. Pada detoksifikasi arang aktif dilakukan proses pengadukan 150 rpm dengan suhu 40 oC. Tahap penarikan sampel dilakukan secara terus menerus pada hidrolisat yang diberi arang aktif. Pengambilan sampel dilakukan sebanyak 14 kali yaitu pada waktu menit ke 1, 3, 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55 dan 60. Parameter yang diamati meliputi kadar HMF, furfural, total gula, dan gula pereduksi.
dengan memplotkan HMF dan furfural di dalam hidrolisat (c) dengan lama adsorpsi (t) (Kirk dan Othmer 1964).
Hubungan antara konsentrasi penjerapan HMF dan furfural dalam adsorben (q) dengan konsentrasi penyerapan HMF dan furfural di dalam hidrolisat (c) dengan menggunakan model isoterm adsorpsi. Perhitungan nilai q dapat dilihat pada persamaan : (Kirk dan Othmer 1964)
q = co−ct xV
m……….(1)
Keterangan :
q = konsentrasi penjerapan HMF dan furfural di dalam adsorben (g/g) co = konsentrasi awal HMF dan furfural di dalam hidrolisat (g/l)
ct = konsentrasi HMF dan furfural di dalam hidrolisat dalam lama waktu adsorpsi tertentu (g/l)
V = volume hidrolisat (l) m = massa adsorben (g)
Nilai konstanta laju adsorpsi (k) dapat ditentukan dengan cara memplotkan nilai konsentrasi penjerapan HMF dan furfural di dalam adsorben (q) dengan nilai konsentrasi HMF dan furfural di dalam hidrolisat (c) pada persamaan Langmuir dan Freundlich.
Plot dari 1/q dan 1/c menghasilkan bentuk linear dari model Langmuir. Persamaan linear tersebut dapat dilihat pada persamaan 1 :
1
Kemiringan dari hasil regresi linear persamaan 2 menghasilkan nilai k/qmaks
dimana k merupakan konstanta laju adsorpsi dan intersepnya menunjukan nilai 1/qmaks. Sedangkan Plot dari log q dan log c menghasilkan bentuk linear dari
model Freundlich. Persamaan linear tersebut dapat dilihat pada persamaan 3 :
log q = log k + n log c ……….…. (3)
3.3.5 Penentuan Kondisi Hidrolisat terhadap Konsentrasi Etanol
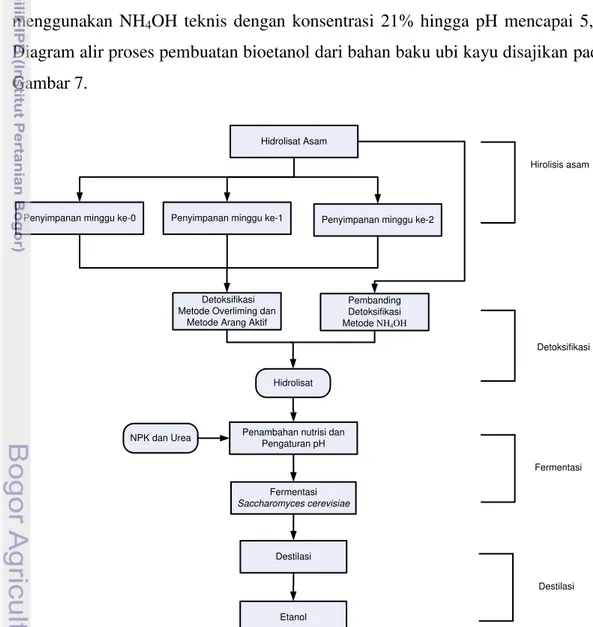
Hidrolisat yang dihasilkan dari proses hidrolisis dengan konsentrasi ubi kayu dan asam sulfat (H2SO4) terbaik dilakukan proses penyimpanan.
Penyimpanan dilakukan di dalam inkubator pada suhu 30 oC. Pengamatan dilakukan setiap minggu dan parameter yang dianalisa meliputi pengukuran total gula dan gula pereduksi.
Setelah proses penyimpanan, dilakukan proses lanjut dengan detoksifikasi. Hidrolisat asam yang dihasilkan didetoksifikasi dengan overliming dan arang aktif dengan konsentrasi arang aktif dan lama waktu kontak terbaik. Sebagai pembanding hidrolisat asam dilakukan proses netralisasi. Proses netralisasi menggunakan NH4OH teknis dengan konsentrasi 21% hingga pH mencapai 5,5.
Diagram alir proses pembuatan bioetanol dari bahan baku ubi kayu disajikan pada Gambar 7.
Penyimpanan minggu ke-0 Penyimpanan minggu ke-1 Penyimpanan minggu ke-2
Hirolisis asam
Detoksifikasi
Fermentasi
Destilasi
Hidrolisat yang dihasilkan setelah proses detoksifikasi kemudian dipanaskan pada suhu 105oC selama 5 menit sebelum fermentasi. Tujuan dari pemanasan adalah membunuh mikroba-mikroba selain ragi yang mengganggu proses fermentasi. Penurunan suhu sampai dengan 30oC dilakukan sebelum fermentasi
IV HASIL DAN PEMBAHASAN
4.1 Karakteristik Ubi Kayu
Bahan baku yang digunakan pada penelitian ini adalah ubi kayu yang diperoleh dari kebun di daerah Cibereum, Jawa Barat. Ubi kayu yang digunakan pada penelitian ini berumur ± 1 tahun dengan ciri-ciri fisik yaitu umbinya berbentuk silinder memanjang berwarna coklat tua dengan daging umbi berwarna putih.
Ubi kayu segar mempunyai karakteristik kadar air yang tinggi diikuti dengan kadar pati. Hasil karakterisasi secara lengkap disajikan pada Tabel 4.
Tabel 4. Karateristik ubi kayu segar
Komponen Ubi kayu segar
Kadar air bahan baku ubi kayu yang digunakan dalam penelitian ini sekitar 66,74%. Hasil penelitian Susmiati (2010) menyatakan, ubi kayu segar mempunyai kadar air sebesar 57%. Perbedaan kadar air ubi kayu ini diduga karena perbedaan jenis ubi kayu yang digunakan. Menurut Balagopalan et al. (1988), nilai kadar air ubi kayu adalah 59,40%, sedangkan menurut Tjokroadikoesoemo (1986) kadar air ubi kayu mencapai 62,50%.
Kadar air ubi kayu digunakan sebagai dasar perhitungan pengenceran asam dan konsentrasi padatan yang akan digunakan pada tahap hidrolisis asam. Kadar air yang tinggi pada bahan baku mempunyai keuntungan yaitu mengurangi jumlah penggunaan air pada saat proses hidrolisis.
et al. 1988). Berdasarkan hasil pengamatan, kadar abu ubi kayu adalah 0,67%, kadar lemak dan protein sebesar 0,36% dan 1,05%. Kadar lemak dan protein berpengaruh terhadap karakteristik gelatinisasi dan kekentalan bahan pada saat diolah. Adanya lemak pada bahan berpati dapat mengganggu proses gelatinisasi karena lemak dapat membentuk kompleks dengan amilosa sehingga menghambat keluarnya amilosa dari granula pati, sedangkan protein dapat menyebabkan kekentalan pati menurun (Mohamed dan Duarteb 2003). Pada penelitian ini diharapkan pati dapat tergelatinisasi sempurna sehingga terbentuk gula-gula sederhana setelah proses hidrolisis asam.
Karbohidrat dalam ubi kayu merupakan komponen utama dalam proses produksi etanol. Ubi kayu yang digunakan mengandung karbohidrat sebesar 31,18%. Karbohidrat ubi kayu terdiri dari pati sebesar 30,42% dan serat kasar sebesar 0,77%. Menurut Balagopalan et al.(1988), kadar pati di dalam ubi kayu sebesar 38,10% dan kadar serat sebesar 0,60%. Pendey et al. (2000), kadar pati dalam ubi kayu sebesar 32,4% dan kadar serat sebesar 1,2%. Untuk komponen serat kasar mengandung selulosa 3,51%, hemiselulosa 11,77% dan lignin 0,67%.
Pada proses hidrolisis secara asam, pati memiliki kemampuan terhidrolisis lebih baik dibandingkan dengan serat. Menurut Judoamidjojo et al. (1989), faktor yang mempersulit hidrolisis serat adalah selulosa mempunyai struktur kristalin (50% - 90%) yang tidak mudah terhidrolisis oleh asam. Selain selulosa di dalam serat terdapat hemiselulosa, sifat hemiselulosa lebih amorf dan lebih mudah terhidrolisis dibandingkan dengan selulosa (Rusdianto 2010).
4.2 Konsentrasi Bahan Baku Ubi Kayu dan Asam Sulfat (H2SO4) pada
Proses Hidrolisis Asam
Proses hidrolisis secara asam merupakan proses untuk memecah komponen polisakarida menjadi monomer-monomer. Proses hidrolisis yang sempurna akan memecah selulosa dan pati menjadi glukosa, sedangkan hemiselulosa akan terpecah menjadi xilosa, manosa, galaktosa dan glukosa.
Pada proses hidrolisis secara asam, konsentrasi bahan baku ubi kayu dan H2SO4 sebagai asam penghidrolisis sangat menentukan hasil hidrolisatnya. Hasil
penelitian Susmiati (2010), menunjukkan bahwa penggunaan H2SO4 0,4 M
penelitian ini, bahan baku yang digunakan adalah ubi kayu segar. Konsentrasi ubi kayu yang diujikan 15 – 30% dengan H2SO4 0,4 M dan konsentrasi ubi kayu
17-30% dengan H2SO4 1 M. Data hasil pengamatan dapat dilihat pada Tabel 5.
Tabel 5. Karakteristik hidrolisat asam pada konsentrasi bahan baku dan asam sulfat (H2SO4) yang berbeda
Konsentrasi Konsentrasi Brix Bahan baku yang tidak Padatan (%) H2SO4 (M) (%) terhidrolisis (kualitatif)
- : bahan baku terhidrolisis sempurna
* : tingkat bahan baku yang tidak terhidrolisis sempurna (semakin banyak tanda *, semakin banyak bahan yang tidak terhidrolisis sempurna)
Pada Tabel 5 dapat dilihat, hasil proses hidrolisis secara asam menunjukkan bahwa semakin tinggi konsentrasi bahan baku yang digunakan akan meningkatkan nilai konsentrasi total gula (% brix). Hal ini disebabkan karena semakin tinggi konsentrasi bahan baku maka semakin banyak pati dan serat yang ada di dalamnya. Pada proses hidrolisis asam, pati dan serat diubah menjadi gula sederhana (monosakarida dan oligosakarida) sehingga semakin banyak pati dan serat akan meningkatkan nilai konsentrasi total gula (% brix). Namun konsentrasi bahan baku yang terlalu tinggi dapat mengakibatkan pati dan serat tidak dapat terhidrolisis secara sempurna. Adanya bahan baku yang tidak terhidrolisis secara sempurna diduga karena kurangnya konsentrasi penghidrolisis asam.
Pada Tabel 5 juga dapat dilihat, semakin tinggi konsentrasi H2SO4 yang
digunakan, maka pati dan serat yang terdapat dalam bahan baku yang dapat terhidrolisis semakin banyak, sehingga nilai total gula (% brix) meningkat. Namun konsentrasi H2SO4 dengan 1 M juga dianggap kurang bila jumlah
20%. Hal ini dikarenakan larutan H2SO4 yang ditambahkan tidak dapat
mengkonversi seluruh pati ubi kayu dalam jumlah besar menjadi gula-gula sederhana, hanya terjadi gelatinisasi pati sehingga tidak terhidrolisis secara sempurna. Bahan baku ubi kayu yang terhidrolisis secara sempurna dan tidak sempurna selama proses hidrolisis asam dapat dilihat pada Gambar 8.
(a) (b)
Gambar 8. Bahan terhidrolisis (a) Ubi kayu tidak terhidrolisis sempurna (b) ubi kayu terhidrolisis sempurna
Pada proses fermentasi untuk menghasilkan etanol, konsentrasi gula yang dibutuhkan untuk menghasilkan etanol adalah 10 –18% (Frazier dan Weshoff 1978). Hasil penelitian yang dilakukan Susmiati (2010) konsentrasi total gula hidrolisat yang baik untuk dilakukan proses fermentasi adalah 15-18%. Amerine
et al. (1987) menambahkan bahwa konsentrasi gula yang tinggi (> 25%), dapat menyebabkan akitivitas khamir menjadi terhambat (substrate inhibitor), waktu fermentasi menjadi lebih lama, serta tidak semua gula dapat terkonversi menjadi etanol. Penggunaan konsentrasi gula yang terlalu rendah akan menghambat pertumbuhan khamir serta menjadikan proses fermentasi menjadi tidak ekonomis, karena penggunaan fermentor yang tidak efisien.
detoksifikasi sesuai untuk proses fermentasi. Berdasarkan parameter tersebut, hanya perlakuan dengan konsentrasi ubi kayu 17, 18 dan 20% dengan H2SO4 1 M
yang memenuhi syarat.
Hasil uji pada Tabel 5 menunjukkan konsentrasi bahan baku 17% menghasilkan total gula (% brix) sebesar 24%, hasil ini menunjukkan bahan baku terhirolisis secara sempurna namun konsentrasi asam yang ada diduga masih dapat menghidrolisis bahan baku lebih tinggi lagi. Hal ini dapat dilihat pada konsentrasi bahan baku 18% menghasilkan total gula (% brix) sebesar 25% terjadi peningkatan total gula (% brix). Sedangkan pada konsentrasi bahan baku 20%, total gula (% brix) hidrolisat yang didapat sebesar 25%. Hasil total gula (% brix) ini sama dengan total gula (% brix) yang dihasilkan pada konsentrasi ubi kayu 18%, hal ini diduga pada konsentrasi bahan baku 20%, larutan H2SO4 yang
digunakan tidak cukup untuk menghidrolisis seluruh ubi kayu sehingga masih terdapat pati yang tidak terhidrolisis secara sempurna. Dengan demikian ditetapkan bahwa bahan baku yang paling baik untuk dilakukan proses lanjut (detoksifikasi dan fermentasi) adalah ubi kayu dengan konsentrasi 18% dengan H2SO4 1 M.
Proses hidrolisis asam menggunakan ubi kayu dengan konsentrasi 18% dan H2SO4 1 M menghasilkan nilai dextrose equivalent sebesar 77,03. Nilai DE 77
menandakan proses hidrolisis mampu mengkonversi sekitar 77% karbohidrat rantai panjang menjadi gula pereduksi. Hasil ini lebih baik bila dibandingkan dengan penelitian yang telah dilakukan Rusdianto (2010), nilai dextrose
equivalent yang dihasilkan sebesar 65,28 dengan perlakuan konsentrasi ubi kayu 18% dan H2SO4 1 M. Menurut Arnata (2010), hidrolisis asam menggunakan
H2SO4 0,4 M dengan bahan baku tepung ubi kayu 30% akan menghasilkan nilai
dextrose equivalent sebesar 66,63.
4.3 Pengaruh Detoksifikasi terhadap Karakteristik Hidrolisat 4.3.1 Proses Detoksifikasi
Hidrolisat asam yang dihasilkan dari proses hidrolisis dengan konsentrasi bahan baku ubi kayu 18% dan H2SO4 1 M dilakukan proses detoksifikasi. Proses
detoksifikasi digunakan untuk meningkatkan kemampuan fermentasi dengan mengurangi senyawa-senyawa yang bersifat toksik pada hidrolisat. Pada penelitian ini proses detoksifikasi yang digunakan meliputi overliming dan arang aktif.
Detoksifikasi overliming adalah proses penambahan kapur tohor Ca(OH)2
ke dalam hidrolisat untuk mengurangi konsentrasi HMF, furfural dan total asam. Detoksifikasi overliming merupakan adaptasi dari proses liming pada produksi gula tebu. Menurut Purwadi (2006), mekanisme proses overliming adalah pembetukan garam-garam dari reaksi asam basa antara H2SO4 dengan Ca(OH2)
dan juga melibatkan pembentukan senyawa baru dari reaktan (gula-gula, HMF dan furfural) dan ion Ca2+.
Hidrolisat yang dihasilkan setelah proses overliming diuji konsentrasi total gula, gula pereduksi, HMF, furfural dan total asam. Hasil karakteristik hidrolisat sebelum dan sesudah proses overliming disajikan pada Tabel 6.
Tabel 6. Karakteristik hidrolisat sebelum dan sesudah proses detoksifikasi overliming
Karakteristik Sebelum Sesudah (%) Penurunan
Total gula (g/l) 265,48 251,49 5,56
Gula Pereduksi (g/l) 218,09 204,50 6,23
HMF (g/l) 3,78 2,48 34,38
Furfural (g/l) 0,029 0,011 60,81
Total Asam (ml NaOH 0,1 N / g bahan) 152 2,2 98,55
Pada Tabel 6 dapat dilihat, hasil analisa hidrolisat setelah proses overliming menunjukkan terjadi penurunan konsentrasi total gula. Penurunan konsentrasi total gula setelah detoksifikasi overliming sebesar 5,56%. Penurunan konsentrasi total gula menunjukkan bahwa gula-gula (oligosakarida dan monosakarida) yang terbentuk dari proses hidrolisis bereaksi dengan ion Ca2+ membentuk senyawa
Proses overliming juga mempengaruhi penurunan konsentrasi gula pereduksi di dalam hidrolisat. Penurunan konsentrasi gula pereduksi sebesar 6,23%, kecilnya penurunan konsentrasi gula pereduksi menunjukan bahwa proses
overliming tidak menyebabkan penurunan yang cukup besar terhadap konsentrasi gula pereduksi di dalam hidrolisat.
Hasil karakteristik hidrolisat, konsentrasi HMF di dalam hidrolisat hasil hidrolisis sebesar 3,78 g/l. Besarnya konsentrasi HMF yang dihasilkan karena terjadi degradasi dari gula-gula sederhana. Menurut Purwadi (2006) HMF dihasilkan dari degradasi berbagai jenis gula seperti manosa, galaktosa dan glukosa. Reaksi pembentukan HMF dijelaskan oleh Fennema (1985) yaitu terjadi pembentukan produk antara pada reaksi dehidrasi intramolekular yaitu 3-deoksioson, bentukan dari D-glukosa. Reaksi β-eliminasi diteruskan dengan bentuk enol pada 3-deoksiglukoson. Cis-3,4-ene gula selanjutnya mengalami perputaran cincin dan dehidrasi untuk menghasilkan HMF. Setelah dilakukan proses overliming konsentrasi HMF di dalam hidrolisat sebesar 2,48 g/l, terjadi penurunan konsentrasi HMF di dalam hidrolisat sebesar 34,38%. Konsentrasi HMF yang ada di dalam hidrolisat setelah detoksifikasi overliming masih cukup besar hal tersebut dapat menghambat dalam proses fermentasi.
Konsentrasi furfural yang ada di dalam hidrolisat dari proses hidrolisis sebesar 0,029 g/l. Setelah dilakukan proses overliming terjadi penurunan konsentrasi furfural sebesar 60,81%. Konsentrasi furfural di dalam hidrolisat sebelum dan sesudah proses overliming yang cukup kecil tidak mempengaruhi di dalam proses fermentasi. Menurut Nigam (2001), konsentrasi furfural kurang dari 0,25 g/l di dalam media fermentasi tidak mempengaruhi konsentrasi etanol yang dihasilkan, tetapi konsentrasi melebihi 1,5 g/l akan mengurangi produktivitas etanol yang dihasilkan dalam proses fementasi. Menurut Purwadi (2006), proses
dalam hidrolisat sebelum dan sesudah proses detoksifikasi overliming disajikan pada Lampiran 2.
Konsentrasi total asam yang ada di dalam hidrolisat dihasilkan dari proses penambahan asam ke dalam bahan baku ketika proses hidrolisis, setelah dilakukan proses detoksifikasi overliming konsentrasi total asam mengalami penurunan sebesar 98,68%. Penurunan nilai total asam yang cukup signifikan dalam hidrolisat karena proses detoksifikasi overliming merupakan reaksi penetralan atau pembentukan garam dari reaksi asam basa antara H2SO4 hasil hidrolisis
dengan larutan Ca(OH)2.
Hasil karakteristik hidrolisat menunjukkan bahwa proses overliming cukup efektif menurunkan konsentrasi HMF, furfural dan total asam tanpa menurunkan konsentrasi total gula dan gula pereduksi terlalu besar. Namun, konsentrasi HMF di dalam hidrolisat yang masih cukup besar yaitu 2,48 g/l. Hal ini menunjukkan hidrolisat yang dihasilkan masih kurang baik untuk dilakukan fermentasi. Menurut Alves et al. (1998), hidroksimetil furfural (HMF), pada konsentrasi 1 g/l, sudah cukup untuk menghambat proses fermentasi. Oleh karena itu dibutuhkan proses lanjut untuk menggurangi konsentrasi HMF yang ada di dalam hidrolisat. Pada penelitian ini proses lanjut yang digunakan adalam detoksifikasi arang aktif.
Gambar 9. Ukuran pori arang aktif
4.3.2 Karakteristik Hidrolisat
4.3.2.1 Hidroksimetil Furfural (HMF)
Hidroksimetil furfural (HMF) merupakan senyawa yang dihasilkan dari degradasi glukosa, galaktosa dan manosa. Senyawa ini merupakan inhibitor dalam proses fermentasi karena dapat menghalangi proses konversi glukosa menjadi etanol. Hasil analisa konsentrasi HMF di dalam hidrolisat setelah proses detoksifikasi arang aktif disajikan pada Tabel 7.
Tabel 7. Pengaruh konsentrasi arang aktif dan lama waktu kontak terhadap konsentrasi HMF (g/l) di dalam hidrolisat
Lama Waktu Kontak (Menit)
Konsentrasi Arang Aktif (%)
1 2,5 5 10
30 2,08 1,87 0,85 0,38
45 1,99 1,53 0,65 0,33
60 1,91 1,34 0,58 0,25
(%) Penurunan
30 16,2 24,5 65,7 84,8
45 19,7 38,4 73,8 86,9
60 22,9 46,0 76,5 90,0
Keterangan : konsentasi HMF awal sebesar 2,48 g/l
1,5 1,6
Pada Tabel 7 menunjukkan, konsentrasi HMF di dalam hidrolisat mengalami penurunan yang lebih besar ketika konsentrasi arang aktif yang ditambahkan semakin besar. Hasil analisa konsentrasi HMF menunjukkan ukuran molekul HMF yang lebih kecil yang menyebabkan arang aktif dapat menjerap HMF ke dalam pori arang aktif. Menurut Weng et al. (2009), ukuran molekul HMF sebesar 0,46 nm.
Hasil analisa terhadap lama waktu kontak menunjukan bahwa semakin lama waktu kontak yang diberikan maka akan semakin besar penurunan konsentrasi HMF di dalam hidrolisat. Pada lama waktu kontak 30 hingga 45 menit konsentrasi HMF yang mampu dijerap oleh arang aktif masih relatif besar bila dibandingkan dengan lama waktu kontak 60 menit. Hal ini diduga karena kondisi arang aktif pada lama waktu kontak 60 menit telah jenuh sehingga semakin sedikit molekul HMF yang dapat dijerap.
Pada Tabel 7 terlihat bahwa terjadi peningkatan persentase penurunan konsentrasi gula pereduksi di dalam hidrolisat ketika konsentrasi arang aktif dan lama waktu kontak ditingkatkan. Hasil analisa terhadap persentase penurunan HMF menunjukkan bahwa konsentrasi arang aktif 1% dan 2% menyebabkan penurunan konsentrasi HMF rata-rata sebesar 19,6 dan 36,3%. Pada penggunaan konsentrasi arang aktif 5% dan 10% terjadi penurunan konsentrasi HMF sebesar 72,0% dan 87,2%. Menurut David et al. (2008), penggunaan konsentrasi arang aktif 5% dapat mengurangi konsentrasi HMF hingga 85%.
Hasil analisa interaksi antara konsentrasi arang aktif dan lama waktu kontak menunjukkan semakin tinggi konsentrasi yang ditambahkan dan semakin lama waktu kontak yang diberikan akan meningkatkan penjerapan HMF yang ada di dalam hidrolisat. Pada Tabel 7 menunjukkan, pada perlakuan dengan konsentrasi arang aktif 5% dengan lama waktu kontak 30 menit konsentrasi HMF yang ada di dalam hidrolisat telah di bawah 1 g/l. Hal ini menunjukkan bahwa hidrolisat telah memenuhi syarat batas maksimum konsentrasi HMF yang ada di dalam hidrolisat untuk proses fermentasi.