PROFIL LEUKOSIT PADA AYAM BROILER
YANG DIBERI EKSTRAK TANAMAN OBAT
FAKULTAS KEDOKTERAN HEWAN INSTITUT PERTANIAN BOGOR
BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi “Profil Leukosit pada Ayam Broiler yang Diberi Ekstrak Tanaman Obat” adalah karya saya dengan arahan dosen pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, September 2013
ABSTRAK
BAGUS SETA CHANDRA WIJAYA. Profil Leukosit pada Ayam Broiler yang Diberi Ekstrak Tanaman Obat. Dibimbing oleh ANITA ESFANDIARI dan BAMBANG PONTJO PRIOSOERYANTO.
Penelitian ini bertujuan untuk melihat pengaruh pemberian formula ekstrak tanaman obat yaitu temulawak (Curcuma xanthorriza Roxb.), temu ireng (Curcuma aeruginosa Roxb.), sambiloto (Andrographis paniculata Nees.), dan meniran (Phyllanthus niruri Linn.) terhadap profil leukosit ayam broiler. Dua puluh lima Day Old Chick (DOC) dibagi menjadi lima kelompok dan diberi perlakuan yang berbeda, yaitu (1) F1, diberi formula ekstrak temulawak, temu ireng, sambiloto, dan meniran; (2) F2, diberi formula temulawak, temu ireng, dan meniran; (3) F3, diberi formula temulawak dan temu ireng; (4) F4, diberi formula sambiloto dan meniran; (5) kelompok kontrol (K-), tidak diberi perlakuan. Ekstrak diberikan selama 28 hari melalui rute oral. Ayam diambil secara acak 5 ekor dari setiap kelompok perlakuan pada hari terakhir perlakuan, kemudian sampel darah diambil dari vena brachialis untuk diperiksa terhadap diferensiasi leukosit yang meliputi persentase limfosit, monosit, heterofil, eosinofil, dan basofil. Hasil pengamatan menunjukkan bahwa persentase limfosit meningkat pada kelompok F2, F3, dan F4, dengan peningkatan yang nyata terjadi pada kelompok F4. Persentase monosit meningkat pada semua kelompok perlakuan, dan persentase heterofil meningkat secara signifikan pada kelompok F1. Berdasarkan data persentase leukosit, disimpulkan bahwa formulasi ekstrak temulawak dan temu ireng merupakan kombinasi terbaik dalam meningkatkan sistem imun tubuh.
ABSTRACT
BAGUS SETA CHANDRA WIJAYA. Leukocyte Profiles in Broilers Chicken Fed by Extracts of Medicinal Plants. Supervised by ANITA ESFANDIARI and BAMBANG PONTJO PRIOSOERYANTO.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan
pada
Fakultas Kedokteran Hewan
PROFIL LEUKOSIT PADA AYAM BROILER
YANG DIBERI EKSTRAK TANAMAN OBAT
BAGUS SETA CHANDRA WIJAYA
FAKULTAS KEDOKTERAN HEWAN INSTITUT PERTANIAN BOGOR
Judul Skripsi : Profil Leukosit pada Ayam Broiler yang Diberi Ekstrak Tanaman Obat
Nama : Bagus Seta Chandra Wijaya NIM : B04080104
Disetujui oleh
Dr. drh. Anita Esfandiari, MSi Pembimbing I
Prof.drh. Bambang Pontjo P, MS. Ph.D. APVet Pembimbing II
Diketahui oleh
drh. Agus Setiyono, MS PhD APVet Wakil Dekan Fakultas Kedokteran Hewan
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Judul yang dipilih dalam penelitian yang dilaksanakan sejak bulan Februari 2011 ini adalah “Profil Leukosit pada Ayam Broiler yang Diberi Ekstrak Tanaman Obat”.
Terima kasih penulis ucapkan kepada ibu, bapak, ketiga kakak dan keluarga besar atas segala dukungan, doa, dan kasih sayangnya. Ungkapan terima kasih sebesar-besarnya disampaikan kepada Dr. drh. Anita Esfandiari, MSi dan Prof. drh. Bambang Pontjo Priosoeryanto, MS.Ph.D. APVet selaku pembimbing skripsi atas ilmu, waktu, dukungan, motivasi, dan kesabaran yang telah diberikan selama ini.
Ungkapan terima kasih juga disampaikan kepada orang-orang yang mendukung dan membantu penulis dalam menyusun skripsi: drh Mawar Subangkit, Pak Djajat, Pak Suryono dan Pak Bambang. Teman satu penelitian Adit, Andrew, Gregorio, dan Oliv. Teman Tim Mawar, Aswin, Awan, Ridwan, Oka, Dian, Made, Rizal, Paguyuban (Riris, Susi, Cupu, Widia, Farah, Hafiz, Babang, Jami, Mutia) dan Ana atas semangat, bantuan, nasihat, dan dukungannya, serta seluruh Avenzoar tercinta dan nama-nama yang tidak bisa penulis cantumkan satu persatu.
Semoga karya ilmiah ini bermanfaat.
Bogor, September 2013
DAFTAR ISI
DAFTAR TABEL ix
DAFTAR GAMBAR ix
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 1
Manfaat Penelitian 1
TINJAUAN PUSTAKA 2
METODE 9
HASIL DAN PEMBAHASAN 12
Hasil 12
Pembahasan 14
SIMPULAN DAN SARAN 17
Simpulan 17
Saran 17
DAFTAR PUSTAKA 17
DAFTAR TABEL
1 Kelompok perlakuan ayam percobaan yang diberi formula ekstrak
empat tanaman obat 10
2 Rataan persentase diferensial leukosit (%) pada ayam broiler yang diberi formula ekstrak temulawak, temu ireng, sambiloto, dan meniran 12
DAFTAR GAMBAR
1 Ayam broiler 2
2 Temulawak 3
3 Temu ireng 3
4 Meniran 4
5 Sambiloto 5
6 Limfosit 6
7 Monosit 6
8 Heterofil 7
9 Eosinofil 8
10 Basofil 8
11 Jadwal perlakuan penelitian 11
PENDAHULUAN
Latar belakang
Indonesia yang memiliki iklim tropis dengan sumber daya alam melimpah mendukung pertumbuhan serta perkembangan berbagai jenis flora dan fauna. Tanaman obat, yang termasuk sebagai obat-obatan alam, diakui masyarakat memiliki peranan dalam upaya pemeliharaan, peningkatan, pemulihan, dan pengobatan penyakit. Tanaman obat dapat mempengaruhi mekanisme pertahanan tubuh dan memiliki efek samping yang lebih sedikit dibandingkan dengan obat-obat farmasetika. Beberapa jenis tanaman obat-obat yang sering digunakan diantaranya adalah temulawak, meniran, sambiloto, dan temuireng (Suhirman dan Winarti 2010).
Leukosit merupakan unit aktif dari sistem pertahanan tubuh. Leukosit mempunyai peranan dalam pertahanan seluler dan humoral organisme terhadap zat-zat asing. Leukosit sebagian dibentuk di sumsum tulang (granulosit, monosit dan sedikit limfosit) dan sebagian lagi di jaringan limfe (limfosit dan sel plasma). Leukosit yang telah terbentuk akan masuk ke dalam darah dan diangkut menuju daerah-daerah yang mengalami peradangan (Brown 1980; Guyton 2006).
Kandungan zat aktif tanaman obat diyakini memiliki aktivitas imunomodulasi untuk meningkatkan kekebalan tubuh terhadap infeksi secara alami. Hal tersebut berhubungan dengan sistem kekebalan nonspesifik seperti modulasi terhadap proliferasi limfosit dan respon seluler sel-sel kekebalan (sel T, sel B, makrofag, neutrofil, natural killer cell, dan sel dendritik) (Yue et al. 2010).
Tujuan
Penelitian ini bertujuan untuk mempelajari profil leukosit ayam broiler (limfosit, monosit, heterofil, eosinofil, dan basofil) yang diberi ekstrak tanaman obat yaitu temulawak, temu ireng, sambiloto, dan meniran.
Manfaat
2
TINJAUAN PUSTAKA
Ayam broiler
Ayam ras pedaging atau broiler (Gambar 1), merupakan jenis ras unggulan hasil persilangan bangsa-bangsa ayam yang memiliki produktivitas tinggi, terutama dalam memproduksi daging. Pemeliharaan ayam broiler relatif singkat berkisar antara 5–6 minggu (Anonim 2006). Ayam broiler merupakan galur ayam hasil rekayasa teknologi yang memiliki keunggulan dalam hal pertumbuhan bobot badan yang cepat sebagai penghasil daging, konversi ransum rendah, dapat dipotong pada umur muda, menghasilkan kualitas daging yang berserat lunak, dan harga yang relatif murah (Bell dan Weaver 2002). Beberapa jenis ayam broiler antara lain Brahma Putra, Cochin China, Cornish, dan Sussex (Sudaryani dan Santoso 2002).
Gambar 1 Ayam Broiler galur Cobb
Tanaman obat
Temulawak
Temulawak (Gambar 2) merupakan tanaman semak berbatang semu dengan tinggi dapat mencapai 2 m atau lebih. Rimpang temulawak berukuran besar, bercabang-cabang, dan berwarna coklat kemerahan. Temulawak atau Curcuma xanthorriza Roxb. merupakan famili Zingiberaceae dan genus Curcuma (Afifah 2003; Supriadi 2008). Curcuma xanthorrhiza dilaporkan memiliki aktivitas anti radang, antitumor, menurunkan kandungan trigliserida darah (hypotriglyceridaeamic), dan hepatoprotektor (Hwang et al. 2000).
3
Gambar 2 Rimpang Temulawak
Temu ireng
Temu ireng (Curcuma aeruginosa Roxb.)(Gambar 3) adalah tanaman semak berbatang semu dengan tinggi mencapai 1,5 m. Rimpang temu ireng berwarna agak kebiruan pada bagian dalam, kulit luar berwarna kuning mengkilat, dan ujungnya berwarna merah muda. Tanaman ini tersebar secara luas di seluruh Asia Tenggara (Larsen et al. 1999; Utami 2008). Berdasarkan taksonominya, temu ireng termasuk ke dalam famili Zingiberaceae, genus Curcuma, dan spesies Curcuma aeruginosa Roxb.
Kandungan rimpang Curcuma aeruginosa meliputi zedoalactone A, zedoalactone B, isofuranodiene, furanodiene, furanodienone, dehydrocurdione, curcumenone, 13-hydroxygermacrone, zedoarol, sesquiterpenes dan guaianolide zedoarondiol (Reanmongkol et al. 2006). Syamsuhidayat dan Hutapea (1991) menambahkan bahwa selain minyak atsiri, tanaman ini mengandung pula saponin, flavonoid, dan polifenol.
4
Meniran
Meniran (Phyllanthus niruri Linn.)(Gambar 4) merupakan salah satu tanaman yang berkhasiat obat yang termasuk dalam famili Euphorbiaceae (Dalimarta 2000). Kandungan tanaman meniran meliputi flavonoid (quercetin, quercitrin, rutin, astragalin, cathecin, nirurin), terpen (limonene, p-cymene, lupeol), coumarin (ellagic acid dan methyl brevifolincarboxylate), lignan (phyllanthin dan hypophyllanthin, niranthin, nirtetralin, phyltetralin dan lintetralin, isolintetralin, 2, 3-desmethoxy seco-isolintetralin, 2, 3-des-methoxy seco-isolintetralin diacetate, linnanthin, demethylenedi-oxyniranthin, nirphyllin dan phyllnirurin), alkaloid, saponin, dan tanin (Bagalkotkar et al. 2006). Flavonoid merupakan komponen yang bersifat imunomodulator yang mampu meningkatkan sistem kekebalan tubuh sehingga mampu menangkal serangan virus, bakteri atau jamur (Suhirman dan Winarti 2010).
Gambar 4 Tanaman Meniran
Sambiloto
Sambiloto atau Andrographis paniculata Nees. (Gambar 5) merupakan tumbuhan perdu. Umumnya dikenal sebagai "Raja Pahit" dan termasuk dalam famili Acanthaceae (Jarukamjorn dan Nemotob 2008). Sambiloto dapat merangsang sistem imun tubuh, baik berupa respon imun spesifik maupun non spesifik (Puri et al. dalam Kurniawan 2011). Respon imun spesifik yang dihasilkan akan menyebabkan diproduksinya limfosit dalam jumlah besar, terutama limfosit B. Limfosit B akan menghasilkan antibodi yang akan mengikat antigen serta merangsang proses fagositosis (Decker 2000).
5
Gambar 5 Tanaman Sambiloto
Leukosit
Leukosit atau sel darah putih merupakan komponen dasar dalam sistem imun seluler. Leukosit adalah sel darah yang berinti dengan ukuran sel lebih besar dan jumlah yang lebih sedikit dibandingkan dengan eritrosit. Berdasarkan keberadaan granul di sitoplasma, leukosit dibedakan menjadi granulosit (neutrofil, eosinofil, dan basofil) dan agranulosit (limfosit dan monosit) (Bacha dan Bacha 2000). Kandungan aktif tanaman obat dapat mempengaruhi produksi leukosit melalui peningkatan produksi sitokin seperti granulocyte-macrophage colony stimulating factor (GM-CSF), interleukin-5 (IL-5), interleukin-6 (IL-6) yang merangsang produksi granulosit dan monosit, serta sitokin interleukin 2 (IL-2) yang dapat merangsang proliferasi limfosit (Chao dan Lin 2010; Yue et al 2010; Latimer 2011).
Limfosit
Limfosit (Gambar 6) adalah jenis leukosit dengan jumlah paling banyak dalam darah ayam (Bacha dan Bacha 2000). Secara histologis, limfosit memiliki inti sel heterokromatik berbentuk lonjong hingga bulat, sitoplasma yang bersifat basofilik dan tidak bergranul (Clark et al. 2009). Limfosit dihasilkan dari stem cell di folikel limfatik dari limfonodus, tonsil, limpa, timus, dan jaringan limforetikuler (Peyer patches) di usus. Limfosit adalah sel motil dan secara umum dapat bergerak seperti neutrofil. Limfosit menuju jaringan melalui mekanisme diapedesis dan dapat kembali lagi ke dalam sirkulasi darah melalui kelenjar limfe (Melvin dan William 1993).
6
Gambar 6 Sel limfosit dengan inti berbentuk bulat dan sitoplasma basofilik (Mitchell dan Johns 2008)
Monosit
Monosit (Gambar 7) adalah leukosit pleomorfik dengan ukuran paling besar diantara jenis leukosit lainnya. Sel ini memiliki inti berbentuk lonjong, berlekuk seperti tapal kuda dan tersusun dari kromatin-kromatin yang halus dengan jumlah sitoplasma yang banyak berwarna abu-abu hingga basofilik, dan memiliki vakuola berukuran kecil yang kadang terlihat jelas pada beberapa sel (Clark et al. 2009).
Monosit memiliki kemampuan memfagosit dan berkembang menjadi makrofag ketika keluar dari pembuluh darah dan masuk ke dalam jaringan. Seperti neutrofil, monosit ditarik oleh faktor-faktor kemotaktik menuju jaringan rusak atau jaringan yang mengalami invasi mikroba. Makrofag berfungsi dalam fagositosis serta inisiasi dan pengaturan dalam peradangan dan respon kekebalan. Makrofag melepaskan sejumlah sinyal kimia yang mengkoordinasikan berbagai fungsi sel-sel lainnya dalam merespon kerusakan jaringan dan invasi mikroba. Makrofag juga berfungsi dalam memproses antigen yang merupakan tahap awal dalam inisiasi respon kekebalan (Frandson et al. 2009).
7
Heterofil
Heterofil (Gambar 8) adalah bentuk netrofil pada unggas yang merupakan pertahanan pertama melawan agen patogen yang menyerang (Fudge 2005). Heterofil merupakan jenis leukosit di dalam sirkulasi darah dengan jumlah terbanyak dibandingkan dengan granulosit lainnya. Sel ini dicirikan dengan bentuk yang cenderung bulat dengan sitoplasma berwarna lebih muda yaitu eosinofilik. Inti kasar, tidak teratur, biasanya memiliki dua sampai tiga lobus. Lobus pada beberapa sel terlihat tidak tersambung karena inti tertutup granul. Granul sitoplasma pada heterofil berbentuk batang atau jarum (Clark et al. 2009).
Heterofil merupakan salah satu basis pertahanan tubuh dari serangan penyakit yang dapat mengakibatkan infeksi atau peradangan. Sel ini bekerja dengan cara fagositosis yaitu dengan mengurung mikroorganisme asing di dalam sitoplasma yang mengandung enzim proteolitik. Setelah melakukan fagositosis, heterofil menjadi tidak aktif dan mati bersama dengan mikroorganisme asing dan akan menghasilkan nanah (Tizard 1988).
Gambar 8 Sel Heterofil dengan granul sitoplasma berbentuk batang (Mitchell dan Johns 2008)
Eosinofil
Eosinofil (Gambar 9) merupakan salah satu granulosit asidofilik yang dapat ditemukan dalam darah unggas. Sel ini berbentuk bulat dengan inti berlobus yang berisi kromatin berwarna basofilik, lebih gelap dibandingkan dengan kromatin pada heterofil. Inti pada umumya memiliki dua lobus dengan sitoplasma berwarna pucat hingga basofilik dan berisi granul eosinofilik. Granul sitoplasma pada eosinofil terlihat berwarna jingga atau merah yang lebih cerah dan mencolok dibandingkan dengan granul sitoplasma pada heterofil (Clark et al. 2009).
8
enzim hidrolitik yang merusak kulit kemudian masuk ke dalam kulit larva cacing (Schalm 2010).
Gambar 9 Sel Eosinofil dengan granul sitoplasma eosinofilik terang (Mitchell dan Johns 2008)
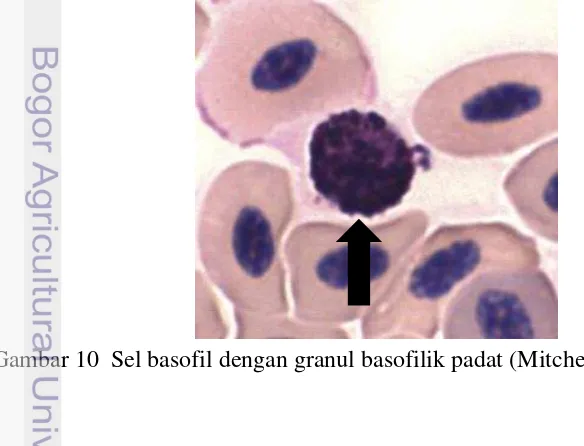
Basofil
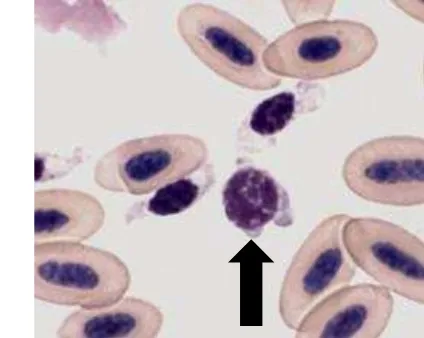
Basofil (Gambar 10) merupakan granulosit yang paling jarang dijumpai dalam sirkulasi darah mamalia, namun kemungkinan lebih sering dijumpai pada darah unggas (Schalm 2010; Latimer 2011). Basofil memiliki inti yang kecil dan bulat, terletak di tengah atau di tepi (Fudge 2005). Inti terdiri dari satu lobus atau tidak berlobus dengan granul sitoplasma yang berwarna basofilik gelap dengan densitas tinggi sehingga tampak menyatu. Inti berwarna lebih pucat dan sebagian terlihat gelap karena tertutup oleh granul sitoplasma (Clark et al. 2009).
Basofil diproduksi di dalam sumsum tulang (Tizard 1988). Basofil mempunyai fungsi membangkitkan proses peradangan akut pada tempat deposisi antigen (Tizard 1988). Granul basofil berisi beberapa senyawa seperti heparin untuk mencegah pembekuan darah serta histamin yang berfungsi dalam meregangkan otot polos pembuluh darah dan konstriksi otot polos saluran pernafasan (Frandson et al. 2009).
9
METODE
Waktu dan Tempat Penelitian
Penelitian dilaksanakan pada bulan Februari sampai Maret 2011. Kegiatan pemeliharaan dan perlakuan hewan coba bertempat di fasilitas kandang hewan percobaan Bagian Patologi, Departemen Klinik, Reproduksi, dan Patologi Fakultas Kedokteran Hewan-Institut Pertanian Bogor. Penghitungan diferensial leukosit dilakukan di Laboratorium Patologi Klinik, Bagian Penyakit Dalam, Departemen Klinik, Reproduksi dan Patologi, Fakultas Kedokteran Hewan Institut Pertanian Bogor.
Bahan dan Peralatan
Bahan yang digunakan pada penelitian ini terdiri dari ayam pedaging day old chicken (DOC) strain cobb sebanyak 25 ekor, vaksin Newcastle disease (ND) live vaccineLassota™, infectious bursal disease (IBD) live vaccine (CAPRIVAC IBD-Inter®), avian influenza (AI) killed vaccine (Medivac®), metanol, giemsa 10%, minyak imersi, kebutuhan harian ayam meliputi air minum, pakan (Sinta®), sekam sebagai alas kandang, formulasi empat ekstrak tanaman obat terdiri dari : F1: temulawak, temuireng, sambiloto dan meniran; F2: temulawak, temu ireng dan meniran; F3: temulawak dan temuireng; F4: sambiloto dan meniran.
Peralatan yang digunakan pada penelitian ini adalah alat pemeliharaan dan perlakuan ayam meliputi 5 petak kandang, timbangan untuk mengukur bobot badan, tempat pakan dan air minum, lampu, syringe untuk vaksinasi, spoit untuk mencekok ekstrak, alat untuk pembuatan sediaan ulas darah yaitu gelas obyek, syringe, label, alat untuk pengamatan sediaan ulas darah yaitu mikroskop dan counter.
Metode Penelitian
Persiapan Kandang Penelitian
Kandang ayam dibuat menurut sistem lantai (floor) dengan panjang 110 cm, lebar 40 cm, dan tinggi 45 cm. Seluruh dinding dan lantai kandang dikapur dengan kapur tembok berwarna putih, didesinfeksi dengan desinfektan kelompok fenol sintetik, dan difumigasi dengan gas formalin 10% v/v sehari sebelum ayam percobaan dimasukkan.
Penyediaan Ekstrak
10 daerah leher bagian belakang dengan dosis 0.2 ml.
Perlakuan penelitian
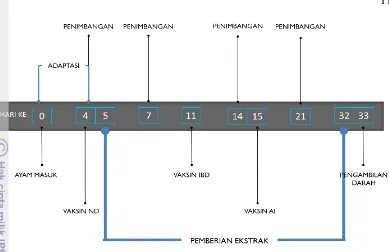
Penelitian ini menggunakan ayam pedaging strain Cobb berumur 1 hari dengan bobot badan seragam. Sebelum perlakuan dimulai, diadakan masa adaptasi selama 4 hari untuk mengembalikan kondisi ayam dari stres karena pemindahan dan transportasi. Sebelum dibagi ke dalam beberapa kelompok perlakuan, bobot ayam tiap kelompok perlakuan ditimbang dan dirata-ratakan untuk menghitung dosis pemberian formula tanaman obat. Sebanyak 25 ekor ayam dibagi ke dalam lima kelompok perlakuan seperti terlihat pada Tabel 1. Tabel 1 Kelompok perlakuan ayam percobaan yang diberi formula ekstrak empat
tanaman obat
Perlakuan Keterangan
Kontrol (-) 5 ekor ayam divaksin ND live vaccine, IBD live vaccine, dan AI killed vaccine, dan diberi aquades sebanyak 1 ml. F1 5 ekor ayam divaksin ND live vaccine, IBD live vaccine,
dan AI killed vaccine, dan diberi formula temulawak, temu ireng, sambiloto, dan meniran sebanyak 1 ml.
F2 5 ekor ayam divaksin ND live vaccine, IBD live vaccine,
Penyajian ekstrak tanaman obat untuk tiap kelompok perlakuan dilakukan dengan cara melarutkan ekstrak tersebut dengan aquades. Dosis yang ditentukan dibagi dengan bobot badan ayam masing-masing kelompok, lalu dirata-ratakan sehingga untuk ayam pada tiap kelompok perlakuan dipakai dosis yang seragam.
11
Gambar 11 Jadwal Perlakuan Penelitian
Pengambilan Sampel Darah
Sampel darah diambil pada hari ke-33 sebanyak 1 ml dari vena brachialis menggunakan syringe. Darah kemudian diteteskan pada gelas obyek, diulas, dan dikeringkan. Ulasan darah diberi tanda sesuai kode ayam, untuk selanjutnya difiksasi menggunakan metanol selama 5 menit. Setelah 5 menit, gelas obyek direndam dalam zat warna giemsa 10% selama 45 menit dan dikeringkan dengan cara diangin-anginkan.
Penghitungan Diferensial Leukosit
Pengamatan terhadap diferensial leukosit dilakukan di bawah mikroskop dengan pembesaran 100 x 10 menggunakan minyak imersi. Jenis leukosit yang dihitung meliputi heterofil, basofil, eosinofil, monosit, dan limfosit. Penghitungan diferensial leukosit dilakukan hingga jumlah leukosit yang diperoleh berjumlah 100 dan hasilnya dinyatakan dalam persentase (%). Counter digunakan sebagai alat bantu menghitung jenis leukosit yang ditemukan.
Rancangan Percobaan
Rancangan percobaan yang digunakan dalam penelitian ini adalah rancangan teracak lengkap. Penelitian ini terdiri atas empat kelompok perlakuan (F1, F2, F3, dan F4) yang dibandingkan dengan kelompok kontrol (K-). Kelompok F1, pesentase leukosit yang diberi ekstrak temulawak, temu ireng, sambiloto, dan meniran. Kelompok F2, persentase leukosit yang diberi ekstrak temulawak, temu ireng, dan meniran. Kelompok F3, persentase leukosit yang diberi ekstrak tanaman temulawak dan temu ireng. Kemudian kelompok F4, persentase leukosit yang diberi ekstrak sambiloto dan meniran.
12
yang diperoleh berjumlah 100 dan hasilnya dinyatakan dalam persentase (%). Setiap kelompok perlakuan dilakukan ulangan sebanyak lima kali.
Analisis Data
Analisis data hasil penelitian dilakukan menggunakan Analysis of Variance (ANOVA) untuk melihat pengaruh perlakuan, kemudian dilanjutkan dengan uji Duncan untuk melihat perbandingan antar kelompok.
HASIL DAN PEMBAHASAN
Hasil
Hasil penghitungan diferensial leukosit ayam broiler strain Cobb setelah pemberian formula ekstrak temulawak, temu ireng, sambiloto, dan meniran selama 28 hari disajikan pada Tabel 2.
Tabel 2 Rataan persentase diferensial leukosit (%) pada ayam broiler yang diberi formula ekstrak temulawak, temu ireng, sambiloto, dan meniran
Kelompok Limfosit Heterofil Monosit Eosinofil Basofil F1 42,00±3,0a 46,00±4,7c 7,80±1,9a 3,60±1,2a 0,00±0,0a F2 48,80±11,1ab 41,20±10,5bc 7,40±3,8a 2,40±2,5a 0,20±0,4a F3 53,00±4,3bc 36,80±6,4ab 7,60±2,5a 2,60±1,5a 0,00±0,0a F4 58,40±3,2c 31,80±4,3a 7,40±1,1a 2,40±0,9a 0,00±0,0a K(-) 48,40±3,8ab 42,00±5,9bc 7,00±3,6a 2,60±1,3a 0,00±0,0a Keterangan : Huruf superskript adalah hasil dari uji wilayah berganda Duncan, dimana huruf
yang berbeda pada kolom yang sama menunjukkan nilai yang berbeda nyata
F1 : kelompok yang diberi ekstrak tanaman temulawak, temu ireng, sambiloto dan meniran,
F2 : kelompok yang diberi ekstrak tanaman temulawak, temu ireng, dan meniran,
13
Limfosit
Tabel 2 menunjukkan bahwa persentase limfosit pada kelompok F4 (kombinasi ekstrak sambiloto dan meniran) berbeda nyata dibandingkan dengan kelompok kontrol (K-), sedangkan kelompok F1, F2, dan F3 tidak berbeda nyata. Kelompok F4 berbeda nyata apabila dibandingkan dengan kelompok F1, F2 dan kontrol, namun demikian tidak berbeda nyata apabila dibandingkan dengan kelompok F3 (kombinasi ekstrak temulawak dan temu ireng).
Kelompok perlakuan F4 (58,40±3,2 %), F3(53,00±4,3 %), dan F2 (48,80±11,1 %) memperlihatkan persentase limfosit lebih tinggi, sedangkan kelompok perlakuan F1 (42,00±3,0 %) menunjukkan persentase limfosit lebih rendah dibandingkan dengan kelompok kontrol (K-) (48,40±3,8 %). Tabel 2 memperlihatkan bahwa persentase limfosit tertinggi terdapat pada kelompok perlakuan F4, dan terendah pada kelompok perlakuan F1.
Heterofil
Hasil pengujian menunjukkan bahwa rataan persentase heterofil pada kelompok F4 berbeda nyata dibandingkan dengan kelompok kontrol, sedangkan kelompok F1, F2, dan F3 tidak berbeda nyata. Kelompok F4 berbeda nyata terhadap kelompok perlakuan F1, F2, dan K(-), tetapi tidak berbeda nyata terhadap kelompok F3.
Kelompok perlakuan F1 (46,00±4,7%) mempunyai rataan persentase heterofil lebih tinggi dibandingkan dengan kelompok kontrol (42,00±5,9 %), sedangkan kelompok perlakuan F2 (41,20±10,5 %), F3 (36,80±6,4 %), dan F4 (31,80±4,3 %) memiliki persentase heterofil cenderung lebih rendah. Kelompok F1 memiliki persentase heterofil tertinggi, sedangkan rataan persentase terendah terdapat pada kelompok F4. Kelompok F4 berbeda nyata terhadap kelompok perlakuan F1, F2, dan K(-), tetapi tidak berbeda nyata terhadap kelompok F3.
Monosit
Persentase monosit pada semua kelompok perlakuan tidak berbeda nyata dibandingkan dengan kelompok kontrol. Rataan persentase monosit kelompok perlakuan F1, F2, F3, dan F4 cenderung lebih tinggi dibandingkan dengan kelompok kontrol. Rataan persentase monosit tertinggi terdapat pada kelompok F1 (7,80±1,9 %). Kelompok perlakuan F2 (7,40±3,8 %) memiliki persentase monosit yang cenderung sama dengan kelompok F4 (7,40±1,1 %).
Eosinofil
14
Hasil penghitungan diferensial leukosit menunjukkan bahwa basofil hanya ditemukan pada kelompok perlakuan F2 (0,20±0,4 %), yang merupakan kelompok dengan pemberian kombinasi ekstrak temulawak, temu ireng, dan meniran.
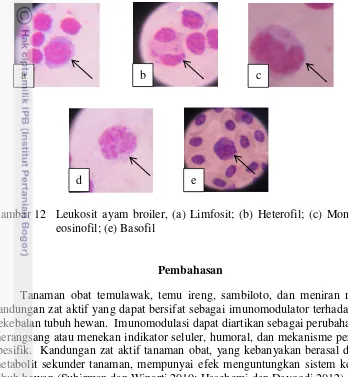
Hasil pengamatan diferensial leukosit pada ayam broiler menggunakan mikroskop dengan pembesaran 100 x 10 menggunakan minyak imersi dapat dilihat pada Gambar 12.
Gambar 12 Leukosit ayam broiler, (a) Limfosit; (b) Heterofil; (c) Monosit; (d) eosinofil; (e) Basofil
Pembahasan
Tanaman obat temulawak, temu ireng, sambiloto, dan meniran memiliki kandungan zat aktif yang dapat bersifat sebagai imunomodulator terhadap sistem kekebalan tubuh hewan. Imunomodulasi dapat diartikan sebagai perubahan dalam merangsang atau menekan indikator seluler, humoral, dan mekanisme pertahanan spesifik. Kandungan zat aktif tanaman obat, yang kebanyakan berasal dari hasil metabolit sekunder tanaman, mempunyai efek menguntungkan sistem kekebalan tubuh hewan (Suhirman dan Winarti 2010; Hasehemi dan Davoodi 2012).
15 interleukin-2 (IL-β) dan interferon gamma (IFN ) oleh sel T dan merangsang produksi limfosit T sitotoksik (Chao dan Lin 2010).
Persentase limfosit pada kelompok F2 dan F3 cenderung lebih tinggi dibandingkan dengan kelompok kontrol. Tingginya persentase limfosit pada kelompok F2 diduga karena kandungan kurkumin dan turmeron pada tanaman temulawak dan temu ireng serta kandungan alkaloid (securinine dan norsecurinine) pada meniran. Peningkatan persentase limfosit pada kelompok F3 diduga akibat kandungan kurkumin dan turmeron pada temulawak dan temu ireng. Kandungan alkaloid pada tanaman meniran dapat meningkatkan proliferasi limfosit T dan limfosit B. Meniran dapat meningkatkan interleukin-4 (IL-4) yang akan mempengaruhi peningkatan limfosit B (Nworu et al 2010). Temulawak dan temu ireng mengandung kurkumin yang dapat meningkatan proliferasi limfosit dan turmeron yang dapat meningkatkan sekresi IL-2 sehingga terjadi peningkatan limfosit (Dalimartha 2000; Jagetia dan Aggarwal 2006; Yue et al. 2010; Latimer 2011; Choudhury et al. 2013).
Persentase heterofil, monosit, dan eosinofil tertinggi terdapat pada kelompok F1 (kombinasi ekstrak temulawak, temu ireng, sambiloto dan meniran). Kandungan kurkumin pada temulawak dan temu ireng dapat meningkatkan interleukin-1 (IL-1), interleukin-6 (IL-6), dan GM-CSF. Interleukin-1 dan IL-6 akan merangsang produksi monosit, sedangkan GM-CSF merangsang produksi monosit dan granulosit (Dalimartha 2000; Schalm 2010; Yue et al. 2010; Choudhury 2013). Pemberian ekstrak sambiloto dapat meningkatkan persentase monosit. Peningkatan persentase monosit pada penelitian ini sejalan dengan hasil penelitian yang dilaporkan Bukoye dan Musbau (2011) bahwa pemberian ekstrak daun sambiloto dapat meningkatkan monosit pada tikus wistar jantan. Ekstrak daun sambiloto mampu meningkatkan sistem kekebalan yang ditandai dengan peningkatan tumor necrosis factoralpha (TNF-α) dan IL-6.
Jenis leukosit basofil hanya ditemukan pada kelompok perlakuan F2. Basofil merupakan leukosit granulosit yang paling jarang ditemukan dalam sirkulasi darah. Basofil tidak selalu ditemukan dalam preparat ulas darah (Bacha dan Bacha 2000).
Kelompok F2 (kombinasi ekstrak temulawak, temu ireng, dan meniran) memiliki persentase limfosit dan monosit yang cenderung lebih tinggi dibandingkan dengan kelompok kontrol, sedangkan persentase heterofil dan eosinofil lebih rendah dibandingkan dengan kelompok kontrol. Penurunan persentase heterofil dan eosinofil diduga akibat kandungan alkaloid (securinine dan norsecurinine) dan flavonoid pada tanaman meniran. Kandungan alkaloid dan flavonoid pada meniran dapat meningkatkan IL-4 dan IFN (Nwanjo β007; Nworu et al 2010). Interleukin-4 (IL-4) merangsang aktivitas T-helper-2 (Th2) dan menekan aktivitas T-helper-1 (Th1) yang mensekresikan Interleukin-3 (IL-3) dan GM-CSF. Interleukin-3 dan GM-CSF berperan dalam pembentukan granulosit termasuk heterofil dan eosinofil (Kumar et al. 2008; Latimer 2011).
16
limfosit akan diikuti dengan penurunan jumlah heterofil pada sirkulasi darah (Schalm 2010).
Kelompok F4 memiliki persentase limfosit dan monosit cenderung lebih tinggi dibandingkan dengan kontrol, persentase heterofil dan eosinofil lebih rendah dibandingkan dengan kontrol. Penurunan persentase heterofil diduga akibat kandungan flavonoid dan alkaloid (securine dan norsecurine) tanaman meniran.
Kelompok F3 yang diberi kombinasi tanaman temulawak dan temu ireng dianggap memiliki pengaruh yang paling baik diantara kelompok perlakuan lainnya. Hal tersebut dapat dilihat dari tingginya persentase limfosit dan monosit. Persentase eosinofil relatif tidak berbeda dengan kelompok kontrol, sedangkan persentase heterofil sedikit lebih rendah dibandingkan dengan kelompok kontrol. Temulawak dan temu ireng diketahui mampu memodulasi pertumbuhan dan respon seluler dari berbagai tipe sel sistem kekebalan. Jagetia dan Aggarwal (2006) melaporkan bahwa kurkumin dengan dosis rendah dapat meningkatkan proliferasi limfosit pada limpa tikus. Kurkumin juga memiliki kemampuan untuk memodulasi fungsi kekebalan pada sel T. Kurkumin memiliki kemampuan memodulasi, mengaktivasi makrofag, dan mengatur fagositosis makrofag peritoneal serta mengatur diferensiasi splenosit. Senyawa kurkuminoid dan sesquiterpenoid memiliki aktivitas imunomodulasi terhadap sel mononuklear pada darah perifer manusia. Senyawa polisakarida secara signifikan meningkatkan produksi sitokin transforming growth factor- (TGF- ), tumor necrosis factor-α (TNF-α), granulocyte-macrophage colony stimulating factor (GM-CSF), interleukin-1α (IL-1α), interleukin-5 (IL-5), IL-6, 8 (IL-8), interleukin-10 (IL-interleukin-10), dan interleukin-13 (IL-13) dan proliferasi sel mononuklear pada darah perifer manusia (Yue et al. 2010).
Dhenge et al.(2009) melaporkan bahwa hasil penelitian pemberian tepung dari daun tanaman sambiloto (Andrographis paniculata) pada ayam broiler menunjukkan adanya peningkatan yang signifikan terhadap konsentrasi hemoglobin, jumlah eritrosit, jumlah leukosit total, dan jumlah limfosit. Kandungan andrographolide, 14-deoxyandrographolide, dan 14-deoxy-11, 12-didehydroandrographolide pada tanaman sambiloto signifikan meningkatkan proliferasi limfosit dalam darah perifer manusia (human peripheral blood limphocyte/hPBL) pada konsentrasi rendah. Senyawa diterpen tiga termasuk andrographolide, meningkatkan proliferasi dan sekresi IL-2 di hPBL. Peningkatan sekresi IL-2 dan interferongamma(IFN ) oleh sel T dan merangsang produksi limfosit T sitotoksik (Chao dan Lin 2010).
Tanaman meniran (Phyllanthus niruri Linn.) dapat digunakan untuk meningkatkan kekebalan non-spesifik dan kekebalan spesifik. Sebuah studi in-vitro pada tikus membuktikan bahwa pemberian oral ekstrak meniran meningkatkan produktivitas antibodi spesifik dan peningkatan aktivitas makrofag atau proliferasi limfosit T. Sebagian limfosit T akan berdiferensiasi menjadi Th1 yang memiliki peran penting dalam respon imun seluler. Ekstrak meniran juga menginduksi sekresi TNF dari makrofag teraktivasi (Sarisetyaningtyas et al. 2006).
17 4. Aktivasi dan fungsi makrofag tikus meningkat yang terlihat dari peningkatan fagositosis, aktivitas enzim lisosom, dan pelepasan TNF-α (Nworu et al. 2010).
SIMPULAN DAN SARAN
Simpulan
Persentase limfosit tertinggi terdapat pada kelompok ayam broiler yang diberi kombinasi ekstrak sambiloto dan meniran, dan persentase heterofil terendah pada kelompok yang diberi kombinasi ekstrak tanaman temulawak, temu ireng, sambiloto dan meniran. Persentase heterofil tertinggi terdapat pada kelompok ayam broiler yang diberi kombinasi ekstrak tanaman temulawak, temu ireng, sambiloto dan meniran, dan persentase heterofil terendah pada kelompok yang diberi kombinasi ekstrak tanaman sambiloto dan meniran. Berdasarkan data persentase leukosit, disimpulkan bahwa formulasi ekstrak temulawak dan temu ireng merupakan kombinasi terbaik dalam meningkatkan sistem imun tubuh.
Saran
Perlu dilakukan penelitian lebih lanjut terhadap pengaruh bahan aktif dari tanaman obat (temulawak, temu ireng, sambiloto, dan meniran) terhadap sistem kekebalan dan dilakukan uji tantang untuk mengetahui pengaruhnya langsung pada ayam.
DAFTAR PUSTAKA
Afifah E. 2003. Khasiat dan ManfaatTemulawak. Jakarta (ID): Agromedia. Ajibadeva, Egbebi. 2011. Effect of alkaloid extract of Phyllanthus niruri on
rabbits infected with enteropathogenic Escherichia coli. International Journal of Tropical Medicine and Public Health. 1:33–39.
[Anonim]. 2006. Budidaya ayam ras pedaging [terhubung berkala]. http://www.warintek.ristek.go.id/peternakan/budidaya/ayam_pedaging.pdf [17 Maret 2012].
Bacha LM, Bacha WJ. 2000. Color Atlas of Veterinary Histology. Ed ke-2. New York (US): Lippincott Williams & Wilkins.
Bagalkotkar G, Sagineedu SR, Saad MS, Stanslas J. 2006. Phytochemicals from Phyllanthus niruri Linn and their pharmacological properties: a review. Journal of Pharmacy and Pharmacology. 58:1559–1570.
18
Brown BA. 1980. Hematology: principles and procedures. Ed ke-3. Philadelphia: Lea and Febringer.
Bukoye O, Musbau A. 2011. Immune modulation potentials of aqueos extract of Andrographis paniculata leaves in male rat. Researcher. 3: 48–57.
Choudhury D, Ghosal M, Abhaya P, Palash M. 2013. Development of single node cutting propagation techniques and evaluation of antioxidant activity of curcuma aeruginosa roxburgh rhizome. International Journal Of Pharmacy And Pharmaceutical Sciences. 5: 227–234.
Chao WW, Lin BF. 2010. Isolation and identification of bioactive compounds in Andrographis paniculata (Chuanxinlian): a review. Chinese Medicine. 5:17. Clark P, Boardman W, Raidal S. 2009. Atlas of Clinical Avian Hematology. Penerjemah Jan Tambayong. Jakarta (ID): EGC
Dhenge SA, Shirbhate RN, Bahiram KB, Wankar AK, Khandait VN, Patankar RB. 2009. Haematobiochemical profile of broilers supplemented with Withania somnifera (Ashwagandha) and Andrographis paniculata (Bhuineem). Indian Journal of Field Veterinarians. 5:5–8
Frandson RD, Wilke WL, Fails AD. 2009. Anatomy and Physiology of Farm Animal 7th Edition. Iowa (US): Willey-Blackwell.
Fudge AM. 2005. Avian Hematology. El Dorado Hills (US): California Avian Laboratory.
Guyton AC, Hall JE. 2006. Textbook of Medical Physiology. Philadelpia (US): Elsevier Saunders.
Hasehemi SR, Davoodi H. 2012. Herbal plants as immuno-stimulator in poultry industry: a review. Asian Journal of Animal and Veterinary Advances. 7:105– 116.
Hoffbrand V. 2006. At a Glance Hematology. Jakarta (ID): EMS.
Hwang JK, Shim JS, dan Pyun YR. 2000. Antibacterial activity of xanthorrizol from Curcuma xanthorriza againts oral pathogens. Fitotherapia. 71:321–323.
Jagetia GC, Aggarwal BB. 2007. Spicing up of the immune system by curcumin.
Journal of Clinical Immunology. 27:19–35.
19 Kumar A, Arun K. 2008. Immunomodulatory properties of Phyllanthus amarus
on human peripheral blood mononuclear cells [skripsi]. Tamil Nadu (IN). Fakultas Bioteknologi, Sri Ramaswamy Memorial University.
Kurniawan A. 2011. Aktivitas antioksidan dan potensi hayati dari kombinasi ekstrak empat jenis tanaman obat Indonesia [skripsi]. Bogor (ID): Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Larsen K, Ibrahim H, Khaw SH, Saw LG. 1999. Gingers of Peninsular Malaysia and Singapore. Kota Kinabalu (MY): Natural History Publications.
Latimer KS. 2011. Duncan & Prasse's Veterinary laboratory Medicine: Clinical Pathology 5thEdition. West Sussex (UK): John Wiley & Son Inc.
Melvin JS, William OR. 1993. Duke’s Physiology of Domestic Animals 11st Edition. London (UK) : Cornell University Pr.
Mitchell EB, Johns J. 2008. Avian hematology and related disorders. Veterinary Clinics of North America: Exotic Animal Practice. 11: 501–522.
Nwanjo HU. 2007. Studies on the effect of aqueous extract of Phyllanthus niruri on plasma glucose level and some hepatospecific markers in diabetic Wistar rats. International Journal of Laboratory Medicine. 2: 1–18.
Nworu CS, Akah PA, Okoye FB, Proksh P, Esimone CO. 2010. The effects of Phyllanthus niruri aqueous extract on the activation of murine lymphocytes and bone marrow-derived macrophages. Immunological Investigations. 39:245–67.
Reanmongkol W, Subhadhirasakul S, Khaisombat N, Fuengnawakit P, Jantasila S, Khamjun A. 2006. Investigation the antinociceptive, antipyretic and anti-inflammatory activities of Curcuma aeruginosa Roxb extracts in experimental animals. Songklanakarin Journal Science Technology. 28:999–1008.
Sarisetyaningtyas PV, Hadinegoro SR, Munasir Z. 2006. Randomized controlled trial of Phyllanthus niruri Linn extract. Paediatrica Indonesiana. 46:3–4. Schalm OW. 2010. Schalm’s Veterinary Hematology Sixth Edition. Editor : dan Balai Besar Penelitian dan Pengembangan Pascapanen Pertanian.
Supriadi D. 2008. Optimalisasi ekstraksi kurkuminoid Temulawak (Curcuma Xanthorriza Roxb [skripsi]. Bogor (ID): Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Syamsuhidayat SS, Hutapea JR. 1991. Invetaris Tanaman Obat Indonesia. Jilid I. Jakarta (ID): Departemen Kesehatan RI.
20
Utami P. 2008. Buku Pintar Tanaman Obat. Jakarta (ID): Agromedia Pustaka. Yue GGL, Chan BCL, Hon PM, Fung KP, Leung PC, Lau CBS. 2010.
Immunostimulatory activities of polysaccharide extract isolated from Curcuma longa. International Journal of Biological Macromolecule. 47: 342–347.
RIWAYAT HIDUP
Penulis dilahirkan di Madiun pada 11 Juni 1990. Penulis adalah putra bungsu dari empat bersaudara dari pasangan Rakidin dan Ismojowati. Penulis mengenyam pendidikan formal di SD Negeri 2 Bangunsari (2002), SMP Negeri 1 Balerejo (2005), dan SMA Negeri 1 Mejayan (2008). Seluruh jenjang pendidikan tersebut ditempuh di kota kelahiran.