KARAKTERISTIK PENEMPELAN DAN KOAGREGASI
BAKTERI ASAM LAKTAT INDIGENOUS DADIAH DAN
YOGURT SEBAGAI KANDIDAT PROBIOTIK
PADA USUS HALUS TIKUS in vitro
SKRIPSI
DEWI SUMARNI
DEPARTEMEN ILMU PRODUKSI DAN TEKNOLOGI PETERNAKAN FAKULTAS PETERNAKAN
RINGKASAN
DEWI SUMARNI. D14062894. 2011. Karakteristik Penempelan dan Koagregasi Bakteri Asam Laktat Indigenous Dadiah dan Yogurt sebagai Kandidat Probiotik pada Usus Halus Tikus in vitro. Skripsi. Departemen Ilmu Produksi dan
Teknologi Peternakan. Fakultas Peternakan. Institut Pertanian Bogor. Pembimbing Utama : Dr. Ir. Rarah R. A. Maheswari, DEA
Pembimbing Anggota : Drh. Adi Winarto, Ph.D
Dadiah merupakan salah satu makanan tradisional hasil fermentasi alami dari susu kerbau yang terkenal di Sumatera Barat. Hasil isolasi terhadap dadiah men-dapatkan dominasi Lactococcus lactis dan Lactobacillus plantarum. Produk susu fermentasi lain yang cukup dikenal masyarakat Indonesia adalah yogurt. Bakteri asam laktat yang berhasil diisolasi dari yogurt susu sapi diantaranya Bifidobacterium longum dan Lactobacillus acidophilus. Penelitian mengenai bakteri asam laktat asal dadiah susu kerbau dan asal yogurt susu sapi sebagai kandidat probiotik sudah dilakukan, khususnya tentang karakteristik pertumbuhannya secara in vitro dalam
keasaman lambung, toleransinya pada garam empedu dan kemampuan antagonistik-nya terhadap bakteri patogen (Sunaryo, 2011). Salah satu kriteria lain untuk memenuhi persyaratan sebagai kandidat bakteri probiotik yang menarik untuk diteliti adalah kemampuan bakteri asam laktat untuk menempel pada permukaan usus halus secara in vitro serta sifat koagregasinya terhadap bakteri asam laktat yang lain, bila digunakan sebagai mixted culture. Manfaat probiotik pada kesehatan saluran
pen-cernaan telah banyak diteliti khususnya untuk mencegah dominasi bakteri patogen pada saluran pencernaan.
Penelitian ini bertujuan untuk mempelajari kemampuan penempelan bakteri asam laktat indigenous dadiah (Lactobacillus plantarum D-01 dan Lactococcus lactis D-01) dan asal yogurt susu sapi (Lactobacillus acidophilus Y-01 dan Bifidobacterium longum Y-01) pada usus halus tikus secara in vitro serta kemampuan koagregasi antar bakteri untuk diidentifikasi sebagai probiotik. Penelitian ini berlangsung dari bulan Mei sampai November 2010 bertempat di Laboratorium Mikrobiologi Bagian Teknologi Hasil Ternak, Laboratorium Lapang Pemuliaan dan Genetika, Laboratorium Terpadu, Departemen Ilmu Produksi dan Teknologi Peternakan, Fakultas Peternakan serta Laboratorium Histologi, Departemen Anatomi, Fisiologi dan Farmakologi, Fakultas Kedokteran Hewan, Institut Pertanian Bogor. Materi yang digunakan meliputi BAL indigenous dadiah (L. plantarum D-01 dan L. lactis D-01)
dan asal yogurt susu sapi (L. acidophilus Y-01 dan B. longum Y-01), tikus putih
(Rattus novergicus) strain Sprague Dawley. Pengamatan penempelan bakteri pada usus tikus menggunakan mikroskop cahaya, sedangkan pengamatan penempelan bakteri pada pelat stainless steel menggunakan mikroskop epifluoresen.
Kemurnian kultur bakteri diperiksa melalui morfologinya yang diamati secara mikroskopik dengan bantuan metode pewarnaan Gram dan uji katalase. Penelitian dibagi meliputi uji agregasi, autoagregasi, koagregasi, penempelan BAL pada usus halus tikus dan pada pelat stainless steel secara in vitro. Preparat usus halus
ii Hasil pengamatan menunjukkan adanya penempelan BAL indigenous dadiah dan asal yogurt susu sapi pada permukaan usus halus tikus. Penempelan terbanyak secara kualitatif tampak pada perlakuan usus dengan mukus tanpa pencucian. BAL yang tampak paling banyak menempel secara kualitatif adalah L. acidophilus Y-01.
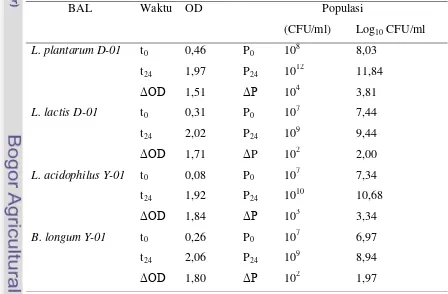
Penempelan juga didapatkan pada pelat stainless steel dengan persentase jumlah BAL yang menempel berkisar antara 65,57%-71,87% dari rataan populasi awal bakteri 8 log10 CFU/ml.Penempelan pada pelat stainless steel terbanyak terjadi pada bakteri L. lactis D-01 yaitu sebesar 5,80 log10 CFU/cm2. Isolat BAL indigenous dadiah (L. plantarum D-01 dan L. lactis D-01) serta asal yogurt susu sapi (L. acidophilus Y-01 dan B. longum Y-01) masing-masingmemiliki nilai agregasi positif
terbukti dengan terbentuknya endapan. Nilai rataan persentase autoagregasi selama lima jam pengujian masing-masing bakteri berada pada posisi lemah. Pasangan BAL yang memiliki kemampuan koagregasi paling baik ditunjukkan pada pasangan kultur
L. lactis D-01 dan L. acidophilus Y-01 dengan nilai koagregasi sebesar 0,16%. Berdasarkan kemampuan penempelannya dapat disimpulkan bahwa isolat BAL
indigenous dadiah (L. plantarum D-01, L. lactis D-01) dan asal yogurt susu sapi (L. acidophilus Y-01 dan B. longum Y-01) terbukti memenuhi salah satu syarat sebagai
probiotik, serta menunjukkan kemampuan untuk berkoagregasi dengan bakteri lainnya untuk mendatangkan manfaat kesehatan pada saluran pencernaan in vitro.
ABSTRACT
Adhesion and Coagregation Characteristics of Lactid Acid Bacterias Indigenous Dadiah and yoghurt as Probiotic Candidate in vitro intestinal
Sumarni, D., R.R. A. Maheswari and A. Winarto
Dadiah is a traditional food from West Sumatra. That made from buffalo milk and ripened in bamboo and covered with banana leaves. One of the criterions of probiotic bacteria is its ability to adhere on the mucosa of intestine. The aims of this research were to identify the characteristic of indigenous dadiah lactid acid bacterias (LABs) (Lactobacillus acidophilus Y-01, Bifidobacterium longum Y-01) and lactid
acid bacteria from yoghurt (Lactobacillus plantarumD-01 and Lactococcus lactis D-01) as probiotic through its abilities to adhere on intestine mucosa of rats (adhesi) and to coaggregate between probiotic bacterias candidate. Probiotic bacterias candidate were tested for aggregation, autoaggregation, coaggregation, adhesion on the intestinal mucosa of rats and attachment on stainless steel plate by in vitro tests. Research showed that indigenous dadiah LABs and LABs from yoghurt had ability to adhere on intestinal mucosa of rat and attache on stainless steel plate. The average number of LABs attached on stainless steel plate was 5 log10 CFU/cm2of average initial bacterial population of 8 log10 CFU/ml. The highest of LABs attached on stainless steel plate was found from L. lactis D-01 that was equal to 5,80 log10 CFU/cm2. Indigenous dadiah LABs and LAB from yoghurt cows had a positive aggregation value proven by the sediment existence. The average of percentage bacterial autoaggregation value was in weak position and fluctuated during the five hours of testing. The coaggregation test found that the lowest coaggregation percentage was between L. lactis D-01 and L. acidophilus Y-01, that showed by the value was 0,16%.
KARAKTERISTIK PENEMPELAN DAN KOAGREGASI
BAKTERI ASAM LAKTAT INDIGENOUS DADIAH DAN
YOGURT SEBAGAI KANDIDAT PROBIOTIK
PADA USUS HALUS TIKUS in vitro
DEWI SUMARNI
D14061894
Skripsi ini merupakan salah satu syarat untuk memperoleh gelar Sarjana Peternakan pada
Fakultas Peternakan Institut Pertanian Bogor
DEPARTEMEN ILMU PRODUKSI DAN TEKNOLOGI PETERNAKAN FAKULTAS PETERNAKAN
Judul Skripsi : Karaktersitik Penempelan dan Koagregasi Bakteri Asam Laktat Indigenous Dadiah dan Yogurt Sebagai Kandidat
Probiotik pada Usus Halus Tikus in vitro
Nama : Dewi Sumarni
NIM : D14061894
Menyetujui,
Pembimbing Utama,
(Dr. Ir. Rarah R. A. Maheswari, DEA) NIP. 19620504 198703 2 002
Pembimbing Anggota,
(Drh. Adi Winarto, Ph.D) NIP. 19580516 198601 1 001
Mengetahui: Ketua Departemen,
Departemen Ilmu Produksi dan Teknologi Peternakan
(Prof. Dr. Ir. Cece Sumantri, M.Agr.Sc) NIP. 19591212 198603 1 004
DAFTAR RIWAYAT HIDUP
Penulis dilahirkan pada tanggal 23 Februari 1988 di kota Bandung, Jawa Barat. Penulis merupakan anak ketiga dari tiga bersaudara dari pasangan Bapak Komar Haidar dan Ibu Ai Suwangsih.
Pendidikan penulis dimulai dengan Pendidikan dasar di SDN 1 Mekar Mukti sampai tahun 2000. Pendidikan menengah pertama diselesaikan pada tahun 2003 di SMPN 1 Leles dan pendidikan menengah atas diselesaikan pada tahun 2006 di SMAN 1 Leles. Pada tahun 2006 penulis diterima untuk menimba ilmu di Institut Pertanian Bogor melalui jalur Undangan Seleksi Masuk IPB (USMI) dan pada tahun 2007 diterima sebagai mahasiswa Departemen Ilmu Produksi dan Teknologi Peternakan, Fakultas Peternakan, Institut Pertanian Bogor
KATA PENGANTAR
Bismillahirrahmanirrahim
Puji syukur penulis panjatkan ke hadirat Allah SWT yang telah melimpahkan rahmat, hidayah dan ridho-Nya, sehingga penulis dapat menyelesaikan penelitian dan penulisan skripsi ini. Shalawat dan salam semoga selalu tercurah kepada Baginda Rosullullah SAW, keluarga, sahabat, serta orang-orang yang istiqomah di jalan Islam hingga akhir zaman. Skripsi ini merupakan salah satu syarat untuk memperoleh gelar sarjana peternakan.
Skirpsi ini berjudul “Karakteristik Penempelan dan Koagregasi Bakteri Asam Laktat Indigenous Dadiah dan Yogurt sebagai Kandidat Probiotik pada
Usus Halus Tikus in vitro“. Penelitian ini diharapkan dapat memberikan informasi
kepada masyarakat mengenai pangan tradisional yang bersifat fungsional seperti dadiah dan yogurt, memberikan informasi mengenai manfaat probiotik serta dapat menjadi alternatif pengembangan produk hasil ternak tradisional menjadi pangan fungsional.
Penulis menyadari bahwa skripsi ini masih jauh dari kesempurnaan. Oleh sebab itu, Penulis sangat mengharapkan kritik dan saran agar skripsi ini menjadi lebih baik. Penulis juga mengucapkan terima kasih kepada seluruh pihak yang telah membantu hingga skripsi ini selesai. Penulis berharap semoga skripsi ini dapat ber-manfaat bagi Penulis khususnya dan bagi pembaca pada umumnya.
Bogor, Januari 2011
iv Persiapan Kultur Bakteri Asam Laktat Indigenous
Dadiahdan Yogurt Susu Sapi ... 21
Pembuatan Kurva Standar BAL dengan Metode Turbidimetri ... 22
Persiapan Sampel Usus Tikus ... 24
Persiapan Pelat Stainless Steel ... 25
Penelitian Utama ... 25
Uji Agregasi ... 25
Uji Autoagregasi ... 26
Uji Koagregasi ... 26
Pengujian Penempelan BAL pada Usus Tikus in vitro ... 27
Pengujian Penempelan BAL pada Permukaan Padat 29
Analisis Data ... 29
HASIL DAN PEMBAHASAN ... 30
Persiapan BAL Indigenous Dadiah dan Asal Yogurt Susu Sapi ... 30
Agregasi BAL Indigenous Dadiah dan Asal Yogurt Susu Sapi ... 34
Autoagregasi BAL Indigenous Dadiah dan Asal Yogurt Susu Sapi ... 36
Koagregasi BAL Indigenous Dadiah dan Asal Yogurt Susu Sapi ... 41
Penempelan BAL Indigenous Dadiah dan Asal Yogurt Susu Sapi pada Permukaan Usus Halus Tikus ... 45
Penempelan BAL Indigenous Dadiah dan Asal Yogurt Susu Sapi pada Permukaan Padat Menggunakan Stainless Steel ... 54
KESIMPULAN DAN SARAN ... 58
Kesimpulan ... 58
Saran ... 59
DAFTAR PUSTAKA ... 60
UCAPAN TERIMA KASIH ... 65
DAFTAR TABEL
Nomor Halaman
1. Pengelompokan Bakteri Berdasarkan Kemampuan Hidupnya
dalam Saluran Pencernaan Manusia ... 12 2. Korelasi OD dan Populasi dalam Pembuatan Kurva Standar ... 22 3. Persamaan BAL Berdasarkan Kurva Standar ... 23 4. Karakteristik Bakteri Asam Laktat Dadiah dan Asal Yogurt Susu
Sapi ... 31 5. Perubahan Populasi BAL Indigenous Dadiah dan Asal Yogurt Susu
Sapi Sebelum dan Sesudah Inkubasi pada 37oC selama 24 Jam ... 35 6. Nilai Presentase Autoagregasi BAL Indigenous Dadiah dan Asal
Yogurt Susu Sapi ... 37 7. Populasi dan Persentase Bakteri Asam Laktat Selama Autoagregasi 40 8. Koagregasi (%) dari Kombinasi Pasangan BAL Indigenous Dadiah
dan Asal Yogurt Susu Sapi ... 42 9. Populasi BAL Inidgenous Dadiah dan Asal Yogurt Susu Sapi
DAFTAR GAMBAR
Nomor Halaman
1. Mikroskopik Usus Halus: (a) Duodenum, (b) Jejunum,(c) Ileum .... 9
2. Mekanisme Bakteri Probiotik dalam Menghambat Infeksi Patogen .. 13
3. Penempelan yang Bersifat Sementara (Reversibel) (a) Sel Planktonik, (b)Sel dalam Cairan Datang dan Kontak dengan Permukaan Padat, (c) Sel-Sel Lepas dari Permukaan dan Menjadi Sel Planktonik Kembali ... 16
4. Penempelan yang Tetap (Ireversibel) (a) Sel Planktonik, (b) Sel dalam Cairan Bersentuhan dengan Permukaan Padat dan Bersifat Ireversibel ... 16
5. Gambaran Agregasi Strain Bifidobacteria A) Autoagregasi Tinggi, B) Autoagregasi Sedang/Medium, C) Autoagregasi Lemah secara Makroskopik (Makro) dan Makroskopik (Mikro) ... 17
6. Diagram Alir Penelitian ... 20
7. (a) Tahapan Uji Katalase, (b) Contoh Hasil Uji Katalase... 22
8. Kurva Standar dengan Metode Turbidimetri ... 23
9. Proses Adaptasi dan Pengambilan Sampel Usus Tikus (a) Pemeliharaan Selama Pemberian Antibiotik, (b) Pemingsanan Tikus, (c) Pembedahan dan Pengambilan Sampel Usus Tikus ... 25
10. Tahapan Proses Pengujian Penempelan BAL pada Usus Tikus in vitro ... 28
11 Perbandingan Agregasi Bakteri Asam Laktat (a) Sebelum Inkubasi, (b) Setelah Inkubasi pada 37oC Selama 24 jam. (Ll : L. lactis D-01, La : L. acidophilus Y-01, Lp : L. plantarum D-01, Bl : B. longum Y-01) ... 34
12. Gambaran Agregasi BAL Indigenous Dadiah dan Asal Yogurt Susu Sapi secara Makroskopik (Makro) dan Makroskopik (Mikro) (Perbesaran Lensa Objektif 100x) ... 36
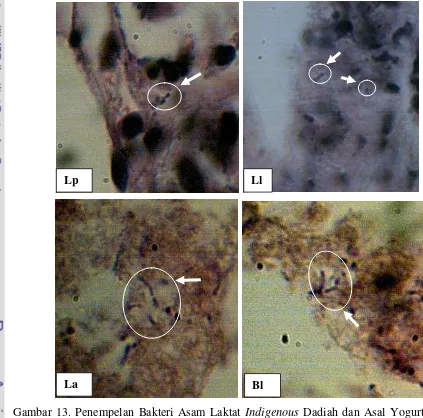
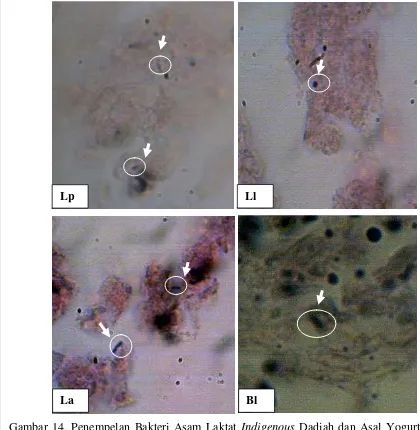
13. Penempelan Bakteri Asam Laktat Indigenous Dadiah dan Asal Yogurt Susu Sapi pada Permukaan Usus Halus (Lp = L. plantarum D-01, Ll = L. lactis D-01, La = L. acidophilus Y-01 dan Bl = B. longum Y-01) dengan Mukus dan Tidak Dicuci dengan PBS Setelah Diinkubasi (Perbesaran Lensa Objektif 100x) ... 46
x 15. Penempelan Bakteri Asam Laktat Indigenous Dadiah dan Asal
Yogurt Susu Sapi pada Permukaan Usus Halus (Lp = L. plantarum D-01, Ll = L. lactis D-01, La = L. acidophilus Y-01 dan
Bl = B. longum Y-01) Tanpa Mukus dan Tidak Dicuci dengan PBS
Setelah Diinkubasi (Perbesaran Lensa Objektif 100x) ... 50 16. Penempelan Bakteri Asam Laktat Indigenous Dadiah dan Asal
Yogurt Susu Sapi pada Permukaan Usus Halus (Lp = L. plantarum D-01, Ll = L. lactis D-01, La = L. acidophilus Y-01 dan
Bl = B. longum Y-01) Tanpa Mukus dan Dicuci 2x dengan PBS
Setelah Diinkubasi (Perbesaran Lensa Objektif 100x) ... 51 17. Penempelan BAL pada Stainless Steel A) L.plantarum D-01,
DAFTAR LAMPIRAN
Nomor Halaman
1. Tahapan Proses Pembuatan Preparat Histologis ... 66
2. Kurva Standar BAL Indigenous Dadiah dan Asal Produk Olahan
Susu Sapi ... 68 3. Komposisi Media MRSB (de-Man’s Ragosa Sharpe Broth)
OXOID CM 0359 ... 70 4. Komposisi Media PBS (Phosphate Buffer Saline) OXOID
BR00146 ... 70 5. Cara Pembuatan Media MRS Broth (de-Man’s Ragosa Sharpe
Broth) OXOID CM 0359 . ... 70 6. Cara Pembuatan Media PBS (Phosphat Buffer Saline) OXOID
PENDAHULUAN
Latar Belakang
Saluran pencernaan merupakan salah satu tempat berkembang biaknya bakteri yaitu baik bakteri patogen maupun bakteri non patogen seperti bakteri asam laktat dan probiotik. Keberadaan bakteri yang baik sangat penting peranannya bagi kekebalan tubuh diantaranya memberikan perlindungan terhadap infeksi bakteri patogen, berperan dalam pencernaan serta penyerapan zat gizi. Populasi bakteri di sepanjang saluran pencernaan adalah semakin kompleks baik jenis maupun jumlahnya, dengan bertambahnya usia seseorang. Kecenderungan pola makan yang tidak sehat dan konsumsi obat-obatan, khususnya antibiotik yang tidak terkontrol menyebabkan perubahan keseimbangan mikroflora dalam saluran pencernaan yang mengarah kepada perkembangan yang dominan dari bakteri berbahaya seperti
Salmonella, Escherichia coli dan Listeria. Perkembangan bakteri-bakteri berbahaya tersebut akan dapat mengakibatkan gejala klinis seperti diare, kanker usus dan penyakit pencernaan lainnya.
Konsumsi bahan pangan yang mengandung bakteri yang baik atau dikenal dengan probiotik dapat dijadikan satu alternatif untuk mencegah perkembangan bakteri berbahaya dalam saluran pencernaan. Produk probiotik telah banyak beredar di pasaran saat ini karena dipercaya bahwa konsumsi probiotik setiap hari akan menciptakan keseimbangan yang baik dalam ekosistem mikrobiota usus yang bisa menguntungkan kesehatan tubuh. Salah satu produk susu fermentasi asli Indonesia adalah dadiah, yang dikenal dengan baik oleh kalangan masyarakat Sumatera Barat. Dadiah atau dadih dihasilkan dari proses fermentasi alami susu kerbau yang di-simpan dalam batang bambu dan ditutup dengan daun pisang. Spesies bakteri yang mendominasi fermentasi dadiah dan berhasil diisolasi diantaranya adalah
Lactobacillus casei subsp. casei, Leuconostoc paramesenteroides, Leuconostoc mesenteroides, Lactobacillus brevis dan Lactococcus lactis subsp. lactis biovar
diacetylactis (Surono, 2004).
2 mampu bertahan dalam kondisi asam lambung, toleransi terhadap garam empedu 0,3% maupun antibiotik amoksisilin dan klorampenikol, serta mempunyai karakteristik antagonistik terhadap bakteri patogen Staphylococcus aureus, Salmonella enteritidis serotipe Typhimurium dan Escherichia coli (Sunaryo, 2011).
Salah satu kriteria lain dari bakteri probiotik yang menarik untuk diteliti adalah kemampuan penempelannya pada permukaan mukosa usus. Kemampuan bakteri asam laktat untuk menempel pada permukaan mukosa sangat penting bukan hanya untuk menjaga keseimbangan jumlah bakteri dalam saluran pencernaan, tetapi juga untuk mencegah perkembangan bakteri patogen. Kemampuan penempelan bakteri asam laktat indigenous dadiah (L. plantarum D-01 dan L. lactis D-01) dan
asal yogurt susu sapi (L. acidophilus Y-01 dan B. longum Y-01)pada usus halus serta sifat koagregasinya menarik untuk diteliti lebih lanjut untuk memenuhi ketentuannya sebagai bakteri probiotik. Penggunaan bakteri asam laktat asal produk olahan susu sapi dipilih sebagai pasangan untuk kultur campuran (mixted culture).
Tujuan
Penelitian ini mempunyai tujuan untuk mempelajari kemampuan penempelan bakteri asam laktat indigenous dadiah dan asal yogurt susu yang masing-masing diidentifikasi sebagai Lactobacillus plantarum D-01 dan Lactococcus lactis D-01,
Lactobacillus acidophilus Y-01 dan Bifidobacterium longum Y-01 pada saluran
pencernaan tikus secara in vitro. Penelitian juga mempelajari kemampuan koagregasi
TINJAUAN PUSTAKA
Dadiah
Dadiah merupakan makanan khas masyarakat Sumatera Barat. Di kalangan masyarakat pedesaan dadiah seringkali dikonsumsi secara langsung atau sebagai lauk pauk pendamping nasi. Dadiah dihasilkan dari proses fermentasi susu kerbau dengan cara tradisional yaitu dengan menyimpan susu kerbau hasil pemerahan langsung ke dalam tabung bambu selama semalaman dan ditutup dengan daun pisang. Mikroba yang berperan dalam fermentasi dadiah berasal dari susu, daun pisang dan bambu (Suryono, 2003). Asam laktat yang terdapat di dalam dadiah diduga mampu me-ngalahkan bakteri patogen atau perusak yang terdapat di dalam susu. Bakteri asam laktat yang diduga sebagai probiotik di dalam dadiah mampu bertahan di dalam saluran pencernaan manusia (Ruspidra, 2006).
Lactobacillus plantarum
Lactobacillus plantarum merupakan salah satu spesies Lactobacillus yang
penting secara industri. Ray dan Bhunia (2008) menggolongkan L. plantarum ke dalam golongan II (heterofermentatif fakultatif) berdasarkan produk utama fermentasinya. Bakteri yang termasuk golongan II memproduksi asam laktat sebagai produk akhir utama atau campuran antara asam laktat, asam asetat dan asam format, etanol dan karbondioksida yang jumlahnya tergantung pada jumlah karbohidrat yang tersedia.
Lactobacillus plantarum memiliki aktivitas antimikroba, ditunjukkan oleh
kemampuan penghambatannya terhadap Lactobacillus curvatus, Lactobacillus sake
dan Listeria monocytogenes karena adanya bakteriosin yang dihasilkannya yaitu
plantarisin B. Produk utama L. plantarum dalam kondisi aerob adalah asam asetat
Surono (2004).
Lactococcus lactis
Lactococcus lactis adalah mikroba yang diklasifikasikan sebagai bakteri asam
laktat karena memfermentasi gula (laktosa) menjadi asam laktat. L. lactis termasuk
bakteri Gram positif, non motil dan tidak membentuk spora (Todar, 2009). Menurut Surono (2004), L. lactis subsp. lactis memiliki bentuk sel bulat dengan susunan
4 28-37oC. Bakteriosin diproduksi oleh 15 strain L. lactis (14 L. lactis subsp. lactis dan
satu dari L. lactis subsp. cremoris) yang tahan pada kondisi panas, sensitif pada
beberapa enzim proteolitik dan lebih aktif pada kisaran pH yang luas. Ketahanan L. lactis terhadap kondisi panas sangat dipengaruhi oleh pH (Moreno et al., 2000).
Yogurt
Yogurt adalah susu asam yang dihasilkan dari fermentasi susu oleh campuran bakteri asam laktat termofilik yaitu Lactobacillus delbrueckii ssp. bulgaricus dan Streptococcus salivarius ssp. thermophilus. Kedua bakteri ini bersama-sama membentuk rasa asam, kekentalan, memperbanyak asam laktat dan intensitas flavor
(Rahman et al., 1992). Bakteri asam laktat sering digunakan untuk menghasilkan produk akhir dengan karakteristik tertentu. Yogurt adalah salah satu pangan yang mengandung probiotik, dengan syarat produk akhir yogurt harus mengandung bakteri
asam laktat ≥ 108 organisme/gram (Adolfsson
et al., 2004). Maheswari (2008) berhasil mengisolasi bakteri asam laktat dari yogurt susu sapi yaitu Lactobacillus acidophilus Y-01 dan Bifidobacterium longum Y-01.
Lactobacillus acidophilus
Lactobacillus acidophilus merupakan bakteri berbentuk batang, panjang,
Gram positif, tidak tumbuh pada suhu 10oC, tumbuh pada suhu 45oC, tidak me-reduksi litmus, tidak tahan pada kondisi garam (6,5%) dan bersifat non-termodurik (Rahman et al.,1992). L. acidophilus mempunyai ketahanan terhadap asam lambung
buatan dengan pH 2,5 selama 3 jam dan bakteriosin yang dihasilkan tetap aktif pada pH 10 (Oh dan Worobo, 2000).
Secara fisiologis L. acidophilus meningkatkan mikroflora usus karena dapat
hidup di usus. Efek pertumbuhan yang ditunjukkan adalah membantu memanfaatkan nutrisi secara efisien terutama dari kalsium, protein, besi dan fosfor pada proses fermentasi yang menghasilkan asam laktat. Kerja intensif dari aktivitas β
5
L. acidophillus mensekresikan senyawa metabolit biosurfaktan, bakteriosin,
asam organik dan H2O2 yang dapat menghambat pelekatan dan pertumbuhan bakteri patogen, serta molekul koagregasi yang menghambat penyebaran bakteri patogen. L. acidophilus menghasilkan D (-) asam laktat yang berfungsi memperbaiki
ketersedia-an mineral biologis, sehingga memperbaiki penyerapketersedia-an mineral, terutama kalsium, sebab kalsium lebih mudah diserap dalam kondisi asam (Surono, 2004).
Bifidobacterium longum
Genus Bifidobacterium merupakan populasi terbesar ketiga dalam saluran usus manusia setelah genera Bacteriodes dan Eubacteria. Genus ini juga didapatkan
paling dominan pada bayi dan anak-anak. Beberapa spesies telah diteliti dan banyak dijumpai pada feses manusia, sehingga sering dijadikan sebagai salah satu indikator kontaminasi fekal meskipun masih diperdebatkan (Nebra dan Blanch, 1999).
Bifidobacterium hidup pada lapisan lumen kolon dan lebih spesifik lagi membentuk koloni dalam jumlah banyak, menyerap nutrisi, mensekresikan asam laktat, asam asetat dan senyawa antimikroba. Bifidobacteria dominan pada dinding usus sehingga mencegah dinding usus dari kolonisasi bakteri yang tidak diinginkan (E. coli) atau
khamir (Candida) (Tamime dan Robinson, 2008).
Diantara kriteria penting bakteri probiotik adalah kemampuan melekat dan berkolonisasi pada mukosa usus manusia. Riset terhadap kemampuan adesi bakteri menunjukkan bahwa polisakarida seluler bisa membantu pelekatan bakteri terhadap permukaan biologis, sehingga memungkinkan terjadi kolonisasi. Bifidobacterium
menghasilkan bifidan sebagai eksopolisakarida (EPS) yang terbukti mengawali adesi dan sebagai pelekat permanen. Beberapa senyawa EPS mengandung gluko dan frukto oligosakarida, serta bisa menghasilkan asam lemak rantai pendek setelah terhidrolisis dalam saluran usus oleh mikroflora usus besar serta memberi pengaruh yang positif bagi kesehatan dan manfaat nutrisi sebagai prebiotik bagi flora usus (Surono, 2004).
Probiotik
6 kesehatan tubuh dan dapat dipengaruhi oleh konsumsi probiotik setiap hari (Lisal, 2005). Probiotik dapat diperoleh melalui konsumsi produk olahan susu fermentasi. Mikroba probiotik dalam susu fermentasi terdiri dari genus Lactobacillus, Pediococcus, Bifidobacterium, Lactococcus, Enterococcus dan Saccharomyces.
Bakteri probiotik yang digunakan dalam produk olahan pangan harus memper-timbangkan aspek keamanan. Genus Lactococcus dan Lactobacillus merupakan
genus bakteri yang paling umum mendapatkan status GARS atau Generally recognized as safe sehingga aman dikonsumsi (Surono, 2004).
Hoier (1992) menyatakan bahwa ada beberapa kriteria yang harus diperhati-kan untuk penentuan strain mikroba probiotik, yaitu: (1) mampu melakudiperhati-kan aktivitas dalam memfermentasikan susu dalam waktu yang relatif cepat, (2) mampu meng-gandakan diri, (3) tahan terhadap suasana asam sehingga mampu hidup dan bertahan dalam saluran pencernaan, (4) menghasilkan produk akhir yang dapat diterima kon-sumen dan (5) mempunyai stabilitas yang tinggi selama proses fermentasi, penyim-panan dan distribusi. Pernyataan tersebut dikuatkan Lisal (2005) yang menegaskan, bahwa karakteristik probiotik yang diinginkan dari satu strain spesifik mencakup: (a) mempunyai kapasitas untuk bertahan hidup /survived, untuk melakukan kolonisasi /colonized, serta melakukan metabolisme /metabolized dalam saluran percernaan, (b)
mampu mempertahankan suatu keseimbangan mikroflora usus yang sehat melalui kompetisi dan inhibisi kuman-kuman patogen, (c) dapat menstimulasi bangkitnya pertahanan imun, (d) bersifat non-patogenik dan non-toksik, serta (e) harus mem-punyai karakteristik teknologi yang baik, yaitu mampu bertahan hidup secara optimal dan stabil selama penyimpanan dan penggunaan (storage and use) dalam bentuk
preparat makanan yang didinginkan atau dikeringkan, agar dapat disediakan dalam jumlah besar untuk industri.
7 menyerap serat kasar, protein, lemak dan mendetoksifikasi zat racun dan metabolit, (3) menghasilkan asam, selain itu beberapa mikroba probiotik dapat menghasilkan bahan antimikroba (bakteriosin). Probiotik dapat diberikan melalui pangan, air minum dan kapsul. Pemberian melalui pangan merupakan cara terbaik untuk memperoleh jumlah dan proporsi yang tepat (Gibson dan Roberford, 1995).
Bakteri probiotik yang bertahan hidup dalam saluran pencernaan setelah dikonsumsi, menunjukkan tahan terhadap lisozim, asam lambung dan asam empedu, sehingga mampu mencapai usus dalam keadaan hidup. Bakteri probiotik mampu melekat pada sel-sel epitelial dan memproduksi zat metabolit yang berperan dalam menjaga dan mempertahankan mikroflora usus. Kondisi seimbang mikroflora usus memberikan aktivitas menguntungkan dan menghasilkan efek positif bagi kesehatan (Yuguchi et al., 1992).
Banyak kendala dijumpai pula dalam penggunaan probiotik, termasuk ke-mampuan bertahan, kolonisasi dan kompetisi nutrien untuk masuk ke dalam suatu lingkungan ekosistem yang sudah mengandung beberapa ratus jenis bakteri lainnya. Lisal (2005) menambahkan, jika bahan yang mengandung probiotik tidak dikonsum-si secara kontinyu, maka bakteri yang ditambahkan itu dengan cepat akan mengalami
wash-out (tidak lagi melekat dan dikeluarkan dari saluran pencernaan). Pendekatan
lain yang dapat mengatasi keterbatasan pemakaian probiotik adalah dengan meng-gunakan prebiotik yaitu suatu unsur makanan yang tidak dapat dicerna dan mem-punyai pengaruh menguntungkan bagi inangnya, yang secara selektif menstimulasi pertumbuhan dan/atau aktivitas metabolik dari satu atau sejumlah terbatas bakteri dalam kolon sehingga memperbaiki kesehatan induk semangnya.
Tikus Putih
Tikus merupakan spesies pertama mamalia yang didomestikasi untuk tujuan ilmiah karena memiliki daya adaptasi yang baik. Tikus yang diproduksi sebagai hewan percobaan dan hewan peliharaan adalah tikus putih (Rattus norvegicus) yang memiliki beberapa keunggulan antara lain penanganan dan pemeliharaan yang mudah karena tubuhnya kecil, sehat dan bersih, kemampuan reproduksi yang tinggi dengan masa kebuntingan yang singkat (Malole dan Pramono, 1989).
8 Kingdom : Animalia
Phylum : Chordata
Kelas : Mamalia
Ordo : Rodentia
Subordo : Sciurognathi Famili : Muridae Subfamili : Murinae Genus : Rattus
Spesies : Rattus norvegicus
Tikus putih (Rattus norvegicus) memiliki ciri-ciri panjang total 440 mm, panjang ekor 205 mm dan berat 140-500 g, dengan rataan 400 g (Balenger, 2001). Karakteristik tikus putih (Rattus norvegicus) menurut Sigit et al. (2006), yaitu tekstur rambut kasar dan agak panjang, bentuk hidung kerucut terpotong, bentuk badan silindris agak membesar ke belakang, warna badan dorsal cokelat hitam kelabu, warna badan vertikal cokelat kelabu pucat, berat 150-600 gram dan panjang total 310-460 mm.
9 sekitar 1-2 jam setelah matahari terbenam dan sekitar 1-2 jam sebelum terbit fajar. Aktivitas bisa bergeser tergantung dari ketersediaan makanan (Sigit et al., 2006).
Usus Halus
Usus halus merupakan bagian dari sistem pencernaan yang berfungsi mencerna dan menyerap zat-zat makanan seperti asam amino, lipid dan mono-sakarida (Banks, 1993). Berbeda lokasi usus halus, berbeda juga jenis mikronutrien yang diabsorbsi (Andra, 2007). Usus halus secara histologi terdiri atas lapisan mukosa (lamina epithelia, lamina propria dan muscularis mucosae, submukosa, muskularis (tunica muscularis) dan serosa (tunica serosa) (Banks, 1993).
Pengamatan terhadap morfologi atau histologi usus seperti tinggi vili, ketebalan dan volume mukosa, kedalaman celah Liberkuhn dan parameter sejenis, dapat menjadi gambaran pertumbuhan saluran pencernaan (Khurfeld, 1999). Deskripsi mikroskopik usus halus dapat dilihat pada Gambar 1.
(a) (b)
( c )
10 Usus halus dibagi dalam tiga daerah yaitu duodenum, jejunum dan ileum. Daerah duodenum memiliki lipatan mukosa yang melingkar dan memiliki banyak vili (Banks, 1993). Duodenum adalah daerah absorbsi besi dan folat, juga menjadi tempat penting terjadinya pencampuran antara makanan dengan garam empedu dan enzim pankreas (Andra, 2007). Daerah jejunum usus halus mirip dengan daerah duodenum. Ukuran vili jejunum lebih langsing, lebih kecil dan jumlahnya lebih sedikit daripada duodenum (Banks, 1993). Jejunum menjadi bagian dari usus halus yang paling banyak menyerap mikronutrien. Selain nutrien, obat juga diserap di sini (Andra, 2007). Daerah ileum usus halus mirip dengan jejunum. Vili pada ileum membentuk kelompok. Daerah ileum tidak memiliki lipatan-lipatan mukosa (Banks, 1993). Motalitas makanan yang melewati ileum lebih lambat daripada jejunum. Hal itu memungkinkan kesempatan makanan untuk kontak lebih lama dengan mukosa sehingga absorbsi nutrisi lebih banyak. (Andra, 2007).
Mikroflora Usus
Hewan atau manusia bersifat bebas dari mikroorganisme ketika berada dalam rahim, namun setelah lahir beberapa tipe bakteri dapat menyerbu tubuh melalui jalur kelahiran. Mikroorganisme tersebut tinggal di saluran pencernaan sampai hewan tersebut mati. Bagian dari saluran pencernaan yang paling banyak dihuni oleh bakteri adalah saluran usus. Bakteri yang menempati saluran usus dan bila dianalogikan sebagai tumbuhan dikenal sebagai mikroflora usus (Nakazawa dan Hosono, 1992).
Mikroflora usus secara alami terdapat dalam saluran pencernaan, yang terdiri atas bermacam-macam mikroba yang memiliki fungsi yang penting. Komposisi mikroflora usus berubah-ubah seiring meningkatnya umur seseorang. Pada manusia dewasa yang sehat, mikroflora usus berada dalam keseimbangan walaupun terdapat perbedaan antara individu satu dengan individu lain (Mizutani, 1992).
Mizutani (1992) melaporkan, bahwa pada orang lanjut usia, jumlah
Bifidobacterium spp. akan semakin menurun atau bahkan hilang, sedangkan
Clostridium perfringens, Escherichia coli, Streptococus spp., serta Lactobacillus
11 Peranan mikroflora usus berdasarkan aktivitasnya dapat dibagi menjadi dua, yaitu aktivitas yang menguntungkan dan aktivitas yang merugikan. Golongan bakteri pertama yang memiliki aktivitas menguntungkan adalah Bifidobacteria, Lactobacillus spp. dan Eubacteria (Yuguchi et al., 1992) atau bakteri-bakteri yang
bersifat anaerobik (Mitsuoka, 1989). Bakteri-bakteri tersebut menguntungkan karena dapat menjaga kesehatan dengan membantu pencernaan, membantu sintesis protein dan vitamin, menekan bakteri merugikan dan menstimulasi sistem imun.
Golongan bakteri yang kedua adalah Clostridium perfringens, Veilonella spp.
dan Proteus spp. memiliki aktivitas yang merugikan (Yuguchi et al., 1992). Selain
ketiga bakteri tersebut, menurut Mitsuoka (1989), bakteri seperti Enterococcus, Staphylococcus dan Pseudomonas aeruginosa juga termasuk kedalam bakteri yang merugikan. Bakteri-bakteri tersebut bersifat merugikan karena selain bersifat patogen, juga menghasilkan toksik yang menimbulkan kebusukan pada usus dan menghasilkan zat-zat yang bersifat karsinogenik. Efek yang mungkin muncul akibat sifat patogen bakteri-bakteri tersebut adalah penyakit saluran pencernaan bahkan abses pada organ-organ vital makhluk hidup.
Menurut Mitsuoka (1989), selain kedua golongan bakteri yaitu bakteri yang menguntungkan dan bakteri yang merugikan ada pula golongan bakteri yang ketiga, yaitu golongan bakteri yang bersifat oportunistik. Bakteri golongan ini apabila ada dalam saluran pencernaan dalam jumlah yang melebihi batas maksimal akan me-nyebabkan timbulnya gangguan pada saluran pencernaan. Bakteri tersebut yaitu
Streptococcus dan Escherichia coli. Yuguchi et al. (1992) menyatakan hal serupa,
bahwa terdapat golongan bakteri yang memiliki sifat menguntungkan dan merugikan yaitu Bacteroides, Streptococcus spp., Escherichia coli serta Enterococcus.
Mikroflora usus pada hewan sangat kompleks dan interaksi diantara mereka saling terkait satu dengan yang lainnya. Interaksi itu dijadikan sebagai cara untuk melakukan seleksi probiotik yang akan digunakan. Molin et al. (1993) menunjukan,
bahwa galur Lactobacillus spp. yang dominan pada mukosa usus manusia sangat berbeda untuk setiap orang baik pada orang sehat maupun sakit. Jumlah Lactobacilli
12 Manajemen mikroflora usus dapat dilakukan dengan peningkatan proporsi bakteri non patogen dan menekan jumlah bakteri patogen. Cara untuk mendapat proporsi bakteri non patogen yang tinggi adalah dengan mengkonsumsi bakteri probiotik dan menyediakan nutrisi yang sesuai untuk bakteri probiotik, agar didalam usus bakteri tersebut berkembang dengan pesat. Kelompok oligosakarida, inulin serta beberapa jenis peptida dari protein dapat mencapai usus, sehingga bakteri non patogen tersebut akan mendominasi populasi (Waspodo, 2001).
Mitsuoka (1989) menyatakan bahwa BAL yang sering dijumpai dapat mencapai usus dalam keadaan hidup serta dapat digunakan sebagai kultur starter produk fermentasi adalah Lactobacilli dan Bifidobacteria, sedangkan genus
Lactococci dan streptococci tidak dijumpai pada usus. Pengelompokan BAL berdasarkan kemampuan hidupnya dalam saluran pencernaan manusia dapat dilihat pada Tabel 1.
Tabel 1. Pengelompokan Bakteri Berdasarkan Kemampuan Hidupnya dalam Saluran Pencernaan Manusia
Grup Distribusi dan Karakteristik Genus dan Contoh Spesiesnya A Umumnya terdapat dalam usus, dapat
mencapai usus dalam keadaan hidup
Bifidobacteria:
B. bifidus, B. breve, B. longum, B. adolecentris, B. infantis
B Sering dijumpai dalam usus Lactobacilli:
L. acidophillus, L. salivarus, L. fermentum
C Dapat mencapai usus dalam keadaan hidup
E Tidak dijumpai pada usus sebagai starter fermentasi susu
Mekanisme penempelan bakteri pada permukaan epitel usus atau yang sering disebut adesi terjadi melalui beberapa mekanisme. Mekanisme adesi yang pertama terjadi melalui ikatan antara struktur bakteri dengan reseptor atau ligan spesifik pada permukaan sel epitel. Mekanisme adesi yang kedua melibatkan gen adherence factor
13 arsitektur sitoskleton di bawah membran mikrovilus. Mekanisme adesi yang ketiga adalah dengan pola agregasi (Lu dan Walker, 2001).
Mekanisme probiotik dalam menghambat infeksi patogen menurut Collado et al (2010) yaitu 1) adanya bahan antimikroba melawan patogen, 2) proses
immunodulasi, 3) perbaikan dari fungsi pelindung, 4) penempelan: persaingan dalam menghambat patogen, menghambat dan menempati tempat pelekatan patogen dan 5) agregasi dan koagregasi dengan patogen. Mukus usus memiliki peran ganda yaitu untuk melindungi mukosa dari mikroorganisme tertentu, penyedia tempat awal pengikatan, sumber nutrisi dan acuan bakteri untuk berkembang biak. Penempelan bakteri pada epitel usus lebih lanjut dibutuhkan untuk kolonisasi sementara dari saluran pencernaan dan penempelan atau penetrasi yang merupakan prasyarat untuk menginfeksi oleh banyak patogen. Kolonisasi mukosal dengan non-patogen merupakan hal penting untuk melindunginya dari strain patogen yang melawan inang melalui competitive exclusion.
14 Antibiotik
Pelczar dan Chan (2008) mengatakan bahwa istilah antibiotik diberikan pada produk metabolik yang dihasilkan suatu organisme tertentu, yang dalam jumlah sangat kecil bersifat merusak atau menghambat mikroorganisme lain atau dengan kata lain antibiotik merupakan suatu zat kimia yang dihasilkan oleh suatu mikroorganisme yang menghambat mikroorganisme lain. Setiap antibiotik sangat beragam efektivitasnya dalam melawan berbagai jenis bakteri, yaitu terdapat antibiotik yang mempunyai sasaran bakteri Gram negatif dan atau Gram positif. Keefektifan suatu antibiotik sangat tergantung pada lokasi infeksi dan kemampuan antibiotik mencapai lokasi tersebut.
Amoksisilin
Amoksisilin merupakan antibiotik yang termasuk ke dalam golongan penisilin sub golongan α-aminobenzil penisilin. Amoksisilin memiliki karakteristik kestabilan terhadap asam dan spektrum antimikrobanya luas terutama terhadap bakteri Gram positif. Antibiotik amoksisilin membunuh bakteri secara langsung, dengan cara mencegah bakteri membentuk semacam lapisan yang melekat di sekujur tubuh selnya. Lapisan ini mempunyai fungsi yang sangat vital bagi bakteri, yaitu untuk melindungi bakteri dari perubahan lingkungan dan menjaga agar tubuh bakteri tidak lisis. Bakteri tidak akan mampu bertahan hidup tanpa adanya lapisan ini. Amoksisilin memperlihatkan intensitas absorpsi dua kali lebih tinggi pada pemberian oral (Schunack et al., 1990).
Penempelan Bakteri pada Permukaan Padat
Penempelan bakteri adalah salah satu proses yang dilakukan oleh sel planktonik bila terdapat permukaan padat yang kontak langsung dengan media pertumbuhan bakteri. Penempelan sel bakteri ke permukaan padat terjadi dalam suatu rangkaian proses dengan beberapa tahap, yaitu (1) adsorpsi senyawa organik oleh permukaan, (2) transport bakteri ke permukaan, (3) adsorpsi mikroba oleh permuka-an dpermuka-an penempelpermuka-an dapat balik ypermuka-ang diikuti oleh (4) pelepaspermuka-an sel (desorption).
Adsorpsi Senyawa Organik
15 molekul organik ini dapat terjadi setelah kontak langsung (Characklis dan Marshall, 1990). Glikoprotein merupakan salah satu molekul organik yang dapat teradsorpsi oleh permukaan dan mempunyai kemampuan untuk mengubah sifat permukaan (Dewanti dan Hariyadi, 1997).
Transpor Bakteri ke Permukaan
Transpor suatu bakteri banyak dipengaruhi oleh motilitas dari bakteri itu sendiri. Menurut Hood dan Zotolla (1995), untuk memperoleh zat nutrisi yang diperlukan agar dapat bertahan hidup, suatu bakteri yang mempunyai flagella cenderung akan bergerak sehingga terjadi transpor bakteri dari fase cair ke permukaan padat. Proses ini merupakan awal dari penempelan secara reversibel suatu bakteri, akan tetapi bakteri dengan atau tanpa flagela masih dapat menempel pada permukaan padat.
Adsorpsi Reversibel Bakteri ke Permukaan
Adsorpsi adalah akumulasi pada interfase atau konsentrasi sel pada suatu substratum atau interfase (Characklis dan Marshall, 1990). Proses adsorpsi banyak dipengaruhi oleh kondisi permukaan bakteri dan juga kondisi dari permukaan inert. Permukaan bakteri dan permukaan inert mempunyai muatan negatif, sehingga agar penempelan bakteri dapat terjadi, diperlukan gaya tarik-menarik yang dapat mengalahkan gaya tolak-menolak antara kedua permukaan. Adsorpsi reversibel adalah interaksi yang lemah antara sel dengan permukaan. Proses ini melibatkan gaya interaksi jarak jauh antara sel dan permukaan termasuk gaya Van der Wall dan interaksi elektrostatis. Pada proses ini, bakteri yang teradsorpsi akan mudah terlepas.
Pelepasan Sel ke Fase Cair (Desorption)
16 Gambar 3. Penempelan yang Bersifat Sementara (Reversibel) (a) Sel Planktonik,
(b)Sel dalam Cairan Datang dan Kontak dengan Permukaan Padat, (c) Sel- Sel Lepas dari Permukaan dan Menjadi Sel Planktonik Kembali
Sumber: Hood dan Zotolla (1995)
Langkah kedua pada proses penempelan bakteri pada permukaan padat yaitu tergantung waktu dan melibatkan produksi material ekstraseluler yang menjadikan bakteri menempel pada permukaan. Penempelan ini akan bersifat tetap (ireversibel). Sel yang menempel pada permukaan padat tidak akan mudah lepas (ireversibel) jika ada kekuatan yang menahan sel yang cukup kuat sel tidak mudah terlepas dan dapat menghasilkan eksopolimer yang membantu penempelan bakteri ke permukaan.
Gambar 4. Penempelan yang Tetap (Ireversibel) (a) Sel Planktonik, (b) Sel dalam Cairan Bersentuhan dengan Permukaan Padat dan Bersifat Ireversibel Sumber: Hood dan Zotolla (1995)
Interaksi Antar Sel Bakteri
17 akan berbeda. Karakteristik dinding sel dan senyawa metabolit yang dihasilkan akan mempengaruhi interaksi yang terjadi.
Autoagregasi
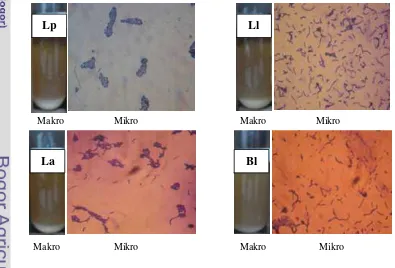
Interaksi diantara strain dapat menguntungkan bagi stabilitas mikroflora usus dengan pembentukan agregat atau koloni pada strain yang sejenis (autoagregasi) dapat mencegah infeksi bakteri patogen dengan menempel dan melakukan translokasi pada permukaan usus. Autoagregasi menentukan kemampuan strain bakteri untuk berinteraksi dengan dirinya sendiri dengan cara yang tidak spesifik (Palomares et al., 2007). Nilai autoagregasi yang <20% dinyatakan sebagai
autoagregasi lemah, sedangkan jika mempunyai nilai 20-70% dinyatakan sebagai autoagregasi sedang/medium. Autoagregasi tinggi memiliki nilai >70%.Kemampuan autoagregasi dipengaruhi oleh media pertumbuhan, suhu inkubasi dan pH. Strain bakteri yang termasuk kelompok autoagregasi rendah, sedang maupun tinggi memiliki hubungan dengan kemampuan hidrophobicity permukaannya yang dinilai berdasarkan perubahan absorbansi suspensi bakteri sebelum dan sesudah diekstraksi dengan xylene (Rahman et al., 2008). Kemampuan autoagregasi dan permukaan hydrophobicity sel dari suatu strain dapat dijadikan pendahuluan penyaringan (seleksi) untuk mengidentifikasi potensial penempelan bakteri (Palomares et al.,
2007). Gambaran autoagregasi dapat diamati pada Gambar 5.
Gambar 5. Gambaran Agregasi Strain Bifidobacteria pada Kelompok a) Auto-agregasi Tinggi, b) AutoAuto-agregasi sedang/Medium dan c) AutoAuto-agregasi Lemah secara Makroskopik (Makro) dan Mikroskopik (Mikro)
Sumber : Rahman et al. (2008)
a b c
18 Koagregasi
Interaksi dapat juga terjadi diantara strain yang berbeda. Koagregasi menurut Kolenbrander et al. (1993) adalah hasil dari interaksi sel ke sel antara tipe sel yang
METODE
Lokasi dan Waktu
Penelitian ini dilaksanakan di Laboratorium Mikrobiologi Hasil Ternak. Bagian Teknologi Hasil Ternak, laboratorium lapang Pemuliaan dan Genetika, Laboratorium Terpadu, Departemen Ilmu Produksi dan Teknologi Peternakan, Fakultas Peternakan serta Laboratorium Histologi, Departemen Anatomi, Fisiologi dan Farmakologi, Fakultas Kedokteran Hewan, Institut Pertanian Bogor. Penelitian dilaksanakan mulai bulan Mei sampai November 2010.
Materi
Bahan yang digunakan berupa kultur bakteri asal dadiah yaitu Lactobacillus plantarum D-01 dan Lactococcus lactis D-01 dan asal yogurt susu sapi Lactobacillus acidophilus Y-01 dan Bifidobacterium longum Y-01. Semua kultur bakteri tersebut merupakan koleksi dari laboratorium Mikrobiologi Bagian Teknologi Hasil Ternak, Fakultas Peternakan, IPB. Kultur ditumbuhkan pada media MRSB (de-Man’s Ragosa Sharpe Broth). Pengujian penempelan bakteri menggunakan usus tikus percobaan yaitu pada bagian usus halus tikus putih (Rattus novergicus) strain Sprague Dawley. Tikus yang digunakan adalah tikus jantan dengan bobot hidup
rata-rata 120-130 gram. Pengujian penempelan bakteri pada permukaan padat dilakukan dengan menggunakan media pelat stainless steel. Bahan-bahan media yang
digunakan dalam penelitian ini diantaranya adalah larutan PBS (Phosphat Buffer Saline), formalin, larutan alkohol 70%, 80%, 90% dan 95%, parafin, de-Man’s Rogosa Sharpe Broth (MRSB), Buffer Pepton Water (BPW), de-Man’s Rogosa Sharpe Agar (MRSA), mounting media dan Hematoxilin-Eosin. Media untuk
pengujian penempelan pada permukaan padat yaitu larutan detergen (SDS) 1%, aquades dan larutan acridin orange 0,026%.
Alat-alat yang digunakan dalam penelitian ini diantaranya adalah inkubator,
20 Prosedur
Penelitian ini dibagi dalam dua tahap. Tahap pertama merupakan penelitian pendahuluan serta tahap kedua merupakan penelitian utama. Diagram alir penelitian yang dilakukan secara garis besar dapat dilihat pada gambar 6.
Gambar 6. Diagram Alir Penelitian Penelitian
Pendahuluan
Persiapan BAL indigenous dadiah dan asal
yogurt susu sapi
(pewarnaan Gram dan uji katalase)
Pembuatan kurva standar dengan metode turbidimetri
Persiapan sampel usus tikus
Persiapan pelat stainless steel
Penelitian Utama
Uji agregasi
Uji autoagregasi
Uji koagregasi
Uji penempelan BAL pada permukaan usus tikus secara in vitro
Uji penempelan BAL pada permukaan
Stainless steel secara in vitro
menempel tidak menempel
21 Penelitian Pendahuluan
Persiapan Bakteri Asam Laktat Indigenous Dadiah dan Yogurt Susu Sapi
(Pelczar dan Chan, 2007). Penelitian pendahuluan meliputi: persiapan bakteri asam laktat yang digunakan dalam pengujian agregasi, autoagregasi, koagregasi dan penempelan terhadap usus tikus (in vitro) dan penempelan pada pelat stainless steel.
Bakteri uji yang digunakan yaitu Lactobacillus plantarum D-01, Lactococcus lactis D-01, Lactobacillus acidophilus Y-01 dan Bifidobacterium longum Y-01.
Karakteris-tik berupa morfologi dan sifat katalase diperiksa untuk konfirmasi kemurnian bakteri asam laktat yang digunakan.
Pengamatan morfologi bakteri dilakukan melalui pewarnaan Gram (Pelczar dan Chan, 2007). Pewarnaan Gram dilakukan dengan cara bakteri asam laktat kultur muda (24 jam) diambil satu mata jarum Öse, kemudian dioleskan pada gelas objek. Gelas objek tersebut difiksasi (dilewatkan diatas api Bunsen), lalu ditetesi larutan-larutan dengan urutan berikut: ungu kristal (UK), larutan-larutan yodium, alkohol 95% (bahan pemucat) dan safranin. Bakteri yang telah diwarnai dicuci dari sisa pewarna dan dikeringkan, kemudian diamati dibawah mikroskop cahaya dengan perbesaran 100x dengan bantuan minyak imersi. Bakteri yang telah diwarnai dengan metode ini dibagi menjadi dua kelompok, yaitu bakteri Gram positif, bila bakteri dapat mempertahankan zat warna ungu kristal dan tampak berwarna ungu tua. Kelompok yang lain yaitu bakteri Gram negatif akan terlihat berwarna merah, karena pada saat dicuci dengan alkohol tidak dapat mempertahankan warna ungu sehingga sewaktu diberi pewarna tandingan dengan warna merah safranin bakteri menyerap warna tersebut dan tampak berwarna merah.
22
(a) (b)
Gambar 7. (a) Tahapan Uji Katalase, (b) Contoh Hasil Uji Katalase Sumber: Pradhika (2010)
Pembuatan Kurva Standar dengan Metode Turbidimetri (Waluyo, 2008). Kurva standar penting untuk mendapatkan jumlah populasi bakteri uji yang digunakan. Kurva standar ditentukan melalui persamaan y = ax + b, yang merupakan persamaan antara optical density (nilai absorbansi) yang diukur dengan spektrofotometer dan jumlah populasi bakteri uji yang diperoleh dengan metode pemupukan. Persamaan ini di dapat dengan melakukan pengenceran (P) bakteri uji pada P0, P1/2, P1/4, P1/8, P1/16 dan P1/32 yang kemudian sampel dari masing-masing pengenceran diukur nilai OD (Optical Density) dengan panjang gelombang 620 nm serta populasi berdasarkan hasil pemupukan. Korelasi antara masing-masing nilai OD dan populasi dari pemupukan ditentukan berdasarkan persamaan y = ax + b. Persamaan yang didapat berguna untuk penentuan jumlah populasi bakteri uji atau untuk standarisasi bakteri uji yang akan digunakan. Korelasi OD dan populasi bakteri asam laktat dalam pembuatan kurva standar dapat dilihat pada Tabel 2.
Tabel 2. Korelasi OD dan Populasi dalam Pembuatan Kurva Standar
Pengenceran P0 P1/2 P1/4 P1/8 P1/16 P1/32
OD (x) x1 x2 x3 x4 x5 x6
Populasi (y) y1 y2 y3 y4 y5 y6
Positif Negatif
23 Korelasi antara nilai OD dan populasi akan menghasilkan persamaan linier seperti tampak pada Gambar 8.
Gambar 8. Korelasi Kurva Standar dengan Metode Turbidimetri
Setiap bakteri memiliki persamaan yang berbeda-beda karena tiap bakteri memiliki karakteristik yang berbeda-beda pula. Standarisasi populasi bakteri dapat diperoleh dari persamaan tersebut dengan memasukan nilai OD (Optical density) pada persamaan y = ax + b, dengan x adalah nilai OD, a dan b merupakan konstanta dari persamaan yang didapatkan dari hasil korelasi antara nilai OD dan nilai populasi, sehingga didapatkan nilai y yang merupakan populasi standar dari bakteri tersebut dengan satuan Log10 CFU/ml. Persamaan dari masing-masing BAL indigenous dadiah dan asal yogurt susu sapi dapat dilihat pada Tabel 3.
24 Persamaan kurva standar diatas hanya dapat digunakan pada penggunaan media dan kondisi penelitian yang sama dengan kondisi penelitian saat pembuatan kurva standar tersebut. Masing-masing bakteri memiliki persamaan kurva standar yang berbeda-beda. Pengujian yang memiliki kondisi berbeda tidak dapat mengguna-kan persamaan kurva standar yang sama.
Rahman (1992) menyatakan bahwa pengukuran optical density (OD) pada
batas tertentu, jumlah sinar yang diserap pada contoh cairan kultur akan sebanding dengan konsentrasi sel. Jika dibuat kurva kalibrasi antara OD dengan jumlah bakteri yang diketahui dalam suatu suspensi bakteri, akan dapat dihitung massa bakteri per unit volume. Waluyo (2008) menambahkan bahwa pengukuran massa sel secara langsung dapat dilakukan dengan mengukur kekeruhan biakan dengan spektro-fotometer atau nefelometer. Dasar teknik perhitungan ini adalah banyaknya cahaya yang diabsorpsi sebanding dengan banyaknya sel mikroba pada batas-batas tertentu. Data yang diperoleh dari pengukuran spektrofotometer dinyatakan dalam konsentrasi mikroba, diperlukan suatu kurva standar yang menyatakan korelasi antara kekeruhan biakan dengan jumlah organisme per ml biakan. Kurva dapat diperoleh dengan menggunakan metode hitungan cawan untuk menentukan jumlah organisme di dalam biakan yang kekeruhannya diketahui. Setelah kurva standar diperoleh, maka sejumlah besar biakan organisme sejenis dengan cepat diukur kekeruhannya dan konsentrasinya segera diketahui dengan membaca kurva.
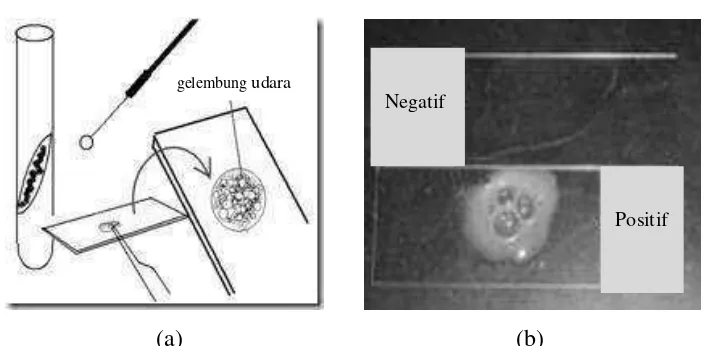
Persiapan Sampel Usus Tikus. Pengujian penempelan (adesi) bakteri kandidat probiotik dilakukan secara in vitro yaitu dengan mengamati penempelannya pada
25 Sampel usus tikus didapat dengan membedah tikus putih yang sebelumnya telah dianastesi, dengan menyuntikkan cairan pembius pada tikus. Setelah tikus pingsan baru dilakukan pembedahan. Pembedahan dilakukan dengan membuka kulit bagian perut dan mengambil saluran pencernaan bagian usus halus. Andra (2006) menyatakan bahwa fungsi utama usus halus adalah tempat berlangsung absorbsi mikronutrien, mineral dan vitamin. Oleh karena itu, pelekatan bakteri probiotik penting untuk mendukung fungsi usus tersebut dengan menghambat penempelan bakteri patogen yang bersifat merugikan sehingga fungsi penyerapan zat nutrien dapat dimaksimalkan. Proses persiapan sampel usus halus tikus dapat dilihat pada Gambar 9.
Gambar 9. Proses Adaptasi dan Pengambilan Sampel Usus Tikus (a) Pemeliharaan Selama Pemberian Antibiotik, (b) Pemingsanan Tikus, (c) Pembedahan dan Pengambilan Sampel Usus Tikus
Persiapan Pelat Stainless Steel. Pengujian penempelan bakteri pada permukaan padat menggunakan media stainless steel. Sebelum digunakan, pelat stainless steel
(SS) terlebih dahulu perlu ditandai dan dibersihkan dari kotoran yang mungkin menempel pada permukaannya. Pelat SS dibilas dengan air destilata kemudian direndam kembali dalam larutan detergen (SDS) 1% suhu 40-450C selama 1 jam, dibilas dengan air destilata sebanyak 2 kali dan dikeringkan. Pengeringan dilakukan di udara terbuka dengan dialasi kertas saring (Dewanti dan Wong, 1995). Pelat SS kemudian dimasukan ke dalam botol jar dan disterilisasi dengan autoklaf 1210C selama 20 menit.
Penelitian Utama
Uji Agregasi (Jankovic et al., 2003). Uji agregasi dilakukan untuk mengetahui kemampuan suatu bakteri untuk membentuk koloni (agregat). Pada uji ini bakteri uji (Lactobacillus plantarum D-01, Lactococcus lactis D-01, Lactobacillus acidophilus
26
Y-01 dan Bifidobacterum longum Y--01) ditumbuhkan pada MRSB (Oxoid, CM
0359) selama 24 jam pada suhu 37°C. Agregasi dinilai positif jika pada MRSB didapatkan agregat yang jelas (partikel seperti pasir) membentuk endapan di dasar tabung dan supernatan akan terlihat jernih. Populasi sebelum diinkubasi dan populasi setelah diinkubasi dihitung untuk melihat adanya pertumbuhan bakteri asam laktat yang diuji. Perhitungan populasi dilakukan dengan mengukur nilai OD (Optical Density).
Uji Autoagregasi (Kost et al ., 2003). Uji autoagregasi dilakukan untuk menentukan besarnya kemampuan interaksi bakteri antara sesamanya. Pada pengujian autoagregasi bakteri ditumbuhkan pada MRSB selama 18 jam pada suhu 370C. Sel dipanen dengan disentrifugasi pada 5000 g selama 15 menit, dicuci dua kali dan dibuang cairannya (supernatan) sehingga tertinggal pelet (padatannya) kemudian dimasukan ke dalam larutan PBS dengan pH 7.2 dan diamati nilai absorbansinya dengan spektrofotometer sampai kekeruhan tertentu yang dicerminkan dengan nilai OD (Optical Density) yang menunjukan bahwa jumlah populasi tersebut sebanyak 108 CFU/ ml. Penentuan jumlah populasi berdasarkan OD menggunakan persamaan yang terbentuk untuk masing-masing bakteri. Suspensi sel dihomogenkan dengan vortex selama 10 detik dan autoagregasi kultur BAL ditentukan selama 5 jam yang diinkubasi pada suhu ruang (27 + 0,5oC). Setiap satu jam, diambil sampel sebanyak 2 ml dan diperiksa nilai absorbansi (A 620 nm). Pengambilan sampel dilakukan
sebanyak 3 kali ulangan dan duplo. Persentase autoagregasi dapat dihitung sebagai 1-(At/A0) x 100, dengan At adalah nilai absorbansi pada t = 1, 2, 3, 4 atau 5 jam dan A0 adalah nilai absorbansi pada t = 0.
27 detik. Tabung kontrol yang berisi 4 ml dari setiap suspensi BAL yang diuji dipersiapkan untuk diamati nilai absorbansinya. Nilai absorbansi (A) diamati pada
620 nm dari suspensi diukur setelah dua bakteri uji dicampur dan setelah 5 jam di inkubasi pada suhu ruangan. Sampel diambil dengan cara yang sama seperti pengujian autoagregasi. Pengambilan sampel dilakukan sebanyak 3 kali ulangan dan duplo. Persentase koagregasi dihitung dengan rumus sebagai berikut:
Koagregasi (%) = (Ax + Ay)/2 –A(x+y) x 100 Ax + Ay/2
Keterangan : Ax = nilai absorbansi bakteri x Ay = nilai absorbansi bakteri y
A(x+y) = nilai absorbansi kultur campuran (bakteri x dan y)
Pengujian Penempelan BAL pada Usus Tikus Secara in vitro (Modifikasi Kost et
al. 2003). Pengujian penempelan BAL pada usus tikus secara in vitro mengacu pada
Kost et al. (2003) yang dimodifikasi pada perlakuan usus dengan mukus dan usus
tanpa mukus. Sampel usus halus tikus yang sebelumnya telah mendapat perlakuan (lihat persiapan sampel usus) dipotong-potong dengan ukuran 1cm2, kemudian dibagi ke dalam beberapa kelompok perlakuan yaitu kontrol usus yang tidak dicuci dengan larutan PBS (K1) dan kontrol usus tikus yang dicuci sebanyak tiga kali dengan larutan PBS (K2). Pencucian dengan PBS dilakukan pada suhu 4oC selama 30 menit untuk menghilangkan mukus pada permukaan usus.
Sampel usus dari kedua kelompok perlakuan kemudian diinkubasi dengan suspensi bakteri (109 sel dalam PBS) pada suhu 370C selama 30 menit. Suspensi bakteri yang digunakan yaitu L. plantarum D-01, L. lactis D-01, L. acidophilus Y-01
dan B. longum Y-01. Masing-masing kelompok usus yang telah diinkubasi dibagi lagi menjadi dua kelompok perlakuan yaitu usus yang tidak dicuci larutan PBS (P1) dan usus yang dicuci dua kali dengan larutan PBS (P2), sehingga terdapat empat perlakuan dalam pengujian tersebut.
Semua usus yang sudah mendapatkan perlakuan (K1P1, K1P2, K2P1 dan K2P2) kemudian difiksasi dalam 10% formalin, dilakukan dehidrasi dengan alkohol konsentrasi bertingkat, yaitu 70%, 80%, 90% dan 95%, selanjutnya dilakukan
embedding dan parafinasi, dipotong secara serial (5 µm) menggunakan mikrotom,
28
mounting, diwarnai dengan pewarnaan Hematoksilin-Eosin kemudian diamati secara
mikroskopis dan hasilnya didokumentasikan. Tahapan proses pengujian penempelan BAL pada usus tikus secara in vitro dapat dilihat pada Gambar 10.
Gambar 10. Tahapan Proses Pengujian Penempelan BAL pada Usus Tikus in vitro
Tikus diberi pakan broiler starter +
dicekok amoksisilin
H0-H5
Tikus hanya diberi pakan broiler starter H6-H11
K2 (usus ≠ mukus):
usus dicuci 3x dgn PBS suhu 40oC selama 30 menit
K2P2: Tikus dibius, dibedah dan diambil organ usus halus
Usus halus dipotong-potong sebesar 1 cm2
29 Pengujian Penempelan BAL pada Permukaan Padat (Dewanti dan Wong,
1995). Analisis penempelan dilakukan dengan membiarkan sel BAL untuk menempel pada permukaan SS selama satu jam pada suhu kamar (27 + 0,5oC), dengan konsentrasi BAL 108 CFU/ml. Pelat SS kemudian dibilas dengan air steril, diwarnai dengan larutan acridine orange 0,026% selama 5 menit, kemudian dicuci
kembali dengan air steril. Jumlah BAL yang menempel dihitung dengan mengguna-kan mikroskop epifluoresen. Bakteri kemudian dibedamengguna-kan secara morfologi.
Metode analisis pengujian penempelan sel bakteri pada permukaan padat (stainless steel) diawali dengan mengukur diameter bidang pandang mikroskop (D). Diketahui bahwa D sebesar 0,17 mm. Luas bidang pandang mikroskop dihitung dengan rumus sebagai berikut:
Luas bidang pandang (mm2) = ¼ D2
Hasil perhitungan luas bidang pandang mikroskop yaitu 0,0227 mm2 atau 0,000227 cm2. Penentuan jumlah bakteri yang melakukan penempelan dilakukan dengan pertama-tama menghitung jumlah bakteri yang menempel pada sepuluh bidang pandang, lalu jumlah tersebut dirata-ratakan. Penentuan jumlah bakteri yang menempel dalam CFU/cm2 digunakan rumus sebagai berikut:
Jumlah bakteri yang menempel per cm2 = rata-rata jumlah koloni
0,000227
Angka yang diperoleh dinyatakan dalam bentuk logaritma. Angka yang diperoleh menunjukkan jumlah bakteri asam laktat yang menempel pada permukaan padat stainless steel.
Analisis Data
HASIL DAN PEMBAHASAN
Persiapan BAL Indigenous Dadiah dan Asal Yogurt Susu Sapi
Bakteri asam laktat yang diuji untuk karakteristik penempelan, autoagregasi dan koagregasi terlebih dahulu dikonfirmasikan kemurniannya melalui pengamatan morfologi dan sifat katalase dari sel-sel bakteri tersebut. Pengujian morfologi dengan bantuan metode pewarnaan Gram dilakukan terhadap bakteri uji Lactobacillus plantarum D-01, Lactococcus lactis D-01, Lactobacillus acidophilus Y-01 dan Bifidobacterium longumY-01.
Lactobacillus plantarum merupakan salah satu isolat BAL yang dominan
dalam pembuatan dadiah susu kerbau dari Sumatera Barat, sedangkan Lactococcus lactis merupakan isolat BAL dari dadiah asal Sumatera Utara. Surono (2004)
mendapatkan spesies bakteri asam laktat berbeda yang mendominasi fermentasi dadiah diantaranya adalah Lactobacillus casei subsp. lactis, Leuconostoc paramesenteroides, Leuconostoc mesenteroides, Lactobacillus brevis dan Lactococcus lactis subsp. lactis biovar diacetylactis. Proses fermentasi dadiah yang terjadi secara alami dan tidak terkontrol memungkinan melibatkan berbagai jenis mikroorganisme khususnya bakteri asam laktat. Dominasi BAL dapat berasal dari susu kerbau (Surono, 2004), bambu sebagai wadah (Evanikastri, 2003), maupun dari daun pisang (Suryono, 2003).
Bakteri Lactobacillus acidophilus dan Bifidobacterium longum biasa ditemu-kan pada saluran pencernaan terutama bagian usus, sehingga biasa disebut dengan bakteri indigenous saluran pencernaan. Kultur bakteri L. acidophilus Y-01 dan B. longum Y-01 yang dipakai dalam pengujian merupakan hasil isolasi dari yogurt susu
sapi yang difermentasi (Maheswari, 2008). L. acidophilus dan B. longum sering
ditambahkan dalam yogurt selain kultur starter utama Streptococcus salivarius subsp. thermophilus dan Lactobacillus delbrueckii subsp. bulgaricus. Penambahan L. acidophilus dan B. longum terutama bertujuan untuk menghasilkan yogurt atau
dadiah probiotik dikarenakan kedua spesies bakteri tersebut sudah diteliti dan mampu bertahan bahkan berkembang biak dalam saluran pencernaan (Sunaryo, 2011). Karakteristik dan morfologi BAL indigenous dadiah susu kerbau dan asal
31 Tabel 4. Karakteristik Bakteri Asam Laktat Dadiah dan Asal Yogurt Susu Sapi
Bakteri Bentuk dan Susunan Pewarnaan
Gram
Uji Katalase
L. plantarum D-01 batang tunggal atau rantai pendek positif negatif
L. lactis D-01 bulat tunggal atau rantai pendek positif negatif
L. acidophilus Y-01 batang tunggal atau rantai pendek positif negatif
32 Hasil pengamatan didapatkan bahwa masing-masing bakteri asam laktat
indigenous dadiah dan asal yogurt susu sapi memiliki bentuk yang seragam dan
diketahui sebagai bakteri Gram positif yang menandakan bahwa bakteri tersebut murni dan tidak terkontaminasi. Hasil pengamatan terhadap morfologi Lactobacillus plantarum D-01 didapatkan bahwa bakteri tersebut memiliki bentuk batang dan
mempunyai susunan tunggal atau rantai pendek. Kriteria tersebut sesuai dengan pernyataan Salminen dan Wright (1998), bahwa L. plantarum berasal dari famili Lactobaciliceae, berbentuk batang dan pada umumnya mempunyai susunan tunggal atau membentuk rantai pendek.
Pengamatan morfologi pada Lactococcus lactis D-01 didapatkan hasil bahwa bakteri ini berbentuk bulat. Menurut Surono (2004), L. lactis memiliki bentuk sel bulat, rantai pendek, bersifat katalase negatif dan suhu optimum pertumbuhannya 28-310C. L. lactis termasuk bakteri Gram positif, non motil, tidak membentuk spora, dan anaerob fakultatif (Todar, 2009; Holt et al., 1994). L. lactis subsp lactis yang diisolasi dari dadih memiliki ciri-ciri tidak menghasilkan spora, anaerob fakultatif, Gram positif, diameter 1,0 µm dan berbentuk rantai pendek, tumbuh optimum pada suhu 30oC (Zakaria et al., 1998).
Lactobacillus acidophilus Y-01 memiliki bentuk batang dan susunan tunggal
atau rantai pendek. Hal ini sesuai dengan Rahman et al. (1992) yang menyatakan
bahwa L. acidophilus merupakan bakteri berbentuk batang dan termasuk golongan
bakteri Gram positif. Hasil pengamatan terhadap bakteri Bifidobacterium longum Y-01 menunjukkan bahwa bakteri ini berbentuk batang pendek dengan susunan tunggal
atau rantai pendek. Holt et al. (1994) menyatakan bahwa Bifidobacterium termasuk
golongan Eubacteria yang berbentuk batang. Beberapa strain akan menunjukkan
bentuk batang yang tidak beraturan dan bercabang.
Keempat bakteri asam laktat (L. plantarum D-01, L. lactis D-01, L. acidophilus Y-01 dan B. longum Y-01) dikelompokkan sebagai bakteri Gram positif