RADIODIAGNOSTIK BERULANG: STUDI DIFERENSIASI SEL
LEUKOSIT DARAH PERIFER MENCIT (
Mus musculus
)
BAMBANG TRIS SETIAWAN
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
(Hibiscus Sabdariffa L.) Terhadap Radiasi Ionisasi Radiodiagnostik Berulang: Studi Diferensiasi Sel Leukosit Darah Perifer Mencit (Mus Musculus) Di bawah bimbingan Drh. DENI NOVIANA, Ph.D and Dr. drh. Sri Estuningsih, M.Si, APVet.
Tujuan penelitian ini adalah untuk mengetahui efek radioprotektif ekstrak tanaman rosela (Hibiscus sabdariffa L.) terhadap radiasi ionisasi radiodiagnostik berulang melalui studi differensiasi sel leukosit darah perifer pada mencit (Mus musculus). Mencit betina sebanyak 48 ekor dibagi kedalam 4 kelompok yaitu: K- (diberi NaCl fisiologis tanpa radiasi), K+ (diberi NaCl fisiologis dengan radiasi), R- (diberi Ekstrak rosela tanpa radiasi), R+ (diberi Ekstrak rosela dengan radiasi). Mencit diberi ekstrak rosela dengan dosis 50 mg/kg berat badan dan NaCl fisiologis dengan volume 0.2 ml/ekor/2 hari sebelum pemaparan radiasi. Radiasi ionisasi dilakukan dengan dosis 0,2 mSv/paparan/2 hari selama 4 & 8 minggu pada berkas sinar utama. Pengambilan darah perifer dilakukan pada setiap kelompok pada minggu ke-0 (sebelum perlakuan), 2, 4, 6 & 8. Pengambilan data pemulihan selama 30 hari setelah minggu 4 dan 8 tanpa paparan radiasi. Hasil penelitian menunjukkan paparan radiasi dapat meningkatkan persentase netrofil band meningkat, netrofil adult, migrasi limfoblas, dan mieloblas serta menurunkan persentase monosit dan limfosit pada jaringan darah perifer. Pemberian ekstrak rosela dapat meningkatkan persentase limfosit dan monosit serta menurunkan persentase netrofil band, netrofil adult, limfoblas, dan mieloblas. Dari hasil penelitian didapatkan bahwa ekstrak tanaman rosela (Hibibscus sabdariffa L.) memiliki efek radioprotektif terhadap radiodiagnostik berulang pada sel leukosit darah perifer mencit (Mus musculus).
(Hibiscus sabdariffa L.) against Recurrent Radiodiagnostic Ionizing Radiation: Study of Leukocytes Differentiation in Mice (Mus musculus) Peripheral Blood. Under supervision: Drh. DENI NOVIANA, Ph.D and Dr. drh. Sri Estuningsih, M.Si, APVet.
The aim of this study was to determine the radioprotective effect of rosella extract (Hibiscus sabdariffa L.) against recurrent radiodiagnostic ionizing radiation: Study of leucocytes differentiation in mice (Mus musculus) peripheral blood. Fourty eight female mice were used in this study and divided into four groups: K- (treated with normal saline without radiation), K + (treated with normal saline with radiation), R- (treated with rosella extract without radiation), R + (treated with rosella extract with radiation). Mice were treated with dose of 50 mg per kg body weight of rosella extract and 0.2 ml normal saline per mice every two days prior to radiation exposure. Mice were exposed for ionizing radiation at dose 0.2 mSv per exposure along 4 and 8 weeks. Mice blood sample were collected with in each group at week 0 (before treatment), 2, 4, 6 and 8 week after treatment. Blood sample were taken also at week 4 and 8, without exposure of radiation (Recovery) for 30 days. Radiation exposure able to increase in the percentage of neutrophils band, neutrophils adult, migration of myeloblast, and lymphoblast as well as the decreasing the percentage of lymphocytes and monocytes at peripheral blood. On the other hand, rosella extract could decreasing in the percentage of neutrophils band, neutrophils adult, lymphoblast, and myeloblast, as well as the increasing percentage of monocytes and lymphocytes of mice peripheral blood. The result that of this research showed rosella extract (Hibiscus Sabdarifa L.) have radioprotective effect against repeated radiodiagnostic at peripheral blood leucocytes mice (Mus musculus).
RADIODIAGNOSTIK BERULANG: STUDI DIFERENSIASI SEL
LEUKOSIT DARAH PERIFER MENCIT (
Mus musculus
)
BAMBANG TRIS SETIAWAN
Skripsi
Sebagai Salah Satu Syarat untuk Memperoleh Gelar Sarjana Kedokteran Hewan pada
Fakultas Kedokteran Hewan
FAKULTAS KEDOKTERAN HEWAN
INTSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa skripsi dengan judul Efek Radioprotektif Tanaman Rosela (Hibiscus sabdariffa L) Terhadap Radiasi Ionisasi Radiodiagnostik Berulang: Studi Diferensiasi Sel Leukosit Darah Perifer Mencit (Mus musculus) adalah karya saya dengan arahan dari pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan daftar pustaka di bagian akhir skripsi ini.
Bogor, Oktober 2011
©Hak Cipta milik IPB, tahun 2011
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah, dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
Nama NRP
(Mus musculus).
: Bambang Tris Setiawan : B04070147
Disetujui.
Drh. Deni Noviana, Ph.D Dr. drh. Sri Estuningsih, M.Si, APVet Pembimbing I Pembimbing II
Diketahui.
Dr. Nastiti Kusumorini Wakil Dekan
karunia dan hidayah-Nya sehingga skripsi ini dapat diselesaikan dengan baik. Judul yang dipilih dalam penelitian yang dilaksanakan sejak bulan Maret 2011 sampai dengan bulan Juni 2011 ini adalah “Efek Radioprotektif Ekstrak Tanaman Rosela (Hibiscus sabdariffa L.) Terhadap Radiasi Ionisasi Radiodiagnostik Berulang: Studi Diferensiasi Sel Leukosit Darah Perifer Mencit (Mus musculus)”. Penyelesaian skripsi tidak lepas dari bantuan berbagai pihak.
Pada kesempatan ini penulis ingin menyampaikan ucapan terima kasih yang sebesar-besarnya kepada:
1. Drh. Deni Noviana, Ph.D selaku dosen pembimbing pertama dan Dr. drh. Sri Estuningsih, MSi, APVet selaku dosen pembimbing kedua atas segala bimbingan, kritik dan saran, motivasi dan kemudahan yang telah diberikan selama penulisan skripsi ini.
2. Kedua Orang Tua Akhmad Akhlak, S.Pd dan Nuraini, A.Md, kakak saya Muhammad Kurniawan, kedua adik saya Afrinaldi dan Nadia Azalia dan Keluarga atas kasih sayang, do’a serta dukungan selama ini.
3. Drh. M. Fakhrul Ulum yang telah memberikan dukungan, nasehat dan masukan yang sangat membantu.
4. Rekan sesama penilitian, Abas, Endah, Griv, dan Windy atas bantuan dan kerja samanya dan kebersamaan selama penelitian.
5. Seluruh staf Bagian Bedah dan Radiologi atas bantuan, kerjasama dan dukungan selama penelitian ini.
6. Teman-teman GIANUZZI atas bantuan, kebersamaan dan dukungan serta persahabatan selama ini.
7. Seluruh pihak yang telah membantu dalam penelitian dan pembuatan skripsi ini.
Penulis menyadari bahwa dalam penulisan skripsi ini masih terdapat kesalahan-kesalahan. Dengan penuh harapan dan keikhlasan penulis mengharapkan kritik dan saran yang membangun untuk menyempurnakan skripsi ini dan sebagai evaluasi bagi penulis. Semoga Allah SWT selalu meridhoi langkah kita semua dan menjadikan skripsi ini bermanfaat.
Bogor, Oktober 2011
Sri Indrapura, Riau pada tanggal 25 Januari 1990 dari ayah yang bernama Akhmad Akhlak, S.Pd dan ibu bernama Nur’aini, A.Md. Penulis merupakan anak ketiga dari lima bersaudara.
Pendidikan formal penulis dimulai dari SD Negeri 004 Bungaraya dan lulus tahun 2001. Penulis melanjutkan pendidikan di SMP Negeri 1 Bungaraya dan lulus pada tahun 2004, kemudian penulis melanjutkan pendidikan di SMA Negeri 8 Siak Sri Indrapura dan lulus pada tahun 2007. Pada tahun 2007 penulis masuk Institut Pertanian Bogor (IPB) melalui jalur Beasiswa Utusan Daerah (BUD) dan memilih Fakultas Kedokteran Hewan (FKH) sebagai jurusan. Penulis pernah menjadi asisten praktikum mata kuliah Anatomi Veteriner I pada tahun 2009, menjadi anggota Ikatan Mahasiswa Kedokteran Hewan Indonesia (IMAKAHI) dan anggota Himpunan Minat Profesi (HIMPRO) Ruminansia FKH IPB. Penulis juga aktif dalam kegiatan pertandingan olahraga futsal dan sepakbola yang ada di IPB.
DAFTAR ISI
DAFTAR ISI………. i
DAFTAR TABEL ... iii
DAFTAR GAMBAR ... iv
DAFTAR LAMPIRAN ... vi
PENDAHULUAN ... 1
Latar Belakang ... 1
Hipotes Awal ... 2
Tujuan ... 2
Manfaat ... 2
TINJAUAN PUSTAKA ... 3
Radiasi Ionisasi ... 3
Efek Radiasi Ionisasi ... 4
Proteksi Radiasi ... 5
Rosela ... 6
Persiapan dan Pemeliharaan Mencit ... 21
Pembuatan dan Pemberian Ekstrak Rosela ... 21
Paparan Radiasi Sinar X... 22
Pengambilan Darah Perifer Mencit ... 22
Pembuatan Preparat Ulas Darah Perifer ... 22
Penghitungan dan Pemeriksaan Ulas Darah Perifer ... 22
Metode Penelitian ... 22
Desain Penelitian dan Hewan Coba ... 22
Pembuatan dan Pemberian Ekstrak Rosela ... 24
Paparan Radiasi sinar-X ... 25
Pengambilan dan Pemeriksaan Darah Perifer ... 25
Pembuatan dan Pemeriksaan Preparat Ulas Darah Perifer ... 26
Analisis Data ... 27
HASIL DAN PEMBAHASAN ... 28
Monosit ... 31
Netrofil ... 34
Netrofil Band ... 34
Netrofil Adult ... 36
Basofil ... 40
Eosinofil ... 41
Limfoblas ... 42
Mieloblas ... 44
SIMPULAN DAN SARAN ... 50
DAFTAR PUSTAKA ... 51
DAFTAR TABEL
Halaman
1 Kandungan senyawa kimia dalam kelopak bunga rosela ... .. 7
2 Kandungan gizi kelopak bunga rosela segar per 100 gram... .. 8
3 Jadwal penelitian ... .. 21
4 Kelompok perlakuan hewan dalam penelitian ... .. 23
5 Persentase limfosit darah perifer mencit pada setiap kelompok paparan radiasi radiodiagnostik berulang.……….... 28
6 Persentase monosit darah perifer mencit pada setiap kelompok paparan radiasi radiodiagnostik berulang ……….... 32
7 Persentase netrofil darah perifer mencit pada setiap kelompok paparan radiasi radiodiagnostik berulang……….… 35
8 Persentase limfoblas darah perifer mencit pada setiap kelompok paparan radiasi radiodiagnostik berulang………. 42
DAFTAR
GAMBAR
Halaman
1 Bunga rosela (Hibiscus sabdariffa L.) ……… 6
2 Mencit Penelitian (Mus musculus)………... 9
3 Skema hematopoeisis………... 11
4 Gambaran normal netrofi………... 15
5 Gambaran normal eosinofil………..16
6 Gambaran normal basofil………. 17
7 Gambaran normal limfosit………... 18
8 Gambaran normal monosit………... 19
9 Alur Penelitian………. 24
10 Pemberian ekstrak rosela dan NaCl fisiologis pada mencit………. 25
11 Pemaparan radiasi sinar-X………... 25
12 Pengambilan dan pengoleksian darah……….. 26
13 Cara pembuatan dan pewarnaan preparat ulas darah………... 27
14 Morfologi sel limfosit……….………. 28
15 Persentase sel limfosit darah perifer mencit pada setiap kelompok total radiasi radiodiagnostik berulang……….. 29
16 Morfologi sel monosit……….. 31
17 Persentase sel monosit darah perifer pada setiap kelompok total radiasi radiodiagnostik berulang.………. 32
18 Morfologi sel netrofil band………..34
19 Persentase sel netrofil band darah perifer pada setiap kelompok total radiasi radiodiagnostik berulang……… 36
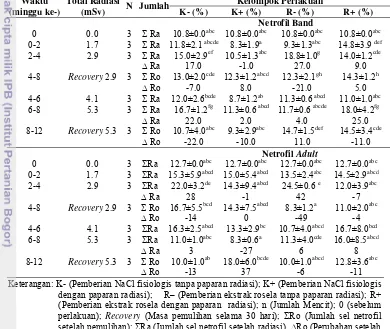
20 Morfologi sel netrofil adult……….. 37
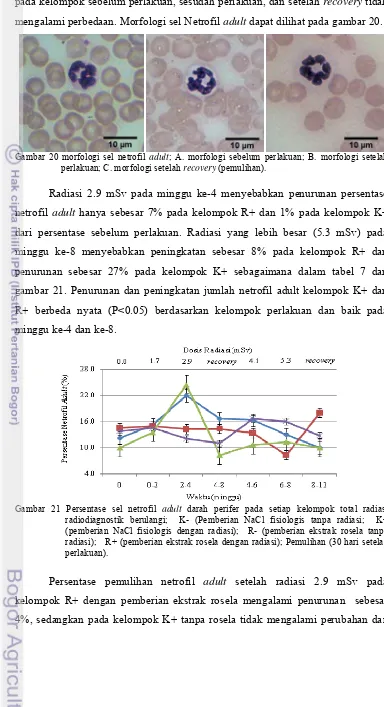
21 Persentase sel netrofil adult darah perifer pada setiap kelompok total radiasi radiodiagnostik berulangi………. 37
22 Morfologi sel basofil……… 40
23 Morfologi sel eosinofil...……….………. 41
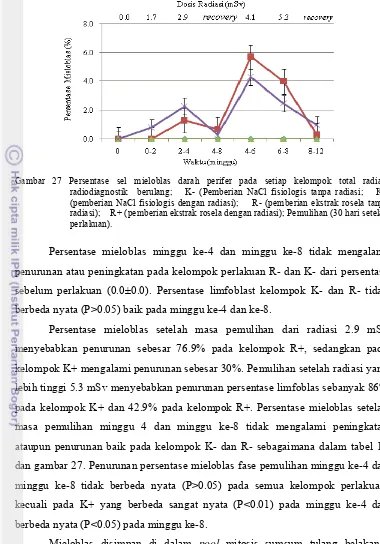
25 Persentase sel limfoblas darah perifer pada setiap kelompok total radiasi radiodiagnostik berulang…….………. 43 26 Morfologi sel mieloblas………... 45 27 Persentase sel mieloblas darah perifer pada setiap kelompok total
DAFTAR LAMPIRAN
Halaman
1 Pemberian obat pada masa aklimatisai……….... 57
2 Dosis Rosela……… 58
PENDAHULUAN
Latar Belakang
Sinar-X ditemukan oleh ahli fisika Jerman yang bernama Wilhelm Conrad
Roentgen pada 8 November 1895. Radiasi sinar-X merupakan suatu gelombang
elektromagnetik dengan panjang gelombang yang pendek, sehingga sinar-X dapat
dimanfaatkan sebagai alat diagnosis dan terapi di bidang kedokteran nuklir
(Suyatno 2008). Namun penggunaan sinar-X juga dapat mengakibatkan kerusakan
pada jaringan tubuh karena energi yang dihasilkan oleh sinar-X merupakan energi
radiasi ionisasi. Energi radiasi ionisasi tersebut berbahaya bagi kesehatan.
Pemaparan gelombang yang tidak terkendali dari radiasi ionisasi dalam jumlah
besar diketahui sebagai penyebab penyakit dan bahkan kematian pada manusia.
Pada Desember 1989, Komite Akademi Sain Nasional melaporkan tentang efek
biologi radiasi ionisasi, menyimpulkan bahwa kerusakan radiasi dapat
menginduksi kanker setelah paparan radiasi dengan dosis rendah (Thrall 2002). Di
Indonesia penggunaan sarana radiodiagnostik sinar-x dalam pengawasan Badan
Pengawas Tenaga Nuklir (BAPETEN) (Ulum dan Noviana 2008).
Radioprotektor dibutuhkan untuk menangkal radiasi. Radioprotektor yang
ideal harus murah, tidak beracun dalam jangkauan dosis yang luas, penggunaan
mudah (secara oral), cepat diserap, memiliki rentang dosis yang luas, dan dapat
bekerja melalui beberapa mekanisme. Tanaman dan produk alami memiliki semua
sifat yang ideal sebagai radioprotektor. Produk dari alam biasanya tidak beracun,
relatif murah, bisa oral dan bisa melalui beberapa mekanisme karena adanya
banyak bahan kimia (Jagetia 2007). Salah satu contoh tanaman dan produk alami
tersebut adalah rosela. Tanaman rosela (Hibiscus sabdariffa L.) merupakan
tamanan dari genus hibiscus yang banyak ditemukan di wilayah tropis. Tanaman
ini di Indonesia dikenal dengan sebutan rosela dan di Malaysia disebut dengan
Asam Paya atau Asam Susur. Penelitian tentang rosela sebagai tanaman obat
tradisional dalam bentuk sediaan teh merah untuk pengobatan berbagai jenis
penyakit sudah dilaporkan oleh Khosravi et al. (2009). Penggunaan ekstrak
juga oleh Wang et al. (2000), Mardiah & Rahayu (2009), Odigie et al. (2003), dan
Olaleye (2007).
Rosela dilaporkan mengandung antioksidan yang tinggi (Widyanto dan
Nelistya 2009). Antioksidan efektif dalam mencegah efek yang ditimbulkan oleh
radiasi sinar-X dan pemulihan sel hematopoeietik akibat radiasi (Wambi et al.
2008), namun belum dilakukan penelitian tentang potensi rosela terhadap
pemulihan sel darah putih akibat radiasi. Sel darah putih merupakan sel
pertahanan pertama dalam merespon adanya benda asing atau suatu kerusakan
pada tubuh (Thrall 2004). Oleh karena itu, darah dapat digunakan sebagai
parameter untuk mengetahui efektivitas ekstrak rosela (Hibiscus sabdariffa L.)
dalam menghindari efek radiasi ionisasi sinar-X.
Hipotesa Awal
H0= Ekstrak tanaman rosela (Hibiscus sabdariffa L.) dapat melindungi sel
leukosit dari efek radiasi.
H1= Ekstrak tanaman rosela (Hibiscus sabdariffa L.) tidak dapat melindungi sel
leukosit dari efek radiasi.
Tujuan
Tujuan penelitian ini adalah untuk mengetahui potensi radioprotektif
ekstrak tanaman rosela (Hibiscus sabdariffa L) terhadap radiasi ionisasi
radiodiagnostik melalui studi diferensiasi sel leukosit darah perifer pada mencit
(Mus musculus).
Manfaat
Hasil dari penelitian ini diharapkan dapat memberikan informasi kepada
masyarakat mengenai potensi ekstrak tanaman rosela (Hibiscus sabdariffa L)
sebagai radioprotektif terhadap radiodiagnostik sel leukosit darah perifer mencit
(Mus musculus).
TINJAUAN PUSTAKA
Radiasi Ionisasi
Radiologi merupakan ilmu diagnostik dalam dunia kedokteran. Radiologi
memanfaatkan sinar-X berupa gambaran diagnostik untuk mendeteksi berbagai
kelainan baik pada jaringan lunak maupun jaringan keras seperti tulang (Thrall
2002; McCurnin dan Bassert 2006). Sinar-X merupakan gelombang
elektromagnetik atau disebut juga dengan foton sebagai gelombang listrik
sekaligus gelombang magnet. Energi sinar-X relatif besar sehingga memiliki daya
tembus yang tinggi. Sinar-X tebagi atas dua bentuk yaitu sinar-X karakteristik dan
sinar-X Brehmsstrahlung (Ulum & Noviana 2008). Panjang sinar-X 10-0.01 nm,
frekuensi 30 petahertz – 30 exahertz (30 x 1015 Hz _ 30 x 1018 Hz) dan memiliki
energi 120 eV – 120 KeV. Gelombang ini lebih pendek dari panjang gelombang
sinar ultraviolet (Thrall 2002).
Proses terbentuknya sinar-X diawali dengan adanya pemberian arus pada
kumparan filamen pada tabung sinar-X sehingga akan terbentuk awan elektron.
Pemberian beda tegangan selanjutnya akan menggerakkan awan elektron dari
katoda menumbuk target di anoda sehingga terbentuklah sinar-X karakteristik dan
sinar-X Brehmsstrahlung. Sinar-X yang dihasilkan akan keluar dan jika
berinteraksi dengan materi dapat menyebabkan beberapa hal diantaranya adalah
efek foto listrik, efek hamburan Compton dan efek terbentuknya elektron
berpasangan. Ketiga efek ini didasarkan pada tingkat radiasi yang berinteraksi
dengan materi secara berurutan dari paling rendah hingga paling tinggi. Radiasi
ionisasi akan mengakibatkan efek biologi radiasi yang dapat terjadi secara
langsung ataupun secara tidak langsung (Swamardika 2009).
Sinar-X dapat menembus bahan dengan daya tembus sangat besar dan
digunakan dalam radiografi. Apabila berkas sinar-X melalui suatu bahan atau
sumber zat, maka berkas tersebut akan bertebaran kesegala jurusan, menimbulkan
radiasi sekunder pada zat yang dilaluinya. Sinar-X dalam radiografi diserap oleh
bahan atau zat sesuai dengan berat atom atau kepadatan bahan/zat tersebut.
Sinar-X apabila mengenai bahan/zat akan menimbulkan ionisasi partikel-partikel bahan
jaringan. Perubahan tersebut dapat berupa aksi langsung yang akan menimbulkan
kerusakan pada makromolekul biologik (DNA, RNA, protein dan enzim) dan aksi
tidak langsung (melalui DNA) yang berakibat pada keturunan (Sulaeman 2003).
Efek Radiasi Ionisasi
Penggunaan radiasi sinar-X diatur dan diawasi sama halnya seperti
penggunaan radiasi pengion di bidang lain seperti industri atau penelitian.
Peraturan pengawasan hanya difokuskan pada keselamatan dosis pada pasien.
Rekomendasi untuk dosis pasien diatur melalui International Atomic Energy
Agency (IAIE) Basic Safety Standart 115 tahun 1996 (Sinaga 2006).
Penggunaan sinar-X juga memiliki nilai negatif secara biologis. Efek
biologis berdasarkan jenis sel yaitu efek genetik dan efek somatik. Efek genetik
terjadi pada sel genetik yang akan diturunkan pada keturunan individu yang
terpapar, sedangkan efek somatik akan diderita oleh individu yang terpapar
radiasi. Apabila ditinjau dari segi dosis radiasi, efek radiasi dapat dibedakan
berupa efek stokastik dan deterministik. Efek stokastik adalah peluang efek akibat
paparan sinar-X yang timbul setelah rentang waktu tertentu tanpa adanya batas
ambang dosis sedangkan efek deterministik merupakan efek yang langsung terjadi
apabila paparan sinar-X melebihi ambang batas dosis dimana tingkat keparahan
bergantung pada dosis radiasi yang diterima (Ulum dan Noviana 2008).
Ionisasi sinar-X membuat sinar-X berbahaya. Ionisasi terjadi ketika sebuah
poton mengeluarkan suatu elektron dari atom, dengan demikian menimbulkan
pasangan ion yang teridiri dari beban negatif elektron dan beban positif atom.
Setelah ionisasi terjadi sifat fisik dan fungsi dari molekul berisi ionisasi atom yang
berubah. Karena DNA melibatkan semua proses sel metabolik dan kologenik,
sebuah ionisasi bisa terjadi pada DNA dan menghasilkan perubahan biologi.
Dengan kata lain, sebuah luka dinduksi pada satu sel DNA dapat mempengaruhi
banyak sel bagi generasi berikutnya. Ionisasi pada DNA dapat meningkatkan (1)
kecepatan mutasi, (2) kecepatan dari aborsi atau kelainan fetus, (3) kerentanan
suatu penyakit dan memperpendek masa hidup, (4) resiko kanker, dan (5) resiko
katarak (Thrall 2002).
Sinar-X dapat memproduksi ionisasi elektron pada suatu jaringan. Karena
dari radikal bebas kimia aktif. Radikal bebas adalah sekelompok bahan kimia baik
berupa atom maupun molekul yang memiliki electron tidak berpasangan pada
lapisan luarnya. Radikal bebas ini dilaporkan paling banyak merusak suatu
jaringan. Persentase kecil dari sinar-X berinteraksi secara langsung dengan DNA,
menghasilkan berbagai potensi perubahan, seperti sebagai dasar kerusakan
nukleutida, kerusakan helai DNA, dan hubungan silang DNA. Efek ini bisa
menjadi minimal apabila diperbaiki oleh enzim dengan cepat atau bisa
menyebabkan kerusakan yang mematikan pada sel (Thrall 2002).
Radiasi juga diketahui menginduksi stress oksidasi melalui pembentukan
radikal bebas, menyebabkan ketidakseimbangan pro-oksidan dan antioksidan di
dalam sel, dan mencapai puncak pada sel mati (Katz et al. 1996 & Kaur et al.
2000). Sejumlah sel memberikan respon terhadap radiasi dosis rendah dengan
perubahan pada ekspresi gen, meskipun jika radiasi tidak terdeposit pada sel
tersebut (Alatas 2006). Gelombang elektromagnetik memiliki energi yang sangat
tinggi, seperti sinar gamma atau sinar-X, disebut juga radiasi ionisasi karena
mereka mengionisasi molekul pada jalur yang dilalui.
Pemaparan gelombang yang tidak terkendali dari radiasi ionisasi dalam
jumlah besar diketahui sebagai penyebab penyakit dan bahkan kematian pada
manusia (Swamardika 2009). Efek radiasi dapat mengakibatkan kerusakan pada
usus (Grudzinski 2000), leukemia (Alatas dan Lusiyanti 2003), mengakibatkan
kanker (Cohen 2002), kerusakan pada sel darah putih perifer (Price dan Wilson
2005), menyebabkan leukemia (Yoshinaga et al. 2005) dan menyebabkan mutasi,
aberasi kromosom, inaktivasi sel dan efek seluler lainnya (Lusiyanti dan Syaifudin
2007).
Proteksi Radiasi
Keselamatan radiasi (Radioprotektif) adalah tindakan yang dilakukan
untuk melindungi pasien (hewan), pekerja (operator, dokter hewan, dan
paramedis), anggota masyarakat, dan lingkungan hidup dari bahaya radiasi. Syarat
proteksi radiasi dalam pemanfaatan sinar-X sebagai sarana penunjang diagnosa
radiodiagnostik harus memperhatikan beberapa hal diantaranya adalah (1)
justifikasi pemanfaatan tenaga nuklir, (2) limitasi dosis dan (3) optimisasi proteksi
dosis paparan. Tindakan dilakukan dengan cara memperkecil luas permukaan
paparan, mempersingkat waktu paparan, menggunakan filter dan menggunakan
teknik radiografi dengan memanfaatkan kVp tinggi (Ulum dan Noviana 2008).
Keselamatan operator, dokter hewan terhadap paparan radiasi dilakukan
dengan melakukan radiografi dalam jarak sejauh mungkin dari sumber sinar-X,
menggunakan sarana proteksi radiasi seperti, apron Pb, sarung tangan Pb, kaca
mata Pb, pelindung tiroid Pb, alat ukur radiasi dan mempersingkat waktu radiasi.
Keselamatan lingkungan terhadap bahaya radiasi dilakukan dengan merencanakan
desain ruang radiografi yang aman baik bagi pasien, operator dan lingkungan.
Ruangan dilapisi dengan Pb dan memperhitungkan beban kerja ruangan terhadap
sinar-X yang sesuai dengan perundang-undangan yang berlaku (Ulum dan
Noviana 2008).
Rosela (Hibiscus sabdariffa L)
Genus Hibiscus (Malvaceae) terdiri dari 275 spesies pada daerah tropis
dan subtropis. Di daerah malaysia ditemukan 43 spesies (Dasuki 2001). Rosela
(Hibiscus sabdariffa L) Merupakan tanaman tropis, banyak dibudidayakan di
Thailand dan dikenal sebagai Krachiap Daeng. Rosela menghasilkan calyxes
berwarna merah yang dapat digunakan untuk membuat selai warna merah yang
cemerlang, jeli, dan jus (Hirunpanish et al. 2006). Sejak awal 1970an, rosela telah
menerima banyak perhatian besar sebagai potensi sumber pewarna makanan
alami, obat-obatan, dan kosmetik (Mazza dan Miniati 1993).
Gambar 1 bunga rosela (Anonim 2009)
Berbagai kandungan yang terdapat dalam tanaman rosela membuatnya
cukup lengkap, yaitu vitamin A, C, D, B1, dan B2. Bahkan kandungan vitamin
C-nya/asam askorbat diketahui 3 kali lebih banyak dari anggur hitam, 9 kali dari
jeruk sitrus, 10 kali dari buah belimbing, dan 2,5 kali dari jambu biji. Vitamin C
merupakan salah satu antioksidan penting. Hasil penelitian mengungkapkan
bahwa kandungan antioksidan pada teh rosela sebanyak 1,7 mmol/prolox. Jumlah
tersebut lebih tinggi daripada jumlah pada kumis kucing (Widyanto dan Nelistya
2009).
Sistem Taksonomi Rosela (Hibiscus sabdariffa L) (Widyanto dan Nelista
2009):
Hibiscus sabdariffa L
Berikut kandungan senyawa kimia dalam kelopak bunga rosela segar dapat
dilihat di dalam tabel berikut:
Tabel 1 Kandungan senyawa kimia dalam kelopak bunga rosela
Nama Senyawa Jumlah
Campuran asam sitrat dan asam malat
Antosianin yaitu gossipetin (hydroxyflavone) dan hibiscin Vitamin C (Sumber : Maryani & Kristiana 2005)
Hasil uji phytokimia tanaman Rosela (Hibiscus sabdariffa L.) banyak
mengandung antosianin dan vitamin C. Sediaan kering dari ekstrak akar
mengandung flavonoid seperti gossypetin, hibiscetine, dan sabdaretine (Chau et
al. 2000 & Pau et al. 2002). Flavanoid diakui secara luas sebagai antioksidan yang
memiliki beberapa khasiat kesehatan pada diet manusia (Koes et al. 1994 &
Pourcel et al. 2007). Akan tetapi fungsi antioksidan flavanoid dalam tanaman
Berikut kandungan gizi dalam 100 g kelopak rosela segar dapat dilihat
dalam tabel berikut :
Tabel 2Kandungan gizi kelopak bunga rosela segar per 100 gram Nama Senyawa Jumlah
Kalori
Rosela mengandung pigmen yang telah diidentifikasi sebagai antosianin,
yaitu cyanidine-3-glukosida dan delphidine-3-glukosida yang penting dalam
pembuatan makanan (Fakaye et al. 2009, Chau et al 2000, & Pau et al. 2002).
Penelitian telah menunjukkan bahwa ekstrak kasar, dan beberapa dari konstituen,
khususnya antosianin dan asam protocathechuic memiliki aktivitas antioksidan
yang kuat secara in vitro dan in vivo (Tanaka et al. 1994, Tanaka et al. 1995,
Tsuda et al. 1996, Tseng et al. 1997, & Wang et al. 2000). Aktivitas antihipertensi
minuman yang dibuat dari kelopak kering tanaman rosela telah ditetapkan pada
hewan model dan manusia (Fakaye et al. 2009).
Antosianin rosela dapat memberikan kontribusi bermanfaat bagi kesehatan
sebagai sumber antioksidan yang baik. Sianin adalah turunan dari struktur kation
flavium dasar yang memiliki kekurangan elektron inti, mereka umumnya sangat
reaktif. Laju kerusakan antosianin tergantung pada banyak faktor seperti suhu pH,
asam askorbat, dan oksigen. Teknik ekstraksi untuk antosianin rosela juga
memainkan peran utama dalam aktivitas antioksidan ekstrak (Fakaye et al. 2009).
Bunga rosela berkhasiat sebagai penurun kadar gula darah, anti bakteri,
dan mampu menurunkan berat badan (Mardiah dan Rahayu 2009). Kelopak rosela
mengandung antioksidan yang dapat menghambat terakumulasinya radikal bebas
penyebab penyakit kronis, seperti kerusakan ginjal, diabetes, jantung koroner, dan
kanker darah. Antioksidan juga dapat mencegah terjadinya penuaan dini. Rosela
memiliki kandungan antioksidan lebih tinggi pada daun dari bunga (wong et al.
2009). Salah satu zat aktif yang berperan sebagai fungsi di atas adalah antosianin.
Antosianin merupakan pigmen tumbuhan yang memberikan warna merah pada
bunga rosela dan berperan mencegah kerusakan sel akibat paparan sinar ultra
violet berlebih. Salah satu khasiatnya adalah dapat menghambat pertumbuhan sel
kanker, bahkan mematikan sel kanker tersebut (Widyanto dan Nelistya 2009).
Mencit
Hewan coba yang digunakan pada penelitian ini yaitu mencit. Mencit (Mus
musculus) telah digunakan sebagai subyek penelitian sejak abad ke-19. Alasan
penggunaan mencit sebagai hewan coba yaitu memiliki potensial reproduksi yang
tinggi, masa kebuntingan yang singkat, jangka hidup yang pendek, berukuran
kecil, harga relatif murah, dan mudah dipelihara (Sirois dan Margi 2005).
Gambar 2 mencit penelitian (Isroi 2009)
Berat badan mencit berbeda-beda tiap individu. Umumnya berat badan
umur mencit 4 minggu berkisar antara 18-20 gram. Mencit liar dewasa bisa
mencapai 30-40 gram pada umur 6 bulan atau lebih (Smith dan Mangkoewidjojo
1987). Mencit laboratorium biasanya mengkonsumsi pakan yang disediakan
dalam bentuk pelet dan merupakan hewan yang banyak beraktivitas pada malam
hari. Hal yang paling penting adalah mencit laboratorium tidak pernah tanpa air
minum, harus konstan disuplai minuman terus-menerus. Mencit merupakan
hari. Mencit yang dipelihara sendiri makannya lebih sedikit dan bobot lebih
ringan dibanding mencit yang dipelihara bersama-sama dalam satu kandang,
kadang-kadang mempunyai sifat kanibal. Temperatur ruangan untuk pemeliharaan
mencit berkisar antara 20-25° C.
Sistem Taksonomi mencit adalah sebagai berikut (Anonim 2011):
Kingdom
Darah adalah suatu suspensi partikel dalam suatu larutan koloid cair yang
mengandung elektrolit. Darah berperan sebagai medium pertukaran antara sel
yang terfiksasi dalam tubuh dan lingkungan luar serta memiliki sifat protektif
terhadap organisme dan khususnya terhadap darah sendiri (Price dan Wilson
2005). Darah adalah jaringan pengikat dengan sel-selnya terendam dalam cairan
matriks yang terdiri dari senyawa organik dan anorganik. Darah mempunyai
fungsi yang sangat penting di dalam sirkulasi (Frandson 1992). Darah merupakan
media transport O2, CO2 dan bahan metabolisme sel, mengatur keseimbangan
asam basa, pengontrol suhu, dan pengatur hormon serta sel imunitas (Ontoseno
2006).
Unsur darah terdiri dari sel darah merah (eritrosit), beberapa jenis sel
darah putih (leukosit), dan fragmen sel yang disebut trombosit. Eritrosit berfungsi
sebagai transpor atau pertukaran oksigen (O2) dan karbondioksida (CO2), leukosit
mempunyai umur yang terbatas, sehingga diperlukan pembentukan optimal yang
konsisten untuk mempertahankan jumlah yang diperlukan untuk memenuhi
kebutuhan jaringan. Pembentukan ini disebut hematopoeisis (pembentukan dan
pematangan sel darah), terjadi dalam sumsum tulang tengkorak, vertebre, pelvis,
sternum, iga-iga, dan epifisis proksimal tulang-tulang panjang. Apabila kebutuhan
meningkat, misalnya pada pendarahan atau penghancuran sel darah, maka dapat
terjadi pembentukan sel darah di sepanjang tulang panjang (Price dan Wilson
2005).
Gambar 3 skema hematopoiesis (Themi et al. 2004)
Proses hematopoiesis terbagi menjadi dua stem sel, yaitu stem sel limfoid
dan mieloid. Stem sel limfoid awalnya terkait dengan timus, dimana dua jenis
limfosit, limfosit-B, dan limfosit-T dapat berkembang. Masing-masing dari sel
limfosit memiliki fungsi-fungsi tertentu dalam sistem kekebalan. Limfosit B dan
T tidak diciptakan bersamaan dari sel prekursor induk limfoid. Sel limfosit yang
terbentuk akan berada di dalam darah perifer untuk menjalankan fungsinya
sebagai penghasil antibodi dan memakan sel yang terinfeksi virus serta mengatur
sel leukosit lainnya (Wellman 2010).
Stem sel mieloid jauh lebih kompleks dari stem sel limfoid. Stem sel
keturunan (sel darah merah) eritrosit, trombosit, monosit, eosinofil, basofil, dan
netrofil/makrofag. Proses terbentuknya eritrosit, trombosit, monosit, netrofil,
eosinofil, dan basofil sebelum menjadi matur (dewasa) terjadi di dalam sumsum
tulang seperti pada gambar 3. Tahap akhir dari garis keturunan mieloid ini
terdapat dalam sel darah perifer normal. Sumsum tulang dan timus merupakan
tempat pembentukan sel-sel darah. Apabila kebutuhan sel darah dalam tubuh
berkurang, timus dan sumsum tulang akan memproduksi sel-sel darah tersebut
(Wellman 2010).
Pada umumnya, volume darah adalah 6-8% dari berat badan (Meyer dan
Harvey 2004). Volume darah tubuh hewan bervariasi jumlahnya tergantung pada
umur, keadaan kesehatan dan makanan, ukuran tubuh, waktu menyusui, faktor
lingkungan, dan derajat aktivitas. Secara umum, jumlah maksimum darah yang
diambil adalah 1% dari berat tubuh hewan (Thrall & Campbell 2004).
Leukosit
Leukosit merupakan sel yang berperan penting dalam sistem imun di
dalam tubuh (Cunningham 2002). Leukosit dalam sirkulasi darah dan yang
bermigrasi ke dalam eksudat peradangan berasal dari sumsum tulang, tempat
eritrosit dan trombosit juga dihasilkan secara terus-menerus. Dalam keadaan
normal, di dalam sumsum tulang dapat ditemukan berbagai jenis leukosit imatur
dan kumpulan leukosit dewasa disimpan di dalam sumsum tulang sebagai
cadangan untuk dilepaskan ke dalam sirkulasi darah. Jumlah tiap jenis leukosit
dalam darah perifer sangat terbatas tetapi berubah “sesuai kebutuhan” jika timbul
proses peradangan. Artinya, dengan dimulainya respon peradangan, sinyal umpan
balik pada sumsum tulang mengubah laju produksi dan pelepasan satu jenis
leukosit atau lebih ke dalam aliran darah (Price dan Wilson 2005).
Menurut Colville dan Bassert (2002), leukosit berfungsi untuk
mempertahankan tubuh dari serangan benda-benda asing. Selain fungsi di atas,
leukosit juga mempunyai fungsi lain dalam proses fagositosis yaitu memakan
benda-benda asing yang masuk ke dalam aliran darah dengan gerakan amoeboid
dan dapat berenang diantara sel-sel jaringan (Tizard 1987).
Dalam keadaan normal, daraf perifer mencit mengandung leukosit dengan
dalam darah meningkat melebihi kisaran normal, dikatakan hewan mengalami
leukositosis, sedangkan apabila terjadi penurunan jumlah leukosit dalam darah di
bawah kisaran normal, hewan dikatakan mengalami leukopenia (Vansteenhouse
2006).
MenurutGunanti (2001), peningkatan jumlah leukosit dari kisaran normal
(Leukositosis) terjadi baik secara fisiologis atau patologis. Secara fisiologi terjadi
akibat adanya peningkatan jumlah sel netrofil dan atau sel limfosit di dalam
sirkulasi dan menyebabkan peningkatan jumlah leukosit total. Peningkatan sekresi
epinefrin dan kortikosteroid yang terjadi pada kondisi stress, baik secara fisik
maupun emosional dapat menyebabkan peningkatan jumlah leukosit. Sedangkan
secara patologis, peningkatan jumlah leuksoit total di dalam sirkulasi dapat
disebabkan karena limfosit aktif melawan mikroorganisme.
Leukopenia dapat disebabkan oleh penyakit tifoid dan malaria, bahan
kimia dan fisika, hipersplenisme, dan anemia hipoplastik dan anaplastik
(Sulaeman 2003). Penurunan jumlah leukosit dari kisaran normal (leukopenia)
menyebabkan pertahanan tubuh menjadi turun sehingga menjadi faktor
predisposisi terhadap infeksi yang dapat mengancam kehidupan. Gejala yang
biasa dijumpai antara lain demam, kelemahan, sepsis, dan bahkan kematian
(Lukmasari 2006). Masa hidup sel darah putih pada hewan domestik sangat
bervariasi mulai dari beberapa jam untuk granulosit, bulanan untuk monosit,
bahkan tahunan untuk limfosit (Frandson 1992).
Menurut Thrall (2004) leukosit terdiri dari dua kelompok, yaitu: (1)
leukosit granulosit yang terdiri dari netrofil, eosinofil, dan basofil, dan (2) leukosit
yang agranulosit yang terdiri dari limfosit dan monosit. Jumlah dan ditribusi
masing-masing jenis sel darah putih atau differensial sel darah putih menjadi
faktor pendukung yang penting dalam mendiagnosa suatu penyakit (Cunningham
2002). Fungsi pertama sel leukosit dan sel-sel plasma berhubungan dengan sistem
imun (Saputri et al. 2010).
Radiasi sinar-X yang berlebihan dapat menyebabkan kerusakan-kerusakan
sel/penyakit yang diikuti dengan abnormalitas pada morfologi darah. Radiasi
dapat menyebabkan produksi sel darah yang tidak terkontrol dengan termutasinya
abnormalitas morfologi darah yang ditimbulkan akibat radiasi adalah leukemia
(Salomon et al. 2009).
Limfoblas adalah tingkatan awal dari tingkatan perkembangan sel limfosit.
Mieloblas adalah tingkatan awal dari tingkatan perkembangan sel granulosit.
Mieloblas dan limfoblas disimpan di dalam pool mitosis sumsum tulang belakang.
Mieloblas merupakan cikal bakal terbentuknya sel leukosit granulosit (Raskin et
al. 2004). Limfoblas dan mieloblas tidak ditemukan dalam sirkulasi darah normal.
Limfoblas dan mieloblas ditemukan di sumsum tulang belakang. Secara
mikroskopis, limfoblas dapat dibedakan dari mieloblas dengan memiliki
nukleolus sedikit dibandingkan mieloblas dan inti kromatin lebih kental, dan tidak
memiliki butiran sitoplasma. Menurut Vansteenhouse (2006), adanya sel
limfoblas dan mieloblas di dalam sel darah perifer normal menandakan terjadinya
leukimia.
Netrofil (heterofil)
Netrofil merupakan sel yang bergerak aktif dan dalam waktu singkat dapat
berkumpul di tempat yang diperlukan. Netrofil merupakan garis pertama dari
pertahanan melawan dan menyerbu mikroorganisme, trauma jaringan, dan banyak
faktor yang menyebabkan peradangan (Teske 2010). Netrofil berpartisipasi pada
respon peradangan dengan cara atraksi kimia ke jaringan tempat terjadinya
peradangan dan fagosit organisme dan material asing yang lain. Setelah
fagositosis, granula lisosomal bergabung dengan fagosom untuk membunuh
organisme dan kemudian mendegradasi material dengan enzim pencernaan (Thrall
2004).
Netrofil merupakan sel darah putih yang memiliki granul-granul pada
sitoplasmanya. Granul-granul netrofil berkontribusi sebagai garis pertama
pertahanan inang dalam melawan bakteri, jamur, protozoa, dan beberapa virus
(Teske 2010). Netrofil memiliki granula yang tidak berwarna, mempunyai inti sel
yang terangkai, kadang seperti terpisah-pisah, protoplasmanya banyak
berbintik-bintik halus atau granula, serta banyaknya sekitar 60 -70 % (Handayani 2008).
Netrofil dewasa memiliki inti berbentuk kacang. Netrofil band memiliki inti
membran inti. Netrofil band terdapat dalam darah yang normal dalam konsentrasi
kecil. Netrofil segmen memiliki inti berbentuk tapal kuda dan mengalami
penyempitan membran inti yang melipat kedalam berbagai bentuk (Thrall 2004).
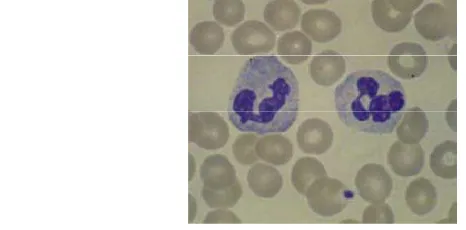
Gambar 4 Gambaran normal netrofil (Hoffbrand (2006) dalam Saputri et al. 2010).
Netrofil dalam sirkulasi dibagi antara kelompok sirkulasi dan kelompok
marginal (sel-sel darah putih yang terletak disepanjang dinding kapiler). Dengan
gerakan amuba, netrofil bergerak dengan cara diapedesis dari kelompok marginal
masuk ke dalam jaringan dan membran mukosa. Netrofil merupakan sistem
pertahanan tubuh primer melawan infeksi bakteri, metode pertahananya adalah
fagositosis. Kelompok granulosit konstan dipertahankan, dipengaruhi oleh
interaksi sel-ke-sel, dan hormon pertumbuhan serta sitokin yang dilepaskan dari
sel inflamasi (Price dan Wilson 2005).
Menurut Thrall (2004), jumlah neutrofil band sekitar 0-0.2 % dari total
leukosit darah dan jumlah netrofil dewasa sekitar 15-20 % dari total leukosit
darah. Netrofilia merupakan peningkatan jumlah netrofil dari kisaran normal.
Netrofilia dapat diakibatkan oleh peradangan, stress, respon kortikosteroid, latihan
yang berlebih, dan respon epinefrin (Raskin et al. 2004). Secara umum, kejadian
netropenia didahului dengan terjadinya penurunan jumlah leukosit dari kisaran
normal yang bersirkulasi. Netropenia dapat diakibatkan oleh stress dan
peradangan akut (Meyer et al. 1992 dalam maulida (2008) & Vansteenhouse
2006). Sedangkan menurut Raskin (2000), netropenia dapat terjadi karena faktor
kongenital, penyakit infeksius, keracunan, termediasi oleh imun, dan irradiasi.
Neutrofilia dapat pula terjadi karena proses fisiologis tubuh, induksi
kortikosteroid, peradangan, dan neoplasia.
Netrofil biasanya menghabiskan waktu 10 jam di dalam sistem vaskular
acak dan searah dimana sel-sel tidak kembali ke sirkulasi lagi. Netrofil bermigrasi
ke jaringan dalam menanggapi bakteri dan rangsangan lainnya (Raskin et al.
2004) dan Hoffbrand (2006) dalam Saputri et al. 2010. Dalam peradangan,
netrofil yang berlebih dalam jaringan mungkin tampak sebagai eksudat atau nanah
(Raskin et al. 2004).
Eosinofil
Eosinofil adalah granulosit dengan inti yang terbagi menjadi 2 lobus
sitoplasma bergranula kasar, refraktil, dan berwarna merah bila diwarnai dengan
zat warna asam, seperti eosin (Campbell 2004). Menurut Thrall (2004) eosinofil
jarang terlihat pada darah normal. Eosinofil memiliki granula bewarna merah
dengan pewarnaan asam, ukuran, dan bentuknya hamper sama dengan netrofil,
tetapi granula dalam sitoplasmanya lebih besar, banyaknya kira-kira 24%
(Handayani 2008). Eosinofil terdiri dari protein yang menyelimuti dan merusak
membran parasit serta memiliki respon untuk membantu sebuah mekanisme
pertahanan menyerang infestasi larva parasit. Eosinofil memiliki inti bergelambir
dua, dikelilingi butir-butir asidofil yang cukup besar (Thrall 2004).
Gambar 5 Gambaran normal eosinofil (Hoffbrand 2006).
Eosinofil merupakan sel fagosit yang lemah dan mengalami kemotaksis.
Eosinofil sering kali diproduksi dalam jumlah yang besar pada penderita infeksi
parasit, dan eosinofil ini bermigrasi ke jaringan yang menderita infeksi parasit.
Eosinofil memfagosit parasit dengan cara: (1) melepaskan enzim hidrolitik dari
granulanya, yang dimodifikasi lisosom; (2) dengan melepaskan bentuk oksigen
yang sangat reaktif yang khususnya bersifat mematikan; dan (3) dengan
melepaskan suatu polipeptida yang sangat larvasidal, yaitu yang disebut protein
Jumlah eosinofil pada mencit sekitar 0-3% dari total jumlah leukosit
(Thrall 2004). Eosinofilia pada hewan domestik merupakan peningkatan jumlah
eosinofil dalam darah dari kisaran normal. Eosinofilia dapat terjadi karena infeksi
parasit, reaksi alergi, dan kompleks antigen-antibodi setelah proses imun
(Frandson 1992). Penurunan jumlah eosinofil dari kisaran normal atau
eosinopenia dapat disebabkan oleh stress dan respon dari kortikosteroid (Raskin et
al. 2004)
Basofil
Basofil merupakan granulosit yang sangat jarang, jumlahnya sangat rendah
dalam aliran darah yaitu 0.5% (Teske 2010). Basofil memiliki granula bewarna
biru dengan pewarnaan basa, sel ini lebih kecil daripada eosinofil, tetapi
mempunyai inti yang bentuknya teratur, di dalam protoplasmanya terdapat
granula-granula yang besar, banyaknya kira-kira 0,5% di sumsum merah
(Handayani 2008).
Gambar 6 gambaran darah basofil (Themi et al. 2004)
Basofil dibentuk di dalam sumsum tulang. Basofil membawa heparin,
faktor-faktor pengaktifan histamine, dan trombosit dalam granula-granulanya
untuk menimbulkan peradangan pada jaringan, fungsi sebenarnya tidak diketahui
dengan pasti (Price dan Wilson 2005). Membran sitoplasma basofil dikelilingi
immunoglobulin E seperti sel mast. Basofil dan sel mast sangat berperan dalam
berbagai macam reaksi alergi. Konsentrasi basofil pada sirkulasi sangat rendah.
Jumlah basofil mencit sekitar 0-0.2% dari total leukosit darah (Thrall 2004).
Basofilia merupakan peningkatan jumlah basofil dari kisaran normal dalam
bersama dengan aliran limfe dan masuk ke jaringan dengan cara diapedesis (Teske
2010). sel limfosit merupakan sel yang paling sensitif terhadap radiasi, dosis
tunggal 0,2 Gy sudah dapat menimbulkan aberasi kromosom yang dapat dideteksi
(Lusiyanti dan Syaifudin 2007).
Peningkatan jumlah limfosit dari kisaran normal (limfositosis) dapat
terjadi karena induksi epinefrin, penyakit infeksius, dan neoplasia, sedangkan
penurunan jumlah limfosit dari kisaran normal (limfopenia) dapat terjadi karena
induksi kortikosteroid, penyakit infeksius, kerusakan pada sistem limfatik,
congenital, dan mastositosis (mastositemia) (Raskin 2000).
Monosit
Monosit memiliki ukuran yang lebih besar daripada limfosit,
protoplasmanya besar, warna biru sedikit abu-abu, serta mempunyai bintik-bintik
sedikit kemerahan. Inti selnya berbentuk bulat atau panjang. Monosit adalah
leukosit terbesar yang berdiameter 15-20 μm dan berjumlah 3-9% dari seluruh sel
darah putih. Monosit dibentuk di dalam sumsum tulang, masuk ke dalam sirkulasi
dalam bentuk imatur dan mengalami proses pematangan menjadi makrofag
setelah masuk ke jaringan. Fungsinya sebagai fagosit (Handayani 2008). Jumlah
monosit pada mencit adalah sekitar 0-3% dari total leukosit darah (Thrall 2004).
Gambar 8 Gambaran normal monosit (Handayani 2008).
Monosit berperan dalam mengatur tanggap kebal dengan mengeluarkan
glikoprotein pengatur monokin seperti interferon, interleukin 1 dan zat
farmakologi aktif seperti prostaglandin dan lipoprotein. Monosit juga merupakan
makrofag muda yang beredar dalam darah dan berperan dalam mempertahankan
normal berada di dalam darah sekitar 40 jam dan dapat hidup di jaringan dalam
beberapa bulan. Monosit normal ditemukan di bagian yang spesifik di beberapa
organ (Tizard 1987).
Sebelum menjadi monosit, sel ini terlebih dahulu menjadi monoblas.
Monoblas biasanya ditemukan di sumsum tulang dan tidak muncul dalam darah
perifer yang normal. Mereka tumbuh menjadi monosit yang pada gilirannya
berkembang menjadi makrofag (Thrall 2004). Monosit juga memiliki kemampuan
untuk menelan dan mendegradasi mikroorganisme, sel-sel yang abnormal, dan
sel-sel debris (Campbell 2004).
Monositosis adalah jumlah monosit melebihi kisaran normal monosit
dalam leukosit. Monositosis dapat terjadi karena infeksi bakteri kronis, penyakit
protozoa, netropenia kronis, penyakit Hodgkin, serta leukemia miemonositik dan
monositik (Sulaeman 2003). Monositopenia atau penurunan jumlah monosit dari
kisaran normal dapat terjadi akibat induksi virus dan netropenia (Price dan Wilson
BAHAN DAN METODE
Tempat dan Waktu
Penelitian ini dilaksanakan di Fakultas Kedokteran Hewan Institut
Pertanian Bogor, dengan mengambil tempat di Bagian Bedah dan Radiologi
sebagai tempat pengambilan dan pemeriksaan darah serta pemaparan radiasi dan
kandang hewan percobaan di fasilitas kandang/hewan coba Bagian Patologi
sebagai tempat pemeliharaan mencit, Departemen Klinik, Reproduksi, dan
Patologi Fakultas Kedokteran Hewan Institut Pertanian Bogor. Penelitian ini
dilaksanakan dari bulan Maret 2011 sampai Juni 2011.
Tabel 3 Jadwal penelitian
No Kegiatan Bulan ke-
1 2 3 4 5 6 7 8 9
1. Proposal √
2. Persiapan penelitian √
3. Pengadaan bahan dan ekstrak √
4. Pelaksanaan penelitian √ √ √ √
5. Penghitungan mikroskopis differensiasi leukosit sel darah
perifer √ √ √ √
6. Pengumpulan data √ √
7. Analisis data √
8. Laporan penelitian √
9. Publikasi Ilmiah √
Bahan dan Alat
Persiapan dan Pemeliharaan Mencit
Bahan yang diperlukan untuk persiapan dan pemeliharaan mencit adalah
48 ekor mencit jantan yang berumur sekitar 6-8 minggu dengan berat badan
20-25 g yang diperoleh dari Pusat Studi Biofarmaka IPB, pakan mencit komersil,
serbuk kayu dan air minum ad libitum. Alat yang digunakan yaitu kandang plastik
(30x20x15 cm) yang dilengkapi dengan tutup kawat, tempat pakan, tempat air
minum mencit, alat penanda, dan alat cekok berupa stomatch tube.
Pembuatan dan Pemberian Ekstrak Rosela (Hibiscus sabdariffa L)
Bahan yang diperlukan untuk pemberian ekstrak rosela adalah bunga
rosela kering (simplisia), etanol 96%, ekstrak rosela, dan aquades untuk
pengenceran, sedangkan alat yang diperlukan adalah syringe 1 cc dan alat cekok
Paparan Radiasi sinar-X
Bahan yang diperlukan untuk melakukan paparan radiasi sinar-X adalah
mencit, sedangkan alat yang diperlukan adalah mesin radiodiagnostik portabel
sinar-X (VR-1020, MA medical corp, Japan), apron Pb, pelindung mata,
pelindung tiroid, dosimeter merk ALOKA CO.,LTD Tokyo Japan, dan kandang
mencit.
Pengambilan Darah Perifer Mencit
Bahan yang diperlukan untuk pengambilan darah perifer mencit adalah
kapas, alkohol 70%, ketamine, xylazine, reverzin (yohimbin), dan Ethylene
Diamine Tetra Acetic Acid (EDTA) 10%. Sedangkan alat yang diperlukan adalah
mikrokapiler hematokrit, tabung efendorf, timbangan, syringe 1 cc, syringe 3 cc,
dan syringe 5 cc.
Pembuatan Preparat Ulas Darah Perifer
Bahan yang diperlukan untuk pembuatan preparat ulas darah perifer adalah
sampel darah, methanol, giemsa 10%, dan air kran yang mengalir. Sedangkan alat
yang diperlukan adalah object glass.
Penghitungan dan Pemeriksaan Darah Perifer (Differensiasi Leukosit Sel
Darah Perifer)
Bahan yang diperlukan untuk penghitungan morfologi jenis
masing-masing sel leukosit adalah sampel darah, minyak imersi, xylol, dan kertas tisu.
Sedangkan Alat yang diperlukan adalah mikroskop cahaya dan counter.
Metode Penelitian
Desain Penelitian dan Hewan Coba
Sebanyak 12 ekor mencit dalam setiap subkelompok dimasukkan ke dalam
kandang plastik yang telah disediakan. Semua mencit diaklimatisasi untuk
menyesuaikan kondisi laboratorium penelitian selama 2 minggu sebelum
penelitian dilaksanakan, yaitu mencit diberi anthelmintik (albendazole®) sediaan
5% dengan dosis 10 mg/kg peroral, antibiotik (clavamox®) 25 mg/kg berat badan
dan Medina 2007). Pakan yang diberikan merupakan pakan komersial sesuai
dengan kebutuhan harian mencit dan minum diberikan secara ad libitum air aqua.
Desain penelitian merupakan hasil modifikasi prosedur penelitian yang
telah dilakukan oleh Fidan et al. (2008). Mencit dibagi menjadi 2 grup radiasi,
yaitu; (1) Grup radiasi rendah yaitu pemaparan radiasi dilakukan setiap 2 hari
sekali selama 4 minggu dan (2) Grup radiasi tinggi yaitu pemaparan radiasi
dilakukan setiap 2 hari sekali selama 8 minggu. Setelah pemaparan radiasi rendah
dan tinggi dilakukan recovery (pemulihan) selama 4 minggu dengan pemberian
ekstrak rosela tanpa dilakukan paparan radiasi seperti pada tabel 4. Hewan coba
dibagi dalam 4 kelompok perlakuan secara acak sebagai berikut:
1. Kelompok Kontrol (K-): mencit menerima perlakuan peroral 2 mL NaCl
fisiologis setiap 2 hari sekali selama 4 minggu untuk mencit grup 1 (n=6) dan
selama 8 minggu untuk mencit grup 2 (n=6).
2. Kelompok Primer (K+): Mencit menerima perlakuan peroral 2 mL NaCl
fisiologis dan radiasi berkas sinar utama dosis 0,2 mSv setiap 2 hari sekali
selama 4 minggu untuk mencit grup 1 (n=6) dan selama 8 minggu untuk
mencit grup 2 (n=6) dengan waktu paparan + 1 detik.
3. Kelompok Rosela (R-): Mencit diberi ekstrak rosela dosis 50 mg/kg berat
badan secara peroral setiap 2 hari sekali selama 8 minggu untuk mencit grup 1
(n=6) dan selama 12 minggu untuk mencit grup 2 (n=6).
4. Kelompok Rosela Primer (R+): Mencit diberi Ekstrak rosela dosis 50 mg/kg
berat badan secara peroral dan radiasi berkas utama dosis 0,2 mSv setiap 2
hari sekali selama 8 minggu untuk mencit grup 1 (n=6) dan selama 12 minggu
untuk mencit grup 2 (n=6) dengan waktu paparan + 1 detik.
Tabel 4 Kelompok perlakuan hewan dalam penelitian
Kelompok N
Radiasi dosis rendah (2.9 mSv) Radiasi dosis tinggi (5.3 mSv)
Ra minggu
tidak masuk ke dalam saluran pernapasan. Pemberian ekstrak rosela dilakukan
setiap dua hari sebelum diradiasi dengan sinar-X.
Gambar 10 pemberian ekstrak rosela dan NaCl fisiologis pada mencit.
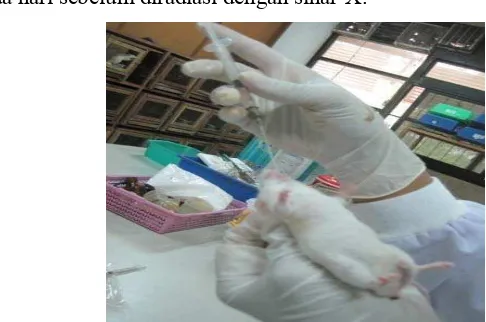
Paparan Radiasi Sinar-X
Pemaparan radiasi ionisasi dosis rendah (2.9 mSv) dan tinggi (5.3 mSv)
dilakukan dengan menggunakan mesin Roentgent dengan dosis 0,2 mSv/2 hari
pada berkas sinar utama dengan pengaturan kVp 80, mAs 12, dan waktu paparan
+ 1 detik. Jarak sumber target (dasar kandang mencit) adalah 100 cm pada berkas
sinar utama. Pemaparan dilakukan di ruang Roentgent pada setiap kelompok K+
dan R+ secara bergantian. Setiap kelompok mencit di letakkan di atas meja
Roentgent dan akan dilakukan pemaparan oleh operator.
Gambar 11 pemaparan radiasi sinar-X
Pengambilan dan Pengoleksian Darah Perifer
Pengambilan darah perifer dilakukan pada setiap kelompok secara acak
Sebelum pengambilan darah dilakukan, mencit terlebih dahulu dibius dengan
kombinasi ketamin dosis 30 mg/kg berat badan dan xylazin dengan dosis 5 mg/kg
berat badan secara intra peritoneal. Pengambilan darah dilakukan dengan
mikrokapiler hematokrit dengan EDTA 10% melalui vena retro orbitale pada
bagian mata (Hrapkiewicz & Medina 2007).
Sebanyak 0,5 ml darah yang di peroleh di masukan ke tabung Ependorf
yang telah diberi EDTA sebanyak 0,1 ml. Darah tersebut disimpan di dalam box
yang diisi dengan es batu tidak lebih dari 24 jam.
Gambar 12 pengambilan dan pengoleksian darah.
Pembuatan dan Pemeriksaan Preparat Ulas Darah (Differensiasi Leukosit
Sel Darah Perifer)
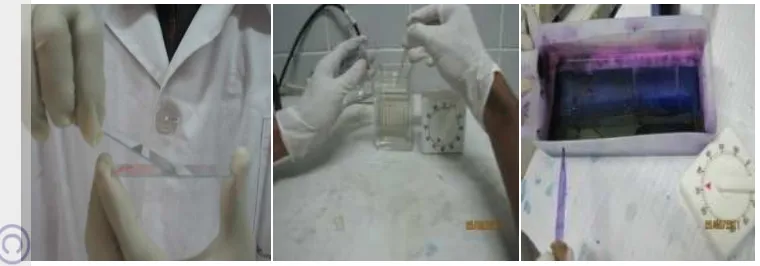
Menurut Weiss dan Tvedten (2004), metode membuat ulas darah pada
slide adalah darah yang telah ditetes ke slide di sentuh menggunakan slide pelebar
dengan cara menarik pelan-pelan kebelakang. Setelah kontak terjadi, slide pelebar
tadi digerakkan ke depan dengan gerakan yang lembut. Ulas darah yang sudah
terbentuk dikeringkan terlebih dahulu, kemudian direndam ke dalam metil alkohol
selama 3-5 menit dan dikeringkan. Ulas darah yang sudah kering kemudian
dimasukkan ke dalam larutan giemsa 10% selama 30 menit. Setelah 30 menit,
cuci slide menggunakan air kran yang mengalir selama 30 detik dan dikeringkan
dari air. Untuk pemeriksaan ulas darah dilakukan di bawah mikroskop cahaya
dengan perbesaran 1000 x dengan bantuan minyak imersi dengan arah
pengamatan zigzag dan xylol sebagai larutan pembersih. Penghitungan
(Limfosit, monosit, netrofil band, netrofil adult, basofil, eosinofil, limfoblas, dan
mieloblas) hingga mencapai jumlah 100 sel leukosit.
Gambar 13 cara pembuatan dan pewarnaan preparat ulas darah.
Perhitungan perubahan persentase sel leukosit darah perifer akibat
pemaparan radiasi dan pemberian ekstrak rosela adalah sebagai berikut:
- Perubahan persentase sel leukosit akibat pemaparan radiasi =
(b-a)/(a+b)*100%
- Perubahan persentase sel leukosit akibat pemberian ekstrak rosela =
(d-c)/(c+d)*100%
Keterangan : a= Persentase sel Leukosit sebelum perlakuan
b= Persentase pada dosis radiasi tertentu
c= Persentase sel pada dosis X
d= Persentase sel leukosit setelah recovery dosis X
X= Jumlah dosis paparan radiasi (mSv)
Analisis Data
Data yang diperoleh dianalisis secara statistik dengan menggunakan
software SPSSversi 13 untuk Microsoft® Windows® uji ANOVA dilanjutkan uji
HASIL DAN PEMBAHASAN
LIMFOSIT
Limfosit merupakan sel darah putih yang memiliki presentase paling
tinggi dalam menyusun sel darah putih atau leukosit (O’Malley 2005). Oleh
karena itu, limfosit sangat berperan dalam fluktuasi jumlah leukosit dalam darah.
Ukuran bervariasi dari 7 sampai dengan 15 mikron. Morfologi sel limfosit pada
kelompok sebelum perlakuan, sesudah perlakuan, dan setelah recovery tidak
mengalami perbedaan. Morfologi sel limfosit dapat dilihat pada gambar 14.
Gambar 14 morfologi sel limfosit; A. morfologi sebelum perlakuan; B. morfologi setelah perlakuan; C. morfologi setelah recovery (pemulihan).
Nilai persentase sel limfosit mencit berdasarkan kelompok perlakuan
terhadap kelompok total radiasi dan fase pemulihan dapat dilihat pada tabel 5.
Tabel 5 Persentase sel limfosit darah perifer mencit pada setiap kelompok total radiasi radiodiagnostik berulang.
Keterangan: K- (Pemberian NaCl fisiologis tanpa paparan radiasi); K+ (Pemberian NaCl fisiologis dengan paparan radiasi); R– (Pemberian ekstrak rosela tanpa paparan radiasi); R+ (Pemberian ekstrak rosela dengan paparan radiasi); n (Jumlah Mencit); 0 (sebelum perlakuan); Recovery (Masa pemulihan selama 30 hari); ΣRo (Persentase sel limfosit setelah pemulihan); ΣRa (Persentase sel limfosit setelah radiasi) ∆Ro (Perubahan setelah recovery); ∆Ra (Perubahan setelah radiasi); - (Penurunan); + (peningkatan); huruf yang sama dalam kolom dan baris yang berbeda menunjukkan hasil yang tidak berbeda nyata (P>0.05).
Radiasi 2.9 mSv pada minggu ke-4 menyebabkan penurunan persentase
limfosit hanya sebesar 2% pada kelompok K+ dan 1% pada kelompok R+ dari
jumlah sebelum perlakuan. Radiasi yang lebih besar (5.3 mSv) pada minggu ke-8
meningkatkan persentase penurunan 4% pada kelompok K+ dan 10% pada
kelompok R+ sebagaimana dalam tabel 5 dan gambar 15. Penurunan nilai pada
kedua kelompok perlakuan dan radiasi tidak berbeda nyata (P>0.05).
Persentase limfosit kelompok R- dengan pemberian ekstrak rosela
mengalami penurunan 13% lebih besar daripada kelompok K- yang mengalami
penurunan 8% pada minggu ke-4 dari persentase sebelum perlakuan. Persentase
limfosit pada minggu ke-8 hanya mengalami penurunan 4% baik pada kelompok
R- dan K-. Penurunan pada kelompok K- dan R- tidak berbeda nyata (P>0.05),
kecuali pada kelompok R- minggu ke-4 berbeda nyata (P<0.05) berdasarkan jenis
perlakuan.
Gambar 15 Persentase sel limfosit darah perifer mencit pada setiap kelompok total radiasi radiodiagnostik berulang. K- (Pemberian NaCl fisiologis tanpa radiasi; K+ (pemberian NaCl fisiologis dengan radiasi); R- (pemberian ekstrak rosela tanpa radiasi); R+ (pemberian ekstrak rosela dengan radiasi); Pemulihan (30 hari setelah perlakuan).
Persentase limfosit setelah masa pemulihan dari radiasi 2.9 mSv
menyebabkan peningkatan 3% pada kelompok k+ dan penurunan 9% pada
kelompok R+ dari persentase sebelum perlakuan. Pemulihan setelah radiasi 5.3
mSv menyebabkan peningkatan persentase limfosit sebanyak 2% pada kelompok
K+ dan 5% pada kelompok R+. Persentase limfosit pada masa pemulihan minggu
4 mengalami peningkatan 6% pada kelompok K- dan 10% pada kelompok R-.
K- dan hanya 1% pada kelompok R- sebagaimana dalam tabel 5 dan gambar 15.
Penurunan dan peningkatan persentase limfosit pada fase pemulihan minggu 4
dan minggu 8 tidak berbeda nyata (P>0.05), kecuali pada kelompok R+ setelah
pemulihan minggu ke-4 yang berbeda nyata (P<0.05) berdasarkan dosis radiasi
dan jenis perlakuan.
Semua peningkatan dan penurunan yang terjadi pada persentase limfosit
baik pada radiasi 2.9 mSv, 5.3 mSv dan masa pemulihan masih dalam kisaran
normal jumlah limfosit darah antara 48.5-83.9% (Thrall 2004). Peningkatan
persentase limfosit (limfositosis) dapat terjadi karena induksi epinefrin, penyakit
infeksius, dan neoplasia (Raskin 2000). Limfositosis dapat terjadi juga pada kasus
leukemia limfoblastik akut yang disebabkan oleh virus, radiasi, dan aberasi
genetik (Price dan Wilson 2005). Penurunan persentase limfosit (limfopenia)
dapat terjadi karena induksi kortikosteroid, penyakit infeksius, kerusakan pada
sistem limfatik, kongenital, dan penyinaran luas (Raskin 2000).
Sel limfosit adalah sel yang paling sensitif terhadap radiasi dan sel yang
pertama kali menghilang dari sirkulasi, kemudian diikuti sel granulosit (Yunarti
2007). Radiasi menyebabkan terbentuknya radikal bebas oksidatif intra maupun
ekstra seluler (Yunarti 2007). Radikal bebas terbentuk karena ion elektron atom
yang dihasilkan dari paparan radiasi berikatan dengan molekul air. Radikal bebas
memiliki elektron bebas tidak berpasangan pada lapisan luarnya yang dapat
menyebabkan kerusakan pada tubuh (Thrall 2002), sehingga persentase sel
limfosit dalam tubuh menjadi menurun akibat radiasi (Yunarti 2007).
Persentase limfosit fase pemulihan setelah radiasi 2.9 mSv minggu ke-4
pada kelompok R- mengalami peningkatan yang lebih banyak dari kelompok K-
dan K+, namun pada kelompok R+ mengalami penurunan. Hal ini mungkin
disebabkan kurangnya penyerapan ekstrak rosela oleh tubuh dan masa terapi yang
masih singkat. Pemulihan setelah radiasi 5.3 mSv minggu ke-8 persentase limfosit
kelompok R+ mengalami peningkatan yang lebih banyak dibandingkan kelompok
yang lain. Pemberian ekstrak rosela pada mencit yang terkena radiasi mengurangi
efek radikal bebas yang menyebabkan persentase limfosit dalam darah meningkat.
Rosela mengandung antioksidan seperti antosianin, vitamin A, flavanoid,
sehingga dapat menghindar dari resiko kanker, tumor, dan lain-lain akibat radiasi
(Wambia et al. 2009). Antioksidan memiliki potensi sebagai radioprotektif
terhadap limfosit dengan cara mengurangi efek radikal bebas dan peningkatan
kapasitas total antioksidan intraselluler (Lee et al. 2010 & Wambia et al. 2009),
sehingga kerusakan akibat radiasi dapat berkurang dan persentase limfosit dapat
meningkat.
MONOSIT
Monosit memiliki ukuran yang lebih besar daripada limfosit,
protoplasmanya besar, warna biru sedikit abu-abu, serta mempunyai bintik-bintik
sedikit kemerahan. Inti selnya berbentuk bulat atau panjang. Monosit adalah
leukosit terbesar yang berdiameter 15-20 μm. Morfologi sel monosit pada
kelompok sebelum perlakuan, sesudah perlakuan, dan setelah recovery tidak
mengalami perbedaan. Morfologi sel monosit dapat dilihat pada gambar 16.
Gambar 16 morfologi sel monosit; A. morfologi sebelum perlakuan; B. morfologi setelah perlakuan; C; morfologi setelah recovery (pemulihan).
Radiasi 2.9 mSv pada minggu ke-4 menyebabkan penurunan persentase
monosit sebesar 10% pada kelompok K+ dan 29% pada kelompok R+ dari
persentase sebelum perlakuan. Radiasi yang lebih besar (5.3 mSv) pada minggu
ke-8 menyebabkan persentase penurunan 10% pada kelompok K+ dan 20% pada
kelompok R+ sebagaimana pada tabel 6 dan gambar 17. Penurunan nilai
kelompok K+ tidak berbeda nyata (P>0.05) baik pada minggu ke-4 dan ke-8,
sedangkan kelompok R+ berbeda nyata (P<0.05) berdasarkan kelompok
perlakuan dan dosis radiasi pada minggu ke-4 dan ke-8.
Nilai persentase sel limfosit mencit berdasarkan kelompok perlakuan
terhadap kelompok total radiasi dan fase pemulihan dapat dilihat pada tabel 6.
Tabel 6 Persentase sel monosit darah perifer pada setiap kelompok total radiasi radiodiagnostik
Keterangan: K- (Pemberian NaCl fisiologis tanpa paparan radiasi); K+ (Pemberian NaCl fisiologis dengan paparan radiasi); R– (Pemberian ekstrak rosela tanpa paparan radiasi); R+ (Pemberian ekstrak rosela dengan paparan radiasi); n (Jumlah Mencit); 0.0 (sebelum perlakuan); Recovery (Masa pemulihan selama 30 hari); ΣRo (Persentase sel monosit setelah pemulihan); ΣRa (Persentase sel monosit setelah radiasi) ∆Ro (Perubahan setelah recovery); ∆Ra (Perubahan setelah radiasi); - (Penurunan); + (peningkatan); huruf yang sama dalam kolom dan baris yang berbeda menunjukkan hasil yang tidak berbeda nyata (P>0.05).
Gambar 17 Persentase sel monosit darah perifer pada setiap kelompok total radiasi radiodiagnostik berulang.; K- (Pemberian NaCl fisiologis tanpa radiasi); K+ (pemberian NaCl fisiologis dengan radiasi); R- (pemberian ekstrak rosela tanpa radiasi); R+ (pemberian ekstrak rosela dengan radiasi); Pemulihan (30 hari setelah perlakuan).
Persentase monosit kelompok R- dengan pemberian ekstrak rosela
mengalami penurunan 29%, sedangkan pada kelompok K- mengalami penurunan
sebesar 26% pada minggu ke-4 dari persentase sebelum perlakuan. Persentase
monosit pada minggu 8 mengalami penurunan 8% pada kelompok R-, sedangkan
pada kelompok K- hanya mengalami penurunan sebesar 4%. Penurunan kelompok
kelompok R- tidak berbeda nyata (P>0.05) ke-8 dan berbeda nyata (P<0.05) pada
minggu ke-4.
Persentase monosit setelah masa pemulihan dari radiasi 2.9 mSv
menyebabkan penurunan sebanyak 46% pada kelompok K+ dan peningkatan 21%
pada kelompok R+. kelompok K+ dan R+ setelah pemulihan 2.9 mSv berbeda
nyata (P<0.05) berdasarkan dosis radiasi dan kelompok perlakuan. Pemulihan
setelah radiasi 5.3 mSv menyebabkan peningkatan persentase monosit sebanyak
9% pada kelompok K+ dan 23% pada kelompok R+. Hasil analisa persentase
pemulihan mencit K+ dan R+ setelah radiasi 5.3 mSv berbeda nyata (P<0.05)
berdasarkan kelompok perlakuan dan dosis radiasi.
Persentase monosit pada masa pemulihan minggu 4 mengalami
peningkatan 21% pada kelompok R- dan sama pada kelompok K- dari persentase
sebelum perlakuan. Pemulihan pada minggu 8 menyebabkan peningkatan sebesar
9% pada kelompok K- dan penurunan sebesar 7% pada kelompok R- sebagaimana
dalam tabel 6 dan gambar 17. Hasil analisa mencit K- dan R- berbeda nyata
(P<0.05) berdasarkan jenis perlakuan setelah pemulihan minggu ke-8 namun tidak
berbeda nyata (P>0.05) setelah pemulihan minggu ke-4.
Pengamatan darah perifer pada penelitian ini di ditemukan sel monosit.
Persentase monosit normal pada mencit adalah sekitar 0-3% dari total leukosit
darah (Thrall 2004). Persentase monosit setelah radiasi 2.9 mSv dan 5.3 mSv baik
pada K+ dan R+ berada diatas batas normal monosit pada leukosit darah.
Persentase monosit sebelum perlakuan pada mencit adalah 9.0±2.7%. Hal ini
berarti, persentase monosit mengalami penurunan dari persentase sebelum
perlakuan. Penurunan persentase monosit (monositopenia) dapat diakibatkan oleh
radiasi, anemia aplastik, kemoterapi, dan infeksi parvo virus (Teske 2010).
Monositopenia atau penurunan persentase monosit juga dapat terjadi akibat
induksi virus dan netropenia (Price dan Wilson 2005).
Persentase monosit fase pemulihan setelah radiasi 2.9 mSv mengalami
penurunan 46% pada kelompok K+, berbeda dengan kelompok R+ yang
mengalami peningkatan 21%. Fase pemulihan setelah radiasi 5.3 mSv terjadi
penurunan 19% pada kelompok K+, berbeda dengan kelompok R+ yang
dapat meningkatkan persentase monosit dari radiasi. Hasil analisa pada kelompok
K+ dan R+ baik pemulihan setelah radiasi 2.9 mSv dan 5.3 mSv berbeda nyata
(P<0.05) berdasarkan dosis radiasi dan jenis perlakuan.
Peningkatan monosit (monositosis) ditemukan pada fase penyembuhan
infeksi (Raskin et al. 2004). Monositosis dapat terjadi akibat peradangan akut dan
kronik, destruksi jaringan, dan netrofilia (Teske 2010). Monositosis ditemukan
pada fase penyembuhan infeksi dan pada penyakit granuloma kronik seperti
tuberculosis dan sarkoidosis (Price dan Wilson 2005). Rosela mengandung kadar
antioksidan yang tinggi yaitu berupa vitamin C atau asam askorbat, vitamin A,
flavanoid, dan antosianin yang kemungkinan dapat mengurangi efek radikal bebas
yang ditimbulkan oleh radiasi, sehingga resiko kerusakan akibat radiasi menjadi
berkurang dan persentase monosit dapat meningkat.
NETROFIL
Netrofil Band (muda)
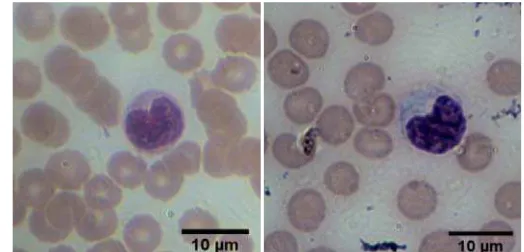
Netrofil band merupakan netrofil yang imatur. Netrofil band memiliki inti
berbentuk tapal kuda, inti halus, sisi sejajar, dan tidak ada penyempitan dalam
membran inti (Thrall 2004). Morfologi sel Netrofil band pada kelompok sebelum
perlakuan, sesudah perlakuan, dan setelah recovery tidak mengalami perbedaan.
Morfologi sel Netrofil band dapat dilihat pada gambar 18.
Gambar 18 morfologi sel netrofil band; A. morfologi sebelum perlakuan; B. morfologi setelah perlakuan; C. morfologi setelah recovery (pemulihan).
Radiasi 2.9 mSv pada minggu ke-4 menyebabkan penurunan persentase
netrofil band hanya sebesar 1% pada kelompok K+ dan peningkatan 9% pada
kelompok R+ dari persentase sebelum perlakuan. Radiasi yang lebih besar pada
minggu ke-8 meningkatkan peresentase peningkatan 2% pada kelompok K+ dan