PENGARUH KOMPOSISI MEDIA DALAM PERTUMBUHAN
PROTOCORM LIKE BODIES
, PLANLET, DAN
AKLIMATISASI
Phalaenopsis amabilis
ERICK RAYNALTA
A24080158
DEPARTEMEN AGRONOMI DAN HORTIKULTURA
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
Phalaenopsis amabilis, known as ‘anggrek bulan’, is one of the most popular kind of orchids and was inaugurated as one of the national flower as 'Puspa Pesona'. The purpose of this study was to determine and study the effects of various tissue culture media composition on Protocorm Like Bodies (PLBs) multiplication, growth of plantlets, and acclimatization of Phalaenopsis amabilis. Basic medium used was a half strengh of Murashige and Skoog (1/2MS) and Hyponex (Hyp) with additional coconut water (CW), benzylaminopurine (BAP), and chitosan. In PLBs multiplication experiments, ½ MS + 15% CW mediumproduced the highest percentage of survival rate. Treatment with ½ MS + 15% CW medium and Hyp. 2 g/l + 15% CW + 2.5 ppm chitosan medium gave the best effect on the fresh weight of plantlets. The composition of the culture medium significantly affect the fresh weight and length of root on 8-WAP(week after planting) in the acclimatization stage.
RINGKASAN
ERICK RAYNALTA.
Pengaruh Komposisi Media Dalam PertumbuhanProtocorm Like Bodies, Planlet, dan Aklimatisasi Phalaenopsis amabilis.
( Dibimbing oleh DEWI SUKMA)
Tujuan dari penelitian ini adalah mengetahui dan mempelajari pengaruh
berbagai komposisi media kultur jaringan dalam proses pertumbuhan clump
protocorm like bodies (PLBs), planlet, dan aklimatisasi Phalaenopsis amabilis.
Penelitian ini dilaksanakan di Laboratorium Kultur Jaringan Tanaman,
Departemen Agronomi dan Hortikultura, Institut Pertanian Bogor pada bulan
April sampai dengan Oktober 2012.
Bahan yang digunakan pada penelitian ini adalah clump PLBs dan planlet
Phalaenopsis amabilis in-vitro asal Kalimantan yang sudah dikulturkan sekitar
1.5 tahun sejak perkecambahan benih dalam media ½ MS (Murashige dan Skoog)
dan disubkultur setiap 3-4 bulan sekali. Rancangan yang digunakan pada
penelitian ini adalah Rancangan Acak Lengkap (RAL). Penelitian ini terdiri atas
dua percobaan, yakni percobaan 1 (Pengaruh Komposisi Media dalam
Pertumbuhan clump PLBs) dan percobaan 2 (Pengaruh Komposisi Media dalam
Pertumbuhan Planlet). Masing-masing percobaan merupakan percobaan dengan
satu faktor perlakuan, yaitu komposisi media kultur jaringan. Setiap percobaan
terdiri dari dua periode kultur (passage) di media perlakuan, dimana setiap
passage adalah selama 8 minggu. Clump PLBs atau planlet awal di tanam
kedalam media perlakuan dan diamati selama 8 minggu (passage 1), selanjutnya
clump PLBs atau planlet disubkultur ke media perlakuan yang sama dan diamati
selama 8 minggu (passage 2). Penelitian ini terdiri atas tiga ulangan setiap
perlakuan, dimana setiap ulangan merupakan satu botol kultur jaringan yang
berisi 3 clumpPLBs atau planlet.
Media yang digunakan pada percobaan 1 adalah ½ MS , ½ MS + 15% air
kelapa, ½ MS + 1.5 ppm BAP, ½ MS + 3 ppm BAP, ½ MS + 15% air kelapa +
1.5 ppm BAP, ½ MS + 15% air kelapa + 3 ppm BAP, Hyponex 2 g/l, Hyponex 2
g/l + 15% air kelapa, Hyponex 2 g/l + 1.5 ppm BAP, Hyponex 2 g/l + 3 ppm
air kelapa + 3 ppm BAP. Media yang digunakan pada percobaan 2 adalah ½ MS ,
½ MS + 15% air kelapa, ½ MS + 2.5 ppm kitosan, ½ MS + 5 ppm kitosan, ½ MS
+ 15% air kelapa + 2.5 ppm kitosan, ½ MS + 15% air kelapa + 5 ppm kitosan,
Hyponex 2 g/l , Hyponex 2 g/l + 15% air kelapa, Hyponex 2 g/l + 2.5 ppm
kitosan, Hyponex 2 g/l + 5 ppm kitosan, Hyponex 2 g/l + 15% air kelapa + 2.5
ppm kitosan, dan Hyponex 2 g/l + 15% air kelapa + 5 ppm kitosan.
Kontaminasi pada percobaan 1 passage 1 sebesar 58.75%, sedangkan pada
passage 2 sebesar 21.05%. Kontaminasi pada percobaan 2 passage 1 sebesar
18.52% , sedangkan pada passage 2 sebesar 24.45%. Kontaminasi pada penelitian
ini disebabkan oleh cendawan dan bakteri.
Pada percobaan 1, komposisi media ½ MS + 15% AK merupakan media
yang menghasilkan clump PLBs hidup tertinggi, yakni 100% pada passage 1 dan
85.71 pada passage 2. Berdasarkan uji F pada taraf 5%, komposisi media tidak
berpengaruh nyata terhadap pertambahan jumlah daun, pertambahan jumlah akar,
dan pertambahan bobot segar clump PLBs usia 8-MST pada passage 1 dan 2
percobaan 1.
Pada percobaan 2, Seluruh komposisi media menghasilkan 100% planlet
hidup. Berdasarkan uji F pada taraf 5%, komposisi media tidak berpengaruh nyata
terhadap pertambahan jumlah daun, pertambahan jumlah akar, dan pertambahan
bobot segar (kecuali pertambahan bobot segar planlet percobaan 2 passage 1)
planlet usia 8-MST pada passage 1 dan 2 percobaan 2. Media optimum
pertambahan bobot planlet pada percobaan 2 passage 1 adalah media ½ MS +
15% AK (1.61 g), ½ MS + 15% AK + 2.5 ppm kitosan (1.17 g), Hyponex 2 g/l +
15% AK (1.46 g), Hyponex 2 g/l + 5 ppm kitosan (1.21 g), Hyponex 2 g/l +
15% air kelapa + 2.5 ppm kitosan (1.59 g), dan Hyponex 2 g/l + 15% AK + 5 ppm
kitosan (1.20 g).
Pada aklimatisasi, planlet yang berasal dari komposisi media ½ MS +
15% AK + 5 ppm kitosan menghasilkan persentase planlet hidup tertinggi yakni
92.59% pada passage 1 dan 100% pada passage 2. Planlet yang berasal dari
percobaan 2 passage 1 dalam komposi media dasar ½ MS atau Hyponex 2 g/l
dengan penambahan air kelapa 15% dan kitosan dengan konsentrasi 2.5 atau 5
media dasar ½ MS atau Hyponex 2 g/l tanpa penambahan air kelapa dan kitosan.
Hal tersebut diduga terjadi karena adanya interaksi positif antara air kelapa dan
kitosan, sehingga planlet yang berasal dari komposisi media dasar ½ MS atau
Hyponex 2 g/l dengan penambahan air kelapa dan kitosan memiliki persentase
hidup yang lebih baik. Penggunaan kitosan dan air kelapa diduga dapat digunakan
sebagai alternatif dalam proses hardening dalam media in-vitro. Menurut
Uthairatanakij et al. (2007), kitosan dapat menurunkan tingkat keparahan penyakit
pada anggrek, mungkin dengan meningkatkan aktifitas PAL (phenylalanine
ammonia-lyase) dan PPO (polyphenol oxidase), lignifikasi yang disebabkan oleh
ditingkatkannya biosintesis senyawa fenol atau diinduksinya metabolit sekunder
dan SAR (systemic acquired resistance).
Berdasarkan uji F, pertambahan jumlah daun dan pertambahan jumlah
akar planlet yang berasal dari percobaan 2 passage 1 menunjukkan hasil yang
tidak berbeda nyata pada taraf 5%. Berdasarkan uji F, pertambahan bobot segar
dan akar terpanjang planlet yang berasal dari percobaan 2 passage 1 menunjukkan
hasil yang berbeda nyata pada taraf 5%. Planlet yang berasal dari media Hyponex
2 g/l + 15% AK + 5 ppm kitosan menghasilkan pertambahan bobot tertinggi pada
passage 1, yakni 0.42 g. Panjang akar terpanjang pada passage 1 dihasilkan oleh
planlet yang berasal dari media ½ MS + 15% AK + 2.5 ppm kitosan,
yakni 4.13 cm.
PENGARUH KOMPOSISI MEDIA DALAM PERTUMBUHAN
PROTOCORM LIKE BODIES
, PLANLET, DAN
AKLIMATISASI
Phalaenopsis amabilis
Skripsi sebagai salah satu syarat
untuk memperoleh gelar Sarjana Pertanian
pada Fakultas Pertanian Institut Pertanian Bogor
ERICK RAYNALTA
A24080158
DEPARTEMEN AGRONOMI DAN HORTIKULTURA
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
ii
Judul:
PENGARUH
KOMPOSISI
MEDIA
DALAM
PERTUMBUHAN
PROTOCORM
LIKE
BODIES,
PLANLET, DAN AKLIMATISASI
Phalaenopsis amabilis
Nama:
ERICK RAYNALTA
NRP :
A24040158
Menyetujui,
Pembimbing
Dr. Dewi Sukma, S.P, M.Si NIP 19700404 199702 2 001
Mengetahui,
Ketua Departemen Agronomi dan Hortikultura Fakultas Pertanian Institut Pertanian Bogor
Dr. Ir. Agus Purwito, M.Sc.Agr NIP. 19611101 198703 1 003
RIWAYAT HIDUP
Penulis dilahirkan di Propinsi DKI Jakarta pada tanggal 2 Desember 1989.
Penulis adalah anak kedua dari Drs. Simon Ramly Sinulingga dan Ir. Korinta
Pinem.
Penulis lulus dari SD Strada van Lith II Jakarta pada tahun 2002,
kemudian penulis melanjutkan pendidikan di SLTPK 5 Penabur Jakarta dan lulus
pada tahun 2005. Selanjutnya penulis lulus dari SMAN 61 Jakarta pada tahun
2008. Penulis mengikuti SPMB pada tahun 2008 dan diterima sebagai mahasiswa
Departemen Agronomi dan Hortikultura, Fakultas Pertanian, Institut Pertanian
iv
KATA PENGANTAR
Puji dan syukur penulis ucapkan kepada Yesus Kristus karena oleh
kasih dan karunia-Nya penulis dapat menyelesaikan penelitian yang berjudul
“Pengaruh Komposisi Media Dalam Pertumbuhan Protocorm Like Bodies,
Planlet, dan Aklimatisasi Phalaenopsis amabilis” dengan baik. Penelitian ini
dibuat sebagai salah satu syarat dalam menyelesaikan pendidikan pada program
studi strata satu Agronomi dan Hortikultura IPB serta untuk memenuhi
keingintahuan penulis mengenai media kultur anggrek yang efektif.
Pada kesempatan ini, penulis mengucapkan terima kasih kepada ibu
tercinta dan alm. ayah tercinta yang telah memberikan dukungan, baik moral
maupun materi kepada penulis. Penulis juga mengucapkan terima kasih kepada
Dr. Dewi Sukma, S.P, M.Si selaku dosen pembimbing skripsi yang telah
mencurahkan sebagian waktunya untuk membimbing dan memberikan
pengarahan kepada penulis selama kegiatan penelitian dan penulisan skripsi ini.
Penulis menyampaikan terima kasih kepada laboran laboratorium kultur jaringan
atas bantuannya selama proses penelitian. Ucapan terima kasih juga penulis
sampaikan kepada teman-teman AGH 45 atas kebersamaan dan dukungan moral
yang tak henti-hentinya diberikan kepada penulis. Semoga hasil penelitian ini
bermanfaat bagi yang memerlukan.
Bogor, Maret 2013
DAFTAR ISI
DAFTAR TABEL ... vii
DAFTAR GAMBAR ... i
DAFTAR LAMPIRAN ... ii
PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan Penelitian ... 2
Hipotesis ... 2
TINJAUAN PUSTAKA ... 3
Anggrek ... 3
Phalaenopsis amabilis ... 4
Teknik Perbanyakan anggrek ... 5
Kultur Jaringan Anggrek ... 5
Sitokinin ... 6
Bahan Organik Kompleks Dalam Media Kultur Jaringan ... 7
Kitosan ... 8
Aklimatisasi ... 9
BAHAN DAN METODE ... 10
Tempat dan Waktu ... 10
Bahan dan Alat ... 10
Metode Penelitian ... 10
Pelaksanaan Penelitian ... 12
Sterilisasi Botol dan Peralatan ... 12
Pembuatan Media Kultur ... 12
Persiapan Ruang Transfer ... 13
Penanaman ... 13
Inkubasi Dalam Ruang Kultur ... 14
Aklimatisasi ... 14
Pengamatan ... 14
HASIL DAN PEMBAHASAN ... 16
Percobaan 1. Pengaruh Komposisi Media dalam Pertumbuhan Clump Protocorm Like Bodies ... 16
Persentase Kontaminasi ... 16
Persentase clump PLBs Hidup ... 17
Pertambahan Jumlah Daun ... 19
Pertambahan Jumlah Akar ... 23
Pertambahan Bobot Segar ... 26
Percobaan 2. Pengaruh Komposisi Media dalam Pertumbuhan Planlet .... 27
Persentase Kontaminasi ... 27
Persentase Planlet Hidup ... 27
Pertambahan Jumlah Daun ... 27
vi
Pertambahan Bobot Segar ... 35
Aklimatisasi ... 36
KESIMPULAN DAN SARAN ... 41
Kesimpulan ... 41
Saran ... 41
DAFTAR PUSTAKA ... 42
DAFTAR TABEL
Nomor Halaman
1. Persentase Clump PLBs Phalaenopsis amabilis Hidup pada
Passage 1 dan 2 ... 18
2. Rata-Rata Pertambahan Jumlah Daun Per Botol Kultur (3 Clump
PLBs) pada Passage 1 ... 21
3. Rata-rata Pertambahan Jumlah Daun Per Botol Kultur (3 Clump
PLBs)pada Passage 2 ... 22
4. Rata-rata Pertambahan Jumlah Akar Per Botol Kultur (3 Clump
PLBs) pada Passage 1 ... 24
5. Rata-rata Pertambahan Jumlah Akar Per Botol Kultur (3 Clump
PLBs) pada Passage 2 ... 25
6. Rata-rata Pertambahan Bobot Segar Per Botol Kultur (3 Clump
PLBs) Phalaenopsis amabilis pada Passage 1 dan 2 ... 26
7. Persentase Planlet Phalaenopsis amabilis yang Hidup pada
Passage 1 dan 2 ... 27
8. Rata-rata Pertambahan Jumlah Daun Per Botol Kultur (3 Planlet)
pada Passage 1 ... 30
9. Rata-rata Pertambahan Jumlah Daun Per Botol Kultur (3 Planlet)
pada Passage 2 ... 31
10. Rata-rata Pertambahan Jumlah Akar Per Botol Kultur (3 Planlet)
pada Passage 1 ... 33
11. Rata-rata pertambahan Jumlah Akar Per Botol Kultur (3 Planlet)
pada Passage 2 ... 34
12. Rata-Rata Pertambahan Bobot Segar Per Botol Kultur (3 Planlet)
Phalaenopsis amabilis pada Passage 1 dan 2 ... 35
13. Persentase Planlet Phalaenopsis amabilis yang Hidup Usia
8-MSA pada Passage 1 dan 2 Percobaan 2 ... 38
14. Pertambahan Bobot Segar, Jumlah Daun, Jumlah Akar, dan Akar
i
DAFTAR GAMBAR
Nomor Halaman
1. Bunga Phalaenopsis amabilis dari Berbagai Ekotipe yang
Berbeda ... 4
2. (A) Kontaminasi yang Disebabkan oleh Bakteri, (B) Kontaminasi
yang Disebabkan oleh Cendawan ... 16
3. Proses Pencoklatan pada PLBs ... 17 4. (A) Kalus Phalaenopsis amabilis Usia 4-MST pada Passage 2,
(B) Clump PLBs Phalaenopsis amabilis yang Berkalus Usia 4-MST pada Passage 2 ... 18
5. Keragaan Planlet dari Clump PLBs Hasil Percobaan 1 Passage 2
usia 8-MST ... 20
6. Planlet dalam botol kultur pada Percobaan 2 Passage 1 Usia
8-MST ... 28
7. Planlet dalam botol kultur pada Percobaan 2 Passage 2 Usia
8-MST ... 28
DAFTAR LAMPIRAN
Nomor Halaman
1. Formulasi Media MS (Murashige dan Skoog, 1962 dalam
Yusnita, 2010) ... 45
2. Alat dan Bahan yang Digunakan ... 45 3. Pertambahan Bobot Segar, Jumlah Daun, Jumlah Akar, dan Akar
Terpanjang 8-MSA pada Passage 2 Percobaan 2 ... 46
1
PENDAHULUAN
Latar Belakang
Indonesia merupakan negara yang sangat kaya akan keanekaragaman
anggrek yang tersebar dalam rimba belantara (Sarwono, 2002). Kurang lebih
sekitar 5,000 jenis anggrek tersebar di seluruh wilayah Indonesia
(Darmono, 2003). Salah satu jenis anggrek yang diminati oleh masyarakat adalah
Phalaenopsis amabilis atau dikenal dengan nama anggrek bulan (Bey et al.,
2006).
Phalaenopsis amabilis memiliki bunga yang berwarna putih susu dengan
labelum berwarna kuning. Kelopak anggrek ini memiliki panjang lebih dari 4 cm
dan lebarnya lebih dari 2.5 cm. Bentuk mahkota bunga ini elips dan bundar pada
bagian atasnya dengan panjang 4.5 cm dan lebar 5 cm. Bunganya yang cukup
besar, mekar serentak, serta daya tahan bunga yang cukup lama, menyebabkan
anggrek ini sering dijadikan tanaman induk untuk persilangan (Djaafarer, 2002).
Teknik perbanyakan yang dapat menghasilkan bibit dalam jumlah besar
dan waktu yang singkat diperlukan karena keberadaan Phalaenopsis amabilis di
alam semakin berkurang akibat dari aktifitas perburuan di alam untuk memenuhi
kebutuhan pasar. Untuk memperoleh bibit dalam jumlah besar dan cepat, metode
kultur jaringan merupakan cara yang tepat dibandingkan dengan cara perbanyakan
lainnya (Iswanto, 2002).
Keberhasilan dalam penggunaan metode kultur jaringan terutama
disebabkan pengetahuan yang lebih baik tentang kebutuhan hara sel dan jaringan
yang dikulturkan. Kebutuhan hara sel dan jaringan tersebut disediakan oleh media
kultur jaringan. Untuk menghasilkan bibit anggrek dengan pertumbuhan yang
optimum maka dibutuhkan komposisi media kultur yang tepat (Gamborg, 1991).
Penelitian mengenai pengaruh bahan organik serta sitokinin pada media
kultur jaringan khususnya anggrek sudah banyak dilakukan. Hasil penelitian Bey
et al. (2006) menunjukkan bahwa perlakuan tunggal air kelapa pada konsentrasi
250 ml/l menghasilkan rerata tinggi kecambah Phalaenopsis amabilis tertinggi,
namun tidak menunjukkan perbedaan yang nyata dengan perlakuan 150 ml/l dan
pada media padat ½ MS, pertumbuhan relatif Grammathophyllum speciosum
tertinggi dicapai pada penambahan kitosan sebesar 25 mg/ l.
Media yang mengandung thidiazuron (TDZ) efektif dalam induksi
langsung embriogenesis pada Phalaenopsis amabilis var. formosa Shimadzu
(Chen dan Chang, 2004). Hasil penelitian Latip et al. (2010) menunjukkan bahwa
persentasi PLBs Phalaenopsis gigantean yang terbentuk dengan penambahan
benzilaminopurin (BAP) secara tunggal lebih rendah dibandingkan dengan
penggunaan TDZ pada konsentrasi yang sama.
Penelitian mengenai komposisi media kultur jaringan ini diharapkan
dapat menghasilkan komposisi media yang sesuai bagi pertumbuhan clump
protocorm like bodies (PLBs), planlet, dan aklimatisasi Phalaenopsis amabilis.
Tujuan Penelitian
Penelitian bertujuan untuk mengetahui dan mempelajari pengaruh
berbagai komposisi media kultur jaringan bagi pertumbuhan clumpPLBs, planlet,
dan aklimatisasi Phalaenopsis amabilis.
Hipotesis
1. Komposisi media berpengaruh terhadap pertumbuhan clump PLBs,
planlet, dan aklimatisasi Phalaenopsis amabilis.
2. Terdapat komposisi media yang optimum dalam pertumbuhan clump
3
TINJAUAN PUSTAKA
Anggrek
Anggrek adalah anggota dari famili Orchidaceae yang merupakan salah
satu famili terbesar selain Asteraceae dan Poaceae (Arditti, 1992) . Famili ini
merupakan salah satu famili bunga-bungaan yang paling besar, memiliki kurang
lebih 43,000 spesies dari 750 genus yang berbeda, dan kurang lebih 5,000
spesiesnya terdapat di Indonesia (Iswanto, 2002), sedangkan Yusnita (2010)
menuliskan bahwa anggrek terdiri dari 750 genera dengan 25,000 hingga 30,000
spesies yang 5,000 spesies di antaranya ada di Indonesia.
Iswanto (2002) menyatakan bahwa penyebaran famili Orchidaceae hampir
meliputi seluruh dunia, kecuali Benua Antartika. Anggrek dapat tumbuh di hutan
hutan gelap, di lereng-lereng terbuka, di batu-batu karang terjal, di batu-batu
daerah pantai dengan garis pasang surut tinggi, atau tepi gurun pasir.
Darmono (2003) mengelompokkan anggrek menjadi empat kelompok
berdasarkan habitatnya, yaitu:
1. Anggrek epifit, yaitu anggrek yang tumbuh menumpang pada pohon lain
tanpa merugikan inangnya.
2. Anggrek terestrial, yaitu anggrek yang tumbuh di permukaan tanah dan
membutuhkan cahaya matahari langsung
3. Anggrek saprofit, yaitu anggrek yan tumbuh pada media yang
mengandung humus serta daun-daun kering, serta membutuhkan sedikit
cahaya matahari.
4. Anggrek litofit, yaitu anggrek yang tumbuh pada batu-batuan serta tahan
terhadap cahaya matahari penuh dan hembusan angin kencang, misalnya
Dendrobium phalaenopsis.
Yusnita (2010) menambahkan kelompok habitat anggrek menurut Darmono
(2010), yakni anggrek tipe semi-aquatic. Menurut Arditti (1992) dari banyak
spesies anggrek, sekitar 25% terrestrial, 70% epifit, dan 5% lainnya dapat hidup
pada berbagai jenis substrat, termasuk bebatuan.
Perbedaan anggrek dengan tanaman lainnya menurut Iswanto (2002) ada
sepalum atau daun kelopak bunga. Satu buah sepalum yang terletak di punggung
dinamakan daun kelopak punggung atau sepalum dorsale. Dua lainnya dinamakan
daun kelopak samping atau sepala lateralia. Daun mahkota atau petala anggrek
berjumlah tiga. Letak petala berseling dengan sepala. Di antara ketiga petala
terdapat bagian yang disebut labelum atau bibir bunga. Di pusat bunga terdapat
alat yang berfungsi sebagai alat kelamin jantan dan betina yang menjadi satu
bagian. Alat kelamin jantan dinamakan stemona atau benang sari, sedangkan alat
kelamin betina dinamakan tangkai putik atau gynostemium.
Phalaenopsis amabilis
Anggrek Phalaenopsis amabilis (Gambar 1) banyak terdapat di Indonesia,
Filipina, dan Australia. Di Indonesia hampir semua pulau dapat dijumpai anggrek
ini antara lain Sumatera, Kalimantan, Sulawesi, Ambon, Buru, Timor, Papua, dan
Jawa (Djaafarer, 2003). Handoyo (2010) menambahkan bahwa Phalaenopsis
amabilis juga terdapat di Pulau Mentawai.
Gambar 1. Bunga Phalaenopsis amabilis dari Berbagai Ekotipe yang Berbeda
Phalaenopsis amabilis yang dikenal dengan nama anggrek bulan ini
pertama kali ditemukan oleh seorang ahli botani dari Belanda yang bernama Dr.
5
yaitu “phalaenos” yang berati ngengat, dan “opsis” yang berarti bentuk. Blume
memberikan nama tersebut karena dia melihat tanaman yang dilihatnya tersebut
memiliki bentuk seperti ngengat/ kupu-kupu. (Djaafarer, 2003).
Phalaeopsis amabilis tumbuh sebagai tumbuhan epifit dengan tipe
pertumbuhan monopodial (Iswanto, 2001). Anggrek ini tumbuh pada ketinggian
antara 0-600 dpl ( Handoyo, 2010).
Teknik Perbanyakan Anggrek
Perbanyakan anggrek secara umum dibagi menjadi dua, yakni
perbanyakan generatif dan vegetatif. Menurut Iswanto (2002), perbanyakan
generatif adalah perbanyakan yang menggunakan organ biji, sedangkan
perbanyakan vegetatif adalah perbanyakan yang menggunakan organ tumbuhan
selain biji (stek, keiki, pemisahan rumpun dan kultur jaringan).
Secara alami, biji anggrek sulit berkecambah tanpa adanya bantuan
mikoriza. Penyebab sulitnya pengecambahan biji anggrek disebabkan oleh biji
anggrek tidak memiliki endosperma atau cadangan makanan (Darmono, 2002),
padahal cadangan makanan sangat diperlukan untuk perkecambahan dan
pertumbuhan awal biji (Sarwono, 2002). Untuk dapat mengecambahkan biji
anggrek, diperlukan teknik dalam penyediaan nutrisi dalam lingkungan aseptik
untuk menghindari kontaminasi oleh mikroorganisme (Darmono, 2002).
Perbanyakan anggrek secara vegetatif dapat dilakukan dengan pemisahan
rumpun, menggunakan keiki, stek batang, stek tangkai bunga, perbanyakan
dengan akar, perbanyakan dengan umbi, dan kultur jaringan (Soeryowinoto dan
Soeryowinoto, 1977). Dibandingkan dengan perbanyakan vegetatif lainnya, kultur
jaringan dapat menghasilkan bibit dalam jumlah yang lebih banyak (Iswanto,
2002).
Kultur Jaringan Anggrek
Kultur jaringan didasarkan atas suatu konsep yang dikemukakan oleh
Scleiden dan Schwan, yaitu bahwa tiap-tiap sel dari manapun saja diambil akan
mampu untuk berkembang menjadi tanaman yang sempurna jika diletakkan pada
jaringan pertama kali diperkenalkan oleh seorang ilmuan Prancis yang bernama
George Morel pada tahun 1960 (Sarwono, 2002).
Keberhasilan dalam penggunaan metode kultur jaringan terutama
disebabkan pengetahuan yang lebih baik tentang kebutuhan hara sel dan jaringan
yang dikulturkan. Kebutuhan hara sel dan jaringan tersebut disediakan oleh media
kultur jaringan. Untuk menghasilkan bibit anggrek dengan pertumbuhan yang
optimum maka dibutuhkan komposisi media kultur yang tepat. Hara terdiri dari
komponen utama (garam mineral, sumber karbon dari gula, vitamin dan pengatur
tumbuh) dan tambahan (senyawa nitrogen organik, asam organik, metabolit, dan
ekstrak tambahan) (Gamborg, 1991).
Dalam penelitian Young et al. (2002), media MS dan Hyponex
menghasilkan persentase tertinggi dalam jumlah PLBs Phalaenopsis
dibandingkan dengan media KC, LM, dan VW. Percobaan Puspitaningtyas et al.
(2006), juga menunjukkan bahwa biji anggrek P. serpentilingua dapat
berkecambah baik pada media MS dan Hyponex.
Penambahan gula diperlukan sebagai sumber karbon. Menurut Gamborg
(1991), Sukrosa atau glukosa 2-4% merupakan sumber karbon paling cocok. Hasil
penelitian Pimsen dan Kanchanapoom (2011), menunjukkan bahwa pada kultur
Grammatophyllum speciosum, pemberian sukrosa sebanyak 2% dalam media MS
menghasilkan daya tahan hidup PLBs sebesar 84% dan memproduksi 3.1 PLBs/
eksplan.
Sitokinin
F. Skoog dan C. O. Miller menemukan suatu zat yang dapat merangsang
pembelahan sel pada penelitian mereka. Skoog dan Miller meneliti senyawa yang
dapat menumbuhkan kalus yang berasal dari empulur tembakau. Penelitiannya
menyatakan bahwa media dasar yang ditambah dengan air kelapa, ekstrak ragi,
dan IAA sangat mendorong pertumbuhan kalus yang cukup lama (Watimena,
1988). Sitokinin ditemukan pada penelitian selanjutnya yang dilakukan pada
tahun 1955 oleh para peneliti di Universitas Wisconsin ketika mengisolasi kinetin
7
dan beberapa substansi sintetik yang memiliki persamaan aktivitas biologis telah
ditemukan (Srivastava, 2002).
Menurut Hendaryono dan Wijayani (1994), sitokinin berfungsi dalam
memacu proses pembentukan tunas yang berasal dari jaringan kalus, daun,
potongan batang atau kotiledon. Pengaruh sitokinin di dalam kultur in-vitro
menurut Widyastuti dan Tjokrokusumo (2001), antara lain berhubungan dengan
proses pembelahan sel, proliferasi tunas ketiak, penghambatan pertumbuhan akar
tanaman dan induksi umbi mikro kentang. Dari hasil-hasil percobaan yang telah
dilakukan, terbukti bahwa 75% spesies tanaman membentuk tunas jika
menggunakan kinetin atau BAP dengan konsentrasi antara 0.5-46 uM
(Hendaryono dan Wijayani, 1994).
Pada anggrek, sitokinin telah digunakan untuk memulai dan menjaga
stabilitas kultur jaringan serta menambah planlet dari pucuk lateral perbungaan
Phalaenopsis. Selain itu sitokinin juga berfungsi dalam menginduksi pembungaan
pada beberapa Dendrobium dan Aranda hibrida serta meningkatkan jumlah
pucuk lateral yang dibentuk oleh tumbuhan Paphiopedillum (Arditti 1992).
BAP dan TDZ adalah zat pengatur tumbuh sintetik dari golongan
sitokinin yang biasa dipakai dalam perbanyakan in-vitro untuk menstimulasi
pembelahan sel dan multiplikasi tunas (George,1993). Syahid dan Kristina (2008)
menyimpulkan bahwa perlakuan dua zat pengatur tumbuh dapat bekerja secara
sinergis pada konsentrasi yang tepat, penambahan TDZ pada konsentrasi 0,05
mg/l–0,15 m/l ke dalam media yang sudah mengandung BAP 0,1 mg/l
meningkatkan jumlah tunas dan berbeda nyata dengan perlakuan BAP 0,1 mg/l +
TDZ 0,01 maupun kontrol pada kultur jaringan tanaman lempuyung.
Bahan Organik Kompleks Dalam Media Kultur Jaringan
Komponen bahan organik kompleks adalah kelompok dari suplemen yang
tidak terdefinisi seperti kasein hidrolisat, air kelapa, jus jeruk, jus tomat, jus
anggur, jus nanas, sap dari birch, puree pisang, dan lain-lain (Beyl, 2005).
Menurut Gamborg (1991), bahan-bahan tersebut dapat menyuplai berbagai
dapat tumbuh baik dalam medium tanpa pelengkap ini apabila kadar garam cukup
tinggi.
Campuran bahan organik kompleks digunakan sebagai sumber organik
dari nitrogen, seperti kasein hidrolisat, campuran lebih dari 20 asam amino yang
berbeda dan ammonium (0.1-1.0 g/l), pepton (0.25-3.0 g/l), tripton (0.25-2.0 g/l),
dan ekstrak malt (0.5-1.0 g/l). Campuran tersebut sangat kompleks dan
mengandung vitamin sebaik asam amino (Beyl, 2005).
Efek penghambatan dari senyawa polifenol dapat dicegah dengan
penambahan polyvinylpyrrolidone (PVP). Menurut Beyl (2005), PVP dapat
digunakan dalam media kultur jaringan untuk mengurangi efek penghambatan
dari polifenol dengan jumlah 250-1000 mg/l.
Hasil penelitian Maslukhah (2008) menunjukkan bahwa penambahan
ekstrak pisang 50 g/l dalam media kultur jaringan pisang raja bulu lebih bagus
pengaruhnya pada parameter panjang akar, jumlah tunas, jumlah daun, dan jumlah
akar dibandingkan konsentrasi yang lebih tinggi. Hasil penelitian Parera (1997)
menunjukkan bahwa pada Dendrobiumspp., pemberian air kelapa sebanyak 20%
memberikan respon terbaik dalam pertumbuhan dan perbanyakan tunas mikro.
Kitosan
Kitosan adalah senyawa turunan dari kitin yang terdeasetilasi pada gugus
nitrogennya. Deasetilasi yang terjadi pada kitin hampir tidak pernah selesai
sehingga dalam kitosan masih ada gugus asetil yang terikat pada beberapa gugus
N (nitrogen). Seperti selulosa dan kitin, kitosan merupakan polimer alamiah yang
sangat melimpah keberadaannya di alam (Kusumawati, 2009).
Menurut Kusumawati (2009), salah satu manfaat kitosan adalah pada
bidang pertanian. Kitosan menawarkan alternatif alami dalam penggunaan bahan
kimia yang terkadang membahayakan lingkungan dan manusia. Kitosan
membangun mekanisme pertahanan pada tumbuhan, menstimulasi pertumbuhan
dan merangsang enzim tertentu (sintesa fitoaleksin, kitinase, pektinase, glukanase
dan lignin).
Melihat manfaat kitosan yang dikemukakan oleh Kusumawati (2009)
9
Uthairatanakij et al. (2007) menyimpulkan bahwa kitosan dapat digunakan
sebagai pemacu pertumbuhan anggrek kususnya untuk tanaman muda dalam
media kultur jaringan. Kitosan meningkatkan panjang tangkai dari Dendrobium
‘Missteen’. Mungkin kitosan menginduksi sinyal untuk menyintesis hormon
tumbuhan seperti giberelin. Meskipun demikian, efek kitosan dalam pertumbuhan
dan perkembangan anggrek dewasa bersifat tidak tetap.
Aklimatisasi
Aklimatisasi berarti proses pengadaptasian tanaman ke lingkungan baru
yang kondisi lingkungannya berbeda dari sebelumnya (Yusnita, 2010). Menurut
Darmono (2003), aklimatisasi merupakan saat yang paling kritis dalam
perbanyakan tanaman secara in-vitro karena peralihan dari heterotrophy ke
autotroph.
Aklimatisasi dapat dilakukan pada kultur anggrek yang sudah memiliki
perakaran (Sandra, 2003), panjangnya sekitar 5-8 cm, dan mempunyai 3-5 daun
membuka (Yusnita, 2010). Anggrek dikeluarkan dari botol secara hati-hati
menggunakan pinset dan setelah itu dicuci bersih menggunakan air mengalir
hingga tidak ada lagi sisa agar-agar yang menempel di akar karena hal ini akan
merangsang pertumbuhan jamur (Sandra, 2003).
Aklimatisasi bibit anggrek memerlukan media tanaman tertentu yang
sifatnya porous, tidak mudah terdekomposisi, mempunyai kemampuan memegang
air dan hara cukup tinggi, tidak menjadi sumber inokulum cendawan patogen, dan
mudah diperoleh dalam jumlah yang dibutuhkan (Yusnita, 2010). Penelitian
Venturieri dan Arbieto (2011) menyimpulkan bahwa media cacahan pakis dan
sphagnum moss merupakan media terbaik dalam aklimatisasi Phalaenopsis
amabilis. Pot yang digunakan untuk menanam anggrek sebaiknya pot tanah liat
karena sifatnya yang mudah menyerap air sehingga kelebihan air siraman dapat
BAHAN DAN METODE
Tempat dan Waktu
Penelitian ini dilaksanakan di Laboratorium Kultur Jaringan Tanaman,
Departemen Agronomi dan Hortikultura, Institut Pertanian Bogor pada bulan
April sampai Oktober 2012.
Bahan dan Alat
Bahan yang digunakan pada penelitian ini adalah clump PLBs dan planlet
Phalaenopsis amabilis in-vitro asal Kalimantan yang sudah dikulturkan sekitar
1.5 tahun sejak perkecambahan benih dalam media ½ MS dan disubkultur setiap
3-4 bulan sekali, larutan stok media Murashige & Skoog (Lampiran 1), pupuk
daun Hyponex 20:20:20, kitosan 1000 ppm, BAP, air kelapa, gula, PVP,
agar-agar, air destilata, alkohol 70%, alkohol 96%, botol kultur, plastik mika, karet
gelang, pot tanah liat berdiameter 15 cm, sphagnum moss, bakterisida, dan
fungisida.
Alat-alat yang digunakan pada penelitian ini adalah gelas ukur, pipet,
cawan petri, pinset, laminar air-flow cabinet, autoklaf, bunsen, timbangan
analitik, pH meter, magnetic stirrer, dan kompor (Lampiran 2).
Metode Penelitian
Penelitian ini terdiri atas dua percobaan, yakni percobaan 1 (Pengaruh
Komposisi Media dalam Pertumbuhan clump PLBs) dan percobaan 2 (Pengaruh
Komposisi Media dalam Pertumbuhan Planlet). Masing-masing percobaan
merupakan percobaan dengan satu faktor perlakuan, yaitu komposisi media
kultur jaringan. Setiap percobaan terdiri dari dua periode kultur (passage) di
media perlakuan, dimana setiap passage adalah selama 8 minggu. Clump PLBs
atau planlet awal ditanam kedalam media perlakuan dan diamati selama 8
minggu (passage 1). Kemudian setelah itu, clump PLBs atau planlet disubkultur
11
Percobaan pertama terdiri atas 12 komposisi media perlakuan dengan 3
ulangan pada setiap perlakuan, sehingga terdapat 36 satuan percobaan. Setiap
ulangan dalam percobaan pertama merupakan satu botol media perlakuan yang
diisi dengan tiga massa (clump) PLBs, sehingga terdapat 108 sampel pengamatan.
Percobaan kedua juga terdiri atas 12 komposisi media perlakuan dengan 3
ulangan setiap perlakuannya, sehingga terdapat 36 satuan percobaan. Setiap
ulangan dalam percobaan kedua merupakan satu botol media perlakuan yang diisi
dengan tiga planlet sehingga terdapat total 108 unit pengamatan.
Media yang digunakan pada percobaan 1 adalah ½ MS , ½ MS + 15% air
kelapa, ½ MS + 1.5 ppm BAP, ½ MS + 3 ppm BAP, ½ MS + 15% air kelapa +
1.5 ppm BAP, ½ MS + 15% air kelapa + 3 ppm BAP, Hyponex 2 g/l, Hyponex 2
g/l + 15% air kelapa, Hyponex 2 g/l + 1.5 ppm BAP, Hyponex 2 g/l + 3 ppm
BAP, Hyponex 2 g/l + 15% air kelapa + 1.5 ppm BAP, dan Hyponex 2 g/l + 15%
air kelapa + 3 ppm BAP. Media yang digunakan pada percobaan 2 adalah ½ MS ,
½ MS + 15% air kelapa, ½ MS + 2.5 ppm kitosan, ½ MS + 5 ppm kitosan, ½ MS
+ 15% air kelapa + 2.5 ppm kitosan, ½ MS + 15% air kelapa + 5 ppm kitosan,
Hyponex 2 g/l , Hyponex 2 g/l + 15% air kelapa, Hyponex 2 g/l + 2.5 ppm
kitosan, Hyponex 2 g/l + 5 ppm kitosan, Hyponex 2 g/l + 15% air kelapa + 2.5
ppm kitosan, dan Hyponex 2 g/l + 15% air kelapa + 5 ppm kitosan. Setiap media
pada perlakuan- perlakuan tersebut ditambahkan gula sebanyak 30 g/l, agar-agar
sebanyak 7 g/l, dan PVP sebanyak 0.5 g/l.
Pengolahan data dilakukan dengan uji F menggunakan perangkat lunak
SAS (Statistical Analysis System). Setelah uji F kemudian dilakukan uji lanjut jika
hasilnya berbeda nyata dengan menggunakan uji DMRT (Duncan Multiple Range
Test) pada taraf nyata 5 %. Adapun model statistika yang digunakan adalah
sebagai berikut :
Keterangan :
i = 1, 2, …, 12 ; j = 1, 2, …, 12
=
Respon pengamatan perlakuan ke-i ulangan ke-j=
pengaruh perlakuan ke-i
=
pengaruh galat percobaan perlakuan ke-i, ulangan ke-jPelaksanaan Penelitian
Sterilisasi Botol dan Peralatan
Kultur jaringan adalah kegiatan yang membutuhkan kondisi steril dalam
pelaksanaannya. Botol kultur, cawan petri, dan alat tanam yang akan digunakan
dicuci dengan menggunakan deterjen. Botol kultur, cawan petri, dan alat tanam
yang telah dicuci kemudian disterilisasi menggunakan autoklaf selama 50 menit
dengan temperatur 121°C pada tekanan 17.5 psi.
Alat tanam dan cawan petri dibungkus dengan kertas sebelum
disterilisasi menggunakan autoklaf. Setelah sterilisasi selesai, alat tanam dan
cawan petri yang langsung digunakan disemprot terlebih dahulu menggunakan
alkohol 70% sebelum dimasukkan kedalam laminar air flow cabinet. Alat dan
cawan petri yang tidak langsung digunakan dimasukkan kedalam oven dengan
suhu 50°C.
Pembuatan Media Kultur
Media kultur ½ MS dibuat dengan memipet larutan stok sesuai dengan
volume takaran untuk media Murashige dan Skoog (MS).Media Hyponex dibuat
dengan menimbang 2 g pupuk menggunakan timbangan analitik. Pupuk yang
telah ditimbang dilarutkan menggunakan akuades pada gelas ukur.
Media dibuat sesuai dengan perlakuan sebanyak setengah liter untuk setiap
perlakuannya. Setiap media yang dibuat ditambahkan sebanyak 30 g/l gula dan
0.5 g/l PVP. Sebelum agar-agar sebanyak 7 g/l ditambahkan, pH diatur menjadi
5.9 dengan mengunakan HCl atau KOH. Media yang telah dicampur dengan
agar-agar dimasak hingga mendidih, kemudian dimasukkan ke dalam botol kultur
dan ditutup dengan plastik yang diikat dengan karet pada bagian leher botol.
Media dalam botol diautoklaf kembali selama 20 menit pada suhu 121°C
13
kedalam ruang kultur, media didiamkan selama satu minggu sebelum digunakan
untuk mengetahui bahwa media yang dibuat telah benar-benar bebas kontaminan.
Persiapan Ruang Transfer
Sebelum penanaman bahan tanam dilakukan, laminar air flow cabinet
yang akan digunakan terlebih dahulu disterilisasi. Langkah-langkah dalam
sterilisasi antara lain:
1. Blower pada laminar air flow cabinet dinyalakan
2. Ruang pada laminar air flow cabinet disemprot dengan alkohol 70%, lalu
diusap menggunakan tisu
3. Lampu UV dinyalakan selama 1 jam
4. Alat tanam dan bahan yang akan digunakan disemprot dengan alkohol
70% sebelum dimasukkan kedalam laminar air flow cabinet.
Penanaman
Percobaan 1 (Pengaruh komposisi media dalam pertumbuhan clump
PLBs), dilaksanakan dengan cara memindahkan sebanyak 3 clump PLBs dari
media sebelumnya ke dalam media perlakuan dalam laminar air flow cabinet.
Botol kultur ditimbang sebelum dan setelah subkultur agar bobot awal clump
PLBs diketahui. Pada minggu ke-8 dilakukan subkultur clump PLBs ke dalam
media perlakuan yang sama.
Percobaan 2 (Pengaruh Komposisi Media Dalam Pertumbuhan Planlet),
dilaksanakan dengan memindahkan atau menyubkultur planlet Phalaenopsis
amabilis dari media sebelumnya ke media perlakuan dalam laminar air flow
cabinet. Botol kultur ditimbang sebelum dan setelah subkultur untuk mengetahui
bobot planlet. Pada minggu ke-8 dilakukan subkultur planlet ke dalam media
perlakuan yang sama atau diaklimatisasi bagi planlet yang sudah cukup kuat. Pada
Inkubasi Dalam Ruang Kultur
Clump PLBs atau planlet yang telah di tanam dalam media perlakuan
kemudian ditumbuhkan dalam ruang kultur pada rak-rak yang tersedia di
dalamnya. Cahaya yang dibutuhkan tanaman bersumber dari lampu fluorescent
dengan intensitas cahaya 1000-2000 lux. Ruang kultur dilengkapi dengan
pendingin ruangan yang suhunya dapat diatur sesuai dengan kebutuhan tanaman.
Umumnya suhu untuk menumbuhkan tanaman di dalam ruang kultur
membutuhkan suhu berkisar antara 24-30°C.
Aklimatisasi
Aklimatisasi dilakukan setelah planlet terlihat siap untuk diaklimatisasi.
Planlet yang diaklimatisasi berasal dari percobaan 2 passage 1 dan 2. Planlet
yang akan diaklimatisasi dikeluarkan dari dalam botol untuk dicuci dan
dibersihkan dari agar-agar yang menempel. Setelah dibersihkan, planlet direndam
selama 2 menit pada larutan Agrept (2 g/l) dan Dithane M-45 (2 g/l). Planlet yang
telah direndam kemudian dikeluarkan dan dikeringanginkan selama 15 menit.
Planlet selanjutnya ditanam pada media sphagnum moss yang berada dalam pot
tanah liat. Planlet yang diaklimatisasi disiram dua kali sehari dan dipupuk
menggunakan Gandasil D dengan konsentrasi 2 g/l seminggu sekali.
Pengamatan
Pengamatan yang dilakukan pada percobaan 1 dan 2 meliputi:
1. Persentase clump PLBs atau planlet hidup.
Pengamatan dilakukan selama dua periode kultur (passage) di media
perlakuan in-vitro, dengan satu passage adalah selama 8 minggu.
Pengamatan dilakukan pada saat akhir passage 1 dan akhir passage 2
untuk percobaan 1 dan 2. Persentase clump PLBs atau planlet yang hidup
dalam media perlakuan in-vitro merupakan perhitungan dari setiap botol
perlakuan yang tidak terkontaminasi. Pada tahap aklimatisasi planlet yang
berasal dari percobaan 2 passage 1 dan 2, pengamatan persentase planlet
15
2. Bobot segar clump PLBs atau planlet.
Pengamatan dilakukan pada awal passage 1, akhir passage 1, awal
passage 2, dan akhir passage 2 untuk percobaan 1 dan 2 in-vitro. Bobot
clump PLBs atau planlet dalam media perlakuan in-vitro diketahui dengan
cara mengurangi bobot botol media yang telah diisi clump PLBs atau
planlet dengan bobot botol yang hanya berisi media. Pada tahap
aklimatisasi planlet yang berasal dari percobaan 2 passage 1 dan 2, planlet
ditimbang pada awal aklimatisasi dan akhir aklimatisasi.
3. Jumlah daun dan akar yang terbentuk.
Pengamatan dilakukan setiap minggu untuk percobaan 1 dan 2 dengan
cara menghitung jumlah daun dan akar total yang sudah terbentuk
sempurna (saat berada dalam media in-vitro pada passage 1 dan 2) dalam
satu botol (ulangan), dimana setiap botol berisi 3 clump PLBs atau planlet.
Pada tahap aklimatisasi planlet yang berasal dari percobaan 2 passage 1
dan 2, pengamatan jumlah daun dilakukan pada awal dan akhir
aklimatisasi.
4. Akar terpanjang planlet.
Akar terpanjang planlet yang berasal dari percobaan 2 passage 1 dan 2
diukur pada akhir aklimatisasi.
5. Persentase kontaminasi
Botol kultur yang terkontaminasi dihitung jumlahnya mulai dari awal
hingga akhir penelitian dalam media in-vitro.
HASIL DAN PEMBAHASAN
Percobaan 1. Pengaruh Komposisi Media dalam Pertumbuhan Clump Protocorm Like Bodies
Persentase Kontaminasi
Persentase kontaminasi pada passage 1 dalam percobaan ini sebesar
58.75%. Kontaminasi disebabkan oleh cendawan dan bakteri (Gambar 2) yang
tumbuh pada permukaan media. Besarnya kontaminasi ini diduga disebabkan oleh
kekuranghati-hatian saat memindahkan bahan tanam ke media perlakuan dalam
laminar air flow cabinet, kondisi ruang kultur yang kurang steril, dan pencucian
botol kultur yang kurang sempuna. Kontaminasi yang disebabkan oleh pencucian
botol yang kurang sempurna tersebut, ditandai oleh munculnya koloni cendawan
atau bakteri dari dinding botol. Menurut Yusnita (2010), pencucian botol yang
kurang sempurna menyebabkan kontaminasi bakteri atau cendawan pada dinding
botol yang biasanya terjadi beberapa minggu atau bulan setelah media disterilkan.
A B
Gambar 2. (A) Kontaminasi yang Disebabkan oleh Bakteri, (B) Kontaminasi yang Disebabkan oleh Cendawan
Persentase kontaminasi pada passage 2 adalah sebesar 21.05%. Turunnya
persentase kontaminasi diduga disebabkan oleh kondisi ruang kultur yang lebih
steril setelah fumigasi dilakukan sehingga memperkecil kemungkinan masuknya
17
Persentase clump PLBs Hidup
Sebagian besar clump PLBs yang ditanam pada passage 1 yang terbebas
dari kontaminasi, menunjukkan kemampuannya untuk beregenerasi. Kemampuan
regenerasi tersebut ditunjukkan dengan bertambahnya ukuran dari clump PLBs
yang ditanam. Selain itu pada beberapa media sudah mulai terlihat munculnya
daun dan akar. Perubahan warna clump PLBs terjadi pada beberapa media
perlakuan yakni, dari warna hijau menjadi warna hijau muda dan bahkan ada yang
tampak memutih. Pada usia 6 MST dalam passage 1 beberapa clump PLBs
mengalami gejala pencoklatan (Gambar 3). Gejala pencoklatan tersebut diduga
terjadi karena akumulasi senyawa fenol yang teroksidasi akibat adanya perlukaan
yang ditimbulkan saat pemisahan clump PLBs sebelum dimasukkan ke dalam
media perlakuan. Menurut Ling et al. (2007), PLBs Phalaenopsis sangat sensitif
terhadap perlukaan yang mengarah pada terjadinya oksidasi fenol dan pencoklatan
jaringan.
Gambar 3. Proses Pencoklatan pada PLBs
Persentase clump PLBs hidup pada passage 1 (Tabel 1) tertinggi dicapai
oleh perlakuan ½ MS + 15% AK dan perlakuan Hyponex 2 g/l + 1.5 ppm BAP
yakni 100%, sedangkan persentase clump PLBs hidup terendah dicapai oleh
perlakuan ½ MS dan perlakuan Hyponex 2 g/l + 15% AK + 3 ppm BAP, yakni
66.67%.
Pada passage 2 (Tabel 1), clump PLBs yang mengalami kematian
lebih besar dibandingkan dengan pada passage 1. Sebagian clump PLBs
A B
Gambar 4. (A) Kalus Phalaenopsis amabilis Usia 4-MST pada Passage 2, (B)
Clump PLBs Phalaenopsis amabilis yang Berkalus Usia 4-MST pada Passage 2
Setelah kalus terbentuk, semakin lama kalus berubah warna menjadi kecoklatan
dan akhirnya mati. Sebagian clump PLBs yang tidak membentuk kalus juga
mengalami kematian. Persentase clump PLBs hidup pada passage 2 tertinggi
dicapai oleh perlakuan ½ MS + 15% AK sebesar 85.71%, sedangkan persentase
clump PLBs hidup terendah dicapai oleh komposisi media ½ MS dan Hyponex 2
g/l, yakni sebesar 33.33%.
Tabel 1. Persentase Clump PLBs Phalaenopsis amabilis Hidup pada Passage
1 dan 2
Perlakuan
Clump PLBs Hidup
passage 1 passage 2
% h/t % h/t
½ MS 66.67 (12/18) 33.33 (6/18)
½ MS + 15% AK 100.00 (27/27) 85.71 (18/21)
½ MS + 1.5 ppm BAP 80.00 (24/30) 60.00 (18/30)
½ MS + 3 ppm BAP 75.00 (18/24) 77.78 (21/27)
½ MS + 15% AK + 1.5 ppm BAP 83.33 (15/18) 50.00 (9/12) ½ MS + 15% AK + 3 ppm BAP 87.50 (21/24) 66.67 (12/18)
Hyp. 2 g/l 70.00 (21/30) 33.33 (9/27)
Hyp. 2 g/l + 15% AK 87.50 (21/24) 42.86 (9/21)
19
Jika dibandingkan dengan media ½ MS dan Hyponex 2 g/l, seluruh media
yang menggunakan BAP (Tabel 1) menunjukkan persentase clump PLBs hidup
yang lebih baik kecuali komposisi media Hyponex 2 g/l + 15% AK + 3 ppm BAP
pada passage 1. BAP diduga mendorong keberhasilan hidup clump PLBs. Hasil penelitian Latip et al. (2010) menunjukkan bahwa BAP pada konsentrasi 1.5 ppm,
3 ppm, dan 3.5 ppm menghasilkan persentase PLBs Phalaenopsis gigantea mati
terendah dibandingkan dengan perlakuan sitokinin lainnya.
Pertambahan Jumlah Daun
Jumlah daun yang tumbuh dapat menggambarkan jumlah tunas yang
muncul. Munculnya daun terjadi setelah PLBs bertunas dan pada akhirnya tunas
tersebut membentuk daun. Menurut Yusnita (2010), PLBs memiliki titik tumbuh
tunas pada bagian atas yang makin lama menunjukkan primordial daun pada
pucuknya.
Pertambahan jumlah daun clump PLBs pada percobaan ini, merupakan
jumlah daun total per botol kultur n-MST dikurangi dengan jumlah daun awal per
botol kultur (0-MST). Pada Tabel 2 tersaji data rata-rata pertambahan jumlah daun
pada percobaan 1 passage 1. Hasil uji F pada passage 1 menunjukkan bahwa
komposisi media tidak berpengaruh nyata terhadap pertambahan jumlah daun
pada minggu ke-1, 2, 3, 4, 5, dan 8. Hasil uji F pada minggu ke 6 dan 7 pada
passage 1 menunjukkan hasil yang berbeda nyata pada taraf 5 %. Media yang
memiliki rata-rata pertambahan jumlah daun tertinggi pada minggu ke-6 dan
minggu ke-7 adalah Hyponex 2 g/l + 1.5 ppm BAP, sedangkan komposisi media
Hyponex 2 g/l + 15% AK + 1.5 ppm BAP menghasilkan pertambahan jumlah
daun terendah. Pada komposisi media Hyponex 2 g/l + 15% AK + 1.5 ppm BAP
jumlah daun mengalami penurunan mulai minggu ke-3 hingga minggu ke-6 akibat
gugurnya daun terdahulu tanpa adanya daun baru yang muncul. Rata-rata
pertambahan jumlah daun usia 8-MST pada passage 1 dalam berbagai komposisi
media perlakuan berkisar antara 0.67-13.00 daun.
Pada percobaan 1 passage 2, pengolahan data pertambahan jumlah daun
secara statistik tidak dilakukan pada komposisi media ½ MS dan Hyponex 2 g/l +
tersebut kurang dari jumlah yang dibutuhkan. Hasil uji F pada seluruh komposisi
media setiap minggunya menunjukkan hasil yang tidak berbeda nyata (Tabel
3). Hasil rata-rata jumlah daun dalam komposisi media Hyponex 2 g/l + 15% AK
+ 1,5 ppm BAP menunjukkan hasil negatif pada minggu ke-3, 4, 5, 6, dan 7
disebabkan oleh jumlah daun pada minggu tersebut kurang dari jumlah daun
awal. Rata-rata pertambahan jumlah daun usia 8-MST pada passage 2 dalam
berbagai komposisi media berkisar antara 4.67-28.67 daun. Gambar planlet dari
PLBs hasil percobaan 1 passage 2 dapat dilihat pada Gambar 5.
Keterangan: P1 : ½ MS , P2 : ½ MS + 15% air kelapa, P3 : ½ MS + 1.5 ppm BAP, P4 : ½ MS + 3 ppm BAP, P6 : ½ MS + 15% air kelapa + 3 ppm BAP, P7 :
Hyponex 2 g/l, P8 : Hyponex 2 g/l + 15% air kelapa, P9 : Hyponex 2 g/l + 1.5 ppm BAP, P10 : Hyponex 2 g/l + 3 ppm BAP, P11 : Hyponex 2 g/l + 15% air kelapa + 1.5 ppm BAP
Gambar 5. Keragaan Planlet dari Clump PLBs Hasil Percobaan 1 Passage 2 usia 8-MST
Penelitian Neliyati (1996) menunjukkan bahwa penambahan BAP
sebanyak 3 ppm pada media kultur selama 16 MST, dapat meningkatkan
persentase PLBs Phalaenopsis Hibrida yang tumbuh sebesar 59%, tetapi jika
konsentrasi BAP dinaikkan menjadi 6 ppm, persentase PLBs yang tumbuh turun
menjadi 51%. Air kelapa juga berpengaruh positif terhadap peningkatan jumlah
PLBs yang terbentuk, hal tersebut dibuktikan juga oleh penelitian Neliyati (1996)
yang menunjukkan bahwa tanpa pemberian air kelapa persentase PLBs yang
tumbuh sebesar 47.2%, namun dengan penambahan air kelapa sebanyak 15%,
21
Tabel 2. Rata-Rata Pertambahan Jumlah Daun Per Botol Kultur (3 Clump PLBs) pada Passage 1
Perlakuan
Rata-rata pertambahan jumlah daun MST
1 2 3 4 5 6 7 8
½ MS 0.00 0.00 0.00 0.00 0.00 0.33 bc 1.33bc 1.67
½ MS + 15%AK 0.67 1.33 3.00 3.67 4.00 6.67ba 9.67ba 11.33
½ MS + 1.5ppm BAP 0.00 0.00 0.67 0.67 2.00 3.00bac 4.67bac 7.33
½ MS + 3ppm BAP 1.00 1.00 1.00 2.67 3.33 3.67bac 4.67bac 7.67
½ MS + 15%AK + 1.5ppm BAP 0.00 0.00 0.00 0.00 0.33 1.00bc 1.33bc 2.33
½ MS + 15%AK + 3ppm BAP 0.00 0.67 1.00 1.00 4.67 6.33bac 8.00ba 10.00
Hyp. 2 g/l 0.67 1.67 1.00 1.67 3.00 3.33bac 5.00bac 7.33
Hyp. 2 g/l + 15%AK 0.33 1.33 1.33 1.33 1.33 2.00bc 3.00bac 4.00
Hyp. 2 g/l + 1.5 ppm BAP 1.33 2.33 4.33 5.00 7.33 9.67a 10.33a 13.00
Hyp. 2 g/l + 3 ppm BAP 1.67 1.67 1.33 1.33 1.33 1.33bc 1.33bc 2.33
Hyp. 2 g/l + 15% AK + 1.5 ppm BAP 0.00 0.00 -0.67 -0.67 -0.67 -0.67c -0.33c 1.00
Hyp. 2 g/l + 15% AK + 3 ppm BAP 0.00 0.00 0.00 0.00 0.00 0.00bc 0.00c 0.67
Uji F tn tn tn tn tn * * tn
KK % 27.06T1 23.16T2 28.87T2 24.57T3 27.27T3 28.78T3 28.72T3 26.85T4
Keterangan: Hyp= Hyponex, AK= air kelapa, tn= Tidak berbeda nyata pada taraf 5%, (*)= berbeda nyata pada taraf 5%, (T1)= hasil transformasi , (T2)= hasil
transformasi , (T3) = hasil transformasi , (T4) = hasil transformasi , MST= minggu setelah tanam, KK= koefisien keragaman, (-)= jumlah daun
n- MST lebih kecil daripada jumlah daun awal
Tabel 3. Rata-rata Pertambahan Jumlah Daun Per Botol Kultur(3 Clump PLBs)pada Passage 2
Perlakuan
Rata-rata pertambahan jumlah daun MST
1 2 3 4 5 6 7 8
½ MS - - - -
½ MS + 15%AK 2.33 4.00 6.00 7.67 10.33 13.00 17.00 20.00
½ MS + 1.5ppm BAP 4.00 3.00 4.33 5.00 7.00 9.00 9.67 12.00
½ MS + 3ppm BAP 2.67 4.00 5.67 8.00 11.00 13.00 20.00 22.00
½ MS + 15%AK + 1.5ppm BAP 1.00 2.67 4.67 6.33 7.00 8.33 9.33 10.00
½ MS + 15%AK + 3ppm BAP 1.67 8.00 10.33 15.33 17.00 19.33 25.00 28.67
Hyp. 2 g/l 2.00 3.33 4.33 5.00 6.33 8.00 10.00 11.33
Hyp. 2 g/l + 15%AK 1.33 3.33 5.00 7.33 9.33 12.33 17.00 19.00
Hyp. 2 g/l + 1.5 ppm BAP 0.33 2.33 2.33 3.33 4.67 5.67 14.67 15.67
Hyp. 2 g/l + 3 ppm BAP 0.67 3.00 4.67 5.33 6.67 8.33 10.67 11.00
Hyp. 2 g/l + 15% AK + 1.5 ppm BAP 0.00 0.67 1.00 1.33 2.33 3.33 4.33 4.67
Hyp. 2 g/l + 15% AK + 3 ppm BAP - - - -
Uji F tn tn tn tn tn tn tn tn
KK % 23.17T2 29.20T2 27.50T3 28.88T3 28.08T3 27.58T3 28.30T3 27.27T3
Keterangan: Hyp= Hyponex, AK= air kelapa, tn= tidak berbeda nyata pada taraf 5%, (T2)= hasil transformasi , (T3) = hasil transformasi , MST= minggu
setelah tanam, KK= koefisien keragaman, (-) = tidak dilakukan uji F karena data kurang dari yang dibutuhkan
23
Pertambahan Jumlah Akar
Pertambahan jumlah akar pada percobaan 1 passage 1 dan passage 2,
merupakan jumlah akar per botol kultur n-MST dikurangi dengan jumlah akar per
botol kultur.0-MST. Pada awal percobaan 1 passage 1 dan 2, bahan tanam yang
digunakan tidak memiliki jumlah akar yang sama. Ada beberapa bahan tanam
yang telah memiliki akar dan ada yang belum memiliki akar.
Rata-rata pertambahan jumlah akar dalam percobaan 1 passage 1 tersaji
pada Tabel 4. Hasil analisis statistik setiap minggunya menunjukkan bahwa
komposisi media tidak berpengaruh nyata terhadap pertambahan jumlah akar
pada taraf 5%. Jumlah akar yang terbentuk dalam berbagai komposisi media pada
passage 1 berkisar antara 0.00-4.67 akar.
Pengolahan data statistik pertambahan jumlah akar pada komposisi media
½ MS dan Hyponex 2 g/l + 15% AK + 3 ppm BAP pada passage 2 tidak
dilakukan karena jumlah ulangan pada perlakuan tersebut kurang dari jumlah
yang dibutuhkan. Hasil pengolahan statistik pada passage 2 menunjukkan bahwa
komposisi media tidak berpengaruh nyata terhadap peubah jumlah akar pada
taraf 5% (Tabel 5). Rata-rata pertambahan jumlah akar dalam berbagai komposisi
media pada passage 2 berkisar antara 3.00-14.00 akar.
Hasil penelitian Parera (1997) menunjukkan bahwa pemberian air kelapa
pada kultur Dendrobium spp. memberikan respon yang negatif terhadap
pertumbuhan akar. Pengaruh sitokinin di dalam kultur in-vitro menurut
Widyastuti dan Tjokrokusumo (2001) salah satunya berhubungan dengan
penghambatan pertumbuhan akar tanaman. Dari hasil penelitian ini, tidak terlihat
perbedaan adanya efek yang ditimbulkan oleh air kelapa dan BAP terhadap
Tabel 4. Rata-rata Pertambahan Jumlah Akar Per Botol Kultur (3 Clump PLBs) pada Passage 1
Perlakuan
Rata-rata pertambahan jumlah akar MST
1 2 3 4 5 6 7 8
½ MS 0.00 0.00 0.00 0.00 0.00 0.00 0.00 1.00
½ MS + 15%AK 0.00 0.00 0.00 0.00 1.67 1.67 1.67 4.67
½ MS + 1.5ppm BAP 0.00 0.00 0.00 0.00 0.00 0.33 1.33 1.33
½ MS + 3ppm BAP 0.33 1.67 2.00 2.00 2.00 2.33 3.00 4.33
½ MS + 15%AK + 1.5ppm BAP 0.00 0.00 0.00 0.00 0.00 0.00 0.67 0.67
½ MS + 15%AK + 3ppm BAP 0.00 0.67 0.67 0.67 1.00 1.33 2.67 3.33
Hyp. 2 g/l 0.33 0.67 1.00 1.00 1.67 2.00 2.67 3.33
Hyp. 2 g/l + 15%AK 0.00 0.00 0.33 0.33 1.33 1.67 2.00 2.00
Hyp. 2 g/l + 1.5 ppm BAP 0.00 0.33 1.67 2.33 4.33 5.33 5.67 8.33
Hyp. 2 g/l + 3 ppm BAP 0.33 0.33 0.33 1.33 2.00 2.00 2.00 2.33
Hyp. 2 g/l + 15% AK + 1.5 ppm BAP 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00
Hyp. 2 g/l + 15% AK + 3 ppm BAP 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00
Uji F tn tn tn tn tn tn tn tn
KK % 11.56T1 28.31T1 20.85T2 22.38T2 22.46T3 24.09T3 27.73T3 25.92T3
Keterangan: Hyp= Hyponex, AK= air kelapa, tn= tidak berbeda nyata pada taraf 5%, (T1)= hasil transformasi , (T2)= hasil transformasi , (T3) =
hasil transformasi , MST= minggu setelah tanam, KK= koefisien keragaman
25
Tabel 5. Rata-rata Pertambahan Jumlah Akar Per Botol Kultur (3 Clump PLBs) pada Passage 2
Keterangan: Hyp= Hyponex, AK= air kelapa, tn= tidak berbeda nyata pada taraf 5%, (T1)= hasil transformasi , (T2)= hasil transformasi , (T3) =
hasil transformasi , MST= minggu setelah tanam, KK= koefisien keragaman, (-) = tidak dilakukan uji F karena data kurang dari yang dibutuhkan
Perlakuan
Rata-rata pertambahan jumlah akar MST
1 2 3 4 5 6 7 8
½ MS - - - -
½ MS + 15%AK 1.33 2.33 3.00 4.00 5.33 7.00 8.33 10.00
½ MS + 1.5ppm BAP 0.67 1.67 2.00 3.00 4.33 5.33 6.33 7.00
½ MS + 3ppm BAP 2.00 3.00 4.00 4.67 5.67 6.67 6.67 7.67
½ MS + 15%AK + 1.5ppm BAP 1.00 2.00 2.00 3.67 4.00 4.67 5.00 5.33
½ MS + 15%AK + 3ppm BAP 0.33 1.33 3.00 4.33 6.33 7.67 11.00 13.00
Hyp. 2 g/l 1.33 1.67 2.67 2.67 5.00 6.00 10.33 10.33
Hyp. 2 g/l + 15%AK 1.00 2.33 3.00 5.67 7.00 8.00 12.67 14.00
Hyp. 2 g/l + 1.5 ppm BAP 1.67 3.00 3.33 3.67 4.33 4.67 7.33 12.33
Hyp. 2 g/l + 3 ppm BAP 0.33 1.67 1.67 2.00 2.33 2.67 3.00 3.67
Hyp. 2 g/l + 15% AK + 1.5 ppm BAP 0.33 0.67 1.00 1.00 1.33 2.00 2.33 3.00
Hyp. 2 g/l + 15% AK + 3 ppm BAP - - - -
Uji F tn tn tn tn tn tn tn tn
KK % 29.58T1 27.19T2 26.69T2 28.04T2 27.02T2 29.51T2 28.37T2 27.40T3
Pertambahan Bobot Segar
Bobot segar tanaman biasa digunakan sebagai tolok ukur pertumbuhan.
Bobot segar digunakan sebagai tolok ukur pertumbuhan pada penelitian ini
karena pengukurannya dapat dilakukan tanpa harus mengeluarkan bahan tanam
dari media perlakuan dan tanaman yang telah ditimbang dapat digunakan lagi
untuk pengamatan selanjutnya. Menurut Sathyanarayana (2007) pengukuran
bobot segar merupakan metode yang cepat dan mudah untuk menilai pertumbuhan
kalus dan tidak menyebabkan kerusakan pada materi yang di timbang.
Tabel 6. Rata-rata Pertambahan Bobot Segar Per Botol Kultur (3 Clump PLBs)
Phalaenopsis amabilis pada Passage 1 dan 2
Perlakuan
Rata-rata pertambahan bobot
Passage 1 (g) Passage 2 (g)
½ MS 0.30 -*
½ MS + 15%AK 1.48 1.10
½ MS + 1.5ppm BAP 0.40 0.46
½ MS + 3ppm BAP 0.34 0.88
½ MS + 15%AK + 1.5ppm BAP 0.58 0.23
½ MS + 15%AK + 3ppm BAP 0.99 1.69
Hyp. 2 g/l 0.69 1.22
Hyp. 2 g/l + 15%AK 0.57 1.74
Hyp. 2 g/l + 1.5 ppm BAP 1.83 1.08
Hyp. 2 g/l + 3 ppm BAP 0.74 -0.04
Hyp. 2 g/l + 15% AK + 1.5 ppm
BAP 0.66 0.42
Hyp. 2 g/l + 15% AK + 3 ppm BAP 0.44 -
Uji F tn tn
KK(%) 14.60262T1 27.18
Keterangan: Hyp= Hyponex, AK= air kelapa, tn= tidak berbeda nyata pada taraf 5%, (T1)= hasil
transformasi , KK= koefisien keragaman, * = tidak dilakukan uji F karena data kurang dari
yang dibutuhkan, (-)= bobot akhir lebih kecil daripada bobot awal
Hasil dari uji F terhadap pertambahan bobot segar pada percobaan 1
passage 1 dan 2 menunjukkan hasil yang tidak berbeda nyata pada taraf 5 %
(Tabel 6). Berkurangnya bobot segar pada komposisi media Hyponex 2 g/l + 3
ppm BAP (passage 2) disebabkan oleh adanya kematian sebagian PLBs yang
menyebabkan bobot segar menjadi berkurang. Menurut Young et al. (2000),
media Hyponex lebih cocok dibanding media ½ MS dalam regenerasi planlet dari
27
Percobaan 2. Pengaruh Komposisi Media dalam Pertumbuhan Planlet
Persentase Kontaminasi
Kontaminasi pada percobaan dua disebabkan oleh cendawan dan bakteri.
Persentase kontaminasi yang terjadi pada passage 1 adalah sebesar 18.52%, dan
persentase kontaminasi pada passage 2 adalah sebesar 24.45%. Persentase
kontaminasi pada percobaan 2 lebih kecil jika dibandingkan dengan percobaan 1.
Persentase Planlet Hidup
Persentase planlet yang hidup, dihitung dari planlet yang terbebas dari
kontaminasi. Pada percobaan ini seluruh planlet yang ditanam dalam media
perlakuan tidak ada yang mengalami kematian. Dapat diartikan bahwa seluruh
media dalam percobaan 2 sesuai untuk planlet Phalaenopsis amabilis. Data
persentase planlet hidup tersaji pada tabel 7.
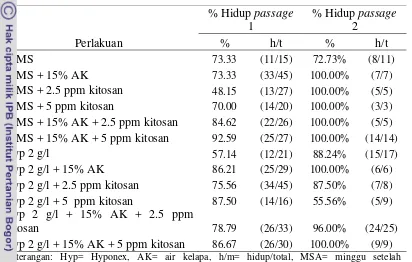
Tabel 7. Persentase Planlet Phalaenopsis amabilis yang Hidup pada Passage
1 dan 2
Perlakuan
Passage 1 Passage 2
% h/t % h/t
½ MS 100.00 (21/21) 100.00 (6/6)
½ MS + 15% AK 100.00 (27/27) 100.00 (12/12)
½ MS + 2.5 ppm kitosan 100.00 (24/24) 100.00 (9/9) ½ MS + 5 ppm kitosan 100.00 (24/24) 100.00 (6/6) ½ MS + 15% AK + 2.5 ppm kitosan 100.00 (21/21) 100.00 (3/3) ½ MS + 15% AK + 5 ppm kitosan 100.00 (24/24) 100.00 (21/21)
Hyp 2 g/l 100.00 (18/18) 100.00 (6/6)
Hyp 2 g/l + 15% AK 100.00 (21/21) 100.00 (12/12) Hyp 2 g/l + 2.5 ppm kitosan 100.00 (21/21) 100.00 (12/12) Hyp 2 g/l + 5 ppm kitosan 100.00 (18/18) 100.00 (3/3) Hyp 2 g/l + 15% AK + 2.5 ppm kitosan 100.00 (24/24) 100.00 (12/12) Hyp 2 g/l + 15% AK + 5 ppm kitosan 100.00 (21/21) 100.00 (21/21) Keterangan: Hyp= Hyponex, AK= air kelapa, h/t= hidup/total
Pertambahan Jumlah Daun
Jumlah daun awal pada percobaan 2 passage 1 dan 2 tidak sama dalam
pengurangan dari jumlah daun per botol kultur n-MST dengan jumlah daun awal
per botol kultur (0-MST). Daun yang dihitung pada setiap pengamatan adalah
daun yang telah terbentuk sempurna.
Pada percobaan 2 passage 1, komposisi media tidak berpengaruh nyata
terhadap pertambahan jumlah daun setiap minggunya. Rata-rata pertambahan
jumlah daun pada percobaan 2 passage 1 tersaji pada Tabel 8 (planlet dalam
botol kultur pada percobaan 2 passage 1 usia 8-MST dapat dilihat pada Gambar
6). Pertambahan jumlah daun dalam berbagai komposisi pada percobaan 2
passage 1 berkisar antara 7.00-17.00 daun.
Gambar 6. Planlet dalam botol kultur pada Percobaan 2 Passage 1 Usia 8-MST
Gambar 7. Planlet dalam botol kultur pada Percobaan 2 Passage 2 Usia 8-MST
Pada percobaan 2 passage 2, pengolahan data secara statistik tidak
29
air kelapa + 2.5 ppm kitosan, Hyponex 2 g/l, dan Hyponex 2 g/l + 5 ppm kitosan
karena jumlah ulangan tidak mencukupi untuk dilakukannya analisis statistik
sesuai dengan metode penelitian ini. Hasil uji F terhadap pertambahan jumlah
daun menunjukkan hasil yang tidak berbeda nyata pada taraf 5%. Rata-rata
pertambahan jumlah daun pada percobaan 2 passage 2 tersaji pada Tabel 9
(planlet dalam botol kultur pada percobaan 2 passage 2 dapat dilihat pada Gambar
7, sedangkan keragaan planlet hasil kultur pada berbagai media perlakuan
percobaan 2 passage 2 dapat dilihat pada Gambar 8). Pertambahan jumlah daun
dalam berbagai komposisi pada percobaan 2 passage 2 berkisar antara
10.00-19.33 daun.
Keterangan: P1 = ½ MS , P2 = ½ MS + 15% air kelapa, P3 = ½ MS + 2.5 ppm kitosan, P4 = ½ MS + 5 ppm kitosan, P5 = ½ MS + 15% air kelapa + 2.5 ppm kitosan,
P6 = ½ MS + 15% air kelapa + 5 ppm kitosan, P7 = Hyponex 2 g/l, P8 = Hyponex 2 g/l + 15% air kelapa, P9 = Hyponex 2 g/l + 2.5 ppm kitosan,
P10 = Hyponex 2 g/l + 5 ppm kitosan, P11= Hyponex 2 g/l + 15% air kelapa + 2.5 ppm kitosan, P12 = Hyponex 2 g/l + 15% air kelapa + 5 ppm kitosan
Gambar 8. Keragaan Planlet Hasil Percobaan 2 Passage 2 usia 8-MST
Prasertsongskun dan Chaipakdee (2011) melaporkan bahwa jumlah daun
per planlet Phalaenopsis cornucervi dalam media VW (Vacin dan Went) dengan
penambahan sebesar 5 ppm kitosan (3.2 + 1.03) hasilnya tidak berbeda nyata
dengan planlet dalam media VW tanpa penambahan kitosan (3.3 + 0.87). Dalam
penelitian tersebut, penambahan kitosan sebesar 15 ppm (4.3 + 2.92)
menunjukkan jumlah daun per planlet yang berbeda nyata dibandingkan dengan
Tabel 8. Rata-rata Pertambahan Jumlah Daun Per Botol Kultur (3 Planlet) pada Passage 1
Perlakuan
Rata-rata pertambahan jumlah daun MST
1 2 3 4 5 6 7 8
½ MS 0.33 1.33 2.00 3.67 5.00 5.33 6.33 7.00
½ MS + 15% AK 2.00 3.67 5.33 8.00 10.67 11.67 15.33 17.00
½ MS + 2.5 ppm kitosan 1.00 2.67 5.67 7.67 8.33 9.33 12.67 14.00
½ MS + 5 ppm kitosan 0.67 1.67 2.67 4.33 5.00 6.33 7.33 9.33
½ MS + 15% AK + 2.5 ppm kitosan 0.67 1.33 3.00 4.67 6.33 8.33 10.00 12.33
½ MS + 15% AK + 5 ppm kitosan 0.33 1.33 2.00 2.00 4.00 4.33 5.67 8.00
Hyp 2 g/l 1.00 3.00 4.00 4.00 5.33 6.67 7.00 8.00
Hyp 2 g/l + 15% AK 0.33 1.00 2.00 3.33 4.67 5.67 6.00 7.33
Hyp 2 g/l + 2.5 ppm kitosan 0.67 3.00 5.33 7.67 9.33 10.33 10.67 12.00
Hyp 2 g/l + 5 ppm kitosan 0.67 2.00 3.00 3.33