Lampiran 2. Data dan Hasil Perhitungan Nilai Bilangan Iodin Metil Ester Asam Lemak Minyak Kelapa Sawit, Campuran Aldehida, Basa Schiff I dan Basa Schiff II
No Sampel Berat
Sampel(g) B,Vol. Blanko (mL) S,Vol. Titrasi Sampel (mL) Bilangan Iodium (IV) IV rata-rata
1 Metil ester asam lemak minyak kelapa
sawit
0,2197
43,92
24,38 115,46
118,02
0,2160 25,44 111,08
0,2043 23,85 127,53
2 Campuran aldehida
0,2175
43,92
30,24 81,65
83,30
0,2144 30,15 83,38
0,2175 29,70 84,87
3 Basa Schiff I 0,2181
43,92
23,46 121,78
123,32
0,2145 23,80 121,77
0,2169 22,80 126,41
4 Basa Schiff II 0,2133
43,92
22,35 131,28
135,95
0,2062 22,13 137,18
0,2064 21,76 139,38
Bilangan iodin (IV) = (B-S) x N x 12,69 Berat sampel (g)
B = Volume Titrasi Blanko (mL) S = Volume Titrasi Sampel (mL) N = Normalitas Na
Nilai Bilangan Iodin untuk Metil Ester Asam Lemak Minyak Kelapa Sawit 1.
2.
3.
Dilakukan cara yang sama untuk menghitung bilangan iodin untuk campuran aldehida, Basa Schiff I dan Basa Schiff II.
(43,92-24,38) x 0,1023 x 12,69 0,2197
IV =
IV =
0,2197 25,3666
IV = 115,46
(43, 92 -25,44) x 0,1023 x 12,69 0,2160
IV =
IV =
0,2160 23,9905
IV = 111,07
(43,92-23,85) x 0,1023 x 12,69 0,2043
IV =
IV =
0,2043 26,0546
Lampiran 3. Data dan Hasil Perhitungan Indeks Antimikrobial Basa Schiff Terhadap Bakteri Staphylococcus aureus dan Escherichia coli
Sampel
Indeks Antimikrobial
Gram Positif
(Staphylococcus aureus)
Gram Negatif
(Escherichia coli)
Basa Schiff I 0,12 0,75
Basa Schiff II 0,42 1,22
Bakteri Staphylococcus aureus
Basa Schiff I
Diameter zona hambat = 6,7 mm Diameter cakram = 6 mm
Indeks Antimikrobial = (diameter zona hambat - diameter cakram) diameter cakram
= 6,7-6 6 = 0,12
Lampiran 4. Data dan Hasil Perhitungan Nilai Efisiensi Inhibitor Korosi
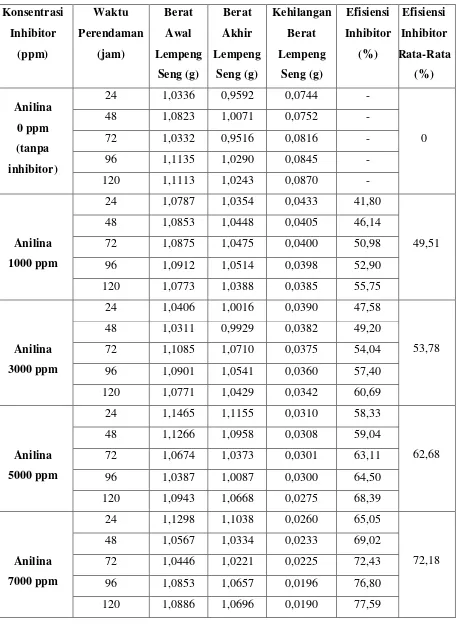
Hasil Perendaman Lempeng Seng dengan Menggunakan Inhibitor Campuran
Aldehida dalam Larutan Media Korosif HCl 0,1 N
Konsentrasi Inhibitor (ppm) Waktu Perendaman (jam) Berat Awal Lempeng Seng (g) Berat Akhir Lempeng Seng (g) Kehilangan Berat Lempeng Seng (g) Efisiensi Inhibitor (%) Efisiensi Inhibitor Rata-Rata (%) Campuran Aldehida 0 ppm (tanpa inhibitor)
24 1,0604 0,9879 0,0725 -
0
48 1,0561 0,9811 0,0750 -
72 1,0685 0,9893 0,0792 -
96 1,0657 0,9837 0,0820 -
120 1,1148 1,0286 0,0862 -
Campuran Aldehida 1000 ppm
24 1,0672 1,0242 0,0430 40,68
47,35 48 1,0912 1,0495 0,0417 44,40
72 1,0654 1,0244 0,0410 48,23 96 1,0655 1,0255 0,0400 51,22 120 1,0901 1,0489 0,0412 52,20
Campuran Aldehida 3000 ppm
24 1,0431 1,0045 0,0386 46,76
52,38 48 1,0524 1,0136 0,0388 48,27
72 1,0793 1,0418 0,0375 52,65 96 1,0643 1,0280 0,0363 55,73 120 1,0602 1,0244 0,0358 58,47
Campuran Aldehida 5000 ppm
24 1,0634 1,0274 0,0360 50,34
54,23 48 1,0961 1,0596 0,0365 51,33
72 1,0621 1,0261 0,0360 54,45 96 1,0386 1,0028 0,0358 56,34 120 1,1078 1,0722 0,0356 58,70
Campuran Aldehida 7000 ppm
24 1,0683 1,0325 0,0358 50,62
54,94 48 1,1113 1,0752 0,0361 51,86
Untuk menentukan nilai Efisiensi Inhibitor korosinya digunakan rumus sebagai berikut :
EI (%) =
W0 - W1
W0 x 100 %
Dimana
EI : Efisiensi Inhibitor
W0 : Berat kehilangan tanpa inhibitor
W1 : Berat kehilangan dengan inhibitor
1. Untuk konsentrasi 1000 ppm
a. Selama 24 jam
EI (%) =
=
0,0725 0,0725 - 0,0430
40,68 % W0 - W1
W0 x 100%
=
b. Selama 48 jam
EI (%) =
=
0,0750 0,0750 - 0,0417
44,40 % W0 - W1
W0
x 100%
=
c. Selama 72 jam
EI (%) =
=
0,0792 0,0792 - 0,0410
48,23 % W0 - W1
W0 x 100%
d. Selama 96 jam
EI (%) =
=
0,0862 0,0862 - 0,0412
52,20 % W0 - W1
W0 x 100%
=
e. Selama 120 jam EI (%) =
=
0,0862 0,0862 - 0,0412
52,20 % W0 - W1
W0 x 100%
=
Rata-rata efisiensi inhibitor:
EI (%) rata-rata =
EI (%) 24 jam + EI (%) 48 jam + EI (%) 72 jam + EI (%) 96 jam + EI (%) 120 jam
=
40,68 % + 44,40 % + 48,23 % + 51,22 % + 52,20 % 5
47,35 %
5
=
2. Untuk konsentrasi 3000 ppm
a. Selama 24 jam EI (%) =
=
0,0725 0,0725 - 0,0386
46,76 % W0 - W1
W0
x 100%
b. Selama 48 jam EI (%) =
=
0,0750 0,0750 - 0,0388
48,27 % W0 - W1
W0
x 100%
=
c. Selama 72 jam
EI (%) =
=
0,0792 0,0792 - 0,0375
52,65 % W0 - W1
W0 x 100%
=
d. Selama 96 jam
EI (%) =
=
0,0820 0,0820 - 0,0363
55,73 % W0 - W1
W0 x 100%
=
e. Selama 120 jam
EI (%) =
=
0,0862 0,0862 - 0,0358
58,47 % W0 - W1
W0 x 100%
=
EI (%) rata-rata =
EI (%) 24 jam + EI (%) 48 jam + EI (%) 72 jam + EI (%) 96 jam + EI (%) 120 jam
=
44,76 % + 48,27 % + 52,65 % + 55,73 % + 58,47 % 5
52,38 %
5
=
3. Untuk konsentrasi 5000 ppm
a. Selama 24 jam EI (%) =
=
0,0725 0,0725 - 0,0360
50,34 % W0 - W1
W0
x 100%
=
b. Selama 48 jam
EI (%) =
=
0,0750 0,0750 - 0,0365
51,33 % W0 - W1
W0 x 100%
=
c. Selama 72 jam
EI (%) =
=
0,0792 0,0792 - 0,0360
54,45 % W0 - W1
W0 x 100%
=
d. Selama 96 jam EI (%) =
=
0,0820 0,0820 - 0,0358
56,34 % W0 - W1
W0
x 100%
e. Selama 120 jam EI (%) =
=
0,0862 0,0862 - 0,0356
58,70 % W0 - W1
W0
x 100%
=
Rata-rata efisiensi inhibitor:
EI (%) rata-rata =
EI (%) 24 jam + EI (%) 48 jam + EI (%) 72 jam + EI (%) 96 jam + EI (%) 120 jam
=
50,34 % + 51,33 % + 54,45 % + 56,34 % + 58,70 % 5
54,23 %
5
=
4. Untuk konsentrasi 7000 ppm
a. Selama 24 jam
EI (%) =
=
0,0725 0,0725 - 0,0358
50,62 % W0 - W1
W0 x 100%
=
b. Selama 48 jam
EI (%) =
=
0,0750 0,0750 - 0,0361
51,86 % W0 - W1
W0 x 100%
=
EI (%) =
=
0,0792 0,0792 - 0,0357
54,92 % W0 - W1
W0 x 100%
=
d. Selama 96 jam
EI (%) =
=
0,0820 0,0820 - 0,0350
57,32 % W0 - W1
W0 x 100%
=
e. Selama 120 jam
EI (%) =
=
0,0862 0,0862 - 0,0345
59,98 % W0 - W1
W0 x 100%
=
Rata-rata efisiensi inhibitor:
EI (%) rata-rata =
EI (%) 24 jam + EI (%) 48 jam + EI (%) 72 jam + EI (%) 96 jam + EI (%) 120 jam
=
50,62 % + 51,86 % + 54,92 % + 57,32 % + 59,98 % 5
54,94 %
5
=
Lampiran 5. Kromatogram Lapis Tipis Anilina : Basa Schiff Hasil Kondensasi
dengan Anilina (Basa Schiff I) dan Fenilhidrazin : Basa Schiff Hasil Kondensasi dengan Fenilhidrazin (Basa Schiff II)
A B C D
I II
Keterangan:
Fasa diam : Kieselgel 60 F254
A : Anilina
B : Basa Schiff hasil kondensasi dengan anilina (Basa Schiff I) C : Fenilhidrazin
D : Basa Schiff hasil kondensasi dengan fenilhidrazin (Basa Schif II) I : Anilina : Basa Schiff I dengan fasa gerak etil asetat : n-heksana
(6:4) v/v
Fasa Gerak
Rf
Anilina Basa Schiff I Fenilhidrazin Basa Schiff II Etil asetat : n-heksana
(6:4) v/v 0,84 0,72 0,67 0,23
Lampiran 6. Gambar Penelitian
Rangkaian alat refluks pada pembuatan metil ester asam lemak minyak kelapa
sawit
Rangkaian alat destilasi vakum
Basa Schiff hasil reaksi antara campuran aldehida dengan anilina
Pengujian sifat antibakteri Basa Schiff
Basa Schiff I vs
Escherichia coli
Basa Schiff II vs
Ozonida
Basa Schiff I vs
Staphylococcus aureus
Basa Schiff II vs
Alat ozonisator
DAFTAR PUSTAKA
Adriana, A. A, Mudjijati, Hermawan, Liliana, P. S. 2000. Pengaruh Penambahan Vitamin C, B2 dan B6 Terhadap Laju Korosi Besi. Yogyakarta: Seminar Kimia Bersama ITB-UKM IV.
Akhadi, M. 2000. Korosi pada Peralatan Elektronik. Jakarta: Elektro Indonesia Tahun VI. No.32.
Ashraf, M. A., Karamat, M., dan Abdul, W. 2011. Synthesis, Characterization and Biological Activity of Schiff Bases. Singapore: IACSIT Press.
Atkins, P. W. 1989. General Chemistry. Second Edition. New York: W.H. Freeman and Company.
Beech, Iwona. 2000. Simple Methods for The Investigation of The Role of Biofilms in Corrosion.
Besari, I., Sulistowati, E., dan Ishak, M. 1982. Kimia Organik. Bandung: Armico (AMC).
Bina Nusantara. 1999. Kimia Lanjut. Edisi I. Revisi II.
Bosich, J. F. 1970. Corrossion Prevention for Practicing Engineers. New York: Bernes and Noble Inc. (92-93).
Bryson, H. J. 1996. Corrosion of Carbon Steel. ASM Handbook. Formerly 9th ed. Metals Handbook. Vol. 13.
Buckle, K. A. 2009. Ilmu Pangan. Penterjemah Hari Purnomo dan Adiono. Jakarta: Universitas Indonesia.
Callister, W. D. 1991. Material Science and Enggineering. An Introduction. 2nd ed. Singapore. (367-396).
Characklis, W. G. dan Marshall, K. C. 1990. Biofilms. John Wiley & Sons, Inc, New York. Hal. 3-195.
Cimerman, Z., Galic, N., dan Bosner, B. 1997. Anal. Chim. Acta.
Coleman, G. H. 1941. Phenylhydrazine. Organic Syntheses. Coll. Vol. 1, p.442. Djaprie, S. 1995. Ilmu dan Teknologi Bahan. Edisi kelima. Jakarta: Erlangga,
483-510.
Eddy, N. O., Odoemelan, E. C., dan Oguko, B. I. Ita. 2010. Electrochim. Port. Acta 28.
Elisabet, J, 1999. Modifikasi Minyak dan Lemak: Teknologi dan Aplkasi dalam Industri Pangan dan Kimia, Seminar Peranan Teknologi Hasil Pertanian dalam Industria Penyediaan Bahan Baku Industri Pangan dan Kimia, Medan.
Endo, Y. H. Sanae and F. Kenshiro. 1997. “Autooksidation of Synthetic Isomers of Tryacylglycerol Containing Eicosapentaenoic Acid”, Dalam Tarigan, J. 2002.
Ester Asam Lemak. Digitized by USU Digital Library FMIPA USU.
Fahrurrozie, A. 2009. Efisiensi Inhibisi Cairan Ionik Turunan Imidazolin Sebagai Inhibitor Korosi Baja Karbon dalam Larutan elektrolit Jenuh Karbon Dioksida. Skripsi. Jakarta: Universitas Pendidikan Indonesia.
Fessenden, R. J dan Fessenden, J. S. 1986. Kimia Organik. Edisi Ketiga. Jilid I. Jakarta: Erlangga.
Fessenden, R. J dan Fessenden, J. S. 1992. Kimia Organik. Edisi Ketiga. Jilid II. Jakarta: Erlangga.
Fick, J. 2003. Chemical Reaction in Ventilation System Ozonolysis of Monoterpen. Sweden: Umea University.
Firmansyah, D. 2011. Studi Inhibisi Korosi Baja Karbon Dalam Larutan HCl 1 M Oleh Ekstrak Daun Sirsak. Tesis. Jakarta: Universitas Indonesia.
Fontana, M.G. 1986. Corrosion Engineering. New York: Mc. Graw Hill Book Company, 39-139.
Gravier, Donald, dan Dacoma, R. 2012. Steel-Corrosion Inhibitors Derived from Soybean Oil Jj. Am. Oil Chem. Soc.
Hamak dan Eissa. 2013. Synthesis, Characterization, Biological Evaluation and Anti Corrosion Activity of Some Heterocyclic Compounds Oxazepine Derivatives from Schiff Bases. Organic Chemistry Current Research.
Hart, H. 1990. Kimia Organik. Edisi Keenam. Jakarta: Erlangga. Hart, H. 2003. Kimia Organik. Edisi Kesebelas. Jakarta: Erlangga.
Hermawan, B. 2007. Ekstrak Bahan Alami sebagai Inhibitor korosi. Chemistry. org/author/Beni Hermawan.com. Diakses 28 Agustus 2014.
Indocor,” Training dan Sertifikasi Proteksi Katodik”, Dalam Loren, S. 2011. Analisis Mekanisme Pengaruh Inhibitor Siskem Pada Material Baja Karbon. Yogyakarta: BATAN kawasan PUSPITEK.
Iverson, W.P. 1972. Mechanisms of Microbial Corrosion. London: Applied Science Pub. Lill., 28-50.
Jawetz. 2001. Mikrobiologi Kedokteran. Surabaya: Salemba Medical. Ketaren, S. 2008. Minyak dan Lemak Pangan. Jakarta: UI-Press.
Kusuma, F. 2010. Aktivitas Antibakteri Ekstrak Etanol Buah Mengkudu (Morinda Citrifolia, Linnaeus) Terhadap Bakteri Pembusuk Daging Segar. Surakarta: Fakultas MIPA UNS.
Maggolo, A dan A. L. Tumolo. 1961. Reactions of Ozone V. A New Method of Determining Unsaturation Values of Fatty Acids and Oils by Ozone. The Journal of The America Oil Chemistry. Vol. 38.
Mahan, B. H. 1987. University Chemistry. Fourth Edition. California: The Benjamin/ Cummings Publishing Company.
Mongoensoekarjo, S. 2003. Manajemen Agrobisnis Kelapa Sawit. Yogyakarta: Gajah Mada University Press.
Morrison, R. T., dan Robert, N. B. 2002. Organic Chemistry. 6th Ed. New Delhi: Prentice-Hall of India Private Limited.
Nasution, M. 2014. Pengantar Mikrobiologi. Medan: USU Press.
O’brien, R. D. 2009. Fats and Oils. Third Edition. USA: Taylor and Francis Group.
Parry. 2013. Pembuatan Basa Schiff Dari Hasil Ozonolisis Minyak Kelapa Sawit Yang Dilanjutkan Kondensasi Dengan Kitosan dan Pemanfaatannya Sebagai Inhibitor Korosi. Medan: Jurusan Kimia FMIPA USU.
Patrick, G. L. 2003. Instant notes Organic Chemistry. 2th Ed. London: Garland Science/BIOS Scientific Publishers.
Prasad, A. V. G. S, et al. 2013. Synthesis And Biological Activity Of Aniline Derivative Schiff Bases. India: International Journal of Research & Development, Vol. 2.
Prakash, Chinnasamy Rajaram dan Raja, Sundararajan. 2013. Synthesis, Characterization and In Vitro Antimicrobial Activity of Some Novel 5-Substituted Schiff and Mannich Base of Isatin Derivatives. King Saud University: Journal of Saudi Chemical Society 17, 337-344.
Priyatmono, Aris. 2008. Asetanilida. Kimiadotcom.wordpress.com. Diakses 22 Agustus 2014.
Rahmi, U. 2006. Pengaruh Jenis Asam dan PH pada Pemurnian Residu Gliserol dari Hasil Samping Produksi Biodiesel. Skripsi. Medan: USU Press.
Rappoport, Z. 2007. The Chemistry of Anilina. England: John Wiley and Sons Ltd. Richtler, M. J, Knaut, J. 1984. Challenges to Nature Industry, Marketing and
Economics of Oleochemical in Western Europe. USA: J.Am.Oil.Chem.Soc. Vol.61. 160.
Riegher, H. P. 1992. Electrochemistry. New York: Chapman and Hall Inc. Riswiyanto. 2010. Kimia Organik. Jakarta: Penerbit Erlangga.
Sarker, S. D dan Lutfun, N. 2007. Chemistry for Pharmacy Students. England: John Wiley & Sons, Ltd
Shah, M. D., Patel, A. S., Mudaliar, G. V, dan N. K. Shah. 2011. Schiff Bases of Triethylenetetramine as Corrosion Inhibitors of Zinc in Hydrochloric Acid.
Chemistry Departement. School of Sciences. Ahmedabad: Gujarat University. Siregar, M. 1988. Dasar-dasar Kimia Organik. Jakarta: Departemen Pendidikan dan
Kebudayaan Direktorat Jendral Pendidikan Tinggi Proyek Pengembangan Pendidikan Tenaga Pendidikan.
Sumber bahan BPOM RI.
Supardi, R. 1997. Korosi. Bandung: Penerbit Tarsito.
Suyarna, Y. 2004. Senyawa Nitrogen Heterosiklik sebagai Material Alternatif Inhibitor Korosi pada Logam. Bandung: Jurusan Pendidikan Kimia FPMIPA UPI.
Tambun, R. 2006. Teknologi Oleokimia. Medan: USU Press.
Trethewey, K. R., dan Chamberlain, J. 1991. Korosi untuk Mahasiswa dan Rekayasawan. Jakarta: PT. Gramedia Pusaka Utama.
Uhlig, H. 1985. Corrosion and Corrosion Control. New York: JohnWiley &Sons Umoren, S. A, Eduok, U. M, Solomon, M. M, dan Udoh, A. P. 2011. Corrosion
Inhibition by Leaves and Stem Extracts Of Sida Acuta for Mild Steel in H2SO4 Solution Investigated by Chemical and Spectroscopy Technique. Arabian Journal of Chemistry.
United Nation. 1994. Microbilogically Influenced Corrosion of Emergency Diesel Generator Service Water Piping. United Nation Regulatory Commission Information 94 – 97.
Vogel, A. I. 1989. Practical Organic Chemistry. 5th Ed. London: Longman Group Ltd. Vogel, A. I. 1985. Buku Teks Analisis Anorganik Kualitatif Makro dan Semimikro.
Jakarta: P.T. Kalman Media Pustaka.
WHO. 2000. Phenylhydrazine. Geneva: Concise International Chemical Assessment Document 19.
www.astographic.com/Escherichia coli. Diakses 20 November 2014.
Yusuf, B., Warsito, A., dan Widiasa, N. 2011. Aplikasi Pembangkit Tegangan Tinggi Impuls untuk Pembuatan Reaktor Ozon. Semarang: Universitas Diponegoro. Zulaekha, Tin. 2006. Pembuatan dan Karakterisasi Elektroda Selektif Ion S2- dengan
BAB 3
METODE PENELITIAN
3.1 Alat-alat
Alat-alat yang digunakan dalam penelitian ini adalah:
- Ozone generator AOSN
- Kromatografi Gas Cair (KGC) Aglient 7890 A
- Gelas Erlenmeyer 1000 mL Pyrex
- Labu leher tiga 1000 mL Pyrex
- Labu leher tiga 500 mL Pyrex
- Gelas ukur 250 mL Pyrex
- Gelas ukur 10 mL Pyrex
- Labu takar1000 mL Pyrex
- Labu takar 100 mL Pyrex
- Labu takar 50 mL Pyrex
- Kondensor bola Pyrex
- Alat vakum Fison
- Botol Akuades - Statif dan klem
- Neraca analitis Shimadzu
- Neraca kaki tiga O’Hauss
- Hotplate stirrer Fisons
- Pengaduk magnetik
- Spektrofotometer FT-IR Shimadzu
- Rotarievaporator Heidolph
- Tabung reaksi Pyrex
- Termometer 210oC Fisons
- Corong kaca Pyrex
- Corong Penetes Pyrex
- Stopper Pyrex
- Tabung CaCl2 Pyrex
- Spatula - Pipet tetes - Desikator - Kertas saring - Teflon - Jarum ose
- Autoklaf Yamato
- Inkubator Fischer
- Oven Gallenkamp
- Pinset
- Rak tabung reaksi - Aluminium voil - Kuvet
- Botol vial - Kapas - Cawan petri - Jangka sorong - Batang pengaduk - Wadah kaca - Chamber
- Lampu UV 254/356 nm - Alat destilasi
3.2 Bahan-bahan
Bahan-bahan yang digunakan dalam penelitian ini adalah: - Minyak kelapa sawit (RBD Palm Olein)
- N-heksana p.a E’merck
- Na2SO4 anhidrous p.a E’merck
- Benzena p.a E’merck
- Kalium Iodida p.a E’merck
- Metanol p.a E’merck
- Anilina p.a E’merck
- Fenilhidrazin p.a E’merck
- Serbuk Zn p.a E’merck
- Asam Asetat glacial p.a E’merck
- Asam Klorida p.a E’merck
- CaCl2 anhidrous p.aE’merck
- Na2SO4 anhidrous p.a E’merck
- Akuades - Es batu
- Pereaksi Fehling - Pereaksi Tollens - Plat seng
- Plat KLT Kieselgel 60 F254
- Dimetilsulfoksida (DMSO) p.aE’merck - Media Nutrient Agar (NA) p.aE’merck - Media Nutrient Broth (NB) p.aE’merck - Media Muller Hinton Agar (MHA) p.aE’merck - Biakan Staphylococcus aureus
- Biakan Escherichia coli
3.3 Prosedur Penelitian
3.3.1 Pembuatan Reagen
3.3.1.1Pembuatan KI 5 %
3.3.1.2 Pembuatan K2Cr2O7 0,1 N
Ditimbang 14,7 g kristal K2Cr2O7 dan dilarutkan dengan akuades dalam labu takar
500 mL sampai garis batas.
3.3.1.3 Pembuatan Na2S2O3 0,1 N
Ditimbang 6,25 g Kristal Na2S2O3.5H2O dilarutkan dengan akuades dan diencerkan
dalam labu takar 250 mL sampai garis tanda lalu distandarisasi dengan larutan K2Cr2O7 0,1 N menggunakan indikator amilum mengikuti titrasi iodometri.
3.3.1.4 Pembuatan CH3COOH 20%
Sebanyak 20 mL CH3COOH glasial dilarutkan dengan akuades dalam labu takar 100
mL sampai garis batas.
3.3.1.5 Pembuatan Indikator Amilum
Ditimbang 1 g serbuk amilum dan dilarutkan dengan 100 mL akuades dan dipanaskan sambil diaduk di atas pemanas hingga mendidih dan disaring dalam keadaan panas.
3.3.2 Pembuatan Metil Ester Asam Lemak Minyak Kelapa Sawit
Sebanyak 100 mL minyak kelapa sawit (RBD Palm Olein) dimasukkan ke dalam labu leher dua 1000 mL, kemudian ditambahkan 120 mL metanol dan 120 mL benzena. Dirangkai alat refluks yang dilengkapi dengan magnetik bar, termometer dan perangkap air berupa tabung CaCl2 pada ujung kondensor. Kemudian diteteskan 2 mL
H2SO4(p) secara perlahan-lahan melalui corong penetes dalam keadaan dingin dan
dikeringkan kembali dengan Na2SO4 anhidrous kemudian disaring. Filtrat yang
diperoleh dirotarievaporasi hingga pelarutnya habis. Metil ester asam lemak kelapa sawit yang diperoleh dianalisis dengan spektrofotometer FT-IR dan ditentukan nilai bilangan iodinnya.
3.3.3 Ozonolisis Metil Ester Asam Lemak Minyak Kelapa Sawit
Sebanyak 200 mL metil ester asam lemak minyak kelapa sawit dimasukkan ke dalam gelas Erlenmeyer 1000 mL. Ditambahkan 200 mL n-heksana dan 100 mL KI 5% kemudian diaduk hingga merata. Dimasukkan selang alat ozonisator ke dalam gelas Erlenmeyer tersebut. Diozonolisis pada suhu ≤ 10oC selama 20 jam hingga diperoleh campuran. Direduksi campuran dengan 5 g serbuk Zn dalam 200 mL asam asetat encer, kemudian diaduk selama ± 15 menit. Dipisahkan seng dan padatan yang terbentuk dengan cara menyaring dan asam asetat dicuci dengan akuades kemudian diuapkan asam asetat dengan destilasi vakum sehingga diperoleh campuran aldehida dari metil ester asam lemak minyak kelapa sawit, kemudian diuji dengan pereaksi Fehling, pereaksi Tollens, dianalisa dengan spektrofotometer FT-IR, ditentukan nilai bilangan iodinnya dan ditentukan efisiensi inhibitor korosinya.
3.3.4 Sintesis Basa Schiff dari Aldehida Turunan Metil Ester Asam Lemak
Minyak Kelapa Sawit yang Diikuti Kondensasi dengan Anilina (Basa
Schiff I)
Basa Schiff dipersiapkan dengan kondensasi campuran aldehida dari metil ester asam lemak minyak kelapa sawit sebanyak 10 g (0,0838 mol) yang dilarutkan dengan 20 mL toluena dan dimasukkan ke dalam labu leher dua. Dirangkai alat refluks yang dilengkapi dengan magnetik bar, termometer dan perangkap air berupa tabung CaCl2
fasa gerak campuran pelarut etil asetat : n-heksana (6:4) v/v untuk membuktikan bahwa anilina telah habis, dilakukan analisa dengan menggunakan spektrofotometer FT-IR, ditentukan nilai bilangan iodinnya, diuji aktivitas antibakterinya dan ditentukan efisiensi inhibitor korosinya.
3.3.5 Sintesis Basa Schiff dari Aldehida Turunan Metil Ester Asam Lemak
Minyak Kelapa Sawit yang Diikuti Kondensasi dengan Fenilhidrazin
(Basa Schiff II)
Basa Schiff dipersiapkan dengan kondensasi campuran aldehida dari metil ester asam lemak minyak kelapa sawit 10 g (0,0838 mol) yang dilarutkan dengan 20 mL toluena dan dimasukkan ke dalam labu leher dua. Dirangkai alat refluks yang dilengkapi dengan magnetik bar, termometer dan perangkap air berupa tabung CaCl2 pada ujung
kondensor. Selanjutnya diteteskan fenilhidrazin sebanyak 11 g (0,1019 mol) melalui corong penetes secara perlahan-lahan ke dalam campuran tersebut. Kemudian direfluks selama 4 jam sambil diaduk. Selanjutnya pelarut dan kelebihan fenilhidrazin diuapkan dengan destilasi vakum. Residu hasil penguapan dilarutkan dalam 10 ml metanol kemudian didinginkan dan disaring residu yang diperoleh. Setelah dilakukan pemeriksaan melalui analisa KLT dengan menggunakan fasa diam Kieselgel 60 F254
dan fasa gerak campuran pelarut etil asetat : n-heksana (6:4) v/v untuk membuktikan bahwa fenilhidrazin telah habis, residu yang diperoleh dikeringkan dalam desikator. Selanjutnya hasil yang diperoleh dianalisa dengan menggunakan spektrofotometer FT-IR, ditentukan nilai bilangan iodinnya, diuji aktivitas antibakterinya dan ditentukan efisiensi inhibitor korosinya.
3.3.6 Analisa Bilangan Iodin
Analisa ini dilakukan terhadap metil ester asam lemak minyak kelapa sawit, aldehida turunan dari metil ester asam lemak minyak kelapa sawit, Basa Schiff hasil kondensasi dengan anilina (Basa Schiff I) dan Basa Schiff hasil kondensasi dengan fenilhidrazin (Basa Schiff II).
benar-benar larut. Ditambahkan larutan Wijs ke dalam gelas Erlenmeyer sebanyak 25 mL kemudian ditutup dan dikocok hingga campuran benar-benar bercampur . Disimpan bahan tersebut dalam ruang gelap selama ± 30 menit. Diambil bahan tersebut dari tempat penyimpanan lalu ditambahkan 25 mL larutan KI 10% dan 150 mL air suling. Dititrasi dengan larutan Na2S2O3 0,1 N sampai warna kuning hampir hilang (kuning
pucat). Ditambahkan 1-2 mL indikator amilum ke dalamnya dan dititrasi kembali sampai warna biru hilang.
Dilakukan hal yang sama terhadap larutan blanko dan dihitung dengan rumus:
Bilangan iodin =
(B-S) x N x 12,69 Massa sampel (gram) Dimana:
B= Volume titrasi blanko (mL) S= Volume titrasi sampel (mL) N= Normalitas Na2S2O3
3.3.7 Pengujian Sifat Antibakteri Basa Schiff
3.3.7.1 Pembuatan Media Mueller Hinton Agar (MHA)
Dimasukkan 7,6 g media MHA ke dalam gelas Erlenmeyer, dilarutkan dengan 200 mL akuades yang diikuti dengan pemanasan dan pengadukan, lalu disterilkan di dalam autoklaf pada suhu 1210C selama 15 menit.
3.3.7.2 Pembuatan Media Nutrien Agar (NA) Miring dan Stok Kultur Bakteri
utama dengan jarum ose lalu digoreskan pada media NA yang telah memadat. Diinkubasi selama 18-24 jam pada suhu 350C.
3.3.7.3 Pembuatan Media Nutrient Broth (NB)
Dimasukkan 6,5 g media NB ke dalam Erlenmeyer dilarutkan dengan 500 mL akuades yang diikuti dengan pemanasan dan pengadukan, lalu disterilkan di autoklaf 1210C selama 15 menit.
3.3.7.4 Pembuatan Inokulum Bakteri
Dimasukkan 5 mL media NB steril dalam tabung reaksi dan diinkubasikan selama 2-3 jam, kemudian ditambahkan Staphylococcus aureus yang sudah di subkultur ke dalam media NB dengan menggunakan jarum ose yang sudah steril, diukur kekeruhan larutan pada panjang gelombang 580 nm sampai diperoleh transmitan 25 %. Dilakukan dengan cara yang sama terhadap bakteri Escherichia coli.
3.3.7.5 Uji Sifat Antibakteri Basa Schiff
3.3.8 Penentuan Efisiensi Inhibitor
3.3.8.1 Persiapan Spesimen
Spesimen atau sampel seng dibuat dengan panjang 5 cm dan lebar 1,5 cm dihaluskan permukaannya dengan menggunakan ampelas besi. Permukaaan yang telah halus ini dicuci dengan akuades, dikeringkan kemudian ditimbang beratnya.
3.3.8.2 Pembuatan Larutan Induk Korosif
Larutan media korosi HCl 0,1 N dibuat dengan cara mengencerkan 8,3 mL HCl 37 % dalam labu takar ukuran 1000 mL sampai tanda batas dengan akuades.
3.3.8.3 Pembuatan Larutan Induk Inhibitor
Larutan inhibitor korosi Basa Schiff 10000 ppm dengan pelarut larutan HCl 0,1 N. Larutan tersebut dibuat dengan melarutkan 1 g Basa Schiff dengan HCl 0,1 N dalam labu takar 100 mL sampai garis batas. Larutan inhibitor yang diinginkan dibuat dengan cara mengencerkan larutan induk 10000 ppm menggunakan larutan HCl 0,1 N dengan variasi larutan inhibitor 1000 ppm, 3000 ppm, 5000 ppm dan 7000 ppm.
3.3.8.4 Uji Efisiensi Inhibitor
Larutan perendaman lempeng seng diambil dari larutan inhibitor 1000 ppm sebanyak 50 mL dimasukkan ke dalam wadah kaca. Lempeng seng yang telah diamplas direndam dalam larutan tersebut selama 24 jam. Lempeng seng diangkat dari media korosi, dicuci secara hati-hati dengan menggunakan sikat halus dan lembut, kemudian dibiarkan kering selama 5 menit dan ditimbang berat akhirnya.
Dimana:
EI = Efisiensi Inhibitor
W0 = kehilangan berat tanpa menggunakan inhibitor
W1 = Kehilangan berat menggunakan inhibitor
Dengan prosedur yang sama seperti diatas dilakukan untuk variasi konsentrasi larutan 0 ppm, 3000 ppm, 5000 ppm dan 7000 ppm dengan waktu perendaman 48, 72, 96 dan 120 jam demikian juga uji effisiensi inhibitor untuk campuran aldehida, anilina, fenilhidrazin, Basa Schiff I dan Basa Schiff II.
3.3.9 Analisis dengan Spektroskopi FT- IR
3.4 Bagan Penelitian
3.4.1 Pembuatan Metil Ester Asam Lemak Minyak Kelapa Sawit
100 mL Minyak Kelapa Sawit (RBD Palm Olein)
Dimasukkan kedalam labu leher dua 1000 mL Ditambahkan 120 mL metanol
Ditambahkan 120 mL benzena
Dirangkai alat refluks yang dilengkapi dengan magnetik bar, termometer dan perangkap air berupa tabung CaCl2
pada ujung kondensor
Ditambahkan 2 mL H2SO4(p) secara perlahan-lahan melalui corong penetes
Direfluks selama 5 jam sambil diaduk Campuran
Diuapkan kelebihan metanol dan pelarut nya dengan rotarievavorator
Residu
Diekstraksi dengan 100 mL n-heksana Dicuci berturut-turut dengan 10 mL akuades
Lapisan n-heksana
Dikeringkan dengan CaCl2 anhidrous selama 1 jam
Disaring Lapisan n-heksana
Dikeringkan dengan Na2SO4 anhidrous selama 1 jam
Disaring
Lapisan n-heksana
Dirotarievavorasi hingga pelarutnya habis
Analisa FT-IR
Residu
Residu Destilat
Residu
Metil ester asam lemak minyak kelapa sawit
3.4.2 Ozonolisis Metil Ester Asam Lemak Minyak Kelapa Sawit
200 mL Metil Ester Asam Lemak Minyak Kelapa Sawit
Dimasukkan ke dalam gelas Erlenmeyer 1000 mL Ditambahkan 100 mL KI 5%
Diaduk hingga merata
Dimasukkan selang alat ozonisator ke dalam gelas Erlenmeyer tersebut
Ditutup sampai rapat Diozonolisis pada suhu Campuran
Ditambahkan 5 g serbuk Zn
Ditambahkan 200 mL asam asetat encer Diaduk selama ± 15 menit
Disaring dengan corong vakum
Filtrat Residu
Diuapkan asam asetat dengan destilasi vakum Hasil
Uji Pereaksi
Fehling Uji PereaksiTollens
Analisa FT-IR Dicuci dengan akuades
Ditambahkan 200 mL n-heksana
Penentuan Nilai
Bilangan Iodin Penentuan EfisiensiInhibitor Korosi
3.4.3 Sintesis Basa Schiff dari Aldehida Turunan Metil Ester Asam Lemak
Minyak Kelapa Sawit yang Diikuti Kondensasi dengan Anilina (Basa
Schiff I)
10 g (0,0838 mol) Campuran Aldehida
Dilarutkan dengan 20 mL toluena Dimasukkan kedalam labu leher dua
Dirangkai alat refluks yang dilengkapi dengan magnetik bar, termometer dan perangkap air berupa tabung CaCl2 pada ujung kondensor
Ditambahakan anilina sebanyak 11 g (0,1182 mol) melalui corong penetes secara perlahan-lahan
Direfluks selama 4 jam sambil diaduk Campuran
Diuapkan pelarut dan kelebihan anilina dengan destilasi vakum
Residu Destilat
Analisa FT-IR
Penentuan Nilai Bilangan Iodin Penentuan Efisiensi Inhibitor Korosi
Uji Aktivitas Antibakteri
3.4.4 Sintesis Basa Schiff dari Aldehida Turunan Metil Ester Asam Lemak
Minyak Kelapa Sawit yang Diikuti Kondensasi dengan Fenilhidrazin
(Basa Schiff II)
10 g (0,0838 mol) Campuran Aldehida
Dilarutkan dengan 20 mL toluena Dimasukkan ke dalam labu leher dua
Dirangkai alat refluks yang dilengkapi dengan magnetik bar, termometer dan perangkap air berupa tabung CaCl2 pada ujung kondensor
Ditambahkan fenilhidrazin sebanyak 11 g (0,1019 mol) melalui corong penetes secara perlahan-lahan
Direfluks selama 4 jam sambil diaduk Campuran
Diuapkan pelarut dan kelebihan fenilhidrazin dengan destilasi vakum
Residu Destilat
Analisa FT-IR Penentuan Nilai Bilangan Iodin Penentuan Efisiensi Inhibitor Korosi
Uji Aktivitas Antibakteri
Dilarutkan dalam 10 mL metanol Didinginkan dan disaring
Residu Destilat
Dikeringkan dalam desikator
3.4.5 Uji Sifat Antibakteri Basa Schiff
3.4.5.1 Pembuatan Media Mueller Hinton Agar (MHA)
3.4.5.2 Pembuatan Media Nutrient Agar Miring dan Stok Kultur Bakteri
7,6 g media MHA (Mueller Hinton Agar)
Dilarutkan dengan 200 mL akuades dalam Erlenmeyer
Dipanaskan sambil diaduk hingga larut dan mendidih Disterilkan dalam autoklaf pada suhu 1210C selama 15 menit
Media MHA (Mueller Hinton Agar) steril
7 g media NA (Nutrient Agar)
Dilarutkan dengan 250 mL akuades ke dalam Erlenmeyer Dipanaskan sambil diaduk hingga larut dan mendidih
Disterilkan dalam autoklaf pada suhu 1210C selama 15 menit Media NA (Nutrient Agar) steril
Dituangkan ke dalam tabung reaksi sebanyak 3 mL Dibiarkan pada temperatur kamar sampai memadat pada posisi miring membentuk sudut 300-450C Diambil biakan bakteri Staphylococcus aureus dari strain utama dengan jarum ose lalu digoreskan pada media NA yang telah memadat
d j l l di k d di NA
Diinkubasi pada suhu 350C selama 18-24 jam
Stok kultur bakteri Staphylococcus aureus
3.4.5.3 Penyiapan Inokulum Bakteri
6,5 g media NB (Nutrient Broth)
Dilarutkan dengan 500 mL akuades ke dalam Erlenmeyer Dipanaskan sambil diaduk hingga larut dan mendidih
Disterilkan dalam autoklaf pada suhu 1210C selama 15 menit
Media NB (Nutrient Broth) steril
Dituangkan ke dalam tabung reaksi sebanyak 5 mL Diambil koloni bakteri Staphylococcus aureus dari stok kultur bakteri dengan jarum ose Disuspensikan ke dalam Nutrient Broth (NB) Diinkubasi pada suhu 350C selama 2-3 jam
Diukur kekeruhan larutan pada panjang gelombang 580-600 nm sampai diperoleh transmitan 25 %
Inokulum bakteri Staphylococcus aureus
3.4.5.4 Uji Aktivitas Antibakteri Basa Schiff
3.4.6 Pembuatan Variasi Konsentrasi Larutan Induk Inhibitor dan Larutan
Korosif Sebagai Media Perendaman
1 g Basa Schiff
dimasukkan ke dalam labu takar 100 mL ditambahkan HCl 0,1 N sampai garis batas dihomogenkan
Basa Schiff 10000 ppm
diencerkan kembali dengan HCl 0,1 N dalam labu takar 50 mL untuk membuat variasi konsentrasi
1000 ppm
(gelas I) 3000 ppm(gelas II) 5000 ppm(gelas III) 7000 ppm(gelas IV) 0,1 mL Inokulum Bakteri
Dimasukkan ke dalam cawan petri
Ditambahkan 15 mL MHA dengan suhu 450-500C Dihomogenkan sampai media dan bakteri tercampur rata Dibiarkan sampai media memadat
Dimasukkan kertas cakram yang telah direndam dengan Basa Schiff ke dalam cawan petri yang telah berisi bakteri
Diinkubasi pada suhu 350C selama 24 jam dalam inkubator
Diukur diameter zona bening disekitar cakram dengan jangka sorong
3.4.7 Penentuan Effisiensi Inhibitor Korosi
Lempeng Seng ukuran 5 cm x 1,5 cm
dihaluskan permukaannya dengan ampelas besi
dicuci dengan akuades dan dikeringkan pada suhu kamar ditimbang beratnya (berat awal)
dimasukkan ke dalam wadah yang berisi media perendaman Basa Schiff 1000 ppm
dibiarkan lempeng seng terendam selama 24 jam
diangkat dan dicuci secara hati-hati dengan menggunakan sikat halus dan lembut
dikeringkan pada suhu kamar ditimbang berat akhirnya
dihitung efisiensi inhibitor korosinya Hasil
BAB 4
HASIL DAN PEMBAHASAN
4.1 Hasil Penelitian
4.1.1 Pembuatan Metil Ester Asam Lemak Minyak Kelapa Sawit Melalui Reaksi
Esterifikasi
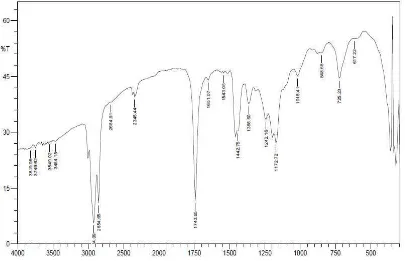
[image:43.595.111.516.482.743.2]Metil ester asam lemak minyak kelapa sawit diperoleh dari hasil esterifikasi antara minyak kelapa sawit (RBD Palm Olein) dengan metanol absolut dalam pelarut benzena menggunakan katalis asam sulfat pekat pada suhu 80-90oC. Volume rata-rata metil ester asam lemak yang diperoleh yaitu 95 mL. Spektrum FT-IR dari campuran metil ester asam lemak minyak kelapa sawit memberikan puncak-puncak serapan kimia pada bilangan gelombang 3010 cm-1, 2924,09 cm-1, 2854,65 cm-1, 2681,91 cm-1, 2345,44 cm-1, 1743,65 cm-1, 1651,07 cm-1, 1442,75 cm-1, 1365,6 cm-1, 1242,16 cm-1, 1172,72 cm-1, 1018,41 cm-1, 848,68 cm-1, 725,23 cm-1 dan 617,22 cm-1 (Gambar 4.1).
Minyak kelapa sawit yang digunakan adalah RBD Palm Olein dengan komposisi kemurnian berdasarkan hasil analisis kromatografi gas memberikan kromatogram (Lampiran 1) kandungan asam lemak seperti pada tabel 4.1.
Tabel 4.1 Komposisi Asam Lemak pada Minyak Kelapa Sawit (RBD Palm Olein)
Asam lemak Rantai karbon Kandungan (%)
Asam Lemak Jenuh
Asam laurat C12:0 0,24
Asam miristat C14:0 1,06
Asam palmitat C16:0 37,22
Asam stearat C18:0 4,04
Asam Lemak Tak Jenuh
Asam oleat C18:1 45,58
Asam linoleat C18:2 10,69
Asam linolenat C18:3 0,16
4.1.2 Ozonolisis Metil Ester Asam Lemak Minyak Kelapa Sawit
Senyawa aldehida turunan metil ester asam lemak minyak kelapa sawit diperoleh dari hasil ozonolisis metil ester asam lemak minyak kelapa sawit dengan adanya ozon yang bereaksi terhadap gugus alkena pada suhu ≤ 10oC kemudian dihidrolisis dengan menggunakan serbuk Zn dalam asam asetat. Dari 200 mL metil ester asam lemak minyak kelapa sawit yang digunakan diperoleh aldehida turunan metil ester asam lemak minyak kelapa sawit sebanyak 110 mL. Hasil aldehida kemudian diuji dengan pereaksi Fehling yang akan menghasilkan endapan berwarna merah bata (Cu2O(s)). Uji
lainnya terhadap senyawa aldehida yaitu uji dengan pereaksi Tollens yang akan menghasilkan endapan berupa cermin perak (Ag(s)). Spektrum FT-IR dari campuran
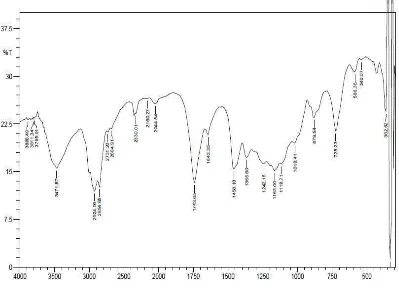
-1
[image:45.595.115.514.138.426.2], 1018,41 cm-1, 879,54 cm-1, 725,23 cm-1, 586,36 cm-1, 540,07 cm-1 dan 362,62 cm-1 (Gambar 4.2).
Gambar 4.2 Spektrum FT-IR Campuran Aldehida Turunan Metil Ester Asam Lemak Minyak Kelapa Sawit
4.1.3 Sintesis Basa Schiff dari Campuran Aldehida Turunan Metil Ester Minyak Kelapa Sawit dengan Anilina (Basa Schiff I)
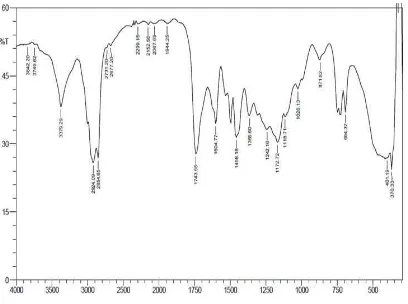
Basa Schiff ini dihasilkan dari reaksi kondensasi antara campuran aldehida turunan metil ester asam lemak minyak kelapa sawit dengan dengan anilina sebagai sumber amina primer dalam pelarut toluena yang direfluks selama 4 jam. Hasil dari reaksi ini kemudian dimurnikan dengan cara pemisahan kelebihan anilina dan pelarut melalui destilasi vakum sehingga diperoleh Basa Schiff campuran. Dari hasil analisa Basa Schiff menggunakan Spektroskopi FT-IR diperoleh spektrum dengan puncak-puncak daerah serapan pada bilangan gelombang 3379,29 cm-1, 2924,09 cm-1, 2854,65 cm-1, 2731,2 cm-1, 2677,2 cm-1, 2337,72 cm-1, 2175,7 cm-1, 2067,69 cm-1, 1944,25 cm
-1
1172,72 cm-1, 1018,41 cm-1, 848,68 cm-1, 725,23 cm-1, 601,79 cm-1 dan 501,49 cm-1 (Gambar 4.3).
Gambar 4.3 Spektrum FT-IR Basa Schiff I
4.1.4 Sintesis Basa Schiff dari Campuran Aldehida Metil Ester Asam Lemak
Minyak Kelapa Sawit dengan Fenilhidrazin (Basa Schiff II)
cm-1, 1550,77 cm-1, 1442,75 cm-1, 1381,03 cm-1, 1249,87 cm-1, 1049,28 cm-1, 925,83 cm-1, 825,53 cm-1 dan 370,33 cm-1 (Gambar 4.4).
Gambar 4.4 Spektrum FT-IR Basa Schiff II
4.1.5 Penentuan Bilangan Iodin
Tabel 4.2 Hasil Uji Bilangan Iodin pada Metil Ester Asam Lemak Minyak Kelapa Sawit, Campuran Aldehida Turunan Metil Ester Asam Lemak Minyak Kelapa Sawit, Basa Schiff I dan Basa Schiff II
Sampel Bilangan Iodin
Metil ester asam lemak minyak kelapa
sawit
118,02
Campuran aldehida turunan metil ester
asam lemak minyak kelapa sawit
83,30
Basa Schiff I 123,32
Basa Schiff II 135,95
4.1.6 Hasil Uji Aktivitas Antibakteri Basa Schiff
[image:48.595.109.527.543.651.2]Uji aktivitas antibakteri ditentukan berdasarkan metode difusi agar. Sifat antibakteri Basa Schiff menunjukkan zona hambat pada pertumbuhan bakteri Staphylococcus aureus dan Escherichia coli seperti yang ditunjukkan pada tabel dibawah ini:
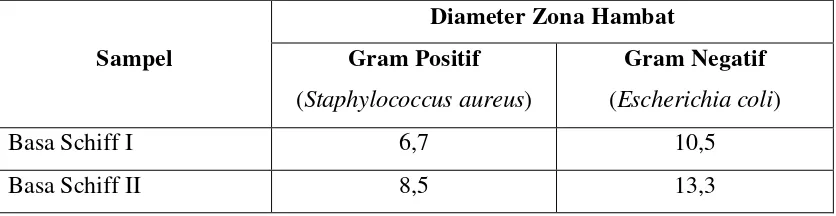
Tabel 4.3 Diameter Zona Hambat (mm) Basa Schiff Terhadap Bakteri Staphylococcus aureus dan Escherichia coli
Sampel
Diameter Zona Hambat
Gram Positif
(Staphylococcus aureus)
Gram Negatif
(Escherichia coli)
Basa Schiff I 6,7 10,5
Basa Schiff II 8,5 13,3
4.1.7 Penentuaan Efisiensi Inhibitor Korosi
Tabel 4.4 Hasil Perendaman Lempeng Seng dengan Menggunakan Inhibitor
Campuran Aldehida Metil Ester Asam Lemak Minyak Kelapa Sawit dalam Larutan Media Korosif HCl 0,1 N
Konsentrasi Inhibitor (ppm) Waktu Perendaman (jam) Berat Awal Lempeng Seng (g) Berat Akhir Lempeng Seng (g) Kehilangan Berat Lempeng Seng (g) Efisiensi Inhibitor (%) Efisiensi Inhibitor Rata-Rata (%) Campuran Aldehida 0 ppm (tanpa inhibitor)
24 1,0604 0,9879 0,0725 -
0
48 1,0561 0,9811 0,0750 -
72 1,0685 0,9893 0,0792 -
96 1,0657 0,9837 0,0820 -
120 1,1148 1,0286 0,0862 -
Campuran
Aldehida
1000 ppm
24 1,0672 1,0242 0,0430 40,68
47,35 48 1,0912 1,0495 0,0417 44,40
72 1,0654 1,0244 0,0410 48,23 96 1,0655 1,0255 0,0400 51,22 120 1,0901 1,0489 0,0412 52,20
Campuran
Aldehida
3000 ppm
24 1,0431 1,0045 0,0386 46,76
52,38 48 1,0524 1,0136 0,0388 48,27
72 1,0793 1,0418 0,0375 52,65 96 1,0643 1,0280 0,0363 55,73 120 1,0602 1,0244 0,0358 58,47
Campuran
Aldehida
5000 ppm
24 1,0634 1,0274 0,0360 50,34
54,23 48 1,0961 1,0596 0,0365 51,33
72 1,0621 1,0261 0,0360 54,45 96 1,0386 1,0028 0,0358 56,34 120 1,1078 1,0722 0,0356 58,70
Campuran
Aldehida
7000 ppm
24 1,0683 1,0325 0,0358 50,62
54,94 48 1,1113 1,0752 0,0361 51,86
Tabel 4.5 Hasil Perendaman Lempeng Seng dengan Menggunakan Inhibitor Anilina dalam Larutan Media Korosif HCl 0,1 N
Konsentrasi Inhibitor (ppm) Waktu Perendaman (jam) Berat Awal Lempeng Seng (g) Berat Akhir Lempeng Seng (g) Kehilangan Berat Lempeng Seng (g) Efisiensi Inhibitor (%) Efisiensi Inhibitor Rata-Rata (%) Anilina 0 ppm (tanpa inhibitor)
24 1,0336 0,9592 0,0744 -
0
48 1,0823 1,0071 0,0752 -
72 1,0332 0,9516 0,0816 -
96 1,1135 1,0290 0,0845 -
120 1,1113 1,0243 0,0870 -
Anilina
1000 ppm
24 1,0787 1,0354 0,0433 41,80
49,51 48 1,0853 1,0448 0,0405 46,14
72 1,0875 1,0475 0,0400 50,98 96 1,0912 1,0514 0,0398 52,90 120 1,0773 1,0388 0,0385 55,75
Anilina
3000 ppm
24 1,0406 1,0016 0,0390 47,58
53,78 48 1,0311 0,9929 0,0382 49,20
72 1,1085 1,0710 0,0375 54,04 96 1,0901 1,0541 0,0360 57,40 120 1,0771 1,0429 0,0342 60,69
Anilina
5000 ppm
24 1,1465 1,1155 0,0310 58,33
62,68 48 1,1266 1,0958 0,0308 59,04
72 1,0674 1,0373 0,0301 63,11 96 1,0387 1,0087 0,0300 64,50 120 1,0943 1,0668 0,0275 68,39
Anilina
7000 ppm
24 1,1298 1,1038 0,0260 65,05
72,18 48 1,0567 1,0334 0,0233 69,02
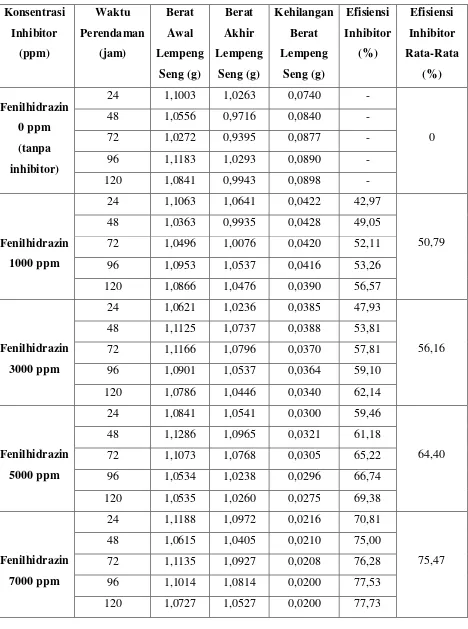
[image:51.595.90.546.117.744.2]Tabel 4.6 Hasil Perendaman Lempeng Seng dengan Menggunakan Inhibitor Fenilhidrazin dalam Larutan Media Korosif HCl 0,1 N
Konsentrasi Inhibitor (ppm) Waktu Perendaman (jam) Berat Awal Lempeng Seng (g) Berat Akhir Lempeng Seng (g) Kehilangan Berat Lempeng Seng (g) Efisiensi Inhibitor (%) Efisiensi Inhibitor Rata-Rata (%) Fenilhidrazin 0 ppm (tanpa inhibitor)
24 1,1003 1,0263 0,0740 -
0
48 1,0556 0,9716 0,0840 -
72 1,0272 0,9395 0,0877 -
96 1,1183 1,0293 0,0890 -
120 1,0841 0,9943 0,0898 -
Fenilhidrazin
1000 ppm
24 1,1063 1,0641 0,0422 42,97
50,79 48 1,0363 0,9935 0,0428 49,05
72 1,0496 1,0076 0,0420 52,11 96 1,0953 1,0537 0,0416 53,26 120 1,0866 1,0476 0,0390 56,57
Fenilhidrazin
3000 ppm
24 1,0621 1,0236 0,0385 47,93
56,16 48 1,1125 1,0737 0,0388 53,81
72 1,1166 1,0796 0,0370 57,81 96 1,0901 1,0537 0,0364 59,10 120 1,0786 1,0446 0,0340 62,14
Fenilhidrazin
5000 ppm
24 1,0841 1,0541 0,0300 59,46
64,40 48 1,1286 1,0965 0,0321 61,18
72 1,1073 1,0768 0,0305 65,22 96 1,0534 1,0238 0,0296 66,74 120 1,0535 1,0260 0,0275 69,38
Fenilhidrazin
7000 ppm
24 1,1188 1,0972 0,0216 70,81
75,47 48 1,0615 1,0405 0,0210 75,00
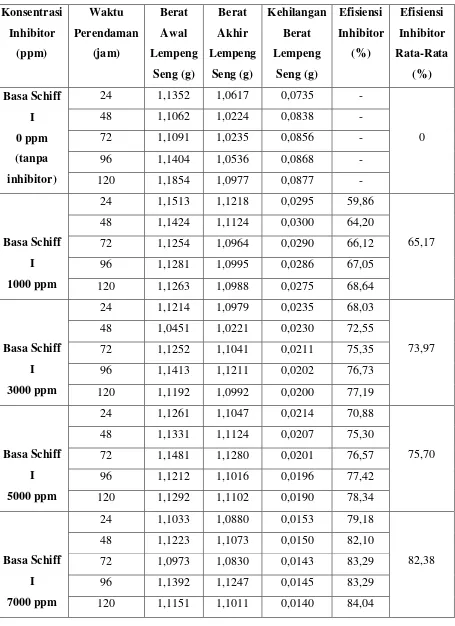
Tabel 4.7 Hasil Perendaman Lempeng Seng dengan Menggunakan Inhibitor Basa Schiff I dalam Larutan Media Korosif HCl 0,1 N
Konsentrasi Inhibitor (ppm) Waktu Perendaman (jam) Berat Awal Lempeng Seng (g) Berat Akhir Lempeng Seng (g) Kehilangan Berat Lempeng Seng (g) Efisiensi Inhibitor (%) Efisiensi Inhibitor Rata-Rata (%) Basa Schiff I 0 ppm (tanpa inhibitor)
24 1,1352 1,0617 0,0735 -
0
48 1,1062 1,0224 0,0838 -
72 1,1091 1,0235 0,0856 -
96 1,1404 1,0536 0,0868 -
120 1,1854 1,0977 0,0877 -
Basa Schiff
I
1000 ppm
24 1,1513 1,1218 0,0295 59,86
65,17 48 1,1424 1,1124 0,0300 64,20
72 1,1254 1,0964 0,0290 66,12 96 1,1281 1,0995 0,0286 67,05 120 1,1263 1,0988 0,0275 68,64
Basa Schiff
I
3000 ppm
24 1,1214 1,0979 0,0235 68,03
73,97 48 1,0451 1,0221 0,0230 72,55
72 1,1252 1,1041 0,0211 75,35 96 1,1413 1,1211 0,0202 76,73 120 1,1192 1,0992 0,0200 77,19
Basa Schiff
I
5000 ppm
24 1,1261 1,1047 0,0214 70,88
75,70 48 1,1331 1,1124 0,0207 75,30
72 1,1481 1,1280 0,0201 76,57 96 1,1212 1,1016 0,0196 77,42 120 1,1292 1,1102 0,0190 78,34
Basa Schiff
I
7000 ppm
24 1,1033 1,0880 0,0153 79,18
82,38 48 1,1223 1,1073 0,0150 82,10
Tabel 4.8 Hasil Perendaman Lempeng Seng dengan Menggunakan Inhibitor Basa Schiff II dalam Larutan Media Korosif HCl 0,1 N
Konsentrasi Inhibitor (ppm) Waktu Perendaman (jam) Berat Awal Lempeng Seng (g) Berat Akhir Lempeng Seng (g) Kehilangan Berat Lempeng Seng (g) Efisiensi Inhibitor (%) Efisiensi Inhibitor Rata-Rata (%) Basa Schiff II 0 ppm (tanpa inhibitor)
24 1,0344 0,9614 0,0730 -
0
48 1,1441 1,0619 0,0822 -
72 1,1354 1,0494 0,0860 -
96 1,1014 1,0143 0,0871 -
120 1,0622 0,9737 0,0885 -
Basa Schiff
II
1000 ppm
24 1,0913 1,0628 0,0285 60,96
68,24 48 1,1333 1,1057 0,0276 66,42
72 1,1093 1,0823 0,0270 68,60 96 1,1303 1,1035 0,0268 69,23 120 1,1174 1,0909 0,0265 70,06
Basa Schiff
II
3000 ppm
24 1,0132 0.9909 0,0223 69,45
74,45 48 1,1602 1,1382 0,0220 73,24
72 1,1232 1,1015 0,0217 74,77 96 1,0914 1,0712 0,0202 76,81 120 1,1163 1,0968 0,0195 77,97
Basa Schiff
II
5000 ppm
24 1,1261 1,1047 0,0214 70,88
75,70 48 1,1331 1,1124 0,0207 75,30
72 1,1481 1,1280 0,0201 76,57 96 1,1212 1,1016 0,0196 77,42 120 1,1292 1,1102 0,0190 78,34
Basa Schiff
II
7000 ppm
24 1,0451 1,0326 0,0125 82,88
85,44 48 1,1051 1,0926 0,0125 84,79
4.2 Pembahasan
4.2.1 Pembentukan Metil Ester Asam Lemak Minyak Kelapa Sawit Melalui
Reaksi Esterifikasi
Metil ester asam lemak minyak kelapa sawit diperoleh melalui reaksi antara minyak kelapa sawit (RBD Palm Olein) dengan metanol absolut menggunakan katalis H2SO4.
Dalam hal ini asam lemak yang diutamakan adalah asam lemak tak jenuh yaitu asam oleat (45,58 %) , asam linoleat (10,69 %) , asam linolenat (0,16 %). Reaksi yang terjadi sebagai berikut (Gambar 4.5):
H2C O
CH O
H2C O
C C C O O O
(CH2)7
(CH2)7
(CH2)7
C H H C C H H C
CHCH2CH
CHCH2CH
(CH2)7 CH3
C H
CHCH2CH
(CH2)4
CHCH2CH3
CH3 + 3 CH3OH
H2SO4 Benzena Metanol
Minyak Kelapa Sawit
H3C (CH2)7 C
H CH (CH2)7 C
O
OCH3
H3C (CH2)4 C
H CHCH2CH CH (CH2)7 C
O
OCH3
CH3CH2CH CHCH2CH CHCH2CH
H
C (CH2)7 C
O
OCH3
+ 3 H2O
Metil Oleat
Metil Linoleat
[image:55.595.110.523.299.632.2]Metil Linolenat
Gambar 4.5 Reaksi Pembentukan Metil Ester Asam Lemak Minyak Kelapa Sawit
gelombang 1651,07 cm-1 yang merupakan serapan khas dari ikatan C=C. Pada bilangan gelombang 1743,65 cm-1 merupakan serapan khas dari gugus karbonil (C=O) dari ester dan didukung dengan puncak vibrasi C-O-C pada daerah bilangan gelombang 1172,72 cm-1, sehingga dapat disimpulkan adanya gugus ester. Serapan pada daerah bilangan gelombang 2924,09-2854,65 cm-1 menunjukkan adanya vibrasi vibrasi streching dari C-H sp3 yang didukung vibrasi bending C-H sp3 pada bilangan gelombang 1365,6 cm-1. Pada daerah bilangan gelombang 725,23 cm-1 merupakan vibrasi CH2 pada –(CH2)n- dimana n ≥ 4 (Gambar 4.1).
4.2.2 Hasil Ozonolisis Metil Ester Asam Lemak Minyak Kelapa Sawit
Senyawa aldehida dapat dihasilkan dari hasil ozonolisis metil ester asam lemak minyak kelapa sawit dengan adanya KI 5 % pada suhu ≤ 10 o C dimana penambahan KI dalam proses ozonolisis bertujuan untuk memerangkap ozon berlebih atau menghapus tingkat ambient ozone (ozon bebas) dalam proses ozonolisis (Fick, 2003). Akhir dari proses ozonolisis dihasilkan perubahan warna dari kuning kecoklatan menjadi warna kuning pucat diikuti adanya muncul busa pada lapisan pinggiran sebelah atas (selama 20 jam) yang mana menunjukkan reaksi ozonolisis telah selesai dan dilanjutkan dengan penambahan serbuk Zn dalam larutan asam asetat encer (CH3COOH 20%) yang akan mereduksi ozonida membentuk campuran aldehida
turunan metil ester asam lemak minyak kelapa sawit.
Uji terhadap pereaksi Fehling yang menghasilkan endapan merah bata dan dengan pereaksi Tollens yang menghasilkan endapan cermin perak pada dinding tabung reaksi menunjukkan uji yang positif terhadap aldehida hasil ozonolisis. Dari hasil uji bilangan iodin yaitu sebesar 83,30 sedangkan bilangan iodin metil ester asam lemak minyak kelapa sawit 118,02 menunjukkan bahwa telah terjadi pemutusan ikatan π dari asam lemak tak jenuh pada metil ester asam lemak minyak kelapa sawit (Tabel 4.2).
Dari analisis spektroskopi FT-IR memberikan dukungan spektrum pada daerah bilangan gelombang 2684,91 cm-1 menunjukkan uluran C-H yang khas pada aldehida, didukung oleh puncak serapan pada daerah bilangan gelombang 2924,09-2854,65 cm
-1
pada daerah 1458,18 cm-1. Puncak serapan pada daerah bilangan gelombang 1743,65 cm-1 menunjukkan uluran C=O aldehida/ester didukung oleh vibrasi (CH2)n (dimana
n≥4) dengan munculnya puncak serapan pada daerah panjang gelombang 725,23 cm-1
(Gambar 4.2).
Adapun reaksi ozonolisis dari metil ester asam lemak minyak kelapa sawit secara hipotesis dalam pembuatan campuran aldehida yaitu (Gambar 4.6):
Ozon (O3)
KI 5%
H3C (CH2)4 C
H CHCH2CH CH (CH2)7 C OCH
3
O
CH3CH2CH CHCH2CH CHCH2CH C
H (CH2)7 C
OCH3
O H3C (CH2)7CH C
H (CH2)7 C O OCH3 O O O O O O O O O O O O O O O O O O molozonida H3C (CH2)7 C
H CH (CH2)7 C
O
OCH3
H3C (CH2)4 C
H CHCH2CH CH (CH2)7 C
O
OCH3
CH3CH2CH CHCH2CH CHCH2CH
H
C (CH2)7 C
O
OCH3
Metil Oleat
Metil Linoleat
Metil Linolenat
H3C (CH2)4CH CHCH2CH CH (CH2)7 C
OCH3 O
CH3CH2CH CHCH2CH CHCH2CH
CH (CH2)7 C
OCH3 O H3C (CH2)7CH CH (CH2)7 C
O OCH3 O O O O O O O O O O O O O O O O O O Zn CH3COOH
H3C (CH2)4 C
CCH2C
CH3CH2C
H3C (CH2)7 C C (CH2)7 C O OCH3 O H + H O 3 O O O H H H + 3 O H + Senyawa ozonida campuran aldehida
[image:58.595.111.521.82.359.2]+ Zn(CH3COO)2
Gambar 4.6 Reaksi Ozonolisis Metil Ester Asam Lemak Minyak Kelapa Sawit Membentuk Campuran Aldehida
Munculnya puncak vibrasi pada daerah bilangan gelombang 3471,87 cm-1 yaitu vibrasi gugus –OH dalam reaksi tersebut secara teori dikarenakan adanya hal yang sulit dihindari sehingga sebagian dari molekul dalam reaksi tersebut mengalami perubahan yaitu pada saat berakhirnya ozonolisis yang ditandai terbentuknya busa akibat terjadinya reaksi antara O3 dengan KI membentuk KOH sehingga sebagian
2 KI + O
3+ H
2O
I
2+ 2 KOH + O
2KOH +
C
O
H
(CH2)7 C O
OCH3
C
O
H
(CH2)7 C O
OK
+ CH
3OH
C
O
H
(CH2)7 C O
OK
+ H
+C
O
H
(CH2)7 C O
OH
+ K
+4.2.3 Hasil Sintesis Basa Schiff melalui Reaksi Kondensasi Campuran Aldehida
Turunan Metil Ester Asam Lemak Minyak Kelapa Sawit dengan Anilina (Basa
Schiff I)
Basa Schiff dihasilkan dari hasil reaksi kondensasi campuran aldehida turunan metil ester asam lemak minyak kelapa sawit dengan anilina dilakukan dengan cara direfluks dalam pelarut toluena selama 4 jam. Terjadinya peningkatan bilangan iodin dari 83,30 terhadap campuran aldehida turunan metil ester asam lemak minyak kelapa sawit menjadi 123,32 terhadap basa Schiff I menunjukkan bahwa telah terbentuknya ikatan rangkap pada C=N. Analisa dengan spektroskopi FT-IR munculnya uluran C=N pada puncak serapan daerah bilangan gelombang 1604,77 cm-1 yang tajam menunjukkan serapan khas basa Schiff, didukung gugus C=O ester pada bilangan gelombang 1743,65 cm-1, serapan khas vibrasi streching C-H sp3 pada bilangan gelombang 2924,09 cm-1 dan serapan khas vibrasi bending C-H sp3 pada bilangan gelombang 1458,18 cm-1 (Gambar 4.3).
H3C (CH2)4 C CH3CH2C CCH2C H3C (CH2)7 C C (CH2)7 C
O OCH3 O H + H O 3
O O O
H H H
+ 3 O H + + Campuran Aldehida 12 NH2 refluks
H3C (CH2)4 C H
CHCH2CH
CH3CH2CH H3C (CH2)7 C
H
C
H (CH2)7 C
N + N
N
N N
+ 3
N +
Basa Schiff I
3
O
[image:60.595.111.520.82.388.2]OCH3 Anilina
Gambar 4.7 Reaksi Pembuatan Basa Schiff I
Hasil pemeriksaan Basa Schiff II yang diperoleh melalui analisa Kromatografi Lapis Tipis (KLT) menggunakan fase diam Kieselgel 60 F254 dan fasa gerak campuran
pelarut etil asetat : n-heksana (6:4) v/v yang dibandingkan dengan anilina sebagai sumber amina primernya, memberikan hasil bahwa anilina belum habis yang ditunjukkan dengan kecilnya perbandingan jarak noda antara anilina dan Basa Schiff I (Lampiran 5).
4.2.4 Hasil Sintesis Basa Schiff melalui Reaksi Kondensasi Campuran Aldehida
Turunan Metil Ester Asam Lemak Minyak Kelapa Sawit dengan Fenilhidrazin
(Basa Schiff II)
dengan spektroskopi FT-IR munculnya uluran C=N pada puncak serapan daerah bilangan gelombang 1604,77 cm-1 menunjukan vibrasi (C=N) dan didukung dengan serapan ulur C-N pada bilangan gelombang 1249,87 cm-1. Serapan ulur pada bilangan gelombang 1597,06 cm-1 menunjukkan adanya vibrasi C=C dari senyawa aromatis. Hal ini juga dukung oleh puncak vibrasi pada daerah bilangan gelombang 2924,09 cm
-1
dan 2854,65 cm-1 menunjukkan serapan khas vibrasi stretching (C-H) sp3 yang didukung dengan vibrasi bending (C-H) sp3 pada daerah bilangan gelombang 1381,03 cm-1. Serapan pada daerah bilangan gelombang 1735,93 cm-1 adalah vibrasi stretching gugus karbonil (C=O) dari ester pada senyawa tersebut dan didukung dengan vibrasi bending (C-O-C) eter pada daerah bilangan gelombang 1049,28 cm-1 (Gambar 4.4). Dari hasil yang diperoleh dapat dibuat hipotesa reaksi sebagai berikut (Gambar 4.8):
CH3(CH2)7 C O
H
+ 3 C
O
H
(CH2)7 C
O
OCH3
2 C
O
H
(CH2) C
O
H
CH3(CH2)4 C O
H
+
Campuran Aldehida
NH NH2
CH3(CH2)7 CH N NH
N CH
CH3(CH2)4 CH N NH
+ 3 (CH2)7 C
O
OCH3
HN
+
N CH CH2 CH
HN
N NH
Basa Schiff II refluks
+ CH3CH2 +
+ C O H 3 12
CH3CH2CH N NH
3 +
[image:61.595.110.518.312.688.2]Fenilhidrazin
Gambar 4.8. Reaksi Pembuatan Basa Schiff II
pelarut etil asetat : n-heksana (6:4) v/v yang dibandingkan dengan fenilhidrazin sebagai sumber amina primernya, memberikan hasil bahwa fenilhidrazin sudah habis yang ditunjukkan dengan hanya satu noda untuk masing-masing senyawa dan adanya perbedaan harga Rf (Lampiran 5).
4.2.5 Hasil Pengujian Sifat Antibakteri
Terbentuknya daerah bening disekitar kertas cakram menunjukkan terjadinya penghambatan pertumbuhan koloni bakteri akibat pengaruh senyawa bioaktif yang terdapat dalam Basa Schiff yang diencerkan dengan DMSO. Dari hasil pengamatan yang dilakukan, diameter zona bening yang terbentuk terhadap bakteri Escherichia coli lebih besar dibandingkan terhadap bakteri Staphylococcus aureus. Sehingga diperoleh nilai indeks antimikrobial kedua Basa Schiff terhadap bakteri Escherichia coli lebih besar dibandingkan terhadap bakteri Staphylococcus aureus.
Davis dan Stout mengemukakan bahwa ketentuan kekuatan daya antibakteri adalah zona hambatan ≥ 20 mm kategori sangat kuat, zona hambatan 10-20 mm kategori kuat, zona hambatan 5-10 mm kategori sedang dan zona hambatan ≤ 5 mm termasuk kategori lemah (Kusuma, F., 2010).
Indeks antimikrobial terhadap bakteri Staphylococcus aureus dan Escherichia coli dapat dilihat pada tabel 4.9 dimana perhitungannya dapat dilihat pada Lampiran 3. Tabel 4.9 Indeks Antimikrobial Basa Schiff Terhadap Bakteri Staphylococcus
aureus dan Escherichia coli
Sampel
Indeks Antimikrobial
Gram Positif
(Staphylococcus aureus)
Gram Negatif
(Escherichia coli)
Basa Schiff I 0,12 0,75
Basa Schiff II 0,42 1,22
Penentuan efisiensi inhibitor korosi dilakukan dalam media korosi HCl 0,1 N selama selang waktu 24, 48, 72, 96 dan 120 jam dengan variasi konsentrasi inhibitor 0, 1000, 3000, 5000 dan 7000 ppm. Dalam hal ini logam yang digunakan yaitu logam seng. Lempeng seng digunakan karena logam seng adalah suatu logam aktif dengan banyak aplikasi industri dan sebagian besar digunakan untuk perlindungan korosi terhadap baja (Shah et al, 2011). Lempeng seng bersifat melapisi material baja untuk memberikan ketahanan yang lebih baik terhadap korosi, namun ketika berada pada udara yang lembab, seng cepat berkarat dengan membentuk suatu produk korosi yang dikenal sebagai karat putih. Hal serupa juga terjadi pada pembersihan seng dengan menggunakan larutan asam menyebabkan seng lebih mudah berkarat. Oleh karena itu proteksi terhadap logam seng bersifat sangat penting (Eddy et al, 2010). Komponen logam seng yaitu terdiri dari 45% Zn dan 55% logam Al. logam tersebut akan mengalami reaksi reduksi oksidasi dengan reaksi sebagai berikut:
a. Zn Zn2+ + 2e- (oksidasi) 2H+ + 2e- H2 (reduksi) Zn + 2H+ Zn2+ + H2
b. 2Al 2Al3+ + 6e- (oksidasi) 6H+ + 6e- 3H2 (reduksi) 2Al + 6H+ 2Al3+ + 3H2
Pada pengujian efisiensi inhibitor korosi metode yang digunakan adalah metode kehilangan berat. Dimana prinsip pada metode kehilangan berat yaitu semakin kecil selisih berat kehilangan lempeng seng tanpa penambahan inhibitor dengan berat kehilangan lempeng seng dengan adanya penambahan inhibitor maka nilai efisiensi inhibitor akan semakin besar (Chitra et al, 2010). Dalam hal ini, dapat dilihat bahwa pada penambahan inhibitor korosi maka kehilangan berat pada seng pun berkurang juga. Dalam hal ini penambahan konsentrasi inhibitor berbanding terbalik dengan kehilangan berat logam seng. Namun pengaruh waktu perendaman seng berbanding lurus terhadap kehilangan berat lempeng seng. Hal ini dikarenakan Basa Schiff tidak mampu membentuk membran teradsorpsi pada permukaan logam seng sehingga difusi antara ion-ion agresif dan O2 terhadap logam tidak dapat dibatasi sehingga korosi
masih dapat berlangsung.
Menurut Trethewey dan Chamberlain (1991) molekul-molekul organik dapat bertindak sebagai inhibitor dengan cara teradsorpsi pada permukaan logam sehingga dapat membatasi difusi oksigen ke permukaan logam, memerangkap ion-ion logam pada permukaan, memantapkan lapisan ganda dan dapat mereduksi laju pelarutan logam. Kemudian Hayakawa (1980) telah melakukan percobaan dengan menggunakan senyawa organik sebagai inhibitor, dimana senyawa tersebut akan membentuk senyawa kelat yang dapat mereduksi laju. Untuk kondisi dari Basa schiff ini, prinsip interaksi antara inhibitor dengan permukaan logam adalah adsorpsi kimia (Ashraf et al, 2011). Basa Schiff yang disintesa pada penelitian ini terdiri dari 2 jenis yaitu:
1. Basa Schiff reaksi antara aldehida metil ester asam lemak dengan senyawa amina primer aromatis dengan 1 atom N (Basa Schiff I).
2. Basa Schiff reaksi antara aldehida metil ester asam lemak dengan senyawa amina primer aromatis dengan 2 atom N (Basa Schiff II).
Dari kedua pengujian inhibitor tersebut, diperoleh data bahwa penggunaan inhibitor yaitu Basa Schiff II memiliki nilai efisiensi inhibisi korosi yang lebih tinggi. Hal ini dikarenakan pada Basa Schiff II lebih banyak terdapat pasangan elektron bebas yang dapat membatasi difusi O2 pada permukaan logam. Sumber elektron bebas pada
Gambar 4.9 Grafik Pengaruh Waktu Perendaman dan Variasi Konsentrasi Inhibitor Korosi terhadap Kehilangan Berat Lempeng Seng
Universitas
Sumatera
Utara
Universitas
Sumatera
Gambar 4.10 Grafik Pengaruh Waktu Perendaman dan Variasi Konsentrasi Inhibitor Korosi terhadap Efisiensi Inhibitor
Universitas
Sumatera
Utara
Universitas
Sumatera
Dari kedua grafik tersebut, dapat ditentukan nilai rata-rata efisiensi inhibitor korosinya. Pada grafik dapat dilihat bahwa konsentrasi inhibitor berbanding lurus dengan nilai efisiensi inhibitor. Peningkatan konsentrasi inhibitor dapat meningkatkan nilai efisiensi inhibitor terutama pada nilai efisiensi inhibitor Basa Schiff I dan Basa Schiff II (Gambar 4.11).
0 10 20 30 40 50 60 70 80 90
1000 ppm 3000 ppm 5000 ppm 7000 ppm
R
at
a
-R
at
a
E
fis
ie
n
si
In
h
ib
it
or
(
%)
Konsentrasi Inhibitor (ppm)
Campuran Aldehida
Anilina
Fenilhidrazin
Basa Schiff I
[image:68.595.108.522.211.446.2]Basa Schiff II
BAB 5
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Berdasarkan hasil penelitian dan analisis data yang telah dilakukan dapat disimpulkan sebagai berikut:
1. Reaksi kondensasi antara 10 g campuran aldehida dari metil ester asam lemak minyak kelapa sawit dengan 11 g anilina menghasilkan Basa Schiff sebanyak 15 g. Sedangkan reaksi kondensasi antara 10 g campuran aldehida dari metil ester asam lemak minyak kelapa sawit dengan 11 g fenilhidrazin menghasilkan Basa Schiff sebanyak 20 g.
2. Uji aktivitas antibakteri kedua Basa Schiff yang dihasilkan menunjukkan kemampuan menghambat yang kuat terhadap bakteri Escherichia coli dengan indeks antimikrobial masing-masing 0,75 dan 1,22 namun terhadap bakteri Staphylococcus aureus menunjukkan kemampuan menghambat yang sedang dengan indeks antimikrobial masing-masing 0,12 dan 0,42.
5.2 Saran
BAB 2
TINJAUAN PUSTAKA
2.1 Minyak Kelapa Sawit
Tanaman kelapa sawit (Elaeis guinensis J.) adalah tanaman berkeping satu yang termasuk dalam famili Palmae. Nama genus Elaeis berasal dari bahasa Yunani Elaionatau, yaitu minyak. Sedangkan nama spesies Guinensis berasal dari kata Guinea, yaitu tempat dimana seorang ahli bernama Jacquin menemukan tanaman kelapa sawit pertama kali di pantai Guinea. Kelapa sawit dapat tumbuh dengan baik pada daerah beriklim tropis dengan curah hujan 2000 mm/tahun dan kisaran suhu 220 -320C (Ketaren, 2008).
Kelapa sawit menghasilkan dua jenis minyak. Minyak yang berasal dari daging buah berwarna merah disebut minyak kelapa sawit atau crude palm oil, sedangkan minyak yang tidak berwarna yang berasal dari inti kelapa sawit disebut minyak inti kelapa sawit atau palm kernel oil (Mongoensoekarjo, 2003).
2.1.1 Komposisi Kimia Minyak Kelapa Sawit
Tabel 2.1 Komposisi Asam Lemak Kelapa Sawit dan Minyak Inti Kelapa Sawit
Asam Lemak Minyak Kelapa Sawit (%) Minyak Inti Sawit (%)
Asam kaprilat - 3-4
Asam kaproat - 3-7
Asam laurat - 46-52
Asam miristat 1,1-2,5 14-17
Asam palmitat 40-46 6,5-9
Asam stearat 3,6-4,7 1-2,5
Asam oleat 39-45 13-19
Asam linoleat 7-11 0,5-2
(Ketaren, 2008).
2.1.2 Proses Pengolahan CPO Menjadi RBD Palm Olein
Langkah-langkah pengolahan CPO (Crude Palm Oil) menjadi RBD Palm Olein (Rifenery Bleaching Deodorizing Palm Olein) melalui beberapa tahap yaitu:
1. Proses Degumming
Pada proses ini dilakukan penghilangan getah dimana dengan menambahkan asam posfat (H3PO4) untuk mengendapkan getah tersebut.
2. Proses Bleaching
Pada proses ini dilakukan pemucatan dengan menggunakan bleaching eart dan dilanjutkan dengan penyaringan sehingga dihasilkan residu (ampas bleaching eart) dan Filtrat (DBPO = Degumming Bleaching Palm Oil).
3. Proses Deodorizing
4. Proses Kristalisasi Fraksinasi
Pada proses ini RBDPO dilakukan pengkristalan bertahap hingga suhu 200C melalui pendinginan dan dilakukan penyaringan kemudian dihasilka