TRANSFORMASI
KEDELAI DENGAN GEN
PROTEINASE
INHIBITOR
II MELALUI
AGROBACTERlUM
DAN
PENEMBAKAN
PARTIKEL
O l e h :
SAPTOWO
Jt
PARDAL
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
ABSTRAK
SAPTOWO
J.
PARDAL. Transformmi Kedelai Dengan Gen Proteinme Inhibitor 11Meialrri Agrobacterium dun Penembakm Partrmkel (di bawah bimbingan GA. Wattimena, Hajrial Aswidinnoor dan
M.
Herman).Penelitian bertujuan untuk ( I ) mendapatkan protokol transformasi kedelai melalui vektor Agrobacrer ium dan Penembakan Partikel yang terbaildoptimum, (2) untuk mentransfer dan meregenerasikan eksplan kedelai hasil transformasi dengan gen pinII, dan (3) untuk mendapatkan tanaman kedelai hasil tmnsformasi yang mengandung gen pin
Il
dm tahan terhadap harna penggerek polong.Penelitian terdiri dari tiga percobaan, yaitu (1) Transformasi kedelai dengan gen
gus, (2) Transformasi kedelai dengan gen proieinase inhibitor (pin)
II,
dan (3) Evaluasitanaman kedelai hasii transformasi. Penelitian rnenggudan dua varietas
kedelai,
yaitu Wilis dan Tidar.Dua
varietas ini dipilih karena menunjukkan respon regenerasi in vitroyang cukup baik dan banyak ditanam petani, terutarna Wilis,
Pada penelitian prtama, sejumlah ekspian embrio muda dan kotiledon muda
umur
14- 1 5 hari setelah pembungam (antksis) telah diinokulasi dengan A. tumefaciens strain EHA 105 dengan plasmid pCambia 1301 yang mengandung gen g m (gen pelapor) dan hph (gen ketahahanan terhadap higromisin). Perlakuan inokulasi meliputi kerapatanbakteri (0,5; 1 ; 1,5), lama inokulasi (dishaker 60 clan 90 menit), dan lama ko-kultivasi (3 dan 5
h
i
)
.
Hasil uji gus menunjukkan bahwa perlakuan inokulasi yang terbaik adalah dengan menggunakan kerapatan bakteri (ODm) = 1 (setara dengan 1 x 10' seVml), lama inokulasi 90 menit dan lama ko-kdtivasi 5 had. Pada metode Penembakan Partikel, dua macam eksplan kotiledon muda dan embrio muda ditembak dengan plasrnid pRQ-6 (mengandung gen gus dan hpt 11). Perfakuan penembakan meliputi besarnya tekanan gas
Helium (1 I 0 0 dm 1300 psi), jarak ternbak (5
dan
7 cm), dan jumlah tembakan (1 dan 2 kali). Hasil menunjukkan bahwa perlakuan terbaik untuk penembakan adalah dengan tekartan gas Helium sebesar 1 100 psi, jmak tembak 5 cmdan
jumlah tembakan 1 atau 2 kali.Pada penelitim kedua, sebanyak 1539 eksplan kotiledon muda kgdelai Wilis dan
984 eksplan Tidar telah diinokulasi dengan A. rtlrnefaciem yang mengandung plasmid pGApinlI (gen pin II clan npt 11). H s i l regenerasi dan seleksi eksplan hail transformasi
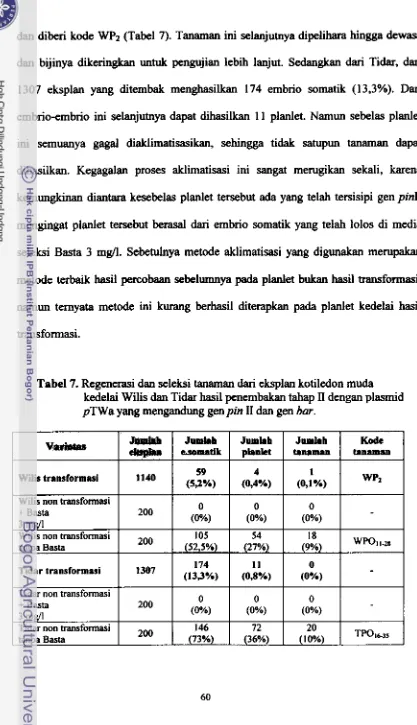
pada media yang mengandung Kanarnisin 200 rng (spesifik unhk seleksi gen nptI0 menunjukkan bahwa eksplan W ilis lebih banyak menghasilkan tanaman regeneran, yaitu sebanyak 8 tanaman (AW I -AWs), sedangkan Tidar hanya 1 tanaman (AT,). Pada metode penernbakan, sebanyak 1 274 eksplan kotiledon muda kedelai W ilis dan 1 763 eksplan Tidar telah ditembak dengan plasmid pTWa (mengandung gen pin I1 dan bar). Hasil regenerasi dan seleksi eksplan hasil transformasi pa& media yang mengandung 3 mg/l herbisida ~ a s t a ~ (spesifik untuk seleksi gen bar) menunjukkm bahwa Tidar dapat menghasilkan 3 tanaman
(TP,,
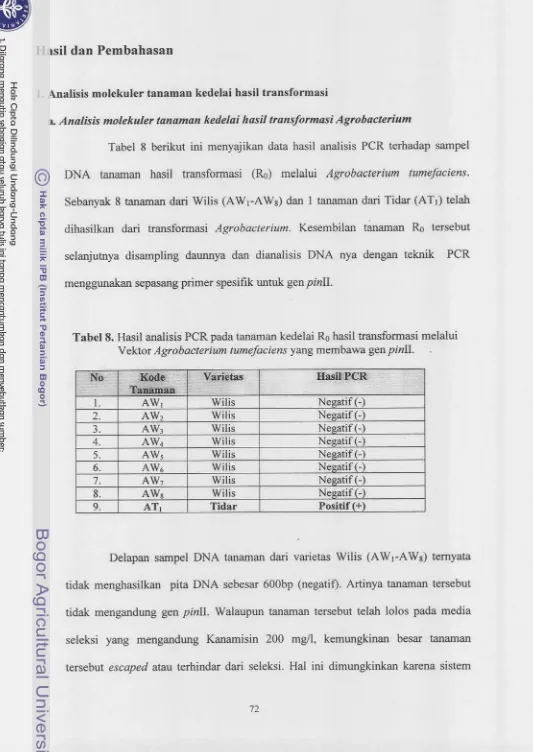
TP2, TP3), sedangkan Wilis hanya 2 tanaman (WPI,WP2).Pada penelitian ketiga, analisis molekuler terhadap 9 tamman hasil transformasi Agrobacterium (8 dari Wiiis dm 1 dari Tidar) dengan teknik Polymerase Chain Reaction
bp), yaitu event ATl (Tidar). Analisis PCR terhadap 5 tanaman hasil transforrnasi P e n e m b Partikel (2 dari Wilis dan 3 dari Tidar) menunjukkan hmya 1 tanaman positif mengandung gen pinII, yaitu event WP2 (Wilis). Kemudian, andisis molekuler terhadap progeni @I) dari event AT, dan WP2 (50 tanaman WP2 dan 40 tanaman ATI) meaunjukkan bahwa ada beberap tanaman
RI
masih membawa gen pinII. Hal ini menunjukkan bahwa gen pin11 diwariskan dari tanaman tehu0 )
ke
progeninya(RI),
walaupun pola segregasinya tidak mengikuti hukum Mendel. Pada progeni WP;! hanya diperoleh 3 sampel DNA positif gen pin11 (No. 44, 45, 46) dan 6 sampel dari progeni ATI(No.
6 , 9, 1 1, 20, 22, 25). Secara paralel tanaman kedelai RI ini juga dibioasai terhadap larva penggerek polong (Etiella zinckenella, Tr.) di Fasilitas Uji Terbatas (Biosafety Containment). Hasil pengamatan terhadap serangan polong dan bij i setelah panen menunjukkan bahwa tanaman W 2 R t terg~long agak peka (rata-rata polong terserang= 45,4%), sedangkan tanaman AT1Rl
tergolong p k a (rata-rata poiong terserang=58,8%). Tanaman WPtas dan WPz4 merupakan event terbaik dari progeni WP2 (tergolong ugak tahan dengan serangan polong 20??), dan ATI-1 r merupakan eventterbaik dari progeni ATI (tergolong agak p e h dengan m g a n polong 30%). Ketiga tanaman ini j uga menunjukkan hasil PCR positif mengandung gen pinII.
Kata Kunci: transformasi, kedelai, proteinme inhibitor I . Agrubacterium, p n e m b a h n partikel.
. .
.ABSTRACT
SAPTOWO
J.
PARDAL. Soybean Transformation wwilk Proteinme Inhibitor 11 GeneThrough Agrobacterirurt and Particle Bombardment (Supervised by GA. Watthem, Hajrial Aswidinnoor and M. Herman).
The objectives of these research were (1) to obtain the best protocols of soybean transformation using Agrobacterhm-mediated bransformation and Particle Bombardment, (2) to transfer and regenerate soybean explants transformed with the proteinase inhibitor I1 gene, and to obtain soybean plants that contained the proteinme inhibitor II gene and resistant to pod barer.
Research was included three experiments i.e 1) Soybean transformation using gus
gen, 2) Soybean trmsfarmation using proteinase inhibitor (pin) II gene, and 3)
Evaluation of soybean transformant plants. Two soybean cdtivars (Wilis and Tidar) were used in this experiments. Both cdtivars were chosen because it shown good response on early in vitro plant regeneration study and very popular to the farmers, especially cv. Wilis.
On the first activity, soybean explants were inoculated with A. tumefaciens strain
EHA 105 which
is
contained plasmid pCambia 1301 with p s gene in T-DNA region. The treatments were included an optical density (0.5; 1 and 1.5), inoculation time (60 and 90 minutes), co-cultivation time (3 and 5 days) and type of explants (young embryo and cotyledon). Result indicatedthat
the best protocol for inoculation was using young cotyledon as explants with 1 x 10' celYrnl of Agrobacterium for 90 minutes inoculation and 5 days co-cdtivation. While on the particle bombardment method, young embryos and cotyledons were bombardedwith
pRQ6 plasmid. Treatment were included Helium gas pressure (1 1 00 and 1 300 psi), shooting distance ( 5 and 7 cm) and number of bombardment (once and twice). The best treatment was using young cotyledon a s explant, bombarded once or twice with gold particles at 1 100 psi of the Helium gas pressure and 5 crn of shooting distance.On the second activity, 1539 young cotyledon explants from Wilis and 984 explants from Tidar were inoculated with A. tumefaciens which is contained proteinase inhibitor
II
geneon
plasmids pGApinLI
construct. Result from plant regeneration and selection of tsansformant explants on media with 200 mgA Kariamycine (spesific for nptIIgene selection) indicated that c.v Wilis were better than Tidar, because its produced more plantlets/plants 8 plants (coded: A W I -AW8), while Tidar produced only one plant (coded: AT& On the Particle Bombardment experiments, 1274 young cotyledon explants of Wilis and 1 763 explants of Tidar were bombarded using gold particle coated
with
pTWa plasmids (contained pinn and bar genes). Result of plant regeneration and selection of transformant explants on media with 3 m g ~ l Basta (spesific for bar gene selection) indicated that cv. Tidar produced three plants (TPI-TP3) while cv.Wi1is produced only 2 plants (WPI and WP2).gene test, while 8 plants from event AW (Wilis) were negative. PCR test of five soybean
plants obtained from bombardments experiments (2 Wilis
and
3 Tidar ) indicated thatno
plants were positive to pin 11 gene, except WP2 (Wilis).Seeds
fiom these positive plants were collected for further evaluation. Furthermore, PCR test of 50 WPtRl plants and 40 AT1R1
plants indicated that there were several of Rl plants still positive on PCR test. Jt indicated that the proteinase inhibitorII
gene was transmitted from parent plants(h)
to the progeny @I). There were three DNA samplesof
WPzRl(No. 44,45,46) and six DNA samples of ATIRl(No. 6, 9, 11,20,22,25) were positive to pin I1 gene. Those R I plants were also challenged to pod borer (Etielfa zinckenella,Tr.)
larvae in the Biosafety Containment. Observation on pod and seed damages percentage after harvesting indicated that WP2 progeny were categoried into rather susceptible to pod borer (pod damages = 45.4%), while AT1 progeny were susceptible to pod borer @od damages = 58.8%). WP2aS and W 2 - 4 6 were the best event of WP2 progeny (categoried into ratherresistant to pod borer with 20°/0 pod damages) and ATI-11 was the best event of ATl progeny (categoried into rather susceptible to pod born with 30% pod damages). those piants were also positive on PCR test.
Lembar Pernyataan
Saya menyatakan dengan seknar-benarnya bahw segala pernyataan Marn disertasi saya yang be rjudul:
"TRANSFORMASI KEDELAI DENGAN GEN PROTEINASE INHIBITOR I1 MELALUI AGROBACTERIUM
DAN
PENEMBAKAN PARTIKELnadalah gagasan atau hasil penelitian disertasi saya sendiri dengan bimbingan Komisi Pembimbing, kecuali yang dengan jelas ditunjukkan rujukannya. Disertasi ini belurn pernah diajukan untuk memperoleh gelar pada program sejenis di Perguruan Tinggi lain.
Semw data
dan
informasi yang digunakan telah dinyatakan secara jelss dan dapat diperiksa kebenarannya.TRANSFORMASI
KEDELAI
DENGAN GEN
PROTEINASE INHIBITOR
I1 MELALUI
AGROBACTERIUM
DAN PENEMBAKAPJ PARTIKEL
O l e h :
SAPTOW0 J. PARDAL
Diserhsi
Sebagai salah satu syamt untnk memperoleh gelar doktor Pada Sekolah Pasmarjam Institut Pertsnian Bogor
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Disertasi : Transformrmsi Kedelai dengan Gen Protinase Inhibitor II melalui Agrobacterium dan Penembakan Partikel.
Nama Mahasiswa : Saptowo Jumali Pardal
NRF
: 975100Program Studi : Agronomi
Menyetujui :
1, Komisi Pem bimbing
Prof.Dr.1r. G.A. Wattimena, MSc.
Ketua
Dr. Ir. Hajrioll Aswidinnoor, MSc. Dr. Ir. M. Herman. MSc.
Anggota Anggota
2. Ketua Program Studi Agronomi
$3-
Dr. Ir. Hairial Aswidinnoor, MSc.
Tanggal Lulus : 27 Januari 2004
. .
.
RIWAYAT
HIDUP
Penulis dilahirkan di kota Sukoharj&olo, Propinsi Jawa Tengah pada tanggal 12 Jdi 1963 dan merupakan anak ketujuh dmi sembilan h u d a r a dari ayah W. Ponomuwono (almarhum tahun 2002) dan ibu Mursiyem ( h h u m a h tahun 1980).
Pada tanggal 26 Juni 1 988 penulis menikah dengan Retno Sri Titi Lestari dan kini telah dikaruniai tiga anak bernarna Rizka Tarnania Saptari, Aditya Rahmat Saputro, dan Septrian Adhi Saputro.
Penulis menarnatkan sekolah dasar di SD Negeri Jetis I Sukoharjo pada tahun 1975, Sekolah Menengah Pertarna
di
SMP
Negeri ISukohajo
padatahun
1979dm
Sekolah Menengah Atas (SMA) Negeri 111 Surakarta pada tahun 1982. Selepas dari
SMA
penulis kuliah S 1 di Fakultas Biologi, Universitas Gadjah Mada-Y ogyakarta clan lulus pada tahun 1987. Seteiah ldus S1 penulis langsung diterirna bekerjadi
Balai Penelitian Tanaman Pangan (BALITTAN) Bogor, tepatnya pada tanggal 1 Nopember 1987. Penulis mulai merintis penelitian Bioteknologi, khususnya di bidang Kultur Jaringan Tanaman Pangan. Pada tahun 1989, penulis mengikuti program training tentangTeknik
Kultur Jaringan Tanaman di Kagawa, Jepang s e l m 8 bulan. Kemudian padatahun
1990 penulis mendapt kesempatan tugas belajarS2
dari Badan Litbang Pertanian melalui proyek ARMPI di Program PascasarjanaIPB,
program studi Agronomi dan lulus pada tahun 1 993. Tahun 1 994 penulis mengikuti training tentang Tmsformasi Genetik di ICI Seed Iowa-Amerika Serikat selama 1 tahun. Kemudian pa& tahun 1998, penulis tugasPRAKATA
Puji syukur penulis panjatkan kehadirat Ailah SWT atas h a t dan karunianya, sehingga penulis berhasil menyelesaikan disertasi yang berjudd : Transformasi Kedelai dengan Gen Proteinme Inhibitor I1 melalui Agrobacferiurn dan Penembakan Partikel. Disertasi ini berisi beberapa hasil penelitian yang merupakan bagian dari proyek peneli tian
APBN
di Bditbiogen tentang Kultur jaringan dan transfomasi kedelai dengangen proteinase inhibitor I1 untuk ketahanan terhadap hama penggerek polong kedelai (1996-2003). Disertasi ini terdiri dari
7
bab dm lampiran yang memuat tentang hasil penelitian tmmformasi kedelai dengan gen proteinme inhibitor I1 rnelalui Agrobacterium clan Penembakan Partikel serta evaluasi tanaman hasil transformasidm
progeninya.Penulis sangat menyadari bahwa penelitian
dan
disertasi ini masih banyak k e k m g a ndan
kelernahannya dikarenakan penelitian regenerasi tanaman kedelai secara in vitro masib sangat sulitd m
rendah tingkat keberhasilmya. Demikian juga penelitian tentang transformasi tanaman kedelai masih sangat terbatas, khususnya di Indonesia ha1 ini baru dilakukau oleh beberapa orang saja. Bahkanuntuk
mforrnasi kedelai dengan gen proteinme inhibitorll bam pertama kali dilakukan baik di dunia maupun di Indonesia. Pendis berharap semoga hasil penelitian iniada
manfaatnya paling tidak dapat memacu penelitian serupa di masa-masa mendatang, tentunya dengm perenanam clan metode penelitian yang lebih baik clan terarah.Ddarn pelaksmaan penelitian dan penulisan disertasi ini penuIis bany ak rnendapatkan bantuan dari berbagai fihak baik berupa materi, fikiran maupun saran-saran
1. Bapak Prof.
Dr.
Ir. G.A. Wattimena, MSc sebagai Ketua Komisi Pembimbing yang telah banyak memberikan bimbingan, arahan dan dorongan semangat sejak penyusunan usulan penelitian, pelaksanaan dm penulisan disertasi.2. Bapak
Dr.
Ir. Hajrial Aswidinnoor, MSc. sebagai anggota komisi sekaligus ketua program shldi Agronomi PascasarajanaIPB
yang telah banyak memkrikan bmtuan berupa bimbingan, masukan dan amhm kepada penulis dengan penuh kesabaran, kearifan dan keterbukaan.3. Bapak
Dr.
Ir.M.
Herman, MSc. sebagai anggota komisi pembimbing dm penanggung jawab RPTP Transformasi Kedelai di Balitbiogen yang telah mengijinkan penulis untuk menggudcan proyek penelitian beliau sebga bahan disertasi clan juga bantuan lain berupa bimbingan dan &an yang sangat berarti bagi penyelesaian program doktor ini.4. Kepala Balitbiogen Bogor yang telah memberi ijin tugas belajar dan fasiiitas untuk penelitian kepada penulis, sehingga penulis dapat melaksanakan kuliah dan penelitian dengan tenang dan lancar
.
5. Kepala Proyek ARMP
II
Badan Litbang Pertmian di Jakarta yang telah memberikan beasiswa program doktor kepada penulis.6. Dekan Sekolah Pascasarjana IPB yang telah memberikan ijin clan kesempatan kepada penulis unhk rnengikuti program doktor di program studi Agronomi.
7. Kedua orang tuaku yang tercinta, Bapak W. Ponomurwono dan Ibu Mursiyem (dmarhurn) yang telah membesarkan dan mendidik penulis dengan penuh semangat ,
8. Kedua me-u yang tercinta, Bapak Saslrosupadmo (almarhum) dan Ibu Suratni yang banyak memberikan dorongan semangat kepada penulis ddam menyelesaikan studi S3 ini.
9. Istriku tercinta, Retno Sri Titi Lestari yang selalu setia mendampingi dan memberikm
dorongan semangat kepada penulis sehingga penulis dapat menyelesaikan studi S3 ini dengan tenang dan lancar.
10. Rekan-reh sekerja, Drs. Edy Listanto, Dra. Diani Damayanti, Slarnet Ssi., Tri
Indraini
R.
Utami, SP., Umar, Muslih, Riri, Endang Ibrahim dan semua fihak yang telah ikut membantukelancaran
pelaksanaan penelitianini.
Akhimya, hampan penulis semoga semua amal baik dari rnereka yang telah membantu penulis mendapatkan pahala yang beriipat ganda dari Allah S WT, amin.
Bogor, Januari 2004
Penulis,
...
DAFTAR GAMBAR xvii
BAB I
.
PENDMULUANLatar Belakang
...
1Tujuan Penelitian
...
4Hipotesis
...
5Kegunaan Penelitian
...
5Kerangka Pemikiran
...
6Alur Penelitian
...
7BAB I1
.
TINJAUAN PUSTAKA...
Kedelai...
..
8...
...
Bama Penggerek Polong Kedelai.
.
.
12...
Protease dm Protease inhibitor 15...
Regenerasi Tanaman Kedelai In Vitro 20...
Transfomasi Kedelai 24...
Transformasi Kedelai dengan Agrobacterium 26 Transforrnasi Kedelai dengan Penembakan Partikel...
31...
Gen PenandaPenyeleksi 36 BAB 111.
TRANSFORMASIDAN
REGENERASI TANAMAN KEDELAI DENGAN GEN GUSDAN
PROTEINASE INHIBTOR 11...
Pendahuluan 37...
Bahan dan Metode 38 Hasil dan Pembahasan...
44...
Kesimpulan 66BAB
IV
.
EVALUASI TANAMAN KEDELAI HASIL TRANSFORMASI Pendahuluan...
67...
Bahan dan Metode 68
...
Hasil dan Pembahasan 72
...
Kesimpulan 81
...
BAE
V
.
PEMBAHASAN UMUM 82BAB VI
.
KESIMPULANU M U M
DAN
SARAN...
Kesimpulan Umum 89
...
BAB
VII. DAFTARPUSTAKA
. . .
. . . .
. . .. . . .
. . . .
.
. .. . . .. . . .
. . . .
. . .
. . . .
. . .. . .
. . . .
. . .
.. . .
. . . .
.
9 1LAMPIMN
. . .
. .
.
. . .
. . . .
.
. . .
. . . .
.
. . . .
.
. . .
. . . .
. . .
.
.
. . .
.
. .
. . . .
. . .
.
. . .
. . . .
. . .
. . . .
. . . .
. . . .
. . .
. . .
.. . .
. . .
. . . .
. .
104DAFTAR TABEL
Teks-
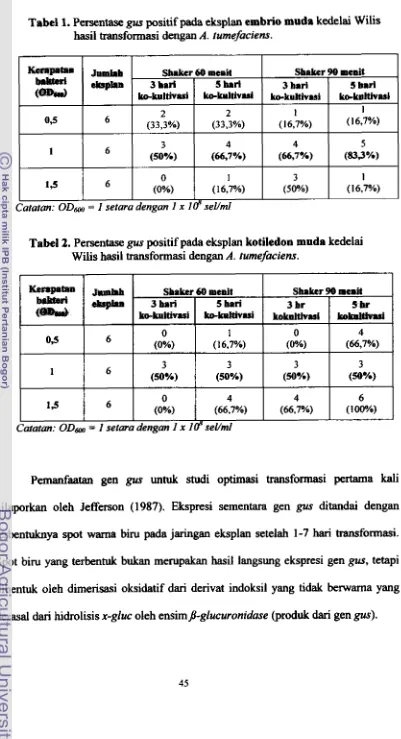
HalamanHasil uji GUS positif pada eksplan embrio muda kedelai hasil ...
transfonnasi melalui Agrobacterium tumefaciens 45
H a i l uji GUS positif pada eksplan kotiledon muda kedelai hasil
transformasi melalui Agrobacterium tumefaciens
...
45Hasil uji GUS positif pada eksplan embrio muda kedelai hasil ...
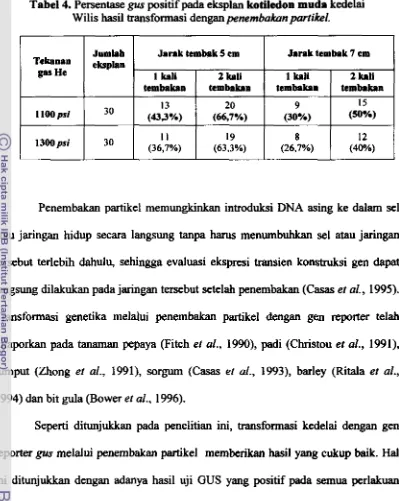
transformasi melalui Penembakan Partikel 49
Hasil uji GUS positif pada eksplan kotiledon muda kedelai hasil
...
transformasi melalui Penembakan Partikel
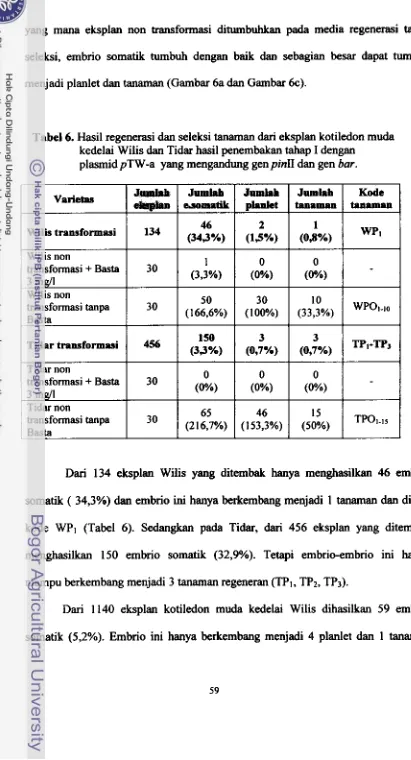
Hasil regenerasi dan seleksi eksplan kotiledon muda kedelai hasil transformasi Agmbacterium pada media yang mengandung Kanamisin
...
200 mg/lHasil regenerasi dan seleksi eksplan kotiledon muda kedelai hasil transformasi melalui Penembakan Partikel tahap I pada media yang
...
mengandung Basta 3 mgll
Hasil regenerasi clan seleksi eksplan kotiledon muda kedelai
hasil
transformasi melalui Penembztkan Partikel tahap 11 pada media yang
...
mengandung Basta 3 mgA
Hasil uji PCR pada tanaman
kedelai
hasil transfomasi melalui A. tumefacien ...Hasil uji PCR pada tanaman kedelai hasil transformasi melalui Penembakan Parti kel
...
Hasil uji
PCR
pada tanaman kedelai WPzRl dan ATtR1
...Lam~iran Hdaman
I
.
Komposisi media kultur untuk transformasi kedelai...
1052
.
Hasil uji bioasai 50 tanaman kedelai WP2Rl terhadap larvaE
.
...
zinckenella.
Tr
.
di FUT Balitbio...
...
1083
.
Hasil uji bioasai 30 tanaman kedelai ATIRl terhadap larva E ....
zinckenella. Tr
.
di FUT Bditbio 1094
.
Hasil analisis chi-square terhadap data hasil PCR galur W 2 R Id m
...
ATIRl 110
5
.
Deskripsi varietas kedelai Wilis...
11113. Hasil uji bioasai tanaman kedelai
R1
hasil transfomasi terhadap Efiella 8 1 zincknella, Tr. di Fasilitas Uji Terbatas, Balitbiogen...
..
. .
.. . ... .
.
.
. . .
.. .
. .
... .
I . Tanaman kedelai sebagai sumber ekspian dan cara penendaan bunga
mekar
. . .
. . .
.
. .
.
. . .
.
. . .
.
,. .
. . . .
. . . .
. . .
. . . .
. . .
,. . .
. . .
. . .
,. . .
.
.
.. . .
. . .
.
,. .
. . .
. .
113
2. Polong muda kedelai umur 14- 15 hari setelah anthesis
... ...
...
...
1143. Peta plasrnid pCambia 1 30 1 (gen gus dan hph)
.
.
. . . .
. . . .
..
.
. . . .
.
.. .
. . . .
. . .
,. . .
. . . .
. .
. 1154. Peta plasmid pRQ-6 (gen gus
dan
hph)
...,... ...,...
...
1165. Peta plasmid pGApinIl (gen pinn
dm
nptII) clan plasmids pTW-a (gen pinlI dan bar). . .. . . .
.
. .
..
. . .. .
.
.
. .
.
. . .. . . .
,. .
.
.
.. . . .
... .
.. . .
...
.
. .
. . . .
. . .
-. .
.
. .
..
. .
. .
. . ... .
.
. . . .
.
. . . - . . .
. . .
117
6. Mesin penembak gen (gene gun) d m mekanisme kerjanya
...
1187. Prosedur pembuatan suspensi emas
. .
..
. ...
, ,.
. . . .
. .
,.
.
. . .
. . .
.,. . .
.
. . .
.
.
.
. . . .
.
. .
. . .
. . .
.. . .
1198. Prosedur pelekatan (presipitasi)
DNA
pada partikel emas. ... . .
. . . .
. . . .
.
.
.
1209.
Larva, pupadan
imago Etiella zinekenella,Tr. dilab.
SemnggaN T
Balitbiogen Bogor...
.
..
. . ..
. .
.
. . ..
.
..
.
.
. . .
.
.
.
. . . .
.
. .
.
. . .. . . .
+.. . . .. . .. . .. . . .
..
.
. . .
.
..
.
. . .
121
BAB I.
PENDAHULUAN
1.1. Latar Belakang
Kedelai merupakan komoditas pangan prioritas k d u a setelah padi di Indonesia. Kebutuhan akan kedelai semakin meningkat, sedangkan produksi kedelai nasiond belurn
mencukupi. Usaha peningkatan p d u k s i kedelai terus dilakukan, namun masih banyak kendala yang dihadapinya. Salah satu kendala yang sangat besar adalah serangan hama
kedelai.
Penggerek polong (Efiella zinchnella, Treitschke) merupakan hama penting kedelai yang masih sulit dikendalikan (MsMfoto et al., 1991; Nurdin et al., 1995;). Serangan hama ini mengakibatkan polong kedelai berlubang dan biji rusak/habis dimakan
oleh larva serangga ini, sehingga dapat menunrnkan hasil kedelai. Rata-rata luas areal serangan selcitar 1 1 -000 ha setiap tahunnya dengan mta-rata kehilangan hasil berkisar 20-
40% berdasarkan hasil uji lapang. Bahkan, intensitas serangan dapat mencapai 90% apabila tidak dilakukan pengendalian (Nurdin, 1 984).
Penggunaan varietas kedelai tahan hama penggerek polong merupakan altematif cara pengendalian hama yang lebih murah, efektif dan aman terhadap lingkungan. Penggunaan varietas than dapat mengurangi aplikasi pestisida, sehingga dapat menghemat biaya p d u k s i
dan
mengurangi bahaya residu yang sering ditimbulkan oleh bahan aktif pestisida. Pada sistem pertanian yang berkelanjutan, cam inilah yang sangat sesuai (Soekarna dan Warnoto, 1985; Turnipseed, S.G. dan M. Kogan, 1987; Sticklen,1 990). Namun, perakitan varietas kedelai khan melalui persilangan biasa sering menghadapi kendala dengan belum diketernukannya varietas kedelai y ang betul-betul
tahan terhadap penggerek polong yang dapat d i j a d h sebagai surnber gen ketahanan (Tenghno et al., 1985; Nurdin, 1984). S e h y a k delapn varietas kedelzti yang dinyatakan relatif tahan terhrldap penggerek polong (diuji di Mojokerto, jawa Timur), ternyata setelah diuji coba talc satupun menunjukkan ke- yang tinggi terhadap penggerek polong (Tengkano et al., 1985). Djuwarso er al., ( 1 994) telah melakukan skrining k e t d m a n terhadap 339 galur kedelai dalm dua m u s h kemarau berturut-turut di daerah Iampung (1 991
-
1992), ternyata juga tidak ada satupun galur yang memilikiketahrtnan
terhadap penggerek polong (rata-rata mengalamikerusakan
polong 60 %).Gen proteinase inhibitor (pin) mempakan gen pengkode senyawa anti nutrisi yang &pat menghambat kerja ensirn proteolitik (proteinase) di dalam perut serangga (Ryan,
1990). Gen
ini
dapat digunakan dalarn perakitan tanaman transgenik tahan terhdap hama tertentu (Hilder et al., 1993). Apabila gen ini berhasil ditransfer ke ddam kromosomtamman dan diekspresikan dengan baik, maka serangga yang memakan tanaman
transgenik tersebut akan terganggu sistem pencernaannya, terharnbat pertumbuhannya dan akhirnya mati j ika level penghambatannya tinggi (Jhonson, et al., 1 990).
Serine proteinase inhibitors (tripsin dan kimotripsin inhibitor) telah menunjukkan keefektifannya menghambat perkembangan lama beberapa jenis Lepidoptera, diantaranya Ostriniu mbilalis (Steffens et al., 1 978; Larocque dan Houseman, I 990), Manduca sexta (Shukle dan Murdock, 1983), Heliothw zea dm Spodoptera exigua (Broadway clan Duffey, 1986) dan juga Heliocoverpa armigera (Johnson et al., 1993). Contoh
keberhasilan
penggunaan gen proteinase inhibitor untuk transfomasi genetik tamman antara lain padi oleh Xu, et al., ( 1 996) dan ubi jalar oleh Newell, ef al., (1 995) (dengangen
tripsin inhibitor cowpea). Kemudian Jhonson, et al., ( 1 990) menggunakan gm proteinase inhibitor Idan
II pada tanaman tembakau.Saat ini telah banyak dikembangkan metode tramforrnasi genetik &naman,
dintaranya yang paling banyak digunakan adalah dengan vektor Agrobacterium dan gene gun (particle bombardment) (Hinchee et al., 1 988; Klein et al., 1988; Sauter et al., 1991).
Durt teknik transformasi ini masing-masing memiliki kelebihan dan k e k m g m . Metode Agrobncteriurn merupakan teknik transfer gen secara alami (ti& langsung) yang sangat
kelemahannya W w a tidak semua jenis tanaman dapat diinfeksi oleh Agrobacferium,
sehingga aplikasinya sangat terbatas pada beberapa jenis tanaman saja. Sedangkan penembakan partikel merupakan teknik transfer gen secara langsung yang sangat praktis dan efekti f. Gen interest ditembakkan secara mekanik dengan mesin penembak, sehingga teknik ini dapat diterapkan pa& hampir semua jenis tanaman yang sebelumnya tidak ciapat dilakukan dengan Agrobacferium (Finer and McMullen, 199 1). Namun, tehik ini memerlukan partikel pembawa DNA yang inert (emc1s/hrngsten)
dan
mesin penembak(gene gun) yang mahal harganya, sehingga biaya operasionalnya sangat mahal (Finer er
ai., 1996). Pada penelitian telah dilakukan transfer gen proteinase inhibitor @in) I1 kentang ke dalm tanaman kedelai melalui Agrobacterium tumefuciens dan penembadan partikel.
1.2. Tujuan Penelitian:
Tujuan utama dari penelitian transformasi kedelai dengan gen proteinase inhibitor
I1 ini adalah sebtgai berikut:
1
.
Untuk
mendapatkan protoko1 transfomasi kedelai rnelalui vektor Agrobacterium dan penernbakan partikel yang optimum (terbaik).2. Untuk mentransfer gen pinU ke dalam tanman kedeiai melalui vektor Agrobacterium dan Penembakan Partikel dan meregenerasib eksplan hasil transformasi secara in vitro.
3. Untuk mendapatkan tanaman kedelai hasil transformasi yang mengandung
1 3 . Hipotesa:
1. Metode tmnsformasi, genotipe tanarnan clan jenis eksplan diduga akan mempengaruhi hasil trmsformasi kedelai.
2. Gen proteinme inhibitor Il kentang kemungkinan besar dapat ditransfer ke dalam tanaman kedelai rnelalui Agrobacterium ataupun penembakan partikel
dan eksplan transforman tersebut diduga dapat diregenerasikan menjadi tanaman.
3. Diantars tanaman kedelai hasil transformmi
baik
melalui Agrobacterium maupun penembakan partikel kemungkinan ada yang mengandung gen pinUdm tahan terhadap hama penggerek polong.
1.4. Kegunaan Penelitian
Penelit ian transformasi geneti
k
kedelai kultivar Indonesia untuk ketahanan terhadap harna penggerek polong (Etiella zinckenella, Tr.) secam ilmiah akan &pat menarnbah pengetahuandi
bidang rekayasa genetika tanaman kedelaidan
clapat rnenambah keragaman genetik kedelai di Indonesia.Sedangkan secara umurn apabila penelitian
ini
berhasilakan
dihasilkan tanaman kedelai transgenik yang memiliki ketahanan terhadap hama penggerek polong yang1. Penggerek polong (EtQlla zinckenella, Tr. ) merupakan salah satu harna penting pada kedelai yang hingga saat ini masih sulit dikendalikan. Pengendalian dengan insektisida kurang efektif
dm
kurang arnan terhadap lingkungan.2. Penggunaan varietas kedelai tahan merupakan cara pengendzllian harna yang
sesuai dengan prinsip
PHT
(Pengendalian Harna Terpadu) karena lebih prakhs, efekti f d m aman terhadap lingkungan.3. Metode pemuliaan untuk mendapatkan varietas tahan tqpntung pada tujuan, surnber gen dan elastisitas biologis dari tanaman yang akan dimuliakan.
4. Sumber gen ketahanan terhadap penggerek plong
belum
didapatkan pada plasma nutfah kedelai hingga saat ini, sehingga merupakan ken& daIam perakitan varietas tahan.5 . Perakitan varietas kedeld tahan penggerek polong melalui teknik rekayasa genetika merupakan alternatif yang cukup baik. Penyisipan gen kehhmm serangga seperti gen proteinme inhibitor I1 (pinII) ke dalam genom kedelai melalui teknik trmsformasi sangat memunglunkan untuk menghasilkan tamman kedeli transgenik
tahan hama
penggerek plong.7. Pengujian tanaman kedelai hasil transformasi dapat dilakukan secara molekuler dan bioasai. Seluruh tahapan penelitian ini dirangkum di dalam Bagan Alir Penelitian (Gambar 1) berikut ini.
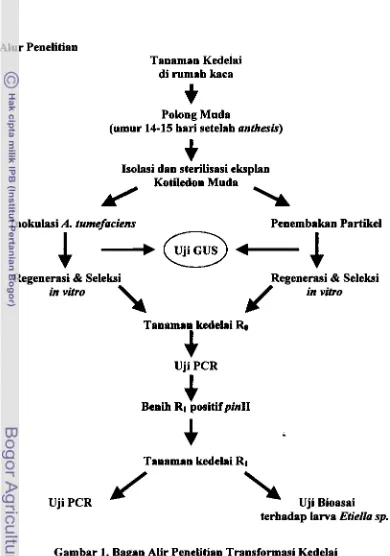
1.6. Alur Penelitian
Tanaman ~ e d e l a i di rumah kaca
Polong Mada
(umur 14-15 hari setelah anthark)
Isolasi dan sterilisasi eksplan
1
(
Kotiledon Muda\
hokulasi A. tumefackm Penem bakan Partikel
Regenerasi & Seleksi Regenerasi & Seleksi
Uji PCR
Tanaman kedelai
R1
[image:25.583.77.467.120.676.2]terhadnp larva Etiella sp.
BAB
11. TINJAUAN PUSTAKA11.1. Kedelai
a. Biologi Kedelai
Kedelai diperkirakan k a s a l dari jenis Glycine soja yang banyak turnbuh liar di Cina, Manchuria dan Korea. Tanaman ini tumbuh merambat dan kulit bijinya sangat
tebal (Basuki, 1991). Kedelai merupakan tanaman semusim, berupa semak rendah, tumbuh tegak, berdaun lebat dengan beragam morfologi. Tinggi tanaman berkisar antara 10-200 cm. Jumlah cabang tergantung kultivar dan lingkungan hidup. Kedelai memiliki 4 tipe dam, yaitu kotiledon (dam biji), b u n primer derhana, daun bertiga (trifoliate) dan profila (Hidajat, 1 985). Bunga termasuk tipe sempurna, besarny a antara 3-7 mrn, berwarna ungu atau putih. Penyerbukan terjadi saat bunga masih tertutup. Polong pertama m u n d sekitar 10-14 hari setelah bunga pertama dan jumlah polong beragam antara 2-20 dalam setiap kelompok bunga Tiap polong dapat berisi 1-5 biji, tetapi umumnya 2-3 biji. Polong muda berwarna hijau dan ditumbuhi trikoma. Polong tua bemama antara kuning hingga kuning kelabu, coklat atau hitam.
mempengaruhi perhmbuhan dan hasil kedelai. Semakin pendek panjang hari akan mempercepat waktu berbunga dan panen.
b. Pemuliaan Kedelai
Pemuliaan kedelai di Indonesia mulai dilakukan secara sistematik pada tahun 1 9 1 5 oleh Koch dengan melakukan seleksi pada vztrietas-varietas daerah. Pada tahun
1 9 1 8 mulai dirnasukkan varietas-varietas berdaya hasil tinggi dari Manchuria, Jepang, Taiwan dan Amerika Utara. Dua varietas dari Taiwan, yaitu Otan
dan
Botan (tercatat sebagai No.16 dan 17) mempunyai arti penting dalam pemdiaan karena sebagi pangkal tolak perakitan varietas selanjutnya. Seleksi dari varietas No. 16 menghasilkan varietas No. 27 clan dari No. 1 7 dihasilkan No. 28dan
No. 29. Dari varietas-varietas daerah, terpilih satu varietas yang berasaldari
Ciomas Bogor clan dicatat sebagai No. 30. Dengan hasil-hasil tersebut, Lembaga PenelitianDe
Onderafdeling Selectie plan Eeybrige Gewassen van Het Lundbouwkundig Instifuut Bogor padzt waktu itu, mempunyai enam varietas sebagai
modal untuk
pekejaan pemuliaan selanjutnya.Perakitan varietas kedelai unggul &pat dilakukan melalui tiga cam, yaitu
harus menjadi jalan untuk memperiuas dan mempertahankan variabilitas genetik agar sumber tersebut @at dimanfaatkan dalam jangka waktu lama (Sumamo h l a m Somaatmadja et al., 1 985).
Keragarnan genetik dapat ditimbulkan melalui persilangan, radiasi dan
penggunaan zat kimia (mutugenesis). Si fat-sifat y ang diperlukan untuk pembentukan
suatu varietas unggul tersebar dalam koleksi plasma nutfah yang ada. Melalui persilangan konvensiond akan diperoleh populasi
dasar
banr yang menjadi wadah(reservoir) bam hagi keragaman genotip untuk pekerjaan pemuliaan selanjutnya. Pemilihan varietas-varietas induk yang baik merupakm syarat utarna dalam pembentukm populasi c b r . Untuk perakitrtn varietas
tahan
hama penyalut midnya dapat dilakukan melalui persilangan apabila tersedia varietdplasmanutfah
yangmemiliki
ketahanan terhadap hama penyakit yang diingmkan (Somaatmadja &lamSomaatmadja et ai., 1985).
Perakitan varietao kedelai dengan metode pemuliaan non konvensiond seperh kultur antera, kamgaman somaklonal, hibridisasi somatik dm transformasi genetik belum banyak
dilakukan
di Indonesia.Varietas Wilis dm Tidar merupakan varietas kedelai yang paling banyak ditanam petani
di
Indonesia karma keduanya memiliki urnur genjah dan produksi yang tinggi. Varietas Wilis dilepas pada tahun 1983 yang merupakm hasil seleksiketurunan persilangan antars varietas Orba x
No.
1682 oleh Sumamodkk
(Hanarida et al., 2003). Varietas ini diantaranya memiliki sifat-sifat sebagai berikut:3. Warm bunga ungu, warna polong tua coklat tua, warm kulit biji kuning
dan
bentuk biji oval agak pipih.4. Kadar protein 37%, War lemak 18%, memiliki sifat tahan rebah dan agak
tahan terhadap penyakit karat dan virus.
5. Dapat diregenerasikan secara in vitro (Pardal et ul., 1 994; ParM et nl., 1 W7). Varietas Tidar dilepas pa& tahun 1987 merupakan hasil mutasi dari B- 1682 yang
dilakukan
di
AVRDC, Taiwan oleh Sumarno dkk (Hanarida et al., 2003). Varietas ini memiliki sifat-sifat diantarmya sebagai berikut:1. Tinggi tanaman 40-60 cm dengan h a i l rata-rata 1,4 tonha.
2. Umur berbunga 35 hari dan umur matang 75 hari.
3. Warm bunga ungu, warm polong tua coklat tua, kulit bij i hijau kekuningan. 4. Kadar protein 37%,
lemak
2W!,
agaktahan
karatdam
dan Idat bi bit.5 . Dapat diregenerasikan secara in vitro (Pardal et al., 1 997).
Deskripsi lengkap dari kedelai varietas Wilis dan Tidar disajikan pada Tabel Lampiran 5 dan Tabel Lampiran 6 (Hanarida et al. 2003).
c. Produksi Kedelai
Praduksi kedelai dalam negeri saat ini rnasih belum mencukupi kebutuhan nasional, sehingga jurnlah impr meningkat terus (Abdulrachman el al., 1 999). Selma sepuluh
tahun
terakhir ( 1 989- 1 999) produksi kedelai secara nasional mengalami peningkatan (Manurung, 1 999). Pada tahun 1 999 produksi mencapai 1 .3 82 j uta ton, sedangkan tahun sebelumnya hanya 1.305 juta ton. Kenaikan produksi sekitar 0,077dari 1.09 juta ha dengan hasil 1.193 to per ha menjadi 1.15 juta ha dengan hasil 1.201 ton per ha (Biro Pusat Statistik, i 999 dan 2000).
11.2. Hama f enggerek Polong Kedelai a. Biologi
Penggerek polong kedelai yang juga dikenal dengan nama "Lima Bean Pod Borer" dm "Pea Pod Borer", termasuk ke dalam famili Pyralidae dari ordo
Lepidoptera. Di Indonesia, hama ini ada dua jenis yaitu Etiella zinckenella Treitschke
dan Etiella hobsoni (Butler). Kedua jenis penggerek piong ini tidak mudah
di bedakan, baik secara morfologi rnaupun tingkah lakunya. Perbedaan yang diketahui hingga saat
ini
adalah
adanya garis putih pada bagian pinggir sayap dari E.zinckenelIa, sedangkan pada E. hobsoni tidak ada. Selain itu pupa
dari
E. zinckenellab e r u k m sedikit lebih besar dari E hobsoni (Naito dan Harnoto, 1 984).
Telur penggerek polong berbentuk lonjong seperti buah alpukat berukuran 0,6 x 0,3
mm.
Telur diletakkan terpencar atau merupakan kelompok kecil (4- 15 butir) pa& bagian bawah daun, kelopak bunga atau polong. Telur berwama putih menglulapdm
sehari kemudian menjadi kern&-m&. Telur yang akan menetas b a r njingga dan telur menetas setelah berumur 3-4
hari
(Nurdiner
a/., 1995). Ulat yangdengan panjang 8-10 mm dan lebar 2 mm. Setelah 9-1 5 hari, kepompong berubah menj adi ngengat. Ngengat E zinckenella M a m a keabu-abuan dan mempunyai garis putih pada sayapnya (Marwoto et a/., 1 99 1 ).
b. Serangan
Penggerek polong E. zinckenella tersebar luas di s e l h dunia. Selain menyerang kedelai, harna ini dapat pula menyerang Crotalaria juncea, C.
usarumoensis, C. stria fa, Vigna sinemis, Cassia spp., Dolichos spp., Tephrosia spp.,
dan Phaseolus lunatus.
Penggerek polong merusak pada stadia larva. Larva yang baru menetas akan memilih tempat di mana polong akan digerek, kemudian membuat benang pintal untuk selubung dan
selanjutnya
menggerek polong. Waktu yang diperlukan untuk prosesini
Iebih h a n g satu setengah jam. Selubung putih tersebut sering masih tampak sampai beberapa hari setelah larva masuk
ke
dalam polong. Setelah selubung hilang, jdan masuk terlihat dengan adanya bintik berwarna coklat tua. Lawa insfar satu yang teIah menggerek polong selanjutnya menggerek biji dan hidup di dalam biji. Dari luar biji tarnpak kepalanya bergerak-gerak dan membay angmelalui
kulit biji. Setelah berganti kulit larva hidup di luar biji atau rnencari polong sehat untuk diserang (Naito et a!.,1983).
telah ditinggalkan oleh larva penggerek polong dijumpai dua lubang gerekan dan
butir-butir kotoran berwarna kuning atau coklat muda yang terikat satu sama lainnya oleh benang pintal. Sisa biji setelah dimakan juga sering dijumpai dalam polong yang
terserang. Aki bat serangan penggerek, polong kedelai menjadi kempis karena bijinya dimakan habis atau sebagian, dan &pat pula gugur. Secara visual mirip dengan
tanda
serangan pengisap polong. Serangan penggerek polong
akan
menurunkan hasil kedelai, baik secara kuantitatif maupun kualitati f.c. Pengendalian
Cara pengendalian hama penggerek polong kedeiai umumnya dilakukan secara kimia dengan pemakaian insektisida.
Cam
inimudah dilakukan
dan
hasihya dapat segera diketahui. Akan tetapi, cam ini menimbdkm dampak negatif seperti timbulnya resistensi dan resurjensi harna terhadap insektisida tertentu, matinya serangga berguna, dan merusak lingkungan. Disamping itu,keberfiasilannya
kadang-Mang tidak seperti yang diharapkan, padahal biayanya cukup tinggi (Nurdin el al., 1995). Oleh karma itu perlu diterapkan metode pengendalian hama secara twpadu (PHT), yaitu cara pengendalian dengan memadukan komponen-kornpnen pengendalian yang sesuai,secara
ekonomi menguntungkandan
secara sosial d a p t diterima serta berwawasan lingkungan (Turnipseed dan Kogan, 1 987).Beberapa komponen PHT yang dapat diterapkan antara lain meliputi cara
kedelai yang ktul-betul tahan tefhadap penggerek polong (Nurdin et al., 1995).
Skrining ketahanan terhadap 33 9 galurlvarietas kedelai selama dua musirn kemarau
berturut-turut di Larnpung, tidak satupm menunjukkan
ketahanan
terhadap penggerek polong (Djuwarso et al., 1994). Beberap varietas yang dikatakan tahan sepertivarietas Guntur dan
No.
29 (Djuwarso dm Naito, 199I), pada uji konfirmasi ternyata tidak menunjukkan ketahanan yang tinggi terhadap penggerek polong (Nurdin ec al.,1995).
a. Prolease
Prodease merupakan ensim yang mengkatalis pelepasan mtai peptida
dan
asam amino dari protein dan ensim ini banyak terdapat di dalarn perut/midgut serangga (Hilder ef al., 1 993). Ensim ini dikelompokkan menjadi dua macam, yaitu endopepiiduse yang dapat memotong mtai protein pada situs spesifik, daneksopeptidase yang dapat memotong/memisahkan asam amino dari ujung C atau
N
terminal. Proteinuse rnerupakanproieme yang bersifat endopeptidase.Telah diketahui sejak lama bahwa seperti vertebrata, serangga hanya memiliki serin proteinme seperti tripsin
drtn
kimotripsin, d m aspart& proteinme seperti pepsin.Proteinase ini optimal aktivitasnya pada
pH
basa antara 8- 1 1 3 . Namun studi terbaru menunjukkan bahwa pada perut serangga juga dijurnpai kelas lain protease (Wolfsondan Murdock, 1 990; Christeller ef al., I 992). Kelas protease ini termasuk sistein (thiol) proleinase dan asprial (kcrrboksil) proteinuse. Serangga yang banyak
aktif p d a pH dibawah 43. Berkenaan dengan hal ini telah diduga bahwa penggunaan sistein proteinae merupakan proses adaptasi dari m g g a herbivora sehingga tetap dapat mernakan biji kacang-kacangan (Iegum) dan jaringan tamman lain yang secara a l m i merniliki kandungan serin proteinase inhibitor yang tinggi (Ryan, 1 990).
b. Proieme inhibiior
Protease inhibitor (PI) merupakan protein/ensim yang secara konstitutif terdapat di berbagai bagim tanaman atau dapat diinduksi produksinya oleh adanya serangan herbivora. Protease inhibitor tanaman bervariasi ukurannya dari 4000- 80.000 Monomer (Richardson, 1 997), tetapi biasanya sekitar 8000-20+000 Monomer misahya serin protswe inhibitors p d a legurn. Beberapa
dari
inhibitor hi, terutama yang memiliki k tmolekul subunitnya sekitar 10.000 biasanya mampu menghambat dua macam ensirn setiap molekul inhibitornya. Jenis inhibitor ini dikenal s e w tipe " double heacled' atau Bowmun-Birk. Sebagai contoh inhibitor Bowman-Birk darikedelai @at maghambat tripsin
dan
kimotripsin (Seidl dan Liener, 1971). Tetapi adajuga
inhibitor
tipeini
yang hanya maghambat satu jenis ensim, misalnya inhibitor Bowman-Birk cowpea hanya menghambat tripsin.Aktivitas proteme inhibitor sangat tergantung p d a pH. Umurnnya aktivitas inbibitor akan tinggi p&
pH
netraldan
akan
menurun pada pH asadrendah hingga pH 3. Mekanisme keja dari protease inhibitor addah bersaing antara molekul inhibitor dan substrat yangmemiliki
situs penempelan (binding site) sama {Hilder et al., 1993).12.300 Monomer) (Plunkett el ai., 1982). Inhibitor I merniliki saw sisi aktif yang menghambat kimotripsin clan ssdikit tripsin, sedan* Inhibitor I1 rnemiliki dua sisi aktif yang dapat menghambat tripsin clan hotripsin. Kedua inhibitor disintesis sebagai prekursor dan mengalami rnodifikasi p& post-mlasi (Cleveland et al.,
1 987) membentuk protein jadi yang akan disimpan di dalam vakuola (Shurnway er al.,
1970).
c. Proferne inhibitor sebagai senyaw a pertahanan ( p ~ o t e ~ w agenl)
Studi tentang pe@ protease inhibitor tanaman terhadap serangan harna mulai dilakukan polda awal
tahun
1947 oleh Mickel dan Standish yang mengamatiadanya p e r t u m b h
tidak
normal larva hama tertentu yang diturnbuthn p d a ekstmk kedelai. Kemudian studi tersebut mengilhami Lipke dan stafnya ( tahun 1954 ) untuk mempelajari toksisitas inhibitor kedelai terhadap perkembangan Tribolium conyhsum(hama umum biji kedelai) (Hilder et al., 1993). Meskipun hasilnya negatif terhadap tripsin inhibitor, studi
ini
menunjukkan adanya inhibitor spesifik terhadap ensim pencernaan larva TriboIiunr. Selanjutnya inhibitor ini berhasil diisolasi dan temyah dapat maghambat dengan sempurna proses pencemaan protein (proteolisis)di
perut(midgut) larva
i?
corijiuurndan
T.
castamurn (Birk et al., 19631, tetapitidak
aktif terhadap tripsindan
kimotripsin mamalia.Studi
lain
menunjukkan bahwa protease inhibitor pada Vigna unguicmrlata jugamenghambat salah satu protease midgut yang diisolasi dari larva Tenebrio molitar
y ang diketahui mengandung ensim menyerupai tripsin dan kimotri psin (Zwilling,
1 968). Kunitz inhibitor selanjutnya juga dapat menghambat pertumbuhan larva
dan
pembentukan pupa dari larva muda penggerek jagung (Ostrinia nubilalis) ketika dicampurkan ke dalarn makanan buatan pada dosis 2-5% (Steffens er a!., 1978).
Inhibitor jagung sendiri ternyata tidak berpengaruh terhadap baik pertumbuhan dan
morfologi larva 0. nubilalis tersebut ketika dicarnpwkan
ke
ddam media buatan dengan level 2-3%, sehingga diduga bahwa ensirn proteolitik dari legum yang berperan dalarnketahanan
jagung terhadap 0, nubilalis.Sdah satu bukti yang menyskinkan p a n protease inhibitor sebagai senyawa
pertahanan terhadap serangan harna tertentu adalah hail penelitian dari Green dm
Ryan (1 972) yang menunjukkan bahwa pelukaan
daun
kentang atau tomat oleh adanya serangan kutu Colorado dewasa atau larvanyaakan
menginduksi akwulasi dengan cepat dua jenis inhibitor pada tanaman tersebut. Pen- kerusakan seranganserangga dapat disimulasikan dengan cam plukaan dam secara mekanik. Senyawa faktor atau hornon luka yang disebut proteinase inhibitor-inducing factor (PIIF) dapat diketemukan pada daun yang dilukai tersebut dm dikirimkan
ke
dam lain
tempat sintesis d m akumulasi inhibitor. Ddam bvaktu 2-3 hari setelahserangadpehkaan
dapat diperoleh
dua
macam inhibitor lebihdari
1 %dari
protein terlarut (soluble protein) pada dam dan akan tetap berada di dalam vakuola dam untuk waktu yang lama (Shurnway er al., 1976; Walker-Simmons dan Ryan, 1977). Penemuan inimembuktih besarnya peranan proteuse inhibitor d a m pertahanan tanaman (Ryan,
Demontrasi pertama tentang pola pertahman tanaman di lapang menggunakan protease inhibitor ditunjukkan oleh Gatehouse et al. ( 1 979). Mereka menemdcan
bahwa adanya level protease inhibitor (CpTJ) didalam biji galur resisten tanaman cowpea, Tvu2027 berhubungan dengan ketahanan tanaman tersebut terhadap hama utamanya, Callosobruchus muculatus.
Pada
varietas resisten cowpeu magandungcukup tinggi level inhibitor, sedikitnya dua kali lipat dari varietas lain atau bahkan 3-4 kali lipat dari s e w a n besar varietas yang diuji. Tripsin inhibitor murni dari cowpea ini telah digunakan dalam bioasai Veeding assay) terhadap larva C. maculutus untuk mengetahui toksisitasnya (Gatehouse et al., 1 979).
d.Gen Proteavc inhibitor untuk rekayasa ketahanm tanaman
Keberhasilan pertma rekayasa genetika tanaman untuk ketahanan terhadap serangga menggunakan gen yang berasal dari tanaman diperoleh dengan gen protease inhibitor cowpea (CpTi)
(Hilder
et al., 1987). inhibitor ini bahan ideal untuk rekayasagenetika tanaman
tahan
serangga sejak senyawaini
menunjukkan efek insektisiddterhadap berbagai macam hama penting di lapang, termasuk kelompok dari Lepidoptera, seperti Heliothis sp. dan Spodoptera sp. Dan juga kelompok Orthoptera,
seperti Locusta sp. ketika diujikm dalm rnakanm butan. Studi lebih lanjut clan hal yang sangat penting, bahwa ternyata senyawa inhibitor ini memiliki toksisitas yang
rendah atau tidak toksik terhadap mmalia. Protease inhibitor hi merupakan
polipeptida kecil yang terdiri dari sekitar 80 asam amino dan tergolong dalam tipe Bowman-Birk dari serin protease inhibitor dua sisi aktif (double-headed serine
Ke berhasilan penggunaan gen tripsin inhibitor cowpea untuk transformasi genetika telah diperoleh pada tanaman Ubi jalar ( I p m o e a batatas
[L.] Lam.)
menggunakm bantuan Agrobacterium tumefaciens (Newell et al., 1995). Gen CpTi juga telah berhasil d i g d a n untuk tramformasi tanaman padi
(Xu
et al., 1996). Tanaman padi transgeni k yang mengekspmikan gen CpTi terbukti dapat rneningkatkan ketahanan tanarnan tersebut terhadap dua spesies penggerek batang padi, yang merupakan hama utama padi. Sehingga dari h a i l penelitian ini dapat disimpulkan bahwa gen tripsin inhibitor dapat digunakan untuk mengontrol serangan harna pad^.1L4,
Regenerasi Tanaman Kedelai secara in v hDasar regenerasi tanaman secara in vitro adalah adanya daya totipotensi sel, yaitu
kemarnpuan sel-sel somatik tanaman secara
individual
atau protoplasdari
sel-sel tersebut unmk tumbuh dan berproliferasi (memperbanyak diri)dan
berorganisssi membentuk j h g a nd m
organ atau tanaman utuh. Ada tiga faktor penting yang mempengaruhi proses regenerasi tanaman secara in vitro, yaitu genotipe, sumber eksplandan
kondisi kultur t e m u k lingkungan dan media kultur. Menurut Ritchiedan
Hadges (1993)komposisi media munglun yang paling p t i n g dimtara kondisi
kultur
yang dipcr1h. Komponenmedia
meliputi unsur hara makm dm mikro, sumber karbon, vitamindan
zat pengatur tumbuh. Masing-masing genotipe tansmsn memiliki respon pertumbuhan invitro yang berbeda meskipun ditumbuhkan pada media kultur yang sama, demikian juga dengan sumberlj enis eksplan tanarnan sehingga diperlukan studi
khusus
untuk
Kedelai dapat diregenerasikan melalui dua proses yang berbda, yaitu meialui organogenesis (shoot morphogenesis) dan embriogenesis somatik (somnric
embryogenesis) (Barwale ei al., 1 986). Morfogenesis t ~ o r g a n o g e n e s i s merupakan
proses pembentukan dan perkembangan tunas dari j aringan meristem tunas. Tunas selanjutnya dapat diakarkan untuk mendapatkan tanaman utuh. Pada proses embriogenesis somatik, embrio somatik (serupa embrio zigotik) yang telah memiliki calon aka dan tunas, terbentuk dari jaringan somatik tanaman (bukan jaringan generatif). Tanaman utuh diperoleh dari hasil perkecambahan embrio somatik tersebut.
Organogenesis dan embriogenesis somatik merupakan dua proses yang berbeda dm keduanya sangat tergantung kepada surnber eksplan dan jenis media kdtur yang digunakan. Meskipun sistemnya berbeda, ada beberapa hal yang sama. Kedua sistem
sangat dipengarhi oleh kultivar/genotipe tanaman (cultivur-spec@c responses), dimana beberapa galur lebih responsi
f
terhadap media kultur dari galur lainnya. Galur tanaman yang memiliki respon tinggi untuk organogenesis, mungkin tidak responsif ddam pembentukan embrio somatik. Galur yang dapat membentuk sejurnlah besar embrio somatik selarna tahap induksi, mungkin tidak dapat memberikan pertumbuhan/proliferasiyang cepat. Sehingga kondisi kultur jaringan yang optimum
untuk masing-masing
galurkultivarharus
ditentukan sesuai dengsn metode regenerasinyrr.Hal
lain yang samaadalah kultur proliferasi dapat terj adi pada kedua sistem regenerasi. Proliferasi sangat berguna terhadap kedua sistern, karena dapat merangsang sel tunggal yang telah tertransfomasi untuk multiplikasi membentuk jaringan yang lebih besar dm
dan keterbatasan masing-masing sistem regenemi, maka organogenesis dan embriogenesis somatik kedelai perlu diinduksi terlebih dahulu.
Organogenesis pada kedelai dilaporkan pertama kali oleh Wright et al. (1 986). Mereka menjelaskan sistem dimam tunas-tunas dapat diperoleh secara de novo dari
nodus kotiledon kecambah kedelai, Jaringan meristem tunas terbentuk di bawah jaringan epidermis dan jaringan morfogenik dapat berproliferasi pda media yang mengandung b e q l adenine (BA).
Embriogenesis somatik pada kedel J pertama kali dilapotkan oleh Christianson et al., ( 1 983). Jaringan embriogenesis berbsil diinduksi dari eksplan embrio zigotik. Jaringan embriogenik
ini
dapat berproliferasi, tetapisistem
ini sulit diulangi dan asal dariembrio somatik tidak diketahui. Studi berikutnya secara histologi terhadap kultur jaringan embriogenik kedelai diketahui bahwa proliferasi embrio berasal dari xl-sel perrnukaadapikal dm hanya sedikit sel yang ter1ibat dalam pembentukm embrio somatik (Finer, 1988). Pada studi tersebut, sel-sel di pemukztaa atas embrio lama m e m h t u k embrio baru. Nsmun, embrio somatik kedelai tidak selalu berstsal dari sel-sel apikal. Ernbrio somatik primer (embrio perkma yang muncul dari eksplan) tergantung kepada
jaringm eksplan dan kadar aukin p a h media iduksinya (Hartweck et al., 1988). Melalui proses proliferasi, satu sel atau sekelompok kecil sel dipermukaan embrio primer membentuk embrio-embrio somatik barn (embrio sekunder).
Kultur embriogenik juga dapat digunakan dengan baik untuk tmsformasi, jika
hasil prolifemi dan masalah penurunan fertilitas tanaman (variasi &bat kultur) yang sering terjadi pada proses proliferasi kultur embriogenik yang lama.
Untuk
keberhasilan
penelitian transformmi kedelai dibutuhkan pengetahuan dm kernampuan yang cukup baik tentang regenerasi tanaman secara in v i m dm transformasi genetik kedelai. Ti& &pat dipungkiri bahwa salah satu hambatan besar dalarntransformasi kedelai adalah r e s p tanaman kedelai pada manipulasi kultur jaringan, karena kedelai termasuk jenis tamman yang rekalsitran atau sulit dimanipulasi secara in vitro (Hutami et aI
.
,
1 999). Penelitian tentang regenerasi kedelai sudah banyak dilakukan, tetapi keberhasilannya masih sangat rendah clan tidak &pat didang. Di Indonesia keberhasilan regenerasi kedelai secara in v i m telah dilaporkan oleh Kurniawan dan Jurnanto (1 9961, Pardal et a]., (1 997) dan Mariska et al., (2000).Untuk keberhasilan dan efisiensi transfomasi, DNA harus diintroduksikan ke dalam sei-sel yang kompeten untuk diregenerasikan menjadi tanaman atau klon-klon sel. Pada beberapa pengalaman, sangat sulit untuk menargetkan DNA
ke
sel-sel kompeten ini. Atau ada pula kejadian DNA berhasil diintroduksikanke
&lam sel-sel yang dapat diregenerasikan menjadi tanaman (regeneruble), tetapi fertilitasnya rendah. Untuk itu pengetahuan tentang sistem regenerasi tanaman kedelai betul-betul harus dikuasai terlebih dahulu sebelum melakukan rnsformasi kedelai (Finer et al., 1996).mengingat sel-sel meristem pembentuk tunas sangat tidak mudah dimasuki (not very accessible).
Kimera terjadi &bat dari transformasi hanya terhadap satu sel (sel tunggal)
dalam j aringan meristem tunas, sehingga sel tersebut ti& dapat berproliferasi rnembentuk jaringan meristem tunas baru. Jika sistem regenerasi dari kotiledon telah
diketahui dengan baik dan dapat diulangi secara memuaskan, maka ekspian tersebut dapat dig& sebagai j aringan target dalam transfomasi kedelai (Finer el al., 1 996).
1.5. Transfomasi KedeIai
Transformasi genetik adalah upaya untuk mengubah susunan genetik sel target dengan cara menyisipkan DNA asing ke dalam susunan genom sel target. Menurut Uchimiya et a/., (1 988) dalam Aswidinnoor (1 995) tanaman m s g e n i k adalah tanaman yang memiliki gen asing yang berfungsi
dan
terintegrasike
dalam genom tanaman tersebut.a. Perkembangan Penelitian Transfomasi Kedelai
~ e j a k adanya laporan pertama tentang vansformasi
dan
regenerasi tanaman ternbakau (Horsch et al., 19851, maka d i p e r k i r h bahwa semua tan- akan &pat ditransformasi secara rutin dalam waktu dekat. Namun, ternyata kedelai dan beberapa tanaman lain masih sulit ditmnsformasi. Wdaupun transformasi kedeiai telah berhasil dilaporkan pa& tahun 1988 oleh dua laboratorium yang berbeda