ISOLATION AND IDENTIFICATION OF ALKALOID COMPOUND FROM ACTINOMYCETES ANLd-2b-3 OF MANGROVE MUD
By
Deliana Hernawati
ISOLASI DAN IDENTIFIKASI SENYAWA ALKALOID DARI ACTINOMYCETESANLd-2b-3 LUMPUR HUTAN BAKAU
Oleh
Deliana Hernawati
Telah dilakukan isolasi dan identifikasi senyawa alkaloid dariactinomycetes ANLd-2b-3 yang hidup di lumpur hutan bakau. Senyawa isolat, A8, dimurnikan dengan metoda kromatografi kolom melalui beberapa tahapan dan diperoleh rendemen sebanyak 3.7 %. Kemurnian isolat diidentifikasi menggunakan metoda Kromatografi Cair Kinerja Tinggi (KCKT) dengan detektorEvaporating Light Scattering Detection(ELSD). Kromatogram KCKT menunjukkan satu puncak dengan nilaiRetention Time(Rt) 20,6 menit. Karakterisasi dengan metoda
spektroskopiFourier Transform Infrared(FTIR) menginformasikan bahwa senyawa A8 merupakan senyawa metabolit sekunder dari golongan alkaloid. Hal ini ditunjukkan oleh adanya pita serapan C-N dari gugus amina tersier pada daerah 1109,95 cm-1spektrum FTIR yang didukung dengan hasil uji
A. Latar Belakang
Indonesia merupakan negara yang memiliki komunitas bakau terluas di dunia,
dengan luas antara 2,5 hingga 4,5 juta hektar, melebihi Brazil (1,3 juta ha),
Nigeria (1,1 juta ha) dan Australia (0,97 ha) (Spaldinget al, 1997). Hutan
bakau pada umumnya berada di daerah pasang surut yang jenis tanahnya
berlumpur, berlempung dan berpasir (Bengen, 1999). Hutan bakau terdiri atas
flora dan fauna yang hidup di daerah pantai. Hutan bakau memiliki
karakteristik yang unik hal ini disebabkan oleh kemampuannya untuk bertahan
hidup di dua zona transisi antara daratan dan lautan dengan tingkat abrasi
(erosi tanah) yang tinggi karena arus air laut yang berubah-ubah pada saat
pasang dan surut, dan mampu hidup pada lingkungan yang rawan pencemaran
oleh adanya limbah (Tarumingken, 2001).
Selain ekosistemnya yang unik hutan bakau juga memiliki mikrooorganisme
yang berbeda dengan mikroorganisme di lingkungan daratan (terrestrial).
Salah satu mikroorganisme yang terdapat di lingkungan hutan bakau ini adalah
actinomycetes(Jensenet al., 1991; Daset al., 2006). Menurut Frobisher
Namun disisi lainactinomycetesdapat dikelompokkan ke dalam kelompok
tersendiri karena mempunyai ciri khas yang berbeda (Rao, 1994). Dalam
sistem klasifikasi,actinomycetesdimasukkan dalam kelompok bakteri, dalam
kelasSchizomycetes, tetapi terbatas hanya dalam ordoActinomycetales
(Alexander, 1977)
Selama sepuluh tahun terakhir para peneliti telah berhasil menemukan lebih
dari 30 senyawa metabolit sekunder yang memiliki aktivitas biologis dari
actinomycetes. Aktivitas biologis yang dimiliki antara lain, seperti antibiotik,
antivirus, antiradang, antitumor, antikanker, dan antioksidan (Wu and Chen,
1995; Rawat and Av-Gay, 2007). Akan tetapi, saat ini perkembangan
penemuan senyawa metabolit sekunder yang memiliki aktivitas biologis baru
dariactinomycetesmenurun, sementara laju re-isolasi senyawa bioaktif yang
telah diketahui meningkat. Oleh karena itu perlu dicari sumberactinomycetes
baru untuk mendapatkan senyawa metabolit sekunder yang memiliki aktivitas
biologis spesifik.
Actinomycetesdapat hidup di daerah pantai, bakau, hingga kedalaman laut
tertentu (Jensenet al., 1991; Daset al., 2006). Karena lingkungan yang
berbeda, diperkirakan bahwaactinomycetesyang berasal dari lumpur hutan
bakau memiliki karakteristik yang berbeda denganactinomycetesyang berasal
dari daratan (terrestrial), sehingga senyawa bioaktif yang dihasilkan pun
memiliki keunikan tersendiri.
Salah satu golongan senyawa metabolit sekunder yang memiliki aktivitas
actinomycetesyang memilki aktivitas biologis antara lain: aburatubolaktam
sebagai antiperadangan dan antipenuaan (Kuramotoet al, 2004),
metasikloprodigiosin dan undesilprodigiosin diisolasi dariactinomycetesjenis
Saccharopolyspora sp.nov yang mempunyai aktivitas sebagai antikanker (Liu
et al, 2005), stourosporin dan rebekkamicin sebagai antitumor (Onaka, 2006)
yang telah berhasil diisolasi dariStreptomyces spdan alkaloid pirrolizidina
yang memiliki aktivitas antikanker (Mahyudin, 2008).
Upaya penelitian maupun pemanfaatanactinomycetesdari lumpur hutan bakau
yang memungkinkan ditemukan beraneka jenis senyawa metabolit sekunder
yang digunakan sebagai antibiotik terus dilakukan . Namun, sampai saat ini
data yang berhubungan dengan senyawa metabolit sekunder terutama dari
actinomyceteslumpur hutan bakau masih terbatas. Oleh karena itu, pada
penelitian ini penulis mencoba mengisolasi dan mengidentifikasi senyawa
alkaloid dariactinomyceteslumpur hutan yang diharapkan ditemukannya
variasi senyawa baru yang memiliki aktivitas biologis yang unik.
B. Tujuan Penelitian
Tujuan dilakukannya penelitian ini adalah untuk mengisolasi dan
mengidentifikasi senyawa alkaloid dariactinomycetesANLd-2b-3 deposit
laboratorium Biomass Universitas Lampung yang diperoleh dari pantai
C. Manfaat Penelitian
Hasil penelitian ini diharapkan dapat menambah informasi dalam
pengembangan lebih lanjut senyawa alkaloid yang dihasilkan oleh
actinomycetesdari lingkungan lumpur hutan bakau yang dapat dimanfaatkan
A. Hutan Bakau
Hutan bakau merupakan hutan yang terdapat diatas rawa-rawa berair payau
yang terletak pada garis pantai dan dipengaruhi oleh pasang-surut air laut.
Hutan ini umumnya tumbuh di tempat-tempat dimana terjadi pelumpuran dan
akumulasi bahan organik, baik di teluk-teluk yang terlindung dari gempuran
ombak, maupun disekitar muara sungai dimana air melambat dan
mengendapkan lumpur yang dibawanya dari hulu (Anwar dkk,1984).
Gambar 1. Hutan Bakau yang terdapat di pantai Ringgung Pesawaran
Lumpur merupakan bagian ekosistem di hutan bakau yang mengandung
bentuk-bentuk yang kompleks (seperti metabolit sekunder, enzim selulase dan
kitinase). Bahan organik tersebut digunakan oleh mikroorganisme sebagai
sumber karbon dan nitrogen. Salah satu mikroorganisme tersebut adalah
actinomycetes(Magarveyet al., 2004; Suryanto dan Yurnaliza, 2005).
B. Actinomycetes
Actinomycetesmerupakan organisme peralihan antara jamur dan bakteri.
(Alexander, 1997). Organisme ini memiliki sifat-sifat yang umum dimiliki
oleh jamur dan bakteri. Terlihat dari luar seperti jamur karena mempunyai hifa
bercabang yang membentuk miselium. Miselium padaactinomycetesdapat
berupa miselium udara dan miselium substrat yang mempunyai spora (Atlas,
1995). Actinomycetesmenyerupai bakteri karena termasuk kelompok bakteri
gram positif yang memiliki dinding sel yang terdiri dari polimer-polimer gula,
asam amino dan asam gula (Alexander, 1997). Walaupun demikian
actinomycetesmempunyai ciri yang khas, yang cukup membatasinya menjadi
satu kelompok yang jelas berbeda. Pada lempeng agar,actinomycetesdapat
dibedakan dengan mudah dari bakteri, dimana koloni bakteri tumbuh dengan
cepat dan berlendir, sedangkanactinomycetesmuncul perlahan dan berbubuk
serta melekat erat pada permukaan agar. Koloniactinomycetesbiasanya keras,
kasar, dan tumbuh tinggi di atas permukaan medium. Umumnya,
actinomycetestidak toleran terhadap asam dan jumlahnya menurun pada pH
5,0. Rentang pH dan suhu yang cocok untuk pertumbuhanactinomycetesini
Actinomycetesdiketahui sebagai penghasil metabolit sekunder, sehingga telah
banyak penelitian dilakukan untuk mengisolasiactinomycetes. Beberapa jenis
actinomycetesyang telah berhasil diisolasi dan diketahui aktivitas biologisnya
antara lain dapat dilihat pada tabel 1.
Table 1. Senyawa metabolit sekunder yang telah diisolasi dan sifat aktivitas biologinya (Jensenet.al.,2006).
C. Senyawa Metabolit Sekunder
Suatu mikroorganisme dapat menghasilkan produk metabolisme yang disebut
metabolit. Senyawa yang dihasilkan selama fase pertumbuhan primer
(tropofase, fase eksponensial atau fase log) disebut metabolit primer contohnya
karbohidrat, protein, lemak, asam nukleat, dan enzim. Senyawa yang
diproduksi selama fase stasioner disebut metabolit sekunder, contohnya
terpenoid, steroid, alkaloid dan flavonoid. (Bajpaiet al, 1981; Zborowski,
2004). Metabolit sekunder tidak dihasilkan oleh seluruh mikroorganisme,
selain itu jenis metabolit sekunder yang terbentuk berbeda antara
mikroorganisme satu dengan yang lain. Pembentukan metabolit sekunder
No Senyawa Nama
actinomycetes
Aktivitas
biologis Molekul target 1. Salinosporamid A S. tropica Antikanker proteasome 2. Rifamisin S. arenicola Antibiotik RNA
polimerase 3. Staurosporin S. arenicola Antikanker Protein kinase
4. Saliniketal S. arenicola Antikanker Ornathine Decarboxylase
5. Siklomarin A S. arenicola Antiinflamasi Antiviral
-sangat bergantung pada kondisi pertumbuhan, terutama komposisi medium.
Metabolit sekunder hanya diproduksi dalam jumlah sedikit. Fungsi senyawa
metabolit sekunder pada organisme diantaranya untuk bertahan terhadap
predator, kompetitor dan untuk mendukung proses reproduksi (Faulkner,
2000).
Salah satu golongan senyawa metabolit sekunder yang terdapat pada
actinomycetesyaitu dari golongan alkaloid (Jensenet al., 1991, Gorajanaet al.,
2005; Onaka, 2006)
D. Senyawa alkaloid
Alkaloid merupakan golongan senyawa metabolit sekunder terbesar dan
diperkirakan ada 5500 alkaloid telah diketahui jenisnya. Tidak ada satu pun
definisi yang memuaskan tentang alkaloid, tetapi alkaloid umumnya mencakup
senyawa-senyawa bersifat basa yang mengandung satu atau lebih atom
nitrogen, biasanya sebagai bagian dari sistem siklik. Secara kimia, alkaloid
adalah golongan yang sangat heterogen berkisar dari senyawa-senyawa yang
sederhana seperticoniinesampai ke struktur pentasiklikstrychnine. Sebagai
hasil metabolit sekunder, senyawa alkaloid berguna sebagai cadangan bagi
biosintesis protein, pelindung, penguat dan pengatur kerja hormon (Harborne,
Sifat–sifat alkaloid :
a. Biasanya merupakan kristal tak berwarna, tidak mudah menguap, tidak larut
dalam air, larut dalam pelarut organik. Beberapa alkaloid berwujud cair dan
larut dalam air. Ada juga alkaloid yang berwarna, misalnya berberin (kuning).
b. Bersifat basa (pahit, racun).
c. Mempunyai efek fisiologis
d. Dapat membentuk endapan dengan asam fosfomolibdat, asam pikrat, dan
kalium merkuriiodida. (Tobing, 1989)
Hingga kini belum ada penggolongan yang jelas dari alkaloid. Menurut,
Matsjeh (2002) alkaloid diklasifikasikan berdasarkan lokasi atom nitrogen di
dalam struktur alkaloid.
Berdasarkan lokasi atom nitrogen di dalam struktur alkaloid, alkaloid
dapat dibagi atas 5 golongan:
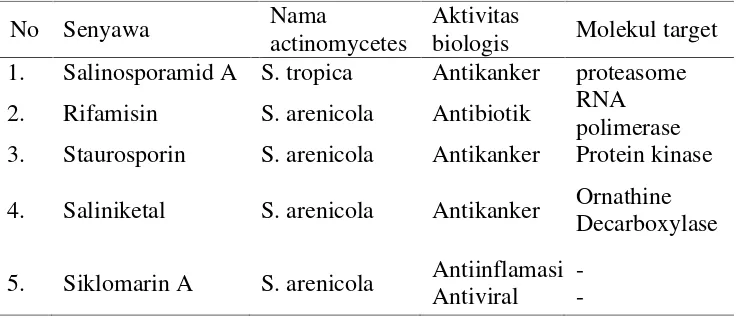
1. Alkaloid heterosiklik
2. Alkaloid dengan nitrogen eksosiklik dan amina alifatik
3. Alkaloid putressina, spermidina, dan spermina
4. Alkaloid peptida
5. Alkaloid
Dari lima golongan di atas, alkaloid heterosiklik adalah yang terbesar. Yang
1. Alkaloid piridin-piperidin
Alkaloid piridin-piperidin mempunyai satu cincin karbon mengandung 1 atom
nitrogen.
2. Alkaloid tropan
Alkaloid tropan mengandung satu atom nitrogen dengan gugus metilnya
(N-CH3), dengan struktur inti:
3. Alkaloid kuinolin
Alkaloid quinolin mempunyai 2 cincin karbon dengan 1 atom nitrogen.
4. Alkaloid isokuinolin
Alkaloid isoquinolin mempunyai 2 cincin karbon mengandung 1 atom
nitrogen.
5. Alkaloid indol
Alkaloid indol mempunyai 2 cincin karbon dengan 1 cincin indol.
6. Alkaloid imidazol
Alkaloid imidazol berupa cincin karbon mengandung 2 atom nitrogen
7. Alkaloid lupinan
Alkaloid lupinan mempunyai 2 cincin karbon dengan 1 atom N, dengan
struktur inti:
8. Alkaloid steroid
Alkaloid steroid mengandung 2 cincin karbon dengan 1 atom nitrogen dan 1
9. Alkaloid amina
Alkaloid amina golongan ini tidak mengandung N heterosiklik. Banyak yang
merupakan tutrunan sederhana dari feniletilamin dan senyawa-senyawa
turunan dari asam amino fenilalanin atau tirosin.
10. Alkaloid purin
Alkaloid purin mempunyai 2 cincin karbon dengan 4 atom nitrogen.
Gambar 2. Struktur jenis–jenis alkaloid (1. Pirolidin, 2. Tropen, 3. Kuinolin, 4. Isokuinolin, 5. Indol, 6. Imidazol, 7. Lupinan, 8. Feniletilamina)
Senyawa-senyawa alkaloid yang telah berhasil diisolasi dariactinomycetes
menunjukkan aktivitas biologis diantaranya:
1. Senyawa aburatubolaktam memiliki aktivitas sebagai antiperadangan dan
antipenuaan (Kuramoto et al, 2004)
1 2 3 4
2. Senyawa anthranilamid yang telah diisolasi dari actinomycetes laut yang
memiliki aktivitas konsentrasi inhibitor minimum 20-107 µg/ml melawan
mikroalga (Biabani et al., 1997).
3. Senyawa diazepinomicin memiliki aktivitas sebagai antibakteri, antikanker dan
antiinflamasi (Lam, 2006)
4. Senyawa stourosporin memiliki aktivitas sebagai obat antitumor (Onaka,
2006).
N N
H N
O
M e H N M e O
H M e
5. Senyawa rebekkamisin sebagai inhibitor protein kinase (Onaka, 2006).
E. Isolasi Dan Karakterisasi Senyawa Alkaloid
1. Ekstraksi
Ekstraksi merupakan suatu metode pemisahan berasarkan perbedaan distribusi
senyawa sampel dalam dua pelarut yang tidak saling melarut. Salah satu
langkah penting yang menentukan keberhasilan ekstraksi adalah pemilihan
pelarut (Haslego,2004)
Syarat-syarat untuk pelarut dalam ekstraksi:
• tidak dapat bercampur dengan air
• memiliki kerapatan yang berbeda dengan air
• karakteristik kelarutannya
• kestabilan dan volatilitas yang baik sehingga dapat dengan mudah
dilepaskan dari senyawa organik dengan cara penguapan
• tidak beracun dan tidak mudah terbakar, tetapi kedua syarat ini sulit untuk
Ekstraksi digolongkan kedalam dua bagian besar berdasarkan pada bentuk
fasa yang diekstraksi yaitu ekstraksi cair-cair dan ekstraksi cair-padat. Untuk
ekstraksi cair-cair dapat menggunakan corong pisah, sedangkan untuk ekstraksi
cair-padat terdiri dari beberapa cara yaitu maserasi, perkolasi dan, sokletsi
(Harborne, 1984).
2. Kromatografi lapis tipis (KLT)
Kromatografi lapis tipis merupakan metoda kromatografi cair yang melibatkan
dua fasa yaitu fasa diam dan fasa gerak. Fasa geraknya berupa campuran
pelarut pengembang dan fasa diamnya dapat berupa serbuk halus yang
berfungsi sebagai permukaan penyerap (kromatografi cair-padat) atau
berfungsi sebagai penyangga untuk lapisan zat cair (kromatografi cair-cair).
Fasa diam (adsorben) yang sering digunakan adalah serbuk silika gel, alumina
dan selulosa yang mempunyai ukuran butir sangat kecil, yaitu 0,063-0,125
mm. Fasa diam yang umum digunakan adalah silika gel yang dapat dipakai
untuk memisahkan campuran senyawa lipofil maupun campuran senyawa
hidrofil (Hostettman dkk., 1995).
Kromatografi lapis tipis dapat digunakan untuk keperluan yang luas dalam
pemisahan-pemisahan. Disamping memberikan hasil pemisahan yang lebih
baik, juga membutuhkan waktu yang lebih cepat. Kromatografi lapis tipis
hanya membutuhkan cuplikan dalam jumlah sedikit dan noda-noda yang
terpisahkan dilokalisir pada plat. Metode lapis tipis mempunyai keuntungan
yang utama yaitu membutuhkan waktu yang lebih cepat dan diperoleh
dengan panjang 10 cm pada silika gel adalah sekitar 20-30 menit (tergantung
sifat fase gerak) (Sastrohamidjojo, 1991).
Menurut Gritter (1991), penampakan bercak pada KLT dapat diidentifikasi
dengan menghitung harga Rf(Retardation Factor)yaitu :
Jarak perjalanan suatu senyawa Rf =
Jarak perjalanan suatu eluen
Harga Rfkomponen murni dapat dibandingkan dengan harga Rfsenyawa
standar, karena pada kondisi tertentu suatu senyawa akan memiliki harga Rf
yang sama. Harga Rfini bergantung pada beberapa parameter yaitu sistem
pelarut, adsorben (ukuran butir, ketebalan), jumlah bahan yang ditotolkan pada
plat, dan suhu (Khopkar, 2002).
3. Kromatografi kolom
Kromatografi kolom digunakan untuk mendapatkan hasil zat murni secara
preparatif dari campuran beberapa senyawa yang diperoleh dari hasil isolasi.
Dalam kromatografi kolom campuran terpisah dalam zona-zona warna yang
berbeda dalam tiap pelarut. Untuk kromatografi kolom dari larutan dibutuhkan
tabung pemisah tertentu yang diisi dengan bahan sorbsi dan juga pelarut
pengembang yang berbeda. Tabung pemisah yang diisi dengan bahan sorbsi
disebut kolom pemisah (Kisman dan Ibrahim, 1998).
Pada dasarnya kromatografi kolom ini meliputi penempatan campuran suatu
senyawa diatas kolom yang diisi serbuk penyerap (silika gel), kemudian dielusi
senyawa-senyawa yang merupakan komponen dari campuran dan kecepatan
daya pisah bergantung pada besarnya komponen terhambat dalam kolom
(Johnson dan Stevenson, 1991).
4. Kromatografi cair kinerja tinggi (KCKT)
Kromatografi Cairan Kinerja Tinggi (KCKT) merupakan salah satu teknik
kromatografi untuk zat cair yang biasanya disertai dengan tekanan tinggi.
KCKT secara mendasar merupakan perkembangan tingkat tinggi dari
kromatografi kolom. Selain dari pelarut yang menetes melalui kolom dibawah
gravitasi, didukung melalui tekanan tinggi sampai dengan 400 atm.
KCKT merupakan suatu kromatografi yang memiliki fungsi sama dengan
Kromatografi Lapis Tipis (KLT) dan kromatografi kolom yaitu untuk
mengetahui hasil analisis kualitatif, analisis kuantitatif, menentukan jumlah
komponen campuran, mengidentifikasi komponen, namun penggunaan KCKT
memiliki keuntungan yaitu hasil keluarannya berupa kromatogram.
Berdasarkan polaritas relative fasa gerak dan fasa diamnya, KCKT dibagi
menjadi dua, yaitu fasa normal yang umum digunakan untuk identifikasi
senyawa nonpolar dan fasa terbalik yang umum digunakan untuk identifikasi
senyawa polar. Pada fasa normal, fasa gerak yang digunakan kurang polar
dibandingkan fasa diam. Sedangkan pada fase terbalik, fasa gerak lebih polar
dibandingkan fasa diam (Gritter dkk, 1991).
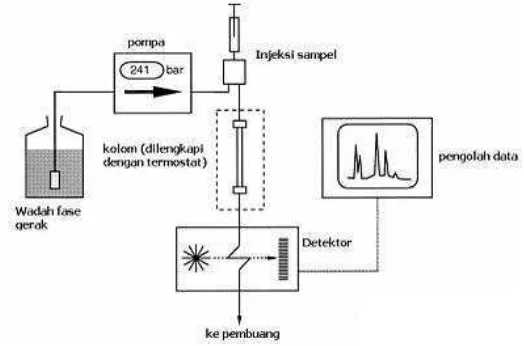
Cara kerja KCKT sebagai berikut: dengan bantuan pompa fasa gerak cair
dialirkan melalui kolom ke detektor. Sampel dimasukkan ke dalam aliran fasa
komponen-komponen campuran. Karena perbedaan kekuatan interaksi antara zat terlarut
terhadap fasa diam. Zat terlarut yang kurang kuat interaksinya dengan fasa
diam akan keluar dari kolom lebih dulu. Sebaliknya, zat terlarut yang kuat
berinteraksi dengan fasa diam akan keluar dari kolom lebih lama. Setiap
komponen campuran yang keluar kolom dideteksi oleh detektor yang
kemudian direkam dalam bentuk kromatogram (Anwar ,1994).
Gambar 8. Diagram alat Kromatografi Cair Kinerja Tinggi (KCKT) (Anwar ,1994)
Metode yang digunakan untuk mendeteksi substansi yang telah melewati
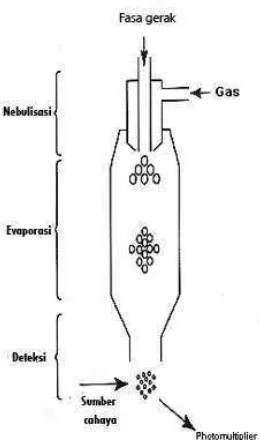
kolom KCKT pada penelitian ini digunakan ELSD (Evaporative Light
Scattering Detection) yaitu, detektor hamburan cahaya menguapkan yang dapat
digunakan untuk mendeteksi analit dengan berbagai panjang gelombang. Pada
detektor ini sampel yang akan dideteksi harus melalui 3 tahap yaitu:
a. Nebulisasi merupakan langkah pertama untuk mengubah seluruh fasa
gerak yang mengalir dari kolom KCKT dengan bantuan gas nitrogen menjadi
b. Evaporasi ( penguapan) merupakan langkah kedua setelah fasa gerak
diubah menjadi aerosol yang dibawa oleh aliran gas ke daerah panas yang
terletak sebelum ruang deteksi. Pelarut akan diuapkan untuk menghasilkan
partikel zat terlarut murni.
c. Deteksi dimana partikel-partikel sampel akan ditembakkan dengan sumber
cahaya, jumlah cahaya yang tersebar yang diukur dengan menggunakan
fotomultiplier dan perangkat elektronik.
Gambar 9. Diagram detektor Evaporative Light Scattering Detection(ELSD)
(http://www.sedere.com/writable/versions/sedere/applications/index-upload-ELSD_Biblio_2010.pdf)
F. Bakteri
Bakteri adalah mikroorganisme bersel tunggal tidak terlihat oleh mata,
berukuran antara 0,5–10 µm dan lebar 0,5-2,5 µm tergantung pada jenisnya.
ditemukan, diantaranya berbentuk coccus, batang, spiral, vibrio (Buckel dkk.,
1987).
Bentuk dan ukuran bakteri ada beberapa macam, antara lain :
a. Bentuk basil : lebar 0,3 -1µm, panjang 1,5–4 µm
b. Bentukcoccus: ukuran tengahnya rata-rata 1 µm
c. Bentuk spiral : lebar 0,5 -1 µm, panjang 2-5 µm, kadang sampai 10 µm
d. Bentukvibrio: lebar 0,5 µm, panjang sampai 3 µm
e. Bentukspirocheta: lebar 0,2 -0,7 µm, panjang 5 -10 µm. (Adam, 1995)
Secara garis besar bakteri dibedakan berdasarkan perbedaan komposisi dinding
selnya yaitu: bakteri gram positif dan gram negatif.
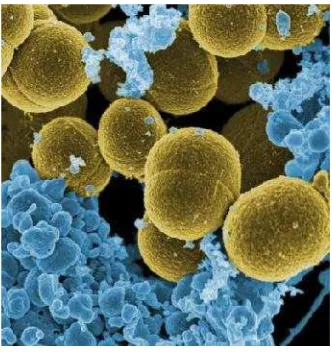
1. Staphylococcus aureus
Staphylococcusmerupakan bakteri Gram positif berbentuk bulat biasanya
tersusun dalam bentuk menggerombol yang tidak teratur seperti anggur.
Staphylococcusbertambah dengan cepat pada beberapa tipe media dengan aktif
melakukan metabolisme, melakukan fermentasi karbohidrat dan menghasilkan
bermacam-macam pigmen dari warna putih hingga kuning gelap.
Staphylococcus cepat menjadi resisten terhadap beberapa antimikroba (Jawetz,
et al., 2001).
KlasifikasiStaphylococcus aureus: • Kingdom :Protozoa
• Divisio :Schyzomycetes
• Ordo :Eubacterialos
• Family :Micrococcaceae
• Genus :Staphylococcus
• Species :Staphylococcus aureus (Salle, 1961)
Gambar 10. BakteriStaphylococcus aureus
(http://millicent.blogdetik.com/2010/06/04/keyboard-sumber-bakteri)
Staphylococcustumbuh dengan baik pada berbagai media bakteriologi
dibawah suasana aerobik atau mikroaerofilik. Tumbuh dengan cepat pada
temperatur 20 -35ºC. Koloni pada media padat berbentuk bulat, lambat dan
mengkilat (Jawetz, et al., 2001).
Staphylococcus aureusmempunyai 4 karakteristik khusus, yaitu faktor
virulensi yang menyebabkan penyakit berat pada normal hast, faktor
differensiasi yang menyebabkan penyakit yang berbeda pada sisi atau tempat
berbeda, faktor persisten bakteri pada lingkungan dan manusia yang membawa
sebelumnya masih efektif (Spicer, 2000). Staphylococcus aureus
menghasilkan katalase yang mengubah hidrogen peroksida menjadi air dan
oksigen (Jawetz,et al., 2001).
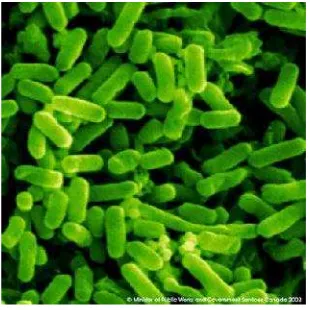
2. Escherichia coli
Organisme ini tersebar luas di alam biasanya lazim terdapat dalam sel
pencernaan manusia dan hewan. Dalam Merchant dan Parker (1961)
disebutkan spesiesE. colitidak dapat mengurangi asam sitrat dan garam asam
sitrat sebagai sumber karbon tunggal dan tidak menghasilkan pigmen, tetapi
kadang-kadang menghasilkan pigmen berwarna kuning.
KlasifikasiEscherichia coli: • Divisio :Schizomycota
• Kelas :Schizomycetec
• Ordo :Eubacteriaceae
• Genus :Escherichia
Gambar 11. BakteriEscherichia coli
(http://dokterternak.com/2011/05/31/penyakit-colibacillosis-akibat-bakteri-e-coli-pada-ayam/)
E. colitersebar diseluruh dunia dan ditularkan bersama air atau makanan yang
terkontaminasi oleh feses. Escherichia coliberbentuk batang, tebal 0,5µm;
panjang antara 1,0 -3,0 µm; bervariasi dari bentuk koloid sampai berbentuk
seperti filamen yang panjang; tidak berbentuk spora; motil dan filamen perithin
beberapa galur tidak memiliki flagella; bersifat Gram negatif (Merchant dan
Parker, 1961).
E. colibersifat aerob atau kualitatif anaerob, dapat tumbuh pada media buatan.
Beberapa sifat E. coli antara lain pertumbuhan optimum pada suhu 37ºC, dapat
tumbuh pada suhu 15ºC -45ºC, tumbuh baik pada pH 7,0 tapi tumbuh juga
pada pH yang lebih tinggi (Merchant dan Parker, 1961).
Koloni terlihat basah, mengkilat, tidak bening, bulat dan dengan tepi yang
terlihat halus dan rata. Koloni muda terlihat granuler halus dan makin tua
menjadi granuler kasar. Escherichia colimenghasilkan asam dan gas dari
glukosa, laktosa, fruktosa, maltosa, arabinosa, xylosa, rhamnosa dan manitol;
gliserol; bervariasi dalam memfermentasi sakrosa dan salisin, pektin dan
adonitol jarang difermentasikan; dekstrin, pati dan glikogen dan inositol tidak
pernah difermentasikan (Merchant dan Parker, 1961).
Escherichia colimenghasilkan katalase, tidak mencairkan gelatin, membentuk
indol, mereduksi nitrat, mengoksidasi dan mengasamkan air susu tanpa
peptonisasi, mengoksidasi kentang sehingga berwarna coklat gelap, tidak
menghasilkan gas H2S (Merchant dan Parker, 1961).
G. Uji Antibakteri
Antibakteri adalah zat yang menghambat pertumbuhan bakteri dan digunakan
secara khusus untuk mengobati infeksi (pelczar dan Chan 1986).
Pengukuran aktivitas antibakteri menurut Jawetz (1986) meliputi 2 cara yaitu:
1. Dilusi
Pada prinsipnya antibiotik diencerkan hingga diperoleh beberapa konsentrasi.
Metode yang dipakai ada dua macam, yaitu metode dilusi kaldu disebut juga
dengan dilusi cair dan metode dilusi agar atau dilusi padat. Pada dilusi cair,
masing-masing konsentrasi obat ditambah suspensi kuman atau bakteri dalam
media. Sedangkan dalam dilusi padat, tiap konsentrasi obat dicampur dengan
media agar, lalu ditanami bakteri (Brander et al., 1991).
Pertumbuhan bakteri ditandai oleh adanya kekeruhan setelah 16-20 jam
diinkubasi. Konsentrasi terendah yang menghambat pertumbuhan bakteri
Hambat Minimal (KHM). Masing-masing konsentrasi antibiotik yang
menunjukkan hambatan pertumbuhan ditanam pada agar padat media
pertumbuhan bakteri dan diinkubasi. Konsentrasi terendah dari antibiotik yang
membunuh 99,9% inokulum bakteri disebut Konsentrasi Bakterisid Minimal
(Brander et al., 1991).
2. Difusi
Media difusi menggunakan kertas disk yang berisi antibiotik dan telah
diketahui konsentrasinya. Pada metode difusi, media yang dipakai adalah agar
Mueller Hinton. Ada beberapa cara pada metode difusi ini, yaitu :
i. Cara Kirby-Bauer
Cara Kirby-Bauer merupakan suatu metode uji sensitivitas bakteri yang
dilakukan dengan membuat suspensi bakteri pada media Brain Heart Infusion
(BHI) cair dari koloni pertumbuhan kuman 24 jam, selanjutnya disuspensikan
dalam 0,5 ml BHI cair (diinkubasi 4-8 jam pada suhu 37°C) (Jawetz et al.,
2001).
Hasil inkubasi bakteri diencerkan sampai sesuai dengan standar konsentrasi
kuman 108 CFU/ml (CFU : Coloni Forming Unit). Suspensi bakteri diuji
sensitivitas dengan meratakan suspensi bakteri tersebut pada permukaan media
agar. Disk antibiotik diletakkan di atas media tersebut dan kemudian diinkubasi
pada suhu 37°C selama 19-24 jam kemudian dibaca hasilnya (Jawetz et al.,
ii. Cara sumuran
Suspensi bakteri 108CFU/ml diratakan pada media agar, kemudian agar
tersebut dibuat sumuran dengan garis tengah tertentu menurut kebutuhan.
Larutan antibiotik yang digunakan diteteskan kedalam sumuran. Diinkubasi
pada suhu 37°C selama 18-24 jam. Dibaca hasilnya, seperti pada cara
Kirby-Bauer (Jawetz et al., 2001).
iii. CaraPour Plate
Setelah dibuat suspensi kuman dengan larutan BHI sampai konsentrasi standar
(108CFU/ml), lalu diambil satu mata ose dan dimasukkan kedalam 4ml agar
base 1,5% dengan temperatur 50°C. Suspensi kuman tersebut dibuat homogen
dan dituang pada media agar Mueller Hinton. Setelah beku, kemudian
dipasang disk atau ring yang diberi antibiotik (diinkubasi 15-20 jam pada suhu
37°C) dibaca dan disesuaikan dengan standar masing-masing antibiotik
(Jawetz et al., 2001).
H. Spektroskopi Infra Merah (IR)
Spektroskopi infra merah adalah suatu metoda analisis yang didasarkan pada
penyerapan sinar infra merah. Fungsi utama dari spektroskopi infra merah
adalah untuk mengenal struktur molekul (gugus fungsional). Spektroskopi
infra merah adalah grafik dari persentasi transmitansi dengan panjang
gelombang atau penurunan frekuensi. Tiap lekukan yang disebut gelombang
atau puncak menunjukkan adsorbsi dari radiasi inframerah oleh cuplikan pada
Prinsip kerja dari metode ini adalah apabila sinar dilewatkan melalui cuplikan
senyawa organik, maka sejumlah frekuensi yang lain akan diteruskan. Karena
atom-atom dalam suatu molekul tidak diam melainkan bervibrasi, maka
penyerapan frekuensi (energi ini mengakibatkan terjadinya transisi diantara
tingkat vibrasi dasar dan tingkat vibrasi tereksitasi. Metode ini juga digunakan
dalam mendeteksi gugus fungsional, mengidentifikasi senyawa dan
menganalisis campuran (Day and Underwood, 1989)
Sebagai contoh spektrum serapan IR senyawa alkaloid dariactinomycetes
yaitu: senyawaN-Carboxamido-staurosporine memberikan data serapanIR : ν
= 2855, 2929, 2359, 2344, 1633, 1458, 1385, 1316, 1282, 1120, 1018 cm-1. (Wuet.al, 2006).
A. Tempat dan Waktu Penelitian
Penelitian ini telah dilakukan dari bulan Februari 2011 sampai bulan
November 2011 di Laboratorium Biomassa Universitas Lampung. Analisis
struktur dengan spektrofotometriFourier Transform Infra Reddilakukan di
Laboratorium Biomassa Universitas Lampung.
B. Alat dan Bahan
1. Alat-alat
Alat-alat yang digunakan pada penelitian ini adalah: alat-alat gelas,
pengguncang orbital (orbital shaker) Wiggen Houser 05-150, jarum ose,
pinset, pipet Ependrof, inkubator CO2Memmert-Germany, otoklaf Hitachi CF
16RX II, alatlaminar air flowESCO/AVC4A1, alat sentrifugasi
Hitachi/CF-46RX, penguap putar vakum Buchii/R205, lampu UV kohler/SN402006,
seperangkat alat kromatografi lapis tipis, seperangkat alat kromatografi kolom,
seperangkat alat Kromatografi Cair Kinerja Tinggi (KCKT) Varian 940-LC
dengan Detektor ELS Varian 385-LC, spektofotometerfourier transform
2. Bahan-bahan
Bahan-bahan yang digunakan adalah: isolat murniactinomycetesAnLd-2b-3
yang terdapat di Laboratorium Biomassa Universitas Lampung, ekstrak ragi,
bubuk agar, tepung pati,Tryptic Soy Broth(TSB),nutrient agar(NA), pepton,
dektrosa, kloramfenikol, sikloheksamida, asam nalidixat, bismut nitrat, asam
tartarat, kalium iodida, pereaksi serium sulfat, natrium hidroksida, asam
klorida, berbagai macam pelarut p.a yang berasal dari J.T Beaker antaralain:
etanol, n-heksana, diklorometana, metanol, silika gel 60 Merck(0,063-0,200
mm), plat KLT silika gel 60 F254, bakteri gram negatif (Escherichia coli), dan
bakteri gram positif (Staphylococcus aureus).
C. Prosedur Penelitian
1. Pembuatan media perkembangbiakanActinomycetes
i. Pembuatan mediaTryptic Soy Broth(TSB)
Tiga puluh sembilan gram TSB dilarutkan dalam 1 L air laut steril kemudian di
sterilkan. Campuran yang dihasilkan disebut media TSB (Magarveyet al.,
2004).
ii. Pembuatan media M1
Sepuluh gram pati, 4 gram ekstrak ragi, 2 gram pepton dilarutkan dalam 1 L air
laut steril kemudian di sterilkan. Campuran yang dihasilkan disebut media M1
2. Produksi senyawa metabolit sekunder (Magarveyet al., 2004)
Isolat murniactinomycetesAnLd-2b-3 telah dibiakkan di dalam tabung gelas
yang berisi 175 mL media TSB sambil diguncang dengan pengguncang orbital
pada suhu 250C dengan kecepatan 120 rpm selama 14 hari. Hasil inkubasi dipindahkan ke dalam botol yang berisi 5 L media M1 dan diinkubasi kembali
selama 21 hari. Biakan yang dihasilkan dipisahkan dengan menggunakan alat
sentrifugasi pada suhu 40C, kecepatan 6500 rpm, selama 15 menit hingga diperoleh filtrat dan biomassanya. Masing-masing filtrat dan biomass ini
dimaserasi selama 1 hari dengan pelarut DCM:MeOH (1:1). Maserat
diekstraksi dengan menggunakan corong pisah. Maserat dari keduanya
masing-masing diuji dengan metode KLT untuk melihat pola kromatogramnya
apabila memunjukkan pola yang sama maka kedua maserat digabung dan
selanjutnya maserat tersebut kemudian diuapkan dengan menggunakan
penguap putar vakum. Ekstrak pekat ini dianalisis menggunakan metode KLT
menggunakan larutan pengembang DCM:MeOH dengan berbagai
perbandingan , hingga diperoleh komposisi eluen terbaik yaitu yang
memberikan pola pemisahan terbaik. Komposisi larutan ini akan digunakan
sebagai eluen dalam pemurnian ekstrak dengan metode kromatografi kolom.
Kromatogram hasil KLT yang dihasilkan diamati dengan lampu UV dengan
panjang gelombang 254 nm dan 366 nm, diidentifikasi menggunakan pereaksi
CeSO4 untuk mengetahui senyawa metabolit sekunder yang ada pada ekstrak
pekat tersebut dan pereaksi Dragendroff untuk mengetahui keberadaan
3. Fraksinasi senyawa metabolit sekunder menggunakan metode kromatografi kolom
Fraksinasi menggunakan metode kromatografi kolom bertujuan untuk
mendapatkan senyawa alkaloid murni dari ekstrak hasil maserasi. Ekstrak
DCM:MeOH pekat diimpregnasi menggunakan pelarut metanol ke dalam
silika impreg dengan perbandingan sampel:silika yaitu 1:2 dan elusi dilakukan
secara elusi landaian menggunakan pelarut yang tepat menghasilkan
fraksi-fraksi. Fraksi-fraksi hasil pemisahan dianalisis kembali dengan metode KLT
menggunakan pereaksi CeSO4dan Dragendoff. Fraksi yang memiliki
kromatogram sama digabung menjadi satu dan selanjutnya direfraksinasi
sampai diperoleh komponen yang murni.
4. Analisis dengan kromatografi cair kinerja tinggi (KCKT)
Kromatografi cair kinerja tinggi pada penelitian ini digunakan untuk
mengetahui tingkat kemurnian dari fraksi yang mengandung alkaloid hasil
pemisahan kolom kromatografi. Sampel sebanyak 5 µL dimasukkan ke dalam
botol vial kemudian diletakkan dalam rak yang selanjutnya akan diinjeksi. Fasa
diam yang digunakan adalah kolom C18dengan panjang 125 mm yang
berdiameter 4,6 mm dan fasa gerak yang dipakai adalah metanol-air (90:10).
Detektor yang digunakan adalahEvaporative Light Scatter Detector(ELSD
5. Identifikasi senyawa menggunakan spektroskopiFrourier Transform Infra Red(FTIR)
Analisis FTIR bertujuan untuk memperhatikan karakteristik serapan gugus
fungsi dari fraksi murni yang mengandung senyawa alkaloid. Caranya,
senyawa digerus bersama KBr hingga homogen, kemudian dikempa hingga
menjadi pelet KBr. Pelet tersebut diidentifikasi menggunakan
spektrofotometer FTIR
6. Pengujian antibakteri
Uji antibakteri senyawa isolate dilakukan terhadap pertumbuhan bakteri (S.
aureusdan E. coli) dengan teknik difusi yaitu dengan meletakkan silinder
(cincin) besi tahan karat berukuran diameter 6 mm pada medium NA yang
telah di inokulasikan bakteri (S. aureusdanE. coli). Caranya 10 mL media
NA dituang ke dalam cawan petri yang sudah disterilkan, lalu dipadatkan
sebagai lapisan pertama. Kemudian media NA cair yang telah diinokulasi
bakteri uji dituang di atas media NA yang telah padat, lalu diratakan dan
dibiarkan memadat, kemudian diletakkan silinder (cincin) besi tahan karat
yang telah steril. Ekstrak senyawa alkaloid dengan konsentrasi 5000 bpj,
kloramfenikol (kontrol positif) dengan konsentrasi 100 bpj dan metanol
(kontrol negatifnya) dimasukkan ke dalam cincin yang berbeda sebanyak 50
µL. Inkubasi dilakukan selama ± 24 jam dan diamati diameter zona hambat
A. Simpulan
Dari hasil penelitian yang telah dilakukan, dapat disimpulkan bahwa :
1. IsolasiactinomycetesANLd-2b-3 menggunakan metoda kromatografi
kolom diperoleh senyawa alkaloid dengan rendemen 3,7 %.
2. Analisis FTIR menunjukkan bahwa senyawa alkaloid tersebut mengandung
gugus fungsi amina tersier, primer atau sekunder, gugus karboksil, dan
gugus hidroksil.
3. Senyawa alkaloid yang diperoleh dari isolatactinomyceteslumpur hutan
bakau memiliki aktivitas antibakteri terhadap bakteriEschericia coli,
Staphylococcus aureus
B. Saran
Berdasarkan hasil penelitian yang diperoleh pada penelitian ini, untuk
penelitian selanjutnya disarankan :
1. Melakukan teknik pemurnian menggunakan metoda lain yang lebih efektif
waktu dan sampel yang diperoleh dapat lebih murni dengan rendemen yang
tinggi.
2. Melakukan analisis struktur senyawa dengan menggunakan metode
spektroskopi C RMI dan H RMI untuk mengetahui informasi struktural
mengenai atom atom hidrogen dan karbon dalam sebuah molekul senyawa
alkaloid, spektroskopiUV untuk mengetahui λmaks, spektroskopi massa untuk mengetahui bobot molekul senyawa alkaloid, sehingga dapat
(Skripsi)
Oleh
Deliana Hernawati
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS LAMPUNG
Oleh
Deliana Hernawati
Skripsi
Sebagai Salah Satu Syarat untuk Mencapai Gelar SARJANA SAINS
pada Jurusan Kimia
Fakultas Matematika dan Ilmu Pengetahuan Alam
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS LAMPUNG
persembahkan skripsi ini
sebagai ungkapan bakti,
hormat kepada:
Bapa dan Mamaku Tercinta
Yang selalu memberikan kasih
sayangnya, tak pernah lelah
bermandi peluh, dan selalu
mendoakanku
Adik-adikku Tersayang
Nama Mahasiswa : Deliana Hernawati
Nomor pokok Mahasiswa : 0517011025
Program Studi : Kimia
Fakultas : Matematika dan Ilmu Pengetahuan Alam
MENYETUJUI 1. Komisi Pembimbing
Dra. Nurul Utami, M.Sc. Dian Herasari, M.Si.
NIP. 196204121989032002 NIP. 19710806200032001
2. Ketua Jurusan Kimia
1. Tim Penguji
Ketua : Dra.Nurul Utami, M.Sc ...
Sekertaris : Dian Herasari, M.Si. ...
Penguji
Bukan Pembimbing : Andi Setiawan,Ph.D. ...
2. Dekan Fakultas MIPA
Prof. Dr. Sutyarso, M.Biomed. NIP 195704241987031001
Penulis dilahirkan di Bogor pada tanggal 05 April 1986 sebagai anak Pertama dari
tiga bersaudara pasangan S. Simamora dan R br. Manalu.
Penulis menyelesaikan pendidikan Taman Kanak-kanak (TK) pada tahun 1992 di TK
Mardi-Yuana, tahun 1998 menyelesaikan Sekolah Dasar (SD) di SD Negeri 1
Wibawa Mukti, tahun 2001 menyelesaikan Sekolah Lanjutan Tingkat Pertama (SLTP)
di SLTP Swasta Cinta Rakyat 2 Siantar Timur, menyelesaikan Sekolah Menegah
Umum (SMU) di SMU Negeri 6 Bekasi, pada tahun 2004 dan pada tahun 2005
penulis diterima sebagai mahasiswa Universitas Lampung (UNILA) melalui jalur
Seleksi Penerimaan Mahasiswa Baru (SPMB).
Selama menjadi mahasiswa, penulis pernah menjadi asisten pembimbing Kimia Dasar
I Fakultas Matematika Dan Ilmu Pengetahuan Alam (MIPA) tahun 2008-2010 dan
Fakultas Pertanian tahun 2010-2011, asisten praktikum Kimia Organik II, Fakultas
MIPA tahun 2006-2008 penulis juga pernah aktif di organisasi Persekutuan Doa
Puji syukur penulis ucapkan atas kehadirat Allah Bapa Surgawi yang telah memberikan kasih dan karunia-NYA sehingga skripsi ini dapat diselesaikan
Skripsi dengan judul “Isolasi dan Identifikasi senyawa Alkaloid dari
Actinomycetes ANLd-2b-3 Lumpur Hutan Bakau” adalah salah satu syrat untuk memperoleh gelar sarjana Sains di Universitas lampung
Dalam kesempatan kali ini penulis mengucapkan terimakasih kepada: 1. Bapak Prof. Suharso Ph. D., Selaku Dekan Fakultas Matematika dan lmu
Pengetahuan Alam Universitas Lampung.
2. Bapak Andi Setiawan,Ph.D., selaku Ketua Jurusan Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas (MIPA) dan Penguji Utama pada ujian skripsi. Terimakasih atas ilmu, saran dan bimbingannya demi keberhasilan penelitian ini
3. Ibu Dra. Nurul Utami, M.Sc selaku dosen Pembimbing Utama dan
Pembimbing Akademik atas kesediannya yang telah memberikan banyak ilmu, saran, bimbingan dalam proses menyelesaikan studi dan penelitian ini.
4. Ibu Dian Herasari, M.Si selaku Pembimbing kedua atas bimbingan dan sarannya dalam proses menyelesaikan penelitian ini.
5. Bapak dan ibu staf dosen, karyawan dan laboran Jurusan Kimia Fakultas MIPA Universitas Lampung.
6. Kedua orang tua saya, adik-adik, kekasih, sahabat, dan rekan-rekan di Jurusan Kimia FMIPA Unila yang selalu memberikan semangat dan dukungan moral selama menyelesaikan studi
Bandar Lampung, 08 Februari 2012 Penulis