OPTIMASI PROSES EKSTRAKSI ANTOSIANIN
PADA BUNGA TELENG
(
Clitoria ternatea
L.) DENGAN METODE
PERMUKAAN TANGGAP
ABDULLAH MUZI MARPAUNG
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
ABSTRACT
MARPAUNG AM. The Optimation of Anthocyanin Extraction From
Butterfly Pea (
Clitoria ternatea
L.) Petal Using Response Surface
Methodology.
Under direction of NURI ANDARWULAN and ENDANG PRANGDIMURTI
The Box-Behnken experimental design with Response Surface Methodology has been used in optimation of extraction process of anthocyanin from butterfly pea (Clitoria ternatea L.) petal. The extraction process was conducted with no light by using water. The ratio of fresh petal to water-HCl (pH 4.5) was 1:4 (w/v). The optimum process was defined as a set of extraction factors by using highest extract volume, anthocyanin and total phenol content as the selected parameters. The three factors were blanching time (0 to 12 minutes), extraction temperature (30 to 60oC) and extraction time (30 to 120 minutes). The research showed that all factors had significant effect to volume by following reduced 2-factor interaction model, while anthocyanin content and total phenol content was effected by following reduced quadratic model. Based on the models, the most efficient extraction process was 6 minutes for blanching time followed by 30 minutes of extraction time at 60oC. The antioxidant activity and stability during storage of the extract was also studied. The research showed that highest antioxidant activity of butterfly pea flower extract was reached at pH 1 (flavylium cation) followed by pH 4.5 (hemiketal form) and pH 7 (quinonoidal base). The study of stability showed that butterfly pea extract was very unstable at pH 12 to 14, both in room temperature and 4oC storage. The extracts with pH 1 to 11 at 4oC were much more stable compare to the room temperature. At room temperature, the highest stability showed by pH 1 and followed by pH 2. At 4oC the extracts with pH 1 to 2 and 7 to 11 were stable during 28 days storage.
RINGKASAN
MARPAUNG AM. Optimasi Proses Ekstraksi
Antosianin Bunga
Teleng (
Clitoria ternatea
L) Dengan Metode Permukaan Tanggap
Dibimbing oleh NURI ANDARWULAN dan ENDANG PRANGDIMURTI
Antosianin merupakan pigmen alami yang memiliki banyak manfaat bagi kesehatan. Pigmen ini dapat dijumpai pada berbagai jenis tanaman. Salah satunya yang potensial adalah bunga teleng (Clitoria ternatea L). Selain kadar yang relatif tinggi, bunga teleng memiliki sejumlah keunggulan dibandingkan dengan sumber antosianin lain. Di antaranya adalah tanaman ini mudah tumbuh dengan perawatan yang minimal serta menghasilkan bunga setiap hari sepanjang tahun sehingga dapat berperan sebagai sumber antosianin yang mudah dan murah bagi masyarakat. Selain itu antosianin bunga teleng memiliki aktivitas antioksidan yang relatif lebih tinggi dibandingkan dengan beberapa jenis antosianin yang lain.
Antosianin bunga teleng, sebagaimana antosianin dari sumber lainnya, bersifat tidak stabil akibat berbagai kondisi pengolahan dan penyimpanan, terutama karena panas. Oleh karena itu proses pengambilan antosianin pada bunga teleng, khususnya proses yang melibatkan panas, perlu dipelajari untuk mendapatkan hasil yang optimal.
Optimasi proses ekstraksi yang dipelajari pada penelitian ini menggunakan metode permukaan tanggap dengan rancangan percobaan Box-Behnken. Rancangan Box-Behnken merupakan rancangan yang efisien untuk tujuan optimasi proses yang melibatkan tiga atau lebih faktor. Terdapat tiga faktor yang dipelajari pada penelitian ini yaitu lama blansir dengan taraf 0 sampai 12 menit, suhu ekstraksi dengan taraf 30oC hingga 60oC serta lama ekstraksi dengan taraf 30 menit hingga 120 menit. Selain ketiga faktor tersebut kondisi proses ekstraksi diatur sebagai berikut. Ekstraksi dilakukan dalam keadaan gelap, rasio bunga segar dan pelarut adalah 1:4 (b/v). Pelarut yang digunakan adalah air-HCl dengan pH 4,5. Terdapat tiga respons atau tanggap yang diukur untuk mendapatkan parameter proses optimal, yaitu volum ekstrak, kadar antosianin dan kadar total fenol.
iv
Selain optimasi proses, pada penelitian ini juga dipelajari spektrum warna, aktivitas antioksidan dan kestabilan warna selama penyimpanan dari ekstrak bunga teleng yang diperoleh melalui proses ekstraksi optimal.
Uji absorbansi pada ekstrak bunga teleng menunjukkan 2 panjang gelombang dengan serapan maksimal pada rentang cahaya tampak yaitu pada panjang gelombang 574 nm dan 619 nm. Panjang gelombang pertama menunjukkan absorbansi dari antosianin dengan bentuk basa kuinonoidal tautomer I dan panjang gelombang kedua menunjukkan absorbansi basa kuinonoidal tautomer II. Selain itu terdapat pula 1 bahu, yaitu pada panjang gelombang 539 nm yang merepresentasikan antosianin dengan bentuk kation flavilium. Uji absorbansi juga menunjukkan bahwa pita II (cincin A sitem benzoil) pada ekstrak bunga teleng mucul pada panjang gelombang 264 287 nm, sedangkan pita I (cincin B-sistem sinamoil) muncul pada panjang gelombang 579-574 nm. Berdasarkan uji absorbansi juga dapat diperkirakan bahwa 41,6 % antosianin pada ekstrak bunga teleng berbentuk terpoliglikolisasi, dan perbandingan antara antosianin terpoliasilasi dengan yang tidak sebesar 416,8 %. Hasil ini sesuai dengan berbagai penelitian yang menyebutkan bahwa antosianin pada bunga teleng merupakan antosianin terpoliglikolisasi dan terpoliasilasi.
Aktivitas antioksidan dari ekstrak bunga teleng yang dipelajari adalah pada pH 1, 4,5 dan 7. Masing-masing mewakili struktur antosianin yang berbeda-beda. Hasil penelitian menunjukkan bahwa aktivitas antioksidan ekstrak bunga teleng tertinggi dicapai pada pH 1 ketika antosianin berada dalam bentuk kation flavilium, diikuti pada pH 4,5 (bentuk hemiketal) dan pH 7 (bentuk basa kuinonoidal). Ini menunjukkan bahwa aktivitas antioksidan ekstrak bunga teleng memiliki karakteristik yang mirip dengan sebagian besar sumber antosianin lain, yaitu mencapai nilai yang semakin tinggi pada pH yang semakin rendah.
Kestabilan warna ekstrak dipelajari selama 28 hari, dengan variasi pH ekstrak antara 1 hingga 14 dan dua suhu penyimpanan, yaitu suhu ruang dan 4oC. Kestabilan warna ekstrak ditentukan dengan mengukur besar serapan cahaya atau absorbansi pada panjang gelombang maksimal dari masing-masing ekstrak setelah penyimpanan, dibagi absorbansi pada hari nol. Ekstrak pH 12 hingga 14 bersifat paling tidak stabil, baik pada suhu 4oC maupun pada suhu ruang. Setelah penyimpanan selama 1 hari ekstrak pH 12 hingga 14 tersebut telah mengalami kehilangan warna hingga 100 %.
Pada penyimpanan di suhu ruang ekstrak bunga teleng relatif hanya stabil pada pH 1, yaitu dengan sisa absorbansi mencapai 86 % setelah 28 hari penyimpanan. Pada lama penyimpanan yang sama absorbansi ekstrak pH 2 hanya tersisa 4 %. Pada pH 3 dan yang lebih tinggi kestabilan warna bahkan semakin rendah, dengan kehilangan warna mencapai 100 % hanya dalam 14 hari penyimpanan.
v
penyimpanan baik pada panjang gelombang maksimalnya maupun pada berbagai panjang gelombang lain yang mewakili karakteristik antosianin.
©Hak Cipta milik IPB, tahun 2012 Hak Cipta dilindungi Undang-undang
OPTIMASI PROSES EKSTRAKSI ANTOSIANIN
PADA BUNGA TELENG
(
Clitoria ternatea
L.) DENGAN METODE
PERMUKAAN TANGGAP
ABDULLAH MUZI MARPAUNG
Tugas Akhir
sebagai salah satu syarat untuk memperoleh gelar
Magister Profesi pada
Program Studi Magister Profesi Teknologi Pangan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
x
Judul Tugas Akhir : Optimasi Proses Ekstraksi Antosianin Bunga Teleng (Clitoria ternateaL.) dengan Metode Permukaan Tanggap
Nama : Abdullah Muzi Marpaung
NRP : F252100105
Disetujui Komisi Pembimbing
Dr. Ir. Nuri Andarwulan, MS Dr. Ir. Endang Prangdimurti, MS
Ketua Anggota
Diketahui
Ketua Program Studi Magister Dekan Sekolah Pascasarjan
Profesi Teknologi Pangan
Dr.Ir. Lilis Nuraida, MSc Dr.Ir Dahrul Syah, MSc. Agr.
Tanggal Ujian :
PRAKATA
Segala puji bagi Allah SWT semata atas segala sesuatu yang telah, sedang dan
akan terjadi pada setiap detail kehidupan ini, khususnya atas perkenan Allah bagi terselesaikannya tugas akhir ini.
Terima kasih penulis ucapkan kepada Ibu Dr. Ir. Nuri Andarwulan MS dan Ibu Dr. Ir. Endang Prangdimurti MS selaku pembimbing, atas masukan dan diskusi yang
inspiratif dan mendalam sehingga tugas akhir ini berkembang menjadi bentuknya yang sekarang. Terima kasih pula disampaikan kepada ayah, ibu, istri, anak dan keluarga besar atas doa, kasih sayang, kehangatan dan dukungannya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Agustus 2012
RIWAYAT HIDUP
Penulis dilahirkan di Pulau Bintan Kepulauan Riau pada tanggal 23 Juni 1967 dari ayah Parlindungan Marpaung B.Ac dan Ibu Rahma Harahap. Penulis merupakan putera pertama dari enam bersaudara.
Tahun 1990 penulis lulus dari Jurusan Pengolahan Hasil Pertanian Fakultas
Teknologi Pertanian Universitas Gadjah Mada. Setelah selama sekitar 12 tahun berkarier sebagai profesional di industri makanan, tahun 2003 penulis memulai usahanya sendiri di bidang pembelajaran sains yang inovatif hingga sekarang. Sejak tahun 2006 penulis juga aktif menulis sejumlah buku eksperimen sains untuk anak-anak
DAFTAR ISI
Halaman
DAFTAR TABEL ... xix
DAFTAR GAMBAR... xxi
DAFTAR LAMPIRAN ... xxiii
I. PENDAHULUAN ... 1
A. Latar Belakang... 1
B. Tujuan... 2
II. TINJAUAN PUSTAKA ... 3
A. Taksonomi dan Morfologi Bunga Teleng (Clitoria ternateaL.) ... 3
B. Manfaat Kelopak Bunga Teleng... 4
C. Senyawa Fitokimia Pada Bunga Teleng dan Perannya Bagi Kesehatan ... 8
D. Antosianin Pada Bunga Teleng ... 11
E. Kestabilan Antosianin ... 14
F. Ekstraksi Antosianin... 19
G. Metode Permukaan Tanggap (Response Surface Methodology)... 21
III. BAHAN DAN METODOLOGI ... 23
A. Bahan dan Alat ... 23
B. Metode Penelitian ... 24
C. Rancangan Percobaan... 26
D. Metode Analisis... 27
IV. HASIL DAN PEMBAHASAN ... 31
A. Optimasi Proses Ekstraksi dan Verifikasi Proses Optimal ... 31
B. Karakterisasi Ekstrak Bunga Teleng ... 39
V. KESIMPULAN DAN SARAN ... 55
A. Kesimpulan... 55
B. Saran ... 55
DAFTAR PUSTAKA... 57
DAFTAR TABEL
Halaman
1 Pemanfaatan bunga teleng untuk pengobatan secara tradisional di berbagai negara 6
2 Manfaat ekstrak bunga teleng bagi kesehatan menurut berbagai penelitian ... 7
3 Senyawa-senyawa flavonoid pada kelopak bunga teleng... 9
4 Enam jenis antosianidin yang paling umum... 12
5 Gugus R pada struktur kimia berbagai jenis ternatin ... 14
6 Berbagai macam proses ekstraksi antosianin bunga teleng... 20
7 Rancangan percobaan Box-Behnken untuk 3 faktor ... 22
8 Faktor dan taraf yang dipelajari di dalam penelitian ... 26
9 Rancangan percobaan dan respons yang diukur di dalam penelitian ... 27
10 Data hasil penelitian ekstraksi bunga teleng... 32
11 Model dan model persamaan yang menghubungkan antara respons dengan semua faktor yang dipelajari... 32
12 Hasil uji korelasi antara volum ekstrak, kadar antosianin dan total fenol ... 38
13 Hasil verifikasi proses ekstraksi pada kondisi optimum (lama blansir 6 menit, suhu ekstraksi 60oC dan lama ekstraksi 30 menit) dengan nilai yang diprediksi sesuai model... 39
14 Absorbansi warna ekstrak bunga teleng pH 1 hingga 14 selama penyimpanan pada suhu ruang ... 49
DAFTAR GAMBAR
Halaman
1 Tanaman dan kelopak bunga teleng (Clitoria ternateaL.) ... 3
2 Struktur kimia antosianidin ... 11 3 Struktur kimia enam jenis antosianidin terpenting ... 12 4 Struktur kimia dari Ternatin ... 13 5 Diagram alir optimasi proses ekstraksi antosianin bunga teleng... 25
6 Permukaan tanggap (kiri) dan kontur (kanan) pengaruh lama blansir dan suhu
ekstraksi terhadap volum ekstrak pada lama ekstraksi 120 menit ... 33 7 Permukaan respons (kiri) dan kontur (kanan) pengaruh lama blansir dan suhu
ekstraksi terhadap kadar antosianin ekstrak pada lama ekstraksi 120 menit ... 35
8 Permukaan respons (kiri) dan kontur (kanan) pengaruh lama blansir dan suhu
ekstraksi terhadap kadar total fenol ekstrak pada lama ekstraksi 120 menit ... 36 9 Oksidasi quercetin menjadi ortho-quinone... 37 10 Absorbansi ekstrak bunga teleng hasil proses ekstraksi optimal... 40
11 Spektrum warna ekstrak bunga teleng pada pH 1 hingga 14. ... 42 12 Perubahan struktur antosianin pada berbagai pH ... 42 13 Absorbansi ekstrak bunga teleng pada pH 1 hingga 7... 43 14 Absorbansi ekstrak bunga teleng pada pH 8 hingga 14... 44 15 Absorbansi ekstrak bunga teleng pada pH 1, 4,5 dan 7 (kiri) dan aktivitas
antioksidannya (kanan) ... 46 16 Spektrum warna ekstrak bunga teleng pada pH 1 hingga 14 selama penyimpanan
pada suhu ruang ... 48 17 Degradasi warna ekstrak bunga teleng pH 1 dan 2 yang disimpan pada suhu
ruang 50
DAFTAR LAMPIRAN
Halaman
I.
PENDAHULUAN
A. Latar Belakang
Antosianin adalah kelompok pigmen larut air terbesar yang terdapat pada tumbuhan. Pigmen ini dijumpai pada berbagai bagian tumbuhan, seperti daun, bunga, buah, batang dan akar. Hingga saat ini terdapat lebih dari 540 jenis antosianin yang berhasil diidentifikasi (Anderson & Francis 2004, diacu dalam Wrolstad et al 2005).
Jumlah ini kemungkinan akan terus bertambah oleh karena identifikasi jenis antosianin yang baru masih terus dilakukan.
Manfaat antosianin bagi kesehatan tubuh telah banyak dilaporkan. Selain sebagai antioksidan yang berfungsi menangkap radikal bebas, antosianin juga berperan di dalam
pemeliharaan jaringan mata (Ghosh & Konishi 2007), antidiabetes, anti inflamasi, menjaga sistem imun dan mencegah agregasi trombosit (Mukherjee et al. 2008). Sementara itu Morris (2009) menambahkan bahwa antosianin dapat berfungsi sebagai analgesik dan memiliki kemampuan mencegah kanker.
Antosianin terdapat pada banyak jenis tanaman pangan, meliputi 27 keluarga (Gosh & Konishi 2007). Salah satu sumber antosianin yang potensial adalah kelopak bunga teleng (Clitoria ternateaL.) Penelitian yang dilakukan oleh Vankar & Srivastava (2010) terhadap 15 jenis bunga menunjukkan bahwa bunga teleng tergolong jenis bunga yang mengandung antosianin relatif tinggi, dengan kandungan sebesar 227,42 mg/kg
bunga segar.
Bunga teleng secara tradisional telah dimanfaatkan baik sebagai pewarna alami, sebagai bahan pangan yang berkhasiat, maupun obat. Masyarakat di wilayah Kerala, India dan Filipina terbiasa mengonsumsi bunga teleng segar (Lee et al. 2011).
Sementara itu, di Thailand bunga teleng kering telah dijual secara komersial. Sedangkan ekstraknya telah diaplikasikan pada berbagai produk seperti sampo danlotion.
Sebagaimana kebanyakan pigmen alami, antosianin bersifat tidak stabil. Pada keadaan netral antosianin berwarna biru, pada keadaan asam berwarna ungu hingga
2
oksigen, enzim, dan gula (Rein 2005). Kestabilan antosianin juga dipengaruhi oleh
konsentrasinya serta keberadaan senyawa lain seperti flavonoid, protein, dan mineral (Rein 2005).
Penelitian terhadap ekstrak bunga teleng menunjukkan bahwa kandungan antosianin di dalam ekstrak bunga tersebut mengalami penurunan, baik selama proses pengolahan maupun selama penyimpanan. Kestabilan antosianin tersebut dipengaruhi
oleh sejumlah faktor, di antaranya suhu proses (Lee et al. 2011), suhu penyimpanan (Tantituvanontet al.2008, Wongsangtaet al.2009, Chaovanalikitet al.2009, Leeet al. 2011), cahaya (Tantituvanont et al. 2008, Lee et al. 2011), pH (Tantituvanont et al. 2008, Chaovanalikit et al. 2009) dan keberadaan ion (Wongsangta et al. 2009).
Sementara itu Lee et al. (2011) juga melaporkan bahwa kestabilan antosianin bunga teleng dapat ditingkatkan dengan penambahan asam benzoat.
Berkenaan dengan sifatnya yang relatif tidak stabil tersebut, proses ekstraksi antosianin pada bunga teleng perlu diatur agar diperoleh hasil yang optimal, baik dalam
jumlah maupun stabilitas antosianin yang dihasilkan. Penelitian Tulyathanet al.(1993) menunjukkan bahwa prosedur ekstraksi kelopak bunga teleng terbaik ialah pada pH 4,5, lama ekstraksi 70 menit dan rasio bunga kering terhadap pelarut (HCl 0,1 %) 3 : 120 disertai pengadukan.
Untuk mendapatkan optimasi proses ekstraksi yang lebih spesifik, penelitian lanjutan perlu dilakukan dengan menyertakan faktor-faktor baru yang diperkirakan memberikan pengaruh terhadap hasil ekstraksi, yaitu suhu dan perlakuan blansir. Metode permukaan tanggap digunakan sebagai upaya mendapatkan parameter proses
ekstraksi yang spesifik.
B. Tujuan
1. Mempelajari pengaruh waktu blansir, suhu dan lama ekstraksi terhadap kandungan antosianin dan total fenol pada ekstrak bunga teleng
2. Optimasi prosedur ekstraksi dengan metode permukaan tanggap
3. Mempelajari hubungan struktur kimia antosianin bunga teleng terhadap aktivitas antioksidannya.
II. TINJAUAN PUSTAKA
A. Taksonomi dan Morfologi Bunga Teleng (
Clitoria ternatea
L.)
Bunga teleng atau disebut juga bunga telang (Clitoria ternatea L.) adalah sejenis tanaman merambat dari keluarga Fabaceae atau polong-polongan. Tanaman ini diperkirakan berasal dari Asia Tenggara, kemudian menyebar luas ke wilayah Amerika Tengah dan Selatan, India dan China. Nama ternatea sendiri berasal dari Ternate,
[image:30.612.145.441.336.667.2]sebuah pulau di wilayah Provinsi Maluku Utara, Indonesia. Di Indonesia tanaman ini juga disebut sebagai bunga biru, disebabkan oleh kelopak bunganya yang berwarna biru (Gambar 1).
4
Meski dikenal sebagai tanaman yang memiliki bunga berwarna biru,
sesungguhnya terdapat satu lagi varietas bunga teleng, yakni varietas dengan bunga berwarna putih. Manfaat bagi kesehatan dari bunga teleng yang berwarna biru, lebih penting dibandingkan dengan bunga teleng yang berwarna putih (Solanki & Jain 2010).
Nama Clitoria ternatea berasal dari Flos clitoridis ternatensibus yang diperkenalkan oleh Jacob Breyne pada tahun 1678 (Fantz 1991). Jacob Breyne adalah
seorang ahli botani keturunan Jerman-Polandia yang pernah bekerja untuk VOC (Vereenigde Oostindische Compagnie) pada abad ke 17. Setelah sistem penamaan Linnaeus ditemukan dan digunakan secara internasional, nama bunga ini menjadi
Clitoria ternateaL.
Klasifikasi bunga teleng di dalam taksonomi adalah sebagai berikut.
Kingdom :Plantae
Subkingdom :Tracheobionta
Division :Spermatophyta
Sub Division :Magnoliphyta
Class :Magnoliopsida
Subclass :Rosidae
Order :Fabales
Family :Fabaceae
Genus :Clitoria
Species :Clitoria ternateaL.
Tanaman ini biasanya ditanam di pekarangan sebagai tanaman hias. Bunganya
sudah mulai bermunculan, sekitar usia 4 hingga 6 minggu setelah bertunas. Jika suhu sesuai dan kadar air di dalam tanah mencukupi, maka tanaman ini akan terus berbunga setiap hari di sepanjang tahun. Jika bunga dibiarkan maka akan menjadi buah. Buahnya berbentuk polong dengan panjang 5 7 cm. Masing-masing polong berisikan 6 hingga
10 biji.
B.
Manfaat Kelopak Bunga Teleng
5
utama pada pengobatan kuno India yang disebut dengan pengobatan ayurveda. Sistem
pengobatan ini sudah dikenal sejak masa kitab Veda atau Weda ditulis yaitu sekitar tahun 1700 hingga 1100 sebelum masehi. Ayurveda sendiri bermakna Ilmu pengetahuan lengkap untuk hidup panjang.
1. Kelopak Bunga Teleng Sebagai Pewarna Alami
Pemanfaatan bunga teleng secara tradisional baik sebagai pewarna pangan dan
non pangan, maupun untuk tujuan kesehatan dapat ditelusuri hingga ke banyak negara. Sejak berabad lalu masyarakat di Pulau Ambon Indonesia memasak nasi dengan ditambahkan bunga teleng untuk menghasilkan nasi yang berwarna biru (Rumpf 1747 diacu dalam Fantz 1991). Di Malaysia ekstrak bunga teleng digunakan untuk mewarnai penganan yang terbuat dari nasi (Leeet al.2011) yang dikenal dengan nama nasi kerabu
(Eckhardt 2011). Penggunaan ekstrak bunga teleng sebagai pewarna makanan juga telah lama dilakukan di, Thailand dan Myanmar. Masyarakat di Lembah Manipur, India menggunakan ekstrak bunga teleng sebagai cat untuk melukis (Sharma et al.2005). Di Thailand ekstrak bunga teleng digunakan untuk mewarnai rambut yang berwarna kelabu
(Tantituvanont et al. 2008). Sementara itu masyarakat di wilayah Kerala, India dan Filipina mengonsumsi bunga teleng sebagai lalapan (Leeet al.2011).
Meskipun telah sering digunakan sebagai pewarna secara tradisional, komersialisasi antosianin bunga teleng sebagai pewarna alami makanan belum
dilakukan. Hal ini disebabkan oleh sifat antosianin yang labil terhadap berbagai faktor (Tantituvanontet al.2008).
2. Manfaat Kelopak Bunga Teleng Bagi Kesehatan
Manfaat bunga teleng sebagai obat tradisional telah diakui sejak lama oleh banyak bangsa, khususnya India. Rangkuman manfaat bunga teleng tersebut dari berbagai referensi disajikan pada Tabel 1.
6
Tabel 1 Pemanfaatan bunga teleng untuk pengobatan secara tradisional di berbagai negara
Manfaat Negara Referensi
Mengurangi perih akibat gigitan serangga
India Agrawalet al. (2007) diacu dalam Chahalet al. (2010) Mengobati penyakit kulit India Agrawalet al. (2007) diacu
dalam Chahalet al. (2010) Penawar bisa ular India Parrotta (2001) diacu dalam
Patil & Patil (2011), Immanuel & Elisabeth (2009)
Penawar sengatan kalajengking
India Parrotta (2001) diacu dalam Patil & Patil (2011)
Mengobati infeksi mata Tamil-India, Ragupathy & Newmaster (2009), Immanuel & Elisabeth (2009)
Obat sakit kepala Tamil- India Ragupathy & Newmaster (2009), Immanuel & Elisabeth (2009)
Mengobati gangguan pencernaan
Tamil- India Immanuel & Elisabeth (2009)
Obat cacar Tamil- India Immanuel & Elisabeth (2009) Obat gatal Tamil- India Immanuel & Elisabeth (2009) Obat kutil Tamil- India Immanuel & Elisabeth (2009) Obat cacing Tamil- India Immanuel & Elisabeth (2009)
Obat sakit disentri Kuba Morton (1983) diacu dalam
Fantz (1991) Mengobati iritasi mata dan
menjernihkan mata
Betawi, Indonesia
Penelitian terhadap komposisi kimia kelopak bunga teleng menunjukkan bahwa
bunga ini kaya akan senyawa fitokimia yang memiliki efek positif bagi kesehatan. Penelitian secara klinis juga membuktikan bahwa kelopak bunga teleng memiliki manfaat yang luas bagi kesehatan manusia, sebagaimana tersaji pada Tabel 2.
Penelitian yang dilakukan oleh Umaet al.(2009) menunjukkan bahwa ekstrak air,
metanol dan kloroform dari kelopak bunga teleng mampu menghambat pertumbuhan beberapa jenis bakteri penghasil extended-spectrum beta-lactamase (ESBL), seperti
Eschericia coli, enterotoxigenic E. Coli (ETEC), enteropathogenic E. Coli (EPEC),
7
mengungkapkan potensi ekstrak bunga teleng untuk melawan infeksi yang disebabkan
[image:34.612.101.512.185.461.2]oleh bakteri yang resisten terhadap antibiotika seperti penisilin.
Tabel 2 Manfaat ekstrak bunga teleng bagi kesehatan menurut berbagai penelitian
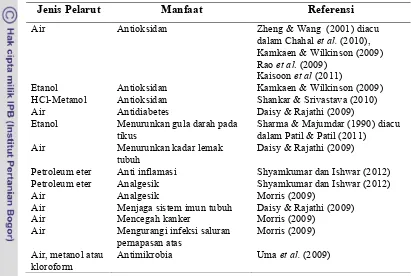
Jenis Pelarut Manfaat Referensi
Air Etanol HCl-Metanol Antioksidan Antioksidan Antioksidan
Zheng & Wang (2001) diacu dalam Chahalet al.(2010), Kamkaen & Wilkinson (2009) Raoet al. (2009)
Kaisoonet al(2011)
Kamkaen & Wilkinson (2009) Shankar & Srivastava (2010)
Air Antidiabetes Daisy & Rajathi (2009)
Etanol Menurunkan gula darah pada
tikus
Sharma & Majumdar (1990) diacu dalam Patil & Patil (2011)
Air Menurunkan kadar lemak
tubuh
Daisy & Rajathi (2009)
Petroleum eter Petroleum eter
Anti inflamasi Analgesik
Shyamkumar dan Ishwar (2012) Shyamkumar dan Ishwar (2012)
Air Analgesik Morris (2009)
Air Menjaga sistem imun tubuh Daisy & Rajathi (2009)
Air Air
Mencegah kanker
Mengurangi infeksi saluran pernapasan atas
Morris (2009) Morris (2009)
Air, metanol atau kloroform
Antimikrobia Umaet al.(2009)
Daisy et al. (2009) melaporkan bahwa ekstrak kelopak dan daun bunga teleng menunjukkan kemampuan untuk menurunkan gula darah, hemoglobin terglikolasi, total kolesterol, trigliserida, urea, kreatinin, dan aktivitas enzim glukosa-6-fosfatase pada tikus yang diamati selama 84 hari. Pada saat yang sama juga terlihat peran kelopak dan
daun bunga teleng untuk meningkatkan insulin darah, kolesterol HDL, protein, kandungan glikogen pada liver dan otot rangka serta aktivitas enzim glukokinase. Hasil ini menunjukkan potensi bunga teleng di dalam membantu penderita diabetes tipe I yang mengalami kerusakan kerja pankreas sehingga tidak dapat menghasilkan hormon
insulin.
8
Hal ini mengindikasikan peran kelopak bunga teleng sebagai immunomodulator pada
sistem imun tubuh.
C.
Senyawa Fitokimia Pada Bunga Teleng dan Perannya Bagi
Kesehatan
Fitokimia adalah semua senyawa alami pada tanaman yang memiliki efek fisiologis yang positif bagi manusia. Di antara fitokimia yang terpenting adalah senyawa-senyawa fenol, khususnya dari golongan flavonoid atau polifenol. Senyawa
flavonoid memiliki struktur kimia yang khas, yakni terdiri dari 15 atom karbon yang tersusun dalam kerangka C6-C3-C6. Berdasarkan perbedaan pada cincin furannya
flavonoid dibagi menjadi 5 kelompok, yaitu antosianin, flavanol, flavanon, flavon dan flavonol. Manfaat flavonoid bagi kesehatan telah sangat banyak diteliti. Salah satu yang
paling utama adalah kemampuan senyawa-senyawa flavonoid berperan sebagai antioksidan yang efektif dan penangkap radikal bebas (Andersen & Markham 2006).
Berbagai penelitian mengungkapkan bahwa di dalam kelopak bunga teleng dijumpai beragam senyawa flavonoid, yang menjadikan bunga teleng memiliki potensi
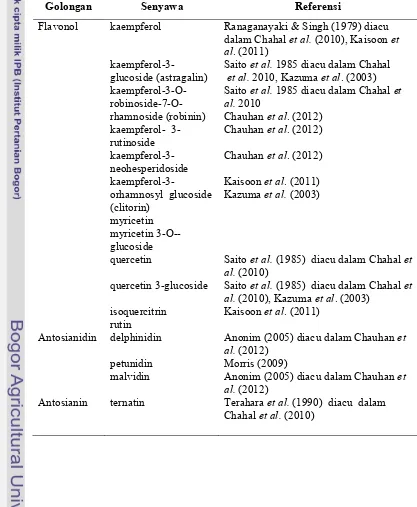
besar untuk berkontribusi di dalam pemeliharaan kesehatan manusia. Beberapa senyawa flavonoid penting yang telah berhasil diidentifikasi pada kelopak bunga teleng disajikan pada Tabel 3.
Penelitian selama 8 tahun menunjukkan bahwa senyawa kaempferol, myricetin
dan quercetin memiliki kemampuan mencegah kanker pankreas pada perokok (Nothlings et al. 2007). Sementara itu quercetin juga dilaporkan mampu mengurangi resiko terkena penyakit kardiovaskuler (Larsonet al. 2010), infeksi saluran pernapasan atas (Nieman et al. 2007 diacu dalam Morris 2009) dan menurunkan tekanan darah
pada penderita hipertensi (Edwards et al. 2007, Larson et al. 2010). Isoquercitrin, jika digunakan bersama senyawa flavonol lain, secara klinis terbukti mampu mengurangi sakit yang dialami oleh penderita penyakit pembuluh darah vena atau chronic
venntungous insufficiency(Schaeferet al.2003 diacu dalam Morris 2009).
Quercetin dan isoquercitrin merupakan substansi antiradang yang efektif dan
9
Delphinidin dilaporkan memiliki kemampuan untuk mencegah kanker payudara
[image:36.612.94.511.227.734.2](Singletary et al. diacu dalam Morris 2009). Menurut Srivastava et al. (2007) yang diacu dalam Morris (2009) delphinidin dan malvidin mungkin melawan kanker dengan cara mendorong terjadinya apoptosis.
Tabel 3 Senyawa-senyawa flavonoid pada kelopak bunga teleng
Golongan Senyawa Referensi
Flavonol kaempferol Ranaganayaki & Singh (1979) diacu dalam Chahalet al.(2010), Kaisoonet al. (2011)
kaempferol-3-glucoside (astragalin) kaempferol-3-O- robinoside-7-O-rhamnoside (robinin) kaempferol- 3-rutinoside kaempferol-3-neohesperidoside
kaempferol-3-orhamnosyl glucoside (clitorin)
myricetin myricetin 3-O--glucoside
Saitoet al.1985 diacu dalam Chahal et al.2010, Kazumaet al. (2003) Saitoet al.1985 diacu dalam Chahalet al.2010
Chauhanet al. (2012) Chauhanet al. (2012)
Chauhanet al. (2012)
Kaisoonet al. (2011) Kazumaet al.(2003)
quercetin
quercetin 3-glucoside
isoquercitrin rutin
Saitoet al.(1985) diacu dalam Chahalet al.(2010)
Saitoet al.(1985) diacu dalam Chahalet al.(2010), Kazumaet al. (2003)
Kaisoonet al. (2011)
Antosianidin delphinidin Anonim (2005) diacu dalam Chauhanet al.(2012)
petunidin Morris (2009)
malvidin Anonim (2005) diacu dalam Chauhanet al.(2012)
10
Delphinidin dan petunidin mampu mencegah pertumbuhan sel kanker
masing-masing sebesar 66% dan 53 % (Zhang et al. 2005 diacu dalam Morris 2009). Ternatin dilaporkan menunjukkan kemampuan menurunkan berat badan lemak pada tikus (Shimokawa et al. 2007 diacu dalam Morris 2009). Sementara itu, robinin dilaporkan merupakan senyawa antioksidan yang potensial (Lau et al. 2005 diacu dalam Morris 2009). Pada penelitian lain dilaporkan bahwa astragalin mampu menghambat radang
selular yang ditimbulkan oleh bakteri periodontal sehingga diperkirakan mampu mencegah periodontosis atau infeksi pada jaringan penyangga gigi (Kou et al. 2008 diacu dalam Morris 2009). Senyawa flavonoid lain, yaitu rutin, dilaporkan memberikan efek perlindungan terhadap radang lambung pada tikus percobaan dengan cara
menangkap spesies oksigen reaktif yang dihasilkan oleh kerusakan pada lambung (Hussainet al. 2009)
Selain senyawa-senyawa flavonoid, pada bunga teleng juga terdapat senyawa
-sitosterol yang dilaporkan mampu menginaktivasi virus HIV, influenza, herpes dan
poxvirus (Kotwal 2007 diacu dalam Morris 2009).
Dari sejumlah senyawa flavonoid yang terdapat pada bunga teleng, antosianin adalah yang paling utama. Antosianin adalah jenis flavonoid yang paling berlimpah terdapat pada buah dan sayur. Manfaatnya terhadap kesehatan manusia telah banyak
dilaporkan. Sejumlah peneliti melaporkan bahwa antosianin merupakan antioksidan yang kuat (Rein 2005), disebabkan oleh kemampuannya untuk menyumbang hidrogen kepada radikal dan membantu mengakhiri reaksi radikal berantai (Rice-Evans et al. 1996). Aktivitas antioksidan ini bergantung kepada jumlah dan susunan gugus hidroksil dan gula terkonjugasi (Wanget al. 2006 diacu dalam Trostet al.2009).
Antosianin juga dilaporkan memiliki kemampuan untuk mencegah kanker (Wang & Stoner 2008), memperlambat penuaan, menghambat penyakit neurologis, inflamasi, diabetes dan infeksi bakteri (Mazzaet al. 2002 diacu dalam Rhone & Basu 2008). Pada sejumlah penelitian disebutkan bahwa antosianin bunga teleng merupakan antioksidan
11
menghambat radikal DPPH sebesar 86 %. Sementara itu penelitian yang dilakukan oleh
Rao et al. (2009) menunjukkan bahwa ekstrak bunga teleng memiliki kemampuan antioksidasi yang lebih baik dibandingkan dengan ekstrak urang-aring (Eclipta
prostrataL.)
Pigmen antosianin bunga teleng yang diekstraksi dengan pelarut yang berbeda
memiliki aktivitas antioksidan yang berbeda. Hasil ekstraksi dengan air menunjukkan aktivitas antioksidan yang lebih tinggi dibandingkan dengan yang diekstraksi dengan etanol (Kamkaen & Wilkinson 2009).
D.
Antosianin Pada Bunga Teleng
Antosianin merupakan pigmen warna yang terdiri dari banyak jenis, dengan
rentang warna yang luas meliputi warna merah, ungu, biru, kuning dan tak berwarna. Secara umum antosianin terdiri dari dua gugus, yaitu gugus antosianidin dan gugus glikosida. Gugus glikosida pada antosianin dapat berupa glukosa, ramnosa, silosa, galaktosa, arabinosa dan fruktosa, baik dalam bentuk monoglikosida, diglikosida dan
terasilasi (Kahkonen & Heinonen 2003). Gugus glikosida tersebut umumnya terletak pada karbon ke 3 dan 5, sedangkan sebagian kecil pada karbon ke 7, 3 and 5 (Macheixet al.1990 diacu dalam Kahkonen & Heinonen 2003).
Sebagaimana halnya flavonoid yang lain, antosianidin tersusun oleh kerangka C6
-C3-C6seperti terlihat pada Gambar 2 (Nakajimaet al. 2004). Menurut Rein (2005)
Gambar 2 Struktur kimia antosianidin
O+
OH
OH
R OH R
O H
1
2
A
12
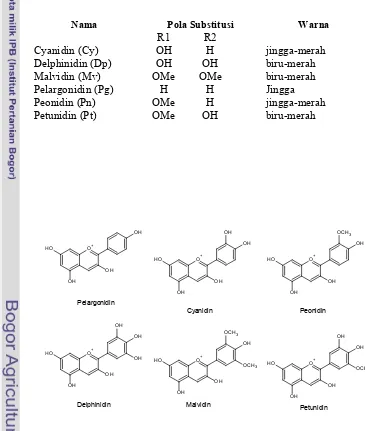
terdapat 22 jenis antosianidin yang terjadi secara alami dan enam di antaranya
[image:39.612.99.464.247.678.2]ditemukan dalam jumlah paling banyak (Tabel 4). Struktur kimia dari keenam jenis antosianidin tersebut dapat dilihat pada Gambar 3 (Rein 2005). Jenis antosianidin inilah yang menentukan warna dari antosianin. Semakin banyak gugus hidroksil pada antosianidin, warna akan semakin biru, sedangkan semakin banyak gugus metoksil, warna akan semakin merah (Nayak, 2011).
Tabel 4 Enam jenis antosianidin yang paling umum
Nama Pola Substitusi Warna
R1 R2
Cyanidin (Cy) OH H jingga-merah
Delphinidin (Dp) OH OH biru-merah
Malvidin (Mv) OMe OMe biru-merah
Pelargonidin (Pg) H H Jingga
Peonidin (Pn) OMe H jingga-merah
Petunidin (Pt) OMe OH biru-merah
Sumber: Nakajimaet al.(2004), Rein (2005)
Antosianidin amat jarang dijumpai di alam secara bebas. Umumnya senyawa ini berada dalam bentuk terglikosilasi sebagai antosianin (Rein 2005). Reaksi glikosilasi ini
membuat antosianin lebih mudah larut dan stabil di dalam air dibandingkan antosianidin (Rein 2005).
Gambar 3 Struktur kimia enam jenis antosianidin terpenting
13
Pada bunga teleng antosianin yang paling banyak ditemukan adalah ternatin,
[image:40.612.218.428.246.413.2]yang terdiri dari delphinidin sebagai antosianidin aglikon dan gugus glikosida yang terpoliasilasi. Terpoliasilasi artinya gugus glikosida memiliki dua atau lebih gugus asil aromatik.. Secara umum antosianin terpoliasetiliasi memiliki kestabilan yang lebih baik pada berbagai kondisi dan memiliki intensitas warna biru lebih tinggi dibandingkan dengan yang tidak terpoliasetilasi (Suzukiet al.2007).
Gambar 4 Struktur kimia dari Ternatin
Hingga saat ini sudah ada 15 jenis senyawa ternatin yang diidentifikasi pada ekstrak bunga teleng. Ternatin A1, A2, B1, B2, D1 dan D2 berhasil diisolasi oleh Terahara et al. (1990) yang diacu dalam Wongcharee et al. (2006). Struktur kimia
umum dari ternatin dapat dilihat pada Gambar 4 (Terahara et al. 1990 diacu dalam Wongcharee et al. 2006). Perbedaan antara jenis ternatin yang satu dengan yang lain ada pada gugus R (Tabel 5). Lima senyawa ternatin yang lain, yaitu ternatins A3, B4, B3, B2, and D2 berhasil diisolasi oleh Terahara et al. (1996). Selanjutnya identifikasi
14
Tabel 5 Gugus R pada struktur kimia berbagai jenis ternatin
Jenis Ternatin Gugus R
Ternatin A1 Ternatin A2 Ternatin B1 Ternatin B2 Ternatin D1 Ternatin D2
-CGCG or CGCG -CGCG or CG -CGCG or CGC -CGC or CG -CGC or CGC -CGC or -C Keterangan C = asam p-kumarat, G = Glukosa
Sumber : Teraharaet al. (1990) diacu dalam Wongchareeet al. (2006)
E.
Kestabilan Antosianin
Sebagaimana halnya dengan pewarna alami lain, antosianin bersifat tidak stabil terhadap berbagai faktor. Secara umum kestabilan antosianin dipengaruhi oleh struktur kimianya. Secara alami antosianin terdapat dalam empat bentuk, yaitu kation flavilium yang berwarna merah, basa kuinonoidal yang berwarna biru, hemiketal dan chalcone
yang tak berwarna. Bentuk kation flavilium adalah yang paling stabil. Beberapa faktor yang berpengaruh terhadap kestabilan antosianin adalah jenis antosiainidin, konsentrasi, pH, suhu, cahaya, keberadaan kopigmentasi, ion logam, enzim, asam askorbat dan oksigen (Rein 2005).
Kestabilan antosianin dapat ditingkatkan melalui kopigmentasi. Di dalam kopigmentasi molekul antosianin bereaksi dengan komponen alamiah lain pada tanaman secara langsung atau melalui interaksi yang lemah dan menghasilkan warna yang lebih kuat dan stabil (Darias-Martinet al.2002 diacu dalam Rein 2005).
1. Pengaruh jenis antosianidin, gugus glikosil dan gugus asil
Kestabilan antosianin dipengaruhi oleh jenis antosianidinnya. Secara umum antosianidin yang memiliki gugus hidroksil lebih banyak memiliki kestabilan yang lebih baik. Dengan demikian, delphinidin adalah yang paling stabil di antara jenis antosiandin yang lain. Akan tetapi, beberapa penelitian menunjukkan adanya pengecualian-pengecualian. Di antaranya di dalam larutan buffer pH 3.1 kestabilan
cyanidin-3-glucoside yang memiliki 5 gugus hidroksil lebih baik dibandingkan delphinidin
15
yang memiliki 4 gugus hidroksil menunjukkan kestabilan lebih baik dibandingkan
dengan petunidin-3-glucoside yang memiliki 5 gugus hidroksil (Cabrita et al. 2000 diacu dalam Rein 2005). Kehadiran gugus metoksil dilaporkan menurunkan kestabilan antosianin.Petunidin-3-glucosideyang memiliki gugus metoksil pada atom C-5 (gugus R2 pada Gambar 2) memiliki kestabilan lebih rendah dibandingkan
cyanidin-3-glucoside yang memiliki gugus hidrogen, begitu juga halnya dengan
peonidin-3-glucoside yang lebih stabil dibandingkan malvidin-3-glucoside (Cabrita et al. 2000 diacu dalam Rein 2005). Kembali, terdapat pengecualian juga pada pola ini. Dilaporkan bahwa malvidin lebih stabil dibandingkan pelargonidin (Mulinacci et al. 2001 diacu dalam Rein 2005) sedangkan peonidin-3-glucoside lebih stabil dibandingkan
pelargonidin-3-glucoside(Cabritaet al. 2000 diacu dalam Rein 2005).
Keberadaan gugus glikosil meningkatkan kestabilan antosianin. Jadi, antosianin lebih stabil dibandingkan dengan bentuk aglikonnya yaitu antosianidin. Stabilitas warna cyanidin lebih baik dibandingkan dengan malvidin, tetapi lebih rendah dibandingkan
dengan malvidin-3-glukosida (Mazza dan Brouillard 1987 diacu dalam Rein 2005). Jenis gugus glikosil juga memberikan pengaruh terhadap kestabilan antosianin. Antosianin buahcranberry yang memiliki gugus glikosil galaktosa bersifat lebih stabil dibandingkan dengan yang memiliki gugus glikosil arabinosa (Starr & Francis 1968
diacu dalam Rein 2005). Antosianin yang memiliki gugus disakarida bersifat lebih stabil daripada yang memiliki gugus monosakarida (Broennum-Hansen & Flink 1985 diacu dalam Rein 2005).
Gugus asil juga meningkatkan kestabilan antosianin. Antosianin bunga
Tradescantia pallida, bersifat lebih stabil dibandingkan antosianin anggur concorddan kol ungu, diperkirakan karena pola asilasi yang beragam (Baublis et al. 1994 diacu dalam Rein 2005). Antosianin terpoliasilasi lebih stabil dibandingkan dengan yang termonoasilasi, baik pada pH asam maupun alkali (Asen 1976 diacu dalam Rein 2005).
Ekstrak lobak merah yang mengandung antosianin terdiasilasi dilaporkan bersifat lebih stabil dibandingkan dengan ekstrak kentang kulit merah yang mengandung antosianin termonoasilasi (Rodriguez-Saona et al. 1999 diacu dalam Rein 2005). Antosianin dengan gugus asil-aromatik bersifat lebih stabil dibandingkan dengan yang memiliki
16
metoksilasi pada gugus asil mampu meningkatkan kestabilan antosianin terhadap
paparan panas (Sadilovaet al.2006 diacu dalam Nayak 2011).
Mekanisme gugus asil di dalam menstabilkan antosianin diperkirakan karena gugus ini menghambat terjadinya reaksi hidrasi pada antosianin (Patraset al. 2010 diacu dalam Nayak 2011).
2. Pengaruh pH
Pada pH rendah, struktur antosianin didominasi oleh bentuk kation flavilium. Sejalan dengan kenaikan pH terjadi perubahan menjadi basa kuinonoidal. Sementara itu reaksi dengan air akan mengubah kation flavilium menjadi hemiketal dan chalcone. Pada pH kurang dari 3, yakni ketika bentuk dominan antosianin adalah kation flavilium, pigmen ini bersifat lebih stabil terhadap kerusakan akibat oksidasi (Francis
1989 diacu dalam He, 2008).
Pengaruh pH terhadap kestabilan antosianin juga dipengaruhi oleh jenis antosianin. Penelitian Fossen et al. (1998) terhadap petunin dan cyanidin-3-glucoside menunjukkan karakteristik yang berbeda di antara kedua jenis antosianin ini. Kestabilan
cyanidin-3-glucoside menurun sejalan dengan kenaikan pH, dan mencapai kestabilan paling rendah pada pH 6 atau lebih besar. Petunin menunjukkan pola yang serupa hingga pH 6, akan tetapi kestabilannya meningkat mencapai maksimal pada pH 8.1.
Penelitian terhadap ekstrak bunga teleng dengan ternatin sebagai jenis antosianin
yang paling dominan menunjukkan hasil berbeda. Chaovanalikit et al. (2009) melaporkan bahwa kestabilan warna ekstrak bunga teleng pH 2-10 yang dipanaskan pada suhu 80 dan 90oC selama 2 jam hanya menurun secara signifikan pada ekstrak pH 8.
3. Pengaruh suhu
Suhu adalah salah satu faktor utama penyebab kerusakan antosianin. Kecepatan
17
Paparan suhu yang lebih tinggi menyebabkan kehilangan antosianin yang lebih
banyak (Tantituvanontet al.2008). Lee et al.(2011) melaporkan bahwa ekstrak bunga teleng yang disimpan pada suhu 5, 27, 37 dan 45oC mengalami penurunan warna biru secara signifikan. Meski demikian laju penurunannya tidak mengikuti kinetika reaksi orde 1. Penyimpanan pada suhu 5oC adalah yang paling stabil. Setelah 30 hari, intensitas warna biru pada ekstrak bunga teleng masih tersisa 85 %. Lee et al. (2011)
juga mempelajari pengaruh suhu yang lebih tinggi terhadap kestabilan antosianin pada ekstrak bunga teleng. Baik suhu 70, 100 dan 160 sama-sama menyebabkan penurunan intensitas warna biru dengan mengikuti kinetika reaksi orde 1. Penurunan paling parah terjadi pada suhu 160 C. Setelah pemanasan 20 menit, intensitas warna telah hilang
hingga 100 %.
Penelitian yang dilakukan oleh Tantituvanont et al. (2008) menunjukkan bahwa ekstrak bunga teleng yang disimpan pada suhu 4oC lebih stabil dibandingkan yang disimpan pada suhu kamar dan 40oC. Ketidakstabilan warna semakin besar jika ekstrak disimpan pada pH 7 (netral).
Mekanisme kerusakan antosianin akibat panas mungkin melewati beberapa cara, di antaranya melalui hidrolisis atau melalui perubahan terhadap kation flavilium. Kenaikan suhu pada pH 2-4 menyebabkan lepasnya gugus glikosil dari antosianin
melalui hidrolisis ikatan glikosidik, sehingga antosianin berubah menjadi bentuk aglikonnya yang bersifat tidak stabil (Adams 1973 diacu dalam Rein, 2005). Sementara itu Francis (1989) diacu dalam He (2008) mengajukan hipotesis bahwa suhu yang lebih tinggi akan menyebabkan perubahan kation flavilium yang stabil menjadi chalcone
yang tidak stabil, kemudian terbukanya cincin C padachalconeakan menjadi jalan bagi proses degradasi lebih lanjut yang menghasilkan substansi berwarna coklat.
Sejumlah peneliti merekomendasikan penyimpanan pada suhu rendah untuk meningkatkan kestabilan antosianin. Tantituvanont et al. (2008) menyarankan
penyimpanan ekstrak bunga teleng pada suhu 4oC.
4. Pengaruh oksigen dan oksidator
18
akan semakin parah. Kehadiran oksigen secara bersama-sama dengan suhu yang
meningkat merupakan faktor penyebab paling utama dari kerusakan antosianin (Nebesky et al. 1949 diacu dalam Rein 2005). Akan tetapi pada penelitian lain dilaporkan bahwa keberadaan oksigen pada periode awal penyimpanan dingin dapat meningkatkan kandungan total fenol dan antosianin, sementara pada penyimpanan yang lebih lama menyebabkan penurunan keduanya (Zheng et al.2007 diacu dalam Byrnes
2011).
Sama halnya dengan oksigen, bahan pengoksidasi yang lain seperti peroksida dan Vitamin C dapat merusak antosianin. Iversen (1999) melaporkan bahwa keberadaan asam askorbat mempercepat terjadinya degradasi antosianin. Menurut Jurd 1972 (diacu
dalam Byrnes 2011), mekanisme degradasi antosianin oleh asam askorbat adalah melalui kondensasi langsung dari asam askorbat pada posisi C4. Penggabungan ini mengakibatkan antosianin dan asam askorbat mengalami kehilangan warna. Mekanisme lain dari degradasi ini diusulkan oleh Iacobucci & Sweeny (1983) diacu dalam Byrnes
(2011), yang menyebutkan bahwa asam askorbat berperan sebagai aktivator oksigen dan menghasilkan radikal bebas yang akan bereaksi dengan antosianin sehingga antosianin menjadi kehilangan warna.
5. Pengaruh cahaya
Cahaya memiliki peran yang unik di dalam memberikan pengaruh terhadap
eksistensi antosianin. Cahaya merupakan faktor yang esensial di dalam biosintesis antosianin, tetapi juga merupakan faktor yang mempercepat degradasi pigmen ini (Markakis 1982 diacu dalam Rein 2005). Menurut Lee et al. (2011) cahaya menyebabkan warna ekstrak bunga teleng semakin tidak stabil. Tantituvanont et al.
(2008) melaporkan bawah warna antosianin lebih stabil dalam kondisi gelap dan paparan cahaya ultraviolet yang terbatas.
6. Pengaruh aktivitas air
Penurunan aktivitas air (Aw) dapat meningkatkan kestabilan antosianin. Pigmen antosianin dalam bentuk kering menunjukkan kestabilan yang baik. Selain itu kehilangan warna dapat juga diminimalisasikan melalui penyimpanan pada suhu rendah,
19
7. Pengaruh faktor lain
Pengaruh bahan pengapsul terhadap kestabilan tepung ekstrak bunga teleng dipelajari oleh Tantituvanont et al. (2008). Penelitian ini menunjukkan bahwa gelatin
mampu memproteksi antosianin pada ekstrak terhadap sinar UV, sedangkan
Hydroxylpropylmethyl Cellulose (HPMC) tidak. Baik gelatin maupun HPMC tidak menunjukkan proteksi yang signifikan terhadap degradasi warna akibat panas.
Pengaruh bahan pengawet terhadap kestabilan antosianin telah pula dipelajari.
Penambahan Asam benzoat 0.02 % mampu meningkatkan kestabilan ekstrak bunga teleng selama penyimpanan (Leeet al.2011).
F.
Ekstraksi Antosianin
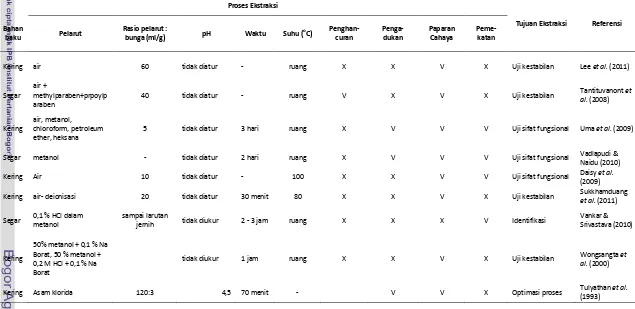
Berbagai teknik ekstraksi antosianin pada bunga teleng telah banyak dilaporkan. Ekstraksi antosianin tersebut ditujukan untuk penelitian lebih lanjut terhadap sifat
fungsional antosianin bunga teleng, ataupun penelitian terhadap kestabilan antosianin selama penyimpanan. Tidak banyak penelitian yang melaporkan proses ekstraksi untuk tujuan mengoptimalkan jumlah ekstrak dan kandungan antosianin yang diperoleh. Umumnya ekstraksi tersebut dilakukan dengan menggunakan pelarut air. Hal ini
disebabkan oleh sifat antosianin bunga teleng yang larut dalam air dengan sangat baik. Rangkuman cara ekstraksi antosianin pada bunga teleng disajikan pada Tabel 6.
Tahapan blansir atau blansir pada proses pengolahan buah dan sayur dilakukan untuk berbagai tujuan, di antaranya untuk inaktivasi enzim dan perusakan dinding sel buah dan sayur sehingga mempermudah keluarnya bahan aktif dari matriks jaringan.
Terdapat dua metode blansir yang umum dilakukan yaitu blansir air panas dan blansir uap air.
Pengaruh perlakuan blansir sebelum proses ekstraksi pigmen antosianin pada berbagai sumber tanaman telah banyak dipelajari. Rossiet al.(2003) melaporkan bahwa
perlakuan blansir uap dapat meningkatkan jumlah antosianin pada ekstrak buah
20
Tabel 6 Berbagai macam proses ekstraksi antosianin bunga teleng
Proses Ekstraksi
Tujuan Ekstraksi Referensi Bahan
baku Pelarut
Rasio pelarut :
bunga (ml/g) pH Waktu Suhu (
oC)
Penghan-curan Penga-dukan Paparan Cahaya Peme-katan
Kering air 60 tidak diatur - ruang X X V X Uji kestabilan Leeet al.(2011)
Segar air +
methylparaben+prpoylp araben
40 tidak diatur - ruang V X V X Uji kestabilan Tantituvanontet
al.(2008)
Kering
air, metanol, chloroform, petroleum ether, heksana
5 tidak diatur 3 hari ruang X V V V Uji sifat fungsional Umaet al.(2009)
Segar metanol - tidak diatur 2 hari ruang X V V V Uji sifat fungsional Vadlapudi & Naidu (2010) Kering Air 10 tidak diatur - 100 X X V V Uji sifat fungsional Daisyet al.
(2009) Kering air- deionisasi 20 tidak diatur 30 menit 80 X X V X Uji kestabilan Sukkhamduang
et al.(2011)
Segar 0,1 % HCl dalam metanol
sampai larutan
jernih tidak diukur 2 - 3 jam ruang X X X V Identifikasi
Vankar & Srivastava (2010)
Kering
50% metanol + 0,1 % Na Borat, 50 % metanol + 0,2 M HCl + 0,1 % Na Borat
tidak diukur 1 jam ruang X X V X Uji kestabilan Wongsangtaet
al.(2000)
21
hingga 52-58 %. Heras-Ramirez et al. (2011) melaporkan bahwa perlakuan blansir
secara signifikan dapat meningkatkan jumlah antosianin yang diekstrak dari kulit apel.
G.
Metode Permukaan Tanggap (
Response Surface Methodology
)
Metode permukaan tanggap adalah kumpulan teknik statistika dan matematika yang digunakan untuk memodelkan respons yang dipengaruhi oleh 2 atau lebih faktor (variabel bebas) dengan tujuan mengoptimalkan respons yang dimaksud. Kebanyakan
rancangan percobaan empiris mengasumsikan bahwa faktor-faktor hanya memberikanefek terhadap respons secara individual, dan tidak ada interaksi antara faktor-faktor tersebut. Metode permukaan tanggap mampu mengevaluasi adanya interaksi di antara faktor. Metode permukaan tanggap telah digunakan secara luas
dibidang kimia, biologi dan pertanian terapan untuk memrediksikan kondisi optimum dari suatu sistem (Liyana-Pathirana & Shahidi 2005 diacu dalam Huanget al.2010).
Jika terdapat hubungan linear antara variabel bebas dengan respons, maka model ordo 1 dapat digunakan mengikuti persamaan sebagai berikut.
= o + iXi +
Dengan Y adalah respons, X adalah variabel bebas, o adalah intersep dan i
adalah koefisien linier danadalah galat.
Jika hubungan antara variabel bebas dan respons berbentuk kurva, maka model ordo 2 merupakan model yang sesuai dengan persamaan sebagai berikut.
= o + iXi + iiX i + ijXi Xj +
Dengan Y adalah respons, Xi dan Xj adalah variabel bebas,o adalah intersep dan
i adalah koefisien linier, ii adalah koefisien kuadrat danadalah galat.
Metode disain yang sering digunakan pada Metode permukaan tanggap adalah
22
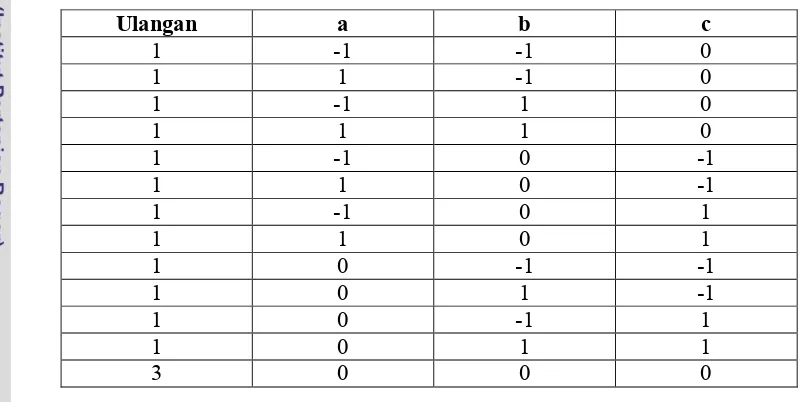
Dibandingkan dengan CCD, rancangan Box-Behnken lebih efisien dengan melibatkan lebih sedikit unit percobaan. Pada prinsipnya rancangan Box-Behnken merupakan kombinasi dari rancangan faktorial 2 taraf dengan rancangan blok tak lengkap dengan menambahkan center run pada rancangannya. Misalkan hendak
[image:49.612.113.513.303.504.2]dipelajari 3 faktor a, b dan c terhadap suatu respons, dan -1 mewakili taraf minimal dan 1 mewakili taraf maksimal dari setiap faktor, maka rancangan percobaan Box-Behnken akan tampak seperti pada Tabel 7.
Tabel 7 Rancangan percobaan Box-Behnken untuk 3 faktor
Ulangan a b c
1 -1 -1 0
1 1 -1 0
1 -1 1 0
1 1 1 0
1 -1 0 -1
1 1 0 -1
1 -1 0 1
1 1 0 1
1 0 -1 -1
1 0 1 -1
1 0 -1 1
1 0 1 1
3 0 0 0
III. BAHAN DAN METODOLOGI
A. Bahan dan Alat
1. Bunga teleng
Bunga teleng diperoleh dari tanaman bunga teleng di pekarangan di Kantor Rumah Sains Ilma, Jalan TPU Parakan No. 148 Pamulang Tangerang Selatan. Tanaman ini mulai ditanam pada tanggal 10 Maret 2011 pada lahan seluas 4 m2.
2. Bahan kimia yang digunakan dalam penelitian ini: a. HCl pekat (Brataco, Indonesia)
b. 1-diphenyl-2-picrylhydrazyl (Merck, Germany) c. Metanol 96% (Brataco, Indonesia)
d. Akuades
e. Folin-Ciocalteau phenol reagent (Merck, Germany) f. Asam galat (Merck, Germany)
g. Kalium klorida (Merck, Germany)
h. Natrium asetat (Brataco, Indonesia) i. Natrium karbonat (AnalaR BDH, England) 3. Alat yang digunakan di dalam penelitian
a. Peralatan kaca laboratorium
b. UV-Vis Spectrophotometer (Genesys 10uv Thermo Electron Corporation, USA)
c. Moisture Analyzer Sartorius MA-35 d. Water-bath shaker
24
B. Metode Penelitian
Penelitian ini terbagi menjadi dua tahap, yaitu optimasi proses ekstraksi antosianin
bunga teleng dan karakterisasi sifat antosianin bunga teleng hasil optimasi.
1. Optimasi proses ekstraksi antosianin bunga teleng
Untuk mendapatkan hasil panen per satuan luas berat hasil panen dibagi dengan luas lahan. Sebanyak 20 helai kelopak bunga diambil dan ditimbang beratnya satu ber satu. Rata-rata dan simpangan baku dari berat kelopak bunga dihitung.
Setiap habis dipanen dilakukan pemisahan pangkal. Berat kelopak tanpa pangkal dihitung satu per satu untuk mengetahui sebaran berat kelopak tanpa pangkal. Rendemen dihitung dengan cara membagi berat kelopak tanpa pangkal dengan berat awal dikali 100 %. Kadar air kelopak bunga tanpa pangkal diukur.
Sebanyak 10 gram kelopak bunga teleng tanpa pangkal dimasukkan ke plastik HDPE ukuran 250 mg. Plastik dikelim dengan menggunakan panas. Kelopak bunga diblansir dengan uap air suhu 100oC selama 0 12 menit. Sesudah itu bunga teleng didinginkan dengan cara direndam di dalam penangas es batu.
Bunga dikeluarkan dari kantong plastik dan dimasukkan ke labu Erlenmeyer 250
ml yang dibungkusaluminium foil. Sisa bunga dibilas dengan 40 ml pelarut (air-HCl pH 4,5 dengan suhu yang sama dengan suhu ekstraksi, yaitu 30-60oC). Ekstraksi dilakukan padawater bath shaker dengan suhu 30 60oC, selama 30 120 menit.
Hasil ekstraksi disaring dengan menggunakan kertas saring whatman 40 (8 M), dan ditampung di dalam erlenmeyer yang dibungkus aluminium foil. Sisa padatan
diperas secara manual. Cairan yang terpisah dicampurkan dengan hasil penyaringan sebelumnya. Terhadap filtrat yang diperoleh dilakukan pengukuran volum, kadar antosianin dan total fenol. Diagram alir optimasi proses ekstraksi disajikan pada Gambar 5.
2. Karakterisasi sifat antosianin bunga teleng hasil optimasi
25
maksimal ekstrak bunga teleng pada pH 1 hingga 14, aktivitas antioksidan pada
berbagai struktur antosianin dan kestabilan ekstrak bunga teleng pH 1 hingga 14 pada penyimpanan suhu ruang dan suhu 4oC
Gambar 5 Diagram alir optimasi proses ekstraksi antosianin bunga teleng
.
Aktivitas antioksidan yang dipelajari adalah aktivitas antioksidan ekstrak bunga
teleng pada pH 1 yang mewakili struktur antosianin sebagai kation flavilium, pH 4,5 sebagai hemiketal atau pseudobasedan pH 7 sebagai basa kuinonoidal. Ekstrak bunga teleng dengna pH 1, 4,5 dan 7 dibuat dengan cara melarutkan 0,1 ml ekstrak dengan 0,9
Pemisahan Pangkal Bunga
teleng
Bunga tanpa pangkal
Blansir
Pendinginan
Ekstraksi
Penyaringan
Ekstrak bunga teleng
uap air 100oC
t : 0 12 menit
pH 4,5, pelarut 4 ml/g bunga, gelap, pengadukan
T : 30-60oC
26
ml larutanbuffer. Untuk pH 1 digunakan larutanbufferKCl 0,02 M (sama dengan yang
digunakan untuk analisis antosianin monomerik). Untuk pH 4,5 digunakan larutan
buffer CH3COONa 0,4 M (sama dengan yang digunakan untuk analisis antosianin monomerik). Untuk pH 7 digunakan larutan buffer Merck yang terbuat dari kalium dihidrogen fosfat/dinatrium hidrogen fosfat.
Kestabilan warna ekstrak bunga teleng pada pH 1 hingga 14 dipelajari dengan
mengukur absorbansi maksimum pada masing-masing pH setiap 7 hari selama 28 hari. Larutan pH 1 hingga 14 dibuat dengan melarutkan HCl atau NaOH dalam akuades sehingga mencapai nilai pH yang diinginkan, yang diukur dengan pH meter. Sebanyak 10 ml sampel dicampurkan dengan 90 ml larutan pH 1 hingga 14, kemudian disimpan di
dalam botol vial coklat pada suhu ruang dan suhu 4oC (refrigerator). Untuk mendapatkan panjang gelombang absorbansi maksimal dari masing-masing ekstrak pH 1 hingga 14, sampel dipindai dengan spektrofotometer pada panjang gelombang 400 nm hingga 700 nm. Setiap 7 hari absorbansi setiap sampel diuji pada panjang gelombang
maksimalnya. Stabilitas warna dihitung dalam persen yang diperoleh dengan cara membagi absorbansi pada hari ke n dengan absorbansi pada hari ke 0.
C. Rancangan Percobaan
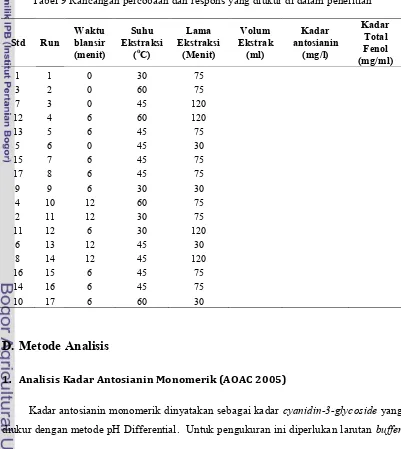
1. Optimasi proses ekstraksi antosianin bunga teleng
Rancangan percobaan yang digunakan pada penelitian ini adalah rancangan Box-Behnken dengan metode permukaan tanggap (response surface methodology). Faktor yang dipelajari dan masing-masing tarafnya disajikan pada Tabel 8.
Tabel 8 Faktor dan taraf yang dipelajari di dalam penelitian
Faktor Satuan
Batas bawah (-1)
Batas atas (1)
Waktu Blansir Menit 0 12
Suhu Ekstraksi oC 30 60
Lama Ekstraksi Menit 30 120
27
percobaan pada center point (0,0,0). Pada penelitian ini digunakan 5 center point,
sehingga jumlah variasi percobaan menjadi 17 (Tabel 9).
2. Karakterisasi sifat antosianin bunga teleng
Aktivitas antioksidan ekstrak bunga teleng pada pH 1, 4,5 dan 7 masing-masing diuji sebanyak 3 kali (triplo). Pengukuran serapan maksimal ekstrak bunga teleng pada
[image:54.612.104.505.264.713.2]pH 1 hingga 14 selama penyimpanan dilakukan sebanyak dua kali ulangan (duplo).
Tabel 9 Rancangan percobaan dan respons yang diukur di dalam penelitian
Std Run Waktu blansir (menit) Suhu Ekstraksi
(oC)
Lama Ekstraksi (Menit) Volum Ekstrak (ml) Kadar antosianin (mg/l) Kadar Total Fenol (mg/ml)
1 1 0 30 75
3 2 0 60 75
7 3 0 45 120
12 4 6 60 120
13 5 6 45 75
5 6 0 45 30
15 7 6 45 75
17 8 6 45 75
9 9 6 30 30
4 10 12 60 75
2 11 12 30 75
11 12 6 30 120
6 13 12 45 30
8 14 12 45 120
16 15 6 45 75
14 16 6 45 75
10 17 6 60 30
D. Metode Analisis
1. Analisis Kadar Antosianin Monomerik (AOAC 2005)
Kadar antosianin monomerik dinyatakan sebagai kadarcyanidin-3-glycosideyang
28
pH 1 dan 4,5. Larutan buffer pH 1dibuat dengan melarutkan 1,864 g kalium klorida
(KCl) dalam 960 ml akuades. Larutan kemudian diukur dengan pH-meter dan pH diatur sehingga mencapai nilai 1 dengan menambahkan asam klorida (HCl) pekat. Larutan ini kemudian dipindahkan ke labu ukur 1 liter dan ditambahkan dengan akuades sampai total volum mencapai 1 liter, sehingga diperoleh larutanbufferKCl 0,025 M pH 1.
Larutan buffer pH 4,5 dibuat dengan cara melarutkan 32,814 g natrium asetat (CH3COONa) dalam 960 ml akuades. Larutan kemudian diukur dengan pH-meter dan
pH diatur sehingga mencapai 4,5 dengan menambahkan HCl pekat. Larutan kemudian
dipindahkan ke labu ukur 1 liter dan ditambahkan dengan akuades sampai total volum sama dengan 1 liter, sehingga diperoleh larutanbufferCH3COONa 0,4 M pH 4,5.
Sebanyak masing-masing 0,2 ml ekstrak diencerkan dengan 1,8 ml larutanbuffer pH 1,0 dan larutan buffer 4,5. Absorbansi kedua sampel ini kemudian diukur pada
panjang gelombang 510 nm dan 700 nm. Selisih absorbansi dihitung dengan rumus sebagai berikut :
A = (A510 A700)pH 1,0 (A510 A700)pH 4,5
Kadar antosianin monomerik (cyanidin-3-glucoside equivalents dalam mg/L) diperoleh dengan rumus sebagai berikut :
(A × MW × DF × 1000)/( × l)
MW adalah berat molekul cyanidin-3-glucoside (449,2 g/mol), DF adalah faktor
pengenceran, adalah absorptivitas molar daricyanidin-3-glucosideyang nilainya sama dengan 26 900, dan l adalah lebar kuvet (1 cm).
2. Analisis Total Fenol (Singleton & Rossi 1965 diacu dalam Kaltet al.2000)
Penentuan kandungan total fenol dilakukan dengan metode Folin-Ciocalteau dengan asam galat sebagai standar. Sebanyak 0,2 ml sampel direaksikan dengan 0,8 ml larutan Natrium karbonat 20 % dan 1 ml larutan Folin-Ciocalteau. Sampel didiamkan
Folin-29
Ciocalteau. Kandungan total fenol dihitung sebagai Ekuivalen Asam Galat (EAG)
dengan persamaan sebagai berikut :
Total kandungan fenol (mg/l EAG) = Abs/m + C
Abs adalah Absorbance (A), m adalah kemiringan kurva standar asam galat dan C adalah konstanta (intersep).
3. Aktivitas antioksidan - DPPHradical-scavenging activity(Sanchez-Moreno 2002 diacu dalam Vankar & Srivastava 2010)
Larutan kontrol dibuat dengan cara melarutkan 1,5 ml larutan DPPH dalam metanol dengan konsentrasi 0,001396 M dengan 0,5 ml metanol. Absorbansinya diukur pada panjang gelombang 517 nm. Sebanyak 0,1 ml ekstrak bunga teleng diencerkan dengan masing-masing 0,9 ml larutanbufferpH 1, pH 4,5 dan pH 7. Kemudian
masing-masing sampel diambil sebanyak 0,1 ml dan ditambahkan dengan 1,5 ml larutan DPPH dan 0,4 ml metanol. Absorbansinya diukur pada panjang gelombang 517 nm. Aktivitas
antioksidan dalam satuan Mol DPPH/100 ml ekstrak diperoleh dengan rumus sebagai
berikut :
(Akontrol Asampel)/AkontrolX mol DPPH X 106X DF
Dengan DF adalah faktor pengenceran, Akontrol adalah absorbansi larutan kontrol
dan Asampeladalah absorbansi larutan sampel
4. Analisis Permukaan Tanggap
Untuk mempelajari pengaruh dari masing-masing faktor dalam bentuk permukaan respons (permukaan tanggap) data diolah dengan menggunakan software
Design-Expert® Versi 8.0.7.1.
Pada prinsipnya uji statistika yang dilakukan berdasarkan kepada analisis sidik
ragam atau ANOVA. Taraf signifikan yang dipilih adalah 5 % ( = 0,05). Software
akan menghitung nilai p (p-value) dari masing-masing faktor dan interaksi antar faktor.
Jika nilainya lebih kecil daripada , maka pengaruh dari faktor tersebut adalah
30
Pada rancangan Box-Behnken interaksi antar faktor yang dapat disertakan di dalam
persamaan hanya terbatas sampai interaksi antara 2 faktor.
Berdasarkan model yang diusulkan untuk masing-masing respons software melakukan analisis untuk mendapatkan proses optimal sesuai dengan kriteria yang dibuat. Pada penelitian ini kriteria proses optimal adalah yang mampu menghasilkan ekstrak dengan kadar antosianin, total fenol dan volum yang maksimal. Urutan tingkat
kepentingan (importance) yang perlu dipenuhi oleh proses yang optimal adalah kadar antosianin, total fenol dan volum.
Untuk menguji kesahihan dari model persamaan yang diusulkan, dilakukan verifikasi. Verifikasi dilakukan dengan cara melakukan 5 ulangan proses ekstraksi
IV. HASIL DAN PEMBAHASAN
A. Optimasi Proses Ekstraksi dan Verifikasi Proses Optimal
Berat rata-rata kelopak bunga teleng yang dipanen adalah sekitar 0,36 gram, kemudian berkurang menjadi sekitar 0,22 gram atau 59,51 % dari berat awal setelah pangkalnya dipisahkan. Data hasil pemanenan bunga teleng dapat dilihat pada Lampiran 1.
Kelopak bunga teleng tanpa pangkal diekstraksi dalam keadaan segar. Tujuan dari proses ekstraksi adalah mengambil satu atau lebih bahan aktif dari matriks alamiahnya dengan menggunakan pelarut tertentu. Semakin besar konsentrasi bahan aktif yang berada dalam pelarut maka semakin baik proses ekstraksi yang dilakukan. Di dalam
penelitian ini proses ekstraksi berjalan optimal jika volum ekstrak, kandungan antosianin dan total fenol di dalam ekstrak mencapai maksimal. Kandungan antosianin diukur sebagai monomerik antosianin, sedangkan total fenol dinyatakan dalam bentuk ekuivalen asam galat. Untuk menghitung total fenol ini kurva baku asam galat perlu
terlebih dahulu ditetapkan (Lampiran 2). Analisis antosianin monomerik dan analisis total fenol berprinsipkan kepada pembacaan serapan cahaya atau absorbansi pada panjang gelombang tertentu dengan menggunakan spektrofotometer. Data absorbansi untuk penghitungan kadar antosianin dan total fenol dapat dilihat pada Lampiran 3.
Data hasil penelitian dapat dilihat pada Tabel 10. Terhadap data tersebut
kemudian dilakukan Anayisis of Variance (ANOVA) atau sidik ragam untuk menemukan model persamaan yang sesuai yang menghubungkan volum ekstrak, kadar antosianin dan total fenol dengan lama blansir, suhu ekstraksi dan lama ekstraksi. Hasil analisis menunjukkan bahwa volum ekstrak dipengaruhi oleh ketiga faktor yang
dipelajari dengan mengikuti model interaksi 2 faktor yang direduksi, sedangkan kadar antosianin dan total fenol mengikuti model kuadratik yang direduksi (Tabel 11). Uraian lebih lengkap dari uji statistika ini dapat dilihat pada Lampiran 4. Selain dalam bentuk persamaan matematika, hubungan masing-masing respons dengan faktor dapat pula
32
permukaan kontur maupun permukaan tanggap diberi warna yang berbeda, mulai dari
[image:59.612.103.509.202.493.2]biru hingga merah. Nilai maksimum yang dapat diperoleh untuk suatu respons direpresentasikan oleh wilayah yang berwarna merah.
Tabel 10 Data hasil penelitian ekstraksi bunga teleng
Std Run Lama Blansir (menit) Suhu Ekstraksi
(oC)
Lama Ekstraksi (menit) Volum Ekstrak (ml) Kadar Antosianin (mg/l) Kadar Total fenol (mg/ml)
1 1 0 30 75 33,6 14,28 0,57
3 2 0 60 75 39,9 36,40 1,10
7 3 0 45 120 38,3 30,73 0,97
12 4 6 60 120 39,6 25,05 1,21
13 5 6 45 75 39,8 34,65 0,98
5 6 0 45 30 33,8 18,70 0,64
15 7 6 45 75 36,4 37,57 1,02
17 8 6 45 75 36,8 36,15 0,96
9 9 6 30 30 37,8 25,13 0,80
4 10 12 60 75 38,6 28,14 0,90
2 11 12 30 75 39 33,15 0,81
11 12 6 30 120 39 38,13 0,83
6 13 12 45 30 37,3 36,13 0,97
8 14 12 45 120 36,4 37,91 1,05
16 15 6 45 75 37,3 40,41 1,03
14 16 6 45 75 38,6 32,90 1,14
10 17 6 60 30 36,8 34,90 1,10
Tabel 11 Model dan model persamaan yang menghubungkan antara respons dengan semua faktor yang dipelajari
Respons Model p-Value Lack of
Fit Model persamaan
Volum Ekstrak
Interaksi 2 faktor direduksi
0,0426 0,5266 Y1= 37,59 + 0,71A + 0,69B + 0,95C 1,68AB
-1,35AC
Antosianin Kuadratik
direduksi 0,0135 0,1567
Y2= 35,78 + 4,40A + 1,73B + 2,12C 6,78AB
-2,56AC - 5,71BC - 4,21A2- 4,27B2 Total
Fenol
Kuadratik
direduksi 0,0018 0,3444
Y3= 1,01 + 0,057A + 0,16B + 0,067C 0,11AB
-0,063AC + 0,022BC - 0,13A2
A = lama blansir, B = suhu ekstraksi, C= lama ekstraksi, Y1= volum ekstrak, Y2= antosianin, Y3= total
fenol)
33
1. Volum Ekstrak
Dengan melihat koefisien dari masing-masing faktor pada model persamaan dapat diketahui faktor mana yang memberikan pengaruh paling besar. Untuk volum ekstrak
terlihat bahwa interaksi antara lama blansir dengan suhu ekstraksi merupakan faktor yang paling berpengaruh, diikuti oleh interaksi antara lama blansir dengan lama ekstraksi. Interaksi baik antara lama blansir dengan suhu ekstraksi maupun antara lama blansir dengan lama ekstraksi memiliki koefisien negatif, artinya volum ekstrak akan
maksimal jika salah satu dari faktor yang berinteraksi memiliki taraf maksimum sedangkan faktor yang satunya lagi bertaraf minimum. Sebaliknya volum ekstrak akan mencapai nilai rendah jika kedua faktor yang saling berinteraksi sama-sama memiliki taraf minimum atau maksimum.
Hal ini menunjukkan bahwa paparan panas, baik yang berasal dari proses blansir maupun dari proses ekstraksi, diperlukan untuk mendapatkan volum ekstrak yang tinggi. Akan tetapi jika paparan panas yang diperoleh terlalu banyak, maka volum ekstrak menjadi lebih rendah. Dengan kata lain volum ekstrak paling maksimal akan
diperoleh jika proses dilakukan tanpa blansir dan diikuti oleh ekstraksi pada suhu tinggi (60oC) dan waktu lama (120 menit), atau blansir deng