PENAPISAN DAN IDENTIFIKASI BAKTERI YANG
BERASOSIASI DENGAN SPONS Jaspis sp. PENGHASIL
INHIBITOR PROTEASE
DEDE MAHDIYAH
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan dengan sebenarnya bahwa tesis Penapisan dan Identifikasi Bakteri yang Berasosiasi dengan Spons Jaspis sp. Penghasil Inhibitor Protease adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Februari 2010
Dede Mahdiyah
ABSTRACT
DEDE MAHDIYAH. Screening and Identification of Sponge Jaspis sp. Associated Bacteria Producing Protease Inhibitor. Under direction of ARIS TRI WAHYUDI and WIDANARNI.
Sponges have been known as excellent sources for natural products such as bioactive compounds. Their bioactivities include enzyme inhibitors, cell division-inhibitors, antiviral, antifungal, antimicrobial, etc. The aims of this study were to screen sponge-associated bacteria producing protease inhibitor. The bacteria were isolated by using sea water complete media to screen protease inhibitor and to determine the activity of the protease inhibitor toward several substrates, i.e proteinase K, crude extract, and subtilisin. The bacteria that produce protease inhibitor were screened with skim milk double layer plate agar. Among 136 isolates examined, three isolates i.e SAB S-17, SAB S-21, and SAB S-43 yielded protease inhibitor. One of the most potential protease inhibitor producer, the bacteria isolates SAB S-21 (± 90%) for those three subtrates, was identified as Bacillus pumilus strain 210_50. This strain produced protease inhibitor with optimum temperature and pH 20oC-40oC and 5-8, respectively.
DEDE MAHDIYAH. Penapisan dan Identifikasi Bakteri yang Berasosiasi dengan Spons Jaspis sp. Penghasil Inhibitor Protease. Dibimbing oleh ARIS TRI WAHYUDI dan WIDANARNI.
Spons merupakan sumber produk alami berupa senyawa bioaktif. Sumber senyawa bioaktif tersebut dapat berupa inhibitor enzim, inhibitor pembelahan sel, antivirus, antifungi, antimikroba, anti-imflamantori, antitumor, atau sitotoksik. Asosiasi spons dengan bakteri mampu menghasilkan inhibitor protease yang berfungsi dalam penghambatan protease yang dihasilkan oleh bakteri patogen. Pencarian inhibitor asal mikroba laut diawali dengan proses penapisan bakteri penghasil inhibitor protease menggunakan lapisan ganda kasein. Inhibitor ini sangat berguna dalam bidang farmakologi. Oleh karena itu, perlu dilakukan penelitian tentang pencarian senyawa inhibitor khususnya inhibitor protease pada bakteri yang berasosiasi dengan spons Jaspis sp.
Penelitian ini dilaksanakan di Laboratorium Mikrobiologi, Departemen Biologi, FMIPA, Institut Pertanian Bogor pada bulan Januari sampai Juni 2009. Isolasi bakteri dari sampel spons dengan cara diusap pada permukaan spons pada tiga tempat menggunakan swab steril ± 1 cm2. Penapisan dan identifikasi bakteri yang berasosiasi dengan spons Jaspis sp. penghasil inhibitor protease menggunakan metode double layer. Produksi dan aktivitas protease menggunakan metode Walter 1984. Aktivitas inhibitor protease diuji pada beberapa suhu mulai dari suhu 10oC hingga 70oC dengan interval 10oC, dan diuji pada kisaran pH 3 sampai 12. Identifikasi bakteri penghasil inhibitor protease meliputi; pewarnaan Gram, pewarnaan spora, uji katalase dan uji biokimia dengan kit MicrobactTM GN A ID dan GN B ID. Identifikasi isolat terpilih dilakukan dengan analisis gen 16S rRNA dengan tahapan: isolasi DNA genom, amplifikasi gen penyandi 16S rRNA, sekuensing dan analisis filogenetik.
Bakteri yang diperoleh dari hasil isolasi sebanyak 136 isolat yang terdiri dari 70 bakteri endofit dan 66 bakteri permukaan. Ke-136 isolat tersebut diberi nama atau penanda yaitu SAB S (Sponge-Associated Bacteria Surface) dan SAB E (Sponge-Associated Bacteria Endophyite). Isolat yang positif menghasilkan inhibitor protease adalah yang mampu menghambat bakteri patogen (P. aeruginosa, S. aureus, EPEC K11) untuk mendegradasi skim. Dari hasil penelitian dapat dianalisa bahwa bakteri patogen yang menghasilkan protease mampu dihambat kemampuan proteolitiknya oleh bakteri yang berasosiasi dengan spons Jaspis sp. yaitu SAB S-17, SAB S-21, dan SAB S-43. Hal ini terlihat dari berkurangnya zona protease dibandingkan dengan kontrol.
Hasil waktu produksi protease dari beberapa bakteri patogen menunjukkan bahwa ketiga bakteri patogen yaitu: P. aeruginosa, S. aureus dan EPEC K11 mampu mensekresikan protease ekstraseluler pada fase stasioner. Ketiga bakteri tersebut memiliki kisaran waktu yang berbeda dalam memproduksi protease.
terhadap enzim yang berasal dari P. aeruginosa namun pada waktu inkubasi 20 jam. Isolat SAB S-21 paling baik dalam menghambat substrat baik proteinase K maupun subtilisin dibandingkan dengan isolat lainnya. Masing-masing penghambatannya sebesar 84,85% dan 64,74%.
Selain itu, kondisi suhu dan pH juga mempengaruhi aktivitas inhibitor protease. Hal yang unik terjadi pada isolat SAB S-17 yang mampu menghasilkan aktivitas inhibitor protease pada suhu 60oC dan pH optimum 6 terhadap substrat proteinase K. Fenomena menarik juga terjadi pada isolat SAB S-21 yang memiliki aktivitas inhibitor protease terhadap ekstrak kasar meningkat sangat tajam pada suhu 10oC sampai dengan suhu 30oC.
Berdasarkan hasil uji optimasi pH isolat SAB S-21 menghasilkan aktivitas inhibitor protease cukup tinggi pada berbagai kisaran pH yaitu pH 3 sampai 12 dengan proteinase K sebagai substratnya. Untuk kedua isolat lainnya memiliki aktivitas inhibitor protease berada pada pH 6 terhadap substrat proteinase K. Proteinase K termasuk kelompok serin protease, dimana serin protease memiliki kisaran pH untuk proteinase K yaitu pH 7,5 sampai 12, jadi isolat SAB S-21 masih menghasilkan aktivitas inhibitor protease pada kondisi pH 12 terhadap substrat proteinase K. Sedangkan pada subtilisin sebagai substratnya isolat SAB S-21 memiliki aktivitas inhibitor protease tertinggi (98.41%) pada pH 7. Untuk isolat SAB S-43 pada pH 6 dan isolat SAB S-17 pada pH 4. Kisaran pH yang diperoleh oleh ketiga isolat tersebut dalam menghasilkan aktivitas inhibitor protease tertingginya pada pH 4 sampai 7, namun ada yang masih tinggi aktivitasnya pada pH 9 untuk isolat SAB S-43.
Berdasarkan sekuen gen 16S rRNA dari tiga isolat yang mampu menghasilkan senyawa inhibitor protease menunjukkan bahwa isolat SAB S-17 termasuk dalam bakteri Paracoccus sp. Jx9, Isolat SAB S-43 termasuk dalam Bacillus subtilis strain DURCK11, dan isolat SAB S-21 termasuk dalam Bacillus pumilus starin 210_50.
©
Hak Cipta milik IPB, tahun 2010
Hak Cipta dilindungi Undang-undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
PENAPISAN DAN IDENTIFIKASI BAKTERI YANG
BERASOSIASI DENGAN SPONS Jaspis sp. PENGHASIL
INHIBITOR PROTEASE
DEDE MAHDIYAH
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Mayor Mikrobiologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
NIM : G351070251
Disetujui Komisi Pembimbing
Dr. Aris Tri Wahyudi, M.Si Dr. Widanarni, M.Si Ketua Anggota
Diketahui
Koordinator Mayor Dekan Sekolah Pascasarjana Mikrobiologi
Dr. Ir. Gayuh Rahayu, M.Si Prof. Dr. Ir. Khairil A. Notodiputro, M.S.
KATA PENGANTAR
Puji syukur kepada Allah SWT. atas segala rahmat karunia serta hidayahNya penulis dapat menyelesaikan penulisan tesis penelitian ini dengan judul: Penapisan dan Identifikasi Bakteri yang Berasosiasi dengan Spons
Jaspis sp. Penghasil Inhibitor Protease.
Penulis mengucapkan terima kasih kepada pembimbing Dr. Aris Tri Wahyudi, M.Si dan Dr. Widanarni M.Si atas bimbingannya dan kepada semua pihak yang telah membantu. Penulis juga mengucapkan terima kasih kepada suami, Rika Indri Astuti, M.Si yang banyak membantu dalam kelancaran penulisan tesis serta dalam penelitian, Yonathan Banoet, S.Si, abah, ema serta keluarga yang selalu mendukung dan mendoakan penulis.
Kritik dan saran penulis harapkan dari segala pihak demi kelancaran dan perbaikan tesis ini. Besar harapan penulis agar tesis ini dapat memberi manfaat untuk diri sendiri dan semua pihak.
Bogor, Februari 2010
RIWAYAT HIDUP
Penulis dilahirkan di Tangerang pada tanggal 16 Oktober 1984 dari ayah Muhammad Payumi dan ibu Siti Muslihah. Penulis merupakan putri kedua dari enam bersaudara.
Tahun 2002 penulis lulus dari MA Miftahul Huda Tangerang, Banten. Pada tahun yang sama lulus masuk Universitas Islam Negeri Syarif Hidayatullah Jakarta melalui jalur Penelusuran Minat dan Kemampuan (PMDK). Penulis memilih Program Studi Biologi Fakultas Sains dan Teknologi. Selama kuliah penulis juga menjadi guru biologi di Madrasah Aliyah dari tahun 2002 sampai sekarang.
DAFTAR ISI
Simbiosis Mikroorganisme dengan Spons ... 4Inhibitor Protease ... 5
Jenis-jenis Inhibitor Protease ... 6
Subtilisin ... 7
Penapisan Bakteri Penghasil Inhibitor Protease yang Berasosiasi dengan Spons Jaspis sp. ... 9
Uji Aktivitas Inhibitor Protease terhadap Ekstrak Kasar, Proteinase K, dan Subtilisin ... 10
Produksi Protease dari Bakteri Patogen ... 10
Pengukuran Aktivitas Protease ... 10
Pengukuran Aktivitas Inhibitor Protease ... 10
Penentuan Suhu Optimum ... 11
Penentuan pH Optimum ... 12
Pengukuran Konsentrasi Protein ... 12
Identifikasi Bakteri Penghasil Inhibitor Protease ... 12
Uji Fisiologis ... 12
Isolasi DNA Genom ... 13
Amplifikasi dan Purifikasi Gen Penyandi 16S-rRNA ... 14
Sekuensing dan Analisis Filogenetik ... 14
HASIL Isolasi Bakteri dari Sampel Spons ... 15
Penapisan Bakteri yang Berasosiasi dengan Spons Jaspis sp. Penghasil Inhibitor Protease ... 15
Produksi Protease dari Bakteri Patogen ... 19
Pengukuran Aktivitas Inhibitor Protease ... 19
Penentuan pH Optimum ... 24
Identifikasi Bakteri Penghasil Inhibitor Protease ... 27
Identifikasi Isolat Terpilih dengan Analisis Gen 16S rRNA... 28
Analisis Pohon Filogenetik ... 29
PEMBAHASAN ... 30
SIMPULAN ... 35
SARAN ... 35
DAFTAR PUSTAKA ... 36
DAFTAR TABEL
Halaman
1. Prosedur pengukuran aktivitas protease (Walter 1984) ... 11
2. Aktivitas inhibitor protease yang dihasilkan oleh bakteri yang berasosiasi dengan spons Jaspis sp. ... 17
3. Aktivitas protease bakteri patogen yang digunakan dalam penelitian ini ... 19
4. Aktivitas inhibitor protease (%) selama 32 jam pada suhu 30oC ... 20
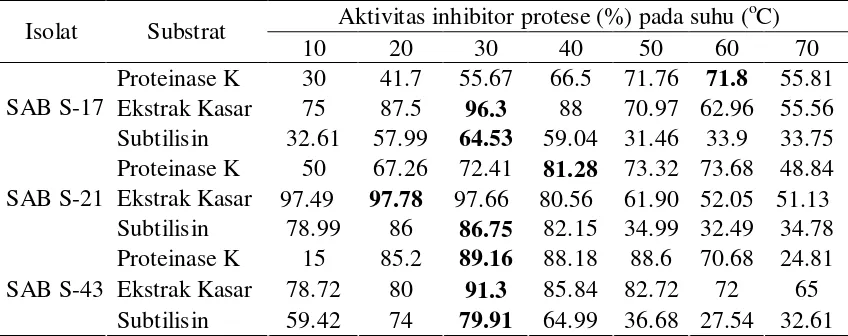
5. Aktivitas inhibitor protease (%) pada berbagai suhu ... 22
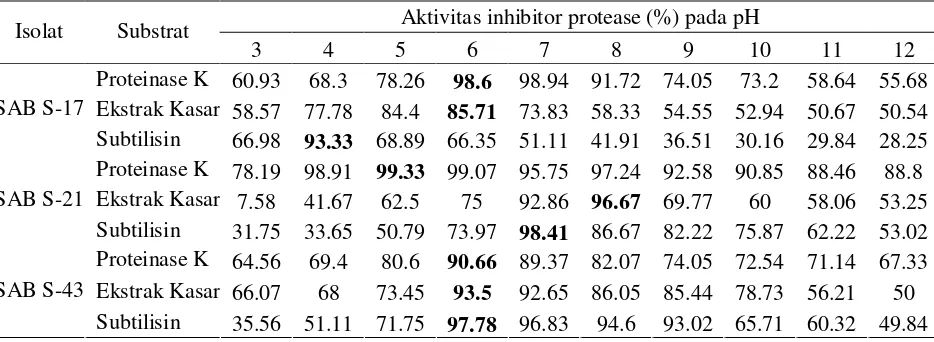
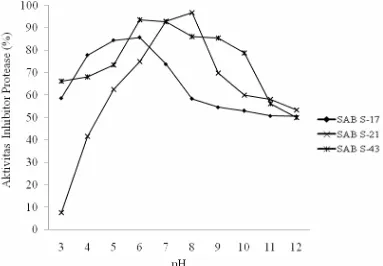
6. Aktivitas inhibitor protease (%) pada berbagai pH ... 24
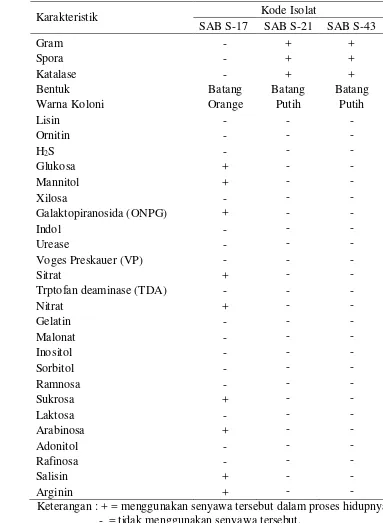
7. Karakteristik fisiologi dan morfologi bakteri penghasil inhibitor protease yang berasosiasi dengan spons Jaspis sp. ... 27
8. Hasil analisis BLASTN ketiga isolat terpilih terhadap data GenBank ... 29
DAFTAR GAMBAR
Halaman
1. Penampilan koloni bakteri pada media SWC yang berhasildiisolasi dari spons Jaspis sp. setalah diinkubasi selama 24 jam ... 15 2. Uji inhibitor protease bakteri patogen dengan bakteri yang
berasosiasi dengan spons Jaspis sp. menggunakan medium SWC sebagai lapisan bawah dan medium NA+susu skim 1,5%
sebagai lapisan atas. ... 16 3. Aktivitas inhibitor protease terhadap substrat proteinase K
selama waktu inkubasi 32 jam pada suhu 30oC ... 20 4. Aktivitas inhibitor protease terhadap substrat ekstrak kasar protease
bakteri patogen selama waktu inkubasi 32 jam pada suhu 30oC ... 21 5. Aktivitas inhibitor protease terhadap substrat subtilisin
selama waktu inkubasi 32 jam pada suhu 30oC ... 21 6. Aktivitas inhibitor protease pada berbagai suhu terhadap
substrat proteinase K ... 23 7. Aktifitas inhibitor protease pada berbagai suhu terhadap
substrat ekstrak kasar protease bakteri patogen ... 23 8. Aktivitas inhibitor protease pada berbagai suhu terhadap
substrat subtilisin ... 24 9. Aktivitas inhibitor protease pada berbagai pH terhadap
substrat proteinase K ... 25 10. Aktivitar inhibitor protease pada berbagai pH terhadap
substrat ekstrak kasar protease bakteri patogen ... 26 11. Aktivitas inhibitor protease pada berbagai pH terhadap
substrat subtilisin ... 26 12. Gel elektroforesis gen 16S rRNA (1300 pb) dari tiga
isolat yang berpotensi sebagai penghasil inhibitor protease ... 28 13. Pohon filogenetik dari tiga isolat terpilih yang berpotensi sebagai
DAFTAR LAMPIRAN
Halaman
1. Komposisi Media ... 40
2.
Kurva Standar Penentuan Konsentrasi ProteinPENDAHULUAN
Latar Belakang
Indonesia merupakan negara yang terkenal dengan kekayaan alamnya, baik di darat maupun di laut. Penelitian terhadap organisme yang ada di lautan khususnya dalam kaitan dengan pencarian senyawa bioaktif dan enzim-enzim penting masih dalam tahap permulaan. Telah diketahui bahwa laut menyimpan kekayaan alam dan manfaat yang sangat besar. Salah satu kekayaan alam laut yang cukup banyak terdapat di perairan Indonesia, seperti di perairan Sumatera, Papua, Kalimantan dan lainnya, adalah jenis spons. Banyak manfaat yang
dihasilkan oleh spons diantaranya sebagai sumber senyawa antibakteri. Spons merupakan salah satu sumber senyawa-senyawa baru dari biota laut yang mempunyai keanekaragaman hayati tinggi. Penelitian yang telah ada terhadap spons telah menghasilkan senyawa-senyawa baru dengan struktur unik dan
memiliki aktivitas farmakologis. Keanekaragaman hayati perairan laut Indonesia memberi peluang untuk memanfaatkan spons laut Indonesia dalam pencarian senyawa bioaktif yang baru.
Spons merupakan salah satu sumber alami yang baik dalam menghasilkan komponen-komponen bioaktif termasuk inhibitor enzim (Munro et al. 1999). Mikroorganisme (bakteri) yang hidup bersimbiosis dengan spons ternyata juga diketahui mampu menghasilkan inhibitor protease seperti yang dilaporkan oleh Stierle et al. (1988) bahwa Micrococcus sp. yang bersimbiosis dengan spons Tedania ignis menghasilkan senyawa diketopiperazina. Juga dilaporkan oleh Elyakov et al.(1991) bahwa bakteri Vibrio sp. yang bersimbiosis dengan spons Dysidea sp. menghasilkan bifenil eter bromina. Osclarit et al.
(1994) juga melaporkan bahwa bakteri Vibrio sp. yang bersimbiosis dengan spons
Hyatella sp. menghasilkan senyawa peptida yang bersifat anti Bacillus. Selain itu
juga dilaporkan oleh Nurhayati dan Suhartono (2004) bahwa bakteri yang diisolasi dari spons Plakortis nigra memiliki aktivitas penghambatan terhadap protease yang dihasilkan Escherichia coli.
dan organisme laut lain. Organisme inang mensintesis senyawa ini sebagai
metabolit sekunder untuk melindungi dirinya dan menjaga keseimbangan lingkungan kaitannya dalam pertahanan diri terhadap predator. Spons laut memiliki sumber yang kaya akan mikroorganisme baru dengan potensi aktivitas farmakologi (Hentschel et al. 2001). Interaksi antara spons dan bakteri terjadi dalam bentuk simbiosis komensalisme dimana dalam interaksi ini dihasilkan senyawa bioaktif (Proksch et al. 2002).
Baru-baru ini inhibitor enzim telah mendapat banyak perhatian tidak hanya sebagai alat untuk mempelajari struktur enzim dan mekanismenya saja tapi juga merupakan senyawa yang berpotensi dalam bidang farmakologi (Bode & Huber 1992). Sebagai contoh, inhibitor enzim berguna dalam diagnosa dan terapi radang, pankreatis dan penyakit lainnya yang disebabkan oleh bakteri penghasil protease. Inhibitor protease juga berguna untuk menginaktivasi protease target yang disekresikan oleh bakteri yang patogen penyebab penyakit terhadap manusia seperti amphysema, pancreatic, artriris, trombosis, tekanan darah tinggi, kanker dan AIDS (Demuth 1990). Telah diketahui bahwa inhibitor protease kebanyakan berasal dari terestrial yang dapat diisolasi dari hewan, tanaman, fungi, dan actinomycetes, hanya sedikit inhibitor protease yang berasal dari bakteri (Imada et al. 1985a).
Lingkungan laut dicirikan dengan adanya kadar garam tinggi dan konsentrasi bahan organik rendah dan laut dalam cenderung memiliki suhu rendah dan tekanan hidrostatik tinggi. Keberadaan lingkungan laut pertama kali
3
Melihat potensi yang tinggi dari mikroorganisme yang bersimbiosis dengan
spons dalam menghasilkan inhibitor maka dalam penelitian ini dilakukan isolasi bakteri yang berasosiasi dengan spons Jaspis sp. untuk kemudian diuji aktivitas inhibitor proteasenya dalam menghambat bakteri patogen penyebab penyakit diare dan foodborne disease, sehingga diharapkan akan diperoleh isolat bakteri potensial yang dapat dikembangkan lebih lanjut khususnya di bidang farmakologi.
Tujuan
Simbiosis Mikroorganisme dengan Spons
Spons merupakan invertebrata multiseluler sederhana yang melekat di habitat bentik pada substrat padat. Semua spons merupakan organisme filter feeder dimana banyak pori yang tipis pada permukaan tubuhnya sehingga air dapat masuk dan bersirkulasi melalui kanal atau saluran dimana mikroorganisme dan partikel organik dapat disaring dan dimakan (Wilkinson 1978).
Spons merupakan sumber produk alami berupa senyawa bioaktif. Sumber senyawa bioaktif tersebut dapat berupa inhibitor enzim, inhibitor pembelahan sel,
antivirus, antifungi, antimikroba, anti-imflamantori, antitumor, atau sitotoksik (Munro et al. 1999). Salah satu contoh spons yang menghasilkan senyawa bioaktif yaitu Achantella sp. penghasil senyawa kalibinol-A yang berfungsi sebagai antibiotik. Selain itu, Jaspis jhonstoni diketahui mampu menghasilkan
senyawa jasplakinolide yang bersifat sitotoksik (Lee et al. 2001).
Banyak sekali mikroorganisme yang diketahui bersimbiosis dengan spons diantaranya dari kelompok arkaea, bakteri heterotrofik, sianobakteria, alga hijau, alga merah, kriptofita, dinoflagellata dan diatom. Simbion dapat bersifat spesifik maupun non-spesifik terhadap spons sebagai inangnya. Wilkinson (1978) menemukan simbiosis mikroorganisme yang spesifik pada spesies spons tunggal. Hal ini terlihat pada simbion antara spesies d-proteobacteria (Aeromonas sp.) dan spons Theonella swinhoei yang menunjukkan asosiasi spesifik.
Simbiosis terjadi secara intraseluler dan ekstraseluler, dan pada tiap-tiap simbiosis mikroorganisme terlihat memiliki habitat yang spesifik pada spons inang. Simbiosis ekstraseluler terjadi pada lapisan luar spons sebagai eksosimbion atau pada mesohyl sebagai endosimbion. Simbion intraseluler atau intranukleus secara permanen berada dalam sel inang atau inti. Pada spons Theonella swinhoei semua populasi bakteri yang bersimbiosis bertempat pada ekstraseluler (Bewley et al. 1996).
Webster dan Hill (2001) meyakini bahwa beberapa kemungkinan
5
lain; atau inang memperoleh simbion spesifik melalui transmisi vertikal dari
induk spons ke larva. Spons terlihat memperoleh simbiosis mikroorganisme melalui mekanisme fagositosis, mikroorganisme ini dapat hidup pada jaringan spons.
Inhibitor Protease
Inhibitor protease adalah suatu senyawa yang memblok situs aktif protease untuk mencegah substrat berikatan dengan situs aktif enzim tersebut (Barret et al. 2003). Inhibitor protease adalah kelas dari suatu jenis obat yang digunakan untuk menangani atau mencegah infeksi oleh virus, termasuk HIV dan Hepatitis C (Bisswanger 2002). Inhibitor protease mencegah replikasi virus dengan mencegah aktivitas HIV-1 protease, enzim yang digunakan oleh virus untuk membelah protein menjadi kumpulan virion. Inhibitor protease banyak dihasilkan oleh berbagai macam mikroorganisme diantaranya yaitu, Serratia marcescens menghasilkan protein inhibitor protease logam yang dikenal dengan nama SmaPI. Inhibitor tersebut dihasilkan dalam jumlah kecil yang menunjukkan penghambatan terhadap protease logam S. marcescens yang memiliki bobot molekul 50 kDa. Protein tersebut berlokasi di bagian periplasma sel dalam suhu pertumbuhan 25oC (Kim et al. 1995).
Inhibitor protease juga dihasilkan oleh Gliocladium sp. yang disebut dengan inhibitor proteinase sistein, TMC-52A-D. Berdasarkan hasil analisa dengan spektrofotometer dan degradasi kimia menunjukkan bahwa TMC-52A-D merupakan peptida epoksisuksinil. Inhibitor tersebut kuat menghambat protease
sistein (Isshiki et al. 1998).
maksimumnya dihasilkan pada pH 6 dalam air laut, suhu 20oC dan digoyang 24-33 jam. Jenis inhibitor lain yang dihasilkan oleh Alteromonas sp. adalah monastatin yang mempunyai bobot molekul tinggi yaitu 20.000 dalton. Inhibitor tersebut termasuk glikoprotein, stabil pada suhu sampai 100oC selama inkubasi 30 menit (Imada et al. 1985a). Selain itu, Alteromonas sp. juga menghasilkan jenis inhibitor leupeptin yang memiliki aktivitas inhibitor pada protease thiol dan protease serin (Kobayashi et al. 2003). Ketiga jenis inhibitor protease yang dihasilkan oleh Alteromonas sp. ini memiliki aktivitas dalam penghambatan yang berbeda. Untuk marinostatin memiliki aktivitas inhibitor terhadap protease serin seperti subtilisin. Monastatin yang termasuk kedalam protease thiol memiliki aktivitas inhibitor terhadap protease yang dihasilkan oleh bakteri patogen terhadap ikan (Kobayashi et al. 2003).
Pseudomonas aeruginosa juga diketahui menghasilkan serralisin (inhibitor protease alkalin) yang memiliki afinitas tinggi terhadap zink protease yang dihasilkan oleh beberapa bakteri gram negatif. Inhibitor tersebut memiliki bobot molekul 11,5 kDa. Fungsi dari inhibitor ini adalah untuk melindungi bakteri dari proteolisis selama sekresi serralisin. Senyawa ini diproduksi sebagai prekursor dengan 125 asam amino dengan urutan signal N-terminal (Feltzer et al. 2003). Anthony et al. (2002) berhasil mengisolasi dysinosin A dari spons famili Dysideidae yang ditemukan dekat pulau Lizard Queensland utara Australia. Dysinosin A merupakan inhibitor yang berpotensi dalam faktor koagulasi darah dan merupakan inhibitor pada trombin serin protease.
Jenis-jenis Inhibitor Protease
7
katepsin, dan renin. Jenis metaloprotease memiliki mekanisme katalitik metal
seperti seng dan cobalt (Barret et al. 2003).
Inhibitor protease sistein dibagi dalam tiga famili sistasin yaitu berdasarkan berat molekul, jumlah ikatan disulpidril, dan struktur primernya. Famili tersebut adalah stefin, sistasin, dan kininogen (Isshihara et al. 1999). Inhibitor tersebut memiliki fungsi biologis pada pengaturan protease endogenous seperti kelompok katepsin dan perlindungan pada protease luar. Beberapa inhibitor protease sistein dari mikroba telah diisolasi dan dikarakterisasi senyawa kimianya (Murao et al. 1985), inhibitor tersebut memiliki berat molekul rendah. Telah dilaporkan oleh Tsushima et al. (1992) inhibitor protease sistein dari Candida albicans memiliki berat molekul 15 kDa.
Subtilisin
Subtilisin adalah protease serin pada prokariot. Subtilisin tidak berhubungan secara evolusi terhadap kimotripsin, tetapi mekanisme katalitiknya sama menggunakan triad katalitik, untuk menciptakan serin nukleofilik. Protease serin dihambat oleh kelompok yang berbeda pada inhibitor, termasuk inhibitor kimia sintetik untuk penelitian atau terapetik, dan juga inhibitor protein alami. Satu keluarga pada inhibitor alami dinamakan serpin (turunan dari inhibitor protease serin) yang dapat membentuk ikatan kovalen dengan protease serin, dan dapat menghambat fungsinya. Subtilisin diperoleh dari B. licheniformis yang memiliki pH optimumnya 6,5 sampai 7,5 (Marangoni 2003).
Proteinase K
Waktu dan Tempat
Penelitian ini dilakukan pada bulan Januari sampai dengan Juni 2009 di Laboratorium Mikrobiologi, Departemen Biologi, FMIPA, Institut Pertanian Bogor.
Alat
Alat yang digunakan pada penelitian ini adalah; cawan petri, tabung reaksi, tabung mikro 1,5 ml, erlenmeyer 100 ml, bunsen, ose, tusuk gigi steril, swab steril, pipet volumetrik, tip, sentrifugal, tabung falkon 50 ml, Laminar Air Flow (LAF), autoklaf, erlenmeyer, PCR (Polymeration Chain Reaction), dan spektrofotometer UV.
Bahan
Bahan yang digunakan pada penelitian ini adalah; sampel spons yang diambil dari perairan sebelah barat dari kepulauan Waigeo, Kabupaten Raja Ampat, Papua Barat, media SWC (Sea Water Complete), PBS (Phosphate Buffer Saline), susu skim 1,5%, isolat bakteri patogen yaitu; Staphylococcus aureus, Pseudomonas aeruginosa, dan EPEC K11, medium LB (Luria Broth), medium
NA (nutrient agar), CBBG (Comassie Briliant Blue G-250), asam fosfor 85%, etanol 95%, kasein hammerstein 2%, TCA 5%, proteinase K 0,5 ml, ekstrak kasar 0,5 ml, dan subtilisin dari Bacilluslicheniformis(SIGMA)0,5 ml.
Metode
Pengambilan Sampel
9
Isolasi Bakteri dari Sampel Spons Jaspis sp.
Spons dibilas dengan air laut sintetik steril supaya bakteri kontaminan yang tidak berasosiasi dengan spons tidak terisolasi, sehingga hanya bakteri dengan daya gabung yang kuat saja yang akan diisolasi (Amstrong 2001). Isolasi bakteri pada permukaan spons dilakukan dengan cara mengusap permukaan spons pada tiga tempat yang berbeda menggunakan swab steril ± 1 cm2, kemudian dicelupkan ke dalam 3 buah erlenmeyer yang berisi media PBS (Phosphate Buffer Saline) steril. Dari masing- masing tabung tersebut dilakukan seri pengenceran dari 10-1 sampai dengan 10-5 sebanyak 100 µL. Pada tiga pengenceran terakhir disebar dalam media SWC (Sea Water Complete) (Lampiran 1), dan diinkubasi pada suhu ruang selama 24 jam. Koloni yang tumbuh dimurnikan dengan metode kuadran dan dipreservasi dalam agar miring.
Penapisan Bakteri Penghasil Inhibitor Protease yang Berasosiasi dengan Spons Jaspis sp.
Penapisan dilakukan dengan menggunakan metode plate agar susu skim
dua lapis (modifikasi Imada 1985a). Lapisan bawah terdiri atas media SWC, sedangkan lapisan atas terdiri atas nutrient agar (NA) yang diberi skim 1,5%. Isolat bakteri laut yang akan ditapis ditusukkan pada lapisan bawah (SWC), lalu diinkubasi 24 dan 48 jam pada suhu 30oC. Isolat yang tumbuh dibuang, kemudian diberi lapisan atas. Isolat bakteri patogen (P. aeruginosa, S. aureus, EPEC K11) ditusukkan pada bagian atas lalu diinkubasi 24 jam pada suhu 37oC. Isolat yang positif menghasilkan inhibitor protease ditunjukkan dengan tidak adanya atau berkurangnya zona protease di sekitar koloni bakteri patogen.
Persentase penghambatan protease dihitung dengan menggunakan rumus (Alford & Bentley 1986) :
Kemudian zona protease dikategorikan dalam tiga kategori yaitu aktivitas rendah
dengan zona/koloni (Z/K) <1, aktivitas sedang Z/K 1-2 dan aktivitas tinggi Z/K >2. Isolat yang menunjukan persentase penghambatan dan zona protease tertinggi digunakan untuk uji selanjutnya.
Uji Aktivitas Inhibitor Protease terhadap Ekstrak Kasar, Proteinase K dan Subtilisin
Uji aktivitas inhibitor protease meliputi penentuan waktu produksi inhibitor protease, aktivitas inhibitor protease, aktivitas pada berbagai suhu, aktivitas pada berbagai pH, dan pengukuran konsentrasi protein. Untuk ekstrak kasar, terlebih dahulu dilakukan produksi protease dan pengukuran aktivitas protease.
Produksi Protease dari Bakteri Patogen. Bakteri patogen yang digunakan adalah EPEC K11, S. aureus, dan P. aeruginosa yang telah diketahui bersifat patogen secara klinis. Bakteri patogen yang telah diremajakan, diinokulasi sebanyak 1-2 lup pada media Luria Bertani Broth (LB) sampai mencapai fase logaritmik (OD mencapai 0.8; λ 620 nm pada suhu 370C). Sebanyak 10% (v/v) inokulum dipindahkan ke dalam 50 ml media produksi (LB), untuk selanjutnya diinkubasi pada kondisi yang sama hingga kembali mencapai OD = 0,8. Kultur kemudian dipanen dengan melakukan sentrifugasi pada kecepatan 8000 rpm selama 15 menit pada suhu 4oC. Supernatan yang mengandung enzim ekstrak kasar diuji aktivitasnya menggunakan metode Walter (1984) pada substrat kasein (sigma) dan kadar proteinnya menurut metode Bradford dalam Hammond dan Kruger (1988).
Pengukuran Aktivitas Protease. Semua ekstrak kasar enzim (supernatan) diukur aktivitasnya berdasarkan Metode Walter (1984) (Tabel 1).
11
Tabel 1 Prosedur pengukuran aktivitas protease (Walter 1984)
Pereaksi Sampel
Inkubasi pada suhu 370C selama 10 menit
TCA (0.1 M) 2 2 2
Aquades 0,2 0 0
Enzim 0 0,2 0,2
Didiamkan pada suhu 370C selama 10 menit, lalu disentrifugasi 4000 rpm selama 10 menit
Fltrat 1,5 1,5 1,5
Na2CO3 5 5 5
Pereaksi folin 1 1 1
Didiamkan pada suhu 370C selama 20 menit Diukur dengan spektrofotometer pada λ 578 nm
Aktivitas protease (IU/ml) =
Setelah diinkubasi, 2 ml asam trikloroasetat (TCA) 5% (w/v) ditambahkan untuk menghentikan reaksi enzim. Campuran disimpan selama 20 menit pada suhu 30oC untuk mengendapkan kasein yang tidak dicerna enzim. Selanjutnya larutan disentrifugasi pada kecepatan 3000 g selama 10 menit, supernatan diukur pada absorbansi 280 nm.
Satu unit aktivitas inhibitor protease didefinisikan sebagai jumlah inhibitor yang dapat menghambat aktivitas protease sebanyak 50%.
dimana campuran yang terdiri atas 0,5 ml substrat dan 0,5 ml inhibitor isolat
terpilih diinkubasi pada tiap suhu uji (10oC – 70oC) selama 12 menit.
Penentuan pH Optimum. Supernatan dari bakteri yang berasosiasi dengan spons diukur pada berbagai pH dari pH 3 hingga 12 dengan interval 1 dan diinkubasi selama 10 menit pada suhu 30oC. Setelah diinkubasi aktivitas inhibitor diukur sesuai metode Imada et al. (1985c). Perlakuan pH di mana 1 ml kasein hammerstein 2% w/v dalam larutan bufer Tris HCl 50 mM diuji pada pH yang berbeda (3 – 12).
Pengukuran Konsentrasi Protein (Metode Bradford dalam Hammond dan Kruger 1988). Uji ini dilakukan untuk membuat kurva standar protein (BSA). Analisa ini diawali dengan pembuatan larutan Bradford dan larutan standar BSA. Larutan bardford dibuat dengan cara sebagai berikut : sebanyak 100 mg CBBG dilarutkan dalam 50 ml etanol 95% (w/v). Setelah itu ditambahkan 100 ml asam fosfat 85% (w/v). Terakhir larutan diencerkan dengan aquades sampai 1 liter. Larutan standar segar dibuat dengan menggunakan protein BSA. Sebanyak 100 mg BSA ditimbang dan ditambahkan 25 ml akuades. Larutan dikocok pelan-pelan, setelah larut diencerkan sampai 50 ml. konsentrasi akhir larutan stok untuk standar ini adalah 2 mg/ml. Konsentrasi Bradford dan kurva standar yang digunakan untuk menentukan konsentrasi protein disajikan pada Lampiran 2. Untuk metode makroassay : sebanyak 5 ml pereaksi Bradford ditambahkan kedalam masing-masing tabung reaksi. Blanko dibuat dengan cara mencampurkan 0,1 ml dan direaksikan dengan 5 ml (makroassay) pereaksi Bradford. Setelah
sekitar 5 menit, masing-masing campuran reaksi diukur absorbansinya pada λ 595 nm.
Identifikasi Bakteri Penghasil Inhibitor Protease
13
dan arginin (MicrobactTM GN B ID). Pewarnaan Gram, endospora dan uji katalase dilakukan sesuai dengan metode Cappucino & Shermna (1983) yaitu dengan menggunakan pereaksi iodium gram, alkohol, dan safranin untuk pewarnaan Gram. Sedangkan untuk pewarnaan endospora ditetesi dengan malakit hijau dan safranin sedangkan untuk uji katalase ditetesi dengan H2O2.
Isolasi DNA Genom. Isolat terpilih dengan kemampuan menghasilkan inhibitor protease digunakan untuk analisis genetika molekuler. Isolasi DNA genom dilakukan dengan metode Murray-Thompson (Cetyl trimethyl Ammonium Bromide, CTAB). Isolat tersebut ditumbuhkan pada media Luria Broth (Tripton 10 g, NaCl 10 g, ekstrak khamir 5 g, akuades 1L) selama semalam, pada inkubator bergoyang di suhu ruang.
Sebanyak 50 mL kultur isolat diambil dan dimasukkan ke dalam 2 tabung sentrifugasi 50 mL steril masing-masing 25 mL. Kemudian disentrifugasi selama 10 menit pada kecepatan 8500 g. Pelet yang didapat kemudian diresuspensi
dengan 250 µl bufer TE (1X), dan dipindahkan ke dalam tabung mikro 1,5 mL
steril. Kemudian disentrifugasi kembali pada kecepatan 9000 g selama 10 menit.
Suspensi kemudian ditambahkan 5 µL lisozim, lalu dicampur merata dengan cara
membolak-balikkan tabung mikro hingga larutan menjadi berlendir dan bening. Selanjutnya, suspensi diinkubasi pada suhu 37oC selama 30 menit. Proses lisis sel
dilanjutkan dengan menambahkan 500 µL (Sodium Dodecyl Sulfate) SDS 10%
dan proteinase K sebanyak 10 µL, tabung mikro 1,5 mL kemudian dibolak-balik. Suspensi diinkubasi pada suhu 37oC selama 60 menit. Sebanyak 80 µL NaCl dan
100 µL CTAB 10% ditambahkan ke dalam suspensi, kemudian diinkubasi pada
suhu 65oC selama 20 menit, tabung kembali dibolak-balik.
Purifikasi DNA dan pengendapan debris sel dilakukan dengan
menambahkan 650 µL fenol : kloroform : isoamilalkohol (25:24:1). DNA
dipisahkan dari debris sel dengan cara disentrifugasi pada 13000 g selama 10 menit. Supernatan yang mengandung DNA dipurifikasi dengan menambahkan
650 µL kloroform:isoamil alkohol (24:1) dan selanjutnya disentrifugasi pada
(-20oC) selama 30 menit dan kemudian dilakukan sentrifugasi pada 13000 g selama 15 menit. Pelet yang didapatkan ditambahkan 70% etanol dingin untuk mengikat air. Suspensi kembali disentrifugasi (13000 g; 15 menit), fase supernatan dibuang sedangkan pelet dikeringudarakan dengan cara membuka tutup tabung mikro 1,5 mL dan dibiarkan selama beberapa jam (2-3 jam). Kemudian pelet DNA dilarutkan dalam 20 µL ddH2O steril dan disimpan pada suhu -20oC (freezer).
Amplifikasi dan Purifikasi Gen Penyandi 16S-rRNA. Primer yang digunakan untuk amplifikasi gen 16S-rRNA ialah 63f (5’-CAG GCC TAA CAC ATG CAA GTC-3’) dan 1387r (5’- GGG CGG WGT GTA CAA GGC-3’) (Marchesi et al. 1998). Primer tersebut akan menghasilkan pita gen teramplifikasi
dengan ukuran sekitar 1300 pb. PCR akan dilakukan pada volume 25 µL dengan
komposisi LA Taq polimerase 0,25 µL, larutan penyangga (GC buffer) 12,5 µL,
dNTP 8 µL, primer masing-masing 1 µL, dan DNA cetakan sebanyak 5 µL serta
ditambahkan ddH2O hingga volume akhir 25 µL. Amplifikasi dilakukan untuk 30 siklus yang meliputi tahap pra-denaturasi pada suhu 94°C selama 2 menit, denaturasi pada suhu 92°C selama 30 detik, annealing pada suhu 55°C selama 30 detik, dan polimerasi pada suhu 75°C selama 1 menit, serta post-PCR pada suhu 75°C selama 5 menit. Hasil amplifikasi dilarikan pada gel elektroforesis agarosa 1%, fragmen 16S-rDNA kemudian dipurifikasi dengan Wizard® SV Gel & PCR Clean-up System (Promega, USA). Metode purifikasi ini berperan dalam mengisolasi DNA dari gel agarosa hasil elektroforesis.
HASIL
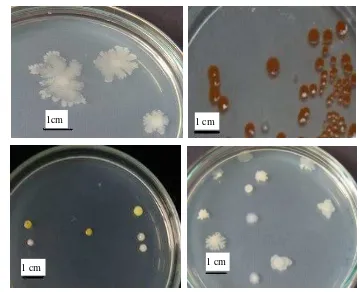
Isolasi Bakteri dari Sampel Spons Jaspis sp.Sebanyak 136 isolat berhasil diisolasi dari spons Jaspis sp. Dari 136 isolat tersebut, sebanyak 70 isolat berasal dari endofit spons dan 66 isolat dari permukaan spons. Isolat yang diperoleh sangat beragam baik dari segi warna, jenis, dan bentuk koloni (Gambar 1). Ke 136 isolat tersebut diberi nama atau penanda yaitu SAB S (Sponge-Associated Bacteria Surface) dan SAB E ( Sponge-Associated BacteriaEndophyite).
Gambar 1 Penampilan koloni bakteri pada media SWC yang berhasil diisolasi dari spons Jaspis sp. setalah diinkubasi selama 24 jam.
Penapisan Bakteri yang Berasosiasi dengan Spons Jaspis sp. Penghasil Inhibitor Protease
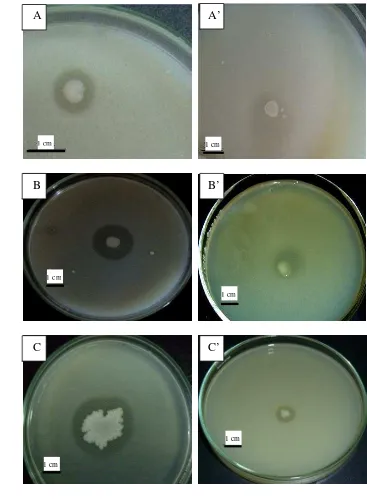
Isolat yang berpotensi sebagai penghasil inhibitor protease adalah yang menyebabkan bakteri patogen tidak mampu atau berkurang kemampuannya dalam mendegradasi protein (skim). Hal ini ditandai dengan tidak terbentuknya zona protease atau berkurangnya diameter zona protease di sekitar bakteri patogen tersebut dibandingkan dengan kontrol (Gambar 2).
1cm
1 cm 1 cm
Gambar 2 Uji inhibitor protease bakteri patogen dengan bakteri yang berasosiasi dengan spons Jaspis sp. menggunakan medium SWC sebagai lapisan bawah dan medium NA+susu skim 1,5% sebagai lapisan atas. (A) Aktivitas proteolitik dari EPEC K11 (zona protease = 3,5 mm), (A’) Aktivitas inhibitor protease oleh SAB S-21 terhadap EPEC K11 (persentase penghambatan = 100%, zona protease = 0 mm), (B) Aktivitas proteolitik dari P.aeruginosa (zona protease = 4 mm), (B’) Aktivitas inhibitor protease oleh SAB S-43 terhadap P. aeruginosa (persentase penghambatan = 62,5%, zona protease = 1,5 mm), (C) Aktivitas proteolitik dari S. aureus (zona protease = 4,5 mm), (C’) Aktivitas inhibitor protease oleh SAB S-17 terhadap S. aureus (persentase penghambatan = 55,5%, zona protease = 2 mm).
A A’
1 cm 1 cm
B B’
1 cm
1 cm
C’ C
1 cm
17
Di antara 136 isolat yang diuji, enam isolat menunjukkan aktivitas inhibitor
protease yang sangat tinggi terhadap EPEK K11 (Tabel 2). Namun untuk persentase penghambatan protease isolat bakteri yang dihasilkan oleh S. aureus hanya berkisar pada aktivitas yang rendah (55,5%). Untuk bakteri patogen P. aeruginosa hanya satu isolat (SAB S-43) yang menunjukkan persentase
penghambatan terbaik yakni pada kisaran 62,5%. Berdasarkan hasil penapisan maka dipilah tiga isolat untuk diuji lebih lanjut yakni isolat SAB S-17 (inhibitor protease dari S. aureus), SAB S-21 (inhibitor protease dari EPEC K11), dan SAB S-43 (inhibitor protease dari P. aeruginosa).
Tabel 2 Aktivitas inhibitor protease yang dihasilkan oleh bakteri yang berasosiasi dengan spons Jaspis sp.
Tabel 2 Lanjutan
Penghambatan terhadap produksi protease dari Kode Isolat
EPEC K11 P. aeruginosa S. aureus
19
Produksi Protease dari Bakteri Patogen
Uji ini dilakukan terhadap bakteri patogen yang akan digunakan sebagai substrat ekstrak kasar protease dalam pengukuran aktivitas inhibitor protease (Tabel 3). Kurva produksi enzim protease dari masing-masing bakteri patogen tertera pada Lampiran 3.
Tabel 3 Aktivitas protease bakteri patogen yang digunakan dalam penelitian ini
Bakteri Waktu
Berdasarkan hasil pengukuran aktivitas inhibitor protease dari bakteri yang berasosiasi dengan spons Jaspis sp. terhadap substrat proteinase K, ekstrak kasar, dan subtilisin terlihat rata-rata aktivitas inhibitor protease dari ketiga isolat (SAB
S-17, SAB S-21, dan SAB S-43) terhadap subtilisin sangat rendah dibandingkan dengan substrat proteinase K. Sedangkan pada substrat ekstrak kasar aktivitas inhibitor protease yang dihasilkan sangat tinggi (Tabel 4).
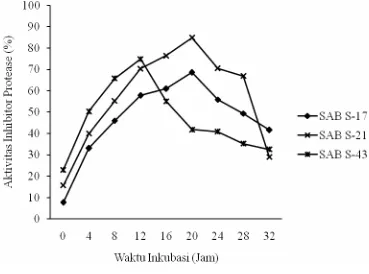
Isolat SAB S-21 paling baik dalam menghambat substrat proteinase K (84,84%). Pada uji aktivitas inhibitor protease menggunakan substrat proteinase K, diketahui bahwa isolat SAB S-17 dan SAB S-21 memiliki aktivitas inhibitor protease terbesar setelah waktu inkubasi 20 jam. Sedangkan isolat SAB S-43 memiliki aktivitas inhibitor protease terbesar setelah waktu inkubasi 12 jam (Gambar 3).
menghambat substrat subtilisin dibandingkan dengan isolat lainnya (Gambar 5),
sebesar 64,74%.
Tabel 4 Aktivitas inhibitor protease (%) selama 32 jam pada suhu 30oC
Aktivitas inhibitor protease (%) pada waktu inkubasi (jam)
Isolat Substrat
0 4 8 12 16 20 24 28 32
Proteinase K 7.66 33.13 45.93 57.82 60.93 68.60 55.91 49.32 41.66
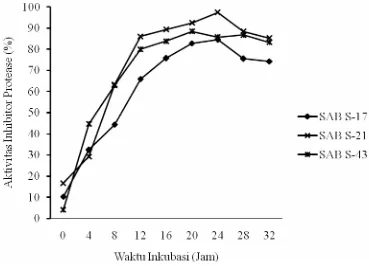
Ekstrak Kasar 10.29 32.43 44.44 65.96 75.71 82.86 84.51 75.52 74.29
SAB S-17
Subtilisin 3.06 11.17 14.65 14.59 15.33 37.63 35.31 27.79 13.28
Proteinase K 15.68 39.91 55.20 70.39 76.44 84.85 70.51 66.92 29.09
Ekstrak Kasar 16.67 29.27 63.44 86.09 89.32 92.50 97.39 88.46 85.34
SAB S-21
Subtilisin 1.15 23.42 38.08 43.97 54.46 64.74 24.82 16.34 15.79
Proteinase K 23.02 50.36 65.72 74.87 55.07 41.90 40.82 35.26 32.51
Ekstrak Kasar 4.17 44.62 62.93 80.00 83.88 88.44 85.79 86.74 83.25
SAB S-43
Subtilisin 6.69 9.49 14.44 21.11 41.93 48.72 42.30 23.19 23.80
21
Gambar 4 Aktivitas inhibitor terhadap substrat ekstrak kasar protease bakteri patogen selama waktu inkubasi 32 jam pada suhu 30oC.
Suhu
Uji ini dilakukan untuk mengetahui suhu optimum dari aktivitas inhibitor protease terhadap susbtrat proteinase K, ekstrak kasar dari bakteri patogen, dan subtilisin (Tabel 5). Hal yang menarik terlihat dari hasil uji aktivitas inhibitor protease dengan menggunakan substrat proteinase K, dimana aktivitas inhibitor protease terbesar terjadi pada suhu 60oC (suhu tinggi). Fenomena tersebut terjadi pada isolat SAB S-17 dengan aktivitas 71,8% (Gambar 6).
Isolat SAB S-21 menunjukkan aktivitas inhibitor protease tertinggi (97,78%) terhadap substrat ekstrak kasar setelah diinkubasi pada suhu 20oC. Hal yang sama juga ditunjukkan oleh isolat SAB S-17 (96,3%), namun pada suhu inkubasi 30oC. Juga pada isolat SAB S-43 (91,3%) setelah diinkubasi pada suhu 30oC (Gambar 7). Sedangkan untuk substrat subtilisin seluruh isolat memiliki aktivitas inhibitor protease terbesar pada suhu 30oC (Gambar 8).
Tabel 5 Aktivitas inhibitor protease (%) pada berbagai suhu
Aktivitas inhibitor protese (%) pada suhu (oC) Isolat Substrat
Isolat SAB S-21 paling baik dalam menghambat substrat subtilisin (86,75%) dengan suhu inkubasi 30oC, sedangkan untuk substrat proteinase K ditunjukkan oleh isolat SAB S-43 (79,91%) setelah diinkubasi pada suhu 30oC. Selain itu, isolat SAB S-43 menunjukkan peningkatan aktivitas inhibitor protease yang sangat tajam pada suhu 20oC hingga suhu 30oC (74%, 79,91%).
23
Gambar 6 Aktivitas inhibitor protease pada berbagai suhu terhadap substrat proteinase K
Gambar 8 Aktivitas inhibitor protease pada berbagai suhu terhadap substrat subtilisin
pH
Aktivitas inhibitor protease pada ketiga substrat dengan tiga isolat sangat dipengaruhi oleh pH (Tabel 6). Hal ini terbukti bahwa isolat SAB S-17 memiliki aktivitas inhibitor protease terbesar terhadap ketiga jenis substrat pada lingkungan yang cenderung asam, bahkan untuk substrat subtilisin aktivitas inhibitor protease
terbesar terjadi pada pH 4, dan berangsur berkurang seiring dengan kenaikan pH.
Tabel 6 Aktivitas inhibitor protease (%) pada berbagai pH
Aktivitas inhibitor protease (%) pada pH
Isolat Substrat
3 4 5 6 7 8 9 10 11 12
Proteinase K 60.93 68.3 78.26 98.6 98.94 91.72 74.05 73.2 58.64 55.68
Ekstrak Kasar 58.57 77.78 84.4 85.71 73.83 58.33 54.55 52.94 50.67 50.54 SAB S-17
Subtilisin 66.98 93.33 68.89 66.35 51.11 41.91 36.51 30.16 29.84 28.25
Proteinase K 78.19 98.91 99.33 99.07 95.75 97.24 92.58 90.85 88.46 88.8
Ekstrak Kasar 7.58 41.67 62.5 75 92.86 96.67 69.77 60 58.06 53.25
SAB S-21
Subtilisin 31.75 33.65 50.79 73.97 98.41 86.67 82.22 75.87 62.22 53.02
Proteinase K 64.56 69.4 80.6 90.66 89.37 82.07 74.05 72.54 71.14 67.33
Ekstrak Kasar 66.07 68 73.45 93.5 92.65 86.05 85.44 78.73 56.21 50
SAB S-43
25
Pada kondisi penentuan pH optimum dalam berbagai kisaran pH, ketiga
isolat mampu menghasilkan inhibitor protease yang tinggi terhadap substrat proteinase K (Gambar 9). Isolat SAB S-21 memiliki aktivitas tinggi (96,67%) dalam menghambat ekstrak kasar dari bakteri patogen EPEC K11 pada pH 8. Begitu juga pada Isolat SAB S-17 dan Isolat SAB S-43 memiliki aktivitas inhibitor protease tinggi dalam menghambat ekstrak kasar dari bakteri patogen P. aeruginosa dan S. aureus pada pH optimum 6 (Gambar 10).
Isolat SAB S-21 juga memiliki aktivitas inhibitor protease tertinggi dalam menghambat substrat subtilisin sebesar 98,41% pada pH optimum 7 (Gambar 11). Isolat SAB S-21 paling baik dalam menghambat substrat baik proteinase K maupun subtilisin jika dibandingkan dengan isolat lainnya pada kondisi pH 5 dan 7. Kisaran pH optimum pada ketiga isolat yang berasosiasi dengan spons Jaspis sp. dalam menghasilkan aktivitas inhibitor protease cukup luas yaitu dari pH 4 sampai 8. Nilai aktivitas inhibitor protease yang dihasilkan oleh ketiga isolat terhadap ketiga substrat dalam kisaran yang sama yaitu lebih dari 85%.
Gambar 10 Aktivitas inhibitor protease pada berbagai pH terhadap substrat ekstrak kasar protease bakteri patogen
27
Identifikasi Bakteri Penghasil Inhibitor Protease
Tiga isolat yang berpotensi menghasilkan senyawa inhibitor protease diidentifikasi secara fisiologi yaitu dari pewarnaan Gram, uji katalase, pewarnaan spora, dan uji biokimia (Tabel 7).
Tabel 7 Karakteristik fisiologi dan morfologi bakteri penghasil inhibitor protease yang berasosiasi dengan spons Jaspis sp.
Kode Isolat
Bentuk Batang Batang Batang
Warna Koloni Orange Putih Putih
Lisin - - -
Isolat yang termasuk bakteri gram negatif diidentifikasi secara biokimiawi
dengan menggunakan Kit Microbact dan hasilnya menunjukkan bahwa isolat SAB S-17 termasuk Enterobacter agglomerans dengan keakuratan 39,89% artinya isolat SAB S-17 homologi dengan Enterobacter agglomerans dengan identitas sebesar 39,89%. Dapat diketahui bahwa tiga isolat yang berpotensi sebagai penghasil inhibitor protease memiliki karakteristik yang beragam, ada satu isolat yang termasuk bakteri gram negatif (SAB S-17) dan dua isolat termasuk bakteri gram positif (SAB S-21, dan SAB S-43). Kedua bakteri gram positif ini juga diketahui menghasilkan endospora, serta memiliki kemampuan menghasilkan enzim katalase yang berperan dalam mendegradasi hidrogen peroksida.
Identifikasi Isolat Terpilih dengan Analisis Gen 16S rRNA
Hasil analisis gen 16S rRNA dari ketiga isolat terpilih diawali dengan amplifikasi gen 16S rRNA dengan PCR. Dari hasil amplifikasi gen 16S rRNA dengan PCR diperoleh pita DNA spesifik berukuran 1300 pasang basa (pb) pada masing-masing isolat (Gambar 12).
Gambar 12 Gel elektroforesis gen 16S rRNA (1300 pb) dari tiga isolat yang berpotensi sebagai penghasil inhibitor protease.
29
Hasil sekuen dari gen 16S rRNA (Lampiran 4) dari tiap isolat kemudian
dianalisis dengan metode BLASTN terhadap data GenBank. Hal ini diperlukan untuk memperoleh data homologi tiap isolat terhadap data GenBank (Tabel 8).
Tabel 8 Hasil analisis BLASTN ketiga isolat terpilih terhadap data GenBank
Isolat Homolog dengan Identitas Nomor Akses SAB S-17 Paracoccus sp. Jx9 86% FJ539115 SAB S-21 Bacillus pumilus
strain 210_50
100% GQ199752
SAB S-43 Bacillus subtilis strain DURCK11
98% FJ430065
Analisis Pohon Filogenetik
Sekuen gen 16S-rRNA ketiga isolat terpilih kemudian digunakan untuk pembuatan pohon filogenetika menggunakan program TreeCon (Gambar 13).
dari perairan Pulau Raja Ampat (Papua) diperoleh 136 isolat dengan bentuk dan warna koloni yang berbeda-beda, tiga isolat diantaranya menunjukkan potensi yang cukup tinggi sebagai penghasil inhibitor protease. Dari hasil penelitian dapat dianalisa bahwa bakteri patogen yang menghasilkan protease mampu dihambat kemampuan proteolitiknya oleh bakteri yang berasosiasi dengan spons Jaspis sp. Hal ini diduga karena bakteri laut memiliki senyawa inhibitor protease yang mekanisme kerjanya menghambat pembentukan zona protease atau mengurangi zona protease dibandingkan dengan kontrol.
Ketiga isolat yang menghasilkan inhibitor protease adalah yang mampu menghambat bakteri patogen (P. aeruginosa, S. aureus, dan EPEC K11) untuk mendegradasi protein (skim). Bukti ini ditandai dengan tidak adanya zona protease atau berkurangnya zona protease disekitar bakteri tersebut dibandingkan
dengan kontrol, pada medium yang mengandung protein (skim). Isolat SAB S-17 mampu menghambat protease bakteri S. aureus sebesar 55,5%, isolat SAB S-43 mampu menghambat protease bakteri P. aeruginosa sebesar 62,5%, dan isolat SAB S-21 mampu menghambat protease bakteri EPEC K11 sebesar 100%.
Hasil waktu produksi protease dari beberapa bakteri patogen (Tabel 3) menunjukkan bahwa ketiga bakteri patogen yaitu: P. aeruginosa mampu mensekresikan protease ekstraseluler pada fase stasioner. S. aureus dan EPEC K11 menghasilkan protease pada saat pertumbuhan bakteri menjelang stasioner. Penelitian tentang produksi optimum protease ini juga dilakukan oleh Fawzya (2002) menunjukkan bahwa bakteri asal ikan hiu (Carcharhinus limbatus) menghasikan protease optimal pada jam ke 24 fase stasioner. Protease yang dihasilkan oleh bakteri pada fase stasioner sebagai mekanisme pertahanan diri terhadap inang.
31
menghasilkan inhibitor protease bakteri patogen E. coli, S. aureus, dan P.
aeruginosa pada waktu inkubasi masing-masing 24, 20 dan 12 jam. Kondisi yang sama dapat dilihat pada Serratia marcescens yang mempunyai aktivitas inhibitor ekstraseluler tertinggi pada jam ke-18, dan aktivitas inhibitor intraseluler pada jam ke-12 (Kim et al. 1995). Begitu pula dengan hasil penelitian yang dilakukan oleh Murao et al. (1982), aktivitas inhibitor tertinggi yang dihasilkan oleh Streptomyces rishiensis adalah pada jam ke 24-36, yaitu pada fase menjelang stasioner. Hasil penelitian terhadap Monascus purpureus menunjukkan aktivitas inhibitor tertinggi pada hari ke-7 sampai ke-10, yaitu pada fase stasioner (Saruno et al. 1981). Beberapa hasil penelitian yang lain menunjukkan hasil yang sama, seperti yang dilakukan oleh Imada et al. (1985a, b). Alteromonas sp. menghasilkan inhibitor marinostatin dengan aktivitas tertinggi pada jam ke-18 sampai ke-36 (Imada et al. 1985b).
Isolat SAB S-21 merupakan isolat yang paling baik dalam menghasilkan inhibitor protease terhadap ketiga substrat. Isolat SAB S-21 mampu menghambat pembentukan protease bakteri patogen pada manusia penyebab diare yaitu EPEC K11. Sedangkan, isolat SAB S-43 mampu menghambat pembentukkan protease pada bakteri P. aeruginosa, dan isolat SAB S-17 mampu menghambat protease yang dihasilkan oleh bakteri S. aureus. Mekanisme kerjanya dengan cara menghambat pembentukan protease ekstraseluler yang diseksresikan oleh bakteri patogen. Proses penghambatan itu bisa berupa mengurangi produktivitas enzim protease yang dihasilkan oleh bakteri patogen dengan cara mencegah substrat
untuk memasuki tempat aktif. Bisa juga berupa menghambat reaksi enzimatik dengan cara berikatan pada bagian lain pada enzim itu (Campbell et al. 1999). Selain itu, kondisi suhu dan pH juga mempengaruhi aktivitas inhibitor protease. Inhibitor protease memiliki aktivitas maksimum pada suhu tertentu, aktivitasnya akan meningkat seiring dengan peningkatan suhu hingga mencapai suhu optimum. Setelah itu kenaikan suhu lebih lanjut akan menyebabkan aktivitasnya menurun.
ini juga terjadi pada Achanthamoeba lugdunensis KA/ E2 berpotensi
menghasilkan inhibitor protease serin yang stabil pada kondisi suhu 40oC sampai 60oC (Kim et al. 2003). Terjadinya aktivitas inhibitor protease pada suhu tinggi karena proteinase K merupakan protease serin yang stabil pada kondisi suhu 40oC sampai 60oC.
Fenomena menarik juga terjadi pada isolat SAB S-21 yang memiliki aktivitas inhibitor protease terhadap ekstrak kasar meningkat sangat tajam pada suhu 10oC sampai dengan suhu 30oC (Gambar 8). Sesuai dengan Lee et al. 2000 yaitu bakteri laut Pseudoalteromonas sp. strain A28 memiliki suhu optimumnya pada 30oC. Selain itu pada bakteri laut Pseudoalteromonas sagamiensis penghasil inhibitor protease memiliki suhu optimum pada 27oC (Kobayashi et al. 2003). Kondisi ini juga terjadi pada Pseudoalteromonas (Alteromonas) yaitu bakteri laut yang hidup bebas dengan plankton dan dapat beradaptasi pada kisaran suhu 10oC sampai 30oC (Corpe 1970).
Ketiga isolat memiliki aktivitas inhibitor protease pada kondisi suhu 10oC dalam menghambat substrat subtilisin. Demikian juga pada kondisi ekstrak kasar sebagai substrat, ketiga isolat menghasilkan aktivitas inhibitor protease cukup tinggi pada suhu 10oC. Aktivitas tersebut akan menurun pada suhu 50oC sampai 70oC karena terjadi denaturasi enzim. Scopes (1987) menyatakan bahwa inhibitor protease yang mengalami perubahan konformasi akan menyebabkan turunnya aktivitas. Disamping itu ada kemungkinan terjadi pemutusan ikatan-ikatan di dalamnya yang menyebabkan inhibitor tersebut tidak stabil pada suhu yang sedikit
tinggi diatas suhu optimumnya.
Kisaran suhu optimum yang diperoleh oleh ketiga isolat yaitu 30oC sampai 60oC membuktikan bahwa kondisi aktifnya inhibitor protease dalam menghambat mekanisme pembentukan protease oleh bakteri patogen berada pada kisaran suhu tersebut. Sedangkan pada suhu tinggi yaitu 70oC aktivitasnya menurun, hal ini karena enzim akan terdenaturasi pada kondisi suhu panas yang mengakibatkan rusaknya struktur, sehingga tidak ada penghambatan atau sedikit penghambatannya (Fujiwara & Yamamoto 1987).
33
dengan proteinase K sebagai substratnya. Hasil yang diperoleh tersebut tidak
berbeda jauh dengan yang dilakukan oleh Wee et al. 2000 yaitu ditunjukkan oleh bakteri Photorhabdus luminescens yang menghasilkan inhibitor protease stabil pada pH 3,5 sampai 11 dengan substrat termolisin, subtilisin, proteinase A dan lain-lain. Untuk kedua isolat lainnya memiliki aktivitas inhibitor protease berada pada pH 6 terhadap substrat proteinase K. Proteinase K termasuk kelompok serin protease, dimana serin protease memiliki kisaran pH untuk proteinase K yaitu pH 7,5 sampai 12, jadi isolat SAB S-21 masih menghasilkan aktivitas inhibitor protease pada kondisi pH 12 terhadap substrat proteinase K.
Sedangkan pada subtilisin sebagai substratnya isolat SAB S-21 memiliki aktivitas inhibitor protease tertinggi (98.41%) pada pH 7. Untuk isolat SAB S-43 pada pH 6 dan isolat SAB S-17 pada pH 4. Hal ini sesuai penelitian yang diakukan oleh Hoffman et al. 2000 dari bakteri laut Pseudoalteromonas atlantica yang memiiki aktivitas tinggi pada pH 4,4 sampai 10,5. Kisaran pH yang diperoleh oleh ketiga isolat tersebut dalam menghasilkan aktivitas inhibitor protease tertingginya pada pH 4 sampai 7, namun ada yang masih tinggi aktivitasnya pada pH 9 untuk isolat SAB S-43. Hasil tersebut sesuai dengan Imada et al. 1986 yang menghasilkan subtilisin inhibitor peptida yang diisolasi dari bakteri Alteromonas sp. yang berasosiasi dengan spons memiliki kisaran pH 4 sampai 7 dan kurang stabil pada pH 10.
Pada uji pH ini menggunakan bufer yang berguna dalam mencegah perubahan radikal pH dengan penambahan larutan asam lain atau larutan basa
Hasil amplifikasi gen 16S rRNA dari ketiga isolat yang diuji menghasilkan
SIMPULAN
Dari penelitian ini, berhasil diisolasi 136 isolat bakteri yang bersimbiosis dengan spons Jaspis sp. baik dari bagian permukaan maupun endofit. Bakteri tersebut memiliki kemampuan dalam penghambatan (kuantitatif % penghambatan) protease terhadap bakteri patogen yaitu P. aeruginosa, S. aureus, dan EPEC K11. Berdasarkan uji fisiologis dan biokimiawi bahwa bakteri potensial terpilih yang mampu menghasilkan inhibitor protease termasuk ke dalam kelompok bakteri gram negatif (isolat SAB S-17) dan bakteri gram positif (SAB S-21 dan SAB S-43). Aktivitas inhibitor protease tertinggi diperoleh oleh isolat SAB S-21 pada waktu inkubasi selama 20 jam untuk proteinase K (84,85%) dan selama 24 jam untuk substrat ekstrak kasar dari bakteri patogen (97,39%), dan untuk substrat subtilisin yaitu selama 20 jam (64,74%). Ketiga isolat yang diuji menghasilkan aktivitas inhibitor protease tertinggi pada kisaran suhu optimum yaitu 30oC terhadap ketiga substrat (proteinase K, substrat ekstrak kasar, dan subtilisin). pH optimum yang diperoleh ketiga isolat ini berada pada kisaran pH 4-8 terhadap ketiga substrat. Berdasarkan hasil sekuen dan analisis
pohon filogenetika isolat SAB S-17 homolog dengan bakteri Paracoccus sp. Jx9 sebesar 86%, isolat SAB S-21 homolog dengan bakteri Bacillus pumilus strain 210_50 sebesar 100%, dan isolat SAB S-43 homolog dengan bakteri Bacilus subtilis strain DURCK11 sebesar 98%.
SARAN
from a new genus and species of Australian sponge of the family Dysideidae. Am Chem Soc 45:13340-13341.
Barret AJ, Rawling ND, Woessner JF. 2003. The Handbook of Proteolityc Enzymes. Ed 2nd. Academic Press.
Begum et al. 2007. Characterization of an intracellular protease from Pseudomonas aeruginosa. J Med Sci 23:227-232.
Bisswanger H. 2002. Enzyme Kinetics Principles and Methods. Weinheim: Wiley-VCH.
Bode W dan Huber R. 1992. Natural protein proteinase inhibitors and their interaction with proteinases. Eur J Biochem 204:433–451.
Bottone EJ dan Peluso RW. 2002. Production by Bacillus pumilus (MSH) of an antifungal compound that is active against Mucoraceae and Aspergillus species: preliminary report. J Med Mic 52:69-74.
Campbell NA, Reece JB, Mitchel LG. 1999. Biologi. Jakarta: Erlangga.
Cappucino JG dan Shermna N. 1983. Microbiology: A laboratory manual. New York: Addison-Wesley Publishing Company.
Demuth HU. 1990. Recent developments in inhibiting cysteine and serine proteases. J Enzyme Inhib 3:249–278.
Dick WA, Cheng L, Wang P. 2000. Soil acid and alkaline phosphatase activity as pH adjustment indicators. Soil Biol Biochem 32:1915-1919.
Ebeling W. 1974. Proteinase K from Tritrachium album Linder. Eur J Biochem 47: 91.
Elyakov GB, Kuznetsova TA, Stonik VA, Mikhailov VV. 1994. New trends of marine biotechnology development. Pure Appl Chem 4:811-818.
Fawzya YN. 2002. Karakterisasi protease ekstraseluler dari isolat bakteri asal ikan hiu (Carcharhinus limbatus). Tesis. Program Pascasarjana Institut Pertanian Bogor.
Feltzer RE, Trent JO, Gray RD. 2003. Alkaline proteinase inhibitor of Pseudomonas aeruginosa. Biol Chem 28:25952-25957.
37
Fujiwara N dan Yamamoto K. 1987. Production of alkaline protease in low cost medium by alkalophilic Bacillus sp. and properties of the enzyme. J Ferment Technol 3:345-348.
Hammond JBW, Kruger J. 1988. The Bradford method for protein quantitation. Di dalam Walker JM, editor. The Protein Protocols Handbook. Ed2nd . New Baersey: Humana Press.hlm 15-21.
Hentschel et al. 2001. Isolation and phylogenetic analysis of bacteria with antimicrobial activities from the Mediterranean sponss Aplysina aerophoba and Aplysina cavernicola. FEMS Microbiol Ecol 35:305-312.
Hoffman M dan Decho WA. 2000. Proteolityc enzyme in the marine bacterium Pseudoateromonas atlantica: post-secretional activation an effects of environmental conditions. Aquatic Mic Ecol 23: 29-39.
Imada C, Simidu U, Taga N. 1985a. Isolation and characterization of marine bacteria producing alkaline protease inhibitor. Bull Jap Soc Sci Fish 51:799-803.
Imada C, Simidu U, Taga N. 1985b. Purification and characterization of the protease inhibitor “monostatin” from a marine Alteromonas sp. with reference to inhibitor of the protease produced by a bacterium pathogenic to fish. Bull Jap Soc Sci Fish 31:1089-1094.
Imada C, Taga N, Maeda M. 1985c. Cultivation conditions for subtilisin inhibitor-producing bacterium and general properties of the inhibitor “marinostatin”. Bull Jap Soc Sci Fish 51:805-810.
Imada C, Hara S, Maeda M, dan Simidu U. 1986a. Amino acid sequences of marinostatins C-1 and C-2 from marine Alteromonas sp. Bull Jap Soc Sci Fish 52:1455–1459.
Imada C, Maeda M, Hara S, Taga N, dan Simidu U. 1986b. Purification and characterization of subtilisin inhibitors ‘‘marinostatin’’produced by marine Alteromonas sp. J Appl Bacteriol 60:469–476.
Imada C. 2004. Enzyme inhibitors of marine microbial origin with pharmaceutical importance. Mar Biotechnol 6:193-198.
Isshiki et al. 1998. TMC-52 A to D, novel cysteine proteinase inhibitors, produced by Gliocladium sp. Antibiotics 51:629-634.
Isshihara M, Atta K, Tawata S, Toyama S. 1999. Purification and characterization of intracelluler cystein protease inhibitor from Chlorella sp. Food Sci Tech 5: 210-213.
Kim HK, Young RH, Yu SH, Chung DI. 2003. Purification and characterization of a 33 kDa serine protease from Acanthamoeba lugdunensis KA/E2 isolated from a Korean keratitis patient. J Parasitol 41: 189-196.
Kobayashi et al. 2003. Pseudoalteromonas sagamiensis sp. Nov. a marine bacterium that produces protease inhibitors. Syst Evol Microbiol 53:1807-1811.
Kobori H, dan Taga N. 1980. Extracellular alkaline phosphatase from marine bacteria: purification and properties of extracellular phosphatase from a marine Pseudomonas sp. Can J Microbiol 26:833–838.
Lee et al. 2000. Involvement of an extracellular protease in algicidal activity of the marine bacterium Pseudoalteromonas sp. Strain A28. J Environ Microbiol 66: 4334-4339.
Lee YK, Lee JH, Lee HK. 2001. Microbial symbiosis in marine sponges. Microbiol 30:254-264.
Marangoni AG. 2003. Enzyme Kinetics and Modern Approach. New Jersey: Willey Interscience.
Marchesi et al. 1998. Design and evaluation of useful bacterium specific PCR primers that amplify genes coding for bacterial 16S-rRNA. Appl Environ Microbiol 64:795-799.
Munro et al. 1999. The discovery and development of marine compounds with pharmaceutical potential. Biotechnology 70:15-25.
Murao S, Kasai N, Kimura Y, Oda K. 1982. Isolation of metalloproteinase inhibitor (FMPI) producing microorganism. Agric Biol Biochem 46:2697-2703.
Nurhayati T, Suhartono MT, Nuraida L, Poerwanto BS. 2006. Preliminary characterization of protease inhibitor from bacteria-associated with sponge from Panggang Island, Seribu Islands. Hayati 13: 58-64.
Nurhayati T, Suhartono MT, Suptijah P, Febrian I. 2004. Screening inhibitor protease dari sponge, Kepulauan Seribu. Bul THP 7:72-83.
Osclarit JM. 1994. Anti-bacillus substance in the marine sponge, Hyatella species, produced by an associated Vibrio species bacterium. Microbiology 78:7-16.
Proksch P, Edrada RA, Ebel R. 2002. Drugs from the seas - current status and microbiological implications. Appl Environ Microbiol 59:125-134.
Saruno R, Setoyama T, Nakashima C, Kato F, Murata A. 1981. Purification and some properties of nuclease inhibitor from Monascus purpureus. Agric Biol Chem 45:133-139.
39
Scopes RK. 1987. Protein Purification, Principles and Practice. Ed Ke-2. New York: Springer-Verlag.
Stierle AC, Cardellina II JH, Singleton FL. 1988. A marine Micrococcus produces metabolites ascribed to the sponge Tedania ignis. Experientia 44:1021.
Tsushima et al. 1992. Candida albicans produces a cystatin type cysteine proteinase inhibitor. J Bacteriol 174: 4807-4810.
Van de Peer Y, De Wachter R. 1993. TREECON: a software package for the construction and drawing of evolutionary trees, copmut. Appl Biosci 9:177-182.
Walter HE. 1984. Proteinases (Protein as Substrates). method with haemoglobin,
casein, and azocoll as substrate. Di dalam Bergmeyer, Graβ1 M, editor. Methods of Enzymatic Analysis. 3rd ed. Weinheim:Verlag Chemie.
Wee EK, Christoper R, Yonan, Chang FN. 2000. A new broad-spectrum protease inhibitor from the entomopathogenic bacterium Photorhabdus luminescens. Microbiology 146: 3141-3147.
Lampiran 1 Komposisi Media
Media SWC (Sea Water Complete) untuk 1100 mL
Bacto Pepton 5,5 gr Yeast Extract 1,1 gr Gliserol 3,3 gr Air Laut steril 825 mL Aquades 275 mL
Agar 16,5 gr
Komposisi PBS (Phosphate Bufer Saline) untuk 500 mL
NaCl 4 gr
KH2PO4 0,1 gr Na2PO4 0,75 gr
KCL 0,1 gr
41
Lampiran 2 Kurva Standar Penentuan Konsentrasi Protein Menurut Metode Bradford
Tabel 9 Konsentrasi protein menurut Metode Bradford
Konsentrasi BSA (mg/ml)
Volume BSA (ml)
Volume Akuades (ml)
0.01 0.06 9.94
0.02 0.1 9.9
0.03 0.15 9.85
0.04 0.2 9.8
0.06 0.3 9.7
0.08 0.4 9.6
0.1 0.6 9.4
0.2 1 9
0.3 1.5 8.5
Kurva standar penentuan konsentrasi protein menggunakan proteinase K
Kurva standar aktivitas protease oleh bakteri Pseudomonas aeruginosa
Kurva Standar aktivitas protease oleh bakteri EPEC K11
Kurva Standar aktivitas protease oleh bakteri S. aureus
43
(A)
(B)
(C)