i
KONEKTIVITAS KOMUNITAS MAKROZOOBENTOS ANTARA
HABITAT MANGROVE, LAMUN DAN TERUMBU KARANG DI
PULAU PRAMUKA, KEPULAUAN SERIBU, PROVINSI DKI
JAKARTA
NINA WULANSARI
SKRIPSI
DEPARTEMEN MANAJEMEN SUMBERDAYA PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
ii
PERNYATAAN MENGENAI SKRIPSI
DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa skripsi yang berjudul :
“Konektivitas Komunitas Makrozoobentos antara Habitat Mangrove, Lamun
dan Terumbu Karang di Pulau Pramuka, Kepulauan Seribu, Provinsi DKI
Jakarta”
adalah benar merupakan hasil karya dan belum pernah diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Semua sumber data dan informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, Februari 2012
iii
RINGKASAN
Nina Wulansari. C24070015. Konektivitas Komunitas Makrozoobentos antara Habitat Mangrove, Lamun dan Terumbu Karang di Pulau Pramuka, Kepulauan Seribu, Provinsi DKI Jakarta. Di bawah bimbingan Isdradjad Setyobudiandi dan Am Azbas Taurusman.
Pada Pulau Pramuka terdapat tiga habitat utama di wilayah pesisir yaitu habitat mangrove, lamun dan terumbu karang. Ketiga habitat tersebut merupakan suatu ekosistem yang saling berinteraksi satu sama lain dan membentuk suatu konektivitas ekologi untuk mendukung biota didalamnya. Proses interaksi yang terjadi melibatkan komponen biotik dan abiotik dan salah satu komponen biotik adalah makrozoobentos. Oleh karena itu diadakan penelitian yang bertujuan untuk mengetahui konektivitas komunitas makrozoobentos antara ketiga habitat tersebut di Pulau Pramuka secara temporal. Manfaat dari penelitian ini diharapkan menjadi masukan dalam pengelolaan habitat mangrove, lamun dan terumbu karang dengan memanfaatkan informasi ilmiah mengenai status makrozoobentos sebagai salah satu indikator kualitas lingkungan perairan pesisir.
Penelitian dilakukan pada bulan September 2010 mewakili musim kemarau dan bulan Januari 2011 mewakili musim hujan di sebelah timur Pulau Pramuka, Kepulauan Seribu, DKI Jakarta. Lokasi dibagi menjadi tiga transek garis dengan posisi tegak lurus pantai. Setiap transek ditentukan 8 titik pengamatan, yaitu pada transek garis A (350 m), B (250 m), dan C (0 m), sehingga terdapat 24 stasiun pengamatan yang dikelompokkan berdasarkan habitat dari garis pantai sebanyak tiga ulangan pada setiap stasiun. Pengambilan contoh makrozoobentos menggunakan corer dengan luas unit pengambilan contoh sebesar 0,0081 m2. Penyaringan contoh makrozoobentos dilakukan dengan saringan halus (pore size 0,5 mm2). Analisis struktur komunitas makrozoobentos dibantu dengan perangkat lunak PRIMER ver. 5.2 dan Ms. Excel 2007.
Makrozoobentos yang ditemukan di Pulau Pramuka pada bulan September 2010 dan Januari 2011 terdiri dari 5 filum, 7 kelas, 65 genus, dan 70 spesies. Persentase jumlah spesies terbesar berasal dari kelas Polychaeta, dengan spesies yang mendominasi di habitat mangrove, lamun dan terumbu karang adalah Notomastus latericeus. Habitat terumbu karang memiliki biomassa, indeks keanekaragaman, dan indeks keseragaman yang lebih tinggi dibandingkan habitat lainnya, namun untuk kepadatan makrozoobentos tertinggi ditemukan pada habitat mangrove, sementara jumlah spesies makrozoobentos tertinggi terdapat pada habitat lamun. Jumlah spesies, kepadatan dan biomassa makrozoobentos pada bulan September 2010 lebih besar daripada bulan Januari 2011. Hal ini diduga disebabkan oleh kondisi curah hujan yang berbeda pada kedua bulan tersebut.
iv
KONEKTIVITAS KOMUNITAS MAKROZOOBENTOS ANTARA
HABITAT MANGROVE, LAMUN DAN TERUMBU KARANG DI
PULAU PRAMUKA, KEPULAUAN SERIBU, PROVINSI DKI
JAKARTA
NINA WULANSARI C24070015
SKRIPSI
Sebagai salah satu syarat untuk memperoleh
gelar Sarjana Perikanan pada Fakultas Perikanan dan Ilmu Kelautan
DEPARTEMEN MANAJEMEN SUMBERDAYA PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
v
PENGESAHAN SKRIPSI
Judul Skripsi : Konektivitas Komunitas Makrozoobentos antara Habitat Mangrove, Lamun dan Terumbu Karang di Pulau Pramuka, Kepulauan Seribu, Provinsi DKI Jakarta.
Nama Mahasiswa : Nina Wulansari
NIM : C24070015
Program Studi : Manajemen Sumberdaya Perairan
Menyetujui, Komisi Pembimbing
Mengetahui,
Tanggal Ujian : 31 Januari 2012 Pembimbing I
Dr. Ir. Isdradjad Setyobudiandi, M. Sc NIP. 19580705 198504 1 001
Pembimbing II
Dr. Am Azbas Taurusman, S. Pi, M. Si NIP. 19730510 200501 1 001
Ketua Departemen Manajemen Sumberdaya Perairan
vi
PRAKATA
Puji dan syukur penulis panjatkan kehadirat Allah SWT, karena berkat rahmat dan karunia-Nya penulis dapat menyelesaikan skripsi yang berjudul Konektivitas Komunitas Makrozoobentos antara Habitat Mangrove, Lamun dan Terumbu
Karang di Pulau Pramuka, Kepulauan Seribu, Provinsi DKI Jakarta; disusun berdasarkan hasil penelitian yang dilaksanakan pada September 2010 dan Januari 2011. Penulisan skripsi ini merupakan salah satu syarat untuk memperoleh gelar Sarjana Perikanan di Departemen Manajemen Sumberdaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Penulis menyadari bahwa skripsi ini masih jauh dari kesempurnaan. Oleh karena itu, penulis mengharapkan kritik dan saran yang bersifat membangun demi kesempurnaan penulisan skripsi ini. Semoga skripsi ini dapat memberikan manfaat bagi ilmu pengetahuan dan dapat menjadi bahan rujukan bagi peneliti dan mahasiswa untuk melakukan penulisan lebih lanjut.
Bogor, Februari 2012
vii
UCAPAN TERIMA KASIH
Pada kesempatan ini, penulis ingin mengucapkan terima kasih yang sebesar-besarnya kepada :
1. Dr. Ir. Isdradjad Setyobudiandi, M.Sc selaku ketua komisi pembimbing yang telah banyak memberikan bimbingan, motivasi, masukan dan saran selama pelaksanaan penelitian dan penyusunan skripsi ini.
2. Dr. Am Azbas Taurusman, S. Pi, M. Si selaku anggota komisi pembimbing yang telah banyak memberikan bimbingan, motivasi, masukan dan saran selama pelaksanaan penelitian dan penyusunan skripsi ini.
3. Dr. Ir. Sigid Hariyadi, M. Sc selaku dosen penguji, atas masukan dan kritik yang diberikan dalam penyusunan skripsi ini hingga menjadi lebih baik.
4. Dr. Ir. Luky Adrianto, M. Si selaku pembimbing akademik yang telah membimbing serta memberi nasehat dan motivasi.
5. Ir. Agustinus M Samosir, M. Phil, selaku ketua Komisi Pendidikan S1 Departemen MSP atas masukan dan kritik yang diberikan.
6. Kedua orang tua tercinta (Mama dan Papa) dan adik-adik penulis (Nila dan Andika) atas segala doa, motivasi, dan dukungannya baik moril maupun materiil. 7. PKSPL-IPB (khususnya Dr. Ir. Ario Damar, M. Si sebagai ketua program rehabilitasi kawasan pesisir Kepulauan Seribu dan Arief Trihandoyo, ST) atas bantuan tenaga, peralatan dan finansial selama penelitian ini berlangsung.
8. Ibu Siti Nursiyamah selaku staf Lab. Biologi Mikro I yang telah banyak membantu selama proses identifikasi hingga terselesaikan dengan lancar.
9. Tim Lamun (Hana dan Riesna Apramilda), Austin Efflin, Satya N Hutagaol, Arif Baswantara, atas kerjasama dan motivasinya selama penelitian dan penyusunan skripsi ini berlangsung.
10.Seluruh civitas MSP, terutama MSP 44 atas perhatian dan nasehatnya kepada penulis.
viii
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta, 20 September 1989 dari pasangan Bapak Purnomo dan Ibu Sri Sulastri. Penulis merupakan anak pertama dari tiga bersaudara. Pendidikan formal yang telah ditempuh antara lain diawali dari TK Kasih Ananda VII Jakarta (1995) kemudian SDS Bakti Mulya 400 Pondok Indah Jakarta Selatan (2001). Penulis melanjutkan pendidikan formal di SMPN 177 Jakarta (2004) dan SMAN 47 Tanah Kusir Jakarta Selatan (2007). Pada tahun 2007, penulis lulus seleksi masuk ke perguruan tinggi yaitu Institut Pertanian Bogor melalui jalur USMI (Undangan Seleksi Masuk IPB) di Departemen Manajemen Sumberdaya Perairan, Fakultas Perikanan dan Ilmu Kelautan.
Selama mengikuti perkuliahan, penulis aktif sebagai anggota Badan Eksekutif Mahasiswa (BEM) Tingkat Persiapan Bersama sebagai staf Pengembangan Minat dan Bakat (2008), kemudian pada tahun 2009 penulis aktif sebagai Sekretaris Departemen Pengembangan Budaya, Olahraga dan Seni dan pada tahun 2010 sebagai Sekretaris Umum I BEM Fakultas Perikanan dan Ilmu Kelautan. Pada tahun 2011 penulis aktif sebagai staf Kementerian Budaya, Olahraga dan Seni BEM Keluarga Mahasiswa IPB Bersahabat, serta aktif mengikuti berbagai macam seminar, pelatihan, PKM GT (Program Kreativitas Mahasiswa Gagasan Tertulis) dan kepanitiaan di lingkungan dalam maupun luar kampus IPB. Selain itu, penulis berkesempatan menjadi asisten mata kuliah Iktiologi (2008/2009) dan Biologi Perikanan (2009/2010 dan 2010/2011).
Sebagai salah satu syarat untuk memperoleh gelar Sarjana pada Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor, penulis menyusun skripsi dengan judul “Konektivitas Komunitas Makrozoobentos antara Habitat Mangrove, Lamun dan Terumbu Karang di Pulau Pramuka, Kepulauan
ix
x
3.5.5. Konektivitas ... 31
3.5.5.1. Korelasi Pearson ... 31
4. HASIL DAN PEMBAHASAN ... 33
4.1. Parameter Fisika dan Kimia Perairan ... 33
4.1.1. Suhu ... 34
4.1.2. Kedalaman ... 34
4.1.3. Kecerahan ... 34
4.1.4. Derajat keasaman (pH) ... 35
4.1.5. Salinitas ... 35
4.1.6. DO (Dissolved oxygen) ... 36
4.1.7. Nutrien (Nitrat dan orthophosphat) ... 36
4.2. Sedimen ... 37
4.2.1. Tekstur sedimen ... 37
4.2.2. Kandungan C-organik sedimen ... 38
4.3. Kondisi Mangrove, Lamun dan Reef Crest ... 39
4.3.1. Kerapatan jenis mangrove ... 39
4.3.2. Persen penutupan lamun ... 40
4.3.3. Persen penutupan karang ... 41
4.4. Struktur Komunitas Makrozoobentos ... 42
4.4.1. Jumlah taksa (spesies) makrozoobentos ... 42
4.4.2. Kepadatan makrozoobentos... 47
4.4.3. Biomassa makrozoobentos ... 61
4.4.4. Indeks keanekaragaman (H’) makrozoobentos ... 63
4.4.5. Indeks keseragaman (E’) makrozoobentos ... 66
4.5. Konektivitas Makrozoobentos dengan Mangrove, Lamun dan Reef Crest serta Hubungannya dengan Parameter Lingkungan ... 68
4.6. Pengelolaan Ekosistem Pesisir di Pulau Pramuka ... 76
5. KESIMPULAN DAN SARAN ... 79
5.1. Kesimpulan ... 79
5.2. Saran ... 80
DAFTAR PUSTAKA ... 81
xi
DAFTAR TABEL
Halaman 1. Rangkuman dari efek penurunan konsentrasi oksigen terlarut terhadap
organisme laut (modifikasi dari Gray et al. 2002 in Taurusman 2007). Garis mendatar dalam tabel memisahkan antara makrozoobentos
dengan ikan ... . 9 2. Tekstur (grain size) untuk sedimen menurut skala Wentworth
(Wentworth 1922 in Gray & Elliott 2009) ... . 10 3. Alat dan bahan yang digunakan dalam pengambilan dan penanganan
sampel makrozoobentos dan sedimen beserta fungsinya ... . 23 4. Parameter yang diamati beserta satuan, alat dan metode
pengukuran ... . 25 5. Parameter fisika dan kimia perairan di lokasi penelitian Pulau Pramuka
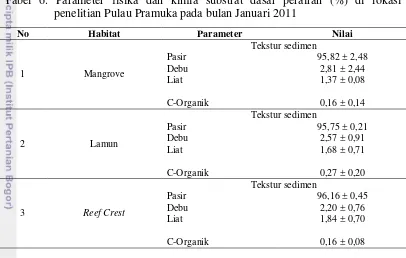
pada bulan September 2010 dan Januari 2011 ... . 33 6. Parameter fisika dan kimia substrat dasar perairan (%) di lokasi
penelitian Pulau Pramuka pada bulan Januari 2011 ... . 37 7. Analisis korelasi Pearson antara kondisi habitat dan struktur komunitas
makrozoobentos ... . 73 8. Analisis ragam parameter komunitas makrozoobentos
xii
DAFTAR GAMBAR
Halaman 1. Diagram alir perumusan masalah penelitian. Diagram bagian atas
dimodifikasi dari UNESCO (1983) ... . 3 2. Peta lokasi penelitian dan pengambilan sampel di Pulau Pramuka ... . 21 3. Corer yang digunakan untuk pengambilan sampel makrozoobentos
dan substrat sedimen dengan luas unit pengambilan contoh sebesar
0,0081 m2 ... . 22 4. Rancangan penelitian yang terbagi menjadi 24 stasiun tegak lurus dari
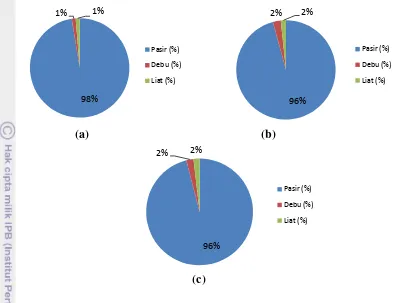
daratan pantai ke arah laut lepas berdasarkan habitat ... . 24 5. Komposisi tekstur sedimen di lokasi penelitian Pulau Pramuka bulan
Januari 2011 pada habitat (a) mangrove, (b) lamun dan (c) reef
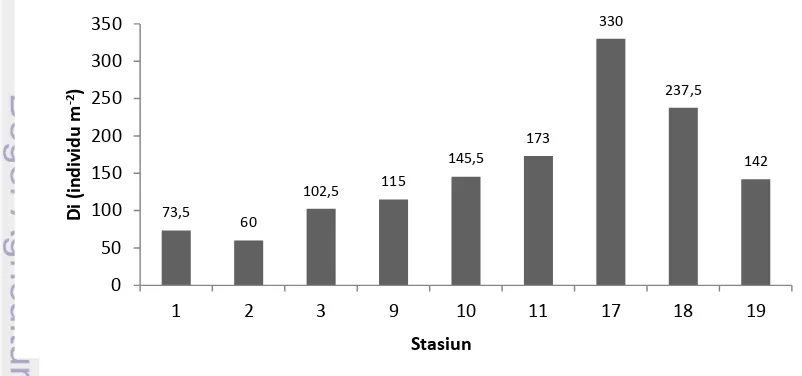
crest ... . 38 6. Kerapatan jenis mangrove (Di) di Pulau Pramuka pada bulan
Januari 2011 ... . 39 7. Persen penutupan lamun di Pulau Pramuka pada bulan September 2010
dan Januari 2011 ... . 41 8. Persen penutupan karang di Pulau Pramuka pada bulan September 2010
dan Januari 2011 ... . 42 9. Komposisi jumlah taksa makrozoobentos yang ditemukan berdasarkan
kelas pada bulan (a) September 2010 dan (b) Januari 2011 ... . 43 10. Jumlah spesies makrozoobentos pada bulan September 2010 dan
Januari 2011 berdasarkan (a) stasiun dan (b) habitat
(n mangrove & n lamun = 9; n reef crest = 6) ... . 45 11. Kepadatan makrozoobentos pada bulan September 2010 dan
Januari 2011 berdasarkan (a) stasiun dan (b) habitat
(n mangrove & n lamun = 9; n reef crest = 6) ... . 48 12. Dendogram kepadatan makrozoobentos di Pulau Pramuka
pada bulan September 2010 berdasarkan (a) stasiun dan
(b) habitat ... . 52 13. Dendogram kepadatan makrozoobentos di Pulau Pramuka
pada bulan Januari 2011 berdasarkan (a) stasiun dan
(b) habitat ... . 54 14. Kepadatan makrozoobentos pada bulan September 2010 dan
Januari 2011 berdasarkan habitat (a1-a2) mangrove, (b1-b2) lamun
xiii
16. Susunan nMDS kelimpahan makrozoobentos selama musim kemarau (kiri) dan musim hujan (kanan) dengan lingkaran hijau mewakili
proporsi dari setiap filum dan keterangan stasiun di dalamnya ... . 60 17. Biomassa makrozoobentos pada bulan September 2010 dan
Januari 2011 berdasarkan (a) stasiun dan (b) habitat
(n mangrove & n lamun = 9; n reef crest = 6) ... . 62 18. Indeks keanekaragaman Shannon-Wiener (H’) makrozoobentos
pada bulan September 2010 dan Januari 2011 berdasarkan (a) stasiun
dan (b) habitat (n mangrove & n lamun = 9; n reef crest = 6) ... . 64 19. Indeks keseragaman Pielou (E’) makrozoobentos pada bulan
September 2010 dan Januari 2011 berdasarkan (a) stasiun
dan (b) habitat (n mangrove & n lamun = 9; n reef crest = 6) ... . 67 20. Diagram alir konektivitas ekologis antara habitat dengan
Makrozoobentos di Pulau Pramuka pada bulan September 2010
xiv
DAFTAR LAMPIRAN
Halaman 1. Posisi geografis lokasi penelitian ... . 87 2. Gambar beberapa alat dan bahan yang digunakan selama
penelitian ... . 88 3. Prosedur kerja pengukuran parameter kualitas air ... . 89 4. Data jumlah kepadatan makrozoobentos (individu per stasiun) di Pulau
Pramuka bulan September 2010, sebanyak 3 ulangan setiap
stasiun ... . 92 5. Data jumlah kepadatan makrozoobentos (individu per stasiun) di Pulau
Pramuka bulan Januari 2011, sebanyak 3 ulangan setiap stasiun ... . 95 6. Baku mutu air laut untuk biota laut (Kepmen LH No. 51
tahun 2004) ... .. 97 7. Kriteria kerusakan dan status padang lamun (Kepmen LH No. 200
tahun 2004) serta kriteria kerusakan terumbu karang (Kepmen LH
No. 04 tahun 2001) ... . 99 8. Komposisi makrozoobentos yang ditemukan berdasarkan
1
1. PENDAHULUAN
1.1. Latar Belakang
Kepulauan Seribu merupakan salah satu kawasan pesisir terletak di wilayah bagian utara Jakarta yang dewasa ini mendapat perhatian khusus dalam hal kebijakan maupun perencanaan pengelolaan wilayah pesisirnya. Kepulauan Seribu mempunyai potensi yang besar untuk dikelola yang berasal dari sumberdaya perairannya sebagai pusat aktivitas dan jasa-jasa lingkungan meliputi: sektor perdagangan, transportasi, perikanan, dan pariwisata (Estradivari et al. 2007).
Pulau Pramuka termasuk ke dalam salah satu pulau berpenghuni di Kepulauan Seribu yang memiliki tingkat kepadatan penduduk cukup tinggi karena dijadikan sebagai Pusat Administrasi Pemerintah Kabupaten (kawasan percontohan) Kepulauan Seribu (Departemen Kehutanan 2008). Hal tersebut memicu aktivitas masyarakat yang juga berpotensi berdampak negatif secara langsung maupun tidak langsung terhadap kondisi pesisir pulau tersebut. Kerusakan tersebut umumnya disebabkan oleh aktivitas manusia di wilayah pesisir seperti kegiatan penambangan pasir dan karang, penggunaan alat tangkap yang tidak ramah lingkungan, serta pembuangan limbah ke perairan (Estradivari et al. 2007).
Pada Pulau Pramuka terdapat tiga habitat utama wilayah pesisir yaitu mangrove, lamun dan terumbu karang. Ketiga habitat tersebut saling berinteraksi satu sama lain. Interaksi tersebut dapat membentuk suatu konektivitas ekologis untuk menciptakan efek stabilitas pada lingkungan dalam mendukung komunitas biota di dalamnya (Amesbury & Francis 1988). Pada ketiga habitat tersebut terdapat proses-proses ekologi, dimana terjadi interaksi antara komponen biotik dan abiotik. Salah satu dari komponen biotik tersebut adalah makrozoobentos.
2
nilai ekonomis penting untuk memenuhi kebutuhan manusia, misalnya adalah dari kelas Krustasea dan Bivalvia (Fitriana 2006).
Melihat berbagai peranan yang dimiliki makrozoobentos, maka penelitian mengenai makrozoobentos sebagai indikator konektivitas ekologi pada tiga habitat utama kawasan pesisir terkait dengan kualitas perairan perlu dilakukan. Penelitian interaksi antar ekosistem (ecological connectivity) di perairan pesisir masih terbatas. Informasi penelitian dengan pendekatan tersebut belum diketahui pernah dilakukan di Kepulauan Seribu, khususnya Pulau Pramuka. Penelitian yang telah dilakukan umumnya lebih bersifat interaksi habitat tertentu pada jenis biota tertentu, seperti penelitian yang dilakukan oleh Aziz (2010) mengenai asosiasi makrozoobentos dengan lamun di Pulau Pramuka atau Fitriana (2006) mengenai asosiasi makrozoobentos dengan hutan mangrove hasil rehabilitasi di Ngurah Rai Bali.
Unsworth (2008) melakukan penelitian mengenai tingkat konektivitas antara komunitas ikan di lamun dengan habitat mangrove dan terumbu karang di perairan Taman Nasional Laut Wakatobi yang menunjukkan bahwa terdapat konektivitas ekologis antara komunitas ikan terhadap ketiga habitat tersebut dilihat dari parameter keragaman spesies dan kelimpahan ikan. Maka melalui penelitian ini akan diperoleh informasi ilmiah dilihat dari struktur komunitas makrozoobentos, yang berguna untuk pengelolaan ekosistem mangrove, lamun, dan terumbu karang secara berkelanjutan di Pulau Pramuka. Sehingga diharapkan dapat dijadikan masukan dalam menentukan perencanaan pengelolaan lingkungan di wilayah Pulau Pramuka, Kepulauan Seribu.
1.2. Perumusan Masalah
3
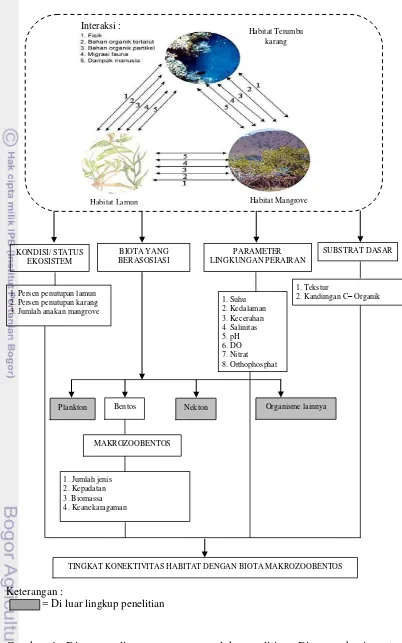
Keterangan :
= Di luar lingkup penelitian
Gambar 1. Diagram alir perumusan masalah penelitian. Diagram bagian atas dimodifikasi dari UNESCO (1983)
Interaksi :
SUBSTRAT DASAR PARAMETER
LINGKUNGAN PERAIRAN BIOTA YANG
BERASOSIASI KONDISI/ STATUS
EKOSISTEM
1. Persen penutupan lamun 2. Persen penutupan karang 3. Jumlah anakan mangrove
1. Suhu 2. Kedalaman 3. Kecerahan 4. Salinitas 5. pH 6. DO 7. Nitrat 8. Orthophosphat
1. Tekstur
2. Kandungan C– Organik
Plankton Bentos Nekton Organisme lainnya
MAKROZOOBENTOS
1. Jumlah jenis 2. Kepadatan 3. Biomassa 4. Keanekaragaman
TINGKAT KONEKTIVITAS HABITAT DENGAN BIOTA MAKROZOOBENTOS Habitat Terumbu
karang
4
Berdasarkan diagram alir bagian atas perumusan masalah penelitian pada Gambar 1, dapat dilihat bahwa ada berbagai interaksi antara habitat mangrove, lamun dan terumbu karang. Interaksi tersebut antara lain adalah interaksi fisik (arus, gelombang, kedalaman, kecerahan), bahan organik terlarut (nutrien dan DOM), bahan organik partikel (POM), migrasi fauna (dewasa, juvenile, plankton), dan dampak manusia (UNESCO 1983). Interaksi antara organisme dan lingkungannya saling mendukung satu sama lain membentuk suatu konektivitas dalam proses keseimbangan ekologi.
Adanya interaksi berimplikasi terhadap kondisi biota dalam hal ini makrozoobentos yang terdapat di ketiga habitat tersebut. Apabila kualitas habitat tersebut menurun, maka akan dapat berdampak langsung maupun tidak langsung terhadap organisme ini. Dengan melihat berbagai parameter lingkungan, substrat dasar perairan, serta kondisi atau status ketiga habitat saat itu dengan organisme yang berasosiasi, akan dapat diketahui tingkat konektivitas antara habitat dengan makrozoobentos.
1.3. Tujuan
Tujuan dari penelitian ini adalah:
1) Mengetahui struktur komunitas makrozoobentos yang berasosiasi dengan habitat mangrove, lamun, dan terumbu karang di Pulau Pramuka secara temporal;
2) Mengetahui konektivitas ekologis antara habitat mangrove, lamun dan terumbu karang dengan komunitas makrozoobentos di Pulau Pramuka.
1.4. Manfaat
5
2.
TINJAUAN PUSTAKA
2.1. Kondisi Umum Lokasi Penelitian
Pulau Pramuka merupakan salah satu pulau dari gugusan Kepulauan Seribu dan termasuk ke dalam wilayah Taman Nasional Laut Kepulauan Seribu (TNKpS). Wilayah Kepulauan Seribu memiliki perairan yang terlindung, aman dari badai dan gelombang laut yang tinggi karena dikelilingi oleh daratan besar Sumatera, Jawa dan Kalimantan (Tomascik et al. 1997). Secara umum keadaan laut Kepulauan Seribu mempunyai kedalaman yang berbeda-beda yaitu berkisar antara 0 - 40 meter (Departemen Kehutanan 2008).
Musim hujan di Kepulauan Seribu biasanya terjadi antara bulan November sampai April dengan jumlah hari hujan antara 10 - 20 hari per bulan. Musim kemarau berlangsung antara bulan Mei sampai Oktober dengan jumlah hari hujan antara 4 - 10 hari per bulan. Rata-rata curah hujan bulanan selama 10 tahun terakhir (1992 - 2002) berkisar antara 43 - 510 mm, dimana curah hujan tertinggi (43 mm) terjadi pada bulan Januari dan curah hujan terendah terjadi pada bulan Agustus (510 mm). Musim Barat dengan tiupan angin Barat Laut - Utara yang kuat dan curah hujan yang tinggi terjadi pada bulan Oktober - April, sedangkan musim Timur dengan tiupan angin Tenggara-Timur dan curah hujan rendah terjadi pada bulan Mei - September (BPLHD DKI Jakarta 2002 in Departemen Kehutanan 2008).
Suhu air dan salinitas laut tidak berfluktuasi secara nyata antara musim
barat, musim timur maupun musim peralihan. Suhu air berkisar antara 28,5 - 30,0 oC pada musim barat (November - Maret) dan 28,50 - 31,0 oC pada
musim timur (Mei - September). Salinitas permukaan berkisar antara 30 - 34‰ pada musim barat maupun pada musim timur (LAPI-ITB 2001).
6
Artinya sebanyak 2,7% per hari sampah di DKI Jakarta masuk ke Teluk Jakarta hingga Kepulauan Seribu (Kardian 2007).
2.2. Parameter Fisika dan Kimia
Parameter fisika dan kimia merupakan faktor abiotik dalam ekologi yang keberadaannya di alam tidak dapat dikontrol. Yang termasuk kedalam parameter fisika antara lain suhu, arus, kecerahan, dan kedalaman, sedangkan yang termasuk kedalam parameter kimia adalah pH, salinitas, DO, dan nutrien. Di samping itu, dalam penelitian ini diamati habitat dari makrozoobentos itu sendiri, yaitu substrat dasar (tekstur dan kandungan C-organik).
2.2.1. Suhu
Suhu merupakan salah satu faktor yang paling berpengaruh di laut. Suhu menjadi sangat penting bagi kehidupan organisme laut karena dapat mempengaruhi aktivitas metabolisme dan perkembangbiakkan organisme tersebut (Hutabarat & Evans 1985).
Pada daerah tropis suhu air laut rata-rata berkisar antara 28 - 31 oC (Nontji 2007). Nybakken (1988) menyatakan bahwa kisaran perubahan suhu pada zona intertidal adalah kecil dan jarang melebihi batas letal organisme. Peningkatan suhu dapat meningkatkan kecepatan metabolisme dan respirasi organisme air yang selanjutnya meningkatkan pula konsumsi oksigen. Peningkatan suhu perairan sebesar 10 oC akan menyebabkan terjadi peningkatan konsumsi oksigen oleh organisme sebesar 2 - 3 kali lipat (Effendi 2003). Kelas Polikaeta akan melakukan adaptasi terhadap kenaikan suhu atau salinitas dengan membuat lubang dalam substrat dan membenamkan diri di bawah permukaan substrat (Alcantara & Weiss 1991).
2.2.2. Kedalaman
7
organik pada substrat atau sedimen sebagai habitat makrozoobentos. Nybakken (1988) menyatakan bahwa seiring dengan bertambahnya kedalaman perairan, gangguan yang disebabkan oleh ombak akan berkurang sehingga komunitas yang lebih dalam cenderung dihuni oleh lebih banyak spesies ekuilibrium daripada spesies oportunistik.
2.2.3. Kecerahan
Kecerahan merupakan ukuran transparansi perairan, yang ditentukan secara visual. Nilai kecerahan dapat dipengaruhi oleh keadaan cuaca, waktu pengukuran, kekeruhan, dan padatan tersuspensi dalam perairan (Effendi 2003). Penetrasi cahaya yang semakin rendah karena meningkatnya kedalaman dan kekeruhan mengakibatkan cahaya yang dibutuhkan untuk proses fotosintesis tumbuhan air menjadi berkurang. Hal itu menyebabkan penyebaran vegetasi mangrove, lamun dan terumbu karang juga akan terhambat atau tidak merata. Oleh karena itu, secara tidak langsung kecerahan akan mempengaruhi pertumbuhan makrozoobentos yang hidup didalamnya.
2.2.4. Derajat keasaman (pH)
Derajat keasaman menyatakan besarnya intensitas keasaman atau kebasaan dari suatu cairan yang mewakili konsentrasi ion hidrogennya. Menurut Nybakken (1988), kisaran pH optimal untuk air laut berkisar antara 7,5 - 8,5. pH bukan merupakan faktor penting bagi organisme di suatu perairan. Hal ini dikarenakan pH memiliki variasi kecil pada perairan laut. Sebagian besar biota akuatik sensitif terhadap perubahan pH dan menyukai nilai pH sekitar 7,0 - 8,5 (Effendi 2003). Perairan dengan pH yang terlalu tinggi atau rendah akan mempengaruhi ketahanan hidup organisme yang hidup didalamnya (Odum 1993).
2.2.5. Salinitas
8
berkisar antara 30 - 34‰ pada musim barat maupun pada musim timur. Pada musim barat, musim timur dan musim pancaroba nilai salinitas tidak berfluktuasi secara nyata (LAPI-ITB 2001).
Salinitas dapat mempengaruhi penyebaran organisme makrozoobentos baik secara vertikal maupun horizontal dan secara tidak langsung mengakibatkan adanya perubahan komposisi organisme dalam suatu ekosistem. Gastropoda yang bersifat mobile mempunyai kemampuan untuk bergerak guna menghindari salinitas yang terlalu rendah, namun Bivalvia dan Polikaeta yang bersifat sessile akan mengalami kematian jika pengaruh air tawar berlangsung lama (Odum 1993). Kisaran salinitas yang masih mampu mendukung kehidupan organisme perairan, khususnya makrozoobentos berkisar antara 15 - 35‰ (Hutabarat & Evans 1985).
2.2.6. DO (Dissolved oxygen)
Oksigen terlarut (DO) mempunyai peran yang penting sekaligus menjadi faktor pembatas bagi kehidupan biota di perairan laut (Nybakken 1988). Kadar oksigen terlarut dapat dipengaruhi oleh suhu, salinitas dan turbulensi air. Kadar oksigen terlarut akan berkurang dengan semakin meningkatnya suhu, ketinggian dan berkurangnya tekanan atmosfer (Jeffries & Mills 1996 in Effendi 2003). Sumber DO dapat berasal dari difusi oksigen yang terdapat di atmosfer dan aktivitas fotosintesis oleh tumbuhan air dan fitoplankton. Faktor yang mempengaruhi distribusi secara vertikal DO di laut antara lain suhu, salinitas, tekanan hidrostatik, fotosintesis dan respirasi, biodegradasi, dan transpor massa air bawah laut (Sanusi 2006).
Keadaan perairan dengan kadar oksigen terlarut yang sangat rendah berbahaya bagi biota didalamnya. Menurut Effendi (2003) perairan yang diperuntukkan bagi kepentingan perikanan sebaiknya memiliki kadar oksigen tidak kurang dari 5 mg l-1. Kadar oksigen terlarut kurang dari 4 mg l-1 akan menimbulkan efek kurang menguntungkan bagi hampir semua biota perairan (UNESCO/WHO/UNEP 1992 in Effendi 2003). DO yang defisit pada dasar perairan akan mengakibatkan dekomposisi yang terjadi pada daerah tersebut sehingga kemudian menjadi anaerob dan menghasilkan H2S. Hal ini akan
9
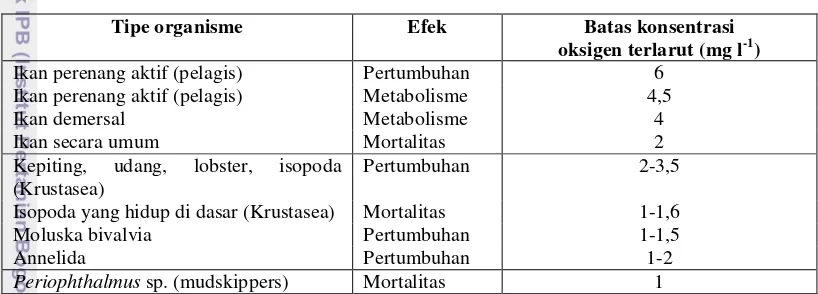
Konsentrasi oksigen di dasar perairan mempunyai peran yang penting terhadap perubahan struktur makrozoobentos dikarenakan pengayaan bahan organik di perairan pesisir (Gray et al. 2002 in Taurusman 2007). Menurut literatur (Gray et al. 2002 in Taurusman 2007), pengurangan konsentrasi oksigen terlarut di perairan memberikan efek bagi tingkah laku sekelompok fauna, jika dilihat dari tingkat sensitifitas ikan, Krustasea, Annelida (Polikaeta), dan Bivalvia (Tabel 1).
Tabel 1. Rangkuman dari efek penurunan konsentrasi oksigen terlarut terhadap organisme laut (modifikasi dari Gray et al. 2002 in Taurusman 2007). Garis mendatar dalam tabel memisahkan antara makrozoobentos dan ikan.
Tipe organisme Efek Batas konsentrasi oksigen terlarut (mg l-1)
Ikan perenang aktif (pelagis) Pertumbuhan 6
Ikan perenang aktif (pelagis) Metabolisme 4,5
Ikan demersal Metabolisme 4
Ikan secara umum Mortalitas 2
Kepiting, udang, lobster, isopoda (Krustasea)
Pertumbuhan 2-3,5
Isopoda yang hidup di dasar (Krustasea) Mortalitas 1-1,6
Moluska bivalvia Pertumbuhan 1-1,5
Annelida Pertumbuhan 1-2
Periophthalmus sp. (mudskippers) Mortalitas 1
Hewan yang dapat bergerak secara mobile akan melarikan diri dari daerah dimana terjadinya penurunan konsentrasi oksigen terlarut, jika tidak mereka akan mengalami kematian. Konsentrasi oksigen terlarut lebih rendah dari 4 mg l-1 di perairan akan menyebabkan kematian akut bagi sebagian besar spesies makrozoobentos. Oleh karena itu, jika DO pada dasar perairan lebih rendah dari 4 mg l-1, maka dapat diduga bahwa komunitas makrozoobentos akan menunjukkan perubahan yang berbeda pada komposisi spesies (Gray et al. 2002 in Taurusman 2007).
2.2.7. Nutrien (Nitrat dan orthophosphat)
10
dihasilkan dari proses oksidasi sempurna senyawa nitrogen di perairan. Nitrat tidak bersifat toksik terhadap organisme akuatik, termasuk makrozoobentos. Kadar nitrat pada perairan alami hampir tidak pernah lebih dari 0,1 mg l-1. Kadar nitrat lebih dari 5 mg l-1 menggambarkan terjadinya pencemaran antropogenik yang berasal dari aktivitas manusia dan hasil ekskresi hewan (Effendi 2003).
Orthophosphat yang merupakan produk ionisasi dari asam orthophosphat adalah bentuk fosfor yang paling sederhana di perairan. Orthophosphat dapat dimanfaatkan secara langsung oleh tumbuhan atau alga di perairan. Keberadaan fosfor di perairan biasanya relatif kecil, dengan kadar yang lebih sedikit daripada kadar nitrogen karena sumber fosfor lebih sedikit dibandingkan dengan sumber nitrogen di perairan (Effendi 2003). Kadar fosfor dalam orthophosphat (P-PO4)
jarang melebihi 0,1 mg l-1, sedangkan kadar fosfor total pada perairan alami jarang melebihi 1 mg l-1 (Boyd 1988 in Effendi 2003). Fosfor tidak bersifat toksik bagi manusia, hewan dan ikan.
2.2.8. Substrat (Sedimen)
Substrat dasar perairan terdiri atas partikel-partikel yang berasal dari pembongkaran batuan dan potongan-potongan kulit kerang serta sisa-sisa rangka dari organisme laut. Ukuran dari partikel tersebut ditentukan oleh sifat fisik mereka sendiri, sehingga menyebabkan tipe substrat yang terdapat di berbagai tempat dunia memiliki sifat berbeda satu sama lain (Hutabarat & Evans 1985). Salah satu cara mengklasifikasikan jenis substrat adalah dengan melihat secara langsung ukuran partikelnya. Berdasarkan ukuran dan besar butir, maka substrat dapat diklasifikasikan seperti yang ditunjukkan oleh Tabel 2.
Tabel 2. Tekstur (grain size) untuk sedimen menurut skala Wentworth (Wentworth 1922 in Gray & Elliott 2009)
Deskripsi tekstur sedimen Ukuran (mm)
Kerikil – bongkah (Pebbles – boulders) >4,00
Butiran (Granule) 4,00
Pasir sangat kasar (Very coarse sand) 2,00
Pasir kasar (Coarse sand) 1,00
Pasir sedang (Medium sand) 0,50
Pasir halus (Fine sand) 0,25
Pasir sangat halus (Very fine sand) 0,125
Lumpur (Silt) 0,0625
11
Menurut Hutabarat & Evans (1985), sedimen dasar laut dapat dibedakan menjadi tiga, antara lain:
1) Sedimen lithogenous, yaitu jenis sedimen yang berasal dari sisa pengikisan batu-batuan di darat. Hal ini dapat terjadi karena adanya suatu kondisi fisik yang ekstrem, seperti adanya perubahan proses pemanasan dan pendinginan maupun aksi kimia yang terdapat di dalam air hujan terhadap permukaan batu;
2) Sedimen biogenous, yaitu jenis sedimen yang berasal dari sisa-sisa rangka organisme hidup yang membentuk endapan partikel halus yang dinamakan ooze dan biasanya mengendap pada daerah yang terletak jauh dari pantai; 3) Sedimen hydrogenous, yaitu jenis sedimen yang berasal dari hasil reaksi
kimia dari dalam air laut dengan konsentrasi lewat jenuh sehingga terjadi pengendapan di dasar laut.
Kualitas sedimen menentukan keberadaan organisme bentik yang bertempat tinggal, terutama adalah senyawa kimia yang terdapat dalam sedimen yang terbentuk akibat proses oksidasi-reduksi (Sanusi 2006). Maka pada lokasi tertentu terdapat pengelompokkan jenis organisme bentik yang berbeda. Nybakken (1988) menyatakan bahwa makrozoobentos tipe deposit feeders cenderung melimpah pada sedimen lumpur maupun sedimen lunak lainnya yang merupakan daerah dengan kandungan bahan organik tinggi, sedangkan untuk makrozoobentos tipe suspension feeders terdapat lebih melimpah pada substrat yang lebih berbentuk pasir dengan bahan organik yang lebih sedikit.
12
pada perairan dengan substrat pasir, antara lain dari kelas Polikaeta (Nephtys dan Glycera) atau Gastropoda (Nybakken 1988).
Perairan dengan substrat lumpur cenderung memiliki ciri berukuran partikel sangat halus, rendahnya ketersediaan oksigen dalam sedimen walau hanya beberapa sentimeter di bawah permukaan, dan cenderung mengakumulasi bahan organik sehingga banyak tersedia makanan yang potensial untuk biota di perairan. Makrozoobentos yang mendominasi perairan substrat lumpur hampir sama dengan perairan substrat pasir, yaitu Polikaeta, Bivalvia dan Krustasea, hanya saja dengan genus yang berbeda. Bahan organik yang melimpah serta sangat kecilnya pengaruh gelombang menyebabkan makrozoobentos tipe deposit feeders mendominasi perairan ini, seperti Polikaeta (Arenicolidae, Spionidae dan Capitellidae), Krustasea (Corophium) dan Bivalvia (Macoma dan Scrobicularia). Makrozoobentos jenis karnivora yang sering ditemukan pada perairan berlumpur antara lain berbagai kepiting, udang, Glycera, Nephtys, Polinices, dan Busycon (Nybakken 1988).
2.3. Mangrove
Hutan mangrove atau mangal adalah sebutan umum yang digunakan untuk menggambarkan suatu varietas komunitas pantai tropis yang didominasi oleh beberapa spesies pohon-pohon yang khas atau semak-semak yang mempunyai kemampuan untuk tumbuh dalam perairan asin. Setidaknya 60 - 75% garis pantai daerah tropis di bumi telah ditumbuhi mangrove. Pohon mangrove yang penting atau dominan di antaranya adalah dari genus Rhizophora, Avicennia, Bruguiera, dan Sonneratia. Mangrove memiliki sejumlah bentuk khusus yang memungkinkan mereka hidup di perairan lautan yang dangkal, yaitu berakar pendek dan menyebar luas dengan akar penyangga atau tudung akarnya yang khas tumbuh dari batang atau dahan. Daunnya kuat, mengandung banyak air serta memiliki jaringan internal penyimpan air dan konsentrasi garam yang tinggi (Nybakken 1988).
13
meluas. Mangrove tidak tumbuh di pantai yang terjal dan berombak besar dengan arus pasang surut yang kuat, karena hal ini tak memungkinkan untuk terjadinya pengendapan lumpur dan pasir, substrat yang diperlukan untuk pertumbuhannya (Nontji 2007).
Mangrove dapat berkembang sendiri yaitu pada tempat dimana tidak terdapat gelombang, sehingga kondisi fisik pertama yang harus ada adalah gerakan air yang minimal. Gerakan air yang lambat menyebabkan partikel sedimen yang halus cenderung mengendap dan berkumpul di dasar perairan. Hasilnya berupa kumpulan lumpur. Tanah hutan mangrove ditandai oleh kadar oksigen yang rendah, kadar garam yang tinggi dan butiran sedimen yang halus dengan kandungan organik tinggi. Mangrove berkembang hanya pada perairan yang dangkal dan daerah intertidal sehingga sangat dipengaruhi oleh pasang-surut (Nybakken 1988).
Menurut Nybakken (1988) komunitas mangrove bersifat unik, disebabkan luas vertikal pohon, dimana organisme daratan menempati bagian atas dan hewan lautan yang sebenarnya menempati bagian bawah. Kelompok fauna akuatik pada komunitas mangrove ada dua tipe, yaitu hidup di kolom air serta hidup pada substrat keras (akar dan batang pohon mangrove) maupun substrat lunak (menempati lumpur) (Bengen 2001). Mangrove memiliki beberapa fungsi ekologis penting yaitu sebagai peredam dari gelombang energi tinggi dan badai pada pantai, membantu menstabilkan sedimen dan meningkatkan akumulasi sedimen lokal didalamnya, penjebak nutrien anorganik, memproduksi sejumlah besar detritus yang berasal dari dedaunan dan ranting pohon mangrove yang jatuh untuk badan air disekitarnya, serta tempat mencari makan, memijah dan daerah asuhan bagi berbagai macam biota laut (Knox & Miyabara 1984).
14
lubang, sehingga air dan udara dapat masuk ke dalam tanah (Chaudhuri & Choudhury 1994 in Fitriana 2006). Umumnya mangrove ditempati oleh kepiting (Uca, Cardisoma, Cleistostoma), udang, Moluska (Littorinidae, Ellobiidae dan Potamididae), serta beberapa jenis Polikaeta (Nybakken 1988).
2.4. Lamun
Lamun adalah tumbuhan berbunga angiosperma yang hidup dan tumbuh terbenam di dalam perairan laut, memiliki tulang daun, batang, akar, bunga, dan buah. Akar dan rimpang dari lamun tumbuh terbenam dalam pasir atau lumpur (McKenzie & Yoshida 2009). Lamun termasuk ke dalam Famili Hydrocharitaceae, Cymodoceaceae dan Potamogetanaceae, namun tidak memiliki hubungan kekerabatan dengan tumbuhan darat dari kelas Poaceae. Terdapat 13 genus dan 58 spesies tersebar di seluruh dunia. Enam genus (Amphibolis, Heterozostera, Phyllospadix, Posidonia, Pseudalthenia, Zostera) terdapat pada kawasan perairan laut beriklim sedang dan sebanyak 7 genus (Cymodoceae, Enhalus, Halodule, Halophila, Syringodium, Thalassia, Thalassodendron) terdistribusi di perairan laut tropis (Kannan & Thangaradjou 2002).
Tumbuhan lamun tumbuh optimal pada salinitas 35‰, namun dapat mentolerir kisaran salinitas antara 4 - 65‰, meskipun tidak semua jenis lamun dapat mentolerir salinitas tersebut sama baiknya. Lamun membutuhkan cahaya untuk fotosintesis. Kebutuhan cahaya permukaan rata-rata berkisar antara 10-20% dengan nilai minimum 4,4% dan maksimum 29% tergantung spesiesnya. Lamun membutuhkan dua nutrien utama untuk tumbuh, yaitu nitrogen dan fosfor. Ketersediaan nutrien untuk lamun bergantung pada kualitas sedimen yaitu dari jenis dan ukuran partikel (McKenzie & Yoshida 2009).
Lamun hidup di perairan dangkal yang berpasir. Sering pula dijumpai di kawasan terumbu karang atau pada lokasi lebih dalam dimana sinar matahari masih dapat menembus perairan. Berbeda dengan alga yang membutuhkan nutrien dalam air, lamun merupakan tumbuhan yang menyerap nutrien dari sedimen atau substrat. Untuk itu, lamun dapat mendaurulangkan nutrien kembali ke dalam ekosistem agar tidak terperangkap di dasar laut (Nybakken 1988).
15
jumlah besar dan memberikan substrat dasar yang sangat baik bagi berbagai jenis alga termasuk diatom dan fauna sessil (Smith 1991). Beberapa fungsi ekologis dari lamun adalah sebagai produsen detritus, mengikat sedimen dan menstabilkan substrat yang lunak dengan sistem perakarannya, tempat berlindung, mencari makan (feeding ground), daerah asuhan (nursery ground), dan memijah (spawning ground) bagi berbagai jenis biota laut, serta sebagai tudung pelindung yang melindungi penghuni padang lamun dari sengatan matahari (Hemminga & Duarte 2000).
Habitat lamun tinggi akan keanekaragaman dan kelimpahan biota di perairan. Lamun yang berada dekat reef flats dan estuari juga akan membantu menyerap nutrien dan masukan bahan kimia lainnya untuk lingkungan perairan laut. Tingkat produksi primer yang tinggi pada lamun berkaitan erat dengan tingginya tingkat produksi perikanan. Lamun memberikan nilai ekonomis yang sangat besar bagi kehidupan manusia, meskipun tidak mudah untuk dihitung secara kuantitatif, sehingga termasuk dalam peringkat ketiga ekosistem paling produktif di laut setelah estuari dan lahan basah (McKenzie & Yoshida 2009).
Di Pulau Pramuka, terdapat 6 jenis lamun, yaitu Cymodoceae rotundata, Cymodoceae serrulata, Enhalus acoroides, Thalassia hemprichii, Halophila ovalis, Halophila pinifolia (Dwindaru 2010). Namun menurut Dwintasari (2010) di Pulau Pramuka juga ditemukan Syringodium isoetifolium. Berdasarkan kriteria Kepmen LH No. 200 tahun 2004, kondisi lamun di Pulau Pramuka tergolong rusak (Dwindaru 2010).
2.5. Terumbu karang
Terumbu karang (Coral reef) merupakan ekosistem khas di wilayah pesisir tropis. Terumbu terbentuk berasal dari endapan masif kalsium karbonat (CaCO3)
yang dihasilkan organisme karang pembentuk terumbu (karang hermatipik) dari filum Cnidaria, ordo Scleractinia yang hidup bersimbiosis dengan zooxanthellae serta tambahan dari alga berkapur dan organisme lain yang ikut mengekskresikan kalsium karbonat (Nybakken 1988).
16
zooxanthellae, alga filamen, makroalga bentik, dan fitoplankton. Namun pada ekosistem mangrove, porsi utama dari produktivitas adalah berasal dari komponen daratan, seperti vegetasi mangrove, dibandingkan dengan yang berasal dari komponen akuatik. Hasil pengamatan yang dilakukan di Puerto Rico menunjukkan bahwa produksi diperkirakan 8 gC m-2 d-1 (Qasim & Wafar 1990).
Reef crest merupakan bagian terdangkal dari tipe habitat terumbu karang yang dihuni oleh keanekaragaman dan kelimpahan fauna yang sangat ekstrem. Pada umumnya kedalaman reef crest hanya kurang dari 10 meter. Habitat reef crest mendapat energi gelombang tertinggi dibandingkan kawasan terumbu karang lainnya dan biasanya perairan dilapisi oleh alga merah dan karang berbentuk lembaran (sheet-like coral forms) sehingga memungkinkan banyak terdapat pecahan karang didalamnya (Kensley 1984). Pada penelitian ini, bagian reef crest dari salah satu tipe habitat terumbu karang dijadikan sebagai lokasi pengambilan contoh makrozoobentos.
Kehidupan karang di lautan dibatasi oleh kedalaman yang biasanya kurang dari 25 m dan oleh area yang mempunyai suhu rata-rata minimum dalam setahun sebesar 10 oC. Pertumbuhan maksimum terumbu karang terjadi pada kedalaman kurang dari 10 m dan suhu sekitar 25 - 29 oC (Hutabarat & Evans 1984). Kadar salinitas perairan laut yang dapat mendukung pertumbuhan terumbu karang berkisar antara 32 - 35‰ (Nybakken 1988). Karena sifat hidup inilah maka terumbu karang banyak dijumpai di Indonesia.
Terumbu karang menyediakan berbagai manfaat langsung maupun tidak langsung. Produktivitas primer yang tinggi di perairan terumbu karang memungkinkan ekosistem ini sebagai tempat pemijahan, pengasuhan, dan mencari makan bagi biota laut. Kerangka hewan karang dapat dijadikan tempat berlindung atau menempelnya biota laut lainnya. Beberapa ikan pelagis menggantungkan masa larvanya terhadap keberadaan terumbu karang. Selain itu, terumbu karang dapat berfungsi sebagai pelindung pantai dari erosi (Mukhtasor 2007).
17
dibutuhkan zooxanthellae untuk berfotosintesis dalam jaringan karang. Akibat yang akan terjadi adalah menurunnya perkembangan terumbu karang bahkan hilangnya terumbu karang tersebut dari daerah yang memiliki tingkat pengendapan yang tinggi (Nybakken 1988).
Menurut Departemen Kehutanan (2008) kondisi terumbu karang di wilayah Kepulauan Seribu kawasan TNKPs dikategorikan sedang sampai rusak. Persentase penutupan karang hidup berkisar antara 4,3 – 50,7% dan didominasi oleh tutupan pasir, pecahan karang serta karang mati yang telah melampaui 50%. Kerusakan ini sebagian besar diakibatkan oleh faktor buatan (ulah manusia) seperti penangkapan ikan yang merusak dan berlebih, pencemaran air, penimbunan sampah, serta penambangan pasir dan karang. Di samping itu faktor alami yang dapat mengakibatkan terjadinya kerusakan terumbu karang adalah pengaruh grazing oleh bulu babi seperti Diadema dan Eucidaris (Nybakken 1988). Penelitian yang dilakukan oleh Sammarco (Nybakken 1988), memperlihatkan bahwa bulu babi Diadema pada kepadatan yang tinggi akan memakan semua organisme tidak hanya alga, dengan demikian akan menghalangi pertumbuhan karang. Penelitian lainnya oleh Glynn (Nybakken 1988) di Kepulauan Galapagos juga memperlihatkan bahwa bulu babi Eucidaris thouarsii memakan karang yang dominan, sehingga mengganggu perkembangan terumbu karang dan menyebabkan berkurangnya terumbu karang di pulau tersebut.
2.6. Konektivitas
Konektivitas antar habitat di perairan dangkal tropis mempengaruhi banyaknya komunitas ikan dan organisme bentik didalamnya (Mumby et al. 2003). Pada penelitian ini konektivitas antara habitat dengan makrozoobentos difokuskan kepada habitat mangrove, lamun dan reef crest (terumbu karang). Habitat mangrove, lamun dan reef crest saling berinteraksi satu sama lain dan membentuk suatu konektivitas ekologis untuk menciptakan efek stabilitas pada lingkungan dalam mendukung komunitas biota didalamnya (Amesbury & Francis 1988).
18
berasal dari terumbu karang. Habitat mangrove dan lamun cenderung sebagai penghasil nutrien. Kelebihan nutrien akan diikat oleh vegetasi pada masing-masing habitat, namun untuk nutrien dengan ukuran lebih besar akan meninggalkan habitat ini sebagai bahan organik terlarut atau partikulat (DOM/POM) yang dapat membantu memelihara organisme karang. Biota laut juga turut membantu dalam perpindahan nutrien diantara ketiga habitat. Berbagai jenis burung, ikan, bahkan invertebrata yang menghuni suatu habitat namun mencari makan pada habitat berbeda yang berdekatan, berpotensi untuk memindahkan nutrien (UNESCO 1983).
Hewan invertebrata yang menutupi akar mangrove menghasilkan larva planktonik yang akan terbawa oleh pergerakan arus ke habitat lain dan menjadi sumber makanan potensial di habitat tersebut. Organisme filter feeders di habitat lamun dan terumbu karang akan diuntungkan dengan melimpahnya larva planktonik yang berasal dari habitat mangrove (UNESCO 1983). Di samping itu, peningkatan bahan organik yang berasal dari mangrove dekat lamun, berpotensial menyediakan sumber makanan yang dapat meningkatkan kelimpahan makrozoobentos (Alongi 1990 in Unsworth 2008).
2.7. Makrozoobentos
Organisme yang hidup pada bagian dasar lautan dikenal sebagai bentos, termasuk didalamnya adalah seluruh hewan-hewan dan tumbuhan yang hidup pada daerah yang masih dipengaruhi air pasang (daerah litoral), daerah continental shelf (sublitoral), hingga yang tinggal di laut sangat dalam (daerah batial dan abisal). Secara ekologis kelompok organisme ini terbagi menjadi dua, yaitu epifauna, merupakan organisme bentik yang hidup di atas permukaan dasar lautan dan infauna, organisme bentik yang cara hidupnya dengan menggali lubang pada dasar lautan (Hutabarat & Evans 1985).
Menurut Gray & Elliott (2009) organisme benthos biasanya digolongkan berdasarkan ukuran saringan (mesh size) yang dipakai, yaitu:
1) Megafauna, merupakan organisme yang berukuran > 5 cm, seperti Echinodermata dan Decapoda;
19
3) Meiofauna, organisme yang berukuran 63 - 500 µm, seperti Nematoda, Oligochaeta dan Gastrotricha;
4) Mikrofauna, organisme yang berukuran < 63 µm, seperti Siliata dan Rotifer. Kelompok organisme dominan yang menyusun makrofauna di dasar lunak sublitoral terbagi menjadi empat kelompok taksonomi, yaitu kelas Polikaeta, kelas Krustasea, filum Echinodermata, dan filum Moluska (Nybakken 1988). Woodin (1976) in Nybakken (1988), mengklasifikasikan organisme infauna menjadi penggali pemakan deposit, pemakan suspensi dan pembentuk tabung dari berbagai tipe (penggali pemakan deposit atau pemakan suspensi).
Makrozoobentos tipe deposit feeders (penggali pemakan deposit) merupakan kelompok hewan bentik yang memiliki kemampuan dalam mencerna detritus yang jatuh atau memang berada di dasar perairan (Nybakken 1988). Di lain pihak, menurut beberapa literatur antara lain Heip (1995), Heilskov & Holmer (2001), dan Wong et al. (2003) yang diacu dalam Taurusman (2007), makrozoobentos tipe suspension feeders (pemakan suspensi) merupakan kelompok hewan bentik yang memiliki kemampuan untuk mengabsorpsi bahan organik dan polutan dari perairan yang kemudian akan digunakan kembali melalui proses mineralisasi.
Dikenal dua pola daur hidup organisme yang berbeda pada habitat manapun. Tipe yang pertama disebut oportunistik, dimana spesies ini memiliki ciri masa hidup yang pendek, perkembangan yang cepat untuk bereproduksi sehingga terdapat banyak periode reproduksi per tahun, larva terdapat hampir atau sepanjang tahun di perairan, dan memiliki angka kematian yang tinggi. Biasanya hewan tipe ini berukuran kecil dan sering menetap atau sessile. Tipe kedua yaitu ekuilibrium dimana mempunyai ciri masa hidup yang panjang, perkembangan mencapai dewasa yang relatif lama sehingga terdapat satu atau lebih periode reproduksi per tahun, dan memiliki angka kematian yang rendah. Hewan tipe ini biasanya berukuran besar dan aktif bergerak (mobile) (MacArthur 1960 in Nybakken 1988).
20
cenderung mendiami daerah yang tidak sering mengalami gangguan agar dapat melengkapi siklus hidupnya. Terlalu banyak gangguan dapat memusnahkan spesies tipe ini sebelum mereka menjadi dewasa dan menghasilkan larva yang dapat menetap di daerah tersebut (Nybakken 1988).
21
3.
METODE PENELITIAN
3.1. Waktu dan Lokasi Penelitian
Penelitian dilakukan di kawasan rehabilitasi lamun dan teripang Pusat Kajian Sumberdaya Pesisir dan Lautan Institut Pertanian Bogor (PKSPL-IPB) sebelah timur Pulau Pramuka, Kepulauan Seribu pada rentang waktu 23 September 2010 dan 23 Januari 2011. Secara geografis lokasi tersebut berada pada 05o44’29,4” - 05o44’44,1” LS dan 106o36’57,0” – 106o37’05,0” BT. Pengambilan sampel dilakukan sebanyak dua kali, yaitu pada bulan September 2010 mewakili musim kemarau dan bulan Januari 2011 mewakili musim hujan.
Penelitian ini dibagi menjadi 3 (tiga) tahapan, yaitu tahap pertama, pengumpulan data dan informasi mengenai objek penelitian, berupa studi literatur dan studi lapangan pada bulan September 2010 dan Januari 2011. Tahapan kedua adalah tahap penanganan dan identifikasi sampel pada bulan Februari – Agustus 2011 dan tahapan ketiga adalah pengolahan data berdasarkan metode analisis yang telah ditetapkan. Gambar 2 berikut adalah peta lokasi pengambilan sampel.
22
3.2. Alat dan Bahan
Alat dan bahan yang digunakan dalam pengambilan sampel makrozoobentos dan sedimen antara lain, Corer (Gambar 3) dengan diameter 0,1016 m dan luas unit pengambilan contoh sebesar 0,0081 m2, kantong plastik, spidol permanen, formalin 4%, saringan halus (pore size ± 0,5 mm2), pewarna Rose Bengal. Sedangkan untuk penanganan sampel adalah saringan halus (pore size ± 0,5 mm2), ember, gayung, pinset, baki, alkohol 70%, botol film, mikroskop cahaya, kaca pembesar, kertas label, data sheet, spidol, dan buku identifikasi.
Gambar 3. Corer yang digunakan untuk pengambilan sampel makrozoobentos dan substrat sedimen dengan luas unit pengambilan contoh sebesar 0,0081 m2
Buku identifikasi yang digunakan adalah The Polychaete Worms Definitions and Keys to the Orders, Families and Genera (Fauchald 1977) dan Guide to Identification of Marine and Estuarine Invertebrates (Gosner 1971). Penentuan stasiun pengamatan menggunakan GPS (Global Positioning System) serta roll meter. Beberapa parameter fisika dan kimia diamati secara in situ dengan menggunakan alat dan bahan seperti termometer untuk mengukur suhu, refraktometer untuk mengukur salinitas, meteran untuk mengukur kedalaman, secchi disk untuk mengukur kecerahan, kertas lakmus untuk mengukur pH, dan DO (Dissolved oxygen) meter untuk mengukur DO di perairan. Lebih jelasnya, alat dan parameter fisika-kimia perairan dapat dilihat pada Tabel 3 dan Tabel 4.
Diameter (D) = 4 Inch = 10,16 cm = 0,1016 m Luas (L) = π.r2
23
Tabel 3. Alat dan bahan yang digunakan dalam pengambilan dan penanganan sampel makrozoobentos dan sedimen beserta fungsinya
No Alat dan bahan Fungsi / kegunaan
Pengambilan sampel
Alat :
1 Corer Mengambil sampel makrozoobentos dan substrat
sedimen 2 Kantong plastik Wadah sampel
3 Spidol permanen Memberi tanda stasiun dan ulangan pada plastik sampel 4 Saringan halus Menyaring air dan lumpur halus sebelum sampel
dimasukkan ke dalam plastik Bahan :
1 Formalin 4% Mengawetkan sampel makrozoobentos
2 Rose Bengal Pewarna organisme pada sampel
Penanganan sampel
Alat :
1 Saringan halus Menyaring organisme
2 Ember Wadah air untuk membilas sampel makrozoobentos
3 Gayung Alat pengambil air
4 Baki Wadah untuk menyaring makrozoobentos
5 Pinset Mengambil organisme yang ditemukan pada sampel
6 Botol film Wadah/ tempat menyimpan sampel makrozoobentos
7 Kertas label Memberi tanda pada botol film
8 Spidol Memberi tanda pada botol film
9 Data sheet Menulis data hasil identifikasi makrozoobentos
10 Mikroskop Mengamati makrozoobentos untuk diidentifikasi 11 Buku identifikasi Mengetahui jenis makrozoobentos
Bahan :
1 Alkohol 70% Mengawetkan sampel makrozoobentos
2 Air Membersihkan sampel
3.3. Rancangan Penelitian
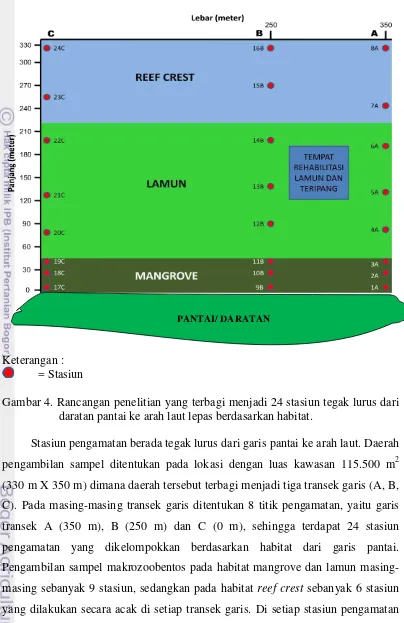
24 Keterangan :
= Stasiun
Gambar 4. Rancangan penelitian yang terbagi menjadi 24 stasiun tegak lurus dari daratan pantai ke arah laut lepas berdasarkan habitat.
Stasiun pengamatan berada tegak lurus dari garis pantai ke arah laut. Daerah pengambilan sampel ditentukan pada lokasi dengan luas kawasan 115.500 m2 (330 m X 350 m) dimana daerah tersebut terbagi menjadi tiga transek garis (A, B, C). Pada masing-masing transek garis ditentukan 8 titik pengamatan, yaitu garis transek A (350 m), B (250 m) dan C (0 m), sehingga terdapat 24 stasiun pengamatan yang dikelompokkan berdasarkan habitat dari garis pantai. Pengambilan sampel makrozoobentos pada habitat mangrove dan lamun masing-masing sebanyak 9 stasiun, sedangkan pada habitat reef crest sebanyak 6 stasiun yang dilakukan secara acak di setiap transek garis. Di setiap stasiun pengamatan dilakukan pengambilan sampel makrozoobentos sebanyak tiga ulangan. Untuk lebih jelas rancangan penelitian dapat dilihat pada Gambar 4.
25
3.4. Pengambilan dan Penanganan Sampel
Parameter yang diamati dalam penelitian ini adalah makrozoobentos, kualitas air dan tekstur sedimen. Data yang diambil berupa data primer dan data sekunder. Data primer diperoleh melalui pengambilan langsung contoh makrozoobentos, air, dan substrat dasar perairan beserta analisisnya selama penelitian berlangsung. Sedangkan data sekunder berupa studi literatur yang menunjang data-data penelitian.
Pada saat melakukan sampling di lokasi, beberapa parameter fisika dan kimia perairan diamati secara in situ, seperti suhu, kedalaman, kecerahan, salinitas, pH, dan oksigen terlarut (DO), sedangkan untuk parameter NO3-N dan
PO4-P diamati secara ex situ. Disamping parameter fisika dan kimia perairan,
diamati pula tipe substrat perairan, kerapatan jenis mangrove, persen penutupan lamun, dan persen penutupan karang yang terdapat pada stasiun pengamatan. Parameter yang melalui tahap analisis laboratorium antara lain kepadatan dan biomassa basah makrozoobentos.
Tabel 4. Parameter yang diamati beserta satuan, alat dan metode pengukuran
No Parameter Satuan Alat Metode pengukuran
Fisika
-1 Beberapa alat dan bahan untuk mengukur NO3-N
Spektrofotometri
5 PO4-P mg l
26
Pengambilan sampel makrozoobentos dilakukan sebanyak tiga ulangan pada setiap titik pengamatan dengan total 72 sampel di satu kali waktu pengambilan. Sedangkan untuk sampel sedimen dilakukan tiga ulangan pada bulan Januari 2011 yang mewakili masing-masing habitat (9 sampel). Parameter fisika dan kimia perairan diukur secara langsung (in situ) setiap titik pengamatan pada saat yang bersamaan dengan pengambilan sampel sedimen. Begitu pula dengan penentuan koordinat stasiun pengamatan, penghitungan jumlah anakan mangrove, serta persen penutupan lamun dan karang.
Sampel makrozoobentos diambil dengan menggunakan corer yang dibenamkan pada dasar perairan hingga kedalaman ± 20 cm. Sampel pasir yang telah diambil segera disaring dan dipisahkan antara pasir, serasah kasar, lumpur, dengan lamun atau karang yang terambil menggunakan saringan halus. Kemudian sampel dimasukkan ke dalam kantong plastik yang sebelumnya telah diberi keterangan nomor stasiun dan ulangan. Sampel makrozoobentos segera diawetkan dengan formalin 4% dan diberi Rose Bengal secukupnya sebagai pewarna.
Pada umumnya penanganan sampel makrozoobentos dilakukan dalam beberapa tahap. Tahap-tahap tersebut antara lain penyaringan, penyortiran, pengawetan, dan identifikasi. Tahap penyaringan dan penyortiran dilakukan dengan menggunakan saringan halus dan pinset hingga sampel makrozoobentos terpisah dari serasah dan sedimen. Makrozoobentos yang telah selesai disortir dimasukkan ke dalam botol film yang telah diberi label, kemudian sampel diawetkan menggunakan alkohol 70%. Setelah itu, makrozoobentos diidentifikasi menggunakan mikroskop, kaca pembesar dan buku identifikasi.
27
3.5. Analisis Data
Data yang dianalisis adalah data primer yang diperoleh dari pengambilan sampel sebanyak dua kali, yaitu pada bulan September 2010 dan bulan Januari 2011. Selain itu digunakan pula data sekunder berasal dari studi pustaka.
3.5.1. Kerapatan jenis mangrove
Kerapatan jenis mangrove adalah jumlah tegakan jenis i dalam suatu unit area menggunakan rumus sebagai berikut (Brower et al. 1990):
Keterangan:
Di = Kerapatan jenis ke-i (Individu m-2)
ni = Jumlah total tegakan ke-i pada stasiun pengamatan (individu)
A = Luas area total pengambilan contoh (m2)
3.5.2. Kepadatan makrozoobentos
Kepadatan makrozoobentos merupakan jumlah individu makrozoobentos per satuan luas (m2) (Brower et al. 1990). Sampel makrozoobentos yang telah diidentifikasi kemudian dihitung kepadatannya dengan menggunakan rumus yang telah dimodifikasi dari Brower et al. (1990):
Keterangan:
Ki = Kepadatan makrozoobentos jenis i (individu m-2)
Ni = Jumlah makrozoobentos jenis i yang ditemukan pada setiap ulangan (individu)
A = Luas bukaan mulut corer (0,0081 m2)
b = Ulangan pengambilan sampel makrozoobentos
3.5.3.Pengelompokkan stasiun pengamatan berdasarkan kepadatan jenis
makrozoobentos
3.5.3.1. Indeks similaritas
28
Multivariate Ecological Research) dan disajikan dalam bentuk dendogram (Clarke & Gorley 2001). Indeks similaritas antar komunitas menggambarkan pengukuran perbedaan kelimpahan pada setiap spesies yang ada (Bray Curtis 1957 in Brower et al. 1990). Berikut ini adalah rumus yang digunakan:
∑∑ | |
Keterangan :
S = Indeks Similaritas D = Indeks Bray Curtis
n = Jumlah variabel yang diperbandingkan
yi1-yi2 = Nilai variabel ke-i pada stasiun pertama dan kedua yang dibandingkan
x1,x2 = Stasiun yang dibandingkan 3.5.3.2. Persen kesamaan (Similarity percentage)
Pengukuran melalui analisis persen kesamaan pertama kali diusulkan oleh Renkonen dan biasa disebut sebagai indeks Renkonen (Krebs 1989). Analisis persen kesamaan atau Similarity Percentage (SIMPER) dengan software PRIMER versi 5.2 digunakan untuk mengidentifikasi spesies makrozoobentos (atau kelompok taksonomi yang lebih tinggi) yang terutama menentukan karakteristik kelompok secara spasial. Spesies makrozoobentos yang khas dan menjadi ciri dari suatu grup adalah mereka yang ditemukan dalam kelimpahan yang tinggi secara konsisten dari seluruh pengambilan contoh. Mereka juga sering menjadi pembeda yang baik antara kelompok (Clarke & Gorley 2001).
29
setiap contohnya (Krebs 1989). Berikut ini adalah rumus yang digunakan (Krebs 1989):
∑
Keterangan:
P = Persen kesamaan antara contoh 1 dan 2
P1i = Persen dari spesies ke-i dalam komunitas contoh ke-1
P2i = Persen dari spesies ke-i dalam komunitas contoh ke-2 3.5.3.3. nMDS (Non-metric multidimensional scaling)
Perangkat lunak PRIMER mampu mengelompokkan stasiun pengamatan dan habitat berdasarkan kepadatan jenis makrozoobentos dengan metode non-metric multidimensional scaling (nMDS). Metode ini merupakan suatu teknik untuk menentukan posisi relatif suatu objek terhadap objek lain, berdasarkan kemiripannya. nMDS menempatkan stasiun-stasiun ke dalam suatu kelompok atau cluster, sehingga stasiun tersebut masuk ke dalam suatu kelompok yang mempunyai sifat lebih mirip.
Nilai stress menunjukkan ukuran kesesuaian antara konfigurasi yang ada dengan ukuran kemiripan yang diinginkan. Nilai ini berkisar antara 0 - 1. Semakin kecil nilai stress menunjukkan bahwa hasil nMDS sesuai dengan konfigurasi yang diinginkan. Konfigurasi yang lebih baik ditunjukkan oleh nilai stress yang lebih rendah, sehingga disarankan agar kelimpahan spesies dapat diinterpretasikan dengan konfigurasi nMDS dengan nilai stress kurang dari 0,2. Stasiun dengan letak plot berdekatan menggambarkan kelompok yang sama atau mirip, sedangkan stasiun dengan letak lebih jauh terpisah menggambarkan kelompok yang berbeda (Clarke 1993 in Taurusman 2007; Eleftheriou & McIntyre 2005).
3.5.4. Indeks ekologis
30
3.5.4.1. Indeks keanekaragaman
Kekayaan spesies dan kesamaannya dalam satu nilai tunggal digambarkan dengan indeks diversitas atau indeks keanekaragaman. Keanekaragaman ditentukan oleh dua hal penting, yaitu jumlah spesies atau taksa yang berbeda dan keseragaman yang mencerminkan penyebaran individu dalam satu kategori sistematik (Bengen 2000). Dalam analisis data, indeks Shannon-Wiener digunakan untuk menggambarkan keanekaragaman jenis, produktivitas, tekanan, dan kestabilan ekosistem yang ditemukan pada setiap stasiun. Berikut ini adalah rumus indeks keanekaragaman dengan menggunakan logaritma basis dua (Krebs 1989):
∑
Keterangan:
H’ : Indeks keanekaragaman (Shannon-Wiener)
pi : Jumlah individu spesies ke-i per jumlah individu total (ni/N) ni : Jumlah spesies i
N : Jumlah total spesies yang ditemukan
3.5.4.2. Indeks keseragaman
Indeks keseragaman diartikan sebagai nilai yang dapat menjelaskan penyebaran individu antar spesies yang berbeda dan diperoleh dari hubungan antara keanekaragaman (H’) dengan keanekaragaman maksimalnya (Krebs 1989). Nilai E sama dengan 1 artinya jumlah individu tiap jenis adalah sama. Semakin merata penyebaran individu antarspesies maka keseimbangan ekosistem akan semakin meningkat. Untuk analisis keseragaman, menggunakan rumus sebagai berikut (Krebs 1989):
Keterangan:
E’ : Indeks keseragaman Pielou
31
3.5.5. Konektivitas
3.5.5.1. Korelasi Pearson
Koefisien korelasi adalah koefisien yang menggambarkan tingkat keeratan hubungan linier antara dua peubah atau lebih. Besaran dari koefisien korelasi tidak menggambarkan hubungan sebab akibat antara dua peubah atau lebih, namun hanya menggambarkan keterkaitan linier antar peubah saja. Koefisien
korelasi sering dinotasikan dengan r dan nilainya berkisar antara -1 dan 1 (-1 ≤ r ≤ 1), nilai r yang mendekati 1 atau -1 menunjukkan semakin erat hubungan
linier antara kedua peubah, sedangkan nilai r yang mendekati nol menggambarkan hubungan kedua peubah tidak linier (Mattjik & Sumertajaya 2002). Koefisien korelasi antara peubah X dan Y dapat dirumuskan sebagai berikut (Walpole 1988):
∑ ∑ ∑
√ ∑ ∑ √ ∑ ∑
Interpretasi hasil analisis korelasi:
1) Mengetahui kekuatan hubungan dua variabel dengan variabel sebagai berikut :
0 : Tidak ada korelasi antara dua variabel
>0 – 0,25 : Korelasi sangat lemah
>0,25 – 0,5 : Korelasi cukup
>0,5 – 0,75 : Korelasi kuat
>0,75 – 0,99 : Korelasi sangat kuat
1 : Korelasi sempurna
2) Mengetahui arah hubungan
32 3) Mengetahui signifikansi hubungan
Signifikansi atau probabilitas atau alpha (α) memberikan gambaran mengenai bagaimana nilai korelasi tersebut mendekati kebenaran atau tidak. Nilai signifikansi sebesar 0,05 mengindikasikan hasil penelitian mempunyai kesempatan untuk benar sebesar 95% dan untuk salah sebesar 5%.
Hipotesis : H0= Tidak ada hubungan signifikan antara X dengan Y
H1= Ada hubungan signifikan antara X dengan Y
Hasil :
33
4.
HASIL DAN PEMBAHASAN
4.1. Parameter Fisika dan Kimia Perairan
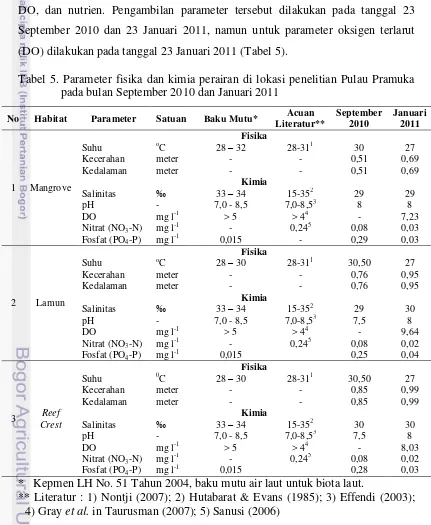
Salah satu faktor yang dapat menjelaskan keadaan perairan pada saat penelitian dilakukan adalah melalui pengamatan beberapa parameter fisika dan kimia perairan. Parameter fisika yang diamati pada penelitian ini meliputi suhu, kedalaman dan kecerahan. Sedangkan untuk parameter kimia adalah salinitas, pH, DO, dan nutrien. Pengambilan parameter tersebut dilakukan pada tanggal 23 September 2010 dan 23 Januari 2011, namun untuk parameter oksigen terlarut (DO) dilakukan pada tanggal 23 Januari 2011 (Tabel 5).
Tabel 5. Parameter fisika dan kimia perairan di lokasi penelitian Pulau Pramuka pada bulan September 2010 dan Januari 2011
No Habitat Parameter Satuan Baku Mutu* Acuan