ABSTRACT
The Potency of Buffalo Rumen Bacteria Isolates in Fermenting Various Herbage and Their Viability during Storage
Sari. Y, T. Toharmat, dan D. Evvyernie
An experiment was aimed to review the ability of isolate to digest the components of forage and the viability of isolate in different storage media. The first trial was to compare the ability of a mixture of six isolates bacteria isolated from buffalo rumen with bacteria from fresh rumen as treatment to digest various forages using t-test. The grasses used in the experiment were Pennisetum purpureum, Panicum maximum, Paspalum notatum, Setaria splendida, dan Brachiaria humidicola. In general, crude fiber content of grasses was above 50% and crude protein was less than 10%, except for Setaria splendid. The second trial applied completely randomized design with 4 x 3 factorial design. Factor A was the storage media (soil, charcoal, tapioca flour and Urea Molasses Block (UMB) and factor B was storage time (0, 1, and 2 weeks). Data were analyzed by Analysis of Variance and significant differences were further evaluated using Duncan Multiple Range Test. The results indicated that coefisien digestibility of dry and organic matter of grasses were lower when the grasses was fermented by the rumen bacteria isolates than those by bacteria in fresh rumen liquor (P< 0.01). On the other hand, ammonia production was higher when rumen bacteria isolates were used (P<0.01) and VFA production was similar when the grasses were fermented either by the rumen bacteria isolates or fresh rumen bacteria. There was a different viability pattern of bacteria isolates preserve different media for two weeks. However, the result indicated that bacteria isolates could be preserved in soil, tapioca powder, or charcoal for one week.
1 PENDAHULUAN
Latar belakang
Rumen mempunyai beberapa spesies bakteri yang jumlah maupun jenisnya sangat bervariasi. Spesies-spesies bakteri tersebut dapat berinteraksi dengan protozoa melalui hubungan simbiosa dan mampu mencerna komponen selulosa, hemiselulosa, dan pati yang merupakan polimer tumbuhan (Arora, 1989). Bakteri rumen kerbau telah diisolasi oleh Astuti (2010) dan Gayatri (2010) dan memiliki kemampuan sebagai degrader sumber serat. Rifai (2010) menunjukkan bahwa isolat bakteri kerbau mampu mendegradasi rumput gajah dan jerami padi, namun belum terbukti dalam mendegradasi berbagai rumput. Beberapa jenis rumput unggul yang telah banyak dikenal peternak di Indonesia adalah Pennisetum purpureum (rumput gajah), Panicum maximum (rumput benggala), Paspalum notatum (rumput bahia), Setaria splendida (setaria gajah) dan Brachiaria humidicola. Rumput mengandung serat kasar yang tinggi dan merupakan sumber energi yang sangat potensial bagi ruminansia. Karakteristik isolat bakteri tersebut memungkinkan untuk digunakan dalam berbagai tujuan diantaranya sebagai sebagai sumber inokulum, untuk evaluasi pakan juga sebagai probiotik.
Evaluasi kualitas pakan ternak ruminansia diantaranya dilakukan dengan teknik in vitro dengan menggunakan bakteri rumen segar (Tilley dan Terry, 1963). Penggunaan rumen segar memungkinkan dihasilkannya nilai nutrisi yang bervariasi akibat jenis dan populasi bakteri rumen segar yang digunakan tidak seragam akibat perbedaan pakan dan waktu pengambilan cairan rumen. Oleh karena itu isolat bakteri rumen diharapkan dapat digunakan sebagai alternatif pengganti cairan rumen sebagai sumber inokulum (Hadziq, 2011; Yunitasari, 2011) dan perlu mempelajari potensi pemananfaatan isolat bakteri tersebut
2 inangnya (Schrezenmeir dan de Vrese, 2001). Namun probiotik harus memenuhi beberapa persyaratan diantaranya stabil dalam penyimpanan, mampu bertahan hidup sampai saluran pencernaan bagian belakang, dan memberikan pengaruh yang menguntungkan pada ternak (Puspitek LIPI, 2009).
Isolat bakteri rumen dalam bentuk media cair mudah disiapkan namun sulit untuk diaplikasikan dan sangat sensitif terhadap perubahan pH, suhu, maupun kandungan oksigen (O2) media, sehingga perlu upaya untuk meningkatkan daya
hidup dalam bentuk padat sehingga dapat meningkatkan manfaat isolat bakteri. Salah satu teknik yang dapat digunakan yaitu pengembangan teknik penyimpanan bakteri dalam bentuk padat atau media padat. Upaya penyimpanan dalam media kering ini memungkinkan isolat bakteri rumen dapat dengan mudah ditangani selama penyimpanan dan pengiriman dari satu tempat ke tempat lain sehingga perlu diketahui masa penyimpanan dan media yang tepat agar daya hidup (viability) isolat tersebut masih tinggi. Kemudahan pengiriman memungkinkan isolat bakteri rumen digunakan untuk berbagai tujuan termasuk sebagai inokulan pengganti cairan rumen atau starter pada pedet periode menyusu atau probiotik. Penelitian ini didisain untuk mengkaji kemampuan enam campuran isolat bakteri dalam mencerna hijauan pakan dan daya hidupnya selama penyimpanan.
Tujuan
3 TINJAUAN PUSTAKA
Teknik Evaluasi Nilai Nutrisi Hijauan Pakan
Metode In vitro
Metode in vitro merupakan metode evaluasi nilai nutrisi pakan dengan melalui pengukuran kecernaan menggunakan mikroorganisme rumen dari cairan rumen segar. Metode ini memakai dasar sistem pencernaan dua tahap. Tahap pertama meliputi perlakuan fermentasi bahan pakan termasuk hijauan dalam fermentasi in vitro menggunakan mikroba cairan rumen segar selama 48 jam. Pencernaan tahap kedua adalah pencernaan hidrolisis komponen bahan kering oleh pepsin. Pencernaan tahap pertama mensimulasi pencernaan dalam rumen dan tahap kedua mensimulasi pencernaan yang terjadi di dalam organ alat pencernaan pasca rumen. Nilai koefisien cerna yang diperoleh dari teknik analisis in vitro tersebut mendekati hasil dengan sistem in vivo (Tilley dan Terry, 1963).
Metode in vitro Tilley dan Terry (1963) yang dimodifikasi oleh Makkar (2002) merupakan proses metabolisme nutrien pakan yang terjadi di dalam rumen dan abomasum atau di luar tubuh ternak. Metode ini sering digunakan untuk menduga kecernaan komponen bahan pakan dalam saluran pencernaan ternak. Teknik in vitro ini memberikan hasil analisa yang cepat dan proses yang murah, serta dapat digunakan untuk mengevaluasi bahan pakan dalam jumlah besar. Namun metode ini sulit diterapkan pada material seperti sampel jaringan atau fraksi dinding sel (Makkar, 2002).
4 Volatile Fatty Acid (VFA)
Ternak ruminansia memiliki mikroba (bakteri dan protozoa) di dalam alat pencernaannya yang merombak nutrien secara fermentatif sehingga menjadi senyawa lain yang berbeda dari molekul nutrien asalnya (Sutardi,1980). Produk akhir yang terpenting dari fermentasi adalah asam lemak terbang atau volatile fatty acids (VFA) terutama asetat, propionat, butirat serta produk lainnya termasuk CO2, methan, dan
panas. Ruminansia menggunakan VFA sebagai sumber energi untuk proses hidupnya (Church dan Pond, 1988; Sutardi 1980). Beberapa spesies bakteri memproduksi amonia dan VFA berantai cabang dari asam-asam amino tertentu. Konsentrasi VFA dalam abomasum adalah setengahnya dari yang ada di dalam cairan rumen. Meskipun sebagian besar absorpsi VFA terjadi dalam omasum, tetapi sejumlah besar masuk ke dalam abomasum (Arora, 1989).
Volatile Fatty Acid (asam lemak terbang) merupakan salah satu produk fermentasi karbohidrat di dalam rumen yang menjadi sumber energi utama bagi ternak ruminansia dan dapat menyumbang 55-60% dari kebutuhan energinya. Konsentrasi VFA dapat dijadikan salah satu tolak ukur fermentabilitas pakan dan sangat erat kaitannya dengan aktivitas mikroba rumen (Parakkasi, 1999).
Amonia (NH3)
Protein pakan di dalam rumen dipecah oleh mikroba menjadi peptide dan asam amino, beberapa asam amino dipecah lebih lanjut menjadi ammonia. Protein mengalami degradasi intensif di dalam rumen pada pH 6,5 (Blackburn dan Hobson, 1960). Ammonia diproduksi bersama dengan peptide dan asam amino yang akan digunakan oleh mikroba rumen dalam pembentukan protein mikroba (McDonald et a.l, 2002).
Produksi NH3 berasal dari protein yang didegradasi oleh enzim proteolitik. Di
5 degradasi maka konsentrasi ammonia dalam rumen akan rendah dan pertumbuhan mikroba rumen akan lambat yang menyebabkan turunnya kecernaan pakan (McDonald et al, 2002).
Amonia yang dibebaskan dalam rumen sebagian dimanfaatkan oleh mikroba untuk mensintesis protein tubuhnya (Arora, 1989). Menurut McDonald et al. (2002), kisaran konsentrasi NH3 yang optimal untuk sintesis protein oleh mikroba rumen
adalah 6 - 21 mM. Konsentrasi nitrogen amonia sebesar 5% sudah mencukupi kebutuhan nitrogen mikroba. Amonia di dalam rumen akan diproduksi terus-menerus walaupun sudah terjadi akumulasi (Sutardi, 1977). Faktor utama yang mempengaruhi penggunaan NH3 adalah ketersediaan karbohidrat dalam ransum yang
berfungsi sebagai sumber energi untuk pembentukan protein mikroba. Menurut Sutardi (1977), agar NH3 dapat dimanfaatkan oleh mikroba penggunaannya perlu
disertai dengan sumber energi yang mudah difermentasi, misalnya dedak padi. Rumput
Rumput daerah tropika mengandung kadar protein yang rendah dan serat kasar yang tinggi bila dibandingkan dengan rumput daerah beriklim sedang yang dipotong pada fase pertumbuhan yang sama. Di lain pihak produksi kadar bahan kering jenis rumput daerah tropika sering jauh lebih tinggi dari pada rumput daerah sedang (McIlroy, 1976; Close dan Menke, 1986). Arora (1989) menyatakan bahwa rumput tropika memiliki banyak lignin daripada rumput yang tumbuh di daerah beriklim sedang. Lignin dinding sel mempengaruhi proses pencernaan pakan dalam saluran pencernaan. Rumput dengan kandungan lignin rendah tetapi mempunyai lebih banyak dinding sel kurang dapat dicerna dibanding legum yang mempunyai lignin dua kali lebih banyak karena mempunyai kandungan dinding sel yang lebih rendah dari pada rumput atau graminae (Arora, 1989; Ogimoto dan Imai, 1981).
6 rumen mampu membantu pencernaan selulosa untuk menghasilkan molekul gula sederhana atau produk fermentasi seperti volatile fatty acids (VFA) yang merupakan sumber energi utama asal pakan pada ruminansia. Bahan kering pakan khususnya rumput pada ruminasia sebagaian besar dicerna dalam rumen (Arora, 1989).
Rumput gajah merupakan tanaman tahunan, berumpun, secara alami terdapat di sungai dan aliaran-aliran air, serta tersebar di seluruh Afrika Utara. Tingginya dapat mencapai 4,5 m. Rumput ini disukai oleh ternak, tahan kering, dan produksinya tinggi. Di daerah lembab atau dengan irigasi produksinya dapat mencapai lebih dari 290 ton rumput segar/ ha/ tahun (McIlroy, 1976). Rumput gajah mempunyai kadar nutrien yang lebih baik dari jenis rumput lainnya. Rumput gajah dapat mengandung 9,2% - 13,4% abu, 1-2%, lemak kasar, 36,6 - 38,8% serat kasar, 40,3 – 42,4% bahan ektrak tanpa nitrogen (BETN), dan 5,5 - 10,7% protein kasar (Batubara dan Manurung, 1990; Hartadi et al., 1986).
Rumput benggala (Panicum maximum) merupakan tanaman tahunan, berumpun, dan tingginya dapat mencapai 0,5 – 4,5m dan memerukan curah hujan 1000 – 1800 mm per tahun.Tanaman ini berasal dari Afrika tropika dan subtropika, serta terdapat pada seluruh daerah tropika humida dan subtropika. Rumput ini disukai oleh ternak, tidak sekasar rumput gajah dan kandungan proteinnya lebih tinggi dibanding rumput tropikal lainnya (4 – 14%). Produksi hijauan segar sebanyak 115 ton/ha/tahun (McIlroy, 1976; Close dan Menke, 1986). Komposisi nutrien rumput benggala adalah sebagai beriku 11,4% abu, 1% lemak kasar, 40,3% serat kasar, 42,3% BETN, 4,9% protein kasar (Hartadi et al., 1986).
7 Rumput setaria gajah (Setaria splendida) merupakan salah satu hijauan pakan yang produktif dan mudah cara penanamannya. Setaria splendida serupa dengan Setaria sphacellata, tetapi lebih besar, lebih tinggi, dan lebih tegar dibanding kultivar komersil lain. Rumput setaria gajah sangat disukai oleh ternak, merupakan rumput tahunan, tumbuh tegak, berumpun dengan tinggi 1,5-3,5 m. panjang daun bisa mencapai 70 cm dengan lebar 12-20 mm. (Bogdan, 1977). Komposisi nutrien Setaria splendida adalah sebagai berikut: 13,8% abu, 34,5% serat kasar, 8,6% protein kasar, dan 41% BETN (Batubara dan Manurung, 1990).
Brachiaria humidicola merupakan tanaman rumput tahunan yang mempunyai banyak stolon dan rizoma dan membentuk lapisan penutup tanah yang padat. Tumbuh pada beragam jenis tanah mulai dari tanah sangat asam (pH 3,5) dan tidak subur, tanah dengan Alumunium tinggi, tanah liat berat merekah, sampai tanah pasir berbatu pH tinggi. Kebutuhan rumput akan unsur Ca rendah. Tahan terhadap tanah berpengairan buruk dan sering ditemukan pada tanah liat basah musiman. B. humidicola memerlukan 1000-4000 mm curah hujan tahunan dengan distribusi yang baik. Kurang baik pada lingkungan dengan curah hujan tahunan <1600 mm dan >6 bulan musim kering. B. humidicola tumbuh paling baik pada lingkungan dataran rendah tropis pada lintang sampai 27o, dengan ketinggian sampai 1000 m.
Kadar protein rumut B. humidicola dapat mencapai PK 5-17%. Kecernaan bahan kering rumput berkisar antara 48-75%. Biasanya kualitas rumput tersebut lebih rendah dibanding spesies Brachiaria yang lain (B. decumbens , B. brizantha atau B. ruziziensis ) dengan kecernaan menurun dengan cepat bila tidak digembalai (Tropical Forages, 2005).
Bakteri Rumen
8 Beberapa bakteri rumen yang dominan adalah bakteri selulolitik. Bakteri rumen dapat digolongkan ke dalam bakteri selulolitik, bakteri amilolitik, bakteri hemiselulolitik, bakeri proteolitik dan lipolitik. Bakteri selulolitik diantarnya adalah Bacteriodes succinogenes, Butyrivibrio fibrisolvens, Ruminococcus albus, Clostridium lochheadii, Clostridium longisporum, Cillobacterium cellulosolvens. Bakteri amilolitik diantaranya yaitu Streptococcus bovis, Bacteroides amylophilus, Bacteroides ruminicola, Succinimonas amylolytica, dan Selenomonas ruminantium. Sejumlah bakteri selulotik juga merupakan bakteri amilolitik contohnya Clostridium lochheadii, Bacteriodes succinogenes, Butyrivibrio fibrisolvens (Hungate, 1966).
Bakteri hemiselulolitik diantaranya Eubacterium, Bacteroides amylogenes, Bacteroides ruminicola, Butyrivibrio fibrisolvens, Ruminococcus flavefaciens, dan Ruminococcus albus. Bakteri metanogenik yaitu Methanobacterium ruminantium. Mikroorganisme rumen tumbuh pada kondisi dengan cairan rumen anaerob, pH 5 – 7,5. Temperatur di dalam rumen adalah 38-42oC (Arora, 1989; Ogimoto dan Imai, 1981; Hungate, 1966).
Penyimpanan dan Pemeliharaan Bakteri
Pembuatan dan penyimpanan koleksi (preservasi) mikroba diperlukan untuk menjaga agar biakan mikroba tetap hidup, sifat mikroba tetap stabil dan tidak berubah, serta hemat biaya dan tenaga. Metode penyimpanan yang dipilh sangat tergantung pada sifat mikroba dan tujuan preservasi. Sifat mikroba tercermin dalam (1) ciri-ciri morfologi mikroba yang beragam, (2) ciri-ciri fisiologi dan biokimia mikroba, (3) dan kemampuan mikroba bertahan hidup baik dalam lingkunan alaminya maupun lingkungan buatan (Machmud, 2001).
Koleksi dan preservasi mikroba meliputi tujuan jangka pendek dan jangka panjang. Preservasi jangka pendek dilakukan untuk keperluan rutin penelitian yang disesuaikan dengan kegiatan program atau proyek tertentu. Preservasi jangka panjang dilakukan dalam kaitannya dengan koleksi dan konservasi plasma nutfah mikroba, sehingga apabila suatu saat diperlukan dapat diperoleh kembali atau dalam keadaan tersedia (Machmud, 2001).
9 penyimpanan sederhana yang efektif untuk penyimpanan isolat jangka pendek atau menengah, dan biasanya tidak sesuai untuk penyimpanan jangka panjang. Diantara teknik tersebut ialah penyimpanan dalam minyak mineral, parafin cair, tanah steril, air steril, manik-manik porselin, lempengan gelatin, dan P2O5 dalam keadaan vakum.
Walaupun tidak digunakan secara luas, teknik tersebut hanya memerlukan peralatan yang sederhana dan mudah diperoleh, sehingga dapat bermanfaat bagi lembaga yang belum memiliki peralatan canggih (Machmud, 2001). Teknik preservasi yang sekarang banyak dikembangkan dengan tingkat daya hidup mikroba yang tinggi adalah teknik pengeringan beku (Puspawati, 2008).
Pengeringan Beku (Freeze dried)
Puspawati (2008) melakukan proses pengeringan beku pada isolat bakteri asam laktat Pediococcus pentosaceus A16, Lactobacillus brevis A17, dan Lactobacillus rhamnosus R21 pada berbagai bahan pelindung. Bahan pelindung yang berupa campuran sukrosa 10%, laktosa 10%, dan susu skim 10% mampu meningkatkan viabilitas ketiga isolat tersebut. Ketahanan kultur kering terhadap garam empedu 0,5% pada ketiga isolat cukup tinggi. Namun, bahan pelindung yang paling baik dalam melindungi isolat bakteri yaitu susu skim karena mampu melindungi bakteri terhadap kerusakan karena paparan larutan dengan keasaman tinggi dan garam empedu 0,5%. Hal ini menunjukkan bahwa berbagai bahan dapat digunakan sebagai media preservasi mikroba. Namun daya hidup mikroba dalam media akan sangat tergantung pada proses preservasi itu sendiri.
Penyimpanan pada Tanah
10 Penyimpanan pada Urea Molasses Block
Urea molases block (UMB) merupakan pakan tambahan yang biasa diberikan pada ternak saat hijauan yang diberikan memiliki kualitas dan palatabilitas yang rendah. Wahyudi (2006) mengevaluasi penggunaan urea molasses mineral probiotik blok (UMMPB) pada sapi perah laktasi terhadap produksi dan kualitas susu pada peternakan skala kecil dan diperoleh hasil bahwa UMMPB mampu meningkatkan produksi dan kualitas susu, sehingga direkomendasikan penggunaannya untuk meningkatkan produktifitas sapi perah periode laktasi.
Urea Molasses Block sebagai suplemen, menyediakan nutrisi esensial pada ternak seperti protein, energi, dan mineral yang biasanya defisien pada hijauan. Urea Molasses Mineral Block (UMMB) berbentuk padat, keras, dan dapat larut di dalam air. Ternak memakannya dengan cara menjilatnya. Urea Molasses Block dapat dibuat dengan beberapa formulasi tergantung suplai dan harga bahan-bahan yang dibutuhkan. Jumlah UMMB yang diberikan tergantung jenis ternak dan beratnya. Molasses Mineral Block 5 kg diberikan pada pedet umur 7-10 hari atau kerbau dengan berat 350-400 kg (FFTC, 2001). Penggunaan UMB atau UMMB untuk pedet dapat diperkaya dengan inokulan bakteri atau probiotik sehingga dapat bermanfaat untuk memacu perkembangan bakteri rumen.
Tepung Tapioka
Tepung tapioka yang dibuat dari ubi kayu mempunyai banyak kegunaan, antara lain sebagai bahan pembantu atau pengisi dalam berbagai industri pangan. Dibandingkan dengan tepung jagung, kentang, dan gandum atau terigu, komposisi nutrien tepung tapioka cukup baik dan juga digunakan sebagai bahan bantu pewarna putih (IPTEKnet, 2005). Tapioka juga banyak digunakan sebagai bahan pengental, bahan pengisi dan bahan pengikat dalam industri makanan, seperti dalam pembuatan puding, sop, makanan bayi, es krim, pengolahan sosis daging, dan industri farmasi (IPTEKnet, 2005). Tepung tapioka dengan berbagai keunggulan fisik dan kimiawinya memungkinkan dapat digunakan sebagai media penyimpan isolat mikroba.
Arang
12 MATERI DAN METODE
Lokasi dan Waktu
Penelitian ini dilaksanakan di Laboratorium Nutrisi Ternak Perah, Departemen Nutrisi dan Teknologi Pakan, Fakultas Peternakan, Institut Pertanian Bogor, Bogor. Penelitian ini dilaksanakan mulai Juli 2011 sampai dengan Februari 2012.
Materi Alat
Alat- alat yang digunakan pada penelitian ini adalah gelas ukur, Erlenmeyer, tabung reaksi, tutup karet, isolasi panfix, hot plate, plastik tahan panas, autoclave, pipet mikro, tabung CO2, kulkas, freezer, bunsen, spoit, magnetic stirer, pipet mohr,
pipet volumetrik, sprayer, bulb, pH meter, timbangan digital, shaker water bath, vortex, tabung fermentor, tutup karet, cawan porselin, cawan conway, labu destilasi, press cooker, oven 60oC, oven 105oC, tanur listrik 600oC, buret, vacum, dan alumunium foil.
Bahan
Hijauan pakan yang digunakan sebagai perlakuan uji kecernaan fermentatif bakteri pada penelitian ini yaitu Pennisetum purpureum, Panicum maximum, Paspalum notatum, Setaria splendida, Brachiaria humidicola. Sumber inokulum yang digunakan yaitu campuran enam isolat bakteri (A27, I8, A9, A3, B61, B6) rumen kerbau yang biasa mengkonsumsi hijauan lokal dengan kualitas nutrisi rendah dan berserat kasar tinggi di Jonggol, Bogor, Jawa Barat. Isolat bakteri yang digunakan telah terbukti mampu mendegradasi serat kasar dan termasuk bakteri selulolitik (Astuti, 2010; Gayatri, 2010).
Sumber inokulum yang digunakan sebagai salah satu bahan komponen media, terdiri dari dua yaitu cairan rumen sapi segar dari rumah potong hewan PT. Elders dan isolat bakteri rumen. Bahan-bahan kimia yang digunakan adalah BHI (brain heart infusion), glukosa, cellobiosa, pati, cystein-HCl, hemin, resazurin, agar powder, gas CO2, larutan McDougall, aquades, larutan HgCl2, larutan pepsin, HCl,
Na2CO3 jenuh, asam borat berindikator, H2SO4 0,005N, NaOH 0,5N, H2SO4,
13 Metode
Pembuatan Stock Culture dalam Media BHI
Sebanyak 200 ml media BHI awalnya terdiri 7,4 g BHI, pati 0,1 g, glukosa 0,1 g, selubiosa 0,1 g, resazurin 1 ml, dan hemin 1 ml, serta aquades 200 ml. Larutan dipanaskan hingga larut. Setelah itu ditambah resazurin dan hemin masing-masing sebanyak 1 ml, kemudian dialiri dengan gas CO2 selama 20 menit dan ditambah
cystein-HCl 0,1 g. Sebanyak 5 ml dimasukkan ke dalam tabung reaksi dan
disterilisasi dalam autoklave selama 15-20 menit (Schelegel, 1994).
Media BHI yang telah disterilisasi digunakan sebagai media untuk Stock Culture bakteri. Enam kultur isolat bakteri tunggal yang disimpan di dalam gliserol diambil sebanyal 1 ml masing-masing diinokulasikan ke dalam tabung reaksi yang berisi 5 ml media BHI kemudian diinkubasi selama 48 jam di dalam shaker water bath dengan suhu 39oC. Setelah itu, stock culture disimpan di dalam kulkas. Untuk uji kecernaan fermentatif isolat secara in vitro masing-masing isolat bakteri dari stock culture diinokulasikan lagi pada media BHI yang baru sebanyak 1 ml pada tabung reaksi dan diinkubasi selama 48 jam di dalam shaker water bath. Setelah 48 jam enam isolat bakteri tersebut dicampur sambil dialiri CO2 dan siap digunakan
untuk uji in vitro.
Pola Pertumbuhan Isolat
Informasi pola pertumbuhan isolat bakteri rumen dikaji dengan menunbuhkan enam isolat tunggal bakteri pencerna serat sebanyak 1 ml masing-masing dalam 5 ml media BHI, lalu diinkubasi selama 48 jam dengan pengamatan setiap 4 jam. Pada setiap 4 jam pengamatan diambil sebanyak 0,6 ml bakteri dan dilakukan pengenceran sebanyak lima kali (0,6 ml bakteri ditambah 2,4 ml air aquadest). Kemudian dihitung absorbansinya pada spektrofotometer dengan panjang gelombang 600 nm. Hasil yang diperoleh dibuat regresinya. Diperoleh puncak pertumbuhan masing-masing isolat bakteri pada pada inkubasi selama 8 jam.
14 media tumbuh isolat bakteri individu digunakan sebagai starter untuk membuat bakteri campuran.
Bakteri Campuran
Bakteri campuran diperoleh dari isolat bakteri tunggal yang ditumbuhkan selama 7 jam dimana masing-masing isolat bakteri tunggal diambil dengan persentase yang berbeda, pertumbuhan bakteri yang paling tinggi jumlahnya (persentasenya) lebih sedikit diinokulasikan dan pertumbuhan bakteri yang paling lambat jumlahnya lebih banyak diinokulasikan. Isolat bakteri campuran ini dimasukkan ke dalam tabung yang berisi media 15 ml media BHI. Kemudian diinkubasi di dalam shaker water bath selama 7 jam. Hasil inkubasi isolat bakteri campuran ini diinokulasikan lagi sebanyak 5% ke dalam tabung yang berisi 100 ml media BHI untuk diamati pertumbuhannya. Pertumbuhan bakteri campuran diinkubasikan selama 10 jam dan populasinya diamati setiap 2 jam. Data pengamatan ini menunjukan bahwa puncak pertumbuhan bakteri campuran adalah 6 jam. Isolat bakteri yang digunakan dalam pengujian penyimpanan dipersiapkan dengan menumbuhkan isolat bakteri campuran pada 5 ml BHI. Sumber isolat yang digunakan adalah media yang pernah ditumbuhkan selama 10 jam.
Percobaan 1: Uji Kemampuan Fermentatif Isolat Bakteri In vitro
Campuran enam isolat bakteri rumen dibandingkan dengan bakteri cairan asal rumen segar sebagai perlakuan dalam kemampuannya mencerna komponen pakan. Sampel cairan rumen diambil dari sapi yang baru dipotong di Rumah Potong Hewan (RPH) PT. Elders yang terletak dalam kampus Fakultas Peternakan, Institut Pertanian Bogor. Isi rumen diperas dan filtratnya dimasukkan ke dalam termos. Sampel cairan rumen dipertahankan pada suhu 39oC dalam termos hingga digunakan.
15 Metode Tilley dan Terry (1963) digunakan untuk mengukur kecernaan bahan kering (KCBK) dan kecernaan bahan organik (KCBO), produksi NH3 dan VFA
(volatile fatty acids). Sampel untuk pengukuran konsentrasi NH3 dan VFA (volatile
fatty acids) diperoleh dengan fermentasi 4 jam. Kadar NH3 ditentukan dengan teknik
mikrodifusi conway, dan konsentrasi VFA total diukur dengan teknik destilasi uap. Pengukuran Kecernaan Bahan Kering dan Bahan Organik
Tabung fermentor berisi 40 ml larutan McDougall dan 0,5 g sampel rumput dimasukkan ke dalam shaker bath dengan suhu 39oC. Cairan rumen dimasukkan sebanyak 10 ml dan sebagian tabung uji ditambah cairan rumen steril 5 ml dan 5 ml (5% dari dari media bakteri pada fase eksponensial) campuran enam isolat bakteri cairan rumen kerbau, lalu dikocok dan dialiri gas CO2 selama 30 detik. Tabung
ditutup dengan karet berfentilasi dan difermentasi selama 48 jam. Pada akhir fermentasi (setelah 48 jam) tutup tabung fermentor dibuka dan cairan dicek pHnya, kemudian ditambah dua tetes HgCl jenuh untuk mematikan mikroba. Tabung disentrifusi selama sepuluh menit dengan kecepatan 3000 rpm dan endapannya ditambahkan 50 ml larutan pepsin-HCl. Inkubasi dilanjutkan selama 48 jam secara aerob. Akhir inkubasi larutan disaring menggunakan kertas Whatman no. 41 dan dibantu pompa vakum. Hasil saringan dimasukkan ke dalam cawan porselen dan dikeringkan pada 105oC untuk mengetahui residu bahan kering dan kemudian diabukan di dalam tanur 600oC untuk menghitung residu bahan organiknya. Kecernaan dihitung dengan rumus:
Keterangan: BK = bahan kering, BO = bahan organik Pengukuran Konsentrasi NH3 dan VFA
Pengukuran diawali dengan penyiapan sampel cairan dengan memasukkan tabung fermentor berisi 40 ml larutan McDougall, ke dalam shaker bath dengan suhu 39oC. Sebanyak 0,5 g sampel rumput dimasukkan ke dalam tabung dan diikuti dengan memasukan 10 ml cairan rumen dan sebagian tabung uji diisi 5 ml cairan rumen steril dan 5 ml campuran enam isolat bakteri. Tabung dikocok dan dialiri gas % KCBK = BKsampel (g) – (BKresidu(g) – BKbalnko(g)) x 100%
BKsampel
16 CO2 selama 30 detik dan ditutup karet berfentilasi dan difermentasi selama empat
jam. Pada akhir fermentasi tutup dibuka dan dicek pHnya, kemudian ditambah dua tetes HgCl. Tabung disentrifusi selama sepuluh menit dengan kecepatan 3000 rpm dan supernatan diambil untuk analisis NH3 dan VFA.
Pengukuran Konsentrasi NH3. Konsentrasi NH3 diukur dengan teknik Mikrodifusi
Conway (General Laboratory Procedures, 1969). Bibir cawan conway diolesi dengan vaselin, kemudian larutan NaCO3 sebanyak sebanyak 1 ml dan diletakkan sebelah
kiri dekat cawan, begitu juga dengan supernatan yang dihasilkan dari pencernaan fermentatif diambil sebanyak 1 ml dan diletakkan pada ruang sekat sebelah kanan yang lain. Larutan asam borat berindikator diambil sebanyak 1 ml dan diletakkan pada cawan kecil yang terletak di tengah cawan Conway. Setelah itu, cawan Conway ditutup rapat agar udara tidak dapat masuk, lalu digoyang-goyangkan sehingga larutan Na2CO3 jenuh bersampur dengan supernatan. Kemudian cawan dibiarkan
selama 24 jam pada suhu kamar. Setelah 24 jam dibuka dan amonia yang terikat dengan asam borat dititrasi dengan H2SO4 0.005 N sampai warna berubah
kemerah-merahan. Kadar N-NH3 dihitung dengan rumus berikut :
Pengukuran Volatile Fatty Acid. Konsentrasi VFA diukur dengan metode destilasi uap (General Laboratory Procedures, 1969). Presscooker diisi dengan aquades sampai tanda max, kemudian air pendingin dari kran dialirkan ke tabung destilasi. Air dipanaskan hingga menghasilkan uap yang akan masuk ke tabung-tabung destilasi sehingga analisis VFA dapat dimulai. Supernatan filtrat hasil fermentasi sebanyak 1 ml dimasukkan ke dalam tabung destilasi, setelah itu ditambahkan H2SO4
15% sebanyak 1 ml. Uap panas akan mendesak VFA dalam tabung destilasi dan terkondensasi di dalam pendingin. Destilat ditampung di dalam labu erlenmeyer yang berisi 5 ml NaOH 0,5 N hingga mencapai 250 ml. Indikator phenol pethalein (PP) ditambahkan sebanyak 2 tetes dan ditritasi dengan HCl 0,5 N sampai warna titrat berubah dari merah menjadi merah muda. Produksi VFA total dihitung dengan rumus: mM VFA total = (a-b) x N HCl x 1000/5; a = volume titran blanko, b = volume titran contoh.
N NH3 = ml H2SO4 x N H2SO4 x 1000
17 Rancangan Percobaan
Nilai KCBK dan KCBO rumput, kadar NH3, VFA dan pH media fermentasi
menggunakan dua sumber bakteri dibandingkan secara statistik. Metoda pengolahan menggunakan Uji-t berpasangan.
Percobaan 2: Uji Viability Isolat Bakteri Selama Penyimpanan Peubah yang Diamati
Peubah yang diamati yaitu jumlah koloni bakteri pada masing-masing media penyimpan setelah periode penyimpanan berakhir.
Rancangan Percobaan
Percobaan kedua menggunakan Rancangan Acak Lengkap (RAL) pola faktorial (4 x 3) dengan 3 ulangan. Faktor A yaitu media penyimpan (tanah, arang, tepung tapioka dan UMB). Media penyimpanan digunakan untuk menyimpan campuran enam isolat bakteri. Faktor B yaitu waktu penyimpanan (0,1 dan 2 minggu). Model matematik yang digunakan dalam analisa statistik adalah:
Xijk = μ + αi + j + ij + εijk
Keterangan:
Xijk = Nilai pengamatan faktor A ke -i, faktor B ke-j dan ulangan ke-k μ = Nilai rataan umum
αi = Pengaruh faktor media simpan ke-i (i= 0,1,2,3,)
j = Pengaruh faktor waktu simpan ke-j (j= 0,1,2)
ij = Pengaruh interaksi antara faktor A (media simpan) ke-i dan faktor B (waktu
simpan) ke-j
εijk = Error (galat) ke-i, ke-j dan ke-k.
Analisis Data
18 Penyiapan Media Penyimpanan
Empat bahan media yang digunakan yaitu tanah, arang, tepung, dan UMB. Tiga bahan media penyimpan yaitu tanah, arang, dan UMB dihaluskan, kemudian diayak, sedangkan tapioka yang diperoleh sudah dalam bentuk tepung halus. Bahan media kemudian dipanaskan dengan oven pada suhu 105oC untuk mendapatkan bahan kering (BK) tiap-tiap bahan. Selanjutnya bahan yang telah di oven tersebut ditimbang masing-masing 20 g di dalam plastik, dialiri gas CO2, plastik direkatkan
menggunakan menggunakan sealer. Kemudian semua bahan disterilisasi selama 1 jam menggunakan autoclave pada suhu 121oC selama 15 menit.
19 HASIL DAN PEMBAHASAN
Kadar Nutrien Berbagai Jenis Rumput
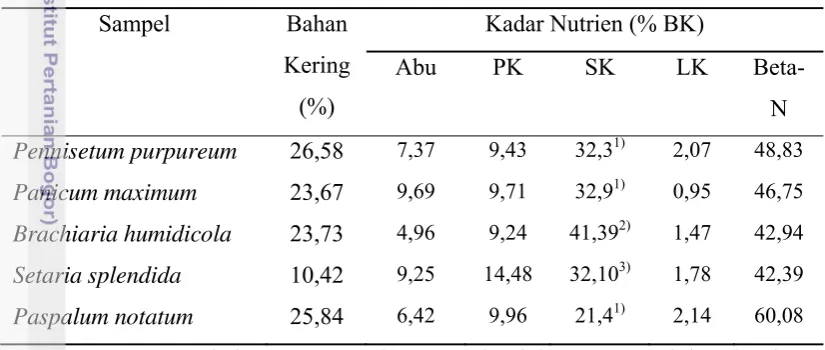
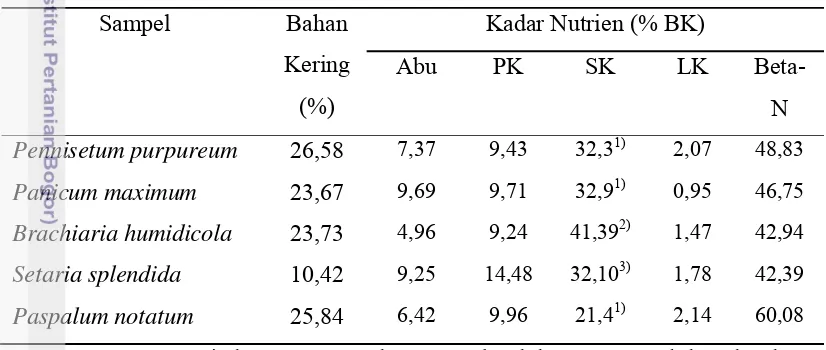
Kadar nutrien masing-masing jenis rumput yang digunakan berbeda-beda. Kadar serat dan protein kasar paling tinggi pada Setaria splendida, kadar lemak kasar yang paling tinggi terdapat pada Paspalum notatum dan bahan ekstrak tanpa nitrogen yang paling tinggi terdapat pada Penisetum purpureum. Sedangkan kadar abu yang paling tinggi terdapat pada Panicum maximum. Kadar nutrien masing-masing jenis rumput yang digunakan dalam penelitian ditunjukkan dalam Tabel 1. Namun secara umum, seluruh rumput yang digunakan mengandung serat kasar tinggi yang melebihi kadar 50% dengan kadar protein umumnya lebih kecil dari 10% kecuali Setaria splendida yang mencapai 14,48%.
Tabel 1. Komposisi Nutrien Berbagai Jenis Rumput yang Dikaji Kecernaannya Sampel Bahan Pennisetum purpureum 26,58 7,37 9,43 32,31) 2,07 48,83 Panicum maximum 23,67 9,69 9,71 32,91) 0,95 46,75 Brachiaria humidicola 23,73 4,96 9,24 41,392) 1,47 42,94 Setaria splendida 10,42 9,25 14,48 32,103) 1,78 42,39 Paspalum notatum 25,84 6,42 9,96 21,41) 2,14 60,08 Keterangan: PK= protein kasar; SK= serat kasar; LK= lemak kasar; Beta-N= bahan ekstrak tanpa
nitogen; 1). Sutardi (1981); 2). Meiaro; 3). Noorazimie
Kecernaan Bahan Kering dan Bahan Organik
20 tersebut berbeda adalah karena isolat bakteri mempunyai populasi total awal yang lebih sedikit dari pada bakteri rumen. Disamping itu kemungkinan jenis bakteri isolat lebih terbatas spesiesnya karena isolat yang digunakan merupakan pemurnian isolat selulolitik rumen, jadi kemungkinan isolat pendegradasi komponen non serat tidak ada sehingga efektifitas kecernaannya menurun. Namun data tersebut menunjukkan bahwa isolat bakteri rumen mampu mencerna komponen rumput yang diuji. Thalib el al. (2004) juga menguji kemampuan dua isolat bakteri (kerbau dan domba) dalam mencerna bahan pakan, dengan hasil yang menunjukkan bahwa kemampuan mencerna bahan juga lebih rendah dari kemampuan cairan rumen domba segar.
Tabel 2. Nilai Koefisien Cerna Bahan Kering (KCBK) dan Bahan Organik Berbagai Jenis Rumput (KCBO) oleh Bakteri Cairan Rumen Segar dan Isolat Bakteri Pennisetum purpureum 47,64±1,60 19,37±3,61 46,19±1,20 16,66±3,36 Panicum maximum 37,09±0,57 20,20±1,81 34,33±1,25 15,72±2,08 Brachiaria humidicola 38,14±0,00 21,60±1,01 36,81±0,28 21,41±2,69 Setaria splendida 42,09±0,39 22,56±3,16 39,70±1,38 18,78±2,79 Paspalum notatum 33,93±0,52 20,19±1,32 32,01±0,40 17,71±1,23 Rataan 39,78±5,27a
19,14±3,43b 37,81±5,49a 18,06±2,20b Keterangan: Superskrip dengan huruf kecil yang berbeda pada baris yang sama menunjukkan
perbedaan yang sangat nyata (P<0,01).
21 Perbedaan nilai koefisien cerna oleh isolat bakteri rumen pencerna serat yang besar dari koefisien cerna oleh bakteri cairan rumen, menggambarkan bahwa isolat bakteri rumen yang digunakan, yang berjumlah enam isolat, tidak seluruhnya berkemampuan mencerna serat kasar tinggi. Rifai (2010) juga melakukan pengujian kecernaan secara in vitro pada rumput gajah dan jerami padi menggunakan isolat bakteri tunggal, perbedaan KCBK antara cairan rumen segar dan isolat hanya 20% dan 11,1% serta KCBOnya 30,2% dan 15,2% perbedaannya. Nilai KCBK dan KCBO rumput gajah lebih tinggi dibanding jerami padi karena rumput gajah memiliki kandungan lignin yang lebih rendah dari jerami padi. Nilai kecernaan yang rendah pada inokulum (isolat bakteri) pada hijauan pakan yang digunakan karena pada perlakuan inokulum isolat bakteri hanya terdapat isolat murni pencerna serat sehingga populasinya juga rendah (Rifai, 2010). Hal lain yang kemungkinan terjadi adalah isolat bakteri tersebut tidak mampu mencerna komponen BETN secara sempurna, karena bakteri hanya mampu mencerna komponen serat. Namun penggunaan jenis sampel yang lebih bervariasi diperkirakan dapat menunjukkan kemampuan isolat bakteri yang sesungguhnya.
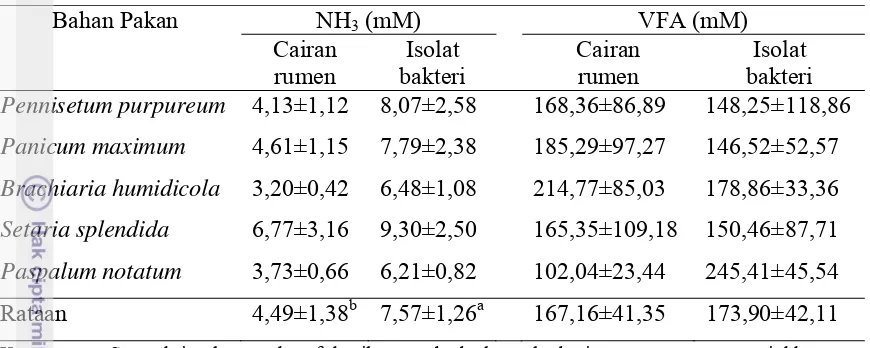
Konsentrasi NH3 dan VFA
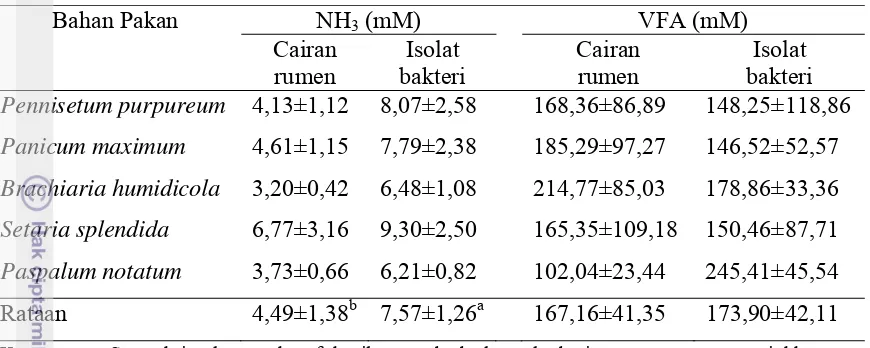
Kadar NH3 filtrat hasil fermentasi rumput dengan bakteri rumen dan isolat
bakteri ditunjukkan dalam Tabel 3. Kadar NH3 lebih tinggi pada hasil fermentasi
beberapa jenis rumput dengan isolat bakteri pencerna serat dari hasil fermentasi dengan cairan rumen segar. Amonia merupakan sumber nitrogen yang sangat penting untuk sintesis protein mikroba rumen. Amonia merupakan hasil perombakan asam amino dari komponen protein pakan (McDonald et al., 2002). Kadar NH3 oleh isolat
bakteri pencerna serat yang lebih tinggi dibanding oleh cairan rumen segar, menunjukkan bahwa isolat bakteri pencerna serat memiliki kemampuan mendegradasi protein lebih tinggi karena isolat bakteri memiliki tingkat adaptasi yang baik terhadap pakan-pakan rumput. Disamping itu data tersebut menunjukkan bahwa isolat bakteri rumen diperkirakan mempunyai kebutuhan akan nitrogen yang tinggi namun kurang mampu memanfaatkan NH3 yang dihasilkannya dengan cepat
22 Tabel 3. Konsentrasi NH3 dan VFA Berbagai Jenis Rumput oleh Bakteri Cairan
Rumen Segar dan Isolat Bakteri
Bahan Pakan NH3 (mM) VFA (mM) Pennisetum purpureum 4,13±1,12 8,07±2,58 168,36±86,89 148,25±118,86 Panicum maximum 4,61±1,15 7,79±2,38 185,29±97,27 146,52±52,57 Brachiaria humidicola 3,20±0,42 6,48±1,08 214,77±85,03 178,86±33,36 Setaria splendida 6,77±3,16 9,30±2,50 165,35±109,18 150,46±87,71 Paspalum notatum 3,73±0,66 6,21±0,82 102,04±23,44 245,41±45,54 Rataan 4,49±1,38b 7,57±1,26a 167,16±41,35 173,90±42,11 Keterangan: Superskrip dengan huruf kecil yang berbeda pada baris yang sama menunjukkan
perbedaan yang sangat nyata (P<0,01).
Kadar VFA filtrat hasil fermentasi rumput oleh isolat bakteri rumen ditunjukkan dalam Tabel 3. Kadar VFA sama tingginya pada hasil fermentasi beberapa jenis rumput dengan isolat bakteri pencerna serat dengan hasil fermentasi dengan cairan rumen segar. Hal ini menunjukan bahwa kemampuan isolat bakteri dalam memfermentasi komponen pakan rumput cukup tinggi dibandingkan dengan bakteri cairan rumen walaupun mempunyai kecernaan bashan kering yang lebih rendah. Penyebab kondisi tersebut adalah karena populasi bakteri pada isolat bakteri lebih spesifik dalam mencerna serat kasar.
Terdapat kadar VFA filtrat yang sangat tinggi baik pada hasil fermentasi dengan bakteri rumen mapun dengan isolat bakteri, namun penyebab tingginya kadar VFA tersebut tidak diketahui. Namun salah satu kemungkinan adalah rendahnya kemampuan baik bakteri cairan rumen maupun bakteri isolat dalam mengkonversi VFA dan NH3 ke dalam komponen sel bakteri. Konsentrasi VFA cairan rumen yang
mendukung pertumbuhan mikroorganisme rumen berkisar antara 80 – 160 mM (Sutardi, 1980).
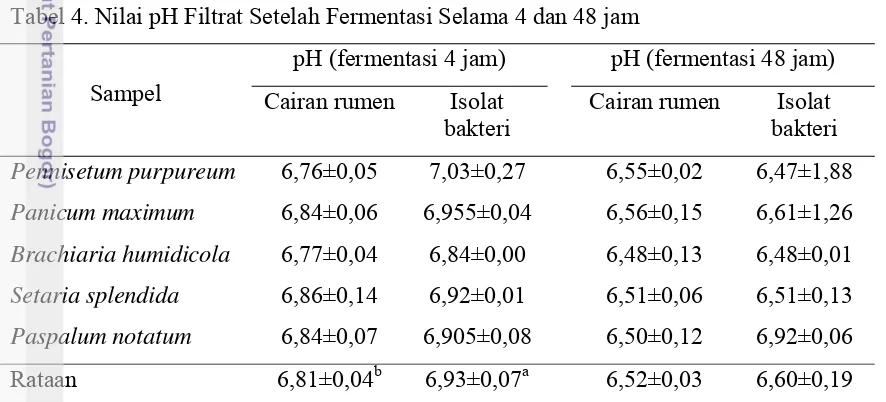
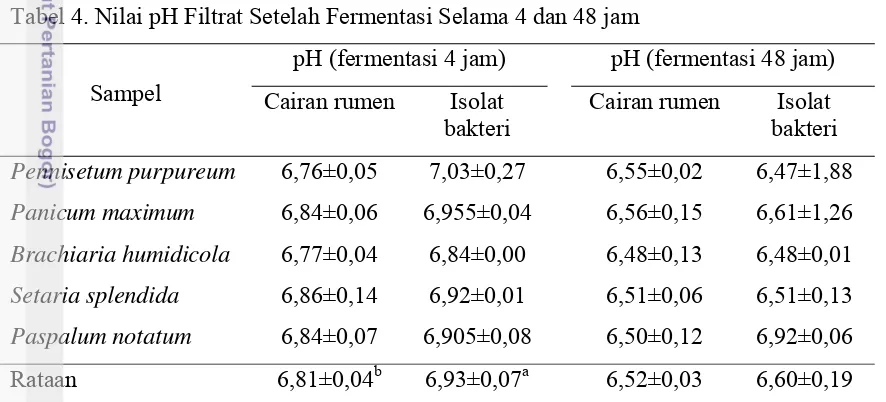
Nilai pH Filtrat pada Inokulum Cairan Rumen dan Isolat Bakteri setelah Difermentasi
23 dibanding filtrat hasil fermentasi cairan rumen setelah diinkubasi selama 4 jam. Nilai pH filtrat hasil fermentasi 4 jam berkorelasi dengan kadar NH3 dan VFA filtrat.
Nilai tersebut menunjukkan bahwa kadar NH3 dalam kondisi larutan tersebut lebih
besar pengaruhnya terhadap pH dengan koefisien korelasi (kk) 0,81 (P<0,01) dibandingkan dengan kadar VFA dengan nilai korelasi -0,22. Kenaikan pH tidak terkait langsung dengan kadar NH3 larutan, namun tingginya kadar NH3
menggambarkan bahwa terjadi fermentasi yang intensif. Kondisi tersebut memungkinkan dihasilkan VFA dan asam laktat. Nilai pH filtrat hasil fermentasi 48 jam tidak berbeda nyata antara cairan rumen dengan isolat bakteri, dan nilai pHnya dalam kondisi normal. Hal ini kemungkinan terjadi akibat penimbunan pada filtrat terutama VFA dari hasil fermentasi oleh kedua sumber bakteri walaupun kemampuan mencerna komponen rumput oleh kedua sumber bakteri tersebut berbeda.
Tabel 4. Nilai pH Filtrat Setelah Fermentasi Selama 4 dan 48 jam
Sampel
pH (fermentasi 4 jam) pH (fermentasi 48 jam) Cairan rumen Isolat
bakteri
Cairan rumen Isolat bakteri Pennisetum purpureum 6,76±0,05 7,03±0,27 6,55±0,02 6,47±1,88 Panicum maximum 6,84±0,06 6,955±0,04 6,56±0,15 6,61±1,26 Brachiaria humidicola 6,77±0,04 6,84±0,00 6,48±0,13 6,48±0,01 Setaria splendida 6,86±0,14 6,92±0,01 6,51±0,06 6,51±0,13 Paspalum notatum 6,84±0,07 6,905±0,08 6,50±0,12 6,92±0,06 Rataan 6,81±0,04b 6,93±0,07a 6,52±0,03 6,60±0,19 Keterangan: Superskrip dengan huruf kecil yang berbeda pada baris yang sama menunjukkan
perbedaan yang sangat nyata (P<0,01).
Daya Hidup Isolat Bakteri Selama Penyimpanan
24 yang tinggi dan daya simpan yang lama. Namun kendala penyimpanan kering beku adalah biaya pengeringan yang mahal dan memerlukan peralatan yang khusus terlebih lagi jika bakteri tersebut anaerob.
Penyimpanan kering menggunakan media tanah dan arang telah umum dilakukan dengan berbagai keunggulan (Machmud 2001; Malik 1990). Daya hidup isolat bakteri rumen yang disimpan dalam media yang berbeda menunjukan pola yang berbeda. Gambar1 menunjukkan bahwa populasi bakteri pada penyimpanan 0 minggu sama pada media tanah, tepung, dan arang, kecuali pada UMB menunjukkan populasi yang lebih tinggi dari yang disimpan pada media tanah dan arang. Pada penyimpanan 1 minggu populasi bakteri sama pada media tepung, arang, dan UMB, sedangkan pada media tanah populasi meningkat sehingga berbeda dengan yang disimpan dalam media UMB. Pada penyimpanan 2 minggu populasi bakteri pada semua media sama. Populasi bakteri pada minggu pertama meningkat khususnya jika disimpan pada media tanah. Namun jika penyimpanan dilanjutkan hingga 2 minggu populasi bakteri menurun kembali mencapai populasi seperti pada awal penyimpanan kecuali pada yang disimpan di UMB. Pola perubahan populasi selama penyimpanan tersebut mengindikasikan bahwa bakteri pada minggu pertama mengalami pertumbuhan. Bakteri selama penyimpanan diperkirakan mampu memanfaatkan media tumbuh yang berada di sekitarnya.
26 KESIMPULAN DAN SARAN
Kesimpulan
Dari penelitian dapat disimpulkan bahwa dari sudut fermentabilitas, isolat bakteri asal rumen kerbau tidak berbeda dengan cairan rumen segar. Namun, dari sudut kecernaan, kemampuan isolat bakteri asal rumen kerbau baru mencapai 50% dari kemampuan cairan rumen segar. Dari sudut penyimpanan, isolat bakteri asal rumen kerbau dapat disimpan dalam tanah, tepung tapioka, atau arang selama satu minggu.
Saran
POTENSI ISOLAT BAKTERI RUMEN KERBAU PENCERNA
SERAT DALAM MEMFERMENTASI BERBAGAI JENIS
RUMPUT DAN DAYA HIDUPNYA
SELAMA PENYIMPANAN
SKRIPSI
Yulfita Sari
DEPARTEMEN ILMU NUTRISI DAN TEKNOLOGI PAKAN FAKULTAS PETERNAKAN
POTENSI ISOLAT BAKTERI RUMEN KERBAU PENCERNA
SERAT DALAM MEMFERMENTASI BERBAGAI JENIS
RUMPUT DAN DAYA HIDUPNYA
SELAMA PENYIMPANAN
SKRIPSI
Yulfita Sari
DEPARTEMEN ILMU NUTRISI DAN TEKNOLOGI PAKAN FAKULTAS PETERNAKAN
RINGKASAN
YULFITA SARI. D24070046. 2012. Potensi Isolat Bakteri Rumen Kerbau Pencerna Serat dalam Memfermentasi Berbagai Jenis Rumput dan Daya Hidupnya Selama Penyimpanan. Skripsi. Departemen Ilmu Nutrisi dan Teknologi Pakan, Fakultas Peternakan, Institut Pertanian Bogor.
Pembimbing Utama : Prof. Dr. Ir. Toto Toharmat, MAgrSc. Pembimbing Anggota : Dr. Ir. Dwierra Evvyernie A., MS., MSc.
Cairan rumen merupakan inokulum yang mengandung mikroorganisme dalam jumlah besar. Populasi dan jenis mikroorganisme dapat bervariasi tergantung kepada jenis pakan, frekuensi pemberian pakan dan waktu pengambilannya. Isolat bakteri asal rumen kerbau juga inokulum yang merupakan sebagian dari mikroorganisme rumen dan diperkirakan dapat digunakan untuk evaluasi nilai nutrisi pakan. Isolat bakteri rumen tersebut mempunyai kemampuan dalam mencerna komponen serat pakan (Astuti, 2010; Gayatri 2010). Rifai (2010) melaporkan bahwa isolat bakteri rumen kerbau secara tunggal mampu mencerna bahan kering rumput gajah dan jerami padi hingga berturut-turut 48,8% dan 41,1%. Namun kemampuannya dalam mencerna komponen beberapa hijauan pakan belum diteliti lebih jauh. Di samping itu pemanfaatan secara luas dibatasi oleh bentuknya yang cair, anaerob dan sulit disimpan. Oleh karena itu tujuan lain dari penelitian ini adalah mengkaji kemampun isolat bakteri rumen dalam mencerna hijauan pakan dan mengkaji daya hidup isolat bakteri tersebut dalam media penyimpanan yang berbeda.
Penelitian ini dilakukan in vitro dalam dua tahap. Tahap pertama membandingkan kemampuan campuran enam isolat bakteri asal rumen kerbau dengan bakteri rumen segar sebagai perlakuan dalam mencerna berbagai hijauan pakan menggunakan uji-t berpasangan. Hijauan pakan tersebut: Pennisetum purpureum, Panicum maximum, Paspalum notatum, Setaria splendida, dan Brachiaria humidicola. Umumnya serat kasar di atas 50% dan protein kasar di bawah 10%, kecuali pada Setaria splendida. Parameter yang diamati yaitu koefisien cerna bahan kering dan bahan organik (KCBK dan KCBO), NH3 dan VFA.Tahap kedua menggunakan Rancangan Acak Lengkap (RAL) pola faktorial (4 x 3) dengan faktor A adalah media penyimpan (tanah, arang, tepung tapioka dan UMB ) dan faktor B adalah waktu penyimpanan (0, 1, dan 2 minggu) dengan 3 ulangan. Data yang diperoleh dianalisis dengan sidik ragam (Analysis of Variance) Parameter yang diamati yaitu viability isolat bakteri selama penyimpanan.
dengan yang disimpan dalam media UMB. Jika penyimpanan dilanjutkan hingga 2 minggu populasi bakteri pada semua media sama dengan populasi bakteri pada awal penyimpanan kecuali pada yang disimpan di UMB. Dari penelitian dapat disimpulkan bahwa dari sudut fermentabilitas, isolat bakteri asal rumen kerbau tidak berbeda dengan cairan rumen segar. Namun, dari sudut kecernaan, kemampuan isolat bakteri asal rumen kerbau baru mencapai 50% dari kemampuan cairan rumen segar. Dari sudut penyimpanan, isolat bakteri asal rumen kerbau dapat disimpan dalam tanah, tepung tapioka, atau arang selama satu minggu.
ABSTRACT
The Potency of Buffalo Rumen Bacteria Isolates in Fermenting Various Herbage and Their Viability during Storage
Sari. Y, T. Toharmat, dan D. Evvyernie
An experiment was aimed to review the ability of isolate to digest the components of forage and the viability of isolate in different storage media. The first trial was to compare the ability of a mixture of six isolates bacteria isolated from buffalo rumen with bacteria from fresh rumen as treatment to digest various forages using t-test. The grasses used in the experiment were Pennisetum purpureum, Panicum maximum, Paspalum notatum, Setaria splendida, dan Brachiaria humidicola. In general, crude fiber content of grasses was above 50% and crude protein was less than 10%, except for Setaria splendid. The second trial applied completely randomized design with 4 x 3 factorial design. Factor A was the storage media (soil, charcoal, tapioca flour and Urea Molasses Block (UMB) and factor B was storage time (0, 1, and 2 weeks). Data were analyzed by Analysis of Variance and significant differences were further evaluated using Duncan Multiple Range Test. The results indicated that coefisien digestibility of dry and organic matter of grasses were lower when the grasses was fermented by the rumen bacteria isolates than those by bacteria in fresh rumen liquor (P< 0.01). On the other hand, ammonia production was higher when rumen bacteria isolates were used (P<0.01) and VFA production was similar when the grasses were fermented either by the rumen bacteria isolates or fresh rumen bacteria. There was a different viability pattern of bacteria isolates preserve different media for two weeks. However, the result indicated that bacteria isolates could be preserved in soil, tapioca powder, or charcoal for one week.
POTENSI ISOLAT BAKTERI RUMEN KERBAU PENCERNA
SERAT DALAM MEMFERMENTASI BERBAGAI JENIS
RUMPUT DAN DAYA HIDUPNYA
SELAMA PENYIMPANAN
YULFITA SARI D24070046
Skripsi ini merupakan salah satu syarat untuk memperoleh gelar Sarjana Peternakan pada
Fakultas Peternakan Institut Pertanian Bogor
DEPARTEMEN ILMU NUTRISI DAN TEKNOLOGI PAKAN FAKULTAS PETERNAKAN INSTITUT PERTANIAN BOGOR
Judul Skripsi: Potensi Isolat Bakteri Rumen Kerbau Pencerna Serat dalam Memfermentasi Berbagai Jenis Rumput dan Daya Hidupnya Selama Penyimpanan
Nama : Yulfita Sari NIM : D24070046
Menyetujui,
Pembimbing Utama, Pembimbing Anggota,
(Prof. Dr. Ir. Toto Toharmat, MAgrSc.) (Dr. Ir. Dwierra Evvyernie A., MS.MSc.) NIP: 19590902 198303 1 003 NIP: 19610602 198603 2 001
Mengetahui: Ketua Departemen
Ilmu Nutrisi dan Teknologi Pakan
(Dr. Ir. Idat G. Permana, MSc.Agr.) NIP: 19670506 199103 1 001
RIWAYAT HIDUP Penulis dilahirkan di Kota Bukittinggi, Sumatera Barat pada tanggal 7 September 1989 dari pasangan Bapak Jefrialdi dan Ibu Ratnawilis(Almh). Penulis mengawali pendidikan dasarnya di Sekolah Dasar Negeri 52 Surau Bacamin pada tahun 1995 dan diselesaikan pada tahun 2001. Pendidikan lanjutan pertama dimulai oleh penulis pada tahun 2001 dan diselesaikan pada tahun 2004 di Madrasah Tsanawiyah Negeri (MTsN) Bukareh. Penulis melanjutkan pendidikan ke Sekolah Menengah Atas Negeri (SMAN) 1 Kamang Magek pada tahun 2004 dan diselesaikan pada tahun 2007.
KATA PENGANTAR
Alhamdulillahirabbil’alamin. Puji syukur penulis panjatkan kehadirat Allah SWT yang telah memberikan rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan penulisan skripsi ini sebagai salah satu syarat untuk memperoleh gelar Sarjana Peternakan pada Fakultas Peternakan. Penelitian ini berjudul: Potensi Isolat Bakteri Rumen Kerbau Pencerna Serat dalam Memfermentasi Berbagai Jenis Rumput dan Daya Hidupnya Selama Penyimpanan. Skripsi ini ditulis berdasarkan hasil penelitian yang penulis lakukan mulai bulan Juli 2011 – Februari 2012 bertempat di Laboratorium Ilmu Nutrisi Ternak Perah, Departemen Ilmu Nutrisi dan Teknologi Pakan, Fakultas Peternakan, Institut Pertanian Bogor.
Tujuan dari penelitian ini adalah untuk mengkaji kemampun enam campuran isolat bakteri dalam mencerna komponen hijauan pakan dan mengkaji daya hidup enam campuran isolat bakteri tersebut dalam media penyimpanan yang berbeda.
Penulis dengan rendah hati mengucapkan terima kasih kepada seluruh pihak yang telah membantu penulis sehingga penulisan skripsi ini dapat terselesaikan dengan baik. Semoga skripsi ini dapat bermanfaat khususnya bagi pembaca dan penulis sendiri.
Bogor, Mei 2012
DAFTAR ISI Teknik Evaluasi Nilai Nutrisi Hijauan Pakan ... 3 Metode In vitro ... 3 Volatile Fatty Acid (VFA) ... 4 Amonia (NH3) ... 4 Rumput ... 5 Bakteri Rumen ... 7 Penyimpanan dan Pemeliharaan Bakteri ... 8 Pengeringan Beku (Freeze dried) ... 9 Percobaan 1: Uji Kemampuan Fermentatif Isolat Bakteri In vitro 14
Rancangan Percobaan ... ... 17 Analisis Data ... ... 17 Penyiapan Media Penyimpanan ... ...18 HASIL DAN PEMBAHASAN ... ...19 Kadar Nutrien Berbagai Jenis Rumput ... ... 19 Kecernaan Bahan Kering dan Bahan Organik ... ...19 Konsentrasi NH3 dan VFA ... ... 21
Nilai pH filtrat pada Inokulum Cairan Rumen dan Isolat Bakteri
setelah Difermentasi ... ...22 Daya Hidup Isolat Bakteri Selama Penyimpanan ... ...23 KESIMPULAN DAN SARAN ... .. 26
DAFTAR TABEL
Nomor Halaman
1. Komposisi Nutrien Berbagai Jenis Rumput yang Dikaji Kecernaannya ... 19 2. Nilai Koefisien Cerna Bahan Kering (KCBK) dan Bahan Organik
Berbagai Rumput (KCBO) oleh Bakteri Cairan Rumen Segar dan
Isolat Bakteri ... 20 3. Konsentrasi NH3 dan VFA Berbagai Jenis Rumput oleh Bakteri
DAFTAR GAMBAR
Nomor Halaman
1. Populasi Isolat Bakteri pada Media dan Lama Penyimpanan yang berbeda ... 24
1 PENDAHULUAN
Latar belakang
Rumen mempunyai beberapa spesies bakteri yang jumlah maupun jenisnya sangat bervariasi. Spesies-spesies bakteri tersebut dapat berinteraksi dengan protozoa melalui hubungan simbiosa dan mampu mencerna komponen selulosa, hemiselulosa, dan pati yang merupakan polimer tumbuhan (Arora, 1989). Bakteri rumen kerbau telah diisolasi oleh Astuti (2010) dan Gayatri (2010) dan memiliki kemampuan sebagai degrader sumber serat. Rifai (2010) menunjukkan bahwa isolat bakteri kerbau mampu mendegradasi rumput gajah dan jerami padi, namun belum terbukti dalam mendegradasi berbagai rumput. Beberapa jenis rumput unggul yang telah banyak dikenal peternak di Indonesia adalah Pennisetum purpureum (rumput gajah), Panicum maximum (rumput benggala), Paspalum notatum (rumput bahia), Setaria splendida (setaria gajah) dan Brachiaria humidicola. Rumput mengandung serat kasar yang tinggi dan merupakan sumber energi yang sangat potensial bagi ruminansia. Karakteristik isolat bakteri tersebut memungkinkan untuk digunakan dalam berbagai tujuan diantaranya sebagai sebagai sumber inokulum, untuk evaluasi pakan juga sebagai probiotik.
Evaluasi kualitas pakan ternak ruminansia diantaranya dilakukan dengan teknik in vitro dengan menggunakan bakteri rumen segar (Tilley dan Terry, 1963). Penggunaan rumen segar memungkinkan dihasilkannya nilai nutrisi yang bervariasi akibat jenis dan populasi bakteri rumen segar yang digunakan tidak seragam akibat perbedaan pakan dan waktu pengambilan cairan rumen. Oleh karena itu isolat bakteri rumen diharapkan dapat digunakan sebagai alternatif pengganti cairan rumen sebagai sumber inokulum (Hadziq, 2011; Yunitasari, 2011) dan perlu mempelajari potensi pemananfaatan isolat bakteri tersebut
2 inangnya (Schrezenmeir dan de Vrese, 2001). Namun probiotik harus memenuhi beberapa persyaratan diantaranya stabil dalam penyimpanan, mampu bertahan hidup sampai saluran pencernaan bagian belakang, dan memberikan pengaruh yang menguntungkan pada ternak (Puspitek LIPI, 2009).
Isolat bakteri rumen dalam bentuk media cair mudah disiapkan namun sulit untuk diaplikasikan dan sangat sensitif terhadap perubahan pH, suhu, maupun kandungan oksigen (O2) media, sehingga perlu upaya untuk meningkatkan daya
hidup dalam bentuk padat sehingga dapat meningkatkan manfaat isolat bakteri. Salah satu teknik yang dapat digunakan yaitu pengembangan teknik penyimpanan bakteri dalam bentuk padat atau media padat. Upaya penyimpanan dalam media kering ini memungkinkan isolat bakteri rumen dapat dengan mudah ditangani selama penyimpanan dan pengiriman dari satu tempat ke tempat lain sehingga perlu diketahui masa penyimpanan dan media yang tepat agar daya hidup (viability) isolat tersebut masih tinggi. Kemudahan pengiriman memungkinkan isolat bakteri rumen digunakan untuk berbagai tujuan termasuk sebagai inokulan pengganti cairan rumen atau starter pada pedet periode menyusu atau probiotik. Penelitian ini didisain untuk mengkaji kemampuan enam campuran isolat bakteri dalam mencerna hijauan pakan dan daya hidupnya selama penyimpanan.
Tujuan
3 TINJAUAN PUSTAKA
Teknik Evaluasi Nilai Nutrisi Hijauan Pakan
Metode In vitro
Metode in vitro merupakan metode evaluasi nilai nutrisi pakan dengan melalui pengukuran kecernaan menggunakan mikroorganisme rumen dari cairan rumen segar. Metode ini memakai dasar sistem pencernaan dua tahap. Tahap pertama meliputi perlakuan fermentasi bahan pakan termasuk hijauan dalam fermentasi in vitro menggunakan mikroba cairan rumen segar selama 48 jam. Pencernaan tahap kedua adalah pencernaan hidrolisis komponen bahan kering oleh pepsin. Pencernaan tahap pertama mensimulasi pencernaan dalam rumen dan tahap kedua mensimulasi pencernaan yang terjadi di dalam organ alat pencernaan pasca rumen. Nilai koefisien cerna yang diperoleh dari teknik analisis in vitro tersebut mendekati hasil dengan sistem in vivo (Tilley dan Terry, 1963).
Metode in vitro Tilley dan Terry (1963) yang dimodifikasi oleh Makkar (2002) merupakan proses metabolisme nutrien pakan yang terjadi di dalam rumen dan abomasum atau di luar tubuh ternak. Metode ini sering digunakan untuk menduga kecernaan komponen bahan pakan dalam saluran pencernaan ternak. Teknik in vitro ini memberikan hasil analisa yang cepat dan proses yang murah, serta dapat digunakan untuk mengevaluasi bahan pakan dalam jumlah besar. Namun metode ini sulit diterapkan pada material seperti sampel jaringan atau fraksi dinding sel (Makkar, 2002).
4 Volatile Fatty Acid (VFA)
Ternak ruminansia memiliki mikroba (bakteri dan protozoa) di dalam alat pencernaannya yang merombak nutrien secara fermentatif sehingga menjadi senyawa lain yang berbeda dari molekul nutrien asalnya (Sutardi,1980). Produk akhir yang terpenting dari fermentasi adalah asam lemak terbang atau volatile fatty acids (VFA) terutama asetat, propionat, butirat serta produk lainnya termasuk CO2, methan, dan
panas. Ruminansia menggunakan VFA sebagai sumber energi untuk proses hidupnya (Church dan Pond, 1988; Sutardi 1980). Beberapa spesies bakteri memproduksi amonia dan VFA berantai cabang dari asam-asam amino tertentu. Konsentrasi VFA dalam abomasum adalah setengahnya dari yang ada di dalam cairan rumen. Meskipun sebagian besar absorpsi VFA terjadi dalam omasum, tetapi sejumlah besar masuk ke dalam abomasum (Arora, 1989).
Volatile Fatty Acid (asam lemak terbang) merupakan salah satu produk fermentasi karbohidrat di dalam rumen yang menjadi sumber energi utama bagi ternak ruminansia dan dapat menyumbang 55-60% dari kebutuhan energinya. Konsentrasi VFA dapat dijadikan salah satu tolak ukur fermentabilitas pakan dan sangat erat kaitannya dengan aktivitas mikroba rumen (Parakkasi, 1999).
Amonia (NH3)
Protein pakan di dalam rumen dipecah oleh mikroba menjadi peptide dan asam amino, beberapa asam amino dipecah lebih lanjut menjadi ammonia. Protein mengalami degradasi intensif di dalam rumen pada pH 6,5 (Blackburn dan Hobson, 1960). Ammonia diproduksi bersama dengan peptide dan asam amino yang akan digunakan oleh mikroba rumen dalam pembentukan protein mikroba (McDonald et a.l, 2002).
Produksi NH3 berasal dari protein yang didegradasi oleh enzim proteolitik. Di
5 degradasi maka konsentrasi ammonia dalam rumen akan rendah dan pertumbuhan mikroba rumen akan lambat yang menyebabkan turunnya kecernaan pakan (McDonald et al, 2002).
Amonia yang dibebaskan dalam rumen sebagian dimanfaatkan oleh mikroba untuk mensintesis protein tubuhnya (Arora, 1989). Menurut McDonald et al. (2002), kisaran konsentrasi NH3 yang optimal untuk sintesis protein oleh mikroba rumen
adalah 6 - 21 mM. Konsentrasi nitrogen amonia sebesar 5% sudah mencukupi kebutuhan nitrogen mikroba. Amonia di dalam rumen akan diproduksi terus-menerus walaupun sudah terjadi akumulasi (Sutardi, 1977). Faktor utama yang mempengaruhi penggunaan NH3 adalah ketersediaan karbohidrat dalam ransum yang
berfungsi sebagai sumber energi untuk pembentukan protein mikroba. Menurut Sutardi (1977), agar NH3 dapat dimanfaatkan oleh mikroba penggunaannya perlu
disertai dengan sumber energi yang mudah difermentasi, misalnya dedak padi. Rumput
Rumput daerah tropika mengandung kadar protein yang rendah dan serat kasar yang tinggi bila dibandingkan dengan rumput daerah beriklim sedang yang dipotong pada fase pertumbuhan yang sama. Di lain pihak produksi kadar bahan kering jenis rumput daerah tropika sering jauh lebih tinggi dari pada rumput daerah sedang (McIlroy, 1976; Close dan Menke, 1986). Arora (1989) menyatakan bahwa rumput tropika memiliki banyak lignin daripada rumput yang tumbuh di daerah beriklim sedang. Lignin dinding sel mempengaruhi proses pencernaan pakan dalam saluran pencernaan. Rumput dengan kandungan lignin rendah tetapi mempunyai lebih banyak dinding sel kurang dapat dicerna dibanding legum yang mempunyai lignin dua kali lebih banyak karena mempunyai kandungan dinding sel yang lebih rendah dari pada rumput atau graminae (Arora, 1989; Ogimoto dan Imai, 1981).
6 rumen mampu membantu pencernaan selulosa untuk menghasilkan molekul gula sederhana atau produk fermentasi seperti volatile fatty acids (VFA) yang merupakan sumber energi utama asal pakan pada ruminansia. Bahan kering pakan khususnya rumput pada ruminasia sebagaian besar dicerna dalam rumen (Arora, 1989).
Rumput gajah merupakan tanaman tahunan, berumpun, secara alami terdapat di sungai dan aliaran-aliran air, serta tersebar di seluruh Afrika Utara. Tingginya dapat mencapai 4,5 m. Rumput ini disukai oleh ternak, tahan kering, dan produksinya tinggi. Di daerah lembab atau dengan irigasi produksinya dapat mencapai lebih dari 290 ton rumput segar/ ha/ tahun (McIlroy, 1976). Rumput gajah mempunyai kadar nutrien yang lebih baik dari jenis rumput lainnya. Rumput gajah dapat mengandung 9,2% - 13,4% abu, 1-2%, lemak kasar, 36,6 - 38,8% serat kasar, 40,3 – 42,4% bahan ektrak tanpa nitrogen (BETN), dan 5,5 - 10,7% protein kasar (Batubara dan Manurung, 1990; Hartadi et al., 1986).
Rumput benggala (Panicum maximum) merupakan tanaman tahunan, berumpun, dan tingginya dapat mencapai 0,5 – 4,5m dan memerukan curah hujan 1000 – 1800 mm per tahun.Tanaman ini berasal dari Afrika tropika dan subtropika, serta terdapat pada seluruh daerah tropika humida dan subtropika. Rumput ini disukai oleh ternak, tidak sekasar rumput gajah dan kandungan proteinnya lebih tinggi dibanding rumput tropikal lainnya (4 – 14%). Produksi hijauan segar sebanyak 115 ton/ha/tahun (McIlroy, 1976; Close dan Menke, 1986). Komposisi nutrien rumput benggala adalah sebagai beriku 11,4% abu, 1% lemak kasar, 40,3% serat kasar, 42,3% BETN, 4,9% protein kasar (Hartadi et al., 1986).
7 Rumput setaria gajah (Setaria splendida) merupakan salah satu hijauan pakan yang produktif dan mudah cara penanamannya. Setaria splendida serupa dengan Setaria sphacellata, tetapi lebih besar, lebih tinggi, dan lebih tegar dibanding kultivar komersil lain. Rumput setaria gajah sangat disukai oleh ternak, merupakan rumput tahunan, tumbuh tegak, berumpun dengan tinggi 1,5-3,5 m. panjang daun bisa mencapai 70 cm dengan lebar 12-20 mm. (Bogdan, 1977). Komposisi nutrien Setaria splendida adalah sebagai berikut: 13,8% abu, 34,5% serat kasar, 8,6% protein kasar, dan 41% BETN (Batubara dan Manurung, 1990).
Brachiaria humidicola merupakan tanaman rumput tahunan yang mempunyai banyak stolon dan rizoma dan membentuk lapisan penutup tanah yang padat. Tumbuh pada beragam jenis tanah mulai dari tanah sangat asam (pH 3,5) dan tidak subur, tanah dengan Alumunium tinggi, tanah liat berat merekah, sampai tanah pasir berbatu pH tinggi. Kebutuhan rumput akan unsur Ca rendah. Tahan terhadap tanah berpengairan buruk dan sering ditemukan pada tanah liat basah musiman. B. humidicola memerlukan 1000-4000 mm curah hujan tahunan dengan distribusi yang baik. Kurang baik pada lingkungan dengan curah hujan tahunan <1600 mm dan >6 bulan musim kering. B. humidicola tumbuh paling baik pada lingkungan dataran rendah tropis pada lintang sampai 27o, dengan ketinggian sampai 1000 m.
Kadar protein rumut B. humidicola dapat mencapai PK 5-17%. Kecernaan bahan kering rumput berkisar antara 48-75%. Biasanya kualitas rumput tersebut lebih rendah dibanding spesies Brachiaria yang lain (B. decumbens , B. brizantha atau B. ruziziensis ) dengan kecernaan menurun dengan cepat bila tidak digembalai (Tropical Forages, 2005).
Bakteri Rumen
8 Beberapa bakteri rumen yang dominan adalah bakteri selulolitik. Bakteri rumen dapat digolongkan ke dalam bakteri selulolitik, bakteri amilolitik, bakteri hemiselulolitik, bakeri proteolitik dan lipolitik. Bakteri selulolitik diantarnya adalah Bacteriodes succinogenes, Butyrivibrio fibrisolvens, Ruminococcus albus, Clostridium lochheadii, Clostridium longisporum, Cillobacterium cellulosolvens. Bakteri amilolitik diantaranya yaitu Streptococcus bovis, Bacteroides amylophilus, Bacteroides ruminicola, Succinimonas amylolytica, dan Selenomonas ruminantium. Sejumlah bakteri selulotik juga merupakan bakteri amilolitik contohnya Clostridium lochheadii, Bacteriodes succinogenes, Butyrivibrio fibrisolvens (Hungate, 1966).
Bakteri hemiselulolitik diantaranya Eubacterium, Bacteroides amylogenes, Bacteroides ruminicola, Butyrivibrio fibrisolvens, Ruminococcus flavefaciens, dan Ruminococcus albus. Bakteri metanogenik yaitu Methanobacterium ruminantium. Mikroorganisme rumen tumbuh pada kondisi dengan cairan rumen anaerob, pH 5 – 7,5. Temperatur di dalam rumen adalah 38-42oC (Arora, 1989; Ogimoto dan Imai, 1981; Hungate, 1966).
Penyimpanan dan Pemeliharaan Bakteri
Pembuatan dan penyimpanan koleksi (preservasi) mikroba diperlukan untuk menjaga agar biakan mikroba tetap hidup, sifat mikroba tetap stabil dan tidak berubah, serta hemat biaya dan tenaga. Metode penyimpanan yang dipilh sangat tergantung pada sifat mikroba dan tujuan preservasi. Sifat mikroba tercermin dalam (1) ciri-ciri morfologi mikroba yang beragam, (2) ciri-ciri fisiologi dan biokimia mikroba, (3) dan kemampuan mikroba bertahan hidup baik dalam lingkunan alaminya maupun lingkungan buatan (Machmud, 2001).
Koleksi dan preservasi mikroba meliputi tujuan jangka pendek dan jangka panjang. Preservasi jangka pendek dilakukan untuk keperluan rutin penelitian yang disesuaikan dengan kegiatan program atau proyek tertentu. Preservasi jangka panjang dilakukan dalam kaitannya dengan koleksi dan konservasi plasma nutfah mikroba, sehingga apabila suatu saat diperlukan dapat diperoleh kembali atau dalam keadaan tersedia (Machmud, 2001).
9 penyimpanan sederhana yang efektif untuk penyimpanan isolat jangka pendek atau menengah, dan biasanya tidak sesuai untuk penyimpanan jangka panjang. Diantara teknik tersebut ialah penyimpanan dalam minyak mineral, parafin cair, tanah steril, air steril, manik-manik porselin, lempengan gelatin, dan P2O5 dalam keadaan vakum.
Walaupun tidak digunakan secara luas, teknik tersebut hanya memerlukan peralatan yang sederhana dan mudah diperoleh, sehingga dapat bermanfaat bagi lembaga yang belum memiliki peralatan canggih (Machmud, 2001). Teknik preservasi yang sekarang banyak dikembangkan dengan tingkat daya hidup mikroba yang tinggi adalah teknik pengeringan beku (Puspawati, 2008).
Pengeringan Beku (Freeze dried)
Puspawati (2008) melakukan proses pengeringan beku pada isolat bakteri asam laktat Pediococcus pentosaceus A16, Lactobacillus brevis A17, dan Lactobacillus rhamnosus R21 pada berbagai bahan pelindung. Bahan pelindung yang berupa campuran sukrosa 10%, laktosa 10%, dan susu skim 10% mampu meningkatkan viabilitas ketiga isolat tersebut. Ketahanan kultur kering terhadap garam empedu 0,5% pada ketiga isolat cukup tinggi. Namun, bahan pelindung yang paling baik dalam melindungi isolat bakteri yaitu susu skim karena mampu melindungi bakteri terhadap kerusakan karena paparan larutan dengan keasaman tinggi dan garam empedu 0,5%. Hal ini menunjukkan bahwa berbagai bahan dapat digunakan sebagai media preservasi mikroba. Namun daya hidup mikroba dalam media akan sangat tergantung pada proses preservasi itu sendiri.
Penyimpanan pada Tanah
10 Penyimpanan pada Urea Molasses Block
Urea molases block (UMB) merupakan pakan tambahan yang biasa diberikan pada ternak saat hijauan yang diberikan memiliki kualitas dan palatabilitas yang rendah. Wahyudi (2006) mengevaluasi penggunaan urea molasses mineral probiotik blok (UMMPB) pada sapi perah laktasi terhadap produksi dan kualitas susu pada peternakan skala kecil dan diperoleh hasil bahwa UMMPB mampu meningkatkan produksi dan kualitas susu, sehingga direkomendasikan penggunaannya untuk meningkatkan produktifitas sapi perah periode laktasi.
Urea Molasses Block sebagai suplemen, menyediakan nutrisi esensial pada ternak seperti protein, energi, dan mineral yang biasanya defisien pada hijauan. Urea Molasses Mineral Block (UMMB) berbentuk padat, keras, dan dapat larut di dalam air. Ternak memakannya dengan cara menjilatnya. Urea Molasses Block dapat dibuat dengan beberapa formulasi tergantung suplai dan harga bahan-bahan yang dibutuhkan. Jumlah UMMB yang diberikan tergantung jenis ternak dan beratnya. Molasses Mineral Block 5 kg diberikan pada pedet umur 7-10 hari atau kerbau dengan berat 350-400 kg (FFTC, 2001). Penggunaan UMB atau UMMB untuk pedet dapat diperkaya dengan inokulan bakteri atau probiotik sehingga dapat bermanfaat untuk memacu perkembangan bakteri rumen.
Tepung Tapioka
Tepung tapioka yang dibuat dari ubi kayu mempunyai banyak kegunaan, antara lain sebagai bahan pembantu atau pengisi dalam berbagai industri pangan. Dibandingkan dengan tepung jagung, kentang, dan gandum atau terigu, komposisi nutrien tepung tapioka cukup baik dan juga digunakan sebagai bahan bantu pewarna putih (IPTEKnet, 2005). Tapioka juga banyak digunakan sebagai bahan pengental, bahan pengisi dan bahan pengikat dalam industri makanan, seperti dalam pembuatan puding, sop, makanan bayi, es krim, pengolahan sosis daging, dan industri farmasi (IPTEKnet, 2005). Tepung tapioka dengan berbagai keunggulan fisik dan kimiawinya memungkinkan dapat digunakan sebagai media penyimpan isolat mikroba.
Arang
12 MATERI DAN METODE
Lokasi dan Waktu
Penelitian ini dilaksanakan di Laboratorium Nutrisi Ternak Perah, Departemen Nutrisi dan Teknologi Pakan, Fakultas Peternakan, Institut Pertanian Bogor, Bogor. Penelitian ini dilaksanakan mulai Juli 2011 sampai dengan Februari 2012.
Materi Alat
Alat- alat yang digunakan pada penelitian ini adalah gelas ukur, Erlenmeyer, tabung reaksi, tutup karet, isolasi panfix, hot plate, plastik tahan panas, autoclave, pipet mikro, tabung CO2, kulkas, freezer, bunsen, spoit, magnetic stirer, pipet mohr,
pipet volumetrik, sprayer, bulb, pH meter, timbangan digital, shaker water bath, vortex, tabung fermentor, tutup karet, cawan porselin, cawan conway, labu destilasi, press cooker, oven 60oC, oven 105oC, tanur listrik 600oC, buret, vacum, dan alumunium foil.
Bahan
Hijauan pakan yang digunakan sebagai perlakuan uji kecernaan fermentatif bakteri pada penelitian ini yaitu Pennisetum purpureum, Panicum maximum, Paspalum notatum, Setaria splendida, Brachiaria humidicola. Sumber inokulum yang digunakan yaitu campuran enam isolat bakteri (A27, I8, A9, A3, B61, B6) rumen kerbau yang biasa mengkonsumsi hijauan lokal dengan kualitas nutrisi rendah dan berserat kasar tinggi di Jonggol, Bogor, Jawa Barat. Isolat bakteri yang digunakan telah terbukti mampu mendegradasi serat kasar dan termasuk bakteri selulolitik (Astuti, 2010; Gayatri, 2010).
Sumber inokulum yang digunakan sebagai salah satu bahan komponen media, terdiri dari dua yaitu cairan rumen sapi segar dari rumah potong hewan PT. Elders dan isolat bakteri rumen. Bahan-bahan kimia yang digunakan adalah BHI (brain heart infusion), glukosa, cellobiosa, pati, cystein-HCl, hemin, resazurin, agar powder, gas CO2, larutan McDougall, aquades, larutan HgCl2, larutan pepsin, HCl,
Na2CO3 jenuh, asam borat berindikator, H2SO4 0,005N, NaOH 0,5N, H2SO4,