PRETREATMENT
BASA MAKROALGA
Gelidium latifolium
UNTUK PRODUKSI BIOETANOL
ELISABETH YAN VIVI ARYANTI
DEPARTEMEN TEKNOLOGI INDUSTRI PERTANIAN FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Pretreatment Basa Makroalga Gelidium Latifolium untuk Produksi Bioetanol adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
ABSTRAK
ELISABETH YAN VIVI ARYANTI. Pretreatment Basa Makroalga Gelidium Latifolium untuk Produksi Bioetanol. Dibimbing oleh DWI SETYANINGSIH. 2013
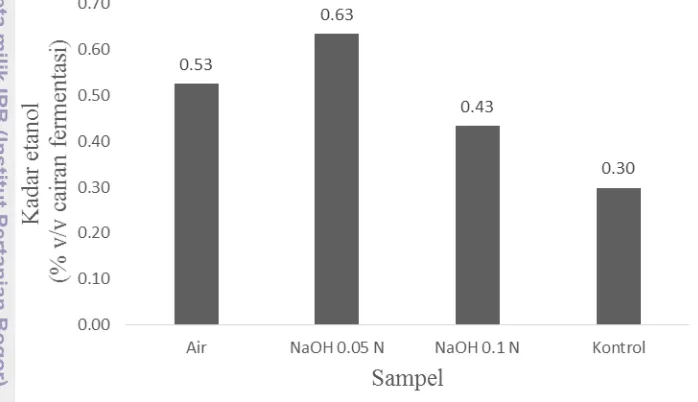
Produksi rumput laut per tahun adalah sekitar 14 juta ton dan diperkirakan akan meningkat lebih dari 22 juta ton pada tahun 2020. Makroalga, salah satunya Gelidium latifolium yang tersebar di sepanjang perairan Indonesia, dianggap menjadi bahan baku yang menjanjikan untuk bioetanol dalam hal keberlanjutan dan konservasi lingkungan. Proses konversi bahan baku menjadi bioetanol melalui tahap pretreatment, hidrolisis asam, fermentasi, dan destilasi. Pretreatment dilakukan untuk menaikkan kadar gula pereduksi dalam bahan sehingga meningkatkan kadar etanolnya. Hasil uji proksimat dari masing-masing bahan yang direndam dengan air, direndam dengan NaOH 0.05 N, dan direndam dengan NaOH 0.1 N berturut-turut adalah kadar air 8.90%, 9.90%, dan 11.78%, kadar abu 8.74%, 9.07 %, dan 11.54%, kadar lemak 0.53%, 0.10%, dan 0.70%, kadar protein 9%, 8.73%, dan 6.45%, kadar karbohidrat 21.95%, 19.60%, dan 19.65%, kadar serat 26.49%, 28.29%, dan 27.29%, selulosa 23.03%, 24.87%, dan 37.2%, lignin 7.29%, 6.435, dan 25.29%, hemiselulosa 51.78%, 54.41%, dan 14.37%. Uji kadar etanol produk dari masing-masing bahan yang direndam dengan air, direndam dengan NaOH 0.05 N, dan direndam dengan NaOH 0.1 N berturut-turut sebesar 0.53%, 0.63%, dan 0.43%. Karakteristik bahan dan produksi etanol pretreatment basa tidak memberikan perbedaan untuk masing-masing bahan. Kata kunci: bioetanol, Gelidium latifolium, makroalga, pretreatment, proksimat
ABSTRACT
ELISABETH YAN VIVI ARYANTI. Alkali Pretreatment in Bioethanol Production from Gelidium Latifolium. Supervised by DWI SETYANINGSIH. 2013
Seaweeds production per year is about 14 million tons and is expected to increase by more than 22 million tons in 2020. Macroalgae, Gelidium latifolium scattered along the coast of Indonesia, is considered to be a promising feedstock for bioethanol in terms of sustainability and environmental conservation. The process stage of converting materials into bioethanol include pretreatment, acid hydrolysis, fermentation, and distillation. Pretreatment done for being able to raise the level of sugar in the raw materials. Proximate test results of each 24.87%, and 37.2% cellulose, 7.29%, 6435, and 25.29% lignin, 51.78%, 54.41%, and 14.37% hemicellulose . Test for the product of each material respectively for 0.53%, 0.63%, and 0.43% ethanol content. Material characteristic and ethanol production are not different for each material.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Teknologi Pertanian
pada
Departemen Teknologi Industri Pertanian
PRETREATMENT
BASA MAKROALGA
Gelidium latifolium
UNTUK PRODUKSI BIOETANOL
ELISABETH YAN VIVI ARYANTI
DEPARTEMEN TEKNOLOGI INDUSTRI PERTANIAN FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
Judul Skripsi : Pretreatment Basa Makroalga Gelidium Latifolium untuk Produksi Bioetanol
Nama : Elisabeth Yan Vivi Aryanti NIM : F34090141
Disetujui oleh
Dr Dwi Setyaningsih, STP MSi Pembimbing I
Diketahui oleh
Prof Dr Ir Nastiti Siswi Indrasti Ketua Departemen
PRAKATA
Puji dan syukur penulis panjatkan ke hadirat Tuhan Yang Maha Kuasa atas berkah dan karunia-Nya karya ilmiah ini dapat diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan bulan Maret-Juli 2013 adalah proses produksi bioetanol dengan judul Pretreatment Basa Makroalga Gelidium Latifolium untuk Produksi Bioetanol.
1. Dr Dwi Setyaningsih, STP MSi selaku Pembimbing Akademik yang senantiasa membimbing penulis selama proses penelitian ini.
2. Neli Muna, STP, Indah Khayati, SSi, Dahlia Wulan Sari, SPi yang telah membimbing dan membantu dalam proses penelitian.
3. Antonius Sukarmin dan Lucia Hudi Antarti, selaku orang tua yang selalu mendoakan, adik-adik dan teman-teman yang terus memberi saya semangat dan motivasi penuh untuk dapat menyelesaikan pembuatan karya ilmiah ini.
Bogor, Nopember 2013
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN 1
Latar Belakang 1
Tujuan 1
Ruang Lingkup 1
METODE PENELITIAN 2
Bahan Penelitian 2
Peralatan Penelitian 2
Waktu dan Tempat Penelitian 2
Prosedur Percobaan 3
Analisis Data 3
HASIL PEMBAHASAN 3
Karakterisasi Bahan Baku 3
Hidrolisis 8
Fermentasi 11
SIMPULAN DAN SARAN 15
Simpulan 15
Saran 15
DAFTAR PUSTAKA 15
LAMPIRAN 18
DAFTAR TABEL
1 Hasil uji komponen kimia Gelidium latifolium 4 2 Perbandingan kadar polisakarida dan karbohidrat 5
3 Komposisi serat dengan uji Van Soest 6
DAFTAR GAMBAR
1 Skema proses delignifikasi 7
2 Struktur L-galaktosa-6-sulfat dan 3.6-anhidro-l-galaktosa 9 3 Gula pereduksi hidrolisat Gelidium latifolium setelah hidrolisis 9 4 Gula pereduksi hidrolisat Gelidium latifolium dari bahan yang tidak dibilas
setelah pretreatment 10
5 Total gula hidrolisat Gelidium latifolium setelah hidrolisis 11 6 Gula pereduksi hidrolisat Gelidium latifolium sebelum fermentasi dan gula
pereduksi hidrolisat Gelidium latifolium setelah fermentasi 12 7 Tingkat efisiensi substrat hidrolisat Gelidium latifolium dan tingkat efisiensi
fermentasi substrat Gelidium latifolium 13
8 Kadar etanol hidrolisat Gelidium latifolium fermentasi empat hari 14
DAFTAR LAMPIRAN
1 Prosedur uji kadar air 18
2 Prosedur uji kadar abu 19
3 Prosedur uji kadar karbohidrat 20
4 Prosedur uji kadar serat 21
5 Prosedur uji kadar lemak 22
6 Prosedur uji kadar protein 23
7 Prosedur uji total gula (Metode Fenol) 24
PENDAHULUAN
Latar Belakang
Hasil ekspedisi Siboga tahun 1899-1900 menunjukkan bahwa sumber daya makroalga (rumput laut) di Indonesia sangat besar dengan jumlah spesies mencapai 555 jenis. Jenis yang paling banyak ditemukan di Indonesia adalah Gracilaria, Gelidium, Euchema, Hypnea, Sargasum, dan Turbinaria. Potensi lahan untuk budidaya makroalga di Indonesia sebesar 1.100.900 ha dan sampai tahun 2003 hanya dimanfaatkan sebesar 20% atau seluas 222.180 ha. (Runtuboy 2001). Peluang besar masih sangat terbuka bagi pengembangan usaha budidaya makroalga di hampir seluruh perairan Indonesia, terutama karena makroalga dapat menghasilkan bahan baku industri yang dapat diturunkan menjadi produk-produk industri pangan maupun bioindustri. Selain itu, siklus budidaya singkat dan mempunyai pasar yang luas dengan volume kebutuhan yang besar.
Fermentasi alkohol membutuhkan substrat yang cocok dan dapat digunakan secara terus-menerus yang dapat menghasilkan gula tinggi dan konsentrasi inhibitor rendah. Makroalga dianggap sebagai sumber biomassa potensial untuk memproduksi bioetanol (Kim et al. 2010 dan Yoon et al. 2010). Selain itu, makroalga dapat dibudidayakan di perairan luas dengan sinar matahari dan tidak memerlukan pupuk atau zat penambah berbasis nitrogen (Buck dan Buchholz 2004)..
Penggunaan makroalga sebagai bahan baku produksi bioetanol memiliki nilai tambah yang lebih tinggi dibandingkan jika makroalga dijadikan sebagai produk agar atau karagenan. Agar atau karagenan hanya dapat dimanfaatkan untuk industri makanan ataupun minuman, sedangkan bioetanol memiliki pemanfaatan yang beragam sesuai dengan kegunaannya. Kegunaan bioetanol antara lain sebagai pelarut, bahan baku industri kosmetik dan farmasi, dan campuran bahan bakar.
2
Tujuan
Tujuan penelitian ini adalah untuk mengetahui pengaruh pretreatment (perendaman) basa dalam menghasilkan gula pereduksi pada makroalga Gelidium latifolium untuk produksi bioetanol.
Ruang Lingkup
Penelitian ini dilakukan di Laboratorium Surfactan and Bioenergy Research Center, Kampus IPB Baranangsiang. Jenis makroalga yang digunakan adalah Gelidium latifolium dan perlakuan yang digunakan dalam produksi bioetanol adalah (perendaman) dengan 3 macam perlakuan perendaman bahan, yaitu perendaman dengan air, perendaman dengan NaOH 0.05 N, dan NaOH 0.1 N
METODE PENELITIAN
Bahan Penelitian
Bahan-bahan yang digunakan dalam penelitian ini adalah rumput laut jenis Gelidium latifolium yang didapat dari Pulau Pari, Kepulauan Seribu, akuades, HCl, NaOH, pupuk NPK, urea, Saccharomyces cereviseae AL IX, PDA (Potato Dextrose Agar), DNS, indikator PP, pereaksi Luff Schoorl, KI, H2SO4, larutan
kanji, Na2S2O7, etanol, heksana, campuran selen, bromocresol green, metil merah,
H3BO3.
Peralatan Penelitian
Alat-alat yang digunakan pada penelitian ini diantaranya wadah perendaman, timbangan digital, pH meter, gelas ukur, kertas saring Whatman, spatula, pipet volumetrik, pipet tetes, labu Erlenmeyer, termometer, otoklaf, inkubator, lap, jarum ose, spektrofotometer, desikator, cawan alumunium, oven, cawan porselen, tanur, pendingin tegak, labu ukur, corong, penangas, stopwatch, buret, corong Buchner, pompa vakum, labu lemak, Soxlet, kapas, labu Kjeldahl, densito meter (Anton Paar).
Waktu dan Tempat Penelitian
3
Prosedur Percobaan
Penelitian ini mencakup pretreatment pada bahan, analisis proksimat pada bahan, pembuatan bioetanol, dan uji produk. Bahan awal Gelidium latifolium merupakan bahan yang sudah dicuci bersih dan dikeringkan dengan kadar air awal 9.66% dan kadar abu 11.91%. Pretreatment pada bahan meliputi perlakuan perendaman bahan dengan tiga jenis perlakuan yaitu perendaman dengan air, perendaman dengan NaOH 0.05 N, dan NaOH 0.1 N. Penentuan konsentrasi basa mengacu pada penelitian Sari (2013) yang dilakukan pada makroalga Gracilaria verrucosa. Perendaman dilakukan selama tiga hari kemudian dicuci bersih, dipotong sehingga ukurannya menjadi ±1 cm, dan dikeringkan di bawah sinar matahari selama dua hari. Penelitian pendahuluan meliputi uji proksimat pada bahan, diantaranya uji kadar air, uji kadar abu, uji kadar karbohidrat, uji kadar serat kasar, uji kadar lemak, uji kadar protein, dan uji komposisi serat kasar.
Proses pembuatan bioetanol dengan bahan yang telah dilakukan perlakuan pretreatment dimulai dengan hidrolisis asam. Sebanyak 15 g bahan dimasukkan ke dalam jar dan ditambahkan H2SO4 1% sebanyak 100 ml. Jar yang sudah diisi
sampel dimasukkan ke otoklaf selama 45 menit pada tekanan 1 atm dan suhu 121OC. Setelah selesai sampel diatur pH-nya sampai menjadi 5-6 dengan cara menambahkan NaOH, kemudian disaring menggunakan pompa vakum dan corong Buchner untuk mendapatkan cairan hidrolisat. Hidrolisat tersebut diambil dan dimasukkan ke dalam labu Erlenmeyer untuk dipasteurisasi. Pasteurisasi dilakukan dengan cara memanaskan sampel pada suhu 70-80OC selama 15 menit di atas penangas air. Setelah selesai dipasteurisasi, ditambahkan urea, NPK, dan starter Saccharomyces cereviseae AL IX sebanyak 10 ml dalam keadaan steril. Proses fermentasi berlangsung selama 4 hari pada suhu ruang. Sampel yang telah difermentasi kemudian didestilasi untuk mendapatkan etanolnya dan diuji kadar etanolnya dengan menggunakan densitometer.
Analisis Data
Rancangan percobaan yang digunakan adalah Rancang Acak Lengkap dengan satu faktor. Selang kepercayaan dihitung menggunakan ANOVA α=5%.
HASIL DAN PEMBAHASAN
Karakteristik Bahan Baku
4
Penelitian Dahlia (2013) menggunakan rumput laut jenis Sargassum sp. Sargassum sp. merupakan rumput laut coklat dengan jenis polisakarida alginat. Metode perendaman dengan menggunakan NaOH 0.05 N dan 0.1 N pada Sargassum sp. menghasilkan peningkatan gula pereduksi sebanyak 46% pada perendaman 0.05 N.
Penelitian pendahuluan merupakan uji proksimat yang dilakukan pada bahan baku, baik yang telah mengalami perlakuan maupun yang tidak mengalami perlakuan. Perlakuan yang dimaksud adalah pretreatment atau perendaman. Perendaman dilakukan pada bahan sebelum digunakan untuk proses produksi bioetanol. Perendaman dengan menggunakan basa dilakukan dengan tujuan untuk menguraikan gugus sulfat yang ada pada polisakarida rumput laut. Dengan treatment basa ini diharapkan terjadi peningkatan gula yang diperoleh. Perendaman dengan basa juga dilakukan dengan tujuan untuk menghilangkan pengotor-pengotor dan juga untuk proses delignifikasi (penghilangan lignin). Pretreatment menyebabkan kerusakan struktur dan pemecahan biomassa melalui pelarutan lignin. Treatment basa juga menyebabkan swelling/pengembangan yang dapat meningkatkan luas permukaan dan penyerapan asam sehingga meningkatkan tingkat hidrolisis. Proses pretreatment yang dilakukan pada penelitian ini menggunakan tiga jenis perlakuan, yaitu perendaman dengan menggunakan air, perendaman dengan NaOH 0.05 N, dan perendaman dengan NaOH 0.1 N.
Tabel 1 Hasil uji komponen kimia makroalga Gelidium latifolium
Kadar Air NaOH 0.05
Lemak (%bk) 0.53±0.02 0.09±0.001 0.69±0.007 0.13±0.02
Protein (%bk) 9.00±0.06 8.73±0.37 6.45±0.39 9.32±0.25
Polisakarida (%bk) 21.95±0.64 19.59±0.76 19.65±0.39 23.81±1.08
Serat kasar (%bk) 26.49±1.27 28.29±1.16 27.29±1.46 16.34±0.10
aSumber: Sari 2013
5 pada kadar air namun perendaman baik dengan air maupun basa tidak mempengaruhi perbedaan nilai tersebut.
Nilai kadar abu tertinggi dimiliki oleh bahan yang tidak mengalami pretreatment, kemudian nilai tertinggi kedua dimiliki bahan yang direndam dengan NaOH 0.1 N dan disusul oleh bahan yang direndam oleh NaOH 0.05 N. Kadar abu terendah dimiliki oleh bahan yang direndam dengan air. Bahan yang tidak mengalami pretreatment memiliki nilai tertinggi dapat diakibatkan karena bahan tidak mengalami proses perendaman yang mampu menghilangkan mineral-mineral dari air laut yang masih menempel pada bahan. Bahan yang direndam dengan basa memiliki kadar abu yang tinggi karena ion Na+ yang menempel pada bahan dianggap sebagai mineral dan terhitung sebagai kadar abu. Hasil Anova (α=5%) menyatakan bahwa tidak ada beda nyata terhadap masing-masing sampel menunjukkan bahwa perendaman dengan air maupun basa tidak memberi pengaruh terhadap bahan meskipun nilainya berbeda-beda.
Makroalga memiliki tingkat kadar lemak yang rendah. Dari hasil pengujian, didapat kadar rata-rata kadar lemak dari masing-masing bahan tidak mencapai 1%, dengan kadar lemak tertinggi dimiliki oleh bahan yang direndam dengan menggunakan NaOH 0.1 N dan yang terendah dimiliki oleh bahan yang direndam dengan menggunakan NaOH 0.05 N. Hasil Anova (α=5%) menyatakan bahwa tidak ada beda nyata terhadap masing-masing sampel.
Pengujian kadar protein menunjukkan adanya perendaman menyebabkan terjadinya penurunan kadar protein, dapat dilihat pada Tabel 1 bahwa kadar protein tertinggi dimiliki oleh bahan yang tidak direndam dan yang terendah dimiliki oleh bahan yang direndam dengan menggunakan basa. Hasil Anova (α=5%) menyatakan bahwa tidak ada beda nyata terhadap masing-masing sampel. Dalam analisis proksimat rumput laut, karbohidrat terdiri dari polisakarida (agar), serat kasar, dan bahan ekstrak tanpa nitrogen. Serat kasar mengandung selulosa, hemiselulosa, polisakarida lain, dan lignin. Lignin bukan merupakan komponen karbohidrat, namun berhubungan erat dan mengikat serat kasar pada bahan. Salah satu fungsi perendaman dengan basa adalah mendegradasi lignin sehingga mampu melepas bebas serat kasar sehingga memungkinkan peningkatan kadar gula. Uji polisakarida dilakukan dengan cara menghidrolisis bahan dengan HCl 3% selama 3 jam untuk menghitung jumlah gula (glukosa) yang terdapat dalam bahan.
Dapat dilihat di Tabel 1, kadar polisakarida mulai yang tertinggi berturut-turut dimiliki oleh bahan yang tidak mengalami pretreatment, bahan yang direndam dengan air, dan bahan yang direndam dengan NaOH. Hasil Anova (α=5%) menyatakan bahwa tidak ada beda nyata terhadap masing-masing sampel. Hal ini menunjukkan bahwa perendaman tidak memberi pengaruh terhadap bahan.
Tabel 2 Perbandingan kadar polisakarida dan karbohidrat
Kadar Air NaOH 0.05 N NaOH 0.1 N aBahan baku
Polisakarida (%bk) 21.95 19.59 19.65 23.81
Karbohidrat (%bk) 46.34 43.92 42.26 52.64
6
Schrool dan kadar karbohidrat dihitung dengan metode by difference. Hampir seluruh karbohidrat bahan mengandung polisakarida yang tinggi yang dapat dimanfaatkan sebagai substrat fermentasi.
Hasil sebaliknya dari kadar polisakarida adalah serat kasar untuk bahan yang mengalami pretreatment. Kadar serat kasar pada bahan yang direndam baik dengan air maupun basa naik dapat dikarenakan adanya penurunan persentase komponen terlarut pada saat perendaman. Ketika bahan yang tidak diberi perendaman masih mengandung komponen terlarut, maka kadar serat kasarnya akan lebih rendah karena komponen terlarut masih tinggi sehingga mengurangi komponen tidak terlarut yang terhitung sebagai serat kasar. Bahan yang direndam akan kehilangan komponen yang mudah terlarut sehingga akan menaikkan persentase kadar komponen tidak terlarut yang terhitung pada uji serat kasar. Hasil uji Anova (α=5%) menyatakan bahwa tidak ada beda nyata terhadap masing-masing sampel menunjukkan perendaman dengan air maupun basa tidak memberi pengaruh pada bahan.
Tabel 3 Komposisi serat dengan uji Van Soest
Uji Air NaOH 0.05 N NaOH 0.1 N bBahan baku
Menurut Banerjee (1978) bahan kering suatu tanaman yang didasarkan pada metode Van Soest dapat dibagi menjadi isi sel dan dinding sel. Isi sel berisi protein,
lemak, karbohidrat, mineral, vitamin terlarut. Dinding sel atau Neutral Detergent
Fiber (NDF) terdiri atas hemiselulosa, selulosa, silika,lignin dan kutin yang masing-masing tersusun secara tunggal atau beberapa kombinasi seperti lignoselulosa dan
nitrogen hemiselulosa (Arora 1983). Pada Uji ADF zat yang digunakan untuk
pengujian adalah setil, trimetil amonium bromida dalam asam sulfat yang berfungsi untuk menentukan kandungan total selulosa dan lignin, sedangkan NDF digunakan untuk menentukan selulosa, hemiselulosa dan lignin. Prinsip dari NDF dan ADF didasarkan pada kelarutan lignin, selulosa, dan hemiselulosa terhadap pereaksi NDF dan ADF.
Selulosa adalah zat penyusun tanaman yang jumlahnya banyak, sebagai material struktur dinding sel semua tanaman (Tillman et al. 1989). Kandungan selulosa pada dinding sel tanaman tingkat tinggi sekitar 35-50% dari berat kering tanaman. Dari hasil pengujian, didapat kadar selulosa terendah dimiliki oleh bahan yang tidak dilakukan pretreatment, kemudian berturut-turut menuju yang paling tinggi yaitu bahan yang direndam dengan air, direndam dengan NaOH 0.05%, dan bahan yang direndam dengan NaOH 0.1%.
7 biomassa selulosa (Kim et al. 2013). Struktur dari lignin adalah kompleks, tidak teratur, dan acak. Akibat dari bentuk struktur tersebut maka lignin merupakan komponen yang sulit dipecah, dikarenakan struktur kristal pada lignin lebih tinggi dibanding selulosa dan hemiselulosa. Perendaman dengan basa diharapkan mampu memecah struktur kristal tersebut sehingga enzim dapat mencapai hemiselulosa dan selulosa agar pada proses hidrolisis asam mampu menghidrolisis lebih banyak gula yang dapat dimanfaatkan saat proses fermentasi.
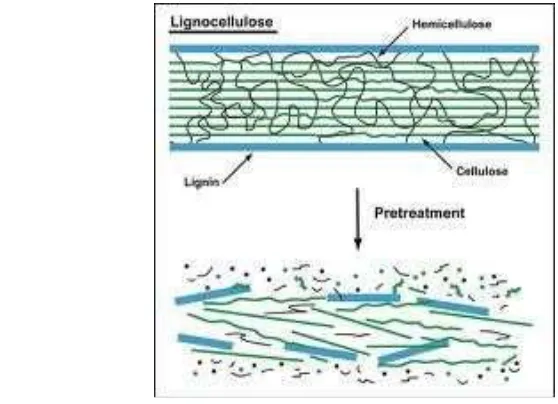
Gambar 1 Skema proses delignifikasi
Salah satu hambatan proses hidrolisis selulosa dan hemiselulosa baik dengan asam maupun enzim adalah adanya lignin yang melindungin komponen tersebut. Gambar 1 merupakan skema proses delignifikasi. Delignifikasi dilakukan dengan NaOH karena larutan ini dapat menyerang dan merusak struktur lignin sehingga dapat memisahkan lignin, selulosa, dan hemiselulosa, serta menyebabkan penggembungan struktur selulosa (Gunam dan Antara 1999). Hal ini dilakukan agar komponen selulosa dan hemiselulosa menjadi lebih mudah untuk dihidrolisis.
Dapat dilihat pada Tabel 3 bahwa kadar lignin terendah untuk bahan yang tidak diberi perlakuan perendaman dan yang paling tinggi adalah bahan yang direndam dengan NaOH 0.1 N. Nilai kadar lignin tertinggi pada bahan yang direndam dengan NaOH 0.1 N dapat dikarenakan adanya non-lignin karbohidrat lain dan kutin yang terhitung sebagai kadar lignin pada bahan. Hal ini menyebabkan asumsi awal bahwa perendaman dengan basa dapat mendegradasi komponen lignin pada bahan tidak terbukti, karena nilai lignin pada bahan yang diberi perlakuan tidak menurun. Delignifikasi tidak terjadi dapat dikarenakan konsentrasi basa yang kurang sesuai sehingga tidak mampu memecah lignin (Harimurti 2010).
8
dan galaktosa. Perbedaan yang sangat tampak pada senyawa selulosa dengan senyawa hemiselulosa adalah bahwa hemiselulosa mudah sekali larut dalam asam, sedang selulosa sebaliknya. Dari hasil pengujian, seperti yang telah disebutkan bahwa hemiselulosa mudah larut dalam suasana basa, maka kadar hemiselulosa yang paling rendah adalah bahan yang direndam pada basa dengan konsentrasi dengan konsentrasi basa yang lebih tinggi menyebabkan hemiselulosa larut sehingga nilai NDF lebih rendah. Karena nilai hemiselulosa yang rendah, persentase lignin dan selulosa naik karena kedua komponen tersebut lebih tahan terhadap basa. Hal ini menimbulkan kesan bahwa lignin dan selulosa kadarnya naik pada perendaman dengan konsentrasi basa yang lebih tinggi. Pada perendaman dengan air dan NaOH 0.05 N, kadar hemiselulosa, lignin, dan selulosa lebih tinggi dibandingkan dengan bahan baku, dapat disebabkan karena bahan baku tidak dilakukan perendaman sehingga masih mengandung komponen lain atau pengotor yang dapat mengurangi persentase NDF dan ADF pada bahan baku.
Hidrolisis
9
Gambar 2 Struktur L-galaktosa-6-sulfat dan 3.6-anhidro-l-galaktosa
Menurut Kim et al. (2010) hidrolisis asam gelidium untuk menghasilkan gula yang dilakukan di dalam otoklaf secara batch produk utamanya adalah D-galaktosa, 3,6-anhydro-L-Galaktosa (3,6-AHG), dan D-glukosa. Diantara hasil tersebut, galaktosa dan glukosa diklasifikasikan sebagai gula monomer yang dapat difermentasi dan 3,6-AHG sebagai gula yang tidak dapat difermentasi (Kim et al. 2010).
10
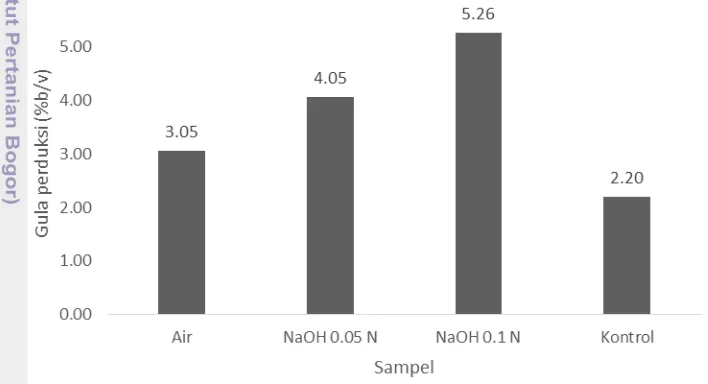
yang dapat menjadi penghambat dalam proses hidrolisis sehingga kadar gula pereduksinya rendah. Hal ini dapat menjadi bukti bahwa perendaman, terutama dengan basa dapat meningkatkan kadar gula pereduksi hidrolisat.
Dapat dilihat pada Gambar 3 dan Gambar 4 perbedaan gula pereduksi hidrolisat yang dilakukan pembilasan setelah pretreatment dengan gula pereduksi hidrolisat yang tidak dilakukan pembilasan setelah pretreatment. Kadar gula pereduksi hidrolisat yang terbuat dari bahan yang dibilas setelah pretreatment lebih tinggi, dikarenakan pembilasan dengan air mampu melarutkan sisa-sisa basa ataupun material lain yang masih menempel pada bahan, sehingga pada saat hidrolisis asam, asam yang digunakan tidak ternetralisir oleh basa yang menempel pada bahan tersebut yang mengakibatkan proses hidrolisis asam lebih efektif dan meningkatkan kadar gula pereduksi hidrolisat.
Gambar 4 Gula pereduksi hidrolisat Gelidium latifolium dari bahan yang tidak dibilas setelah pretreatment
11
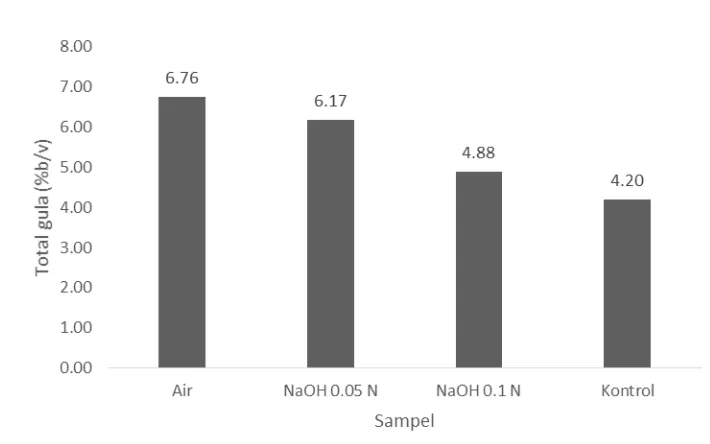
Gambar 5 Total gula hidrolisat Gelidium latifolium setelah hidrolisis Dari gambar 5 dapat dilihat terjadinya peningkatan gula total dari bahan-bahan yang dilakukan perendaman. Kontrol yang merupakan bahan-bahan baku memiliki total gula awal yang paling rendah dan bahan yang direndam dengan air memiliki total gula paling tinggi. Hal ini dapat disebabkan masih banyaknya komponen lain atau pengotor dalam bahan baku sehingga total gulanya rendah. Untuk bahan yang direndam dengan basa memiliki total gula yang lebih rendah dibandingkan dengan yang direndam air dapat dikarenakan ada komponen gula yang larut dan terurai dalam basa, terutama hemiselulosa. Selain itu komponen gula lain yang bukan termasuk gula pereduksi juga tidak terlarut dalam basa sehingga menyebabkan total gula bahan yang direndam dengan basa lebih rendah dibandingkan dengan yang direndam oleh air. Gula total merupakan campuran gula reduksi dan non reduksi yang merupakan hasil hidrolisis. Semakin tinggi kadar gula pereduksi, maka semakin tinggi juga jumlah gula monosakarida yang dapat digunakan dalam proses fermentasi.
Fermentasi
Galaktosa merupakan nutrisi nonkonvensional bagi khamir. Metabolisme galaktosa pada khamir dilakukan dengan bantuan enzim khusus pada jalur Leloir (Frey 1996) yakni galaktosa mutarotase, galaktokinase, galaktosa 1-fosfat uridiltransferase, UDP 4-epimerase dan fosfoglukomutase. Sebagian besar organisme termasuk Saccharomyces cerevisiae memiliki enzim khusus tersebut (Timson 2007). Pada saat galaktosa yang tersedia dalam media, enzim-enzim tersebut akan mengubah D-galaktosa menjadi D-glukosa 6-fosfat.
12
cerevisiae AL IX, kadar etanol yang menggunakan Gelidium latifolium tanpa pretreatment adalah 0.3% (Sari 2013).
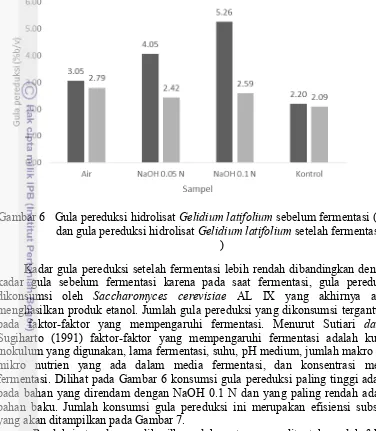
Gambar 6 Gula pereduksi hidrolisat Gelidium latifolium sebelum fermentasi ( ) dan gula pereduksi hidrolisat Gelidium latifolium setelah fermentasi (
)
Kadar gula pereduksi setelah fermentasi lebih rendah dibandingkan dengan kadar gula sebelum fermentasi karena pada saat fermentasi, gula pereduksi dikonsumsi oleh Saccharomyces cerevisiae AL IX yang akhirnya akan menghasilkan produk etanol. Jumlah gula pereduksi yang dikonsumsi tergantung pada faktor-faktor yang mempengaruhi fermentasi. Menurut Sutiari dalam Sugiharto (1991) faktor-faktor yang mempengaruhi fermentasi adalah kultur inokulum yang digunakan, lama fermentasi, suhu, pH medium, jumlah makro dan mikro nutrien yang ada dalam media fermentasi, dan konsentrasi media fermentasi. Dilihat pada Gambar 6 konsumsi gula pereduksi paling tinggi adalah pada bahan yang direndam dengan NaOH 0.1 N dan yang paling rendah adalah bahan baku. Jumlah konsumsi gula pereduksi ini merupakan efisiensi substrat yang akan ditampilkan pada Gambar 7.
Produksi etanol yang dihasilkan oleh suatu proses ditentukan oleh faktor bahan baku yang tersedia, banyaknya gula hasil konversi bahan baku yang siap di fermentasi, dan efisiensi dari proses fermentasi gula untuk menghasilkan alkohol. Sebagai substrat fermentasi untuk produksi etanol, gula sederhana dari bahan baku diperoleh melalui proses hidrolisis.
13
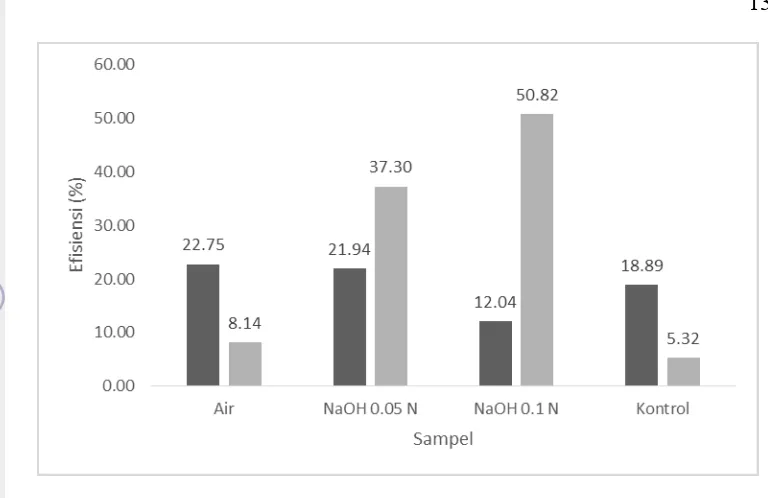
Gambar 7 Tingkat efisiensi fermentasi hidrolisat Gelidium latifolium ( ) dan tingkat efisiensi substrat hidrolisat Gelidium latifolium ( )
Produksi etanol yang tinggi berkorelasi dengan efisiensi substrat dan efisiensi fermentasinya. Substrat yang digunakan tidak seluruhnya dikonversi menjadi etanol. Berdasarkan persamaan reaksi fermentasi alkohol yakni : Glukosa 2 C2H5OH + 2 CO2+ 2 ATP + 5 Kkal. Dari reaksi tersebut, 70% energi bebas
yang dihasilkan dibebaskan sebagai panas. Secara teoritis 51,5% karbohidrat diubah menjadi etanol dan 48.9% menjadi CO2 (Prescott dan Dunn 1981).
Efisensi substrat merupakan persentase substrat awal yang dikonsumsi untuk produksi terhadap substrat awal yang digunakan dalam produksi. Dapat dilihat pada Gambar 7 tingkat efisiensi substrat yang tertinggi dimiliki oleh sampel hasil perendaman dengan menggunakan NaOH 0.1 N. Hal ini dapat dibuktikan pada Gambar 6 dengan selisih gula pereduksi yang dikonsumsi pada saat fermentasi tinggi. Sedangkan efisiensi fermentasi merupakan persentase konsentrasi etanol hasil produksi dibandingkan dengan persentase etanol teoritis yaitu 51.5%. Efisiensi fermentasi tertinggi dimiliki oleh bahan yang direndam dengan air dan yang terendah oleh bahan yang direndam dengan basa. Adanya perbedaan dapat dikarenakan produksi etanol dalam hidrolisat rumput laut dipengaruhi oleh adanya senyawa inhibitor pada hidrolisat. Senyawa inhibitor seperti hidroksimetil furfural dan furfural hasil hidrolisis asam bahan lignoselulosa akan menghambat pertumbuhan mikroba dalam proses fermentasi untuk menghasilkan etanol (Palmqvist dan Hagerdal 2000). Senyawa ini merupakan hasil sampingan yang selalu ada pada saat fermentasi ketika substrat yang digunakan merupakan hasil hidrolisis asam.
14
kemungkinan sisa perendaman basa yang menggangu aktivitas khamir tersebut. Dari hasil Anova (α=5%) menunjukkan bahwa tidak terdapat beda nyata pada masing-masing efisiensi, baik efisiensi fermentasi maupun efisiensi substrat.
Perendaman dengan menggunakan NaOH 0.05 N mampu meningkatkan gula pereduksi, meningkatkan produksi etanol, meningkatkan efisiensi substrat, dan meningkatkan efisiensi fermentasi dibandingkan dengan yang direndam air maupun bahan baku. Perendaman dengan menggunakan NaOH 0.1 N mampu meningkatkan gula pereduksi dan meningkatkan efisiensi substrat dibandingkan dengan ketiga bahan lainnya, namun produksi etanol lebih rendah dibandingkan dengan bahan yang direndam dengan air dan NaOH 0.05, dan memiliki efisiensi fermentasi paling rendah dibandingkan dengan bahan yang lainnya.
15 bahan yang dilakukan perlakuan perendaman maupun yang tidak dilakukan perlakuan.
SIMPULAN DAN SARAN
Simpulan
Perendaman dengan NaOH 0.1 N menurunkan kadar hemiselulosa pada bahan karena gugus sulfat yang terlarut dalam basa sehingga menaikkan kadar gula pereduksi setelah proses hidrolisis. Perendaman dengan NaOH 0.05 N memiliki kadar hemiselulosa hampir sama dengan yang direndam air dan bahan baku namun dengan kadar gula pereduksi lebih tinggi.
Hasil uji kadar etanol menyatakan bahwa kadar etanol tertinggi dimiliki oleh sampel yang berasal dari bahan yang direndam dengan menggunakan NaOH 0.05 N. Efisiensi substrat tertinggi pada bahan yang direndam dengan NaOH 0.1 N namun memiliki efisiensi fermentasi terendah, sebaliknya efisiensi substrat bahan yang direndam NaOH 0.05 N lebih rendah dibandingkan dengan bahan yang direndam NaOH 0.1 N namun memiliki efisiensi fermentasi tinggi sehingga kadar etanolnya paling tinggi.
Saran
Perendaman dengan basa pada Gelidium latifolium tidak diperlukan karena tidak memberi pengaruh nyata. Pada penelitian selanjutnya dapat dikembangkan variasi faktor maupun perlakuan yang mampu meningkatkan tingkat efiensi substrat, efisiensi fermentasi, dan menghasilkan kadar etanol yang lebih tinggi.
DAFTAR PUSTAKA
Apriyantono A, Dedi F, Puspitasari NL, Sedarnawati, Budiyanto S. 1989. Analisis Pangan. Bogor: Pusat Antar Universitas Institut Pertanian Bogor.
Arora SP. 1983. Microbial Digestion in Ruminants. CI Sutrisno, R Murwani, penerjemah. New Delhi: Indian Council of Agricultural Research. Banerjee GF. 1978. Animal Nutrition. New Delhi: Oxford dan IBH Publishing Company.
Buck BH, Buchholz CM. 2004. The Offshore-Ring: A new system design for the open ocean aquaculture of macroalgae. Journal of Applied Phycology 16: 355-368.
16
Freile-Pelegr Y, Murano E. 2005. Agars from three species of Gracilaria (Rhodophyta) from Yucatan Peninsula. Bioresource Technology 96 (2005) 295-302.
Frey PA. 1996. The Leloir Pathway: Mechanism Imperative For Three Enzymes To Change The Stereochemical Configuration Of A Single Carbon In Galactose. Federation of American Societies For Experimental Biology 10: 46-470.
Furia. 1975. Handbook of Flavor Ingredients Vol 2. US.
Glicksman M. 1983. Food Hydrocolloids Vol 1. Florida: Boca Raton Press.
Gunam IBW, Antara NS. 1999. Study on Sodium Hydroxide Treatment of Corn Stalk to Increase Its Cellulose Saccharification Enzymaticallyby Using Filtrate of Tricoderma resei. Agric. Technol. J. 5 (1): 34-38
Harimurti N. 2010. Potensi Limbah Kulit Buah Kakao Sebagai Bahan Baku Bioetanol Generasi II. Bogor: Balai Besar Litbang Pascapanen Pertanian Higuchi T. (1980). Lignin structure and morphological distribution in plant cells.
In Kirk, T.K. et al. (eds.) Lignin biodegradation; microbiology, chemistry and potential applications p.1-19. Bocca Raton Florida: CRC Press Inc. Jones WGM, Peast S. 1942. J. chem. Soc. P.225
Kim YS, Chae SW, Park DH, Sunwoo C. 2010. Pretreatment of Gelidium amansii for the Production of Bioethanol. Korea: Bull.
Kim YA, Kim DH, Kim TY, Shin MK, Kim YJ, Yoon JJ, Chang IS. 2013. Use of red algae, Ceylon moss (Gelidium amansii) hydrolyzate for clostridial fermentation. Elsevier
Oura E. 1983. Reaction Product of Yeast Fermentation. Di dalam H. Dellweg (ed). Biotechnology Volume III. New York: Academic Press.
Palmqvist E, Hahn-Hagerdal B. 2000. Fermentation of Lignocellulosic Hydrolysates. II: Inhibitors and Mechanism of Inhibition. Bioresource Technology 74: 25-33.
Peterson MS, AH Johnson. 1978. Encyclopedia of Food Science. Westport: The AVI Publishing company
Prescott SC, Dunn CG. 1981. Industrial Microbiology. New York : McGraw-Hill Book Co.Ltd.
Rasyid A, Rachmat R, Murniasih T. 1999. Karakterisasi Polisakarida Agar Dari Gracilaria sp. dan Gelidium sp. Pra Kipnas VII Forum Komunikasi I Ikatan Fikologi Indonesia. 57-62.
Runtuboy N dan Sahrun. 2001. Rekayasa Teknologi Budidaya Rumput Laut (Kappaphycus alvarezii).Di dalam Laporan Tahunan Balai Budidaya Laut Tahun Anggaran 2000. Balai Budidaya Laut.
Tillman RW, Scotter DR, Wallis MG, Clothier BE. 1989. Water-repellency and its measurement by using intrinsic sorptivity. Australian Journal of Soil Research, 27: 637–644.
Sari DW. 2013. Optimasi Hidrolisis dan Fermentasi Makroalga Gelidium latifolium dan Gracilaria verrucosa Sebagai Penghasil Bioetanol. Bogor: Institut Pertanian Bogor
17 Sugiharto PE. 1991. Analisis Kuantitatif Kadar Etanol dari Bonggol Pisang oleh
Saccharomyces cerevisiae. Malang: Universitas Brawijaya.
[SNI] Standar Nasional Indonesia. 1992. SNI 01-2891-1992 Cara Uji Makanan dan Minuman. BSN.
[SNI] Standar Nasional Indonesia. 1994. SNI 06-3565-1994 Syarat Mutu Etanol. BSN.
Timson DJ. 2007. Galactose metabolism in Saccharomyces cerevisiae: A review. Dynamic Biochemistry 3: 63-73.
Tsuchiya Y, Hong KC. 1965. Agarose and Agaropectin in Gelidium and Gracilaria Agar.
Van Soest PJ. 1982. Nutritional Ecology of Ruminant, Ruminant Metabolism Nutritional Strategies, the Cellulolytyc Fermentation and Chemestry of Forage and Fibers. USA: Cornellis O.R.
Wi SG, Kim HJ, Mahadevan SA, Yang DJ, Bae HJ. 2009. The Potential Value of the Seaeweed Ceylon moss (Gelidium amansii) as an Alternative Bioenergy Resource. Bioresource Technology
18
Lampiran 1 Prosedur uji kadar air (SNI, 1992) Cara kerja:
Ditimbang dengan seksama 1-2 gr cuplikan pada sebuah botol timbang tertutup yang telah diketahui bobotnya. Untuk contoh berupa cairan, botol timbang dilengkapi dengan pengaduk dan pasir kwarsa/kertas saring berlipat.
Dikeringkan pada oven suhu 105OC selama 3 jam. Didinginkan dalam eksikator
Ditimbang, ulangi pekerjaan ini hingga diperoleh bobot tetap. Perhitungan:
19 Lampiran 2 Prosedur uji kadar abu (SNI, 1992)
Cara kerja:
Ditimbang dengan seksama 2-3 gr contoh ke dalam sebuah cawan porselen (platina) yang telah diketahui bobotnya, untuk contoh cairan uapkan diatas penangas air sampai kering
Diarangkan diatas nyala pembakar, lalu diabukan dalam tanur listrik pada suhu maksimum 550OC sampai pengabuan sempurna (sekali-kali pintu tanur dibuka sedikit, agar oksigen bias masuk)
Didinginkan dalam eksikator, lalu timbang sampai bobot tetap Perhitungan:
W = Bobot contoh sebelum diabukan, dalam gram
20
Lampiran 3 Prosedur uji kadar karbohidrat (SNI, 1992) Cara kerja:
Dipipet 10 ml saringan ke dalam Erlenmeyer 500 ml, ditambahkan 25 ml larutan luff (dengan pipet) dan beberapa butir batu didih serta 25 ml air suling
Dipanaskan campran tersebut dengan nyala yang tetap. Diusahakan agar larutan dapat mendidih dalam waktu 3 menit (gunakan stopwatch), didihkan terus selama tepat 10 menit (dihitung dari mulai saat mendidih dan gunakan stopwatch) kemudian dengan cepat dinginkan dalam bak berisi es
Kadar karbohidrat = 0.90 x kadar glukosa W1 = bobot cuplikan, dalam mg
W = glukosa yang terkandung untuk ml tio yang dipergunakan, dalam mg, dalam daftar
21 Lampiran 4 Prosedur uji kadar serat (SNI, 1992)
Cara kerja:
Ditimbang seksama 2-4 gr cuplikan. Dibebaskan lemaknya dengan cara ekstraksi dengan cara Soxlet atau dengan cara mengaduk, diengenap tuangkan contoh dalam pelarut organik sebanyak 3x. Contoh dikeringkan dan dimasukkan ke dalam Erlenmeyer 500 ml
Ditambahkan 50 ml larutan H2SO4 1.25%, kemudian didihkan
selam 30 menit dengan menggunakan pendingin tegak
Ditambahkan 50 ml NaOH 3.25% dan didihkan lagi selama 30 menit
Dalam keadaan panas, disaring dengan corong Buchner yang berisi kertas saring tak berabu Whatman 54.41 atau 541 yang telah dikeringkan dan diketahui bobotnya
Dicuci endapan yang terdapat pada kertas saring berturut-turut dengan HSO 1.25% panas, air panas, dan etanol 96%
Diangkat kertas saring beserta isinya, dimasukkan ke dalam kotak timbang yang telah diketahui bobotnya, dikeringkan pada suhu 105OC
didinginkan dan ditimbang sampai bobot tetap
Bila ternyata kadar serat kasar lebih besar dari 1% diabukan kertas saring beserta isinya, ditimbang sampai bobot tetap
Perhitungan:
W = Bobot cuplikan, dalam gram W1 = Bobot abu, dalam gram
22
Lampiran 5 Prosedur uji kadar lemak (SNI, 1992) Cara kerja:
Ditimbang seksama 1-2 gr contoh, dimasukkan ke dalam selongsong kertas yang dialasi dengan kapas
Disumbat selongsing kertas berisi contoh tersebut dengan kapas, dikeringkan dalam oven pada suhu tidak lebih dari 80OC selama lebih
kurang 1 jam, kemudian dimasukkan ke dalam alat soxlet yang telah dihubungkan dengan labu lemak berisi batu didih yang telah dikeringkan dan telah diketahui bobotnya
Diekstrak dengan heksana atau pelarut lemak lainnya selama lebih kurang 6 jam
Disulingkan heksana dan dikeringkan ekstrak lemak dalam oven pengering pada suhu 105OC
Didinginkan dan ditimbang
Diulangi pengeringan ini hingga tercapai bobot tetap Perhitungan:
W = Bobot contoh, dalam gram
23 Lampiran 6 Prosedur uji kadar protein (SNI, 1992)
Cara kerja:
Ditimbang seksama 0.51 gr cuplikan, masukkan ke dalam labu Kjeldahl 100 ml
Ditambahkan 2 gr campuran selen dan 25 ml H2SO4 pekat
Dipanaskan diatas pemanas listrik atau api pembakar sampai mendidih dan larutan menjadi jernih kehijau-hijauan (sekitar 2 jam)
Dibiarkan dingin, kemudian diencerkan dan dimasukkan ke dalam labu ukur 100 ml, ditepatkan sampai tanda garis
Dipipet 5 ml larutan dan dimasukkan ke dalam alat penyuling, tambahkan 5 ml NaOH 30% dan beberapa tetes indikator PP
Disulingkan selama lebih kurang 10 menit, sebagai penampung gunakan 10 ml larutan asam borat 2% yang telah dicampur indikator
Dibilas ujing pendingin dengan air suling
Dititar dengan larutan HCL 0.01 N
Dikerjakan penetapan blanko Perhitungan:
W = bobot cuplikan
V1 = Volume HCL 0.01 N yang dipergunakan penitaran contoh V2 = Volume HCL 0.01 N yang dipergunakan penitaran blanko N = Normalitas FICI
24
Lampiran 7 Prosedur uji total gula (Metode Fenol) (Apriyanto et al., 1989)
Prinsip: gula sederhana, oligosakarida, polisakarida, dan turunannya dapat bereaksi dengan fenol dalam asam sulfat pekat menghasilkan warna kekuningan yang stabil.
Cara kerja:
Pembuatan kurva standar
Dipipet 2 ml larutan glukosa standar yang mengandung 0, 10, 20, 30, 40, dan 50 µ glukosa, masing-masing dimasukkan ke dalam tabung reaksi.
Ditambahkan 1 ml larutan fenol 5%, dikocok.
Ditambahkan dengan cepat 5 ml larutan asam sulfat pekat dengan cara larutan tersebut dituangkan secara tegak lurus ke permukaan larutan.
Dibiarkan selama 10 menit, dikocok, lalu ditempatkan dalam penangas air selama 15 menit.
Diukur absorbansinya pada 490 nm untuk heksosa dan 480 nm untuk pentose dan asam uronat.
Dibuat kurva standar. Penetapan sampel
25 Lampiran 8 Prosedur uji gula pereduksi (Metode DNS) (Apriyantono et al. 1989) Prinsip: dalam suasana alkali gula pereduksi akan mereduksi asam 3,5-dinitrosilat (DNS) membentuk senyawa yang dapat diukur absorbansinya pada panjang gelombang 550 nm.
Cara kerja
Sampel harus dalam bentuk cairan jernih. Jika tidak jernih atau mengandung komponen lain maka harus dilakukan penyaringan terlebih dahulu.
Dimasukkan 1 ml sampel ke dalam tabung reaksi, ditambahkan 3 ml pereaksi DNS.
Ditempatkan dalam air mendidih selam 5 menit. Dibiarkan dingin sampai suhu ruang.
Diencerkan sampel bila diperlukan sampai terukur pada kisaran 20%-80% T pada panjang gelombang 550nm. Air digunakan sebagai blanko.
Dibuat kurva standar dengan menggunakan larutan glukosa standar dengan kisaran 0,2-5 mg/ml
Untuk sample yang sedikit mengandung glukosa, ditambahkan 10 mg glukosa ke dalam masing-masing sampel. Tiga ml pereaksi DNS akan berekasi dengan ±10 mg glukosa, oleh karena itu sampel harus diencerkan dulu sampai mengandung glukosa ±5 mg.
Catatan:
Reaksi pembentukan warna terjadi pada suasana basa, oleh karena itu sampel yang bersifat asam harus dinetralkan terlebih dahulu dengan penambahan NaOH.
26
RIWAYAT HIDUP
Elisabeth Yan Vivi Aryanti terlahir sebagai anak pertama pasangan Antonius Sukarmin dan Lucia Hudi Antarti pada tanggal 22 Januari 1992. Penulis menyelesaikan jenjang pendidikan menengah atas di SMA Negeri 1 Bekasi, Jawa Barat pada tahun 2009. Pada tahun yang sama penulis melanjutkan pendidikan di Departemen Teknologi Industri Pertanian, Fakultas Teknologi Pertanian, Institut Pertanian Bogor melalui jalur masuk SNMPTN (Seleksi Nasional MAsuk Perguruan Tinggi Negeri).