Aquilaria malaccensis
Oleh:
Mey Sulistyo Putri
A14070062
DEPARTEMEN ILMU TANAH DAN SUMBERDAYA LAHAN
FAKULTAS PERTANIAN
Nutrition Status toward Agarwood Formation in Aquilaria malaccensis. Supervised by GUNAWAN DJAJAKIRANA and BASUKI SUMAWINATA
Agarwood is known as one of non-timber forest commodity in the world. Agarwood has a lot of function such as raw material for perfume, incense, cosmetics, and medicine for some diseases. Indonesia has a good potential resource to produce agarwoods. At present, mechanism and processes of agarwood formation is not yet known exactly. There are three hypothesis in agarwood formation, that are 1) pathology hypothesis, 2) sliced dan pathology, and 3) non-pathology hypothesis. Meanwhile, ancient community used traditional system to stimulate agarwood formation by slicing, nailing, branch cutting, and peeling of stem rind.
This research was done to know microbial effect and plant nutrition status in Aquilaria malaccensis and their correlation in agarwood formation. Chemical and biological analysis were used in this research. Chemical analysis was used to determine plant nutrition status. Meanwhile biological analysis was used to examine the microbes that caused agarwood formation.
The result of this reseach showed that agarwood was formed either because of assosiation between microbes and Aquilaria malaccensis and slicing in that plant. The highest microbial population was found in branch protected by canopy. According to physiologic analysis, not all microbes in agarwood can dissolve cellulose and pectin. A high number of Agarwood was formed in plant with high N and Mn contents. Field trial showed that fungi were more potential than bacteria in agarwood formation.
MEY SULISTYO PUTRI. 2013. Eksplorasi Peran Mikrob dan Status Hara Tanaman terhadap Pembentukan Gaharu pada Aquilaria malaccensis. Di bawah bimbingan GUNAWAN DJAJAKIRANA dan BASUKI SUMAWINATA.
Gaharu merupakan salah satu komoditas hasil hutan bukan kayu (HHBK) yang sudah mendunia. Gaharu memiliki banyak kegunaan seperti, bahan dasar parfum, dupa, kosmetik, dan sebagai obat beberapa penyakit. Indonesia memiliki potensi sumberdaya pohon penghasil gaharu yang tinggi. Sampai saat ini, mekanisme dan proses pembentukan gaharu belum diketahui dengan pasti. Ada tiga hipotesis dalam pembentukan gaharu yaitu 1) hipotesis patologi, 2) pelukaan dan patologi, dan 3) hipotesis non patologi. Sementara itu, masyarakat awam menggunakan cara tradisional untuk merangsang pembentukan gaharu dengan pelukaan seperti: disayat, dipaku, pemangkasan cabang, dan mengelupas kulit batang.
Penelitian ini dilakukan untuk mengetahui ada tidaknya pengaruh mikrob dan status hara tanaman pada Aquilaria malaccensis serta hubungannya dengan pembentukan gaharu. Dalam penelitian ini dilakukan analisis kimia dan biologi. Analisis kimia dilakukan untuk mengetahui status hara tanaman. Analisis biologi dilakukan untuk mengetahui mikrob yang menyebabkan pembentukan gaharu.
Hasil penelitian menunjukkan terbentuknya gaharu dikarenakan adanya asosiasi antara tanaman dengan mikrob ataupun adanya luka pada pohon. Populasi mikrob terbanyak terdapat di bagian dahan yang terlindung oleh kanopi. Dari uji fisiologis yang dilakukan, tidak semua mikrob yang ditemukan pada gaharu bisa melarutkan selulosa dan pektin. Gaharu dengan jumlah yang banyak terbentuk pada tanaman dengan kadar nitrogen (N) dan mangan (Mn) tinggi. Hasil uji lapang menunjukkan bahwa fungi lebih berpotensi merangsang pembentukan gaharu dibanding bakteri.
Aquilaria malaccensis
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian dari Fakultas Pertanian
Institut Pertanian Bogor
DEPARTEMEN ILMU TANAH DAN SUMBERDAYA LAHAN
FAKULTAS PERTANIAN
Nama : Mey Sulistyo Putri NIM : A14070062
Menyetujui,
Pembimbing Skripsi I Pembimbing Skripsi II
Dr. Ir. Gunawan Djajakirana, M. Sc Dr. Ir. Basuki Sumawinata, M. Agr NIP. 19580824 198203 1 004 NIP. 19570610 198103 1 003
Mengtahui, Ketua Departemen
(Dr. Ir. Syaiful Anwar, M. Sc) NIP. 19621113 198703 1 003
Penulis merupakan putri dari pasangan keluarga Bapak Suprapto dan Ibu Lilik Supadmi. Sebagai anak ke dua dari dua bersaudara yaitu Mardani Bagus Santoso dan Mey Sulistyo Putri.
Riwayat pendidikan penulis dimulai pada tahun 1993 – 1995 di TK Darmawanita Purwoasri. Tahun 2001 penulis lulus SD Negeri Desa Pesing, kemudian pada tahun 2004 penulis menyelesaikan pendidikan di SMPN 1 Papar. Pada tahun yang sama penulis melanjutkan studi di SMAN 2 Pare dan lulus pada tahun 2007. Tahun 2007 penulis diterima di Institut Pertanian Bogor melalui jalur USMI dengan mayor Manajemen Sumberdaya Lahan.
Segala puji syukur bagi Allah SWT yang senantiasa memberikan rahmat, taufik, serta hidayahnya, sehingga penelitian dan penulisan skripsi yang berjudul “Eksplorasi Peran Mikrob dan Status Hara Tanaman terhadap Pembentukan Gaharu pada Aquilaria malaccensis” dapat diselesaikan dengan baik. Skripsi ini diajukan sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian pada Departemen Ilmu Tanah dan Sumberdaya Lahan program studi Manajemen Sumberdaya Lahan, Fakultas Pertanian, Institut Pertanian Bogor.
Semua hasil ini tidak lepas dari peran berbagai pihak yang telah memberikan bantuan, baik secara moril maupun materil. Pada kesempatan ini, penulis mengucapkan terima kasih kepada:
1. Dr. Ir. Gunawan Djajakirana, M. Sc dan Dr. Ir. Basuki Sumawinata, M. Agr selaku pembimbing skripsi yang telah memberi masukan, bimbingan dan fasilitas selama melaksanakan penelitian dan penyusunan skripsi. 2. Dr. Rahayu Widyastuti, M. Sc selaku dosen penguji yang banyak
memberikan saran untuk kesempurnaan tulisan ini.
3. Pak Usman yang bersedia menemani dan memberikan banyak ilmu selama penelitian di lapang.
4. Pak Nurdin dan keluarga yang bersedia menyediakan tempat tinggal selama penelitian di lapang.
5. Pak Oman dan keluarga serta warga Rantau Rasau yang membantu inokulasi untuk pengujian lapang.
6. Yayasan Karya Salemba Empat yang membantu sebagian biaya penelitian dan penulisan skripsi.
Penulis berharap semoga karya ilmiah ini dapat bermanfaat dan dapat memperluas wawasan kita.
Bogor, Januari 2013
DAFTAR TABEL ... x
4.2 Hubungan Mikrob Selulolitik dan Pektinolitik dengan Pembentukan Gaharu ... 20
4.3 Peran Hara Tanaman terhadap Populasi Mikrob dan Pembentukan Gaharu ... 21
4.4 Hasil Uji Lapang ... 24
V. KESIMPULAN DAN SARAN ... 26
TEKS
Nomor Halaman
1. Populasi Mikrob pada Beberapa Pohon A. malaccensis ... 17
2. Indeks Pelarutan Isolat Terbaik dari Beberapa Pohon A. malaccensis ... 19
3. Banyaknya Mikrob Selulolitik dan Pektinolitik pada Beberapa Pohon A. malaccensis ... 21
4. Kandungan Hara pada Beberapa Pohon A. malaccensis ... 22
LAMPIRAN Nomor Halaman 1. Komposisi Media CMC (per liter) ... 33
2. Komposisi Media Citric Pectin 0.5% (percliter) ... 33
3. Komposisi media Pectinolytic Bacteria (per liter) ... 34
4. Deskripsi Isolat (Bakteri) Terpilih ... 34
DAFTAR GAMBAR
TEKS
Nomor Halaman
1. Pola Spiral Inokulasi Pohon Gaharu ... 14
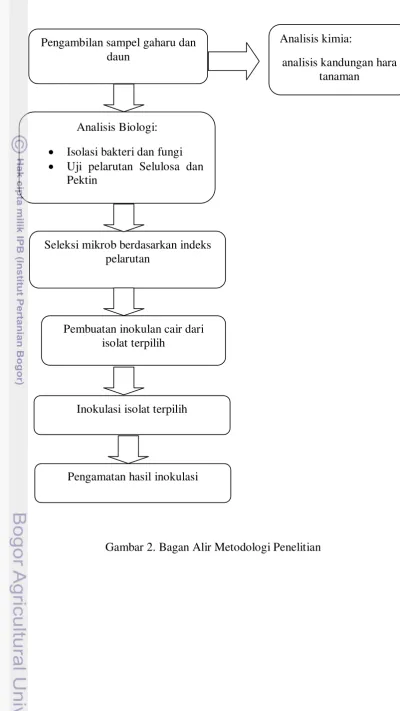
2. Bagan Alir Metodologi Penelitian ... 16
3. Panjang Infeksi yang Terbentuk pada Pohon A. malaccensis Setelah Inokulasi ... 24
LAMPIRAN Nomor Halaman 1. Lokasi Pengambilan Sampel Daun dan Gubal Gaharu... 30
a) Lokasi Pengambilan Sampel di Desa Pulo Aro ... 30
b) Pohon G1 ... 30
c) Pohon G2 ... 30
d) Pohon G3 ... 31
e) Fungi yang Menempel pada Dahan ... 31
2. Kondisi Pohon G1 dan Gaharu yang Terbentuk ... 31
a) Gigitan Tupai pada Pohon G1 ... 31
b) Gaharu yang Terbentuk dari Pemangkasan Dahan Pucuk ... 31
c) Gaharu yang Terbentuk dari Gigitan Tupai ... 32
3. Gaharu Hasil Inokulasi ... 32
4. Pembentukan Zona Bening oleh Fungi ... 32
I. PENDAHULUAN
1.1 Latar BelakangGaharu merupakan salah satu komoditas hasil hutan bukan kayu (HHBK) yang sudah mendunia. Harga jual dari gaharu paling tinggi dibandingkan HHBK lain, seperti rotan, sutera, bambu, nyamplung, ataupun madu. Gaharu digunakan sebagai bahan dasar industri parfum, dupa, kosmetik, dan obat-obatan (Sumarna, 2002). Gaharu yang mempunyai aroma khas bahkan diekspor ke Arab Saudi khusus untuk pengharum ka’bah di Mekah.
Indonesia memiliki potensi sumberdaya pohon penghasil gaharu yang tinggi. Hal ini dikarenakan terdapat enam genus pohon penghasil gaharu yang tersebar di Indonesia. Adapun daerah penyebaran gaharu di Indonesia adalah: Kalimantan, Sulawesi, Sumatera, Ambon, Jawa, Nusa Tenggara Barat, dan Nusa Tenggara Timur. Gaharu yang terdapat di Indonesia berasal dari genus Aquilaria, Gonystylus, Gyrinops, Einkleia, Aetoxylon, dan Wiekstroemia. Pohon yang paling banyak dicari oleh para pemburu gaharu adalah dari genus Aquilaria dan
Gyrinops karena kualitas dan harga jualnya yang lebih tinggi.
Sampai saat ini, mekanisme dan proses pembentukan gaharu belum diketahui dengan pasti. Santoso et al. (2006) melaporkan bahwa proses dan mekanisme terbentuknya gaharu pada pohon penghasil gaharu disebabkan karena pohon terinfeksi fungi pada bagian batang yang terluka. Atas dasar asumsi tersebut dimungkinkan penyakit secara biologis dapat dikembangkan sebagai inokulan dan terlukanya batang dapat direkayasa dengan pengeboran dan proses infeksi penyakit.
1.2 Tujuan
Penelitian ini dilakukan untuk mengetahui ada tidaknya pengaruh mikrob dan status hara pada A. malaccensis serta hubungannya dengan pembentukan gaharu.
1.3 Hipotesis
1. Mikrob yang mampu mendegradasi selulosa dan pektin mampu merangsang pembentukan gaharu.
II. TINJAUAN PUSTAKA
2.1Botani Pohon Penghasil Gaharu (A. malaccensis)
Tanaman Aquilaria spp. memiliki ciri sebagai berikut: batang tanaman dapat mencapai tinggi 35-40 m, diameter sekitar 60 cm, dan berkayu keras. Kulit batangnya licin berwarna putih atau keputih-putihan. Daun lonjong memanjang dengan panjang 5-8 cm, lebar 3-4 cm, berujung runcing dan berwarna mengkilat. Bunga berada di ujung ranting, atau ketiak atas dan bawah daun. Buah berada dalam polong berbentuk bulat telur atau lonjong, berukuran panjang sekitar 5 cm, dan lebar 3 cm. Biji bulat atau bulat telur yang ditutupi bulu-bulu halus yang berwarna kemerahan (Iriansyah et al., 2007).
Berikut ini adalah taksonomi A. malaccensis berdasar CITES (2004) : Kingdom : Plantae
Divisi : Termathophyta Sub Divisi : Angiospermae Klas : Magnoliopsida
Gaharu merupakan endapan resin yang terakumulasi pada jaringan kayu sebagai reaksi pohon terhadap pelukaan atau infeksi patogen. Gaharu terbentuk sebagai reaksi pertahanan terhadap infeksi patogen melalui pelukaan pada batang, cabang, atau ranting, atau pengaruh fisik lain. Infeksi patogen menyebabkan keluarnya resin yang terdeposit pada jaringan kayu, lama-kelamaan jaringan kayu mengeras dan menjadi cokelat (Santoso et al., 2007).
pertama, gaharu diduga terbentuk sebagai respon pohon penghasil gaharu terhadap infeksi cendawan yang menghasilkan keluarnya “resin”. Pada hipotesis kedua, beberapa peneliti menduga bahwa pelukaan memegang peran utama dalam pembentukan gaharu diikuti oleh infeksi cendawan sebagai faktor pendukung. Sedangkan pada hipotesis ketiga (hipotesis non patologi) diyakini bahwa pembentukan gaharu adalah sebagai respon pertahanan pohon terhadap pelukaan saja.
Hasil penelitian Pojanagoro & Kaewrak (2005) menyatakan bahwa pelukaan secara mekanik dapat menginduksi pembentukan gaharu pada pohon A. crassna. Hal ini didukung oleh hasil penelitian Blanchette & Beek (2005) yang menyatakan jenis pelukaan merupakan salah satu faktor yang menentukan induksi pembentukan gubal gaharu. Pelukaan dengan menggunakan kampak yang membuat luka di permukaan batang saja ternyata tidak mampu memacu pembentukan gubal gaharu. Pelukaan yang diperlukan untuk menginduksi pembentukann gubal gaharu bisa dibuat dengan menggunakan alat bor sampai ke bagian xilem dan luka tersebut dibiarkan terbuka supaya ada aerasi untuk menghalangi penyembuhan.
Menurut Suwardi & Edriana (2005) selama proses pembentukan gaharu akan terjadi perubahan beberapa sifat secara bertahap yaitu: a). warna dari putih menjadi coklat, kehitaman dan akhirnya hitam kehijauan; b). Serat kayu diganti resin sehingga pada akhir proses serat kayu tidak nampak lagi; c). Berat jenis makin berat hingga bisa tenggelam dalam air. Suwardi & Edriana (2005) juga menyatakan daya tumbuh pohon akan berkurang disebabkan bagian kayu menjadi diisi resin sehingga pohon menjadi mati. Terbentuknya gaharu selain pada batang juga dapat terjadi pada dahan dan akar.
2.3 Bakteri
mengandung senyawa karbon, hidrogen, nitrogen, oksigen, fosfor, serta sulfur atau unsur anorganik seperti K, Mg, Ca, Fe, Co, Zn, Cu, Mn dan Ni. Keseluruhan unsur ini dibutuhkan oleh bakteri heterotrof sebagai sumber nutrisi (Madigan & Martinko, 2005).
Madigan et al. (2009) menambahkan, banyak mikrob, termasuk bakteri merupakan patogen tanaman. Mereka dapat merusak dengan berbagai cara. Beberapa bakteri menimbulkan dampak fisik sehingga menurunkan kualitas dan harga jual. Bakteri lain, menyebabkan masalah pertumbuhan, sehingga berpengaruh terhadap penurunan biomasa, biji, buah, dan komponen lain. Spesies tertentu seperti: Pseudomonas, Xanthomonas, Xylella, dan Erwinia adalah beberapa contoh bakteri patogen.
2.4 Fungi
Gandjar et al. (2000) mendefinisikan fungi sebagai jasad yang bersifat heterotrof, dinding sel spora mengandung kitin, tidak berplasmid, tidak berfotosintesis, tidak bersifat fagotrof, umumnya memiliki hifa yang berdinding yang dapat berinti banyak (multinukleat) atau berinti tunggal (mononukleat), dan memperoleh hara dengan cara absorbsi.
Madigan et al. (2009) menjelaskan bahwa habitat fungi cukup beragam, baik di air maupun di darat. Beberapa fungi termasuk golongan akuatik, mayoritas hidup di air tawar dan beberapa di daerah marin. Fungi yang hidup di darat banyak ditemukan di tanah atau tanaman yang sudah mati dan memainkan peran penting dalam mineralisasi karbon organik.
Madigan et al. (2009) menambahkan, kebanyakan fungi adalah parasit bagi tanaman. Sebagian besar fungi yang menjadi patogen adalah Phytopthora
2.5 Hara tanaman
Pertumbuhan tanaman sangat dipengaruhi oleh kandungan hara, terutama hara esensial. Penyakit pada tanaman sering disebabkan karena tanaman kekurangan hara esensial. Unsur hara ini mempunyai peran tersendiri misalnya: 2.5.1 Unsur Nitrogen (N)
Menurut Barker & Bryson (2007) nitrogen dapat berada dalam berbagai senyawa yang bisa digunakan untuk metabolisme tanaman. Umumnya, lebih dari 75 % nitrogen di dalam daun terkandung dalam kloroplas. Kekurangan nitrogen akan menghambat pertumbuhan tanaman karena akan menurunkan protein dalam kloroplas. Nitrogen merupakan unsur yang mobil, jika terjadi defisiensi unsur ini akan ditransfer ke jaringan yang lebih muda. Karena itulah, gejala defisiensi nitrogen terlihat pertama kali pada tanaman bagian bawah.
2.5.2 Unsur Fosfor (P)
Sanchez (2007) menyatakan fosfor digunakan dalam bentuk teroksidasi dan terhidrasi sepenuhnya sebagai orthofosfat. Tanaman biasanya menyerap fosfor dalam bentuk H2PO4- dan HPO42-, tergantung pada pH. Fosfor digunakan untuk pembentukan sel, pembentukan albumen, perkembangan akar, metabolisme karbohidrat, dan transfer energi. Brady & Weil (2002) menambahkan fosfor merupakan komponen esensial dari senyawa organik adenosin trifosfat (ATP) yang terbentuk melalui proses fotosintesis. Fosfor juga merupakan komponen esensial dari DNA dan RNA, yang secara langsung menyusun protein pada tumbuhan dan hewan. Defisiensi P mengakibatkan pertumbuhan terhambat (kerdil) karena pembelahan sel terganggu dan daun menjadi ungu atau coklat mulai dari ujung daun.
2.5.3 Unsur Kalium (K)
perakaran. Kekurangan kalium akan mengakibatkan tunas dan akar tidak berkembang.
2.5.4 Unsur Kalsium (Ca)
Kalsium merupakan elemen kunci dalam dinding sel. Sekitar 60% Ca berasosiasi dengan dinding sel. Dalam tanaman, kalsium berada dalam bentuk Ca2+ melekat pada dinding sel melalui pertukaran kation. Fungsi utama Ca pada tanaman sebagai penjaga kestabilan dan keutuhan sel. Hal ini dikarenakan kehadiran Ca berfungsi menguatkan dinding sel primer. Selain itu, Ca menghambat degradasi pektat dalam dinding sel dengan menghambat pembentukan poligalakturonase (Rahman & Punja, 2007; Pilbeam & Morley, 2007).
2.5.5 Unsur Magnesium (Mg)
Berdasarkan Merhaut (2007) magnesium memiliki peran besar dalam fisiologis dan molekul tanaman, seperti menjadi komponen klorofil, kofaktor untuk proses enzimatik yang terkait dengan fosforilasi, defosforilasi, dan hidrolisis berbagai senyawa, dan sebagai penstabil struktural berbagai nukleotida. Unsur ini merupakan unsur penyusun klorofil daun; magnesium juga terlibat dalam pembentukan gula; translokasi karbohidrat; mengatur serapan hara lain; sebagai carier fosfat dalam tanaman; dan aktivator enzim transfosfoliase, dehidrogenase, dan karboksilase. Karena magnesium merupakan komponen integral dari klorofil dan proses enzimatik yang berhubungan dengan fotosintesis dan respirasi. Asimilasi karbon dan transformasi energi akan terpengaruh oleh kekurangan magnesium. Karena itulah kekurangan magnesium dapat menghambat pertumbuhan, khususnya akar dan tunas. Tingkat penghambatan dipengaruhi oleh: keparahan kekurangan magnesium, jenis tanaman, kondisi lingkungan, dan status nutrisi umum dari tanaman.
2.5.6 Unsur Besi (Fe)
protein ferredoxin dan dibutuhkan untuk reduksi nitrat dan sulfat, asimilasi N2, dan energi (NADP). Unsur ini juga berfungsi sebagai katalisator formasi enzim dan klorofil (Jones et al., 1991).
2.5.7 Unsur Tembaga (Cu)
Tembaga diidentifikasi sebagai nutrisi tanaman sekitar tahun 1930. Penyerapan Cu oleh tanaman dipengaruhi oleh faktor seperti: pH tanah dan konsentrasi Cu di tanah. Konsentrasi Cu tertinggi dalam tanaman ada pada jaringan akar, hal itu mengakibatkan gejala kelebihan sering terlihat pada akar. Kekurangan Cu ditunjukkan dengan gejala: roseting, klorosis, daun muda menggulung, dan tanaman menjadi kerdil (Kopsell & Kopsell, 2007).
2.5.8 Unsur Seng (Zn)
Seng merupakan unsur hara mikro yang merupakan penyusun protein kloroplas, plastocyanin yang merupakan bagian dari sistem transport elektron yang menghubungkan fotosistem I dan II. Unsur ini juga berpartisipasi dalam metabolisme protein dan karbohidrat, serta fiksasi N2. Seng juga merupakan bagian dari enzim: cytocrome oksidase, asam ascorbic oksidase, dan phylophenol oksidase. Defisiensi seng menyebabkan tanaman kerdil dan nekrokis pada daun muda dan meristem apikal (Jones et al., 1991).
2.5.9 Unsur Mangan (Mn)
Mangan (Mn) merupakan salah satu unsur hara yang ketersediaannya berlimpah di alam dengan rata–rata konsentrasi 650 ppm (Glikes et al., 1988
dalam Thompson & Huber, 2007). Burnel, (1988, Römheld & Marshcen, (1991)
dalam Thompson & Huber, 2007) menyebutkan bahwa fungsi utama Mn adalah sebagai aktivator enzim: dehidrogenase, transferase, hidroksilase, dan dehidroksilase.
kelarutan N, kelarutan karbohidrat, sistem hormonal, dan sistesis bahan sekunder seperti: fenol, lignin, klorofil, dan lain-lain.
Gejala kelebihan Mn yang dijelaskan oleh Assche et al. (1977 dalam
Thompson & Huber, 2007) adalah terbentuknya bintik berwarna gelap atau bercak pada daun. Horst (1988 dalam Thompson & Huber, 2007) menambahkan, tingginya konsentrasi Mn pada tanaman juga menyebabkan munculnya gejala kekurangan unsur lain seperti Fe, Cu, dan Ca.
2.6 Selulosa
Selulosa adalah polisakarida yang terdiri dari rantai glukosa (1-4) ß-D glukan yang dihubungkan oleh ikatan hidrogen. Polisakarida ini merupakan komponen paling melimpah dari biomasa. Selulosa banyak ditemukan terutama pada dinding sel dengan konsentrasi sebesar 35% sampai 50 % dari berat kering tanaman (Lynd et al., 2002).
2.7 Pektin
III. BAHAN DAN METODE
3.1 Waktu dan Tempat
Penelitian dilaksanakan dari bulan Oktober 2011 sampai Oktober 2012. Sampel gubal dan daun gaharu diambil di Desa Pulo Aro, Kecamatan Tabir Ulu, Kabupaten Merangin, Provinsi Jambi. Analisis biologi dan kimia dilakukan di Laboratorium Bioteknologi Tanah serta Laboratorium Kimia dan Kesuburan Tanah, Departemen Ilmu Tanah dan Sumberdaya Lahan, Institut Pertanian Bogor. Untuk uji lapang, dilaksanakan di Rantau Rasau, Kabupaten Tanjung Jabung Timur, Provinsi Jambi.
3.2 Alat dan Bahan
Alat yang digunakan dalam penelitian di antaranya: autoclaf, laminar air flow, cawan petri, labu erlenmayer, pipet, tabung reaksi, jarum ose, bunsen, timbangan digital, tisu, alat tulis, AAS, dan Spectrofotometer UV-VIS.
Bahan yang digunakan dalam penelitian ini adalah sampel daun dari A. malaccensis yang akan digunakan untuk menentukan status hara tanaman dan sampel gaharu yang diambil dariPulo Aro, Kabupaten Merangin, Provinsi Jambi.
diisolasi. Hal ini dilakukan agar mikrob yang akan diteliti berada pada kondisi dorman sehingga tidak mendapat gangguan dengan perubahan lingkungan di sekitarnya.
1.2 Pengambilan Sampel Daun
Pengambilan sampel daun dilakukan untuk mengetahui status hara pada tanaman. Contoh daun diambil dari tiga tingkat tajuk (tajuk bagian bawah, tengah, dan atas) yang menghadap barat dan timur. Pengambilan sampel daun dilakukan hanya pada tajuk yang menghadap barat dan timur dikarenakan area ini mendapatkan penyinaran yang intensif, sehingga bisa berfotosintesis dengan maksimal. Sampel daun yang diambil dari setiap lokasi dimasukkan ke dalam amplop kertas. Amplop kertas digunakan karena kertas ini bisa menyerap air, sehingga daun tidak busuk sebelum dianalisis.
2. Analisis Kimia
Analisis kimia yang dilakukan berupa analisis hara tanaman melalui daun. Analisis hara dilakukan karena kandungan hara dalam tanaman dapat mempengaruhi kesehatan dan daya tahan tanaman terhadap infeksi mikrob. Adapun hara tanaman yang dianalisis adalah: N, P, K, Ca, Mg, Mn, Cu, Zn, dan Fe. Analisis kandungan Nitrogen pada jaringan daun dilakukan dengan menggunakan metode semi mikro Kjeldal, sedangkan delapan unsur hara yang lain dianalisis menggunakan metode pengabuan basah.
Hasil destruksi daun akan digunakan untuk menentukan status hara tanaman. kandungan fosfor (P) diukur dengan Spectrofotometer UV-VIS pada panjang gelombang 660 nm, kandungan Ca, Mg, Mn, Cu, Zn, dan Fe diukur dengan AAS, sedangkan kandungan kalium (K) diukur dengan Flamefotometer. 3. Analisis Biologi
Analisis biologi dilakukan untuk mengetahui ada tidaknya peran mikrob dan efektivitasnya terhadap pembentukan gaharu pada A. malaccensis.
Tahapan dari analisis biologi adalah: 3.1 Isolasi Mikrob
Mikrob yang diisolasi dari pohon A. malaccensis adalah fungi dan bakteri. Isolasi dilakukan di laboratorium Bioteknologi Tanah Institut Pertanian Bogor. Isolasi dilakukan dengan menggunakan media PDA untuk isolasi fungi dan TSA 5% untuk isolasi bakteri.
Isolasi fungi dan bakteri dilakukan dengan metode agar tuang. Langkah awal metode dilakukan dengan menimbang 10 gram sampel, memasukkan sampel ke dalam erlenmeyer berisi 90 ml larutan fisiologis. Sampel yang sudah direndam kemudian dikocok dengan kecepatan 150 rpm. Suspensi yang telah dikocok diambil 1 ml menggunakan pipet dan dimasukkan ke dalam tabung reaksi yang berisi 9 ml larutan fisiologis, sehingga didapat suspensi dengan seri pengenceran 10-2. Langkah yang sama dilakukan untuk membuat seri pengenceran 10-3, 10-4, 10-5, 10-6, 10-7, 10-8, dan 10-9. Dari setiap seri pengenceran diambil 1 ml suspensi dan ditumbuhkan pada medium. Isolasi fungi dilakukan pada pengenceran 10-2 sampai 10-5, sedangkan bakteri di isolasi dari pengenceran 10-7 sampai 10-9. 3.2 Pemurnian
dengan metode gores, sedangkan pada fungi dilakukan dengan metode titik. Hal ini dilakukan karena miselium fungi akan hancur jika sama-sama menggunakan metode gores.
3.3 Uji Fisiologis
Mikrob yang sudah murni dilakukan pengujian fisiologis berupa uji pelarutan selulosa dan pektin. Hal ini dilakukan untuk mengetahui efektivitas mikrob dalam melarutkan selulosa dan pektin. Untuk uji selulosa digunakan media CMC, sementara pengujian pektin menggunakan media Citric pectin 0.5% untuk fungi dan Pectinolytic Bacteri untuk bakteri.
Pada dasarnya uji pelarutan selulosa dan pektin sama, hanya medianya saja yang membedakan. Uji pelarutan selulosa dan pektin dilakukan dengan menumbuhkan mikrob pada media selektif dan diinkubasi selama 3 hari pada suhu ruangan. Mikrob yang telah diinkubasi dilakukan pewarnaan dengan menggunakan Congo red untuk uji pelarutan selulosa dan Kalium iodine untuk pelarutan pektin. Pembentukan zona bening di sekitar biakan merupakan indikasi bahwa mikrob tersebut bisa melarutkan selulosa dan pektin. Indeks selulolitik dan pektinolitik dihitung dengan rumus:
3.4 Seleksi Isolat
4. Pengujian Lapang
Pengujian lapang dilakukan untuk mengetahui efektivitas mikrob yang telah diisolasi dalam menghasilkan gaharu pada A. malaccensis.
Pengujian lapang dilakukan dengan tiga tahapan, yaitu: 1. Pembuatan inokulan
Isolat yang terseleksi dibuat inokulan cair dengan cara menumbuhkan isolat tersebut pada media Nutrient Broth.
2. Inokulasi
Inokulan yang telah dibuat diinokulasikan pada pohon A. malaccensis di Rantau Rasau, Kabupaten Tanjung Jabung Timur, Provinsi Jambi. Inokulasi dilakukan dengan cara menginjeksikan inokulan pada pohon yang telah dibor. Pengeboran dilakukan dengan posisi miring ke bawah dengan pola berbentuk spiral mengelilingi batang.
Gambar 1. Pola Spiral Inokulasi Pohon Gaharu*
Dalam satu pohon terdapat lima lubang injeksi. Setiap isolat diberikan ulangan sebanyak tiga pohon, jadi total setiap isolat terdapat 15 titik pengamatan. Setiap lubang di injeksi inokulan sebanyak 1 – 2 ml, kemudian ditutup dengan kapas.
3. Pengamatan hasil inokulasi
Gambar 2. Bagan Alir Metodologi Penelitian Pengambilan sampel gaharu dan
daun
Analisis kimia:
analisis kandungan hara tanaman
Analisis Biologi:
Isolasi bakteri dan fungi
Uji pelarutan Selulosa dan Pektin
Seleksi mikrob berdasarkan indeks pelarutan
Pembuatan inokulan cair dari isolat terpilih
Inokulasi isolat terpilih
IV. HASIL DAN PEMBAHASAN
4.1 Isolasi dan Seleksi Mikrob pada A. malaccensisPopulasi bakteri dan fungi diketahui dari hasil isolasi dari pohon yang sudah menghasilkan gaharu. Sampel yang diambil merupakan gaharu yang terbentuk dari gigitan tupai, fungi yang menempel pada batang, pemangkasan dahan dan pelukaan akar. Hasil isolasi total mikrob pada beberapa pohon A. malaccensis disajikan pada tabel di bawah ini.
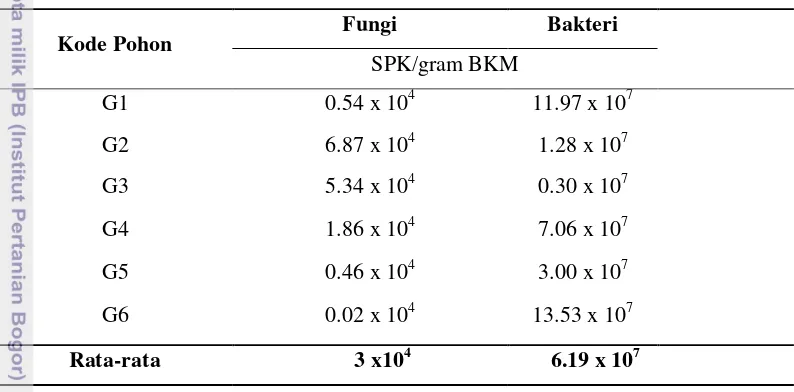
Tabel 1. Populasi Mikrob pada Beberapa Pohon A. malaccensis Kode Pohon
Berdasarkan hasil isolasi yang dilakukan dari ke enam sampel, diketahui populasi fungi paling banyak ada pada G2. Populasi bakteri terbanyak didapat pada sampel G6. Pada sampel yang sama, dapat diketahui juga bahwa populasi fungi lebih rendah dibanding yang lain. Sampel G3 mempunyai populasi bakteri terendah dibandingkan ke lima sampel yang lain. Populasi mikrob terbanyak (bakteri dan fungi) pada A. malaccensis (G2 dan G6) terdapat pada bagian dahan pohon dan gaharu terbentuk secara alami. Pada sampel dengan populasi bakteri paling rendah (G3) gaharu terbentuk dari proses pemangkasan dahan.
perusak kayu dan menyebabkan berkurangnya tingkat pertumbuhan mikrob. Hal ini kemungkinan disebabkan efek dari intensitas radiasi ultraviolet (UV) yang tinggi.
Pernyataan Zabel & Morrel (1992) menjelaskan kondisi yang terjadi pada G2, G3, dan G6. Meskipun ketiganya diambil dari bagian dahan pohon, tapi G3 memiliki total populasi bakteri paling sedikit dibanding pohon lain (0.30 x 107). Banyaknya populasi fungi pada G2 (6.87 x 104) dan bakteri pada G6 (13.53 x 107) dikarenakan sampel G2 dan G6 tertutupi oleh kanopi. Tutupan kanopi membuat mikrob terlindung dari radiasi UV dan menjaga kelembaban sehingga mikrob bisa tumbuh dengan baik. Kanopi juga menyediakan banyak oksigen dari hasil fotosintesis yang dibutuhkan organisme aerob.
Sedikitnya populasi bakteri pada G3 dikarenakan gaharu yang terbentuk berasal dari pemangkasan dahan, sehingga sampel tidak mendapatkan perlindungan dari radiasi matahari. Selain itu, pemangkasan dahan menyebabkan nutrisi pada tanaman berkurang karena tidak mendapatkan nutrisi yang merupakan hasil fotosintesis. Ketersediaan nutrisi yang sedikit menyebabkan pertumbuhan bakteri terhambat dan populasi lebih sedikit dari yang lain.
Keadaan yang terjadi pada G6 mengindikasikan adanya kompetisi antara bakteri dan fungi. Madigan et al. (2009) mengungkapkan kompetisi di antara mikrob dipengaruhi oleh tingkat penyerapan nutrisi, tingkat metabolisme, dan tingkat pertumbuhan. Bakteri memiliki tingkat pertumbuhan lebih cepat dibanding fungi karena penyerepan nutrisinya lebih tinggi. Terbatasnya nutrisi yang didapat oleh fungi menyebabkan rendahnya populasi fungi yang ada pada G6.
Tabel 1 juga menunjukkan bahwa, banyaknya populasi bakteri dan fungi yang terdapat pada beberapa pohon A. malaccensis tidak berkorelasi dengan banyaknya gaharu yang ditemukan pada pohon tersebut. Berdasarkan pengamatan di lapangan, gaharu banyak terbentuk pada pohon G1. Hasil isolasi menunjukkan bahwa populasi bakteri dan fungi terbanyak tidak berasal dari pohon G1, tetapi berasal dari pohon G6 (13.53 x 107) dan G2 (6.87 x 104).
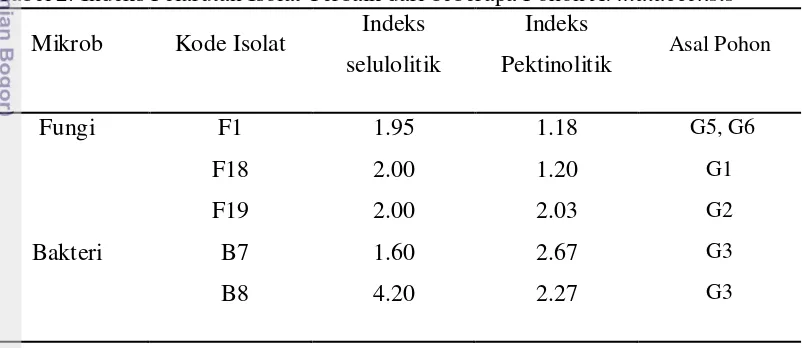
Untuk mendapatkan isolat terbaik, dilakukan seleksi terhadap isolat yang telah didapat. Seleksi dilakukan berdasarkan kemampuan isolat melarutkan selulosa dan pektin. Aktivitas selulolitik dan pektinolitik ditentukan berdasarkan pembentukan zona bening pada media biakan setelah dilakukan pewarnaan. Dari hasil isolasi diperoleh 19 isolat fungi dan 9 isolat bakteri. Setelah dilakukan uji pelarutan selulosa dan pektin didapatkan 5 isolat terbaik yang terdiri dari 3 isolat fungi dan 2 isolat bakteri, seperti yang ditampilkan pada Tabel 2.
Tabel 2. Indeks Pelarutan Isolat Terbaik dari beberapa Pohon A. malaccensis
Mikrob Kode Isolat Indeks selulolitik
Pengujian berdasarkan zona bening menghasilkan indeks selulolitik antara 1.95 – 2.00 untuk fungi, dengan indeks tertinggi pada F18 dan F19 sebesar 2.00. Indeks selulolitik bakteri 1.60 pada B7 dan 4.20 pada B8. Sedangkan pengujian pektinase menghasilkan indeks antara 1.20 – 2.03 untuk fungi dengan indeks tertinggi 2.03 oleh F19. Pengujian pektinolitik bakteri adalah 2.27 dan 2.67 dengan indeks tertinggi adalah B7.
eksoglukanase, dan ß-glukosidase). Ketiga enzim ini bekerja secara terstruktur seperti dijelaskan oleh Teeri et al. (1997 dalam Lynd et al., 2002). Endoglukanase memotong secara acak ikatan internal selulosa amorf pada rantai selulosa, selanjutnya eksoglukanase mereduksi ujung rantai menjadi glukosa dan selobiosa. Selanjutnya, ß-glukosidase menghidrolisis selobiosa menjadi glukosa yang bisa digunakan oleh mikrob.
Terbentuknya zona bening pada pengujian pektin karena adanya degradasi pektin oleh enzim pektinase atau pektolitik. Agrios (2005) menjelaskan, proses degradasi pektin diawali oleh kerja enzim pektin metil esterase yang membuang cabang dari rantai pektin. Pektin metil esterase merubah tingkat kelarutan pektin sehingga mudah dipisahkan oleh pektinase. Selanjutnya, rantai pektin melepaskan rantai yang lebih pendek yang terdiri dari satu atau beberapa molekul galakturonan. Rantai galakturonan dipecah oleh enzim pektinase berupa Poligalakturonase dan pektinliase. Pemecahan ini dilakukan agar galakturonan bisa dimanfaatkan mikrob. Poligalakturonase dan Pektinliase memutuskan rantai dengan menghidrolisis penghubung di antara dua molekul galakturonan.
Pektinase dan selulose sebagai enzim pendegradasi dinding sel merupakan faktor penting dalam patogenesis. Hal ini dikarenakan degradasi pektin dan selulosa akan melemahkan dinding sel tanaman. Degradasi pektin menyebabkan terputusnya ikatan antara selulosa dan hemiselulosa pada dinding sel. Degradasi selulosa akan melemahkan dinding sel karena jumlah selulosa paling banyak dibanding pektin dan hemisellulosa.
4.2 Hubungan Mikrob Selulolitik dan Pektinolitik dengan Pembentukan Gaharu
membuktikan hipotesis pertama, dilakukan pendataan banyaknya mikrob selulolitik, pektinolitik, serta mikrob selulolitik dan pektinolitik pada beberapa pohon A. malaccensis.
Dari Tabel 3 berikut ini diketahui bahwa, fungi pendegradasi selulosa terbanyak ditemukan pada pohon G1 dan G5 di mana masing–masing pohon terdapat 3 jenis fungi. Fungi pendegradasi pektin terbanyak terdapat pada pohon G1, G5, dan G6 sebanyak 3 jenis fungi per pohon. Fungi yang mendegradasi selulosa dan pektin terbanyak pada pohon G1 dengan jumlah 3 jenis. Bakteri terbanyak yang mampu mendegradasi selulosa, pektin, ataupun mendegradasi keduanya didapatkan dari pohon G3 sebanyak 2 jenis.
Tabel 3. Banyaknya Mikrob Selulolitik dan Pektinolitik pada Beberapa Pohon A. malaccensis
Kode Pohon Selulolitik Pektinolitik
Selulolitik & Pektinolitik
Fungi Bakteri Fungi Bakteri Fungi Bakteri
G1 3 1 3 0 3 0
Banyaknya jenis fungi yang ditemukan pada G1 sejalan dengan banyaknya gaharu yang terbentuk pada pohon ini. Pada pohon G1 banyak ditemukan bekas gigitan tupai (Lampiran 2). Gigitan tupai ini bisa mempengaruhi banyaknya jenis fungi maupun bakteri yang ditemukan pada pohon G1. Hal ini dikarenakan tupai bisa menjadi media perpindahan bakteri ataupun spora fungi dari suatu tempat ke tempat lain. Pohon G2 memiliki populasi fungi terbanyak, tapi fungi yang bisa melarutkan selulosa atau pektin tidak sebanyak G1. Hal ini menunjukkan bahwa tidak semua fungi bisa merangsang pembentukan gaharu.
4.3 Peran Hara Tanaman terhadap Populasi Mikrob dan Pembentukan Gaharu
organik yang bermolekul besar seperti protein, karbohidrat, lemak atau senyawa organik lain melalui proses metabolisme. Proses metabolisme menghasilkan senyawa yang lebih sederhana yang bisa dimanfaatkan sebagai sumber karbon untuk mikrob. Karena itulah, mikrob bisa ditemukan bersimbiosis dengan tanaman, baik simbiosis mutualisme, komensalisme, ataupun parasitisme.
Sebagai sumber nutrisi, unsur hara mempengaruhi pertumbuhan serta perkembangan mikrob. Fungsi unsur hara pada pertumbuhan mikrob di jelaskan Zabel & Morrel (1992) dan Madigan et al. (2009). Unsur Nitrogen (N) berfungsi untuk sintesis protein dan unsur pokok lain seperti: nukleoprotein, lipoprotein, enzim dan kitin. Unsur Fosfor (P) berfungsi untuk sintesis asam nukleat dan fosfolipit. Kalsium (Ca) berperan menjaga kestabilan dinding sel pada kebanyakan mikrob. Unsur logam juga dibutuhkan mikrob untuk reaksi enzimatik.
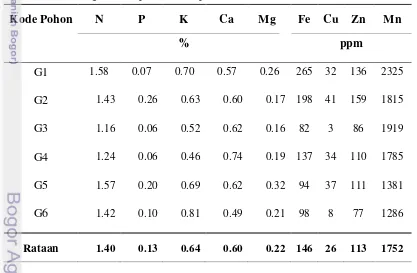
Tabel 4. Kandungan Hara pada Beberapa Pohon A. malaccensis
Merujuk pada Tabel 4, diketahui unsur hara yang tertinggi pada beberapa pohon A. malaccensis adalah nitrogen (N). Rata – rata kadar N 1.40%, dengan kadar N tertinggi pada G1 (1.58%). Hal ini sejalan dengan pendapat Sutejo (2002)
yang menyatakan bahwa nitrogen menjadi bahan terbanyak yang dikandung oleh tanaman setelah C, H, dan O. Kadar Fe dan Mn pada G1 juga paling tinggi dari ke enam sampel, yaitu 265 ppm Fe dan 2325 ppm Mn. Sementara itu pohon G2 memiliki kadar P, Cu, dan Zn tertinggi sebesar 0.26% untuk P, 41 ppm untuk Cu, dan 159 ppm untuk Zn. Kadar Ca tertinggi adalah 0.74% pada G4. Untuk kadar K dan Mg tertinggi berada pada G6 dan G5 sebesar 0.81% dan 0.32%.
Merujuk pada Tabel 4, terlihat bahwa kadar unsur mikro (Fe, Cu, Zn dan Mn) berkorelasi dengan populasi fungi pada beberapa pohon A. malaccensis.
Pohon G2 yang memiliki kadar unsur mikro tinggi memiliki populasi fungi yang banyak (6.87 x 104). Rendahnya kadar unsur mikro pohon G6 berkorelasi dengan sedikitnya populasi fungi (0.02 x 104) pada pohon tersebut. Kadar hara tanaman tidak begitu berpengaruh pada populasi bakteri. Rendahnya kadar unsur makro dan mikro pohon G3 berkorelasi dengan sedikitnya populasi bakteri (0.30 x 107) pada pohon tersebut. Pohon G6 yang memiliki populasi bakteri paling banyak (13.53 x 107) memiliki kadar unsur mikro rendah, dan unsur makro tidak terlalu tinggi.
Mikrob pada tanaman mendapatkan sumber nutrisi dari throughfall dan
stemflow. Throughfall adalah bagian curah hujan yang lolos mencapai tanah melalui sela-sela kanopi ataupun sebagai jatuhan setelah tersangkut di kanopi.
Stemflow adalah bagian curah hujan yang mencapai tanah dengan mengalir pada batang. Hal ini sesuai dengan hasil penelitian Schort et al. (2001) yang menunjukkan bahwa throughfall dan stemflow umumnya mengandung beberapa hara potensial (N, P, K, Ca, Mg). Hara tersebut merupakan unsur yang dibutuhkan untuk pertumbuhan mikrob. Sridhar (2009) menambahkan, throughfall dan
stemflow ini menguntungkan bagi mikrob karena mereka bisa mendapatkan nutrisi dari bahan yang tersedia (daun, kulit kayu, ranting, dan sampah kering).
dikarenakan nitrogen (N) dibutuhkan untuk memproduksi fitoaleksin dan unsur mangan (Mn) dalam tanaman berfungsi mengaktifasi senyawa aromatik.
Fitoaleksin adalah zat toksin yang dihasilkan oleh tanaman dalam jumlah yang cukup hanya setelah dirangsang oleh berbagai mikrob patogenik atau oleh kerusakan mekanis dan kimia (Agrios,1997). Gangguan mekanis pada G1 berupa gigitan tupai dan pemangkasan dahan bagian pucuk lebih banyak dibanding pohon lain (Lampiran 2). Pada pohon G1 juga ditemukan fungi selulolitik dan pektinolitik terbanyak (Tabel 3). Keadaan ini merangsang pohon memproduksi fitoaleksin lebih banyak dari lima pohon lainnya sebagai mekanisme pertahanan diri berupa senyawa sesquiterpenoid yang beraroma harum.
4.4 Hasil Uji Lapang
Uji lapang isolat terpilih dilaksanakan di Rantau Rasau, Kabupaten Tanjung Jabung Timur, Provinsi Jambi. Inokulasi dilakukan pada bulan Mei 2012 dan pengamatan dilakukan pada bulan Oktober 2012. Hasil uji lapang berupa jarak vertikal dan horizontal jaringan batang yang berwarna kecoklatan di sekitar lubang bor ditampilkan pada gambar di bawah ini.
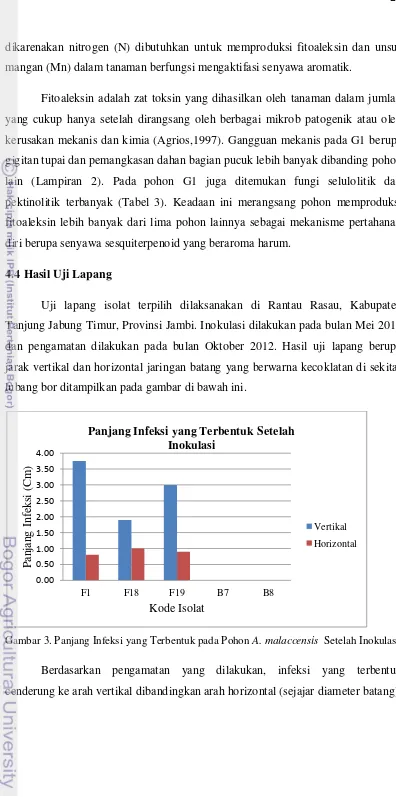
Gambar 3. Panjang Infeksi yang Terbentuk pada Pohon A. malaccensis Setelah Inokulasi
Berdasarkan pengamatan yang dilakukan, infeksi yang terbentuk cenderung ke arah vertikal dibandingkan arah horizontal (sejajar diameter batang).
Jarak terpanjang (vertikal ) dibentuk oleh isolat F1, sepanjang 3.75 cm, sedangkan jarak terpendek dibentuk oleh isolat F18, 1.9 cm. Isolat F 18 mampu membentuk jarak terlebar (horizontal), sebesar 1 cm, sedangkan isolat F1 membentuk jarak tersempit, sebesar 0.8 cm.
V. KESIMPULAN DAN SARAN
5.1 KesimpulanMikrob dan kandungan hara pada A. malaccensis berpengaruh terhadap pembentukan gaharu. Hasil uji lapang menunjukkan, fungi lebih efektif dalam menginfeksi pohon A. malaccensis dibandingkan bakteri.
5.2 Saran
VI. DAFTAR PUSTAKA
Abbott, DW. & Boraston, AB. 2008. Structural Biology of Pectin Degradation by Enterobacteriaceae: USA. American Society for Microbiology.
Agrios, GN. 1997. Plant Pathology4th ed. Toronto: Academic Press. Agrios, GN. 2005. Plant Pathology. USA: Elseiver Academic Press.
Alexander, M. 1977. Soil MicrobiologySecond Edition: New York. John Wiley & Sons, Inc.
Barker, AV. & Bryson, GM. 2007. Nitrogen. In Barker AV. & Pilbeam DJ. (Eds).
Handbook of Plant Nutrition. USA: Taylor & Francis Group.
Blanchette, RA. & Beek, HH. 2005. Cultivated Agarwood. http://www.freepatentsonline.com/20050008657.html. (25 mei 2011).
Brady, NC. & Weil, RR. 2002. The Nature and Properties of Soils: New Jersey, USA. Pearson Education, Inc.
CITES. (2004). Significant Trade in Plants. Implementation of Resolution Conf. 12.8. Progress with the implementation of species review (PC 14 Doc. 9.2.2). http://www.cites.org/eng/com/pc/14/E-Minutes-PC14.pdf . (03 Juni 2012). Gandjar, I., Samson, RA., Tweel-Vermeulen, KVD., Oetari, A., & Santoso, I.
2000. Pengenalan Kapang Tropik Umum. Jakarta: Yayasan Obor Indonesia. Iriansyah, M., Rayan, Ngatiman, Yuliansyah, Suryanto, & Praba, SB. 2007.
Gaharu Komoditi Masa Depan yang Menjanjikan.
Isnaini, Y. 2008. Peran Pelukaan Alami dalam Pembentukan Gubal Gaharu: Studi Kasus pada Aquilaria malaccensis Koleksi Kebun Raya Bogor. Dalam M. Litay, Fachrudin, E. Soekendarsi, & A. Zulkifli (Eds). Prosiding seminar biologi ke-XIV. Universitas Hasanudin, 9-10 Juli 2008. Hal 264-267.
Jones, JB., Wolf, JB., & Mills, HA. 1991. Plant Analysis Handbook. USA: Micro-Macro Publishing, Inc.
Kopsell, DE. & Kopsell, DA. 2007. Copper. In Barker, AV. & Pilbeam, DJ. (Eds).
Handbook of Plant Nutrition. USA: Taylor & Francis Group.
Lynd, LR., Weiner, PJ., Zyl, WH., & Pretorius, Isak S. 2002. Microbial Cellulose Utilizations: Fundamentals and Biotechnology. USA: American Society for Microbiology.
Madigan, MT., & Martinko, JM. 2005. Brock Biology of Microorganisms, 11 th ed. Englewood Cliffs, N. J: Prentice Hall.
Merhaut, DJ. 2007. Magnesium. In Barker, AV. & Pilbeam, DJ. (Eds).
Handbook of Plant Nutrition. USA: Taylor & Francis Group.
Pilbeam, DJ. & Morley, PS. 2007. Calcium. In Barker, AV. & Pilbeam, DJ. (Eds).
Handbook of Plant Nutrition. USA: Taylor & Francis Group.
Pojanagoro, S. & Kaewrak, C. 2005. Mechanical methods to stimulate aloes wood formation in Aquilaria crassna Pierre Ex h.Lec. (kritsana) trees. Acta Hort. (IHSH) 676:161-166. Http://www.actahort.org/books/676/676 20.htm. (25 mei 2011).
Rahman, M. & Punja, ZK. 2007. Calcium and Plant Disease. In Datnoff, LE., Elmer, WH., & Huber, DM. (Eds). Mineral Nutrition and Plant Disease.
USA: The American Phytopatological Society.
Sanchez, CA. 2007. Phosphorus. In Barker, AV. & Pilbeam, DJ. (Eds).
Handbook of Plant Nutrition. USA: Taylor & Francis Group.
Santoso, E., Agustini L., Turjaman M.,. Sumarna Y, dan Irianto RSB., 2006. Biodiversitas dan Karakterisasi Jamur Potensial Penginduksi Resin Gaharu. Temu Pakar Gaharu, PHKA-ASGARIN. Surabaya.
Santoso, E., Agustini, L., Sitepu, IR., & Turjaman, M. 2007. Efektifitas Pembentukan Gaharu dan Komposisi Senyawa Resin Gaharu pada Aquilaria
spp. Jurnal Penelitian Hutan dan Konservasi Alam 06, 543 – 551.
Schrot, G., Elias, MEA., Uguen, K., Sexias, R., & Zech, W. 2001. Nutrient fluxes in rainfall, throughfall and stemflow in tree-based land use systems and spontaneous tree vegetation of central Amazonia. Agriculture, Ecosytems and Environment 87, 37 – 49.
Sridhar, KR. 2009. Fungi in The Canopy: an Appraisal. In Rai, M. & Bridge, PD. (Eds). Applied Mycology. London: CAB International.
Sumarna, Y. 2002. Budidaya Gaharu. Seri Agribisnis. Jakarta: Penebar Swadaya. Sumarna, Y. 2008. Beberapa Aspek Ekologi, Populasi Pohon, dan Permudaan
Alam Tumbuhan Penghasil Gaharu Kelompok Karas (Aquilaria spp.) di Wilayah Provinsi Jambi. Bogor: Puslitbang Hutan dan Konservasi Alam.
Suwardi, ES. & Edriana, E. 2005. Gaharu dan Prospek Peningkatan Nilai Tambah Melalui Penyulingan Tepat Guna. Dalam Y. Isnaini & D. Rahmawati (Eds).
Prosiding Peluang dan Tantangan Pengembangan Gaharu di Indonesia; Bogor, 1-2 Desember 2005. Hlm: 189-218.
Sutejo, MM. 2002. Pupuk dan Cara Pemupukan. Jakarta: Rineka Cipta.
Thompson, IA. & Huber, DM. 2007. Manganese and Plant Disease. In Datnoff, LE., Elmer, WH., & Huber, DM. (Eds). Mineral Nutrition and Plant Disease.
VII. LAMPIRAN
a. Lokasi Pengambilan Sampel di Desa Pulo Aro
b. Pohon G1 c. Pohon G2
d. Pohon G3 e. Fungi yang Menempel pada Dahan Lanjutan Gambar Lampiran 1
a. Gigitan Tupai pada Pohon G1
Gambar Lampiran 2. kondisi Pohon G1 dan Gaharu yang Terbentuk
c. Gaharu yang Terbentuk dari Gigitan tupai Lanjutan Gambar Lampiran 2
Gambar Lampiran 3. Gaharu Hasil Inokulasi
Gambar Lampiran 5. Pembentukan Zona Bening oleh Bakteri
Tabel Lampiran 1. Komposisi Media CMC (per liter) 1. KH2PO4 1 gram
2. K2SO4 0.5 gram 3. NaCl 0.5 gram 4. FeSO4 0.01 gram 5. MnSO4 0.01 gram 6. NH4NO3 1 gram 7. CMC 10 gram 8. Agar 15 gram
Tabel Lampiran 2. Komposisi Media Citric Pectin 0.5% (per liter) 1. NaNo3 6 gram
Tabel Lampiran 3. Komposisi Media Pectinolytic Bacteria (per liter) 1. Citrus pectin 1 %
2. (NH4)2SO4 67 % 3. K2HPO4 0.2 % 4. MgSO4. 7H2O 0.02 % 5. Agar 1.5 %
6. Nutrient solution 0.1 % yang terdiri dari: a. FeSO4. 7H2O 5 mg
b. MnSO4. 7H2 O 1.6 mg c. ZnSO4. 7H2O 1.4 mg d. COCl2 2.0 mg
Tabel Lampiran 4. Deskripsi Isolat (Bakteri) Terpilih
Kode Isolat Gambar Deskripsi
B7
Koloni berwarna putih, berbentuk bundar dengan tepian berlekuk dan elevasi seperti tombol.
B8
Tabel Lampiran 5. Deskripsi Isolat (Fungi) Terpilih
Kode Isolat Tampak Atas Tampak Bawah Deskripsi
F1
Bagian atas fungi berwarna pink, bagian bawah berwarna putih kecoklatan. Miselium tumbuh ke samping dengan tekstur hairy.
F18
Bagian atas fungi berwarna hijau, bagian bawah berwarna cokelat tua. Miselium tumbuh ke samping dengan tekstur
hairy.
I. PENDAHULUAN
1.1 Latar BelakangGaharu merupakan salah satu komoditas hasil hutan bukan kayu (HHBK) yang sudah mendunia. Harga jual dari gaharu paling tinggi dibandingkan HHBK lain, seperti rotan, sutera, bambu, nyamplung, ataupun madu. Gaharu digunakan sebagai bahan dasar industri parfum, dupa, kosmetik, dan obat-obatan (Sumarna, 2002). Gaharu yang mempunyai aroma khas bahkan diekspor ke Arab Saudi khusus untuk pengharum ka’bah di Mekah.
Indonesia memiliki potensi sumberdaya pohon penghasil gaharu yang tinggi. Hal ini dikarenakan terdapat enam genus pohon penghasil gaharu yang tersebar di Indonesia. Adapun daerah penyebaran gaharu di Indonesia adalah: Kalimantan, Sulawesi, Sumatera, Ambon, Jawa, Nusa Tenggara Barat, dan Nusa Tenggara Timur. Gaharu yang terdapat di Indonesia berasal dari genus Aquilaria, Gonystylus, Gyrinops, Einkleia, Aetoxylon, dan Wiekstroemia. Pohon yang paling banyak dicari oleh para pemburu gaharu adalah dari genus Aquilaria dan
Gyrinops karena kualitas dan harga jualnya yang lebih tinggi.
Sampai saat ini, mekanisme dan proses pembentukan gaharu belum diketahui dengan pasti. Santoso et al. (2006) melaporkan bahwa proses dan mekanisme terbentuknya gaharu pada pohon penghasil gaharu disebabkan karena pohon terinfeksi fungi pada bagian batang yang terluka. Atas dasar asumsi tersebut dimungkinkan penyakit secara biologis dapat dikembangkan sebagai inokulan dan terlukanya batang dapat direkayasa dengan pengeboran dan proses infeksi penyakit.
1.2 Tujuan
Penelitian ini dilakukan untuk mengetahui ada tidaknya pengaruh mikrob dan status hara pada A. malaccensis serta hubungannya dengan pembentukan gaharu.
1.3 Hipotesis
1. Mikrob yang mampu mendegradasi selulosa dan pektin mampu merangsang pembentukan gaharu.
II. TINJAUAN PUSTAKA
2.1Botani Pohon Penghasil Gaharu (A. malaccensis)
Tanaman Aquilaria spp. memiliki ciri sebagai berikut: batang tanaman dapat mencapai tinggi 35-40 m, diameter sekitar 60 cm, dan berkayu keras. Kulit batangnya licin berwarna putih atau keputih-putihan. Daun lonjong memanjang dengan panjang 5-8 cm, lebar 3-4 cm, berujung runcing dan berwarna mengkilat. Bunga berada di ujung ranting, atau ketiak atas dan bawah daun. Buah berada dalam polong berbentuk bulat telur atau lonjong, berukuran panjang sekitar 5 cm, dan lebar 3 cm. Biji bulat atau bulat telur yang ditutupi bulu-bulu halus yang berwarna kemerahan (Iriansyah et al., 2007).
Berikut ini adalah taksonomi A. malaccensis berdasar CITES (2004) : Kingdom : Plantae
Divisi : Termathophyta Sub Divisi : Angiospermae Klas : Magnoliopsida
Gaharu merupakan endapan resin yang terakumulasi pada jaringan kayu sebagai reaksi pohon terhadap pelukaan atau infeksi patogen. Gaharu terbentuk sebagai reaksi pertahanan terhadap infeksi patogen melalui pelukaan pada batang, cabang, atau ranting, atau pengaruh fisik lain. Infeksi patogen menyebabkan keluarnya resin yang terdeposit pada jaringan kayu, lama-kelamaan jaringan kayu mengeras dan menjadi cokelat (Santoso et al., 2007).
pertama, gaharu diduga terbentuk sebagai respon pohon penghasil gaharu terhadap infeksi cendawan yang menghasilkan keluarnya “resin”. Pada hipotesis kedua, beberapa peneliti menduga bahwa pelukaan memegang peran utama dalam pembentukan gaharu diikuti oleh infeksi cendawan sebagai faktor pendukung. Sedangkan pada hipotesis ketiga (hipotesis non patologi) diyakini bahwa pembentukan gaharu adalah sebagai respon pertahanan pohon terhadap pelukaan saja.
Hasil penelitian Pojanagoro & Kaewrak (2005) menyatakan bahwa pelukaan secara mekanik dapat menginduksi pembentukan gaharu pada pohon A. crassna. Hal ini didukung oleh hasil penelitian Blanchette & Beek (2005) yang menyatakan jenis pelukaan merupakan salah satu faktor yang menentukan induksi pembentukan gubal gaharu. Pelukaan dengan menggunakan kampak yang membuat luka di permukaan batang saja ternyata tidak mampu memacu pembentukan gubal gaharu. Pelukaan yang diperlukan untuk menginduksi pembentukann gubal gaharu bisa dibuat dengan menggunakan alat bor sampai ke bagian xilem dan luka tersebut dibiarkan terbuka supaya ada aerasi untuk menghalangi penyembuhan.
Menurut Suwardi & Edriana (2005) selama proses pembentukan gaharu akan terjadi perubahan beberapa sifat secara bertahap yaitu: a). warna dari putih menjadi coklat, kehitaman dan akhirnya hitam kehijauan; b). Serat kayu diganti resin sehingga pada akhir proses serat kayu tidak nampak lagi; c). Berat jenis makin berat hingga bisa tenggelam dalam air. Suwardi & Edriana (2005) juga menyatakan daya tumbuh pohon akan berkurang disebabkan bagian kayu menjadi diisi resin sehingga pohon menjadi mati. Terbentuknya gaharu selain pada batang juga dapat terjadi pada dahan dan akar.
2.3 Bakteri
mengandung senyawa karbon, hidrogen, nitrogen, oksigen, fosfor, serta sulfur atau unsur anorganik seperti K, Mg, Ca, Fe, Co, Zn, Cu, Mn dan Ni. Keseluruhan unsur ini dibutuhkan oleh bakteri heterotrof sebagai sumber nutrisi (Madigan & Martinko, 2005).
Madigan et al. (2009) menambahkan, banyak mikrob, termasuk bakteri merupakan patogen tanaman. Mereka dapat merusak dengan berbagai cara. Beberapa bakteri menimbulkan dampak fisik sehingga menurunkan kualitas dan harga jual. Bakteri lain, menyebabkan masalah pertumbuhan, sehingga berpengaruh terhadap penurunan biomasa, biji, buah, dan komponen lain. Spesies tertentu seperti: Pseudomonas, Xanthomonas, Xylella, dan Erwinia adalah beberapa contoh bakteri patogen.
2.4 Fungi
Gandjar et al. (2000) mendefinisikan fungi sebagai jasad yang bersifat heterotrof, dinding sel spora mengandung kitin, tidak berplasmid, tidak berfotosintesis, tidak bersifat fagotrof, umumnya memiliki hifa yang berdinding yang dapat berinti banyak (multinukleat) atau berinti tunggal (mononukleat), dan memperoleh hara dengan cara absorbsi.
Madigan et al. (2009) menjelaskan bahwa habitat fungi cukup beragam, baik di air maupun di darat. Beberapa fungi termasuk golongan akuatik, mayoritas hidup di air tawar dan beberapa di daerah marin. Fungi yang hidup di darat banyak ditemukan di tanah atau tanaman yang sudah mati dan memainkan peran penting dalam mineralisasi karbon organik.
Madigan et al. (2009) menambahkan, kebanyakan fungi adalah parasit bagi tanaman. Sebagian besar fungi yang menjadi patogen adalah Phytopthora
2.5 Hara tanaman
Pertumbuhan tanaman sangat dipengaruhi oleh kandungan hara, terutama hara esensial. Penyakit pada tanaman sering disebabkan karena tanaman kekurangan hara esensial. Unsur hara ini mempunyai peran tersendiri misalnya: 2.5.1 Unsur Nitrogen (N)
Menurut Barker & Bryson (2007) nitrogen dapat berada dalam berbagai senyawa yang bisa digunakan untuk metabolisme tanaman. Umumnya, lebih dari 75 % nitrogen di dalam daun terkandung dalam kloroplas. Kekurangan nitrogen akan menghambat pertumbuhan tanaman karena akan menurunkan protein dalam kloroplas. Nitrogen merupakan unsur yang mobil, jika terjadi defisiensi unsur ini akan ditransfer ke jaringan yang lebih muda. Karena itulah, gejala defisiensi nitrogen terlihat pertama kali pada tanaman bagian bawah.
2.5.2 Unsur Fosfor (P)
Sanchez (2007) menyatakan fosfor digunakan dalam bentuk teroksidasi dan terhidrasi sepenuhnya sebagai orthofosfat. Tanaman biasanya menyerap fosfor dalam bentuk H2PO4- dan HPO42-, tergantung pada pH. Fosfor digunakan untuk pembentukan sel, pembentukan albumen, perkembangan akar, metabolisme karbohidrat, dan transfer energi. Brady & Weil (2002) menambahkan fosfor merupakan komponen esensial dari senyawa organik adenosin trifosfat (ATP) yang terbentuk melalui proses fotosintesis. Fosfor juga merupakan komponen esensial dari DNA dan RNA, yang secara langsung menyusun protein pada tumbuhan dan hewan. Defisiensi P mengakibatkan pertumbuhan terhambat (kerdil) karena pembelahan sel terganggu dan daun menjadi ungu atau coklat mulai dari ujung daun.
2.5.3 Unsur Kalium (K)
perakaran. Kekurangan kalium akan mengakibatkan tunas dan akar tidak berkembang.
2.5.4 Unsur Kalsium (Ca)
Kalsium merupakan elemen kunci dalam dinding sel. Sekitar 60% Ca berasosiasi dengan dinding sel. Dalam tanaman, kalsium berada dalam bentuk Ca2+ melekat pada dinding sel melalui pertukaran kation. Fungsi utama Ca pada tanaman sebagai penjaga kestabilan dan keutuhan sel. Hal ini dikarenakan kehadiran Ca berfungsi menguatkan dinding sel primer. Selain itu, Ca menghambat degradasi pektat dalam dinding sel dengan menghambat pembentukan poligalakturonase (Rahman & Punja, 2007; Pilbeam & Morley, 2007).
2.5.5 Unsur Magnesium (Mg)
Berdasarkan Merhaut (2007) magnesium memiliki peran besar dalam fisiologis dan molekul tanaman, seperti menjadi komponen klorofil, kofaktor untuk proses enzimatik yang terkait dengan fosforilasi, defosforilasi, dan hidrolisis berbagai senyawa, dan sebagai penstabil struktural berbagai nukleotida. Unsur ini merupakan unsur penyusun klorofil daun; magnesium juga terlibat dalam pembentukan gula; translokasi karbohidrat; mengatur serapan hara lain; sebagai carier fosfat dalam tanaman; dan aktivator enzim transfosfoliase, dehidrogenase, dan karboksilase. Karena magnesium merupakan komponen integral dari klorofil dan proses enzimatik yang berhubungan dengan fotosintesis dan respirasi. Asimilasi karbon dan transformasi energi akan terpengaruh oleh kekurangan magnesium. Karena itulah kekurangan magnesium dapat menghambat pertumbuhan, khususnya akar dan tunas. Tingkat penghambatan dipengaruhi oleh: keparahan kekurangan magnesium, jenis tanaman, kondisi lingkungan, dan status nutrisi umum dari tanaman.
2.5.6 Unsur Besi (Fe)
protein ferredoxin dan dibutuhkan untuk reduksi nitrat dan sulfat, asimilasi N2, dan energi (NADP). Unsur ini juga berfungsi sebagai katalisator formasi enzim dan klorofil (Jones et al., 1991).
2.5.7 Unsur Tembaga (Cu)
Tembaga diidentifikasi sebagai nutrisi tanaman sekitar tahun 1930. Penyerapan Cu oleh tanaman dipengaruhi oleh faktor seperti: pH tanah dan konsentrasi Cu di tanah. Konsentrasi Cu tertinggi dalam tanaman ada pada jaringan akar, hal itu mengakibatkan gejala kelebihan sering terlihat pada akar. Kekurangan Cu ditunjukkan dengan gejala: roseting, klorosis, daun muda menggulung, dan tanaman menjadi kerdil (Kopsell & Kopsell, 2007).
2.5.8 Unsur Seng (Zn)
Seng merupakan unsur hara mikro yang merupakan penyusun protein kloroplas, plastocyanin yang merupakan bagian dari sistem transport elektron yang menghubungkan fotosistem I dan II. Unsur ini juga berpartisipasi dalam metabolisme protein dan karbohidrat, serta fiksasi N2. Seng juga merupakan bagian dari enzim: cytocrome oksidase, asam ascorbic oksidase, dan phylophenol oksidase. Defisiensi seng menyebabkan tanaman kerdil dan nekrokis pada daun muda dan meristem apikal (Jones et al., 1991).
2.5.9 Unsur Mangan (Mn)
Mangan (Mn) merupakan salah satu unsur hara yang ketersediaannya berlimpah di alam dengan rata–rata konsentrasi 650 ppm (Glikes et al., 1988
dalam Thompson & Huber, 2007). Burnel, (1988, Römheld & Marshcen, (1991)
dalam Thompson & Huber, 2007) menyebutkan bahwa fungsi utama Mn adalah sebagai aktivator enzim: dehidrogenase, transferase, hidroksilase, dan dehidroksilase.
kelarutan N, kelarutan karbohidrat, sistem hormonal, dan sistesis bahan sekunder seperti: fenol, lignin, klorofil, dan lain-lain.
Gejala kelebihan Mn yang dijelaskan oleh Assche et al. (1977 dalam
Thompson & Huber, 2007) adalah terbentuknya bintik berwarna gelap atau bercak pada daun. Horst (1988 dalam Thompson & Huber, 2007) menambahkan, tingginya konsentrasi Mn pada tanaman juga menyebabkan munculnya gejala kekurangan unsur lain seperti Fe, Cu, dan Ca.
2.6 Selulosa
Selulosa adalah polisakarida yang terdiri dari rantai glukosa (1-4) ß-D glukan yang dihubungkan oleh ikatan hidrogen. Polisakarida ini merupakan komponen paling melimpah dari biomasa. Selulosa banyak ditemukan terutama pada dinding sel dengan konsentrasi sebesar 35% sampai 50 % dari berat kering tanaman (Lynd et al., 2002).
2.7 Pektin
III. BAHAN DAN METODE
3.1 Waktu dan Tempat
Penelitian dilaksanakan dari bulan Oktober 2011 sampai Oktober 2012. Sampel gubal dan daun gaharu diambil di Desa Pulo Aro, Kecamatan Tabir Ulu, Kabupaten Merangin, Provinsi Jambi. Analisis biologi dan kimia dilakukan di Laboratorium Bioteknologi Tanah serta Laboratorium Kimia dan Kesuburan Tanah, Departemen Ilmu Tanah dan Sumberdaya Lahan, Institut Pertanian Bogor. Untuk uji lapang, dilaksanakan di Rantau Rasau, Kabupaten Tanjung Jabung Timur, Provinsi Jambi.
3.2 Alat dan Bahan
Alat yang digunakan dalam penelitian di antaranya: autoclaf, laminar air flow, cawan petri, labu erlenmayer, pipet, tabung reaksi, jarum ose, bunsen, timbangan digital, tisu, alat tulis, AAS, dan Spectrofotometer UV-VIS.
Bahan yang digunakan dalam penelitian ini adalah sampel daun dari A. malaccensis yang akan digunakan untuk menentukan status hara tanaman dan sampel gaharu yang diambil dariPulo Aro, Kabupaten Merangin, Provinsi Jambi.
diisolasi. Hal ini dilakukan agar mikrob yang akan diteliti berada pada kondisi dorman sehingga tidak mendapat gangguan dengan perubahan lingkungan di sekitarnya.
1.2 Pengambilan Sampel Daun
Pengambilan sampel daun dilakukan untuk mengetahui status hara pada tanaman. Contoh daun diambil dari tiga tingkat tajuk (tajuk bagian bawah, tengah, dan atas) yang menghadap barat dan timur. Pengambilan sampel daun dilakukan hanya pada tajuk yang menghadap barat dan timur dikarenakan area ini mendapatkan penyinaran yang intensif, sehingga bisa berfotosintesis dengan maksimal. Sampel daun yang diambil dari setiap lokasi dimasukkan ke dalam amplop kertas. Amplop kertas digunakan karena kertas ini bisa menyerap air, sehingga daun tidak busuk sebelum dianalisis.
2. Analisis Kimia
Analisis kimia yang dilakukan berupa analisis hara tanaman melalui daun. Analisis hara dilakukan karena kandungan hara dalam tanaman dapat mempengaruhi kesehatan dan daya tahan tanaman terhadap infeksi mikrob. Adapun hara tanaman yang dianalisis adalah: N, P, K, Ca, Mg, Mn, Cu, Zn, dan Fe. Analisis kandungan Nitrogen pada jaringan daun dilakukan dengan menggunakan metode semi mikro Kjeldal, sedangkan delapan unsur hara yang lain dianalisis menggunakan metode pengabuan basah.
Hasil destruksi daun akan digunakan untuk menentukan status hara tanaman. kandungan fosfor (P) diukur dengan Spectrofotometer UV-VIS pada panjang gelombang 660 nm, kandungan Ca, Mg, Mn, Cu, Zn, dan Fe diukur dengan AAS, sedangkan kandungan kalium (K) diukur dengan Flamefotometer. 3. Analisis Biologi
Analisis biologi dilakukan untuk mengetahui ada tidaknya peran mikrob dan efektivitasnya terhadap pembentukan gaharu pada A. malaccensis.
Tahapan dari analisis biologi adalah: 3.1 Isolasi Mikrob
Mikrob yang diisolasi dari pohon A. malaccensis adalah fungi dan bakteri. Isolasi dilakukan di laboratorium Bioteknologi Tanah Institut Pertanian Bogor. Isolasi dilakukan dengan menggunakan media PDA untuk isolasi fungi dan TSA 5% untuk isolasi bakteri.
Isolasi fungi dan bakteri dilakukan dengan metode agar tuang. Langkah awal metode dilakukan dengan menimbang 10 gram sampel, memasukkan sampel ke dalam erlenmeyer berisi 90 ml larutan fisiologis. Sampel yang sudah direndam kemudian dikocok dengan kecepatan 150 rpm. Suspensi yang telah dikocok diambil 1 ml menggunakan pipet dan dimasukkan ke dalam tabung reaksi yang berisi 9 ml larutan fisiologis, sehingga didapat suspensi dengan seri pengenceran 10-2. Langkah yang sama dilakukan untuk membuat seri pengenceran 10-3, 10-4, 10-5, 10-6, 10-7, 10-8, dan 10-9. Dari setiap seri pengenceran diambil 1 ml suspensi dan ditumbuhkan pada medium. Isolasi fungi dilakukan pada pengenceran 10-2 sampai 10-5, sedangkan bakteri di isolasi dari pengenceran 10-7 sampai 10-9. 3.2 Pemurnian
dengan metode gores, sedangkan pada fungi dilakukan dengan metode titik. Hal ini dilakukan karena miselium fungi akan hancur jika sama-sama menggunakan metode gores.
3.3 Uji Fisiologis
Mikrob yang sudah murni dilakukan pengujian fisiologis berupa uji pelarutan selulosa dan pektin. Hal ini dilakukan untuk mengetahui efektivitas mikrob dalam melarutkan selulosa dan pektin. Untuk uji selulosa digunakan media CMC, sementara pengujian pektin menggunakan media Citric pectin 0.5% untuk fungi dan Pectinolytic Bacteri untuk bakteri.
Pada dasarnya uji pelarutan selulosa dan pektin sama, hanya medianya saja yang membedakan. Uji pelarutan selulosa dan pektin dilakukan dengan menumbuhkan mikrob pada media selektif dan diinkubasi selama 3 hari pada suhu ruangan. Mikrob yang telah diinkubasi dilakukan pewarnaan dengan menggunakan Congo red untuk uji pelarutan selulosa dan Kalium iodine untuk pelarutan pektin. Pembentukan zona bening di sekitar biakan merupakan indikasi bahwa mikrob tersebut bisa melarutkan selulosa dan pektin. Indeks selulolitik dan pektinolitik dihitung dengan rumus:
3.4 Seleksi Isolat
4. Pengujian Lapang
Pengujian lapang dilakukan untuk mengetahui efektivitas mikrob yang telah diisolasi dalam menghasilkan gaharu pada A. malaccensis.
Pengujian lapang dilakukan dengan tiga tahapan, yaitu: 1. Pembuatan inokulan
Isolat yang terseleksi dibuat inokulan cair dengan cara menumbuhkan isolat tersebut pada media Nutrient Broth.
2. Inokulasi
Inokulan yang telah dibuat diinokulasikan pada pohon A. malaccensis di Rantau Rasau, Kabupaten Tanjung Jabung Timur, Provinsi Jambi. Inokulasi dilakukan dengan cara menginjeksikan inokulan pada pohon yang telah dibor. Pengeboran dilakukan dengan posisi miring ke bawah dengan pola berbentuk spiral mengelilingi batang.
Gambar 1. Pola Spiral Inokulasi Pohon Gaharu*
Dalam satu pohon terdapat lima lubang injeksi. Setiap isolat diberikan ulangan sebanyak tiga pohon, jadi total setiap isolat terdapat 15 titik pengamatan. Setiap lubang di injeksi inokulan sebanyak 1 – 2 ml, kemudian ditutup dengan kapas.
3. Pengamatan hasil inokulasi
Gambar 2. Bagan Alir Metodologi Penelitian Pengambilan sampel gaharu dan
daun
Analisis kimia:
analisis kandungan hara tanaman
Analisis Biologi:
Isolasi bakteri dan fungi
Uji pelarutan Selulosa dan Pektin
Seleksi mikrob berdasarkan indeks pelarutan
Pembuatan inokulan cair dari isolat terpilih
Inokulasi isolat terpilih