PRODUKSI SIRUP FkUKTOSA DARl IMULlN UMBl DAHLIA
DALAM REAKTOR
SINAMBUNG
UrJGGUN TERKEMAS
MENGGUNAKAN ENZlM INULINASE IMOBll
Oieh
SUJATMONO TONI SULISTYO
F 24. 0130
1 9 9 2
FAKULTAS TEKNOLOGI PERTANIAN INSTITUT PERTANIAN BOGOR
Sujatmono Toni Sulistyo. F 24.0130. Produksi Sirup Fruk- tosa dari Inulin Umbi Dahlia dalam Reaktor Sinambung Ung-
gun Terkemas Menggunakan Enzim Inulinase Imobil. Di bawah bimbingan Djumali Mangunwidjaja dan Darnoko.
RINGKASAN
Sirup fruktosa merupakan alternatif bahan pemanis lain yang kebutuhannya semakin lama semakin meningkat. Selain dari pati, sirup ini dapat juga diproduksi dari inulin yang berasal dari umbi dahlia (Dahlia p i n n a t a Cav.) yang relatif mudah dibudidayakan di Indonesia. Gula cair dari inulin ini mempunyai banyak kelebihan dibandingkan gula cair dari pati, diantaranya rendemennya tinggi (sam- pai 97 persen) dan prosesnya singkat (hanya 1 tahap). Secara skematis, reaksi hidrolisis inulin menjadi fruktosa dapat dituliskan :
(C6H1005) m f mH20
.
mC6H1206inulin f ruktosa
Produksi sirup fruktosa dengan reaktor sinambunq menggunakan enzim inulinase imobil, mempunyai tingkat pro- duktivitas, stabilitas dan efisiensi yang lebih tinggi di-
bandingkan reaktor curah.
menggunakan enzim inulinase imobil, mempelajari produkti-
vitas reaktor sinambung unggun terkemas serta mempelajari tingkat stabilitas operasi enzim inulinase imobil.
Dari penelitian pendahuluan didapatkan selang laju dilusi 0.04/jam, 0.05/jam, O.lO/jam dan 0.20/jam yang setara dengan waktu tinggal dalam reaktor selama 25 jam, 20 jam, 10 jam dan 5 jam, sedangkan konsentrasi enzim yang digunakan adalah 2 persen dan 4 persen substrat (v/w).
Perolehan sirup fruktosa, derajat konversi (X) dan produktivitas reaktor tertinggi dicapai pada laju dilusi O.ZO/jam dengan konsentrasi enzim 4 persen substrat (v/w)
yaitu masing-masing sebesar 102.287 mg.ml-l, 77.84 persen dan 0.34 1 mg
.ml-l .
menit-'. Produktivitas penggunaan enzim pada reaktor sinambung ungun terkemas tertinggi dicapai pada laju dilusi 0.04/jam dengan konsentrasi enzim 2 per- sen substrat (v/w), yaitu seb,esar 12.417 g fruktosa kumu- latif/mg enzim, yang setara dengan 6.0 kali produktivitas penggunaan enzim pada reaktor curah. Rendemen imobilisasi tertinggi dicapai pada laju dilusi 0.20/jam dengan konsen- trasi enzim 2 persen substrat (v/w) yaitu sebesar 14.54 persen.PRODUKSI SIRUP FRUKTOSA DARI INULIN UMBI DAHL.I.4
DALAM REAKTOR SINAMBUNG UNGGUN TERKEMAS MENGGUNAKAN ENZIM LNULINASE IMOBlL
Oleh
SUJATMONO TOM SULISTYO F 24.0130
SKRIPSI
Sehagai salali satu syarat untuk memperoleh gelar
SARJANA TEKNOLOGI PERTANIAN
Pada Jurusan Teknologi Industri Pertanian
Fakultas Teknologi Pertanian
Institut Pertanian Bogor
1 9 9 2
FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR
INSTITUT PERTANIAN BOGOR
FAKULTAS TEKNOLOGI PERTANIAN
PPIIODUKSI SIRUP FRUKTOSA DARI LWmIN UMBI DAHLIA
DALAM REAKTOR SINAMBUNG UNGGUN TERKEMAS
MENGGUNAKAN ENZIM IlWLINASE IMOBIL
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar
SARJANA TEKNOLOGI PERTANIAN
Pada Jurusan Teknologi Industri Pertanian
Fakultas Teknologi Pertanian
Institut Pertanian Bogor
Oleh
SUJATMONO TONI SULISTYO
F 24.0130
Dilahirkan pada tanggal 5 Nopelnber 1968
di Metro
KATA PENGANTAR
Puji syukur penulis panjatkan ke hadirat Allah SWT, karena hanya berkat rahmat dan hidayah-Nyalah penulis da- pat menyelesaikan skripsi ini tepat pada waktunya.
Dalam kesempatan ini, penulis mengucapkan terima ka- sih kepada :
1. Dr.Ir. Djumali Mangunwidjaja, DEA sebagai dosen pem- bimbing I dan Ir. Darnoko, MSc. sebagai pembimbing I1 yang telah memberi bimbingan dan pengarahan, hingga selesainya skripsi ini.
2. Ir. M. Zein Nasution, MApp.Sc. selaku dosen penguji yang banyak memberi masukan untuk perbaikan skripsi
ini.
3. Seluruh ~ivitas akademika yang telah membantu baik secara langsung maupun tidak langsung.
4. Keluarga di rumah yang banyak memberi bantudn moril dan materiil selama masa kuliah sampai selesainya skripsi
ini.
Tak ada gading yang tak retak, walaupun penulis telah berusaha menyusun skripsi ini dengan baik. Untuk itu, penulis mengharapkan kritik dan saran yang membangun.
DAFTAR IS1
...
KATA PENGANTAR...
DAFTAR TABELDAFTAR GAMBAR
...
...
...
DAFTAR LAMPIRAN r.
...
I PENDAHULUAN
...
.
A LATAR BELAKANG
B
.
TUJUAN PENELITIAN...
I 1.
TINJAUAN PUSTAKA...
A
.
TANAMAN DAHLIA...
B.
INULIN. POLIMER FRUKTOSA ALAMI...
C
.
INULINASE...
D.
D-FRUKTOSA...
E.
IMOBILISASI ENZIM...
F.
REAKTOR SINAMBUNG UNGGUN TERKEMAS...
G.
PENENTUAN PARAMETER KINETIKA REAKSI EN-ZIMATIK
...
I11.
METODOLOGI...
A.
BAHAN DAN ALAT...
B.
WAKTU DAN TEMPAT...
C
.
METODA PENELITIAN...
D.
TATA LAKSANA...
IV.
HASIL DAN PEMBAHASAN...
A.
PENELITIAN PENDAHULUAN...
1
.
Analisis Tepung Umbi Dahlia...
2
.
Analisis Aktivitas Enzim dan Penen- tuan Ukuran Manik...
3
.
Penentuan Laju Dilusi. . .
B.
PENELITIAN UTAMA...
1
.
Derajat Konversi Produk pada Reaktor Sinambung Unggun Terkemas. . .
2
.
Aktivitas Enzim Imobil...
3
.
Produktivitas Reaktor Sinambung Ung- gun Terkemas...
4
.
Produktivitas Penggunaan Enzim pada Reaktor Sinambung Unggun Terkemas...
5
.
Rendemen Imobilisasi (R)...
V.
KESIMPULAN DAN SARAN...
A
.
KESIMPULAN...
B.
SARAN...
DAFTAR PUSTAKA
...
...
DAFTAR TABEL
Halaman
Tabel 1. Pengaruh dimensi kolom terhadap kon-
stanta spesifik
...
2 4Tabel 2. Hasil analisis beberapa komponen te-
...
pung umbi dahlia 42
Tabel 3. Tingkat aktivitas beberapa ukuran
Manik inulinase imobil
...
4 3Tabel 4. Hasil perhitungan umur tengah enzim
imobil
...
60Tabel 5. Hasil perhitungan rendemen imobilisasi 68
DAFTAR GAMBAR Halaman Gambar Gambar Gambar Gambar Gambar Gambar Gambar Gambar Gambar Gambar
1. Siklus umbi dahlia dari mulai tanam
hingga panen (Hartmann, et al., 1 9 8 9 ) 6
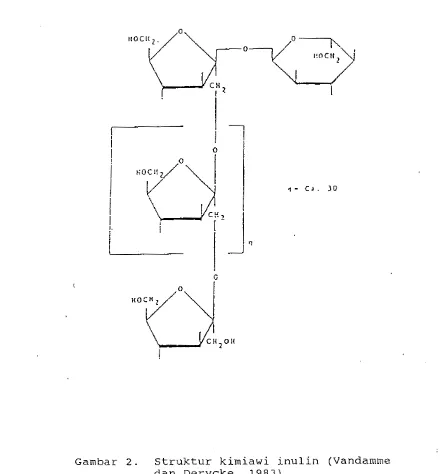
2. Struktur kimiawi inulin
...
8 3. Pengaruh pH terhadap aktivitas inulin-ase
...
11 4. Pengaruh suhu terhadap produktivitasinulinase
...
1 I5. Pengaruh suhu terhadap aktivitas inu-
linase
...
126. Pengaruh konsentrasi substrat dan suhu
...
pada hidrolisis inulin 12
...
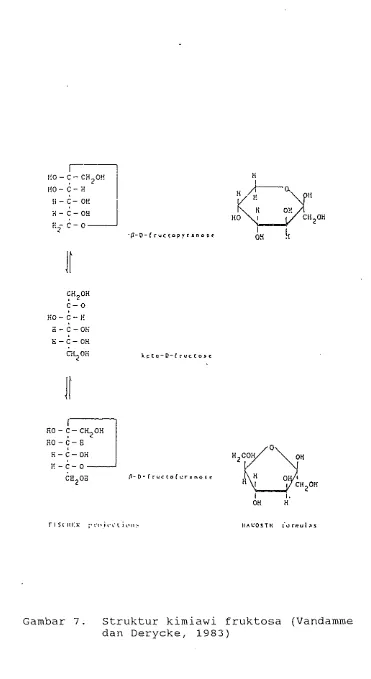
7. Struktur kimiawi fruktosa 14
8. Klasifikasi metoda imobilisasi sel
atau enzim
...
17...
9. Skema imobilisasi sel atau enzim 17 10. Jenis reaktor sinambung Unggun Terke-
...
kemas 2 3
Gambar 11. Hubungan laju reaksi awal dengan kon-
...
sentrasi substrat 28
Gambar 12. Penyajian grafik 1/V = f(l/S)
...
2 8 Gambar 13. Diagram alir proses penyiapan substrat 34Gambar 14. Diagram alir proses imobilisasi enzim
dengan metoda penjeratan
...
37Gambar 15. Diagram skema sistem Reaktor sinambung unggun terkemas aliran ke atas yang
. . .
digunakan dalam penelitian ini 3 9
Gambar 16. Proses produksi sirup fruktosa secara sinambung dalam reaktor unggun terke-
Gambar 17. Hubungan antara konsentrasi substrat dengan laju reaksi awal
..*...
Gambar 18. Grafik hubungan l/[S] dengan 1/V...
Gambar 19. Grafik hubungan antara konsentrasifruktosa dengan penqgantian volume un- tuk konsentrasi enzim 2 persen sub-
...
strat (v/w)
Gambar 20. Grafik hubungan antara konsentrasi fruktosa dengan penggantian volume un- tuk konsentrasi enzim 4 persen sub- strat (v/w)
...
Gambar 21. Grafik hubungan antara derajat konver-si dengan waktu tinggal dalam reaktor Gambar 22. Pola penyerangan rantai tunggal inu-
linase pada inulin
...
Gambar 23. Grafik penurunan aktivitas enzim inu-linase imobil selama waktu operasi un- tuk konsentrasi enzim 2 persen subs- trat (v/w)
...
Gambar 24. Grafik penurunan aktivitas enzim inu-linase imobil selama waktu operasi un- tuk konsentrasi enzim 4 persen subs- trat (v/w)
...
Gambar 25. ~ r a f i k perbandingan produktivitas re- aktor sinambung unggun terkemas de- ngan menggunakan enzim imobil pada konsentrasi enzim 2 persen dan 4 per- sen substrat (v/w)
...
Gambar 26. Perbandingan PPE pada reaktor sinam-bung unggun terkemas untuk konsentra- si enzim 2 persen substrat (v/w) de- ngan PPE pada reaktor curah
...
Gambar 27. Perbandingan PPE pada reaktor sinam-bung unggun terkemas untuk konsentra- si enzim 4 persen substrat (v/w) de-
...
DAFTAR LAMPIRAN Halaman Lampiran Lampiran Lampiran Lampiran Lampiran Lampiran Lampiran Lampiran Lampiran Lampiran Lampiran
1. Daftar tata nama dan satuan
...
7 62. Daftar bahan kimia
...
773. Daftar peralatan
...
78 4. Tata cara analisis komponen tepungumbi dahlia,analisis hasil hidroli-
sis dan pengukuran aktivitas enzim 79
5. Perhitungan kadar inulin dalam umbi dahlia dan penentuan volume enzim
inulinase yang digunakan
...
856a. Data laju reaksi awal proses hidro- lisis inulin secara curah mengguna-
kan enzim inulinase imobil
...
8 6Gb.' Data laju reaksi awal proses hidro- lisis inulin secara curah mengguna-
ka.n enzim inulinase bebas
...
8 67a. Data produk yang terbentuk pada hi- drolisis inulin dalam reaktor si- nambung unggun terkemas menggunakani enzim inulinase imobil pada konsen-
trasi enzim 2 persen substrat (v/w) 8 7 7b. Data produk yang terbentuk pada hi-
drolisis inulin dalam reaktor si- nambung unggun terkemas menggunakan enzim inulinase imobil pada konsen-
trasi enzim 4 persen substrat (v/w) 8 7
8 . Data keadaan tunak hasil hidrolisis inulin dalam reaktor sinambung ung- gun terkemas menggunakan enzim inu-
linase imobil
...
8 89 . Aktivitas enzim inulinase imobil untuk beberapa waktu pengambilan
Lampiran 10. Produktivitas reaktor sinambung unggun terkemas menggunakan enzim inulinase imobil dengan konsentrasi
2 persen dan 4 persen substrat (v/w) 9 0 Lampiran lla. Produktivitas penggunaan enzim pada
reaktor sinambung unggun terkemas menggunakan enzim imobil pada kon-
sentrasi 2 persen substrat (v/w)
. . .
9 1 Lampiran Ilb. Produktivitas penggunaan enzim padareaktor sinambung unggun terkemas menggunakan enzim imobil pada kon-
I. PENDAHULUAN
A. LATAR BELAKANG
Ketersediaan akan pemanis, terutama pemanis alami saat ini sangat kurang. Dengan hadirnya pemanis buat- an, malah banyak membawa dampak kurang baik bagi kon- sumen. Sedangkan dua jenis sumber pemanis alami yang telah ada saat ini yaitu gula kristal (dari tebu) dan gula cair (dari pati), sampai saat ini belum dapat mencukupi kekurangan akan pemanis tersebut. Pada ta- hun 1990, impor gula kristal dan pemanis lainnya men- capai 258 958.05 ton (BPS, 1990). Sedangkan untuk ta- hun 1991 pemerintah merencanakan impor gula sebesar
2 000 000 ton (Kompas, Pebruari 1991). Impor yula yang begitu besar disebabkan karena tidak adanya keseimbangan antara konsumsi gula dan produksi gula, sehingga pada tahun 1990, Indonesia kekurangan gula sebesar 519 800 ton lebih (BPS, 1990).
tigz tahapan proses), dengan demikian dapat menekan biaya proses.
Tanaman dahlia di Indonesia sampai saat ini baru dibudidayakan untuk diambil bunganya sebagai bunga po- tong, sedangkan umbinya masih terbuang percuma. Kan- dungan inulin yang cukup tinggi pada umbi dahlia ( 5 0 -
70 persen,bk), merupakan potensi yang cukup besar un- tuk dimanfaatkan. Kemudahan dalam menanam dan tidak diperlukannya syarat-syarat pertumbuhan yang rumit, merupakan beberapa faktor pendukung budidaya tanaman
ini. Indonesia sebagai daerah tropis, tampaknya cocok sebagai daerah budidaya tanaman ini.
penjeratan mudah dilakukan, murah, aktivitas enzim da- pat bertahan lama (lebih stabil) dan lebih aman terha- dap pengaruh dari luar (Chibata, 1978).
Reaktor sinambung unggun terkemas berjenis aliran
ke atas banyak digunakan untuk penelitian pada skala laboratorium sampai skala pilot plan. Jika dibanding- kan dengan reaktor sinambung jenis lainnya (misalnya CSTR), maka reaktor unggun terkemas lebih efisien. Penggunaan sistem sinambung akan memberikan produkti- vitas lebih tinggi jika dibandingkan dengan sistem curah. Beberapa kelebihan lainnya dari penggunaan sistem sinambung adalah kontrol secara otomatis dan operasi mudah, kondisi operasi lebih stabil, biaya le- bih rendah dan mudah dalam pengontrolan kualitas pro- duk (Chibata, 1978).
B. TUJUAN PENELITIAN
A. TANAMAN DAHLIA
Dahlia (Dahlia pinnata Cav.) merupakan tanaman internasional, terdapat pada hampir semua bagian du- nia. Nama dahlia berasal dari nama Professor Andreas Dahl, yang sangat berjasa dalam mengembangkan dan mempopulerkan tanaman ini (Walker, 1954). Popularitas tanaman ini, mungkin disebabkan oleh kenyataan bahwa dahlia mudah untuk dibudidayakan dan memberikan hasil yang maksimum dengan input yang minimum. Dahlia meru- pakan tanaman yang sehat dan kuat, jarang terkena pe-
nyakit. Musuh serius bagi dahlia adalah musim dingin (kebekuan) (Pizzetti dan Cocker, 1968).
Menurut Pizzetti dan Cocker (1968), dahlia terma- suk dalam fam6li Compositae, tanaman berumbi akar lu- nak dengan syarat penanaman harus terkena sinar matahari langsung. Perbanyakan dapat dilakukan mela-
lui benih (biji), pernotongan (stek) dan pembagian umbi akar
.
dihgin) di dalam tong atau kertas yang berlapis kertas koran. Tanah boleh dibiarkan tetap melekat pada umbi untuk mencegah pengeringan. Gambut merupakan bahan yang baik untuk penyimpanan umbi akar dahlia. Menurut Vandamme dan Derycke (1983), umbi akar' dahlia banyak mengandung inulin (suatu polimer fruktosa alami). Hartmann et al. (1989) juga menyatakan bahwa umbi akar dahlia merupakan gudang penyimpanan makanan. Siklus hidup umbi dari tanam sampai panen tertera pada
Gambar 1.
B . I N U L I N , POLIMER FRUKTOSA ALAMI
Inulin merupakan suatu polisakarida yang terdapat pada berbagai tanaman yang termasuk famili Compositae dan Graminae. Inulin tersebut ditemukan dalam umbi akar dahlia, Jerusalem artichoke, chicory, dandelion, burdock, scorzonera dan cardon. Inulin ini tersedia dalam tanaman tersebut sebagai cadangan karbohidrat. Nama inulin tampaknya diambil dari nama tanaman genus inula (Alant) dari famili Compositae (Vandamme dan Derycke, 1983).
Inulin dan senyawa analog inulin merupakan poli- fruktan yang mengandung rantai ikatan linier 8-2,l
( 6 8 6 1 ' u u e m 2 l e ~ ) uaued e b b u ~ q
Sekitar 30 unit fruktosa membentuk satu rantai inulin. Pada chicory, panjang rantai rata-rata adalah 18 unit fruktosa dan 1 unit glukosa. Rata-rata panjang rantai inulin beragam sebagai funqsi dari tanaman dan musim
(Rutherford dan Deacon, 1972). Inulin biasanya me- ngandung minimum 30 unit fruktosa, atau dengan kata lain derajat polimerisasi (DP) seharusnya 30 atau le- bih. Derajat polimerisasi ini menyebabkan berat mole- kul inulin mencapai 5400. Sehubungan dengan beragam- nya panjang rantai inulin yang ada, maka berat molekul inulin bervariasi antara 3500 sampai 5500 (Vandamme dan Derycke, 1983)
.
Vandamme dan Derycke (1983) juga menyatakan bahwa inulin tidak larut dalam air dingin, bahkan dalam air yang bersuhu 5 5 O ~ inulin hanya larut 5 persen. Inulin dapat tergumpalkan/ terendapkan dalam campuran etanol- air. Inulin juga dapat dihidrolisis dalam suatu medi- um asam pada suhu tinggi (70-80°c). Enziin inulinase menghidrolisis inulin menjadi fruktosa atau oligosaka- rida lain di bawah kondisi reaksi yang lunak.
INULINASE
Inulinase sebenarnya adalah R-fruktosidase dan bekerja memotong satuan fruktosa dari inulin pada po- sisi terminal 0-2,1. Enzim inulinase ini dapat digo- longkan sebagai 2,l-8-D-frukto-fruktanohidrolase (EC
Inulinase dengan aktivitas D-fruktosidase ditemu- kan dalam tanaman dan dalam mikroba (kapang, khamir dan bakteri). Inulinase dapat diisolasi dari umbi tanaman Jerusalem artichoke dan akar chicory dan dandelion. Inulinase yang berasal dari tanaman tidak menunjukkan aktivitas degradasi sama sekali. Seba- liknya, beberapa inulinase dari mikroba mempunyai ak- tivitas degradasi yang luar biasa. Inulinase dari ka- pang Steriqmatocytis niyra, Aspergillus awamori, Penicillium sp., inulinase dari bakteri Lactobacillus plantarum dan dari khamir Candida kefyr, C. salmanti- censis, Kluyveromyces fraqillis, Debaromyces cantarel- li dan D. phaffii, semuanya menunjukkan aktivitas degradasi dan termasuk tipe 8-fruktosidase (Vandamme dan Derycke, 1983).
Uchiyama et al. (1973) menyatakan bahwa inulinase dari Arthrobacter ureafaciens menghidrolisis inulin menjadi D-fruktofuranosa-1,2',3'-dianhidrida dan se- jumlah kecil satuan oligofruktosa lainnya. Enzim ini khusus untuk ikatan R-(2,l) satuan fruktosa dan dina- makan inulinase 11. Sedangkan inulinase I11 yang ber- asal dari Aspergillus niger 12 biasanya membentuk inu- lotriosa dan inulopentosa dan hampir tidak ada aksi menghidrolisis terhadap oligomer yang lebih rendah
Snyder dan Phaff (1962) menyatakan bahwa inulin- ase adalah enzim ekstraseluler yang bekerja dengan aksi penyerangan rantai tunggal. Selanjutnya dikata- kan juga bahwa inulinase disebut sebagai grup enzim pemecah akhir, sehingga produk hasil hidrolisis semua- nya berbentuk monosakarida.
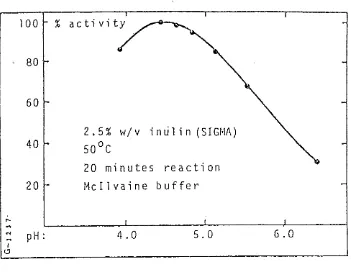
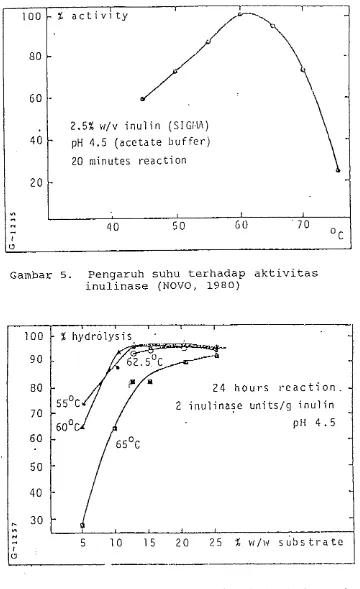
Menurut NOVO (1?80), inulinase dari Asperqillus ficuum mempunyai aktivitas optimum pada suhu 60°c dan pada selang pH 4 . 5 - 5.0. Hasil ini didapatkan dari percobaan seperti pada Gambar 3 , 4, 5 dan 6. Masa in- kubasi yang disarankan adalah 24 jam, karena selama waktu tersebut telah dapat dicapai tingkat produktivi-
tas yang cukup tinggi, yaitu di atas 90 persen. Inu- linase jenis ini mempunyai pola aksi luar (exo-) dan dalam (endo-). Tetapi lebih dari 80 persen aksi yang dilakukan adalah pola luar.
D
.
D-FRUKTOSAGambar 3. Pengaruh pH terhadap aktivitas inulinase (NOVO, 1980)
Gambar 4. Pengaruh suhu terhadap produktivitas inulinase (NOVO, 1980)
100
9 5
9 0
I I i
-
-
% l i y d r o l y s i s-
-
-\
-
-
15% w/w i n u l i n [pH '4.52 4 h o u r s r e a c t i o n
8 5
-
2 i n u l i n a s e uni t s / g1:
"
-
.,
f
2
w
6 0 6 5 o-
,
.
5 5 CGambar 5. Pengaruh suhu terhadap aktivitas inulinase (NOVO, 1980)
100
-
% h;drbly;is '.
90-
80
-
2 4 h o u r s r e a c t i o n . 55O70
-
60'
6 0
-
50
-
40
-
30
-
b.
,, "
I
0
qula, suhu dan pH. Kemanisan akan turun bila konsen- trasi, suhu dan keasaman meninqkat.
Ditinjau dari sudut kimia, fruktosa adalah mono- sakarida yanq mempunyai sebuah struktur keto. Kristal fruktosa mempunyai konfiqurasi R-D-fruktopiranosa. Kristal fruktosa ini bersifat anhidrida, dan ini meru- pakan satu-satunya bentuk kristal yanq diketahui. Lima bentuk isomerik fruktosa telah diketahui yang dapat salinq beralih bentuk denqan cara mutar rotasi. Persentase distribusi isomer mutar rotasi D-fruk- tosa pada 2 0 O ~ adalah 68.4-76.0 untuk B-piranosa, 28.0-31.6 untuk 8-furanosa dan 4 untuk a-piranosa (Barker,1976). Struktur kimiawi fruktosa dapat dili- hat pada Gambar 7.
Fruktosa merupakan qula yanq sanqat higroskopis, karena sanqat mudah menyerap air dari udara. ~ a r u t a n
fruktosa paling stabil pada pH 3.3 dan kestabilan ini tidak terqantung pada suhu dan konsentrasi. Fruktosa merupakan qula komersial yanq paling reaktif dalam
makanan.
Menurut Doty dan ~anninen (1979),gula fruktosa mempunyai tingkat kemanisan 1.5-2.0 kali tingkat kema- nisan sukrosa. Dengan kelebihan ini, maka diharapkan fruktosa dapat dijadikan sebagai bahan pemasok utama untuk industri di Indonesia.
Selain itu, fruktosa juga tidak menimbulkan rasa pahit seperti halnya pemanis buatan. Dengan kemanisan yang tinggi ini, maka gula fruktosa akan sangat bergu- na bagi industri yang membutuhkan pemanis sebagai ba- han baku untuk menghasilkan produk dengan mutu baik dan bahan baku yang lebih hemat (Doty dan Vanninen,
1979).
Fruktosa akhir-akhir ini banyak diproduksi secara hidrolisis enzimatik. Proses hidrolisis secara en- zimatik ini banyak memberikan keuntungan, karena tidak
I
menimbulkan dampak yang mencemari lingkungan. Selain itu enzim mempunyai cara kerja yang spesifik.
E. IMOBILISASI E N Z I M .
tahun 1971. Sebelum itu digunakan berbagai istilah seperti enzim tidak larut air ("water insoluble en- zyme"), enzim terjerat ("trapped enzyme"), enzim tetap ("fixed enzyme") dan enzim yang didukung oleh matriks ("matrix-supported enzyme").
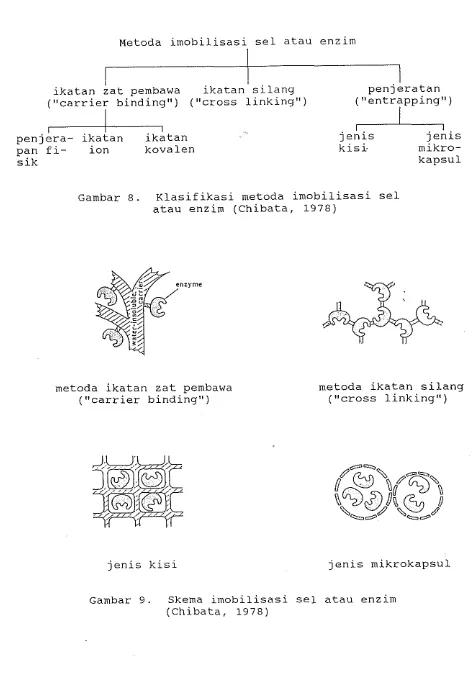
1. ~ l a s i f i k a s i Metoda Imobilisasi
Menurut Chibata (1978), secara garis besar
metoda imobilisasi enzim dapat dikelompokkan menja- di tiga katagori, yaitu :
a. Metoda ikatan pembawa ("carrier binding"), ya- itu pengikatan enzim pada zat pembawa ("carri- er") yang tidak larut air, dengan jalan pen- jerapan fisik, ikatan ionik atau ikatan kovalen. b. Metoda ikatan silang ("cross linkingu), yaitu
ikatan silang antara molekul enzim dengan pe- reaksi dua fungsi atau multi fungsi.
c. Metoda penjeratan ("entrapping"), yaitu menem-
patkan enzim ke dalam kisi-kisi suatu gel/manik semipermiabel atau melingkupi enzim dengan suatu membran polimer semipermiabel. Ada dua tipe metoda penjeratan ini, yaitu tipe kisi dan tipe mikrokapsul.
Metoda imobilisasi sel atau enzim
I
ikatan zat pembawa ikatan silang penj kratan ("carrier binding") ("cross linking") ("entrapping")
I
I
penjera- lkatan ikatan jenis
-
jenispan fi- ion kovalen kisi. mikro-
sik kapsul
Gambar 8. Klasifikasi metoda imobilisasi sel atau enzim (Chibata, 1978)
metoda ikatan zat pembawa ("carrier binding")
jenis kisi
metoda ikatan silang ("cross linking")
[image:30.599.86.558.86.761.2]jenis mikrokapsul
Buckle et al. (1985) mengatakan bahwa teknik imobilisasi dapat dilakukan dengan menggunakan polisakarida k-karagenan alami dan kalsium alginat dan dibuktikan telah banyak berhasil.
Chibata (1978) menyatakan bahwa metoda penje- ratan merupakan metoda yang dapat dipakai untuk mengimobilisasi banyak enzim karena tata caranya mudah dan dapat dilakukan pada kondisi lunak. Metoda penjeratan ini berbeda dengan metoda ikatan kovalen dan ikatan silang dimana enzim tidak ter- ikat pada matriks gel atau membran. Beberapa bahan dapat digunakan untuk melakukan imobilisasi enzim dengan metoda penjeratan seperti pati, bubuk "kon- jak", k-karagenan, poliakrilamida, asam poliakri- lat, polivinil alkohol, polivinil pirolidon, silika resin dan polietilen glikol-dimetakrilat untuk tipe kisi dan nilon, poliuresa, polistiren, etilselulo- sa, nitroselulosa dan kolodion untuk tipe mikrokap- SUl.
2. Natrium Alginat
alginat tergantung dari persiapan contoh, tetapi biasanya 2-5 persen (w/w). Liesbetini dan Nastiti
(1989) mengatakan bahwa dari tiga macam konsentra- si alginat yang digunakan yaitu 1.0 persen, 1.5 persen dan 2.0 persen (w/v), ternyata konsentrasi
alginat 1.0 persen (w/v) memberikan tingkat produk- tivitas tertinggi. Selanjutnya Laskin (1985) me- ngatakan bahwa kerugian dari tipe gel ini adalah kebutuhan akan multivalen kation untuk stabilitas gel. Umumnya digunakan kalsium (ca2+) dengan kon- sentrasi 5-10 mM dalam medium. Terdapat masalah jika di dalam medium terdapat pospat. Meskipun demikian, kalsium memungkinkan untuk mengembalikan matriks penjerat di bawah kondisi yang lunak. Gel ini dapat dilarutkan dengan menambah "calcium chelating" (seperti EDTA atau sitrat) kemudian en- zim atau sel yang terjerat dikeluarkan. Penggunaan Na-Alginat sebagai bahan pembawa, telah dipakai oleh khalayak dan memberikan hasil yang cukup me- muaskan.
3. Perubahan Sifat Enzim Terimobilisasi
enzim menjadi terhambat. Tahanan difusi terbagi dua bagian yaitu difusi eksternal dan internal. Difusi
eksternal disebabkan adanya transpor substrat dari larutan besar ke permukaan biokatalis melalui la- pisan batas air. Difusi internal disebabkan sub- strat harus berdifusi masuk ke bagian dalam manik enzim terimobilisasi (Klibanov, 1983).
Adanya beberapa kelemahan seperti berkurangnya aktivitas enzim, maka Klibanov (1983) menyarankan agar ukuran gel (manik) diperkecil, mengoptimumkan struktur geometri biokatalis terimobilisasi, me- naikkan konsentrasi substrat, menaikkan porositas dan mengoptimumkan distribusi biokatalis.
Jika enzim terikat oleh penyangga ("support"), maka aktivitas enzim dapat menurun. Menurut Chiba- ta (1978), ha1 ini disebabkan oleh beberapa ha1 seperti :
a. Molekul enzim terimobilisasi berada dalam konfi- gurasi yang menghalangi substrat masuk k e sisi aktif enzim
b. Grup reaktif pada sisi aktif enzim mungkin dili- batkan dalam pengikatan dengan penyangga
c. Molekul enzim selama pengikatan berada dalam konfigurasi inaktif dan
Temperatur dan pH optimum enzim terimobilisasi dapat berubah atau tetap tergantung sifat enzim dan sifat bahan pengikat enzim tersebut. Melrose (1971) di dalam ~ a r t i g u e (1975) telah mempelajari 50 enzim terimobilisasi. Diantara k e 50 enzim ter- imobilisasi tersebut, 30 diantaranya mempunyai sta- bilitas panas yang lebih tinggi, 4 enzim mempunyai stabilitas lebih rendah dan 12 enzim lainnya mem- punyai stabilitas panas sama seperti enzim bebas.
said (1987) menyatakan bahwa imobilisasi enzim memberikan beberapa keuntungan, diantaranya adalah
sebagai berikut :
1. Stabilitas enzim diperbaiki
2. Dapat dibuat untuk tujuan.khusus
3. Operasi dapat berlangsung sinambung, sehingga lebih praktis
4. Reaksi membutuhkan ruangan yang lebih kecil
5. Kemurnian enzim lebih tinggi dan jumlah produk yang lebih baik dapat dicapai
6 . Kontrol reaksi lebih baik dan
7. Penyelamatan sumber daya alam dengan populasi lebih rendah dapat diperoleh.
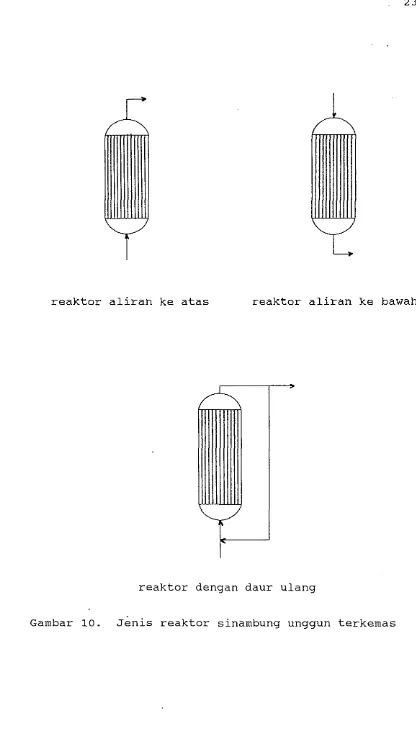
F. REAKTOR SINAMBUNG UNGGUN TERKEMAS
Tiga jenis reaktor sinambung unggun terkemas yaitu aliran ke atas, aliran ke bawah dan daur ulang paling banyak digunakan untuk imobilisasi enzim atau sel. Dalam hubungannya dengan reaktor ini, yang perlu di- perhatikan adalah batas tekanan yang melalui kolom dan pengaruh dimensi kolom terhadap kecepatan reaksi
(Chibata, 1978).
Selanjutnya Chibata (1978) menyatakan bahwa untuk penerapan pada skala industri, aliran langsung sub- strat adalah penting. Pada imobilisasi aminoacylase, kecepatan reaksi pada kolom aminoacylase adalah sama jika menggunakan jenis reaktor aliran k e atas ataupun aliran ke bawah. Tetapi ditegaskan oleh Chibata (1978) bahwa bagaimanapun juga, dalam banyak kasus reaktor jenis aliran ke bawah menyebabkan pemampatanl penekanan manik enzim dalam kolom sehingga reaktor je- nis aliran ke atas lebih umum digunakan untuk indus- tri. Lebih jauh lagi, ketika gas diproduksi selama reaksi enzimatik, maka reaktor jenis aliran k e atas cocok untuk digunakan.
reaktor aliran ke atas reaktor aliran ke bawah
t-'
[image:36.602.113.529.50.794.2]reaktor dengan daur ulang
inaktivasi enzim imobil tidak terjadi. Tingkat kon- versi dapat ditentukan pada kondisi tunak ini (Cho et al., 1982).
1. Faktor Dimensi Xolom
Perbandingan antara tinggi kolom dengan dia- meter kolom (HID) mempengaruhi konstanta spesifik (k). Konstanta spesifik didefinisikan sebaqai kecepatan dekomposisi kompleks enzim-substrat. Tetapi pengaruh H/D tidak linier, ha1 ini dapat dilihat pada Tabel 1 di bawah ini.
Tabel 1. Pengaruh dimensi kolom terhadap konstanta spesifika
- -
H/ D konstanta spesifik (k)
1.5 59.1
+
1.54.1 62.5
+
0.9,
7.1 61.7 2 1.821.4 61.0
+
0.3Menurut Kim et a1.(1982), dari hasil pene- litiannya dengan menggunakan tiga macam perban- dingan HID yaitu 3.9, 10.3 dan 21.3, disimpulkan bahwa H/D = 10.3 memberikan hasil yang optimal.
2. Faktor Xecepatan Alir
[image:37.605.142.532.195.646.2]aktivitas. Penurunan aktivitas bergantung pada wak- tu alir, bukan pada volume alir, sebab volume alir adalah seragam pada setiap bagian kolom. Penurunan aktivitas enzim pada setiap bagian dalam kolom tidak seragam. Beberapa penyebabnya adalah :
a. Perbedaan stabilitas antara larutan "bulk" (be-
sar) dengan larutan produk
b. Pencemaran enzim oleh racun yang berasal dari larutan substrat
c. Penstabil enzim yang semakin melemah d. Enzim yang bersangkutan semakin lemah
e. Adanya denaturasi tidak balik ("irreversible") enzim karena temperatur terlalu tinggi atau ter- jadi perubahan temperatur reaksi.
3. Faktor Ukuran ManiX
Bentuk enzim/sel imobil diklasifikasikan men- jadi empat tipe yaitu manik (partikel), membran
(film, plat), pipa dan serat. Namun kebanyakan dibuat dalam bentuk manik dengan pertimbangan mudah ditangani, zat pembawa yang cocok untuk imobilisasi secara komersial umumnya tersedia dalam bentuk manik, luasan bentuk manik lebih besar dan efisien- si kerja lebih tinggi (Chibata, 1978).
adalah pertemuan antara substrat dengan biokatalis dalam manik imobilisasi. ~ a j u reaksi yang dikata-
lis oleh biokatalis dipengaruhi oleh konsentra%i substrat dan produk yang dihasilkan, tahanan difusi
eksternal dan internal serta tahanan pindah massa eksternal. Salah satu faktor penting yang harus diperhatikan adalah ukuran manik. Dari penelitian yang telah dilakukan, penggunaan ukuran manik yang lebih kecil (0.5-2.0 mm) memberikan nilai konversi lebih tinggi bila dibandingkan dengan ukuran manik yang lebih besar (4.0-4.5 mm). Menurut Liesbetini dan Nastiti (1989) ha1 ini disebabkan karena sema- kin kecil ukuran manik, tahanan difusi dari permu- kaan manik sebagai membran semipermeabel menurun. Disamping itu jumlah manik yang tersentuh semakin banyak, dengan demikian kemungkinan proses perte- muan antara substrat dengan biokatalis semakin be- sar sehingga konversi substrat menjadi produk akan semakin tinggi.
Secara umum kelebihan sistem sinambung dibanding- kan sistem curah adalah (Chibata, 1978):
1. Kontrol secara otomatis dan operasi mudah
2. Kondisi operasi lebih stabil
3. Biaya lebih rendah
G. PENENTUAN PARAMETER KINETIKA REAKSI ENZIMATIK
T e k n i k t a t a cara p e n e n t u a n p a r a m e t e r k i n e t i k a
r e a k s i e n z i m a t i k b a n y a k d i t e l i t i o l e h B a i l e y d a n O l l i s
( 1 9 7 7 ) .
R e a k s i e n z i m a t i s u n t u k s a t u s u b s t r a t , model k i n e -
t i k a n y a m e n g i k u t i model M i c h a e l i s M e n t e n . Dalam s u a t u
r e a k s i s e d e r h a n a :
mempunyai l a j u r e a k s i :
A i b a e t a l . ( 1 9 7 3 ) m e n u r u n k a n p e r s a m a a n d i a t a s men-
j a d i :
Jika digambar antara konsentrasi substrat dengan laju reaksi awal akan didapatkan hasil seperti pada Gambar 11.
[image:41.595.101.535.59.778.2] [image:41.595.138.525.366.760.2][substratl
Gambar 11. Hubungan laju reaksi awal dengan konsentrasi substrat
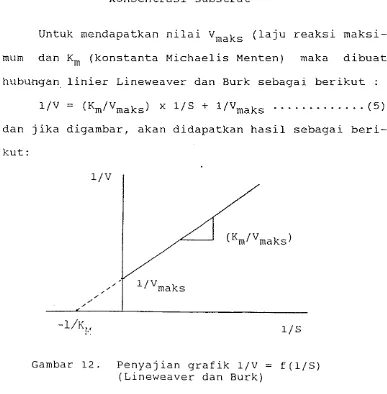
Untuk mendapatkan nilai Vmaks (laju reaksi maksi- mum dan Km (konstanta Michaelis Menten) maka dibuat hubungan linier Lineweaver dan Burk sebagai berikut :
[image:41.595.158.463.503.735.2]1/V = (Km/Vmaks) x 1/S
+
l/Vmaks . . . ( 5) dan jika digambar, akan didapatkan hasil sebagai beri- kut:Reaktor unggun terkemas termasuk salah satu jenis reaktor piston. Model aliran dalam reaktor dapat di- gambarkan sebagai berikut :
Dengan pergerakan piston dalam reaktor, konsen- trasi S menurun secara terus menerus. Neraca bahan pada dV dapat dituliskan sebaqai berikut :
Dengan memasukkan persamaan Michaelis Menten :
inteqrasi menghasilkan :
-
Vmaks = Km In S/So+
(S - So)...
(10) Bila derajat konversi, X = (So - S)/So, didapatkanUntuk hidrolisis sinambung, laju dilusi dapat didekati dari :
-
Vmaks - Dmaks
. . .
(12)Oleh karena itu, selang laju dilusi dapat diper- oleh dengan mengambil selang laju dilusi di bawah
Dmaks'
Cho et al. (1982) mengatakan bahwa untuk dapat memperoleh konsentrasi produk tetap, maka harus dibuat kondisi tunak, dan produk diambil pada keadaan tunak tersebut. Untuk mencapai keadaan tunak seperti ini, dapat dilakukan dengan mengatur laju alir tetap.
Guna mendapatkan parameter kinetika reaksi, Media
(1991) menggunakan 4 macam konsentrasi substrat, yaitu 9.10 persen, 10.63 persen, 12.75 persen dan 15.94 per- sen (w/v). Pengambilan contoh dilakukan sebanyak delapan kali selama waktu reaksi 24 jam. Kesimpulan yang diperoleh menyebutkan bahwa sampai konsentrasi substrat tertinggi, belum dicapai keadaan tunak. Sa- rannya adalah perlu digunakan konsentrasi substrat yang lebih tinggi lagi untuk mencapai keadaan tunak. Dengan konsentrasi enzim 1 persen dan 2 persen sub-
111. METODOLOGI A. BAHAN DAN ALAT
Bahan baku yang digunakan adalah umbi dahlia (Dahlia pinnata Cav.) yang diperoleh dari daerah Gis- ting, Lampung Selatan.
Bahan kimia yang diperlukan, meliputi bahan kimia untuk analisis tepung umbi akar dahlia, bahan kimia untuk produksi sirup fruktosa, serta bahan kimia untuk analisis hasil hidrolisis. Bahan kimia selengkapnya yang digunakan dalam penelitian ini disajikan pada Lampiran 2.
Enzim yang digunakan untuk hidrolisis inulin ada-
lah inulinase (Novozym 230) dari kapang Aspergillus ficuum, yang berasal dari PT. Sufra Incomer, Perwakil- an NOVO Jakarta. Sedangkan Natrium Alginat yang dipa- kai berasal dari SIGMA (jenis "medium viscosity").
Peralatan yang digunakan meliputi peralatan untuk produksi sirup fruktosa dan peralatan untuk analisis hasil hidrolisis. Daftar peralatan selengkapnya yang digunakan dalam penelitian ini dapat dilihat pada Lam- piran 3.
B. WAKTU DAN TEMPAT
Tempat yang digunakan untuk penelitian ini adalah
Laboratorium Bioindustri, Pusat Antar Universitas Bio- teknologi-IPB, Laboratorium pada JuKusan Teknologi In- dustri Pertanian, Fakultas Teknologi Pertanian, Insti- tut Pertanian Bogor, serta Bangsal Percontohan Pengo-
lahan Hasil Pertanian (BPPHP).
C. METODA PENELITIAN
Penelitian ini dilakukan dalam dua tahapan, yaitu penelitian pendahuluan dan penelitian utama. Peneli- tian pendahuluan dilakukan untuk menganalisis beberapa komponen penyusun tepung umbi dahlia, mengukur aktivi- tas enzim inulinase serta untuk menentukan kisaran
laju dilusi dan konsentrasi substrat (inulin) yang akan digunakan dalam penelitian utama. Selain itu da- lam penelitian pendahuluan juga dipelajari teknik di- sain reaktor serta penentuan ukuran manik enzim imo- bil. Tata cara analisis tepung umbi dahlia serta peng- ukuran aktivitas inulinase terdapat pada Lampiran 4.
Pada penelitian utama dilakukan hidrolisis dengan laju dilusi dan konsentrasi substrat yang didapatkan dari penelitian pendahuluan. Kondisi proses lainnya,
beberapa selang waktu selama proses berlangsung. Tata cara analisis hasil hidrolisis terdapat pada Lampir- an 4.
D. TATA LAKSANA
Umbi akar dahlia yang akan digunakan terlebih dahulu dicuci sampai bersih kemudian dikupas dan di- iris menggunakan pisau stainless steel. Selanjutnya umbi yang telah teriris tipis dikeringkan di bawah si- nar matahari untuk mengurangi bobot kandungan airnya. Baru kemudian dilakukan pengeringan dengan oven bersu- hu 50-60°c. Pengeringan dihentikan jika umbi telah mudah dipatahkan. Irisan umbi kering ini kemudian digiling menggunakan "Cutter-Mill" dengan saringan 40
Umbi Dahlia
%--)
Perajangan
r-7
Pengeringan dengan Sinar Matahari 3-4 jam
~ e n g e r i n g a n den an Oven Suhu 50-60 C
4
C
(
Irisan Umbi Keringi
Penggilingan,40 mesh
(
Tepung Umbi Dahlia)
Pelarutan dengan Air suhu 80-90°c, 30 mnt
Siap Pakai
[image:47.602.216.475.81.672.2]Enzim inulinase disiapkan untuk diukur aktivi- tasnya. Pengukuran aktivitas ini dilakukan dengan Metoda DNS (Dinitro Salycylic Acid). Jumlah enzim sebagai protein diukur dengan Metoda Lowry et al.. Setelah diketahui aktivitasnya, kemudian dilakukan pembuatan enzim imobil menggunakan metoda penjeratan dengan matriks penjerat Natrium-Alginat. Kehilangan
enzim akibat imobilisasi dapat diketahui dengan meng- ukur jumlah enzim yang terlepas dari manik enzim imo- bil. Jumlah enzim yang terjerat diketahui dengan me- ngurangkan jumlah enzim yang terlepas dari jumlah en- zim total.
Pembuatan enzim imobil dilakukan dengan bantuan pompa peristaltik untuk menyeragamkan ukuran manik. Untuk membentuk ukuran tersebut digunakan selang kecil dengan berbagai ukuran yaitu untuk diameter manik 1.4
mm, 2.3 mm dan 3.3 mm. Pertama kali larutan Na-Algi-
buffer asetat sebanyak dua kali, dan hasil cuciannya dimasukkan ke dalam wadah penampung manik-manik yang berisi larutan CaC12. Dari tiga ukuran manik yang terbentuk, dilakukan pengukuran aktivitas enzim inu- linase imobil dengan metoda DNS. contoh untuk peng- ukuran jumlah enzim yang terlepas dari manik, diper- oleh dari wadah penampung manik-manik yang berisi CaC12.
Pada penelitian pendahuluan dilakukan hidrolisis inulin secara curah. Konsentrasi tepung (tepung : air) yang digunakan adalah 1 : 9 1 : 6, 1 : 4,
1 : 3, 1 : 2 dan 1 : 1.5 yang sesuai dengan konsentra- si substrat (inulin) 3.30 persen, 9.38 persen, 13.14 persen, 16.43 persen, 21.90 persen dan 26.28 persen (wjv). Konsentrasi enzim yang digunakan adalah 2 persen substrat (vjw)
.
Menurut Media (1991),konsentrasi enzim 2 persen substrat (vjw) menghasilkan rendemen yang lebih tinggi dibandingkan konsentrasi enzim 1 persen substrat (v/w).
/
Inulinase)
(Novozym 230)y
Pencampuran
I
~ m o b i l i s a s i dalam
CaC12 1-2 jam
.i
Pencucian Manik-manik dengan Buffer Asetat
Penyaringan
'7
Campuran CaClz dan Enzim
C
[image:50.595.121.513.103.638.2]Pengukuran Junlah Enzim yang Terlepas dari Manik
Parameter kinetika reaksi didapatkan dengan meng- gambarkan data konsentrasi fruktosa yang terbentuk de- ngan waktu pengambilan contoh, kemudian dengan persa- maan Lineweaver Burk akan didapat nilai VXaks dan Km. Kisaran laju dilusi ditentukan dengan menganggap
-
'rnaks - Dmaks.
~enelitian utama dilakukan dengan sistem sinam- bung menggunakan reaktor sinambung unggun terkemas (seperti pada Gambar 15) dengan biokatalis enzim inu- linase imobil. Volume reaktor yang terisi substrat sebesar 230 ml dari 550 ml volume reaktor total. Hi- drolisis dilakukan dengan menggunakan empat macam laju dilusi yaitu 0.20/jam, O.lO/jam, O.OS/jam dan 0.04/jam serta dua macam konsentrasi enzim yaitu 2 persen dan
4 persen substrat (v/w). Hidrolisis dimulai dari laju dilusi tertinggi dengan lama reaksi sebanyak tiga kali
I
waktu tinggal dalam reaktor untuk masing-masing laju dilusi. Pengambilan contoh dimulai pada awal waktu tinggal kedua. Jumlah contoh yang diambil adalah em- pat buah untuk setiap waktu tinggal dalam reaktor dengan selang waktu sama. Selama waktu tinggal per- tama, merupakan waktu pengkondisian keadaan tunak,
sehingga pada awal waktu tinggal kedua, diharapkan keadaan tunak telah tercapai. Data keadaan tunak dari setiap laju dilusi diambil darj
Substrat
Pompa Peristaltik
[image:52.595.67.525.99.670.2]Wadah Substrat
Substrat (inulin) dialirkan ke dalam reaktor dari wadah substrat dengan bantuan pompa peristaltik. Kecepatan pengaliran diatur dari volume kecepatan pada pompa. Dalam waktu yang bersamaan, maka akan dike- luarkan produk dari reaktor. Produk yang keluar diam- bil dan langsung dilakukan pemucatan yaitu dengan pe- nambahan arang aktif 1.5 persen (w/v), dipanaskan pada suhu 80-90°c selama 15 menit. Kemudian contoh disa- ring. Pemucatan secara langsung ini dimaksudkan untuk menginaktifkan enzim yang mungkin tercuci dari manik enzim imobil sehingga terikut dengan produk. Untuk menjernihkan produk dari bahan-bahan terlarut, maka ditambahkan beberapa tetes Pb-asetat setengah basa. Kemudian produk dinetralkan dengan menambahkan asam atau basa. Konsentrasi produk diukur dengan teknik spektroskopi menggunakan Metoda DNS. Diagram alir proses produksi sirup fruktosa secara sinambung disa-
jikan pada Gambar 16.
Substrat rnuiin Enzim Imobil
1.
Pemasukan ke dalam reaktor
4
Pengaturan Laju Dilusi
~idrolisis dalam Reaktor Unggun Terkemas 60°c, p H 4.5 Selama 3 Kali Waktu
Tinggal Dalam Reaktor
1
Pengambilan Contoh1
Pemucatan, Arang Aktif 1.5 %
80-90°c, 15 mnt Penyaringan
r - l
i
KotoranLarutan Bersih
Penambahan Pb-asetat Setengah Basa
Penetralan
a
[image:54.599.97.504.75.672.2](
Larutan Jernih)
IV. HASIL DAN PEMBAHASAN
A. PENELITIAN PENDAHULUAN
Penelitian pendahuluan dilakukan untuk mengukur kadar komponen penyusun bahan baku, mengukur aktivitas enzim bebas, menentukan ukuran manik enzim imobil dan
menentukan selanq laju dilusi (Dilution rate = D ) .
1. Analisis Tepung Umbi Dahlia
Hasil analisis tepung umbi dahlia dimaksudkan untuk menjadi dasar proses selanjutnya. Hasil tersebut dapat dilihat pada Tabel 2.
Tabel 2. ~ a s i l analisis beberapa komponen tepung umbi dahlia
Komponen Kadar (persen, bk)
Air Abu
Protein Inulin
Bahan-bahan lain
(Selulosa, lemak, dll)
2. Analisis Aktivitas Enzim dan Penentuan Ukuran Manik
[image:55.595.159.519.387.597.2]aktivitas sebesar 4.2 pmol fruktosa.menit-'.mg enzim-l. Dengan metoda penjeratan menggunakan Na- alginat, enzim yang hilang akibat imobilisasi ada- lah sebesar 8.4 persen. Dari penentuan ukuran manik didapatkan bahwa ukuran manik 2.3 mm meng-
hasilkan tingkat aktivitas tertinggi dibandingkan ukuran manik lainnya yaitu 1.4 mm dan 3.3 mm. Dengan demikian, maka ukuran manik 2.3 mm dipilih untuk penelitian selanjutnya. Menurut Chibata (1978), semakin kecil ukuran manik, maka hambatan difusi akan semakin kecil sehingga menghasilkan produktivitas lebih tinggi. Tetapi jika ukuran manik terlalu kecil, maka memungkinkan terjadinya pencucian enzim pada waktu pengaliran substrat.
Data selengkapnya dari pengukuran aktivitas manik inulinase imobil dapat dilihat pada Tabel 3 di bawah ini.
Tabel 3. Tingkat aktivitas beberapa ukuran manik inulinase imobil
3 . Penentuan Laju D i l u s i
Setelah dilakukan hidrolisis secara curah, di- dapat hubungan antara konsentrasi substrat dengan
laju reaksi awal seperti yang terlihat pada Gam- bar 17. Dari gambar dapat dilihat bahwa kondisi tunak telah tercapai. ~erlihat juga bahwa Vmaks untuk enzim imobil lebih rendah dibandingkan Vmaks enzim bebas. Hal ini disebabkan karena adanya beberapa hambatan yang terjadi jika enzim dalam bentuk imobil. Klibanov (1983) mengatakan bahwa ada tiga penyebab penurunan aktivitas pada enzim imobil yaitu pengaruh pembagian ("partitioning"), pengaruh hambatan difusi dan pengaruh hambatan sterik.
Dalam bentuk imobil, sifat-sifat fisikokimia fasa baru berbeda dengan fasa lama. Oleh karena itu semua komponen proses enzimatik seperti sub- strat, ion-ion hidrogen, produk, penghambat, akti- vator, kovaktor dan lainnya dibagi antara fasa en- zim imobil dengan fasa cairan besar. Hambatan di- fusi terbagi atas dua jenis, yaitu hambatan difusi
.-
(I)
Y
(d
a
E
5 10 15 2 0 2 5
K o n s e n t r a s i S u b s t r a t
( g / 1 0 0rnl)
A
-
m [image:58.595.52.520.106.657.2]v Enzirn l m o b i l --
-
Enzirn B e b a sini, pengaruh hambatan sterik tidak terjadi, karena hambatan sterik hanya terjadi jika molekul sub- strat mempunyai bobot molekul tinggi, sedangkan inulin hanya berbobot 3 5 0 0 - 5 5 0 0 . Adanya ham- batan-hambatan tersebut, akan mempengaruhi aktivi- tas enzim, yang selanjutnya akan menurunkan kece- patan reaksinya.
Wong ( 1 9 7 5 ) menyatakan bahwa reaksi belum ber- langsung bila substrat belum bertemu dengan enzim. Setelah enzim bertemu substrat, maka akan membentuk kompleks enzim-substrat yang akan terakumulasi melalui fasa antara untuk mencapai tingkat kondisi tunak. Semakin tinggi konsentrasi substrat yang digunakan maka akan semakin tinggi pula konsentrasi awal kompleks enzim substrat pada kondisi tunak tersebut. Ketika hampir semua enzim terikat dalam kompleks enzim-substrat, kenaikan konsentrasi sub- strat selanjutnya hanya akan meningkatkan sedikit kompleks enzim substrat, bahkan kenaikan ini dapat diabaikan, demikian juga dengan laju reaksi awal. Jadi, kenaikan konsentrasi substrat akan meningkat- kan laju reaksi hingga mencapai laju maksimum.
reaksi awal dengan konsentrasi substrat linier. Daerah ini disebut sebagai daerah kinetika berordo satu. Pada konsentrasi substrat sangat tinggi, laju reaksi awal tidak terpengaruh oleh konsentrasi substrat. Daerah ini disebut daerah berordo nol.
Pada konsentrasi substrat sedang, hubungan laju reaksi awal dengan konsentrasi substrat tidak meng- ikuti kinetika berordo satu maupun ordo no1 (Se- gel, 1975).
Nilai Vmaks (laju reaksi maksimum) dan Km (konstanta, Michaelis Menten) didapatkan dengan menggunakan persamaan (5) (Bailey dan Ollis, 1972). Dengan menggambar hubungan antara 1/[S] dengan 1/V akan didapatkan garis lurus seperti terlihat pada Gambar 18. Persamaan garis lurus tersebut mempu- nyai kemiringan Km/Vmaks, perpotongan dengan sumbu X memberikan nilai -l/Km sedangkan perpotongan de- ngan sumbu Y menghasilkan l/Vmaks. Pendekatan yang
-
digunakan adalah bahwa Vmaks - Dmaks Dari Gam- bar 18 diperoleh nilai Vmaks = 0.49/jam untuk enzim imobil dan Vmaks = 1.77/jam untuk enzim bebas. Se-
dangkan nilai Km = 10.68 persen untuk enzim imobil dan K, = 20.33 persen untuk enzim bebas. Dengan
1
4-
E n r i m l m o b i l
+Enzim Bebas
I
[image:61.595.63.522.80.634.2]-___. -. . -- . ____
substrat yang diambil adalah disekitar nilai Km yaitu 13.14 persen (w/v). Konsentrasi substrat ini adalah di atas nilai Km, ha1 ini dimaksudkan agar reaksi membentuk ordo no1 (keadaan tunak). Pene- tapan konsentrasi substrat ini diperkuat oleh pendapat Segel (1975), yang menyebutkan bahwa konsentrasi substrat yang dipilih untuk membuat analisis kinetika enzimatik sebaiknya disekitar nilai Km reaksi tersebut. Data laju reaksi awal pada berbagai konsentrasi substrat selengkapnya dapat dilihat pada Lampiran 6a dan Lampiran 6b.
B. PENELITIAN UTAMA
Hidrolisis sinambung pada penelitian utama dila- kukan dengan menggunakan laju dilusi yang didapat dari penelitian pendahuluan, sedangkan konsentrasi enzim ditetapkan berdasarkan kesimpulan penelitian sebelum- nya. Data analisis produk yang terbentuk pada hidro- lisis sinambung selengkapnya terdapat pada Lampiran 7a dan 7b. Pada Gambar 19 dan Gambar 20 dapat dilihat sebaran data konsentrasi fruktosa terhadap penggantian volume. Penggantian volume (PV) dinyatakan sebagai
(Horitsu et al., 1985) :
Waktu pengambilan contoh (jam) PV =
Data keadaan tunak untuk setiap laju dilusi pada
konsentrasi enzim 2 persen dan 4 persen substrat (v/w) berasal dari rata-rata hasil analisis kedelapan waktu pengambilan contoh. Data hasil hidrolisis sinambung pada keadaan tunak selengkapnya terdapat pada Lampir-
an 8.
Menurut Chibata (1978), perubahan laju dilusi akan mempengaruhi laju alir, selanjutnya laju alir
akan mempengaruhi kecepatan penurunan aktivitas. Se- dangkan menurut Meyss et al. (1985), kecepatan reaksi tidak selalu sebanding dengan konsentrasi enzim. Tetapi pada awal reaksi, kecepatan awal akan berban- ding langsung dengan konsentrasi enzim.
1. Derajat Konversi Produk pada Reaktor Sinambung Ung- gun Terkemas
Hubungan antara waktu tinggal dalam reaktor
( 2
) dengan derajat konversi (X) dapat dilihat padaGambar 21. Derajat konversi dinyatakan sebagai :
61.50 persen substrat telah terkonversi. Hal yang berbeda tampak pada konsentrasi enzim 4 persen sub- strat (vjw), dengan semakin lama waktu tinggal da- lam reaktor, derajat konversi semakin kecil. Pada waktu tinggal 5 jam, 77.84 persen konversi telah tercapai. Tetapi jika xaktu tinggal dalam reaktor diperpanjang sampai 25 jam, hanya 39.22 persen sub- strat yang terkonversi.
Pada konsentrasi enzim 2 persen substrat
(vjw), untuk waktu tinggal dalam reaktor terpendek yaitu 5 jam, pembentukan produk baru sebagian. Jika waktu tinggal dalan reaktor diperpanjang, akan dihasilkan tingkat konversi lebih tinggi. Hal ini dimungkinkan karena semakin lama waktu tinggal da- lam reaktor, maka waktu temu antara substrat dengan
biokatalis lebih lama sehingga akan meningkatkan derajat konversi substrat menjadi produk. Hal yang berbeda tampak untuk konsentrasi enzim 4 persen substrat (vjw). Konversi tertinggi terjadi pada waktu tinggal dalam reaktor selama 5 jam, dan jika waktu tinggal diperpanjang, tingkat konversi akan menurun.
dan adanya penghambatan oleh produk. Mangunwidjaja (1989) menyatakan bahwa beberapa reaksi enzimatik
yang berlangsung pada satu substrat dan satu produk merupakan reaksi dapat balik. Beberapa contoh ada- nya reaksi balik adalah pada proses isomerisasi glukosa menjadi fruktosa dan konversi asam fumarat menjadi asam malat. Keyes (1985) menyatakan bahwa persamaan kesetimbangan untuk reaksi balik adalah sebagai berikut :
Reaksi balik dimungkinkan terjadi pada hidro- lisis dengan konsentrasi enzim 4 persen sub- strat (v/w), karena pada waktu tinggal 5 jam, kon- versi hampir terjadi secara sempurna sehingga jika waktu tinggal diperpanjang, fruktosa akan tergabung kembali menjadi beberapa oligofruktosa atau inulin. Meyes (1985) menyatakan bahwa laju reaksi balik akan meningkat dengan meningkatnya konsentrasi pro- duk.
Disamping adanya reaksi balik, kemungkinan se- bab lain adalah adanya penghambatan oleh produk karena produk terakunulasi pada permukaan manik. Mangunwidjaja (1989) nenyatakan bahwa untuk sejum-
merupakan suatu penghambat. Adanya akumulasi pada permukaan manik akan menurunkan permeabilitas ma- triks penjerat sehingga menghambat intensitas pertemuan antara substrat dengan enzim. Semakin lama waktu tinggal dalam reaktor, akan semakin tinggi hambatan oleh akumulasi produk sehingga akan mengurangi konversi substrat.
Secara keseluruhan, konversi tertinggi dicapai pada penggunaan konsentrasi enzim 4 persen substrat (v/w) dengan laju dilusi 0.20/jam yaitu 77.84 per- sen. Tingkat konversi yang tinggi ini dimungkinkan karena inulinase dari Aspergillus ficuum bekerja dengan sistem penyerangan rantai tunggal, dan model degradasinya lebih cenderung bertipe luar (exo-) (Snyder dan Phaff, 1962). Artinya inulinase akan menyerang rantai inulin dari sebelah luar satu demi satu. Sistem penyerangan ini akan menyebabkan tingkat hidrolisis dari polimer k e monomer lebih sempurna. Pada Gambar 22 dapat dilihat pola pe- nyerangan rantai tunggal inulinase.
Gambar 2 2 . Pols penyerangan ,rantai tunggal
2. ~ k t i v i t a s Enzim Imobil
Pengamatan aktivitas enzim imobil dilakukan sebanyak enam kali selama waktu reaksi. Aktivitas enzim yang diukur didefinisikan sebagai mmol fruk- tosa-menit-l.mg enzim-l, dimana untuk 1 manik ter- dapat 2.75
x
mg enzim untuk konsentrasi enzim2 persen substrat (v/w), dan 5.50
x
lo-* mg enzim untuk konsentrasi enzim 4 persen substrat (v/w).Data pengukuran aktivitas enzim imobil selengkap- nya terdapat pada Lampiran 9.
Jika digambarkan antara aktivitas enzim imobil relatif dengan waktu operasi, akan didapatkan gra- fik seperti pada Gambar 23 dan Gambar 24. Aktivi- tas enzim relatif (AER) dinyatakan sebagai :
Aktivitas Enzim Pada Jam ke-t
AER =
x
100 %Aktivitas Enzim Awal
Terlihat bahwa semakin lama waktu operasi, ak- tivitas enzim semakin berkurang. Sampai waktu ope- rasi terakhir (181 jam), telah terjadi penurunan aktivitas rata-rata sebesar 29 persen. Penurunan aktivitas sebesar ini dapat disebabkan oleh bebera-
Gambar 23. G r a f i k penurunan aktivitas enzim imobil untuk konsentrasi enzim 2 persen
110
. . .
-
e?
-
m-.- . . . . . . . . I
...
. . . .
.= 40
.-
-
X l j
I
104
0
0 xt 41 &I PC* 1(U IZO l JEl 1 61 1M
Gambar 24. Grafik penurunan aktivitas enzim imobil untuk konsentrasi enzim 4 persen
I
I
2M
[image:71.595.103.530.54.663.2]mengatakan bahwa beberapa penyebab menurunnya ting- kat aktivitas enzim imobil adalah akibat inaktivasi oleh panas dan akibat terkikisnya manik enzim imo-
bil selama waktu operasi.
Dalam penelitian ini, suhu dijaga tetap dengan menggunakan jaket pemanas. Sedangkan pH diatur dengan penambahan buffer asetat ke dalam substrat pada awal proses. Meskipun demikian, masih dimung- kinkan adanya perubahan suhu dan pH optimal. Per-
ubahan pH dapat terjadi karena hanya dilakukan pe- ngaturan pada awal proses. Peningkatan suhu dapat menyebabkan enzim terdenaturasi, sedangkan perubah- an pH akan mengubah keadaan ion-ion pada enzim se- hingga dapat merusak enzim. ~ e r k i k i s n ~ a manik en- zim imobil karena lama waktu operasi, akan mem- pengaruhi stabilitas enzim. Disamping ketiga penye- bab di atas, pengaruh lingkungan luar seperti adanya racun yang berasal dari substrat, juga dapat merusak enzim.
Stabilitas operasi enzim inulinase imobil dapat diketahui dengan menghitung umur tengah en- zim. Chibata (1978) mengatakan bahwa umur tengah enzim dapat ditentukan dengan rumusan :
2 . 3 0 3
kd = Log
-
Eo...
(15)dimana : t = waktu operasi (jam)
kd = konstanta pengurangan aktivitas enzim Et = aktivitas enzim pada jam ke-t
Eo = aktivitas enzim awal
Dengan menggunakan persamaan (15) dan persa- maan (16), dapat dicari umur tengah enzim imobil
seperti pada Tabel 4.
Tabel 4. Hasil perhitungan umur tengah enzim imobil
. Umur Tengah Enzim Imobil(jam) Jam ke-
Konst.Enzim 2%S Konst.Enzim 4%S
[image:73.608.158.535.89.600.2]3 . p r o d u k t i v i t a s R e a k t o r Sinambung Unggun Terkemas
Guna mempelajari kinerja ("performance") reak- tor sinambung unggun terkemas dengan menggunakan enzim imobil, dihitung produktivitas reaktor pada konsentrasi enzim 2 persen dan 4 persen substrat (v/w). Data perhitungan selengkapnya terdapat pada Lampiran 10. Luong dan Tseng (1981) merumuskan pro- duktivitas (PR) sebagai :
F = laju alir (ml.menit-l)
P = konsentrasi fruktosa (mg.ml-I)
V = volume reaktor yang terisi substrat (ml)
Pada Gambar 25, terlihat bahwa produktivitas tertinggi adalah sebesar 0.34 1 mg
.
ml-l .
menit-' yang tercapai pada laju dilusi 0.20/jam dan konsen- trasi enzim 4 persen. Secara keseluruhan, terdapat kecenderungan bahwa produktivitas reaktor dengan menggunakan enzim imobil pada konsentrasi 4 persenLaju
Dilusi
(I/jam)
G a m b a r 25. G r a f i k perbandingan produktivitas r e a k t o r sinambung unggun terkemas dengan mengguna- k a n enzim inulinase imobil pada konsentrasi
[image:75.595.50.518.69.668.2]reaksi mempengaruhi pembentckan kompleks enzim-sub- strat (ES) yang selanjutnya akan mempengaruhi kece-
patan pembentukan produk.
Disamping itu, terdapat kecenderungan bahwa dengan meningkatnya laju dilusi, produktivitas reaktor akan semakin tinggi. Ini juga berarti bah- wa semakin lama waktu tinggal dalam reaktor, pro- duktivitas reaktor akan sezakin rendah. Hal ini dapat terjadi karena pada ~ a k t u tinggal reaktor rendah, telah terjadi konversi produk per satuan waktu yang tinggi, dan jika waktu tinggal dalam reaktor diperpanjang, maka produk yang terbentuk akan meningkatkan kecepatan terjadinya reaksi ba- lik.
4 . Produktivitas Penggunaan Enzim (PPE) pada Reaktor
Sinambung Unggun Terkemas
Guna mempelajari tingkat efisiensi penqgunaan enzim pada reaktor sinambung unggun terkemas, di- bandingkan PPE pada reaktor sinambung unggun ter- kemas dan PPE pada reaktor curah.
PPE =
F = laju alir (rn1.nenj.t-l)
P = konsentrasi fruktosa (mg.ml-l)
T = waktu selang pengambilan contoh (menit)
JE = Jumlah enzim (ng)
[image:77.595.185.490.77.229.2]Data PPE pada reaktor sinambung unggun terke- mas untuk konsentrasi enzim 2 persen dan 4 persen substrat (v/w) dengan basis volume reaktor 1 liter dapat dilihat pada Lampiran lla dan llb.
Gambar 26 memperliha-tkan perbandingan PPE pada reaktor sinambung unggun terkemas untuk konsentrasi enzim 2 persen substrat (v/w) untuk empat macam laju dilusi yang digunakan dengan PPE pada reaktor curah. Sedangkan Gambar 27 memperlihatkan perban- dingan PPE pada reaktor sinambung unggun terkemas untuk konsentrasi enzim 4 persen substrat (v/w) dengan PPE pada reaktor curah.
0 0.2 0.4 0.6 0.8 1 1.2 1.4 1.6 1.8 2
[image:78.595.51.517.68.597.2]Penggantian Volume
Gambar 26. Perbandingan P P E pada reaktor sinambung unggun terkemas untuk konsentrasi enzim
Penggantian Volume
Gambar 2 7 . Perbandingan PPE pada reaktor sinambung unggun terkemas untuk konsentrasi enzim
Untuk konsentrasi enzim 2 persen substrat (v/w), PPE tertinggi dicapai pada laju dilusi 0.04/jam, yaitu 12.417 g fruktosa kumulatif/mg en- zim yang merupakan nilai 6.0 kali lebih tinggi di- bandingkan PPE pada reaktor curah. Untuk konsen- trasi enzim 4 persen substrat (v/w), PPE tertinggi dicapai pada laju dilusi 0.20/jam yaitu 7.444 g fruktosa kumulatif/mg enzim yang merupakan nilai
3.6 kali PPE pada reaktor curah.
5. Rendemen Imobilisasi (R)
Penampakan sistem imobilisasi pada reaktor unggun terkemas dapat diketahui dengan menghitung rendemen imobilisasi. Rendemen imobilisasi dinya- takan sebagai :
Produktivitas Reaktor
R = x 100%
Akt. Enzim Bebas
x
Jml Enzim Imobilisasidimana :
Produktivitas Reaktor = mg.
ml-l .
menit-'Aktivitas Enzim Bebas = mg. ml-' .menit-'. m g ~ - l Jumlah Enzim Imobilisasi = mgE
Hasil perhitungan rendemen imobilisasi dapat dilihat pada Tabel 5 di bawah ini.
Tabel 5 . Hasil perhitungan rendemen imobilisasi
Rendemen Imobilisasi ( % )
D( jam-')
[El = 2 %S [El = 4 %S
[image:81.605.150.533.93.662.2]Tampak pada Tabel 5 bahwa rendemen imobilisasi dari teknik imobilisasi yang digunakan relatif rendah. Rendemen tertinggi dicapai dengan melakukan laju dilusi 0.20/jam dengan menggunakan konsentrasi enzim 2 persen substrat (v/w) yaitu sebesar 14.54
V. KESIMPULAN DAN SARAN
A. KESIMPULAN
Hidrolisis inulin menggunakan reaktor sinambung unggun terkemas dengan substrat inulin umbi dahlia, memberikan perolehan sirup fruktosa tertinggi sebesar 102.287 mg.ml-I pada laju dilusi 0.20/jam (waktu ting- gal 5 jam) dan konsentrasi enzim 4 persen substrat (v/w). Pada konsentrasi enzim 2 persen substrat (v/w), kadar sirup fruktosa meningkat dengan semakin menurunnya laju dilusi, sedangkan pada konsentrasi en- zim 4 persen substrat (v/w) kadar sirup fruktosa me- ningkat sejalan dengan meningkatnya laju dilusi.
reaktor curah. Rendemen imobilisasi tertingqi sebesar 14.54 persen, yanq dicapai pada laju dilusi 0.20/jam (waktu tinggal 5 jam) dengan konsentrasi enzim 2 per-
sen substrat (v/w).
Semakin lama waktu operasi, aktivitas enzim imo- bil semakin berkurang. Sampai akhir waktu operasi (181 jam), aktivitas enzim imobil telah berkurang rata-rata sebesar 29 persen.
B. SARAN
Saran-saran yang diberikan berdasarkan hasil penelitian yanq telah dilakukan adalah :
1. Perbaikan pada metoda imobilisasi dengan teknik
penjeratan perlu dilakukan
,
misalnya dengan meng- gunakan matriks penjerat yanq lain dan menggunakanukuran manik yang optimal, mengingat rendemen imo- bilisasi yang diperoleh masih rendah dan penurunan aktivitas enzim imobil masih cukup besar.
2. Perlu dilakukan kajian lanjut dengan menggunakan waktu operasi yang lebih lama lagi, untuk lebih mengetahui tingkat stabilitas operasi.
DAFTAR PUSTAXA
Aiba, S., A.E. Humphrey dan N.F. Millis. 1973. Biochemi- cal Engineering. Academic Press, Inc., New York. AOAC. 1980. official Methods of Analysis of the Associa-
tion of Official Analytical Chemists. Washington. Barker, S.A. 1976. Process Biochem., December, 20-25. Bailey, J.E. dan D.F. Ollis. 1977. Biochemical Engi-
neering Fundamnetals. McGraw-Hill Kogakusha, Ltd., Tokyo.
Byun, S.M. dan B.M. Nahm. 1978. Production of fructose from Jerusalem artichoke by enzimatik hydrolysis. J. Food Sci. 43 : 1871.
Buckle, K.A., R.A. Edwards, G.H. Fleet dan M. Wootton. 1985. Food Science. DGHE dan IDP Publ., Kensington Australia.
BPS. 1990. Statistik Indonesia. BPS, Jakarta
Chibata, I. 1978. Immobilized Enzymes. Kodansha Ltd., Tokyo.
Cho, G.H., C.Y. Choi, Y.D. Choi dan M.H. Han. 1982. Ethanol production by immobilized yeast and its C02 gas effects in packed bed reactor. J. Chem. Tech. Biotechnol. 32 : 959-967.
Doty, T. dan Vanninen. 1979. The properties, manufacture and uses as an industrial raw material..
a
dalam G.Birch dan K.J. Parker (eds.). Sugar : Science and Technology. Appl. Sci. Publ., London.
Darnoko, D., M. Cheryan dan W.E. Artz. 1989. Saccharifi- cation of Cassava Starch in An Ultrafiltration Reac- tor. J. Enzyme Microb. Technol. 11 : ,154 - 159. Horitsu, H., S. Adachi, Y. Takahashi, K. Kawai dan Y.
Kawano. 1985. Production of citric acid by Asper- yillus niger immobilized in polyacrylamide gels. J.
Appl. Microb. Biotech. 22 : 8-12.
Kierstan, M.P.J. 1 9 7 8 . Production of fructose syrup from inulin containing plants. Biotechnol. Bioeng. XXX : 4 4 7 - 4 5 0 .
Kim, W.Y. dan S.M. Byun. 1 9 8 2 . Hydrolisis of inulin from Jerusalem artichoke by inulinase immobilized on ami- noethylcellulose. Enzyme Microb. Technol. J. 4 : 2 3 9 - 2 4 4 .
Klibanov, A.M. 1 9 8 3 . Immobilized enzymes and cells as practical catalyst. J. Science. 2 1 9 : 7 2 2 - 7 2 7 .
Lowry, O.H., N.J. Rosebrough, A.L. Farr dan W.H. Randal. 1 9 5 1 . J. Biol. Chem., 1 9 3 , 2 6 5 .
Laskin, A.I. 1 9 8 5 . Enzymes and Immobilized Cells in Bio- technology. The Benjamin/Cummings Publ. Company, Inc.
,
Canada.Luong, J.H.T. dan M.C. Tseng. 1 9 8 4 . Process and Technoeconomics of ethanol production by immobillized cells. Appl. Microbiol. Biotechnol. 1 9 : 2 0 7
-
2 1 6 . Liesbetini H. dan Nastiti S.I. 1 9 8 9 . Model AmobilisasiSel Menggunakan Kalsium Alginat Sebagai Matriks Po- limer. Laboratorium Bioindustri, PAU-Bioteknologi IPB, Bogor.
Miller, G.L. 1 9 5 9 . Use of dinitrosalycylic acid reagent for determination of reducing sugar. Anal. Chem. 3 1 : 4 2 6 - 4 2 8 .
Melrose, G.J.H. 1 9 7 1 . Rev. Pure Appl. Chem. 2 1 : 8 3 . Messing, R.A. (ed.). 1 9 7 5 . Immobilized Enzymes for In-
dustrial Reactor. Academic Press, New York.
Mayes, P.A., D.K. Granner, V.W. Rodwell dan D.W.JR. Mar- tin. 1 9 8 5 . Harper's Review of Biochemistry. Lange Medical Publ. Los Altos, California.
Mangunwidjaja,D. 1 9 8 9 . Dasar-dasar Bioteknologi. Agro- industri Press, Bogor.
Nakamura, T., S. Maruki, S. ~akatsu, S. Veda. 1978. - Di dalam Vandamm