ABSTRAK
UJI ZAT ANTIBAKTERI ISOLAT Lactobacillus DARI TEMPOYAK DURIAN (Durio zibethinus)
Oleh :
Robbi Surya Lesmana
Telah dilakukan isolasi Lactobacillus dari Tempoyak durian, kemudian diuji zat antibakteri isolat Lactobacillus tersebut terhadap bakteri uji E. coli dan S. Aureus selama tujuh hari. Hasil isolasi didapatkan tiga isolat Lactobacillus yang diberi kode L1, L2 dan L3. Karakterisasi isolat dilakukan dengan cara pengamatan warna koloni, bentuk koloni pada media agar tegak, pengecatan Gram,
pengamatan bentuk sel, uji motilitas, uji katalase dan pengukuran panjang dan lebar sel. Perbedaan ketiga isolat terdapat pada warna koloni, bentuk konfigurasi sel dan bentuk koloni pada media agar tegak. Untuk uji zat antibakteri digunakan metode difusi agar dengan pengulangan 3 kali, dari hasil uji zat antibakteri
dihasilkan zona bening terhadap kedua bakteri uji. Hasil perhitungan anara (α 1% dan 5%) terhadap E. coli, dengan perbedaan ketiga isolat dan waktu produksi zona bening yang dihasilkan tidak menunjukan signifikan, hal ini menunjukan
perbedaan isolat dan perbedaan waktu produksi tidak mempengaruhi kemampuan zat antibakteri. Namun interaksi antara waktu produksi dengan isolat menunjukan signifikan, hasil perhitungan BNT (α 1% dan 5%) L3 hari pertama (2,17 cm) berbeda signifikan dengan L3 hari keenam (1,73 cm) dan hari ketiga (1,73 cm). Hasil perhitungan anara (α 1% dan 5%) terhadap S. aureus pada perbedaan isolat dan waktu produksi tidak menunjukan perbedaan nyata, dan pada interaksi isolat dengan hari menunjukan perbedaan yang signifikan, namun setelah diuji lanjut dengan BNT tidak berbeda nyata. Dari ketiga isolat yang ditemukan ternyata tidak ada perbedaan yang signifikan dalam menghambat kedua bakteri uji setelah diuji dengan anara (α 1% dan 5%).
UJI ZAT ANTIBAKTERI ISOLAT Lactobacillus DARI TEMPOYAK DURIAN (Durio zibethinus Murr.)
(Skripsi)
Oleh :
Robbi Surya Lesmana 0517021061
JURUSAN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS LAMPUNG
Mahasiswa Jurusan Biologi FMIPA Unila
6. Alamat Mahasiswa : Jl. Proklamasi Raya no. 44 Cimone Tangerang, Banten
10. Alamat Orang Tua : Jl. Proklamasi Raya no. 44 Cimone, Tangerang, Banten
I. PENDAHULUAN
A. Latar Belakang
Tempoyak durian yang menjadi makanan khas daerah Lampung, merupakan aset daerah yang ternyata memiliki keunikan. Pembuatan tempoyak durian hanya dengan menambahkan garam pada dasar wadah yang digunakan daging buah durian. Menurut Yuliana dan Murhadi (2007), cara pembuatan tempoyak hanya menambahkan garam dengan konsentrasi 10-12,5 % lalu disimpan dan didiamkan, pada saat tempoyak disimpan dalam waktu yang relatif lama dapat terjadi pertumbuhan dan penyusutan beberapa mikroorganisma sehingga mempengaruhi rasa dan daya tahan tempoyak tersebut.
tersebut dapat dipergunakan oleh mikroorganisme untuk hidup, melakukan metabolisme dan fermentasi.
Menurut Ekowati (2000), dua buah isolat bakteri asam laktat yang didapat dari fermentasi tempoyak durian dapat membentuk asam organik.
Dijelaskan, pada isolat Lactobacillus B1 asam organik yang dihasilkan adalah asam laktat 0,4275%(v/v), asam asetat 0,017%(v/v), asam
propionate 0,0502%(v/v) dan asam butirat 0,01%(v/v). Sedangkan asam organik yang dibentuk oleh Lactobacillus B2 yaitu asam laktat
0,9242%(v/v) dan asam asetat 1,1924 %(v/v).
Riani dkk (2005), melaporkan bahwa Lactobacillus menghasilkan anti bakteri, supernatan antibakteri yang didapatkan ternyata mampu menghambat pertumbuhan bakteri patogen. Ogunbanwo (2003) memberitahukan bahwa Lactobacilluc brevis OG1 dapat menghasilkan metabolit berupa bakteriosin, dan aktivitas bakteriosin terbaik
menggunakan media MRS + Yeast Ekstract (3%). Menurut Purwoko (2007) metabolit yang dihasilkan mikroorganisme dapat mempengaruhi lingkungan sekitarnya.
Pada penelitian yang dilakukan oleh Rahmadi (2006), Kultur Lactobacillus brevis AE 1.6 dan Lactobacillus plantarum Pi28a diuji terhadap S. Aureus
dihasilkan zona hambat sebesar 14,35 mm untuk kultur Lactobacillus brevis AE 1.6s, dan kultur Lactobacillus plantarum Pi28a sebesar 13,05
3
Pada Lactobacillus yang diisolasi dari susu kuda sumbawa, 24 dari 36 isolat yang didapatkan mempunyai spektrum antimikroba yang luas, karena dapat menghambat bakteri gram positif dan gram negatif, namun setelah dinetralkan pHnya dengan NaOH, tidak dihasilkan zona bening. Beberapa Lactobacillus yang diisolasi dari susu kuda sumbawa tersebut mampu memproduksi bakteriosin, sehingga ketika pH media dinetralkan masih dapat menghambat bakteri yang uji ( Sujaya, Ramona, Widarini, Suarini, Dwipayanti, Nocianitri, Nursini, 2008).
Data tentang kemampuan daya hambat isolat Lactobacillus dari tempoyak durian perlu dikaji lebih dalam agar diketahui kemampuannya
menghambat bakteri patogen, untuk mengetahuinya maka perlu dilakukan penelitian tentang kemampuan Lactobacillus yang diisolasi dari tempoyak terhadap bakteri sehingga dapat diketahui potensi isolat Lactobacillus dari tempoyak sebagai pengawet hayati.
B. Tujuan Penelitian
Penelitian ini bertujuan untuk :
1) Mengetahui daya antibakteri dari ekstrak antimikroba yang dihasilkan isolat Lactobacillus terhadap bakteri uji.
C. Manfaat Penelitian
Dapat digunakan sebagai informasi dalam penggunaan Lactobacillus sebagai pengawet hayati.
D. Kerangka Fikir
Lactobacillus adalah bakteri penghasil asam laktat yang bersifat
heterofermentatif. Menurut Jenie (1996), produk bakteri asam laktat yang bersifat heterofermentatif adalah asam laktat, asam asetat, CO2 dan etanol
dalam jumlah yang besar. Bakteri asam laktat yang bersifat
homofermentatif mengubah 95% glukosa atau heksosa menjadi asam laktat dan sejumlah kecil CO2 serta asam-asam volatil. Ogunbanwo
(2003) menjelaskan bahwa Lactobacillus dapat memproduksi beberapa senyawa, seperti asam laktat, diasetil, hidrogen peroksida dan bakteriosin selama proses fermentasinya.
Hasil fermentasi Lactobacillus yang berupa senyawa asam organik dan alkohol berpotensi dapat menghambat pertumbuhan bakteri lain. Bahkan dapat digunakan sebagai perkusor untuk membentuk senyawa antibakteri tertentu. Banyak antibakteri diproduksi pada proses metabolisme
5
Fermentasi yang terjadi terus-menerus dapat mengakibatkan akumulasi produk fermentasi, sehingga bila dihasilkan antibakteri maka dapat
meningkatkan daya bunuh antibakteri tersebut. Metabolit sekunder berupa asam organik maupun alkohol dihasilkan pada saat fase stationer, fase stationer yang lama dapat meningkatkan jumlah produk metabolit skunder, sehingga dapat terjadi akumulasi jumlah metabolit yang dihasilkan.
Pada proses pembuatan tempoyak dapat terjadi proses metabolisme dengan memanfaatkan bahan organik yang ada pada durian. Durian mengandung karbohidrat yang dapat dimetabolisme menjadi senyawa yang lebih sederhana seperti asam laktat ataupun senyawa lainnya. Pada penelitian Ekowati (2000) bakteri asam laktat yang terdapat dalam fermentasi tempoyak dapat menghasilkan asam organik. Lactobacillus tidak hanya melakukan fermentasi dan menghasilkan asam organik, dapat juga menghasilkan senyawa lain seperti alkohol atau protein. Pada penelitian yang dilakukan oleh Ogunbanwo (2003), dilaporkan bahwa Lactobacillus yang ditumbuhkan pada media MRS + Yeast ekstrak 3%
dapat menghasilkan aktivitas bakteriosin sebesar 6400 AU/ml.
Waktu fermentasi juga dapat mempengaruhi produk fermentasi, sehingga akumulasi antibakteri yang difermentasi oleh Lactobacillus dapat
mempengaruhi daya bunuh terhadap bakteri.
E. Hipotesis
Hipotesis yang diajukan pada penelitian ini adalah :
1. Isolat Lactobacillus dari tempoyak durian dapat menghasilkan zat antimikroba yang dapat menghambat bakteri uji.
II. TINJAUAN PUSTAKA
A. Antibiotik
Antibiotik merupakan komponen alami ataupun sintetik yang dapat membunuh bakteri, terdapat banyak jenis antibiotik yang bekerja secara berbeda terhadap bakteri, biasanya antibiotik tidak bekerja langsung terhadap virus. Antibiotik dihasilkan oleh bakteri, organisme eukaryotik, termasuk tanaman. Biasanya dihasilkan untuk melindungi diri dan membunuh bakteri lain (Lerner, K. Lee and Lerner, Brenda Wilmoth, 2003).
Meskipun ada lebih dari 100 macam antibiotik, namun umumnya mereka berasal dari beberapa jenis antibiotik saja, sehingga mudah untuk dikelompokkan. Ada banyak cara untuk menggolongkan antibiotik (Lerner, 2003).
Berdasarkan struktur kimianya, menurut Glazer (2007), antibiotik dikelompokkan sebagai berikut:
a) Golongan Aminoglikosida. Diantaranya amikasin, dibekasin, gentamisin, kanamisin, neomisin, netilmisin, paromomisin, sisomisin, streptomisin, tobramisin.
sefuroksim, sefadroksil, seftazidim), golongan beta-laktam monosiklik, dan golongan penisilin (penisilin, amoksisilin).
c) Golongan Glikopeptida. Diantaranya vankomisin, teikoplanin, ramoplanin dan dekaplanin.
d) Golongan Poliketida. Diantaranya golongan makrolida (eritromisin, azitromisin, klaritromisin, roksitromisin), golongan ketolida (telitromisin), golongan tetrasiklin (doksisiklin, oksitetrasiklin, klortetrasiklin).
e) Golongan Polimiksin. Diantaranya polimiksin dan kolistin. f) Golongan Kinolon (fluorokinolon). Diantaranya asam nalidiksat,
siprofloksasin, ofloksasin, norfloksasin, levofloksasin, dan trovafloksasin. g) Golongan Streptogramin. Diantaranya pristinamycin, virginiamycin,
mikamycin, dan kinupristin-dalfopristin.
h) Golongan Oksazolidinon. Diantaranya linezolid dan AZD2563. i) Golongan Sulfonamida. Diantaranya kotrimoksazol dan trimetoprim. j) Antibiotika lain yang penting, seperti kloramfenikol, klindamisin dan asam
fusidat.
B. Aksi Antibiotik
9
ketika pertahanan dari inang tidak mampu atau tidak dapat menghancurkan bakteri patogen maka pemberian bakteriosidal dapat membunuh mikroba patogen dengan beberapa kondisi tertentu yang berkaitan, seperti konsentrasi bakteriosidal tersebut (Nester, Denise, Evans, Martha, 2009).
C. Spektrum Antibiotik
Antibiotik dapat membunuh atau menghambat mikroorganisme, beberapa membunuh atau menghambat mikroba dengan spektrum sempit, misalnya hanya membunuh bakteri gram positif saja, sedangkan beberapa mempengaruhi dengan spektrum luas, secara umum dapat disebut membunuh bakteri Gram positif dan negatif. Antibiotik dengan efek yang luas disebut broad spectrum
antimicrobials. Antibiotik jenis ini sangat penting dalam kehidupan karena
secara halus dapat membunuh segala jenis mikroba jika diperlukan dalam keadaan yang mendesak tanpa perlu mengetahui penyebab mikroba tersebut hadir. Kekurangan dari antibiotik berspektrum luas ini adalah berimbas pada semua bakteri yang ada, dapat juga membunuh flora normal yang seharusnya ada, ataupun membunuh bakteri yang ternyata sangat diperlukan. Antibiotik dengan daya bunuh sempit atau biasa disebut narrow spectrum antimicrobials,
memerlukan identifkasi terlebih dahulu untuk mengetahui daya bunuhnya dan kepekaannya terhadap bakteri patogen (Nester dkk, 2009).
Sel bakteri Gram negatif mempunyai perlindungan pada membran terluarnya. solute kecil yang berukuran kurang dari 1000 dalton, melintangi dinding permeabilitasnya yang menjadi penghalang utama berupa protein yang biasa disebut porin. Porin sangat sempit untuk dilewati senyawa termasuk antibiotik, difusi melalui porin dengan ukuran lebih dari 1000 dalton sangat sulit terjadi. Begitu pula pada chanel permeabilitas berisi udara pada membran bilayer, sulit dilewati karena bagian luarnya diseliputi selaput molekul lipid. Berbeda dengan Gram positif, lebih mudah dilewati membranya oleh antibiotik berukuran besar sekalipun (Glazer, 2007).
D. Mekanisme Antibiotik
Antibiotik dapat menghambat kerja reaksi. Reaksi tersebut ada yang penting untuk pertumbuhan sehingga menggangu pertumbuhan mikroba. Penghambatan pada beberapa reaksi dapat terjadi secara langsung, yaitu antibiotik langsung memblokir beberapa reaksi tersebut, namun masing-masing reaksi memerlukan konsentrasi antibiotik yang berbeda. Ketergantungan pada konsentrasi ini menggambarkan perbedaan kepekaan reaksi tersebut terhadap antibiotik (Glazer, 2007).
Menurut Nester dkk (2009) mekanisme aksi antibiotik ada 4 poin, yaitu :
1. Menghambat sintesis dinding sel
Dinding sel bakteri sangat unik, karena mengandung peptidoglikan. Ada
11
menyebabkan sel lisis (Purwoko, 2007). Antibiotik ini meliputi penisilin, sepalosporin, sikloserin, vankomisin, ristosetin dan basitrasin. Antibiotik ini menghambat sintesis dinding sel terutama dengan mengganggu sintesis peptidoglikan. Dinding sel bakteri menentukan bentuk karakteristik dan
berfungsi melindungi bagian dalam sel terhadap perubahan tekanan osmotik dan kondisi lingkungan lainnya. Di dalam sel terdapat sitoplasma dilapisi dengan membran sitoplasma yang merupakan tempat berlangsungnya proses biokimia sel. Dinding sel bakteri terdiri dari beberapa lapisan. Pada bakteri Gram positif struktur dinding selnya relatif sederhana dan Gram negatif relatif lebih komplek. Dinding sel bakteri Gram positif tersusun atas lapisan peptidoglikan yang relatif tebal, dikelilingi lapisan teichoic acid dan pada beberapa species mempunyai lapisan polisakarida. Dinding sel bakteri Gram negatif mempunyai lapisan peptidoglikan relatif tipis, dikelilingi lapisan lipoprotein, lipopolisakarida, fosfolipid dan beberapa protein (Hardy, 2002).
Menurut Pabio (2009), peptidoglikan merupakan komponen yang menentukan kelenturan dinding sel pada Gram positif dan berperanan pada integritas Gram negatif. Gangguan pada sintesis komponen ini dapat menyebabkan sel lisis dan dapat menyebabkan kematian sel. Antibiotik yang menyebabkan gangguan sintesis lapisan ini aktivitasnya akan lebih nyata pada bakteri gram positif. Aktivitas menghambatan atau membunuh hanya dilakukan selama pertumbuhan sel dan aktivitasnya dapat ditiadakan dengan menaikkan tekanan osmotik media untuk mencegah pecahnya sel. Bakteri tertentu seperti mikobakteria dan
Selama mensintesis peptidoglikan, sel memerlukan enzim hidrolase dan sintetase. Untuk menjaga sintesis supaya normal, kerja kedua enzim ini harus seimbang satu sama lain. Biosintesis peptidoglikan berlangsung dalam beberapa stadium dan antibiotik pengganggu sintesis peptidoglikan aktif pada stadium yang berlainan. Sikloserin terutama menghambat enzim racemase dan sintetase yang berperan dalam pembentukan dipeptida. Vankomisin bekerja pada stadium kedua diikuti oleh basitrasin, ristosetin dan diakhiri oleh penisilin dan sefalosporin yaitu menghambat transpeptidase (Hardy, 2002).
2. Menghambat sintesis protein
Penghambatan sintesis protein dapat berlangsung di dalam ribosom. Menurut Nester dkk (2009), berdasarkan koefisien sedimentasinya, ribosom
di-kelompokkan dalam 3 grup.
a) Ribosom 80s, terdapat pada sel eukariot. Partikel ini terdiri dari subunit 60s dan 40s.
b) Ribosom 70s, didapatkan pada sel prokariot dan eukariot. Partikel ini terdiri dari subunit 50s dan 30s.
c) Ribosom 55s, hanya terdapat pada mitokondria mamalia dan menyerupai ribosom bakteri baik fungsi maupun kepekaannya terhadap antibiotik.
13
mekanisme kerja seperti ini mempunyai daya antibakteri sangat kuat. Antibiotik kelompok ini meliputi aminoglikosid, makrolid, linkomisin, tetrasiklin,
kloramphenikol, novobiosin, puromisin (Nester dkk, 2009).
Penghambatan biosintesis protein pada sel prokariot ini bersifat sitostatik, karena mereka dapat menghentikan pertumbuhan dan pembelahan sel. Bila sel
dipindahkan ke media bebas antibiotik, mereka dapat tumbuh kembali setelah antibiotik berkurang dari sel kecuali streptomisin yang mempunyai aktivitas bakterisid. Pengaruh zat ini terhadap sel eukariot diperkirakan sitotoksik. Beberapa penghambat ribosom 80s seperti puromisin dan sikloheksimid sangat toksik terhadap sel mamalia, oleh karena itu tidak digunakan untuk terapi, sedang tetrasiklin mempunyai toksisitas relatif kecil bila digunakan oleh orang dewasa. Tetrasiklin menghambat biosintesis protein yang terdapat pada ribosom 80s dan 70s. Erytromisin berikatan dengan ribosom 50s. Streptomisin berikatan dengan ribosom 30s dan menyebabkan kode mRNA salah dibaca oleh tRNA, sehingga terbentuk protein abnormal dan non fungsionil (Hardy, 2002).
3. Menghambat sintesis asam nukleat
namun antibiotik yang mempunyai mekanisme kegiatan seperti ini pada
umumnya kurang selektif dalam membedakan sel bakteri dan sel mamalia (Pabio, 2009).
Menururt Hardy (2002), antibiotik yang mempengaruhi sintesis asam nukleat dan protein mempunyai mekanisme kegiatan pada tempat yang berbeda, antara lain :
a) Mempengaruhi replikasi DNA, seperti bleomisin, phleomisin, mitomisin, edeine dan porfiromisin.
b) Mempengaruhi transkripsi, seperti aktinomisin, kromomisin, ekonomisin, rifamisin, korisepin dan streptolidigin.
c) Mempengaruhi pembentukan aminoacyl-tRNA, seperti borrelidin. d) Mempengaruhi translasi, antara lain kloramphenikol, streptomisin,
neomisin, kanamisin, karbomisin, crytromisin, linkomisin, dan tetrasiklin.
Antibiotik yang mempengaruhi sintesis protein dan asam nukleat, mayoritas aktif pada bagian translasi dan di antara mereka banyak yang berguna dalam terapi. Karena mekanisme translasi antara sel bakteri dan sel eukariot berbeda, maka mungkin mereka memperlihatkan toksisitas selektif (Hardy, 2002).
4. Menghambat jalur metabolime utama
Beberapa antibiotik mempunyai cara membunuh dan menghambat dengan
15
menginisiasi sintesis dari asam folat dan akhirnya menghambat sintesis koenzim untuk biosintesis nukleotida. Sel hewan akan kekurangan enzim saat sintesis asam folat yang merupakan bagian dari jalur metabolisme (Nester dkk, 2009).
E. Metoda Difusi Antibiotik
Metoda difusi antibiotik ini disebut metoda Kirby-Bauer. Pertama diberikan konsentrasi bakteri standar disebar pada permukaan agar dengan metoda spread plate, kemudian pada permukaan tersebut diberikan disc yang memenuhi
konsentrasi yang berbeda, selama inkubasi maka zat antibiotik akan keluar dari disc yang membentuk gradien konsentrasi sekitar disc tersebut. Sementara itu perbanyakan sel akhirnya akan membentuk lapisan pada permukaan media kecuali daerah sekitar disc yang telah terdifusi oleh antibiotik pertumbuhnnya akan
terhambat atau mati. Daerah itu disebut zona bening. Ukuran zona merupakan pengaruh dari karakteristik antibiotik (Nester dkk, 2009).
Metode difusi ini biasa digunakan untuk menentukan kepekaan pemberian antibiotik terhadap bakteri. Metode ini digunakan untuk mengetahui efek menghambat atau membunuh suatu antibiotik terhadap bakteri. Antibiotik yang diletakan akan berdifusi pada agar dan membentuk jarak dari tengah tempat antibiotik diberikan. Diameter yang dihasilkan merupakan zona yang
F. Tempoyak
Tempoyak oleh penduduk di Sumatera Selatan dinamakan Asinan durian. Tempoyak merupakan makanan yang biasanya dikonsumsi sebagai lauk. Tempoyak juga dapat dimakan langsung dan dijadikan bumbu masakan.
Tempoyak merupakan makanan hasil olahan buah durian yang diperoleh dengan cara fermentasi sederhana, bentuknya berupa bubur daging durian dengan rasa asam. Tempoyak dibuat hanya dengan penambahan garam sebanyak 10 - 12,5% ke dalam daging buah yang kemudian diperam beberapa hari sesuai keinginan (Widianarko, Pratiwi, Retnaningsih. 2000).
Tempoyak merupakan salah satu bentuk pengawetan dari buah durian. Karena Salah satu kesulitan dalam penanganan buah durian adalah sifatnya yang mudah rusak, sehingga tidak tahan disimpan lama. Dalam bentuk utuh berkulit, daging buah durian yang telah masak, umumnya mempunyai daya tahan selama 4 - 6 hari (Widianarko dkk, 2000).
Pada pembuatan tempoyak terjadi proses fermentasi yang melibatkan
mikroorganisme yang menghasilkan asam laktat (Ekowati, 2000). Bakteri asam laktat menjadi mungkin berada pada tempoyak, karena perubahan rasa pada tempoyak yang menjadi masam saat fermentasi.
G. Lactobacillus
Lactobacillus termasuk golongan bakteri asam laktat yang sering dijumpai pada
makanan fermentasi, produk olahan ikan, daging, susu, dan buah-buahan
17
termasuk bakteri Gram positif, berbentuk batang, tidak membentuk spora tetapi mendapatkan energi dari pengubahan glukosa menjadi gula lain seperti laktosa. Nama Lactobacillus diberikan karena kekhususannya dalam memetabolisme gula (Lerner, 2003).
Genus bakteri ini membentuk sebagian besar dari kelompok bakteri asam laktat, dinamakan demikian karena kebanyakan anggotanya dapat merubah laktosa dan gula lainnya menjadi asam laktat. Pada manusia, bakteri ini dapat ditemukan didalam vagina dan sistem pencernaan, mereka bersimbiosis dan merupakan sebagian kecil dari flora usus. Banyak spesies dari Lactobacillus memiliki kemampuan membusukkan materi tanaman yang sangat baik. Produksi asam laktatnya membuat lingkungan sekitarnya bersifat asam dan mengganggu pertumbuhan beberapa bakteri merugikan. Beberapa anggota genus ini telah memiliki genom sendiri (Lerner, 2003).
Sejauh ini telah diketahui bahwa keberadaan bakteri ini tidak bersifat patogen dan aman bagi kesehatan sehingga sering digunakan dalam industri pengawetan makanan, minuman dan berpotensi sebagai produk probiotik. Sifat yang menguntungkan dari bakteri Lactobacillus dalam bentuk probiotik adalah dapat digunakan untuk mendukung peningkatan kesehatan. Bakteri probiotik berperan sebagai flora normal dalam sistem pencernaan. Fungsinya adalah untuk menjaga keseimbangan asam dan basa sehingga pH dalam kolon konstan (Riani,
Riani dkk, (2005) melaporkan bahwa Lactobacillus menghasilkan anti bakteri. Lactobacillus dapat menghambat pertumbuhan bakteri patogen Streptococcus,
Staphylococcus aureus, dan Escerichia coli, bahkan supernatan yang disimpan
selama 6 bulan memiliki kemampuan sama. Lactobacillus juga mampu
menghambat pertumbuhan bakteri lain yang merugikan atau patogen. Goldin dan Gorbach (1992) mengatakan bahwa beberapa substansi antibiotik yang dihasilkan bakteri probiotik, misalnya L. acidophilus menghasilkan asidotin, asidophilin, bakteriosin, laktosidin, L. bulgaricus menghasilkan bulgarican, L. plantarum menghasilkan laktolin, L. brevis menghasilkan laktobullin dan laktobrevin, dan L. reuteri menghasilkan rauterin.
H. Bakteri Uji
Pada penelitian ini bakteri uji yang dipakai adalah E. coli yang mewakili bakteri Gram negatif dan S. aureus yang mewakili bakteri Gram positif. Kedua bakteri ini dianggap mewakili bakteri yang diklasifikasikan berdasarkan Gram. Kedua bakteri uji ini berasal dari isolasi murni yang didapatkan dari fakultas kedokteran Unila.
19
polisakarida dan dilindungi oleh lapisan lipid yang tidak dapat mempertahankan Kristal violet pada pewarnaan Gram (Lerner, 2003).
Jenis dinding sel berdasarkan Gram ternyata berpengaruh terhadap kepekaan antibiotik. Diketahui bahwa bekteri Gram positif atau negatif menentukan tipe antibiotik yang cocok untuk menyerang bakteri tersebut, karena kerja antibiotik salah satunya menyerang dinding sel (Lerner, 2003).
Staphylococcus aureus adalah kelompok bakteri Gram positif yang termasuk
genus staphylococcu. beberapa infeksi disebabkan oleh genus ini. Escherichia coli adalah bakteri kelompok Gram negatif yang biasa hidup pada saluran
III. METODE PENELITIAN
A. Tempat Dan Waktu Penelitian
Isolasi Lactobacillus dan uji zat antibakteri Lactobacillus dilaksanakan di Laboratorium Mikrobiologi dan Laboratorium Molekuler Jurusan Biologi FMIPA Unila dimulai bulan Januari 2010 sampai maret 2010.
B. Alat dan bahan
Alat-alat yang digunakan dalam penelitian ini yaitu, tabung reaksi, cawan petri, Erlenmeyer ukuran 500 ml, 100 ml dan 50 ml, ose, spatula, neraca, gelas objek, gelas ukur, mikroskop, mikro pipet, pipet effendorf, microtube, Bunsen, laminar airflow, autoklav, inkubator dengan suhu 370 C, pipet tetes, dan
peralatan lainnya.
Bahan yang digunakan adalah tempoyak durian, media MRS Broth, media NB (Nutrient Broth), agar batangan, cat Gram, akuades, H2O2 3%, alkohol 96%
21
C. Metode Penelitian
Ekstrak antibakteri yang dihasilkan selama 7 hari berturut-turut akan diuji daya antibakterinya. Bakteri uji dalam penelitian ini adalah E. Coli (Gram negatif), dan S.aureus (Gram positif). Metode uji daya antibakteri yang digunakan adalah metode Kirby-Bauer, yaitu metode difusi antibiotik menggunakan sumur (Nester dkk, 2009). Kemampuan zat antibakteri akan terlihat dari besar diameter zona bening yang dihasilkan.
D. Rancangan Percobaan
Rancangan percobaan yang dipakai dalam penelitian yaitu menggunakan rancangan acak kelompok dengan pengulangan 3 kali. Pengamatan dilakukan terhadap diameter zona bening yang dihasilkan pada masing-masing produksi zat antibakteri.
E. Variabel yang diamati
Variabel yang diamati atau diukur dalam penelitian ini adalah diameter zona bening yang dihasilkan ekstrak antibakteri isolat Lactobacillus terhadap bakteri uji.
F. Prosedur Kerja
Prosedur kerja pada penelitian ini terbagi menjadi 3 bagian yaitu, isolasi Lactobacillus dari tempoyak kemudian karakterisasi Lactobacillus dan uji zat
1. Isolasi Lactobacillus dari tempoyak
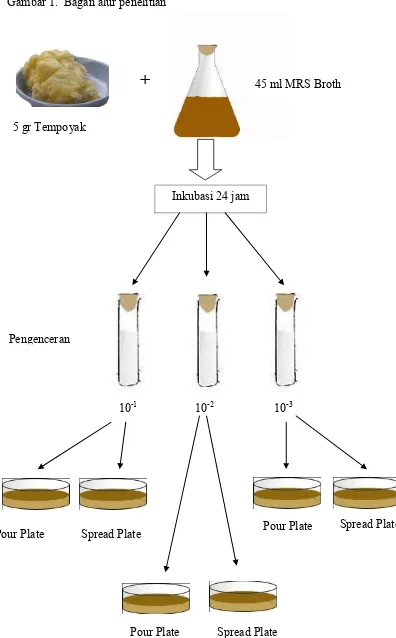
Media yang digunakan untuk isolasi adalah MRS Broth dan MRS agar. a) Lima gram tempoyak dimasukan dalam 45 ml MRS broth,
dihomogenkan lalu diinkubasi selama 1 hari dengan suhu 37o C.
b) Setelah inkubasi dibuat seri pengenceran 10-1, 10-2 dan 10-3 menggunakan akuades steril lalu dihomogenkan.
c) Masing-masing pengenceran diinokulasi dengan cara tabur (pour plate) dan sebar (spread plate) dalam cawan petri, kemudian
diinkubasi kembali selama 1 hari pada suhu 37o C.
2. Pemurnian Lactobacillus
Tiap koloni hasil pour plate dan spread plate dimurnikan untuk memastikan bahwa bakteri yang didapat tidak bercampur. Pemurnian dilakukan dengan cara :
a) Menginokulasi koloni yang dianggap Lactobacillus pada media MRS agar miring.
b) Lalu diinkubasi salama 24 jam dengan suhu 370 C, koloni yang tumbuh kemudian dikarakterisasi.
3. Karakterisasi Lactobacillus
23
a) Morfologi koloni. Melihat bentuk koloni dan warna koloni b) Uji katalase, Satu koloni diambil dengan ose dan diletakan pada
gelas objek lalu ditetesi H2O2 3%. Jika terbentuk gelembung gas
itu menandakan katalase positif. Lactobacillus bersifat katalase negatif maka ketika diteteskan H2O2 3% tidak timbul gelembung
gas.
c) Pengecatan Gram, Lactobacillus adalah bakteri yang bersifat gram positif (berwarna ungu).
d) Bentuk sel, melihat bentuk sel pada mikroskop, Lactobacillus berbentuk batang.
e) Uji motilitas, satu koloni diambil menggunakan ose runcing, lalu ditumbuhkan pada media MRS tegak kemudian diinkubasi. Jika pertumbuhan koloni menyebar menunjukan motil. Lactobacillus bersifat motil.
f) Pengukuran isolat, isolat lactobacillus diukur menggunakan mikrometer yang ditambahkan pada mikroskop.
4. Penyiapan starter
5. Produksi zat antibakteri Lactobacillus
a) Sebanyak 5 ml starter dimasukan ke dalam 45 ml MRS broth pada Erlenmeyer 100 ml.
b) Lalu diinkubasi pada inkubator dengn suhu 370 C.
c) Setelah itu setiap harinya selama 7 hari diambil kultur sebanyak 1 ml kemudian dimasukan kedalam microtube.
d) Kultur disentrifuge dengan kecepatan 11000 rpm selama 5 menit. e) Supernatan yang didapat adalah ekstrak antibakteri yang akan diuji.
6. Uji zat antibakteri
Setelah didapat supernatan, lalu diuji terhadap bakteri uji.
a) Satu ose bakteri uji diinokulasi ke dalam tabung reaksi yang berisi 5 ml aquades steril, kemudian divortek.
b) Kemudian sebanyak 1 ml bakteri uji dimasukan pada cawan petri setelah itu ditambahkan 25 ml NA steril, dihomogenkan, lalu tunggu media hingga padat.
c) Setelah padat dibuat lubang untuk sumur dengan diameter 1 cm. Lalu dibuat tiga buah garis diluar cawan petri yang melintang daerah tengah diameter sumur. Kemudian dimasukan sebanyak 100 µl supernatan antibakteri.
d) Kultur diinkubasi selama 1 hari pada suhu 370 C, setelah itu diukur diameter zona bening yang dihasilkan pada garis yang telah dibuat menggunakan penggaris.
25
G. Analisis Statistika
Diagram Alir
Isolasi Lactobacillus dari Tempoyak
Pemurnian Isolat Lactobacillus
Karakterisasi Isolat Lactobacillus
Pembuatan starter untuk produksi zat antibakteri
Produksi zat antibakteri pada media produksi
Uji zat antibakteri
Pengambilan data
27
Gambar 1. Bagan alur penelitian
+
5 gr Tempoyak
45 ml MRS Broth
Inkubasi 24 jam
10-1 10-2 10-3
Pengenceran
Pour Plate
Pour Plate
Pour Plate Spread Plate
Pemurnian
Mendapatkan isolat Lactobacillus
Peremajaan pada agar miring
1 Ose
+
25 ml MRS BrothInkubasi 1 hari
Starter
29
Starter
Media Produksi 45 ml MRS Broth 5 ml starter
Inkubasi selama 7 hari
V. SIMPULAN DAN SARAN
A. Simpulan
Dari hasil penelitian yang telah dilakukan, maka didapatkan kesimpulan sebagai berikut:
1. Didapatkan tiga Lactobacillus pada tempoyak durian dan diberi kode L1, L2 dan L3. Perbedaan isolat terdapat pada warna koloni, L1 dan L2 berarna putih kekuningan sedangkan L3 putih susu, bentuk koloni pada media agar tegak, L1 berbentuk flat, L2 filiform dan L3 beaded.
2. Isolat Lactobacillus menghasilkan zat antibakteri yang dapat menghambat bakteri uji E. coli dan S. Aureus.
3. Aktivitas antibakteri terbaik terhadap E. coli dihasilkan oleh ekstrak antibakteri isolat L2 dan L3 pada hari pertama sebesar 2,17 Cm,
sedangkan aktivitas terbaik antibakteri terhadap S. aureus dihasilkan oleh ekstrak antibakteri isolat L2 hari ketujuh sebesar 1,93 Cm.
42
B. Saran
Perlunya diadakan penelitian lanjutan untuk mengetahui jenis spesies apa yang telah berhasil diisolasi dari tempoyak durian, jenis antibakteri apa yang