EPOKSIDA MINYAK JARAK PAGAR SEBAGAI
PEMLASTIS FILM POLIVINIL KLORIDA
ASEP SAEFUROHMAN
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
i
Dengan ini saya menyatakan bahwa tesis “Epoksida Minyak Jarak Pagar Sebagai
Pemlastis Film Polivinil Klorida” adalah karya saya dengan arahan dari komisi
pembimbing dan belum pernah diajukan dalam bentuk apapun kepada perguruan
tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang
diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks
dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, September 2008
ii ABSTRACT
ASEP SAEFUROHMAN.Epoxidized Jatropha’s Oil as Plasticizer for Poly(vinyl) Chloride Film. Under direction of PURWANTININGSIH SUGITA, and SUMINAR S. ACHMADI.
The aims of this research were (1) to determine the optimum condition for epoxidation on jatropha’s oil through variations of temperature (T) and catalyst concentration at the same reaction time (t) of 12 hours, (2) to characterize the epoxidized products or plasticizer by the parameters of iodine number and oxirane number, as observed on the infrared spectra, (3) to determine the reaction order and the activation energy using kinetics studies, (4) to find the optimum blend of PVC and the epoxidized jatropha’s oil and in terms of tensile strength, elasticity, and elongation of the film, and (5) to characterize the film surface. The results showed that the optimum condition of synthesizing the plasticizer produced oxirane number of 4.2%. On the other hand, iodine number was significantly decreased to 2.6-15.3 times lower but the oxirane number was relatively high, 123.4-205.8 times higher than before the epoxidation. Analysis with response surface method showed that mathematical equation model for optimization was oxirane number of 17.8733 + 0.5498x + 1.2830y – 0.0039z – 0.1960xy – 0.004xz. The plasticizers that were characterized by Gas Chromatography-Mass Spectrometry showed a retention time of 14.809 corresponded to methyl cis-9.10– epoxyoleate (MW 312). The reactions was found to be first-order and rate constants for iodine number at temperature 50, 60, and 70 oC were 9.97 × 10-2, 3.4 × 10-2, 21.34 × 10-2
, respectively. On the other hand, the rate constants for oxirane number were 11.28 × 10-2, 4.39 × 10-2, 1.89 × 10-2
. The activation energy for iodine number and oxirane number were found to be 24.99 kcal/moland 82.296 kcal/mol,respectively. A series of polymer blends of poly(vinyl) chloride (PVC) and epoxidized jatropha’s oil were prepared and characterized. From tensile tests, it was found that the tensile strength decreasing with the increasing proportion of plasticizer. On the other hand, elongation and elasticity of the materials increased with the increasing amount of the plasticizer. Good plasticization effects of the PVC:epoxidized jatropha’s oil (7:3 ratio) were studied. The morphological of PVC film was characterized by scanning electron microscope and showed that the higher amount of plasticizers gave soft surface and more uniform pattern.
iii
Polivinil Klorida. Dibimbing oleh PURWANTININGSIH SUGITA, dan SUMINAR S. ACHMADI
Komponen penyusun plastik terdiri atas dua jenis, yaitu komponen utama berupa polimer (resin) yang merupakan komponen terbesar dari bahan plastik dan aditif. Aditif adalah komponen yang sangat penting pada plastik, walaupun hanya dalam jumlah sedikit tidak lebih dari 5%. Aditif digunakan pada plastik untuk meningkatkan sifat fungsionalnya seperti ketahanan terhadap api, kekuatan, dan fleksibilitas. Salah satu zat aditif paling penting adalah pemlastis (plasticizer). Pemlastis menguasai 65% dari 7.5 juta ton pasar zat aditif di dunia yang setara dengan US$7,6 miliar. Kegunaan utama, yaitu sekitar 90%, digunakan untuk polivinil klorida (PVC). Bahan pemlastis ditambahkan pada PVC agar tidak bersifat kaku dan rapuh dan pemlastis terbesar yang digunakan sekarang ini diambil dari kelompok senyawa ftalat (ester turunan dari asam ftalat). Pemlastis jenis ftalat seperti dietilheksil adipat (DEHA), dietilheksil ftalat (DEHP), dan dioktil ftalat (DOP) merupakan pemlastis berbahan dasar minyak bumi (petrokimia) yang dikategorikan berbahaya dan toksik.
Dampak negatif yang ditimbulkan mendukung lahirnya pencarian bahan alternatif sebagai substitusi pemlastis berbasis minyak bumi. Salah satu alternatif sebagai pensubstitusi adalah pemlastis berbasis minyak nabati. Minyak nabati memiliki keunggulan, karena dapat terurai secara alami dan mudah diperbaharui sehingga bersifat ramah lingkungan. Salah satu bahan pemlastis berbasis minyak nabati adalah minyak jarak pagar. Minyak jarak pagar mempunyai sifat fisik dan kimia yang mirip dengan minyak kedelai. Kandungan asam lemak takjenuhnya sekitar 46% yang didominasi asam takjenuh oleat. Senyawa ini berpotensi sebagai bahan dasar untuk membentuk pemlastis kelompok epoksida. Penelitian ini bertujuan untuk mengoptimumkan sintesis epoksida minyak jarak pagar melalui ragam suhu (T) dan konsentrasi katalis pada waktu (t) reaksi 12 jam, mencirikan pemlastis MJPE melalui bilangan iodin dan bilangan oksirana serta gugus fungsi dengan FTIR, menentukan persamaan kinetika reaksinya yang meliputi penentuan orde reaksi dan energi aktivasi (Ea), mengoptimumkan pencampuran antara PVC
dengan MJPE dan pencirian sifat reologi filmnya yang meliputi kuat tarik, elastisitas, dan elongasi, dan mencirikan film guna melihat tekstur dan transisi kacanya (Tg). Tahapan penelitian meliputi optimalisasi sintesis dan pencirian
pemlastis minyak terepoksidasi. Pada optimalisasi epoksidasi minyak jarak pagar menggunakan dua peubah, yaitu suhu reaksi dan konsentrasi katalis pada waktu reaksi tetap 12 jam. Selanjutnya penentuan nilai Ea epoksidasi dilakukan pada
kondisi konsentrasi katalis optimum, waktu reaksi 12 jam, pada ragam suhu 50, 60, dan 70 oC. Melalui pengolahan nilai bilangan iodin dan oksirana setiap suhu didapatkan parameter kinetika, yaitu orde reaksi dan tetapan laju reaksi (k), yang akan berguna untuk perhitungan energi aktivasi (Ea). Sementara itu aplikasi MJPE
iv
Pencarian kondisi optimum dilakukan dengan terlebih dahulu mengukur parameter kimia keadaan bahan MJP. Parameter yang diukur meliputi bilangan iodin, bilangan oksirana, dan bilangan peroksida. Hasil pengukuran awal ketiga parameter tersebut menghasilkan nilai bilangan iodin, 97.4625 g I2/100, oksirana
dan peroksida berturut-turut 0.0205 % dan 0.7294 eq/1000g. Sintesis epoksidasi MJP menjadi MJPE dilakukan pada waktu tetap 12 jam, dengan ragam suhu 50, 60dan 70 oC dan ragam konsentrasi katalis 1, 2, 3, dan 4%. Peragaman suhu dan katalis menunjukkan nilai bilangan iodin turun seiring dengan naiknya suhu dan konsentrasi katalis. Nilai bilangan iodin turun seiring naiknya suhu dan konsentrasi katalis, diiringi dengan naiknya nilai bilangan oksirana. Dari hasil pengukuran awal bilangan iodin dibandingkan dengan hasil sintesis epoksidasi diketahui pada suhu 50 oC untuk bilangan iodin menurun 1.5–4.2 kali dari kondisi awal. Pada suhu 60 oC bilangan iodin turun 1.8–4.23 kali dan pada suhu 70 oC menurun 2.58–15.3 kali dari kondisi bilangan iodin awal. Sementara itu untuk bilangan oksirana naik 58.5–107.3 kali dari kondisi bilangan oksirana sebelum epoksidasi pada suhu 50 oC. Selanjutnya pada suhu 60 oC bilangan oksirana naik 87.8–131.7 kali dan pada suhu 70 oC naik 123.4–205.8 kali dari bilangan oksirana sebelum epoksidasi.
Seluruh data perlakuan hasil sintesis dioptimalisasi dengan metode respons permukaan (response surface method) menggunakan Minitab 14. Pengolahan ini menghasilkan kurva dua-tiga dimensi yang dapat dianalisis untuk menjelaskan pengaruh berbagai respons (suhu dan konsentrasi katalis). Penurunan bilangan iodin terjadi dengan adanya kenaikan suhu dan bertambahnya konsentrasi katalis pada daerah optimum dan minimum. Nilai bilangan iodin minimum akan diperoleh pada saat suhu 50 oC dan konsentrasi katalis 1%. Nilai bilangan iodin optimum didapatkan pada saat suhu 70 oC dan konsentrasi katalis 4% dengan nilai bilangan iodin 7.12.
Reaksi epoksidasi optimum terjadi pada kondisi suhu 70 oC dan katalis Amberlite IR-120 4% dalam waktu reaksi 12 jam. Pada kondisi reaksi ini menghasilkan nilai bilangan oksirana sebesar 4.2%. Nilai bilangan iodin MJPE turun 13–14 kali dari kondisi bilangan iodin awal, sebaliknya bilangan oksirana MJPE meningkat 208 kali dari kondisi awal. Hal ini membuktikan telah terjadinya reaksi epoksidasi.
Berdasarkan pengolahan dengan software Minitab 14 untuk melihat interaksi setiap respons (suhu dan katalis) maka didapatkan hasil analisis koefisien kuadratik yang menunjukkan bahwa model persamaan matematika untuk optimasi ini adalah: bilangan oksirana = 17.8733 + 0.5498x + 1.2830y–0.0039z–0.1960xy – 0.004xz dengan nilai R-Sq 75.9 %. Sementara itu analisis keragaman atau Anova menunjukkan bahwa nilai P (0.001) lebih kecil dari taraf α (5%). Oleh karena itu dapat disimpulkan bahwa semua peubah suhu dan katalis memiliki pengaruh nyata pada bilangan oksirana.
v menunjukkan gugus fungsi OH dari diol.
Selanjutnya dilakukan analisis GC-MS untuk mengidentifikasi senyawa epoksida yang terbentuk dan didapatkan bahwa pada MJPE dengan waktu retensi 14.809 menit dan luas area 4.66% terdapat senyawa metil cis-9,10–epoksioleat dengan senyawa C19H36O3, BM=312.
Pencampuran PVC dengan pemlastis MJPE dilakukan pada keadaan fase cair-cair menggunakan pelarut THF. Hasil uji tarik menggunakan alat Instron ASTM-D-1822 menunjukkan bahwa pencampuran dan penambahan pemlastis pada PVC dapat mengubah sifat fisik polimer tersebut, terlihat dari adanya perubahan nilai kuat tarik, elastisitas, dan elongasinya. Nilai kuat tarik pada film PVC dengan bobot molekul 62000 g/mol semakin menurun dengan bertambahnya konsentrasi pemlastis. Sementara itu pada film PVC dengan bobot molekul 43000 g/mol juga kuat tarik turun nilai seiring kenaikan konsentrasi pemlastis. Hal ini menunjukkan bahwa kenaikan konsentrasi pemlastis akan menurunkan nilai kuat tarik pada film PVC. Menurunnya nilai kuat tarik pada PVC disebabkan oleh terdifusinya pemlastis ke dalam polimer sehingga melemahkan interaksi antarpolimer dan mencegah terbentuknya jaringan yang kaku pada polimer. Sementara itu nilai elastisitas dan elongasi naik seiring kenaikan konsentrasi pemlastis pada film PVC.
Selanjutnya, data uji tarik yang diperoleh diolah menggunakan perangkat lunak Minitab 14 untuk melihat interaksi atau respons data terhadap beberapa faktor, di antaranya ragam jumlah pemlastis dan bobot molekul PVC. Pemlastis yang berasal dari senyawa terepoksidasi tinggi akan berinteraksi kuat dengan PVC dan menambah kompatibilitas polimer sehingga akan berpengaruh terhadap kuat tarik, elastisitas dan elongasi polimer.
Kenaikan konsentrasi pemlastis akan menaikan nilai elastisitas film PVC. Pada PVC dengan bobot molekul 62000 g/mol tanpa penambahan pemlastis (blanko) nilai elastisitas sangat kecil dan naik tajam seiring kenaikan penambahan konsentrasi pemlastis. Kenaikan nilai elastisitas ini juga terjadi pada PVC dengan bobot molekul 43.000 g/mol. Penambahan pemlastis pada polimer memengaruhi kelenturan polimer dengan menurunkan sifat getas dan kaku pada polimer sehingga menaikan elastisitas pada polimer.
Pengaruh pemlastis dan bobot molekul PVC terhadap nilai elongasi film PVC. Nilai elongasi bertambah seiring kenaikan konsentrasi pemlastis. Elongasi terbesar didapatkan pada saat kisaran pemlastis 3 g yang menghasilkan nilai elongasi lebih besar 2.6. Hal ini disebabkan oleh adanya plastisasi polimer yang disebabkan oleh penambahan pemlastis sehingga menaikan elongasi pada polimer. Elongasi bertambah besar seiring kenaikan jumlah pemlastis yang. Selanjutnya data keseluruhan kuat tarik, elastisitas dan elongasi diolah dengan Minitab 14 untuk mencari nilai optimum kondisi pencampuran PVC dengan pemlastis dan nilai optimum adalah pada kondisi campuran PVC dan pemlastis 7:3.
vi
PVC yang menggunakan pemlastis memperlihatkan keseragaman tekstur yang merata sehingga teksturnya nampak lebih halus. Hal ini dikarenakan pemlastis mengisi kisi-kisi antarruang polimer sehingga permukaan atau tekstur film menjadi halus, tidak kisut, dan tidak berlubang.
Nilai transisi kaca film untuk blanko PVC dengan bobot molekul 62000 g/mol setelah ditambahkan pemlastis mengalami penurunan nilai transisi kaca dari 43.6 menjadi 42.7 oC. Sementara itu untuk PVC dengan bobot molekul 43000 g/mol nilai transisi kaca turun dari 41.8 menjadi 40.9 oC. Nilai transisi kaca secara teoretis untuk PVC adalah berkisar 81–87 oC, sedangkan hasil pengukuran film PVC blanko pada penelitian ini nilai berkisar 40–43 oC. Hal ini disebabkan oleh PVC komersial yang digunakan belum murni atau terkontaminasi pada proses pembuatannya sehingga nilai Tg yang teridentifikasi berbeda.
Sementara itu susunan rantai karbon panjang yang terdapat pada pemlastis akan menyebabkan interaksi antara polimer dengan pemlastis tidak sempurna. Interaksi yang sempurna antara polimer dengan pemlastis akan tercapai jika terjadi introduksi yang cukup dari gugus epoksi pada rantai belakang senyawa diena yang menunjukkan tingkat epoksidasi yang tinggi pada pemlastis. Interaksi yang kuat antara bahan PVC dengan pemlastis akan menurunkan nilai transisi kaca (Tg) film hasil pencampuran PVC dengan pemlastis berdasarkan interaksi
molekular polar-polar. Hal ini disebabkan oleh kecenderungan semakin pendek ikatan pada rantai polimer akan semakin menurunkan nilai transisi kaca film hasil pencampuran PVC dengan pemlastis dan menunjukkan terjadinya plastisasi. Plastisasi pada PVC oleh pemlastis akan memodifikasi sifat bahan film dan memengaruhi suhu Tg polimer. Sementara itu, turunnya transisi kaca pada film
hasil pencampuran PVC dan pemlastis pada penelitian ini tidak terlalu banyak disebabkan oleh konfigurasi rantai karbon pemlastis yang berasal dari MJP relatif panjang sehingga interaksi molekular antara PVC dan pemlastis tidak besar sehingga perbedaan nilai Tg antara blanko PVC dan hasil pencampuran PVC dan
vii
©
Hak Cipta milik IPB, tahun 2008 Hak Cipta dilindungi Undang-Undang1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa
mencamtumkan atau menyebutkan sumber
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan
karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah
b. Pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
2. Dilarang mengumumkan dan memperbanyak sebagian atau seluruh karya
viii
EPOKSIDA MINYAK JARAK PAGAR SEBAGAI
PEMLASTIS FILM POLIVINIL KLORIDA
ASEP SAEFUROHMAN
Tesis
Sebagai salah satu syarat untuk untuk memperoleh gelar Magister Sains pada
Program Studi Ilmu Kimia
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
ix
x
NIM : G452050031
Disetujui
Komisi Pembimbing
Dr. Dra. Purwantiningsih Sugita, MS Prof. Dr. Suminar S. Achmadi
Ketua Anggota
Diketahui
Ketua Program Studi Kimia Dekan Sekolah Pascasarjana
Prof. Dr. Ir. Latifah. K. Darusman, MS. Prof. Dr. Ir. Khairil A. Notodiputro, MS.
xi
Puji syukur penulis sampaikan Kehadirat Allah SWT yang telah
memberikan rahmat dan karunia-Nya, sehingga penulis dapat menyelesaikan tesis
ini dengan judul “ Epoksida Minyak Jarak Pagar Sebagai Pemlastis Film Polivinil
Klorida”. Penelitian ini dilakukan selama 7 bulan (September 2007-April 2008) di
Laboratorium Kimia Organik IPB. Jasa analisis instrumen diperoleh dari
Laboratorium Instrumentasi UIN Jakarta, Laboratorium Teknologi Polimer
BATAN Jakarta, Laboratorium Bahan Industri Nuklir BATAN Puspiptek
Serpong, Laboratorium Zoologi LIPI Cibinong Bogor, dan Laboratorium Uji
Polimer Pusat Penelitian Fisika, LIPI Bandung.
Terima kasih penulis sampaikan kepada Ibu Dr. Dra. Purwantiningsih
Sugita, M.S dan Prof. Dr. Suminar S. Achmadi sebagai pembimbing yang telah
dengan sabar memberikan bimbingan, arahan dan saran-saran dalam upaya
penyusunan tesis ini. Penulis sampaikan juga terima kasih kepada semua staf dan
laboran di laboratorium organik IPB (Bu Yeni, Pak Sabur) yang telah membantu
sarana dan prasarana selama penulis melakukan penelitian. Ungkapan terima
kasih juga disampaikan kepada orang tua penulis, mamih, papih, serta seluruh
keluarga (Teh Enong, A Didin, Ceceu, Adi dan Dede) atas segala doa dan kasih
sayangnya. Kepada teman-teman di pascasarjana Program Studi S-2 kimia (Tedi,
Bu Dini, Dinah) dan kost (Joko, Dwi, Rossi, Satria) penulis sampaikan terima
kasih dan semua pihak yang tidak bisa penulis sebutkan satu persatu, yang telah
membantu dalam penyelesaian tesis ini.
Semoga karya ilmiah ini bermanfaat.
Bogor, September 2008
xii
Penulis dilahirkan di Pandeglang pada tanggal 27 Agustus 1978 sebagai
anak keempat dari pasangan M. Sidik dan E. Syamsiah. Pendidikan sarjana
ditempuh di Jurusan Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam
Universitas Lampung, lulus pada tahun 2003. Pada tahun 2005, penulis diterima
di Program Studi Ilmu Kimia pada Sekolah Pascasarjana IPB. Beasiswa
pendidikan pascasarjana (BPPS) diperoleh dari Departemen Pendidikan Nasional
Indonesia.
Penulis bekerja sebagai dosen bidang matematika dan IPA di Institut Agama
Islam Negeri (IAIN) ”Sultan Maulana Hasanudin Banten” dan staf pengajar tidak
tetap bidang IPA pada Universitas Terbuka (UT) di Serang. Selama mengikuti
program S-2, penulis menjadi anggota Himpunan Kimia Indonesia wilayah Jawa
xiii
Polivinil klorida (PVC) ... 4
Epoksidasi ... 6
Penentuan Nilai Energi Aktivasi (Ea) Sintesis Epoksidasi ... 7
METODE PENELITIAN ... 9
Alat dan Bahan ... 10
Optimalisasi Sintesis dan Pencirian Pemlastis Minyak Jarak Pagar Terepoksidasi ... 10
Penentuan Nilai EaEpoksidasi ... 10
Aplikasi MJPE sebagai Pemlastis pada Polimer PVC ... 10
HASIL DAN PEMBAHASAN ... 12
Kondisi Optimum Reaksi Epoksidasi MJPE ... 12
Ciri MJPE Optimum berdasarkan FTIR dan GC-MS ... 17
Energi Aktivasi (Ea) ... 17
Campuran Optimum PVC dengan Pemlastis ... 21
Ciri Film berdasarkan SEM ... 26
Tg Film berdasarkan DSC ... 27
KESIMPULAN DAN SARAN ... 29
DAFTAR PUSTAKA ... 30
xiv
Halaman
1 Pengaruh penambahan konsentrasi pemlastis pada plot suhu
modulus ketegaran ... 4
2 Reaksi pembukaan cincin oksirana ... 6
3 Hubungan antara suhu dan katalis dan bilangan iodin ... 13
4 Respons permukaan suhu dan katalis dan bilangan iodin ... 13
5 Hubungan antara suhu dan katalis dan bilangan oksirana ... 14
6 Respons permukaan suhu dan katalis terhadap bilangan oksirana ... 15
7 Hubungan antara (a) bilangan iodin (b) dan bilangan oksirana terhadap waktu ... 16
8 Hubungan waktu dan ln([DBo]/[DB]) pada suhu 50, 60, dan 70 oC untuk penentuan nilai tetapan laju reaksi (k) ... 19
9 Regresi hubungan antara 1/T dan ln k untuk penentuan Ea ... 20
10 Regresi hubungan antara 1/T dan ln k untuk penentuan Eaoksirana ... 21
11 Hubungan antara PVC dan MJPE dan kuat tarik ... 23
12 Respons permukaan PVC dan MJPE dan elastisitas ... 24
13 Hubungan antara PVC dan MJPE dan elongasi ... 25
xv
Halaman
1 Spesifikasi PVC niaga ... 5
2 Hasil sintesis epoksidasi pada ragam peubah suhu (50–70 oC ) dan katalis (1–4%) ... 12
3 Nilai koefisien determinasi (R2 ) iodin untuk persamaan orde reaksi ... 18
4 Tetapan laju reaksi epoksidasi MJPE ... 19
5 Nilai koefisien determinasi (R2 ) oksirana untuk persamaan orde reaksi ... 20
6 Tetapan laju reaksi epoksidasi MJPE untuk bilangan oksirana ... 20
7 Data hasil uji kuat tarik PVC dan campurannya ... 22
xvi
Halaman
1 Penentuan bilangan oksirana (AOAC 1999) ... 34
Bilangan iodin (AOAC 1999) ... 34
Bilangan peroksida (AOAC 1999) ... 35
Uji Tarik ... 35
2 Bagan alir penelitian ... 37
3 Data optimalisasi sintesis jarak pagar terepoksidasi (MJPE) ... 38
4 Perhitungan teoretis faktor konversi ... 38
5 Hasil kondisi optimum reaksi epoksidasi menggunakan Minitab 14... 38
6 Hasil uji koefisien kuadratik untuk bilangan oksirana ... 39
7 Hasil uji Anova untuk bilangan oksirana ... 39
8 Spektrum FTIR MJP dan MJPE ... 39
9 Analisis gugus fungsi MJP dan MJPE dengan FTIR ... 40
10 Analisis MJPE dengan GC-MS ... 40
11 Data untuk penentuan orde reaksi epoksidasi pada suhu 50, 60, 70 oC ... 41
12 Kurva regresi penentuan orde reaksi epoksidasi pada suhu 50, 60, 70 oC ... 41
13 Data untuk penentuan tetapan laju reaksi (k) pada suhu 50, 60, 70 oC ... 42
14 Penentuan nilai tetapan laju (k) dan energi aktivasi (Ea) ... 42
15 Data untuk penentuan orde reaksi epoksidasi pada suhu 50, 60, 70 oC (bilangan oksirana) ... 42
16 Data untuk penentuan tetapan laju reaksi (k) pada suhu 50, 60, 70 oC (bilangan oksirana) ... 43
17 Kurva regresi penentuan orde reaksi epoksidasi pada suhu 50, 60, 70 oC (bilangan oksirana) ... 43
18 Penentuan nilai tetapan laju (k) dan energi aktivasi (Ea) dari nilai oksirana .. 43
19 Data hasil uji tarik ... 44
20 Data hasil hitung kuat tarik, elastisitas, dan elongasi... 45
21 Respons permukaan PVC dan MJPE terhadap kuat tarik ... 45
22 Respons permukaan PVC dan MJPE terhadap elastisitas ... 46
23 Respons permukaan PVC dan MJPE terhadap elongasi ... 46
24 Hasil uji koefisien kuadratik Minitab 14 untuk kuat tarik ... 46
25 Hasil uji koefisien kuadratik Minitab 14 untuk elongasi ... 46
26 Hasil pengukuran DSC (a) PVC 43000 g/mol blanko dan (b) 43000 g/mol + pemlastis ... 47
Pendahuluan
Plastik merupakan salah satu bahan yang banyak digunakan untuk peralatan rumah tangga, bahan kemasan, peralatan medis, dan sebagainya. Selama pelita V kebutuhan plastik di Indonesia tidak kurang dari 22 ribu ton untuk jenis kantong plastik saja (Sumule & Suwahyono 2005). Tahun 1999 sampai 2003 industri berbahan baku plastik di Indonesia tumbuh rata-rata 10% per tahunnya. Kapasitas produksi termoplastik di Indonesia sampai dengan tahun 2003 mencapai sekitar 1.9 juta ton. Proyeksi produksi plastik PVC resin sampai tahun 2008 di Indonesia diperkirakan dapat mencapai 592 ribu ton. Makin banyak penggunaan produk plastik di masyarakat, semakin banyak pula industri dan bahan baku untuk pembuatannya (Hira 2006).
Komponen penyusun plastik terdiri atas dua jenis, yaitu komponen utama berupa polimer (resin) yang merupakan komponen terbesar dari bahan plastik dan aditif. Aditif adalah komponen yang sangat penting pada plastik, walaupun hanya dalam jumlah sedikit tidak lebih dari 5%. Aditif digunakan pada plastik untuk meningkatkan sifat fungsionalnya seperti ketahanan terhadap api, kekuatan, dan fleksibilitas.
medis seperti pengemas untuk darah dan tabung darah, sarung tangan, dan kateter (Prasetyo 2002).
Bahan pemlastis ditambahkan pada PVC agar tidak bersifat kaku dan rapuh. Pemlastis terbesar yang digunakan sekarang ini diambil dari kelompok senyawa ftalat (ester turunan dari asam ftalat). Pemlastis lainnya yang juga sering digunakan adalah dietilheksil adipat (DEHA), bifenil poliklorin (PCB), dan dietilheksil ftalat (DEHP) (Sheftel 2000). PVC yang menggunakan pemlastis jenis DEHA, berdasarkan penelitian di Amerika Serikat, dapat mengontaminasi makanan dengan mengeluarkan bahan pemlastis ini ke dalam makanan. Pada tahun 1998, di Amerika Serikat pernah ditemukan DEHA pada keju yang dibungkus dengan plastik PVC. Berdasarkan data kajian yang dilakukan terhadap hewan coba tikus, DEHA dapat mengganggu sistem reproduksi, menyebabkan janin cacat, dan dapat mengakibatkan kanker (Awang 1999). Selain DEHA, DEHP juga umum digunakan dalam PVC sebagai pemlastis. DEHP juga berbahaya karena dapat bermigrasi dari permukaan bahan masuk ke lingkungan dan akhirnya dapat kontak dengan pasien sehingga membahayakan kesehatan. Metcalf et al. (1973) juga melaporkan bahwa DEHP ditemukan sebagai polutan di dalam sistem perairan. Hasil uji in vitro terhadap larva nyamuk Physa snail dan
mosquito fish (Gambusia affinis) menunjukkan bahwa DEHP berturut-turut sebanyak 35.52 dan 18.30 ppm, menghambat sistem metabolisme (James et al. 1975).
Pemlastis jenis ftalat seperti DEHA, DEHP, dan dioktil ftalat (DOP) merupakan pemlastis berbahan dasar minyak bumi (petrokimia) yang dikategorikan berbahaya dan toksik. Dampak negatif yang ditimbulkan mendukung lahirnya pencarian bahan alternatif sebagai substitusi pemlastis berbasis minyak bumi. Salah satu alternatif sebagai pensubstitusi adalah pemlastis berbasis minyak nabati. Minyak nabati memiliki keunggulan, karena dapat terurai secara alami dan mudah diperbaharui sehingga ramah lingkungan.
berbasis minyak kedelai, yaitu epoxidized soybean oil (ESO), kini menguasai pasar pemlastis dunia sekitar 43%, sedangkan pemlastis dari minyak bunga matahari sekitar 9% (Hill 2000). Minyak jarak pagar mempunyai sifat fisik dan kimia yang mirip dengan minyak kedelai. Kandungan asam lemak takjenuhnya sekitar 46% yang didominasi oleh asam takjenuh oleat. Karena itu, senyawa ini berpotensi sebagai bahan dasar untuk membentuk pemlastis kelompok epoksida.
Epoksidasi minyak jarak pagar (MJP) dilakukan dengan penambahan H2O2
sebagai oksidator dan Amberlite R-120 sebagai katalis. Metode ini pernah digunakan oleh Rios (2003) pada epoksidasi minyak kedelai hanya saja katalis yang digunakan adalah H2SO4.
Pencirian minyak jarak pagar terepoksidasi (MJPE) dilakukan melalui penentuan bilangan iodin dan bilangan oksirana. Pencirian gugus fungsi MJPE menggunakan FTIR. Selanjutnya, MJPE diaplikasikan pada polimer PVC dengan ragam bobot molekul polimer dan ragam konsentrasi pemlastis.
Tujuan Penelitian Penelitian ini bertujuan:
1. Mengoptimumkan sintesis epoksida minyak jarak pagar melalui ragam suhu (T)dan konsentrasi katalis pada waktu (t) reaksi 12 jam.
2. Mencirikan pemlastis MJPE melalui bilangan iodin dan bilangan oksirana serta gugus fungsi dengan FTIR.
3. Menentukan persamaan kinetika reaksinya yang meliputi penentuan orde reaksi dan energi aktivasi (Ea).
4. Mengoptimumkan pencampuran antara PVC dengan MJPE dan pencirian sifat reologi filmnya yang meliputi kuat tarik, elastisitas, dan elongasi. 5. Mencirikan film guna melihat teksturnya dan Tg (suhu transisi kaca).
Hipotesis
TINJAUAN PUSTAKA
Pemlastis
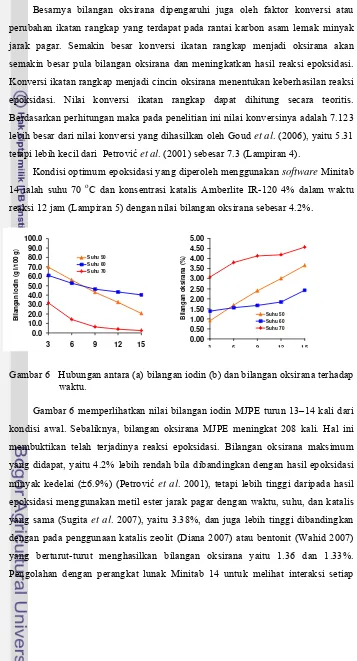
Pemlastis merupakan zat yang berguna untuk menambah elastisitas dan fleksibilitas polimer. Pemlastis mengisi ruang antarrantai polimer sehingga dapat mengubah sifat plastik dari keras, getas, dan rapuh menjadi lembut, lentur, dan tahan lama. Sebagian besar pemlastis merupakan senyawa polar yang dapat menambah kekuatan jaringan ikat sekunder pada cincin polimer dan memperbesar derajat kebebasan polimer yang berdampak pada elastisitas dan kelenturannya (Grenspan & Gall 2003). Jenis-jenis pemlastis yang umum digunakan adalah (1) ftalat, (2) adipat, (3) trimetilat, (4) maleat, (5) benzoat, (6) minyak nabati terepoksidasi, (7) sulfonamida, (8) fosfat, (9) glikol atau polieter, (10) polimer.
Fungsi utama pemlastis adalah mengurangi modulus ketegaran polimer pada suhu yang digunakan, dengan menurunkan suhu transisi kacanya (Tg),
sehingga akan mengubah polimer yang kaku menjadi lebih lentur dan elastis. Pengaruh pemlastis pada modulus diilustrasikan pada Gambar 1. Penambahan konsentrasi pemlastis dan naiknya suhu menyebabkan transisi dari modulus ketegaran tinggi (glassy) ke modulus ketegaran rendah (rubbery). Terlihat bahwa transisi polimer terplastisasi terjadi pada kisaran suhu lebih rendah daripada polimer yang tidak terplastisasi.
Gambar 1 Pengaruh penambahan konsentrasi pemlastis pada plot suhu modulus ketegaran.
Poli(vinil klorida) (PVC)
Poli(vinil klorida) adalah salah satu polimer sintetik yang diproduksi secara melimpah. Pada tahun 1835, Justus Von Liebig dan mahasiswanya Victor
Regnault mereaksikan etilena diklorida dengan alkohol menghasilkan PVC. E. Baumann (1872) melarutkan vinil klorida dalam tabung yang disinari cahaya matahari dan dihasilkan suatu padatan PVC. Sementara itu Klasse (1914), di Jerman, melaporkan bahwa PVC dapat dibuat dari adisi hidrogen klorida pada asetilena.
Selama lebih dari dua dasawarsa, sejumlah besar PVC telah digunakan sebagai kemasan makanan dan peralatan medis. PVC merupakan bahan kedua terbesar yang dipakai setelah polietilena sebagai kemasan. Kemasan dari bahan PVC mencapai 7-8% dari total penjualan PVC di Amerika Serikat. Pada tahun 1992, PVC telah digunakan di seluruh Uni Eropa sebesar 5 juta ton. Aplikasi PVC di dunia sebagai kemasan di bidang makanan secara keseluruhan sebesar 28%, di bidang kesehatan sebesar 31%, dan 41% di bidang lainnya. Produksi terbesar PVC sebagai kemasan makanan ialah berupa pelat film dan botol. Lapisan pelat film PVC ini memiliki ketebalan antara 10–15 µm. (Kontominas et al. 2000).
Aplikasi yang luas dari PVC antara lain disebabkan oleh kemampuannya dalam menerima pemlastis dalam jumlah yang bervariasi. PVC yang kurang bersifat fleksibel biasanya mengandung aditif 5–10%, sedangkan yang bersifat fleksibel mengandung 10–30% (Sunny et al. 2004). Aplikasi PVC didasarkan pada sifatnya yaitu bersifat kaku, sehingga banyak digunakan sebagai pipa, jendela, dan lainnya. Sementara itu PVC yang bersifat fleksibel banyak digunakan sebagai pelapis lantai, film, dan pelapis kawat. PVC niaga memiliki kristalinitas yang rendah dengan bobot molekul antara 25.000–150.000. Spesifikasi PVC niaga ditunjukkan pada Tabel 1.
Tabel 1 Spesifikasi PVC niaga
Epoksidasi
Epoksidasi merupakan reaksi pembentukan eter siklik (oksirana) dari senyawa yang berikatan rangkap. Oksirana merupakan produk autooksidasi asam-asam lemak takjenuh. Reaksi epoksidasi penting dalam sintesis bahan organik, karena produknya yang berupa epoksida merupakan zat antara yang dapat dikonversi menjadi beraneka ragam produk. Menurut Rios (2003), pada dasarnya terdapat empat metode untuk menghasilkan epoksida dari ikatan rangkap pada rantai asam lemak, yaitu (1) dengan asam perkarboksilat, (2) peroksida organik dan anorganik, (3) halohidrin, dan (4) molekul oksigen.
Asam peroksiasetat merupakan salah satu pereaksi untuk epoksidasi (perkarboksilat) yang dibentuk melalui interaksi antara asam asetat dan H2O2.
Reaksi ini dapat berlangsung baik dengan menggunakan hidrogen peroksida yang berlebih (Gall & Greenspan 2003). Asam peroksiasetat dapat dibentuk terlebih dahulu secara terpisah atau secara in situ. Reaksi epoksidasi menggunakan teknik
in situ memiliki beberapa keuntungan, antara lain mengurangi pemakaian H2O2
sehingga menghemat biaya (Swern 1982). Wood & Termini (1958) melaporkan bahwa proses epoksidasi biasanya dilakukan pada suhu 65–75 oC. Suhu yang lebih rendah akan memperpanjang waktu reaksi dan menurunkan efisiensi epoksidasi.
Laju reaksi epoksidasi dapat ditingkatkan dengan penambahan H2O2,namun
penambahan H2O2 pada konsentrasi tertentu juga akan memengaruhi dan
mengurangi kestabilan cincin oksirana (Goud etal. 2006). Menurut Petrovićetal. (2001), pembukaan cincin oksirana juga dapat disebabkan oleh kelebihan pereaksi lain seperti CH3COOH, H2O, dan ion H+. Reaksi pembukaan cincin oksirana
ditampilkan pada Gambar 2.
Penentuan Nilai Energi Aktivasi (Ea) Síntesis Epoksidasi
Energi aktivasi merupakan energi minimum yang harus dimiliki oleh molekul pereaksi untuk menghasilkan produk atau menghasilkan tumbukan yang efektif. Energi aktivasi merupakan jumlah energi yang harus diberikan pada reaktan agar bereaksi satu sama lain. Ea didapatkan dengan mengalurkan log k
(tetapan laju reaksi) dengan 1/T berdasarkan persamaan Arrhenius. Energi aktivasi diperoleh dari nilai kemiringan garis (Ea/2.303 R dengan nilai R = 8.3145 J mol
-1K-1). Persamaan Arrhenius yang digunakan adalah sebagai berikut:
)
Penentuan nilai Eadidahului dengan penentuan orde reaksi, dan tetapan laju
reaksi epoksidasi. Penentuan orde reaksi berdasarkan percobaan akan menghasilkan sejumlah data yang menunjukkan hubungan antara waktu reaksi dan perubahan konsentrasi pereaksi. Dari data ini akan diperoleh tetapan lajunya (k) berdasarkan orde reaksinya.
Laju reaksi epoksidasi (Petrovic et al. 2001) merupakan persamaan laju untuk oksidasi ikatan rangkap oleh asam peroksiasetat yang dapat dituliskan sebagai berikut:
[ ]
DB /dt k[ ] [
DB n11 PAA]
n2...(3)d =
−
Keterangan: [DB] dan [PAA] adalah konsentrasi molaritas ikatan rangkap dan asam peroksiasetat, k adalah tetapan laju.
Petrovic et al. (2001) melaporkan bahwa epoksidasi terhadap ikatan ganda atau asam peroksiasetat pada laju tetap, k= k3 [PAA], diasumsikan kinetika
epoksidasinya adalah orde pertama sehingga persamaan laju reaksi orde pertama pada epoksidasi dapat dituliskan sebagai berikut:
[ ]
DB /dt k[ ]
DB...(4)d =
−
[ ] [ ]
/ ...(5)ln DB 0 DB =kt
Kemiringan antara plot ln [DB]0/[DB] terhadap waktu reaksi akan menunjukkan
orde reaksi.
Penelitian mengenai penentuan Ea epoksidasi minyak nabati telah cukup
banyak dilakukan, baik dengan katalis heterogen maupun homogen (Rios 2003). Penelitian pada ESO telah dilakukan oleh Petrovic et al. (2001) menggunakan teknik epoksidasi in situ dalam pelarut toluena, dengan asam peroksiasetat dan peroksiformat serta resin penukar ion sebagai katalis, yang menghasilkan Ea
sebesar 54.7 kJ/mol. Celikay et al. (2002) juga telah melakukan penelitian Ea
untuk epoksidasi pada minyak biji rami dengan menggunakan asam perasetat, dioksirana, hidrogen peroksida, dan menghasilkan Ea sebesar 76.7 kJ/mol. Goud et al. (2006) melaporkan Ea yang didapatkan dari epoksidasi in situ minyak
karanja (Pongamia glabra) dengan asam peroksiasetat dalam pelarut asam asetat glasial dan H2O2, yakni sebesar 14.9 kkal/mol. Sementara itu Sugita et al. (2007)
BAHAN DAN METODE
Alat dan Bahan
Alat-alat yang digunakan terdiri atas spektrofotometer inframerah transformasi Fourier (FTIR) tipe Shimadzu 8400 zul, kromatografi gas-spektrometer massa (GC-MS) Shimadzu 8400, kalorimetri pemayaran diferensial (DSC) Seiko SSC 5200H, mikroskop elektron payaran (SEM) JEOL JSM-5310LV, alat uji kuat tarik Strograph-R1, komputer dengan perangkat lunak Minitab 14, dan alat-alat kaca yang biasa dipakai di laboratorium.
Bahan yang digunakan pada penelitian antara lain minyak jarak pagar hasil olahan dari BPPT Serpong dengan sumber biji jarak pagar dari daerah Jember, katalis Amberlite R-120 dari Rhom & Haas (Philadelpia, AS), H2O2 35%, larutan
asam asetat-kloroform (3:2), serta PVC BM 43000 dan BM 62000 g/mol dari Sigma Aldrich, Singapura.
Optimalisasi Sintesis dan Pencirian Pemlastis Minyak Jarak Pagar Terepoksidasi (MJPE)
Optimalisasi epoksidasi minyak jarak pagar menggunakan dua peubah, yaitu suhu reaksi dan konsentrasi katalis pada waktu reaksi tetap 12 jam (Sugita et al. 2007). Prosedurnya adalah sebagai berikut: larutan pertama, yakni 10 g minyak jarak pagar yang dilarutkan dalam 0.84 g asetat glasial dan 2.5 ml toluena, dipanaskan pada suhu 50 oC. Kemudian larutan kedua, yaitu campuran 5.78 g H2O2 35% dengan 0.25 g (b/v) katalis Amberlite R-120, ditambahkan tetes demi
tetes pada larutan pertama sambil diaduk kuat dengan pengaduk magnet. Suhu dijaga konstan pada 50 oC dengan terus diaduk kuat, dan reaksi dibiarkan berlangsung selama 12 jam. Campuran dinetralkan dengan menambahkan NaHCO3, disaring, dan diendapkan. Fase minyak dipisahkan dan kemudian dicuci
(Celikay et al. 2002). Perolehan data bilangan iodin dan oksirana dioptimalisasi dengan menggunakan perangkat lunak Minitab 14. Metode tersebut digunakan untuk menggambarkan pengaruh ragam katalis dan suhu (T), terhadap bilangan oksirana atau bilangan iodin.
Penentuan Nilai Ea Epoksidasi
Penentuan Ea epoksidasi dilakukan pada kondisi konsentrasi katalis
optimum, waktu reaksi 12 jam, pada ragam suhu 50, 60, dan 70 oC. Tahapan reaksi yang dilakukan sama seperti tahap 1, tetapi reaktan yang digunakan 10 kali lebih banyak. Untuk memantau jalannya reaksi dilakukan pengambilan cuplikan setiap 3 jam. Cuplikan dinetralkan dan dicuci kemudian dianalisis bilangan iodin dan oksirananya. Nilai bilangan iodin dan oksirana setiap suhu diolah untuk mendapatkan parameter kinetika, yaitu orde reaksi dan tetapan laju reaksi (k), yang akan berguna untuk perhitungan energi aktivasi (Ea).
Orde reaksi ditentukan dengan memasukkan data bilangan iodin atau bilangan oksirana setiap suhu 50, 60, dan 70 oC pada kurva hubungan antara waktu dan bilangan iodin atau bilangan oksirana. Orde reaksi ditentukan berdasarkan tingkat kesesuaian dengan data percobaan (curve fitting method) dengan memperhitungkan koefisien determinasi (R2) terbesar. Tetapan laju reaksi (k) diperoleh dari kemiringan garis lurus hubungan antara waktu dan bilangan iodin atau bilangan oksirana sesuai dengan orde reaksinya. Sementara Ea
ditentukan berdasarkan kemiringan garis dari hubungan antara 1/T (sumbu x) terhadap ln k (sumbu y). Bagan alir optimalisasi reaksi minyak jarak pagar terepoksidasi dan penciriannya dapat dilihat pada Lampiran 2.
Aplikasi MJPE sebagai Pemlastis pada Polimer PVC
molekul 43000 g/mol dan ragam MJPE 2 g, dan 3 g sehingga total perlakuan berjumlah 12. Hasil pencampuran ini dianalisis sifat fisiknya yang meliputi uji kuat tarik, pemanjangan (elongasi), dan elastisitas. Data sifat fisik ini dianalisis dengan menggunakan perangkat lunak Minitab 14. Produk juga dicirikan dengan DSC untuk melihat Tg (suhu transisi kaca), dan dengan SEM untuk melihat tekstur
HASIL DAN PEMBAHASAN
Kondisi Optimum Reaksi Epoksidasi MJPE
Pencarian kondisi optimum dilakukan dengan terlebih dahulu mengukur parameter kimia keadaan bahan MJP. Parameter yang diukur meliputi bilangan iodin, bilangan oksirana, dan bilangan peroksida dengan hasil berturut-turut 97.4625 g I2/100 g, 0.0205 % dan 0.7294 eq/1000g. Epoksidasi MJP menjadi
MJPE dilakukan pada waktu tetap 12 jam, dengan ragam suhu 50, 60dan 70 oC dan ragam konsentrasi katalis 1, 2, 3, dan 4%. Data Tabel 2 menunjukkan bahwa sintesis pada ragam peubah suhu dan konsentrasi katalis menghasilkan nilai bilangan iodin dan oksirana yang berbeda. Peragaman suhu dan katalis menunjukkan hasil nilai bilangan iodin cenderung turun seiring dengan naiknya suhu dan konsentrasi katalis. Nilai bilangan iodin turun seiring naiknya suhu dan konsentrasi katalis, diiringi dengan naiknya nilai bilangan oksirana. Data selengkapnya dapat dilihat pada Lampiran 3. Hasil pengukuran awal bilangan iodin dibandingkan dengan hasil sintesis epoksidasi maka pada suhu 50 oC untuk bilangan iodin mengalami penurunan 1.5–4.2 kali dari kondisi awal. Pada suhu 60
oC bilangan iodin turun 1.8–4.23 kali dan pada suhu 70 oC penurunan terjadi
2.58–15.3 kali dari kondisi bilangan iodin awal. Demikian pada ragam suhu dan katalis yang berbeda juga menghasilkan nilai bilangan oksirana yang beragam. Pada suhu 50, 60, 70 oC nilai bilangan oksirana ini naik seiring naiknya konsentrasi katalis. Sementara itu untuk bilangan oksirana terjadi kenaikan 58.5– 107.3 kali dari kondisi bilangan oksirana sebelum epoksidasi pada suhu 50 oC. Selanjutnya pada suhu 60 oC terjadi kenaikan bilangan oksirana sebesar 87.8– 131.7 kali dan pada suhu 70 oC kenaikan sebesar 123.4–205.8 kali dari bilangan oksirana sebelum epoksidasi.
Tabel 2 Hasil sintesis epoksidasi pada ragam peubah suhu (50–70 oC ) dan katalis (1–4%)
Parameter Suhu 50 oC Suhu 60 oC Suhu 70 oC Bilangan iodin (g I2/100 g) 63.5–23.7 51.3–23 37.7–6.4
3.5 Bil I od
20
2.5 40
60
A mber lit
50 60 70 1.5
80 Suhu
Semua data pada Lampiran 3 kemudian dioptimalisasi dengan metode respons permukaan (response surface method) dihasilkan kurva dua-tiga dimensi yang dapat menjelaskan pengaruh suhu dan konsentrasi katalis Amberlite IR-120 terhadap bilangan iodin dan oksirana. Hasilnya berturut-turut pada Gambar 4a dan 4b.
Gambar 4a Hubungan antara suhu dan katalis dan bilangan iodin ( = kecenderungan membaik).
Gambar 4b Respons permukaan suhu dan katalis dan bilangan iodin (inset: = daerah optimum; = daerah minimum).
atas suhu ±60–70 oC penguraian asam perasetat akan lebih cepat dibanding epoksidasi ikatan rangkap sehingga akan mengurangi hasil epoksidasi dan ini akan berpengaruh terhadap nilai bilangan iodin (Celikay et al. 2002).
Respons permukaan (Gambar 4b) menjelaskan adanya keteraturan penurunan bilangan iodin dengan naiknya suhu dan bertambahnya konsentrasi katalis pada daerah optimum dan minimum. Nilai bilangan iodin minimum diperoleh pada suhu 50 oC dan konsentrasi katalis 1% (bagian mendatar paling bawah pada kurva), sedangkan nilai bilangan iodin optimum didapat pada suhu 70
oC dan konsentrasi katalis 4% (kurva yang menjulang ke atas) dengan nilai
bilangan iodin pada kisaran 7.12 g I2/100 g. Hal ini sesuai dengan data hasil
sintesis epoksidasi bilangan iodin (Lampiran 3).
Nilai bilangan iodin mencerminkan jumlah ikatan rangkap atau derajat ketidakjenuhan. Penurunan bilangan iodin yang tajam terjadi pada kondisi optimum menunjukkan adanya konversi ikatan rangkap yang cepat pada suhu 70
o
C dan waktu 12 jam dengan katalis 4%. Nilai bilangan iodin ini lebih kecil dibandingkan pada suhu 50 dan 60 oC, tetapi lebih besar daripada suhu 80 oC pada waktu dan jumlah katalis yang sama. Hal ini menunjukkan bahwa penurunan bilangan iodin sangat dipengaruhi oleh suhu.
Gambar 5b Respons permukaan suhu dan katalis dan bilangan
oksirana (inset: = daerah optimum; = daerah minimum).
Lebih lanjut Gambar 5b memperlihatkan bahwa nilai bilangan oksirana minimum akan diperoleh pada suhu 50 oC dan konsentrasi katalis 1% (bagian mendatar paling bawah pada kurva). Secara teoretis kenaikan suhu dan katalis akan mempercepat pengubahan ikatan rangkap menjadi gugus oksirana. Kenaikan bilangan oksirana terjadi secara signifikan pada rentang suhu 50–70 oC konsentrasi katalis 1–4% (kurva menjulang dari bawah ke atas). Hal ini sesuai dengan hasil sintesis epoksidasi bilangan oksirana (Lampiran 3). Kondisi optimum untuk bilangan oksirana didapatkan pada suhu kira-kira 70 oC dengan kosentrasi katalis mencapai 4% dengan menghasilkan bilangan oksirana yaitu >3.5 (daerah kurva mendatar paling atas). Pada suhu yang lebih tinggi yaitu ±80
o
C bilangan oksirana turun dan ditunjukkan dengan titik balik penurunan pada daerah lengkungan kurva bagian ujung paling atas. Menurut Goud et al. (2006), konversi ikatan rangkap menjadi oksirana dengan cepat akan terjadi pada suhu 80–85 oC dalam kisaran waktu yang singkat, yaitu antara 3 dan 6 jam reaksi. Namun kisaran suhu ini juga dapat mengakibatkan ketidakstabilan cincin oksirana dan pembukaan cincin oksirana. Pada proses sintesis epoksidasi, untuk mencegah reaksi eksotermik tidak terkontrol, maka setiap tingkat kisaran suhu dipisahkan dengan perbedaan 10 oC. Peningkatan suhu akan mendorong pembentukan asam perasetat. Hal ini akan mempercepat laju epoksidasi, tetapi sekaligus meningkatkan laju hidrolisis, sehingga terjadi pembukaan cincin oksirana (Campanela & Baltanas 2005).
0.0
Besarnya bilangan oksirana dipengaruhi juga oleh faktor konversi atau perubahan ikatan rangkap yang terdapat pada rantai karbon asam lemak minyak jarak pagar. Semakin besar konversi ikatan rangkap menjadi oksirana akan semakin besar pula bilangan oksirana dan meningkatkan hasil reaksi epoksidasi. Konversi ikatan rangkap menjadi cincin oksirana menentukan keberhasilan reaksi epoksidasi. Nilai konversi ikatan rangkap dapat dihitung secara teoritis. Berdasarkan perhitungan maka pada penelitian ini nilai konversinya adalah 7.123 lebih besar dari nilai konversi yang dihasilkan oleh Goud et al. (2006), yaitu 5.31 tetapi lebih kecil dari Petrovićetal. (2001) sebesar 7.3 (Lampiran 4).
Kondisi optimum epoksidasi yang diperoleh menggunakan software Minitab 14 ialah suhu 70 oC dan konsentrasi katalis Amberlite IR-120 4% dalam waktu reaksi 12 jam (Lampiran 5) dengan nilai bilangan oksirana sebesar 4.2%.
Gambar 6 Hubungan antara (a) bilangan iodin (b) dan bilangan oksirana terhadap waktu.
respons (suhu dan katalis) berdasarkan analisis koefisien kuadratik menghasilkan model persamaan matematika untuk optimalisasi sebagai berikut: Bilangan oksirana = 17.8733 + 0.5498x + 1.2830y–0.0039z–0.1960xy–0.004xz dengan nilai
R-Sq dan R-Sq (adj) berturut-turut 75.9 % dan 63.8 % (Lampiran 6). linearitas sebesar 75.9% tergolong rendah kurang dari 0.95. Analisis keragaman atau Anova menunjukkan bahwa nilai P (0.001) lebih kecil daripada taraf α (5%). Oleh karena itu, dapat disimpulkan bahwa semua peubah suhu dan katalis memiliki pengaruh nyata terhadap bilangan oksirana (Lampiran 7).
Ciri MJPE Optimum Berdasarkan FTIR dan GC-MS
Daerah serapan C=C pada MJP terdapat pada 1652.82 cm-1. Pada MJPE serapan ini berkurang atau tidak terlihat lagi dengan semakin bertambahnya tingkat epoksidasi, karena ikatan rangkap mengalami pemutusan dan mengikat oksigen untuk membentuk cincin oksirana. Terbentuknya cincin oksirana pada MJPE juga ditunjukkan oleh serapan pada 729.24 cm-1 yang merupakan serapan khas untuk gugus fungsi epoksi. Sementara itu pada MJPE juga terdapat serapan pada 3500 cm-1 yang menunjukkan gugus fungsi OH dari diol (Lampiran 8 dan 9).
Selanjutnya dilakukan analisis GC-MS untuk mengidentifikasi senyawa epoksida yang terbentuk dan didapatkan bahwa pada MJPE dengan waktu retensi 14.809 menit dan luas area 4.66% terdapat senyawa metil cis-9,10–epoksioleat dengan senyawa C19H36O3, BM=312 (Lampiran 10). Juga terdapat senyawa lain
seperti asam laurat, metil palmitat, asam palmitat, metil stearat, dan asam oleat. Data ini menjelaskan bahwa telah terjadi reaksi epoksidasi MJP menjadi MJPE yakni pada residu asam oleatnya. Data GC-MS juga menunjukkan kandungan senyawa epoksi yang terdapat pada MJPE. Senyawa epoksi ini menjadi indikator adanya konversi ikatan rangkap yang terdapat pada MJP menjadi senyawa epoksioleat pada MJPE. Dengan demikian senyawa epoksioleat dengan kemiripan 93% terdapat pada MJPE .
Energi Aktivasi (Ea)
nilai Ea. Reaksi epoksidasi secara in situ melibatkan dua reaksi utama, yang
pertama adalah pembentukan asam peroksiasetat, sedangkan yang kedua adalah pembentukan epoksida dari reaksi asam peroksiasetat dengan ikatan rangkap, (Goud et al. 2006) :
AA adalah asam asetat (acetic acid), PAA adalah asam peroksiasetat (peroxoacetic acid), dan EO adalah gugus epoksi (epoxide group), k1, k2, dan k3
adalah tetapan laju reaksi.
Berdasarkan persamaan (6) dan (7), dengan mengasumsikan PAA tetap selama reaksi reaksi epoksidasi MJP adalah orde pertama, karena hanya melibatkan satu pereaksi tunggal (persamaan 6) yaitu MJP, akan tetapi penentuan ini juga harus diperkuat dengan metode integrasi, yaitu dengan melihat koefisien determinasi (R2). Data dan kurva penentuan orde reaksi epoksidasi untuk bilangan iodin ditunjukkan pada Lampiran 11 dan 12. Hasil analisis menunjukkan bahwa hasil epoksidasi MJP menjadi MJPE menghasilkan orde satu. Hal ini terlihat dari nilai R2pada orde satu lebih tinggi dibandingkan orde 2 dan 3 untuk setiap suhu. Tabel 3, menjelaskan nilai koefisien determinasi pada orde pertama, pada suhu 50, 60, dan 70 oC.
Tabel 3 Nilai koefisien determinasi (R2 ) orde pertama untuk reaksi epoksidasi Suhu (°C) Orde Persamaan garis R2
50 Ke-1 y = 0.0997x - 0.2243 0.9786 60 Ke-1 y = 0.034x + 0.3151 0.9701 70 Ke-1 y = 0.2134x + 0.4335 0.9811 Pada penentuan tetapan laju reaksi (k), persamaan yang digunakan pada orde pertama adalah sebagai berikut:
)
Tetapan laju reaksi (k) untuk kinetika reaksi epoksidasi MJPE dibuat dari persamaan 9, yaitu dengan membuat kurva regresi hubungan antara waktu sebagai sumbu x, dan ln([DBo]/[DB]) sebagai sumbu y, sehingga didapat persamaan garis
y = a + bx. Data penentuan tetapan laju reaksi dapat dilihat pada Lampiran 13. Kurva hubungan antara waktu dan ln[iodin] pada suhu 50, 60, dan 70 oCuntuk penentuan nilai tetapan laju reaksi (k) ditampilkan pada Gambar 7.
Gambar 7 Hubungan antara waktu dan ln ([DBo]/[DB]) pada suhu 50, 60, dan 70 oC untuk penentuan nilai tetapan laju reaksi (k).
Kemiringan atau gradien dari persamaan garis pada Tabel 5 merupakan tetapan laju reaksi yang hasilnya diringkaskan pada Tabel 4.
Tabel 4 Tetapan laju reaksi epoksidasi MJPE Suhu reaksi
Tabel 4 menunjukkan bahwa perbedaan suhu reaksi 10 oC telah memberikan pengaruh yang signifikan terhadap nilai tetapan laju (k). Kenaikan suhu 10 oC telah cukup signifikan untuk memperbesar fraksi molekul MJPE dan asam peroksiasetat yang teraktifkan atau memiliki energi kinetik melebihi Ea reaksi
epoksidasi. Tabel 4 selanjutnya digunakan untuk menentukan Ea dengan
menggunakan persamaan Arrhenius. Ea ini diperoleh dari kemiringan kurva
hubungan 1/T dengan ln k (Gambar 8), yakni sebesar 24.99 kJmol-1 (Lampiran 14). Nilai ini lebih rendah dari nilai Ea epoksidasi minyak kedelai yang dilakukan
kJmol-1 yang berarti laju reaksi pada reaksi epoksidasi berlangsung lebih cepat. Namun nilai linearitas persamaan Arhennius yang diperoleh hanya 0.7885.
Gambar 8 Regresi hubungan antara 1/T dan ln k untuk penentuan Ea.
Penentuan orde reaksi juga dilakukan dengan menggunakan perubahan bilangan oksirana selama berlangsungnya reaksi epoksidasi. Pengujian untuk orde ke-0, 1, dan 2 dengan data bilangan oksirana kembali memberikan R2 terbesar pada orde pertamadengan rata-rata 0.93 dibanding pada orde ke-0,dan 2 berturut-turut R2 0.91 dan 0.88 (Lampiran 15). Nilai koefisien determinasi orde pertama pada suhu 50, 60, dan 70 oC ditunjukkan pada Tabel 5. Kemiringan dari persamaan garis pada Tabel 7, yang merupakan nilai k, diringkaskan pada Tabel 6 dan digunakan untuk penentuan Ea. Terlihat bahwa perbedaan nilai tetapan laju
reaksi berdasarkan kenaikan bilangan oksirana ini lebih nyata dibanding yang berdasarkan penurunan bilangan iodin.
Tabel 5 Nilai koefisien determinasi (R2 ) oksirana untuk persamaan orde reaksi Suhu (°C) Orde Persamaan garis R2
50 Ke-1 y = -0.1128x – 2.5357 0.9375 60 Ke-1 y = -0.0439x – 3.1485 0.9225 70 Ke-1 y = -0.0189x –2.539 0.9369
Tabel 6 Tetapan laju reaksi epoksidasi MJPE untuk bilangan oksirana
Ea yang diperoleh dari percobaan berdasarkan bilangan oksirana ini sebesar
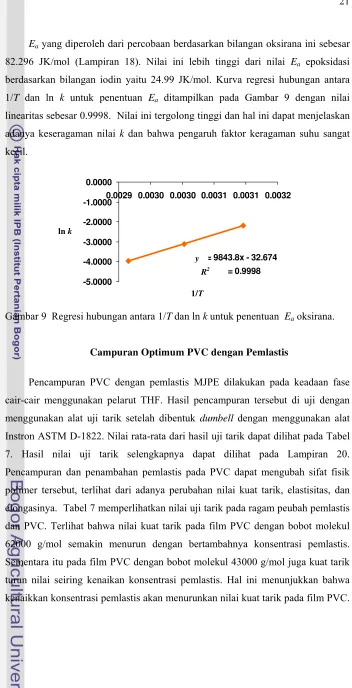
82.296 JK/mol (Lampiran 18). Nilai ini lebih tinggi dari nilai Ea epoksidasi
berdasarkan bilangan iodin yaitu 24.99 JK/mol. Kurva regresi hubungan antara 1/T dan ln k untuk penentuan Ea ditampilkan pada Gambar 9 dengan nilai
linearitas sebesar 0.9998. Nilai ini tergolong tinggi dan hal ini dapat menjelaskan adanya keseragaman nilai k dan bahwa pengaruh faktor keragaman suhu sangat kecil.
Gambar 9 Regresi hubungan antara 1/T dan ln k untuk penentuan Eaoksirana.
Campuran Optimum PVC dengan Pemlastis
Pencampuran PVC dengan pemlastis MJPE dilakukan pada keadaan fase cair-cair menggunakan pelarut THF. Hasil pencampuran tersebut di uji dengan menggunakan alat uji tarik setelah dibentuk dumbell dengan menggunakan alat Instron ASTM D-1822. Nilai rata-rata dari hasil uji tarik dapat dilihat pada Tabel 7. Hasil nilai uji tarik selengkapnya dapat dilihat pada Lampiran 20. Pencampuran dan penambahan pemlastis pada PVC dapat mengubah sifat fisik polimer tersebut, terlihat dari adanya perubahan nilai kuat tarik, elastisitas, dan elongasinya. Tabel 7 memperlihatkan nilai uji tarik pada ragam peubah pemlastis dan PVC. Terlihat bahwa nilai kuat tarik pada film PVC dengan bobot molekul 62000 g/mol semakin menurun dengan bertambahnya konsentrasi pemlastis. Sementara itu pada film PVC dengan bobot molekul 43000 g/mol juga kuat tarik turun nilai seiring kenaikan konsentrasi pemlastis. Hal ini menunjukkan bahwa kenaikkan konsentrasi pemlastis akan menurunkan nilai kuat tarik pada film PVC.
y = 9843.8x - 32.674
0.0029 0.0030 0.0030 0.0031 0.0031 0.0032
Menurut Krauskof dan Godwin (2003) menurunnya nilai kuat tarik pada PVC disebabkan oleh terdifusinya pemlastis ke dalam polimer sehingga melemahkan interaksi antarpolimer dan mencegah terbentuknya jaringan yang kaku pada polimer. Sementara itu nilai elastisitas dan elongasi naik seiring kenaikan konsentrasi pemlastis pada film PVC. Data selengkapnya dapat dilihat pada Lampiran 19.
Tabel 7 Data hasil uji kuat tarik PVC dan campurannya.
Contoh Kuat Tarik
menunjukkan bahwa pemlastis yang terdifusi pada antarruang polimer dapat mengurangi interaksi antarmolekul pada polimer sehingga menjadi lebih lentur dan menurunkan nilai kuat tariknya.
Gambar 10 Hubungan antara PVC dan MJPE (pemlastis) dan kuat tarik ( = kecenderungan membaik).
.
Gambar 11 menjelaskan pengaruh PVC dan pemlastis terhadap elastisitas (Data lengkap pada Lampiran 20 dan kurva tiga dimensinya pada Lampiran 22). Berdasarkan hasil pada Tabel 9 terlihat bahwa kenaikan konsentrasi pemlastis akan menaikkan nilai elastisitas film PVC. Pada PVC dengan bobot molekul 62000 tanpa penambahan pemlastis (blanko) nilai elastisitas sangat kecil dan naik tajam seiring kenaikan penambahan konsentrasi pemlastis. Kenaikkan nilai elastisitas ini juga terjadi pada PVC dengan bobot molekul 43000. Menurut Biju
Gambar 11 Hubungan antara PVC dan MJPE (pemlastis) dan elastisitas ( = kecenderungan membaik).
Gambar 12 menjelaskan pengaruh pemlastis dan bobot molekul PVC terhadap nilai elongasi film PVC (Data lengkap pada Lampiran 20 dan kurva tiga dimensinya pada Lampiran 23). Nilai elongasi bertambah seiring kenaikan konsentrasi pemlastis. Elongasi terbesar didapatkan pada saat kisaran pemlastis 3 g yang menghasilkan nilai elongasi lebih besar 2.6. Hal ini disebabkan oleh adanya plastisasi polimer yang disebabkan oleh penambahan pemlastis sehingga menaikkan elongasi pada polimer. Elongasi akan bertambah besar seiring kenaikan jumlah pemlastis yang ditambahkan (Biju et al. 2007). Pada PVC dengan bobot molekul 43000 g/mol, nilai elongasi pada nisbah PVC:MJPE (7:3) adalah 2, ini lebih rendah dari nilai elongasi pada nisbah PVC:MJPE (8:2) yang nilainya 2.5. Hal ini mungkin disebabkan oleh distribusi pemlastis yang tidak merata pada proses pencampuran PVC dengan pemlastis sehingga tidak terdifusi dengan baik pada film PVC. Selanjutnya data keseluruhan kuat tarik, elastisitas dan elongasi diolah dengan Minitab 14 untuk mencari nilai optimum kondisi pencampuran PVC dengan pemlastis. Hasil pengolahan menunjukkan bahwa nilai optimum pencampuran adalah pada kondisi nisbah pencampuran PVC dan pemlastis 7:3.
Gambar 12 Hubungan antara PVC dan MJPE (pemlastis) dan elongasi ( = kecenderungan membaik).
Pengolahan dengan perangkat lunak Minitab 14 untuk melihat interaksi setiap respons (PVC dan pemlastis) berdasarkan analisis koefisien kuadratik menghasilkan model persamaan matematika untuk kuat tarik sebagai berikut: -13.9865 + 2.8257x + 2.6952y–1.4266z–1.2981xy–2.7224xz dengan nilai R-Sq
adalah 88.5% (Lampiran 24). Dengan nilai R-Sq 88.5%, linearitas ini tergolong rendah kurang dari 0.95. Artinya terdapat ketidakseragaman pencampuran yang dilakukan terutama faktor bobot molekul PVC dan pemlastis. Sementara itu analisis keragaman atau Anova menunjukkan bahwa nilai P (0.001) lebih kecil dari taraf α (5%). Oleh karena itu dapat disimpulkan bahwa semua peubah bobot molekul PVC dan pemlastis memiliki pengaruh nyata terhadap kuat tarik.
Ciri Film Berdasarkan SEM
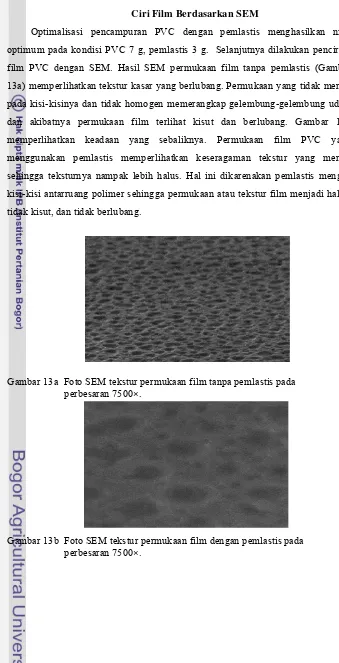
Optimalisasi pencampuran PVC dengan pemlastis menghasilkan nilai optimum pada kondisi PVC 7 g, pemlastis 3 g. Selanjutnya dilakukan pencirian film PVC dengan SEM. Hasil SEM permukaan film tanpa pemlastis (Gambar 13a) memperlihatkan tekstur kasar yang berlubang. Permukaan yang tidak merata pada kisi-kisinya dan tidak homogen memerangkap gelembung-gelembung udara dan akibatnya permukaan film terlihat kisut dan berlubang. Gambar 13b memperlihatkan keadaan yang sebaliknya. Permukaan film PVC yang menggunakan pemlastis memperlihatkan keseragaman tekstur yang merata sehingga teksturnya nampak lebih halus. Hal ini dikarenakan pemlastis mengisi kisi-kisi antarruang polimer sehingga permukaan atau tekstur film menjadi halus, tidak kisut, dan tidak berlubang.
Gambar 13a Foto SEM tekstur permukaan film tanpa pemlastis pada perbesaran 7500×.
Tg Film Berdasarkan DSC
Tabel 8 menjelaskan hasil pengukuran hasil campuran PVC dengan pemlastis atau film yang menghasilkan nilai transisi kaca yang berbeda pada ragam pencampuran PVC dan pemlastis yang optimum.
Tabel 8 Data hasil uji Tg film dengan DSC
Identitas Sampel Tg (o C)
PVC BM 62000 43.6
PVC BM 43000 41.8
PVC BM 62000 + Pemlastis (7:3) 42.7 PVC BM 43000 + Pemlastis (7:3) 40.9
Tabel 8 menjelaskan bahwa nilai transisi kaca film untuk blanko PVC dengan bobot molekul 62000 g/mol setelah ditambah pemlastis mengalami penurunan nilai transisi kaca dari 43.6 menjadi 42.7 oC (termogram DSC selengkapnya dapat dilihat pada Lampiran 26-28). Sementara itu untuk PVC dengan bobot molekul 43000 g/mol nilai transisi kaca turun dari 41.8 menjadi 40.9 oC. Nilai transisi kaca secara teoritis untuk PVC adalah berkisar dari 81 sampai 87 oC, sedangkan hasil pengukuran film PVC blanko pada penelitian ini nilai berkisar dari 40 sampai 43 oC. Hal ini tampaknya disebabkan oleh PVC komersial yang digunakan belum murni atau terkontaminasi pada proses pembuatannya sehingga nilai Tg yang teridentifikasi berbeda.
Sementara itu susunan rantai karbon panjang yang terdapat pada pemlastis akan menyebabkan interaksi antara polimer dengan pemlastis tidak sempurna. Interaksi yang sempurna antara polimer dengan pemlastis akan tercapai jika terjadi introduksi yang cukup dari gugus epoksi pada rantai belakang senyawa diena yang menunjukkan tingkat epoksidasi yang tinggi pada pemlastis. Menurut Biju et al. (2007), interaksi yang kuat antara bahan PVC dengan pemlastis akan menurunkan nilai transisi kaca (Tg) film hasil campuran PVC dengan pemlastis
menunjukkan terjadinya plastisasi. Plastisasi pada PVC oleh pemlastis akan memodifikasi sifat bahan film dan memengaruhi suhu Tg polimer. Sementara itu,
turunnya transisi kaca pada film hasil campuran PVC dan pemlastis pada penelitian ini tidak terlalu banyak disebabkan oleh konfigurasi rantai karbon pemlastis yang berasal dari MJP relatif panjang sehingga interaksi molekular antara PVC dan pemlastis tidak besar sehingga perbedaan nilai Tg antara blanko
PVC dan hasil pencampuran PVC dan pemlastis tidak signifikan. Sementara itu perbedaan nilai Tg antara blanko PVC dengan hasil pencampuran PVC dan
pemlastis akan signifikan jika pemlastis yang digunakan adalah berasal dari petrokimia seperti dioktil ftalat (DOP) karena konfigurasi karbosiklik yang dimiliki senyawa DOP menyebabkan interaksi yang lebih baik antara pemlastis
dan polimer. Comment [ F1] : perlu acuan untuk
KESIMPULAN
Kesimpulan dari penelitian ini adalah bahwa kondisi optimum sintesis epoksidasi terjadi pada suhu 70 oC dan katalis Amberlite IR-120 4% dalam waktu reaksi 12 jam, dengan bilangan oksirana 4.2%. Daerah serapan C=C pada MJP pada 1652.82 cm-1 dan pada MJPE berkurang atau tidak terlihat seiring bertambahnya tingkat epoksidasi karena pemutusan dan pengikatan oksigen untuk membentuk cincin oksirana. Pada MJPE juga terdapat serapan pada 729.24 cm-1 yang merupakan serapan khas gugus fungsi epoksi dan serapan O-H pada serapan 3500 cm-1. Analisis GC-MS mengidentifikasi senyawa epoksida mencapai sekitar 4.66% berupa senyawa metil cis-9.10–epoksioleat dengan senyawa C19H36O3
yang bobot molekulnya 312.
Hasil analisis menunjukkan bahwa epoksidasi MJP menjadi MJPE menghasilkan orde satu dengan nilai koefisien determinasi, R2 sekitar 0.98pada suhu 50–70 oC, sedangkan untuk bilangan oksirana nilai koefisien determinasi pada suhu tersebut adalah sekitar 0.93 dan Ea 25 JK/mol dan Ea 82 JK/mol.
Campuran optimum PVC dan MJPE 7 g PVC dan 3 g MJPE menghasilkan penurunan nilai kuat tarik, dan kenaikan elastisitas serta elongasi. Pada Film dengan nisbah PVC:pemlastis 7:3 untuk bobot molekul PVC 62000 g/mol mengalami penurunan Tg dari 43.6 menjadi 42.7 oC. Sementara itu untuk hasil
campuran PVC:pemlastis 7:3 untuk bobot molekul PVC 43000 g/mol Tg turun
dari 41.8 menjadi 40.9 oC.
SARAN
Perlu dilakukan penelitian lanjutan untuk melihat nilai transisi kaca (Tg) dan
DAFTAR PUSTAKA
AOAC. 1999. Official Methods of Analysis of the Association of Official Analytical Chemists. Ed. Ke 15. Arlington: Association of Official Analytical Chemists.
Awang MR. 1999. Bahaya bahan kimia dalam pembungkus plastik. http://www.prn2.usm.my/mainsite/bulletin/1999/kosmik12.html.[12 Mei 2007].
Biju K et al. 2007. Plasticizing Effect of Epoxidized natural rubber on PVC/ELNR blends preapared by solution blending. Mater Sci Poland
25:919-932.
Billmeyer FW. 1984. Textbook of Polymer Science. New York: John Wiley. Campella B, Baltanas M. 2005. Degradation of the oxirane ring of epoxidized
vegetable oils in liquid-liquid systems: Reactivity with solvated acetic and peracetic acids. Latin Am App Res 35:211-216.
Carraher G, Charles E, Editor. 2003. Polymer Chemistry. Ed ke-6. New York: Marcel Dekker.
Cavanaugh T. 1995. Plastics additives’95. Chemical Marketing Reporter p. SR. 10. (terhubungberkala). Http://www.carbohydrateeconomy.org/library/ uploadedfiles/Biochemical Plasticizers.html. [26 Des 2006].
Celikay R et al. 2002. Epoxidation of partially norbornylized linseed oil.
Macromol Chem Phys 203:2042-2057.
Chou TC, Lee V. 1997. Epoxidation of oleic acid in the present of benzaldehyde using cobalt (II) tetraphenylporpyirin as catalyst. Indust & Eng Chem Res
36:1485-1490.
Fried JR. 2005. Polymer Science and Technology. New Delhi: Prentice Hall of India.
Goud Vet al. 2006. Epoxidation of Karanja (Pongamia glabra) Oil by H2O2. J
Am Oil Chem Soc l83:635-640.
Greenspan FP, Gall RJ. 2003. Epoxy fatty acid plasticizer. Indust & Eng Chem
45:2722-2726.
Hazimah AH, Salimah A, Ahmad I. 2000. Epoxidation palm oil creates exciting avenues for palm-based industrilization. Forum information service. 43:0218-5726.
Hill K. 2000. Fats and oils as oleochemical raw materials. Pure Appl Chem 72: 1255-1254.
Hira N. 2006. Industri Plastik Indonesia. Jakarta: Bank Ekspor Indonesia.
James R, Metcalf R, Chieh C, Yung P. 1975. Plasticizer in the environment: The fate of di-N-octyl phthalate in two model ecosystem and uptake and metabolism of DOP by aquatic organisms. Archives Environ Contam Toxicol 3:244-255.
Khalil A, Sinomeit B. 2003. Phtalates. J Plast 36:873-879. King G. 1949. Estimation of Epoxides. London: Macmilian.
Kirk RE, DF Othmer. 1965. Encyclopedia of Chemical Technology. Ed ke-2. Volume ke-8. New York: J Wiley.
Kontominas L et al. 2000. Migration of di-(2-ethylhexyl) Adipate Plasticizer from Food-Grade Polyvinyl Chloride Film into Hard and Soft Cheeses. J Dairy Sci 83:1712-1718.
Krauskof LG, Godwin A. 2003. Plasticizers. Hanser 5:174-175.
Petrovic ZS et al. 2001. Kinetics of in situ Epoxidation of Soybean Oil in Bulk Catalyzed by Ion Exchange Resin. J Am Oil Chem Soc 78:7-15.
Prasetyo W. 2002. PVC Modern Plastics,. Di dalam: Peranan Penelitian dan Pengembangan Ilmu Pengetahuan dan Teknologi Bahan dalam Mewujudkan Kemandirian Teknologi dan Meningkatkan Sumber Daya Alam lokal. Prosiding Pertemuan Ilmiah Ilmu Pengetahuan dan Teknologi Bahan; Jakarta Mei 2002. hlm.31-38.
Priyde E, Rothfus J. 1999. Industrial and Nonfood Uses of Vegetable Oils. New York: McGraw Hill.
Rangrajan B, Harvey A. 1995. Kinetic parameter of two phase model for in situ
epoxidation of soybean oil.J Am Oil Chem Soc 72:1261-1269.
Rios LA. 2003. Heterogeneously catalyzed reactions with vegetable oils: Epoxidation and nucleophilic epoxide ring opening with alcohol [disertasi]. Aachen: The Institute of Chemical Technology and Heterogenous Catalysis. University RWTH.
Saha B, Streat M. 1998. Cation excange resin-catalysed esterification of acetic acid with 2-(1-cyclohexenyl) cyclohexanone. Catal Lett 51:121-127
Sugita P et al. 2007. Kinetics study of Jatropha curcas L. methyl ester epoxidation reaction with Amberlite R-120 catalyst. (Presented in International Conference and Workshop on Basic and Applied Science, Airlangga University, 6-7 Agu 2007).
Sumule O, Suwahyono U. 2005. Bioplastik: Produk Teknologi Tinggi Berwawasan Lingkungan. Jakarta: BPPT. [terhubung berkala]. http://BPPT.go.id./bioplastik.pdf. [23 Mei 2007].
Sunny MC, Ramesh P, George R. 2004. Use of polymeric plasticizers in polyvinyl chloride to reduce conventional plasticizer migration for critical applications. J Elast Plast 36:362-370.
Sheftel VO. 2000. Harmful substances in plastics. http:mindfully.org./plastic/ harmful.
Swern D. 1982. Bailey’s Industrial Oil and Fat Products. Ed ke-4. Volume ke-2. New York: John Wiley.
Wood W, Termini J. 1958. Ion exchange resin catalyst stability in in situ
epoxidation. J Am Oil Chem Soc 7:331-335.
Comment [ F3] : cek jenis dokumen
Lampiran 1
Penentuan Bilangan Oksirana (AOAC 1999)
Contoh sebanyak 0.4 g ditimbang, dimasukkan ke dalam labu erlenmeyer 250 ml, kemudian dilarutkan dalam 10 ml asetat glasial. Setelah itu, ditambahkan indikator kristal ungu sebanyak 5 tetes (maksimum 0.1 ml) dan dititrasi dengan larutan HBr 0.1 N sampai berwarna hijau kebiruan selama 30 detik.
Bilangan oksirana (%) = V ×N ×1.60 ×100 %
Bobot contoh
Dengan:
V = volume HBr (ml)
N = normalitas HBr
I = bilangan iodin minyak jarak pagar
Bilangan Iodin (AOAC 1999)
Sampel ditimbang sebanyak 0.5 g, kemudian dimasukkan ke dalam labu erlenmeyer 250 ml, bertutup asah. CCl4 sebanyak 10 ml ditambahkan dengan
menggunakan gelas ukur untuk melarutkan lemak, kemudian sebanyak 25 ml larutan Hanus ditambahkan ke dalamnya. Setelah itu larutan disimpan selama 3 jam dalam ruang gelap. Sebanyak 20 ml KI 10% dimasukkan ke dalam erlenmeyer segera ditutup. Dikocok sebentar, kemudian dititrasi menggunakan larutan Na2S2O3 0.1 N sampai larutan berwarna kuning muda, lalu ditambahkan
amilum 1% sebagai indikator. Titrasi dihentikan pada saat larutan berubah warna dari warna biru menjadi tidak berwarna. Bilangan iodin dinyatakan sebagai gram iodin yang diserap per 100 g.
Bilangan iodin = 12.69 ×T× (V3- V4)
M
Dengan:
T : normalitas larutan standar Na2S2O3 0.1 N
V3 : volume larutan Na2S2O3 0.1 N yang diperlukan untuk mentitrasi larutan
blanko (ml).
V4 : volume larutan Na2S2O3 0.1 N yang diperlukan untuk mentitrasi larutan
contoh (ml).
M` : bobot contoh (g).
Bilangan Peroksida (AOAC 1999)
Ditimbang 5.0 g MJP dimasukkan ke dalam erlenmeyer 250 ml bertutup asah dan ditambahkan 30 ml larutan asam asetat-kloform (3:2), larutan digoyang sampai bahan terlarut semua, dan ditambahkan 0.5 ml larutan KI jenuh. Didiamkan selama satu menit dan digoyang, kemudian ditambahkan 30 ml akuades. Dititrasi dengan Na2SO3 0.1 N sebanyak dua tetes sampai warna kuning
hampir hilang. Ditambahkan 0.5 ml larutan pati 1%. Titrasi dilanjutkan sampai warna biru mulai hilang. Bilangan peroksida dinyatakan dalam ekuivalen dari peroksida dalam setiap 1000 g contoh. Bilangan peroksida dihitung sebagai berikut:
Bilangan peroksida = mlNa2SO3×Na2SO3×1000 Bobot contoh (g)
Uji Tarik
Kuat tarik = A B × 0.3 cm
dengan:
A= nilai yield (kg) B= tebal dumbell (cm)
Uji maksimum kekuatan tarik = C D × 0.3 cm dengan:
C = nilai tensile (kg) D = tebal dumbell (cm)
Elastisitas = (P1-P0) ×100%
P0
dengan:
P0 = panjang dumbell awal
Lampiran 2
Lampiran 3 Data optimalisasi sintesis MJPE
Lampiran 4 Perhitungan teoretis faktor konversi oksirana EOm=[(IVo/2Aj)/100+(IVo/2Aj) ×Ao]Ao×100
Aj= 126.9045
EOm = {(97.4625/2×126.9)/(100+(97.4625/2×126.9) ×16)} ×16×100
= 7.123


![Gambar 7 Hubungan antara waktu dan ln ([DBo]/[DB]) pada suhu 50, o](https://thumb-ap.123doks.com/thumbv2/123dok/590031.344020/36.612.91.450.89.789/gambar-hubungan-antara-waktu-dan-dbo-pada-suhu.webp)