OPTIMASI PRODUKSI N-ASETILGLUKOSAMINA
DARI KITIN MELALUI FERMENTASI OLEH
Aspergillus rugulosus
501
FITRI WULANDARI
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
FITRI WULANDARI. Optimasi Produksi N-asetilglukosamina dari Kitin melalui
Fermentasi oleh
Aspergillus rugulosus
501. Dibimbing oleh DJAROT
SASONGKO HAMI SENO dan IWAN SASKIAWAN.
ABSTRACT
FITRI WULANDARI. Optimation of N-acetylglucosamine Production from
Chitin by
Aspergillus rugulosus
501 Fermentation . Under the direction of
DJAROT SASONGKO HAMI SENO and IWAN SASKIAWAN.
OPTIMASI PRODUKSI N-ASETILGLUKOSAMINA
DARI KITIN MELALUI FERMENTASI OLEH
Aspergillus rugulosus
501
FITRI WULANDARI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Biokimia
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul Skripsi
:Optimasi Produksi N-asetilglukosamina dari Kitin melalui
Fermentasi oleh
Aspergillus rugulosus
501
Nama
: Fitri Wulandari
NIM
: G84050430
Disetujui
Komisi pembimbing
Drs. Djarot Sasongko HS, M.S.
Dr. Iwan Saskiawan
Ketua
Anggota
Diketahui
Dr. drh. Hasim, DEA
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
PRAKATA
Puji syukur penulis panjatkan kepada Allah SWT yang telah memberikan
rahmat dan hidayah-Nya sehingga penulis menyelesaikan dengan baik penelitian
dan penulisan karya ilmiah yang berjudul Optimasi Produksi N-asetilglukosamina
dari Kitin melalui Fermentasi oleh
Aspergillus rugulosus
501. Karya ilmiah ini
ditulis berdasarkan penelitian yang dilaksanakan di Laboratorium Biokimia
Mikrob, Bidang Mikrobiologi, Pusat Penelitian Biologi LIPI-Bogor selama
kurang lebih 5 bulan yaitu pada bulan Februari sampai Juni 2009 sebagai
prasyarat untuk memperoleh gelar Sarjana Sains Departemen Biokimia, Fakultas
Matematika dan Ilmu Pengetahuan Alam.
Proses menuju keberhasilan yang harus dilalui penulis selama penelitian dan
penyusunan karya ilmiah ini tidak lepas dari bantuan berbagai pihak. Oleh karena
itu, penulis mengucapkan terima kasih kepada Drs. Djarot Sasongko HS, M.S. dan
Dr. Iwan Saskiawan selaku pembimbing atas segala kesabaran dan keikhlasan
dalam memberikan bimbingan, arahan, dan masukan bagi penulis. Ucapan terima
kasih penulis sampaikan pada Bu Nunuk, Bu Kesi, Teh Ninuk, Teh Neng, Teh
Rini, Suri, Rini, dan Santi atas motivasi, masukan, dan bantuannya selama
penelitian. Ucapan terima kasih juga penulis sampaikan kepada ayah, ibu, kedua
adikku (Devi dan Dewi), dan Dian Nurdiansyah atas segala dukungan dan doa
bagi penulis serta kepada teman-teman Biokimia 42 atas segala motivasi dan
bantuannya.
Semoga karya ilmiah ini bermanfaat.
Bogor, September 2009
RIWAYAT HIDUP
Penulis dilahirkan di Klaten, Jawa Tengah pada tanggal 15 Mei 1987 dari
ayahanda Suwandi dan ibunda Tukinem. Penulis merupakan anak pertama dari
tiga bersaudara.
Tahun 2005 penulis lulus dari SMU Negeri 1 Cawas, Klaten dan lolos
seleksi masuk IPB melalui jalur Undangan Seleksi Masuk IPB (USMI). Penulis
memilih Bidang Biomolekul, Departemen Biokimia, Fakultas Matematika dan
Ilmu Pengetahuan Alam.
DAFTAR ISI
Halaman
DAFTAR GAMBAR ………..
viii
DAFTAR LAMPIRAN ………..
viii
PENDAHULUAN ………..
1
TINJAUAN PUSTAKA
Kitin ………...
1
Kitinase ………...
2
N-asetilglukosamina ………...
3
Aspergillus rugulosus
501 ………..
3
BAHAN DAN METODE
Bahan dan Alat ………
4
Metode Penelitian ………...
4
HASIL DAN PEMBAHASAN
Produksi GlcNAc ………
5
Hasil Optimasi ………
6
Pemekatan Konsentrasi GlcNAc dari Hasil Fermentasi ………...
8
SIMPULAN DAN SARAN ……….
9
Simpulan ………...
9
Saran ………...
9
DAFTAR PUSTAKA ………..
9
DAFTAR GAMBAR
Halaman
1 Struktur kitin dan kitosan ………..
2
2 Mekanisme pemotongan eksokitinase dan endokitinase ...
3
3 Struktur kimia GlcNAc ……….
3
4 Kapang
A. rugulosus
501 ………..
4
5 Media kitin untuk produksi GlcNAc ……….
5
6 Pengaruh pH pada produksi GlcNAc ………
6
7 Penurunan pH media kitin selama fermentasi dengan pengaruh pH awal …
6
8 Pengaruh sumber N pada produksi GlcNAc ……….
7
9 Penurunan pH media kitin selama fermentasi ………...
8
10 Ekstrak fermentasi kitin oleh
A. rugulosus
501 ………..
8
11 Panjang gelombang maksimum dengan metode Reissig ………....
9
12
Hasil analisis HPLC ………..9
DAFTAR LAMPIRAN
Halaman
1 Produksi GlcNAc dari kitin melalui fermentasi semi padat ………... 13
2 Analisis kuantitatif GlcNAc dengan metode Reissig (1955) ……….. 14
3 Pembuatan reagent dan pereaksi yang digunakan dalam penelitian ………... 15
4 Kurva standar GlcNAc ………... 15
5 Pengaruh pH pada produksi GlcNAc melalui fermentasi semi padat ……… 16
6 Pengaruh sumber N pada produksi GlcNAc melalui fermentasi semi padat.. 20
7 Contoh perhitungan ……… 23
8
Penurunan pH media selama fermentasi pada optimasi pH ………24
9 Penurunan pH media selama fermentasi pada optimasi sumber N ………… 24
1
PENDAHULUAN
Indonesia merupakan negara penghasil udang terbesar ketiga di dunia dan setiap tahunnya dihasilkan sekitar 0.08 juta ton udang. Limbah yang dihasilkan dalam konsumsi udang sebagai bahan pangan berkisar 30-70% dari berat udang (Setyahadi 2006). Salah satu bentuk pemanfaatan limbah udang adalah diolah menjadi kitin dan kitosan. Kitin yang terkandung dalam Crustaceae berada dalam kadar yang cukup tinggi berkisar 20-60% tergantung spesies, sedangkan kulit udang mengandung 14-35% kitin. Limbah yang mengandung kitin di Indonesia dihasilkan sekitar 56.200 ton/tahun (DKP 2000).
Kitin merupakan homopolimer dari β-1,4
N-asetil-D-glukosamina (GlcNAc) dan
polimer terbanyak kedua di alam setelah selulosa. Kitin dapat didegradasi menjadi
monomernya yaitu N-asetilglukosamina
(GlcNAc). N-asetilglukosamina dapat
dimanfaatkan sebagai antipenuaan, pengawet, dan antibiotik (Yurnaliza 2002).
Pada umumnya GlcNAc diperoleh secara
kimiawi dengan menghidrolisis kitin
menggunakan asam pekat seperti asam klorida (HCl). Akan tetapi metode ini kurang ramah lingkungan karena bahan kimia yang digunakan untuk menghasilkan GlcNAc sangat banyak. Selain itu GlcNAc yang dihasilkan juga sangat sedikit (kurang dari 65%) dan sulit dikontrol (Sashiwa et al. 2002). Saat ini telah berkembang penelitian yang mensintesis GlcNAc dari kitin secara enzimatik menggunakan beberapa enzim seperti enzim kitinase (Sashiwa et al. 2002) dan lisozim (Aiba 2009).
Salah satu mikroorganisme yang
menghasilkan enzim kitinase adalah
Aspergillus rugulosus 501. Yurnaliza (2002) menyatakan bahwa kitinase pada jamur
memiliki aktivitas eksokitinase dan
endokitinase sehingga mampu mendegradasi kitin secepat pembentukan kitin itu sendiri. A. rugulosus 501 sendiri memiliki aktivitas kitinase secara eksokitinase.
Penelitian ini bertujuan mencari kondisi optimum produksi GlcNAc dari kitin secara enzimatik menggunakan enzim kitinase dari kapang A. rugulosus 501 melalui fermentasi substrat semi padat. Produksi GlcNAc dapat diperoleh secara optimal melalui rekayasa substrat untuk memacu pertumbuhan jamur A. rugulosus 501.
Hipotesis penelitian adalah media kitin
dengan penambahan sumber N yang
difermentasi oleh A. rugulosus 501 dapat menghasilkan GlcNAc secara maksimum. Hasil penelitian diharapkan dapat memberi alternatif kepada masyarakat untuk mengolah kitin menjadi produk yang bernilai tinggi dengan cara yang mudah dan murah, sehingga pencemaran lingkungan oleh kulit udang dapat ditangani secara cepat dan efektif.
TINJAUAN PUSTAKA
Kitin
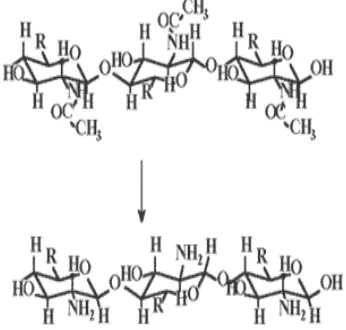
Kitin merupakan aminoglukoprotein yang tersusun atas residu glikoprotein yaitu N-asetilglukosamina (GlcNAc) seperti terlihat pada Gambar 1 (Piza 1999). Kitin merupakan polimer kedua terbesar di alam
setelah selulosa atau biopolimer yang
mengandung nitrogen (N)terbanyak yang ada di alam. Senyawa ini banyak terdapat di cangkang pada udang dan kepiting, siput, serangga, cacing, dan beberapa dinding sel jamur dan alga. Kitin berbentuk padat berwarna putih dan memiliki sifat tidak larut dalam air dan pelarut organik. Akan tetapi, kitin larut dalam asam pekat seperti asam sulfat, asam nitrit, asam fosfat, dan asam fotmiat anhidrat dan dapat terurai dengan adanya enzim (Yurnaliza 2002; Pasaribu 2004; Setyahadi 2006).
Polimer ini memiliki tiga bentuk
polimorfik yaitu α-kitin, β-kitin, dan γ-kitin. Ketiganya memiliki perbedaan yang terletak pada orientasi rantai polisakarida. Pada α-kitin, rantai-rantai polimer tersusun secara antiparalel. Pada umumnya, kitin jenis ini banyak terdapat pada jamur dan arthropoda, β-kitin memiliki rantai-rantai polimer yang tersusun secara paralel dan reaktifitasnya relatif tinggi. Kitin tipe γ-kitin tersusun atas tiga rantai, dua rantai tersusun secara paralel dan satu rantai lainnya tersusun secara antiparalel (Peter 2005).
Sebagai salah satu negara pengekspor
udang, Indonesia memiliki peluang
2
Sebaran ketersediaan kulit udang
mencakup pantura Jawa, Sumetera Utara,
Lampung, Sulawesi Selatan, Sulawesi
Tenggara, Sulawesi Tengah, dan
Kalimantan Timur. Limbah udang yang dihasilkan di Indonesia sekitar 40-60% dengan estimasi kandungan kitin 15% dari limbah tersebut. Tersebarnya bahan baku (kulit udang atau kulit kepiting kering) merupakah salah satu kendala yang harus diatasi (Setyahadi 2006).
Kitin dapat dihasilkan dari kulit udang secara enzimatik, kimiawi, dan gabungan dari enzimatik dan kimiawi. Proses kimiawi diperoleh dengan menghilangkan mineral
menggunakan asam dan dilanjutkan
penghilangan protein menggunakan alkali yang dipanaskan. Proses enzimatik yaitu dilakukan menggunakan reaksi enzimatik. Proses ini merupakan pilihan yang ideal karena ramah lingkungan dan prosesnya mudah dikontrol. Sedangkan proses kimiawi dan enzimatik biasanya digunakan untuk mengkonversi kitin menjadi kitosan (Wibowo 2006).
Beberapa peranan penting kitin dalam dunia bioteknologi dan industri yaitu dapat digunakan dalam industri kertas, fiber, tekstil,
kosmetik, obat-obatan pada beberapa
penyakit seperti obesitas dan hiperlipidemia, pangan, gizi, dan film. Selain itu, kitin juga sebagai sumber N-asetilglukosamina yang
dimanfaatkan sebagai antibiotik dan
pengawet (Peter 2005;Yurnaliza 2002).
Gambar 1 Struktur kitin (atas) dan kitosan (bawah) (Piza 1999).
Kitinase
Kitinase sering disebut sebagai poli (1,4-β [2-asetamido-2-deoksi-glukosaminide]
glikano hidrolase, merupakan enzim yang mendegradasi kitin menjadi monomernya yaitu N-asetilglukosamina. Enzim kitinase
menghidrolisis ikatan
β-1,4-asetamido-2-deoksi-D-glikosida. Jenis-jenis bakteri yang dapat menghasilkan enzim kitinase adalah Vibrio parahaemaluticus, Flavobacterium indolthecium, Serratia marcencens, Enterobacter liquefaciens, Bacillus cereus, Klebsiella sp., dan Micrococcus colpogenes. Sedangkan jenis-jenis jamur yang dapat
menghasilkan enzim kitinase adalah
Mortierella sp, Mucor subtillisimum, Aspergillus fumigtus, Trichoderma viridae, dan Aspergillus sp. 501 (Yurnaliza 2002; Widhyastuti et al. 2006).
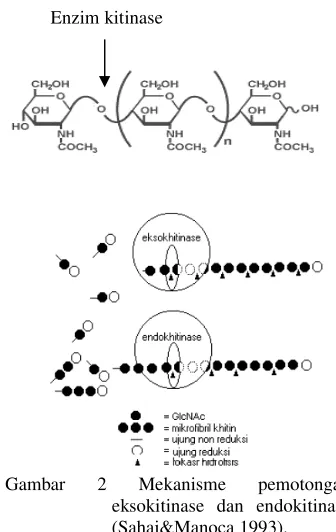
Enzim kitinase menurut Sahai&Manocha (1993) dibagi menjadi tiga tipe antara lain endokitinase, eksokitinase, dan
β-1,4-N-asetilglukosamidase. Endokitinase
merupakan enzim yang memotong secara acak ikatan β-1,4 pada bagian internal kitin dengan produk akhir oligomer pendek N-asetilglukosamina. Eksokitinase merupakan enzim yang mengkatalisis secara aktif pembebasan unit-unit diasetilkhitobiosa tanpa terbentuk monosakarida dan oligosakarida. Pemotongan hanya terjadi pada bagian nonreduksi dan lebih teratur (tidak secara acak). Enzim ini sering juga disebut
khitobiosidase. Mekanisme pemotongan
endokitinase dan eksokitinase diperlihatkan
pada Gambar 2. Sedangkan
β-1,4-N-asetilglukosamidase merupakan enzim yang memotong kitin menjadi monomernya yaitu N-asetilglukosamina.
Kitinase dalam mikroorganisme dapat dihambat secara kompetitif oleh beberapa senyawa. Peter (2005) menuliskan bahwa kitinase dihambat oleh alosamidin dan beberapa senyawa selain gula. Argifin dan Argadin menghambat kitinase serangga Lucilia cuprina. Yurnaliza (2002) melaporkan bahwa N-asetilglukosamina dan glukosa menghambat sintetis kitinase pada Trichoderma harzianumm.
Enzim ini memiliki beberapa peranan penting dalam kehidupan manusia. Kitinase
dilaporkan dapat dimanfaatkan dalam
3
Gambar 2 Mekanisme pemotongan
eksokitinase dan endokitinase (Sahai&Manoca 1993).
N-asetilglukosamina
N-asetilglukosamina (GlcNAc)
merupakan monomer dari kitin yang
memiliki rumus molekul C6H15NO6 yang
berisi campuran murni 6.9 % nitrogen dengan struktur kimia yang sama dengan selulosa yang diganti oleh suatu unit asetil amino (CH3COONH2) (Pasaribu 2004). Struktur
kimia GlcNAc dapat dilihat pada Gambar 3. Pada umumnya GlcNAc berbentuk bubuk putih dengan rasa manis dan memiliki fungsi sebagai bioregulator. GlcNAc mendapat perhatian besar dalam osteoarthritis dan digunakan sebagai pengganti gula (Sashiwa et al. 2002). Selain itu, monosakarida ini dapat dimanfaatkan untuk kecantikan kulit, meningkatkan daya ingat, dan mengontrol fungsi usus dengan memacu perkembangan Bifidobakterium yang menguntungkan bagi tubuh manusia (Aiba 2009). Di alam,
GlcNAc dimanfaatkan mikroorganisme
sebagai sumber karbon dan nitrogen
(Yurnaliza 2002).
Senyawa GlcNAc pada umumnya
dihasilkan melalui hidrolisis asam (HCl) dari
kitin. Produksi GlcNAc paling bagus
dihasilkan dari hidrolisis β-kitin. Produksi GlcNAc dari kitin harus melewati dua tahap. Pada awalnya kitin dipecah secara perlahan oleh endokitinase menjadi oligosakarida. Selanjutnya, oligosakarida dipecah secara
cepat oleh eksokitinase menjadi GlcNAc (Sashiwa et al. 2002).
Gambar 3 Struktur kimia GlcNAc (Aiba 2009).
Aspergillusrugulosus 501
Aspergillus digolongkan dalam kapang lendir yang merupakan mikroorganisme yang heterogen (Pelczar&Chan 1986). Kapang A .rugulosus 501 merupakan koleksi dari laboratorium Koleksi Kultur Mikrob Bidang Mikrobiologi Puslit Biologi LIPI. Kapang ini dapat diisolasi dari tanah, kayu yang lapuk, dan lingkungan yang berair. Namun kapang ini paling banyak dijumpai di dalam tanah. Di dalam tanah, mikroorganisme ini berperan sebagai pengurai bahan-bahan organik dan membantu membentuk bongkahan tanah. Bahan-bahan organik yang mampu diuraikan adalah selulosa, hemiselulosa, tepung, inulin, kitin, dan tanin (Rao 1994).
Di alam, A. rugulosus 501 hidup secara aerob dengan kadar oksigen yang tinggi. Sedangkan pada kelembaban tanah yang terlalu tinggi jumlahnya menurun. Jamur ini dapat tumbuh dalam medium yang diasamkan (pH 5.0) dan kaya akan sumber karbon seperti monosakarida (glukosa) dan polisakarida (amilase).
Menurut Sutrisno (1998), A. rugulosus 501 digolongkan ke dalam kerajaan Jamur, divisi Mycophyta, kelas Eumycetes, sub kelas
Ascomycetes, ordo Plectuscales, famili
Aspergilaceae, genus Aspergillus, dan
species A. rugulosus 501. Ciri-ciri spesifik
kapang ini adalah memiliki rata-rata
pertumbuhan 3 hari. Spora A. rugulosus 501 berbentuk bulat dengan diameter 0.5-1 μm dan bereproduksi secara aseksual dengan membentuk spora. Pada Gambar 4 terlihat spora A. rugulosus 501 berwarna biru
kehijauan (Wulandari 2008). Beberapa
spesies Aspergillus dapat tumbuh baik pada suhu 37ºC tapi terdapat juga yang tumbuh pada suhu 28°C (Fardiaz 1992).
4
Kapang A. rugulosus 501 merupakan
spesies jamur yang memiliki aktivitas kitinase dari beberapa spesies dalam genus Aspergillus (Widhyastuti et al. 2006). Rattanakit et.al (2002) melakukan penelitian menggunakan ekstrak enzim kitinase dari isolat Aspergillus sp. untuk mendegradasi kitin menjadi N-asetilglukosamina dan menghasilkan 33% N-asetilglukosamina.
Pada umumnya, spesies Aspergillus yang bersifat patogen dapat menyebabkan infeksi,
alergi, dan keracunan. Penyakit yang
disebabkan oleh Aspergillus dikenal dengan nama Aspergillosis. Rabie et al. (1976)
melaporkan bahwa Aspergillus rugulosus
menghasilkan sterigmatosistin yaitu suatu senyawa yang bersifat karsinogenik pada hewan seperti ayam.
Gambar 4 Kapang A. rugulosus 501.
BAHAN DAN METODE
Bahan dan Alat
Bahan-bahan yang digunakan pada
penelitian ini adalah kitin udang berasal dari PT Vital House Cirebon, kentang, dekstrosa, KH2PO4, MgSO4.7H2O, agar bakteriologis,
bakto pepton, ekstrak khamir, amonium sulfat, urea, p-dimetilaminobenzaldehida (DMAB), asam asetat glasial, kalium tetraborat, akuades, HCl 10 N, tween 80, H2SO4 20%, etanol, asetonitril, standar
N-asetilglukosamina, dan akuades. Sedangkan kultur yang digunakan adalah A. rugulosus 501 dari koleksi laboratorium Koleksi Kultur Mikrob Bidang Mikrobiologi Puslit Biologi LIPI.
Alat-alat yang digunakan adalah alat-alat gelas, tip steril, alumunium foil, mikropipet, ose, kertas pH, tabung vial (ependorf), sudip, loop, plastik tahan panas, tabung film, dan bunsen, inkubator shaker, inkubator, High Performance Liquid Chromatography (HPLC), batang pengaduk, vorteks, lemari pendingin, pH meter, indikator pH, laminar air flow hood, sentrifuse mikro, freezer, neraca analitik, Hot Air Rapid Drying Oven,
autoklaf, freeze dryer, evaporator, dan spektrofotometer UV-Vis.
Metode Penelitian
Penelitian ini dilakukan melalui enam tahap, antara lain peremajaan kultur, produksi
GlcNAc, optimasi GlcNAc, analisis
kuantitatif GlcNAc dengan metode Reissig, analisis kualitatif GlcNAc, dan pemekatan GlcNAc sehingga diperoleh konsentrasi GlcNAc tinggi.
Peremajaan Kultur (Hadioetomo 1993)
Kapang (Aspergillus sp. 501)
ditumbuhkan dalam media agar miring Potato Dextrose Agar (PDA). Kemudian hasil peremajaan diinkubasi pada suhu 28ºC selama 2-3 hari. Untuk pemanenan spora,
sebanyak 3 mL akuades steril yang
ditambahkan tween sebanyak 0.1% (v/v) (Rattanakit et al. 2002) dimasukan ke dalam kultur pada agar miring. Spora dikorek dengan ose dan diencerkan dengan akuades steril yang ditambahkan tween hingga mencapai nilai OD 0,5. Pengukuran OD dilakukan menggunakan spektrofotometer UV-Vis pada λ 600 nm.
Produksi GlcNAc
Produksi N-asetilglukosamina dilakukan melalui proses fermentasi semi padat. Sebanyak 2% (v/v) kultur A. rugulosus 501 diinokulasikan ke dalam 50 mL media kitin
yanga terdiri atas kitin 2% (b/v),
KH2PO4.3H2O 0,1 % (b/v), MgSO4.7H2O 0.
0,5 % (b/v), sumber nitrogen 0.1% (b/v) (Wang et al. 2002), glukosa 2% (b/v), dan akuades. Kemudian media kitin diinkubasi pada inkubator shaker pada suhu ruang (28°C) selama 10 hari dengan pengambilan sampel pada hari ke- 0, 5, 6, 7, 8, 9, dan 10. (Wulandari 2008). Hasil produksi GlcNAc
kemudian dipekatkan konsentrasinya
menggunakan evaporator pada suhu 50ºC dan freeze dryer.
Optimasi Produksi GlcNAc
5
nitrogen lain, diantaranya urea, amonium sulfat, bakto pepton, dan ekstrak khamir.
Analisis Kuantitatif GlcNAc dengan metode Reissig et al. (1955)
Sampel yang diambil pada hari ke-0, 5, 6, 7, 8, 9, dan 10 disentrifuse pada kecepatan 10.000 g selama 5 menit. Supernatan sebanyak 0,25 mL dipisahkan kemudian ditambahkan kalium tetraborat pH 9,1 sebanyak 0,05 mL untuk mengikat GlcNAc. Larutan direndam dalam air mendidih selama
3 menit untuk mempercepat reaksi
pengikatan antara kalium tetraborat dengan
GlcNAc. Setelah dingin, ditambahkan
reagent p-dimetilaminobenzaldehida
(DMAB) sebanyak 1,25 mL lalu dengan segera diinkubasi pada suhu 37ºC selama 20 menit. Selanjutnya, absorban diukur dengan spektrofotometer UV-Vis pada panjang gelombang 584 nm. Untuk kurva standar, konsentrasi standar GlcNAc yang digunakan adalah 10, 20, 30, 40, 50, dan 60 μg/mL.
Analisis Kualitatif GlcNAc
Kandungan GlcNac dalam sampel
dianalisis dengan HPLC (Shimadzu model LC20AB) menggunakan kolom C18. Fase gerak yang digunakan adalah asetonitril:air (70:30, v/v) dengan rata-rata aliran 1 mL/menit dan suhu ruang (Kuk et al. 2005). Produk diidentifikasi menggunakan detektor UV pada panjang gelombang 230 nm.
Pemekatan Konsentrasi GlcNAc
Pemekatan konsentrasi GlcNAc yang
diperoleh dari fermentasi dilakukan
menggunakan dua alat yaitu evaporator dan freeze dryer. Ekstrak ferementasi sebanyak kurang lebih 500 mL dievaporator pada suhu 50°C selama kurang lebih 2 jam hingga diperoleh volume akhir 10 mL. Pemekatan menggunakan freeze dryer, sampel dibekukan terlebih dahulu pada suhu -40°C, setelah itu dalam keadaan vakum, sampel dikering bekukan pada tekanan 0,1 atm hingga hampir seluruh H2O hilang dan sampel menjadi
serbuk basah.
Analisis Statistik
Analisis statistik yang digunakan adalah
rancangan acak kelompok (RAK)
(Mattjik&Sumertajaya 2002). Model linier yang digunakan adalah
Yij = µ + τi + βj + εij
keterangan:
i = sumber nitrogen; j = waktu inkubasi; Yij = pengamatan pada perlakuan ke-i
dan kelompok ke-j
µ = rataan umum
τi= pengaruh perlakuan ke-i
βj= pengaruh kelompok ke-j
εij= pengaruh acak pada perlakuan ke-i dan
kelompok ke-j.
Data yang diperoleh dianalisis dengan uji Duncan pada tingkat kepercayaan 95% dan taraf 0,05. Analisis data dilakukan dengan program SAS.
HASIL DAN PEMBAHASAN
Produksi GlcNAc
Produksi GlcNAc dalam penelitian ini dilakukan dengan metode fermentasi substrat semi padat. Kapang A. rugulosus 501 yang diinokulasikan dalam media kitin diharapkan mampu mendegradasi kitin menjadi GlcNAc
yang larut dalam ekstrak dari hasil
fermentasi. Jumlah A. rugulosus 501 yang
diinokulasikan ke dalam media kitin
sebanyak 1% (v/v). Media kitin (Gambar 5) yang digunakan dalam penelitian ini terdiri atas kitin yang masih berbentuk lembaran, KH2PO4, MgSO4. 7H2O, glukosa, dan
berbagai sumber nitrogen organik dan anorganik. Lembaran kitin dalam penelitian ini berfungsi sebagai substrat fermentasi semi padat. KH2PO4 dan MgSO4. 7H2O berfungsi
sebagai sumber mineral yaitu kalium (K), magnesium (Mg), dan belerang (S), makro elemen, dan buffer pH. Glukosa berfungsi sebagai sumber karbon dan energi untuk pertumbuhan mikroorganisme. Komposisi dalam media kitin ini bertujuan untuk memenuhi kebutuhan nutrisi bagi kapang A. rugulosus 501. Semakin baik pertumbuhan A. rugulosus 501, maka semakin banyak enzim kitinase yang dihasilkan dan produksi GlcNAc juga semakin banyak.
6
Media kitin yang telah diinokulasi kapang A. rugulosus 501 kemudian diinkubasi selama 10 hari (Wulandari 2009). Lamanya inkubasi ini disebabkan karena kitin masih
berbentuk lembaran sehingga untuk
menghidrolisis kitin menjadi GlcNAc
membutuhkan waktu yang lama. Suhu inkubasi yang digunakan adalah suhu ruang yang merupakan suhu paling baik untuk A. rugulosus 501 memproduksi enzim kitinase. Setelah 10 hari inkubasi, media kitin yang telah diinokulasi A. rugulosus 501 tampak jernih yang menunjukkan bahwa kitin telah dihidrolisis menjadi GlcNAc.
Hasil Optimasi
Pengaruh pH Awal Media Kitin pada Produksi GlcNAc
Optimasi pH awal media kitin dilakukan untuk memproduksi GlcNAc antara lain pH 4,0; 5,0; 6,0; 7,0. Optimasi pH ini
dimaksudkan untuk memacu pertumbuhan A.
rugulosus 501 sehingga mampu menghidrolisis kitin menjadi GlcNAc dengan enzim kitinase yang dihasilkan. Optimasi pH pada media dapat dilihat pada Gambar 6. Produksi GlcNAc tertinggi terjadi pada media kitin yang memiliki pH awal 4,0 yaitu 1,669 μg/mL pada hari ke-8, diiukuti pH 5,0; 6,0; dan 7,0. Hal ini sesuai dengan penelitian yang dilakukan oleh Rattanakit et al. (2002) bahwa
produksi GlcNAc tertinggi melalui
fermentasi substrat padat dengan ekstrak enzim dari Aspergillus sp. antara lain berturut-turut pH 4,0; 5,0; 6,0; 7,0. Produksi GlcNAc tertinggi terjadi pada pH 4,0 disebabkan pada media pH 4,0 merupakan nilai pH yang baik untuk pertumbuhan A. rugulosus 501. Selain itu, Yurnaliza (2002) menyatakan bahwa kitinase bersifat aktif pada pH asam.
Gambar 6 Pengaruh pH pada produksi GlcNAc. (♦) pH 4, (■) pH 5, (▲) pH 6, (x) pH 7.
Selama proses fermentasi terjadi
penurunan nilai pH pada media. Penurunan pH dapat dilihat pada Gambar 7. Inkubasi selama 5 hari seluruh media cenderung mengalami penurunan pH menjadi pH 3,0 dan stabil hingga hari ke-10. Hal ini disebabkan adanya aktivitas ekstraseluler pada sel A. rugulosus 501 yang mengeluarkan senyawa-senyawa asam selama pertumbuhan seperti asam piruvat dan asam asetat. (Pelczar&Chan 1986).
Gambar 7 Penurunan pH media kitin selama fermentasi dengan pengaruh pH awal. (♦) pH 4, (■) pH 5, (▲) pH 6, (x) pH 7.
Pengaruh Sumber Nitrogen (N) pada Produksi GlcNAc
Nitrogen diperlukan untuk pembentukan protoplasma dan dinding sel. Sumber N dapat berasal dari pepton, ekstrak khamir, urea, amonium nitrat, polipepton, dan amonium sulfat. Konsentrasi sumber N dalam media perlu diperhatikan. Kadar nitrogen yang
terlalu tinggi akan menyebabkan
perbandingan C dan N menjadi lebih kecil sehingga A. rugulosus 501 tidak dapat tumbuh dengan baik (Widhyastuti et al. 2008).
7
yang baik untuk produksi enzim kitinase (Souza et al. 2004; Widhyastuti et al. 2008).
Urea merupakan sumber N anorganik yang bagus untuk pertumbuhan dan produksi enzim kitinase dari A. rugulosus 501 sehingga GlcNAc yang dihasilkan juga tinggi. Sedangkan ekstrak khamir dan bakto pepton merupakan sumber N organik yang
baik untuk produksi enzim kitinase.
Widhyastuti et al. (2008) melaporkan bahwa aktivitas kitinase A. rugulosus 501 tertinggi diperoleh pada media yang mengandung polipepton (7,602 x 10-2 U/mL) dan urea (7,558 x 10-2 U/mL).
Berbeda dengan sumber N lainnya, amonium sulfat yang merupakan sumber N anorganik memperlihatkan produksi GlcNAc
paling rendah. Meskipun mengalami
peningkatan produksi GlcNAc pada hari ke-6, namun pada hari ke-7 mengalami penurunan drastis dan meningkat yang cukup tidak berarti pada hari ke-8 dan tetap stabil sampai hari ke-10. Kecilnya produksi GlcNAc pada media yang mengandung amonium sulfat disebabkan amonium sulfat dapat membebaskan amonia yang bersifat
toksik sehingga dapat menghambat
pertumbuhan A. rugulosus 501.
Amonium sulfat digunakan sebagai
sumber N karena memiliki kelarutan yang tinggi, harga murah dan tidak mempengaruhi struktur protein. Namun amonium sulfat tidak bersifat sebagai larutan penyangga dan dapat
membebaskan amonia sehingga
memungkinkan terjadinya penambahan pH (Suhartono 1989 di dalam Nuraida et al. 2005). Nuraida et al. (2005) melaporkan bahwa yield biomassa Aspergillus sp. pada media yang mengandung amonium sulfat memiliki kisaran yang kecil dibandingkan yield biomassa Aspergillus sp. pada media yang mengandung pepton dan ekstrak khamir. Semakin meningkat konsentrasi amonium sulfat dalam media, yield biomassa Aspergillus sp. yang dihasilkan semakin kecil.
Selama proses fermentasi, media dengan berbagai sumber N cenderung mengalami penurunan pH menjadi pH 3,0 dan stabil hingga hari ke-10. Penurunan pH ini disebabkan adanya penambahan glukosa sebagai sumber karbon dalam media kitin. Jenkins di dalam Desniar (2004) menyatakan bahwa jika sumber karbon yang paling besar di dalam kultur medium adalah suatu karbohidrat maka pH akan turun selama pertumbuhan di bawah kondisi aerob.
Mikroorganisme menghasilkan senyawa
metabolisme seperti asam piruvat dan asam asetat dengan adanya gula berlebih. Asam organik jika berdisosiasi dalam air akan menghasilkan H+ yang dapat menurunkan pH cairan kultivasi. Media dengan sumber N urea pada hari ke-9 cenderung mengalami peningkatan pH hingga hari ke-10 (Gambar 9). Peningkatan pH ini disebabkan oleh penggunaan urea sebagai sumber N akan
menyebabkan terakumulasinya alkalin
sebagai hasil metabolisme urea.
Media kitin tanpa sumber N digunakan sebagai kontrol dalam produksi GlcNAc.
Kitin memiliki rumus empiris
C6H6CNHCOCH3 dan berisi campuran murni
6,9% nitrogen (Pasaribu 2004). Hal ini menyebabkan kitin dapat digunakan sebagai sumber C dan N sehingga tanpa adanya penambahan sumber N, A. rugulosus 501 bisa tumbuh dengan baik dan menghasilkan enzim kitinase. Hal ini terbukti dalam media
tersebut menghasilkan GlcNAc dengan
jumlah yang cukup tinggi.
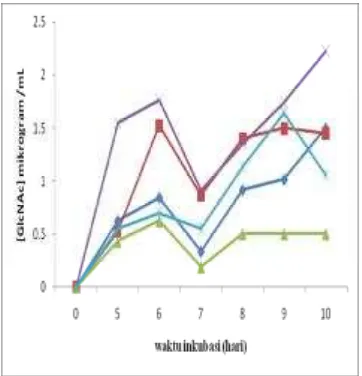
Berdasarkan analisis statistik, perlakuan sumber N dan kelompok waktu berbeda nyata terhadap produksi GlcNAc dengan tingkat kepercayaan 0,05. Hal ini menunjukan bahwa sumber N dan waktu inkubasi mempengaruhi
produksi GlcNAc. Hasil uji Duncan
menunjukan sumber N urea dan amonium sulfat memiliki perbedaan yang signifikan. Sumber N ekstrak khamir, bakto pepton, dan media tanpa sumber N tidak memiliki perbedaan pengaruh yang signifikan terhadap produksi GlcNAc.
8
Gambar 9 Penurunan pH media kitin selama fermentasi. (♦) bacto pepton, (■) ekstrak khamir, (▲) amonium sulfat, (x) urea, (*) tanpa sumber N.
Pemekatan Konsentrasi GlcNAc dari Hasil Fermentasi
Senyawa GlcNAc yang diperoleh dari
fermentasi dapat dikumpulkan dengan
memekatkan konsentarsi GlcNAc. Proses pemekatan pada umumnya dilakukan dengan ultrafiltrasi. Tujuan pemekatan konsentrasi
ini adalah untuk memudahkan isolasi
GlcNAc dari ekstrak fermentasi. Aiba (2009) melakukan isolasi GlcNAc melalui presipitasi menggunakan etanol absolut diperoleh 43% GlcNAc. Setthakaset (2008) dengan cara yang sama diperoleh 65% GlcNAc.
Konsentrasi optimum GlcNAc yang dihasilkan dalam penelitian ini sangat rendah yaitu 2,228 μg/mL. Hasil ini lebih rendah dari produksi GlcNAc yang diperoleh melalui metode kimia yaitu di bawah 65% (Sashiwa et.al 2002). Rendahnya konsentrasi ini disebabkan oleh sulitnya enzim kitinase menghidrolisis ikatan β (1-4) glikosidik pada kitin yang masih berupa lembaran. Untuk memperoleh konsentrasi GlcNAc yang lebih tinggi maka dilakukan proses pemekatan konsentrasi GlcNAc. Dalam penelitian ini
konsentrasi GlcNAc dipekatkan
menggunakan evaporatordan freeze dryer. Evaporator adalah alat yang digunakan untuk meningkatkan konsentrasi dengan menghilangkan pelarut (H2O) melalui proses
evaporasi. Hasil pemekatan yang diperoleh berupa larutan kental berwarna coklat kekuningan. Freeze dryer merupakan alat yang dapat memekatkan konsentrasi GlcNAc melalui proses perubahan wujud dari padat menjadi uap (sublimasi) pada suhu dan tekanan yang sangat rendah (-40°C, 0,1 atm). Hasil pemekatan dari freeze dryer diperoleh berupa serbuk berwarna coklat dan setelah dilarutkan menggunakan buffer diperoleh larutan berwarna kuning pekat (Gambar 10).
(a) (b)
(c) (d)
Gambar 10 Ekstrak fermentasi kitin oleh A. rugulosus 501. (a) Sebelum dipekatkan; (b) Hasil pemekatan evaporator; (c) Hasil pemekatan freeze dryer; dan (d) Hasil
pemekatan freeze dryer
dilarutkan buffer asetat.
Analisis dengan metode Reissig (1955)
pada λ 584 nm menunjukan OD larutan
setelah dipekatkan 0,126 sedangkan sebelum dipekatkan 0,33. Akan tetapi, ekstrak
fermentasi yang dipekatkan setelah
ditambahkan kalium tetraborat dan DMAB menghasilkan warna kuning coklat. Hal ini
menyebabkan panjang gelombang
maksimum sampel dalam metode Reissig berubah (Gambar 11).
Standar GlcNAc memiliki panjang
gelombang maksimum 584 nm. Hal ini sesuai dengan penelitian yang dilakukan Reissig et al. (1955). Ekstrak fermentasi yang dipekatkan dengan evaporator tidak
menunjukan puncak sebagai panjang
gelombang maksimum. Hal ini juga terjadi pada ekstrak yang dipekatkan menggunakan freeze dryer.
Warna coklat yang dihasilkan dari proses pemekatan merupakan hasil samping dari fermentasi kitin oleh A. rugulosus 501. Selama fermentasi kapang A. rugulosus 501 tidak hanya melepaskan enzim kitinase tetapi juga senyawa lain sebagai hasil metabolisme berupa asam-asam organik (Pelczar&Chan 1986). Dimungkinkan hasil samping yang diproduksi A .rugulosus 501 lebih banyak dibanding GlcNAc, sehingga konsentrasi GlcNAc sulit dianalisis dengan metode
Reissig. Kemungkinan lainnya adalah
9
(a)
(b)
(c)
Gambar 11 Panjang gelombang maksimum
dengan metode Reissig. (a)
Standar GlcNAc; (b) Hasil
pemekatan evaporator; (c) Hasil pemekatan freeze dryer.
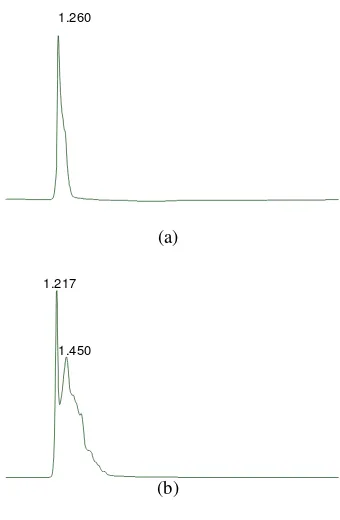
Banyaknya hasil samping dari fermentasi ini juga terlihat pada analisis menggunakan HPLC (Gambar 12). Hasil analisis HPLC menunjukkan adanya puncak yang memiliki waktu retensi (Rt) sama dengan standar GlcNAc yaitu 1,2. Ini menunjukkan adanya GlcNAc dalam ekstrak fermentasi. Namun selain puncak tersebut, juga terdapat puncak yang berdekatan dengan puncak GlcNAc dengan Rt 1,4. Puncak ini merupakan oligomer hasil hidrolisis dari kitin selama fermentasi.
(a)
(b)
Gambar 12 Hasil analisis HPLC. (a) Standar GlcNAc 1000 ppm; (b) Sampel hasil fermentasi.
SIMPULAN DAN SARAN
Simpulan
Produksi tertinggi GlcNAc (2,228 μg/mL) dari kitin melalui fermentasi substrat semi padat diperoleh pada media yang memiliki pH awal 4,0 dan sumber N urea pada hari ke-10.
Saran
Perlu adanya penambahan substrat
fermentasi seperti dedak untuk memacu
pertumbuhan kapang A. rugulosus 501,
sehingga konsentrasi GlcNAc dapat
ditingkatkan. Produksi GlcNAc dengan metode ini kurang efektif karena GlcNAc yang dihasilkan masih sangat rendah, sehingga perlu dicari metode lain yang lebih efektif.
DAFTAR PUSTAKA
Aiba S. 2009. Chemical and enzymatic modification of chitin and chitosan towards functional materials. [Laporan Penelitian]. Ibaraki: Environmentally Degradable Polymer Research Group, 1.217
10
Institute for Biological Resources and Functions-AIST.
DKP [Departemen Kelautan dan Perikanan]. 2000. Statistik Data Perikanan.Jakarta: Departemen Kelautan dan Perikanan.
Desniar. 2004. Pemanfaatan tetes tebu (Molases) dan urea sebagai sumber karbon dan nitrogen dalam produksi alginat yang dihasilkan oleh bakteri Pseudomonas aeruginosa. Buletin Teknologi Hasil Perikanan 7:26-36.
Fardiaz S. 1992. Mikribiologi Pangan I. Jakarta: Gramedia Pustaka Utama.
Hadioetomo RS. 1993. Mikrobiologi Dasar dalam Praktek. Jakarta: Gramedia Pustaka Utama.
Kuk et al. 2005. Production of
N-acetyl-β-D-glucosamine from chitin by
Aeromonas sp. GJ-18 crude enzyme. Appl Microbiol Biotechnol 68: 384-389.
Mattjik AA, Sumertajaya IM. 2002.
Perancangan Percobaan. Bogor: IPB Press.
Nuraida L, Sugiyono, Didah N, Nurheni SP. 2005. Produksi lipase Aspergillus sp. dengan teknik imobilisasi. [Laporan Penelitian]. Bogor: IPB Press.
Pasaribu N. 2004. Berbagai ragam
pemanfaatan polimer.
http://library.usu.ac.id/download/ft/tki mia-nurhaida.pdf [28 Juni 2008].
Pelczar MJ, Chan ECS. 1986. Dasar-dasar Mikrobiologi. Hadioetomo RS, Imas
T, Tjitrosomo SS, Angka SL,
penerjemah. Jakarta : UI press.
Terjemahan dari : Elements of
Microbiology.
Peter MG. 2005. Chitin and chitosan from animal sources. Di dalam: Steinbuchel
A dan SK Rhee, editor.
Polysacharides and Polyamides in the Food Industry. Volume ke-1. Wernheim: Wiley-VCH.
Piza FAT, Siloto AP, Carvalho CV, Franco TT. 1999. Production, characterization and purification of chitosanase from Bacillus cereus. Braz. J. Chem. Eng 16 : 185-192.
Rabie CJ, Steyn M, Schalkwyk van GC. 1976. New species of Aspergillus producing sterigmatocystin. Applied
and Environmental Microbiology 33: 1023-1025.
Rao NS. 1994. Mikroorganisme Tanah dan Pertumbuhan Tanaman. Herwati Susilo;penerjemah. Jakarta: UI Press. Terjemahan dari: Soil Microoganisms and Plant Growth.
Rattanakit N et al. 2002. Saccharification of chitin using solid-state culture of Aspergillus sp. S1-13 with shellfish waste as a substrate. Journal of Bioscience and Bioengineering 95: 391-396.
Reissig JL, Strominger JL, Leloir FA. 1955. A modified colorimetric method for
the estimation of N-acetylamino
sugars. J. Biol. Chem 217:959-966.
Sahai AS, Manocha MS. 1993. Chitinases of fungi and plants: their involvement in
morphogenesis and host-parasite
interaction. FEMS Microbiolology
11:317-338.
Sashiwa H et al. 2002. Production of N-acetyl-D-glucosamine from α-chitin
by crude enzymes from Aeromonas
hydrophyla H-2330. Carbohydrate Research 337:761-763.
Setthakaset P, Rath P, Anawat A, Mongkol S. 2008. Preparation of N -acetyl-D-glucosamine using enzyme from Aspergillus sp.. Journal of Metals, Materials and Minerals 18: 53-57.
Setyahadi S. 2006. Pengembangan produksi kitin secara mikrobiologi. Di dalam: Prospek Produksi dan Aplikasi Kitin-kitosan sebagai Bahan Alami dalam Membangun Kesehatan Masyarakat dan Menjamin Keamanan Produk. Prosiding Seminar Nasional Kitin Kitosan; Bogor, Mei 2006. Bogor: Departemen Teknologi Hasil Perairan. hlm 33-51.
Souza RF, Soares RMA, Nascimento RP, Coelho RRR, Gomes RC. 2004. Effect
of different carbon sources on
endochitinase production by
Colletotrichum gloeosporioides. Current Microbiology 51: 16-21.
Sutrisno B. 1998. Taksonomi Tumbuhan
untuk Farmasi. Jakarta: Fakultas Farmasi, Universitas Pancasila.
11
of two antifungal chitinases
extracellularly produced by Bacillus amyloliquefaciens V656 in a shrimp and crab shell powder medium. Journal of Agricultural and Food Chemistry 50: 2241-2248.
Wibowo S. 2006. Produksi kitin kitosan secara komersial. Di dalam: Prospek Produksi dan Aplikasi Kitin-kitosan sebagai Bahan Alami dalam Membangun Kesehatan Masyarakat dan Menjamin Keamanan Produk. Prosiding Seminar Nasional Kitin Kitosan; Bogor, Mei 2006. Bogor:
Departemen Teknologi Hasil
Perairan.hlm 33-51.
Widhyastuti N et al. 2006. Studi potensi Aktinomisetes untuk produksi enzim kitinase guna menunjang industri farmasi. [Laporan Teknik 2006]. Bogor: Bidang Mikrobiologi, Pusat Penelitian Biologi-LIPI.
Widhyastuti N, Kasirah, Ninu Setianingrum. 2008. Produksi kitinase Aspergillus rugulosus 501 pada media cair.
[Laporan Teknik 2008]. Bogor:
Bidang Mikrobiologi, Pusat Penelitian Biologi-LIPI.
Wulandari F. 2008. Optimasi produksi N-asetilglukosamina dari kitin melalui fermentasi oleh Aspergillus rugulosus 501 dan Streptomyces sp. [Laporan Praktik Lapangan]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Yurnaliza. 2002. Senyawa kitin dan kajian
aktivitas enzim mikrobial
13
Lampiran 1 Produksi GlcNAc dari kitin melalui fermentasi semi padat
Peremajaan mikrob
Produksi GlcNAc melalui fermentasi
substrat semi padat
Analisis GlcNAc
- Metode Reissig
1955
- HPLC
Pemekatan konsentrasi GlcNAc
-
rotary evaporator
- fresh dryer
Perlakuan pada
media
Sumber N:
-
Ekstrak khamir
-
Bakto pepton
-
Amonium sulfat
-
urea
Pengaruh pH:
14
Lampiran 2 Analisis kuantitatif GlcNAc dengan metode Reissig (1955)
0,5 mL sampel
(sampling hari
ke-5,6,7,8,9, dan 10)
sentrifus
0,25 mL
supernatan
0,05 mL
kalium
tetraborat
Diinkubasi dalam air
mendidih (3 menit)
1,25 mL reagent
p-dimetilaminobenzaldehida
(DmAB)
Inkubasi 37°C
20 menit
Spektrofotometer
λ584 nm
15
Lampiran 3 Pembuatan reagent dan pereaksi yang digunakan dalam penelitian
Kalium tetraborat
Sebanyak 2,444 gram serbuk kalium tetraborat ditambahkan 20 mL akuades
kemudian ditambahkan larutan KOH 0,5 N untuk menaikan pH dan larutan asam
borat 1 N untuk menurunkan pH sampai mencapai nilai pH 9,1
DMAB (p-dimetilaminobenzaldehida)
Sebanyak 1 gram serbuk DMAB ditambahkan 1,25 mL HCl 10 N dan 8,75 mL
asam asetat di dalam botol gelap. Sedangkan reagent DMAB untuk analisis
terdiri atas 1 mL DMAB induk ditambahkan 9 mL asam asetat glasial.
Lampiran 4 Kurva standar GlcNAc
no.
konsentrasi
µg
(0,25ml)
serapan
1
0
0
2
2,5
0,151
3
5
0,298
4
7,5
0,428
5
10
0,592
6
12,5
0,696
7
15
0,821
8
20
1,048
Persamaan:
16
Lampiran 5 Pengaruh pH pada produksi GlcNAc melalui fermentasi semi padat
Hari ke-0
Hari ke-5
Sampel Ulangan Serapan
[GlcNAc]
µg/mL
[GlcNAc]
terkoreksi
Rata-rata
pH4
1
0,02
0,102028
0,40811
0,247812
pH 4
2
0,014
0
0
pH 4
3
0,019
0,083832
0,335326
pH 5
1
0,019
0,083832
0,335326
0,335326
pH 5
2
0,019
0,083832
0,335326
pH 5
3
0,019
0,083832
0,335326
pH 6
1
0,019
0,083832
0,335326
0,432372
pH 6
2
0,02
0,102028
0,40811
pH 6
3
0,022
0,13842
0,553678
pH 7
1
0,02
0,102028
0,40811
0,40811
pH 7
2
0,023
0,156616
0,626462
pH 7
3
0,02
0,102028
0,40811
Sampel
Ulangan Serapan
[GlcNAc]
µg/mL
[GlcNAc]
terkoreksi
Rata-rata
pH4
1
0,009
0
0
0
pH 4
2
0,01
0
0
pH 4
3
0,009
0
0
pH 5
1
0,012
0
0
0,223551
pH 5
2
0,019
0,083832
0,335326
pH 5
3
0,019
0,083832
0,335326
pH 6
1
0,019
0,083832
0,335326
0,432372
pH 6
2
0,023
0,156616
0,626462
pH 6
3
0,019
0,083832
0,335326
pH 7
1
0,011
0
0
0
pH 7
2
0,008
0
0
17
Lampiran 5 (lanjutan)
Hari ke-6
Hari ke-7
Sampel
Ulangan
Serapan
[GlcNAc]
µg/mL
[GlcNAc]
terkoreksi
Rata-rata
pH4
1
0,019
0,083832
0,335326
0,432372
pH 4
2
0,02
0,102028
0,40811
pH 4
3
0,022
0,13842
0,553678
pH 5
1
0,018
0,065636
0,262542
0,262542
pH 5
2
0,018
0,065636
0,262542
pH 5
3
0,018
0,065636
0,262542
pH 6
1
0,02
0,102028
0,40811
0,383849
pH 6
2
0,02
0,102028
0,40811
pH 6
3
0,019
0,083832
0,335326
pH 7
1
0,018
0,065636
0,262542
0,262542
pH 7
2
0,013
0
0
pH 7
3
0,014
0
0
Sampel Ulangan
Serapan
[GlcNAc]
µg/mL
[GlcNAc]
terkoreksi
Rata-rata
pH4
1
0,031
0,302184
1,208734
0,650724
pH 4
2
0,018
0,065636
0,262542
pH 4
3
0,021
0,120224
0,480894
pH 5
1
0,02
0,102028
0,40811
0,432372
pH 5
2
0,02
0,102028
0,40811
pH 5
3
0,021
0,120224
0,480894
pH 6
1
0,021
0,120224
0,480894
0,529417
pH 6
2
0,022
0,13842
0,553678
pH 6
3
0,022
0,13842
0,553678
pH 7
1
0,022
0,13842
0,553678
0,553678
pH 7
2
0,021
0,120224
0,480894
18
Lampiran 5 (lanjutan)
Hari ke-8
Sampel
Ulangan
Serapan
[GlcNAc]
µg/mL
[GlcNAc]
terkoreksi
Rata-rata
pH4
1
0,029
0,265792
1,063166
1,669699
pH 4
2
0,023
0,156616
0,626462
pH 4
3
0,06
0,829867
3,31947
pH 5
1
0,026
0,211204
0,844814
0,869075
pH 5
2
0,027
0,2294
0,917598
pH 5
3
0,026
0,211204
0,844814
pH 6
1
0,027
0,2294
0,917598
0,626462
pH 6
2
0,021
0,120224
0,480894
pH 6
3
0,021
0,120224
0,480894
pH 7
1
0,018
0,065636
0,262542
0,262542
pH 7
2
0,018
0,065636
0,262542
pH 7
3
0,016
0,029244
0,116974
Hari ke-9
Sampel
ulangan Serapan
[GlcNAc]
µg/mL
[GlcNAc]
terkoreksi
Rata-rata
pH4
1
0,025
0,193008
0,77203
0,917598
pH 4
2
0,024
0,174812
0,699246
pH 4
3
0,032
0,32038
1,281518
pH 5
1
0,029
0,265792
1,063166
1,038905
pH 5
2
0,026
0,211204
0,844814
pH 5
3
0,031
0,302184
1,208734
pH 6
1
0,029
0,265792
1,063166
0,747769
pH 6
2
0,024
0,174812
0,699246
pH 6
3
0,021
0,120224
0,480894
pH 7
1
0,019
0,083832
0,335326
0,335326
pH 7
2
0,017
0,04744
0,189758
19
Lampiran 5 (lanjutan)
Hari ke-10
Sampel
Ulangan Serapan
[GlcNAc]µg/mL
[GlcNAc]
terkoreksi
Rata-rata
pH4
1
0,023
0,156616
0,626462
0,57794
pH 4
2
0,018
0,065636
0,262542
pH 4
3
0,026
0,211204
0,844814
pH 5
1
0,021
0,120224
0,480894
0,432372
pH 5
2
0,019
0,083832
0,335326
pH 5
3
0,021
0,120224
0,480894
pH 6
1
0,023
0,156616
0,626462
0,480894
pH 6
2
0,021
0,120224
0,480894
pH 6
3
0,019
0,083832
0,335326
pH 7
1
0,024
0,174812
0,699246
0,699246
pH 7
2
0,021
0,120224
0,480894
20
Lampiran 6 Pengaruh sumber N pada produksi GlcNAc melalui fermentasi semi
padat
Hari ke-0
sumber N
ulangan serapan
[GlcNAc]
µg/mL
[GlcNAc]
terkoreksi
Rata-rata
bakto pepton
1
0,014
0
0
0
2
0,006
0
0
3
0,006
0
0
ekstrak khamir
1
0,01
0
0
0
2
0,009
0
0
3
0,009
0
0
amonium sulfat
1
0,013
0
0
0
2
0,01
0
0
3
0,008
0
0
urea
1
0,007
0
0
0
2
0,008
0
0
3
0,005
0
0
tanpa sumber N
1
0,003
0
0
0
2
0,005
0
0
3
0,004
0
0
Hari ke-5
sumber N
ulangan serapan
[GlcNAc]
µg/mL
[GlcNAc]
terkoreksi
Rata-rata
bakto pepton
1
0,027
0,2294
0,917598128
0,626462
2
0,02
0,102028
0,408110216
3
0,022
0,13842
0,553678191
ekstrak khamir
1
0,021
0,120224
0,480894203
0,529417
2
0,019
0,083832
0,335326228
3
0,025
0,193008
0,772030153
amonium sulfat
1
0,022
0,13842
0,553678191
0,432372
2
0,02
0,102028
0,408110216
3
0,019
0,083832
0,335326228
urea
1
0,036
0,393164
1,572654016
1,548393
2
0,034
0,356772
1,427086041
3
0,037
0,41136
1,645438004
tanpa sumber N
1
0,023
0,156616
0,626462178
21
Lampiran 6 (lanjutan)
Hari ke-6
sumber N
ulangan serapan
[GlcNA]
µg/mL
[GlcNAc]
terkoreksi
Rata-rata
bakto pepton
1
0,026
0,211204
0,844814141
0,844814
2
0,022
0,13842
0,553678191
3
0,03
0,283988
1,135950091
ekstrak khamir
1
0,036
0,393164
1,572654016
1,524131
2
0,031
0,302184
1,208734079
3
0,039
0,447751
1,791005979
amonium sulfat
1
0,024
0,174812
0,699246166
0,626462
2
0,024
0,174812
0,699246166
3
0,021
0,120224
0,480894203
urea
1
0,038
0,429555
1,718221991
1,766745
2
0,042
0,502339
2,009357941
3
0,036
0,393164
1,572654016
tanpa sumber N
1
0,025
0,193008
0,772030153
0,699246
2
0,023
0,156616
0,626462178
3
0,024
0,174812
0,699246166
Hari ke-7
sumber N
ulangan serapan
[GlcNAc]
µg/mL
[GlcNAc]
terkoreksi
Rata-rata
bakto pepton
1
0,019
0,083832
0,335326228
0.335326
2
0,017
0,04744
0,189758253
3
0,021
0,120224
0,480894203
ekstrak khamir
1
0,025
0,193008
0,772030153
0.869075
2
0,025
0,193008
0,772030153
3
0,029
0,265792
1,063166103
amonium sulfat
1
0,017
0,04744
0,189758253
0.189758
2
0,017
0,04744
0,189758253
3
0,017
0,04744
0,189758253
Urea
1
0,024
0,174812
0,699246166
0.917598
2
0,028
0,247596
0,990382116
3
0,029
0,265792
1,063166103
tanpa sumber N
1
0,022
0,13842
0,553678191
0,553678
2
0,022
0,13842
0,553678191
22
Lampiran 6 (lanjutan)
Hari ke-8
sumber N
ulangan serapan
[GlcNAc]
µg/mL
[GlcNAc]
terkoreksi
Rata-rata
bakto pepton
1
0,027
0,2294
0,917598128
0.917598
2
0,024
0,174812
0,699246166
3
0,03
0,283988
1,135950091
ekstrak khamir
1
0,033
0,338576
1,354302054
1.402825
2
0,03
0,283988
1,135950091
3
0,038
0,429555
1,718221991
amonium sulfat
1
0,022
0,13842
0,553678191
0.505156
2
0,021
0,120224
0,480894203
3
0,021
0,120224
0,480894203
urea
1
0,033
0,338576
1,354302054
1.354302
2
0,033
0,338576
1,354302054
3
0,033
0,338576
1,354302054
tanpa sumber N
1
0,024
0,174812
0,699246166
1,13595
2
0,036
0,393164
1,572654016
3
0,03
0,283988
1,135950091
Hari ke-9
sumber N
ulangan serapan
[GlcNAc]
µg/mL
[GlcNAc]
terkoreksi
Rata-rata
bakto pepton
1
0,028
0,247596
0,990382116
1.014643
2
0,026
0,211204
0,844814141
3
0,031
0,302184
1,208734079
ekstrak khamir
1
0,038
0,429555
1,718221991
1.49987
2
0,033
0,338576
1,354302054
3
0,034
0,356772
1,427086041
Amonium sulfat
1
0,021
0,120224
0,480894203
0.505156
2
0,022
0,13842
0,553678191
3
0,021
0,120224
0,480894203
Urea
1
0,045
0,556927
2,227709904
1.742483
2
0,036
0,393164
1,572654016
3
0,034
0,356772
1,427086041
tanpa sumber N
1
0,03
0,283988
1,135950091
1,378563
2
0,033
0,338576
1,354302054
23
Lampiran 6 (lanjutan)
Hari ke-10
sumber N
ulangan serapan
[GlcNAc]
µg/mL
[GlcNAc]
terkoreksi
Rata-rata
bakto pepton
1
0,028
0,247596
0,990382116
1.49987
2
0,024
0,174812
0,699246166
3
0,053
0,702495
2,809981804
ekstrak khamir
1
0,039
0,447751
1,791005979
1.451347
2
0,032
0,32038
1,281518066
3
0,032
0,32038
1,281518066
amonium sulfat
1
0,022
0,13842
0,553678191
0.505156
2
0,021
0,120224
0,480894203
3
0,021
0,120224
0,480894203
urea
1
0,052
0,684299
2,737197816
2.22771
2
0,044
0,538731
2,154925916
3
0,039
0,447751
1,791005979
tanpa sumber N
1
0,025
0,193008
0,772030153
1,014643
2
0,031
0,302184
1,208734079
3
0,029
0,265792
1,063166103
Lampiran 7 Contoh perhitungan
Persamaan kurva standar
y = 0,014393 + 0,054957x
a = 0,014393
b = 0,054957
y = Absorbans
x = [GlcNAc]
y = 0,014393 + 0,054957x
0,030 = 0,014393 + 0,054957x
x = 0,283988
[GlcNAc] = 0,283988 μg/mL
24
Lampiran 8 Penurunan pH media selama fermentasi pada optimasi pH
Sampel
Waktu inkubasi (hari)
0
5
6
7
8
9
10
pH 4
4
3
3
3
3
3
3
pH 5
5
3
3
3
3
3
3
pH 6
6
3
3
3
3
3
3
pH 7
7
3
3
3
3
3
3
Lampiran 9 Penurunan pH media selama fermentasi pada optimasi sumber N
Sampel
Waktu inkubasi (hari)
0
5
6
7
8
9
10
Bakto pepton
4
3
3
3
3
3
3
Ekstrak khamir
4
3
3
3
3
3
3
Ammonium sulfat
4
3
3
3
3
3
3
Urea
4
3
3
3
4
5
6
Tanpa sumber N
4
3
3
3
3
3
3
Lampiran 10 Analisis statistik (output progam SAS)
Hasil analisis ragam
Dependent Variable: y1 konsentrasi GlcNAc
Sum of
Source
DF Squares
Mean Square F Value Pr > F
Model
10 10.16492777 1.01649278 14.04
<.0001
Error
24 1.73764177 0.07240174
Corrected
34 11.90256954
Total
R-Square Coeff Var Root MSE y1 Mean
0.854011 31.22667 0.269076 0.861686
25
Lampiran 10 (lanjutan)
Hasil uji Duncan
Alpha
0.05
Error Degrees of Freedom 24
Error Mean Square
0.072402
Means with the same letter are not significantly different.
Duncan Grouping Mean N perlk
A 1.3649 7 n4 (amonium sulfat)
B 1.0391 7 n2 (ekstrak khamir)
B
B 0.7617 7 n5 (tanpa sumber N)
B
B 0.7481 7 n1 (bakto pepton)
B