PENGUJIAN MUTU SEDIAAN TABLET PARASETAMOL GENERIK TAK BERLOGO DIBANDINGKAN DENGAN GENERIK BERLOGO DAN
MEREK DAGANG SECARA IN VITRO
SKRIPSI
OLEH:
MALA PEBRIANI 040804018
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
PENGUJIAN MUTU SEDIAAN TABLET PARASETAMOL GENERIK TAK BERLOGO DIBANDINGKAN DENGAN GENERIK BERLOGO DAN
MEREK DAGANG SECARA IN VITRO
SKRIPSI
Diajukan Untuk Melengkapi Salah Satu Syarat Untuk Mencapai Gelar Sarjana Farmasi Pada
Fakultas Farmasi Universitas Sumatera Utara
OLEH:
MALA FEBRIANI 040804018
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
Pengesahan Skripsi
Judul:
PENGUJIAN MUTU SEDIAAN TABLET PARASETAMOL GENERIK TAK BERLOGO DIBANDINGKAN DENGAN GENERIK BERLOGO DAN
MEREK DAGANG SECARA IN VITRO
Oleh:
MALA PEBRIANI NIM 040804018
Dipertahankan di hadapan Panitia Penguji Skripsi Fakultas Farmasi Universitas Sumatera Utara
Pada tanggal: September 2008
Pembimbing I, Panitia Penguji:
(Drs. Chairul Azhar Dlt. MSc., Apt) (Dra. Hayati Lubis,Msi., Apt.) NIP 130 809 701 NIP 130 353 238
Pembimbing II, (Drs. Chairul Azhar Dlt. MSc., Apt) NIP 130 809 701
(Drs. Fathur Rahman Harun M.Si.,Apt.) (Drs. Agusmal Dalimunthe, MS., Apt.)
NIP 130 872 281 NIP 131 286 002
(Dra. Azizah Nasution, MSc., Apt.) NIP 131 283 721
Dekan,
KATA PENGANTAR
Assalamu ‘alaikum Wr. Wb.
Puji dan syukur penulis panjatkan ke hadirat Allah SWT atas segala
limpahan karunia dan rahmat yang tidak terhingga sehingga penulis dapat
menyelesaikan penelitian serta penyusunan skripsi ini. Skripsi ini diajukan untuk
memenuhi persyaratan dalam mencapai gelar Sarjana Farmasi pada Fakultas
Farmasi Universitas Sumatera Utara.
Penulis mengucapkan terima kasih yang tak terhingga kepada Ayahanda
Nasrin Effendi Harahap, Ibunda Rosmiati dan kedua adikku Yuli dan Haris yang
telah memberikan cinta dan semangat, serta kepada Keluarga Besar Hj. Ramiah
(Ua) atas semua curahan kasih sayang dan jasa-jasa mereka.
Ucapan terima kasih serta penghargaan juga ditujukan kepada:
1. Bapak Dekan dan para Pembantu Dekan Fakultas Farmasi Universitas
Sumatera Utara.
2. Bapak Drs. Chairul Azhar Dalimunthe, M.Sc.,Apt. dan Bapak Drs. Fathur
Rahman Harun M.Si.,Apt. sebagai dosen pembimbing atas segala arahan serta
nasehat selama proses penelitian dan penyusunan skripsi ini.
3. Bapak Drs. Edy Suwarso sebagai dosen penasehat akademik atas segala
nasehat dan bimbingannya selama proses perkuliahan
4. Bapak dan Ibu Panitia Penguji atas segala arahan dan masukan yang sangat
5. Kepala dan para staf Laboratorium Kimia Bahan Makanan dan Laboratorium
Anatomi Fisiologi Tumbuhan atas seluruh fasilitas yang diberikan selama
proses penelitian dan pengalaman berharga penulis sebagai asisten dosen.
6. Sahabat-sahabat penulis: Paksi, Nizar, Pipit, Neni, Muti, Lela, Mimi, Nisa,
Ririn, Zulfah, Ya’kub, Ryan, dan Riza. Rekan-rekan mahasiswa farmasi
stambuk 2004 serta seluruh pihak yang telah memberikan kasih sayang,
bantuan, motivasi, dan inspirasi bagi penulis selama masa perkuliahan sampai
penyusunan skripsi ini.
7. Keluarga besar Unit Kegiatan Mahasiswa Islam (UKMI) Ath-Thibb dan
Al-Falaq atas kebersamaan yang indah dalam nuansa islamiah.
Semoga Allah SWT memberikan balasan yang berlipat ganda atas jasa-jasa besar
mereka.
Penulis menyadari bahwa tulisan ini masih jauh dari kesempurnaan sehingga
membutuhkan banyak masukan dan kritikan. Namun demikian, penulis berharap
semoga skripsi ini dapat menjadi sumbangan berarti bagi ilmu pengetahuan
khususnya di bidang farmasi.
Medan, September 2008
Penulis,
ABSTRAK
Pengujian mutu tablet Parasetamol generik tak berlogo telah dilakukan dan
dibandingkan dengan sediaan tablet Parasetamol berlogo dan merek dagang secara
in vitro. Pengujian mutu tablet dengan menggunakan parameter uji kekerasan dan
uji friabilitas untuk persyaratan industri farmasi dan parameter uji waktu hancur,
penetapan kadar, keseragaman bobot, dan uji disolusi menurut Farmakope
Indonesia Edisi IV. Hasil dari pengujian yang diperoleh menunjukkan tablet
parasetamol generik tak berlogo memenuhi persyaratan industri farmasi kecuali
uji kekerasan. Hal yang sama juga diperoleh pada tablet berlogo dan merek
dagang. Sebaliknya pengujian parameter menurut Farmakope Indonesia Edisi IV
tablet generik tak berlogo semua memenuhi persyaratan. Pengujian hasil yang
ABSTRACT
DAFTAR ISI
Halaman
JUDUL ...i
HALAMAN PENGESAHAN ...ii
ABSTRAK ...iii
ABSTRACT ...iv
DAFTAR ISI ...v
DAFTAR TABEL ...ix
DAFTAR GAMBAR ...x
DAFTAR LAMPIRAN ...xi
BAB 1 PENDAHULUAN ...1
1.1 Latar belakang ...1
1.2 Perumusan masalah ...3
1.3 Hipotesa ...4
1.4 Tujuan penelitian... ...4
BAB II TINJAUAN PUSTAKA. ...5
BAB III METODOLOGI PENELITIAN. ... 5
3.1 Alat-alat ... 5
3.2 Bahan-bahan ... 5
3.3 Metode Penelitian ... 6
3.3.1 Teknik Pengambilan Sampel...6
3.3.2.1 Air Bebas Karbondioksida P ... 6
3.3.2.2 Natrium Hidroksida 0,1 N ... 6
3.3.2.3 Natrium Hidroksida 0,2 N ... 6
3.3.2.4 Dapar Fosfat pH 5,8 ... 6
3.3.3 Pembuatan Tablet. ... 7
3.4.Evaluasi Tablet...7
3.4.1 Uji Kekerasan Tablet...8
3.4.2 Uji Friabilitas...8
3.4.3 Uji Waktu Hancur...8
3.5 Panjang Gelombang Maksimum dan Linieritas Kurva Kalibrasi ...9
3.5.1 Pembuatan Larutan Baku Parasetamol...9
3.5.2 Penentuan Panjang Gelombang Maksimum...9
3.5.3 Pembuatan Kurva Kalibrasi...10
3.6 Uji Validasi Tablet Parasetamol Secara Spektrofotometri UV...10
3.7 Penetapan Kadar Sediaan Tablet Parasetamol...10
3.8 Penetapan Keragaman Bobot Sediaan Tablet Parasetamol...11
3.9 Panjang Gelombang Maksimum dan Linieritas Kurva Kalibrasi Parasetamol Dalam Medium Dapar Pospat pH5,8...11
3.9.1 Pembuatan Larutan Baku...11
3.9.2 Penentuan Panjang Gelombang Maksimum...12
3.9.3 Pembuatan Kurva Kalibrasi...12
3.10 Uji Disolusi Tabel Yang di Buat Sendiri...12
3.11 Analisis Data Secara Statistik...13
BAB IV HASIL DAN PEMBAHASAN...15
4.1 Evaluasi Tablet Parasetamol...15
4.1.1 Uji Kekerasan...15
4.1.2 Uji Friabilitas ...16
4.1.3 Uji Waktu Hancur... 17
4.2 Hasil Penentuan Panjang Gelombang Maksimum dan Linieritas Kurva Kalibrasi...18
4.3 Penetapan Kadar Parasetamol Pada Tablet Buatan Sendiri...20
4.4 Penetapan Kadar Parasetamol Dalam Sampel Sediaan ...20
4.5 Hasil uji keragaman bobot parasetamol dalam sediaan tablet...21
4.6 Hasil Penentuan Kurva Serapan dan Kurva Kalibrasi Parasetamol BPFI Dalam Pelarut Dapar Pospat pH 5,8...23
4.7 Hasil uji disolusi parasetamol dalam sediaan tablet...24
BAB V KESIMPULAN DAN SARAN ... ..28
5.1 Kesimpulan ... ..28
5.2 Saran ... ..29
DAFTAR TABEL
Halaman
TABEL 1 Kriteria Penerimaan Uji Disolusi...13
TABEL 2 Data Kekerasan Tablet Parasetamol ...16
TABEL 3 Data Friabilitas Tablet Parasetamol...17
TABEL 4 Data Waktu Hancur Tablet Parasetamol ...18
TABEL 5 Data Panang gelombang maksimum & Absorbansi BPFI...19
TABEL 6 Kadar rata-rata parasetamol pada sediaan tablet ... ..21
TABEL 7 Hasil Uji Keragaman Bobot ... ..22
DAFTAR GAMBAR
Halaman GAMBAR 1 Kurva Serapan Parasetamol BPFI (konsentrasi 6,5 mcg/ml)
dalam Pelarut NaOH 0,1 N Secara Spektrofometer Ultraviolet ..18
GAMBAR 2 Kurva Kalibrasi Parasetamol BPFI Dalam Pelarut NaOH 0,1 N
Secara Spektrofotometer Ultraviolet Pada Panjang Gelombang 257 nm...19
GAMBAR 3 Kurva Serapan, Data dan Kurva Kalibrasi Parasetamol BPFI
Dalam Dapar Fosfat pH 5,8 Secara Spektrofotometri
UV...24
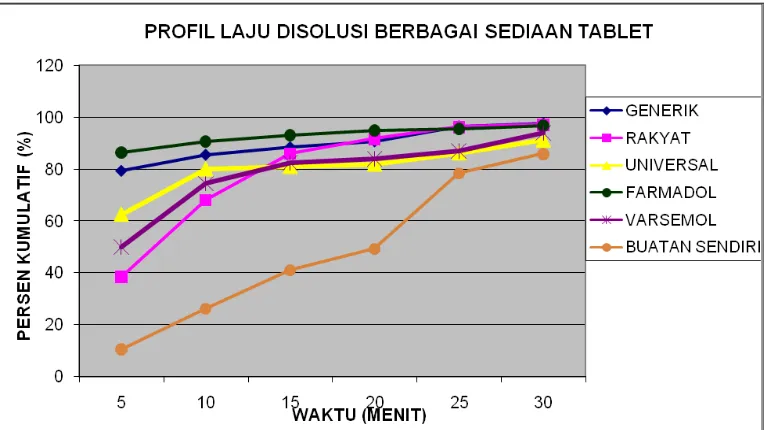
GAMBAR 4 Grafik % kumulatif Rata-Rata Disolusi Tablet Parasetamol generik
DAFTAR LAMPIRAN
Halaman Lampiran 1. Hasil penentuan kurva serapan parasetamol BPFI pada C= 6,5
mcg/ml terhadap pelarut sebagai blanko...32
Lampiran 2.Hasil penentuan persamaan regresi dari kurva kalibrasi parasetamol BPFI pada panjang gelombang =257 nm terhadap pelarut sebagai blanko...33
Lampiran 3. Contoh perhitungan kadar parasetamol...35
Lampiran 4. Data kadar parasetamol dalam sediaan tablet...36
Lampiran 5. Perhitungan statistik penetapan kadar parasetamol pada sediaan generik indofarma...37
Lampiran 6. Perhitungan statistik penetapan kadar parasetamol pada sediaan generik universal...39
Lampiran 7. Perhitungan statistik penetapan kadar parasetamol pada sediaan varsemol®...41
Lampiran 8. Perhitungan statistik penetapan kadar parasetamol pada sediaan farmadol®...43
Lampiran 9. Perhitungan statistik penetapan kadar parasetamol pada sediaan penurun panas indorakyat...45
Lampiran 10. Formula pembuatan tablet parasetamol (Tablet Validasi)...47
Lampiran 11.Perhitungan statistik penetapan kadar parasetamol pada tablet buatan sendiri...50
Lampiran 12. Uji validasi tablet parasetamol yang dibuat sendiri...52
Lampiran 13. Perhitungan keragaman bobot...53
Lampiran 14. Contoh perhitungan friabilitas tablet...56
Lampiran 16. Hasil penentuan kurva serapan parasetamol BPFI pada C = 6
mcg/ml terhadap medium disolusi sebagai blanko...58
Lampiran 17. Hasil penentuan persamaan regresi dari kurva kalibrasi
parasetamol BPFI pada panjang gelombang 243,5 nm terhadap medium disolusi sebagai blanko...59
ABSTRAK
Pengujian mutu tablet Parasetamol generik tak berlogo telah dilakukan dan
dibandingkan dengan sediaan tablet Parasetamol berlogo dan merek dagang secara
in vitro. Pengujian mutu tablet dengan menggunakan parameter uji kekerasan dan
uji friabilitas untuk persyaratan industri farmasi dan parameter uji waktu hancur,
penetapan kadar, keseragaman bobot, dan uji disolusi menurut Farmakope
Indonesia Edisi IV. Hasil dari pengujian yang diperoleh menunjukkan tablet
parasetamol generik tak berlogo memenuhi persyaratan industri farmasi kecuali
uji kekerasan. Hal yang sama juga diperoleh pada tablet berlogo dan merek
dagang. Sebaliknya pengujian parameter menurut Farmakope Indonesia Edisi IV
tablet generik tak berlogo semua memenuhi persyaratan. Pengujian hasil yang
ABSTRACT
BAB I PENDAHULUAN
1.1 Latar Belakang
Saat ini walaupun tersedianya obat generik berlogo (OGB) dengan harga
relatif murah, namun tetap dirasa mahal oleh masyarakat khususnya di pedesaan.
Ini disebabkan OGB belum sepenuhnya dapat diakses oleh masyarakat karena
sebagian besar obat tersebut dikemas dalam jumlah besar. Oleh karena itu
pemerintah menilai diperlukan suatu obat bebas dengan kemasan kecil,
berkualitas dan harga murah sehingga dapat dijangkau dan diakses oleh
masyarakat luas. Pada tanggal 8 Mei 2007 keluarlah program obat generik tak
berlogo atau obat rakyat. Berbeda dengan obat generik berlogo yang ada, obat
generik tak berlogo ini mempunyai merek sesuai dengan penyakit yang akan
diobati.
Obat generik tak berlogo ini dijual eceran dalam kemasan kecil seharga Rp
1.000 per strip, berisi 2-10 tablet dan dapat dibeli di pasar non-panel, seperti
warung, toko obat atau melalui dokter yang menjalankan praktek dispensing.
Program ini dimaksudkan untuk menjamin ketersediaan, pemerataan dan
keterjangkauan obat murah dan berkualitas bagi masyarakat sehingga mereka
dapat melakukan self medication atau pengobatan sendiri. Program obat rakyat ini
merupakan terobosan penting, mengingat selama ini masih banyak warga yang tak
obat bukan semata-mata komoditi ekonomi tetapi sekaligus komoditas sosial
harus kembali ditegakkan. (Yus, Republika Rabu, 9 Mei 2007).
Parasetamol adalah derivat amino fenol yang bekerja sebagai analgesik
yaitu menghilangkan atau mengurangi nyeri ringan sampai sedang dan juga
bekerja sebagai antipiretik yaitu menurunkan suhu tubuh dengan menghambat
biosintesa prostaglandin yang cepat diabsorbsi di saluran cerna. Konsentrasi
tertinggi dalam plasma dapat dicapai dalam waktu setengah jam dan masa paruh
plasma dicapai 1-3 jam (Wilmana, 1995). Pemilihan parasetamol sebagai model
disebabkan parasetamol adalah salah satu obat analgetik-antipiretik yang banyak
digunakan khususnya di fasilitas pelayanan kesehatan pemerintah.
Penetapan kadar parasetamol dapat dilakukan dengan cara Kromatografi
Cair Kinerja Tinggi yang dilengkapi dengan detektor 243 nm dan kolom 3,9 nm x
30 cm berisi bahan pengisi L1 ( Ditjen POM, 1995 ). The United States
Pharmacopeia (2007) mencantumkan bahwa penetapan kadar parasetamol
ditentukan secara kromatografi Cair Kinerja Tinggi dengan detektor 243 nm
dengan fase gerak air : metanol = 3 : 1. Parasetamol dapat juga ditentukan secara
spektrofotometri ultraviolet dalam suasana basa dengan panjang gelombang 257
nm dan suasana asam pada panjang gelombang 245 nm. (Moffat, 1986).
Metode spektrofotometri memiliki keuntungan antara lain dapat digunakan
untuk analisa suatu zat dalam jumlah kecil, pengerjaanya cepat, sederhana, cukup
sensitif dan selektif serta mudah dalam interpretasi hasil yang diperoleh. Oleh
karena itu, untuk mencari metode alternatif yang tepat untuk analisis rutin mutu
sediaan tablet secara spektrofotometri ultraviolet. Untuk penetapan kehandalan
metode lebih dahulu dibuat sediaan tablet dengan komposisi umumnya suatu
tablet dengan kadar senyawa aktif yang diketahui dengan tepat, kemudian
dianalisis dengan cara yang sama untuk sampel.
Menanggapi sebagian anggota masyarakat yang belum sepenuhnya
mempercayai kemanjuran obat generik tak berlogo tersebut, maka perlu dilakukan
suatu pembuktian ilmiah terhadap mutu dari program obat baru tersebut. Oleh
karena itu, penulis tertarik untuk melakukan studi pengujian mutu tablet
parasetamol generik tak berlogo dibandingkan dengan generik berlogo dan merek
dagang dengan melakukan pengujian dari segi fisis (kekerasan & friabilitas) yang
merujuk pada persyaratan mutu farmasi industri dan secara in vitro (waktu
hancur, penetapan kadar zat aktif, keseragaman sediaan dan disolusi) merujuk
pada Farmakope Indonesia edisi IV.
1.2 Perumusan Masalah
Apakah tablet Parasetamol generik tak berlogo mempunyai mutu yang
sama dengan Parasetamol generik berlogo dan merek dagang secara in vitro sesuai
dengan persyaratan mutu farmasi industri dan persyaratan Farmakope Indonesia
edisi IV?
1.3.Hipotesis
Mutu sediaan tablet Parasetamol generik tak berlogo adalah sama secara in
vitro dengan generik berlogo dan merek dagang sesuai dengan persyaratan yang
tercantum dalam persyaratan mutu farmasi industri dan persyaratan Farmakope
1.4.Tujuan Penelitian
Untuk mengetahui apakah sediaan tablet parasetamol sudah memenuhi
persyaratan mutu farmasi industri (uji kekerasan & uji friabilitas) dan persyaratan
Farmakope Indonesia edisi IV secara in vitro ( uji waktu hancur, penetapan kadar,
BAB II
TINJAUAN PUSTAKA
2.1. Uraian Umum
2.1.1. Sifat Fisika dan Kimia Parasetamol
Sinonim : Paracetamolum
Asetaminofen.
Nama kimia : 4-hidroksiasetanilida.
Rumus molekul : C8H9NO2
Rumus bangun : HO NHCOCH3
Kandungan : tidak kurang dari 98,0 % dan tidak lebih dari 101,0 %
C8H9NO2, dihitung terhadap zat yang telah dikeringkan.
Pemerian : Serbuk hablur, putih, tidak berbau, rasa sedikit pahit.
Kelarutan : Larut dalam air mendidih dan dalam natrium hidroksida 1 N,
mudah larut dalam etanol.
Penyimpanan : Dalam wadah tertutup rapat dan tidak tembus cahaya
(DitJen POM., 1995).
2.2.Farmakologi
Parasetamol merupakan metabolit fenasetin dengan efek antipiretik
ditimbulkan oleh gugus aminobenzen. Asetaminofen di Indonesia lebih dikenal
Efek analgetik Paracetamol dapat menghilangkan atau mengurangi nyeri ringan
sampai sedang. Paracetamol menghilangkan nyeri, baik secara sentral maupun
secara perifer. Secara sentral diduga Paracetamol bekerja pada hipotalamus
sedangkan secara perifer, menghambat pembentukan prostaglandin di tempat
inflamasi, mencegah sensitisasi reseptor rasa sakit terhadap rangsang mekanik
atau kimiawi. Efek antipiretik dapat menurunkan suhu demam. Pada keadaan
demam, diduga termostat di hipotalamus terganggu sehingga suhu badan lebih
tinggi (Zubaidi, 1980).
Paracetamol bekerja dengan mengembalikan fungsi termostat ke keadaan
normal. Pembentukan panas tidak dihambat tetapi hilangnya panas dipermudah
dengan bertambahnya aliran darah ke perifer dan pengeluaran keringat. Efek
penurunan suhu demam diduga terjadi karena penghambatan terbentuknya
prostaglandin (Zubaidi, 1980).
Senyawa Paracetamol memiliki waktu paruh 1 – 3 jam, dan tidak
menyebabkan perdarahan gastrointestinalis atau gangguan asam basa seperti asam
asetilsalisilat, tetapi mempunyai bentuk toksisitas hepatik sedang sampai berat.
(Andrianto.P., 1985).
2.3.Spektrofotometri Ultraviolet
Spektrofotometer adalah alat yang terdiri dari spektrometer dan
fotometer. Spektrometer berfungsi untuk menghasilkan sinar dengan panjang
gelombang tertentu dan fotometer berfungsi sebagai alat pengukur intensitas
spektrofotometri yaitu dapat menetapkan kadar suatu zat yang sangat kecil
(Vogel,1994).
Spektrofotometri Ultraviolet adalah pengukuran panjang gelombang dan
intensitas sinar ultraviolet yang diabsorbsi oleh sampel. Sinar ultraviolet memiliki
energi yang cukup untuk mempromosikan elektron pada kulit terluar ke tingkat
energi yang lebih tinggi. Spektroskopi ultraviolet biasanya digunakan untuk
senyawa di dalam larutan. Spektrum ultraviolet mempunyai pita yang lebar dan
hanya sedikit informasi tentang struktur yang biasa didapatkan dari spektrum ini.
Tetapi spektrum ini sangat berguna untuk pengukuran secara kuantitatif.
Konsentrasi dari analit di dalam larutan bisa ditentukan dengan mengukur serapan
pada panjang gelombang tertentu dengan menggunakan hukum Lambert-Beer
(Dachriyanus,2004)
Menurut hukum Lambert, serapan (A) berbanding lurus dengan ketebalan
lapisan (b) yang disinari :
A= k. b
Dengan bertambahnya ketebalan lapisan, serapan akan bertambah.
Menurut Hukum Beer, yang hanya berlaku untuk cahaya monokromatis dan
larutan yang sangat encer, serapan (A) dan konsentrasi (c) adalah proporsional:
A= k. c
Jika konsentrasi bertambah, jumlah molekul yang dilalui berkas sinar akan
Kedua persamaan ini digabungkan dalam hukum Lambert-Beer, maka
diperoleh bahwa serapan berbanding lurus dengan konsentrasi dan ketebalan
lapisan:
A= k . c. b
Nilai tetapan (K ) dalam hukum Lambert-Beer tergantung pada sistem
konsentrasi mana yang digunakan. Bila c dalam gram perliter, tetapan tersebut
disebut dengan absorptivitas (a) dan bila dalam mol per liter tetapan tersebut
adalah absorbtivitas molar (∈ ) (Day and Underwood,1999)
Parasetamol secara struktur diketahui mempunyai gugus kromofor dan
gugus auksokrom yang menyebabkan senyawa ini dapat menyerap radiasi pada
daerah ultraviolet. Parasetamol mempunyai spektrum ultraviolet dalam suasana
asam pada panjang gelombang 245 nm ( 1 1
A 668 a) dan dalam suasana basa pada
panjang gelombang 257 nm (A 715 a) (Moffat, 1986). 11
2.4.Sediaan Tablet
2.4.1.Pengertian Tablet
Tablet adalah sediaan padat yang mengandung bahan obat dengan ataupun
tanpa bahan pengisi. Sebagian besar tablet dibuat dengan cara pengempaan dan
merupakan bentuk sediaan yang paling banyak digunakan. Tablet dapat dibuat
dengan berbagai ukuran, bentuk dan penandaan permukaan tergantung pada desai
cetakan ( DitJen POM, 1995).
Secara umum tablet dibuat dengan 3 cara yaitu : granulasi basah, granulasi
kering dan kempa langsung. Tujuan granulasi basah dan kering adalah untuk
buat dengan cara menekan massa serbuk pada tekanan sehingga menjadi tablet
yang besar yang tidak berbentuk baik, kemudian digiling dan diayak hingga
diperoleh granul dengan ukuran partikel yang diinginkan (DitJen POM., 1995).
Dewasa ini sediaan tablet semakin populer pemakaiannya dan merupakan
sediaan yang paling banyak diproduksi. Tablet merupakan salah satu sediaan yang
banyak mengalami perkembangan baik formulasi maupun cara pengunaannya.
Beberapa keuntungan. Beberapa keuntungan sediaan tablet diantaranya adalah
sediaan lebih kompak, biaya pembuataannya lebih sederhanan dosisnya tepat,
mudah pengemasannya, sehingga penggunaanya lebih praktis jika dibandingkan
dengan sediaan yang lain ( Lachman, dkk.,1994 )
Selain mengandung bahan aktif, tablet biasanya mengandung bahan
tambahan yang mempunyai fungsi tertentu. Bahan tambahan yang umum
digunakan adalah bahan pengisi, bahan pengikat, bahan pengembang, bahan
pelicin atau zat lain yang cocok. Bahan tambahan yang digunakan pada
pembuatan tablet harus inert, tidak toksik dan mampu melepaskan obat dalam
keadaan relatif konstan pada jangka waktu tertentu (Soekemi, 1987).
2.4.2.Komposisi Tablet
Komposisi umum dari tablet adalah zat berkhasiat, bahan pengisi, bahan
pengikat atau perekat, bahan pengembang dan bahan pelicin. Kadang-kadang
dapat ditambahkan bahan pewangi (flavoring agent), bahan pewarna (coloring
agent) dan bahan-bahan lainnya (Ansel, 1989).
2. Bahan pengisi
Untuk mendapatkan berat yang diinginkan, terutama apabila bahan obat
dalam jumlah yang kecil. Bahan pengisi haruslah bersifat inert. Bahan-bahan
yang umum digunakan sebagiai bahan pengisi antara lain laktosa, sukrosa,
manitol, sorbitol, avicel, bolus alba, kalsium sulfat, dll (Lachman, dkk., 1994).
3. Bahan pengikat
Untuk mengikat komponen-komponen tablet untuk dijadikan granul
dengan ukuran yang sama dan bentuk spheris setelah dipaksakan melewati
ayakan. Dengan adanya bahan pengikat, komponen tablet akan mudah dibentuk
menjadi granul, sehingga akan memudahkan didalam pencetakan. Pemilihan
bahan pengikat tergantung pada sifat fisika dan kimia dari bahan obat, daya ikat
yang diperlukan dan tujuan pemakaian obatnya.
4. Bahan pengembang
Untuk memudahkan tablet menjadi partikel-partikel kecil ketika berkontak
dengan cairan pencernaan sehingga luas permukaan diperbesar dan absorbsinya
dipermudah (Lachman, dkk., 1994).
5. Bahan pelicin
Untuk meningkatkan daya alir granul-granul pada corong pengisi,
mencegah melekatnya massa pada punch dan die, mengurangi gesekan antara
butir-butir granul dan mempermudah pengeluaran tablet dari die. Hasil terbaik
saat ini sebagai bahan pelicin adalah talk serta kalsium atau magnesium stearat
Tablet yang dinyatakan baik harus memenuhi syarat sebagai berikut:
1. Memiliki kemampuan atau daya tahan terhadap pengaruh mekanis selama
proses produksi, pengemasan dan distribusi.
2. Bebas dari kerusakan seperti pecah-pecah, rompal pada permukaan dan
sisa-sisanya.
3. Dapat menjamin kestabilan fisik maupun kimia dari zat berkhasiat yang
terkandung didalamnya.
2.4.3 Evaluasi Tablet
1. Kekerasan tablet
Tablet harus mempunyai kekuatan atau kekerasan tertentu serta tahan atas
kerenyahan agar dapat bertahan terhadap berbagai guncangan mekanik pada saat
pembuatan, pengepakan, dan pengapalan. Selain itu tablet juga harus dapat
bertahan terhadap perlakuan berlebihan oleh konsumen. Kekerasan tablet yang
cukup serta tahan penyerbukan dan kerenyahan merupakan persyaratan penting
bagi penerimaan konsumen.( Lachman dkk, 1994). Kekerasan dinyatakan dalam
satuan kg dari tenaga yang dibutuhkan untuk memecah tablet
(Soekemi,dkk.,1987).
2. Friabilitas.
Untuk mengetahui keutuhan tablet (terkikis) karena selama tranfortasi
tablet mengalami benturan dengan dinding wadahnya. Tablet yang mudah
menjadi bubuk , menyerpih dan pecah- pecah pada penanganannya, akan
kehilangan keelokannya serta konsumen enggan menerimanya, dan dapat
menimbulkan pengotoran pada tempat pengangkutan dan pengepakan, juga dapat
3.Waktu hancur
Menurut Lachman dkk (1994), jika dikaitkan dengan disolusi maka waktu
hancur merupakan faktor penentu dalam pelarutan obat. Sebelum obat larut dalam
media pelarut maka tablet terlebih dahulu pecah menjadi partikel-partikel kecil
sehingga daerah permukaan partikel menjadi lebih luas. Namun uji ini tidak
memberi jaminan bahwa partikel-partikel akan melepaskan bahan obat dalam
larutan dengan kecepatan yang seharusnya, karena uji waktu hancur hanya
menyatakan waktu yang diperlukan tablet untuk hancur di bawah kondisi yang
ditetapkan, dan lewatnya seluruh partikel melalui saringan berukuran mesh-10.
4. Kadar zat berkhasiat
Kadar zat berkhasiat tertera dalam monografi masing-masing tablet baik
batasan nilainya maupun cara penetapannya. Menurut Lachman dkk (1994),
bahwa selain memenuhi persyaratan kadar suatu tablet juga harus dapat
melepaskan kandungan zat berkhasiatnya mendekati 100 % dan diabsorbsi secara
utuh sehingga dapat menimbulkan efek farmakologis.
5. Keseragaman sediaan
Keseragaman sediaan ditetapkan dengan 2 cara yaitu :
a. Keragaman bobot dilakukan terhadap tablet yang 50 % bahan aktifnya lebih
besar atau sama dengan 50 mg.
b. Keseragaman kandungan dilakukan terhadap tablet yang 50 % bahan
6.Disolusi
Disolusi adalah proses dimana suatu zat pada menjadi terlarut dalam suatu
pelarut. Saat sekarang ini disolusi dipandang sebagai salah satu uji pengawasan
mutu yang paling penting dilakukan pada sediaan farmasi.
Pada uji disolusi dapat diketahui partikel-partikel obat akan melepas
bahan obat dalam larutan dengan kecepatan tertentu. Cepatnya melarut obat atau
tablet menentukan berapa kadar bahan berkhasiat yang terlepas kedalam darah,
oleh karena itu laju disolusi berhubungan langsung dengan efikasi (kemanjuran)
dari tablet dan perbedaan biovaibilitas dari berbagai formula (Lachman,
dkk.,1994).
Secara singkat, alat untuk menguji karakteristik disolusi dan sediaan
pada kapsul atau tablet terdiri dari :
(1.)motor pengaduk dengan kecepatan yang dapat diubah
(2.)keranjang baja stainless berbentuk silinder atau dayung untuk ditempelkan ke
ujung batang pengaduk
(3.)bejana dari gelas, atau bahan lain yang inert dan transparan dengan volume
1000 ml, bertutup sesuai dengan di tengah-tengahnya ada tempat untuk
menempelkan pengaduk, dan ada lubang tempat masuk pada 3 tempat, dua
untuk memindahkan contoh dan satu untuk menempatkan termometer.
(4.)Penangas air yang sesuai untuk menjaga temperatur pada media disolusi
dalam bejana.
Pada tiap pengujian, volume dari media disolusi (seperti yang
biarkan mencapai temperatur 37o C ± 0,5 oC. Kemudian 1 tablet atau 1 kapsul
yang diuji dicelupkan ke dalam bejana atau ditempatkan dalam keranjang dan
pengaduk diputar dengan kecepatan seperti yang ditetapkan dalam monografi.
Pada waktu-waktu tertentu contoh dari media diambil untuk analisis kimia dari
bagian obat yang terlarut. Tablet dan kapsul harus memenuhi persyaratan seperti
BAB III
METODOLOGI PENELITIAN
3.1. Alat
Alat-alat yang digunakan dalam penelitian ini adalah, Disintegration tester
(Erweka), Dissolution Tester (Erweka DT), Strong Cobb Hardness Tester
(Erweka), Roche Friabilator (Erweka), Spektrofotometer Ultra violet ( UV Mini
1240 Shimadzu ), Stopwacth, Neraca listrik, alat-alat gelas dan alat laboratorium
lainnya.
3.2. Bahan
Bahan-bahan yang digunakan dalam penelitian ini adalah natrium
hidroksida 97,5% b/v (E.Merck), kalium dihidrogen fosfat (E.Merck), air suling,
Parasetamol Pembanding (Badan POM), Bahan baku tablet parsetamol (PT.
Brataco Chem), Amilum Manihot, Talcum, Mg Stearat, Laktosa, Tablet
Parasetamol Generik Tak Berlogo (rakyat) produksi PT. Indo Farma, Tablet
Parasetamol Generik Berlogo produksi PT. Indo Farma, Tablet Parasetamol
Generik Berlogo produksi Universal Farm Industri, Tablet Varsemol® produksi
3.3. Metode Penelitian
3.3.1. Teknik pengambilan sampel
Sampel yang akan diuji sebanyak 5 (lima) merek sediaan tablet
parasetamol.Teknik pengambilan kelima sediaan sampel secara purposif dan
setiap sediaan obat masing-masing memiliki nomor bets yang sama. Kelima
sampel tersebut produksi dari 1 pabrik generik tak berlogo, 2 pabrik generik
berlogo, dan 2 pabrik merek dagang dengan jumlah masing-masing zat aktif 500
mg per tablet, yang diambil dari beberapa apotek yang ada di Pasar Pramuka,
Jakarta Timur.
3.3.2. Pembuatan Pereaksi
3.3.2.1. Air bebas Karbondioksida ( Ditjen POM.,1995)
Air suling yang telah dididihkan selama 5 menit atau lebih dan didiamkan
sampai dingin dan tidak boleh menyerap karbon dioksida dari udara.
3.3.2.2. Natrium Hidroksida 0,1 N ( Ditjen POM.,1979)
Larutkan 4 gram natrium hidroksida dalam air bebas karbon dioksida
secukupnya hingga 1000 ml.
3.3.2.3. Natrium Hidroksida 0,2 N (Ditjen POM.,1979)
Larutkan 8 gram natrium hidroksida dalam air bebas karbon dioksida
secukupnya hingga 1000 ml.
3.3.2.4. Dapar fosfat pH 5,8 (Ditjen POM., 1995)
Larutkan 27,22 gram kalium dihidrogen fosfat dalam air bebas
kedalam labu tentukur 200 ml kemudian ditambah dengan NaOH 0,2 M sebanyak
3,6 ml dicukupkan dengan air bebas karbondioksida sampai garis tanda.
3.3.3 Pembuatan Tablet
R/ Parasetamol 500 mg
Amilum manihot 5 %
Mucilago amili 10% q.s.
Mg stearat 1%
Talkum 1%
Laktosa q.s.
M.f. tab dtd no.C
Ke dalam lumpang dimasukkan parasetamol, ditambahkan amilum
manihot sebagai pengembang dalam, dan saccharum lactis lalu dicampur hingga
homogen. Mucilago amili ditambahkan sedikit demi sedikit hingga diperoleh
massa yang tidak lengket bila dikepal, kemudian digranulasi dengan ayakan mesh
8, Granulat basah dikeringkan pada lemari pengering pada suhu tidak lebih dari
40-60o C selama lebih kurang 2 jam. Setelah kering granulat diayak kembali
dengan ayakan mesh 12, ditambahkan amilum manihot sebagai pengembang luar,
talkum dan magnesium stearat dalam jumlah tertentu, diaduk homogen,lalu
dicetak menjadi tablet dengan bobot 600 mg dan penampang 13 mm.
3.4. Evaluasi Tablet
3.4.1. Uji Kekerasan Tablet
Uji kekerasan tablet menggunakan Strong Cobb Hardness Tester
dijepit dengan memutar skrup pengatur hingga tanda lampu “stop” menyala, lalu
ditekan tombol sampai tablet pecah. Pada saat tablet pecah angka yang
ditunjukkan jarum pada skala dibaca. Kekerasan tablet adalah angka yang
ditunjukkan jarum pada skala. Dilakukan uji kekerasan terhadap 6 tablet, dan
dihitung rata-ratanya. Tablet memenuhi syarat bila kekerasan tablet antara 4 – 8
kg (Parrot, 1971).
Uji kekerasan tablet ini dilakukan pada keenam sediaan tablet parasetamol.
3.4.2. Uji Friabilitas
Uji friabilitas tablet menggunakan alat Roche Friabilator (Erweka)
dengan cara ditimbang sebanyak 20 tablet yang telah dibersihkan dari debu,
dicatat beratnya (a gram). Tablet dimasukkan kedalam alat friabilator, lalu alat
dijalankan selama 4 menit dengan 100 kali putaran. Setelah batas waktu yang
ditentukan tablet dikeluarkan dan dibersihkan dari debu, lalu ditimbang beratnya
(b gram). Persentase friabilitas dihitung dengan rumus :
Friabilitas (F) = (a-b) / a x 100 %
dimana F = friabilitas, a = berat 20 tablet sebelum diputar, b = berat 20 tablet
setelah diputar. Tablet memenuhi syarat jika persentase kehilangan berat ≤ 0,8 %
(Voigt, R., 1994).
Uji friabilitas tablet ini dilakukan pada keenam sediaan tablet parasetamol.
3.4.3. Uji Waktu Hancur
Pengujian waktu hancur dilakukan dengan alat Disintegration tester
(Erweka) terhadap 6 tablet. Dimasukkan 1 tablet pada masing-masing tabung dari
± 2o C sebagai media kemudian alat dijalankan. Waktu hancur tablet dicatat yaitu
sejak tablet dinaik turunkan sampai tablet hancur. Tablet dinyatakan hancur jika
tidak ada bagian tablet yang tertinggal dikasa. Tablet memenuhi syarat jika waktu
hancur tablet tidak lebih dari 15 menit. Bila 1 tablet atau 2 tablet tidak hancur
sempurna ulangi pengujian dengan 12 tablet lainnya; tidak kurang 16 tablet dari
18 tablet yang diuji harus hancur semua (DitJen POM., 1995).
Uji waktu hancur tablet ini dilakukan pada keenam sediaan tablet
parasetamol.
3.5. Panjang Gelombang Maksimum dan Linieritas Kurva Kalibrasi 3.5.1. Pembuatan Larutan Baku Parasetamol
Ditimbang secara seksama 50,0 mg Paracetamol BPFI lalu dimasukkan ke
dalam labu tentukur 100 ml, kemudian ditambahkan 25 ml NaOH 0,1 N
diencerkan dengan 50 ml air suling, dikocok selama 15 menit, kemudian
ditambahkan air suling hingga garis tanda (C = 500 mcg/ml). Selanjutnya dipipet
sebanyak 10 ml lalu dimasukkan ke dalam labu tentukur 50 ml dan dicukupkan
dengan air suling sampai garis tanda (C = 100 mcg/ml).
3.5.2 Penentuan Panjang Gelombang Serapan Maksimum
Dipipet sebanyak 6,5 ml larutan baku parasetamol lalu dimasukkan ke
dalam labu tentukur 100 ml ditambahkan 10 ml NaOH 0,1 N, kemudian
diencerkan dengan air suling sampai garis tanda (C = 6,5 mcg/ml). Serapan
diukur pada panjang gelombang 200 – 400 nm dan sebagai blanko digunakan
3.5.3 Pembuatan Kurva Kalibrasi
Dipipet 3,5ml; 5ml; 6,5ml; 8ml; 9,5ml dari larutan standar. Dan
masing-masing dimasukkan ke dalam labu tentukur 100 ml lalu ditambah 10 ml NaOH
0,1 N lalu diencerkan dengan air suling hingga garis tanda. Serapan diukur
pada panjang gelombang serapan maksimum dan sebagai blanko digunakan
NaOH 0,1N.
3.6. Uji validasi metode Tablet Parasetamol secara spektrofotometri UV
Ditimbang seksama 20 tablet Paracetamol yang dibuat sendiri kemudian
digerus, lalu ditimbang seksama sejumlah serbuk tablet setara dengan 50 mg
Paracetamol, dimasukkan ke dalam labu tentukur 100 ml, ditambahkan 25 ml
NaOH 0,1 N, diencerkan dengan 50 ml air, dikocok selama 15 menit lalu
ditambahkan air secukupnya hingga 100 ml, dicampur dan disaring menggunakan
kertas saring, filtrat yang pertama dibuang sampai kertas saring jenuh. Dipipet
10,0 ml filtrat lalu diencerkan dengan air suling secukupnya hingga 50 ml. Dari
larutan ini dipipet 6,5 ml, ditambahkan 10 ml NaOH 0,1 N encerkan dengan air
suling secukupnya hingga 100,0 ml (C = 6,5 mcg/ml). Lalu diukur serapannya
pada panjang gelombang maksimum yang diperoleh.
3.7. Penetapan Kadar Sediaan Tablet Parasetamol
Untuk penetapan kadar kelima sampel dilakukan dengan prosedur yang
3.8. Penetapan Keragaman Bobot Sediaan Tablet Parasetamol
Menurut Farmakope Indonesia Edisi IV jika tablet mengandung zat aktif
50 mg atau lebih yang merupakan 50% atau lebih, dari bobot, satuan sediaan.
Maka uji keseragaman sediaan dilakukan dengan cara keragaman bobot.
Penetapan keragaman bobot dilakukan dengan cara ditimbang seksama 10 tablet,
satu persatu dan dihitung bobot rata – rata. Kemudian ditentukankan kadarnya
secara spertrofotometri ultraviolet (butir 2.6.). Dari hasil penetapan kadar dihitung
jumlah zat aktif dari masing – masing dari 10 tablet dengan anggapan zat aktif
terdistribusi homogen. Memenuhi persyaratan dalam keragaman bobot jika
terletak antara 85% hingga 115% dari yang tertera pada etiket dan simpangan
baku relatif kurang dari atau sama dengan 6,0%. Jika tidak memenuhi syarat maka
dilakukan uji 20 satuan tambahan, dan persyaratan di penuhi jika tidak lebih dari 1
satuan dari 30 terletak di luar rentang 85,0% hingga 115,0% dari yang tertera pada
etiket dan tidak ada satuan yang tertera pada etiket dan tidak ada satuan yang
terletak di luar rentang 75,0% hingga 125,0% dari yang tertera pada etiket dan
simpangan baku relatif dari 30 satuan sediaan tidak lebih dari 7,8%.
Penetapan keragaman bobot tablet ini dilakukan pada kelima sediaan
tablet parasetamol.
3.10. Panjang Gelombang Serapan Maksimum dan Linieritas Kurva Kalibrasi Dalam Medium Dapar Fosfat pH 5,8
3.10.1 Pembuatan Larutan Baku
Ditimbang secara seksama 50 mg Paracetamol BPFI, lalu dimasukkan ke
dalam labu tentukur 100 ml dan dilarutkan dengan medium disolusi, lalu
Selanjutnya dipipet sebanyak 5 ml dengan pipet volum lalu dimasukkan ke dalam
labu tentukur 100 ml dan ditambahkan dengan medium disolusi hingga garis
tanda (C = 25 mcg/ml).
3.10.2 Penentuan Panjang Gelombang Serapan Maksimum
Dipipet 6 ml dari larutan standar lalu dimasukkan ke dalam labu tentukur
25 ml dan ditambahkan medium disolusi hingga garis tanda (C = 6 mcg/ml).
Serapan lalu diukur pada panjang gelombang 200 - 400 nm dan sebagai blanko
digunakan medium disolusi.
3.10.3 Pembuatan Kurva Kalibrasi
Dipipet 4 ml; 5 ml; 6 ml; 7 ml; dan 8 ml dari larutan standar ; lalu
dimasukkan ke dalam labu tentukur 25 ml dan ditambahkan medium disolusi
hingga garis tanda. Serapan lalu diukur pada panjang gelombang maksimum dan
sebagai blanko digunakan medium disolusi.
3.11 Uji Disolusi Tablet yang Dibuat Sendiri
Untuk menguji laju disolusi tablet dilakukan dengan menggunakan alat
Dissolution Tester (Erweka).
Medium : 900 ml larutan dapar Fosfat pH 5,8
Alat : tipe 2 (metode dayung)
Kecepatan putaran : 50 rpm
Satu tablet dimasukkan ke dalam wadah disolusi yang telah berisi 900 ml
medium disolusi yang bersuhu 37o ± 0,5o C. Kemudian dayung diputar dengan
kecepatan 50 rpm per menit. Pada interval waktu 5, 10, 15, 20, 25, dan 30 menit
larutan dipipet sebanyak 0,27 ml dan dimasukkan ke dalam labu tentukur 25 ml,
lalu diencerkan dengan medium disolusi sampai garis tanda. Serapan diukur pada
panjang gelombang maksimum terhadap medium disolusi sebagai blanko.
Volume medium diusahakan tetap dengan menambahkan medium disolusi
sebanyak 0,27 ml setelah pemipetan. Dalam waktu 30 menit harus larut tidak
kurang dari 80 % (Q) C8 H9 NO2 dari jumlah yang tertera pada etiket (DitJen,
POM., 1995).
Interprestasi : Persyaratan dipenuhi bila jumlah zat aktif yang terlarut dari
sediaan yang diuji sesuai dengan tabel penerimaan. Lanjutkan pengujian sampai
[image:39.595.114.511.500.650.2]tiga tahap, kecuali bila hasil pengujian melalui tahap S1 atau S2.
Tabel 1. Kriteria Penerimaan Uji Disolusi.
Tahap Jumlah
yang diuji Kriteria penerimaan
S1 6 Tiap unit sediaan tidak kurang dari Q + 5 %
S2 6
Rata-rata dari 12 unit (S1 + S2) adalah sama dengan atau lebih besar dari Q dan tidak 1 unit sediaan yang lebih kecil dari Q - 15 %
S3 12
Rata-rata dari 24 unit (S1 + S2 + S3) adalah sama dengan atau lebih besar dari Q, tidak lebih dari 2 unit sediaan yang lebih kecil dari Q – 15 % dan tidak 1 unit pun yang lebih kecil dari Q – 25 %
3.12. Analisis Data Secara Statistik
Untuk mengetahui apakah data diterima atau ditolak digunakan rumus dibawah ini
t =
n sd
x x−
Standar deviasi (SD) dihitung dengan rumus :
SD =
( )
1 2 − −
∑
n x xDengan dasar penolakan data adalah t hitung≥ t tabel dan bila t hitung mempunyai nilai
negatif , data ditolak jika t hitung ≤ -t tabel
Untuk mencari kadar sebenarnya dengan taraf kepercayaan (ik) 99% ,
dengan derajat kebebasan dk=n-1 , digunakan rumus
μ = x ± t
(
)
λ2 1
1− dk
n SD ×
Keterangan : μ = interval kepercayaan
=
α tingkat kepercayaan
dk = derajat kebebasan
3.14 Parameter Uji Validasi
Kesalahan Relatif (KR)
KR =
U Xi U −
x 100 %
Keterangan : t = harga t tabel sesuai dengan dk=n-1
x = kadar rata-rata sampel
SD= standar deviasi
Koefisien Variasi (KV)
KV =
Xi SD
x 100 %
Keterangan : U = kadar teoritis
X = kadar yang diperoleh dari hasil percobaan
Xi = kadar rata-rata yang diperoleh dari hasil percobaan
SD = standar deviasi
KR = kesalahan relatif
BAB IV
HASIL DAN PEMBAHASAN
4.1. Evaluasi Tablet Parasetamol
Hasil evaluasi fisik tablet parasetamol yang dilakukan berdasarkan
persyaratan industri : uji kekerasan, uji friabilitas, dan uji waktu hancur .
4.1.1. Uji Kekerasan
Berdasarkan Tabel 2 menunjukkan bahwa setiap tablet yang diuji
mempunyai kekerasan yang berbeda-beda mulai dari 8,38 kg sampai 12,58 kg.
Tablet yang dibuat sendiri dengan bahan pengikat amilum manihot 10% b/v
memiliki kekerasan sebesar 7,50 kg, sehingga kekerasan tablet tersebut masih
memenuhi persyaratan menurut Parrot yakni antara 4-8 kg. (Data pengujian dan
perhitungan pada Lampiran 1). Sediaan tablet generik tak berlogo sudah tidak
berada dalam batas penerimaan begitu juga dengan sediaan lain dipasaran yang
mungkin disebabkan beberapa faktor seperti perbedaan tekanan kompresi yang
diberikan atau perbedaan massa granul yang mengisi die pada saat pencetakan
tablet. Selain itu, berbedanya nilai kekerasan juga dapat diakibatkan oleh variasi
jenis dan jumlah bahan tambahan yang digunakan pada formulasi. Bahan pengikat
adalah contoh bahan tambahan yang bisa menyebabkan meningkatnya kekerasan
Tabel 2. Data Kekerasan Tablet Parasetamol
No Sediaan Tablet Kekerasan
( Kg ) Persyaratan
1 Generik Tak Berlogo Indorakyat 12,25
Memenuhi syarat jika kekerasan sebesar 4-8 kg
2 Generik Berlogo Indofarma 8,75
3 Generik Berlogo Universal 12,58
4 Merek Varsemol 8,38
5 Merek Farmadol 9,08
6 Buatan sendiri 7,50
Keterangan : Persyaratan Kekerasan Tablet menurut Parrot (1971)
4.1.2 Uji Friabilitas
Cara lain untuk mengukur kekuatan tablet, yaitu uji friabilitas
(kerenyahan) karena kekerasan tablet bukanlah indikator yang absolut dari
kekuatan tablet. Pada beberapa formulasi, bila dikempa menjadi tablet yang
sangat keras, cenderung akan terjadi cap pada pergesekan, sehingga
menghilangkan bagian atas.
Pada Tabel 3 dapat dilihat bahwa setiap tablet yang diuji juga memiliki
tingkat kerenyahan yang baik. Sediaan dipasaran yang diuji mempunyai nilai
persentase friabilitas yang berbeda yaitu antara 0,13% sampai 0,72%, untuk tablet
generik tak berlogo sendiri mempunyai nilai persentase friabilitas sebesar 0,29%
sedangkan untuk tablet yang dibuat sendiri memiliki nilai sebesar 0,77%. Nilai
tersebut masih memenuhi syarat uji yaitu ≤ 0,8 % (Voight,R.,1995). Oleh karena
masih terpenuhinya syarat uji friabilitas, maka keutuhan tablet sampai ke tangan
Tabel 3. Data Friabilitas Tablet Parasetamol
No Sediaan Tablet Friabilitas
(%) Persyaratan
1 Generik Tak Berlogo Indorakyat 0,29
Memenuhi syarat jika friabilitas
≤ 0,8 %
2 Generik Berlogo Indofarma 0,19
3 Generik Berlogo Universal 0,21
4 Merek Varsemol 0,72
5 Merek Farmadol 0,13
6 Buatan sendiri 0,77
Keterangan : Persyaratan Friabilitas Tablet menurut Voight (1995).
4.1.3 Uji Waktu Hancur
Pada Tabel 4 dapat dilihat bahwa tablet generik tak berlogo memiliki
waktu hancur sebesar 6 menit 6 detik, sedangkan generik berlogo indofarma
mempunyai waktu hancur yang lebih cepat yaitu 53 detik dan tablet merek dagang
Farmadol mempunyai waktu hancur yang lebih lama yaitu 13 menit 50 detik.
Sebaliknya tablet yang dibuat sendiri dengan menggunakan bahan pengembang
amilum manihot dan pengikat mucilago amili 10%, memiliki waktu hancur
sebesar 14 menit 5 detik. (Data pengujian dan perhitungan pada Lampiran 1)
Tablet Parasetamol generik tak berlogo, generik berlogo dan merek dagang
masih memenuhi persyaratan waktu hancur berdasarkan Farmakope Indonesia
edisi IV yaitu tidak lebih dari 15 menit . Adanya perbedaan waktu hancur ini
dapat disebabkan kemungkinan adanya perbedaan jumlah dan jenis bahan
Tabel 4. Data Waktu Hancur Tablet Parasetamol
No Sediaan Tablet Waktu Hancur
(menit) Persyaratan
1 Generik Tak Berlogo Indorakyat 6,06
Memenuhi syarat jika waktu hancur
≤ 15 menit
2 Generik Berlogo Indofarma 0,53
3 Generik Berlogo Universal 10,31
4 Merek Varsemol 13,39
5 Merek Farmadol 13,50
6 Buatan sendiri 14,05
Keterangan : Persyaratan Waktu Hancur Tablet menurut Farmakope Indonesia Edisi IV
4.2. Hasil Penentuan Panjang Gelombang Serapan Maksimum dan Linieritas Kurva Kalibrasi
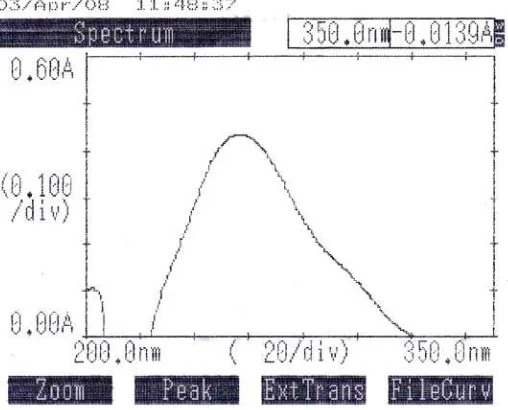
Dari hasil pengukuran secara spektrofotometri ultra violet dengan menggunakan
pelarut NaOH 0,1 N diperoleh serapan maksimum parasetamol BPFI pada
panjang gelombang 257 nm dengan serapan 0.4333 (Data pengujian pada
Lampiran 4). Panjang gelombang ini sama dengan panjang gelombang yang
terdapat dalam literature yaitu menurut Moffat, A.C (1986).
Gambar 1.Kurva serapan Parasetamol BPFI (konsentrasi 6.5 mcg/ml ) dalam
[image:45.595.177.431.502.707.2]Tabel 5. Data Panjang Gelombang Serapan Maksimum & Absorbansi
Parasetamol BPFI
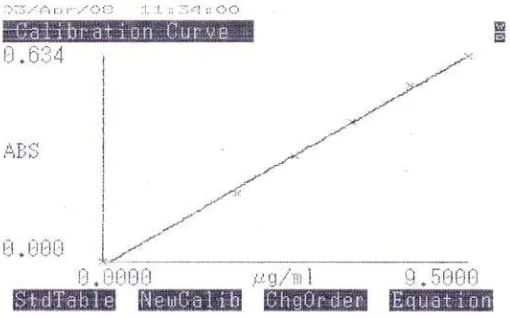
Kurva kalibrasi parasetamol BPFI dapat dilihat pada Gambar 2, berikut :
Gambar 2.Kurva kalibrasi Parasetamol BPFI dalam pelarut NaOH 0,1N secara
spektrofotometri ultraviolet pada panjang gelombang 257 nm.
Dari hasil penentuan linieritas kurva kalibrasi parasetamol BPFI dalam rentang
3.5 mcg/ml – 9.5 mcg /ml pada panjang gelombang maksimum 257 nm diperoleh
hubungan yang linier antara serapan dengan konsentrasi dimana koefisien
korelasi = 0,9988 dan persamaan regresi Y = 0.0682X – 0.0107. (Data
perhitungan pada Lampiran 4). Koefisien korelasi yang didapat masih
[image:46.595.172.427.350.509.2]4.3. Penetapan Kadar Parasetamol Pada Tablet Buatan Sendiri
Dari hasil uji validasi tablet yang dibuat sendiri dengan parameter ketepatan
(accuracy) diperoleh kadar rata-rata 97,57 % dengan standard deviasi (SD) =
0,2921. Kadar ini memenuhi persyaratan Farmakope Indonesia edisi IV yaitu
tidak kurang dari 90,0 % dan tidak lebih dari 115,0 %. Parameter ketepatan
memberikan kesalahan relatif (KR) = 2,4309 dan untuk parameter ketelitian
(presisi) memiliki koefisien variasi (KV) = 0,2994. Kriteria penerimaan untuk
penetapan kadar apabila koefisien variasi tidak lebih besar dari 2% (CPOB,2003).
Oleh karena itu metode yang digunakan ini dapat diterima untuk penetapan kadar
parasetamol dalam sediaan tablet secara spektrofotometri ultraviolet. (Data
pengujian dan perhitungan pada Lampiran 12,13 & 14)
4.4. Penetapan Kadar Parasetamol Dalam Sampel Sediaan
Kadar parasetamol dalam sediaan tablet parasetamol generik tak berlogo
(PT.Indofarma) rata-rata 100,61% dengan kadar sebenarnya 100,02≤ μ ≤ 101,20,
tablet parasetamol generik berlogo Indofarma rata-rata 97,47% dengan kadar
sebenarnya 96,49 ≤ μ ≤ 98,46 , tablet parasetamol generik berlogo Universal rata
-rata 97,34 % dengan kadar sebenarnya 96,79 ≤ μ ≤ 97,88 , tablet Varsemol
(PT.Varia Sekata) rata-rata 98,52 % dengan kadar sebenarnya 97,32 ≤ μ ≤99,72,
tablet Farmadol (PT.Fahrenheit) rata-rata 93,54% dengan kadar sebenarnya 91,58
≤ μ ≤ 95,49 , dan tablet yang dibuat sendiri rata-rata 97,57 % dengan kadar
sebenarnya 96,97 ≤ μ ≤ 98,17. (Data pengujian dan perhitungan pada Lampiran
Tabel 6. Kadar rata-rata parasetamol pada sediaan tablet
No Nama Sediaan Kadar Rata-rata
(%) Persyaratan
1 Tablet Generik Tak Berlogo (PT.Indofarma) 100,61
Memenuhi persyaratan jika kadar diantara 90%
-115%
2 Tablet Generik Berlogo (PT.Indofarma) 97,47
3 Tablet Generik Berlogo (PT. Universal) 97,34
4 Tablet Varsemol ( PT. Varia Sekata) 98,52
5 Tablet Farmadol ( PT. Fahrenheit) 93,54
6 Tablet yang dibuat sendiri 97,57
Keterangan : Persyaratan Penetapan Kadar Tablet menurut Farmakope Indonesia Edisi IV(1995)
Menurut Farmakope Indonesia edisi IV (Ditjen POM.,1995), tablet
Parasetamol mengandung tidak kurang dari 90,0 % dan tidak lebih dari 115,0 %
dari jumlah yang tertera pada etiket. Dari hasil penetapan kadar pada Tabel 6
dapat dilihat bahwa semua tablet Parasetamol generik tak berlogo, generik
berlogo dan merek dagang memenuhi standar persyaratan kadar berdasarkan
Farmakope Indonesia edisi IV (Ditjen POM.,1995). Kadar Parasetamol dalam
tablet berkisar antara 93,54 % sampai 100,61 % dimana kadar tertinggi diperoleh
pada Tablet Generik Tak Berlogo dan yang terendah diperoleh pada Tablet
Farmadol.
4.5. Hasil Uji Keragaman Bobot Parasetamol Dalam Sediaan Tablet
Menurut Farmakope Indonesia edisi IV (1995) bahwa persyaratan
keragaman bobot dipenuhi jika jumlah zat aktif dalam masing-masing dari 10
satuan sediaan terletak antara 85,0% - 115,0% dari jumlah yang tertera pada etiket
Tabel 7. Hasil Uji Keragaman Bobot
No Nama Obat Kadar Rata-Rata
(%)
Standar Deviasi
Relatif (%) Persyaratan
1 Generik Tak Berlogo Indofarma 100,43 0,72 Memenuhi
Syarat jika Kadar diantara 85,0%-115,0% dan Standar Deviasi ≤6,0%
2 Generik Berlogo Indofarma 97,91 0,73
3 Generik Berlogo Universal 97,81 0,57
4 Merek Varsemol 96,24 0,43
5 Merek Farmadol 95,12 0,74
6 Buatan Sendiri 98,69 0,76
Keterangan : Persyaratan Keragaman Bobot Tablet menurut Farmakope Indonesia Edisi IV(1995)
Dari Tabel 7 dapat dilihat hasil uji keragaman bobot tablet Parasetamol
Generik Tak Berlogo sebesar 100,43 % dengan standar deviasi relatif 0,72, tablet
generik Berlogo Indofarma sebesar 97,91 % dengan standar deviasi relatif 0,73,
tablet Parasetamol Generik Berlogo Universal sebesar 97,81 % dengan standar
deviasi relatif 0,57, tablet Varsemol sebesar 96,24 % dengan standar deviasi
relatif 0,43, dan tablet Farmadol sebesar 95,12 % dengan standar deviasi relatif
0,74, sedangkan untuk tablet buatan sendiri sebesar 98,69% dengan standar
deviasi sebesar 0,76. (Data pengujian dan perhitungan pada Lampiran 15).
Berarti semua sediaan tablet Parasetamol memenuhi persyaratan Farmakope
Indonesia edisi IV (Ditjen POM,1995).
Pada umumnya metode analisis resmi mensyaratkan pengambilan
sejumlah sampel tablet, penggerusan, pencampuran, dan analisis untuk
memperoleh nilai kadar rata-rata. (Lachman dkk , 1994). Walaupun hasil rata-rata
penentuan kadar itu kelihatannya memenuhi syarat, didalamnya mungkin saja
terdapat penyimpangan kadar yang cukup besar, sehingga penderita mungkin saja
mengalami kelebihan dosis atau kekurangan dosis. Ada tiga faktor yang
obat pada pencampuran bubuk atau granulasi, pemisahan dari campuran bubuk
atau granulasi selama proses pembuatan dan penyimpangan berat tablet.
4.6. Hasil Penentuan Kurva Serapan Dan Kurva Kalibrasi Parasetamol BPFI dalam Pelarut Dapar Fospat PH 5,8
Serapan maksimum dari panjang gelombang parasetamol adalah 245 nm
dalam pelarut asam. (Moffat, A.C., 1986). Hasil pengukuran secara
spektrofotometri ultra violet dengan menggunakan pelarut Dapar Fosfat pH 5,8
diperoleh serapan maksimum parasetamol BPFI pada panjang gelombang 243,5
nm dengan serapan 0.4310. (Data pengujian pada Lampiran 16). Serapan
maksimum pada panjang gelombang 243,5 nm ini masih dapat ditolerir karena
mengandung implikasi bahwa maksimum tersebut tepat pada atau dalam batas 2
nm dari panjang gelombang yang ditentukan.(Ditjen POM,1995).
Hasil penentuan kurva serapan, data dan kurva kalibrasi Parasetamol BPFI
dengan konsentrasi 6 mcg/ml dengan larutan dapar fosfat pH 5,8 dapat dilihat di
Gambar 3.Kurva Serapan, Data Dan Kurva Kalibrasi Parasetamol BPFI Dalam
Dapar Fosfat pH 5,8 secara spektrofotometri ultraviolet.
Pada penentuan kurva kalibrasi, larutan Paracetamol BPFI dibuat dengan
konsentrasi berturut-turut : 4 mcg/ml; 5 mcg/ml; 6 mcg/ml; 7 mcg/ml; 8
mcg/ml, diperoleh hubungan yang linier antara serapan dengan konsentrasi
dimana koefisien korelasi (r) = 0,9997 dan persamaan regresi Y = 0.07095X+
0.00175 (Data perhitungan pada Lampiran 17). Koefisien korelasi yang didapat
4.7. Hasil Uji Disolusi Parasetamol Dalam Sediaan Tablet
Menurut Farmakope Indonesia Edisi IV, disebutkan bahwa dalam waktu
30 menit Parasetamol yang terlarut tidak kurang dari 80 % (Q) C8 H9 NO2
dari jumlah yang tertera pada etiket. Berdasarkan hasil pengujian ternyata tablet
Parasetamol baik generik berlogo, merek dagang, maupun generik tak berlogo
memenuhi persyaratan uji disolusi. Hasil % kumulatif rata-rata uji disolusi tablet
Parasetamol generik berlogo , merek dagang dan generik tak berlogo dapat terlihat
[image:52.595.115.510.374.497.2]pada Tabel 8 dan Gambar 5 di bawah ini.
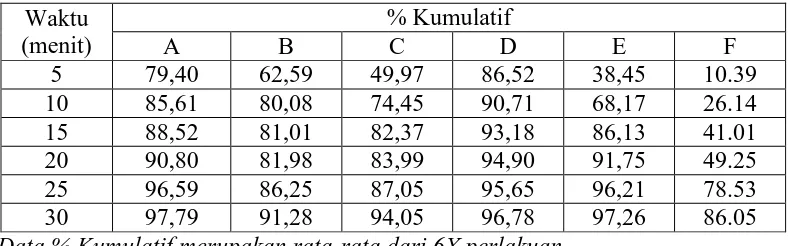
Tabel 8.Hasil % Kumulatif Rata-rata Uji Disolusi Tablet Parasetamol Dalam Medium Disolusi Dapar Fosfat pH 5,8
Waktu (menit)
% Kumulatif
A B C D E F
5 79,40 62,59 49,97 86,52 38,45 10.39
10 85,61 80,08 74,45 90,71 68,17 26.14
15 88,52 81,01 82,37 93,18 86,13 41.01
20 90,80 81,98 83,99 94,90 91,75 49.25
25 96,59 86,25 87,05 95,65 96,21 78.53
30 97,79 91,28 94,05 96,78 97,26 86.05
Data % Kumulatif merupakan rata-rata dari 6X perlakuan.
Gambar 5. Grafik % kumulatif rata-rata disolusi tablet Parasetamol generik
berlogo, Merek Dagang Dan generik tak berlogo dalam Medium Disolusi Dapar Fosfat pH 5,8.
Dari Tabel 8 dan Gambar 5 dapat dilihat bahwa persen kumulatif yang
terabsorbsi pada menit ke-30 untuk tablet Parasetamol generik tak berlogo
Indofarma sebesar 97,26%, tablet Parasetamol generik berlogo Universal sebesar
91,28 %, tablet Varsemol sebesar 94,05 %, tablet Farmadol sebesar 96,78 %,
tablet generik berlogo sebesar 97,79 %. Pada tablet yang dibuat sendiri sebesar
86,05% (Data perhitungan pada Lampiran 18). Sehingga semua sediaan tablet
memenuhi persyaratan Farmakope Indonesia edisi IV.
Menurut Lachman dkk (1994) biasanya untuk memperoleh kadar yang
tinggi di dalam darah ditentukan oleh cepatnya obat dan tablet melarut.
Pembebasan bahan obat dari sediaan obat dapat menggambarkan faktor yang
dikontrol untuk ketersediaan hayati obat. Oleh karena itu, laju disolusi dapat
berhubungan langsung dengan efikasi (kemanjuran) dari tablet. Karakteristik
farmasetik, content availability). Hal ini dirumuskan sebagai skala dan kecepatan
suatu bahan aktif atau suatu komponen efektif diabsorpsi dari sediaan obatnya dan
akan bermanfaat pada tempat kerjanya.
Sediaan tablet yang baik harus memiliki onset of action yang cepat dan
duration of action yang lama sehingga obat dapat dengan cepat memberikan
respon farmakologisnya. Berdasarkan grafik dapat disimpulkan bahwa sediaan
tablet farmadol memiliki onset of action yang paling baik dibandingkan dengan
sediaan tablet yang lain. Karena pada menit ke-5 sudah melepaskan kadar zat
berkhasiat lebih dari 80%, untuk tablet generik tak berlogo tercapai pada menit
ke-15, untuk tablet generik indofarma dan universal tercapai pada menit ke-10,
untuk varsemol tercapai pada menit ke-15, untuk tablet yang dibuat sendiri
tercapai pada menit ke-30.
Secara teori kekerasan sediaan tablet berhubungan dengan friabilitas dan
laju disolusi obat. Makin besar nilai kekerasannya maka friabilitasnya makin kecil
dan waktu hancur akan semangkin lama (Lachman,dkk,1994). Hal ini tidak sesuai
dengan hasil yang diperoleh dimana pada uji kekerasan tablet generik tak berlogo
memiliki kekerasan yang diluar persyaratan tetapi memiliki laju disolusi yang
relatif cepat dibanding dengan tablet sediaan lainnya. Berdasarkan hal diatas
diduga penggunaan bahan tambahan sebagai bahan pengisi, pengikat, penghancur,
pelicin dan perbedaan tekanan compressi tablet dalam proses formulasi mungkin
akan menghambat atau mempercepat laju disolusi sediaan tablet.
Onset of action adalah waktu yang dibutuhkan sampai obat menunjukkan
sedangkan duration of action adalah lama obat terus menerus menghasilkan
respon. Duration of action dari parasetamol 4-6 jam, tetapi duration of action
tidak dapat digunakan dalam pembahasan ini karena duration of action lebih
digunakan untuk perlakuan secara in vivo. Masa kerja parasetamol agak pendek,
sehingga sering memerlukan 4 kali pemberian/hari. Dosis lazim parasetamol
adalah 10-15 mg/kgBB/kali dan tidak boleh diberikan lebih dari 4 g/hari. (Tjay
BAB V
KESIMPULAN DAN SARAN
5.1. Kesimpulan
Hasil pengujian mutu fisis tablet parasetamol generik tak berlogo dengan
parameter uji kekerasan dan uji friabilitas memenuhi persyaratan industri farmasi
kecuali uji kekerasan. Hal yang sama juga diperoleh pada tablet pembandingnya.
Sebaliknya hasil pengujian mutu menurut Farmakope Indonesia Edisi IV dengan
parameter uji waktu hancur, penetapan kadar, keseragaman bobot dan uji disolusi
memenuhi persyaratan, demikian pula dengan tablet pembandingnya.
5.2.Saran
Disarankan kepada peneliti selanjutnya agar memeriksa parasetamol
DAFTAR PUSTAKA
Ansel,H.C., (1989). Pengatar Bentuk sediaan Farmasi. Edisi 4. UI Press. Jakarta. Halaman 96,147.
Ditjen POM. (1979). Farmakope Indonesia . Edisi III . Departemen Kesehatan RI.Jakarta. Halaman : 7, 712.
Ditjen POM. (1995). Farmakope Indonesia . Edisi IV . Departemen Kesehatan RI.Jakarta. Halaman : 4, 649-650, 999-1000, 1066, 1085-1087, 1124-1210.
Harun, F. R. (1996). Penentuan Kadar Vitamin Larut Air Dalam Sediaan Tablet
Secara Simultan Dengan Cara Kromatografi Cair Kinerja Tinggi. Tesis
Magister Farmasi. Program Pasca Sarjana . Institut Teknologi Bandung.
Lachman L., Lieberman H.A., Kanig J.L., (1994), Teori dan Praktek Farmasi
Industri diterjemahkan oleh Suyatni S., Edisi II, UI Press, Jakarta.
Halaman : 651- 662.
Moffat, A.C., et al., (1986). Clarke’s Isolation and Identification of Drug. Second Edition. Pharmaceutical Press, London. Page: 327.
Parrot, E.L., (1971). Pharmaceutical Technology Fundamental Pharmaceutics. Minneapolis. Burgess Publishing Company. Page. 75
Shargel,L dan Andrew B.C.Y. (1988). Biofarmasetika dan Farmakokinetika
Terapan. Airlangga University Press. Surabaya. Halaman : 15-16.
Soekemi,R.A,Yuanita,T, Fat Aminah, Salim Usman. (1987). Tablet. Mayang Kencana. Halaman : 18-19.
Syukri,Y.,(2002). Biofarmasetika. UI Press. Yogyakarta.Halaman : 36-38
Voigt. R,.(1994). Buku Pelajaran Teknologi Farmasi. Penerjemah Dr. Soendani Noerono. Edisi Kelima. Gadjah Mada University Press, Yogyakarta.
Halaman : 165, 179, 222.
Yus. 2007. Obat Rakyat Rp.1000 Dipasarkan . Republika Rabu, 9 Mei 2007
Wilmana,Freddy,(1995). Analgesik-Antipiretik Analgesik Anti-Inflamasi Nonsteroid Dan Obat Pirai dalam Ganiswara (1995), Farmakologi Dan Terapi, Edisi Keempat Bagian Farmakologi Fakultas Kedokteran
Lampiran 1. Data Hasil Uji Kekerasan, Uji Friabilitas, dan Uji Waktu A. Uji Kekerasan tablet
No
Kekerasan Tablet (kg)
G. Indofarma G.
Universal Varsemol
® Farmadol® Rakyat B. Sendiri
1 12.5 9 7.25 9.25 12 5.5
2 12.25 8 8.75 9.25 13.5 3
3 12.25 9 9 9.75 13.75 7.5
4 12 9.25 7.25 8.5 11.25 4.5
5 12.75 8.25 8.75 9.25 11.5 6.75
6 11.75 9 9.25 8.5 13.5 6.5
Rata-rata 12.25 ± 0.35a 8.75 ± 0,50 8.38 ± 0.90 9.08 ± 0.49 12.58 ± 1.13 5.63 ± 1.66
a) standart deviasi
B. Uji friabilitas
No Sediaan Bobot 20 Tablet (mg) Friabilitas (%)
Sebelum (a) Sesudah (b)
1 G.Indofarma 12.1880 12.1640 0.1969
2 G. Universal 10.8780 10.8550 0.2114
3 Varsemol® 12.0940 12.0070 0.7194
4 Farmadol® 12.7740 12.7580 0.1253
5 Rakyat 12.1000 12.0650 0.2893
6 B.Sendiri 10.7780 10.6950 0.7701
C. Uji Waktu Hancur
No Waktu Hancur (menit)
G. Indofarma G. Universal Varsemol® Farmadol® Rakyat B. Sendiri
1 0.33 6.35 14.3 13.4 1.41 12.41
2 0.33 8.37 14.15 14.21 4.27 13.2
3 0.34 10 14.13 14.38 6.2 13.54
4 0.57 9.5 14.2 14.47 6.5 14.11
5 0.57 12 14.24 12.21 8 14.2
6 1.05 13.24 9.29 12.35 7.59 14.45
Rata- 0.53 ± 0.28a 10.31 ± 2.48 13.39 ± 2.01 13.50 ± 1.02 6.06 ± 2.46 14.05 ± 0.76 rata
Lampiran 2. Contoh Perhitungan Friabilitas Tablet
Rumus : F = (a-b)/a x 100%
Keterangan : F = Friabilitas
a = Bobot tablet sebelum diputar dalam alat Friabilitas Tester selama 4 menit (100
putaran)
b = Bobot tablet setelah diputar dalam alat Friabilitas Tester selama 4 menit (100
putaran)
Syarat friabilitas tablet :
Kehilangan bobot tidak boleh lebih dari 0,8 % (x ≤ 0,8 %), sebagai contoh diambil
Tablet generik indofarma
Bobot 20 tablet sebelum diputar = 12,1880 g
Bobot 20 tablet setelah diputar = 12,1645 g
Friabilitas Tablet = 12,1880 – 12,1645/12,1880 x 100 % = 0,19 %
Perhitungan friabilitas dalam sediaan tablet lainnya dilakukan dengan cara yang
Lampiran 3. Hasil Penentuan Kurva Serapan Parasetamol BPFI Pada C = 6,5
Lampiran 4. Hasil Penentuan Persamaan Regresi Dari Kurva Kalibrasi
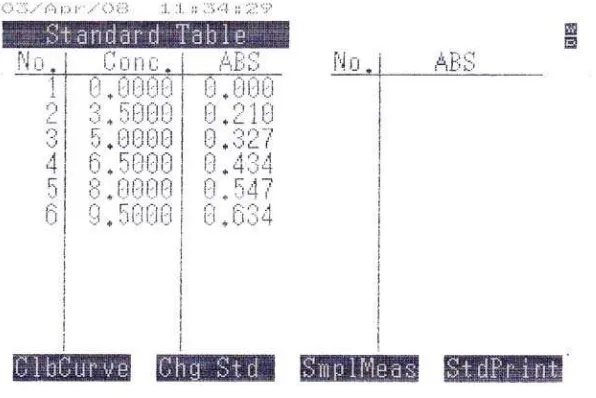
[image:62.595.134.432.189.388.2]Parasetamol BPFI Pada Panjang Gelombang = 257 nm Terhadap Pelarut Sebagai Blanko.
Tabel Data Kurva Kalibrasi
C (mcg/ml)
(X) A (Y) XY X
2 Y2 0,0 3,5 5,0 6,5 8,0 9,5 0.000 0,210 0,327 0,434 0,547 0,634 0,000 0,735 1,635 2,821 4,376 6,023 0,00 12,25 25,00 42,25 64,00 90,25 0,0000 0,0441 0,1069 0,1884 0,2992 0,4020
ΣX = 32,5 ΣY = 2,152 ΣXY = 15,59 ΣX2
= 233,75 ΣY2 = 1,0406 X = 5,4166 Y = 0,3587
a
∑
∑
∑
∑ ∑
− −= 2 2
) ( . X X n Y X XY n 2 ) 5 , 32 ( ) 75 , 233 ( 6 ) 152 , 2 )( 5 , 32 ( ) 59 , 15 ( 6 − − =
= 0,0682
b = Y – a X
= 0,3587 – (0,0682 x 5,4166)
= -0,0107
Persamaan regresi diperoleh dengan mensubsitusikan nilai a dan b, sehingga
persamaan regresi adalah:
Y = 0,0682 X - 0,0107
Dengan nilai r sebagai berikut :
Lampiran 5. Contoh perhitungan kadar parasetamol
Misalnya untuk tablet parasetamol yang dibuat sendiri :
Berat 20 tablet = 10695 mg
Berat Parasetamol dalam 20 tablet = 20 x 500 mg = 10.000 mg
Berat setara 50 mg Parasetamol =
mg mg 10000
50
x 10695 mg = 53,475 mg
Pengujian 1
Serbuk ditimbang seksama sebanyak 53 mg kemudian dilarutkan sesuai
prosedur yang telah disebutkan sebelumnya dan diukur serapan pada panjang
gelombang maksimum.
Misalnya A(Y) = 0,4164 dengan menggunakan persamaan regresi :
Y = 0,0682 X - 0,0107
Diperoleh konsentrasi (X) larutan =
0682 , 0 0107 , 0 4164 , 0 +
= 6,2634 mcg/ml
Diketahui konsentrasi teoritisnya = Berat yang ditimbang
Berat setara 50 mg
X Konsentrasi tengah
Diketahui konsentrasi teoritisnya= 6,5 475 , 53 53 × mg mg
mcg/ml =6,4423 mcg/ml
Kadar =
ml mcg ml mcg / 4423 , 6 / 2634 , 6
x 100,31 %
= 97,5250 %
Perlakuan perhitungan kadar parasetamol dalam sediaan tablet ini dilakukan
sebanyak 6 (enam) kali. Perhitungan kadar parasetamol dalam sediaan tablet
Lampiran 6. Data Kadar Parasetamol dalam Sedian Tablet
No Formula Sampel Berat
[image:65.595.113.533.140.653.2](mg) Berat setara (mg) Absorbansi (A) Konsentrasi Teoritis (mcg/ml) Konsentrasi Praktek (mcg/ml) Kadar (%) Kadar Rata-rata (%) Generik Indofarma Berat 20 tablet = 11986 mg
62 59.94 0.4373 6.7234 6.5697 98.02
97.72
62 59.94 0.4329 6.7234 6.5052 97.05
1 62 59.94 0.4344 6.7234 6.5285 97.40
62 59.94 0.4417 6.7234 6.6342 98.98
62 59.94 0.4325 6.7234 6.4998 96.97
62 59.94 0.4368 6.7234 6.5625 97.91
Generik Universal Berat 20 tablet = 10761 mg
54 53.81 0.4275 6.5236 6.3082 97.00
97.69
54 53.81 0.4225 6.5236 6.3333 97.38
2 54 53.81 0.4213 6.5236 6.3333 97.38
54 53.81 0.4321 6.5236 6.4694 99.48
54 53.81 0.4232 6.5236 6.3548 97.72
54 53.81 0.4213 6.5236 6.3208 97.19
Varsemol® Berat 20 tablet = 12040 mg
60 60.2 0.4275 6.4784 6.4264 99.50
98.86
60 60.2 0.4225 6.4784 6.3530 98.37
3 60 60.2 0.4213 6.4784 6.3351 98.09
60 60.2 0.4321 6.4784 6.4945 100.56
60 60.2 0.4232 6.4784 6.3637 98.53
60 60.2 0.4213 6.4784 6.3351 98.09
Farmadol® Berat 20 tablet = 12718 mg
63 63.59 0.4014 6.4397 6.0432 93.96
95.43
63 63.59 0.4493 6.4397 6.7470 104.91
4 63 63.59 0.4001 6.4397 6.0252 93.69
63 63.59 0.4031 6.4397 6.0682 94.35
63 63.59 0.4005 6.4397 6.0306 93.77
63 63.59 0.3923 6.4397 5.9106 91.90
Penurun