PENETAPAN KADAR CAMPURAN IBUPROFEN DAN PARASETAMOL DALAM SEDIAAN TABLET SECARA VOLUMETRI
SKRIPSI
Diajukan untuk melengkapi salah satu syarat untuk memperoleh gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH: EKI NALDI NIM 081524016
PROGRAM FARMASI EKSTENSI FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
PENGESAHAN SKRIPSI
PENETAPAN KADAR CAMPURAN IBUPROFEN DAN PARASETAMOL DALAM SEDIAAN TABLET
SECARA VOLUMETRI
OLEH : EKI NALDI NIM 081524016
Dipertahankan di hadapan Panitia Penguji Fakultas Farmasi
Universitas Sumatera Utara Pada tanggal: februari 2010
Pembimbing I, Panitia Penguji,
Drs. Syafruddin, MS., Apt. Dra. Nurmadjuzita, M.Si., Apt. NIP 194811111976031003 NIP 194809041974122001
Pembimbing II,
Drs. Syafruddin, MS., Apt.
NIP 194811111976031003 Drs. Fathur Rahman Harun, M.Si.,Apt.
NIP. 195201041980031002
Dra. Sudarmi, M.Si., Apt. NIP 195409101983032001
Dra. Salbiah, M.Si., Apt. NIP 194810031987012001 Medan,…..Februari 2010
Fakultas Farmasi Universitas Sumatera Utara
Dekan,
KATA PENGANTAR
Puji dan syukur kehadirat Allah yang Maha Kuasa yang telah melimpahkan rahmat, karunia dan ridhoNya, sehingga penulis dapat menyelesaikan skripsi yang berjudul “Penetapan Kadar Campuran Ibuprofen dan Parasetamol dalam Sediaan Tablet Secara Volumetri”. Skripsi ini diajukan sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi pada Fakultas Farmasi Universitas Sumatera Utara.
Salah satu parameter mutu sediaan farmasi adalah kandungan zat aktif. Tujuan penelitian ini adalah untuk mengembangkan metode sehingga didapatkan metode alternative dalam penetapan kadar campuran Ibuprofen dan Parasetamol dalam sediaan tablet secara volumetri. Ternyata Ibuprofen dapat ditetapkan kadarnya secara alkalimetri dan parasetamol secara nitrimetri
Pada kesempatan ini penulis menyampaikan terima kasih sebesar-besarnya kepada Bapak Drs. Syafruddin., M.S., Apt dan Bapak Drs. Fathur Rahman Harun., M.Si., Apt, yang telah membimbing dengan penuh kesabaran, tulus dan ikhlas selama penelitian dan penulisan skripsi ini berlangsung. Ucapan terima kasih juga disampaikan kepada Ibu Dra. Nurmadjuzita., M.Si., Apt, Ibu Dra. Sudarmi, M.Si.,Apt dan Ibu Dra. Salbiah., M.Si. Apt yang telah memberikan kritik dan saran pada skripsi ini. Ucapan terima kasih juga disampaikan kepada Dekan Fakultas farmasi Universitas Sumatera Utara, Prof. Dr. Sumadio Hadisahputra, Apt., yang telah memberikan bantuan dan fasilitas selama masa pendidikan.
Penulis juga tidak lupa mengucapkan terima kasih dan penghargaan yang tulus kepada kedua orang tua tercinta serta kakak dan adik-adikku, teman angkatan ekstensi 08 dan lain-lain atas doa, dorongan dan pengorbanan baik moril maupun materil dalam penyelesaian skripsi ini.
Medan, ……Maret 2010 Penulis,
Eki Naldi
Penetapan Kadar Campuran Ibuprofen Dan Parasetamol Dalam Sediaan Tablet Secara Volumetri
Abstrak
Kombinasi ibuprofen dan parasetamol merupakan salah satu jenis
kombinasi dalam formula tablet analgetik-antipiretik dan antiinflamasi yang dapat
menghasilkan efek potensiasi dalam meringankan nyeri, mengurangi demam dan
radang. Tujuan penelitian ini adalah untuk mencari metode alternatif pada
penentuan kadar campuran ibuprofen dan parasetamol dalam sediaan tablet secara
volumetri.
Metode alternatif yang digunakan pada penetapan kadar ibuprofen yaitu
secara alkalimetri dengan pentiter larutan natrium hidroksida, dimana parasetamol
tidak akan tertitrasi sedangkan parasetamol ditetapkan secara nitrimetri dengan
pentiter natrium nitrit.
Dari hasil penelitian diperoleh kadar ibuprofen dan parasetamol dalam
sediaan tablet masing-masing untuk Bimacyl® 106,18% ± 0,55% dan 98,49% ± 1,08%, Iremax® 100,93% ± 0,59% dan 96,51% ± 3,12%, Neo Rheumachyl®
105,10% ± 0,89% dan 94,52% ± 1,00%, Oskadon SP® 104,33% ± 1,35% dan
98,74% ± 0,72%. Dari hasil uji validitas metode yang digunakan memberikan hasil akurasi dan presisi yang dapat diterima dengan persen perolehan kembali
untuk ibuprofen 99,07 % (RSD = 1,91%) dan 99,81 % (RSD = 1,13) untuk
parasetamol.
Hasil penelitian menunjukan bahwa kadar ibuprofen dan parasetamol
dalam sediaan tablet dengan berbagai merek dagang memenuhi persyaratan tablet
menurut Farmakope Indonesia Edisi IV tahun 1995 yaitu tidak kurang dari 90,0 %
dan tidak lebih dari 110,0 % dari jumlah yang tertera pada etiket.
Determination Of a Mixture Ibuprofen and Paracetamol In The Tablet Using by Volumetric
Abstract
Combination of ibuprofen and paracetamol is one type of combination in
tablet antipyretic-analgesic and anti-inflamatory, that can result potentiation
effects to relieve pain, reduce fever and inflamation. The purpose of this research is to find alternative methods of determine the amount of a mixture ibuprofen and paracetamol in tablet dosage using volumetric
An alternative method used in determining the amount of ibuprofen in alkalimetry with titrant sodium hydroxide solution, paracetamol which will not influence and paracetamol determined with nitrimetri using sodium nitrite as a titrant.
From the research results obtained amount of ibuprofen and paracetamol in tablet dosage for each Bimacyl® 106,18% ± 0,55% dan 98,49% ± 1,08%,
Iremax® 100,93% ± 0,59% and 96,51% ± 3,12%, Neo Rheumachyl® 105,10% ± 0,89% and 94,52% ± 1,00%, Oskadon SP® 104,33% ± 1,35% and 98,74% ± 0,72%, From the results of tested the validity of the method used gives results of accuracy and precision that is acceptable, the percent recovery for ibuprofen 99.07% (RSD = 1.91%) and 99.81% (RSD=1.13) for paracetamol.
The result showed that amount of ibuprofen and paracetamol in tablet was
fulfilled requirement of Farmakope Indonesia edisi IV 1995, not less than 90.0
percent and not more than 110.0 percent of the labeled amount.
DAFTAR ISI
Halaman
JUDUL ... i
HALAMAN PENGESAHAN ...ii
KATA PENGANTAR ... iii
ABSTRAK ... iv
ABSTRACT ... v
DAFTAR ISI ... vi
DAFTAR TABEL ... ix
DAFTAR GAMBAR... x
DAFTAR LAMPIRAN ... xi
BAB I. PENDAHULUAN ... 1
1.1. Latar Belakang ... 1
1.2. Perumusan Masalah ... 3
1.3. Hipotesis ... 3
1.4.Tujuan ... 4
BAB II. TINJAUAN PUSTAKA ... 5
2.1. Ibuprofen ... 5
2.2. Parasetamol ... 6
2.3. Volumetri ... 7
2.4. Metode Penetapan Kadar Ibuprofen ... 9
2.4.1. Alkalimetri ... 9
2.4.2. Secara Spektrofotometer UV-VIS ... 10
2.4.3. Secara Kromatografi Cair Kinerja Tinggi ... 10
2.5. Metode Penetapan Kadar Parasetamol ... 10
2.5.1. Nitrimetri (Titrasi Diazotasi) ... 10
2.5.2. Serimetri ... 13
2.5.3. Secara Spektrofotometer UV-VIS ... 14
2.5.4. Secara Kromatografi Cair Kinerja Tinggi ... 14
2.6. Spektrofotometer Inframerah ... 14
2.7. Validasi Metode Analisis ... 17
3.2. Bahan -bahan... 21
3.3. Pengambilan Sampel ... 21
3.4. Prosedur Penelitian ... 22
3.4.1. Pembuatan Pereaksi ... 22
3.4.1.1. Pembuatan Larutan Natrium Hidroksida 0,1 N ... 22
3.4.1.2. Pembuatan Larutan Fenolftalein ... 22
3.4.1.3. Pembuatan Larutan Natrium Nitrit 0,1 N ... 22
3.4.1.4. Pembuatan Pasta Kanji Iodida ... 22
3.4.1.5. Pembuatan Larutan Asam Sulfat 10 % b/b... 22
3.4.1.6. Pembuatan Larutan HCl 2 N... 22
3.4.2. Pembakuan Larutan Natrium Hidroksida 0,1 N ... 23
3.4.3. Pembakuan Larutan Natrium Nitrit 0,1 N ... 23
3.4.4. Identifikasi Baku Ibuprofen Dan Parasetamol (PT. Mutifa) Dengan Spektrofotometer Inframerah ... 23
3.4.5. Penentuan Kadar Baku Ibuprofen (PT. Mutifa) ... 24
3.4.6. Penentuan Kadar Baku Parasetamol (PT.Mutifa) ... 24
3.4.7. Penetapan Kadar Ibuprofen dalam Sediaan Tablet ... 25
3.4.8. Penetapan Kadar Parasetamol dalam Sediaan Tablet... 25
3.4.9. Uji Validasi dengan Parameter Akurasi dan Presisi... 26
3.4.9.1. Uji Akurasi dengan Persen Perolehan Kembali (%Recovery) ... 26
3.4.9.2. Uji Presisi ... 26
3.4.9.3. Analisis Data Secara Statistik ... 27
BAB IV. HASIL DAN PEMBAHASAN ... 28
4.1. Identifikasi Baku Ibuprofen dan Parasetamol Secara Spektrofotometri Inframerah FTIR ... 28
4.2. Penentuan Kadar Baku Ibuprofen (PT. Mutifa) Secara Alkalimetri ... 30
4.3. Penentuan Kadar Baku Parasetamol (PT. Mutifa) Secara Nitrimetri ... 31
4.4. Penentuan Kadar Ibuprofen dan Parasetamol Dalam Sediaan Tablet ... 31
4.4. Uji Validasi Metode Analisis ... 32
BAB V. KESIMPULAN DAN SARAN ... 35
4.2. Saran ... 35
DAFTAR PUSTAKA ... 36
DAFTAR TABEL
Halaman
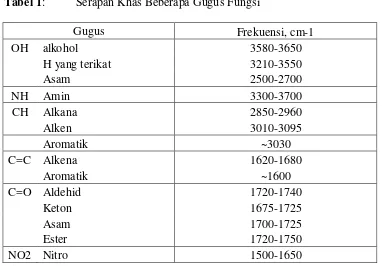
Tabel 1. Serapan Khas Beberapa Gugus Fungsi ... 17
Tabel 2. Rentang Kesalahan Yang Diijinkan ... 18
Tabel 3. Rentang Presisi yang diperbolehkan ... 19
Tabel 4. Hasil Penetapan Kadar Baku Ibuprofen Secara Alkalimetri... 30
Tabel 5. Hasil Penetapan Kadar Baku Parasetamol Secara Nitrimetri ... 31
Tabel 6. Kadar Rata-rata Ibuprofen dan Parasetamol dalam Sediaan Tablet ... 31
Tabel 7. Hasil Penetapan Perolehan Kembali Ibuprofen dalam Tablet Iremax Secara Alkalimetri dengan Metode Penambahan Baku (Standard Addition Method) ... 33
DAFTAR GAMBAR
Halaman
Gambar 1. Struktur Kimia Ibuprofen ... 5
Gambar 2. Struktur Kimia Parasetamol ... 6
Gambar 3. Perubahan Struktur Kimia Fenolftalein ... 10
Gambar 4. Hidrolisis Parasetamol ... 13
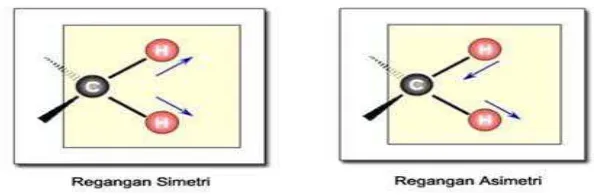
Gambar 5. Contoh Vibrasi Regangan Simetri dan Asimetri ... 15
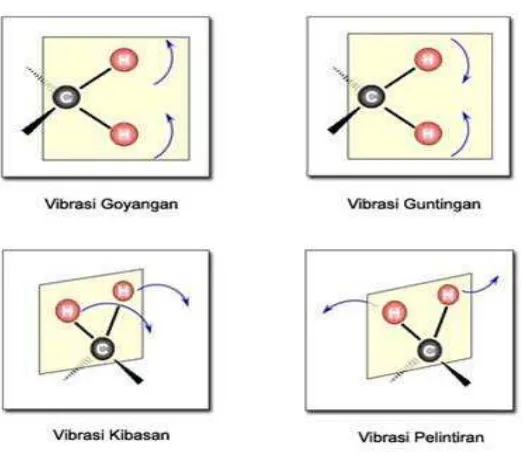
Gambar 6. Contoh vibrasi Tekuk ... 16
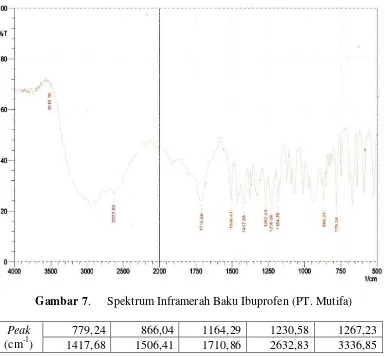
Gambar 7. Spektrum Inframerah Baku Ibuprofen (PT. Mutifa) ... 28
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Hasil Penentuan Kadar Baku Ibuprofen (PT. Mutifa) Secara Alkalimetri ... 38
Lampiran 2. Perhitungan Statistik Kadar Baku Ibuprofen (PT. Mutifa) Secara Alkalimetri ... 39
Lampiran 3. Hasil Penentua Kadar Baku Parasetamol (PT. Mutifa) Secara Nitrimetri ... 41 Lampiran 4. Perhitungan Statistik Kadar Baku Parasetamol (PT. Mutifa)
Secara Nitrimetri ... 42
Lampiran 5. Data Kadar Ibuprofen dalam Sediaan Tablet dengan Berbagai Merek Dagang ... 44 Lampiran 6. Perhitungan Statistik Kadar Ibuprofen dalam Sediaan Tablet
Bimacyl ... 45 Lampiran 7. Perhitungan Statistik Kadar Ibuprofen dalam Sediaan Tablet
Iremax ... 47 Lampiran 8. Perhitungan Statistik Kadar Ibuprofen dalam Sediaan Tablet Neo Rheumacyl... 49 Lampiran 9. Perhitungan Statistik Kadar Ibuprofen dalam Sediaan Tablet
Oskadon SP ... 51 Lampiran 10. Data Kadar Parasetamol dalam Sediaan Tablet dengan Berbagai Merek Dagang ... 53 Lampiran 11. Perhitungan Statistik Kadar Parasetamol dalam Sediaan Tablet
Bimacyl ... 54 Lampiran 12. Perhitungan Statistik Kadar Parasetamol dalam Sediaan Tablet
Iremax ... 56 Lampiran 13. Perhitungan Statistik Kadar Parasetamol dalam Sediaan Tablet
Neo Rheumacyl ... 58 Lampiran 14. Perhitungan Statistik Kadar Parasetamol dalam Sediaan Tablet
Oskadon SP ... 60 Lampiran 15. Data Hasil Perolehan Kembali Ibuprofen dalam Sediaan Tablet
Lampiran 16. Data Hasil Perolehan Kembali Parasetamol dalam Sediaan Tablet Iremax Secara Nitrimetri dengan Metode Penambahan Baku
(Standard Addition Method) ... 63
Lampiran 17. Contoh Perhitungan % Recovery dengan Metode Penambahan Baku (Standard Addition Method) ... 64
Lampiran 18. Contoh Perhitungan Persentase (%) Perolehan Kembali Tablet Iremax ... 65
Lampiran 19. Contoh Perhitungan Pembakuan Larutan NaOH 0,1 N ... 67
Lampiran 20. Contoh Perhitungan Pembakuan Larutan NaNO2 0,1 N ... 68
Lampiran 21. Contoh Perhitungan Penimbangan Sampel Tablet ... 69
Lampiran 22. Nilai Distribusi t ... 70
Lampiran 23. Sertifikat Baku Ibuprofen (PT. Mutifa) ... 71
Lampiran 24. Sertifikat Baku Parasetamol (PT. Mutifa)... 72
Lampiran 25. Spektrum Inframerah Ibuprofen pada Literatur Pharmaceutical Substance (UV and IR) and Pharmaceutical and Cosmetic Excipients (IR) ... 73
Penetapan Kadar Campuran Ibuprofen Dan Parasetamol Dalam Sediaan Tablet Secara Volumetri
Abstrak
Kombinasi ibuprofen dan parasetamol merupakan salah satu jenis
kombinasi dalam formula tablet analgetik-antipiretik dan antiinflamasi yang dapat
menghasilkan efek potensiasi dalam meringankan nyeri, mengurangi demam dan
radang. Tujuan penelitian ini adalah untuk mencari metode alternatif pada
penentuan kadar campuran ibuprofen dan parasetamol dalam sediaan tablet secara
volumetri.
Metode alternatif yang digunakan pada penetapan kadar ibuprofen yaitu
secara alkalimetri dengan pentiter larutan natrium hidroksida, dimana parasetamol
tidak akan tertitrasi sedangkan parasetamol ditetapkan secara nitrimetri dengan
pentiter natrium nitrit.
Dari hasil penelitian diperoleh kadar ibuprofen dan parasetamol dalam
sediaan tablet masing-masing untuk Bimacyl® 106,18% ± 0,55% dan 98,49% ± 1,08%, Iremax® 100,93% ± 0,59% dan 96,51% ± 3,12%, Neo Rheumachyl®
105,10% ± 0,89% dan 94,52% ± 1,00%, Oskadon SP® 104,33% ± 1,35% dan
98,74% ± 0,72%. Dari hasil uji validitas metode yang digunakan memberikan hasil akurasi dan presisi yang dapat diterima dengan persen perolehan kembali
untuk ibuprofen 99,07 % (RSD = 1,91%) dan 99,81 % (RSD = 1,13) untuk
parasetamol.
Hasil penelitian menunjukan bahwa kadar ibuprofen dan parasetamol
dalam sediaan tablet dengan berbagai merek dagang memenuhi persyaratan tablet
menurut Farmakope Indonesia Edisi IV tahun 1995 yaitu tidak kurang dari 90,0 %
dan tidak lebih dari 110,0 % dari jumlah yang tertera pada etiket.
Determination Of a Mixture Ibuprofen and Paracetamol In The Tablet Using by Volumetric
Abstract
Combination of ibuprofen and paracetamol is one type of combination in
tablet antipyretic-analgesic and anti-inflamatory, that can result potentiation
effects to relieve pain, reduce fever and inflamation. The purpose of this research is to find alternative methods of determine the amount of a mixture ibuprofen and paracetamol in tablet dosage using volumetric
An alternative method used in determining the amount of ibuprofen in alkalimetry with titrant sodium hydroxide solution, paracetamol which will not influence and paracetamol determined with nitrimetri using sodium nitrite as a titrant.
From the research results obtained amount of ibuprofen and paracetamol in tablet dosage for each Bimacyl® 106,18% ± 0,55% dan 98,49% ± 1,08%,
Iremax® 100,93% ± 0,59% and 96,51% ± 3,12%, Neo Rheumachyl® 105,10% ± 0,89% and 94,52% ± 1,00%, Oskadon SP® 104,33% ± 1,35% and 98,74% ± 0,72%, From the results of tested the validity of the method used gives results of accuracy and precision that is acceptable, the percent recovery for ibuprofen 99.07% (RSD = 1.91%) and 99.81% (RSD=1.13) for paracetamol.
The result showed that amount of ibuprofen and paracetamol in tablet was
fulfilled requirement of Farmakope Indonesia edisi IV 1995, not less than 90.0
percent and not more than 110.0 percent of the labeled amount.
BAB I
PENDAHULUAN
1.1 Latar Belakang
Upaya masyarakat untuk melakukan pengobatan terhadap dirinya sendiri dikenal dengan istilah swamedikasi, swamedikasi umumnya dilakukan untuk mengatasi keluhan-keluhan dan penyakit ringan yang banyak dialami masyarakat seperti demam, nyeri, batuk, influenza dan lain-lain. Swamedikasi menjadi salah satu alternatif yang diambil masyarakat untuk meningkatkan keterjangkauan pengobatan. Obat bebas dan obat bebas terbatas menjadi pilihan masyarakat dalam melaksanakan swamedikasi, salah satu golongan obat bebas terbatas yang sering digunakan dewasa ini adalah obat analgetik-antipiretik dan antiinflamasi (Ditjen Binfar, 2006).
Campuran ibuprofen dan parasetamol merupakan salah satu jenis kombinasi dalam formula sediaan tablet analgetik-antipiretik dan antiinflamasi, kombinasi ini dapat menghasilkan efek potensiasi dalam meringankan nyeri ,demam dan radang (Segedin,K., 2009).
Pada pembuatan sediaan farmasi, pemeriksaan kadar zat aktif merupakan persyaratan yang harus dipenuhi untuk menjamin kualitas sediaan tersebut dan salah satu persyaratan tersebut adalah kadar zat aktif yang dikandung sediaan harus memenuhi persyaratan Farmakope Indonesia atau buku-buku resmi lainya (Depkes RI, 2009).
Cair Kinerja Tinggi (KCKT) (FI.ed IV, USP 30) dan dalam Japanese Pharmacopoeia XV dan British Pharmacopoeia 2007, baku ibuprofen ditentukan
secara alkalimetri sedangkan baku parasetamol dan sediaan tabletnya dalam bentuk tunggal dapat ditentukan secara KCKT (FI ed IV, USP 30) dan menurut Higuchi, T dan Hanssen, B.E, (1968) parasetamol dalam sediaan tablet dapat ditentukan secara nitrimetri setelah dihidrolisa terlebih dahulu.
Ditinjau dari struktur ibuprofen dan parasetamol yang mempunyai gugus kromofor maka senyawa ini dapat menyerap radiasi pada daerah ultraviolet. Menurut Moffat, A.C., dkk., (2005) ibuprofen memiliki serapan maksimum dalam larutan basa pada panjang gelombang 265 nm (A11=18.5a) sedangkan parasetamol dalam larutan asam pada panjang gelombang 245 nm (A11=668a) dan dalam larutan basa pada panjang gelombang 257 nm (A11=715a). Kombinasi kedua komponen ini bila dilakukan penentuan kadarnya secara multikomponen dalam larutan basa dapat memberikan hasil yang kurang baik karena harga A11 ibuprofen terlalu kecil bila dibandingkan dengan parasetamol. Metode KCKT memerlukan alat dan biaya operasional yang relatif mahal serta waktu analisis yang relatif lama.
Mengingat hal tersebut diatas maka diperlukan metode analisis alternatif yang memerlukan alat dan biaya operasional yang lebih murah serta lebih mudah dalam pelaksanaanya namun masih dapat memberikan hasil dengan akurasi dan presisi yang baik. Salah satu metode alternatif yang dapat digunakan adalah secara volumetri dimana ibuprofen ditentukan secara alkalimetri dan parasetamol secara nitrimetri.
1.2 Perumusan Masalah
1. Apakah metode volumetri dapat digunakan untuk menetapkan kadar campuran ibuprofen dan parasetamol dalam sediaan tablet?
2. Apakah metode volumetri yang digunakan dapat memenuhi kriteria validasi metode analisis?
3. Apakah kadar campuran ibuprofen dan parasetamol dalam sediaan tablet yang beredar dipasaran telah sesuai dengan ketentuan Farmakope Indonesia Edisi IV Tahun 1995?
1.3 Hipotesa
1. Metode volumetri dapat digunakan untuk menetapkan kadar campuran ibuprofen dan parasetamol dalam sediaan tablet.
2. Metode volumetri yang digunakan memenuhi kriteria validasi metode analisis
1.4 Tujuan
1. Untuk megetahui metode alkalimetri dan nitrimetri dapat digunakan untuk menetapkan kadar campuran ibuprofen dan parasetamol
2. Untuk mengetahui validitas dari metode volumetri yang digunakan. 3. Untuk mengetahui kadar campuran ibuprofen dan parasetamol dalam
BAB II
TINJAUAN PUSTAKA
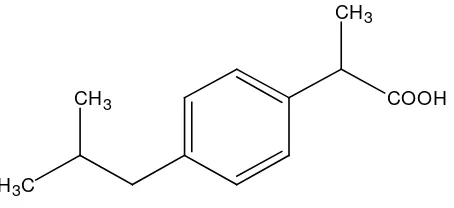
2.1. Ibuprofen
Ibuprofen atau asam 2-(-4-Isobutilfenil) propionat dengan rumus molekul C13H18O2 dan bobot molekul 206.28, rumus bangun dari ibuprofen adalah sebagai berikut :
COOH CH3
CH3
H3C
Gambar 1. Struktur Kimia Ibuprofen
Ibuprofen berupa serbuk hablur putih hingga hampir putih, berbau khas lemah dan tidak berasa dengan titik lebur 75.0 – 77.5◦C. Ibuprofen praktis tidak larut dalam air, sangat mudah larut dalam etanol, dalam metanol, dalam aseton dan dalam chloroform serta sukar larut dalam etil asetat (Ditjen POM, 1995).
Larutan ibuprofen dalam NaOH 0.1N dengan (A11=18.5a), memperlihatkan serapan maksimum pada panjang gelombang 265 dan 273 nm sedangkan pada inframerah memperlihatkan puncak pada 1721, 1232, 779, 1185, 1273 dan 870 cm-1 (Moffat. A. C., dkk., 2005).
1-2 jam setelah pemberian oral, dengan waktu paruh 1.8-2 jam, dosis: 400 mg 3-4 dd (Katzung, B.G., 2002; Siswandono dan Soekardjo, B., 2000).
Ibuprofen menimbulkan efek analgesik dengan menghambat secara langsung dan selektif enzim-enzim pada system saraf pusat yang mengkatalis biosintesis prostaglandin seperti siklooksigenase sehingga mencegah sensitasi reseptor rasa sakit oleh mediator-mediator rasa sakit seperti bradikinin, histamin, serotonin, prostasiklin, prostaglandin, ion hidrogen dan kalium yang dapat merangsang rasa sakit secara mekanis atau kimiawi (Siswandono dan Soekardjo, B., 2000).
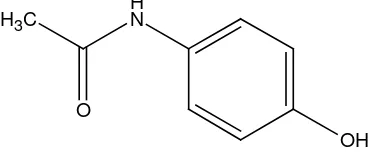
2.2. Parasetamol
Parasetamol atau 4-hidroksiasetanilida dengan rumus molekul C8H9NO2 dan bobot molekul 152.16, rumus bangun dari parasetamol adalah sebagai berikut:
OH
H N H3C
O
Gambar 2. Struktur Kimia Parasetamol
Parasetamol berupa serbuk hablur putih, tidak berbau dan rasa sedikit pahit dengan titik lebur 169-170.5◦C. Parasetamol mudah larut dalam air mendidih, sangat mudah larut dalam chloroform, larut dalam etanol, metanol, dimetil formamida, aseton dan etil asetat, praktis tidak larut dalam benzen. (Ditjen POM, 1995).
gelombang 257 nm (A11=715a) sedangkan pada inframerah memperlihatkan puncak pada 1506, 1657, 1565, 1263, 1227, 1612 cm−1. (Moffat A.C., dkk, 2005).
Parasetamol dengan pKa 9.5 diabsorpsi cepat melalui usus dan konsentrasi tertinggi dalam plasma dicapai dalam waktu ½ jam dan masa paruh dalam plasma antara 1-3 jam, dimetabolisme oleh enzim mikrosom dan dieksresikan melalui ginjal. Turunan dari para-aminofenol ini bekerja sebagai analgetik-antipiretik serta memiliki aktivitas antiinflamasi yang rendah dan dapat diberikan secara oral, intravena serta rektal. Parasetamol merupakan obat pilihan pertama dalam penanganan nyeri dan demam karena relatif aman, tidak mengiritasi lambung dan dapat digunakan untuk anak-anak serta pasien asma. Efek samping yang ditimbulkan adalah methemoglobin dan hepatotoksik (Ditjen Binfar, 2006; Mycek.J.M., 2001).
Sebagai antipiretik parasetamol dapat meningkatkan eliminasi panas pada penderita suhu tinggi dengan cara menimbulkan dilatasi pembuluh darah perifer dan mobilisasi air sehingga terjadi pengenceran darah dan pengeluaran keringat. Pengaruh obat pada suhu badan normal relatif kecil. Penurunan suhu tersebut adalah hasil kerja obat pada system saraf pusat yang melibatkan pusat kontrol suhu di hipotalamus (Siswandono dan Soekardjo, B., 2000).
2.3. Volumetri
analit dan kadar zat dihitung dari volume pereaksi yang bereaksi ekivalen dengan analit (Satiadarma, K., 2004).
Untuk dapat dilakukan analisis volumetri harus dipenuhi syarat-syarat berikut : 1. Harus ada suatu reaksi yang sederhana, yang dapat dinyatakan dengan suatu
persamaan kimia, zat yang akan ditetapkan harus bereaksi lengkap dengan reagensia dalam proporsi yang stokiometri atau ekivalen
2. Reaksi harus praktis dan berjalan sangat cepat, dalam beberapa keadaan penambahan katalis akan menaikan kecepatan reaksi.
3. Harus tersedia indikator yang dapat digunakan untuk menentukan titik akhir titrasi.
Berdasarkan reaksi kimianya, volumetri dapat dikelompokan atas : 1. Reaksi penentralan (asidimetri dan alkalimetri)
Penetapan kadar suatu zat (asam atau basa) berdasarkan prinsip netralisasi, bila sebagai titran digunakan larutan baku asam, maka penetapan tersebut dinamakan asidimetri, sebaliknya bila larutan baku basa sebagai titran, maka penetapan itu disebut alkalimetri.
2. Reaksi pembentukan kompleks
Merupakan reaksi yang menghasilkan suatu kompleks atau ion komplek yang dapat larut tetapi sedikit terdisosiasi, misalnya reaksi ion perak dengan ion sianida untuk membentuk kompleks Ag(CN)2- yang sangat stabil
3. Reaksi oksidasi reduksi (Redoks)
Reaksi-reaksi kimia yang menyangkut oksidasi-reduksi secara luas digunakan dalam analisa volumetri
Proses yang kita gunakan untuk menentukan secara teliti konsentrasi suatu larutan dikenal dengan standarisasi dengan menggunakan standar primer, dengan syarat sebagai berikut:
1. Mudah didapat dalam bentuk murni atau dalam keadaaan kemurnian yang diketahui dengan harga yang wajar. Pada umumnya jumlah pengotoran harus tidak melebihi 0.01 sampai 0.02% dan harus mungkin diuji kemurnianya dengan uji-uji yang diketahui kepekaanya.
2. Zat itu harus tetap, harus mudah dikeringkan dan harus tidak higroskopik, tidak berkurang beratnya sewaktu terkena udara.
3. Mempunyai berat ekivalen yang tinggi sehingga kesalahan penimbangan akan menjadi lebih kecil dan mudah larut serta reaksi cepat dan stokiometri (Basset,J., dkk. 1994)
2.4. Metode Penetapan Kadar Ibuprofen
2.4.1. Alkalimetri
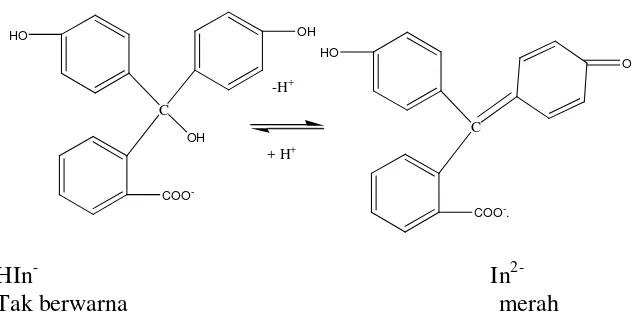
Bila ditinjau dari harga pKa nya, ibuprofen dapat ditetapkan kadarnya secara alkalimetri, Btitish Pharmacopoeia tahun 2007 dan The International Pharmacopoeia third edition tahun 2003, kadar ibuprofen dapat ditetapkan secara
C OH
COO
--H+
+ H+ OH HO
C
COO-.
HO
O
HIn- In
2-Tak berwarna merah
Gambar 3. Perubahan Struktur Fenolftalein
2.4.2. Secara Spektrofototmetri UV-VIS
Jika dilihat dari strukturnya Ibuprofen memiliki gugus kromofor yang dapat menyerap radiasi pada daerah ultraviolet, Menurut Ebeshi, U. B., 2009, kadar ibuprofen dalam sediaan tablet dapat ditetapkan kadarnya secara spektrofotometri ultraviolet karena Ibuprofen memiliki serapan maksimum dalam larutan basa pada panjang gelombang 265 nm (A11=18.5a).
2.4.3. Secara Kromatografi Cair Kinerja Tinggi
Menurut Farmakope Indonesia Edisi IV tahun 1995 dan USP XXX tahun 2007, kadar ibuprofen dalam sediaan tablet dapat ditetapkan secara KCKT dengan menggunakan fase gerak; canpuran larutan asam kloroasetat 1 %b/v dengan asetonitril yang diatur pada PH 3.0.
2.5. Metode Penetapan Kadar Parasetamol
2.5.1. Nitrimetri (Titrasi Diazotasi)
reaksi diazotasi yakni reaksi antara amina aromatik primer dengan asam nitrit dalam suasana asam membentuk garam diazonium (Gandjar, G.H., dan Rohman, A., 2007).
Dalam nitrimetri, berat ekivalen suatu senyawa sama dengan berat molekulnya karena 1 mol senyawa bereaksi dengan 1 mol asam nitrit dan menghasilkan 1 mol garam diazonium. Pada titrasi diazotasi, penentuan titik akhir dapat menggunakan indikator luar, indikator dalam dan secara potensiometri (Kar, A., 2005).
Indikator luar yang digunakan adalah pasta iodida atau kertas kanji-iodida, ketika larutan digoreskan pada pasta, adanya kelebihan asam nitrit akan mengoksidasi iodida menjadi iodium dengan adanya kanji akan menghasilkan warna biru segera. Reaksi yang terjadi dapat dituliskan sebagai berikut (Ditjen POM, 1995).
NaNO2 + HCl → HNO2 + NaCl KI + HCl → KCl + HI
2 HI + 2 HONO → I2 + 2 NO + 2H2O I2 + kanji → kanji iod ( biru)
Titik akhir titrasi tercapai apabila pada penggoresan larutan yang dititrasi pada pasta kanji-iodida akan terbentuk warna biru segera sebab warna biru juga terbentuk beberapa saat setelah dibiarkan diudara, hal ini disebabkan karena oksidasi iodida oleh udara (O2) menurut reaksi (Kar, A., 2005).
Untuk menyakinkan apakah benar-benar suda h terjadi titik akhir titrasi, maka pengujian seperti di atas dilakukan lagi setelah dua menit. Indikator dalam terdiri atas campuran trepeolin OO dan metilen biru. Trepeolin OO merupakan indikator asam-basa yang berwarna merah dalam suasana asam dan berwarna kuning bila dioksidasi oleh adanya kelebihan asam nitrit, sedangkan metilen biru sebagai pengkontras warna sehingga pada titik akhir titrasi akan terjadi perubahan dari ungu menjadi biru sampai hijau tergantung senyawa yang dititrasi. Pemakaian kedua indikator ini ternyata memiliki kekurangan. Pada indikator luar harus diketahui dulu perkiraan jumlah titran yang diperlukan, sebab kalau tidak diketahui dulu perkiraan jumlah titran yang dibutuhkan maka akan sering melakukan pengujian apakah sudah tercapai titik akhir titrasi atau belum. Disamping itu kalau sering melakukan pengujian, dikhawatirkan akan banyak sampel yang hilang pada saat pengujian titik akhir. Sementara itu pada pemakaian indikator dalam walaupun perlakuanya mudah tetapi seringkali untuk senyawa yang berbeda akan memberikan warna yang berbeda (Gandjar, G.H., dan Rohman, A., 2007).
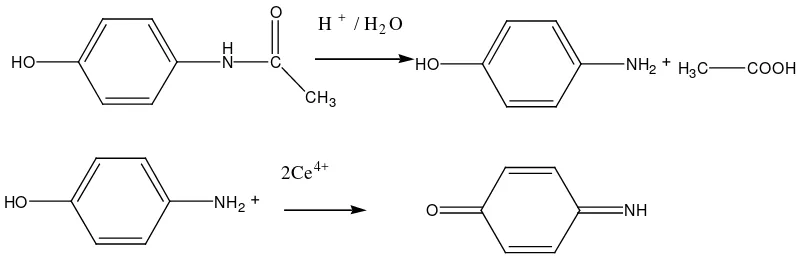
Menurut Higuchi 1968 dan The International Pharmacopoeia tahun 2003, kadar parasetamol dapat ditetapkan secara nitrimetri, dimana parasetamol direfluks dengan H2SO4 10 % b/b, sehingga diperoleh para-aminofenol dan dititrasi secara nitrimetri, menggunakan indikator pasta kanji, dengan Reaksi sebagai berikut :
HO
H N
C
H2O / H +
NH2
HO O
CH3 CH3COOH
Gambar 4 . Hidrolisis Parasetamol
2.5.2. Serimetri
Menurut British Pharmacopoeia tahun 2007 dan Hermann, J 1991 parasetamol dapat ditetapkan kadarnya secara serimetri menggunakan larutan serium(IV)sulfat sebagai pentiter. Dilarutkan 0.300 g didalam campuran 10 ml akuades dan H2SO4 encer, kemudian direfluks selama 1 jam dan diencerkan sampai 100.0 ml dengan akuades. Pipet 20 ml dan tambahkan 40 ml akuades, 15 ml HCl encer dan 0.1 ml ferroin, kemudian dititrasi dengan larutan Serium(IV) sulfat 0.1 N sampai terbentuk warna kuning kehijauan dan dilakukan titrasi blanko.
1 ml serium (IV) sulfat setara dengan 7.56 mg C8H9NO2 Reaksi : HO H N C CH3 O
H + / H2O
HO NH2 H
3C COOH
HO NH2
O NH
2.5.3. Secara Spektrofototmetri UV-VIS
Jika dilihat dari strukturnya parasetamol memiliki gugus kromofor yang dapat menyerap radiasi pada daerah ultraviolet, Menurut Moffat, dkk., (2005) parasetamol memiliki serapan maksimum dalam larutan asam pada panjang gelombang 245 nm (A11=668a) dan dalam larutan basa pada panjang gelombang 257 nm (A11=715a).
Menurut Farmakope Indonesia edisi III tahun 1979, parasetamol dalam sediaan tablet dapat ditetapkan secara spektrofotometri ultraviolet pada larutan basa pada panjang gelombang 257 nm dan menurut Shrestha dan Pradhananga, tahun 2009, parasetamol dapat ditetapkan kadarnya secara spektrofotometri visibel berdasarkan pembentukan warna setelah direaksikan dengan 1-naftol atau resorsinol kemudian dianalisis pada panjang gelombang 505 nm.
2.5.4. Secara Kromatografi Cair Kinerja Tinggi
Menurut Farmakope Indonesia Edisi IV tahun 1995 dan USP XXX tahun 2007, kadar parasetamol dalam sediaan tablet dapat ditetapkan secara KCKT dengan menggunakan fase gerak; campuran air-metanol (3:1).
2.6. Spektrofotometer inframerah
Energi yang dihasilkan oleh radiasi ini akan menyebabkan vibrasi atau getaran pada molekul. Pita absorbsi inframerah sangat khas dan spesifik untuk tipe ikatan kimia atau gugus fungsi, metode ini sangat berguna untuk mengidentifikasi senyawa organik dan organometalik (Dachriyanus, 2004)
Vibrasi molekul dapat digolongkan atas dua golongan : 1. Vibrasi regangan (Streching)
Vibrasi regangan (Stretching Vibration), yaitu vibrasi yang mengakibatkan perubahan panjang ikatan suatu ikatan, vibrasi regangan dibagi menjadi dua macam :
a. Regangan simetri yakni bergerak bersamaan dan searah dalam satu bidang datar
b. Regangan asimetri yakni bergerak bersamaan dan tidak searah tapi masih dalam satu bidang datar
Gambar 5: Contoh Vibrasi Regangan Simetri Dan Asimetri
2. Vibrasi tekuk (Bending Vibrations)
Vibrasi tekuk (Bending Vibrations), yaitu vibrasi yang mengakibatkan perubahan sudut ikatan antara dua ikatan, vibrasi ini dibagi menjadi 4 bagian:
• Vibrasi Guntingan (Scissoring), unit struktur bergerak mengayun simetri dan masih dalam bidang datar.
• Vibrasi Kibasan (Wagging), unit struktur bergerak mengibas keluar dari bidang datar.
[image:30.595.162.423.307.535.2]• Vibrasi Pelintiran (Twisting), unit struktur berputar mengelilingi ikatan yang menghubungkan dengan molekul induk dan berada di dalam bidang datar ( Susilo, A., 2009 ).
Tabel 1: Serapan Khas Beberapa Gugus Fungsi
Gugus Frekuensi, cm-1
OH alkohol 3580-3650
H yang terikat 3210-3550
Asam 2500-2700
NH Amin 3300-3700
CH Alkana 2850-2960
Alken 3010-3095
Aromatik ~3030
C=C Alkena 1620-1680
Aromatik ~1600
C=O Aldehid 1720-1740
Keton 1675-1725
Asam 1700-1725
Ester 1720-1750
NO2 Nitro 1500-1650
2.7. Validasi Metode Analisis
Beberapa parameter analisis yang harus dipertimbangkan dalam validasi metode analisis :
1. Kecermatan (accuracy)
Merupakan ukuran yang menunjukan derajat kedekatan hasil analisis dengan kadar analit yang sebenarnya. Kecermatan dinyatakan sebagai persen perolehan kembali (recovery) analit yang ditambahkan. Kecermatan ditentukan dengan dua cara yaitu metode simulasi (spiked-placebo recovery) dan metode penambahan baku (standard addition method). Dalam metode simulasi sejumlah analit bahan murni ditambahkan ke dalam campuran bahan pembawa sediaan farmasi lalu campuran tersebut dianalisis dan hasilnya dibandingkan dengan kadar analit yang ditambahkan, tetapi bila tidak memungkinkan membuat sampel placebo karena matriksnya tidak diketahui seperti obat-obat paten atau karena analitnya berupa suatu senyawa endogen misalnya metabolit skunder maka dapat dipakai metode adisi. Metode adisi dibuat dengan menambahkan sejumlah analit dengan konsentrasi tertentu pada sampel yang diperiksa, lalu dianalisis dengan metode tersebut (Harmita, 2004).
Rentang kesalahan yang diijinkan pada setiap konsentrasi analit pada matriks dapat dilihat pada tabel dibawah ini :
Tabel 2. Rentang persen recovery yang diperbolehkan
No. Analit pada matriks sampel (%) Rata-rata yang diperoleh (%)
1 ≥10 98-102
2 ≥1 90-110
3 0.1- 1 80-120
2. Keseksamaan (Precision)
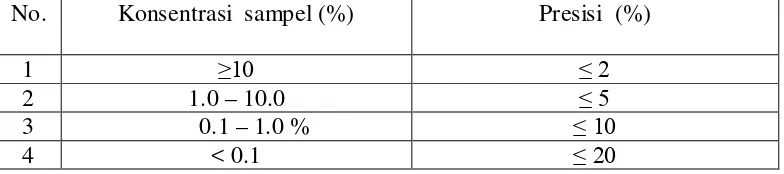
[image:33.595.120.512.334.421.2]Merupakan ukuran yang menunjuakan derajat kesesuaian antara hasil uji individual, diukur melalui penyebaran hasil individual dari rata-rata jika prosedur diterapkan secara berulang pada sampel-sampel yang diambil dari campuran yang homogen. Keseksamaan dilakukan dengan cara melakukan analisis, minimal 9 kali perlakuan yaitu tiga konsentrasi dengan tiga replikasi atau minimal 6 replikasi pada konsentrasi 100 %. Rentang presisi yang diperbolehkan dapat dilihat pada tabel dibawah ini (Anonim 2, 2007)
Tabel 3. Rentang presisi yang diperbolehkan
No. Konsentrasi sampel (%) Presisi (%)
1 ≥10 ≤ 2
2 1.0 – 10.0 ≤ 5
3 0.1 – 1.0 % ≤ 10
4 < 0.1 ≤ 20
3. Selektivitas (spesifisitas)
4. Linearitas
Adalah kemampuan metode analisis yang memberikan respon secara langsung atau dengan bantuan transformasi matematika yang baik, proporsional terhadap konsentrasi analit dalam sampel. Menurut USP XXX, linieritas dilakukan dengan melakukan analisis, minimal 5 konsentrasi dengan kisaran 80-100 % dari konsentrasi perlakuan.
5. Rentang (Range)
Rentang metode adalah pernyataan batas terendah dan tertinggi analit yang sudah ditunjukan dapat ditetapkan dengan kecermatan dan linieritas yang dapat diterima (Gandjar, G.H., dan Rohman, A., 2007).
6. Batas Deteksi dan Batas Kuantisi
Batas deteksi merupakan jumlah terkecil analit dalam sampel yang dapat dideteksi yang masih memberikan respon signifikan dibandingkan dengan blanko, batas deteksi merupakan uji batas. Batas kuantisi merupakan kuantitas terkecil analit dalam sampel yang masih dapat memenuhi kriteria cermat dan seksama ( Harmita, 2004)
7. Ketangguahan metode
BAB III
METODOLOGI PENELITIAN
Metode penelitian yang dilakukan adalah metode eksperimental. Penelitian ini dilaksanakan di Laboratorium Kimia Farmasi Kuantitatif Fakultas Farmasi Universitas Sumatera Utara
3.1. Alat - alat
Alat-alat yang digunakan dalam penelitian ini adalah alat-alat gelas, oven, neraca listrik (Vibra AJ), spektrofotometer FTIR (Shimadzu ).
3.2. Bahan - bahan
Bahan-bahan yang digunakan dalam penelitian ini jika tidak dinyatakan lain adalah yang berkualitas pro analisa (p.a) dari E. Merck, yaitu asam klorida, asam sulfat, asam sulfanilat, etanol (teknis), fenolftalein, kalium biftalat, kalium iodida, kalium bromida, kanji, natrium hidroksida, natrium nitrit, akuades dan akuades bebas CO2 (Laboratorium kimia Farmasi Kuantitatif), baku Ibuprofen (PT. Mutifa) serta baku Parasetamol (PT. Mutifa).
3.3. Pengambilan Sampel
Pengambilan sampel dilakukan secara purposif yaitu tanpa membandingkan
antara satu sampel dengan yang lain karena sampel dianggap homogen. Sampel yang digunakan adalah tablet Bimacyl®(Bima Mitra Farma), Iremax®
3.4. Prosedur Penelitian
3.4.1. Pembuatan Pereaksi
3.4.1.1. Pembuatan Larutan Natrium Hidroksida 0,1 N
Dilarutkan sebanyak 4 g natrium hidroksida dalam akuades bebas CO2, kemudian dicukupkan sampai 1000 ml (Ditjen POM, 1979)
3.4.1.2. Pembuatan Larutan Fenolftalein
Dilarutkan sebanyak 1 g fenolftalein P dalam 100 ml etanol (95 %) (Ditjen POM, 1979)
3.4.1.3. Pembuatan Larutan Natrium Nitrit 0,1 N
Dilarutkan sebanyak 7,5 g natrium nitrit P dalam akuades sampai 1000 ml (Ditjen POM, 1995).
3.4.1.4. Pembuatan Pasta Kanji Iodida
Dipanaskan 100 ml akuades dalam beaker glass, ditambahkan larutan 750 mg kalium iodida dalam 5 ml akuades, pada saat mendidih tambahkan sambil diaduk, suspensi 5 g kanji dalam 30 ml akuades, didihkan selama 2 menit, kemudian didinginkan (Ditjen POM, 1995).
3.4.1.5. Pembuatan Larutan Asam Sulfat 10 % b/b
Dimasukan 500 ml akuades dalam wadah, lalu ditambahkan 102 ml H2SO4 pekat melalui dinding wadah dan dicukupkan sampai 1000 ml, lalu biarkan dingin. (Ditjen POM, 1995)
3.4.1.6. Pembuatan larutan HCl 2 N
3.4.2. Pembakuan Larutan Natrium Hidroksida 0.1 N
Ditimbang seksama 300 mg kalium biftalat yang sebelumnya telah dikeringkan pada suhu kamar, dilarutkan dalam 25 ml akuades bebas CO2 dan ditambahkan 3 tetes indikator fenolftalein, dikocok dan dititrasi dengan larutan natrium hidroksida 0.1 N, hingga terjadi warna merah jambu mantap, dihitung normalitas larutan natrium hidroksida (hasil dapat dilihat pada lampiran 19 halaman 67). 1 ml natrium hidroksida 0,1 N setara dengan 20,42 kalium biftalat
3.4.3. Pembakuan Larutan Natrium Nitrit 0.1 N
Ditimbang seksama 250 mg asam sulfanilat, larutkan dalam 50 ml HCl 2 N, dinginkan sampai suhu lebih kurang 15° C, dititrasi dengan larutan natrium nitrit 0.1 N . Titik akhir titrasi ditetapkan dengan menggunakan pasta kanji iodida yang telah dioleskan pada porselen, titik akhir tercapai apabila terbentuk warna biru segera ketika pertama kali digoreskan dan didiamkan selama 2 menit dan digoreskan lagi, segera memberikan warna biru. Sebelumnya dilakukan titrasi orientasi (hasil dapat dilihat pada lampiran 20 halaman 68).
1 ml natrium nitrit 0,1 N setara dengan 17,329 asam sulfanilat
3.4.4. Identifikasi Baku Ibuprofen dan Parasetamol (PT. Mutifa) dengan
Spektrofotometer Inframerah FTIR
3.4.5. Penentuan Kadar Baku Ibuprofen (PT. Mutifa)
Ditimbang seksama lebih kurang 250 mg (penimbangan serbuk sebanyak 6 kali perlakuan) dimasukan ke dalam gelas Erlenmeyer, lalu ditambahkan 25 ml etanol 95% dan dikocok, kemudian ditambahkan akuades 25 ml dan 3 tetes larutan fenolftalein, dikocok dan dititrasi dengan larutan natrium hidroksida 0,1 N sampai terbentuk warna merah jambu mantap dan lakukan titrasi blanko. Dihitung volume larutan natrium hidroksida yang terpakai dan dihitung kadar Ibuprofen (hasil dapat dilihat pada lampiran 1 halaman 38).
3.4.6. Penentuan Kadar Baku Parasetamol (PT. Mutifa)
3.4.7. Penetapan Kadar Ibuprofen dalam Sediaan Tablet
Ditimbang dan diserbukan 40 tablet, ditimbang seksama serbuk setara dengan 500 mg Ibuprofen (penimbangan serbuk sebanyak 6 kali perlakuan) dimasukan ke dalam labu tentukur 50 ml, lalu ditambahkan etanol 95 %, kocok dan encerkan dengan etanol 95% sampai garis tanda, kemudian disaring, 10 ml pertama dibuang. Dipipet 25 ml filtrat, dimasukan kedalam gelas Erlenmeyer 250 ml, tambahkan 25 ml akuades dan 3 tetes larutan fenolftalein, dikocok homogen dan dititrasi dengan larutan NaOH 0,1 N hingga terbentuk warna merah jambu mantap, dicatat volume terpakai dan dilakukan titrasi blanko dan dihitung kadar Ibuprofen (hasil dapat dilihat pada lampiran 5 halaman 44).
3.4.8. Penetapan Kadar Parasetamol dalam Sediaan Tablet
3.4.9. Uji Validasi dengan Parameter Akurasi dan Presisi
3.4.9.1. Uji Akurasi dengan Persen Perolehan Kembali (% Recovery)
Uji akurasi dilakukan dengan metode penambahan baku (Standar Addition Method) yaitu dengan membuat 3 konsentrasi analit dengan rentang spesifik 80%,
100% dan 120%, dimana masing-masing dilakukan sebanyak 3 kali replikasi. Setiap rentang spesifik mengandung 70 % analit dan 30 % baku, kemudian dianalisis dengan perlakuan yang sama seperti pada penetapan kadar sampel .
Persen perolehan kembali (% recovery) dapat dihitung dengan rumus sebagai berikut :
Keterangan :
A = konsentrasi sampel yang diperoleh setelah penambahan baku B = konsentrasi sampel sebelum penambahan baku
C = konsentrasi baku yang ditambahkan
3.4.9.2. Uji Presisi
Uji presisi (keseksamaan) ditentukan dengan parameter RSD (Relatif Standar Deviasi) dengan rumus :
Keterangan :
3.4.9.3. Analisis Data Secara Statistik
Untuk menghitung standar deviasi (SD) digunakan rumus:
Untuk menghitung apakah data diterima atau ditolak digunakan rumus sebagai berikut :
Dasar penolakan data jika: t hitung ≥ t tabel dan t hitung ≤ t tabel
Untuk mencari kadar sebenarnya dengan taraf kepercayaan 99%, dengan derajat kebebasan dk = n – 1, digunakan rumus :
keterangan ;
µ = interval kepercayaan = kadar rata-rata sampel x = kadar sampel
t = harga t tabel sesuai dengan dk = n - 1 = tingkat kepercayaan
BAB IV
HASIL DAN PEMBAHASAN
4.1. Identifikasi Baku Ibuprofen dan Parasetamol Secara Spektrofotometri
Inframerah FTIR
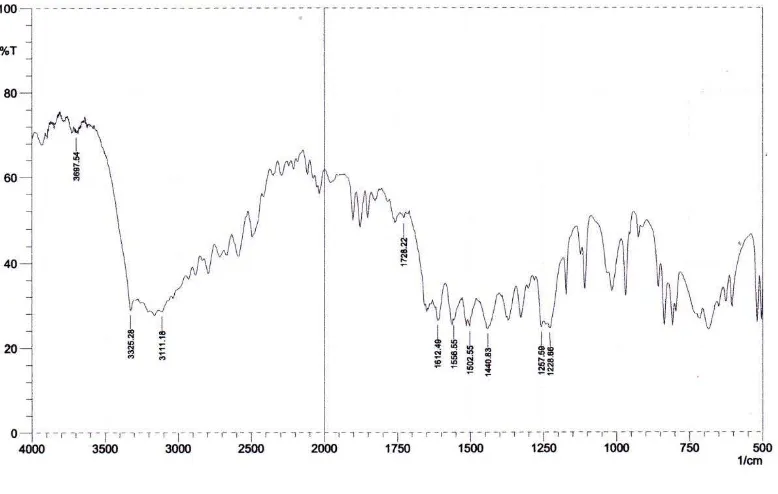
[image:42.595.118.503.327.684.2]Baku Ibuprofen dan Parasetamol yang diperoleh dari PT. Mutifa sebelum digunakan sebagai pembanding terlebih dahulu diidentifikasi menggunakan Spektrofotometer Inframerah FTIR pada rentang bilangan gelombang 4000-500 cm-1, spektrum inframerah ibuprofen dan parasetamol dapat dilihat pada Gambar 1 dan 2.
Gambar 7. Spektrum Inframerah Baku Ibuprofen (PT. Mutifa)
Peak (cm-1)
Gambar 8. Spektrum Inframerah Baku Parasetamol (PT. Mutifa) Peak
(cm-1)
1228,66 1257,59 1440,83 1502,55 1556,55 1612,49 1728,22 3111,18 3325,28 3697,54
Dari hasil spektrum ibuprofen dan parasetamol diperoleh bentuk spektrumnya yang hampir sama dengan spektrum pembanding yang tertera pada literatur (spektrum inframerah literatur dapat dilihat pada lampiran 25 halaman 73) terlihat bilangan gelombang pada daerah sidik jari hampir sama dengan bilangan gelombang yang terlihat dalam literatur Clarke’s 2005 yaitu untuk ibuprofen pada 779 cm-1, 870 cm-1 , 1185 cm-1, 1232 cm-1, 1273 cm-1, 1721 cm-1 dan untuk parasetamol pada 1227 cm-1, 1263 cm-1 , 1506 cm-1, 1565 cm-1, 1612 cm-1 dan 1657 cm-1.
pada spektrum inframerah parasetamol terdapat peak yang tajam pada bilangan gelombang 3325,28 cm-1 menunjukan adanya gugus OH dan pada bilangan gelombang 3697,54 cm-1 menunjukan adanya gugus NH. Dari data spektrum yang diperoleh dapat diambil kesimpulan baku yang diidentifikasi adalah ibuprofen dan parasetamol.
4.2. Penentuan Kadar Baku Ibuprofen (PT. Mutifa) Secara Alkalimetri
[image:44.595.112.518.331.469.2]Hasil penetapan kadar baku ibuprofen secara alkalimetri menggunakan pentiter natrium hidroksida 0,1056 N dapat dilihat pada tabel dibawah ini :
Tabel 4. Hasil penetapan kadar baku Ibuprofen secara alkalimetri
Berat baku ibuprofen (mg)
Volume Larutan NaOH 0,1056 N
Kadar baku ibuprofen (%)
Kadar ibuprofen rata-rata (%)
250,7 11,75 98,83
98,66
251,4 11,75 98,35
250,2 11,75 98,83
250,9 11,75 98,55
250,4 11,75 98,75
250,1 11,75 98,87
4.3. Penentuan Kadar Baku Parasetamol (PT. Mutifa) Secara Nitrimetri
[image:45.595.114.513.249.382.2]Hasil penetapan kadar bahan baku parasetamol secara nitrimetri menggunakan pentiter natrium nitrit 0,1 N, yang dapat dilihat pada tabel dibawah ini :
Tabel 5. Hasil penetapan kadar bahan baku parasetamol secara nitrimetri.
No Berat baku parasetamol (mg) Volume Larutan NaNO2 (ml) Kadar baku parasetamol (%) Kadar parasetamol rata-rata (%)
1 259,1 17,15 100,78
100,64
2 259,0 17,10 100,53
3 249,1 16,50 100,85
4 253,5 16,75 100,61
5 250,9 16,55 100,43
Dari hasil penelitian ini diperoleh kadar rata-rata bahan baku Parasetamol yang dihitung secara statistik adalah 100,64 % dengan kadar sebenarnya
. Hasil yang diperoleh lebih besar dibandingkan dengan kadar yang tertera dalam sertifikat analisis (perhitungan kadar dapat dilihat pada lampiran 2 halaman 41).
4.4. Penentuan Kadar Ibuprofen Dan Parasetamol Dalam Sediaan Tablet
[image:45.595.114.525.623.753.2]Hasil penentuan kadar ibuprofen dan parasetamol dalam sediaan tablet dapat dilihat pada tabel dibawah ini:
Tabel 6. Kadar rata-rata ibuprofen dan parasetamol pada sediaan tablet
No Nama Dagang
Ibuprofen Parasetamol
Dari data diatas menunjukan bahwa kadar Ibuprofen (pKa = 4,4) dapat ditentukan secara alkalimetri dengan pelarut etanol 95 %, pentiter NaOH 0,1 N mengguanakan indikator fenolftalein, dimana parasetamol tidak akan tertitrasi karena bersifat asam sangat lemah (pKa = 9,5). Nitrimetri dapat digunakan untuk penetapan kadar parasetamol dalam campuranya karena ibuprofen tidak memiliki gugus amin primer aromatis (Gandjar, G.H., dan Rohman, A., 2007).
Dari studi literatur tidak ditemukan persyaratan kadar campuran ibuprofen dan parasetamol dalam sediaan tablet, sehingga peneliti mengambil rujukan pada monografi masing-masing tablet yang tertera pada Farmakope Indonesia Edisi IV tahun 1995.
Dari data diatas menunjukan bahwa kadar ibuprofen dan parasetamol dalam sediaan tablet dengan beberapa nama dagang memenuhi persyaratan kadar yang tertera dalam Farmakope Indonesia Edisi IV tahun 1995 yaitu tidak kurang dari 99,0 % dan tidak lebih dari 110,0 % dari jumlah yang tertera pada etiket.
4.5. Uji Validasi Metode Analisis
Validasi metode menurut United States Pharmacopoeia (USP) dilakukan untuk menjamin bahwa metode analisis yang digunakan akurat, spesifik, reproduksibel dan tahan pada kisaran analit yang akan dianalisis. Pada penelitian ini juga dilakukan validasi metode analisis dengan cara penambahan baku (Standar addition method). Adapun uji validasi yang digunakan yaitu uji akurasi
analit dan 30 % baku (contoh perhitungan dapat dilihat pada lampiran 18 halaman 65).
Tabel 7. Hasil penetapan perolehan kembali ibuprofen dalam tablet Iremax®
secara alkalimetri dengan metode penambahan baku (Standar addition method)
Rentang Spesifik (%) Konsentrasi (mg) Persen Perolehan Kembali (%) 80
159,0325 96,82
159,0325 96,95
159,0325 96,72
100
199,3353 98,80
200,4246 99,22
200,4246 99,66
120
241,8166 101,28
241,8166 101,05
241,8166 101,14
% recovery 99,07
SD (Standar Deviasi) 1,89
RSD (Relativ Standar Deviasi) 1,91
Tabel 8. Hasil penetapan perolehan kembali parasetamol dalam tablet Iremax®
secara nitrimetri dengan metode penambahan baku (Standar addition method)
Rentang Spesifik (%) Konsentrasi (mg) Persen Perolehan Kembali (%) 80
309,0846 98,20
310,6071 100,02
310,6071 100,50
100
389,7815 100,21
389,7815 98,76
389,7815 98,33
120
466,6720 101,51
466,6720 100,48
465,9107 100,28
% recovery 99,81
SD (Standar Deviasi) 1,12
[image:47.595.113.520.480.707.2]BAB V
KESIMPULAN DAN SARAN
5.1. Kesimpulan
Metode alkalimetri dan nitrimetri dapat digunakan untuk penetapan kadar campuran ibuprofen dan parasetamol dalam sediaan tablet. Dari hasil uji validitas metode yang digunakan memberikan hasil akurasi dan presisi yang dapat diterima.
Dari hasil penelitian diperoleh kadar ibuprofen dan parasetamol dalam sediaan tablet memenuhi persyaratan tablet menurut Farmakope Indonesia Edisi IV tahun 1995 yaitu tidak kurang dari 90,0 % dan tidak lebih dari 110,0 % dari jumlah yang tertera pada etiket.
5.2. Saran
DAFTAR PUSTAKA
Anonim (2006 ). Japanense Pharmacopoeia, Fifteen Edition. Electronic Version. hal. 267, 268, 744.
Anonim 1 (2007). British Pharmacopoeia 2007. Volume I. Electronic Version. London: hal. 843
Anonim 2 (2007). The United States Pharmacopoeia 30- The National Formulary 25. United States Pharmacopoeial Convention, Inc. Electronic version. hal.1266, 2327.
Anonim (2008). Invitro Dissolution And Assay Of Ibuprofen Tablet. Diambil dari: URL: HYPERLINK.
Anonim (2010). Spektroskopi Inframerah. Diambil dari: URL: HYPERLINK
Basset, J. dkk., (1995). Buku Ajar Vogel: Kimia Analisi Kuantitatif Anorganik. Edisi 4. Penterjemah: Hadyana, A dan Setiono. Jakarta: EGC.hal.259-270 Depkes RI. (2009). Undang-undang RI No. 36 Tentang kesehatan. Departemen
kesehatan RI. Jakarta: hal. 117
Ditjen POM. (1979). Farmakope Indonesia. Edisi III. Jakarta. Departemen Kesehatan Republik Indonesia. hal.748, 749.
Ditjen POM. (1995). Farmakope Indonesia. Edisi IV. Jakarta. Departemen Kesehatan Republik Indonesia. hal.449-450, 650-651.
Ditjen Binfar. (2006). Pedoman Penggunaan Obat Bebas dan Bebas Terbatas. Jakarta. Departemen Kesehatan Republik Indonesia. hal.10.
Ebeshi, U.B., (2009). Comparative Utilization Of Visual, Potentiometric Titrations And UV Spectrophotometric Methods In The Determination Of Ibuprofen. African Journal Of Pharmacy And Pharmacology. Vol.3(9). Nigeria: hal.426-431
Harmita. (2004). Petunjuk Pelaksanaan Validasi Metode dan Cara Perhitunganya. Review Artikel. Majalah Ilmu Kefarmasian: Volume I(3): hal.117-135.
Herman, J. (1991). Pharmaceutical Chemistry. England: hartnolls Badmin conwall. hal 399.
Higuchi ,T., dan Hanssen, B.E., (1968). Pharmaceutical Analysis. A Wiley-Interscience Publication: Singapore: hal.550 – 551.
Kar, A., (2005). Pharmaceutical Drug Analysis. Revised Second Edition. New age International Publichers. London: hal.103
Katzung, G.B., (2002) Farmakologi Dasar Dan Klinik. Penterjemah: Bagian Farmakologi Fakultas Kedokteran Universitas Airlangga. Jakarta: Penerbit Salemba Medika. hal. 457-458.
Moffat, A.C., dkk. (2005). Clarke‘S Analysis Of Drug And Poisons. Thirth edition London: Pharmaceutical Press. Electronic version.
Mycek, M.J., (2001). Farmakologi Ulasan Bergambar. Edisi 2. Penterjemah: Azwar agoes: Jakarta: Widyamedika. Hal. 404-410
Segedin, K., (2009). Pain-Relief Drug Combines Paracetamol And Ibuprofen. Diambil dari: URL: HYPERLINK.
Shrostha dan Pradhananga. (2009). Spectrofotometric Method For The Determination Of Paracetamol. J Nepal Chem..Soc Vol 24: Japan.Hal. 39-44
Siswandono dan Soekardjo, B., (2000). Kimia Medisinal. Edisi 2. Surabaya: Airlangga University Press. hal. 291.303
Susilo, A., (2009). Spektrofotometri Inframerah. Diambil dari: URL: HYPERLINK
Underwood, L. A., (1981). Analisa Kimia Kuantitatif. Edisi ke 4. Penterjemah: R. Soendoro. Penerbit Erlangga: Jakarta: hal: 38
Lampiran 1. Hasil Penetapan Kadar Baku Ibuprofen (PT.Mutifa) Secara Alkalimetri.
Berat bahan baku (mg)
Volume Larutan NaOH 0,1056 N
Kadar Bahan baku (%)
Kadar rata-rata
(%)
250,7 11,75 98,83
98,66
251,4 11,75 98,35
250,2 11,75 98,83
250,9 11,75 98,55
250,4 11,75 98,75
250,1 11,75 98,87
Volume Blanko = 0,4 ml
N NaOH = 0,1056
Lampiran 2. Perhitungan Statistik Kadar Baku Ibuprofen (PT. Mutifa) Secara Alkalimetri.
No Kadar (xi) (%)
1 98,63 -0,03 0,0009
2 98,35 -0,31 0,0961
3 98,83 0,17 0,0289
4 98,55 -0,11 0,0121
5 98,75 0,09 0,0081
6 98,87 0,21 0,0441
Σ = 0,1902
Jika taraf kepercayaan 99 % dengan nilai = 0,01; n = 6, dk = 5, dari tabel distribusi t diperoleh nilai t tabel = 4,032141
Data ditolak jika t hitung ≥ t tabel atau t hitung ≤ - t tabel
t hitung 1 = 0,3769
t hitung 2 = 3,8945
t hitung 3 = -2,1357
t hitung 4 = 1,3819
t hitung 5 = -1,1307
Lampiran 2. Sambungan …
karena - t tabel ≤ t hitung ≤ t tabel maka data diterima maka kadar sebenarnya terletak antara :
Lampiran 3. Hasil Penetapan Kadar Baku Parasetamol (PT. Mutifa) Secara Nitrimetri.
No
Berat bahan baku (mg)
Volume Larutan NaNO2 (ml)
Kadar (%)
Kadar rata-rata (%)
1 259,1 17,15 100,78
100,43
2 259,0 17,10 100,53
3 249,1 16,50 100,85
4 253,5 16,75 100,61
5 250,9 16,55 100,43
6 255,9 16,70 99,36
N NaNO2 = 0,1007
Lampiran 4. Perhitungan Statistik Kadar Bahan Baku Parasetamol (PT. Mutifa) Secara Nitrimetri
No Kadar (xi) (%)
1 100,78 0,35 0,1225
2 100,53 0,10 0,0100
3 100,85 0,42 0,1764
4 100,61 0,18 0,0324
5 100,43 0,00 0,0000
6 99,36 -1,07 1,1449
Σ = 1,4862
Jika taraf kepercayaan 99 % dengan nilai = 0,01; n = 6, dk = 5, dari tabel distribusi t diperoleh nilai t tabel = 4,032141
Data ditolak jika t hitung ≥ t tabel atau t hitung ≤ - t tabel
t hitung 1 = - 1,5723
t hitung 2 = - 0,4492
t hitung 3 = - 1,8870
t hitung 4 = - 0,8086
t hitung 5 = 0,0000
t hitung 6 = 4,8068
No Kadar (xi)
1 100,78 0,14 0,0196
2 100,53 -0,11 0,0121
3 100,85 0,21 0,0441
4 100,61 -0,03 0,0009
5 100,43 -0,21 0,0441
Σ = 0,1208
Jika taraf kepercayaan 99 % dengan nilai = 0,01; n = 5, dk = 4, dari tabel distribusi t diperoleh nilai t tabel = 4,60409
Data ditolak jika t hitung≥ t tabel atau t hitung≤ - t tabel
t hitung 1 = - 1,8018
t hitung 2 = 1,4157
t hitung 3 = - 2,7027
t hitung 4 = 0,3861
t hitung 5 = 2,7027 (semua data diterima) karena - t tabel ≤ t hitung ≤ t tabel maka data diterima
maka kadar sebenarnya terletak antara :
Lampiran 5. Data Kadar Ibuprofen dalam Sediaan Tablet dengan Berbagai Nama Dagang
No Nama
Dagang
Penimbangan Setara Volume
Setara ( mg) Volume titrasi (ml) Kadar (%) (mg) (mg) pemipetan
(ml)
1 Bimacyl®
1726,5 499,62 25,00 249,81 13,50 106,24 1728,2 500,11 25,00 250,06 13,55 106,54 1726,9 499,74 25,00 249,87 13,50 106,21 1728,3 500,14 25,00 250,07 13,55 106,53 1726,5 499,62 25,00 249,81 13,45 105,83 1727,8 500,00 25,00 250,00 13,45 105,75
2 Iremax®
1862,2 497,11 25,00 248,55 12,80 101,07 1876,2 500,84 25,00 250,42 13,10 102,74 1872,0 499,72 25,00 249,86 12,85 100,94 1872,5 499,86 25,00 249,93 12,85 100,92 1873,5 500,12 25,00 250,06 12,90 101,27 1865,8 498,07 25,00 249,03 12,75 100,47
3 Neo
Rheumacyl®
1891,5 498,80 25,00 249,40 13,30 104,79 1892,3 499,01 25,00 249,50 13,45 105,96 1893,2 499,25 25,00 249,62 13,40 105,50 1888,4 497,98 25,00 248,99 13,25 104,55 1893,1 499,22 25,00 249,61 13,30 104,70 1893,1 499,22 25,00 249,61 13,35 105,10
4 Oskadon SP®
Lampiran 6. Perhitungan Statistik Kadar Ibuprofen dalam Sediaan Tablet Bimacyl®
No Kadar (xi) (%)
1 106,24 0,06 0,0036
2 106,54 0,36 0,1296
3 106,21 0,03 0,0009
4 106,53 0,35 0,1225
5 105,83 -0,35 0,1225
6 105,75 -0,43 0,1849
Σ = 0,5640
Jika taraf kepercayaan 99 % dengan nilai α= 0,01; n = 6, dk = 5, dari tabel distribusi t diperoleh nilai t tabel = 4,032141
Data ditolak jika t hitung≥ t tabel atau t hitung≤ - t tabel
t hitung 1 = - 0,4376
t hitung 2 = - 2,6258
t hitung 3 = - 0,2188
t hitung 4 = - 2,5529
t hitung 5 = 2,5529
Lampiran 6. Sambungan …
karena - t tabel ≤ t hitung ≤ t tabel maka data diterima maka kadar sebenarnya terletak antara :
Lampiran 7. Perhitungan Statistik Kadar Ibuprofen dalam Sediaan Tablet Iremax ®
No Kadar (xi) (%)
1 101,07 -0,17 0,0289
2 102,74 1,50 2,2500
3 100,94 -0,30 0,0900
4 100,92 -0,32 0,1024
5 101,27 0,03 0,0009
6 100,47 -0,77 0,5929
Σ = 3,0651
Jika taraf kepercayaan 99 % dengan nilai α = 0,01; n = 6, dk = 5, dari tabel distribusi t diperoleh nilai t tabel = 4,032141
Data ditolak jika t hitung ≥ t tabel atau t hitung ≤ - t tabel
t hitung 1 = 0,5318
t hitung 2 = - 4,6919
t hitung 3 = 0,9384
t hitung 4 = 1,0009
t hitung 5 = - 0,0938
t hitung 6 = 2,4085
No Kadar (xi)
1 101,07 0,14 0,0196
2 100,94 0,01 0,0001
3 100,92 -0,01 0,0001
4 101,27 0,34 0,0961
5 100,47 -0,46 0,2116
Σ = 0,3275
Jika taraf kepercayaan 99 % dengan nilai = 0,01; n = 5, dk = 4, dari tabel distribusi t diperoleh nilai t tabel = 4,60409
Data ditolak jika t hitung ≥ t tabel atau t hitung ≤ - t tabel
t hitung 1 = -1,0938
t hitung 2 = -0,07818
t hitung 3 = 0,07818
t hitung 4 = 2,6563
t hitung 5 = 3,5938
karena -t tabel≤ t hitung≤ t tabel maka data diterima maka kadar sebenarnya terletak antara :
Lampiran 8. Perhitungan Statistik Kadar Ibuprofen dalam Sediaan Tablet Neo Rheumacyl®
No Kadar (xi) (%)
1 104,79 -0,31 0,0961
2 105,96 0,86 0,7396
3 105,50 0,40 0,1600
4 104,55 -0,55 0,3025
5 104,70 -0,40 0,1600
6 105,10 0,00 0,0000
Σ = 1,4582
Jika taraf kepercayaan 99 % dengan nilai α = 0,01; n = 6, dk = 5, dari tabel distribusi t diperoleh nilai t tabel = 4,032141
Data ditolak jika t hitung ≥ t tabel atau t hitung ≤ - t tabel
t hitung 1 = 1,4059
t hitung 2 = -3,9002
t hitung 3 = -1,8141
t hitung 4 = 2,4943
t hitung 5 = 18141
Lampiran 8. Sambungan …
karena - t tabel ≤ t hitung ≤ t tabel maka data diterima maka kadar sebenarnya terletak antara :
Lampiran 9. Perhitungan Statistik Kadar Ibuprofen dalam Sediaan Tablet Oskadon SP®
No Kadar (xi) (%)
1 103,19 -1,14 1,2996
2 104,35 0,02 0,0004
3 104,56 0,23 0,0529
4 103,59 -0,74 0,5476
5 104,91 0,58 0,3364
6 105,38 1,05 1,1025
104,33 Σ = 3,3394
Jika taraf kepercayaan 99 % dengan nilai α = 0,01; n = 6, dk = 5, dari tabel distribusi t diperoleh nilai t tabel = 4,03214
Data ditolak jika t hitung≥ t tabel atau t hitung≤ - t tabel
t hitung 1 = 3,4162
t hitung 2 = -0,0599
t hitung 3 = -0,6892
t hitung 4 = 2,2176
t hitung 5 = -1,8141
Lampiran 9. Sambungan …
karena - t tabel ≤ t hitung ≤ t tabel maka data diterima maka kadar sebenarnya terletak antara :
Lampiran 10. Data Kadar Parasetamol dalam Sediaan Tablet dengan Berbagai Nama Dagang
No Nama Dagang Penimbangan Setara Volume Kadar (mg) (mg) Titrasi (ml) (%)
1 Bimacyl®
492,6 249,46 16,50 98,91
495,8 251,08 16,55 98,57
494,7 250,53 16,45 98,19
497,5 251,95 16,50 97,93
492,5 249,41 16,60 99,53
498,2 252,30 16,50 97,79
2 Iremax®
462,7 247,03 16,50 99,27
466,8 249,22 16,25 96,91
464,4 247,94 16,35 98,01
470,6 251,25 16,15 95,54
464,7 248,10 15,85 94,95
466,1 248,85 15,80 94,37
3 Neo
Rheumacyl®
542,5 250,36 16,00 94,99
544,1 251,09 16,05 95,00
544,6 251,32 16,10 95,21
541,2 249,76 15,80 94,03
541,2 249,76 15,80 94,03
542,1 250,17 15,80 93,87
4 Oskadon SP®
497,0 251,62 16,75 98,94
493,7 249,95 16,70 99,30
494,3 250,26 16,65 98,89
495,2 250,71 16,65 98,71
494,8 250,51 16,60 98,49
Lampiran 11. Perhitungan Statistik Kadar Parasetamol dalam Sediaan Tablet Bimacyl®
No Kadar (xi) (%)
1 98,91 0,42 0,1764
2 98,57 0,08 0,0064
3 98,19 -0,30 0,0900
4 97,93 -0,56 0,3136
5 99,53 1,04 1,0816
6 97,79 -0,70 0,4900
98,49 Σ = 2,1580
Jika taraf kepercayaan 99 % dengan nilai = 0,01; n = 6, dk = 5, dari tabel distribusi t diperoleh nilai t tabel = 4,032141
Data ditolak jika t hitung ≥ t tabel atau t hitung ≤ - t tabel
t hitung 1 = - 0,6393
t hitung 2 = - 0,1218
t hitung 3 = 0,4566
t hitung 4 = 0,8524
t hitung 5 = - 1,5830
Lampiran 11. Sambungan …
karena - t tabel ≤ t hitung ≤ t tabel maka data diterima maka kadar sebenarnya terletak antara :
Lampiran 12. Perhitungan Statistik Kadar Parasetamol dalam Sediaan Tablet Iremax®
No Kadar (xi) (%)
1 99,27 2,76 7,6176
2 96,91 0,40 0,1600
3 98,01 1,50 2,2500
4 95,54 -0,97 0,9409
5 94,95 -1,56 2,4336
6 94,37 -2,14 4,5796
96,51 Σ = 17,9817
Jika taraf kepercayaan 99 % dengan nilai α = 0,01; n = 6, dk = 5, dari tabel distribusi t diperoleh nilai t tabel = 4,03214
Data ditolak jika t hitung ≥ t tabel atau t hitung ≤ - t tabel
t hitung 1 = - 3,5650
t hitung 2 = - 0,5167
t hitung 3 = - 1,9375
t hitung 4 = 1,2530
t hitung 5 = 2,0150
Lampiran 12. Sambungan …
karena - t tabel ≤ t hitung ≤ t tabel maka data diterima maka kadar sebenarnya terletak antara :
Lampiran 13. Perhitungan Statistik Kadar Parasetamol dalam Sediaan Tablet Neo Rheumacyl®
No Kadar (xi) (%)
1 94,99 0,47 0,2209
2 95,00 0,48 0,2304
3 95,21 0,69 0,4761
4 94,03 -0,49 0,2401
5 94,03 -0,49 0,2401
6 93,87 -0,65 0,4225
94,52 Σ = 1,8301
Jika taraf kepercayaan 99 % dengan nilai = 0,01; n = 6, dk = 5, dari tabel distribusi t diperoleh nilai t tabel = 4,032141
Data ditolak jika t hitung ≥ t tabel atau t hitung ≤ - t tabel
t hitung 1 = - 1,9028
t hitung 2 = - 1,9433
t hitung 3 = - 2,7935
t hitung 4 = 1,9838
t hitung 5 = 1,9838
Lampiran 13. Sambungan …
karena - t tabel ≤ t hitung ≤ t tabel maka data diterima maka kadar sebenarnya terletak antara :
Lampiran 14. Perhitungan Statistik Kadar Parasetamol dalam Sediaan Tablet Oskadon SP®
No Kadar (xi) (%)
1 98,94 0,11 0,0121
2 99,30 0,47 0,2209
3 98,89 0,06 0,0036
4 98,71 -0,12 0,0144
5 98,49 -0,34 0,1156
6 98,67 -0,16 0,0256
98,83 Σ = 0,1902
Jika taraf kepercayaan 99 % dengan nilai = 0,01; n = 6, dk = 5, dari tabel distribusi t diperoleh nilai t tabel = 4,03214
Data ditolak jika t hitung ≥ t tabel atau t hitung ≤ - t tabel
t hitung 1 = - 0,9615
t hitung 2 = - 4,1084
t hitung 3 = - 0,5245
t hitung 4 = 1,0490
t hitung 5 = 2,9720
t hitung 6 = 1,39865
No Kadar (xi)
1 98,94 0,20 0,0400
2 98,89 0,15 0,0225
3 98,71 -0,03 0,0009
4 98,49 -0,25 0,0625
5 98,67 -0,07 0,0049
98,74 0,4908
Jika taraf kepercayaan 99 % dengan nilai = 0,01; n = 5, dk = 4, dari tabel distribusi t diperoleh nilai t tabel = 4,60409
Data ditolak jika t hitung ≥ t tabel atau t hitung ≤ - t tabel
t hitung 1 = - 1,2763
t hitung 2 = - 1,9572
t hitung 3 = 0,1915
t hitung 4 = 1,5954
t hitung 5 = 0,4467( semua data diterima) karena - t tabel ≤ t hitung ≤ t tabel maka data diterima
maka kadar sebenarnya terletak antara :
Lampiran 15. Data hasil persen perolehan kembali Ibuprofen dalam sediaan tablet Iremax secara Alkalimetri dengan Metode Penambahan Baku (Standar addition method)
No Rentang Spesifik (%) Penimbangan analit (mg) Penimbangan baku (mg) Setara (mg) Volume Pemipetan (ml) Volume titrasi
( ml )
Konsentrasi Baku yang ditambahkan (C) mg Persen perolehan Setelah Penambahan baku (A) mg Sebelum Penambahan baku (B) mg 1 80
839,5 94,90 224,1009 25,00 7,70 159,0325 113,0925 47,45 96,82
2 839,4 94,80 224,0742 25,00 7,70 159,0325 113,0791 47,40 96,95
3 839,5 95,00 224,1009 25,00 7,70 159,0325 113,0925 47,50 96,72
4
100
1048,8 117,50 279,9727 25,00 9,55 199,3353 141,2882 58,75 98,80
5 1048,8 119,20 279,9727 25,00 9,60 200,4246 141,2882 59,60 99,22
6 1048,7 118,70 279,9460 25,00 9,60 200,4246 141,2747 59,35 99,66
7
120
1258,6 142,70 335,9779 25,00 11,50 241,8166 169,5512 71,35 101,28 8 1258,7 143,00 336,0046 25,00 11,50 241,8166 169,5647 71,50 101,05 9 1258,6 142,90 335,9779 25,00 11,50 241,8166 169,5512 71,45 101,14
Kadar rata-rata ( % recovery) 99,07
Standar Deviasi (SD) 1,89
Lampiran 16. Data Hasil Persen Perolehan Kembali parasetamol Dalam Sediaan Tablet Iremax Secara Nitrimetri dengan Metode Penambahan Baku (Standar Addition Method)
No Rentang Spesifik (%) Penimbangan analit (mg) Setara (mg) Volume titrasi (ml) Konsentrasi Analit yang ditambahkan (C) mg Persen perolehan (%) Setelah penambahan analit ( A ) mg
Sebelum penambahan
analit ( B) mg 1
80
414,6 221,3561 20,30 309,0846 213,6308 97,2 98,20
2 414,9 221,5163 20,40 310,6071 213,7854 96,8 100,02
3 413,8 220,9290 20,40 310,6071 213,2186 96,9 100,50
4
100
522,5 278,9642 25,60 389,7815 269,2284 120,3 100,21
5 525,3 280,4592 25,60 389,7815 270,6711 120,6 98,76
6 520,4 277,8430 25,60 389,7815 268,1463 123,7 98,33
7
120
621,6 331,8740 30,65 466,6720 320,2916 144,2 101,51
8 624,5 333,4223 30,65 466,6720 321,7859 144,2 100,48
9 622,8 332,5147 30,60 465,9107 320,9099 144,6 100,28
Kadar rata-rata ( % recovery ) 99,81
Standar Deviasi (SD) 1,12