PENETAPAN KADAR CAMPURAN PARASETAMOL DAN IBUPROFEN DALAM TABLET MERK “X”
DENGAN METODE KROMATOGRAFI CAIR KINERJA TINGGI FASE TERBALIK
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Ilmu Farmasi
oleh:
Maria Angelina Ratna Kumalasari Adipranoto NIM : 068114065
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
PENETAPAN KADAR CAMPURAN PARASETAMOL DAN IBUPROFEN DALAM TABLET MERK “X”
DENGAN METODE KROMATOGRAFI CAIR KINERJA TINGGI FASE TERBALIK
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Ilmu Farmasi
oleh:
PENETAPAN KADAR CAMPURAN PARASETAMOL DAN IBUPROFEN DALAM TABLET MERK “X”
DENGAN METODE KROMATOGRAFI CAIR KINERJA TINGGI FASE TERBALIK
Yang diajukan oleh :
Maria Angelina Ratna Kumalasari Adipranoto NIM : 068114065
telah disetujui oleh :
Halaman persembahan
Terjadilah pada ku menurut
perkataanMu
Omnia tampus habent
Our greatest glory is not never falling,,,,
But in rising everytime we fall
Kupersembahkan karyaku ini untuk: Alm. Simbah Uti ku tersayang, Bapak Ignatius Antyo A., Ibu Suzana Suparyatun Th.M.Indra, V.David Sony Sahabatku Almamaterku
LEMBAR PERNYATAAN PERSETUJUAN
PUBLIKASI KARYA ILMIAH UNTUK KEPENTINGAN AKADEMIS
Yang bertanda tangan di bawah ini, saya mahasiswa Universitas Sanata Dharma : Nama : Maria Angelina Ratna Kumalasari Adipranoto Nomor Mahasiswa : 068114065
Demi pengembangan ilmu pengetahuan, saya memberikan kepada Perpustakaan Universitas Sanata Dharma karya ilmiah saya yang berjudul :
“PENETAPAN KADAR CAMPURAN PARASETAMOL DAN IBUPROFEN DALAM TABLET MERK “X”
DENGAN METODE KROMATOGRAFI CAIR KINERJA TINGGI FASE TERBALIK”
beserta perangkat yang diperlukan (bila ada), dengan demikian saya memberikan kepada Perpustakaan Universitas Sanata Dharma hak untuk menyimpan, mengalihkan dalam bentuk media lain, mengelolanya dalam bentuk pangkalan data, mendistribusikan secara terbatas, dan mempublikasikannya di Internet atau media lain untuk kepentingan akademis tanpa perlu meminta ijin dari saya maupun memberikan royalti kepada saya selama tetap mencantumkan nama saya sebagai penulis.
Demikian pernyataan ini saya buat dengan sebenarnya. Dibuat di Yogyakarta
Pada tanggal : 15 Maret 2010 Yang menyatakan
(Maria Angelina Ratna Kumalasari Adipranoto)
PRAKATA
Puji dan syukur kepada Tuhan Yang Maha Esa, yang telah melimpahkan berkat rahmat-Nya penulis dapat menyelesaikan skripsi berjudul ”Optimasi Pemisahan Campuran Parasetamol Dan Ibuprofen Dengan Metode Kromatografi Cair Kinerja Tinggi” sebagai salah satu syarat memperoleh gelar Sarjana Farmasi (S.Farm) di Fakultas Farmasi.
Penulis mengucapkan terima kasih kepada semua pihak yang mendorong, memotivasi dan memberi saran hingga selesainya skripsi ini, terutama kepada:
1. Ibu Rita Suhadi, M.Si., Apt. Selaku Dekan Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
2. Jeffry Julianus, M.Si. selaku dosen pembimbing yang telah membimbing penulis, memberikan masukan, dan dukungan selama penyusunan skripsi ini.
3. Christine Patramurti, M.Si., Apt. selaku penguji yang ikut mengarahkan penulis, memberikan masukan, dan memberikan dukungan selama penyusunan skripsi serta besedia menguji skripsi ini.
4. Dra. MM. Yetty Tjandrawati,M.Si. selaku dosen penguji yang memberikan kritik dan saran untuk skripsi ini.
5. Yohanes Dwiatmaka, S.Si., M.Si. selaku Kepala Laboratorium Fakultas Farmasi Universitas Sanata Dharma.
6. Seluruh staf laboratorium di Fakultas Farmasi Universitas Sanata Dharma Yogyakarta terutama Mas Ottok, Mas Bimo, Pak Parlan, dan Mas Kunto yang telah membantu dan mendukung kelangsungan skripsi ini.
7. Keluarga St. S. Tartono, mba Ita, mas Haksoko, dek Citra, Icang, mba Rani, mba Rini, keluarga Munawar ‘Krengseng’ Batang.
8. Teman seperjuanganku, Pungki dan Micell atas kebersamaan dalam menyelesaikan skripsi.
9. Yoki, Aang, Tony dan Boim atas dukungan dan kebersamaannya selama penelitian di laboratorium.
10.Teman-temanku Rudi, Pita, Ulan, Jati, Chuey, Dani ndut, Jimmy, Tumplink, Octav terima kasih atas warna warni kehidupan yang telah diberikan.
11.Teman-teman FST angkatan 2006 atas kebersamaan yang tak kan terlupakan. 12.Orang-orang yang telah memberikan inspirasi hidup.
13.Semua pihak yang tidak dapat disebutkan satu per satu.
Penulis menyadari bahwa skripsi ini masih terdapat banyak kekurangan. Oleh karena itu penulis mengharapkan kritik dan saran untuk membantu penulis dalam perkembangan selanjutnya. Akhir kata, semoga skripsi ini berguna bagi pembaca.
PERNYATAAN KEASLIAN KARYA
Saya menyatakan dengan sesungguhnya bahwa skripsi yang saya tulis ini tidak memuat karya atau bagian karya orang lain, kecuali yang telah disebutkan dalam kutipan dan daftar pustaka, sebagaimana layaknya karya ilmiah.
Yogyakarta, 24 Maret 2010
Penulis
Maria Angelina Ratna Kumalasari A.
INTISARI
Saat ini banyak obat yang dikemas dalam suatu bentuk sediaan tablet dengan kombinasi beberapa zat aktif untuk memperbaiki efek terapinya. Salah satu kombinasi ini adalah campuran parasetamol dan ibuprofen merk ”x”. Obat ini termasuk ke dalam obat yang dijual bebas dipasaran. Perlu dilakukan analisis untuk mengetahui kebenaran kadar campuran parasetamol dan ibuprofen dalam tablet merk ”x” yang tertera dalam kemasan tersebut dengan metode Kromatografi Cair Kinerja Tinggi (KCKT) fase terbalik Menurut FI IV (1995), tablet parasetamol atau ibuprofen mengandung parasetamol atau ibuprofen tidak kurang dari 90,0% dan tidak lebih dari 110,0% dari jumlah yang tertera dari etiket.
Penelitian ini merupakan penelitian noneksperimental dengan rancangan penelitian deskriptif. Kadar campuran parasetamol dan ibuprofen dianalisis secara kuantitatif dengan menggunakan metode KCKT fase terbalik dengan fase diam kolom oktadesilsilan (C18); perbandingan fase gerak metanol: aquabidest (90:10, pH
4,0); kecepatan alir 1,5 ml/menit, detektor UV pada panjang gelombang 230 nm. Kadar parasetamol dan ibuprofen adalah 350,412 – 371,495 mg/tablet dan 195,978 – 203,428 mg/tablet. Hasil yang diperoleh menunjukan bahwa kadar parasetamol dan ibuprofen masuk dalam rentang persyaratan tablet 90-110% dari yang tertera dalam etiket.
Kata kunci : parasetamol, ibuprofen, KCKT fase terbalik
ABSTRACT
Today, there are a lot of drug that combine in any dosage form design to improve theurapetic effect. One of the combination is tablet of paracetamol and ibuprofen. This drug is used free in the market. Therefore analysed quantatively to get the truth of the content in the tablet with high performance liquid chromatography (HPLC) reversed phase method. According to FI IV (1995), tablet of paracetamol or ibuprofen contains no less than 90% and not more than 110% paracetamol or ibuprofen from quantity that mention on label.
This study is a non experimental descriptive. This research use HPLC reversed phase method with static phase oktadesilsilan (C18), mobile phase methanol
: aquabidest (90:10 v/v) with added asetic acid until pH 4,0, flow rate 1,5 ml/minute, UV detector at 230 nm
Result of the research is tablet of paracetamol and ibuprofen contain parsetamol 350,412 – 371,495 mg/tablet and ibuprofen 195,978 – 203,428 mg/tablet. The result showed amount of paracetamol and ibuprofen still in a range 90-110% from quantity that mention on label.
Key words : Paracetamol, Ibuprofen, HPLC reversed phase
DAFTAR ISI
Hal
HALAMAN JUDUL... ii
HALAMAN PERSETUJUAN PEMBIMBING... iii
HALAMAN PENGESAHAN... iv
HALAMAN PERSEMBAHAN... v
PERNYATAAN PERSETUJUAN PUBLIKASI... vi
PRAKARTA... vii
PERNYATAAN KEASLIAN KARYA... ix
INTISARI... x
ABSTRACT... xi
DAFTAR ISI... xii
DAFTAR TABEL... xv
DAFTAR GAMBAR... xvi
DAFTAR LAMPIRAN... xviii
BAB II. PENELAAHAN PUSTAKA... 5
A. Tablet …... 5
1. Definisi dan instrumentasi... 15
2. Kromatografi partisi... 18
3. Waktu tambat dan resolusi... 20
4. Analisis kualitatif dan kuantitatif... 22
G. Landasan Teori... 23
H. Hipotesis... 24
BAB III. METODE PENELITIAN... 25
A. Jenis dan Rancangan Penelitian... 25
1. Pembuatan fase gerak... 27
2. Pembuatan larutan baku parasetamol dan ibuprofen... 27
3. Optimasi metode... 27
4. Penetapan kadar campuran parasetamol dan ibuprofen dalam tablet merk “x”……….. 29 G. Analisis Hasil... 29
BAB IV. HASIL DAN PEMBAHASAN... 31
A. Pemilihan Sampel... 31
B. Pembuatan Fase Gerak... 32
C. Pembuatan Larutan baku... 34
D. Penetapan Panjang Gelombang Pengamatan Parasetamol dan Ibuprofen dengan Spektrofotometer uv... 34 E. Pembuatan Kurva Baku Parasetamol dan Ibuprofen... 37
F. Penetapan Kadar Campuran Parasetamol dan Ibuprofen dalam Tablet Merk “x”………... 39 1. Analisis kualitatif... 40
2. Analisis kuantitatif... 46
BAB V. KESIMPULAN DAN SARAN... 48
A. Kesimpulan... 48
B. Saran... 48
DAFTAR PUSTAKA... 49
LAMPIRAN... 52
BIOGRAFI PENULIS... 90
DAFTAR TABEL
Tabel I Persyaratan keseragaman bobot tablet ...……… 8
Tabel II Indeks polaritas beberapa pelarut……….. 17
Tabel III Keseragaman bobot tablet merk ”x”..………... 32
Tabel IV Konsentrasi parasetamol vs AUC...………... 38
Tabel V Konsentrasi ibuprofen vs AUC.……… 39
Tabel VI Data waktu retensi baku parasetamol, ibuprofen dan sampel... 42
Tabel VII Hasil penetapan kadar campuran parasetamol dan ibuprofen dalam tablet merk “x”... 47
DAFTAR GAMBAR
Hal
Gambar 1. Rumus struktur parasetamol... 10
Gambar 2. Rumus struktur ibuprofen... 11
Gambar 3. Tingkat energi elektronik molekul...………... 13
Gambar 4. Peralatan KCKT...……….. 16
Gambar 5. Mekanisme pemisahan kromatografi partisi………. 18
Gambar 6. Reaksi silanisasi... 19
Gambar 7. Reaksi pembuatan kolom oktadesilsilan... 20
Gambar 8. Pemisahan dua senyawa... 21
Gambar 9. Reaksi kolom oktadesilsilan dengan asam klorida... 34
Gambar 10. Gugus kromofor dan auksokrom pada parasetamol... 35
Gambar 11. Gugus kromofor pada ibuprofen... 35
Gambar 12. Spektra serapan gabungan parasetamol dan ibuprofen... 36
Gambar 13. Kromatogram pemisahan dari campuran parasetamol dan ibuprofen dengan fase gerak metanol : aquabidest (90:10 v/v) pH 4,0 kecepatan alir 1,5 ml/menit... 41 Gambar 14. Bagian non-polar ibuprofen dan parasetamol... 43
Gambar 15. Interaksi parasetamol dengan fase diam... 44
Gambar 16. Interaksi ibuprofen dengan fase diam... 44
Gambar 17. Interaksi parasetamol dengan fase gerak... 45
Gambar 18. Interaksi ibuprofen dengan fase gerak... 45
DAFTAR LAMPIRAN
Hal
Lampiran 1. Sertifikat analisis parasetamol... 53
Lampiran 2. Sertifikat analisis ibuprofen... 54
Lampiran 3. Data penimbangan baku parasetamol dan ibuprofen... 55
Lampiran 4. Spektra panjang gelombang pengamatan……… 56
Lampiran 5. Kromatogram fase gerak dan metanol………...……. 57
Lampiran 6. Kromatogram peak ibuprofen mengekor pada pH 5,0 ……….. 59
Lampiran 7. Kromatogram peak ibuprofen pada pH 4,0... 60
Lampiran 8. Kromatogram baku parasetamol……….…….... 61
Lampiran 9. Kromatogram baku ibuprofen... 70
Lampiran 10. Contoh perhitungan resolusi pemisahan campuran parasetamol dan ibuprofen dalam tablet merk “x”... 79
Lampiran 11. Kromatogram sampel campuran parasetamol dan ibuprofen dalam tablet merk”x”... 80 Lampiran 12. Contoh perhitungan konsentrasi baku parasetamol…..……….. 85
Lampiran 13. Contoh perhitungan konsentrasi baku ibuprofen…..………... 85
Lampiran 14. Data persamaan kurva baku parasetamol dan ibuprofen………….... 86
Lampiran 15. Data penimbangan bobot rata-rata 20 tablet………...………... 86
Lampiran 16. Data penimbangan bobot sampel……… 87
Lampiran 17. Data kadar parasetamol dan ibuprofen dalam tablet merk”x”…….… 87 Lampiran 18. Contoh perhitungan kadar parasetamol dan ibuprofen dalam sampel 88
xix
BAB I
PENGANTAR
A. Latar Belakang
Saat ini banyak obat yang dikemas dalam suatu bentuk sediaan dengan kombinasi beberapa zat aktif. Hal ini ditujukan untuk mendapatkan efek terapi yang lebih baik. Salah satu kombinasi ini adalah campuran parasetamol dan ibuprofen. Parasetamol diindikasikan untuk sakit kepala, nyeri, dan demam. Sedangkan ibuprofen diindikasikan untuk nyeri dan radang pada penyakit reumatik, gangguan otot skelet lainnya, dan demam. Kombinasi ini dikemas dalam sediaan tablet merk ”x” yang mengandung 350 mg parasetamol dan 200 mg ibuprofen dan diindikasikan untuk pengobatan nyeri muskuloskeletal. Tablet merk ”x” dengan kombinasi tersebut tergolong dalam obat bebas, sehingga perlu dilakukan suatu penelitian tentang penetapan kadar kedua komponen untuk menjamin kualitas obat tersebut.
Dalam menetapkan kadar kedua komponen tersebut, diperlukan suatu metode analisis yang tepat untuk mengontrol kualitas obat dalam rangka pengawasan mutu. Hal ini ditujukan agar kadar yang diperoleh memenuhi persyaratan yang ditentukan. Berdasarkan Farmakope Indonesia edisi IV, tablet parasetamol mengandung parasetamol C8H9NO2 tidak kurang dari 90,0% dan tidak lebih dari 110,0% dari
jumlah yang tertera pada etiket. Tablet ibuprofen mengandung ibuprofen C13H18O2,
tidak kurang dari 90,0% dan tidak lebih dari 110,0% dari jumlah yang tertera dalam etiket. Kontrol kualitas obat dalam rangka pengawasan mutu perlu dilakukan karena
dosis merupakan hal yang penting dalam suatu sediaan obat. Jika kadar parasetamol dan ibuprofen dalam tablet merk”x” kurang dari dosis yang tertera dalam etiket, maka efek terapi yang dihasilkan kurang optimum. Sedangkan jika kadar melebihi dosis yang tertera, maka dapat menyebabkan overdosis dan merugikan pasien.
Salah satu metode analisis yang dapat untuk menetapkan kadar parasetamol dan ibuprofen dalam tablet merk ”x” adalah Kromatografi Cair Kinerja Tinggi (KCKT). Kelebihan dari metode KCKT adalah memiliki sensitivitas yang tinggi dan dapat memperoleh pemisahan yang baik dalam waktu singkat.
Penelitian ini mengacu dari penelitian sebelumnya yang telah dilakukan oleh Prabowo (2010) tentang Optimasi pemisahan campuran parasetamol dan ibuprofen dengan metode kromatografi cair kinerja tinggi fase terbalik. Pada penelitian tersebut, hasil yang paling optimum adalah dengan menggunakan fase gerak campuran metanol:aquabidest (90:10, pH 4,0) sedangkan fase diam yang digunakan adalah oktadesilsilan(C18) dengan kecepatan alir 1,5 ml/menit dan diperoleh nilai relosusi
1. Permasalahan
a. Apakah metode Kromatografi Cair Kinerja Tinggi (KCKT) menggunakan fase gerak campuran metanol:aquabidest (90:10, pH 4,0) dapat digunakan untuk menetapkan kadar parasetamol dan ibuprofen dalam tablet merk ”x”?
b. Apakah kadar parasetamol dan ibuprofen dalam tablet merk ”x” yang ditetapkan kadarnya dengan metode KCKT menggunakan fase gerak campuran metanol:aquabidest (90:10, pH 4,0) sesuai dengan yang tertera pada label dalam kemasan?
2. Keaslian Penelitian
Metode KCKT fase terbalik telah banyak digunakan untuk menetapkan kadar campuran obat. Penelitian mengenai campuran parasetamol dan ibuprofen dengan metode KCKT pernah dilakukan oleh Prasanna (2009) menggunakan fase gerak asetonitril:buffer fosfat (60:40 v/v, pH 7,0). Namun metode KCKT dengan menggunakan fase gerak metanol:aquabidest (90:10, pH 4,0) belum pernah dilakukan untuk menetapkan kadar campuran parasetamol dan ibuprofen dalam tablet merk ”x”.
3. Manfaat Penelitian
b. Manfaat metodologis. Penelitian ini diharapkan dapat memberikan informasi bahwa metode KCKT fase terbalik dengan fase gerak metanol:aquabidest (90:10, pH 4,0) dapat digunakan untuk menetapkan kadar parasetamol dan ibuprofen dalam tablet merk”X”.
c. Manfaat praktis. Penelitian ini diharapkan dapat memberikan informasi apakah kadar parasetamol dan ibuprofen dalam tablet merk”X” sesuai dengan label pada kemasan.
B. Tujuan penelitian
Berdasarkan latar belakang dan permasalahan yang ada tujuan penelitian ini sebagai berikut:
1. Mengetahui bahwa metode KCKT menggunakan fase gerak campuran metanol:aquabidest (90:10, pH 4,0) dapat digunakan untuk menetapkan kadar parasetamol dan ibuprofen dalam tablet merk ”x”.
BAB II
PENELAAHAN PUSTAKA
A. Tablet
Tablet merupakan sediaan padat yang mengandung bahan obat dengan atau tanpa bahan pengisi. Berdasarkan metode pembuatan, tablet digolongkan menjadi tablet cetak dan tablet kempa. (Anonim, 1995). Pada umumnya, tablet mengandung bahan tambahan yang memiliki fungsi yang berbeda-beda. Bahan-bahan tambahan yang digunakan dalam pembuatan tablet adalah bahan pengisi, bahan pengikat, bahan penghancur, dan bahan pelicin.
Bahan pengisi diperlukan jika jumlah zat aktif tidak cukup memenuhi massa tablet. Selain itu bahan pengisi juga ditambahkan untuk memperbaiki daya kohesi, sehingga dapat memacu aliran dan dapat dikempa langsung. Bahan pengisi yang biasa digunakan adalah laktosa, amilum, sukrosa (Voigt, 1995).
Bahan pengikat ditujukan untuk meningkatkan kohesifitas antar partikel serbuk, sehingga memberikan kekompakan dan daya tahan tablet (Voigt, 1995). Penambahan ini dimaksudkan agar tablet kompak dan tidak mudah pecah. Bahan pengikat yang umum digunakan adalah cairan amilum, gelatin, gom arab, tragakan, dan derivat selulosa.
Bahan penghancur ditujukan untuk memudahkan pecahnya atau hancurnya tablet dalam medium air atau cairan lambung sehingga pecah menjadi granul atau
partikel penyusunnya dan dapat memberikan efek terapetik yang diharapkan. Bahan penghancur yang umum digunakan adalah pati (Lachman, 1976).
Bahan pelicin ditujukan untuk memudahkan pengeluaran tablet dari ruang kempa melalui pengurangan gesekan antara dinding dengan permukaan sisi tablet. Bahan pelicin juga ditujukan untuk memperbaiki sifat alir granul dan mencegah massa tablet yang melekat pada dinding ruang kempa. Bahan pelicin yang sering digunakan adalah magnesium stearat, talk, dan polietilenglikol (Voigt, 1995).
Bahan-bahan tambahan yang sering digunakan dalam pembuatan tablet adalah amilum manihot, gelatin, dan magnesium stearat.
Amilum manihot (pati singkong). Pati singkong diperoleh dari umbi akar Manihot utilissima. Amilum manihot merupakan serbuk halus dan berwarna putih.
Kelarutan praktis tidak larut dalam air dingin dan dalam etanol (Anonim, 1995). Gelatin merupakan zat yang diperoleh dari hidrolisa parsial kolagen dari kulit. Gelatin berupa lembaran, kepingan atau potongan, atau serbuk kasar sampai halus, kuning lemah atau coklat terang. Larutan berbau lemah seperti kaldu. Kelarutan, tidak larut dalam air dingin, mengembang dan lunak bila dicelup dalam air, menyerap air secara bertahap sebanyak 5 sampai 10 kali beratnya, larut dalam air panas, dalam asam asetat 6 N dan dalam campuran panas gliserin dan air, tidak larut dalam etanol dalam kloroform, dalam eter, dan dalam minyak lemak dan dalam minyak menguap.
dengan tidak kurang dari 6,8% dan tidak lebih dari 8,3% Magnesium Oksida (MgO). Magnesium stearat merupakan serbuk halus, putih dan voluminus, bau khas lemah, mudah melekat dikulit, bebas dari butiran. Kelarutannya tidak larut dalam air, dalam etanol, dan dalam eter.
Tablet merupakan suatu bentuk sediaan yang banyak digunakan saat ini. Keuntungan dari bentuk tablet antara lain relatif murah dan relatif mudah digunakan pada masyarakat. Kebanyakan tablet digunakan dengan pemberian secara oral, dan kebanyakan ditambahkan zat warna, zat pemberi rasa, dan lapisan-lapisan dalam berbagai jenis. Tablet juga dapat digunakan secara sublingual, bukal, atau melalui vaginal. Tablet dapat berbeda-beda dalam bentuk, ukuran, berat, kekerasan, ketebalan, dan waktu hancur tergantung cara pemakaian dan pembuatannya (Ansel, 1985).
Kualitas tablet dapat dilihat dari evaluasi sifat fisik tablet (Aulton and Summer, 1994). Evaluasi kualitas tablet meliputi penampilan tablet, keseragaman ukuran tablet, keseragaman bobot dan kandungan, waktu hancur, kekerasan, kerapuhan, dan keseragaman kandungan.
Menurut Farmakope Indonesia edisi III, keseragaman ukuran tablet dinyatakan bahwa diameter tablet tidak lebih dari 3 kali dan tidak kurang dari 1 1/3 tebal tabletnya (Anonim, 1979).
Tablet harus memenuhi uji keseragaman bobot, jika zat aktif merupakan bagian terbesar dari tablet dan jika uji keseragaman bobot cukup mewakili keseragaman kandungan. Keseragaman bobot bukan merupakan indikasi yang cukup dari keseragaman kandungan jika zat aktif merupakan bagian kecil dari tablet (Anonim, 1995). Berdasarkan Farmakope Indonesia edisi III, untuk tablet tidak bersalut, harus memenuhi syarat keseragaman bobot, yaitu dengan menimbang 20 tablet dan menghitung bobot rata-rata tablet. Jika ditimbang satu per satu tidak boleh lebih dari 2 tablet yang bobotnya menyimpang dari dari kolom A dan tidak ada tablet yang menyimpang dari kolom B. Untuk tablet tidak bersalut yang memiliki bobot lebih dari 300 mg, tidak lebih dari 2 tablet yang menyimpang 5% dari bobot rata-rata dan tidak boleh ada tablet yang meyimpang 10% dari bobot rata-rata.
Tabel I. Persyaratan keseragaman bobot tablet
Penyimpangan bobot rata-rata dalam % Bobot rata-rata
tidak lebih dari 15 menit sedangkan untuk tablet bersalut tidak lebih dari 60 menit (Anonim, 1995).
Kekerasan, dikehendaki tablet yang cukup keras agar tidak pecah saat distribusi, tetapi tidak terlalu keras agar tablet dapat hancur dan menimbulkan efek. Kekerasan tablet minimum yang sesuai dalam bidang industri farmasi adalah 4 kg (Ansel, 1989).
Kerapuhan, benturan-benturan pada proses pengemasan dan pengangkutan tidak cukup kuat untuk memecahkan tablet, tetapi dapat menghilangkan beberapa partikel obat dari permukaan tablet (Aulton and Summer, 1994).
Keseragaman kandungan, berdasarkan United State Pharmacopeia, 10 unit dosis ditetapkan kadarnya sesuai dengan monografi yang tercantum. Jika tidak dicantumkan dalam monografi, harus memenuhi persyaratan dalam rentang 85%-115% dari kandungan yang tertera pada label dan memiliki standar deviasi kurang dari 6 % (Allen and Popovich, 2005).
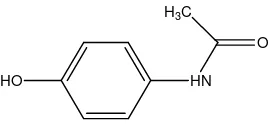
B. Parasetamol
Parasetamol dengan nama lain asetaminofen atau 4`-hidroksiasetanilida dengan rumus molekul C8H9NO2 memiliki bobot molekul 151,6 gram/mol.
HO HN H3C
O
Gambar 1. Rumus struktur parasetamol
Satu bagian parasetamol larut dalam 70 bagian air, 20 bagian air panas, 7 bagian etanol, dan 50 bagian kloroform. Parasetamol tidak larut dalam eter. Parasetamol memiliki serapan maksimum pada daerah ultraviolet, pada panjang gelombang 245 nm (A1%1 cm = 900). Parasetamol memiliki nilai pKa 9,51 (Clarke,
1969).
Parasetamol diindikasikan untuk sakit kepala, nyeri muskuloskeletal sementara, dismenor, dan demam. Parasetamol tidak memiliki aktivitas antiinflamasi yang berarti dan parasetamol kurang mengiritasi lambung. Dosis oral : 0,5-1 gram tiap 4-6 jam hingga maksimum 4 gram sehari. Kelebihan dosis parasetamol dapat menyebabkan kerusakan hati, pendarahan pada bagian perut, dan gangguan pada ginjal (Anonim, 2000).
Berdasarkan Farmakope Indonesia edisi IV, tablet parasetamol mengandung parasetamol C8H9NO2 tidak kurang dari 90,0% dan tidak lebih dari 110,0% dari
C. Ibuprofen
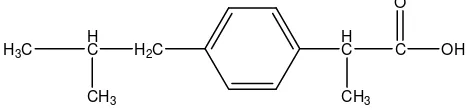
Ibuprofen dengan nama lain (±)-2-(p-Isobutilfenil) asam propionat dengan rumus molekul C13H18O2 memiliki bobot molekul 206,28 g/mol. Pemerian berupa
serbuk hablur, putih hingga hampir putih; berbau khas lemah. Kelarutannya praktis tidak larut dalam air, sangat mudah larut dalam etanol, dalam metanol, dalam aseton, dan dalam kloroform; sukar larut dalam etil asetat (Anonim,1995). Ibuprofen memiliki serapan maksimum pada daerah ultraviolet panjang gelombang serapan maksimum ± 223 nm (Clarke, 1969). Ibuprofen memiliki pKa 4,3 (Anonim, 2010)
H2C
Gambar 2. Rumus struktur ibuprofen
Ibuprofen berkhasiat sebagai antiinflamasi, analgesik, dan antipiretik. Obat ini memiliki efek samping yang lebih sedikit dibandingkan dengan obat anti inflamasi nonsteroid (AINS) lainnya. Dosis ibuprofen 1,6 – 2,4 g sehari yang diperlukan untuk rheumatoid arthritis. Kelebihan dosis dari ibuprofen, dapat menyebabkan pendarahan, tukak, gangguan pendengaran, dan gagal ginjal (Anonim, 2000).
Berdasarkan Farmakope Indonesia edisi IV, tablet ibuprofen mengandung ibuprofen C13H18O2, tidak kurang dari 90,0% dan tidak lebih dari 110,0% dari
D. Penelitian Terdahulu
Penelitian tentang penetapan kadar campuran parasetamol dan ibuprofen pernah dilakukan oleh Battu dan Prasanna (2009). Penelitian ini menggunakan fase gerak campuran asetonitril:buffer fosfat (60:40) pH 7,0 dengan fase diam kolom Oktadesilsilan (Use Inertsil C18, 5m , 150 mm x 4.6 mm) dengan kecepatan alir
0,8ml/menit dan panjang gelombang 260 nm. Hasil recovery yang diperoleh untuk parasetamol adalah 98,90±0,815% dan untuk ibuprofen adalah 96,01±.0,580%, koefisien korelasi 0,999 dan 0,998; nilai resolusi 1,30 dan 1,30; nilai Limit of Detection (LOD) 6 ng/ml dan 10 ng/ml; dan nilai Limit of Quantitation (LOQ) 15
ng/ml dan 25 ng/ml.
Selain itu juga pernah dilakukan penelitian oleh Prabowo (2010) tentang optimasi pemisahan campuran parasetamol dan ibuprofen dengan metode KCKT. Pada penelitian tersebut, hasil yang paling optimum adalah dengan menggunakan fase gerak campuran metanol:aquabidest (90:10, pH 4,0) sedangkan fase diam yang digunakan adalah oktadesilsilan(C18) dengan kecepatan alir 1,5 ml/menit dan
diperoleh nilai relosusi yaitu 6,7.
E. Spektrofotometri Ultraviolet
elektromagnetik ultraviolet dekat (190-380 nm) dengan memakai instrumen spektrofotometer (Mulja dan Suharman, 1995).
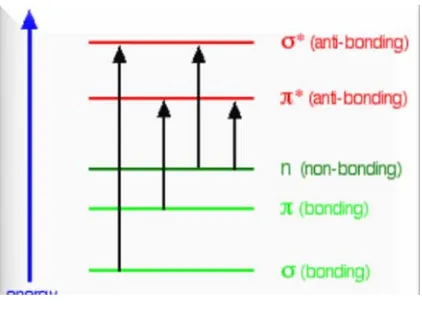
Serapan cahaya oleh molekul dalam daerah spektrum ultraviolet dan terlihat tergantung dari struktur elektronik molekul (Sastrohamidjojo, 2002 b). Apabila suatu molekul dikenai oleh REM maka akan terjadi eksitasi ke tingkat energi yang lebih tinggi yang dikenal sebagai orbital elektron antiikatan. Ada empat tipe transisi elektronik yang mungkin terjadi yaitu σ→σ* , π→ π*, n → π*, n → σ*. Eksitasi elektron (σ → σ*) memberikan energi yang terbesar dan terjadi pada daerah ultraviolet jauh yang diberikan oleh ikatan tunggal, misalnya alkana. Eksitasi elektron π→ π* diberikan oleh ikatan rangkap dua dan rangkap tiga, juga terjadi pada daerah ultraviolet jauh. Sedangkan eksitasi elektron (n → σ*) terjadi pada gugus karbonil yang terjadi pada ultraviolet jauh (Mulja dan Suharman, 1995).
Gambar 3. Tingkat energi elektronik molekul (Skoog et al., 1998)
menyerap radiasi namun bila terikat bersama kromofor dapat meningkatkan penyerap oleh kromofor atau menggeser puncak ke panjang gelombang yang lebih panjang (Christian, 2004).
Spektrofotometer ultraviolet digunakan untuk analisis kualitatif dan kuantitatif. Pada analisis kuantitatif, selalu melibatkan pembacaan absorban radiasi elektromagnetik oleh molekul, atau radiasi elektromagnetik yang diteruskan, yang disebut absorban (A) tanpa satuan dan transmitan dengan satuan persen (%T). Formula matematik yang dibuat Bouger, Lambert, dan Beer tentang hubungan antara transmitan atau absorban terhadap intensitas radiasi atau konsentrasi zat yang dianalisis dan tebal larutan yang mengabsorbsi sebagai berikut:
Keterangan :
T = persen transmitan
Io = intensitas radiasi yang datang
It = intesitas radiasi yang diteruskan
ε= daya serap molar (Liter.mol-1.cm-1)
A = serapan (Mulja dan Suharman, 1995) Ikatan konjugasi merupakan ikatan rangkap yang berselang-seling dengan satu ikatan tunggal. Dalam orbital molekul, elektron π mengalami delokalisasi lanjut dengan adanya ikatan terkonjugasi. Adanya efek delokalosasi ini akan menyebabkan penurunan tingkat energi π* dan memberikan pengurangan karakter antiikatan. Sebagai konsekuensinya, panjang gelombang molekul yang mempunyai ikatan rangkap terkonjugasi akan mengalami pergeseran batokromik (Rohman dan Gandjar, 2007).
F. Kromatografi Cair Kinerja Tinggi
1. Definisi dan instrumentasi
Kromatografi adalah prosedur pemisahan senyawa campuran zat-zat kimia yang berdasarkan perbedaan migrasi dari masing-masing komponen campuran yang terpisah pada fase diam di bawah pengaruh pergerakan fase yang bergerak. Kromatografi bertujuan untuk memisahkan komponen dari matriks sampel dan tetap dibiarkan dalam fase diam kemudian ditentukan untuk dianalisis (Mulja dan Suharman, 1995).
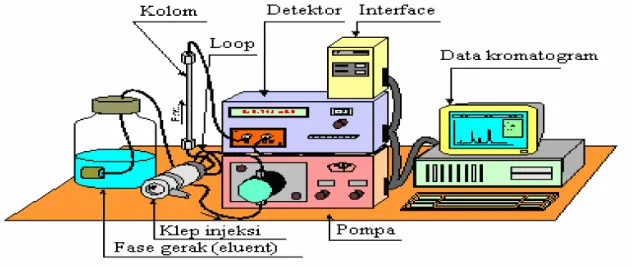
kecepatan dan efisiensi yang tinggi (Anonim, 1995). Gambar peralatan KCKT adalah sebagai berikut:
Gambar 4. Peralatan KCKT
(Kazakevich and Nair, 1996) Variabel-variabel yang harus diperhatikan dalam KCKT adalah fase gerak, fase diam, dan detektor.
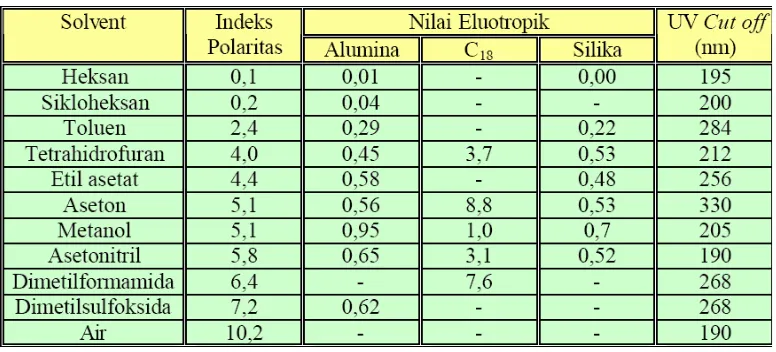
Berikut ini tabel beberapa nilai indeks polaritas pelarut yang sering digunakan:
Tabel II. indeks polaritas beberapa pelarut
( Snyder et al., 1997) Fase diam dari KCKT berupa kolom kromatografi yang merupakan bagian penting karena pemisahan komponen-komponen sampel terjadi di dalam kolom. Keberhasilan pemisahan komponen-komponen sampel sangat bergantung pada keadaan kolom sehingga pemilihan kolom yang tepat sangatlah penting (Mulja dan Suharman, 1995). Oktadesilsilan (C18) merupakan fase diam yang paling banyak
dipakai karena mampu memisahkan senyawa-senyawa dengan kepolaran yang rendah, sedang, maupun tinggi (Rohman dan Gandjar, 2007).
oleh spesies analit yang mempunyai struktur atau gugus kromoforik (Rohman dan Gandjar, 2007).
2. Kromatografi partisi
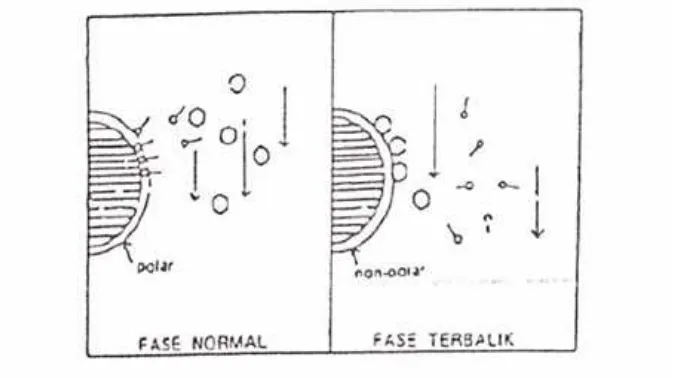
Prinsip kromatografi partisi adalah partisi analit diantara 2 fase yang tidak saling campur, karena adanya perbedaan koefisien distribusi dari masing-masing senyawa (Johnson and Stevenson, 1978). Pada kromatografi partisi digunakan fase gerak dan fase diam dengan polaritas yang berbeda. Jika fase gerak bersifat polar dan fase diam non polar, dikenal dengan fase terbalik (Anonim, 1995). Mekanisme pemisahan pada kromatografi partisi dapat digambarkan sebagai berikut:
Gambar 5. Mekanisme pemisahan kromatografi partisi (Munson, 1984)
Di dalam kromatografi, K didefinisikan sebagai perbandingan konsentrasi analit dalam fase diam(Cs) dan fase gerak (Cm) (Rohman dan Gandjar, 2007).
Kolom yang biasa digunakan dalam kromatografi partisi fase terbalik adalah kolom dengan kemasan fase terikat yang memiliki sifat stabil karena fase diamnya terikat secara kimia pada penyangga, sehingga tidak mudah terbawa oleh fase gerak. Penyangga pada kemasan fase terikat biasanya terbuat dari silika yang sudah diseragamkan, berpori, dan umumnya partikel mempunyai diameter 3,5 atau 10 µm (Skogg et al., 1998).
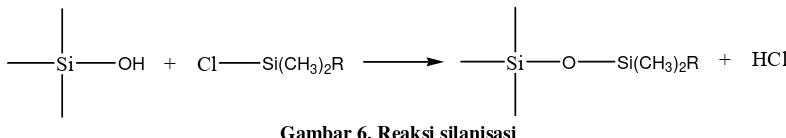
Pada KCKT partisi fase terbalik biasanya mengandung bagian organik yang terikat secara kimia dengan gugus silanol pada permukaan silika. Bagian organik tersebut umumnya hidrokarbon rantai panjang, sehingga fase gerak umumnya polar. Gugus silanol permukaan dapat direaksikan dengan berbagai cara menempelkan berbagai jenis gugus organik. Kemasan fase terikat dengan tipe ikatan siloksan (Si-O-Si-O) dibuat dengan mereaksikan organoklorosilan dengan gugus silanol pada permukaan silika gel. Reaksi silanasi sebagai berikut:
Si OH + Cl Si(CH3)2R Si O Si(CH3)2R + HCl
Gambar 6. Reaksi silanisasi
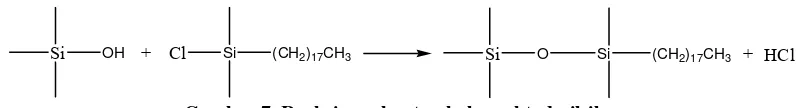
Si OH + Cl Si (CH2)17CH3 Si O Si (CH2)17CH3 + HCl
Gambar 7. Reaksi pembuatan kolom oktadesilsilan
Gugus yang ditempelkan pada silanol pada umumnya adalah hidrokarbon rantai panjang. Panjang pendeknya rantai karbon mempengaruhi tertambatnya senyawa pada fase diam (Skoog et al., 1998).
Fase gerak yang sering digunakan adalah campuran metanol atau asetonitril dengan air atau dengan larutan buffer. Untuk analit yang bersifat asam atau basa lemah, peranan pH sangat penting karena jika pH fase gerak tidak diatur maka analit akan mengalami ionisasi, sehingga ikatan dengan fase diam akan menjadi lemah jika dibandingkan dalam bentuk tidak terionisasi, spesies yang terionisasi akan terelusi lebih cepat (Rohman dan Ganjar, 2007).
3. Waktu retensi dan resolusi
Waktu retensi (tR) atau waktu tambat (retention time) adalah selang waktu
yang diperlukan oleh analit mulai saat injeksi sampai keluar dari kolom dan sinyalnya ditangkap detektor. Selain waktu tambat analit, dikenal pula waktu tambat untuk pelarut pengembang atau pengembang campur yang dinyatakan sebagai tM (Mulja
dan Suharman, 1995).
analit akan lebih banyak di dalam fase gerak atau (Cm>Cs) yang berarti analit akan
lebih lama tinggal di dalam fase gerak dan memiliki waktu retensi lebih cepat (Mulja dan Suharman, 1995).
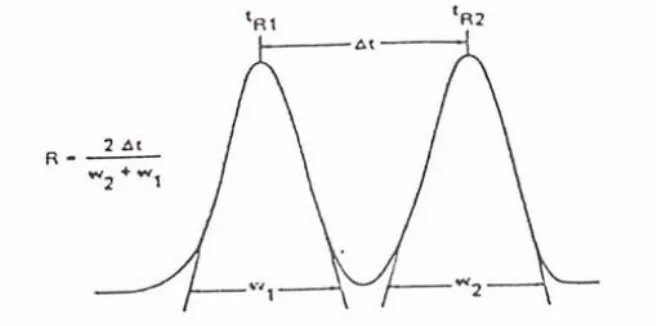
Faktor resolusi (R) adalah ukuran pemisahan dari dua puncak berdekatan yang dapat diukur dengan persamaan :
Harga tR1 dan tR2 merupakan waktu retensi senyawa yang diukur pada titik
maksimum puncak, harga w1 dan w2 merupakan lebar alas puncak (Johnson and
Setevenson, 1978). Pemisahan dua senyawa dapat digambarkan sebagai berikut :
Gambar 8. Pemisahan dua senyawa (Johnson and Setevson, 1978)
1976). Untuk pemisahan yang baik R harus ≥ 1,5 karena berarti pemisahan kedua senyawa ≥ 99,7% (Sastrohamidjojo, 2002 a).
4. Analisis kualitatif dan kuantitatif
KCKT dapat digunakan untuk analisis kualitatif dan kuantitatif dari suatu sampel atau cuplikan. Hasil dari pemisahan adalah kromatogram. Dari kromatogram diperoleh informasi mengenai waktu retensi suatu senyawa (Noegrohati, 1994).
G. Landasan Teori
Banyak obat yang dikemas dalam suatu bentuk sediaan tablet dengan kombinasi beberapa zat aktif. Kombinasi ini ditujukan untuk mendapatkan efek terapi yang lebih baik, salah satunya campuran parasetamol dan ibuprofen. Sediaan tablet mengandung zat aktif dan bahan tambahan seperti bahan pengisi, bahan pengikat, bahan penghancur, dan bahan pelicin. Berdasarkan FI IV, baik tablet parasetamol maupun ibuprofen mengandung tidak kurang dari 90,0% dan tidak lebih dari 110,0% dari jumlah yang tertera pada etiket.
Parasetamol dan ibuprofen merupakan senyawa non volatile dan memiliki panjang gelombang serapan pada daerah ultraviolet. Kedua senyawa juga larut dalam metanol sehingga dapat ditetapkan kadarnya bersama-sama. Salah satu metode yang cocok untuk menganalisis kedua senyawa tersebut adalah metode KCKT. Kelebihan dari metode ini adalah memiliki sensitifitas dan selektifitas yang tinggi.
Kondisi optimal sistem KCKT fase terbalik adalah dengan menggunakan fase diam oktadesilsilan (C18); fase gerak metanol:aquabidest (90:10 v/v) dengan
H. Hipotesis
1. Metode KCKT menggunakan fase gerak campuran metanol:aquabidest (90:10, pH 4,0) dapat digunakan untuk menetapkan kadar parasetamol dan ibuprofen dalam tablet merk ”x”.
BAB III
METODE PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian ini termasuk dalam penelitian noneksperimental dengan rancangan penelitian deskriptif, karena tidak ada perlakuan terhadap subyek uji yaitu tablet merk”x”.
B. Variabel
1. Variabel bebas dalam penelitian ini adalah sistem KCKT yang digunakan.
2. Variabel tergantung dalam penelitian ini adalah kadar parasetamol dan ibuprofen dalam tablet merk ”x”.
3. Variabel pengacau terkendali adalah pelarut, baku parasetamol dan baku ibuprofen
C. Definisi Operasional
1. Tablet merk ”x” merupakan tablet yang mencantumkan kandungan parasetamol 350 mg dan ibuprofen 200 mg dalam labelnya dan memiliki nomor produksi yang sama.
2. Sistem Kromatografi Cair Kinerja Tinggi (KCKT) fase terbalik yang digunakan adalah seperangkat alat KCKT dengan fase diam kolom C18 dan fase gerak
campuran metanol : aquabidest (90:10), ditambah asam asetat glasial hingga pH 4,0.
3. Kadar campuran parasetamol dan ibuprofen dalam tablet merk ”x” ditetapkan dalam jumlah mg/tablet.
D. Bahan Penelitian
Baku parasetamol dan ibuprofen (Working standard, PT. Konimex), metanol (p.a., E. Merck), aquabidestilata (Pharmaceutical laboratories, PT. Ikapharmindo Putranas), dan asam asetat glasial (E. Merck), asam sulfat pekat (p.a., E. Merck), dan kalium bikromat (p.a., E. Merck).
E. Alat Penelitian
Spektrofotometer uv/vis (Optima SP 3000 F), sistem KCKT (model LC-2010C HT, CAT No. 228-46703-38, SERIAL No. C21254706757 LP, Shimadzu Coorporation), kolom oktadesilsilan (C18) merk KNAUER, seperangkat komputer
F. Tata Cara penelitian
1. Pembuatan fase gerak
Fase gerak yang digunakan dalam penelitian campuran metanol : aquabidest dengan perbandingan 90:10 sebanyak 500,0 ml, diatur pada pH 4 dengan penambahan asam asetat glasial. Campuran digojog dan disaring dengan penyaring Whatman organik dengan bantuan pompa vakum. Fase gerak didegassing selama 15 menit.
2. Pembuatan larutan baku parasetamol dan ibuprofen
a. Larutan stok parasetamol. Parasetamol baku lebih kurang 10 mg ditimbang seksama dan dilarutkan dengan metanol dalam labu takar 10,0 ml hingga tanda.
b.Larutan stok ibuprofen. Ibuprofen baku lebih kurang 10,0 mg ditimbang seksama dan dilarutkan dengan metanol dalam labu takar 10,0 ml hingga tanda.
3. Optimasi Metode KCKT
spektrum serapan antara panjang gelombang versus absorbansi. Selanjutnya dari kurva parasetamol dan ibuprofen tersebut, spektra ditumpangtindihkan untuk mengetahui panjang gelombang pengamatan pada deteksi dengan KCKT fase terbalik.
b.Pembuatan kurva baku parasetamol dan ibuprofen. Larutan stok parasetamol diambil 0,350; 0,525; 0,615; 0,700; 0,790 dan 0,875 ml dan diencerkan dengan metanol dalam labu takar 5,0 ml hingga tanda, sehingga didapatkan konsentrasi sebesar 70; 105; 122,5; 140; 157,5; dan 175 ppm. Saring dengan milipore dan didegassing selama 15 menit. Masing-masing seri larutan baku parasetamol sebanyak 50,0 μl disuntikkan ke dalam sistem KCKT dengan kolom ODS (5mm×30cm) menggunakan fase gerak metanol : aquabidest dengan perbandingan 90:10 ditambah dengan asam asetat glasial hingga pH 4 dan kecepatan alir 1,5 ml/menit. Replikasi dilakukan sebanyak 3 kali dan dipilih persamaan kurva baku parasetamol yang paling baik.
Larutan stok ibuprofen diambil 0,2; 0,3; 0,35; 0,4; 0,45; dan 0,5 ml dan diencerkan dengan metanol dalam labu takar 5,0 ml hingga tanda, sehingga didapatkan konsentrasi sebesar 40; 60; 70; 80; 90; dan 100 ppm. Saring dengan milipore dan didegassing selama 15 menit. Masing-masing seri larutan baku
ml/menit. Replikasi dilakukan sebanyak 3 kali dan dipilih persamaan kurva baku ibuprofen yang paling baik.
4. Penetapan kadar campuran parasetamol dan ibuprofen dalam tablet
merk”X”
Tablet campuran parasetamol dan ibuprofen merk “x” sebanyak 20 tablet ditimbang seksama kemudian dihitung bobot rata-rata tablet. Seluruh tablet digerus. Serbuk campuran parasetamol-ibuprofen lebih kurang 100 mg ditimbang seksama, kemudian dilarutkan dengan metanol ke dalam labu takar 10,0 ml. Larutan disaring dengan kertas saring dan sebanyak 3,0 ml larutan tersebut diencerkan dengan metanol hingga 10,0 ml (sebagai larutan intermediet). Larutan intermediet 0,440 ml diencerkan dengan metanol hingga 5,0 ml (sebagai larutan kerja) . Saring dengan milipore dan di degassing selama 15 menit. Larutan kerja 20,0 µl disuntikkan ke dalam sistem KCKT dengan kolom C18 (5mm × 30 cm). Replikasi sebanyak 10 kali.
G. Analisis Hasil
Analisis kualitatif yang dilakukan adalah dengan membandingkan waktu retensi (tR) senyawa sampel dengan senyawa baku. Analisis kuantitatif yang
BAB IV
HASIL DAN PEMBAHASAN
A. Pemilihan sampel
Sampel yang digunakan pada penelitian ini adalah tablet merk “x” yang beredar di daerah Yogyakarta. Pemilihan sampel ini didasarkan atas obat yang memiliki nomor registrasi, nomor batch, dan mencantumkan komposisi zat aktif parasetamol dan ibuprofen.
Nomor regristrasi penting karena merupakan jaminan legalitas suatu produk untuk dapat dipasarkan. Sampel juga diharuskan memiliki nomor batch yang sama. Hal ini dikarenakan agar sampel tersebut melalui serangkaian proses produksi yang sama dan menjamin kandungan produk adalah parasetamol dan ibuprofen. Pencantuman komposisi zat aktif penting karena kandungan zat aktif yang ada harus sesuai dengan komposisi yang tertera pada etiket.
Dalam etiket pada kemasan, tertera kandungan parasetamol 350 mg dan ibuprofen 200 mg. Menurut Sevilla (1993), pengambilan sampel minimal 10% dari populasi, sedangkan untuk populasi kecil pengambilan sampel minimal 20%. Pengambilan sampel sebanyak 20 tablet kemudian dihitung bobot rata-ratanya. Sampel yang digunakan memiliki nomor batch yang sama dan dilakukan replikasi sebanyak 10 kali.
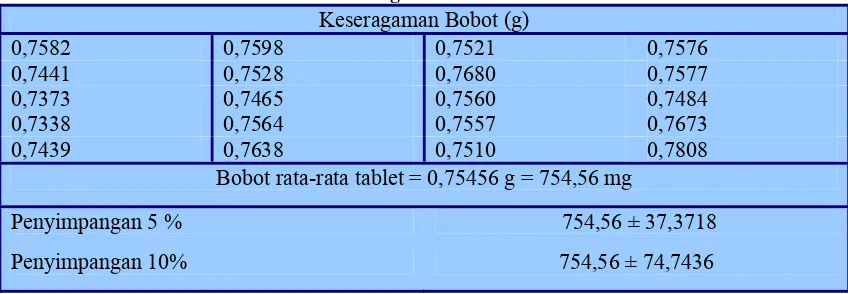
Tabel III. Keseragaman bobot tablet merk ”x”
Bobot rata-rata tablet = 0,75456 g = 754,56 mg
Penyimpangan 5 % 754,56 ± 37,3718
Penyimpangan 10% 754,56 ± 74,7436
Berdasarkan penimbangan bobot 20 tablet, diperoleh bobot rata-rata tablet merk ”x” adalah 754,56 mg. Kandungan parasetamol adalah 350 dan ibuprofen 200 mg. Sehingga tablet merk ”x” mengandung bahan tambahan kurang lebih sebanyak 200 mg.
Berdasarkan Farmakope Indonesia edisi IV, syarat keseragaman bobot untuk tablet tidak bersalut yang memiliki bobot rata-rata lebih dari 300 mg, tidak boleh lebih dari 2 tablet yang bobotnya menyimpang 5% dari bobot rata-rata dan tidak ada satupun tablet yang bobotnya menyimpang 10% dari bobot rata-rata (Anonim, 1995). Berdasarkan hasil yang diperoleh tidak ada satupun tablet yang menyimpang dari persyaratan keseragaman bobot.
B. Pembuatan Fase Gerak
Fase gerak yang digunakan pada penelitian ini adalah campuran metanol:aquabidest (90:10, pH 4 dengan penambahan asam asetat glasial). Campuran ini berdasarkan atas penelitian yang dilakukan oleh Prabowo (2010).
Berdasarkan penelitian, campuran metanol dan aquabidest akan menghasilkan larutan yang memiliki pH 5,0. Pada kondisi ini, ibuprofen mengalami tailing (Lampiran 6). Dilakukan modifikasi pengaturan pH menjadi 4,0 dengan penambahan asam asetat glasial dan diperoleh peak yang lebih baik (tidak tailing) (Lampiran 7).
Asam asetat glasial dipilih untuk mengatur pH karena bersifat asam lemah. Sehingga penambahan sedikit saja, tidak menyebabkan fase gerak bersifat terlalu asam. Jika fase gerak terlalu asam (pH ≤ 2), maka dapat menyebabkan kerusakan kolom. Pada pH terlalu asam oktadesilsilan akan bereaksi dengan asam dan akan melepaskan oktadesilnya sehingga kembali ke bentuk silanol. Berikut ini gambaran reaksinya:
Si O Si (CH2)17CH3 H2O HCl/ Si OH + Cl Si (CH2)17CH3
Gambar 9. Reaksi kolom oktadesilsilan dengan asam klorida
Salah satu komponen dari fase gerak yang digunakan adalah metanol. Senyawa yang akan diuji memiliki kelarutan yang baik di dalam metanol. Metanol memiliki viskositas yang rendah yaitu 0,54cP, sehingga dapat mengurangi tekanan pada kolom untuk menjaga keawetan dari kolom dan pompa. Fase gerak yang digunakan bersifat polar, sedangkan fase diam yang digunakan adalah C18 bersifat
C. Pembuatan Larutan Baku
Larutan baku dibuat dengan seri konsentrasi tertentu. Pelarut yang digunakan adalah metanol p.a karena kedua komponen senyawa larut dalam metanol. Selain itu metanol juga merupakan komponen terbesar dari fase gerak, sehingga mudah terelusi dengan fase gerak.
Larutan baku yang digunakan untuk pengukuran panjang gelombang pengamatan dilakukan dengan menggunakan baku parasetamol:ibuprofen dengan perbandingan 7:4 yaitu 10,5 ppm untuk parasetamol dan 6 ppm untuk ibuprofen.
Larutan baku kedua senyawa untuk pembuatan kurva baku dibuat dalam 5 seri konsentrasi. Konsentrasi untuk parasetamol adalah 70; 105; 122,5; 140; 157,5 dan 175 ppm. Sedangkan konsentrasi ibuprofen adalah 40; 60; 70; 80; 90; dan 100 ppm.
D. Penetapan Panjang Gelombang Pengamatan Parasetamol dan Ibuprofen
dengan Spektrofotometer UV
Penetapan panjang gelombang pengamatan ditujukan untuk mengetahui panjang gelombang dimana parasetamol dan ibuprofen memiliki serapan yang optimal secara bersamaan pada sistem KCKT. Detektor yang digunakan pada sistem KCKT adalah spektrofotometer ultraviolet.
berperan dalam penyerapan radiasi ultraviolet. Penyerapan radiasi ultraviolet tergantung pada struktur elektronik dari kedua senyawa.
Gambar gugus kromofor dan auksokrom masing-masing senyawa dapat dilihat pada gambar berikut:
N
Gambar 10. Gugus kromofor dan auksokrom pada parasetamol
Keterangan: kromofor
auksokrom
Gambar 11. Gugus kromofor pada ibuprofen
Keterangan: kromofor
panjang gelombang maksimum dan intensitas serapan maksimum dari parasetamol. Berdasarkan Clarke (1969), parasetamol memiliki serapan maksimum pada panjang gelombang 245 nm, sedangkan ibuprofen pada panjang gelombang 233 nm
Analisis dengan sistem KCKT tidak menggunakan salah satu λmax
parasetamol atau ibuprofen saja, karena hanya sensitif pada perubahan salah satu konsentrasi. Maka diperlukan suatu panjang gelombang dimana senyawa yang akan dianalisis yaitu parasetamol dan ibuprofen memiliki serapan yang optimal secara bersamaan untuk dapat di ukur pada detektor UV pada sistem KCKT. Panjang gelombang ini disebut dengan panjang gelombang pengamatan. Pada panjang gelombang pengamatan ini terjadi tumpang tindih antara serapan parasetamol dan ibuprof
parasetamol dan ibuprofen saling tumpang tindih dapat dilihat pada gambar berikut:
en.
Hasil Spektra serapan
Gambar 12. Spektra serapan gabungan parasetamol (A) konsentrasi 10,5 ppm dan ibuprofen (B) konsentrasi 6 ppm
240 nm dan berpotongan pada panjang gelombang 230 nm. Berdasarkan spektra tumpang tindih tersebut, panjang gelombang yang digunakan pada analisis dengan sistem KCKT adalah 230 nm, karena merupakan panjang gelombang perpotongan kedua s
240 nm, maka serapan ibuprofen akan kecil atau dapat tidak memberikan serapan.
l., 2004). Persamaan kurva baku parasetamol dan ibuprofen yang
diperoleh:
enyawa sehingga memiliki serapan yang optimum secara bersamaan.
Perbandingan komposisi parasetamol dan ibuprofen dalam tablet merk “x” adalah 7:4. Komposisi ibuprofen lebih kecil jika dibandingan parasetamol, maka pemilihan panjang gelombang pengamatan lebih diutamakan untuk memperoleh serapan yang tinggi pada ibuprofen. Jika panjang gelombang pengamatan yang digunakan pada 223 nm, maka hasil yang diperoleh akan kurang optimal karena panjang gelombang tersebut berdekatan dengan panjang gelombang metanol yaitu 205. Jika menggunakan panjang gelombang
E. Pembuatan Kurva Baku Parasetamol dan Ibuprofen
Tabel IV. Konsentrasi parasetamol vs AUC
Baku Parasetamol
Replikasi 1 Replikasi 2 Replikasi 3
Seri baku
101,850 3927465 103,950 3648424 107,100 3486008
119,310 4606396 121,770 4284769 125,460 3878446
135,800 5323163 138,600 4935837 142,800 4178335
153,260 6049820 156,420 5328015 161,160 4905496
169,750 7062694 173,250 6050790 178,500 5561752
A -617076,429 A -72879,640 A -82861,082
B 44271,589 B 35363,588 B 31223,768
r 0,998 r 0,997 r 0,992
Persamaan kurva baku yang diperoleh adalah: Replikasi 1 : y = 44271,589X-617076,429
n bahwa hasil uji sebanding dengan konsentrasi (jumlah) analit di alam sampel.
Replikasi 2 : y = 35363,588X-72879,640 Replikasi 3 : y = 31223,768X-82861,082
Berdasarkan hasil yang diperoleh menunjukan bahwa persamaan kurva baku parasetamol yang digunakan untuk menetapkan kadar adalah pada replikasi 1, yaitu y=44271,589X-617076,429 yang memiliki nilai r = 0,998. Nilai tersebut menggambarka
Tabel V . Konsentrasi ibuprofen vs AUC Baku Ibuprofen
Replikasi 1 Replikasi 2 Replikasi 3
Seri baku
66,500 1029707 59,400 1031771 60,600 1218188
76,000 1153765 69,300 1203848 70,700 1409751
85,500 1319124 79,200 1336962 80,800 1636694
95,000 1507308 89,100 1514881 90,900 1847692
1646629 99,00 1671321 101,000 1965876
A 165051,100 A 89238,929 A 112782,971
B 15425,695 B 15948,001 B 18631,602
r 0,996 r 0,999 r 0,997
Persamaan kurva baku yang diperoleh adalah: Replikasi 1 : y = 15425,695X + 165051,100
n bahwa hasil uji sebanding dengan konsentrasi (jumlah) analit di alam sampel
F. Penetapan kadar campuran parasetamol dan ibuprofen dalam tablet Replikasi 2 : y = 15948,001X + 89238,929
Replikasi 3 : y = 18631,602X + 112782,971
Berdasarkan hasil yang diperoleh menunjukkan bahwa persamaan kurva baku ibuprofen yang digunakan untuk menetapkan kadar adalah pada replikasi 2, yaitu y= 15948,001X + 89238,929 yang memiliki nilai r = 0,999. Nilai tersebut menggambarka
d
merk”X” dengan KCKT
mengekstraksi senyawa parasetamol dan ibuprofen dari tablet. Hal ini didasarkan kedua senyawa mudah larut dalam metanol sedangkan untuk bahan-bahan tambahan lain tidak larut dalam metanol, disaring dengan kertas saring. Bahan-bahan tambahan seperti bahan pengisi, pengikat, penghancur, dan pelicin tidak larut dalam metanol karena karakteristik kelarutan amilum, gelatin, dan magnesium stearat tidak larut dalam m
ghilangkan gelembung, karena adanya elembung dapat menggangu pengukuran.
1. An
analisis kualitatif. Hasil kromatogram sampel yang diperoleh adalah sebagai berikut: etanol.
Penyaringan ditujukan untuk menghilangkan partikel-partikel karena jika tidak dihilangkan dapat menyumbat kolom. Millipore digunakan untuk menjamin bahwa tidak ada senyawa dari bahan tambahan yang dapat mengganggu pengukuran. Lalu larutan di degassing untuk men
g
alisis Kualitatif
i
ii
iii
Gambar 13. Kromatogram pemisahan dari campuran parasetamol (A) dan ibuprofen(B) dengan fase gerak metanol : aquabidest (90:10 v/v) pH 4,0 kecepatan alir 1,5 ml/menit
A. Baku parasetamol konsentrasi tengah (122,5 ppm) B. Baku ibuprofen konsentrasi tengah (70 ppm)
Dari gambar kromatogram sampel, dapat dilihat waktu retensi masing-masing senyawa dan dibandingkan dengan waktu retensi baku yang ditunjukkan sebagai berikut:
Tabel VI . Data waktu retensi(tR) baku parasetamol, ibuprofen dan sampel
Senyawa tR baku (menit) tR sampel (menit)
Parasetamol 1,682 1,681
Ibuprofen 2,967 2,954
Berdasarkan hasil yang diperoleh dapat dilihat bahwa waktu retensi baku parasetamol adalah 1,682 menit dan baku ibuprofen adalah 2,967 menit. Waktu retensi masing-masing senyawa dalam sampel adalah 1,681 dan 2,954. Jadi dapat disimpulkan bahwa sampel mengandung parasetamol dan ibuprofen. Waktu retensi parasetamol dan ibuprofen berbeda. Hal ini dikarenakan perbedaan interaksi kedua senyawa dengan fase diam dan fase gerak pada sistem KCKT. Fase diam yang digunakan adalah C18 yang bersifat nonpolar, sedangkan fase gerak yang digunakan
adalah metanol:aquabides (90:10, pH 4,0) bersifat polar maka senyawa yang bersifat lebih polar akan lebih cepat keluar dari kolom. Parasetamol cenderung bersifat lebih polar dibandingkan dengan ibuprofen, sehingga parasetamol akan lebih dulu terelusi. Hal ini dikarenakan fase gerak yang digunakan bersifat lebih polar dibandingkan fase diamnya.
tersebut telah memenuhi persyaratan yang ditentukan (lebih dari 1,5) dan peak kedua senyawa runcing (tidak tailing)
N
Gambar 14. Gugus nonpolar parasetamol dan ibuprofen yang akan berinteraksi dengan fase diam
Keterangan : = gugus nonpolar
O
Gambar 15. Interaksi parasetamol dengan fase diam
Si
Gambar 16. Interaksi ibuprofen dengan fase diam
Berdasarkan gambar 16 dan 17, gugus non polar yang terdapat pada parasetamol dan ibuprofen akan berinteraksi dengan fase diam melalui interaksi van der Waals. Dibandingkan parasetamol, ibuprofen memiliki interaksi yang lebih
O
Gambar 17. Interaksi parasetamol dengan fase gerak metanol : aquabidest
CH3
Berdasarkan gambar 17 dan 18, gugus polar dari parsetamol dan ibuprofen akan berinteraksi dengan fase gerak (campuran metanol dan aquabidest). Fase gerak campuran metanol dan aquabidest ini berinteraksi melalui interaksi hidrogen. Fase gerak akan berinteraksi dengan parasetamol dan ibuprofen melalui interaksi hidrogen. Dibandingkan ibuprofen, parasetamol memiliki interaksi yang lebih banyak dengan fase gerak. Hal ini menyebabkan parasetamol akan memiliki waktu retensi yang lebih pendek.
Berdasarkan ketiga kromatogram dapat dilihat bahwa terdapat peak diantara parasetamol dan ibuprofen. Peak tersebut berada diantara menit ke-2 dan ke-3. Peak tersebut dapat berasal dari pelarut yang digunakan karena pada kromatogram metanol, terdapat peak diantara menit ke-2 dan ke-3 . Pada kromatogram sampel, dapat dilihat terdapat peak pada menit ke-4. Peak tersebut dapat dikarenakan adanya bahan-bahan tambahan yang larut dalam metanol, misalnya bahan pewarna. Tablet merk “x” memiliki 2 lapisan warna, yaitu putih dan hijau.
2. Analisis Kuantitatif
Tabel VII . Hasil penetapan kadar campuran parasetamol dan ibuprofen dalam tablet merk
BAB V
KESIMPULAN DAN SARAN
A. Kesimpulan
1. Metode KCKT menggunakan fase gerak campuran metanol:aquabidest (90:10, pH 4,0) dapat digunakan untuk menetapkan kadar campuran parasetamol dan ibuprofen dalam tablet merk ”x”.
2. Kadar parasetamol yang diperoleh adalah 350,411-371,495 mg/tablet dan kadar ibuprofen adalah 195,978-203,428 mg/tablet . Kadar parasetamol dan ibuprofen dalam tablet merk ”x” yang ditetapkan kadarnya dengan metode KCKT menggunakan fase gerak campuran metanol:aquabidest (90:10, pH 4,0) sesuai dengan yang tertera pada label dalam kemasan.
B. Saran
Perlu dilakukan penetapan kadar campuran parasetamol dan ibuprofen dalam tablet merk lain dengan metode KCKT fase terbalik menggunakan sistem yang sama.
DAFTAR PUSTAKA
Allen Jr and Popovich, N .G., 2005, Ansel’s Pharmaceutical Dosage Forms and Drug Delivery Systems, 8th edition, 235, William and Wilkins, Pensylvania. Anonim, 1979, Farmakope Indonesia ed. III, 6-7 , Departemen Kesehatan Indonesia,
Jakarta.
Anonim, 1995, Farmakope Indonesia ed. IV, 4-6, 107, 404, 450, 515, 649, 1009-1011, Departemen Kesehatan Indonesia, Jakarta.
Anonim, 2000, Informatorium Obat Nasional Indonesia 2000, 185, 355, Departemen Kesehatan Republik Indonesia Direktorat Jendral Pengawasan Obat dan Makanan, Jakarta.
Anonim, 2010, Motrin(Ibuprofen) Summary, http://www.druglib.com/druginfo/ diakses tanggal 26 Maret 2010
Ansel, H. C., 1985, Introduction to Pharmaceutical Dosage Forms, diterjemahkan oleh Farida Ibrahim, 244-245, Penerbit Universitas Indonesia, Jakarta. Aulton, M., and Summer, M., 1994, Pharmaceutitics : The Science of Dosage Form
Design, 2nd ed., 305-306, Churchill Living Stone, London.
Battu, P. R., and Reddy, M. S., 2009a, RP-HPLC Method for Simultaneous Estimation of Paracetamol and Ibuprofen in Tablets,
http://www.ajrconline.org/AJRC%20V0l2%20(1)%20PDF%20Final/19.pdf,
diakses tanggal 29 Agustus 2009
Chan, C.C., Lam, H., Lee, Y.C., and Zhang, X., 2004, Analytical Method Validation and Instrument Performance Verification, 16, John Wiley & Sons, Inc., USA.
Christian, 2004, Analytical Chemistry, ed.6, 465, 604, John Willey & Sons, Inc, USA. Clarke, E.G.C., 1969, Isolation and Identification of Drugs, 465, The Pharmaceutical
Press, London.
Gritter, R. J., Bobbit, J. M., and Schwarting, A. E., 1985, Introduction to Chromatography, diterjemahkan oleh Kosasih Padmawinata, Edisi II, 205-219, Penerbit ITB, Bandung.
Johnson,E.L.,and Stevenson, R., 1978, Basic Liquid Chromatography, diterjemahkan oleh Kosasih padmawinata, 6-9, 17-25, 90-91, 99-103, Penerbit ITB, Bandung.
Kazakevich, Y. and Nair, H. M., 1996, Basic Liquid Chromatography Textbook on KCKT, http://KCKT.chem.shu.edu/NEW/KCKT Book. diakses pada 25 Oktober 2009.
Lachman, 1976, Teori dan Praktek Industri Farmasi, Edisi III, 28, 31, 107-113, UI Press, Jakarta.
Mulja, M. dan Suharman, 1995, Analisis Instrumental, 6-11, 26, 31, 34, Universitas Airlangga, Surabaya.
Munson, J.W., 1984, Pharmaceutical Analysis Modern Methods, diterjemahkan oleh Harjana Parwa B, 14-16, Universitas Airlangga Press, Surabaya.
Noegrohati, S., 1994, Pengantar Kromatografi, dalam Noegrohati, S dan Narsito, (Eds.), Risalah Prinsip dan Aplikasi Beberapa Teknik Analisis Instrumental, 16-17, Laboratorium Analisis Kimia dan Fisika Pusat UGM, Yogyakarta. Pescok, R. L., Shields, L.D., and Caims, T., 1976, Modern Methods of Chemical
Analysis, 2nd ed., 51, John Wiley & Sons, Canada.
Prabowo,Y.P., 2009, Optimasi Pemisahan Campuran Parasetamol dan Ibuprofen dengan Metode Kromatografi Cair Kinerja Tinggi Fase Terbalik, Skripsi, Fakultas Farmasi USD, Yogyakarta.
Rohman, A., dan Ganjar, I., G., 2007, Kimia Farmasi Analisis, cetakan kedua, 33, 323-345, Penerbit pustaka Pelajar, Yogyakarta.
Sastrohamidjojo, H., 2002a, Kromatografi, 1, 71-72, Penerbit Liberty, Yogyakarta. Sastrohamidjojo, H., 2002b, Spektroskopi, 11, 22-32, Penerbit Liberty, Yogyakarta. Sevilla, G., C., 1993, Pengantar Metode Penelitian, diterjemahkan oleh Alimuddin
Skoog, D., A., Holler, F.J., and Nieman, T.A., 1998, Principles of Instrumental Analysis, 5th ed., 329-351, Harcourt Bace College, Philadelphia.
Snyder, L.R., Kirkland, J.J., and Glajch, j.L., 1997, Practical HPLC Method Development, 2nd ed., 208-209, 252, Wiley & Sons, Inc., New York.
Voigt, R., 1984, Lehrbuch der Pharmacezeutischen Technologie, diterjemahkan oleh Soendani Noerono, Edisi ke-5, 163-164, Gadjah Mada University Press, Yogyakarta.
Lampiran 3. Data penimbangan baku parasetamol dan ibuprofen 1. Baku parasetamol
Parasetamol (g) Replikasi 1 Replikasi 2 Replikasi 3
Berat kertas 0,367 0,186 0,187
Berat kertas + zat 0,377 0,196 0,197
Berat kertas + zat 0,3771 0,1964 0,1972
Berat kertas + sisa 0,3674 0,1865 0,1870
Berat zat 0,0097 0,0099 0,0102
2. Baku ibuprofen
Ibuprofen (g) Replikasi 1 Replikasi 2 Replikasi 3
Berat kertas 0,376 0,441 0,359
Berat kertas + zat 0,386 0,451 0,369
Berat kertas + zat 0,3859 0,4508 0,3700
Berat kertas + sisa 0,3764 0,4409 0,3599
Lampiran 4. Spektra panjang gelombang pengamatan
Lampiran 8. Kromatogram baku parasetamol 1. Konsentrasi 70 ppm
a. Replikasi 1
b. Replikasi 2
c. Replikasi 3
b. Replikasi 2
3. Konsentrasi 122,5 ppm a. Replikasi 1
c. Replikasi 3
b. Replikasi 2
5. Konsentrasi 157,5 ppm a. Replikasi 1
c. Replikasi 3
b. Replikasi 2
Lampiran 9. Kromatogram baku ibuprofen 1. Konsentrasi 40 ppm
a. Replikasi 1
c. Replikasi 3
b. Replikasi 2
3. Konsentrasi 70 ppm a. Replikasi 1
c. Replikasi 3
b. Replikasi 2
5. Konsentrasi 90 ppm a. Replikasi 1
c. Replikasi 3
b. Replikasi 2
Lampiran 10. Contoh perhitungan resolusi pemisahan campuran parasetamol dan ibuprofen dalam tablet merk “x”
Diketahui : tR parasetamol = 1,681 menit; w1 = 0,216 menit
tR ibuprofen = 2,954 menit; w2 = 0,200 menit
Perhitungan :
Lampiran 11. Kromatogram sampel campuran parasetamol dan ibuprofen dalam tablet merk “x”
1. Kromatogram sampel replikasi 1
3. Kromatogram sampel replikasi 3
5. Kromatogram sampel replikasi 5
7. Kromatogram sampel replikasi 7
9. Kromatogram sampel replikasi 9
Lampiran 12. Contoh perhitungan konsentrasi larutan baku parasetamol 1. Skema pembuatan
Timbang 10 mg parasetamol ↓
Larutkan dalam metanol hingga 10,0 ml ↓
Ambil 0,350; 0,525; 0,615; 0,700; 0,790; dan 0,875; ml ↓
Encerkan dengan metanol dalam labu takar 5,0 ml hingga tanda 2. Perhitungan seri konsentrasi baku parasetamol
Bobot parasetamol = 0,0099 g = 9,9 mg 9,9 mg/10 ml = 990 ppm 0,350 x 990 ppm = C x 5 69,3 ppm
Lampiran 13. Contoh perhitungan konsentrasi larutan baku ibuprofen 1. Skema pembuatan
Timbang 10 mg ibuprofen ↓
Larutkan dalam metanol hingga 10,0 ml ↓
Ambil 0,2; 0,3; 0,35; 0,4; 0,45; dan 0,5 ml ↓
Encerkan dengan metanol dalam labu takar 5,0 ml hingga tanda
2. perhitungan seri konsentrasi baku ibuprofen Bobot parasetamol = 0,0099 g = 9,9 mg
9,9 mg/10 ml = 990 ppm 0,2 x 990 ppm = C x 5
Lampiran 14. Data persamaan kurva baku parasetamol dan ibuprofen 1. Baku parasetamol
Baku Parasetamol
Replikasi 1 Replikasi 2 Replikasi 3
Seri baku
119,31 4606396 121,77 4284769 125,46 3878446
135,8 5323163 138,6 935837 4 142,8 4178335
153,26 6049820 156,42 5328015 161,16 4905496
169,75 7062694 173,25 6050790 178,5 5561752
A -617076,4293 A -72879,6409 A -82861,0823
B 44271,5894 B 35363,5877 B 31223,7678
R 0,998 R 0,997 r 0,992
2.Baku ibuprofen
Baku Ibuprofen
Replikasi 1 Replikasi 2 Replikasi 3
Seri baku
66,5 1153765 69,3 1203848 70,7 1409751
76 1319124 79,2 1336962 80,8 1636694
15. Data penimbangan bobot rata-rata 20 tablet
0,75 2 0,7598 0,7521 0,7576 8
0,7441 0,7528 0,7680 0,7577
0,7373 0,7465 0,7560 0,7484
0,7338 0,7564 0,7557 0,7673
0,74 9 0,7638 3 0,7510 0,7808
Bob t rata-rata tablet = 0,75456o g = 754,56 mg
Penyimpangan 5 % 754,56 ± 37,3718
Penyimpangan
5% = 5/100 x 754,56 = 37,3718 10% =10/100 x 754,56 = 74,7436
an 16 nimba bot pel
Lampir . Data Pe ngan bo sampel No Bobot sam
2 5080306 367,6032 1254746 208,7558 3 4932582 355,1615 1200240 197,3756 4 5143074 372,4725 1201517 199,6558 5 5075995 364,8456 1189869 195,8051
6 4638243 334,8699 1209447 198,1472
7 4990540 366,1665 1201910 201,6904
8 4970894 367,7101 1172583 197,9038
9 5016096 357,5999 1231838 201,3525
10 4922872 359,3850 1198737 199,8022
X 360,9534 X 199,7030
Lampiran 18. Contoh perhitungan kadar parasetamol dan ibuprofen dalam sampel
y = 44271,5894X -617076,4293 ersamaan kurva baku ibuprofen : y = 15948,0014X + 89238,9286
9 Bobot sampel = 100,74
Parasetamol
y = 44271,5894X -617076,4293 50759 44271,5894X -617076,4293 X= 12 942 faktor pengenceran =128 942 /0,44x10/3
54,56/100,74 x 416 = 195, Persamaan kurva baku parasetamol: P
AUC parasetamol 5075995; AUC ibuprofen 118986
95=
8,5 ppm x ,5 ppm x 5
= 48,7099 m K
754,56/100,74 x 48,7099 = 364,8456 mg
ampiran 19. Perhitungan CV parasetamol dan ibuprofen dalam sampel
etamol dan ibuprofen 90-110%
Range kadar yang diperbolehkan 15 mg
Range = 350,4117-371,4951 mg/tablet
Range kadar yang diperbolehkan 90/100 x 200 = 180 mg
roleh = 195,8051 mg
Range = 195,9778-203,4282 mg/tablet = 1,8653
Lampiran 20. Perhitungan range paras 1. Parasetamol
Dalam etiket = 350 mg
90/100 x 350 = 3
110/100 x 350 = 385 mg
BIOGRAFI PENULIS
Penulis skripsi berjudul Penetapan Kadar Campuran Parasetamol Dan Ibuprofen Dalam Tablet Merk “X” Dengan Metode Kromaografi Cair Kinerja Tinggi Fase Terbalik ini memiliki nama lengkap Maria Angelina Ratna Kumalasari Adipranoto. Penulis dilahirkan di Kendal pada tanggal 18 Februari 1989 sebagai anak ketiga dari tiga er ri pasangan Ignatius Antyo Adipranoto dan Suzana Suparyatun. Pendidikan formal yang pernah ditempuh penulis yaitu TK Sanjaya Padma Weleri
Kanisius Brana Weleri (1994-2000); SLTP Kanisius Budi Murni We L Van Lith Muntilan (2003-2006); dan pada tahun 2006 melanjutkan pendidikan di Fakultas Farmasi Universitas Sanata Dharma Yogyakarta. Sel dalam berbagai kegiatan dan organisasi antara lain
seb Farmasi (2007), sekretaris Seminar Aksi
Anti Tem san wisudawan/wisudawati (2007), peserta
dian Masyarakat (2008), Sekretaris PPnEC (2008). Selain itu penulis
jug ten dosen pratikum Kimia Dasar (2008), praktikum
Biofarm
b saudara, da
(1992-1994); SD
leri (2000-2003); SMA P
ama kuliah, penulis aktif
agai sekretaris Tiga Hari Temu Akrab bakau (2007), sekretaris pelepa program Pengab
a pernah menjadi asis