ANALISIS CAMPURAN PARASETAMOL, PROPIFENAZON DAN KAFEIN DALAM TABLET DENGAN METODE KROMATOGRAFI
CAIR KINERJA TINGGI FASE TERBALIK
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Ilmu Farmasi
Oleh:
Happy Suryawan Eko Wardoyo
NIM: 058114011
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
ii
ANALISIS CAMPURAN PARASETAMOL, PROPIFENAZON DAN KAFEIN DALAM TABLET DENGAN METODE KROMATOGRAFI
CAIR KINERJA TINGGI FASE TERBALIK SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Ilmu Farmasi
Oleh:
Happy Suryawan Eko Wardoyo
NIM: 058114011
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
iii
v
Tidak ada masalah yang terlalu besar untuk dihadapi
Tidak ada jalan yang terlalu panjang untuk dijalani
dan tidak ada orang yang terlalu sulit untuk
dihadapi, ketika kita mampu menyikapi setiap
peristiwa yang terjadi dengan hati yang jernih, kepala
dingin dan semangat dari Yesus Kristus.
Kupersembahkan karyaku ini kepada:
vi PRAKATA
Puji syukur penulis panjatkan kepada Allah Bapa di Surga, hanya
karena berkat dan kasih karunia-Nya maka skripsi ini dapat diselesaikan oleh
penulis. Skripsi ini disusun untuk memenuhi salah satu syarat memperoleh gelar
Sarjana Farmasi (S. Farm.) di fakultas Farmasi Universitas Sanata Dharma
Yogyakarta.
Selama penyusunan skripsi ini, banyak pihak yang telah membantu
penulis dalam menyelesaikannya, maka pada kesempatan ini penulis
mengucapkan terima kasih kepada:
1. Ibu Rita Suhadi, M. Si., Apt. selaku Dekan Fakultas Farmasi Universitas
Sanata Dharma Yogyakarta.
2. Ibu Christine Patramurti, M. Si., Apt. selaku pembimbing yang telah banyak
meluangkan waktunya dalam memberikan arahan dan semangat selama
penyusunan skripsi ini.
3. Bapak Jeffry Julianus, M.Si. selaku penguji yang telah meluangkan waktunya
dan memberi banyak masukkan.
4. Ibu Lucia Wiwid Wijayanti, M.Si. selaku penguji yang telah meluangkan
waktunya dan member banyak masukkan.
5. Seluruh staf laboratorium kimia : Mas Bimo, Mas Kunto, Mas Parlan, dan Pak
Kasiran yang telah membantu penulis selama penelitian di laboratorium.
vii
11.Oktaf dan Robby makasih atas bantuannya.
12.Sinta “lele”, Imel, Erlin, Inus, Nikson, Dani, makasih dukungannya.
13.Teman-teman kelompok A2 makasih atas canda tawa dan kebersamaannya.
14.Teman-teman kos makasih atas doa dan bantuannya.
15.Ko Vicky, Arif, makasih atas masukkannya.
16.Teman-teman kelas A dan FST 2005 makasih atas dukungannya, friends
forever.
17.Semua orang yang sudah membantuku dan tidak tertulis di sini, makasih atas
semua bantuannya.
Penulis menyadari bahwa skripsi yang disusun ini masih banyak
memiliki kekurangan. Oleh karena itu penulis mengharapkan kritik dan saran
untuk perbaikan dan perkembangan selanjutnya. Akhir kata, semoga skripsi ini
berguna bagi kemajuan ilmu pengetahuan.
viii
PERSYARATAN KEASLIAN KARYA
Saya menyatakan dengan sesungguhnya bahwa skripsi yang saya tulis
ini tidak memuat karya atau bagian karya orang lai, kecuali yang telah disebutkan
dalam kutipan dan daftar pustaka, sebagaimana layaknya karya ilmiah.
Yogyakarta, 2 Desember 2008
Penulis,
LEMBAR PERNYATAAN PERSETUJUAN
PUBLIKASI KARYA ILMIAH UNTUK KEPENTINGAN AKADEMIS
Yang bertanda tangan di bawah ini, saya mahasiswa Universitas Sanata Dharma :
Nama : Happy Suryawan Eko Wardoyo
Nomor Mahasiswa : 058114011
Demi pengembangan ilmu pengetahuan, saya memberikan kepada Perpustakaan
Universitas Sanata Dharma karya ilmiah saya yang berjudul :
ANALISIS CAMPURAN PARASETAMOL, PROPIFENAZON, DAN KAFEIN
DALAM TABLET DENGAN METODE KROMATOGRAFI CAIR KINERJA
TINGGI FASE TERBALIK
Dengan demikian saya memberikan kepada Perpustakaan Universitas Sanata
Dharma hak untuk menyimpan, mengalihkan dalam bentuk media lain,
mengelolanya dalam bentuk pangkalan data, mendistribusikan secara terbatas, dan
mempublikasikannya di internet atau media lain untuk kepentingan akademis
tanpa perlu meminta ijin dari saya maupun memberikan royalti kepada saya
selama tetap mencantumkan nama saya sebagai penulis.
Demikian pernyataan ini yang saya buat dengan sebenarnya.
Dibuat di Yogyakarta
Pada tanggal 16 Februari 2009
Yang menyatakan
ix INTISARI
Dewasa ini banyak obat analgesik yang beredar di pasaran, terutama dalam bentuk tablet. Obat tersebut biasanya mengandung beberapa campuran zat aktif untuk mendapatkan khasiat yang lebih baik. Beberapa kombinasi campuran zat aktif yang dipakai adalah parasetamol, propifenazon, dan kafein. Belum adanya metode resmi yang cepat dan akurat untuk penetapan kadar parasetamol, propifenazon dan kafein dalam tablet secara simultan. Hal ini yang mendasari penulis untuk melakukan penetapan kadar parasetamol, propifenazon dan kafein dalam tablet secara simultan menggunakan metode Kromatografi Cair Kinerja Tinggi fase terbalik. Tujuan dari penelitian ini adalah untuk mengetahui apakah metode KCKT dapat digunakan dalam penetapan kadar parasetamol, propifenazon dan kafein dalam tablet dan juga mengetahui apakah kadar ketiga zat aktif tersebut sesuai atau tidak dengan kadar yang tertera pada etiket.
Penelitian ini mengikuti jenis dan rancangan penelitian non eksperimental deskriptif , menggunakan metode Kromatografi Cair Kinerja Tinggi (KCKT) fase terbalik dengan kolom C18, fase gerak metanol : akuabides (40 :60), kecepatan alir
2,0 ml/menit dan detektor UV pada panjang gelombang 272 nm.
Dari hasil penelitian ini didapatkan bahwa metode KCKT dapat digunakan untuk menetapkan kadar parasetamol, propifenazon dan kafein dalam tablet. Kadar masing-masing senyawa sesuai dengan yang tertera pada etiket, yaitu untuk parasetamol, propifenazon dan kafein berturut-turut adalah (247,0+9,62) mg/tablet, (146,7+5,50) mg/tablet, dan (52,2+2,07) mg/tablet.
x
ABSTRACT
Nowadays, analgesic medicine have a lot revolves, especially in tablets.
That’s medicines usually contains more than one active compounds to have better virtue. Several active compounds combination are used, there are paracetamol, propyphenazone and caffeine. Determination method of paracetamol, propyphenazone and caffeine in tablet simultaneous which uses according to accurate are not available. It becomes the basic of this research in the determination of paracetamol, propyphenazone and caffeine in tablet with reverse phase High Performance Liquid Chromatography method. The aims from this research are to know whether HPLC method can be used in determining concentration of paracetamol, propyphenazone and caffeine in tablet and to know whether concentration of these three actives compounds suitable with the one which is stamped in the etiquette.
This research is descriptive non experimental research, uses reverse phase High Performance Liquid Chromatography method with C18 column, mobile
phase methanol : aquabidest (40 : 60), flow rate 2,0 ml/minute and UV detector in 272 nm.
The result of this research is reverse phase High Performance Liquid Chromatography method can be used to determination concentration of paracetamol, propyphenazone and caffeine in tablet. The concentration of each compound in tablet should be suitable with the etiquette, that are (247,0+9,62) mg/tablet for paracetamol, (146,7+5,50) mg/tablet for propyphenazone, and (52,2+2,07) mg/tablet for caffeine.
xi
DAFTAR ISI
HALAMAN JUDUL……….……….……….……….……….………. ii
HALAMAN PERSETUJUAN PEMBIMBING……….……….……. iii
HALAMAN PENGESAHAN……….……….……….……….……… iv
HALAMAN PERSEMBAHAN……….……….……….….………… v
PRAKATA……….……….……….……….……….……….….. vi
PERNYATAAN KEASLIAN KARYA……… viii
xii
D. Kafein……….……….……….……….……….……….……… 7
E. Tablet Flu……….……….……….……….……….……….……….. 9
F. Spektrofotometer UV……….……….……….…….………. 10
G. Kromatografi Cair Kinerja Tinggi……….……….…….……… 11
1. Definisi dan instrumentasi……….………….……….………. 11
2. Pembagian jenis kromatografi……….……….……….……… 16
3. Kromatografi partisi……….……….………….……….……….. 17
4. Pemisahan puncak dalam kromatografi……….……….……….. 19
5. Analisis kualitatif dan kuantitatif……….………..……….…………. 26
H. Keterangan Empiris……….……….……….……….……….……… 27
BAB III. METODE PENELITIAN……….……….. 28
A. Jenis dan Rancangan Penelitian……….……….……….……… 28
B. Definisi Operasional……….……….……….……….……….………….. 28
C. Bahan Penelitian……….…….……….……….……….……….……….. 29
D. Alat Penelitian.……….……….……….……….……….………. 29
E. Tata Cara Penelitian………….……….……….……….……….……… 30
1. Pembuatan larutan baku parasetamol….……….……….……… 30
2. Pembuatan larutan baku propifenazon……….……….……….. 31
3. Pembuatan larutan baku kafein……….……….……….……….….. 31
4. Pembuatan fase gerak……….……….……….……….………. 31
5. Optimasi metode KCKT……….……….……….……….………… 32
xiii
F. Analisis Hasil……….……….……….….……….……….……… 33
BAB IV. HASIL DAN PEMBAHASAN……….………….……… 35
A. Pemilihan dan Penyiapan Sampel……….……….……… 35
B. Penyiapan Fase Gerak……….……….……….……….………… 36
C. Pembuatan Larutan Baku……….……….……….……….………….. 37
D. Optimasi Metode……….….……….……….……….………. 38
1. Penentuan panjang gelombang overlapping………..………. 38
2. Pembuatan kurva baku parasetamol, propifenazon dan kafein……….……….……… 45
E. Analisis Kualitatif……….……….……….……….……….………… 51
F. Analisis Kuantitatif……….…….……….……….……….…………. 52
BAB V. KESIMPULAN……….……….……….……… 54
DAFTAR PUSTAKA……….……….….……….……….……….…… 55
LAMPIRAN……….…….……….……….……….……….………….. 57
xiv
DAFTAR TABEL
Tabel I. Karakteristik beberapa pelarut pada HPLC fase
terbalik……….………... 15 Tabel II. Penimbanagan tablet……… 36 Tabel III. Data kurva baku parasetamol……….……….…….………. 48 Tabel IV. Data kurva baku propifenazon……….……….………. 49 Tabel V. Data kurva baku kafein……….……….….……….………. 50 Tabel VI. Data waktu retensi (tR) masing-masing senyawa baku dan
dalam sampel………. 52 Tabel VII. Data kadar parasetamol, propifenazon dan kafein dalam
xv
DAFTAR GAMBAR
xvi
Gambar 17. Spektra serapan parasetamol……….……….……….. 41 Gambar 18. Spekta serapan propifenazon……….……….……… 42 Gambar 19. Spekta serapan kafein……….……….………. 43. Gambar 20. Gabungan spektra serapan maksimum……….……. 44 Gambar 21. Kromatogram campuran baku parasetamol,
propifenazon dan kafein………. 45 Gambar 22. Gugs non polar parasetamol, propifenazon dan kafein. . 46
Gambar 23. Kurva baku parasetamol………. 48 Gambar 24. Kurva baku propifenazon……… 49 Gambar 25. Kurva baku kafein……….. 50 Gambar 26. Kromatogram parasetamol, propifenazon dan kafein
xvii
DAFTAR LAMPIRAN
Lampiran1. Sertifikat analisis parasetamol……….……….…… 58 Lampiran 2. Sertifikat analisis propifenazon……….……….… 59 Lampiran 3. Sertifikat analisis kafein……….……….……….. 61 Lampiran 4. Data penimbanagn bahan……….……….………. 62 Lampiran 5. Kromatogram baku parasetamol……….………… 63 Lampiran 6. Kromatogram baku propifenazon……….……….. 69 Lampiran 7. Kromatogram baku kafein……….……….………. 75 Lampiran 8. Kromatogram parasetamol, propifenazon dan
kafein dalam sampel………... 81 Lampiran 9. Contoh perhitungan kadar larutan baku
parasetamol……….. 82 Lampiran 10. Contoh perhitungan kadar larutan baku
propifenazon……….. 84 Lampiran 11. Contoh perhitungan kadar larutan baku kafein……… 86 Lampiran 12. Contoh perhitungan kadar parasetamol, propifenazon
dan kafein dalam sampel……….……….…………... 88 Lampiran 13. Perhitungan CV parasetamol, propifenazon dan
1
BAB I
PENDAHULUAN
A. Latar Belakang
Dewasa ini banyak obat analgesik yang beredar di pasaran, terutama
dalam bentuk tablet. Obat tersebut biasanya mengandung beberapa campuran zat
aktif untuk mendapatkan khasiat yang lebih baik. Selain itu penggunaan
kombinasi zat aktif bertujuan untuk meminimalisir efek samping dari zat aktif bila
diberikan pada bentuk tunggal dengan dosis yang tinggi untuk mencapai efek
terapi yang diinginkan (Raffa,2006). Beberapa kombinasi campuran zat aktif yang
sering dipakai adalah parasetamol, propifenazon, dan kafein. Contoh obat yang
mengandung ketiga senyawa aktif tersebut adalah Saridon, Bodrex migraine, dan
Paramex. Obat tersebut berkhasiat sebagai analgesik. Dalam percobaan ini
digunakan obat dengan merek “X” yang memiliki kandungan parasetamol,
propipenazon dan kafein dengan perbandingan 5:3:1.
Dalam campuran obat yang mengandung parasetamol, propifenazon dan
kafein diperlukan suatu metode yang dapat digunakan untuk menetapkan kadar
ketiga senyawa tersebut. Suatu metode yang tepat sangat diperlukan untuk
mengontrol kualitas dan mutu suatu obat, dalam hal ini adalah mengetahui jumlah
zat aktif yang sesuai dengan etiket, sehingga dapat diketahui keamanan dari obat
tersebut.
Pada penelitian ini, penulis mengacu dari penelitian Rendy (2008)
secara simultan dengan metode Kromatografi Cair Kinerja Tinggi (KCKT) fase
terbalik. Pada penelitian tersebut telah didapatkan bahwa metode KCKT yang
digunakan telah teruji memiliki validitas yang baik dalam menetapkan kadar
parasetamol, propifenazon dan kafein. Hal ini yang mendasari penulis melakukan
penetapan kadar parasetamol, propifenazon dan kafein dalam produk obat
menggunakan metode KCKT fase terbalik. Produk obat yang digunakan adalah
tablet.
1. Permasalahan
Berdasarkan latar belakang di atas, maka dapat disusun permasalahan
sebagai berikut:
a. Apakah metode KCKT fase terbalik dapat digunakan untuk penetapan kadar
parasetamol, propifenazon dan kafein dalam tablet?
b. Apakah kadar parasetamol, propifenazon dan kafein dalam tablet sesuai
dengan kadar yang tertera pada etiket?
2. Keaslian Penelitian
Metode analisis penetapan kadar parasetamol, propifenazon dan kafein
dalam tablet pernah dilakukan oleh Dimitrovska, dkk dengan metode
kromatografi lapis tipis dan spektrofotometri UV (Dimitrovska et al, 1995).
Namun metode KCKT fase terbalik belum pernah dilakukan untuk penetapan
Penelitian ini mengacu pada penelitian dari Rendy (2008) mengenai optimasi
pemisahan campuran parasetamol, propifenazon dan kafein dengan metode KCKT
fase terbalik.
3. Manfaat Penelitian
Penelitian ini diharapkan dapat bermanfaat sebagai berikut:
a. Manfaat Praktis. Penelitian ini diharapkan dapat mengetahui apakah kadar
parasetamol, propifenazon dan kafein dalam tablet sesuai dengan kadar yang
tertera pada etiket.
b. Manfaat Metodologis. Penelitian ini diharapkan dapat memberikan prosedur
penggunaan metode KCKT dalam penetapan kadar parasetamol, propifenazon dan
kafein dalam tablet.
B. Tujuan Penelitian
Berdasarkan latar belakang dan permasalahan yang ada, maka penelitian
ini bertujuan untuk:
1. Mengetahui apakah metode KCKT fase terbalik dapat digunakan untuk
penetapan kadar parsetamol, propifenazon dan kafein dalam tablet.
2. Mengetahui apakah kadar parasetamol, propifenazon dan kafein dalam tablet
4
BAB II
PENELAAHAN PUSTAKA
A. Tablet
Dalam Farmakope Indonesia (1995) menyebutkan definisi dari tablet
adalah suatu sediaan padat mengandung bahan obat dengan atau tanpa bahan
pengisi. Tablet adalah sediaan obat padat takaran tunggal yang dicetak dari serbuk
kering, Kristal atau granulat yang umumnya dengan penambahan bahan pembantu
yang pembuatannya menggunakan mesin yang sesuai dengan tekanan yang tinggi.
Tablet merupakan bentuk sediaan yang banyak digunakan saat ini. Keuntungan
dari bentuk tablet antara lain adalah relatif murah dan relatif mudah digunakan
pada masyarakat (Voight,1984).
Komponen dalam tablet dibagi menjadi dua, yaitu zat aktif dan eksipien.
Zat aktif dapat terdiri dari satu macam, atau lebih tergantung dari tujuan efek
terapi yang diinginkan. Demikian juga dengan eksipien, dalam sediaan tablet
dapat mengandung berbagai jenis eksipien tergantung dari kebutuhan. Aturan
umum yang harus dipegang adalah antar komponen yang terdapat dalam tablet
tidak boleh terjadi inkompatibilitas baik secara fisika maupun kimia. Eksipien
yang digunakan dalam tablet adalah bahan pengisi, pengikat, penghancur,
lubricant, antiadherent, dan glidant (Sulaiman, 2007).
Tablet dapat berbeda-beda dalam ukuran, bentuk, berat, kekerasan,
ketebalan, daya hancurnya dan dalam aspek lainnya tergantung pada cara
pemberian obat secara oral, dan kebanyakan dari tablet ini dibuat dengan
penambahan zat warna, zat pemberi rasa, dan lapisan-lapisan dalam berbagai
jenis. Tablet lain yang penggunaannya dengan cara sublingual, bukal, atau melalui
vaginal, tidak boleh mengandung bahan tambahan seperti pada tablet yang
diberikan secara oral (Ansel, 1985).
B. Parasetamol
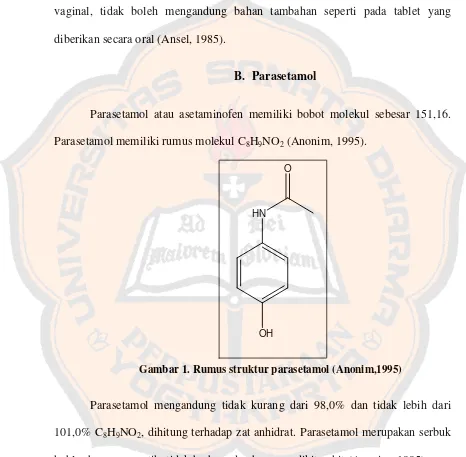
Parasetamol atau asetaminofen memiliki bobot molekul sebesar 151,16.
Parasetamol memiliki rumus molekul C8H9NO2 (Anonim, 1995).
OH HN
O
Gambar 1. Rumus struktur parasetamol (Anonim,1995)
Parasetamol mengandung tidak kurang dari 98,0% dan tidak lebih dari
101,0% C8H9NO2, dihitung terhadap zat anhidrat. Parasetamol merupakan serbuk
hablur berwarna putih, tidak berbau, dan berasa sedikit pahit (Anonim, 1995).
Parasetamol memiliki titik lebur antara 1690C dan 1720C. Satu bagian
parasetamol larut dalam 70 bagian air, 20 bagian air panas, 7 bagian etanol, dan
Parasetamol mempunyai serapan maksimum di daerah ultraviolet. Serapan
jenis parasetamol dalam etanol pada 250,0 nm dengan A
% 1
1cm=913. Serapan jenis
parasetamol dalam metanol pada 250,0nm dengan A
% 1
1cm=900 (Autherhoff,1987).
Parasetamol merupakan derivat asetanilida dengan efek antipiretik yang
telah digunakan sejak tahun 1893. Efek antipiretik ditimbulkan oleh gugus
aminobenzen. Parasetamol juga digunakan sebagai analgesik. Namun penggunaan
parasetamol untuk meredakan demam (antipiretik) tidak seluas penggunaannya
sebagai analgesik. Efek analgesik dari parasetamol yaitu meredakan rasa nyeri
ringan hingga sedang. Dosis oral untuk nyeri dan demam 2- 3 kali sehari 0,5- 1 g,
maksimum 4 g/hari (Tjay dan Rahardja,2002).
Tablet parasetamol mengandung parasetamol tidak kurang dari 90,0% dan
C. Propifenazon
N N
O
Gambar 2. Rumus struktur propifeanzon (Anonim,1989)
Propifenazon atau propilantipirin adalah derivat fenazon tanpa daya
antiradang dengan sifat kurang lebih sama. Risiko agranulositosis lebih ringan.
Dosis penggunaan 1-3 kali sehari 150-300 mg. Umumnya dikombinasi dengan
analgetika lain (Tjay dan Rahardja, 2007).
Propifenazon berbentuk kristal dengan rasa agak pahit. Titik didih 1030C.
mudah larut dalam alkohol dan eter. Kelarutan dalam air sebesar 0,24 g / 100 ml
pada 16,50C (Anonim, 1989).
Tablet propifenazon mengandung propifenazon tidak kurang dari 90,0%
dan tidak lebih dari 110,0% dari jumlah yang tertera pada etiket (Anonim, 1995).
D. Kafein
Kafein merupakan senyawa turunan xantin yang mempunyai nama lain
molekul 194,19 atau hidrat dengan mengandung 1 molekul air dengan bobot
molekul 212,21 (Anonim, 1995). Kafein berupa serbuk putih atau bentuk jarum
mengkilat, biasanya menggumpal, tidak berbau dan berasa pahit. Kafein
mengandung tidak kurang dari 98,5% dan tidak lebih dari 101,0% C8H10N4O2
dihitung terhadap zat anhidrat. Larutan bersifat netral terhadap kertas lakmus
(Anonim,1995).
Gambar 3. Rumus struktur kafein (Anonim,1995)
Kafein memiliki titik lebur antara 2350C dan 2370C. Satu bagian kafein
1cm=470) sedangkan dalam etanol kafein memberikan serapan
maksimum pada panjang gelombang 273 nm (A
% 1
1cm= 519) (Clarke,1969).
Kafein merupakan turunan xantin yang menyebabkan relaksasi otot polos,
terutama otot polos bronkus, merangsang sistem saraf pusat (SSP), otot jantung
dan meningkatkan diuresis. Efek samping dari penggunaan kafein ini berupa
sukar tidur. Kafein biasanya digunakan dengan dosis sebesar 50 mg jika diberikan
bersama dengan analgetik (Tjay dan Rahardja, 2002).
Tablet kafein mengandung kafein tidak kurang dari 90,0% dan tidak lebih
dari 110,0% dari jumlah yang tertera pada etiket (Anonim, 1995).
E. Tablet Flu
Tablet flu sangat banyak beredar di pasaran. Tablet flu biasanya
mengandung lebih dari satu zat aktif. Kombinasi yang ada dalam tablet flu antara
lain adalah analgesik, antipiretik, antihistamin, dekongestan hidung, ekspektoran,
dan antitusif. Tablet flu hanya berfungsi untuk meringankan gejala saja dan tidak
untuk digunakan pada jangka waktu yang panjang (Anonim, 2008).
Tablet flu memiliki kombinasi beberapa zat aktif untuk mendapatkan efek
terapi yang diinginkan, contoh kombinasi zat aktif yang digunakan adalah
parasetamol, propifenazon, dan kafein. Propifenazon umumnya digunakan
bersama analgetika lain dalam hal ini adalah parasetamol untuk mendapatkan efek
terapi yang lebih cepat (Tjay dan Rahardja, 2007).
Tablet flu dapat diperoleh tanpa menggunakan resep dokter karena
merupakan golongan obat bebas. Untuk itu pemilihan tablet flu ini harus
didasarkan pada gejala flu yang timbul. Oleh karena itu perlu diketahui secara
pasti komposisi dari tablet flu agar sesuai dengan gejala flu yang akan diobati
F. Spektrofotometer UV
Spektroskopi adalah salah satu teknik analisis fisiko-kimia yang
mengamati tentang interaksi atom atau molekul dengan radiasi elektromagnetik
(REM). Spektrofotometri ultraviolet adalah salah satu teknik analisis spektroskopi
yang memakai sumber radiasi elektromagnetik ultraviolet dekat (190-380 nm)
dengan memakai instrument spektrofotometer (Mulja dan Suharman, 1995).
Apabila suatu molekul dikenai suatu radiasi elektromagnetik maka akan
terjadi eksitasi ke tingkat energi yang lebih tinggi yang dikenal sebagai orbital
elektron antibonding. Ada empat tipe transisi elektronik yang mungkin terjadi
yaitu δ δ*, n δ*, n π*, dan π π*. Eksitasi elektron (δ δ*
) memberikan
energi yang terbesar dan terjadi pada daerah ultraviolet jauh yang diberikan oleh
ikatan tunggal, misalnya alkana. Eksitasi elektron (π π*
) diberikan oleh ikatan
rangkap dua dan tiga, juga terjadi pada daerah ultraviolet jauh. Eksitasi elektron
(n δ*
) terjadi juga pada gugus karbonil (dimetil keton dan asetaldehid) yang
terjadi pada daerah ultraviolet jauh (Mulya dan Suharman, 1995).
Suatu molekul dapat menyerap radiasi elektromagnetik jika memiliki
kromofor, yaitu gugus penyerap dalam molekul. Molekul yang mengandung
kromofor disebut kromogen. Pada senyawa organik dikenal pula gugus
auksokrom, yaitu gugus yang tidak menyerap radiasi namun bila terikat bersama
kromofor dapat meningkatkan penyerapan oleh kromofor atau mengubah panjang
gelombang serapan maksimum (Christian, 2004).
Spektrofotometer ultraviolet melibatkan energi elektronik yang cukup
banyak untuk analisis kuantitatif dibandingkan kualitatif. Analisis kuantitatif
selalu melibatkan pembacaan absorban radiasi elektromagnetik oleh molekul, atau
radiasi elektromagnetik yang diteruskan yang disebut absorban (A) tanpa satuan
dan transmitan dengan satuan persen (% T). Bouger, Lambert, dan Beer membuat
formula secara matematik hubungan antara transmitan atau absorban terhadap
intensitas radiasi atau konsentrasi zat yang dianalisis dan tebal larutan yang
mengabsorbsi sebagai :
(1)
(2)
Dimana T = persen transmitan
I0 = intensitas radiasi yang datang
It = intensitas radiasi yang diteruskan
= daya serap molar (Lt.mol-1. Cm-1)
C = konsentrasi (mol. Lt-1)
b = tebal larutan (cm)
A = serapan / absorbansi
(Mulya dan Suharman, 1995).
G. Kromatografi Cair Kinerja Tinggi
1. Definisi dan instrumentasi
Kromatografi adalah prosedur pemisahan senyawa campuran berdasarkan
masing-masing senyawa di antara dua fase yang saling bersinggungan dan tidak
saling campur, yang disebut sebagai fase gerak (mobile phase) yang berupa zat
cair atau zat gas dan fase diam (stationary phase) yang berupa zat cair atau zat
padat (Noegrohati, 1994).
Kromatografi Cair Kinerja Tinggi (KCKT) merupakan salah satu metode
kromatografi cair yang fase geraknya dialirkan secara cepat dengan bantuan
tekanan, dan hasilnya dideteksi dengan instrument (Willard, Merriet, Dean, dan
Settle, 1988). Pada mulanya teknik kromatografi ini disebut dengan High
Pressure Liquid Chromatography karena pada instrumen ini terdapat sistem
pompa tekanan tinggi yang mampu mengalirkan fase gerak pada tekanan tinggi
sampai 300 atmosfer dan tekanan pada bagian atas kolom kurang dari 70 atmosfer
(Anonim, 1995). Pada akhir tahun 1970, perkembangan instrumen ini dapat
menghasilkan pemisahan yang baik atau menghasilkan penampilan peak yang
baik sehingga sistem ini lebih dikenal dengan Kromatografi Cair Kinerja Tinggi
(Kromidas, 2000).
KCKT merupakan teknik analisis yang paling sering digunakan dalam
analisis farmasi untuk pemisahan, identifikasi dan determinasi dalam campuran
yang kompleks (Skoog, Holler, dan Nieman, 1998). Peralatan KCKT dapat dilihat
Gambar 4. Peralatan KCKT (Kasakevich dan Nair, 1996)
Ada tiga variabel utama pada sistem KCKT yang harus diperhatikan,
yaitu:
a. Fase gerak
Kemampuan KCKT untuk memisahkan banyak senyawa terutama
tergantung pada keanekaragaman fase gerak. Fase gerak pada KCKT sangat
berpengaruh pada tambatan dan pemisahan senyawa (Munson, 1984). Fase
gerak untuk analisis secara KCKT harus bersifat murni, tanpa cemaran, tidak
bereaksi dengan kemasan, dapat melarutkan cuplikan (solute), viskositas
rendah, memungkinkan memperoleh kembali cuplikan dengan mudah (jika
diperlukan) dan harganya wajar (Johnson dan Stevenson, 1978). Fase gerak
KCKT harus bebas dari gas terlarut karena dapat mempengaruhi respon
detektor sehingga menghasilkan sinyal palsu dan mempengaruhi kolom
(Gritter, Bobbit, dan Schwarting, 1985).
Kepolaran pelarut merupakan ukuran kekuatan pelarut untuk
mengelusi suatu senyawa. Kandungan utama fase gerak pada kromatografi
diubah dengan menambahkan garam untuk menimbulkan pengaruh
penggaraman, asam, basa, dapar untuk melarutkan atau mengendapkan asam
atau basa, pereaksi pengompleks untuk menimbulkan jenis pengaruh pelarutan
yang khas untuk gugus fungsi tertentu atau golongan senyawa tertentu, atau
pelarut organik yang dapat bercampur dengan air. Pemodifikasi organik yang
banyak digunakan adalah metanol, asetonitril dan tetrahidrofuran (Gritter et
al., 1985;Munson, 1984).
Kepolaran pelarut dinyatakan dalam bentuk P’ (indeks polaritas).
Besarnya polaritas campuran pelarut dapat dihitung dengan persamaan
berikut:
P’ = Φa P’a + Φb P’b (3)
Dengan Φa dan Φb adalah fraksi volume pelarut a dan b dalam campuran,
sedangkan P’a dan P’b adalah angka P’ pelarut murni (Gritter et al, 1991).
Berikut adalah beberapa nilai indeks polaritas dari beberapa pelarut yang
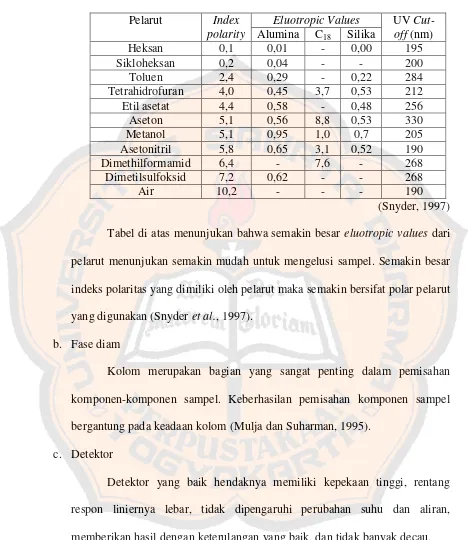
Tabel 1. Karakteristik beberapa pelarut pada HPLC fase terbalik
Pelarut Index polarity
Eluotropic Values UV
Cut-off (nm)
Tabel di atas menunjukan bahwa semakin besar eluotropic values dari
pelarut menunjukan semakin mudah untuk mengelusi sampel. Semakin besar
indeks polaritas yang dimiliki oleh pelarut maka semakin bersifat polar pelarut
yang digunakan (Snyder et al., 1997).
b. Fase diam
Kolom merupakan bagian yang sangat penting dalam pemisahan
komponen-komponen sampel. Keberhasilan pemisahan komponen sampel
bergantung pada keadaan kolom (Mulja dan Suharman, 1995).
c. Detektor
Detektor yang baik hendaknya memiliki kepekaan tinggi, rentang
respon liniernya lebar, tidak dipengaruhi perubahan suhu dan aliran,
memberikan hasil dengan keterulangan yang baik, dan tidak banyak decau.
Secara umum detektor dibagi menjadi 2 kategori, yaitu :
1) Bulk property detectors, merupakan detektor yang mengukur perubahan
sensitif dan menghendaki temperatur yang terkendali. Contoh detektor
jenis ini yaitu detektor indeks bias.
2) Solute property detectors, merupakan detektor yang hanya mengukur sifat
fisik solute. Detektor tipe ini 1000 kali lebih sensitif dan mampu
mengukur solute sampai satuan nanogram atau lebih kecil lagi. Contoh
detektor jenis ini yaitu detektor fluoresensi, detektor penyerapan
(UV-Vis), dan detektor elektrokimia (Munson, 1984; Willard et al.,1988).
2. Pembagian jenis kromatografi
Secara umum kromatografi dapat dibagi menjadi lima jenis, yaitu :
a. Kromatografi cair-cair atau kromatografi partisi
Pada kromatografi partisi, fase diam dapat polar atau non polar. Bila
fase diam polar dan fase gerak non polar disebut kromatografi partisi fase
normal, sedangkan bila fase diam non polar dan fase gerak polar dinamakan
kromatografi partisi fase terbalik (Munson, 1984).
b. Kromatografi adsorpsi
Kromatografi ini menggunakan fase diam padat dan fase gerak cair
atau gas. Solute dapat diadsorpsi pada permukaan partikel padat (Harris,
1999).
c. Kromatografi pertukaran ion
Anion atau kation diikatkan secara kovalen pada fase diam padat,
biasanya resin. Ion-ion solute muatan berlawanan menyerang fase diam
d. Kromatografi eksklusi
Pada kromatografi ini tidak ada interaksi tarik menarik antara fase
diam dan solute. Fase gerak cair atau gas melalui gel berpori. Ukuran pori
cukup kecil untuk mengeluarkan molekul solute yang besar. Molekul solute
yang kecil akan masuk ke dalam pori gel, sedangkan molekul yang besar akan
mengalir tanpa memasuki pori gel (Harris, 1999).
e. Kromatografi afinitas
Digunakan untuk interaksi spesifik antara satu jenis molekul solute dan
sebuah molekul yang lain yang secara kovalen terikat pada fase diam.
Misalnya untuk pemisahan komponen protein (Harris, 1999).
3. Kromatografi partisi
Pada salah satu dari dua fase kromatografi partisi, yaitu fase gerak dan fase
diam harus lebih polar dibanding yang lain. Bila fase diam lebih polar, disebut
kromatografi partisi fase normal. Bila sebaliknya dinamakan kromatografi partisi
fase terbalik. Mekanisme pemisahan pada kromatografi partisi dapat digambarkan
sebagai berikut:
Prinsip kromatografi partisi didasarkan pada partisi solute di antara dua
fase yang tidak saling campur, karena adanya perbedaan koefisien distribusi dari
masing-masing senyawa. Jika solute ditambahkan ke dalam sistem yang terdiri
dari dua pelarut tidak saling campur dan keseluruhan sistem dibiarkan setimbang,
maka solute akan tersebar di antara dua fase menurut persamaan:
(4)
K adalah koefisien distribusi, CS adalah konsentrasi solute dalam fase diam, dan
Cm adalah konsentrasi solute dalam fase gerak (Johnson dan Stevenson, 1978).
Kolom yang biasa digunakan pada kromatografi partisi fase terbalik adalah
kolom dengan kemasan fase terikat yang memiliki sifat stabil karena fase diamnya
terikat secara kimia pada penyangga, sehingga tidak mudah terbawa oleh fase
gerak. Penyangga pada kemasan fase terikat biasanya terbuat dari silica yang
sudah diseragamkan, berpori, dan umumnya partikel mempunyai diameter 3,5
atau 10 µm (Skoog et al., 1998).
KCKT partisi fase terbalik biasanya mengandung bagian organik yang
terikat secara kimia dengan gugus silanol pada permukaan silica. Bagian organik
tersebut umumnya hidrokarbon rantai panjang, sehingga fase gerak umumnya
polar. Gugus silanol permukaan dapat direaksikan dengan berbagai cara untuk
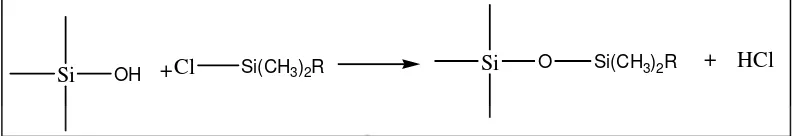
menempelkan berbagai jenis gugus organik. Kemasan fase terikat dengan tipe
ikatan siloksan (Si-O-Si-O) dibuat dengan mereaksikan organoklorosilan dengan
Si OH +Cl Si(CH3)2R Si O Si(CH3)2R + HCl
Gambar 6. Reaksi silanisasi
Reaksi tersebut digunakan untuk membuat isian kolom oktadesilsilan (ODS) dari
gugus silanol dan oktadesilklorosilan sebagai berikut:
Si OH +Cl Si (CH2)17CH3 Si O Si (CH2)17CH3 + HCl
Gambar 7. Reaksi pembuatan kolom oktadesilsilan
Pada kromatografi partisi fase terbalik dengan kemasan fase terikat, R pada
siloksan biasanya berupa gugus C18 atau C8. Panjang pendeknya rantai karbon
mempengaruhi tertambatnya suatu senyawa pada fase diam (Skoog et al., 1998).
4. Pemisahan puncak dalam kromatografi
Keberhasilan atau kegagalan analisis tergantung pada pemilihan kolom
dan kondisi kerja yang tepat. Ukuran kinerja dari kolom dapat dilihat dari
kemampuan kolom dalam memisahkan senyawa. Kolom yang efisien mencegah
pelebaran puncak atau menghasilkan puncak yang sangat sempit (Johnson dan
Stevenson, 1978).
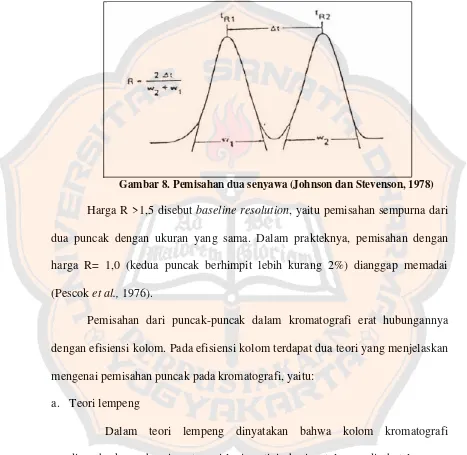
Faktor resolusi adalah ukuran pemisahan dari 2 puncak. Daya pisah, R,
dapat diukur dengan persamaan:
Harga tR2 dan tR1 adalah waktu retensi senyawa, diukur pada titik
maksimum puncak dan Δt adalah selisih antara tR2 dan tR1. Harga w2 dan w1 ialah
lebar alas puncak. Pemisahan dua senyawa dapat digambarkan sebagai berikut:
Gambar 8. Pemisahan dua senyawa (Johnson dan Stevenson, 1978)
Harga R >1,5 disebut baseline resolution, yaitu pemisahan sempurna dari
dua puncak dengan ukuran yang sama. Dalam prakteknya, pemisahan dengan
harga R= 1,0 (kedua puncak berhimpit lebih kurang 2%) dianggap memadai
(Pescok et al., 1976).
Pemisahan dari puncak-puncak dalam kromatografi erat hubungannya
dengan efisiensi kolom. Pada efisiensi kolom terdapat dua teori yang menjelaskan
mengenai pemisahan puncak pada kromatografi, yaitu:
a. Teori lempeng
Dalam teori lempeng dinyatakan bahwa kolom kromatografi
digambarkan sebagai suatu seri lapisan tipis horizontal yang disebut lempeng
teoritis. Setiap molekul analit akan mengalami keseimbangan antara fase diam
dan fase gerak. Pemisahan akan lebih baik jika terjadi keseimbangan
tinggi. Oleh karena itu jumlah teoritis juga dapat digunakan sebagai ukuran
efisiensi kolom (Noegrohati, 1994). Hubungan antara waktu retensi (tR), lebar
alas peak (W), dan jumlah lempeng teoritik (N) dapat dinyatakan dengan
persamaan (Johnson dan Stevenson, 1978; Munson, 1984):
(6)
Bilangan lempeng teoritik (N) berbanding lurus dengan panjang kolom
(L). Karena panjang kolom yang bermacam-macam, maka diperlukan ukuran
koefisien kolom yang tidak tergantung pada panjang kolom. HETP (Height
Equvalent to a Theoritical Plate) atau H merupakan ukuran koefisien kolom
yang lebih disukai karena memungkinkan perbandingan antara kolom yang
panjangnya berlainan, yang dapat diukur dengan persamaan (Munson, 1984):
(7)
b. Teori laju
Teori lempeng hanya menggambarkan laju migrasi secara kuantitatif,
tetapi tidak dapat menggambarkan pengaruh variabel-variabel lain yang
menyebabkan terjadinya pelebaran peak, oleh karena itu perlu diketahui teori
laju. Pada waktu migrasi, solute mengalami transfer antara fase diam dan fase
gerak berkali-kali. Karena solute hanya dapat bergerak jika berada dalam fase
gerak, migrasi di dalam kolom juga tidak teratur, dan mengakibatkan laju
rata-rata solute relatif terhadap fase gerak juga sangat bervariasi, sehingga terjadi
Menurut teori laju ini, efisiensi kolom dinyatakan dengan persamaan
Van Deemter yang dapat dinyatakan sebagai berikut (Willard et al., 1988):
(8)
(9)
Dimana λ = tetapan ukuran ketidakteraturan kemasan
dp = diameter rata-rata partikel penyangga
D = kedifusian linarut dalam fase gerak
k’ = fakor kapasitas
µ = kecepatan alir
γ = factor koreksi kelikuan saluran dalam kolom
Dari persamaan di atas dapat dilihat terdapat tiga variabel yang
mempengaruhi efisiensi kolom, yaitu:
1) Difusi Eddy, yang dinyatakan sebagai A (2λdp). Difusi Eddy
menggambarkan ketidakhomogenannya kecepatan alir dan panjang
lintasan di sekitar partikel yang terpack-ing (Gambar 9). Lintasan alir yang
tidak sama pasti ditemukan dalam kolom terpack-ing. Suatu molekul
solute dapat melewati kolom dekat dinding kolom di mana kerapatan
kolom rendah dengan cepat mencapai akhir kolom, khususnya pada kolom
dengan diameter kecil. Sedangkan suatu molekul solute yang melewati
bagian tengah kolom akan mencapai akhir kolom lebih lambat. Hal ini
menyebabkan perbedaan laju tiap molekul melalui kolom berbeda-beda.
Untuk meminimalkan difusi Eddy ini, maka diameter rata-rata partikel
Gambar 9. Diffusi Eddy (Willard et al., 1988)
2) Difusi longitudinal, Nilai B (2γD/µ) menyatakan efek dari difusi
longitudinal, pergerakan acak dari molekul dalam fase gerak. Pengaruh
difusi longitudinal terhadap ketinggian lempeng menjadi signifikan hanya
pada kecepatan fase gerak yang rendah/lambat. Kecepatan difusi dari
solute yang tinggi pada fase gerak dapat menyebabkan molekul solute
terdispers secara aksial sementara dengan lambat bermigrasi melalui
kolom.
3) Transfer massa Transfer massa dinyatakan dengan nilai Cstasionery dan
Cmobile. Cstasionery merupakan hasil dari ditahannya solute karena adanya fase
diam. Suatu molekul bergerak lambat dalam fase diam, sementara molekul
lainnya melaju melalui kolom bersama dengan fase gerak. Untuk
mengatasi hal ini diperlukan fase diam yang lebih encer (tidak terlalu
Gambar 10. Transfer massa fase diam (Willard et al., 1988)
Cmobile menggambarkan adanya peristiwa dimana solute dalam fase diam
bertemu dengan fase gerak yang masih baru. Hal ini dapat digambarkan
sebagai berikut (Willard et al.,1988):
Gambar 11. Transfer massa fase gerak (Willard et al., 1988)
Pada analisis secara KCKT, kondisi percobaan yang menghasilkan puncak
yang simetris selalu lebih disukai, karena puncak yang asimetris dapat
menghasilkan pengukuran bilangan lempeng teoritik dan faktor resolusi yang
tidak akurat, perhitungan yang tidak teliti, penurunan derajat resolusi dan
puncak-puncak minor yang tidak terdeteksi pada ekor puncak-puncak, serta waktu retensi yang
tidak reprodusibel. Parameter yang digunakan untuk menilai bentuk puncak
adalah peak asymmetry factor (As), yang diukur pada 10% tinggi puncak. Puncak
yang simetri memiliki nilai As sama dengan 1, sedangkan puncak dengan nilai As
digunakan yaitu peak tailing factor, yang diukur pada 5% tinggi puncak (Snyder
et al.,1997).
Gambar 12. Penentuan peak asymmetry dan peak tailing factor (Synder et al., 1997)
Distribusi analit dalam fase gerak dan fase diam pada saat terjadi tailing dan
leading dapat dilihat sebagai berikut:
Gambar 13. Distribusi analit dalam fase gerak dan fase diam (Kuwana, 1980)
Gugus silanol yang tidak bereaksi karena adanya halangan sterik dapat
pada puncak kromatogram. Untuk mengurangi gugus silanol yang masih bebas,
reaksi dianjurkan dengan penambahan trimetilklorosilan yang dapat mencapai
gugus silanol karena ukurannya yang lebih kecil dibanding organoklorosilan yang
lain. Penambahan trimetilklorosilan dapat menutupi banyak gugus silanol yang
masih bebas, namun tidak semua gugus tersebut dapat tertutupi (Skoog et al.,
1998).
Puncak kromatogram yang tidak simetri (tailing dan leading) sering
dijumpai bila konsentrasi solute dalam fase gerak terlalu besar. Senyawa-senyawa
polar juga berpotensi menimbulkan tailing apabila masih terdapat residu gugus
silanol pada fase diam. Penyebab tailing yang lain yaitu ketidaksesuaian antara
solute dan kolom, pengemasan kolom yang tidak seragam, dan faktor yang terjadi
di luar kolom, seperti injektor (Noegrohati, 1994).
5. Analisis Kualitatif dan Analisis Kuantitatif
Waktu tambat atau waktu retensi adalah selang waktu yang diperlukan
oleh linarut (solut) mulai saat injeksi sampai keluar dari kolom dan sinyalnya
ditangkap oleh detektor dan dinyatakan sebagai tR ( Mulya dan Suharman,1995).
Waktu retensi tidak terpengaruh oleh adanya komponen lain (Nair,H.M dan
Bonelli,E.J.,1988).
Analisis kualitatif dilakukan dengan cara membandingkan waktu retensi
senyawa murni dan waktu retensi senyawa yang dimaksud dalam sampel. Respon
yang berupa tinggi peak maupun luas area peak dapat digunakan untuk analisis
H. Keterangan Empiris
Penelitian ini bersifat non eksperimental deskriptif yang bertujuan untuk
mengetahui apakah metode KCKT dapat digunakan untuk menetapkan kadar
parasetamol, propifenazon, dan kafein dalam tablet, serta untuk mengetahui
apakah kadar parasetamol, propifenazon, dan kafein dalam tablet sesuai dengan
28
BAB III
METODE PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian ini mengikuti jenis dan rancangan penelitian non eksperimental
deskriptif karena tidak ada perlakuan terhadap subyek uji.
B. Definisi Operasional
1. Parasetamol, propifenazon, dan kafein yang ditetapkan kadarnya adalah
parasetamol, propifenazon dan kafein yang terkandung dalam tablet merek
“X”.
2. Tablet yang dianalisis adalah tablet merek “X” yang mencantumkan
kandungan parasetamol, propifenazon, dan kafein pada kemasannya dengan
perbandingan 5:3:1, yang memiliki nomor produksi yang sama.
3. Sistem Kromatografi Cair Kinerja Tinggi (KCKT) fase terbalik yang
digunakan adalah seperangkat alat KCKT dengan fase diam kolom reserved
phase C18 dan fase gerak campuran metanol dan aquabides.
4. Kadar parasetamol, propifenazon dan kafein dalam tablet ditetapkan dengan
C. Bahan Penelitian
Bahan yang digunakan dalam penelitian adalah parasetamol kualitas
working standar (Wenzhou Pharmaceutical Factory), propifenazon kualitas
working standar (Vani Chemicals & Intermediates Limited), kafein kualitas
working standar (Brataco Chemika), metanol p.a. (E. Merck), aquabides
(Laboratorium Kimia Organik Fakultas Farmasi Universitas Sanata Dharma), dan
tablet merek “X” dengan nomor produksi yang sama.
D. Alat –Alat
Alat – alat yang digunakan dalam penelitian ini adalah :
1. Spektrofotometer UV/Vis merek Perkin-Elmer Lamda 20
2. Kuvet UV
3. Seperangkat KCKT yang terdiri dari :
a. Pompa merek Shimadzu LC-10 AD No. C20293309457 J2
b. Detektor UV Vis merek Shimadzu SPD 10 AV No. C20343503697
KG.
c. CBM 101 merek Shimadzu No. C50363502311
d. Seperangkat komputer merek ACER
e. Printer merek Hewlett Packard Deskjet 670 C
f. Injektor jenis katup suntik model 77251
g. Kolom C-18 merek DuPont Instruments Zorbax 4,6 mm x 25 cm
P.N.880952-702
5. Alat degassing ultrasonic merek Retsch tipe T640 No. 935922013
6. Penyaring Whatmann anorganik dan organik
7. Membran filter
8. Neraca analitik merek Scaltec SBC 22
9. Vakum merek Gast model DOA-P104-BN
10.Milipore
11. Mikropipet
12.Seperangkat alat gelas
E. Tata Cara Penelitian
1. Pembuatan Larutan Baku Parasetamol
a. Pembuatan Larutan Baku Induk Parasetamol. Lebih kurang 50 mg
baku parasetamol yang ditimbang seksama dilarutkan dalam metanol sampai 10
ml.
b. Pembuatan Seri Larutan Baku Parasetamol. Larutan baku induk
parasetamol dari langkah di atas dipipet 125 µl; 250 µl; 375 µl; 500 µl; 625 µl dan
750 µl dan dimasukkan dalam labu ukur 10 ml dan diencerkan dengan metanol
hingga tanda sehingga didapatkan konsentrasi 62,5 ppm; 125,0 ppm; 187,5 ppm;
2. Pembuatan Larutan Baku Propifenazon
a. Pembuatan Larutan Baku Induk Propifenazon. Lebih kurang 30 mg
baku propifenazon yang ditimbang seksama dilarutkan dalam metanol sampai 10
ml.
b. Pembuatan Seri Larutan Baku Propifenazon. Larutan baku induk
propifenazon dari langkah di atas dipipet 125 µl; 250 µl; 375 µl; 500 µl; 625 µl
dan 750 µl dan dimasukkan dalam labu ukur 10 ml dan diencerkan dengan
metanol hingga tanda sehingga didapatkan konsentrasi 37,5 ppm; 75,0 ppm; 112,5
ppm; 150,0 ppm; 187,5 ppm; dan 225,0 ppm.
3. Pembuatan Larutan Baku Kafein
a. Pembuatan Larutan Baku Induk Kafein. Lebih kurang 10 mg baku
kafein yang ditimbang seksama dilarutkan dalam metanol sampai 10 ml.
b. Pembuatan seri larutan baku kafein. Larutan baku induk kafein dari
langkah di atas dipipet 125 µl; 250 µl; 375 µl; 500 µl; 625 µl dan 750 µ l dan
dimasukkan dalam labu ukur 10 ml dan diencerkan dengan metanol hingga tanda
sehingga didapatkan konsentrasi 12,5 ppm; 25,0 ppm; 37,5 ppm; 50,0 ppm; 62,5
ppm; dan 75,0 ppm.
4. Pembuatan Fase Gerak
Fase gerak yang digunakan dalam penelitian ialah menggunakan campuran
metanol dan aquabides dengan perbandingan 40:60. Fase gerak dibuat sesuai
penyaring Whatmann anorganik dengan bantuan pompa vakum. Fase gerak
kemudian di degassing selama 15 menit.
5. Optimasi metode KCKT
a. Penentuan panjang gelombang overlapping dengan spektrofotometri
UV. Lebih kurang 10 mg baku parasetamol, propifenazon, dan kafein yang
ditimbang seksama dilarutkan dengan metanol hingga 10 ml. Larutan tersebut
diencerkan hingga konsentrasi 10 ppm untuk tiap zat dan dibaca absorbansinya
pada panjang gelombang 200 – 300 nm dengan spektrofotometer UV.
Berdasarkan kurva panjang gelombang vs absorbansi parasetamol, propifenazon,
dan kafein yang diperoleh, diamati dan ditentukan panjang gelombang
pengamatannya..
b. Pembuatan kurva baku parasetamol, propifenazon dan kafein. Seri
konsentrasi larutan baku parasetamol, propifenazon, dan kafein dari langkah no. 1
yang telah disaring dengan penyaring milipore dan degasing selama 15 menit
diinjeksikan pada sistem KCKT dengan fase gerak metanol : aquabides dengan
rasio 40 : 60 dan flow rate 2 ml/menit. Diamati peak yang muncul dan AUC (Area
Under Curve) dari tiap peak yang muncul. Lalu, ditentukan persamaan regresi
linear antara konsentrasi tiap analit terhadap AUC.
6. Pembuatan larutan sampel
Sebanyak dua puluh tablet yang memiliki nomor produksi sama ditimbang
tiap tablet kemudian dihitung bobot rata- ratanya. Tablet digerus dan ditimbang
mg propifenazon, dan 10 mg kafein. Serbuk sampel dilarutkan dalam 10 ml. Dari
larutan sampel dipipet 500 μl dan diencerkan dengan metanol hingga didapatkan
volume 10 ml. Saring dengan millipore dan degassing selama 15 menit.
7. Penetapan kadar parasetamol, propifenazon dan kafein dalam sampel
Larutan sampel diinjeksikan dalam injector port dengan menggunakan
KCKT syringe dengan fase diam kolom reverse phase C18, fase gerak metanol
dan aquabides dengan perbandingan 40:60 dan flow rate 2 ml/menit. Amati
kromatogram yang dihasilkan. Dengan memasukan harga AUC sampel dalam
masing- masing persamaan kurva baku parasetamol, propifenazon dan kafein
sehingga didapatkan kadar parasetamol, propifenazon dan kafein dalam sampel.
Kemudian data disajikan dalam bentuk X+SD dengan satuan mg/tablet.
F. Analisis Hasil
Analisis yang dilakukan dalam penelitian ini adalah:
1. Analisis kualitatif
Analisis kualitatif dilakukan dengan membandingkan waktu retensi (tR)
yang didapatkan dalam sampel dengan waktu retensi (tR) senyawa baku.
2. Analisis kuantitatif
Analisis kuantitatif yang dilakukan adalah penetapan kadar dari
parasetamol, propifenazon dan kafein berdasarkan analisis data AUC sampel dan
X+SD dengan satuan mg/tablet yang kemudian dibandingkan dengan yang tertera
pada etiket, apakah kadarnya sudah sesuai dengan yang tertera pada etiket atau
35
BAB IV
HASIL DAN PEMBAHASAN
A. Pemilihan dan Penyiapan Sampel
Pada penelitian ini yang digunakan sebagai sampel adalah tablet dengan
merek “X” yang beredar di Yogyakarta. Pemilihan sampel ini didasarkan pada
obat yang mencantumkan komposisi zat aktifnya berupa parasetamol,
propifenazon dan kafein. Di masyarakat terdapat beberapa obat yang mengandung
ketiga zat aktif tersebut, tetapi dengan jumlah yang berbeda. Pada penelitian ini
digunakan sampel dengan merek “X” yang memiliki perbandingan kadar
parasetamol, propifenazon dan kafein 5:3:1. Sampel yang digunakan adalah tablet
merek “X” karena pada tablet merek lain mengandung zat aktif yang berbeda.
Selain itu tablet merek “X” juga banyak digunakan di pasaran karena memiliki
efek terapi yang cepat. Sediaan yang memenuhi batasan tersebut hanya ada satu
produk, sehingga penulis hanya menggunakan satu produk sebagai sampel.
Pemilihan sampel yang dilakukan adalah pemilihan sediaan dengan merek
“X” yang memiliki nomor produksi yang sama. Dari kemasan diambil 20 tablet
obat ditimbang tiap tablet kemudian dihitung bobot rata-ratanya. Penimbangan
dilakukan tiap tablet dimaksudkan untuk mengetahui ada tidaknya tablet yang
memiliki bobot menyimpang jauh dari bobot rata-ratanya. Bobot rata-rata tablet
lebih dari 300 mg tidak boleh lebih dari 2 tablet yang menyimpang dari bobot
rata-ratanya sebesar 5%, dan tidak satu tabletpun yang boleh menyimpang dari
bobot rata-ratanya sebesar 10%. Hasil penimbangan tablet dapat dilihat pada
Tabel II. Penimbangan tablet
sebesar 10% dari bobot rata-ratanya. Pada penelitian ini dilakukan replikasi
sebanyak 5 kali.
B. Penyiapan Fase Gerak
Pemilihan fase gerak dan fase diam dalam penelitian ini mengacu pada
penelitian Rendy (2008) mengenai optimasi penetapan kadar campuran
parasetamol, propifenazon dan kafein dengan metode KCKT yang telah terbukti
memiliki validitas yang baik.
Fase gerak yang digunakan pada penelitian ini adalah campuran antara
bersifat polar, sedangkan fase diam yang digunakan adalah kolom C18 yang
bersifat non polar sehingga sistem kromatografi yang digunakan adalah
kromatografi partisi fase terbalik. Pada penelitian ini tidak digunakan etanol tetapi
digunakan metanol karena metanol dapat melarutkan ketiga komponen tersebut
dan memiliki viskositas yang lebih rendah dari etanol sehingga dapat mengurangi
tekanan pada kolom dan meningkatkan efisiensi kolom untuk memisahkan
komponen campuran.
C. Pembuatan Larutan Baku
Larutan baku dibuat dengan konsentrasi tertentu dan menggunakan
metanol p.a sebagai pelarut. Penggunaan metanol didasarkan pada kelarutan
ketiga komponen yang akan diuji. Selain itu syarat pelarut yang dapat digunakan
dalam sistem KCKT adalah pelarut yang kemurniannya tinggi, dapat bercampur
dengan fase gerak dan mudah terelusi.
Larutan baku dibuat dalam 6 seri konsentrasi untuk tiap komponen yang
diuji. Konsentrasi untuk parasetamol adalah 62,74 ppm; 125,48 ppm; 188,21 ppm;
250,95 ppm; 313,69 ppm dan 376,43 ppm. Konsentrasi untuk propifenazon adalah
37,55 ppm; 75,10 ppm; 112,65 ppm; 150,20 ppm; 187,75 ppm dan 225,30 ppm
sedangkan konsentrasi kafein adalah 11,20 ppm; 22,40 ppm; 33,60 ppm; 44,80
ppm; 56,00 ppm dan 67,20 ppm. Pemilihan seri konsentrasi kurva baku ini
dimaksudkan agar kadar yang terdapat dalam sampel berada dalam rentang seri
konsentrasi larutan baku yang digunakan sehingga persamaan kurva baku yang
D. Optimasi Metode 1. Penentuan panjang gelombang overlapping
Penentuan panjang gelombang overlapping dimaksudkan untuk
mengetahui panjang gelombang di mana parasetamol dan propifenazon masih
dapat memberikan serapan serta mengetahui panjang gelombang kafein yang
dapat memberikan serapan optimal. Sebelum menentukan panjang gelombang
overlapping, panjang gelombang serapan maksimum dari masing-masing senyawa
harus ditentukan terlebih dulu. Hal ini bertujuan untuk mendapatkan panjang
gelombang masing-masing senyawa dalam metanol yang menunjukan serapan
maksimum.
Penentuan panjang gelombang serapan maksimum dilakukan
menggunakan kadar 1 mg% karena kadar tersebut lebih kecil dari kadar kafein
pada pembuatan kurva baku, sehingga untuk memastikan kadar kafein yang
terkecil tetap dapat terdeteksi. Pembacaan serapan dilakukan pada rentang
panjang gelombang antara 200-300 nm karena parasetamol, propifenazon dan
kafein memiliki panjang gelombang serapan maksimum pada rentang tersebut.
Senyawa yang diukur secara spektrofotometri ultraviolet harus memiliki
gugus kromofor dalam strukturnya agar dapat menyerap radiasi ultraviolet.
Penyerapan sinar radiasi oleh suatu senyawa tergantung pada struktur elektronik
dari senyawa tersebut. Pada gugus kromofor yang dimiliki oleh parasetamol,
propifenazon dan kafein terdapat ikatan rangkap yang mengandung elektron π
yang bila dikenai sinar radiasi elektromagnetik akan mudah tereksitasi ke tingkat
yang lebih tinggi yaitu π*
yang langsung terikat pada gugus kromofor. Gugus auksokrom memiliki pasangan
elektron bebas pada orbital n yang dapat berinteraksi dengan elektron π pada
gugus kromofor sehingga dengan adanya auksokrom ini akan mengubah panjang
gelombang serta intensitas serapan maksimum dari senaywa. Gambar gugus
kromofor dan auksokrom masing-masing senyawa dapat dilihat pada gambar
berikut.
OH HN
O
Gambar 14. Gugus kromofor dan auksokrom parasetamol
Keterangan: = auksokrom
N N O
Gambar 15. Gugus kromofor dan auksokrom propifenazon
Keterangan : = auksokrom
= kromofor
N
N
N
N O
O
Gambar 16. Gugus kromofor kafein
Keterangan : = kromofor
= aukskrom
Dalam Farmakope Indonesia edisi IV (1995) disebutkan bahwa pengujian
panjang gelombang serapan maksimum mempunyai makna jika serapan
teoritis. Serapan yang dihasilkan pada masing-masing senyawa dapat dilihat pada
gambar berikut.
Gambar 17. Spektra serapan parasetamol (λmaks= 248 nm)
Berdasarkan gambar tersebut dapat dilihat bahwa parasetamol memberikan
serapan maksimum pada panjang gelombang 248 nm. Sedangkan parasetamol
memiliki panjang gelombang serapan maksimum teoritis pada 249 nm. Dalam
penelitian ini terdapat pergeseran panjang gelombang serapan maksimum, namun
penyimpangan ini masih memnuhi syarat yang tercantum dalam Farmakope
Indonesia edisi IV sehingga dapat dipastikan senyawa tersebut adalah
Gambar 18. Spektra serapan propifenazon (λmaks= 247 dan 274 nm)
Berdasarkan gambar tersebut dapat dilihat bahwa propifenazon
memberikan serapan maksimum pada panjang gelombang 247 dan 274 nm.
Propifenazon dalam etanol memiliki panjang gelombang serapan maksimum pada
248 nm dan 277 nm. Pada pembacaan serapan maksimum ini terdapat
penyimpangan sebesar 3 nm. Hal ini dapat dikarenakan pada penelitian digunakan
Gambar 19. Spektra serapan kafein (λmaks= 272 nm)
Berdasarkan gambar tersebut dapat dilihat bahwa kafein memberikan
serapan maksimum pada panjang gelombang 272 nm. Kafein dalam etanol
memiliki panjang gelombang serapan maksimum pada 273 nm. Dalam penelitian
ini terjadi pergeseran panjang gelombang serapan maksimum namun
penyimpangan ini masih memenuhi persyaratan yang tercantum dalam Farmakope
Indonesia edisi IV. Hal ini membuktikan bahwa senyawa tersebut adalah kafein.
Analisis tidak dilakukan pada panjang gelombang serapan maksimum
salah satu senyawa karena hanya sensitif terhadap perubahan konsentrasi senyawa
yang bersangkutan. Karena hal tersebut diperlukan panjang gelombang
dihasilkan kemudian ditumpang tindihkan, dan didapatkan gambar sebagai
berikut.
Gambar 20. Gabungan spektra serapan maksimum parasetamol (---), propifenazon (---), dan kafein (---)
Dari gambar tersebut, dipilih panjang gelombang overlappingnya, yaitu
272 nm. Panjang gelombang ini dipilih dengan alasan agar kafein dalam sampel
yang memiliki kadar paling kecil dapat tetap terdeteksi. Pada panjang gelombang
ini serapan kafein cukup optimal, sedangkan untuk serapan parasetamol dan
propifenazon kurang optimal namun tetap dapat terdeteksi karena konsentrasinya
2. Pembuatan kurva baku parasetamol, propifenazon dan kafein
Tiap konsentrasi larutan baku parasetamol, propifenazon dan kafein
diinjeksikan pada KCKT dengan fase diam C18, fase gerak metanol : air dengan
perbandingan 40:60, menggunakan flow rate 2 ml/menit diukur pada panjang
gelombang 272 nm.
Dengan menggunakan sistem kromatografi di atas, didapatkan
kromatogram campuran baku parasetamol, propifenazon dan kafein adalah seperti
pada gambar berikut.
Parasetamol Kafein
Propifenazon
Gambar 21. Kromatogram campuran baku parasetamol, propifenazon dan kafein (5:3:1)
Pada kromatogram tersebut terlihat adanya perbedaan waktu retensi (tR)
tiap senyawa. Waktu retensi adalah waktu yang dibutuhkan suatu senyawa untuk
keluar dari kolom. Dari gambar dapat dilihat bahwa waktu retensi parasetamol
menit. Perbedaan waktu retensi tiap senyawa dipengaruhi oleh interaksi
masing-masing senyawa dengan fase diam dan fase geraknya. Tiap senyawa memiliki sisi
polar dan non polar pada strukturnya. Pada penelitian ini, fase diam yang
digunakan bersifat non polar, sedangkan fase geraknya bersifat polar. Karena hal
itu, maka senyawa yang cenderung non polar akan lebih lama keluar dari kolom
atau memiliki waktu retensi yang lebih besar. Interaksi senyawa dengan fase diam
terjadi pada bagian senyawa yang non polar. Gugus non polar dari masing-masing
senyawa dapat dilihat pada gambar berikut.
OH
Gambar 22. Gugus non polar pada parasetamol (A), propifenazon (B) dan kafein (C)
Keterangan : = gugus non polar
Dari gambar tersebut dapat dilihat bahwa propifenazon memiliki gugs non
polar yang paling banyak. Hal inilah yang menyebabkan propifenazon akan lebih
lama tertahan pada fase diam daripada parasetamol dan kafein. Pada kromatogram
yang dihasilkan didapatkan propifenazon memiliki waktu retensi yang paling
besar daripada senyawa lainnya. Parasetamol memiliki gugus non polar yang
paling sedikit, hal inilah yang menyebabkan parasetamol memiliki waktu retensi
lebih banyak dari parasetamol dan lebih sedikit dari propifenazon sehingga kafein
tertambat pada kolom dengan waktu yang lebih lama dari parasetamol tetapi lebih
cepat dari propifenazon.
Penentuan persamaan kurva baku untuk masing-masing senyawa
dilakukan 3 kali replikasi. Persamaan kurva baku menyatakan hubungan linier
antara konsentrasi dengan AUC yang dihasilkan. Sebagai parameter linieritasnya
digunakan koefisien korelasi (r). Koefisien korelasi menunjukan korelasi antara
konsentrasi dengan AUC. Dalam penelitian ini, dari 3 kali replikasi dipilih salah
satu replikasi yang kemudian digunakan sebagai data kurva baku. Pemilihan data
kurva baku ini didasarkan pada nilai r yang digunakan, yaitu nilai r yang lebih
besar dari nilai r tabel untuk enam data dengan derajat bebas (db) = 4. yaitu
sebesar 0,917 ( pada taraf kepercayaan 99%). Selain itu pemilihan data kurva
baku juga didasarkan pada nilai SE (standard error) yaitu nilai SE yang paling
kecil karena semakin kecil SE maka kesalahan yang terjadi dalam penelitian juga
semakin kecil. Persamaan untuk masing-masing baku parasetamol, propifenazon
Tabel II. Data kurva baku parasteamol
Replikasi 1 Replikasi 2 Replikasi 3
C (ppm) AUC C (ppm) AUC C (ppm) AUC
63,05 433277 62,24 375404 62,74 363578 126,10 782447 124,48 736919 125,48 744345 189,15 1158864 186,71 1148448 188,21 1138321 252,20 1645115 248,95 1555291 250,95 1521173 315,25 2030640 311,19 1979372 313,69 1905797 378,30 2514297 373,43 2323369 376,43 2260491
B = 6632,35 B = 6369,16 B = 6080,56 A = -36153 A = -34268,87 A = -12893,13
r = 0,9986 r= 0,9996 r = 0,9999 y=6080,56x-12893,13 SE = 47038,95 SE = 23093,16 SE = 11593,81
Keterangan : merupakan data kurva baku yang digunakan
Gambar 23. Kurva baku parasetamol
Tabel III. Data kurva baku propifenazon
Replikasi 1 Replikasi 2 Replikasi 3
C (ppm) AUC C (ppm) AUC C (ppm) AUC
37,55 534864 37,16 584806 36,95 426220 75,10 908171 74,33 880325 73,90 815260 112,65 1297158 111,49 1349126 110,85 1250126 150,20 1760441 148,65 1852736 147,80 1710807 187,75 2230475 185,81 2159391 184,75 2264568 225,30 2653911 222,98 2706848 221,70 2829904
B = 11432,70 B = 11494,70 B = 13011,42
Keterangan : merupakan data kurva baku yang digunakan
Gambar 24. Kurva baku propifenazon