POTENSI LEUKEMIA INHIBITORY FACTOR DALAM
PENINGKATAN KEMAMPUAN CONDITIONED MEDIUM
UNTUK PENGARAHAN EMBRYONIC STEM CELLS
MENCIT MENJADI CARDIOMYOCYTE
DWI AGUSTINA
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa tesis Potensi Leukemia Inhibitory Factor Dalam Peningkatan Kemampuan Conditioned Medium Untuk Pengarahan
Embryonic Stem Cells Mencit Menjadi Cardiomyocyte adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, September 2009
ABSTRACT
DWI AGUSTINA. The Potency of Leukemia Inhibitory Factor in Increasing the Ability of Conditioned Medium to Promote Mouse Embryonic Stem Cells into Cardiomyocyte. Under Direction of ITA DJUWITA and ADI WINARTO.
Embryonic stem cells (ESC) are self-renewing and pluripotent cells derived from the inner cell mass of blastocyst stage embryo that capable to differentiate into all type of cells including cardiomyocyte (cardiac muscle cell). Recently, there are several published methods to increase the number of cardiomyocyte differentiated from mouse ESC. In the present study, we examined the effect of conditioned medium (CM) collected from cardiomyocyte primary cultured of neonatal mouse modified with leukemia inhibitory factor (LIF), designed as CML, on the differentiation of mouse ESC toward cardiomyocyte. The media tested were: (1) DMEM, (2) DMEM+CML0, and (3)
DMEM+ CML10, with the ratio of DMEM and CML was 1:1. The three media
were tested on to ESC colonies, each consisting of 8 colonies. Differentiation of ESC into cardiomyocyte were indicated by: (1) the presence of beating area in ESC colonies, and (2) the genes expression of Nkx2.5 and -MHC in cardiomyocyte differentiated from ESC. The results of these research showed that: (1) ESC colony treated with DMEM+CML10 showed the number of
cardiomyocyte-like cells (indicated by beating area) was higher than the DMEM+CML0 and DMEM (P<0.05); and (2) both CML0 and CML10 increased
the mRNA band intensity of Nkx2.5 and -MHC genes. In conclusion, LIF supplemented in the cardiomyocyte primary cultured of neonatal mouse increased the potency of CM to promote ESC into cardiomyocyte.
DWI AGUSTINA. Potensi Leukemia Inhibitory Factor Dalam Peningkatan Kemampuan Conditioned Medium Untuk Pengarahan Embryonic Stem Cells
Mencit Menjadi Cardiomyocyte. Dibimbing oleh ITA DJUWITA dan ADI WINARTO.
Penggunaan sel punca atau stem cell sebagai terapi sel terhadap penyakit degeneratif seperti myocardial infarction, yang diakibatkan oleh rusaknya
cardiomyocyte atau sel otot jantung, telah mulai dikembangkan. Sel punca atau
stem cell adalah salah satu alternatif yang dapat digunakan untuk terapi sel yang mengalami kerusakan tersebut. Sel punca merupakan sel-sel yang belum berdiferensiasi serta memiliki kemampuan untuk berproliferasi dan berdiferensiasi menjadi berbagai tipe sel dengan fungsi yang lebih spesifik. Salah satu jenis sel punca yang sering digunakan untuk penelitian biomedis adalah embryonic stem cells, merupakan sel punca yang berasal dari inner cell mass (ICM) embrio tahap blastosis. Setelah dikultur dan dikembangkan pada kondisi yang sesuai, ICM akan menghasilkan sel punca yang dapat berdiferensiasi menjadi semua tipe sel tubuh, termasuk menjadi cardiomyocyte.
Penggunaan sel punca untuk mengatasi kerusakan cardiomyocyte telah dilaporkan keberhasilannya pada beberapa hewan coba yang mengalami
myocardial infarction. Namun perlu dilakukan suatu metode untuk mendapatkan
cardiomyocyte dalam jumlah yang banyak dari hasil pengarahan ESC tersebut. Beberapa metode telah dilakukan untuk meningkatkan pengarahan ESC mencit menjadi cardiomyocyte, antara lain dengan penambahan faktor pertumbuhan, dan atau penggunaan conditioned medium (CM). Penggunaan CM tersebut pada kultur pengarahan ESC telah dilaporkan dapat meningkatkan jumlah
cardiomyocyte yang terbentuk, karena di dalam CM terdapat faktor pertumbuhan (protein) serta lingkungan kultur primer yang mendukung pengarahan ESC menjadi cardiomyocyte. Penambahan faktor pertumbuhan pada kultur primer
cardiomyocyte untuk memproduksi CM telah dilakukan untuk meningkatkan kemampuan dari CM untuk pengarahan ESC menjadi cardiomyocyte, sehingga jumlah cardiomyocyte yang didapatkan akan lebih meningkat. Salah satu alternatif faktor pertumbuhan yang bisa ditambahkan pada kultur primer
cardiomyocyte adalah leukemia inhibitory factor (LIF). Leukemia inhibitory factor merupakan sitokin yang telah terbukti memiliki pengaruh positif terhadap perkembangan sel cardiomyocyte pada kultur primer melalui 3 lintasan sinyal transduksi yang dipicu oleh aktivasi gp130. Namun perlu dilakukan pembuktian terhadap kemampuan CM, yang diproduksi dari kultur primer cardiomyocyte yang telah diinduksi LIF, dalam pengarahan ESC menjadi cardiomyocyte.
Pada penelitian ini diproduksi CM dari kultur primer cardiomyocyte
neonatal yang diinduksi dengan LIF. Kemudian dilihat kemampuan CM tersebut dalam pengarahan ESC menjadi cardiomyocyte. Adapun medium perlakuan dalam penelitian ini adalah: (1) DMEM+CML10, (2) DMEM+CML0, dan (3)
medium kultur primer cardiomyocyte yang diinduksi dengan 10 ng/mlLIF; CML0
berasal dari medium kultur primer cardiomyocyte tanpa induksi LIF. Ketiga medium perlakuan tersebut diberikan pada saat pengarahan ESC menjadi
cardiomyocyte. Parameter yang diamati adalah tingkat diferensiasi (pengarahan) ESC menjadi cardiomyocyte dengan cara pengamatan langsung terhadap jumlah area berdenyut setelah hari ke-7 kultur diferensiasi hingga hari ke-14 serta kemampuan ekspresi Nkx2.5 dan -MHC dari cardiomyocyte hasil pengarahan ESC, yang dilihat secara kualitatif dari intensitas pita mRNA hasil RT-PCR pada gel agarose.
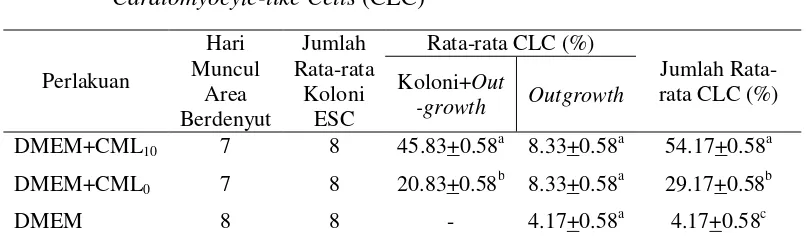
Hasil pengamatan area berdenyut pada diferensiasi ESC dari koloni yang diberi perlakuan menunjukkan bahwa area berdenyut pada koloni ESC yang diberi perlakuan DMEM+CML0 dan DMEM+CML10 muncul lebih awal bila
dibandingkan dengan perlakuan DMEM. Jumlah rata-rata cardiomyocyte-like cells (CLC) hasil pengarahan ESC mencit yang diberi perlakuan DMEM+CML10
menunjukan hasil yang secara nyata lebih baik dibandingkan dengan kedua perlakuan yang lainnya (P<0.05). Hal ini mengindikasikan bahwa LIF memiliki peranan dalam meningkatkan kualitas dari CM yang dihasilkan, sehingga CM memiliki kemampuan yang lebih baik dalam mengarahkan ESC menjadi CLC. Sedangkan dari hasil evaluasi RT-PCR pada setiap kelompok perlakuan menunjukkan adanya ekspresi Nkx2.5 dan -MHC, namun terdapat perbedaan ketebalan pita dari tiap perlakuan. Pengarahan ESC yang diberi perlakuan DMEM+CML10 dan DMEM+CML0 menunjukkan pita ekspresi Nkx2.5 dan
-MHC yang lebih tebal bila dibandingkan dengan hasil pengarahan ESC yang diberi DMEM. Hal ini mengindikasikan bahwa penambahan CM pada medium kultur pengarahan ESC (DMEM) meningkatkan pengarahan ESC mencit menjadi
cardiomyocyte, dilihat dari ketebalan pita yang menunjukkan banyaknya koloni ESC yang mengandung gen dan faktor transkripsi yang spesifik pada jantung, dibandingkan dengan koloni ESC yang diberi perlakuan DMEM.
Berdasarkan hasil penelitian dapat disimpulkan bahwa kultur primer
cardiomyocyte yang diinduksi LIF menghasilkan CM yang lebih berkualitas dibandingkan dengan CM tanpa induksi LIF, sehingga dapat meningkatkan kemampuan CM dalam pengarahan ESC menjadi cardiomyocyte. Hal tersebut diduga karena CM yang diinduksi dengan LIF mengandung lebih banyak faktor-faktor pertumbuhan yang menunjang dan kondusif untuk pengarahan ESC menjadi CLC. Selain itu, pemberian CM (baik yang diinduksi dengan LIF maupun tidak) pada medium kultur pengarahan ESC juga dapat meningkatkan pengarahan ESC mencit menjadi cardiomyocyte bila dibandingkan dengan medium kultur pengarahan saja. Hal tersebut diduga karena kandungan di dalam CM yang lebih mendekati kondisi in vivo dari cardiomyocyte.
Kata kunci: conditioned medium, cardiomyocyte, embryonic stem cells mencit,
© Hak Cipta milik IPB, tahun 2009 Hak Cipta dilindungi Undang-undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
POTENSI LEUKEMIA INHIBITORY FACTOR DALAM
PENINGKATAN KEMAMPUAN CONDITIONED MEDIUM
UNTUK PENGARAHAN EMBRYONIC STEM CELLS
MENCIT MENJADI CARDIOMYOCYTE
DWI AGUSTINA
TESIS
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Sains Veteriner
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Potensi Leukemia Inhibitory Factor Dalam Peningkatan Kemampuan Conditioned Medium Untuk Pengarahan Embryonic Stem Cells Mencit Menjadi Cardiomyocyte
Nama : Dwi Agustina N R P : B151060061
Disetujui
Komisi Pembimbing
Dr. drh. Ita Djuwita, M. Phil drh. Adi Winarto, Ph.D Ketua Anggota
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana Sains Veteriner
Dr. drh. Bambang Pontjo. P., M.S. Prof. Dr. Ir. Khairil A. Notodiputro, M.S.
Puji dan syukur penulis panjatkan kepada Allah SWT atas limpahan
rahmat dan karunia-Nya sehingga penelitian dan penulisan tesis dengan judul
‘Potensi Leukemia Inhibitory Factor Dalam Peningkatan Kemampuan Untuk
Pengarahan Embryonic Stem Cells Menjadi Cardiomyocyte’ dapat diselesaikan.
Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Juni 2008 ini
ialah analisis pengarahan stem cell atau sel punca yang berasal dari embrio mencit
menjadi cardiomyocyte dengan menggunakan conditioned medium yang diinduksi
leukemia inhibitory factor (LIF) dalam pembuatannya. Hasil penelitian ini
diharapkan dapat bermanfaat untuk mendapatkan kondisi yang optimal dan efisien
dalam pengarahan embryonic stem cells mencit menjadi cardiomyocyte.
Dalam penelitian dan penulisan tesis ini, berbagai kendala dan
permasalahan dapat terselesaikan dengan baik berkat bantuan, dukungan,
dorongan, dan kerjasama dari semua pihak yang telah membantu hingga
berakhirnya semua kegiatan penelitian. Dengan penuh kerendahan hati, penulis
menyampaikan terima kasih dan penghargaan yang tidak terhingga kepada semua
pihak yang langsung mau pun tidak langsung turut andil dan memotivasi
penyelesaian tesis ini, antara lain kepada:
1. Ibu Dr. drh. Ita Djuwita, M.Phil., selaku Ketua Komisi Pembimbing dan
Bapak drh. Adi Winarto, Ph.D., selaku Anggota Komisi Pembimbing. Di
tengah aktivitas yang padat, beliau berkenan membimbing dan mengarahkan
penulis dalam penelitian dan penulisan tesis ini.
2. Bapak drh. Srihadi Agungpriyono, Ph.D., atas kesediaannya sebagai penguji
luar komisi pada ujian tesis serta masukan dan sarannya kepada penulis.
3. Bapak Dr. drh. Bambang Pontjo P., M.S., selaku Ketua Program Studi Sains
Veteriner dan segenap staf P.S. SVT serta Sekolah Pasca Sarjana IPB, atas
bantuannya selama penulis menempuh pendidikan Strata 2.
4. Bapak Prof. drh. Arief Boediono, Ph.D., Bapak drh. M. Fakhrudin, Ph.D.,
Bapak drh. Kusdiantoro Mohammad, M.Si., Ibu drh. Wahono Esthi
masukan, dan dukungannya selama penulis menempuh pendidikan Strata 2.
5. Bapak dr. Boenjamin Setiawan, Ph.D., Bapak Ferry Sandra, drg., Ph.D., dan
Ibu dr. Caroline T. Sardjono, Ph.D., atas kesempatan yang diberikan kepada
penulis untuk melanjutkan pendidikan Strata 2.
6. Stem Cell and Cancer Institute dan PT. Kalbe Farma, Tbk., atas bantuan
beasiswanya; serta rekan-rekan di SCI atas dukungannya selama penulis
melakuan penelitian.
7. Andina Bunga Lestari, M.Si., Dini Budhiarko, S.Si., Riris Lindiawati, M.Si.,
R. Harry Murti, S.Si., Nuril Farizah, S.Pi., M.Si., Bapak Dr. Ir. Thomas Mata
Hine, M.Si., Bapak Ir. Bayu Rosadi, M.Si., Ibu Yani, dan Bapak Wahyu, serta
rekan-rekan P.S. SVT 2006 dan P.S. BRP 2004-2006, atas masukan, bantuan,
dan dukungannya selama ini.
8. Rekan-rekan Perwira 50, Twin House, Tantry, Amel, Rani, Fina, Terry, dan
Dina, atas dukungan, bantuannya, dan semangatnya selama ini.
9. Keluargaku tercinta: Bapak Eddy Kuseni, Ibu Riyanti, Mbak Henny Purwanti,
A’ Ade Yana Kurniawan, dan Rezaeka Putra Kurniawan, atas bantuan moril
dan spirituil yang telah diberikan selama ini.
Serta kepada seluruh pihak yang tidak mungkin penulis sebutkan satu
persatu dalam tulisan ini, semoga amal baiknya dibalas oleh Allah SWT, dengan
cara dimudahkan segala urusannya dan dilimpahkan rizqinya, Amin.
Akhir kata, penulis menyadari bahwa tesis ini masih jauh dari
kesempurnaan. Namun dengan lapang dada dan semangat memperbaiki, penulis
menerima segala kritikan yang membangun demi perbaikan tesis ini. Semoga
tesis ini dapat berguna dalam rangka pengembangan sel punca untuk terapi
mengatasi penyakit degeneratif, khususnya pengarahan embryonic stem cells
menjadi cardiomyocyte.
Bogor, September 2009
Penulis dilahirkan di Bandung, Jawa Barat pada tanggal 18 Agustus 1982,
dari Ayahanda Eddy Kuseni dan Ibunda Riyanti. Penulis merupakan putri kedua
dari dua bersaudara.
Tahun 2000 penulis lulus dari SMU Negeri 2 Bandung dan pada tahun
yang sama lulus seleksi masuk Universitas Pendidikan Indonesia melalui jalur
Ujian Masuk Perguruan Tinggi Negeri. Penulis memilih program studi Biologi,
Jurusan Pendidikan Biologi, Fakultas Pendidikan Matematika dan Ilmu
Pengetahuan Alam, Universitas Pendidikan Indonesia dan menyelesaikan studinya
pada tahun 2004 dengan gelar Sarjana Sains.
Kesempatan untuk melanjutkan pendidikan ke program Magister diperoleh
pada tahun 2006. Biaya penelitian sepenuhnya didukung oleh Stem Cell and
Cancer Institute, tempat penulis bekerja sebagai Research Assistant sejak tahun
DAFTAR ISI
Kultur Primer Cardiomyocyte... 22
Penyediaan Embryonic Stem Cells ... 23
Koleksi Blastosis dan Isolasi Inner Cell Mass ... 23
Kultur Inner Cell Mass dan Uji Pluripotensi ... 25
DAFTAR GAMBAR
1. Myocardial infarction ... 5
2. Bagian-bagian embrio stadium blastosis ... 7
3. Metode immunosurgery untuk mengisolasi ICM dari blastosis mencit ... 9
4. Perkembangan ICM menjadi ESC dan pembentukan EB ... 11
5. Inkubasi blastosis dalam pronase ... 24
6. Proses immunosurgery ... 25
7. Kultur ICM ... 26
8. Hasil pewarnaan alkaline phosphatase terhadap koloni ICM... 27
9. Koloni ESC yang membentuk EB pada hari ke-9 diferensiasi ... 29
PENDAHULUAN
Latar Belakang
Sampai saat ini, pengobatan terhadap penyakit degeneratif seperti
myocardial infarction, Parkinson’s, dan diabetes masih terus dikembangkan.
Timbulnya penyakit degeneratif tersebut disebabkan adanya sel-sel yang tidak
berfungsi sebagaimana mestinya karena mengalami kerusakan atau kematian.
Alternatif pengobatan yang dapat dilakukan adalah dengan melakukan terapi sel
untuk menggantikan sel-sel yang rusak dalam tubuh dengan sel-sel yang secara
sel punca pada mencit dan hewan laboratorium lainnya diantaranya adalah:
myocardial infarction, hati (Guasch & Fuchs 2005), Alzheimer, diabetes, dan
Parkinson (Doss et al. 2004).
Sel punca adalah sel-sel yang belum berdiferensiasi serta memiliki
kemampuan untuk berproliferasi dan berdiferensiasi menjadi berbagai tipe sel
dengan fungsi yang lebih spesifik. Kemampuan tersebut disebabkan adanya daya
plastisitas yang dimilikinya (Yu & Thomson 2006). Sampai saat ini telah dikenal
tiga jenis sel punca, yaitu embryonic stem cells (ESC), adult stem cells, dan
embryonic germ cells. Salah satu jenis sel punca yang sering digunakan untuk
penelitian biomedis adalah ESC, merupakan sel punca yang berasal dari inner cell
mass (ICM) embrio tahap blastosis (Wobus & Boheler 2005). Setelah dikultur
dan dikembangkan pada kondisi yang sesuai, ICM akan menghasilkan sel punca
yang belum berdiferensiasi dan bersifat pluripoten, yaitu memiliki kemampuan
untuk berproliferasi, dan dapat berdiferensiasi menjadi semua tipe sel tubuh,
termasuk menjadi cardiomyocyte (sel otot jantung). Sel-sel tersebut dapat
digunakan dalam terapi sel untuk mengatasi penyakit degeneratif seperti
2
Kerangka Pemikiran
Penelitian pemanfaatan ESC untuk menggantikan cardiomyocyte yang
rusak telah banyak dilakukan, terutama dengan menggunakan mencit sebagai
model (Murashov et al. 2005). Beberapa metode yang telah dikembangkan untuk
mengarahkan perkembangan ESC mencit menjadi cardiomyocyte, antara lain
dengan penambahan faktor pertumbuhan (seperti retinoic acid, activin-a,
epidermal growth factor, dan fibroblast growth factor (Schuldiner et al. 2000),
telah digunakan dalam pengarahan ESC menjadi cardiomyocyte karena mudah
dalam pembuatannya dan lebih ekonomis. Penggunaan CM tersebut pada kultur
pengarahan ESC dapat meningkatkan jumlah cardiomyocyte yang terbentuk,
karena di dalam CM terdapat faktor pertumbuhan (protein) serta lingkungan
kultur primer yang mendukung pengarahan ESC menjadi cardiomyocyte (Miwa et
al. 2003). Penambahan faktor pertumbuhan dalam memproduksi CM untuk
pengarahan ESC telah dilakukan untuk meningkatkan kemampuan dari CM untuk
pengarahan ESC menjadi cardiomyocyte, sehingga jumlah cardiomyocyte yang
didapatkan akan lebih meningkat (Behfar et al. 2002). Leukemia inhibitory factor
(LIF) dapat dijadikan sebagai alternatif faktor pertumbuhan yang dapat
ditambahkan dalam memproduksi CM, karena penambahan LIF pada kultur
primer cardiomyocyte dapat meningkatkan sintesis protein dari cardiomyocyte
dalam kultur primer tersebut (Kodama et al. 1997). Namun demikian, hal itu
masih perlu dibuktikan lebih lanjut dalam pengarahan ESC menjadi
cardiomyocyte dengan penggunaan CM yang diberi penambahan LIF pada
pengarahan ESC tersebut.
Berdasarkan pemikiran di atas, dalam penelitian ini dilakukan analisis
pengaruh penggunaan LIF terhadap kemampuan CM dalam peningkatan
pengarahan ESC menjadi cardiomyocyte. Adapun ESC yang digunakan dalam
Tujuan dan Manfaat Penelitian
Penelitian ini bertujuan untuk menganalisis pengaruh penggunaan LIF
terhadap kemampuan CM dalam pengarahan ESC mencit menjadi cardiomyocyte.
Hasil penelitian ini diharapkan dapat bermanfaat untuk mendapatkan kondisi yang
optimal dan efisien dalam pengarahan ESC mencit menjadi cardiomyocyte.
Aplikasi pengarahan ESC mencit ini juga dapat dikembangkan sebagai model
dalam penelitian medis, terutama yang berhubungan dengan myocardial
infarction.
Hipotesis Penelitian
Pada penelitian ini diajukan hipotesis bahwa penambahan LIFpada kultur
primer cardiomyocyte mencit neonatal dapat meningkatkan kemampuan CM
4
cardiomyocyte (sel otot jantung) tersebut meninggal karena serangan jantung
(NIH 2001; WHO 2007). Myocardial infarction terjadi akibat kerusakan
permanen otot jantung pada bagian tertentu dari jantung yang diakibatkan
penyakit coronary artery. Penyakit ini merupakan penyempitan pembuluh darah
arteri yang mengalirkan darah ke cardiomyocyte akibat adanya penimbunan lemak
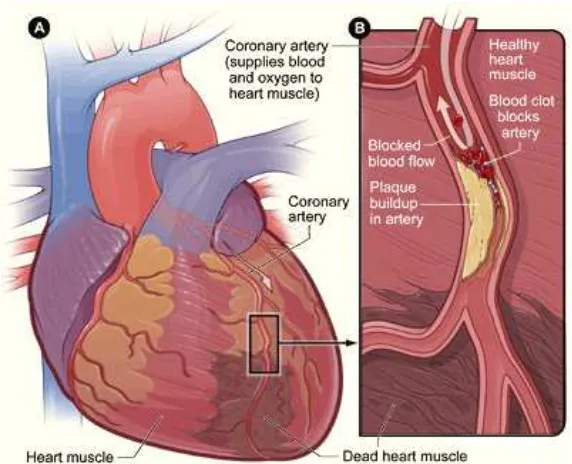
dan pengapuran pada pembuluh darah tersebut (Gambar 1). Tidak tercukupinya
suplai darah dan oksigen ke cardiomyocyte secara terus-menerus akan
menyebabkan kerusakan bahkan kematian dari cardiomyocyte. Cardiomyocyte
yang telah mati tidak dapat melakukan regenerasi kembali, sehingga hal tersebut
akan mempengaruhi kerja jantung dan dapat meningkatkan disfungsi jantung
karena berkurangnya cardiomyocyte yang membantu jantung berfungsi (NIH
2001; NHLBI 2008).
Berbagai cara telah dilakukan untuk mengatasi myocardial infarction,
seperti prosedur pembedahan, terapi pengobatan, serta pencangkokkan organ.
Namun lebih dari setengah pasien yang didiagnosis mengalami gagal jantung
meninggal 5 tahun kemudian setelah diagnosis awal (Ryan et al. 1999; Smits et al.
2005). Langkah yang kini banyak dilakukan untuk memperbaiki kerusakan
jaringan pada jantung adalah dengan menghambat kematian cardiomyocyte dan
melakukan transplantasi cardiomyocyte pada daerah jantung yang mengalami
infarct. Salah satu sumber cardiomyocyte untuk transplantasi sel yang digunakan
pada para penderita gagal jantung berasal dari sel punca, dimana dengan kondisi
tertentu dapat berkembang menjadi sel-sel khusus yang sehat dan dapat berfungsi
dengan baik menggantikan sel-sel yang rusak atau tidak berfungsi sebagaimana
Gambar 1 Myocardial infarction: (A) jantung yang mengalami kerusakan
cardiomyocyte dan (B) penyempitan pembuluh darah arteri yang menyebabkan kerusakan cardiomyocyte (NHLBI 2008).
Embryonic Stem Cells
Sel punca adalah sel pembangun setiap organ dan jaringan tubuh kita;
merupakan sel yang belum berdiferensiasi dan dengan kondisi tertentu dapat
berproliferasi serta berdiferensiasi menjadi berbagai tipe sel dengan fungsi khusus
(NIH 2001). Dengan demikian, karakteristik penting yang membedakan sel punca
dengan tipe sel tubuh lainnya adalah kemampuan berproliferasi dalam periode
waktu yang panjang, dan dapat diinduksi untuk berkembang menjadi tipe sel
tertentu (Fischbach & Fischbach 2004).
Saat ini terdapat tiga jenis sel punca, yaitu embryonic stem cells (ESC),
adult stem cells (ASC), dan embryonic germ cells. Dari ketiga jenis sel punca
tersebut, yang paling banyak digunakan dalam penelitian biomedis adalah ESC
dan ASC. Embryonic stem cells diperoleh dari inner cell mass (ICM) yang
terdapat pada embrio stadium blastosis. Sel-sel ini bersifat pluripoten atau
memiliki kemampuan untuk berkembang menjadi semua tipe sel penyusun tubuh
fetus dan organisme dewasa (Wobus & Boheler 2005). Adult stem cells adalah
sel-sel yang belum berdiferensiasi yang terdapat pada jaringan yang telah
6
organisme dewasa lainnya. Sel-sel tersebut dapat berproliferasi dalam tubuh dan
membuat klon yang identik dengan mereka selama kehidupan organisme, atau
menjadi khusus untuk menghasilkan tipe sel dari jaringan asal (Guasch & Fuchs
2005). Beberapa jaringan dewasa yang telah dilaporkan mengandung sel punca
adalah retina, hati (Rafii & Lyden 2003), ginjal (Lakshmipathy et al. 2004), otak,
kulit, usus, pankreas (Guasch & Fuchs 2005), dan sumsum tulang (Cedar et al.
2007). Sel punca juga telah ditemukan pada umbilical cord blood dan plasenta
(Bornstein et al. 2005). Pada organ lain, seperti jantung, tidak ditemukan sel
punca (Hughes 2002). Beberapa dari ASC tersebut bersifat multipoten, yakni
dapat berdiferensiasi menjadi beberapa tipe sel tertentu. Penggunaan ESC
memiliki beberapa kelebihan dibandingkan dengan ASC, yaitu sifatnya yang
pluripoten, jumlahnya yang banyak sehingga mudah untuk dikembangkan dalam
kultur, serta kecilnya penolakan dari sistem immun tubuh penderita. Selain itu,
sel-sel tersebut memiliki kemampuan untuk memperbanyak diri tanpa batasan
dengan karyotype yang relatif stabil (Xu et al. 2002; Gallo et al. 2006).
Penelitian terhadap ESC dari mencit telah dilakukan sejak tahun 1981
dengan dilaporkannya keberhasilan Evans dan Kaufman mengisolasi sel punca
dari embrio mencit. Sel-sel tersebut diketahui dapat berproliferasi dalam jangka
waktu yang lama dan memiliki kemampuan untuk berdiferensiasi menjadi
berbagai tipe sel. Sejak saat itulah ESC mencit menjadi salah satu sumber yang
diperlukan untuk penelitian biomedis (Downing & Battey 2007).
Hingga saat ini, pemanfaatan ESC mencit sebagai model penelitian terapi
penyakit degeneratif, dimana perlakuan diberikan pada beberapa hewan
percobaan, telah mengalami kemajuan yang pesat. Hasil dari penelitian ESC
mencit untuk terapi penyakit degeneratif yang telah dilakukan meliputi penyakit
myocardial infarction, hati (Guasch & Fuchs 2005), Alzheimer, diabetes, dan
Parkinson (Doss et al. 2004). Penelitian-penelitian tersebut dijadikan dasar untuk
pengembangan ESC dari manusia yang nantinya dapat diterapkan pada manusia
Isolasi Inner Cell Mass sebagai Sumber Embryonic Stem Cells
Sumber ESC mencit diperoleh dengan mengisolasi ICM dari embrio
stadium blastosis, yaitu pada hari ke-4 perkembangan embrio mencit (Wobus &
Boheler 2005). Pada perkembangan embrionik, stadium blastosis terbentuk saat
terdapat rongga di antara sel-sel morula yang berisi cairan yang disebut blastosol.
Blastosis tersusun oleh dua jenis sel, yaitu trofektoderm yang terdapat pada bagian
luar dan ICM pada bagian dalam, serta terdapat lapisan yang menyelimuti
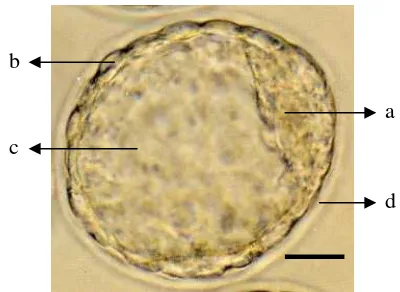
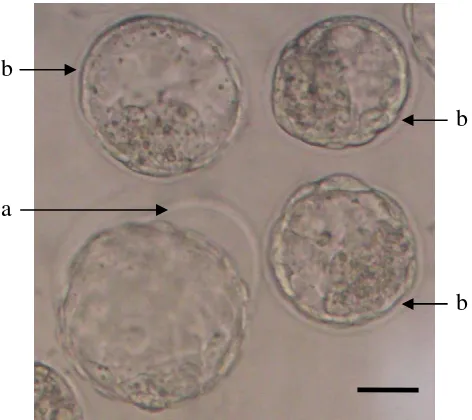
blastosis yang disebut zona pellucida (ZP) (Gambar 2). Inner cell mass
digambarkan sebagai suatu koloni dengan ukuran sel yang kecil, memiliki nukleus
berukuran besar, dan sitoplasma yang sedikit. Pada perkembangannya,
trofektoderm akan menghasilkan sel-sel trofoblas, yang selanjutnya akan
berkembang menjadi plasenta. Sedangkan ICM akan berkembang menjadi semua
jaringan tubuh embrio, dan juga jaringan non trofoblas yang menunjang
perkembangan embrio (jaringan ekstraembrionik, termasuk kantung kuning telur,
allantois, dan amnion) (NIH 2001; Park et al. 2004; Kim et al. 2005).
Gambar 2 Bagian-bagian embrio mencit stadium blastosis: (a) ICM, (b) trofoblas, (c) blastosol, (d) ZP. Bar = 40 m.
Terdapat beberapa metode isolasi ICM yang telah dikenal dan dilakukan
oleh para peneliti hingga saat ini, yaitu metode immunosurgery (Lee et al. 2005),
pembedahan mikro atau microsurgery (Georgiades & Rossant 2006), enzimatik
(Schoonjans et al. 2003), dan dengan menggunakan sinar laser (Tanaka et al.
2006). Perbedaan dari tiap-tiap metode tersebut adalah alat dan bahan yang
digunakan, serta waktu yang dibutuhkan untuk mendapatkan ICM. Bahan utama
b
a
c
8
pada metode immunosurgery yaitu rabbit anti-mouse antibody (untuk ESC dari
embrio mencit) atau rabbit anti-human antibody (untuk ESC dari embrio
manusia) dan complement sera from guinea pig. Pada metode microsurgery
diperlukan mikromanipulator dan keterampilan dalam penggunaan alat tersebut.
Metode isolasi ICM secara enzimatik dilakukan dengan cara menginkubasi
blastosis tanpa ZP dalam larutan tripsin 0.25%. Sedangkan untuk isolasi ICM
dengan sinar laser, selain dibutuhkan mikromanipulator juga dibutuhkan peralatan
laser yang harganya cukup mahal, biasanya metode ini digunakan pada blastosis
yang berasal dari manusia (Agustina et al. 2008).
Pada metode immunosurgery, microsurgery, dan enzimatik, diperlukan
proses penghilangan ZPterlebih dahulu untuk mempermudah dalam proses isolasi
ICM. Zona pellucida merupakan lapisan material ekstraselular yang disintesis
selama perkembangan oosit dan memiliki ketebalan sekitar 7 m (Nagy et al.
2003). Bahan yang biasanya digunakan untuk menghilangkan ZPblastosis adalah
enzim pronase dengan konsentrasi 0.25 - 0.5% (Oh et al. 2005). Pada penelitian
yang menggunakan blastosis manusia, penggunaan pronase biasanya digantikan
dengan tyrode’s acid (Cowan et al. 2004). Hal ini dilakukan untuk mengurangi
kontak blastosis dengan bahan-bahan yang berasal dari hewan. Namun
penggunaan tyrode memerlukan penanganan yang cepat agar blastosis tidak
terlalu lama terpapar dengan larutan asam tersebut. Setelah ZPlisis akibat kontak
dengan tryode’ acid, blastosis dicuci beberapa kali untuk menghilangkan sisa-sisa
asam yang tertinggal (Skottman & Hovatta 2006). Blastosis yang telah
dihilangkan ZP-nya, baik dengan menggunakan enzim pronase ataupun tyrode’s
acid, selanjutnya dapat dilakukan isolasi ICM.
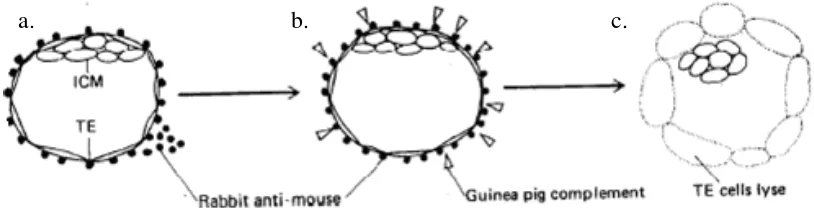
Isolasi ICM menggunakan metode immunosurgery (Gambar 3),
merupakan metode isolasi ICM dengan menggunakan antibodi yang hanya
mengenali trofoblas. Mula-mula dilakukan inkubasi blastosis tanpa ZP dalam
rabbit anti-mouse antibody kemudian dilanjutkan dengan inkubasi dalam
complement sera from guinea pig. Immunosurgery dapat melisiskan sel-sel
trofoblas sehingga sel-sel ICM yang terdapat di dalamnya dapat dengan mudah
kondisi tertentu sehingga menghasilkan ESC yang bersifat pluripoten (Solter &
Knowles 1975; Nagy et al. 2003; Park et al. 2004).
Gambar 3 Metode immunosurgery untuk mengisolasi ICM dari blastosis mencit: (a) blastosis diinkubasi dalam rabbit anti-mouse serum, (b) diinkubasi dengan guinea pig complement, (c) sel-sel trofoblas (TE) akan lisis dan ICM dapat diisolasi (Nagy et al. 2003).
Kultur Embryonic Stem Cells Mencit
Embryonic Stem Cells memiliki karakter yang spesifik yakni mampu
untuk terus berproliferasi selama periode yang panjang dan tetap menjaga
pluripotensinya (Doss et al. 2004). Oleh karena itu dibutuhkan suatu kondisi
kultur yang kondusif untuk pertumbuhan ESC. Pada umumnya, medium kultur
ESC yang biasanya digunakan adalah dulbecco’s modified eagle’s medium
(DMEM) (Sigma, USA) yang diberi tambahan 10-20% fetal bovine serum (FBS)
(Sigma, USA), 5 l/ml penicillin-streptomycin (Sigma, USA), 1% nonessential
amino acids (Sigma, USA), 0.1 mM -mercaptoethanol, dan 10 ng/ml leukemia
inhibitory factor (LIF). Penambahan LIF, sitokin yang tergabung dalam famili
interleukin-6 (IL-6), pada kultur ESC mencit berperan untuk menjaga sel tetap
berproliferasi tanpa berdiferensiasi. Hal ini dikarenakan adanya ikatan LIF
dengan 2 bagian reseptor yang komplek, yaitu LIF receptor (LIFR) dan reseptor
glikoprotein 130 (gp130). Adanya ikatan tersebut memicu terjadinya aktivasi dari
factor transkripsi signal transducer and activator of transcription 3 (STAT 3),
yang berperan penting dalam menjaga kelangsungan proliferasi ESC dari mencit
secara in vitro (Pan & Thomson 2007).
10
Pada beberapa penelitian, mouse embryonic fibroblast (MEF) digunakan
sebagai feeder layer dari kultur ESC. Selama kultur, MEF mensekresikan
faktor-faktor pertumbuhan, seperti basic fibroblast growth factor (bFGF) dan LIF, yang
penting untuk proliferasi dan mempertahankan sifat pluripotensi dari ESC.
Namun, penggunaan feeder layer memiliki resiko terjadinya kontaminasi pada
kultur ESC, karena terjadi kontak langsung antara feeder layer dengan ESC
(Ulloa-Montoya et al. 2005). Pada beberapa penelitian, fungsi feeder layer telah
digantikan oleh penggunaan conditioned medium yang diperoleh dari kultur
primer fibroblast, penambahan faktor pertumbuhan (misalnya bFGF), atau
kombinasi keduanya (Xu et al. 2005). Adapun penambahan LIF pada medium
pluripotensi dari ESC akan semakin menurun seiring dengan lamanya kultur
(Wobus & Boheler 2005).
Uji Pluripotensi dari Embryonic Stem Cells Mencit
Untuk mengetahui apakah ESC yang dikultur masih belum berdiferensiasi,
maka dapat dilakukan pengujian dengan penanda yang spesifik pada ESC yang
masih bersifat pluripoten. Penanda yang umumnya digunakan adalah Octamer-4
(Oct4), Nanog, Sox-2, Foxd3, stage-specific embryonic antigen 1 (SSEA1), dan
reseptor yang berikatan dengan membran seperti gp130 (O’Shea 2004; Keller
2005). Selain itu, ESC juga dapat diuji pluripotensinya dengan melihat tingkat
aktivitas telomerase (Thomson et al. 1998) dan aktivitas enzim alkaline
phosphatase-nya (Wei et al. 2005).
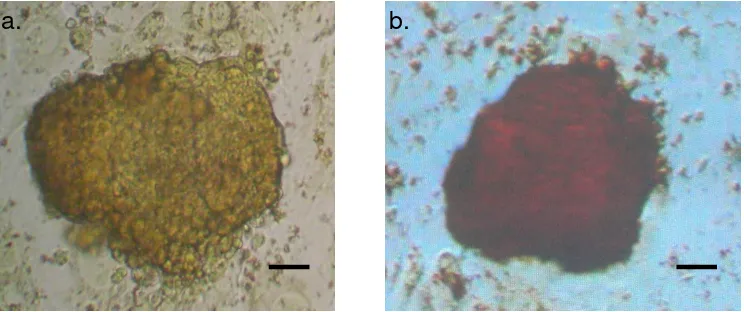
Pewarnaan alkaline phosphatase merupakan salah satu uji pluripotensi
ESC yang paling sederhana. Pewarnaan ini dilakukan untuk mengetahui
spesifik, dan kuantitatif dari ESC yang tingkat pluripotensinya masih tinggi
(O’Connor et al. 2008).
Diferensiasi Embryonic Stem Cells menjadi Cardiomyocyte
Menurut Boheler et al. (2002), ESC akan berdiferensiasi membentuk suatu
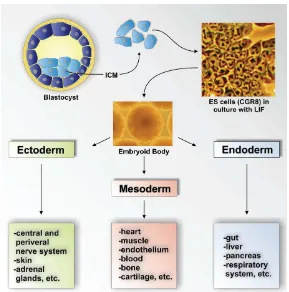
koloni yang disebut embryoid bodies (EB) jika LIF ditiadakan dalam kultur ESC.
Kemampuan tersebut disebabkan sifat pluripoten atau daya plastisitas yang
dimilikinya (Wobus & Boheler 2005). Embryoid bodies merupakan sekumpulan
atau agregat sel yang menyerupai embrio yang tersusun oleh derivat dari ketiga
lapisan kecambah embrio, yaitu ektoderm, endoderm, dan mesoderm (Gambar 4).
Menurut Baharvand et al. (2006), proses terjadinya diferensiasi dari sel punca
dapat diketahui dengan adanya formasi dari EB, yang melanjutkan proliferasi dan
diferensiasi menjadi berbagai jenis sel, termasuk cardiomyocyte.
12
Pengarahan ESC untuk dapat berdiferensiasi menjadi sel tipe tertentu
dipengaruhi oleh beberapa faktor yang diregulasi oleh faktor pertumbuhan yang
sesuai. Sampai saat ini telah dilaporkan beberapa metode untuk mengarahkan
perkembangan ESC mencit menjadi cardiomyocyte, antara lain dengan
penambahan faktor pertumbuhan, seperti activin-a, epidermal growth factor
(Schuldiner et al. 2000), retinoic acid, fibroblast growth factor (FGF), bone
morphogenic proteins (BMP) 2 & 4, transforming growth factor (TGF) - , nitric
oxide, erythropoietin, ascorbic acid, dimethyl sulfoxide (DMSO), dan oxytocin
(Singla & Sobel 2005), dan atau penggunaan conditioned medium (CM) (Miwa et
al. 2003).
Secara umum, CM diartikan sebagai medium yang telah digunakan dalam
kultur sel tertentu. Diperkirakan CM mengandung faktor-faktor pertumbuhan
yang disekresikan oleh sel-sel dalam kultur sebelumnya. Conditioned medium
dilaporkan telah digunakan dalam beberapa penelitian, diantaranya penggunaan
CM dari fibroblas untuk menggantikan feeder layer (Xu et al. 2005), CM dari
neural stem cell untuk pengarahan sel punca menjadi neuron (Zhang et al. 2006),
CM dari kultur primer cardiomyocyte tikus neonatal untuk pengarahan sel punca
menjadi cardiomyocyte (Miwa et al. 2003).
Conditioned medium yang dimaksud dalam penelitian ini adalah medium
yang didapat dari kultur primer cardiomyocyte yang berasal dari jantung mencit
umur 1-3 hari. Penggunaan CM tersebut pada kultur pengarahan ESC dapat
meningkatkan cardiomyocyte yang terbentuk, karena di dalam CM terkandung
sejumlah senyawa penting yang dihasilkan oleh cardiomyocyte dari kultur primer
dan dapat menginduksi dan mendukung pengarahan ESC menjadi cardiomyocyte
Leukemia Inhibitory Factor
Leukemia Inhibitory Factor (LIF) merupakan sitokin yang tergabung
dalam famili interleukin-6 (IL-6) dan faktor pertumbuhan serta diferensiasi
dengan aktivitas pleiotropik (Bader et al. 2000). Sitokin ini memiliki dua
isoform, yaitu diffusible molecule (D-LIF) dan extracellular matrix-bound
(M-LIF). Adapun reseptor LIF yang spesifik berikatan dengan LIF adalah LIFR- ,
yang membentuk heterodimer dengan subunit yang umumnya spesifik pada
seluruh reseptor dari anggota famili tersebut, yaitu subunit gp130. Ikatan tersebut
akan memicu terjadinya aktivasi dari JAK/STAT (Janus kinase/Signal transducer
and activator of transcription) cascades (Bader et al. 2000; Wobus et al. 2005).
Salah satu peranan LIF adalah bertindak sebagai faktor pertumbuhan di
hematopoiesis, tulang, jaringan neuroektodermal, dan diperkirakan juga
mempengaruhi tahapan perkembangan dari sistem kardiovaskular dalam cara
yang berlawanan (Bader et al. 2000). Salah satu isoform LIF, yaitu M-LIF,
diketahui berperan sebagai inhibitor diferensiasi mesodermal selama proses
gastrulasi, sehingga sebelum proses gastrulasi biasanya terjadi penekanan
terhadap jumlah LIF untuk mengatasi masalah tersebut. Selain itu, LIF juga
bertindak sebagai inhibitor diferensiasi pada ESC mencit. Hal ini dikarenakan
adanya ikatan LIF dengan LIFR dan gp130 yang memicu terjadinya aktivasi dari
faktor transkripsi STAT3, yang berperan penting dalam menjaga kelangsungan
proliferasi ESC dari mencit secara in vitro (Wobus et al. 2005; Pan & Thomson
2007).
Pada kultur primer cardiomyocyte neonatal, terdapat peningkatan ekspresi
dari M-LIF yang menyebabkan antiapoptotic serta peningkatan pertumbuhan dan
perkembangan dari cardiomyocyte melalui jalur STAT3 (Kodama et al. 1997).
Menurut Kodama et al. (2000), terdapat 3 lintasan sinyal transduksi dalam
perkembangan cardiomyocyte yang dimediasi oleh gp130, yang menghasilkan
peningkatan sintesis protein dari cardiomyocyte. Lintasan yang pertama terjadi
karena adanya ikatan antara LIF dengan reseptornya yang mengaktivasi JAK,
diikuti dengan fosforilasi dari gp130, menghasilkan binding sites untuk
protein-protein daerah Src-homology 2 (SH2), seperti growth factor receptor bound
14
Ras/Raf/MEK/ERK/p90RSK. Lintasan berikutnya adalah melalui STAT yang juga
merupakan daerah SH2 yang memiliki faktor yang mampu untuk berikatan
dengan fosforilasi gp130. Ikatan tersebut akan mengalami fosforilasi dan
translokasi ke dalam nukleus. Lintasan ketiga dipicu oleh aktivasi gp130 pada
fosforilasi dan aktivasi dari phosphatidylinositide 3-kinase (PI3K). PI3K
mengaktifkan Akt kinase dan berperan penting dalam sintesis protein melalui p70
S6 kinase (p70S6K).
Cardiomyocyte
Cardiomyocyte merupakan sel otot jantung yang secara autoritmik
membantu dalam kontraksi jantung untuk memompa darah dari dan keluar
jantung. Secara in vivo, sel ini memiliki lima komponen utama, yaitu (1)
membran plasma (sarkolema) dan T-tubules, untuk konduksi impuls, (2)
sarcoplasmic reticulum, penyimpan kalsium yang diperlukan untuk pergerakan
otot, (3) contractile elements, (4) mitokondria, dan (5) nukleus. Cardiomyocyte
tidak multinucleate, bagian belakang tiap sel saling bergabung membentuk
struktur yang disebut intercalated discs. Tiap cakram memiliki gap junctions
yang secara elektrik berpasangan dengan sel-sel tetangganya. Terjadinya
kontraksi spontan pada cardiomyocyte diatur oleh daerah pacemaker di bagian
atrium kanan jantung. Daerah pacemaker ini akan menginduksi gelombang
depolarisasi yang akan menyebar ke seluruh bagian jantung untuk menghasilkan
denyut jantung (Boheler et al. 2002; Becker et al. 2006).
Pada umumnya kultur primer cardiomyocyte yang digunakan sebagai
sumber conditioned medium diisolasi dari jantung hewan yang baru dilahirkan
(neonatal). Ketika dikultur, jantung neonatal lebih mudah terdispersi,
mengandung lebih banyak sel-sel prekursor dan memiliki kemampuan proliferasi
serta daya tahan yang lebih tinggi dibandingkan jantung hewan dewasa. Tingkat
kesulitan untuk mendapatkan sel yang relatif mudah berproliferasi ini biasanya
meningkat sejalan dengan meningkatnya umur hewan. Hal ini disebabkan oleh
beberapa faktor, antara lain: onset terjadinya diferensiasi, peningkatan bahan
Cardiomyocyte yang didapatkan dari pengarahan ESC dapat diidentifikasi
secara langsung dengan kemunculan dari area berdenyut, biasanya dimulai dari
hari ke-4 setelah dimulainya proses diferensiasi. Area berdenyut mengandung
sel-sel yang mononukleat dan berbentuk batang, serta memiliki sel-sel-sel-sel yang saling
berhubungan satu sama lain sama sepeti yang ditemukan pada cardiomyocyte
yang berkembang di jantung secara in vivo. Terdapat 3 tahapan perkembangan
cardiomyocyte dari pengarahan ESC, yaitu tahap awal (terbentuknya
pacemaker-like cells atau primary myocardial-like cells), tahap menengah, dan tahap akhir
(terbentuknya atrial-, ventricular-, nodal-, His-, dan Purkinje-like cells). Pada
diferensiasi tahap awal, cardiomyocyte berbentuk kecil dan membulat. Namun
seiring dengan tingkat kematangannya, cardiomyocyte tersebut akan memanjang
dengan perkembangan myofibril dan sarkomer yang lebih baik (Boheler et al.
2002). Pada diferensiasi tahap akhir, akan ditemukan ikatan myofibril yang telah
terbentuk dengan baik, dan juga sarkomer yang secara jelas telah dapat dibedakan
antara A bands, I bands, dan Z disks. Secara keseluruhan, baik dari ukuran dan
bentuknya, cardiomyocyte yang berasal dari pengarahan ESC telah dilaporkan
memiliki kesamaan dengan cardiomyocyte pada hewan pengerat neonatal (Banach
et al. 2003).
Analisis RT-PCR pada sel-sel yang diisolasi dari EB dengan area yang
berdenyut memeperlihatkan adanya ekspresi dari gen-gen dan faktor transkripsi
yang spesifik pada jantung, seperti Nkx2.5, GATA-4, , –myosin heavy chain
(MHC), atrial natriuretic factor (ANF), cardiac troponin, myosin light chains
(MLC) -1a, -1v, -2a, -2v, sarcomeric Ca2+ -ATPase 2 (SERCA2), type 2
ryanodine receptor (RyR2), Na/Ca exchanger 1 (Nex1), calsequestrin (Csq),
phospholamban, dan connexins 40, 43, dan 45 (Wei et al. 2005; Bidez 2006).
Sama seperti pada perkembangan awal myocardial, mRNA terlebih dahulu
mengkode faktor transkripsi GATA-4 dan Nkx2.5 sebelum mengkode atrial
natriuretic factor (ANF), MLC-2v, - dan -MHC, Na+-Ca+ exchanger, dan
phospholamban (Boheler et al. 2002).
Pada perkembangan embrio in vivo, Nkx2.5 pertama kali diekspresikan
antara hari ke-3 dan ke-6 days postcoitum (dpc), dan tetap terekspresi hingga
MLC-16
2v, cardiac ankyrin repeat protein (CARP), dan HAND1, yang tidak akan
terdeteksi apabila Nkx2.5 mengalami mutasi. Secara in vitro, Nkx2.5 terdeteksi
setelah hari ke-2 dimulainya proses diferensiasi ESC. Sedangkan -MHC secara
in vitro akan mulai terekspresi pada hari ke-8 setelah dimulainya proses
diferensiasi, sedangkan pada perkembangan embrio in vivo mulai terdeteksi pada
BAHAN DAN METODE PENELITIAN
Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan di Laboratorium Embriologi, Departemen
Anatomi, Fisiologi, dan Farmakologi, dan Laboratorium Terpadu, Fakultas
Kedokteran Hewan, Institut Pertanian Bogor. Penelitian dilaksanakan dari bulan
Januari 2009 hingga Juni 2009, dengan penelitian pendahuluan dilaksanakan dari
bulan Juni 2008 sampai dengan Desember 2008.
Rancangan Percobaan
Rancangan percobaan adalah Rancangan Acak lengkap (RAL) dengan tiga
kali pengulangan. Koloni ESC yang diberi perlakuan adalah 24 koloni yang
dibagi dalam 3 kelompok perlakuan. Sebagai perlakuan adalah (1)
DMEM+CML10, (2) DMEM+CML0, dan (3) DMEM (sebagai kontrol). Adapun
DMEM adalah Dulbecco’s Modified Eagle’s Medium yang diberi tambahan 5
l/ml penicillin-streptomycin (Sigma, USA), 1% nonessential amino acids
(Sigma, USA), dan 0.1 mM -mercaptoethanol; CML10 berasal dari medium
kultur primer cardiomyocyte yang diinduksi dengan 10 ng/ml LIF; CML0 berasal
dari medium kultur primer cardiomyocyte tanpa induksi LIF.
Ketiga medium perlakuan tersebut diberikan pada saat pengarahan ESC
menjadi cardiomyocyte. Parameter yang diamati adalah tingkat diferensiasi
(pengarahan) ESC menjadi cardiomyocyte dengan cara pengamatan langsung
terhadap jumlah area berdenyut setelah hari ke-7 kultur diferensiasi hingga hari
ke-14 serta kemampuan ekspresi Nkx2.5 dan -MHC dari cardiomyocyte hasil
pengarahan ESC, yang dilihat secara kualitatif dari intensitas pita cDNA hasil
18
Tahapan dan Prosedur Kerja
Pembuatan Conditioned Medium
Conditioned medium (CM) didapatkan dari cairan supernatan medium
kultur primer cardiomyocyte dari mencit putih (Mus musculus) betina galur ddy
umur 1-3 hari (neonatal). Isolasi cardiomyocyte dilakukan menurut Lin et al.
(2005). Bagian ventrikel jantung dicacah halus menjadi berukuran 1-2 mm
dengan menggunakan pisau bedah (Surgical Blade No.10, General Care).
Kemudian jaringan diinkubasi selama beberapa waktu dalam Dulbecco’s
Phosphatase-Buffered Saline (dPBS) (Gibco, USA) yang mengandung tripsin
0.25% (Gibco, Canada) dan EDTA 1mM (Merck, Darrnstadt, Germany) selama
15 menit pada suhu 37°C. Suspensi sel disaring dan dicucikemudian disentrifus
dengan kecepatan 200 g selama 8 menit. Pelet yang didapatkan kemudian
dikultur pada cawan petri yang telah berisi medium kultur, yaitu Dulbecco’s
Modified Eagle’s Medium (DMEM) (Sigma, USA) yang diberi tambahan 20%
fetal bovine serum (FBS) (Sigma, USA), 5 l/ml penicillin-streptomycin (Sigma,
USA), 1% nonessential amino acids (Sigma, USA), dan 0.1 mM
-mercaptoethanol (Sigma, USA). Kultur kemudian diinkubasi dalam inkubator
dengan suhu 37oC dan kadar CO2 5% selama 2 jam. Supernatan, yang berisi
sel-sel yang tidak melekat pada cawan petri, dipindahkan ke cawan petri baru yang
berisi medium kultur dan diinkubasi kembali selama 2 jam. Hal tersebut
dilakukan sebanyak 2 kali ulangan. Setelah itu dilakukan penanaman akhir sel-sel
tersebut pada cawan petri yang telah dilapisi 0.1% gelatin (Sigma, USA).
Setelah 48 jam, medium kultur primer cardiomyocyte diganti dengan
medium kultur bebas serum dan dikultur selama 24 jam. Kemudian kultur primer
cardiomyocyte tersebut dikultur dalam medium kultur yang diinduksi leukemia
inhibitory factor (LIF) (Sigma, USA) dengan konsentrasi 0 dan 10 ng/ml.
Conditioned medium (CML0 dan CML10) ditampung pada hari ke-4 sampai ke-7
dan disimpan pada suhu 4oC sebelum digunakan untuk perlakuan pada
Penyediaan Embryonic Stem Cell
a. Superovulasi dan isolasi blastosis hasil fertilisasi in vivo
Mencit yang digunakan dalam penelitian ini adalah mencit putih (Mus
musculus) betina galur ddy umur 8-12 minggu sebanyak 10 ekor tiap ulangannya.
Superovulasi dilakukan menurut Nagy et al. (2003), dengan menyuntikan secara
intraperitoneal 5 IU Pregnant Mare’s Serum Gonadotropin (PMSG) (Intervet
International BV, Folligon, Boxmeer, Holland) lalu diikuti 46 jam kemudian
dengan menyuntikan 5 IU Human Chorionic Gonadotropin (hCG) (Intervet
International BV, Chorulon, Boxmeer, Holland). Setelah penyuntikan hCG,
setiap mencit betina dikawinkan dengan mencit jantan dengan perbandingan 1:1.
Keesokan harinya, dilakukan pemeriksaan vaginal plug untuk mengidentifikasi
mencit yang melakukan perkawinan (terjadi kopulasi). Mencit-mencit yang
memiliki vaginal plug disatukan dalam satu kandang dan dilakukan pemanenan
embrio tahap blastosis pada hari keempat setelah penyuntikan hCG. Blastosis
dipanen dengan cara membilas tanduk rahim (kornua uterus) dengan medium
dPBS. Sambil dievaluasi di bawah mikroskop stereo (Nikon, SMZ-2T, Japan),
blastosis dicuci berturut-turut dalam medium dPBS dan DMEM masing-masing
sebanyak 2 kali ulangan. Selanjutnya blastosis dikultur dalam medium DMEM,
yang diberi tambahan 10% FBS (Sigma, USA), 5 l/ml penicillin-streptomycin
(Sigma, USA), 1% nonessential amino acids (Sigma, USA), dan 0.1 mM
-mercaptoethanol (Sigma, USA), kemudian diinkubasi dalam inkubator (Sanyo,
MCO-95, Japan) dengan suhu 37oC dan kadar CO2 5%.
b. Isolasi inner cell mass
Isolasi inner cell mass (ICM) dilakukan menurut Nagy et al. (2003)
dengan beberapa modifikasi. Embrio yang telah mencapai stadium blastosis
dihilangkan zona pellucida-nya dengan menggunakan enzim pronase 0.25%
selama 7-10 menit, kemudian blastosis dipindahkan ke dalam medium dPBS
untuk menghentikan aktivitas pronase. Selanjutnya blastosis tanpa zona pellucida
tersebut dicuci dalam DMEM tanpa serum sebanyak dua kali. Isolasi ICM
dilakukan dengan menginkubasi blastosis tanpa zona pellucida dalam rabbit
anti-mouse antibody (Sigma, USA) selama 90 menit dan complement sera from guinea
20
CO2 5%. Kedua serum yang digunakan terlebih dahulu telah dilarutkan dalam
DMEM tanpa serum dengan perbandingan volume 1:3. Setelah terpisah dari
sel-sel trofoblas, ICM sel-selanjutnya dipindahkan ke dalam DMEM kultur untuk
menghilangkan pengaruh serum dan menghilangkan sisa-sisa sel trofoblas yang
masih menempel pada ICM.
c. Kultur embryonic stem cell
Setelah diisolasi, ICM dikultur dalam cawan petri yang telah dilapisi 0,1%
gelatin (Sigma, USA). Medium kultur ESC yang digunakan adalah DMEM high
glucose (Sigma, USA) yang diberi tambahan 20% FBS (Sigma, USA), 1%
nonessential amino acids (Sigma, USA), 5 l/ml penicillin-streptomycin (Sigma,
USA), 0.1 mM -mercaptoethanol (Sigma, USA), dan 20 ng/ml mLIF (Sigma,
USA) (Passier & Mummery 2005). Medium kultur diganti setiap 2-3 hari dan
pada hari ke-7 dilakukan pengecekan uji pluripotensi dari ICM yang telah
berproliferasi dengan menggunakan pewarnaan alkaline phosphatase.
d. Pewarnaan alkaline phosphatase
Pewarnaan ini merupakan uji pluripotensi terhadap ESC (O’Connor et al.
2008). Proses pewarnaan dimulai dengan mengeluarkan medium kultur dari
cawan petri kemudian koloni-koloni ICM dicuci dua kali dalam dPBS lalu
difiksasi dengan 4% paraformaldehide (dalam PBS) selama 20 menit pada suhu
ruang. Sel-sel yang terfiksasi dicuci dua kali dengan PBS dan diinkubasi dengan
larutan substrat AP yang mengandung 200 g/ml naphtol AS-MX phosphate
(Sigma) dan 1 mg/ml Fast Red TR Salt (Sigma) dalam 100 mM Tris Buffer, pH
8.2, selama 30 menit pada suhu ruang, kemudian koloni-koloni ICM dicuci dalam
dPBS. Sel-sel yang berwarna merah menandakan positif AP dan
mengindikasikan bahwa sel-sel tersebut masih bersifat pluripoten.
Pengarahan Embryonic Stem Cells menjadi Cardiomyocyte
Pengarahan ESC atau tahap diferensiasi diawali dengan tripsinasi seluruh
koloni ICM hasil kultur selama 7 hari (0.25% tripsin dalam dPBS selama 1
menit), kemudian sel-sel hasil tripsinasi tersebut dibagi ke dalam 3 cawan petri
yang telah dilapisi dasarnya dengan 0.1% gelatin (Sigma, USA). Medium kultur
hari kultur akan terbentuk embryoid bodies (EB) dari kumpulan ESC pada
tiap-Pembuktian terjadinya ekspresi gen pada cardiomyocyte yang didapatkan
dari hasil pengarahan ESC, dilakukan deteksi mRNA dari Nkx2.5 dan -MHC
dengan menggunakan metode Reverse Transcription-Polymerase Chain Reaction
(RT-PCR). Keduanya berturut-turut merupakan faktor transkripsi dan gen yang
menghasilkan protein-protein sitoplasmik yang spesifik pada jantung (Kumar et
al. 2005).
Setelah diferensiasi hari ke-14, seluruh koloni ESC, khususnya koloni
ESC yang memiliki area berdenyut (Bin et al. 2006), diekstrak total RNA-nya
dengan menggunakan TRIZOL® (Invitrogen). Mula-mula cawan petri yang berisi
EB dicuci dengan dPBS dingin sebanyak 2 kali kemudian dimasukkan 1 ml
Trizol. Agar proses lisis pada sel-sel lebih sempurna maka dilakukan pengikisan
dasar cawan petri dengan menggunakan cell scraper, setelah itu diinkubasi selama
5 menit pada suhu ruang. Seluruh larutan isi cawan petri tadi dipindahkan ke
dalam tabung 2 ml lalu ditambah dengan 200 l kloroform, dicampur dan
diinkubasi 10 menit pada suhu ruang. Larutan kemudian disentrifus 12,000 g
selama 15 menit pada suhu 4oC. Supernatan dipindahkan ke dalam tabung mikro
baru kemudian ditambahkan 500 l isopropil alkohol (isopropanol), dicampur
hingga homogen kemudian diinkubasi pada suhu kamar selama 10 menit. Larutan
kemudian disentrifus 12,000 g selama 20 menit pada suhu 4oC, supernatan yang
didapat dibuang dan pelet RNA dikoleksi. Pada pelet yang didapat ditambahkan
etanol 75% dalam DPECdH2O (dingin) sebanyak 1,000 l kemudian
dihomogenkan dengan vortex dan disentrifus 12,000 g selama 20 menit pada suhu
4oC. Etanol (supernatan) dibuang dengan hati-hati dan pelet dikeringkan selama
22
l RNAse free water dan siap digunakan untuk amplifikasi PCR atau disimpan
pada suhu -20oC sebelum digunakan untuk amplifikasi PCR.
Reaksi RT-PCR menggunakan SuperScriptTM III One-Step RT-PCR
System with Platinum® Taq High Fidelity (Invitrogen). Primer yang digunakan
adalah Nkx2.5 dan -myosin heavy chain ( -MHC) (Tabel 1).
Tabel 1 Primer yang Digunakan dalam RT-PCR
Primer Urutan Basa Produk
Nkx2.5 AGC AAC TTC GTG AAC TTT G (sense)
CCG GTC CTA GTG TGG A (antisense) 345 bp
-MHC ACC GTG GAC TAC AAC AT (sense)
CTT TCG CTC GTT GGG A (antisense) 288 bp Sumber: Takahashi et al. (2003).
Total campuran reaksi RT-PCR adalah 25 l yang terdiri 12.5 l 2x
reaction mix, 0.5 l MgSO4, 2 l primer sense, 2 l primer antisense, 1 l
Platinum Taq, dan 7 l total RNA. Campuran tersebut dihomogenkan kemudian
dimasukkan ke dalam mesin PCR (GeneAmp PCR System 9600) dengan program
yang dapat dilihat pada Lampiran 3.
Produk PCR dianalisis pada gel agarose 1.5% yang mengandung ethidium
bromide (EtBr) 1.25 l/ml. Elektroforesis dilakukan pada voltase 100 volt selama
30-50 menit. Hasil elektroforesis dibaca dengan UV illuminator viewer.
Analisa Data
Data yang bersifat kualitatif akan disajikan secara deskriptif, sedangkan
data kuantitatif akan diuji secara statistik menggunakan ANOVA (analysis of
variance) dan dilanjutkan dengan uji Duncan untuk menentukan beda nyata antar
perlakuan. Analisis akan menggunakan software SPSS 17.0 for windows dan MS
HASIL DAN PEMBAHASAN
Kultur Primer Cardiomyocyte
Cardiomyocyte yang digunakan dalam kultur primer dikoleksi dari jantung
mencit neonatal umur 1-3 hari. Pemakaian sumber jantung mencit neonatal
dikarenakan kultur primer cardimyocyte neonatal mengandung lebih banyak
sel-sel prekursor dan memiliki kemampuan proliferasi yang lebih tinggi dibandingkan
yang berasal dari cardiomyocyte mencit dewasa. Selain itu, keuntungan lain dari
penggunaan cardiomyocyte dari mencit neonatal adalah kestabilan dari fenotipnya
yang lebih tinggi dibandingkan dengan cardiomyocyte dari mencit dewasa (Wang
et al. 1999). Berdasarkan hal tersebut, diharapkan conditioned medium yang
dikoleksi dari kultur primer cardiomyocyte neonatal memiliki kemampuan yang
lebih baik dalam pengarahan ESC menjadi cardiomyocyte dibandingkan dengan
cardiomyocyte mencit dewasa.
Sebanyak 70 mencit neonatal, yang berasal dari 10 induk, dikoleksi
jantungnya. Isolasi cardiomyocyte dilakukan menurut Lin et al. (2005). Total
cardiomyocyte yang didapat adalah 3,9 juta sel/ml DMEM yang kemudian dibagi
ke dalam 6 cawan petri 35 mm yang telah dilapisi gelatin sebelumnya dan
ditambahkan media kultur primer cardiomyocyte hingga 2 ml. Hasil pengamatan
menunjukkan bahwa dua hari setelah penanaman awal, hampir seluruh
cardiomyocyte telah melekat pada cawan petri dan secara spontan berdenyut
akibat depolarisasi gelombang yang diinisiasi oleh pacemaker. Adapun struktur
dari cardiomyocyte memiliki sedikit perbedaan dengan cardiomyocyte mencit
dewasa yang sudah memiliki ikatan myofibril yang lebih baik serta bentuk sel
yang memanjang.
Setelah 48 jam, medium kultur tersebut diganti dengan medium kultur
bebas serum dan dikultur selama 24 jam. Kemudian kultur primer cardiomyocyte
tersebut dikultur dalam medium kultur yang diinduksi LIF dengan konsentrasi 0
dan 10 ng/ml. Total conditioned medium yang didapat pada tiap pemberian LIF
adalah masing-masing sebanyak 24 ml (CML0 dan CML10). Tiap jenis CM
tersebut kemudian difilter dengan filter 0.22 m dan disimpan pada suhu 4oC
24
Penyediaan Embryonic Stem Cells
Koleksi Blastosis dan Isolasi Inner Cell Mass
Untuk mendapatkan sumber ESC, yaitu ICM pada embrio tahap blastosis,
dilakukan koleksi embrio pada hari ke-3.5 setelah penyuntikan hormon hCG.
Dari hasil koleksi, terdapat embrio yang belum mencapai tahap blastosis (Tabel
2).
Tabel 2 Persentase Rata-rata Perolehan Blastosis dan ICM
Jumlah Embrio Blastosis
215+19.92 43.88+12.06 72.71+5.13 100+4.04 95.95+0
Persentase rata-rata blastosis yang didapat pada tiap pengulangan adalah
43.88% dari total embrio yang dikoleksi. Setelah seluruh embrio yang dikoleksi
dikultur selama 24 jam, persentase blastosis meningkat menjadi 72.71%. Oleh
karena itu isolasi ICM dilakukan 24 jam setelah proses koleksi embrio. Menurut
Nagy et al. (2003), pada hari ke-3.5 days postcoitum (dpc) embrio mencit
mencapai tahap blastosis. Namun dengan adanya perkembangan embrio pada tiap
individu yang tidak sama maka embrio yang didapat pada hari ke-3.5 dpc
bervariasi dari embrio tahap morula hingga blastosis ekspan.
Sebelum dilakukan isolasi ICM, terlebih dahulu seluruh blastosis yang
telah dikoleksi dihilangkan zona pellucida-nya. Proses menghilangkan zona
pellucida dilakukan dengan inkubasi blastosis dalam enzim pronase 0.25% selama
7-10 menit. Waktu yang diperlukan untuk menghilangkan zona pellucida pada
tiap blastosis menunjukkan perbedaan, tergantung pada ketebalan dari zona
pellucida. Menurut Nagy et al. (2003), blastosis pada umumnya memiliki zona
pellucida dengan ketebalan sekitar 7 m. Namun pada blastosis hasil koleksi
didapatkan ketebalan zona pellucida yang tidak seragam. Perbedaan ketebalan
zona pellucida tersebut berkaitan dengan tahapan dari blastosis itu sendiri. Dalam
perkembangannya blastosis memiliki tiga tahapan perkembangan, yaitu blastosis
awal, blastosis, dan blastosis ekspan. Ketika blastosis mencapai tahapan ekspan,
berhubungan dengan mendekatinya proses implantasi pada perkembangan in vivo,
pada saat ini sel-sel trofoblas akan mensintesis enzim yang menyerupai tripsin
yang akan mencerna lapisan glikoprotein dari zona pellucida (Nagy et al. 2003).
Hasil kerja enzim pronase selama proses pelisisan zona pellucida diamati di
bawah miskroskop untuk melihat keberadaan zona peluucida. Blastosis yang
sudah tidak dilapisi zona pellucida segera dipindahkan ke drop yang berisi
DMEM plus FBS untuk menghentikan kerja enzim pronase.
Gambar 5 Inkubasi blastosis dalam pronase: (a) lisisnya zona pellucida dari blastosis eksplan, (b) zona pellucida yang belum lisis. Pronase 0.25% selama 7 menit. Bar = 50 m.
Setelah proses penghilangan zona pellucida, selanjutnya dilakukan isolasi
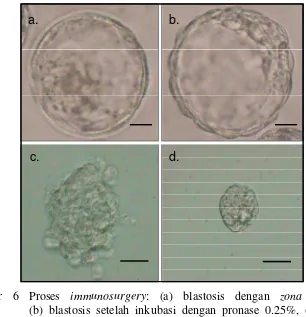
ICM dengan menggunakan metode immunosurgery (Gambar 6). Pada proses
immunosurgery, rabbit anti-mouse antibody dan complement sera from guinea pig
terlebih dahulu dilarutkan dalam medium DMEM tanpa FBS dengan
perbandingan 1:3, dan waktu inkubasi tiap serum adalah 90 menit. Konsentrasi
serum dan waktu inkubasi yang digunakan dalam penelitian ini merupakan hasil
optimasi dari beberapa konsentrasi serum dan waktu inkubasi. Saat blastosis
diinkubasi dalam rabbit anti-mouse antibody, antibodi tersebut akan mengenali
sel-sel trofoblas dan akan berikatan dengannya. Ikatan tersebut kemudian akan
dilisiskan oleh complement sera from guinea pig, sehingga hanya akan tersisa
ICM saja ( Nagy et al. 2003). Hasil immunosurgery didapatkan 95.95% ICM atau a
b
b
26
150 ICM dari tiap ulangan yang kemudian dikultur dalam medium kultur ESC
yang diinduksi dengan LIF untuk mempertahankan sifat pluripotensinya serta
tetap berproliferasi.
Gambar 6 Proses immunosurgery: (a) blastosis dengan zona pellucida, (b) blastosis setelah inkubasi dengan pronase 0.25%, (c) lisisnya
trofoblas setelah immunosurgery, (d) ICM. Bar = 50 m.
Kultur Inner Cell Mass dan Uji Pluripotensi
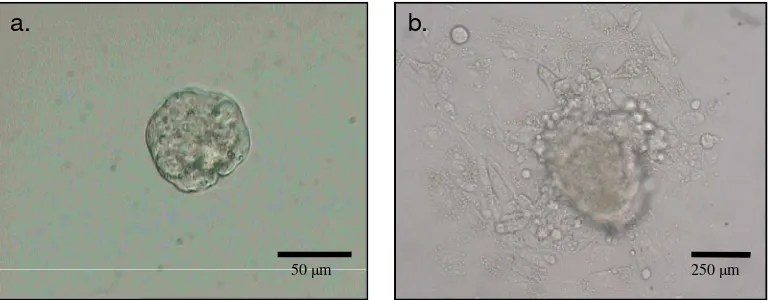
Hasil pengamatan selama 7 hari kultur ICM menunjukkan bahwa rata-rata
terdapat 25 koloni ICM yang terbentuk dari penanaman 150 ICM di awal kultur
(Gambar 7). Hal tersebut diakibatkan terjadinya penggabungan antara ICM yang
satu dengan yang lain membentuk koloni. Selain itu, rendahnya ICM yang
berkembang dalam kultur bisa jadi diakibatkan kerusakan ICM pada saat proses
isolasinya. Kerusakan ICM pada metode immunosurgery umumnya terjadi pada
blastosis yang selama proses penghilangan zona pellucida mengalami
pengkerutan, yang mengindikasikan bahwa ikatan antara sel trofoblas sudah
terputus. Ketika blastosis yang demikian diinkubasi pada kedua serum yang
a. b.
digunakan dalam metode immunosurgery, maka kedua serum tersebut selain
melisiskan trofoblas yang ada di bagian luar juga akan dapat masuk ke dalam
blastosis dan menyebabkan kerusakan ICM.
Gambar 7 Kultur ICM: (a) hari ke-0, (b) hari ke-7)
Hasil ICM di atas selanjutnya dikultur dengan menggunakan medium
kultur yang diberi tambahan 20ng/ml LIF. Seperti telah diketahui bahwa pada
kultur ESC mencit, LIF memiliki peranan untuk menjaga sel tetap berproliferasi
tanpa berdiferensiasi. Hal ini dikarenakan adanya ikatan LIF dengan
reseptor-reseptor spesifiknya pada sel punca (LIFR dan gp130) yang memicu terjadinya
aktivasi dari faktor transkripsi STAT3, yang berperan penting dalam menjaga
kelangsungan proliferasi ESC dari mencit secara in vitro (Wobus et al. 2005; Pan
& Thomson 2007). Adapun penambahan LIF dalam medium kultur ESC dengan
konsentrasi di atas rata-rata (biasanya 10ng/ml) dilakukan untuk mengatasi
kekurangan suplai LIF dalam medium yang biasanya terpenuhi oleh feeder layer
yang digunakan, yaitu mouse embryonic fibroblast (MEF) (Xu et al. 2005).
Fungsi MEF untuk mensekresikan faktor pertumbuhan yang penting untuk
proliferasi dan mempertahankan pluripotensi dari ESC (bFGF dan LIF), pada
penelitian ini digantikan dengan penambahan konsentrasi LIF dalam medium
kultur untuk menjaga kelangsungan proliferasi ESC tanpa berdiferensiasi.
Sedangkan fungsi MEF sebagai substrat tempat sel melekat sehingga sel dapat
berproliferasi dengan baik (Heng et al. 2004), dalam penelitian ini digantikan oleh
gelatin tipe B yang berasal dari kulit sapi, merupakan substansi protein yang
berasal dari kolagen, protein alami yang ada di tendon, ligamen, dan jaringan
50 m 250 m