KARAKTERISASI GEL CINCAU HIJAU KEMASAN
SELAMA PENYIMPANAN DINGIN
RADEN DANI BRIANTOTO
ILMU DAN TEKNOLOGI PANGAN FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
Dengan ini saya menyatakan bahwa skripsi berjudul Karakterisasi Gel Cincau Hijau Kemasan Selama Penyimpanan Dingin adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Februari 2014
Raden Dani Briantoto
ABSTRAK
RADEN DANI BRIANTOTO. Karakterisasi Gel Cincau Hijau Kemasan Selama Penyimpanan Dingin. Dibimbing oleh ENDANG PRANGDIMURTI dan DIAN HERAWATI.
Gel cincau hijau tanpa perlakuan pemanasan memiliki masa simpan yang sangat pendek, yaitu satu hari jika disimpan dalam suhu ruang. Pada penelitian sebelumnya telah berhasil dibuat gel cincau hijau dengan penambahan hidrokoloid untuk mempertahankan karakteristik fisiknya setelah dipanaskan. Penelitian ini bertujuan untuk mempelajari karakteristik gel cincau hijau dengan perlakuan pasteurisasi (CHP) dan pengukusan (CHK) pada penyimpanan suhu dingin (5-10oC) selama 15 hari. Produk dianalisis setiap tiga hari dari aspek fisik (kekuatan gel, warna, laju sineresis, dan nilai pH), aspek mikrobiologi (TPC), dan aspek fungsional (total klorofil, komponen fenolik, kapasitas antioksidan, dan serat pangan). Hasil penelitian menunjukkan bahwa secara umum CHP dan CHK memiliki perubahan dengan pola yang hampir sama, yaitu mengalami peningkatan sineresis, serat pangan, dan total mikroba, sedangkan intensitas warna hijau, nilai pH, total klorofil, total fenol, dan kapasitas antioksidan mengalami penurunan selama penyimpanan selama 15 hari. Pada akhir penyimpanan, CHP mengalami sineresis (6,66%) yang lebih besar daripada CHK (4,90%). Nilai pH keduanya relatif stabil selama penyimpanan. CHK memiliki warna yang lebih hijau (nilai a* lebih negatif) daripada CHP, terutama pada awal penyimpanan. Pada akhir penyimpanan, seluruh aspek fungsional CHP dan CHK mengalami sedikit penurunan dibandingkan pada awal penyimpanan. CHK memenuhi SNI 7388:2009 tanpa penyimpanan, sedangkan CHP memenuhi SNI hingga penyimpanan hari ke-12.
ABSTRACT
RADEN DANI BRIANTOTO. Characterization of Packaged Green Grass Jelly during Cool Storage. Supervised by ENDANG PRANGDIMURTI and DIAN HERAWATI.
Green grass jelly without heat treatment has a very short shelf life, which is one day if stored at ambient temperature. In the previous research, green grass jelly with addition of hydrocolloid had been made to maintain its physical characteristic after heat treatment. The objective of this research is to study the characteristic of pasteurized (CHP) and steamed (CHK) green grass jelly at cool storage (5-10oC) for 15 days. The product had been analyzed for its physical (gel strength, colour, syneresis rate, and pH value), microbiological (TPC), and functional properties (total chlorophyll, phenolic compound, antioxidant capacity, dietary fiber) every three days. The result showed that CHP and CHK commonly have similar pattern of changes, which had increased in syneresis rate, dietary fiber, and total microbes, whereas green colour intensity, pH value, total chlorophyll, total phenolic compound, and antioxidant capacity decreased after stored within 15 days. In the end of storage period, syneresis rate of CHP (6,66%) was higher than CHK (4,90%). pH value were relatively stable during storage for both products. CHK had higher green colour intensity (a* value more negative) than CHP, which prominently showed at the beginning of storage. All functional properties of CHP and CHK slightly decreased during storage. CHK complied SNI 7388:2009 without storage, while CHP complied SNI until 12 days of storage.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Teknologi Pertanian
pada
Departemen Ilmu dan Teknologi Pangan
KARAKTERISASI GEL CINCAU HIJAU KEMASAN
SELAMA PENYIMPANAN DINGIN
RADEN DANI BRIANTOTO
ILMU DAN TEKNOLOGI PANGAN FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
Judul Skripsi : Karakterisasi Gel Cincau Hijau Kemasan Selama Penyimpanan Dingin
Nama : Raden Dani Briantoto NIM : F24090131
Disetujui oleh
Dr Ir Endang Prangdimurti, MSi NIP. 19680723 199203 2 001
Dian Herawati, STP, MSi NIP. 19750111 200701 2 001
Diketahui oleh
Dr Ir Feri Kusnandar, M.Sc NIP. 19680526 199303 1 004
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah swt atas segala karunia-Nya sehingga skripsi tugas akhir ini berhasil diselesaikan pada waktu yang tepat. Penelitian dilakukan di Laboratorium ITP IPB. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Februari 2013 ini ialah pangan tradisional yang memiliki sifat fungsional yang baik untuk kesehatan, dengan judul Karakterisasi Gel Cincau Hijau Kemasan Selama Penyimpanan Dingin. Penelitian ini adalah penelitian lanjutan dari penelitian sebelumnya.
Pada kesempatan ini penulis mengucapkan terima kasih kepada bapak, mama, dan adik yang selalu memberi dukungan, doa, dan kasih sayang. Terima kasih penulis ucapkan kepada Ibu Dr. Ir. Endang Prangdimurti, Msi dan Ibu Dian Herawati, STP, Msi selaku dosen pembimbing yang selalu memberikan saran, pengarahan, dan bimbingan selama kuliah, penelitian, hingga tersusunnya skripsi ini. Terima kasih kepada Ibu Antung Sima Firlieyanti, STP, M.Sc atas saran dan kesediaan waktu sebagai dosen penguji. Terima kasih untuk DIKTI selaku pemberi dana melalui skema Penelitian Unggulan Perguruan Tinggi tahun 2012-2013. Terima kasih kepada rekan selama penelitian Rizki W., Agustin T. H., dan M. Putra A. yang telah bekerjasama dengan sangat baik. Terima kasih kepada Kak Gita, Kak Andika, dan Kak Bangun untuk saran dan masukannya. Terima kasih untuk laboran dan teknisi Bapak Rojak, Bapak Gatot, Ibu Antin, Mbak Nurul, Mbak Vera, dan Mbak Ari yang membantu dalam kegiatan analisis. Terima kasih untuk Pak Parman yang selalu bersedia meluangkan waktunya mencari bahan baku daun cincau hijau. Terima kasih teman-teman ITP 46 yang saya sayangi dan saya banggakan Farah, Afi, Sarida, Icha, Pricilia, Lina, Cicely, Ayash, Mila, Grace, Trina, Cici, Jaim, Olga, Iqbal, Ajie, Seno, Anan, Ardi, Yanda, Charles, dan rekan-rekan lainnya yang tidak dapat saya sebutkan satu per satu. Terima kasih kepada staf UPT ITP Mbak Anie, Mbak Darsih, Bu Novie, serta Ibu dan Bapak UPT lainnya untuk informasi dan pelayanan yang ramah.
Penulis mengharapkan segala masukan dan kritik yang membangun karena skripsi ini masih jauh dari sempurna. Semoga skripsi tugas akhir ini bermanfaat bagi semua pihak yang membutuhkan terutama untuk perkembangan teknologi pangan. Terima kasih.
Bogor, Februari 2014
DAFTAR ISI
DAFTAR TABEL DAFTAR GAMBAR DAFTAR LAMPIRAN
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
METODOLOGI PENELITIAN 2
Alat dan Bahan 3
Metode Penelitian 3
HASIL DAN PEMBAHASAN 7
Karakteristik Gel Cincau Hijau Selama Penyimpanan Suhu Dingin 7 Analisis Korelasi Karakteristik Gel Cincau Hijau 20
SIMPULAN DAN SARAN 25
Simpulan 25
Saran 25
DAFTAR PUSTAKA 26
LAMPIRAN 29
DAFTAR TABEL
1 Hasil analisis mikrobiologi gel cincau hijau selama penyimpanan
dingin 20
2 Interpretasi koefisien korelasi nilai r 21
3 Tingkat korelasi perubahan gel cincau hijau selama penyimpanan
dingin 21
DAFTAR GAMBAR
1 Diagram alir penelitian 2
2 Bentuk umum kurva standar dari Stevens LFRA Texture Analyser 4 3 Perubahan persentase sineresis gel cincau hijau selama penyimpanan
dingin 8
4 Perubahan kecepatan sineresis gel cincau hijau selama penyimpanan
dingin 9
5 Perubahan nilai pH gel cincau hijau (tanpa air sineresis) selama
penyimpanan dingin 10
6 Perubahan nilai L* gel cincau hijau selama penyimpanan dingin 11 7 Perubahan nilai a* gel cincau hijau selama penyimpanan dingin 11 8 Perubahan nilai b* gel cincau hijau selama penyimpanan dingin 12 9 Perubahan warna gel cincau hijau selama penyimpanan dingin 12 10 Perubahan kekuatan pecah gel cincau hijau selama penyimpanan
dingin 13
11 Perubahan titik pecah gel cincau hijau selama penyimpanan dingin 14 12 Perubahan rigiditas gel cincau hijau selama penyimpanan dingin 14 13 Perubahan total klorofil gel cincau hijau selama penyimpanan dingin 15 14 Perubahan total fenol gel cincau hijau selama penyimpanan dingin 16 15 Perubahan kapasitas antioksidan gel cincau hijau selama
penyimpanan dingin 17
16 Kadar serat gel cincau hijau kukus selama penyimpanan dingin 19 17 Kadar serat gel cincau hijau pasteurisasi selama penyimpanan dingin 19
DAFTAR LAMPIRAN
1 Standar Nasional Indonesia 7388:2009 tentang Batas Maksimum
Cemaran Mikroba dalam Pangan 29
2 Persentase dan kecepatan sineresis gel cincau hijau selama
penyimpanan dingin 30
3 Nilai pH gel cincau hijau selama penyimpanan dingin 31 4 Nilai L*a*b* gel cincau hijau selama penyimpanan dingin 32 5 Tekstur gel cincau hijau selama penyimpanan dingin 33 6 Total klorofil gel cincau selama penyimpanan dingin 34
7 Kurva standar asam galat 35
8 Total fenol gel cincau hijau selama penyimpanan dingin 36
10 Kapasitas antioksidan gel cincau hijau selama penyimpanan dingin 38 11 Kadar air gel cincau hijau selama penyimpanan dingin 39 12 Mikrobiologi gel cincau hijau selama penyimpanan dingin 40 13 Uji statistik t-test kadar serat gel cincau hijau kukus selama
penyimpanan dingin 41
14 Uji statistik t-test kadar serat gel cincau hijau pasteurisasi selama
penyimpanan dingin 43
PENDAHULUAN
Latar Belakang
Cincau hijau adalah makanan tradisional yang secara tradisional banyak digunakan sebagai obat penurun panas, obat radang lambung, rasa mual, dan penurun tekanan darah tinggi (Sunanto 1995). Hasil ekstraksi daun cincau yang berwarna hijau menunjukkan tingginya kandungan klorofil. Selain itu, daun cincau hijau mengandung senyawa fenolik yang bersifat sebagai antioksidan dan antikanker (Zakaria et al. 2001). Cincau hijau dapat membentuk gel yang bersifat
irreversibel walaupun hanya diekstrak dengan menggunakan air dingin. Gel yang terbentuk mudah sekali mengalami sineresis, yaitu peristiwa keluarnya air dari gel cincau hijau (Sunanto 1995).
Pemanfaatan gel cincau hijau masih terbatas karena produk tersebut relatif tidak dapat bertahan lama. Hal ini karena beberapa kendala utama dalam proses pembuatan gel cincau hijau antara lain persiapan dan proses pembuatannya yang masih tergolong tradisional tanpa adanya proses pemanasan, kemungkinan penggunaan air yang tidak memenuhi syarat mutu, dan sanitasi yang tidak terjamin. Faktor-faktor tersebut menyebabkan tingginya cemaran biologis sehingga umur simpan gel cincau hijau menjadi sangat singkat. Hasil analisis mikrobiologi terhadap 14 sampel cincau hijau memperlihatkan bahwa sampel gel cincau hijau mengandung total mikroba sebesar 1,6 x 104 sampai dengan 2,0 x 106 CFU/g (Pramitasari 2012). Oleh karena itu, perlu dilakukan proses termal untuk mengurangi tingkat cemaran mikroba pada produk. Namun, proses termal dapat mengakibatkan tingginya laju sineresis dan mempengaruhi degradasi warna produk.
Penambahan hidrokoloid pada produk gel cincau hijau dapat memperbaiki tekstur produk walaupun mengalami perlakuan pemanasan pada proses pembuatannya. Hidrokoloid yang digunakan adalah karagenan sebanyak 2,00 %. Produk yang telah diberi tambahan karagenan ini tidak berbeda nyata dengan produk cincau komersial secara tekstur, warna, dan sensori. Penambahan NaHCO3 sebanyak 0,125% pada ekstrak cincau dapat mempertahankan warna hijau produk, memiliki laju sineresis yang rendah, dan dapat mempertahankan pH pada kisaran nilai pH normal (Prakoso 2013).
Perlakuan pasteurisasi pada suhu 95oC selama 22 menit terhadap gel cincau hijau yang diberi penambahan hidrokoloid memiliki tingkat sineresis yang tidak berbeda signifikan dengan cincau tanpa pelakuan pasteurisasi. Selain itu, pasteurisasi ini dapat mempertahankan karakter fisik dan fungsional serta dapat menurunkan log mikroba target sebanyak 5,22 log CFU/g gel cincau hijau (Ginanjar 2013). Perlakuan pengukusan gel cincau hijau pada suhu 100oC selama 5 menit dapat menurunkan log mikroba target sebanyak 1,76 log CFU/g gel cincau hijau (Prakoso 2013).
2
dingin produk gel cincau yang telah diberi tambahan hidrokoloid berupa karagenan perlu diteliti lebih lanjut.
Tujuan Penelitian
Tujuan penelitian untuk mengetahui perubahan mutu fisik, mikrobiologis, dan fungsional produk gel cincau hijau yang telah mengalami perlakuan pasteurisasi dan pengukusan selama penyimpanan suhu dingin (5-10oC).
METODOLOGI PENELITIAN
Tahap pertama penelitian adalah pembuatan gel cincau hijau menggunakan bahan baku daun cincau segar dengan penambahan NaHCO3 dan karagenan dengan perlakuan pengukusan sesuai dengan formulasi dari Prakoso (2013). Selanjutnya, dilakukan pengamatan setiap tiga hari selama 15 hari terhadap karakter produk selama penyimpanan dengan analisis terhadap sifat fisik, mikrobiologis, dan sifat fungsionalnya sesuai dengan interval pengamatan yang telah ditentukan.
Gambar 1 Diagram alir penelitian
Gel cincau hijau dibuat dari bahan baku daun tanaman cincau segar dengan usia 1-3 hari setelah dipanen. Daun yang tidak langsung diproses harus disimpan pada suhu refrigerator, yaitu 5-10oC, untuk mengurangi laju kerusakan daun yang berdampak pada warna produk yang dihasilkan.
Daun cincau dipilih dan dipisahkan dari tangkainya kemudian dicuci bersih dengan air mengalir. Daun diblansir selama 2-3 menit pada suhu 70-80oC. Perbandingan antara daun dan air (AMDK) yang digunakan adalah 1:15 sesuai dengan konsentrasi terbaik yang dilaporkan oleh Wyanto (2000). Ekstrak cincau hijau dibuat berdasarkan cara yang dilakukan Prakoso (2013). Sebanyak 100 gram
Pembuatan gel cincau hijau dengan penambahan karagenan dan NaHCO3 dalam kemasan cup plastik
Pengukusan
Analisis setiap tiga hari terhadap sifat fisik (sineresis, warna, pH, tekstur), mikrobiologis (TPC), dan fungsional (klorofil, fenol,
antioksidan, serat)
Pasteurisasi
3 daun cincau yang telah bersih diremas-remas secara perlahan di dalam 1500 ml AMDK. Hasil ekstraksi disaring dengan dua lapis kain saring sambil diperas.
Larutan karagenan dan NaHCO3 disiapkan terpisah. Sebanyak 2,00 gram karagenan dilarutkan sedikit demi sedikit untuk setiap 100 ml ekstrak cincau hijau. Setelah karagenan larut, ditambahkan 0,125 gram NaHCO3 untuk setiap 100 ml ekstrak cincau hijau dan diaduk hingga homogen. Selanjutnya, campuran ekstrak cincau hijau, karagenan, dan NaHCO3 dimasukkan ke dalam cup poliester dan dilakukan proses sealing dengan plastik PE (polietilen) polos dengan tebal 0,02 mm sebelum membentuk gel. Proses gelling dilakukan dengan mendiamkan ekstrak cincau hijau selama 2,5 jam pada suhu ruang. Setelah struktur gel terbentuk, produk dikukus dengan uap panas pada suhu 100oC selama 5 menit untuk cincau kukus atau dipasteurisasi pada suhu 95oC selama 22 menit untuk cincau pasteurisasi. Produk didinginkan pada suhu ruang dan disimpan dalam refrigerator pada suhu 5-10oC.
Analisis dilakukan dengan mengamati perubahan yang terjadi pada produk yang disimpan pada suhu refrigerator (5-10oC) setiap tiga hari sekali. Parameter yang diamati selama penyimpanan adalah fisik (sineresis, warna, tekstur, pH), mikrobiologi (total mikroba, total kapang dan kamir), dan fungsional (total klorofil, total fenol, kapasitas antioksidan, serat).
Alat dan Bahan
Alat
Alat yang digunakan dalam penelitian ini adalah refrigerator, sentrifusa, pH meter, Stevens LFRA Texture Analyser, Chromameter Minolta CR 300, neraca analitik, kain saring, cup plastik, tabung reaksi, labu takar, labu erlenmeyer, pipet volumetrik, mikropipet, dan cawan petri
Bahan
Bahan-bahan yang digunakan dalam pembuatan gel cincau hijau adalah daun cincau hijau Premna oblongifolia Merr., Air Minum Dalam Kemasan (AMDK), NaHCO3, dan karagenan. Bahan-bahan yang digunakan untuk analisis adalah buffer fosfat dengan pH 7,00, reagen Folin-Ciocalteau, sodium karbonat 5%, asam galat, asam askorbat, metanol 99,9%, reagen DPPH, dan aseton 99,8%.
Metode Penelitian
Sineresis
Sineresis gel diamati menurut standar AOAC (1995) dengan menyimpan gel yang terbentuk pada suhu refrigerator. Sineresis gel dihitung dengan mengukur air yang keluar dari gel (kehilangan berat) selama penyimpanan dan kemudian dibandingkan dengan berat gel awal. Air yang keluar dari gel dipisahkan dengan menggunakan kertas saring.
Sineresis Gel =
4
Warna
Perubahan warna produk diamati dengan alat Minolta CR 300 Chromameter yang bekerja berdasarkan prinsip pengukuran warna yang dipantulkan dari permukaan sampel. Lampu getar di dalam alat akan memancarkan sinar xenon dan menghasilkan penyebaran serta penerangan cahaya yang merata pada permukaan sampel. Hasil pengukuran chromameter dikonversikan ke dalam sistem Hunter dengan lambang L*, a*, dan b*. Nilai L* menyatakan parameter kecerahan yang memiliki nilai 0 (hitam) sampai 100 (putih). Nilai a* menyatakan warna kromatik campuran merah dan hijau, dengan nilai +a* (positif) dari 0 sampai +100 untuk warna merah dan nilai –a* (negatif) dari 0 sampai -80 untuk warna hijau. Nilai b* menyatakan warna kromatik campuran biru dan kuning, dengan nilai +b* (positif) dari 0 sampai +70 untuk warna biru dan nilai –b* (negatif) dari 0 sampai -70 untuk warna kuning.
Nilai pH
Alat pH meter dikalibrasi dengan menggunakan larutan buffer pH 4,00 dan 7,00. Sebelum pengukuran, produk gel cincau hijau dihomogenkan dengan cara memotong-motong dan digerus hingga halus. Sampel yang telah homogen diukur pH dengan menggunakan pH meter yang telah dikalibrasi.
Tekstur
Tekstur gel diukur dengan menggunakan alat Stevens LFRA Texture Analyser dengan kondisi pengukuran sebagai berikut: jarak antara probe dengan gel sebesar 60 mm, kecepatan probe 1 mm/detik, kecepatan kertas 1 mm/detik, diameter probe sebesar 0,5 inchi, sensitivitas 100 mV, dan tegangan 60%.
Parameter yang diamati pada pengukuran ini adalah kekuatan pecah gel, titik pecah gel, dan rigiditas gel dengan menggunakan rumus Angalet (1986) serta Fry dan Hudson (1983) yang telah dimodifikasi sebagai berikut:
Kekuatan pecah (g/cm2) =
=
Titik pecah (cm) = penetrasi pecah = AC
Rigiditas (g/cm) =
=
5
Total Plate Count
Sampel ditimbang 10 gram dalam plastik steril dan ditambahkan pengencer sebanyak 90 ml. Setelah homogen, larutan sampel diencerkan hingga tingkat pengenceran 10-3. Dari masing-masing tingkat pengenceran diambil 1 ml dan dimasukkan ke dalam cawan petri steril (duplo), lalu ditambahkan media Plate Count Agar (PCA) sebanyak 12-15 ml. Setelah agar memadat, cawan diinkubasi dengan posisi terbalik pada suhu 37C selama 48 ± 2 jam. Setelah inkubasi, jumlah koloni yang tumbuh pada cawan dihitung dan dilaporkan berdasarkan metode Bacteriological Analytical Manual (BAM 2001). Cawan yang dipilih adalah cawan yang menunjukkan jumlah koloni antara 25-250.
Total Kapang dan Kamir
Sampel tanpa air sineresis ditimbang 10 gram dalam plastik steril dan ditambahkan pengencer sebanyak 90 ml. Setelah homogen, larutan sampel diencerkan hingga tingkat pengenceran 10-3. Dari masing-masing tingkat pengenceran diambil 1 ml dan dimasukkan ke dalam cawan petri steril (duplo), lalu ditambahkan media Acidified Potato Dextrose Agar (APDA) sebanyak 12-15 ml. Setelah agar memadat, cawan diinkubasi dengan posisi terbalik pada suhu 30C selama 48 ± 2 jam. Setelah inkubasi, jumlah koloni yang tumbuh pada cawan dihitung dan dilaporkan berdasarkan metode Bacteriological Analytical Manual (BAM 2001). Cawan yang dipilih adalah cawan yang menunjukkan jumlah koloni antara 15-150.
Total Klorofil
Analisis dilakukan menurut metode penelitian yang dilakukan oleh Nollet (2000). Gel cincau hijau yang sudah dipisahkan dari air sineresis diekstrak sebanyak ± 2,5 gram dengan aseton 99,8% dan ditepatkan 10 ml. Kemudian divorteks dan dibiarkan selama satu malam dalam refrigerator. Selanjutnya sampel disentrifugasi dengan kecepatan 3000 rpm selama 15 menit. Pengukuran filtrat dilakukan menggunakan spektrofotometer pada gel cincau hijau tanpa air sineresis dengan panjang gelombang 645 nm dan 663 nm. Total klorofil, klorofil a, dan klorofil b dihitung dengan persamaan berikut:
Total klorofil (mg/L) = 20,2 A645 nm + 8,02 A663 nm Klorofil a (mg/L) = 12,7 A663 nm – 2,69 A645 nm Klorofil b (mg/L) = 22,9 A645 nm – 4,68 A663 nm
Total Fenol
Analisis dilakukan dengan metode penelitian yang dilakukan oleh Sakanaka
6
panjang gelombang 760 nm. Konsentrasi total fenol dihitung berdasarkan kurva standar asam galat dan dinyatakan sebagai mg GAE per g gel cincau hijau.
Kapasitas Antioksidan
Gel cincau hijau ± 1 gram yang sudah dipisahkan dari air sineresis diekstrak dengan 7 ml larutan metanol. Sampel disentrifusa pada kecepatan 3000 rpm selama 15 menit. Supernatan kemudian diambil sebanyak 6 ml dan ditambahkan 2 ml larutan DPPH 0,25 mM. Kemudian diinkubasi pada suhu ruang dan ruang gelap selama 30 menit. Pengukuran absorbansi dilakukan dengan spektrofotometer pada panjang gelombang 517 nm sesuai metode penelitian Sharma dan Bhat (2009). Konsentrasi kapasitas antioksidan dihitung berdasarkan kurva standar asam askorbat dan dinyatakan sebagai mg AEAC per g gel cincau hijau.
Kadar Serat Pangan
Analisis dilakukan dengan metode penelitian yang dilakukan oleh Asp et al.
(1983). Terdapat empat tahap dalam menentukan Soluble Dietary Fiber (SDF),
Insoluble Dietary Fiber (IDF), dan Total Dietary Fiber (TDF). Persiapan sampel
Sampel diberi perlakuan freeze-dried, kemudian 1,0 gram sampel dimasukkan ke dalam erlenmeyer dan ditambahkan 25 ml buffer sodium fosfat pH 6,00. Sebanyak 100 µ L enzim termamyl ditambahkan ke dalam suspensi sampel dan diinkubasi pada suhu 80oC selama 15 menit pada inkubator bergoyang. Setelah dingin, pH diatur hingga 1,5 dangan menambahkan HCl 4 N. Selanjutnya ditambahkan 1 ml enzim pepsin (0,1 g/ml) dan diinkubasi kembali pada suhu 37oC selama 120 menit dengan perlakuan pengadukan.
Pengaturan pH dilakukan kembali hingga 6,8 dengan menambahkan NaOH 4 N. Enzim pankreatin (0,1 g/ml) ditambahkan dan diinkubasi lagi pada suhu 37oC selama 120 menit dengan perlakuan pengadukan. Kemudian pH diatur hingga 4,5 dengan HCl 4 N dan disaring vakum dengan kertas saring Whatman No. 40 yang telah dikeringkan hingga diperoleh berat yang konstan (B). Penyaringan disertai pembilasan dengan air destilata sebanyak 2 x 10 ml sehingga diperoleh residu dan filtrat.
Penentuan serat pangan tidak larut (Insoluble Dietary Fiber)
Residu dicuci dengan 2 x 10 ml etanol 78% dan 2 x 10 ml aseton pro analisis. Larutan residu dikeringkan pada suhu 105oC hingga mencapai berat konstan selama 3 jam (C). Cawan porselin dipanaskan dengan oven pada suhu 105oC dan ditimbang setelah dingin (D). Kertas saring dan residu diabukan dalam tanur pada suhu 500oC selama 5 jam, kemudian ditimbang setelah dingin (E). Penentuan serat pangan larut (Soluble Dietary Fiber)
7 dengan oven pada suhu 105oC selama 1-3 jam, didinginkan dalam desikator dan ditimbang (H). Selanjutnya kertas saring dan residu diabukan pada suhu 550°C selama 5 jam, didinginkan dalam desikator, dan ditimbang (I).
Penentuan total serat pangan (Total Dietary Fiber)
Total serat didapatkan dari hasil penjumlahan serat makanan tidak larut dan serat makanan larut dalam bahan. Persamaan yang digunakan adalah sebagai berikut:
% Serat pangan tidak larut (IDF) dalam basis kering IDF = [( - )-( - )]
% Serat pangan larut (SDF) dalam basis kering SDF = [( - )-(- )]
% Total serat pangan = % IDF + % SDF Keterangan :
A = bobot sampel kering (g) B,F = bobot kertas saring kering (g)
C,G = bobot kertas saring dan residu setelah pengeringan (g) D, H = bobot cawan porselin kering (g)
E, I = bobot cawan porselin kering dan abu sampel (g)
Rancangan Percobaan
Rancangan percobaan secara umum disusun secara duplo dengan 2 kali ulangan. Hasil tiap pengamatan dilihat perubahannya selama penyimpanan dingin. Kemudian dilanjutkan dengan uji Pearson untuk mengetahui korelasi antar perubahan selama penyimpanan.
HASIL DAN PEMBAHASAN
Karakteristik Gel Cincau Hijau Selama Penyimpanan Suhu Dingin
Sineresis
Sineresis adalah peristiwa keluarnya air dari gel cincau hijau (Sunanto 1995). Sineresis yang terjadi pada gel cincau hijau relatif tinggi dan cepat. Umumnya air di dalam gel hanya termobilisasi secara mekanis, sehingga masih menunjukan sifat sebagai air bebas yang dapat dikeluarkan dari gel dengan cara pemanasan (Whitney 1969 yang dikutip oleh Untoro 1985). Menurut Aurand dan Woods (1973), sineresis dipengaruhi oleh nilai pH, temperatur, tekanan mekanik, dan konsentrasi fase terdispersi.
8
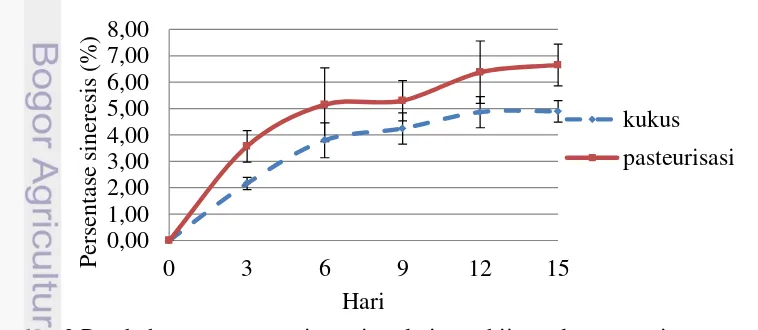
pembentukan agregat yang terus terjadi sehingga ikatan gel mengkerut dan membebaskan air bebas yang lebih banyak (Ginanjar 2013). Peningkatan terbesar terjadi hingga penyimpanan hari ke-6. Nilai rata-rata kecepatan sineresis berada pada kisaran 0,00 - 0,72% untuk cincau hijau kukus dan 0,00 - 1,19% untuk cincau hijau pasteurisasi. Kecepatan sineresis mencapai puncaknya pada penyimpanan hari ke-3 dan mengalami penurunan kecepatan pada hari berikutnya. Kecepatan sineresis sempat meningkat pada penyimpanan hari ke-12, namun menurun kembali pada hari berikutnya. Secara umum, sineresis pada gel cincau hijau kukus dan pasteurisasi semakin meningkat dengan lamanya waktu penyimpanan, namun kecepatannya semakin menurun. Hasil pengamatan terhadap sineresis gel cincau hijau selama penyimpanan dingin dapat dilihat selengkapnya pada Lampiran 2.
Artha (2001) menyebutkan bahwa komponen utama pembentuk gel cincau hijau merupakan polimer pektin bermetoksi rendah dengan asam D-galakturonat g g β-(1,4)-glikosidik dan galaktosa sebagai rantai sampingnya. Kelarutan karagenan dikaitkan dengan struktur molekulnya, terutama derajat hidrofiliknya, yaitu gugus ester sulfat dan unit galaktopiranosa yang berlawanan dengan unit 3,6 anhidro-D-galaktosa yang bersifat hidrofobik. Lambda karagenan tidak mempunyai gugus 3,6 anhidro-D-galaktosa dan mengandung ester-sulfat dalam jumlah tinggi sehingga dapat larut dalam air dingin. Kappa dan iota karagenan memiliki gugus hidrofilik ester-sulfat dalam jumlah yang lebih rendah dan mengandung anhidrogalaktosa yang bersifat hidrofobik dalam jumlah yang lebih tinggi sehingga tidak larut dalam air dingin kecuali dalam bentuk garam natrium (Towle 1973). Karagenan mengalami depolimerisasi secara perlahan selama penyimpanan (Pebrianata 2005). Semakin lama produk cincau disimpan, maka kerusakan polimer pektin bermetoksi rendah dan karagenan semakin tinggi sehingga air yang keluar dari produk semakin banyak.
Hasil penelitian terkait sineresis gel agak berbeda dibandingkan dengan penelitian sebelumnya. Gel cincau yang diberi perlakuan pengukusan memiliki tingkat sineresis sebesar 7,41% setelah penyimpanan selama 3 hari (Prakoso 2013), sedangkan gel cincau dengan perlakuan pasteurisasi memiliki tingkat sineresis sebesar 2,84% setelah penyimpanan selama 3 hari (Ginanjar 2013).
9
Gambar 4 Perubahan kecepatan sineresis gel cincau hijau selama penyimpanan dingin
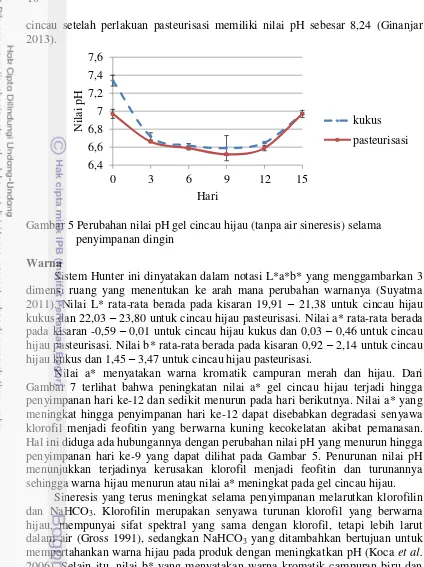
Nilai pH
Pengukuran nilai pH dilakukan pada gel cincau hijau tanpa air sineresis. Hasil pengukuran dapat dilihat pada Gambar 5 yang menunjukkan pola perubahan yang hampir sama pada gel cincau hijau kukus dan pasteurisasi. Nilai rata-rata pH berada pada kisaran 6,59 – 7,34 untuk cincau hijau kukus dan 6,52 – 6,97 untuk cincau hijau pasteurisasi. Data hasil pengukuran pH dapat dilihat selengkapnya pada Lampiran 3.
Penurunan nilai pH terjadi sampai penyimpanan hari ke-9, kemudian naik kembali sampai hari terakhir penyimpanan, baik pada gel cincau hijau kukus maupun pasteurisasi. Asam organik dilepaskan dari dalam jaringan (daun) akibat proses pemanasan (Gross 1991). Hal tersebut menyebabkan gel cincau hijau mengalami penurunan nilai pH setelah diberi perlakuan panas. Penambahan NaHCO3 dilakukan untuk mempertahankan pH produk selama pemanasan dan penyimpanan sehingga tetap berada pada kisaran pH netral.
Perubahan nilai pH diduga ada kaitannya dengan sineresis. Sineresis yang terjadi hingga penyimpanan hari ke-9 melepaskan sebagian air bebas yang terdapat dalam gel cincau hijau. Hal ini diduga ikut melarutkan sebagian NaHCO3 yang bersifat basa. Selain itu, pembentukan asam-asam organik yang meningkat selama penyimpanan mengakibatkan nilai pH yang terukur pada gel cincau hijau menjadi lebih rendah. Setelah penyimpanan hari ke-9, nilai pH mengalami peningkatan kembali. Hal ini dapat disebabkan oleh meningkatnya pembentukan struktur double helix pada gel karagenan selama penyimpanan sehingga melepaskan air bebas dari dalam gel cincau hijau. Proses pembentukan gel karagenan diawali dengan perubahan polimer karagenan menjadi bentuk gulungan acak (random coil). Ketika suhu diturunkan, maka polimer karagenan akan membentuk struktur double helix (pilinan ganda) dan menghasilkan titik-titik pertemuan (junction point) dari rantai polimer (Glicksman 1982). Air bebas yang dibebaskan dapat mengakibatkan asam-asam organik yang terbentuk selama penyimpanan keluar dari dalam gel dan ikut terlarut dalam air sineresis.
10
cincau setelah perlakuan pasteurisasi memiliki nilai pH sebesar 8,24 (Ginanjar 2013).
Gambar 5 Perubahan nilai pH gel cincau hijau (tanpa air sineresis) selama penyimpanan dingin
Warna
Sistem Hunter ini dinyatakan dalam notasi L*a*b* yang menggambarkan 3 dimensi ruang yang menentukan ke arah mana perubahan warnanya (Suyatma 2011). Nilai L* rata-rata berada pada kisaran 19,91 – 21,38 untuk cincau hijau kukus dan 22,03 – 23,80 untuk cincau hijau pasteurisasi. Nilai a* rata-rata berada pada kisaran -0,59 – 0,01 untuk cincau hijau kukus dan 0,03 – 0,46 untuk cincau hijau pasteurisasi. Nilai b* rata-rata berada pada kisaran 0,92 – 2,14 untuk cincau hijau kukus dan 1,45 – 3,47 untuk cincau hijau pasteurisasi.
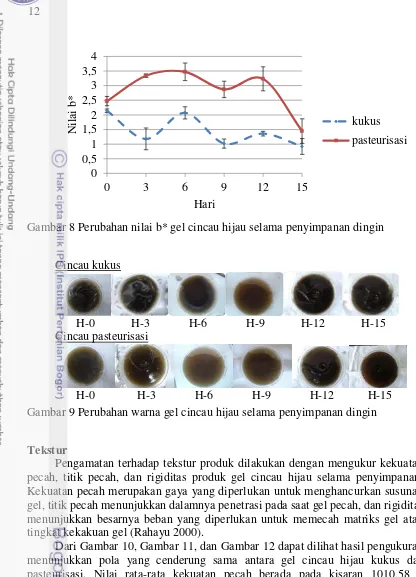
Nilai a* menyatakan warna kromatik campuran merah dan hijau. Dari Gambar 7 terlihat bahwa peningkatan nilai a* gel cincau hijau terjadi hingga penyimpanan hari ke-12 dan sedikit menurun pada hari berikutnya. Nilai a* yang meningkat hingga penyimpanan hari ke-12 dapat disebabkan degradasi senyawa klorofil menjadi feofitin yang berwarna kuning kecokelatan akibat pemanasan. Hal ini diduga ada hubungannya dengan perubahan nilai pH yang menurun hingga penyimpanan hari ke-9 yang dapat dilihat pada Gambar 5. Penurunan nilai pH menunjukkan terjadinya kerusakan klorofil menjadi feofitin dan turunannya sehingga warna hijau menurun atau nilai a* meningkat pada gel cincau hijau.
Sineresis yang terus meningkat selama penyimpanan melarutkan klorofilin dan NaHCO3. Klorofilin merupakan senyawa turunan klorofil yang berwarna hijau, mempunyai sifat spektral yang sama dengan klorofil, tetapi lebih larut dalam air (Gross 1991), sedangkan NaHCO3 yang ditambahkan bertujuan untuk mempertahankan warna hijau pada produk dengan meningkatkan pH (Koca et al.
11 Perpindahan panas pada fase gas lebih cepat dibandingkan fase cair karena massa molekul yang lebih rendah (Mc Cabe 1993). Namun, kontak antara bahan dengan media perpindahan panas pada proses pasteuriasasi lebih lama sehingga komponen klorofil sudah lebih banyak mengalami kerusakan. Nilai a* pada gel cincau pasteurisasi di setiap titik pengamatan lebih besar karena perlakuan panas yang tinggi dan waktu yang lebih lama dibandingkan pada gel cincau kukus sehingga warna produk menjadi kurang hijau. Gel cincau kukus dan pasteurisasi memiliki nilai a* yang semakin tinggi sampai hari ke-12 untuk kemudian turun kembali pada hari ke-15 penyimpanan. Hal tersebut menunjukkan semakin lama gel cincau hijau kukus maupun pasteurisasi disimpan, maka warnanya semakin tidak hijau. Penurunan intensitas warna hijau produk gel cincau hijau selama penyimpanan dapat dilihat pada Gambar 9. Hal ini dapat disebabkan oleh terjadinya degradasi senyawa klorofil dan larutnya turunan klorofil larut air seperti klorofilin selama penyimpanan.
Pada penelitian ini gel cincau setelah perlakuan pengukusan dan pasteurisasi memiliki nilai L*, a*, b* sebesar 21,04, -0,59, 2,14 dan 22,88, 0,03, 2,47. Hasil penelitian sebelumnya untuk gel cincau yang telah diberi perlakuan pengukusan memiliki nilai L*, a*, b* sebesar 23,43, -2,23, 4,13 (Prakoso 2013), sedangkan gel cincau setelah perlakuan pasteurisasi memiliki nilai L*, a*, b* sebesar 22,64, -0,60, 4,20 (Ginanjar 2013).
Gambar 6Perubahan nilai L* gel cincau hijau selama penyimpanan dingin
12
Gambar 8 Perubahan nilai b* gel cincau hijau selama penyimpanan dingin
Cincau kukus
H-0 H-3 H-6 H-9 H-12 H-15 Cincau pasteurisasi
H-0 H-3 H-6 H-9 H-12 H-15 Gambar 9 Perubahan warna gel cincau hijau selama penyimpanan dingin
Tekstur
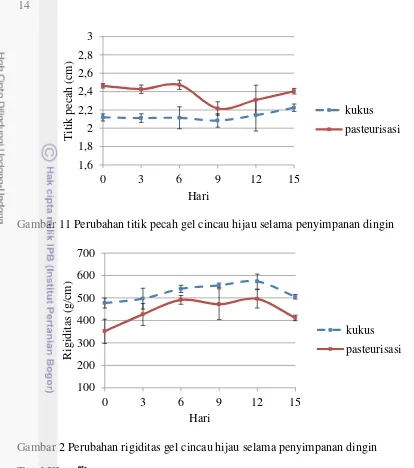
Pengamatan terhadap tekstur produk dilakukan dengan mengukur kekuatan pecah, titik pecah, dan rigiditas produk gel cincau hijau selama penyimpanan. Kekuatan pecah merupakan gaya yang diperlukan untuk menghancurkan susunan gel, titik pecah menunjukkan dalamnya penetrasi pada saat gel pecah, dan rigiditas menunjukkan besarnya beban yang diperlukan untuk memecah matriks gel atau tingkat kekakuan gel (Rahayu 2000).
Dari Gambar 10, Gambar 11, dan Gambar 12 dapat dilihat hasil pengukuran menunjukkan pola yang cenderung sama antara gel cincau hijau kukus dan pasteurisasi. Nilai rata-rata kekuatan pecah berada pada kisaran 1010,58 – 1225,49 g/cm2 untuk cincau hijau kukus dan 866,50 – 1210,75 g/cm2 untuk cincau hijau pasteurisasi. Nilai rata-rata titik pecah berada pada kisaran 2,08 – 2,22 cm untuk cincau hijau kukus dan 2,21 – 2,47 cm untuk cincau hijau pasteurisasi. Nilai rata-rata rigiditas berada pada kisaran 477,17 – 573,30 g/cm untuk cincau hijau kukus dan 351,64 – 495,92 g/cm untuk cincau hijau pasteurisasi. Nilai kekuatan pecah yang didapat sebanding dengan nilai rigiditasnya dan berbanding terbalik dengan titik pecah. Semakin kaku produk, maka semakin tinggi nilai kekuatan pecah gel. Tingkat kekakuan yang tinggi menyebabkan tingkat penetrasi yang
0 0,5 1 1,5 2 2,5 3 3,5 4
0 3 6 9 12 15
Ni
la
i
b
*
Hari
13 rendah pada produk sehingga nilai titik pecahnya rendah. Hasil analisis tekstur selengkapnya dapat dilihat pada Lampiran 5.
Pada gel cincau kukus, kekuatan pecah dan rigiditas meningkat hingga penyimpanan hari ke-12 dan menurun pada hari berikutnya, sedangkan nilai titik pecah stabil selama penyimpanan. Pada gel cincau pasteurisasi, kekuatan pecah meningkat hingga penyimpanan hari ke-6 dan menurun pada hari berikutnya hingga penyimpanan hari terakhir. Nilai titik pecah relatif stabil hingga hari terakhir penyimpanan. Nilai rigiditas meningkat hingga penyimpanan hari ke-12 dan menurun pada hari berikutnya. Nilai rigiditas gel cincau kukus lebih tinggi dibandingkan gel cincau pasteurisasi sehingga memiliki nilai titik pecah yang lebih rendah.
Kekuatan pecah dan rigiditas gel cincau kukus maupun pasteurisasi umumnya mengalami peningkatan hingga penyimpanan hari ke-12. Hal ini dapat disebabkan perlakuan panas berupa pengukusan dan pasteurisasi yang dilakukan pada proses pembuatan gel karagenan memiliki suhu yang lebih tinggi dari suhu pembentukan gel. Perlakuan panas tersebut dapat membentuk gulungan acak (random coil) pada gel karagenan. Penyimpanan yang dilakukan pada suhu dingin mengubah susunan polimer karagenan menjadi double helix. Pembentukan struktur double helix meningkat selama penyimpanan sehingga melepaskan air bebas dan mengakibatkan interaksi antara polimer semakin kuat karena polimer cenderung bergerak mendekat antara satu dengan lainnya (Glicksman 1982). Karagenan mengalami depolimerisasi secara perlahan selama penyimpanan (Pebrianata 2005). Semakin lama produk cincau disimpan, maka kerusakan karagenan semakin tinggi sehingga dapat menyebabkan menurunnya kekuatan pecah dan rigiditas gel cincau hijau pada akhir penyimpanan.
14
Gambar 11 Perubahan titik pecah gel cincau hijau selama penyimpanan dingin
Gambar 2 Perubahan rigiditas gel cincau hijau selama penyimpanan dingin
Total Klorofil
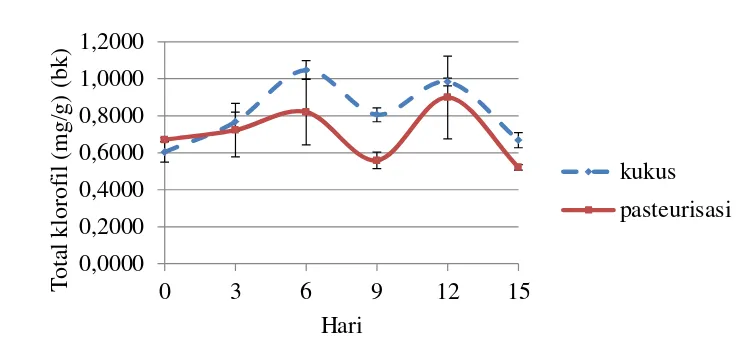
Klorofil adalah zat warna hijau daun yang terbentuk dari proses fotosintesis pada tumbuh-tumbuhan. Klorofil terdapat di dalam granular plastida yang berwarna hijau yang disebut kloroplas (Meyer 1982). Meyer (1982) juga menyebutkan bahwa struktur molekul klorofil terdiri dari satu atom Mg sebagai intinya, empat cincin pirol mengelilinginya dan keempatnya dihubungkan dengan atom Mg dengan dua ikatan kovalen masing-masing pada atom N dari cincin pirol, sedangkan cincin pirol yang satu dengan yang lain dihubungkan oleh sebuah gugusan methinil (-CH-). Analisis total klorofil dilakukan pada gel cincau hijau kukus dan pasteurisasi tanpa air sineresis. Nilai rata-rata total klorofil berada pada kisaran 0,60 – 1,04 mg/g (bk) untuk cincau hijau kukus dan 0,52 – 0,89 mg/g (bk) untuk cincau hijau pasteurisasi. Hasil analisis selengkapnya dapat dilihat pada Lampiran 6.
Pada Gambar 13 dapat terlihat bahwa gel cincau kukus maupun pasteurisasi memiliki pola perubahan total klorofil yang cenderung sama. Nilai total klorofil meningkat hingga penyimpanan hari ke-6 dan sedikit menurun hingga hari
15 terakhir penyimpanan, baik pada cincau kukus maupun pasteurisasi. Hal tersebut dapat menunjukkan bahwa selama penyimpanan, terutama setelah penyimpanan hari ke-6, klorofil terdegradasi menjadi senyawa lain seperti feofitin dan feoforbid sehingga nilai total klorofil yang terukur menurun.
Penambahan NaHCO3 yang merupakan larutan basa dapat membantu mencegah degradasi klorofil menjadi feofitin yang menyebabkan hilangnya gugus Mg2+ (Ferruzzi et al. 2002). Sineresis yang terjadi hingga penyimpanan hari ke-9 melepaskan sebagian air bebas yang diduga ikut melarutkan sebagian NaHCO3. Penyimpanan hingga hari ke-6 tidak menurunkan total klorofil karena NaHCO3 sebagian masih terdapat dalam gel cincau hijau sehingga degradasi klorofil terhambat. Penyimpanan selanjutnya menyebabkan total klorofil menurun karena NaHCO3 sudah mulai terlarut seluruhnya dalam air sineresis.
Gambar 3 Perubahan total klorofil gel cincau hijau selama penyimpanan dingin
Total Fenol
Daun cincau hijau mengandung flavonoid, saponin, polifenol, dan alkaloid (Zakaria dan Prangdimurti 2000) yang termasuk ke dalam gugus fenolik. Fenol merupakan zat antioksidan dari golongan antioksidasi pemutus rantai yang akan memotong perbanyakan reaksi berantai sehingga akan mengendalikan dan mengurangi peroksidasi lipid. Flavonoid adalah senyawa yang memiliki aktivitas antioksidan yang dapat mempengaruhi beberapa reaksi yang tidak diinginkan dalam tubuh, misalnya dapat menghambat reaksi oksidasi (Ebadi 2000). Analisis total fenol dilakukan pada gel cincau hijau kukus dan pasteurisasi tanpa air sineresis. Nilai rata-rata total fenol berada pada kisaran 947,79 – 1498,64 mg/g (bk) untuk cincau hijau kukus dan 965,61 – 1390,15 mg/g (bk) untuk cincau hijau pasteurisasi. Hasil analisis selengkapnya dapat dilihat pada Lampiran 8.
Untuk mendapatkan hasil total fenol dari sampel diperlukan kurva standar dari asam galat yang dapat dilihat pada Lampiran 7. Komponen fenolik di dalam produk gel tidak stabil dan bebas (Tang et al. 2003). Suradikusumah (1989) menambahkan bahwa fenol dan turunannya memiliki sifat cenderung larut dalam air. Polifenol dapat berinteraksi dengan polisakarida dan protein disebabkan ikatan hidrogen dan interaksi hidrofilik dalam kondisi terlarut. Ukuran molekul dan fleksibilitas konformasi polifenol merupakan faktor yang sangat penting bagi kekuatan interaksi protein-polifenol. Interaksi juga bergantung pada karakteristik struktural, biomolekul, dan polifenol. Penurunan total fenol disebabkan oleh
16
gangguan kompleks polifenol-protein dan polifenol-karbohidrat karena pemanasan (Stewart et al. 2000). Komponen fenol yang terdapat pada gel cincau hijau dapat terlarut dalam air sineresis sehingga menurunkan total fenol yang terukur.
Dari Gambar 14 terlihat bahwa pengukuran total fenol pada gel cincau hijau kukus maupun pasteurisasi memiliki pola perubahan yang cenderung sama, yaitu sedikit menurun pada penyimpanan hari ke-3, meningkat pada penyimpanan hari ke-6, dan menurun lagi pada hari berikutnya. Peningkatan total fenol dapat terjadi karena sineresis yang terjadi menyebabkan total fenol lebih terkonsentrasi (lebih pekat) dalam gel cincau hijau. Penurunan total fenol yang terukur menunjukkan bahwa komponen fenol ikut terlarut dalam air sineresis selama penyimpanan.
Pada penelitian ini gel cincau dengan perlakuan pengukusan dan pasteurisasi memiliki total fenol sebesar 1164,28 mg/g (bk) (47,38 mg GAE/l) dan 1159,97 mg/g (bk) (49,58 GAE/l). Gel cincau setelah diberi perlakuan pengukusan memiliki total fenol sebesar 39,00 mg GAE/l (Prakoso 2013), sedangkan gel cincau setelah perlakuan pasteurisasi memiliki total fenol sebesar 36,12 mg GAE/l (Ginanjar 2013).
Gambar 4 Perubahan total fenol gel cincau hijau selama penyimpanan dingin
Kapasitas Antioksidan
Antioksidan adalah senyawa yang berada pada konsentrasi lebih rendah dari substratnya secara signifikan dapat menunda atau mencegah oksidasi (Moein et al. 2007). Kapasitas antioksidan menunjukkan kemampuan komponen antioksidan pada bahan untuk meredam DPPH sebagai radikal bebas. Gel cincau hijau mengandung senyawa antioksidan berupa komponen fenolik dan klorofil. Senyawa fenolik, terutama flavonoid, dapat menangkap radikal bebas, mereduksi, mendonorkan atom hidrogen dan meredam oksigen singlet (Kumaran dan Karunakaran 2007). Endo et al (1985) menyatakan bahwa klorofil memiliki kemampuan mereduksi radikal bebas DPPH dengan struktur porfirin yang berperan untuk aktivitas antioksidan. Karagenan yang ditambahkan juga memiliki potensi sebagai antioksidan yang berasal dari kandungan sulfat pada strukturnya (Gomez-Ordonez et al. 2012).
Pada Gambar 15 terlihat bahwa perubahan kapasitas antioksidan gel cincau hijau kukus dan pasteurisasi cenderung memiliki pola yang sama. Kapasitas antioksidan pada gel cincau hijau kukus maupun pasteurisasi mengalami
17 peningkatan hingga penyimpanan hari ke-6, lalu menurun hingga akhir penyimpanan. Peningkatan kapasitas antioksidan diduga disebabkan tingkat sineresis yang tinggi sehingga menyebabkan senyawa antioksidan, terutama polifenol, lebih terkonsentrasi pada gel cincau hijau dan meningkatkan nilai kapasitas antioksidannya. Penurunan kapasitas antioksidan secara umum disebabkan oleh gangguan kompleks polifenol-protein dan polifenol-karbohidrat karena pemanasan (Stewart et al. 2000). Nilai rata-rata kapasitas antioksidan berada pada kisaran 2,34 – 11,42 mg/g (bk) untuk cincau hijau kukus dan 2,98 – 13,22 mg/g (bk) untuk cincau hijau pasteurisasi. Pada pengukuran kapasitas antioksidan diperlukan kurva standar dari asam askorbat yang dapat dilihat pada Lampiran 9. Hasil analisis kapasitas antioksidan selengkapnya dapat dilihat pada Lampiran 10.
Pada penyimpanan hari ke-6, nilai kapasitas antioksidan mencapai puncaknya, baik pada cincau kukus maupun pasteurisasi. Hal tersebut diduga karena adanya padatan yang bukan total fenol maupun klorofil yang ikut leaching
dan terbawa oleh air sineresis sehingga meningkatkan nilai kapasitas antioksidannya. Setelah hari ke-6, tekstur gel cincau hijau kukus maupun pasteurisasi mulai menurun diiringi dengan tingkat sineresis yang terus meningkat. Hal ini menyebabkan senyawa-senyawa antioksidan seperti komponen klorofil dan fenolik terlepas dari matriks gel dan ikut terlarut dalam air sineresis sehingga menurunkan nilai kapasitas antioksidannya.
Gambar 5 Perubahan kapasitas antioksidan gel cincau hijau selama penyimpanan dingin
Serat Pangan
Menurut American Association of Cereal Chemist (2001), serat pangan adalah bagian yang dapat dimakan dari tanaman atau karbohidrat analog yang resisten terhadap pencernaan dan absorpsi pada usus halus dengan fermentasi lengkap atau parsial pada usus besar. Berdasarkan kelarutannya dalam air, serat pangan terbagi menjadi dua jenis yaitu serat pangan larut atau Soluble Dietary Fiber (SDF) dan serat pangan tidak larut atau Insoluble Dietary Fiber (IDF). SDF terdiri dari pektin dan turunannya, gum, serta mucilage. Sementara IDF terdiri dari selulosa, hemiselulosa, lignin dan selulosa termodifikasi (Komolka et al.
18
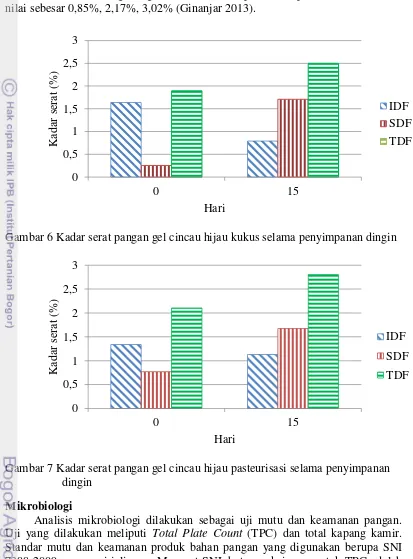
Nilai IDF pada awal dan akhir penyimpanan adalah 1,64% dan 0,79% untuk cincau hijau kukus, dan 1,33% dan 1,12% untuk cincau hijau pasteurisasi. Nilai SDF pada awal dan akhir penyimpanan adalah 0,25% dan 1,70% untuk cincau hijau kukus, dan 0,76% dan 1,67% untuk cincau hijau pasteurisasi. Nilai Total Dietary Fiber (TDF) pada awal dan akhir penyimpanan adalah 1,89% dan 2,50% untuk cincau hijau kukus, dan 2,10% dan 2,80% untuk cincau hijau pasteurisasi.
Pada Gambar 16 dan Gambar 17 terlihat bahwa gel cincau kukus mengandung TDF yang lebih rendah dibandingkan gel cincau pasteurisasi. IDF cenderung menurun, sedangkan SDF dan TDF meningkat selama penyimpanan, baik pada gel cincau kukus maupun pasteurisasi. Semakin tinggi suhu pasteurisasi, semakin tinggi kenaikan serat pangan gel cincau hijau (Ginanjar 2013). Perlakuan panas yang lebih lama pada gel cincau pasteurisasi menyebabkan kadar serat pangan yang terkandung didalamnya lebih tinggi dibandingkan gel cincau kukus. Pemanasan dapat membentuk kompleks polisakarida-fenolik. Formasi dari kompleks-kompleks antara polisakarida dengan komponen fenolik dapat terdeteksi sebagai serat pangan (Komolka et al. 2012).
Pada awal penyimpanan, terdapat kemungkinan terbentuknya senyawa-senyawa yang terdeteksi dan terukur sebagai serat. Akibat pemanasan atau kondisi asam akan melabilkan atau memutuskan ikatan hidrogen di dalam atau antar rantai polimer, serta pemutusan ikatan glikosidik pada beberapa komponen serat makanan. Hal ini berarti terjadi perubahan sterik antar molekul monomer atau polimer, antara lain lignin. Peningkatan kadar lignin sangat dimungkinkan akibat y “ g ” y g g g . g atau asam maka senyawa fenol jaringan tanaman membentuk ikatan silang, g g “ g ” (Dreher 1987). Lignin merupakan IDF, sehingga dengan terukurnya senyawa-senyawa yang terdeteksi sebagai lignin dapat meningkatkan jumlah IDF dalam gel cincau hijau pada awal penyimpanan.
Selama penyimpanan, serat tidak terdegradasi secara enzimatis, namun lebih disebabkan terjadinya degradasi kimiawi. Jumlah IDF yang terukur cenderung β-(1,4)-glikosidik penyusun gel cincau hijau rusak selama penyimpanan, salah satunya ditunjukkan oleh terjadinya sineresis. Selain itu, senyawa yang terukur sebagai IDF pada awal penyimpanan mengalami degradasi sehingga kadar IDF yang terukur menurun. Jumlah SDF yang terukur meningkat karena adanya penambahan karagenan pada formulasi gel cincau hijau. Karagenan sebagian besar tersusun oleh ikatan galaktosa yang membentuk konformasi acak dalam bentuk semi padat dan suhu rendah memicu terbentuknya ikatan silang ganda dari anhidro-galaktosa. Agregasi lebih lanjut juga terjadi pada bagian ikatan silang ganda yang telah terbentuk sehingga air keluar dari dalam produk dan mengakibatkan interaksi antara polimer semakin kuat (Yuguchi 2002). Interaksi ini dapat menyebabkan SDF yang terukur menjadi lebih tinggi pada hari terakhir penyimpanan.
19 0,25%, 1,89% dan 1,33%, 0,76%, 2,10%. Gel cincau setelah diberi perlakuan pengukusan memiliki nilai IDF, SDF, dan TDF sebesar 0,54%, 1,22%, 1,77% (Prakoso 2013), sedangkan gel cincau setelah perlakuan pasteurisasi memiliki nilai sebesar 0,85%, 2,17%, 3,02% (Ginanjar 2013).
Gambar 6 Kadar serat pangan gel cincau hijau kukus selama penyimpanan dingin
Gambar 7 Kadar serat pangan gel cincau hijau pasteurisasi selama penyimpanan dingin
Mikrobiologi
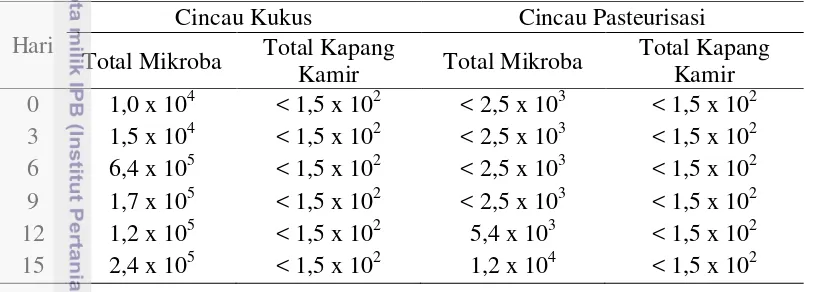
Analisis mikrobiologi dilakukan sebagai uji mutu dan keamanan pangan. Uji yang dilakukan meliputi Total Plate Count (TPC) dan total kapang kamir. Standar mutu dan keamanan produk bahan pangan yang digunakan berupa SNI 7388-2009 mengenai jeli agar. Menurut SNI, batas maksimum untuk TPC adalah 1,0 x 104 koloni/g dan untuk total kapang kamir sebesar 1,0 x 102 koloni/g.
Hasil analisis mikrobiologi dapat dilihat pada Tabel 1. Gel cincau hijau kukus mengandung total mikroba awal sebesar 1,0 x 104 dan terus mengalami peningkatan secara eksponensial hingga hari terakhir penyimpanan. Total kapang
20
kamir awal sebesar < 1,5 x 102 dan tidak mengalami perubahan hingga hari terakhir penyimpanan. Gel cincau hijau pasteurisasi mengandung total mikroba awal sebesar < 2,5 x 103 hingga penyimpanan hari ke-9, lalu meningkat secara eksponensial hingga hari terakhir penyimpanan. Total kapang kamir selama penyimpanan tidak berubah, yaitu sebesar < 1,5 x 102. Berdasarkan hasil analisis, produk gel cincau kukus dalam kemasan memiliki mutu mikrobiologi yang baik dan aman untuk dikonsumsi dengan tanpa penyimpanan atau hari ke-0 karena nilainya masih berada pada batas maksimum SNI 7388:2009 yang dapat dilihat pada Lampiran 1. Produk gel cincau pasteurisasi memiliki mutu mikrobiologi yang baik dan aman untuk dikonsumsi hingga penyimpanan hari ke-12.
Tabel 1 Hasil analisis mikrobiologi gel cincau hijau selama penyimpanan dingin
Hari
Cincau Kukus Cincau Pasteurisasi
Total Mikroba Total Kapang
Kamir Total Mikroba
Analisis Korelasi Karakteristik Gel Cincau Hijau
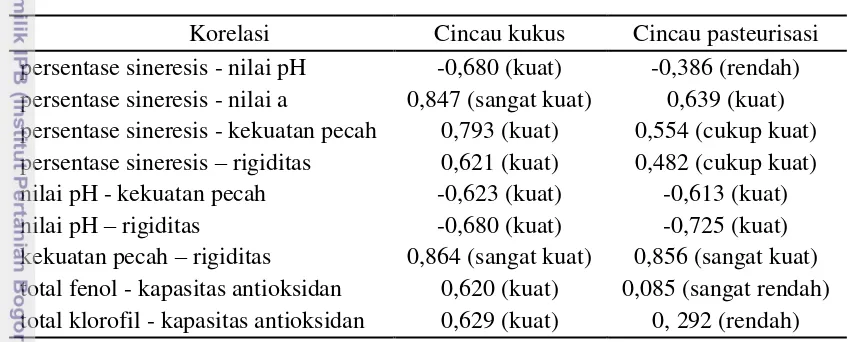
Analisis korelasi dilakukan pada gel cincau kukus maupun pasteurisasi. Analisis menggunakan aplikasi SPSS 20 dengan teknik analisis Pearson Product Moment Correlation (r). Korelasi ini dikemukakan oleh Karl Pearson tahun 1900 untuk mengetahui derajat hubungan dan kontribusi variabel bebas (independent) dengan variabel terikat (dependent). Korelasi ini dilambangkan (r) dengan ketentuan nilai r antara -1 hingga +1. Apabila nilai r = -1 artinya korelasi negatif sempurna, r = 0 artinya tidak ada korelasi, dan r = +1 artinya korelasi positif sempurna (Riduwan dan Sunarto 2011). Selanjutnya interpretasi nilai r akan ditunjukkan pada Tabel 2. Hasil analisis korelasi dapat dilihat pada Tabel 3.
Hubungan Persentase Sineresis dan Nilai pH Gel Cincau Hijau Kukus
Dari hasil uji korelasi pada Tabel 3 diketahui bahwa perubahan persentase terjadinya sineresis pada gel cincau hijau kukus berkorelasi terhadap perubahan nilai pH yang terukur. Dengan uji lanjut Pearson didapat nilai -0,680 yang menunjukkan korelasi kuat dan berbanding terbalik antara keduanya.
21 Semakin asam produk maka nilai pH yang terukur semakin rendah. Perubahan persentase sineresis yang semakin tinggi berbanding terbalik dengan nilai pH yang terukur pada gel cincau kukus selama penyimpanan.
Tabel 2 Interpretasi koefisien korelasi nilai r (Riduwan dan Sunarto 2011) Interval Koefisien Tingkat Hubungan
0,800 – 1,000 sangat kuat
0,600 – 0,799 kuat
0,400 – 0,599 cukup kuat
0,200 – 0,399 rendah
0,000 – 0,199 sangat rendah
Tabel 3 Tingkat korelasi perubahan gel cincau hijau selama penyimpanan dingin Korelasi Cincau kukus Cincau pasteurisasi persentase sineresis - nilai pH -0,680 (kuat) -0,386 (rendah) persentase sineresis - nilai a 0,847 (sangat kuat) 0,639 (kuat) persentase sineresis - kekuatan pecah 0,793 (kuat) 0,554 (cukup kuat) persentase sineresis – rigiditas 0,621 (kuat) 0,482 (cukup kuat) nilai pH - kekuatan pecah -0,623 (kuat) -0,613 (kuat) nilai pH – rigiditas -0,680 (kuat) -0,725 (kuat) kekuatan pecah – rigiditas 0,864 (sangat kuat) 0,856 (sangat kuat) total fenol - kapasitas antioksidan 0,620 (kuat) 0,085 (sangat rendah) total klorofil - kapasitas antioksidan 0,629 (kuat) 0, 292 (rendah)
Hubungan Persentase Sineresis dan Nilai a* Gel Cincau Hijau
Pada Tabel 3 dapat dilihat bahwa perubahan persentase sineresis selama penyimpanan memiliki korelasi terhadap nilai a* yang terukur pada gel cincau hijau. Nilai yang didapat dari uji lanjut Pearson adalah 0,847 dan 0,639 yang menunjukkan perubahan persentase sineresis yang terjadi selama penyimpanan berkorelasi sangat kuat dengan gel cincau hijau kukus dan berkorelasi kuat dengan gel cincau hijau pasteurisasi terhadap perubahan nilai a*.
22
Hubungan Persentase Sineresis dan Tekstur Gel Cincau Hijau Kukus
Hasil analisis korelasi antara perubahan persentase sineresis dengan kekuatan pecah dan rigiditas selama penyimpanan dapat dilihat pada Tabel 3. Dari uji lanjut Pearson yang dilakukan pada gel cincau kukus didapat nilai sebesar 0,793 untuk korelasi persentase sineresis dengan kekuatan pecah dan nilai 0,621 untuk korelasi persentase sineresis dengan rigiditas. Nilai tersebut menunjukkan adanya korelasi yang kuat antara keduanya.
Pembentukan tekstur gel cincau kukus dipengaruhi oleh adanya penambahan karagenan sebagai hidrokoloid tambahan. Proses pembentukan gel karagenan diawali dengan perubahan polimer karagenan menjadi bentuk gulungan acak (random coil). Perubahan ini disebabkan proses pemanasan dengan suhu yang lebih tinggi dari suhu pembentukan gel karagenan. Ketika suhu diturunkan, maka polimer karagenan akan membentuk struktur double helix (pilinan ganda) dan menghasilkan titik-titik pertemuan (junction point) dari rantai polimer (Glicksman 1982). Proses pengukusan membentuk struktur random coil pada gel karagenan di awal penyimpanan. Selama penyimpanan, pembentukan struktur
double helix meningkat sehingga melepaskan air bebas dan mengakibatkan interaksi antara polimer semakin kuat karena polimer cenderung bergerak mendekat antara satu dengan lainnya. Hal ini menyebabkan meningkatnya nilai kekuatan pecah maupun rigiditas gel cincau kukus. Persentase sineresis yang semakin tinggi sebanding dengan nilai kekuatan pecah dan rigiditas yang terukur pada gel cincau kukus selama penyimpanan.
Hubungan Nilai pH dan Tekstur Gel Cincau Hijau
Hasil analisis korelasi antara perubahan nilai pH dengan perubahan kekuatan pecah dan rigiditas dapat dilihat pada Tabel 3. Dari uji lanjut Pearson yang dilakukan pada gel cincau kukus maupun pasteurisasi didapat nilai sebesar -0,623 dan -0,613 untuk korelasi nilai pH dengan kekuatan pecah. Nilai tersebut menunjukkan adanya korelasi yang kuat dan berbanding terbalik antara keduanya. Uji lanjut Pearson antara nilai pH dan rigiditas menunjukkan nilai 0,680 dan -0,725. Nilai tersebut juga menunjukkan adanya korelasi yang kuat dan berbanding terbalik antara keduanya.
Karagenan akan stabil pada pH 7 atau lebih, tetapi pada pH yang lebih rendah stabilitasnya akan menurun bila terjadi peningkatan suhu (Glicksman 1982). Penambahan ion natrium yang berasal dari NaHCO3 ke dalam karagenan akan meningkatkan water holding capacity (WHC). Ion-ion monovalen terikat menjadi heliks ganda dan menetralisasi sebagian ikatan-ikatan sulfit sehingga menurunkan sineresis pada gel (Montero dan Perez-Mateos 2002). Selama penyimpanan, NaHCO3 yang terdapat dalam matriks bahan terlepas dan larut dalam air sineresis. Hal tersebut dapat menyebabkan tingkat keasaman gel cincau kukus meningkat. Semakin asam produk maka nilai pH yang terukur semakin rendah.
23 yang semakin rendah berbanding terbalik dengan nilai kekuatan pecah dan rigiditas yang terukur pada gel cincau hijau selama penyimpanan. Hasil analisis korelasi gel cincau hijau kukus hampir sama dengan gel cincau hijau pasteurisasi selama penyimpanan.
Hubungan Kekuatan Pecah dan Rigiditas Gel Cincau Hijau
Hasil analisis korelasi antara perubahan kekuatan pecah dan rigiditas gel cincau hijau selama penyimpanan dapat dilihat pada Tabel 3. Dari uji lanjut Pearson didapat nilai korelasi sebesar 0,864 dan 0,856 untuk cincau hijau kukus dan pasteurisasi. Nilai tersebut menunjukkan bahwa perubahan kekuatan pecah memiliki korelasi yang sangat kuat dengan rigiditasnya.
Kekuatan pecah merupakan gaya yang diperlukan untuk menghancurkan susunan gel, sedangkan rigiditas menunjukkan besarnya beban yang diperlukan untuk memecah matriks gel atau tingkat kekakuan dari gel. Gel terbentuk karena molekul linier yang tidak dapat membentuk ikatan heliks ganda yang kontinu. Hal ini diakibatkan struktur yang tidak beraturan. Bagian linier tersebut kemudian bergabung untuk membentuk struktur tiga dimensi yang kokoh. Semakin kuat tautan antar polimer yang membentuk jaringan gel semakin tinggi tingkat kekakuan (rigiditas) dan semakin tinggi nilai kekuatan pecahnya (Rahayu 2000). Perubahan kekuatan pecah yang semakin tinggi sebanding dengan nilai rigiditas gel cincau hijau yang terukur selama penyimpanan. Hasil analisis korelasi gel cincau hijau kukus hampir sama dengan gel cincau hijau pasteurisasi selama penyimpanan.
Hubungan Total Fenol dan Kapasitas Antioksidan Gel Cincau Hijau Kukus
Senyawa fenol adalah senyawa kimia yang berpotensi sebagai antioksidan. Hal ini disebabkan oleh keberadaan gugus hidroksil dalam senyawa fenol. Gugus hidroksil dapat berfungsi sebagai penyumbang atom hidrogen ketika bereaksi dengan senyawa radikal melalui mekanisme transfer elektron sehingga proses oksidasi dihambat. Senyawa fenolik, terutama flavonoid, dapat menangkap radikal bebas, mereduksi, mendonorkan atom hidrogen dan meredam oksigen singlet (Kumaran dan Karunakaran 2007).
Tabel 3 menunjukkan hasil analisis korelasi dari perubahan total fenol dengan perubahan kapasitas antioksidan gel cincau hijau kukus. Dari uji lanjut Pearson didapat nilai 0,620 yang menunjukkan korelasi yang kuat antara keduanya. Hasil analisis korelasi menunjukkan bahwa aktivitas antioksidan disebabkan oleh kandungan total fenol pada gel cincau kukus. Perubahan total fenol yang semakin tinggi sebanding dengan kenaikan kapasitas antioksidan yang terukur pada gel cincau hijau kukus selama penyimpanan.
Hubungan Total Klorofil dan Kapasitas Antioksidan Gel Cincau Hijau Kukus
24
25
SIMPULAN DAN SARAN
Simpulan
Gel cincau pasteurisasi mengalami sineresis yang lebih besar daripada gel cincau kukus. Secara umum, sineresis pada gel cincau hijau kukus dan pasteurisasi semakin meningkat dengan lamanya waktu penyimpanan, namun kecepatannya semakin menurun. Cincau kukus dan pasteurisasi mengalami penurunan nilai pH selama penyimpanan hingga hari ke-12 dan nilai pH keduanya tidak berbeda jauh, yaitu berkisar 6,5-7,0. Nilai a* pada skala Hunter kedua produk mengalami peningkatan selama penyimpanan, atau mengalami penurunan warna hijau dengan nilai a* untuk cincau kukus lebih rendah daripada cincau pasteurisasi. Kekuatan pecah dan rigiditas untuk kedua produk meningkat hingga akhir penyimpanan. Cincau kukus memiliki kekuatan pecah dan rigiditas yang lebih tinggi dibandingkan cincau pasteurisasi.
Nilai total klorofil cincau kukus dan pasteurisasi cenderung menurun hingga hari terakhir penyimpanan dengan kandungan total klorofil yang lebih tinggi pada cincau kukus. Total fenol cincau pasteurisasi lebih tinggi dibanding cincau kukus dan cenderung menurun hingga hari akhir penyimpanan. Kapasitas antioksidan gel cincau pasteurisasi maupun kukus mengalami peningkatan hingga penyimpanan hari ke-6, kemudian cenderung menurun sampai hari terakhir penyimpanan dengan nilai kapasitas antioksidan cincau pasteurisasi yang lebih tinggi.
Total Dietary Fiber (TDF) cincau pasteurisasi lebih tinggi dibandingkan cincau kukus dengan nilai yang meningkat selama penyimpanan. Penyimpanan yang dilakukan hingga hari ke-15 tidak berpengaruh nyata terhadap kadar serat (IDF, SDF, TDF) gel cincau hijau pada taraf signifikansi 0,05. Jumlah total mikroba kedua produk meningkat sebesar 1 log selama penyimpanan 15 hari. Gel cincau pasteurisasi memiliki total mikroba 1 log lebih rendah dibandingkan gel cincau kukus. Berdasarkan syarat mutu SNI 7388:2009, total mikroba pada gel cincau kukus memenuhi SNI hingga hari ke-0 atau tanpa penyimpanan, sedangkan gel cincau pasteurisasi memenuhi SNI hingga penyimpanan hari ke-12.
Saran
26
DAFTAR PUSTAKA
AACC [American Association of Cereal Chemist]. 2001. The Definition of Dietary Fibre. Cereal Foods World 46: pp. 89-148. ISSN 0146-6283.
Angalet SA. 1986. Evaluation of the voland-stevens LFRA texture analyzer for measuring the strength of pectin sugar jellies. J. Texture Studies 17: 87-96. AOAC [Association of Official Analytical Chemists]. 1995. Official Methods.
Washington DC.
Artha N. 2001. Isolasi dan karakterisasi sifat fungsional komponen pembentuk gel cincau hijau (Cyclea barbata L. Miers) [disertasi]. Bogor: Program Pascasarjana, IPB.
Asp NG, Johannson CG, Halmer H, Silsestrom M. 1983. Rapid enzymatic assay of insoluble and soluble dietary fiber. J Agric Food Chem. 31:467-482.
Aurand LW, Woods AE. 1973. Food Chemistry. Caloocan: The AVI Publishing Comp.
[BAM] Bacteriological Analytical Manual. 2001. Aerobic Plate Count. http://www.fda.gov/. [29 Desember 2013].
Camus A. 2000. Karakteristik pembentukan gel campuran hidrokoloid cincau hijau (Premna oblongifolia Merr.), alginat, dan Low Methoxyl Pectin (LMP) DE 36-44% [skripsi]. Bogor: Fakultas Teknologi Pertanian, IPB.
Dreher ML. 1987. Handbook of Dietary Fiber and Applied Approach. New York: Marcel Dekker.
Ebadi MS. 2002. Pharmacodynamic Basic of Herbal Medicine. New York: CRC Press.
Endo Y, Usuki R, Kaneda T. 1985. Antioxidant effects of chlorophyll and pheophytin on the autoxidation of oils in the dark: The mechanism of antioxidative action of chlorophyll. JAOCS 62: 1387-1390.
Ferruzzi MG, Schwartz SJ. 2001. Thermal degradation of commercial grade sodium copper chlorophyllin. J. Agric. Food Chem. 53 (18): 7098 -7102. Fry JC, Hudson JB. 1983. Development of a penetrometer test of the gel of Jam
[laporan penelitian]. The British Food Manufacturing Industries Research Association.
Ginanjar BMR. 2013. Evaluasi mutu fisik, mikrobiologi, dan sifat fungsional gel cincau hijau (Premna oblongifolia Merr.) dalam kemasan dengan perlakuan pasteurisasi [skripsi]. Bogor: Fakultas Teknologi Pertanian, IPB.
Glicksman M. 1982. Food Hydrocolloid. Boca Raton: CRC Press.
Gomez-Ordonez E, Jimenez-Escrig A, Ruperez P. 2012. Effect of the red seaweed
Mastocarpus stellatus intake on lipid metabolism and antioxidant status in healthy Wistar rats. Food Chem. 135: 806-811.
Gross J. 1991. Pigments in Vegetables. New York: Van Nostrand Reinhold
Koca N, Karadeniz F, Burdurlu HS. 2006. Effect of pH on chlorophyll degradation and color loss in blanched green peas. Food Chem. 100: 609-615. Komolka P, Gorecka D, Dziedzic K. 2012. The effect of thermal processing of
cruciferous vegetables on their content of dietary fiber and its fractions. Acta Sci. Pol. Technol. Aliment. 11 (4): 347-354.
27 Mc Cabe, WL. 1993. Unit Operation of Chemical Engineering 5th Edition.
McGrew-Hill Book Co. Singapore.
Meyer LH. 1982. Food Chemistry 4th Edition. Van Nostrand Reinhold Company Affiliated East West Student Press Put. Ltd. New Delhi.
Moein S, Farzami B, Khaghani S, Moein MR, Larijani B. 2007. Antioxidant properties and prevention of cell cytotoxicity of Phlomis Persica Boiss. DARU
15(2): 83.
Montero P and Perez-Mateos M. 2002. Effect of Na+, K+, and Ca2+ on gels formed from fish mince containing a carrageenan or alginate. Food Hydrocolloids 16: 375-385.
Nollet LML. 2000. Physical characterization and nutrient analysis. Di dalam: Nollet LML. Handbook of Food Analysis Vol.1. Second Edition, Revised and Expanded. New York: Marcel Dekker. Inc.
Pebrianata E. 2005. Pengaruh pencampuran kappa dan iota karagenan terhadap kekuatan gel dan viskositas karagenan campuran [skripsi]. Bogor: Fakultas Perikanan dan Ilmu Kelautan, IPB.
Prakoso ABB. 2013. Improvement of green grass (Premna oblongifolia Merr.) j y’s production process and its effects on physical and functional properties [skripsi]. Bogor: Fakultas Teknologi Pertanian, IPB.
Pramitasari N. 2012. Cemaran mikrobiologis pada gel cincau hijau (Premna oblongifolia Merr.) serta evaluasi sanitasi dan higiene pada penjual gel cincau hijau di wilayah bogor. [skripsi]. Bogor: Fakultas Teknologi Pertanian IPB. Rahayu S. 2000. Review the effects of pH, CaCl2, and alginate addition to the
green grass jelly characteristics (Cyclea barbata L. Miers) [tesis]. Bogor: Fakultas Teknologi Pertanian, IPB.
Riduwan, Sunarto H. 2011. Pengantar Statistika untuk Penelitian. Bandung: Penerbit Alfabeta.
Sakanaka S, Tachibana Y, Okada Y. 2005. Preparation and antioxidant properties of extract of Japanese persimmon leaf tea (kakinocha-cha). Food Chemistry
89: 569-575.
Setyaningtyas W. 2000. Karakteristik pembentukan gel campuran hidrokoloid cincau hijau Premna oblongifolia Merr. dan alginat [skripsi]. Bogor: Fakultas Teknologi Pertanian, IPB.
Sharma OP, Bhat TK. 2009. Analytical methods: DPPH antioxidant assay revisited. Food Chem.113: 1202-1205.
SNI [Standar Nasional Indonesia]. 2009. Batas maksimum cemaran mikroba dalam pangan. http://bbihp.kemenperin.go.id [29 Desember 2013].
Stewart AJ, Bozonnet S, Mullen W, Jenkins GJ, Michael EJ, Crozier A. 2000. Occurrence of flavonols in tomatoes and tomato-based products. J. Agric. and Food Chem. 48: 2663-2669.
Sunanto H. 1995. Budidaya Cincau. Yogyakarta: Kanisius.
Suradikusumah, E. 1989. Kimia Tumbuhan. Bogor: Pusat Antar Ilmu Hayat IPB. Suyatma NE. 2011. Physical properties of foods: color analysis. Bogor: Institut
Pertanian Bogor.
28
Towle GA. 1973. Carragenan. Di dalam: Whistler RL (ed.) Industrial Gums. New York: Academic Press.
Untoro A. 1985. Mempelajari beberapa sifat dasar dalam pembentukan gel dari cincau hijau (Premna oblongifolia Merr.) [skripsi]. Bogor: Fakultas Teknologi Pertanian IPB.
Yuguchi Y, Thuy TTT, Urakawa H, Kajiwara K. 2002. Structural characteristics of carrageenan gels: temperature and concentration dependence. Food Hydrocolloids 16: 515-522.
Zakaria FR, Prangdimurti E. 2000. Skrining aktivitas biologis tanaman cincau untuk pengkayaan khasiat gel cincau hijau [considated report]. Bogor: Institut Pertanian Bogor.
29 Lampiran 1 Standar Nasional Indonesia 7388:2009 tentang Batas Maksimum